PANNON EGYETEM
RÉZ- ÉS MANGÁNTARTALMÚ KOMPLEXEK
ENZIMUTÁNZÓ TULAJDONSÁGAINAK VIZSGÁLATA DOKTORI (PhD) ÉRTEKEZÉS
Készítette:
CSONKA RÓBERT okleveles vegyész
Témavezet ő : Dr. SPEIER GÁBOR
egyetemi tanár
PANNON EGYETEM
KÉMIAI ÉS KÖRNYEZETTUDOMÁNYI DOKTORI ISKOLA
VESZPRÉM 2010
RÉZ- ÉS MANGÁNTARTALMÚ KOMPLEXEK ENZIMUTÁNZÓ TULAJDONSÁGAINAK VIZSGÁLATA
Értekezés doktori (PhD) fokozat elnyerése érdekében
Írta:
Csonka Róbert
Készült a Pannon Egyetem Kémiai és Környezettudományi Doktori Iskolájának keretében.
Témavetető: Dr. Speier Gábor
Elfogadásra javaslom (igen/nem)
...
(aláírás)
A jelölt a doktori szigorlaton ... %-ot ért el.
Veszprém, ...
...
Szigorlati Bizottság elnöke
Az értekezést bírálóként elfogadásra javaslom:
Bíráló neve: ... igen/nem
...
(aláírás) Bíráló neve: ... igen/nem
...
(aláírás)
A jelölt az értekezés nyilvános vitáján ... %-ot ért el.
Veszprém, ...
...
Bíráló Bizottság elnöke A doktori (PhD) oklevél minősítése: ...
...
EDT elnöke
KIVONAT
Réz- és mangántartalmú komplexek enzimutánzó tulajdonságainak vizsgálata
Készítette: Csonka Róbert
A szervezetünkben lejátszódó biokémiai folyamatok pontos mechanizmusának megértése, a metalloenzimek megismerése napjaink gyógyszerkémiai alapkutatásainak tárgya. A bioszervetlen kémia tudományág különböző szerkezeti, és funkcionális enzimmodell-rendszerek kidolgozásával kínál lehetőséget ismereteink bővítésére ebben a témakörben.
A biokatalizátorok egyik nagy és jelentős csoportját képezik az oxidoreduktázok, amelyek néhány képviselője a fenoxazinon szintetáz, a pirokatechin oxidáz és dioxigenáz, a metán-monooxigenáz és a kataláz. Ezek az enzimek rezet, mangánt és vasat használnak katalitikus folyamataik kivitelezéséhez. Mechanizmusuk felderítése érdekében részletes reakciókinetikai vizsgálatokat végeztünk olyan réz- és mangántartalmú komplexekkel, amelyek képesek voltak a megfelelő enzim funkcionális modellezésére. Az előállított vegyületek közül a [Cu2(bpy)2(phga)4], a [Cu4(bnac)4(µ-EtO)4], a [Cu(bpy)(ox)]n és a [Cu(bpy)(bma)H2O]n összetételű komplexek esetén röntgendiffrakciós szerkezet- meghatározásra alkalmas egykristályokat is nyertünk. A többi esetben spektroszkópiai módszerekkel (UV-Vis, IR, ESR, AAS) határoztuk meg a lehetséges formációt. Az elvégezett kísérletsorozatok eredményeképpen kiszámítottuk a kinetikai paramétereket, majd javaslatokat tettünk a lehetséges reakciómechanizmusokra.
ABSTRACT
Investigating the enzyme mimicking properties of copper and manganese complexes
By Róbert Csonka
Understanding metalloenzymes and the exact mechanism of several biochemical processes enacted in the human body is the subject of recent pharmacological research.
The methods of bioinorganic chemistry give us the opportunity to widen our scientific horizon by developing structural and functional enzyme model systems.
One populous group of the most important biocatalysts is the oxidoreductases.
Some of their representatives are the phenoxazinone synthase, catechol oxidase, catechol dioxygenase, methane-monooxygenase and catalase. These enzymes use copper, iron and manganese as the key factors of their catalytic processes. Detailed studies in reaction kinetics were carried out with copper and manganese containing complexes that were able to functionally mimic the corresponding enzyme. From the complexes studied, four of them [Cu2(bpy)2(phga)4], [Cu4(bnac)4(µ-EtO)4], [Cu(bpy)(ox)]n and [Cu(bpy)(bma)H2O]n were structurally resolved by X-ray analysis. The remaining complexes were characterized by spectroscopic methods (UV-Vis, IR, ESR, AAS). As a result of our investigation we determined the kinetic parameters and we made suggestions for plausible reaction mechanisms.
ZUSAMMENFASSUNG
Untersuchungen einiger Kupfer- und Mangankomplexe als Enzymmodelle
Von Róbert Csonka
Das Verständnis von Metallenzymen als auch die Aufklärung des genauen Mechanismus verschiedener biochemischer Prozesse im menschlichen Körper sind Gegenstand der modernen pharmakologischen Forschung. Die Methoden der bioanorganischen Chemie erweitern unseren wissenschaftlichen Horizont durch die Entwicklung struktureller und funktioneller Modellsysteme zur Beschreibung der Wirkung von Enzymen.
Eine umfangreiche Gruppe wichtiger Biokatalysatoren bilden die Oxidoreduktasen.
Einige Vertreter dieser Gruppe sind Phenoxazinonsynthase, Brenzcatechin-Oxydase, Brenzcatechin-Dioxygenase, Methan-monooxygenase und Katalase. In diesen Enzymen bilden Kupfer, Eisen und Mangan die Schlüsselelemente für die jeweiligen katalytischen Prozesse. In dieser Arbeit wurden ausführliche Studien über die Reaktionskinetik von Kupfer- und Mangan enthaltenden Komplexe durchgeführt. Diese Komplexe sind in der Lage, die Rolle des korrespondierenden Enzyms nachzuahnen. Die Struktur von vier der untersuchten Komplexe, [Cu2(bpy)2(phga)4], [Cu4(bnac)4(µ-EtO)4], [Cu(bpy)(ox)]n und [Cu(bpy)(bma)H2O]n wurden durch Röntgenstrukturanalyse aufgeklärt. Die übrigen Komplexe wurden mithilfe spektroskopischer Methoden (UV-Vis, IR, ESR, AAS) charakterisiert. Als Ergebnis unserer Untersuchungen wurden die kinetischen Parameter bestimmt, Vorschläge für plausible Reaktionsmechanismen gemacht.
A DOLGOZATBAN EL Ő FORDULÓ RÖVIDÍTÉSEK
PHS fenoxazinon szintetáz
CO pirokatechin oxidáz
PTU fenil-tiourea
CTD pirokatechin dioxigenáz
NAD+ nikotinamid-adenin-dinukleotid kation
acac acetil-aceton
bpy 2,2’-bipiridin
TEMPO 2,2,6,6-tetrametil-1-piperidinil-oxil OAP orto-amino-fenol vagy 2-amino-fenol APX 2-amino-3H-fenoxazin-3-on
PDA orto-fenilén-diamin
DAP 2,3-diamino-fenazin
BQMI benzokinon-monoimin
DBCatH2 3,5-di-terc-butil-pirokatechint DBQ 3,5-di-terc-butil-o-benzokinon flaH 3-hidroxiflavon vagy flavonol
bnacH benzoil-aceton
Cl4CatH2 3,4,5,6-tetra-kloro-pirokatechin
oxH2 oxálsav
baH benzoesav
phgaH fenil-glioxilsav
bmaH2 2-terc-butil-maleinsav NEt3 trietil-amin
6’-MeIndH 1,3-bisz(6’-metil-2’-piridil-imino)-izoindolin 6’-Me2PAP 1,4-di-(6’-metil-2’-piridil)-aminoftalazin
Szeretném kifejezni köszönetemet témavezetőmnek, Dr. Speier Gábor egyetemi tanár úrnak, valamint Dr. Kaizer Józsefnek az elmúlt évek során nyújtott segítségükért, megállíthatatlanul özönlő szakmai tanácsaikért. Köszönöm továbbá kutatócsoportunk minden tagjának ösztönzését, segítőkészségét, közülük is Dr. Pap Józsefnek a kezdeti nehézségekben nyújtott segítő jobbért.
Mindennél jobban köszönöm családom végtelen bíztatását és bizalmát.
Veszprém, 2010
Csonka Róbert
TARTALOMJEGYZÉK
BEVEZETÉS ... 1
1. IRODALMI ÁTTEKINTÉS ... 3
1.1. A biokatalizátorok és az anyagcsere-folyamatok ... 3
1.2. Metalloenzimek és modelljeik ... 4
1.2.1. A fenoxazinon szintetáz enzim (PHS – EC 1.10.3.4) és modelljei ... 7
1.2.2. A pirokatechin oxidáz enzim (CO – EC 1.10.3.1) és modelljei ... 10
1.2.3. A pirokatechin dioxigenázok és modelljeik ... 15
1.2.4. A metán-monooxigenáz enzim (MMO -- EC 1.14.13.25) ... 20
1.2.5. A kataláz enzim (EC 1.11.1.6) ... 25
2. CÉLKIT Ű ZÉSEK ... 33
3. EREDMÉNYEK ÉS ÉRTÉKELÉSÜK ... 36
3.1. PHS enzimmodellek ... 36
3.1.1. A PHS enzim működési modelljei TEMPO szabadgyökkel ... 36
3.1.2. A PHS enzim modellezése mangántartalmú komplexszel ... 44
3.2. A pirokatechin oxidáz (CO) enzim modelljei ... 49
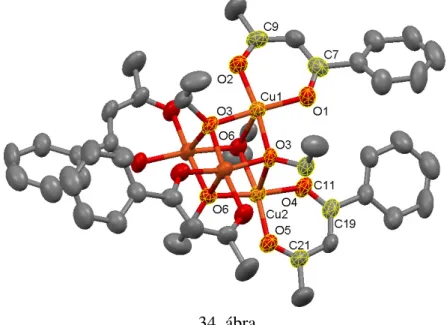
3.2.1. A Cu4(bnac)4(µ-EtO)4 előállítása, szerkezete és katalitikus hatása a di-terc-butil- pirokatechin oxidációjára ... 50
3.2.2. A Mn2(6’Me2PAP)2Cl4 előállítása, szerkezete és katalitikus hatása a di-terc-butil- pirokatechin oxidációjára ... 60
3.3. A Cu(I)-(bpy)-(DBCat) rendszer. Pirokatechin dioxigenáz, vagy pMMO modell? ... 65
3.4. Kataláz enzimmodellek ... 77
3.4.1. A Cu2(bpy)2(phga)4 előállítása, szerkezete, katalitikus hatása a H2O2 dizmutációjára ..77
3.4.2. A prolintartalmú [Mn2L(OAc)(H2O)2](H2O)2 előállítása, és katalitikus hatása a H2O2 dizmutációjára ... 83
4. KÍSÉRLETI RÉSZ ... 88
5. ÖSSZEFOGLALÁS ... 94
IRODALOMJEGYZÉK ... 97
1
BEVEZETÉS
Környezetszennyezés, betegségek, túlnépesedés, élelmezési problémák, és még lehetne sorolni a XXI. századba lépő emberre váró gondokat, amikre megoldást kell találnia. Szinte megszámlálhatatlan az egészségre káros anyagok száma, amit különféle nagyüzemek a levegőbe, földbe és vizeinkbe juttatnak. Modern, civilizációs betegségek alakulnak ki, amik ellen védekezni próbálunk, de egyre csak újabbakkal találjuk szembe magunkat. Minél jobban átalakítjuk környezetünket, annál jobban alakulnunk kell hozzá.
Ez első olvasásra talán paradoxonnak tűnik, de csupán annyit jelent, hogy tanuljunk a természettől. Az élő szervezetek védekező rendszerében is a dinamikusságon van a hangsúly. Ilyen, és hasonló elven működő rendszerek kifejlesztése az irányelv a természettudományok legtöbb ágában. Divatos kifejezéssel élve a „zöld kémia” kell, hogy irányvonalat adjon a kor kémiai kutatóinak. A biológiai, biokémiai reakciók pontosabb megismerésével és alkalmazásával nem csak a hulladékok környezetkímélő lebontását oldhatjuk meg, hanem tisztább, hatékonyabb gyógyszereket is előállíthatunk. Ilyen, és még számtalan más hasonló lehetőség rejlik az enzimek kémiájában.
Az élő szervezetekben lezajló biokémiai folyamatok többsége összetett, gyors konszekutív reakciók sorozata. A reakciók sebességét és specifikusságát az enzimek alakítják. Az emberi test harmonikusan működő összetett rendszer. Működése közben fellépő problémák, zavarok eredményeként betegségek alakulnak ki, és ez sok esetben éppen a biokatalizátorok hiányos, vagy túlműködésének következménye. Felépítésüket tekintve az enzimek nagy része fehérjéken kívül fémet is tartalmazhat. Ez alakítja ki az ún.
aktív centrumot – a metalloenzimek esetében a fém és a koordinációs övezete –, ami teljes mértékben meghatározza az enzim specifikusságát. Működési mechanizmusuk részleteinek tisztázásához azonban összetett – nem csupán egy tudományágat magába foglaló – vizsgálatsorozatra van szükség.
Az analitikai technikák, mint például a röntgendiffrakció, ICP, AAS fejlődése, valamint az elektromikroszkópok felbontásának javulása nagyobb betekintést engedett az anyagok pontos szerkezetébe. A biológiai ismeretek fontossága a testben lezajló enzimreakciókról és azok körülményeiről, célzott viselkedésükről elengedhetetlen mindenféle gyógyászattal kapcsolatos tevékenységhez, kutatáshoz. Az egyes folyamatok pontos megértéséhez azonban többre van szükség. Így alakulhatott ki évtizedekkel ezelőtt egy új, interdiszciplináris tudományterület, a bioszervetlen vagy biokoordinációs kémia.
2
Az enzimek nagy méretük és összetettségük révén nehezen kezelhető vegyületek.
Tisztításuk, izolálásuk nem kevésbé körülményes munka. Szerkezetüket, vagy funkciójukat alapul véve ún. bioutánzó vegyületeket hozhatunk létre, amelyek felépítésükben sokkal egyszerűbbek a megfelelő enzimnél. Enzimutánzó tulajdonságuk abból fakad, hogy azonos folyamatokat katalizálnak, azonban azt nagyságrendekkel kisebb hatásfokkal teszik. Mivel az elsődleges cél a folyamat lépésről-lépésre történő leírása, így az utóbbi jellemző kulcsfontosságú, hiszen a lassú reakciók jobban nyomonkövethetőek. A modellvegyületek reakcióinak pontos feltérképezésével tehát, egy lépéssel közelebb kerülhetünk a valós enzimmechanizmusok megértéséhez.
Az enzimek egyik nagy és jelentős csoportját képezik az oxidoreduktázok, melyek reakcióiban elektron, vagy hidrogénatom transzfer történik a kölcsönhatásba lépő molekulák között. Alcsoportjai az oxigenázok és az oxidázok. Általunk vizsgált képviselőik a fenoxazinon szintetáz, a pirokatechin oxidáz és dioxigenáz, a metán- monooxigenáz és a kataláz enzimek. Ezek bemutatása, valamint funkciójuknak pontosabb megismerése modellvegyületeik leírásán, jellemzésén keresztül a jelen értekezés témája.
3
1. IRODALMI ÁTTEKINTÉS
1.1. A biokatalizátorok és az anyagcsere-folyamatok
Változatosak, bonyolultak, szelektívek. Ez a három legfontosabb jellemző kifejezés, amivel az élőlények biokémiai folyamatait nagymértékben meghatározó katalizátorokat körül lehetne írni. Nélkülük a szervezetben az anyagátalakulások egyáltalán nem, vagy csak lassan játszódnának le. Feladatuk tehát a folyamatok aktiválási energiájának csökkentése. Molekulatömegük általában 1,2 × 104 – 5 × 105 Dalton között változhat. Felépítésüket tekintve az egyszerű fehérjék (apoenzimek) kizárólag α- aminosavakból épülnek fel. Az összetett fehérjék (proteidek, holoenzimek) az alapvető aminosavak mellett nem fehérje jellegű részt is tartalmaznak. Többnyire ilyen részek alakítják ki az aktív centrumot. Azokat a molekulákat, amelyek átalakulásában az enzimek katalitikus szerepet töltenek be, szubsztrátumnak nevezzük. A szubsztrátum molekula általában kisebb molekulatömeggel rendelkezik – M < 103 Dalton – mint maga az enzim.
Természetes formában általában az enzimek inaktív állapotban vannak.
„Bekapcsolásukhoz” egy koenzim, vagy bármilyen más másodlagos faktor (pl. fémion) szükséges. Ez a folyamat az aktív centrumhoz méretben és funkcióban is hasonló, mégis jól elkülöníthető alloszterikus centrumon keresztül megy végbe. A kofaktor kapcsolata az enzimmel megváltoztatja a rendszer alakját, vagy éppen polaritását, utat engedve ezáltal a szubsztrátumnak a kapcsolódáshoz, majd átalakuláshoz. A körfolyamat az összes szubsztrátum termékké való alakulása után a kofaktor leválásával zárul. A kémiai reakcióktól eltérően az enzimkinetikában nem ütközésen alapuló, hanem adszorpciós kölcsönhatások dominálnak. A különböző molekulákat van der Waals, hidrogénhíd- kötések, és elektrosztatikus erők rögzítik az enzimfelülethez. A szubsztrátum változásával járó tényleges reakció természetesen kémiai jellegű [1].
A katalizált reakció szempontjából 6 fő csoportba lehet az enzimeket sorolni:
1. Hidrolázok. Fehérjék peptidkötését, poliszacharidok glikozidkötését, vagy zsírok és foszfátok észterkötését hasítják hidrolízis reakciójuk katalízise révén.
4
2. Oxidoreduktázok. Ezek az enzimek redoxireakciókat katalizálnak, melyek során elektronok, vagy hidrogénatom kerül át egyik molekuláról a másikra.
3. Transzferázok. Egy meghatározott atomcsoport átvitelét katalizálják egyik molekuláról a másikra (pl. -CH3, -NH2, -COOH, stb.).
4. Izomerázok. Ez az enzimcsoport különböző átrendeződéses reakciókat segít elő. 5. Liázok. A szubsztrátum adott csoportját távolítják el nem hidrolitikus reakció
során, vagyis eliminációs reakciókat katalizálnak.
6. Ligázok. Két molekula összekapcsolását katalizálják. A kapcsolt atomok szerint vannak C-O, C-N és C-C kötést kapcsoló ligázok [2].
A dolgozat célja az oxidoreduktáz enzimcsalád néhány tagjának megismertetése.
Ezeken belül is a metalloenzimek bemutatása, ahol a fém nem kofaktorként szerepel, hanem az aktív centrum kulcsfontosságú elemeként szolgál.
1.2. Metalloenzimek és modelljeik
Az enzimeknek ez a csoportja az összetett fehérjék (proteidek, holoenzimek) közé tartozik. Tagjainak a reakciósebesség-növelő képessége – mint ahogy a bevezetőben is már említésre került – egy kémiailag és fizikailag is jól elkülöníthető részükhöz kapcsolható: az aktív centrumhoz. Ennek az egységnek a meghatározó elemei a fémionok – leginkább vas, réz, cink, mangán – melyek képesek stabilis kelátkomplexek kialakítására. A fém-fehérje kapcsolatban a specifikusság és a kötött sztöchiometriai arány meghatározó tényezők. A fémionok említett tulajdonságain kívül, az azonosíthatóság szempontjából jelentőségüket megnöveli, hogy az általuk és a szubsztrátum által kialakított fém-protein kötések spektroszkópiai módszerekkel végzett vizsgálatokra alkalmasak. Kiemelkedő közülük is a rézion, amely az oxidáz és oxigenáz enzimek gyakori alkotóeleme (például citokróm-c- oxidáz). Szerepe van még vitaminok, szteroidok, aminosavak bioszintézisében és metabolizmusában is. Nyomelemként a legtöbb élőlény számára létfontosságú. A vas biokémiai szerepéhez hasonlóan bizonyos élőlények oxigén anyagcseréjének nélkülözhetetlen résztvevője. Aktív centrumban való előfordulása szerint három típusa lehetséges:
5
• Az első típusú „kék” réz(II)iont tartalmazó komplexek intenzív sávot adnak 600 nm-nél, és szokatlanul kicsi hiperfinom AII csatolási állandót mutatnak az ESR spektrumban. Nevüket arról a jellegzetességükről kapták, hogy a proteineket, amikben előfordulnak (pl. azurin, plasztocianin) kékre festik. A szín a ligandum- fém töltésátvitelből adódik a cisztein kénatomjával történő koordinációja eredményeként. Szerkezeti felépítésüket trigonális piramis, bipiramis és torzult tetraéderes forma jellemzi. A trigonális alapot két hisztidin és egy cisztein molekula alakítja ki, az axiális ligandumok változatosak [3].
• A második típusú réz(II) a normális, vagy „nem kék” centrum. Ismertebb képviselőik a galaktóz oxidáz, az amin oxidáz és a Cu/Zn szuperoxid dizmutáz enzimek. Szerkezetükben a planáris és a tetragonális-piramis formák a kedvezményezettek. Abszorpciójuk a látható tartományban gyenge (ε = 100-1000 M-1 cm-1), ESR spektrumuk éppen csak megfigyelhető, a hiperfinom csatolási állandó 150 Gauss körüli [3, 4].
• A harmadik típus antiferromágnesesen csatolt binukleáris centrummal rendelkezik [5], ezért ESR-ben inaktívak. Tirozináz, pirokatechin oxidáz és hemocianin enzimek jellemző alkotóeleme. Intenzív abszorpciós sávot adnak 330 nm körül az UV-látható spektrumban. Oxidált állapotban [Cu(II)-Cu(II)] a réz 3-3 hisztidinhez koordinálódva található meg bennük trigonális piramis szerkezetet alakítva. A két fém között gyakran µ-hidroxo, vagy aktív állapotban peroxo híd (O22-) alakul ki µ-η2:η2 formában.
Az utóbbi enzimfajták többek között aromás vegyületek oxidatív lebontását végzik, gyakran vas ionokkal együtt. A reakciómechanizmusok kialakításához és megértéséhez szükséges az az ismeret, hogy a fémion a metalloenzimekben belső feszültséget (entatikus állapot) alakít ki – hat az enzim elektronszerkezetére és sztereokémiájára –, így reakcióképessé teszi azt. Ilyen módon akár a fém oxidációs száma is megváltozhat.
Gyakori példa erre a réz(I) oxidációja réz(II)ionná. A reakció egyik magyarázata a réz(II) esetén kialakuló stabilisabb geometriai szerkezet (síknégyzetes, de inkább torzult oktaéderes forma) kialakulása. Itt rögtön meg is említhető a réz(II)ionok elektronszállításban, valamint elektronátvitelben betöltött fontos szerepe. Ez a tulajdonság közvetetten alakítja az enzim reakcióját dioxigénnel a következő séma szerint (1. ábra).
6 AH2
A
Cu(II)-fehérje
Cu(I)-fehérje
H2O
1/2 O2
M + O2 MO2 (M+O2- )
M2O2 [(M+)2O22- ] 2M + O2
1. ábra
Az AH2-szubsztrátum redukálja a fémet, ami dioxigénnel újra oxidálható. Ehhez szükséges az elektronátvivő szerepe. Ilyen módon lehetőség nyílik az oxidációs folyamatban felszabaduló energia szétosztására, és ezáltal energiadús vegyületek képződésére.
A molekuláris oxigén (EN= 3,5) köztudottan erős oxidálószer. Ennek, és a fémion elektronátadó képességének köszönhetően biológiailag a dioxigén megkötése, szállítása legtöbbször MO2 szuperoxo-, (1) vagy M2O2 peroxokomplexek (2) formájában történik.
Sok esetben nem dönthető el biztosan a fémion oxidációs állapota, azonban oxidációs foka nő, miközben a dioxigén redukálódik.
(1)
(2)
Ilyen formában a dioxigén a metalloenzimek által, vagy közvetlenül is részt vehet a biológiai oxidációs folyamatokban.
A metalloenzimek katalitikus hatása, valamint reakcióik, azok mechanizmusa a tudomány számára még nem minden esetben tisztázott terület. Nagy moláris tömegük és kis fémtartalmuk miatt kezelésük és spektroszkópiai jellemzőiknek vizsgálata nehéz és körülményes. Az egyszerűbb kezelhetőség érdekében a gyakorlatban modellvegyületek kialakításával próbálkoznak. Mivel ezek a vegyületek több szempontból hasonlítanak az eredeti enzimre, így bioutánzó rendszernek tekinthetők. Akár reakciókinetikai, akár szerkezeti vizsgálatuk jó közelítéssel ad információt a természetes enzimekről.
Egy modellvegyület megválasztásánál az első feladat eldönteni, hogy milyen célnak feleljen meg, vagyis milyen szempontból hasonlítson a helyettesítendő enzimre. A két lehetséges forma:
7
FUNKCIONÁLIS MODELLEK: Céljuk a szelektivitás, aktivitás (enzimek esetén), vagy teljes működési mechanizmus helyettesítése, utánzása. A szerkezeti hasonlóság nem meghatározó szempont. A ligandum kiválasztása kizárólag a folyamat minőségének megtartása érdekében történik.
SZERKEZETI MODELLEK: Az aktív centrum térbeli felépítésének megismerését segíti elő a minta és a modell spektroszkópiai adatainak összehasonlításával. A ligandumok helyes megválasztásával egyre jobban lehet közelíteni, egy enzim szerkezetéhez. A leggyakoribb felmerülő probléma, hogy a szintetikus vegyületek gyakran túl stabilisak. Ez hátrány katalitikus funkciók ellátásánál és lebomlási folyamatok során is.
1.2.1. A fenoxazinon szintetáz enzim (PHS – EC 1.10.3.4) és modelljei
A multiréz-oxidáz enzimcsoport tagjai közül a lakkáz, az aszkorbát oxidáz és a ceruloplazmin enzimek a leggyakrabban kutatottak. A fenoxazinon szintetáz enzimre (vagy o-amino-fenol oxidáz) azért terelődött a kutatók figyelme, mert a gyógyszeripar egy fontos készítményének az aktinomycin D bioszintézisének az utolsó lépésében van szerepe. Ez az egyik legrégebben alkalmazott tumorellenes kemoterápiás szer például a choriocarcinoma, a Wilm’s tumor és a rhabdomyosarcoma kezeléséhez, ráadásul gyulladáscsökkentő hatása is ismeretes.
Korábban kimutatták, hogy onkogén vírusokkal (pl. RSV) való fertőzést, a DNS szintézist gátló anyagok megakadályozzák. A gátló anyagok közül az egyik csoport a DNS-hez kapcsolódva módosítja a templát szerkezetét, és ezáltal megzavarja az mRNS bioszintézisét (transzkripció), amely a fehérjeszintézis bevezető fázisának tekinthető. A DNS templát funkcióját zavarja a Pseudomonas és Streptomyces antibioticus termelte oligopeptid-tartalmú aktinomycin D (2. ábra). Pontos hatása abban áll, hogy az aktinomycin D gyűrűje beékelődik, interkalálódik a DNS két bázispárja közé és megakadályozza, hogy a DNS hatékony templátként működjön. Az aktinomycin D-ben a fenoxazin gyűrűhöz két öttagú peptidlánc kapcsolódik, amiben metil-valin (MeVal), szarkozin (Sar), prolin (Pro),
8
CONHR
CH3 N O
CONHR
CH3 O NH2 CONHR
CH3 OH
NH2
O
R = Thr-DVal-Pro-Sar-MeVal
2 fenoxazinon szintetáz
1,5 O2 3 H2O
1 2222
D-valin (Dval) és treonin (Thr) található. A metil-valin karboxilcsoportja és a treonin hidroxilcsoportja között észter-kötés alakul ki [6, 7].
2. ábra
A fenoxazinon szintetáz enzim által katalizált biokémiai reakció
A fenoxazinon szintetáz kristályszerkezetét 2006-ban Smith írta le [8]. (3. ábra) Az enzim két oligomer formában létezik. Egy kevésbé aktív dimerként és egy nagyobb bioaktivitással bíró, de egyben stabilabb hexamerként. A monomerek egyenként 5-5 Cu atomot tartalmaznak, ezek között pedig mindhárom korábban említett réz típus megtalálható. Az ötödik Cu atom a spektroszkópiai adatok alapján kettes típusú réz, azonban az enzimre jellemző három két-elektron oxidációs folyamatban közvetlenül nem vesz részt. Szerepe a hexamer struktúra összetartásában van.
3. ábra
A fenoxazinon szintetáz enzim (PHS) szerkezete [8]
9
NH2 OH
NH2+ O NH2
OH
NH2 OH
+ -2e-
-2H
H N OH
NH2
OH HN
OH
NH2+ O
N O
NH2 O HN
O
NH2 OH
-2e-
-2e- -2H
-2H Tautomerizáció
Cu(I) + O2= Cu(II)OO Cu(II)OO + SH = Cu(II)OOH + S
3 3 4
5 4a
5a 6
A kutatókat az aktinomycin D kedvező tulajdonságainak megismerése után rögtön foglalkoztatni kezdte gazdaságos előállítása és természetes képződésének pontos megismerése. Az 1950-es években a fenoxazinok kémiájával, különböző kromofórok előállításával Brockmann [9] foglalkozott behatóbban, majd a 60-as évek elején Katz [10]
vizsgálta meg elsőként más-más baktériumokból származó enzim extraktumok viselkedését külső fém behatással szemben. Az első igazi modell kísérletekre viszont várni kellett az 1980-as évekig. Ebben az időben derült ki ugyanis, hogy rézsók és egyszerű réz komplexek oxidáló hatása és elektronátvitelben való szerepe a megfelelő réztartalmú enzimek modelljeként alkalmazható. A fenoxazinon szintetáz enzimről Prati és munkatársai készítettek részletesebb tanulmányt [11]. Munkájuk szoros összefüggésben van C. E. Barry enzimmel végzett kísérleteivel [6]. Az így kialakult első kép az enzim reakciómechanizmusáról (3-5) alapjaiban három két-elektron oxidációs folyamatot alkot.
Az enzimnek csupán az első oxidációs lépésben van szerepe. Ez indítja el a következő két oxidációs lépést, amelyek a levegő oxigénjének hatására gyorsan lejátszódnak.
(3)
(4)
(5)
Ahogy a (3-5) reakciók is mutatják, a legegyszerűbb módja a szóban forgó enzim modellezésének az o-amino-fenol oxidatív kapcsolási reakciójának vizsgálata. A termékként kapott 2-amino-3H-fenoxazin-3-on (6) nem csak szerkezetileg hasonló az aktinomycin D-hez, de önmagában is alkalmazott antibiotikum és daganatellenes szer, amely questiomycin A néven ismert [12, 13]. Szintén biológiai aktivitással bírnak a csupán
10
egy aminocsoporttal különböző fenilén-diaminok reakciójából származó diamino-fenazin származékok, amik a 1960-as évekig csak azofestékként voltak használatban [14, 15].
Előállításuk questiomycinéhez hasonló oxidáció útján történik, így továbbra is kutatott téma a területen [16]. Mindkét esetben a reakciókat hasonló módon katalizálják réz(I)-, réz(II)- és kobalt(II)sók, valamint kobaloxim, ferroxim, kobalt(III)- és réz(II)-oxalát, továbbá mangán komplexek. Az enzimmechanizmus kutatásában Simándi modellreakciói mutattak rá, hogy gyökök is szerepelhetnek a kérdéses első két-elektron oxidációs folyamatban. ESR merésekkel sikerült ugyanis igazolnia, hogy a (3-5) reakciókban 2- amino-fenoxil gyök intermedier képződik, ami nagy valószínűséggel egy terner fém- hidroperoxo-, vagy fém-peroxo-szubsztrát komplex kialakulásán keresztül történhet [17, 18].
1.2.2. A pirokatechin oxidáz enzim (CO – EC 1.10.3.1) és modelljei
A oxidoreduktáz enzimek következő képviselője a növényvilág számos tagjában megtalálható, és a fenoxazinon szintetázhoz hasonlóan szintén a rézcentrumok határozzák meg az aktivitását. Az édesburgonyából (Ipomoea batatas) kinyert és sikeresen meghatározott szerkezet, 39 kDa tömegű enzimet takar, amely természetes állapotában (met forma) hármas típusú réz központtal rendelkezik [19] (4. ábra).
4. ábra
Az édesburgonyából kinyert pirokatechin oxidáz enzim természetes (met) formában
11
Ebben az inaktív állapotban felismerhető a hármas réz típusra érvényes réziononkénti 3-3 hisztidin koordináció, a trigonális piramis szerkezet és a Cu(II)-Cu(II) közötti oxo-híd 2,87 Å távolsággal. A redukált (dezoxi) formában a centrumok híd- kapcsolata megszűnik, a CuA-hoz víz kötődik torzult trigonális piramissá váltva a geometriát, miközben a CuB körül egy síknégyzetes koordinatíve telítetlen állapot alakul ki. A távolságuk ebben az állapotban 4,40 Å. Egy másik kétmagvú rézcentrummal rendelkező enzim a tirozináz (EC 1.14.18.1.), melynek kristályszerkezetét évekkel később határozták meg, hasonló aktív centrumot mutat [20]. Az azonos osztályba tartozó biokatalizátorokat, és kinetikai kísérleteket alapul véve, már a szerkezet pontos ismerete nélkül is születtek hipotézisek a mechanizmussal kapcsolatban [21]. A feltételezések közös pontja az enzim oxi állapotára vonatkozik, ami a szubsztrát kapcsolódásakor jön létre, és a spektroszkópiai, valamint a modellvegyületek reakcióiból származó adatok alapján µ-η2:η2 formában tartalmaz peroxo híd-ligandumot [22].
Szerkezetét tekintve – legalábbis az aktív centrum szempontjából – a pirokatechin oxidáz meglehetősen hasonlít a tirozináz enzimhez, azonban funkcióban kicsit elmarad tőle, ugyanis monooxigenáz aktivitással nem rendelkezik. Hasonlóságuk onnan származik, hogy orto-difenol származékok oxidációját képesek katalizálni orto-kinonná dioxigén jelenlétében, miközben a dioxigént vízzé redukálják. Biológiailag értelmezve a növények érési-rothadási ciklusában a barna (fekete) színt eredményezik. Ez a képződő melaninoknak köszönhető melyek nagyon jó fotokémiai tulajdonságokkal rendelkeznek.
Sötét színük révén képesek a napsugárzásból származó káros UV sugarakat elnyelni, így a szervezetek számára védelmi funkciót töltenek be [23]. (Az UV sugárzás elnyelése csökkenti a szabadgyökök képződését, amelyek közvetlen okozói nagyon sok nemkívánatos biológiai folyamatnak, többek között a DNS károsodásának.)
A tirozinból kiinduló melaninhez tartó leegyszerűsített folyamat az 5. ábrán látható [24]. A szintézis első szakaszában a kizárólag enzimatikus folyamat mindössze csak az o- DOPAkinon kialakulásáig tart. A melanocitákban termelődő tirozináz enzim DOPÁ-vá (L- 3,4-dihidroxi-fenilalanin) oxidálja a p-hidroxi-fenilalanint, ami ezután több különböző enzim közreműködésével is képes o-DOPAkinonná oxidálódni. Hasonló felépítésű fenolokon más réztartalmú enzimek is képesek az említett reakciót katalizálni. Ezeket összefoglaló néven polifenol-oxidáz (PPO) enzimeknek hívjuk. Ilyen például a lakkáz, vagy az L-aszkorbát oxidáz is [25].
12
HO NH3
COO
Tirozin
Tirozináz O2 +
HO NH3
COO +
O NH3
COO +
HO O2 O
DOPA o- DOPAkinon-H+
O NH2
COO + O
HO HO
o- DOPAkinon H+ - H
NH COO LeukoDOPAchrome HO
O
NH COO DOPAchrome eumelanin
feomelanin
+ cisztein Tirozináz Pirokatechin oxidáz
5. ábra
A tirozinból kiinduló melanin szintézis
Az enzimek szerepe a mechanizmusban egyértelműen a réz központjukhoz köthető, bár részleteiben nem ismert pontosan, hogy miként. További fontos paraméterek a CuA– CuB távolság, a híd-ligandum jelenléte, a pH, a fémek redox hajlama, valamint a protein negyedleges szerkezete s annak hidrofil-hidrofób felülete. Mindezek együtt határozzák meg a funkciót, és alapul szolgálhat egy-egy modell-vegyület előállításához.
Az eddigi ismeretek alapján Krebs [26] és Solomon [22] által javasolt mechanizmus egy körfolyamat, amelyben az enzim két mól pirokatechint oxidál kinonná, miközben egy mól dioxigént használ fel (6. ábra). A met és dezoxi állapot az enzim szerkezetének meghatározásakor ismertté vált, azonban az oxi állapot csupán a spektroszkópiai mérések alapján feltételezhető. Ezek a két réz közötti dupla oxo hidat sugallják µ-η2:η2 formában a jellegzetes Raman spektroszkópiával mért jellemzőik alapján. A Limulus polyphemusból származó oxihemocianin (Hc) enzim esetén a megegyező spektrumok mellett röntgenadatok is alátámasztják ugyanezt a struktúrát [27].
A szubsztrát kapcsolódása további kérdéseket vet fel. A CO enzim természetes inhibitora – a fenil-tiokarbamid (PTU) – tioéter hidat képezve egy nitrogénen keresztül kapcsolódik az enzim központhoz. Pirokatechint szuperimponálva az inhibitorra a CO-PTU komplexben a van der Waals-kötések száma úgy alakul ideálisan, ha az egy oldalon koordinálódik a CuB rézhez. Ezt az elképzelést erősíti meg az egyik közelben levő glutamát (Glu 236), amely a szubsztrát deprotonálódásában asszisztálhat [19].
13
CuAII CuBII O H
His His His His
His His
CuAII CuBII O H
His His His His
His His
CuAI CuBI His
His His His
His
His CuAII CuBII
O
His His His His
His His
O
OH OH 2H+
O O H+
CuAII CuBII O
His His His His
His His
O O2
OH OH
3H+ O O
+ H2O
met-forma
dezoxi-forma oxi-forma
O2H
O O
O O
2 H++ H2O
CuAII CuBII O H
His His His His
His His
HO O
6. ábra
A Krebs és Solomon által javasolt körfolyamat a CO enzim mechanizmusára [26, 22]
A modellkísérleteket is figyelembe véve, és a két Cu(II)-ion ideális távolságából adódóan az oxi formában a hidat alkotó szerkezet sem kizárt. Mivel ez az állapot elég instabilis, így rövid ideig létezik, ezért csak kevés számításba vehető módszer áll a kutatók rendelkezésére. Általában csak ESR és abszorpciós spektroszkópiai módszerekre lehet hagyatkozni. A rézionok közötti távolságot EXAFS (röntgenabszorpciós finomszerkezet spektroszkópia) méréssel lehet meghatározni. Az ESR-rel a réz típusa állapítható meg;
abszorpciós és rezonancia spektroszkópiával pedig a peroxo O–O kötés jellege deríthető ki.
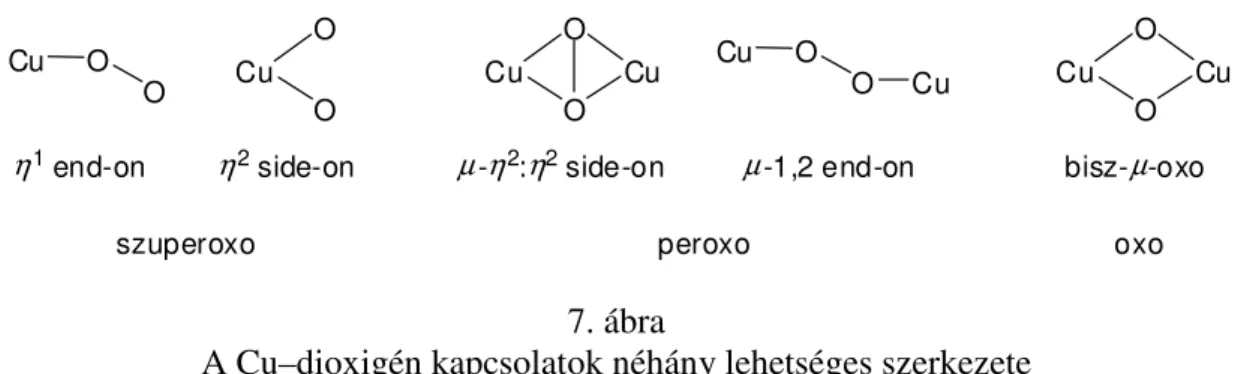
A 6. ábrán bemutatott µ-η2:η2 kapcsolat O–O Raman frekvenciája ~750 cm-1 körül jelentkezik nagyon gyenge jelként. UV-Vis spektrumban egy erős fényelnyelési abszorpció látható ~345 nm körül (log ε = 3,78 – 4,04 származási helytől függően), és egy gyengébb 580 nm-nél (log ε = 2,65) [5, 28]. Ezek az értékek összevethetőek a sokkal gyakrabban előforduló bisz-µ-oxo szerkezettel, ahol a Raman rezgés ~610 cm-1-nél, valamint az UV- Vis maximum 450 nm-en (log ε = 4,11) jelentkezik [29]. Néhány lehetséges Cu–dioxigén koordinálódás mód a következő ábrán látható (7. ábra).
14
O O
Cu Cu
O O
Cu
Cu O
O Cu O Cu
O O Cu
O Cu
η1end-on η2side-on szuperoxo
µ-1,2 end-on µ-η2:η2side-on
peroxo oxo
bisz-µ-oxo
7. ábra
A Cu–dioxigén kapcsolatok néhány lehetséges szerkezete
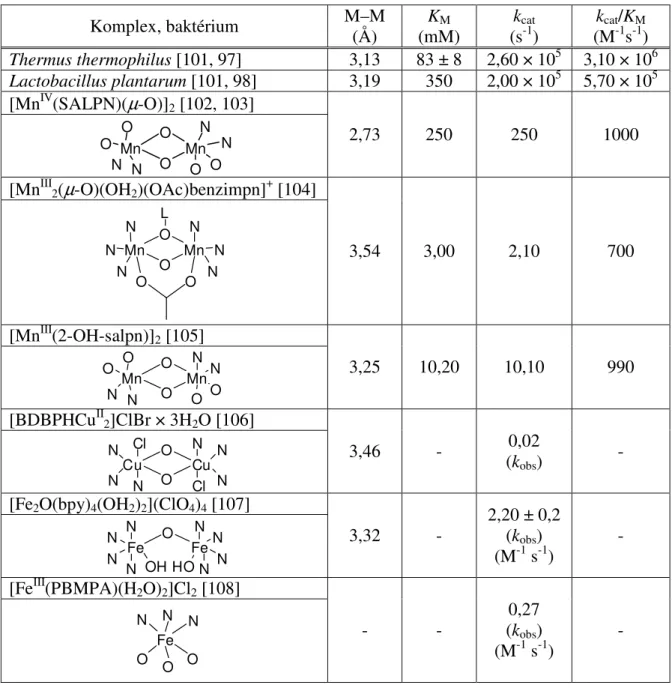
A CO működési és funkcionális modelljeit bemutató tudományos közlemények száma évről-évre nagy ütemben növekszik. Néhány kiválasztott vegyület, és azok kinetikai adatai a 1. táblázatban vannak összeállítva.
1. táblázat. Egy-, és kétmagvú CO modellek szerkezeti és kinetikai adatai
Komplex Cu–Cu
(Å)
KM (M)
kcat (s-1)
kcat/KM
(M-1s-1) Cu2(Lig1)(OH)(ClO4)4 [30]
3,45 8,90 × 10-5 7,80 × 10-1 8752
Cu2(Lig2-O)(CF3SO3)3 [31]
3,70 2,90 × 10-3 3,30 × 10-2 11,40
Cu2(Lig3)(µ-OH)3+ [32]
3,76 4,90 × 10-3 - -
(aktív forma) Cu2(Lig4-O)(µ-OH)(ClO4)2 [33]
2,99 4,20 × 10-4 4,50 × 10-2 107
Cu2(Lig5)(MeCN)2(ClO4)4 EtOH [34]
4,76 nincs aktivitás
Cu(acac)2 , Cu(bpy)2 stb. [35] - - - -
OH Cu N CuN
N
N N N
O3ClO OClO3
Cu N Cu
N N
N N O N
O S
O
Cu N Cu
N N
N N N O
O
Cu Cu
O O H
N N N
N
Cu N Cu
N N
N N N
N N
O
15
OH OH
pirokatechin 1,2-dioxigenáz
O2 HO
O OH
O
pirokatechin
ci sz,ci sz-mukonsav
pirokatechin 2,3-dioxigenáz
O2
CHO OH COOH
α-hidroxi-mukonsav-szemialdehid
A bemutatott komplexek kiválasztásánál figyelembe vettem, hogy lehetőleg minden spektroszkópiailag ismert típus szerepeljen.
A táblázatban a rézionok közötti kapcsolat és a távolság is fel lett tüntetve. Ahogy korábban is említésre került, ezek fontos adatok, ugyanis a szubsztrátum koordinálódásának módját határozzák meg. Amennyiben a távolság nagyobb, mint 4 Å, a modell már kevés eséllyel, vagy csak alacsony hatásfokkal képes az oxidációt katalizálni.
Mindezekből egyenesen következik, hogy a kétmagvú komplexek többnyire jobb katalitikus sajátságokkal rendelkeznek, mint egymagvú analógjaik [35]. Az oxi állapot alakját illetően látszólag nem vonható le szigorú következtetés a reakció kimenetelével kapcsolatban, bár a µ-OH híddal rendelkező komplexek jobban teljesítenek. Ez arra utalhat, hogy ebből a szempontból csak a fém redoxi tulajdonságai számítanak. Kutatása azonban továbbra is fontos feladat marad, hiszen az inertnek ismert triplett állapotú dioxigén aktiválása ebben a stádiumban teljesedik ki, és még nem ismert pontosan, hogy hogyan.
1.2.3. A pirokatechin dioxigenázok és modelljeik
Az előző fejezetben tárgyalt enzim szerepe a pirokatechin származékok oxidációján alapul. Oxigénezésük azonban bonyolultabb folyamat, és az erre „szakosodott” enzimek is több módon láthatják el ezt a feladatot. Attól függően, hogy a két hidroxilcsoport között, vagy a gyűrű egy másik pontján katalizálják a C–C kötés felszakítását, megkülönböztetünk intradiol-, vagy extradiol-típusú hasítást (8. ábra).
8. ábra
A pirokatechin dioxigenázok által katalizált reakciók
16
O O
R Fe3+
O O
R Fe2+
O O
R Fe2+
O2
O O
O O
R Fe3+
O O O
O
O COOH R
R COOH
Fe3+
Intradiol hasítást végző enzimek
A 8. ábra felső része a pirokatechin intradiol hasításának reakcióját mutatja.
Termékként cisz,cisz-mukonsavat kapunk, ami adipinsavvá hidrogénezhető. Az adipinsav iparilag fontos nyersanyag műanyagok, vagy természetben lebomló polimerek gyártásához.
Enzimatikus úton történő előállítása tehát divatos téma jelenleg a kémiai és biomérnöki kutatásokban [36]. A szomszédos hidroxilcsoportok közötti gyűrűhasítást több enzim is képes elvégezni különböző szubsztrátum származékokon. Az irodalomban előforduló két fontosabb képviselőjük a talajban található baktériumokból kinyert pirokatechin 1,2- dioxigenáz (1,2-CTD; EC 1.13.11.1) és protocatechuat 3,4-dioxigenáz (3,4-PCD; 3,4- dihidroxi-benzoát 3,4-dioxigenáz; EC 1.13.11.3). A korábban bemutatott enzimektől eltérően a katalitikus hatásuk a nagy spinszámú, nem porfirin-vázas vas(III) aktív centrumuknak köszönhető. A 3,4-PCD enzimet már az 1960-as években ki tudták nyerni kristályos formában [37], különböző spektroszkópiai módszerekkel is vizsgálták [38, 39], azonban röntgenszerkezetét csak 1988-ban ismerték meg [40]. A vas(III)ion trigonális bipiramisos környezetben található, két tirozin és két hisztidin, plusz egy víz molekula koordinálódik hozzá alapállapotban. A szubsztrátummal együtt készült röntgenvizsgálat alapján egy fontos szerkezeti változás történik az aktív formájában. A pirokatechinek kétfogú ligandumként kapcsolódnak, és kiszorítanak egy tirozint a koordinációs övezetből, valamint a forma oktaéderesre változik [41].
9. ábra
A pirokatechin 1,2-dioxigenáz javasolt mechanizmusa
Az 1,2-CTD szerkezetének meghatározására jóval később 2000-ben került sor [42].
Az eredmények az mutatták, hogy nincs számottevő eltérés a 3,4-PCD enzimtől. A szerves
17
ligandumok hasonló módon koordinálódnak a központi vashoz, és annak oxidációs állapota nem változik az enzimfolyamat során. Mindemellett ismerve, hogy a triplett állapotú oxigén nagy affinitással rendelkezik gyökös jelleggel rendelkező reakciópartnerekkel szemben, logikus feltételezni egy szemikinonon keresztül induló mechanizmust, ahogy a 9. ábra is mutatja [43].
Extradiol hasítást végző enzimek
A 8. ábra alsó része a pirokatechinek extradiol hasítását vázolja. A katalizált reakcióban való eltérés alapján nem meglepő, hogy szerkezetileg is nagy különbségeket találtak „intradiolos” rokonaikkal szemben. Legszembetűnőbb, hogy a vasion a centrumban ezúttal Fe2+ formában található a natív enzimekben. A 2,3-CTD (EC 1.13.11.2) például egy tetramer, ami egységenként egy-egy Fe2+-t tartalmaz [44] két hisztidin és egy glutaminsav alkotta környezetben az első elérhető szerkezet alapján.
Érdekesség, hogy 2,3-dioxigenázok más fémeket használó válfajait is azonosították Mn(II) [45, 46] – Arthrobacter globiformis-ból kinyert 3,4-dihidroxi-fenilacetát-2,3-dioxigenáz (EC 1.12.11.15) – és Mg(II) centumokkal [47], – ugyanazon enzim Klebsiella pneumoniae-ból – bár az utóbbi röntgen szerkezete nem ismeretes (10. ábra).
10. ábra
Fe és Mn tartalmú pirokatechin 2,3-dioxigenázok aktív centruma [48, 46]
18
A mechanizmust tekintve alapvető különbség az intradiol és extradiol hasítást végző enzimek között, hogy az előbbieknél molekuláris oxigén jelenléte szükséges az aktív állapot eléréséhez, míg az utóbbiak a szubsztrátum segítségével képesek a dioxigén megkötésére, továbbá az aktiválódásra. A 10. ábra bal oldalán egy nemrég meghatározott [48] vastartalmú 2,3-CTD aktív centruma látható 4-nitro-pirokatechin szubsztrátummal, az enzimreakció különböző fázisaiban. A szerencsés szerkezet-meghatározásra azért kerülhetett sor, mert a tetramer enzim egységei kis részletekben különböznek egymástól, így az egyes egységekben, adott pillanatban, a reakciók nem azonos intermedier szakasznál tartanak.
A hasonló mangántartalmú enzim röntgen adatait is alapul véve, a Lipscomb csoport a 11. ábrán látható extradiol 2,3- dioxigenáz katalitikus ciklust javasolta [49]. Fontos megjegyezni, hogy a feltételezett gyökös mechanizmus miatt, valamint a röntgen, a Mössbauer, ESR és IR mérések alátámasztásával [50] a legújabb kutatások szerint, a fém oxidációs állapota nem változik, és az aktív forma egy Fe(II)-O2- (vas- szuperoxo) adduktumban teljesedik ki.
11. ábra (jobbra) Az extradiol hasítást végző 2,3- dioxigenázok javasolt mechanizmusa [49]
19
O O O
O
O
O
OH O O
O O
O O
O O
O
7 8 9 10
11 12
intradiol extradiol
egyéb
Az extradiol hasítás lehetősége az 1,2-CTD enzimeknél és modelljeiknél
Kevésbé ismert tény az intradiol hasítást végző enzimeknél, hogy bizonyos szubsztrátumok alkalmazásánál extradiol hasítás során keletkező végtermékeket is lehet azonosítani. 1975-ben Fujiwara fedezte fel, hogy a Pseudomonas fajokból származó 1,2- CTD a 3-metil-pirokatechint – a keletkező termékek alapján – extradiol módon is hasítja.
Később kiderült, hogy akár o-amino-fenollal [51] is hasonló reakciók mehetnek végbe.
Számtalan bioutánzó – főleg vas – komplexet gyártottak a mechanizmus megismerése érdekében [52, 53], de egyelőre még a szelektivitást is nehezen tudják megmagyarázni.
Tény, hogy befolyásoló hatással van a reakció kimenetelét tekintve a fém oxidációs állapota, a szubsztrátum koordinációja és az oldószer is. Ez utóbbira érdemes külön figyelmet fordítani, ugyanis Speier és Tyeklár modellkísérleteikben szubsztituált pirokatechin származékok autooxidációs folyamatait vizsgálva [54] azt találták, hogy az aprotikus, vagy protikus közeg jelenléte már a köztitermékként kialakuló szemikinont is meghatározza. Ez további hatással van a gyűrűnyitási, vagy a benzokinon végtermékek képződésére. A különbségek utalhatnak az enzim aktív centrumában uralkodó hidrofil- hidrofób körülményekre. A fém oxidációs állapotával kapcsolatban ismét csak a modellkísérletekre lehet hivatkozni. Legyen szó Rh2+, 3+, Co3+, Ir3+ [55], vagy Fe2+,3+ [53]
komplexekről, többnyire mindenfajta gyűrűhasítási terméket megfigyeltek. A 12. ábrán a leggyakrabban detektált intra-, és extradiol hasítás termékei lettek összegyűjtve a sok esetben alkalmazott 3,5-di(terc-butil)-pirokatechin (dtbcatH2) példáján keresztül.
12. ábra
Az intradiol és extradiol hasítás termékei dtbcatH2 szubsztrátum esetén
20
CH4 CH3OH
O2,NADH H2O, NAD metán-
monooxigenáz
metanol- dehidrogenáz
H2CO
HCOOH
NAD NADH
hangyasav- dehidrogenáz
NAD NADH
formaldehid- dehidrogenáz
CO2
1.2.4. A metán-monooxigenáz enzim (MMO -- EC 1.14.13.25)
A dolgozatban szó volt eddig réz és vas centrummal is rendelkező enzimekről. A metanofil, vagy metanotróf baktériumokban található metán-monooxigenáz (MMO, EC 1.14.13.25.) valahová a kettő közé sorolható. A magyarázat annyi, hogy két jól elkülöníthető formája létezik, a „szemcsés” (particulate – pMMO) és „oldható” (soluble – sMMO). A fémek az enzim szekréció és aktivitás szempontjából is fontos szerepet játszanak. A pMMO-t minden baktérium alfaj (egy kivételével) képes termelni, és rézben gazdag környezet szükséges hozzá, ezen felül réznek köszönhető az aktivitása is. Az sMMO-t már kevesebb példány termeli, főleg rézhiányos környezetben, és valószínűleg ennek köszönhetően az aktív centrumban vas található [56]. Ezek a jellemzők a szubsztrátum specifikusságukat is alapjában meghatározzák. Az első forma a rövidebb egyenes láncú szénhidrogéneket (C1-C5) elsősorban alkoholokká, valamint a megfelelő alkéneket epoxidokká képes oxidálni. A második forma jóval többfajta vegyület átalakítására alkalmas [57, 58]. Ez utóbbiról számtalan publikáció jelent meg és jelenik meg, még a szerkezetének meghatározása után is, ugyanis kutatása minden formában könnyebb az oldhatósága miatt [59]. A 13. ábra részletekben szemlélteti a metán teljes biológiai lebontását jól ábrázolva a MMO szerepét a folyamatban.
13. ábra
A metán teljes biodegradációja a Methylococcus capsulatus (Bath) baktériumban [60]
A továbbiakban a metán-monooxigenáz pMMO formáját mutatnám be részletesebben, ugyanis a 3.3 fejezet címszereplő rendszerének képességei sokkal inkább ehhez hasonlíthatóak.
A sejtmembránhoz kötődő partikuláris metán-monooxigenáz röntgen-szerkezetét 2005-ben Methylococcus capsulatus (Bath) baktériumból Rosenzweig csoportjában
21
határozták meg [61]. A trimer enzim három ~ 100 kDa tömegű egységből áll, ahogy a 14.
ábra mutatja eltérő színekkel. Egységenkénti három aktív centrum jelenlétét feltételezik.
Az egymagvú rézközpont környezetét két hisztidin és egy glutamin alkotja. A közelében a kétmagvú réz körül három hisztidin, valamint az egy másik alegységben levő cink körül két hisztidin, egy glutaminsav és egy aszpartámsav található. A első röntgenszerkezet megmérése után, az elkövetkezendő évek folyamán, különböző kutatóhelyek számos ellentmondó eredményt publikáltak a spektroszkópiai méréseik alapján. Ezek megkérdőjelezni látszanak az előzőleg közölteket. Egy nemrég megjelent összegző cikk [62] alapján a Mössbauer mérések a „cink” központban kétmagvú vasra utalnak, az ESR adatok szerint pedig több különböző rézion is jelen lehet. A tisztítási eljárások következtében kicserélődhetnek egyes fémionok ami a cink jelenlétét kérdésessé teszi. Az EXAFS adatok közeli Cu–Cu kapcsolatra utalnak, így ezek megerősítik az eredeti észlelést [63]. Érdekes, hogy egy másik baktériumból (Methylococcus trichosporium OB3b) kinyert szintén pMMO enzim nemrég bemutatott röntgen szerkezetéből már teljesen hiányzott a cink centrum [64]. Mi lehet akkor a valódi szerkezet? Annak tisztázása csak az alkalmas szubsztrátummal együtt kristályosított röntgendiffrakciós méréstől várható a jövőben.
14. ábra
A pMMO enzim trimer szerkezete normál (a), és sejtmembránra merőleges (b) nézetekből [61]
A szerkezettel kapcsolatos sok bizonytalanság ellenére a kutatók többsége mindenképpen valamilyen rézcentrumot tart valószínűnek a rendelkezésre álló adathalmaz alapján. A számtalan előállított komplex, amelyekkel funkcionálisan próbálják modellezni
22
CuII CuIII O O
C H
H H
H
C H
H H C
H
H H
C H
H H
OH CuII CuIII
O O
H
CuII CuII O O
H
CuII CuIII O O
H
CuI CuII O
C H H
H
a pMMO-t, főleg rezet tartalmaz. A többi réz-metalloenzimhez hasonlóan, réz-dioxigén (CuxOy) komplexekkel [65] próbálják leírni azt a mechanizmust ami arról ismert, hogy képes a metánban levő legerősebb alifás C–H kötéseket (kötési energia: 104 kcal / mol) is felszakítani, majd oxidációt véghezvinni.
Komoly figyelmet szerzett például Chan és munkatársainak cikke [66], amely szerint trinukleáris réz-centrumot is tartalmazhat a pMMO. Az állításukat izotróp ESR jelekre, potenciometriás titrálásra és ide kapcsolódó számítógépes DFT (density functional theory – sűrűségfunkcionális elmélet) elméleti számításokra alapozták. Szerintük, a trinukleáris mag tökéletesen beilleszthető az enzim egy hidrofil aminosavakkal teli egységébe, ami ráadásul nem is azoknak az aktív centrumoknak az egyike, amit a röntgenszerkezet alkotói leírtak. Az ide illeszthető hidroxilezési mechanizmus hasonló a 15. ábrán láthatóhoz, annyi különbséggel, hogy az egyik oxigén atom µ3-O-Cu3 formában alkot hidat három réz között. Néhány korábban előállított, szintén trinukleáris magot tartalmazó Cu2+-pirazolát [67] és összetettebb [68] funkcionális modell komplex, és azok pMMO aktivitása jó alátámasztással szolgálnak ehhez a feltevéshez.
Ezektől függetlenül, azonban továbbra is a leginkább elfogadott nézet a kétmagvú centrum jelenlétéhez kötődik. A modellreakciókban a pirokatechin oxidáz enzimmel megegyezően (1.2.2 fejezet), ebben az esetben is a µ-η2:η2-peroxo Cu22+ és bisz-µ-oxo Cu23+ formációknak köszönhető az egész enzimutánzó, és ennek alapján feltehetőleg az enzimatikus folyamat is [69, 70]. Az utóbbiról még nem található biológiai hivatkozás, azonban a gyakorlat és az elméleti számítások ebben az esetben mutatják a legerősebb katalitikus képességet. A 15. ábrán látható mechanizmus szerint a „kör” ráadásul még tovább szűkül egy vegyes oxidációs állapotú, kétmagvú rendszerre [71].
15. ábra
A pMMO modellkísérlet mechanizmusa kétmagvú rendszernél [71]
A harmadik lehetséges aktív centrum az enzimben cinket, vagy nagyobb valószínűséggel rezet tartalmazhat. Kicsinek tartják ugyan a valószínűségét, hogy ezen a
23
helyen is katalitikus reakciók játszódjanak le, azonban az egymagvú Cu–O2 rendszer is képes C–H kötés aktiválásra. A szuperoxo-réz vegyületek side-on és end-on formái – ugyan nem túl nagy hatékonysággal, de – fenolok oxidációjára képesek [69]. A CuII–OOH (hidroperoxid) és CuII(O2•-) (szuperoxid) komplexek – részletes spektroszkópiai mérésekkel igazolva – reaktívak ugyan, de magukban nem képesek C–H kötések bontására, csak valamilyen hidrogén atom donorral (fenol, TEMPOH). Az így keletkező magas vegyértékű réz-oxo (CuIII=O, CuIV=O) formációk az elméleti számolások alapján létrejöhetnek, azonban a gyakorlatban még nem mutatták ki őket. Kialakulásuk heterolitikus CuII–OOH, vagy homolitikus O–O kötés-hasadással lehetséges, ami termodinamikailag nem kedvezményezett, mégis racionális magyarázat a mechanizmus szempontjából [65, 72, 73] (16. ábra).
16. ábra
A pMMO egymagvú modell rendszerénél felvázolt lehetséges mechanizmus [65]
A fenti ábrán a réz ebben az esetben egy N–CH3 rendszert oxidál, amely ráadásul a ligandum egysége. Nehéz olyan egymagvú komplexet találni az irodalomban, ami igazi modellje lehetne az enzimnek. A tesztek szerint a vegyületeknek, amelyek megfelelhetnének ennek a kritériumnak, oxidálni kellene maximum 5 szénatom hosszúságú szénhidrogéneket C2-nél, ráadásul enantioszelektíven [74]. Lucas és Karlin mutattak be egy anizol tartalmú, négyfogú polipiridil ligandumot, ami rézzel toluolt és etil- benzolt volt képes oxidálni, azonban mindehhez a komplex dimerizációja szükséges [70].
24
HO OH
NH3+
HO OH
NH3+ OH 2 H+, 2e-
aszkorbát dehidro-aszkorbát
O2 H2O
2 H+, 2e-
aszkorbát dehidro-aszkorbát
O2 H2O
DβM
N PHM H O
O- O
NH O
O- O OH
A reakció az alifás oldalláncon történt. Kunishita és Itoh a komplexükkel kumén- hidroperoxid által aktiválva egy akridin származék oxidálását voltak képesek elérni [75].
Ezek a cikkek mind egyedi eseteket mutatnak be C–H kötés aktiválására, így funkcióban közel állnak a pMMO-hoz. Specifikusságukról és több szubsztrátummal szemben mutatott viselkedésükről azonban a rendelkezésünkre álló adatmennyiség rendkívül hiányos.
Amennyiben a fentiekben egymagvú rézrendszerekről volt szó, két további enzimet érdemes még röviden megemlíteni. Ezek a dopamin-β-monooxigenáz (DβM – EC 1.14.17.1) és peptidil-glicin monooxigenáz (PHM, EC 1.14.17.3). Mindkét enzim aszkorbát segítségével (hidrogén absztrakció) képes hidroxilezni C–H kötéseket [76, 77]
(17. ábra).
17. ábra
A DβM és PHM enzimek biológiai funkciója [76]
A 17. ábra a DβM dopamin, és PHM peptidil-glicin oxidációját szemlélteti az erre alkalmas enzimek segítségével. Az esetek többségében, amikor pMMO aktivitásról, CH kötés oxidálásról esik szó a modellkísérletek során, ezek az enzimek is szóba kerülnek. A 16. ábrán bemutatottakhoz hasonlóan feltételezik működésüket, ami egyben a PHM tökéletes funkcionális modellezését is mutatja. Ha a jövőben bizonyossá válik, hogy a pMMO egymagvú aktív centrumot is tartalmaz, akkor talán majd az ezekkel az enzimekkel végzett kísérletek is hozzájárulnak a mechanizmus megfejtéséhez.
![A fenoxazinon szintetáz kristályszerkezetét 2006-ban Smith írta le [8]. (3. ábra) Az enzim két oligomer formában létezik](https://thumb-eu.123doks.com/thumbv2/9dokorg/872622.46935/16.892.140.752.684.1062/fenoxazinon-szintetáz-kristályszerkezetét-smith-írta-oligomer-formában-létezik.webp)

![6. táblázat. A 19 komplex által katalizált OAP oxidáció kinetikai adatai (leveg ő n, 40°C-on, DMF oldószerben) Mérés szám [O 2 ] (10-3 M) [Mn] (10-4 M) [OAP] (10-3 M) V 0(10-8 M s -1 ) 1 1,13 1,67 1,67 3,27 2 1,13 1,67 4,17 6,99 3 1,](https://thumb-eu.123doks.com/thumbv2/9dokorg/872622.46935/54.892.226.668.138.772/táblázat-komplex-katalizált-oxidáció-kinetikai-adatai-oldószerben-mérés.webp)
![9. táblázat. A 23 komplex krisztallográfiai adatai Komplex [Cu 4 (bnac) 4 ( µµµµ -EtO) 4 ] Összegképlet Cu 4 O 12 C 48 H 56](https://thumb-eu.123doks.com/thumbv2/9dokorg/872622.46935/60.892.218.700.223.733/táblázat-komplex-krisztallográfiai-adatai-komplex-bnac-µµµµ-összegképlet.webp)