DOKTORI (PhD) ÉRTEKEZÉS
Készítette
SELMECZI KATALIN okleveles vegyészmérnök
RÉZ(II) KOMPLEXEK, MINT FUNKCIONÁLIS ÉS SZERKEZETI ENZIMMODELLEK FOSZFORSAV ÉSZTEREK HIDROLÍZISÉBEN
VALAMINT PIROKATECHIN OXIDÁCIÓJÁBAN
Témavezetők Dr. Speier Gábor Dr. Marius Réglier
Veszprémi Egyetem, Szerves Kémia Tanszék
Université d’Aix-Marseille III, Laboratoire de Bioinorganique Structurale 2003
THÈSE Présentée par
Katalin SELMECZI
pour obtenir le grade de Docteur en Sciences de l’Université de Veszprém et
de l’Université de Droit d’Économie et des Sciences d’Aix-Marseille
Spécialité: Chimie Organique
REACTIVITÉ CHIMIQUE DE COMPLEXES DE CUIVRE(II):
APPLICATIONS EN HYDROLYSE DES PHOSPHOESTERS ET EN OXYDATION DU CATÉCHOL
Directeurs de Thèse: Dr. Gábor SPEIER Dr. Marius RÉGLIER
Université de Veszprém, Departement de Chimie Organique
Université d’Aix-Marseille III, Laboratoire de Bioinorganique Structurale 2003
RÉZ(II) KOMPLEXEK, MINT FUNKCIONÁLIS ÉS SZERKEZETI ENZIMMODELLEK FOSZFORSAV ÉSZTEREK HIDROLÍZISÉBEN
VALAMINT PIROKATECHIN OXIDÁCIÓJÁBAN Értekezés doktori (PhD) fokozat elnyerése érdekében a Veszprémi Egyetem Kémia Doktori Iskolájához illetve
az Université de Droit, d’Economie et des Sciences d’Aix-Marseille III, Faculté des Sciences et Techniques de Saint Jérôme-hoz tartozóan.
Írta:
SELMECZI Katalin
Témavezetők: Dr. SPEIER Gábor
Dr. Marius RÉGLIER
Elfogadásra javaslom (igen / nem) ………
(aláírás) Elfogadásra javaslom (igen / nem) ………
(aláírás) A jelölt a doktori szigorlaton …... % -ot ért el.
Veszprém, …...
a Szigorlati Bizottság elnöke
Az értekezést bírálóként elfogadásra javaslom:
Bíráló neve: Dr. GAJDA Tamás igen /nem
……….
(aláírás) Bíráló neve: Dr. Andréas HEUMANN igen /nem
……….
(aláírás)
A jelölt az értekezés nyilvános vitáján…...% - ot ért el.
Veszprém, ……….
a Bíráló Bizottság elnöke A doktori (PhD) oklevél minõsítése…...
………
Az EDT elnöke
Kivonat
Réz(II) komplexek, mint funkcionális és szerkezeti enzimmodellek foszforsav észterek hidrolízisében valamint pirokatechin oxidációjában
Készítette Selmeczi Katalin
Veszprémi Egyetem, Szerves Kémia Tanszék
Université d’Aix-Marseille III, Laboratoire de Bioinorganique Structurale Témavezetők Dr. Speier Gábor
Dr. Marius Réglier
Jelen dolgozat célja a metalloenzimek csoportjába tartozó metallofoszfoészterázok illetve pirokatechin oxidáz enzim hatásmechanizmusának, szerkezet és reakciókészség közötti összefüggés vizsgálata egyszerű modellreakciókon keresztül.
Modellvegyületként különböző réz(II)-RNPY2 típusú komplexeket állítottunk elő, melyek szerkezetét spektroszkópiai és röntgendiffrakciós módszerekkel határoztuk meg.
A felhasznált egy- illetve kétmagvú komplexek aktivált foszforsavészterek hidrolízisében mutatott aktivitásbeli különbség alapján bizonyossá vált a fémionok közötti együttműködés a kétmagvú komplex esetén. Így nemcsak a szubsztrátum egyszerű Lewis savas aktiválásról beszélhetünk, hanem a második fémionhoz koordinálódott vízmolekula együttes aktiválásáról is.
Az előállított két, kétmagvú réz(II)-komplexek pirokatechin oxidációjában mutatott aktivitásán keresztül jól vizsgálható a szerkezet és a reakciókézség közötti kapcsolat. A merevebb hidroxohidas szerkezet esetén a reakció a klasszikus Michaelis-Menten kinetikát követi, míg a lazább, összekötöhíd nélküli komplex esetén egy réz(I)-dioxigén kémiáról beszélhetünk.
Abstract
Studies of some copper-containing functional and structural enzyme models in the hydrolysis of phosphate ester and oxidation of catechol
Written by Katalin Selmeczi
University of Veszprém, Department of Organic Chemistry
Université d’Aix-Marseille III, Laboratoire de Bioinorganique Structurale Supervisors Dr. Gábor Speier
Dr. Marius Réglier
Model reactions for metallo-phosphoesterases and catechol oxidase have been investigated to elucidate the mechanism of the reaction and the relation between structure and reactivity.
Copper(II)-RNPY2 complexes have been prepared and characterized by X-ray diffraction and spectroscopic methods.
The activity of these mono- and binuclear copper(II) complexes in activated phosphate diester cleavage suggest strongly that the binuclear copper(II) complex mediates a hydrolytic attack on the substrate with cooperativity between the two metal centers. This hints to a combined water and substrate activation by Lewis acid coordination.
Studies on structure and reactivity relation for catechol oxidation catalyzed by these binuclear copper(II) complexes revealed that the hidroxo-bridged rigid dicopper complex follows a Michaelis-Menten type kinetics, while that with the flexible dicopper complex the copper(I)- dioxygen chemistry determines the kinetic scenario.
Zusammenfassung
Die Anwendung von Kupfer(II)-Komplexen als funktionelle und strukturelle Modelle in der Hydrolyse von Phosphorsäure Estern und in
der Oxidation von Brenzkatechin
Gefertigt von: Katalin SELMECZI
Lehrstuhl für Organische Chemie
Universität Veszprém
Doktorvater: Prof. Dr. Gábor SPEIER
Dr. Marius RÉGLIER
Modellreaktionen für Metalloprotease und Brenzkatechin Oxidase wurden untersucht um über deren Mechanismen Informationen und Struktur-Reaktivität Zusammenhänge zu gewinnen. Diese Kupfer-Komplexe Cu(II)-RNPY2 wurden hergestellt und ihre Strukturen spektroskopisch und mit Diffraktometrie ermittelt.
Die Aktivität von diesen mononuklearen und dinuklearen Kupfer-Komplexen in der Hydrolyse von Phosphat Diester zeigt, dass Kooperativität zwischen den Kupferionen in dem dinuklearen Kupfer-Komplex vorhanden ist. Aus dieser Tatsache lässt sich folgen, dass der Katalyst dieser Reaktion sowohl als Lewis-Säure das Wasser aktiviert als also durch Koordination des Wassers eine Aktivierung vorhanden ist.
Die Anwendung dieser binuklearen Kupfer-Komplexe als Katalysatoren bei der Oxidation von Brenzkatechin zeigte, dass die Kinetik mit dem Kupfer-Komplex mit der fixen Hydroxy-Brücke eine Michaels-Menten Kinetik aufweist und die mit dem flexiblen Kupfer-Komplex eine Kupfer-Sauerstoff Chemie folgt.
Ce travail a été préparé au Département de Chimie Organique à l’Université de Veszprém, sous la direction de Docteur Gábor Speier et au Laboratoire de Bioinorganique Structurale, à la Faculté des Sciences et Techniques de St Jerôme, Université d’Aix- Marseille III, sous la direction de Docteur Marius Réglier.
Je tiens à exprimer tout d’abord mes remerciements à Marius Réglier pour m’avoir accueillie dans son laboratoire. Il a su me faire découvrir et apprécier le monde fascinant de la chimie biomimétique grâce à son enthousiasme et sa curiosité permenante. Je le remercie pour sa grande disponibilité, pour la patience et pour le soutien inestimable qu’il a su m’apporter au cours de ces années.
Je remercie aussi l’équipe du LBS, plus particulièrement Michel Giorgi, essentiel au bon fonctionnement de l’équipe, pour sa compétence en mésure par diffraction des RX.
Je tiens à remercier Gábor Speier pour ses conseils scientifiques ainsi que de nombreuses personnes de son équipe pour leur amitié, leur soutien moral tout au long de cette thèse.
Au cours de ce travail, de nombreuses collaborations ont débuté, essentielles à son développement. Ainsi je remercie Docteur Farkas Etelka, Docteur Peintler Gábor et Docteur Rockenbauer Antal pour leur disponibilité et leurs conseils.
Enfin, j’exprime de vifs remerciements aux personnes qui me sont proches et qui ont contribué par leur soutien à l’aboutissement de ce travail.
Veszprém, le novembre 2003. Selmeczi Katalin
Abréviations
LISTE DES ABREVIATIONS
ADN Acide déoxyribonucléique
ARN Acide ribonucléique
ApA Adenine-3’,5-adenine
BNPP bis(p-nitrophényl)phosphate
BDNPP bis(2,4-dinitrophényl)phosphate
bpy 2,2’-bipyridine
cAMP Adenine-2’,3’-cyclic-monophosphate
CO Catéchol Oxydase
DTBCH2 3,5-Di-tert-butylcatéchol
DTBQ 3,5-Di-tert-butyl-1,2-benzoquinone EPNP Ethyl-p-nitrophényl phosphate
EPPS Acide N-(2-hydroxyéthyl)piperazine-N’-(3-propanesulfonique) EXAFS Extended X-ray Absorption Fine Structure
HEPES Acide N-(2-hydroxyéthyl)piperazine-N’-(2-éthanesulfonique)
Hc Hemocyanine
HPLC Chromatographie Liquide à Haute Performance HPNP 4-nitrophényl-2-hydroxypropyl phosphate ibCO Catéchol Oxidase d’Ipomoea batatas
IR Infra-rouge
LMCT Ligand-Metal Charge Transfer
MES Acide 2-(N-morpholino)éthanesulfonique NMR Résonance Magnétique Nucléaire
PNP p-nitrophénol
PNPate p-nitrophenolate
PTU Phénylthiouréa
Rdt Rendement
RPE Resonance Paramagnétique Électronique RX Diffraction des rayons X
TBAP Tetrabutylammonium perchlorate
Tyr Tyrosinase
UV-vis Ultraviolet-visible
Sommaire SOMMAIRE
INTRODUCTION GENERALE...1
CHAPITRE I. INTRODUCTION BIBLIOGRAPHIQUE...3
I. 1 Les protéines à cuivre...3
I. 2 Les phosphoestérases...6
I. 2.1 Métallo-phosphoestérase...6
I. 2. 2 La fonction et la structure de quelques metallo-phosphoestérases...8
I. 2. 2. 1 Nucléases...8
I. 2. 2. 2 Polymérases...10
I. 2. 2. 3 Phosphatases...12
I. 2. 3 Hydrolases synthétiques...13
I. 2. 3. 1 Les substrats utilisés dans l’hydrolyse...14
I. 2. 3. 2 Nucléases artificielles...15
I. 3 La Catéchol Oxydase...21
I. 3. 1 Caractérisation spectroscopique de la CO...22
I. 3. 2 La structure RX de la CO...22
I. 3. 2. 1 Les centres bicuivrique en états différents...23
I. 3. 3 Mécanisme d’action proposé pour la CO...25
I. 3. 4 Les modèles fonctionnels...25
CHAPITRE II. SYNTHESE ET CARACTERISATION DES COMPLEXES CUIVRIQUES...30
II. 1 Description du complexe CuL1(CF3SO3)2 (C1)...31
II. 1. 1 Spectroscopies UV-vis, IR, RPE et RX...31
Sommaire
ii
II. 2 Description du complexe Cu2L2(CF3SO3)4 (C2)...36
II. 2. 1 Spectroscopies d’UV-vis, IR, RPE et RX...36
II. 3 Description du complexe Cu2L3(CF3SO3)4 (C3)...39
II. 3. 1 Spectroscopie d’UV-vis, IR, RPE et RX...39
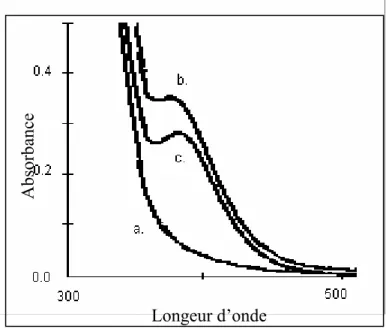
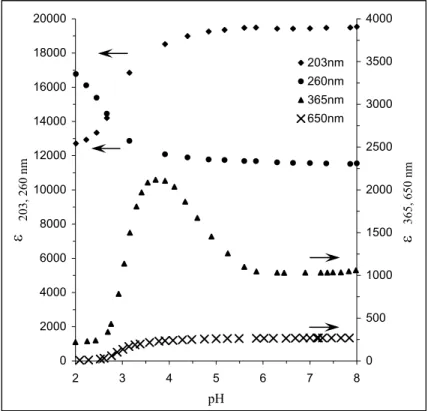
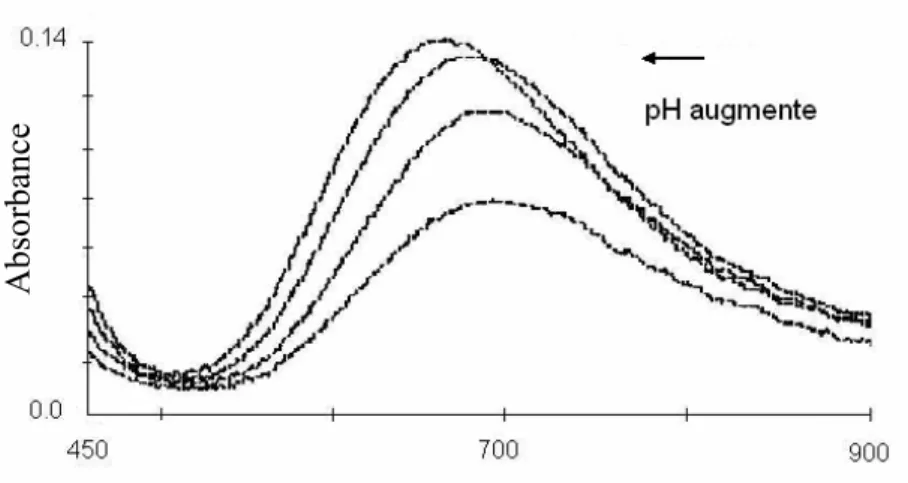
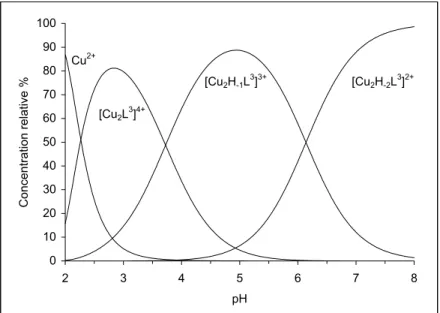
II. 3. 2 Propriété acido-basique...41
CHAPITRE III. ACTIVITÉ PHOSPHATASE DES COMPLEXES C1 ET C3...46
III. 1 Activité phosphatase du complexe mononucléaire C1...47
III. 1. 1 Effet du pH...48
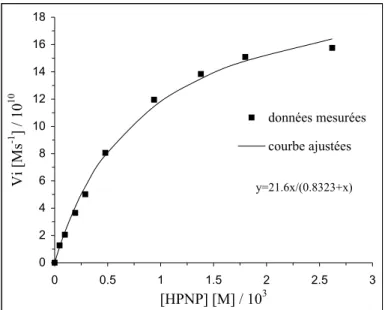
III. 1. 2 Effet de la concentration du substrat...50
III. 1. 3 Effet de la concentration du complexe C1...51
III. 2 Activité phosphatase du complexe binucléaire C3...51
III. 2. 1 Effet du pH...52
III. 2. 2 Effet de la concentration du substrat...54
III. 2. 3 Effet de la concentration du complexe C3...55
III. 3 Discussion...55
III. 4 Clivage hydrolytique de l’ADN...61
III. 4. 1 Discussion...64
CHAPITRE IV. OXIDATION DU DTBCH2 EN PRESENCE DES COMPLEXES C2 ET C3...65
IV. 1 L’oxydation du DTBCH2 en présence du complexe C2...67
Sommaire
IV. 1. 1 Effet de la concentration du DTBCH2...68
IV. 1. 2 Effet de la concentration du complexe C2...69
IV. 1. 3 Effet de la concentration de l’oxygène...69
IV. 1. 4 Détermination des paramètres d’activation...70
IV. 1. 5 Mécanisme proposé...70
IV. 1. 6 Analyse cinétique par méthode Michaelis-Menten...72
IV. 1. 7 Modélisation...73
IV. 1. 8 Discussion...76
IV. 2 L’oxydation du DTBCH2 en présence du complexe C3...77
IV. 2. 1 Effet de la concentration du DTBCH2...77
IV. 2. 2 Effet de la concentration du complexe C3...80
IV. 2. 3 Effet de la concentration de l’oxygène...80
IV. 2. 4 Détermination des paramètres d’activation...80
IV. 2. 5 Analyse cinétique par méthode Michaelis-Menten...81
IV. 2. 6 Modélisation...82
IV. 2. 7 Discussion...83
IV. 3 Discussion générale...84
CHAPITRE V. CONCLUSION GENERALE...86
CHAPITRE VI. PARTIE EXPERIMENTALE...87
VI. 1 Généralites...87
VI. 2 Préparation des amines tertiaires...87
VI. 3 Préparation du complexe monocuivrique...89
Sommaire
iv
VI. 5 Titration potentiométrique...91
VI. 6 Titration photométrique...91
VI. 7 Condition opératoire des réactions d’hydrolyse des phosphodiesters...91
VI. 8 Clivage hydrolytique de l’ADN...92
VI. 9 Cinétique de l’oxydation de 3,5-di-tert-butylcatechol...93
REFERENCES BIBLIOGRAPHIQUES...94
LISTES DES FIGURES ET TABLEAUX...100
ANNEXES...106
DOKTORI (PhD) ÉRTEKEZÉS TÉZISEI THESIS OF THE PhD DISSERTATION
INTRODUCTION GENERALE
Introduction générale
1 INTRODUCTION GENERALE
Les enzymes, catalyseurs des réactions biologiques, sont connues depuis longtemps pour accélérer les réactions chimiques. Dans le site actif de ces systèmes au moins un atome métallique nécessaire à la réactivité de l’enzyme est souvent présent. Malgré le développement de la technique de mesure qui donnent des possibilités de mieux connaître et comprendre la structure et la fonction des protéines, notre connaisances des enzymes sont encore incomplètes. L’étude à l’état solide (diffraction des rayons X) se heurte à de nombreuse difficultés dus en partie aux problèmes de purification et de cristallisation. Les examens en solution (EXAFS, RMN) peuvent être utilisés pour les métalloenzymes, plus précisement pour la reconnasaince de la sphère de coordination des ions métalliques.
Parce que les caractéristiques physicochimiques d’un ion métallique ligandé à un protéine ne peuvent être fondamentalement différentes des propriétés du métal lui-même, la modélisation chimique s’avère être un outil puissant dans l’étude des sites actifs des métalloenzymes. La biomimétisme consiste à reproduire la structure du site actif d’une enzyme à l’aide de petits objets moléculaires afin de reproduire les caractéristiques spectroscopiques de l’enzymes (modèles structuraux) et son activité enzymatique (modèles fonctionnels).
Nous nous sommes plus particulièrement intéressés à deux métalloenzymes: la phosphatase et la Catéchol Oxydase (CO).
La première est issue de la classe des protéines dites métallohydrolases qui fonctionnent en présence de Mg2+, Zn2+, Ca2+, Fe3+. La deuxième contient au sein de leur site actif un centre dinucléaire à cuivre.
Modéliser ces enzymes et mettre au point de nouveaux systèmes capables d’hydrolyser la liaison phosphoester ainsi d’oxyder du catéchol représente un enjeu important aussi bien en biologie qu’en médecine. Notre but a donc été de synthétiser des complexes inspirés de la structure du site actif des phosphatases et de la CO, afin
-de mettre en évidence les paramètres structuraux essentiels à la réactivité de l’enzymes et
-de pouvoir reproduire la réaction enzymatique pour comprendre du mécanisme d’action.
Introduction générale Dans la première partie de ce rapport, une étude bibliographique des deux enzymes que nous avons voulu modéliser sera présentée. La deuxième partie dévéloppera la synthèse et la caractérisation des complexes mono- et binucléaire à cuivre(II).
La réactivité de ces complexes en hydrolyse des phosphoesters activés ainsi en oxydation du catéchol seront présentée en troisième et quatrième parties, respectivement. La conclusion générale et la partie expérimentale constitueront la cinquième et sixième partie de ce rapport.
CHAPITRE I
INTRODUCTION BIBLIOGRAPHIQUE
Chapitre I. – Introduction bibliographique I. INTRODUCTION BIBLIOGRAPHIQUE
I. 1 Les protéines à cuivre
Le cuivre est connu depuis 1925 comme un oligo-élement indispensable mais son rôle accompli dans biologie est découvert par développement de chimie bioinorganique, biologie moléculaire et chimie biomimétique dans les deux dernières décennies.
Les cuproenzymes sont capables d’activer l’oxygène moléculaire dans des réactions nombreuses et variées (activité d’oxydase, oxygénase). Elles participent dans le transport d’électron, d’O2, la dégradation du radical O2.-. Elles sont actives dans le cycle de l’azote en transformant les composés NO2-, NO. ou N2O. Certaines activités sont décrites dans le Tab. 1.
Tableau 1. Les fonctions de quelques cuproprotéines.1,2
Enzymes Fonctions Oxydases
Cytochrome c Oxydase O2 → H2O
Amine Oxydase RCH2NH2 + O2 → RCHO + H2O2 + NH3
Galactose Oxydase RCH2OH + O2 → RCHO + H2O2
Ascorbate Oxydase ascorbate + O2 → dehydroascorbate + 2H2O Catéchol Oxydase o-diphénole + O2 → o-quinone
Monooxygénases
Tyrosinase monophénole + O2 → o-diphénole + H2O Dopamine β-Hydroxylase dopamine + O2 → noradrénaline + H2O
Dioxygénases
Quercetinase quercetin + O2 → CO + depsid (ester carboxylique) Superoxide Dismutase 2O2.- → O2 2- + O2
Hemocyanine O2 transport
Protéine “bleue” à cuivre e- transport Nitrite réductase NO → NO2-
N2O réductase N2O → N2 + H2O
Chapitre I. – Introduction bibliographique
4
La classification standard des centres métalliques biologiquement actifs des protéines à cuivre de type I, type II et type III était initialement nécessaire pour corréler la fonction avec les propriétés analytiques (absorption optique, RPE, magnétisme). Ces informations sont pour une grand part comprise et affinées grâce aux détails structuraux disponibles.
Cependant plusieurs centres biologiques à cuivre qui ont été découverts ne cadraient pas avec le schéma conventionnel. Dans le Tab. 2 sont résumées les caractéristiques des types différents des centres cuivriques.
Comme on peut le voir, le cuivre est un élément abondant pour les protéines impliquées dans le métabolisme et le transfert de l’oxygène. Parmi ces protéines, par exemple, la CO, tyrosinase et dopamine β-hydroxylase participent dans la synthèse des catécholamines, des neurotransmetteurs. Selon des résultats d’une recherche récente, le défaut chronique de cuivre causerait la faiblesse des artères et l’agrandissement du coeur qui pourraient s’expliquer par diminution de la quantité de ces neurotransmetteurs.1
Au cours de cette thèse, nous nous sommes intéressés à modéliser la CO et les phosphatases. Ces dernières ne font pas parties des cuproenzymes in vivo mais leurs mécanismes d’action peuvent être bien étudiés par les composants modèles à cuivre.
C’est pourquoi au cours de cette introduction les deux systèmes biologiques seront présentés ainsi que leurs modèles structuraux et fonctionnels décrits dans la littérature. Les systèmes synthétiques exposés correspondent aux travaux les plus récents ou les plus représentatifs de ces dernières années.
Tableau 2. Principales propriétés des centres métalliques de cuproprotéines.1
Type I Type II Type III Type (2+3) CuA MT-Cu
Nucléarité mononucléaire mononucléaire binucléaire trinucléaire binucléaire mono-
multinucléaire
Fonction transfer d’électron catalyse et réactivité redox
activation de O2 pour le transport et l’oxygénation
activation de O2 pour la fonction oxydase
transfer d’électron
régulation, stockage et transport
Enzyme azurine, laccase, plastocyanine
amine et galactose oxydase, superoxide dismutase, cytochrome c oxydase (CuB)
hemocyanin, tyrosinase, catéchol oxydase
ascorbate oxydase, laccase
N2O réductase, cytochrome c oxydase (CuA)
metallothionine (MT), CUP2
Caractéristique structurale Nombre de
coordination L3 (trig. plan) + L1 L4 ou L5 (plan carré, pyramide carrée)
CuI : L3 (trigonal plan)
CuI : L3 (trigonal)
CuII : L4 L4 L3 (trigonal
plan) Atome
coordiné
S-(Cys), 2N(His) +
S(Met) 3N (His), site vacant 2×3 N(His), CuII:µ-η2:η2-O22-
N(His), en partie (O)OH
2S-(Cys-), 2N (His),
S(Met), O(peptide) 3S-(Cys-) Caractères spectroscopiques de la forme oxydée ou oxygénée
RPE
subdivision hyperfine de 63Cu/
65Cu, bas facteur g
paramètres normaux de CuII
no signal (fort couplage
antiférromagnétique)
paramètres normaux de CuII
faible subdivision hyperfine, bas facteur g
no forme oxydée
Absorption
abs. intense dans la région visible, LMCT (Cys--Cu2+)
no abs. intense, transition interdite du ligand
abs. intense, LMCT (O22--Cu2+)
abs. intense, LMCT (O22--Cu2+)
abs. intense dans la région IR (MMCT)
Chapitre I. – Introduction bibliographique
6 I. 2 Les phosphoestérases
La cellule humaine est constituée de 23 chromosomes et environ trois billion de paires de bases d’acide déoxyribonucléique (ADN). Dans ce labyrinthe d’ADN, 100 000 gènes sont codés et transcrits en acide ribonucléique messager (mARN) avant d’être traduit en protéines correspondantes. Une seule mutation dans un de ces gènes produit la perte de mARN ou la dégradation de protéines essentielles et cause de sérieuses conséquences. Il est donc particulièrement important de maintenir l’intégrité des codes génétiques et des fonctions propres des protéines. La Nature a choisi l’ester de phosphate par son remarquable stabilité hydrolytique pour lier les nucléosides entre eux dans l’ADN et l’ARN.3
La demi-vie d’hydrolyse des phosphodiesters de l’ADN a été estimée à 200×106 ans à pH neutre et 25°C. Plus rapide hydrolyse des ARNs est due à la présence de groupes hydroxyles sur le ribose qui peut assurer le transfert intramoléculaire de phosphoryle et l’autohydrolyse, la demi-vie estimée est 800 ans dans condition identique.4#
L’hydrolyse de l’ADN et l’ARN est surtout contrariée par la grande charge négative du squelette qui inhibe l’attaque de nucléophile.
Néanmoins, l’hydrolyse de phophodiesters est très importante à certain stade du cycle de la cellule. Par exemple, l’ADN étranger doit être détruit après la reconnaissance, les mutations d’ADN doivent être excisées et puis réparées. Pour accomplir ces tâches la Nature utilise une classe d’enzymes: les métallo-phosphoestérases.
I. 2. 1 Métallo-phosphoestérase
Les phosphoestérases sont des enzymes responsables du clivage hydrolytique des liaisons phosphoesters. Ces catalyseurs accélèrent la réaction hydrolyse de l’ADN et l’ARN d’un facteur 1016. De nombreuses phosphoestérases fonctionnent en présence d’ions métalliques qui sont des cofacteurs essentiels et qui coopèrent directement à l’hydrolyse. Les métaux les plus souvent impliqués sont Mg2+, Zn2+, Mn2+, Ca2+, Fe3+. Dans certain cas, il est difficile de déterminer leur présence dans les enzymes et surtout d’identifier la sphère de coordination. L’analyse de la structure par spectroscopie des rayons X et l’étude du changement du pH peuvent fournir des informations sur la relation enzyme-métal.
#L’âge de la terre est environ 4 billion années.
Chapitre I. – Introduction bibliographique La chaîne d’acide aminé des métallohydrolases peut participer comme acide/base ou comme nucléophile dans la transformation des substrats. L’efficacité catalytique est déterminée par la coopération entre le métal et le groupement organique fonctionnel (Tab. 3).5,17
P O
-O
OR
OR P
OR
OH OR
-O
-O OH-
P O
-O
OR OH RO-
+
Figure 1. Mécanisme du clivage de la liaison en phosphodiester par l’ion hydroxyde.
Le mécanisme général d’hydrolyse des phosphoesters présenté sur la Fig. 1 est de type SN2. Dans ce mécanisme, le réactif nucléophile, qui dans les plus part des cas est l’ion hydroxyle, attaque le phosphate. L’étape importante de la réaction est la stabilisation de l’état transition du phosphore qui possède une géométrie de bipyramide à base trigonale, suivie de la libération du groupement partant.
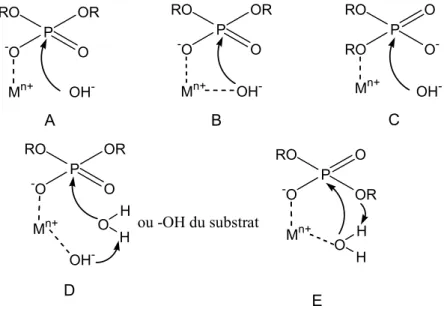
Les ions métalliques peut accélérer le clivage des manières suivantes: 16
1. Liaison au métal par l’oxygène du phosphoester (activation d’acide de Lewis) (Fig. 2. A)
2. Liaison du phosphoester au métal, l’attaque nucléophile via la formation d’un hydroxyde métallique (activation d’acide de Lewis + formation d’hydroxyde) (Fig. 2. B)
3. Stabilisation du groupement sortant par coordination au métal (Fig. 2. C)
4. Déprotonation d’une molécule d’eau ou le groupement d’OH du substrat (transestérification) par l’hydroxyde coordiné au métal (Fig. 2. D)
5. Activation de molécule d’eau coordinée au métal qui peut participer comme acide dans la réaction (Fig. 2. E).
Chapitre I. – Introduction bibliographique
8
P RO
-O
OR O Mn+ OH-
P RO
-O
OR O Mn+ OH-
P RO RO
O O- OH-
A B C
Mn+
P RO
-O
OR O Mn+
OH- D
O
P RO
-O
O OR Mn+
E H
H O H
H ou -OH du substrat
Figure 2. Différents modes d’activation des phosphodiesters catalysés par le centre métallique.
I. 2. 2 Fonction et structure de quelques métallo-phosphoestérases
I. 2. 2. 1 Nucléases
Les nucléases sont des enzymes hydrolitiques qui peuvent cliver des biopolymères importants et les acides nucléiques. Le rôle de ces enzymes est la dégradation des biopolymères, digestion, modification d’acide nucléique, réparation d’ADN et défense virale (enzyme de restriction). Les endonucléases clivent des liaisons interne alors que les exonucléases enlèvent les nucléotides terminaux.
Staphylococcal nuclease est une endonucléase extracellulaire qui clive la liaison phosphodiester (ADN et ARN) formant un 3’-mononucléotide. L’hydrolyse n’est pas spécifique, mais possède une grande efficacité catalytique. Parmi les enzymes déjà présentées, elle catalyse la réaction la plus rapide avec l’accélération de vitesse de 1016. La structure du site actif et le mécanisme d’action proposé sont présentés sur la Fig. 3.17
Le phosphodiester est activé par la coordination du Ca2+ et la liaison du pont hydrogène de groupement Arg-guanidinium. Le nucléophile responsable de l’hydrolyse pourrait être issu de la coopération de l’ion Ca2+ et du carboxylate Glu43. La stabilisation du phosphore pentacoordiné est assurée par le second Arg-guanidinium.
Tableau 3. Exemples des enzymes hydrolases en représentant les caractéristiques de leur site actif.
(Glu-base; His, Lys, Arg-acide; Ser, Glu-nucléophile)
Enzyme Source Substrat Ion métallique Distance inter-
métallique [Ǻ] Groupement
fonctionnel Référence
ADN polymerase I E. coli ADN Zn2+, Mg2+ 3.9 Asp, Glu 6 P1 nucléase P. citrinum ARN, AND 2Zn2+ + Zn2+ 3.2 His, Asp 7 Transcriptase inverse
(ribonucléase site H) HIV-1 ARN 2Mn2+ (Mg2+) ~4 Asp, Glu 8 Staphylococcal
nuclease Ca 2+ Arg, Glu, Asp 9
EcoRV endonucléase E. coli ADN 2Mg2+ n.d Asp, Glu 10
Phospholipase C B. cereus phosphatidylcholine 2Zn2+, Zn2+ 3.3 His, Asp 11 Phosphatase acide
pourpre haricot rouge alkylphosphate Fe3+, Zn2+ 3.26 His, Asn, Asp 12 Phosphatase alcaline E. coli alkylphosphate 2Zn2+ + Mg2+ 3.9 His, Asp, Ser 13 Fructose-1,6-
bisphosphatase rein porcin D-fructose1,6-
bisphosphate 2Zn2+ ou Mn2+ 3.6-3.8 Glu, Asp 14 Protéine phosphatase 1 Fe3+, Zn2+ His, Asp, Asn 15
Chapitre I. – Introduction bibliographique
10
O RO P
RO
O
Ca2+
Asp40
OH2
H2O Asp21 Thr41 NH
NH2 NH2 Arg87
HN
NH2 NH2 Arg35
+ +
Glu43
O- O
Figure 3. Mécanisme proposé pour la Staphylococcal nuclease.
L’Endoribonucléase H d’E. coli hydrolyse l’ARN d’hybride spécifique d’ADN/ARN. Cette activité RNAse H est vraisemblablement impliquée dans la réplication de l’ADN. Il est évident aujourd'hui que dans son site actif un seul Mg2+ est coordiné aux Asp10, Gly11 (carbonyl), Asn44 (oxygène d’amide) et Glu48 (Fig. 4). Selon le mécanisme proposé, Asp70 active la molécule de H2O pour l’attaque sur le phosphore alors que le métal joue un rôle d’acide de Lewis sur l’hybride ARN/ADN.18
Gly48 O Mg2+
Asn44 O
Gly11 Asp10 P
O O
Asp70
O- O O
H H
R R 3'
5'
Figure 4. Mécanisme proposé pour l’Endoribonucléase H d’E. coli.
I. 2. 2. 2 Polymérases
Les polymérases sont des enzymes qui catalysent la réplication et la synthèse d’ADN et d’ARN. De nombreuses de ces enzymes possèdent également des fonctions d’exonucléase ou ribonucléase. On peut les diviser en trois catégories majeures,
Chapitre I. – Introduction bibliographique les polymérases d’ADN, d’ARN et transcriptase inverse qui fonctionnent en présence de magnésium comme cofacteur essentiel.
L’ADN polymérase réplique la double hélice de l’ADN, elle est aussi capable d’hydrolyser l’ADN et de cette façon corriger les défauts de paires de base, l’ARN polymérase est responsable de la transcription. La transcriptase inverse catalyse trois réactions, la conversion de la simple hélice d’ARN en double hélice d’hybride d’ADN/ARN (fonction DNA polymérase), la digestion d’hybride d’ARN (fonction ribonucléase H) et la conversion de simple hélice d’ARN en double (deuxième réaction d’ADN polymérase).
L’ADN Polymérase I catalyse en 3’ le transfert d’ADN et l’hydrolyse de nucléotide terminal de simple hélice (activité de 3’-5’exonucléase). Le fragment en C-terminal de la E. coli DNA Polymérase I, nommé fragment Klenow, possède une activité polymérase et 3’-5’-exonucléase, sa structure RX a révélé sa séparation d’environ 30 Ǻ de l’autre fragment en N-terminal qui possède une activité de 5’-3’ exonucléase. Ces deux parties fonctionnent indépendamment et ont des sites de fixation de l’ADN différents.19
La partie qui est la responsable de l’activité de 3’-5’exonucléase contient deux métaux (Mg2+ ou Zn2+) qui se sont séparés en 3.9 Ǻ. L’un des métaux est fortement lié à l’enzyme, l’autre assure la fixation du substrat (Fig. 5).18 Les deux métaux sont liés par l’oxygène du phosphodiester par un pont µ-1,1 et le groupement carboxylate, de cette façon, les métaux peuvent coopérer et hydrolyser le substrat par l’activation double d’acide Lewis.
L’hydroxyde formé par MA comme nucléophile attaque le phosphore pendant que MB
stabilise le groupement sortant par liaison d’oxygène 3’.
MB H2O H2O
O-
MA
O O
O O
O O O
P O O O O
Base
O
O Base
O
3'
3'
- -
5'
H
Asp355 Asp501 Glu357
Figure 5. Mécanisme proposé pour l’ADN Polymerase I d’E. coli.
Chapitre I. – Introduction bibliographique
12
Un mécanisme analogue a été proposé pour l’endonucléase de restriction EcoRV 21 et pour le clivage d’ARN effectué par les ribosomes.22
I. 2. 2. 3 Phosphatases
Les enzymes qui catalysent l’hydrolyse de phosphoester en condition acide (pH optimal 4.9-6.0), qui sous forme oxydée ont une couleur pourpre caractéristique (λmax~550 nm) et rose (λmax~510 nm) sous leur forme réduite sont nommés Phosphatase Acide Pourpre (PAP). Les PAPs se trouvent dans les bactéries, les plantes et les animaux, elles catalysent l’hydrolyse d’une grande variété de substrats tels que les arylphosphates, les di- et trinucléotides, les phosphoprotéines. Chez les mammifères, elles ont vraisemblablement un rôle important dans les processus dégradatifs.
Les centres actifs des PAPs chez tous les organismes sont semblables et contiennent du Fe3+- Fe2+ (ou un Fe3+ et d’autre ion métallique bivalent (Zn2+, Mn2+)). Krebs et coll. ont publié la structure de la PAP de haricot rouge, leur site actif est constitué de Fe3+ et Zn2+
liés par un pont hydroxo et carboxylato (Fig. 6). Selon le mécanisme proposé, les His202 et His296 activent le phosphomonoester pour l’attaque nucléophile et stabilisent l’état transition. Le Fe3+ forme l’hydroxyde nucléophilique pendant que le Zn2+ est la responsable pour la liaison au substrat.23
Asp135
Fe3+
OH- His325
Tyr167 OH-
Asp135
Zn2+
O- O
Asn201 His286 Asp164
P O- OR
-O His296
His202
Figure 6. Mécanisme d’action de la PAP lors de l’hydrolyse d’un phosphomonoester.
Les Phosphatases alcalines sont des enzymes abondantes dans la nature. Elles catalysent l’hydrolyse nonsélective des phosphomonoesters et fonctionnent à pH élevé (pH 9-10) mais ses rôles biologiques ne sont pas toujours très clairs. La phosphatase alcaline la plus étudiée est celle de E. coli qui contient dans son site actif deux Zn2+ et un
Chapitre I. – Introduction bibliographique ion Mg2+ selon la structure RX. Le Mg2+ participe dans la construction de la structure, les Zn2+ sont les responsables pour l’activité catalytique.13,24
I. 2. 3 Hydrolases synthétiques
Malgré la présence de nombreuses hydrolases dans la nature, le développement des nucléases synthétiques est de plus en plus important et utile. Avec ces composants de petite masse molaire l’étude de mécanisme d’hydrolyse est plus facile que par rapport à l’enzyme, ils peuvent fournir des informations adéquats pour comprendre les processus dans le site actif, ils sont plus robustes et plus accessibles que les enzymes. Avec les agents de reconnaissance (oligonucléotides antisenses) les composants artificiels sont très utiles dans le clivage non-oxydatif, spécifique en séquence des acides nucléiques et ils pourront être les outils importants dans la chimiothérapie spécifique en gène et dans la biotechnologie à l’avenir.25
Applications majeures des hydrolases synthétiques :
1. Enzymes de restriction artificielles. Les enzymes de restriction font la reconnaissance et le clivage des fragments d’ADN contenant 4, 6 et 8 paires de base. Malheureusement ils causent la coupure d’ADN en nombreux fragments, lesquels sont difficiles à séparer. Par contre en joignant une chaîne d’oligonucléotides contenant 15 paires de bases avec un partie hydrolase artificielle on peut former un nucléase artificielle spécifique en séquence de base.26
2. On peut les utiliser dans la précision de la conformation. La structure 3D des acides nucléiques peut être déterminé par spectroscopie des rayons X et RMN.
L’inconvénient de ces méthodes est la difficulté d’obtenir des cristaux exploitables par diffraction des rayons X et d’interpréter des spectres RMN. Pour compléter ces méthodes les hydrolases synthétiques peuvent reconnaître certaines conformations comme cruciforme, région simple brin, hélice gauche.
3. Les métallonucléases synthétiques peuvent être capable de dépister le rôle précis du métal dans les hydrolases naturelles. Quoiqu’ils n’atteignent pas l’activité catalytique des enzymes, les complexes métalliques s’avèrent les plus efficaces systèmes non-enzymatiques dans l’hydrolyse des phosphodiesters en conditions physiologiques.
Chapitre I. – Introduction bibliographique
14
On suppose que l’ion métallique peut accélérer l’hydrolyse en assurant
− l’activation de phosphodiester
− la neutralisation de charge pour faciliter l’attaque du nucléophile, la stabilisation l’état de transition et le groupement partant
− un nucléophile efficace à pH neutre.
Dans le centre actif des enzymes naturelles les ions Ca2+, Mg2+, Mn2+, Zn2+ et Fe2+/Fe3+
sont présents. Par contre les complexes modèles de Ca2+, Mg2+, Mn2+, Fe2+ sont moins connus car ils sont des acides Lewis plus faibles. Quelques complexes à Fe3+ sont publiés qui tentent de mimer le centre actif dans les phosphatases.27 Les ions Zn2+, Cu2+ et Ln3+ ont des acidités de Lewis plus élevés et de nombreuses publications sont connues bien que le Cu2+ et Ln3+ ne sont pas des ions pertinents en biologie. Leur forte acidité de Lewis peut assurer la neutralisation de la charge et la polarisation de la liaison du phosphore ainsi qu’ils peuvent diminuer la valeur pKa de H2O coordinée au métal en formant un hydroxyde à pH physiologique. L’autre avantage de Cu2+ et Zn2+ est que leurs géométries de coordination sont bien étudiées et caractérisées par des méthodes spectroscopiques et de telle façon le mécanisme d’action peut plus facilement examiner.
Par la suite, nous présenterons d’abord les substrats modèles utilisés dans la réaction d’hydrolyse ensuite les complexes comme modèles fonctionnels et structuraux des nucléases.
I. 2. 3. 1 Les substrats utilisés dans l’hydrolyse
Les substrats naturels des nucléases d’ARN et d’ADN sont inertes vis-à-vis de l’hydrolyse à pH physiologique. Pour éliminer ce problème et pour pouvoir suivre les réactions modèles on utilise des esters de p-nitrophénol (PNP) comme substrats modèles qui miment le phosphoester. Ces esters activés sont plus réactifs grâce à bon groupement partant PNP, leur détection par spectroscopie UV-vis, HPLC et 31P RMN est plus facile et dans la plupart des cas, leur hydrolyse catalysée par des complexes modèles peut être extrapolée à l’hydrolyse de substrats biologiques. En considérant que si la libération du groupement partant du substrat naturel est l’étape limitante, cette hypothèse n’est pas correcte car le pKa du PNP est inférieur au pKa d’OH du substrat naturel et de cette façon le premier n’exige pas de stabilisation électrostatique à pH physiologique.28
Chapitre I. – Introduction bibliographique
Les substrats modèles:
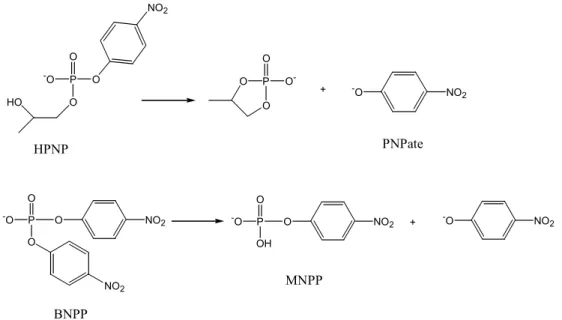
1. Le plus souvent utilisé comme substrat modèle d’ARN est le phosphate de 2-hydroxypropyle et de p-nitrophényl (HPNP), comme substrat modèle d’ADN est le phosphate de bis-p-nitrophényl (BNPP) ou de bis(2,4-dinitrophényl (BDNPP).
O2N O P
O-
O
O O2N O P
O-
O
O NO2 O2N O P
O-
O
O NO2
NO2 O2N
HPNP HO BNPP
BDNPP
2. Dans les dernières années, les dinucléosides mono- et diphosphate non activés comme adenine-2’,3’-cyclic-monophosphate (cAMP), adenine-3’,5-adenine (ApA) sont plus en plus utilisés.
HO
Ad
O O
O
HO
Ad
-O P O
O OH
O
O
Ad
OH OH
P O O- O 2',3'-cAMP
ApA
I. 2. 3. 2 Nucléases artificielles
Spécifications des complexes modèles :
1. Comme nous l’avons montré, ils doivent être de fort acide de Lewis pour pouvoir déprotoner l’eau coordinée au métal à pH physiologique.
2. Ils doivent avoir au moins deux sites de coordination libres en position cis pour pouvoir assurer la coordination du substrat et de l’hydroxyde.
3. Ils doivent avoir une charge globale positive ou neutre pour pouvoir favoriser la coordination du phosphoester chargé négativement.
Dans le but de pouvoir comprendre le mécanisme d’action de ces enzymes et non seulement former des hydrolases artificielles efficaces, de nombreuses publications ont été publiées sur l’activité des modèles mono- et binucléaires.
Chapitre I. – Introduction bibliographique
16
Par la suite, nous présenterons quelques complexes mono- et binucléaires du cuivre(II) en comparant les valeurs thermodynamiques et cinétiques comme pKa, kobs, krel, kcat/KM et k2 en considérant qu’il est difficile de trouver des conditions et paramètres identiques pour tous les cas présentés.
Le pKa signifie le pH où le premier proton de H2O coordinée au métal est libéré, kobs est la constante de vitesse en pseudo premier ordre, krel=kobs/knoncatalysé, kcat/KM est donné dans quelques cas où la réaction suit la cinétique Michaelis-Menten et k2 est la constante de vitesse en second ordre (kobs/[complexe]).
De nombreux complexes à Zn2+, Co3+, Ln3+ sont connus mais dans le cadre de cette dissertation nous ne consulterons que les complexes à cuivre(II).
Les kobs sont données pour le pH proches du pKa déterminé par titration potentiométrique démontrant le rôle déterminant de l’hydroxyde coordiné au cuivre(II) dans l’hydrolyse. Nous considérons que les ligands Cl-, NO3-, acetato, seront échangés dans la solution aqueuse.
Les complexes mononucléaires les plus souvent étudiés sont les modèles 1, 2, 4 via lesquels on peut bien présenter le rôle de l’hydroxyde. Selon le mécanisme proposé le substrat est coordiné au cuivre(II) par l’échange d’une molécule d’eau suivi soit l’attaque intramoléculaire de l’hydroxyde coordiné au métal sur le phosphore (hydrolyse) soit la deprotonation d’OH du substrat (transestérification) (Fig. 2/A, D). Pour le modèle 4, si R=H la réaction d’hydrolyse ou transestérification est très lente car on l’examine au dessous de pKa, par contre pour R=CH2N(CH3)2 l’amine tertiaire joue le rôle de base pour déprotoner l’hydroxyde du HPNP et accélérer la réaction. Si le pH>8.0 où la molécule d’eau coordinée est déjà deprotonée, la vitesse d’hydrolyse et transestérification catalysée par le complexe 4 où R=H augmente, kobs=6.8×10-7 s-1 et 3.5×10-5 s-1 respectivement.
Comme nous l’avons présenté pour les enzymes, le groupement organique de la chaîne peptidique joue un rôle important (Tab. 3). Dans le modèle 3, où deux chaînes de propyne avec des groupements d’ammonium (empêche la formation de chélate intramoléculaire) sont fixées sur la bpy (lieu de la coordination du cuivre(II)), on peut constater une augmentation appréciable de la vitesse par rapport au simple bpy (2).
Chin et coll. ont examiné les modèles 5a, b, c pour hydrolyse du BDNPP. Ils ont trouvé qu’à pH 8.8 et 25°C, 5c est 40 fois plus actif que le complexe 5a. Selon le mécanisme proposé pour 5c, le substrat s’échange avec la molécule d’eau et le nucléophile Cu-alkoxyde attaque le phosphodiester coordiné (transestérification). Il est intéressant que
Chapitre I. – Introduction bibliographique le 5c 100 fois plus actif que le 5b où l’hydrolyse s’effectue par l’hydroxyde coordiné au cuivre(II). Tout cela vient de la structure différente de l’intermédiaire car 5c peut former un chélate plus stable via le bras hydroxypropyle.
La compréhension véritable du mécanisme d’action des phosphoesterases peut être conduite via l’étude des complexes binucléaire à cuivre(II). Dans ces cas, la coopération entre les ions métalliques, la possibilité d’activation par double acide Lewis et que tous quelle façon influencent la vitesse de la réaction par rapport aux complexes mononucléaires peuvent être examinées. Les exemples présentés pour les complexes binucléaires peuvent être considérés comme les dimères des complexes mononucléaires correspondants (1-8, 4-9, 6-11, 7-12) et de cette manière l’activation soit par double acide Lewis (8, 9, 11, 12, Fig. 7/A) soit par simple activation d’acide Lewis et formation de l’hydroxyde nucléophile (10, Fig. 7/B) peuvent être mise en évidence. Le taux de synergisme entre les deux cuivre(II) peut être bien exprimer par la valeur de kobsbinucléaire/kobsmononucléaire (Tab. 4).
P RO
O
OR O Cu2+ Cu2+
P RO
-O
OR O Cu2+ OH-
A B
-
Cu2+
OH-
Figure 7. Modes d’activation des phosphodiesters catalysés par les centres bicuivriques.
Chapitre I. – Introduction bibliographique
18
Tableau 4. Activité des complexes mono- et binucléaire à cuivre(II) lors de l’hydrolyse des phosphodiesters.
Composés modèles Paramètres cinétiques COMPLEXES MONONUCLEAIRE
1.
EPNP29
KM=6.2×10-2 M, kcat=1.96×10-5 s-1, kcat/KM=1.87×10-4 M-1s-1 kobs=7.2×10-8 s-1, k2=7.2×10-5 M-1s-1
pH 7.3, 50°C, H2O, [complexe]=1×10-3 M, [EPNP]=5×10-3 M [CuLCl2] ApA34 kobs=4.2×10-7 s-1, k2=1.1×10-4 M-1s-1, 50°C pKa=7.3 2’,3’-cAMP32 kobs=8.7×10-6 s-1, k2=2.2×10-3 M-1s-1, 25°C
pH 7.3, H2O, [complexe]=4×10-3 M [ApA]=[2’,3’-cAMP]=5×10-5 M 2.
HPNP31
kobs=1.63×10-5 s-1, k2=8.15×10-3 M-1s-1, krel=145
pH 7.0, 25°C, H2O, [complexe]=5×10-3 M, [HPNP]=2×10-4 M [CuL(H2O)2] bpy BNPP17
pKa=6.6 kcat=1.2×10-6 s-1, krel=11000
pH 6.6, 20°C, EtOH/H2O (19:1), [complexe]=5×10-3 M 3.
BNPP17
KM=9.0×10-3 M, kcat=4.4×10-3 s-1, kcat/KM=0.48 M-1s-1 krel=4×107
pH 6.6, 20°C, EtOH/H2O (19:1), [complexe]=5×10-3 M [Cu(L)(H2O)2(NO3-)](NO3-)
4. HPNP30a
R=H kobs=5.74×10-6 s-1, k2=2.8×10-3 M-1s-1, krel=51, pH 7.0 kobs=3.5×10-5 s-1 pH 9.0
R=CH2N(CH3)2 kobs=3.89×10-5 s-1, krel=345, pH 7.0 25°C, H2O, [complexe]=2×10-3 M, [HPNP]=2×10-4 M
BNPP30b,c R=H
[CuL(H2O)] kobs non mesurable pH 7.0 pKa=8.1 R=H kobs=6.8×10-7 s-1 pH 9.0
pKaamine=6.5 R=CH2N(CH3)2 35°C, EtOH/H2O (75:25), [complexe]=2×10-4 M
N N
N
N
N
NMe2H+
NMe2H+
N N
N N
R N R
Chapitre I. – Introduction bibliographique 5.
BDNPP31
a) k2=2.0×10-2 M-1s-1, R=H, pKa=8.8
b) k2=9.5×10-3 M-1s-1, R=CH2CH2OH, pKa=8.8 c) k2=7.2×10-1 M-1s-1, R=CH2CH2CH2OH, pKa=8.7 pH 8.8, 25°C, H2O/DMSO, [complexe]=1×10-2 M
[CuL(H2O)]
6.
HPNP32
kobs=4.0×10-5 s-1 , k2=4×10-2 M-1s-1
pH 7.0, 25°C, H2O, [complexe]=1×10-3 M [HPNP]=5×10-5 M
[CuLCl]
pKa=6.6 7.
HPNP33
kobs=1.3×10-5 s-1, k2=2.7×10-2 M-1s-1, krel=448 EPNP33
kobs=9.0×10-8 s-1, k2=1.88×10-4 M-1s-1, krel=82 pH 6.4, 25°C, 35% EtOH/H2O
[complexe]=4.8×10-4 M, [HPNP]=2×10-4 M
[CuL(CH3COO-)2]
pKa=6.9
COMPLEXES BINUCLEAIRES
8.
ApA34 kobs=2.2×10-4 s-1, k2=0.11M-1s-1 krel= 105, synergisme 524, 50°C 2’,3’-cAMP34 kobs=2.5×10-3 s-1, k2=1.25M-1s-1 krel=108, synergisme 300, 25°C pH 7.3, H2O, [complexe]=2×10-3 M
[ApA]=[2’,3’-cAMP]=5×10-5 M [Cu2LCl4]
N
N R
N
OH N N NH
HN N
OEt HO
N N
N N
N N N
N N N
Chapitre I. – Introduction bibliographique
20 9.
HPNP30a
kobs=2.93×10-4 s-1, k2=0.15M-1s-1 krel=2600, synergisme 51
pH 7.0, 25°C, H2O, [complexe]=2×10-3 M [HPNP]=2×10-4 M
[Cu2L(H2O)2]
pKa1=7.4, pKa2=8.2 10.
2,4-BDNPP35
KM=1.13×10-3 M, kcat=3.4×10-5 s-1 kcat/KM=0.03 M-1s-1
krel=26
pH 6.6, 50°C, MeOH/H2O (25V/V%) [Cu2(L-O-)(H2O)(OH)(CH3COO-)]
pKa=5.7 11.
HPNP32
kobs=2.1×10-3 s-1, k2=2.1M-1s-1 krel=2600, synergisme 53
pH 7.0, 25°C, H2O, [complexe]=1×10-3 M [HPNP]=5×10-5 M
[Cu2LCl2]Cl
pKa1=6.7, pKa2=7.2 12.
HPNP33
kobs=2.9×10-4 s-1, k2=0.6M-1s-1 krel=10000, synergisme 22 KM=4.0×10-3 M, kcat=2.1×10-3 s-1 kcat/KM=0.525 M-1s-1
EPNP33
kobs=3.0×10-5 s-1, k2=6.25×10-2 M-1s-1 [Cu2L(H2O)2] krel=27000, synergisme 330
pKa1=6.5, pKa2=6.6 pH 6.4, 25°C, 35% EtOH/H2O
[complexe]=4.8×10-4 M, [HPNP]=2×10-4 M
N N
N OH
N
OH OH
OH N N NH
HN N
N NH
N NH
N N
N N NH O
N N
N
OR RO
OR
HO OH
N N N
N N N
N N