Sok minden más mellet,
a szellem, értelem és emberség képviseletéért, Paray Ágoston Gusztáv emlékére
unokád
DOKTORI (PhD) ÉRTEKEZÉS
A cink(II)- és a réz(II)-tetrafenil- és oktaetil-porfirinek fotofizikai sajátságai, komplexképzésük és kioltásuk
nitrogéntartalmú donor molekulákkal
Készítette: Témavezető:
Szintay Gergely Dr. Horváth Attila
egyetemi tanársegéd egyetemi tanár
Veszprémi Egyetem Kémia Doktori Iskola
Általános és Szervetlen Kémia Tanszék
Veszprém, 2004
A CINK(II)- ÉS A RÉZ(II)-TETRAFENIL- ÉS OKTAETIL-PORFIRINEK FOTOFIZIKAI SAJÁTSÁGAI, KOMPLEXKÉPZÉSÜK ÉS KIOLTÁSUK
NITROGÉNTARTALMÚ DONOR MOLEKULÁKKAL
Értekezés doktori (PhD) fokozat elnyerése érdekében Írta: Szintay Gergely
Készült a Veszprémi Egyetem Kémia Doktori Iskolája keretében
Témavezető: Dr. Horváth Attila
Elfogadásra javaslom (igen / nem)
(aláírás) A jelölt a doktori szigorlaton …... % -ot ért el,
Veszprém, Keszthely …...
a Szigorlati Bizottság elnöke Az értekezést bírálóként elfogadásra javaslom:
Bíráló neve: …... …... igen /nem
……….
(aláírás) Bíráló neve: …... …... igen /nem
……….
(aláírás) A jelölt az értekezés nyilvános vitáján …...% - ot ért el
Veszprém/Keszthely, ……….
a Bíráló Bizottság elnöke A doktori (PhD) oklevél minősítése …...
………
Az EDT elnöke
TARTALOM
TARTALOM...i
ÁBRA- ÉS TÁBLÁZATJEGYZÉK ...iv
Ábrajegyzék...v
Táblázatjegyzék...vi
KIVONAT, ABSTRACT, AUSZUG...vii
Magyar nyelvű kivonat...viii
Angol nyelvű kivonat ...x
Német nyelvű kivonat ...xi
1. BEVEZETÉS, CÉLKITŰZÉS...1
2. IRODALMI ÁTTEKINTÉS...4
2.1 Általános tudnivalók a porfirinekről ...5
2.1.1 A porfinváz szerkezete és nevezéktana ...5
2.1.2 A porfinváz alapvető jellemzői ...7
2.1.3 Metalloporfirinek létrejöttének feltétele és a SAT komplexek ...8
2.1.4 Porfirinvegyületek stabilitása ...9
2.2 Metalloporfirinek koordinációs kémiája ...11
2.3 Porfirinek és metalloporfirinek sztereokémiája ...14
2.3.1 A porfin kristályszerkezete...17
2.3.2 A tetrafenil- és az oktaetil-porfirinek kristályszerkezete...19
2.3.3 A Cu(TPP) és a Zn(TPP) kristályszerkezete ...20
2.4 Porfirinek és metalloporfirinek fotofizikája ...23
2.4.1 Porfirinek és metalloporfirinek elnyelési sajátságai...23
2.4.2 Porfirinek és metalloporfirinek kisugárzási sajátságai...25
2.4.3 A Jablonski diagram...27
2.5 Porfirinek és metalloporfirinek fotokémiája ...28
2.5.1. Energiaátadási reakciók (ET) ...29
2.5.2. Elektronátadási reakciók ...29
2.5.2.1. Fotoredukció...30
2.5.2.2. Fotooxidáció...31
2.5.3. Ligandumcsere reakciók...32
2.6 Porfirinvegyületek a természetben [56l] ...32
2.6.1 Szabad (fém mentes) porfirinek a természetben ...32
2.6.2 Metalloporfirinek a természetben...33
3. KÍSÉRLETI RÉSZ ...34
3.1 Anyagok ...35
3.2 Preparatív eljárások ...35
3.3 Minták elkészítése ...37
3.3.1 A Zn(II)-porfirinek egyensúlyi vizsgálatainak előkészítése...37
3.3.2 A Cu(II)-porfirinek egyensúlyi vizsgálatainak előkészítése ...38
3.3.3 A Stern-Volmer-féle kioltási mérések előkészítése ...38
3.4 Műszerek ...39
3.5 Mérési adatok kiértékelése ...41
3.6 A vizsgált metalloporfirinek fotofizikája ...41
3.6.1 A Zn-porfirinek fotofizikája...42
3.6.2 A Cu-porfirinek fotofizikája...47
3.7 Egyensúlyi vizsgálatok...52
3.7.1 Az MRA vizsgálatok eredményei ...52
3.7.2 Az egyensúlyi folyamat...55
3.7.3 Hőmérséklet függő mérések és termodinamikai állandók...56
3.8 A gerjesztett állapotú réz-porfirin élettartamának hőmérsékletfüggése...69
3.9 Lumineszcencia kioltási kísérletek...72
ÖSSZEFOGLALÁS...80
IRODALOM ...84
TÉZISEK...90
THESES ...94
KÖSZÖNETNYILVÁNÍTÁS...98
FÜGGELÉK...100
ÁBRA- ÉS
TÁBLÁZATJEGYZÉK
Ábrajegyzék
Ábra Cím Oldal
1. ábra A porfinváz triviális nevezéktana. 5
2. ábra A porfin számozási sémája Webb és Fleischer alapján. 7 3. ábra A ZnTPP fotodegradációja metilén-klorid oldószerben. 11 4. ábra Porfirinek és metalloporfirinek koordinácós kémiai kölcsönhatásainak általános összefoglalása. 12 5. ábra Az ötös koordinációjú metalloporfirinekre használt idealizált négyzetes-piramisos koordinációs
csoport (C4v). 15
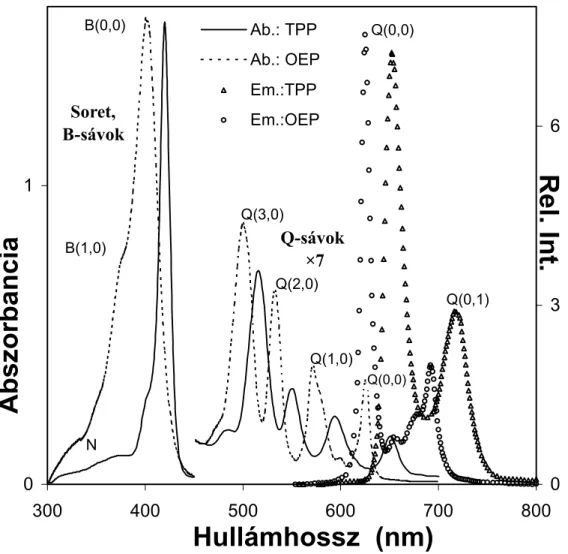
6. ábra A M(TPP) komplexek kétdimenziós vázlata és jellemző atomszámozásuk. 21 7. ábra A H2OEP és a H2TPP elnyelési és kisugárzási színképe szobahőmérsékleten, toluol oldószerben. 24
8. ábra Általános Jablonski diagram. 27
9. ábra A Zn(TPP) reverzibilis fotokémiai redukciója. 30
10. ábra Központi fématom oxidálása mangán(II)-ftalocianin származék fotokémiai oxidációja során. 31 11. ábra Klorin tartalmú CuTPP oxidálása DDQ -val CH2Cl2 -ben. 36 12. ábra Lézervillanófény fotolízis berendezés vázlata. 40 13. ábra A cink-tetrafenil- és cink-oktaetil-porfirin elnyelési (Ab.) és kisugárzási (Em.) színképe toluolban,
szobahőmérsékleten.
43 14. ábra A Zn(TPP) és Zn(OEP) triplett gerjesztett állapotú molekuláinak különbségi színképei
szobahőmérsékleten, toluol oldószerben és c~10-2 M piridin koncentráció mellett. 44 15. ábra A Zn(II)-porfirinek energia állapotainak és fotofizikai átmeneteinek Jablonski-féle ábrázolása. 46 16. ábra A réz- tetrafenil és oktaetil-porfirin elnyelési (Ab.) és kisugárzási (Em.) színképe toluolban,
szobahőmérsékleten. 48
17. ábra A Cu(TPP) és Cu(OEP) tripmultiplett gerjesztett állapotú molekuláinak különbségi színképei
szobahőmérsékleten, toluol oldószerben. 49
18. ábra A Cu(II)-porfirinek energia állapotainak és fotofizikai átmeneteinek Jablonski-féle ábrázolása. 50 19. ábra A Cu(TPP) piridin rendszer vizsgálata maradék abszorbanciára. A beillesztett ábra a 2 illetve 3
részecske feltételezéskor kapott szórás jellegű értékek kinagyítását mutatja. 54 20. ábra A Cu(TPP) (a) és a Cu(OEP) (b) fotometrikus titrálása 4-pikolinnal 10°C hőmérsékleten. A
beillesztett ábra a négyes- és az ötös-koordinált réz(II)-porfirin PSEQUAD program által számolt alapállapotú komplexeinek elnyelési színképeit mutatja.
57
21. ábra A Zn(TPP) (a) és a Zn(OEP) (b) fotometrikus titrálása piridinnel 20°C hőmérsékleten. A beillesztett ábra a négyes- és az ötös-koordinált cink(II)-porfirin PSEQUAD program által számolt alapállapotú komplexeinek elnyelési színképeit mutatja.
58
22. ábra A Zn(TPP) (a) és a Zn(OEP) (b) kisugárzási színképének változása növekvő piridin koncentráció hatására 20°C hőmérsékleten. A tömör pontok a mért és korrigált kisugárzási értékeket, míg a folytonos vonal a PSEQUAD programmal végzett illesztés eredményét mutatja.
63
23. ábra (a) A Zn(OEP) piridinnel és származékaival képzett komplexeinek egyensúlyi állandói a hőmérséklet reciprokának függvényében (b) A Zn(OEP)4p komplexre mért egyensúlyi állandók a hőmérséklet reciprokának függvényében, kinagyítva, a termodinamikai paraméterek számolásához alapul szolgáló egyenes egyenleteinek feltüntetésével
65
24. ábra A Cu(TPP) (a) és a Cu(OEP) (b) lumineszcencia élettartamának változása a hőmérséklet függvényében, Arrhenius típusú ábrázolás. A 24b. ábrán feltüntetett mért és számolt értékek a kioltási mérések 20, 30, 40, 50 és 60°C-on mért τ adataiból származnak.
71
25. ábra A gerjesztett állapotú *Cu(OEP) különbségi színképének változása növekvő piridin koncentráció függvényében 30°C-on, toluolban.
72 26. ábra A Cu(TPP) (a) és Cu(OEP) (b) lumineszcenciájának kioltása szobahőmérsékleten acetonitrillel. 74 27. ábra Cu(OEP) 20°C-on mért lumineszcencia élettartamának változása Lewis bázisokkal Stern-Volmer-
féle ábrázolásban 75
28. ábra A Cu(OEP) kioltási sebességi állandóinak hőmérsékletfüggése Eyring-Polányi-féle ábrázolásban. 77
Táblázatjegyzék
Táblázat Cím Oldal
1. táblázat Gyakori porfirinek triviális neve és szerkezete 6
2. táblázat Fémionok illeszkedése a porfinvázba 8
3. táblázat Metalloporfirinek stabilitási osztályai, savakkal szembeni ellenálló képességük alapján 9 4. táblázat Metallo-oktaalkil-porfirinek stabilitási indexei (Si) és stabilitási osztályai 10 5. táblázat Porfirinek eltérése a teljes planaritástól 17
6. táblázat Kötéshosszak a porfin molekulában 18
7. táblázat Kötésszögek a porfin molekulában 19
8. táblázat Kötéshosszak és kötésszögek átlagértékeinek összevetése a porfin és szubsztituált származékai
között 20
9. táblázat A Cu(TPP) molekulát jellemző relatív koordináták és kötéshosszak 22 10. táblázat Metalloporfirinek lumineszcencia sajátságai a központi fématomtól függően, szoba-
hőmérsékleten (300°K) és alacsony hőmérsékleten (77°K) 25
11. táblázat Egyes fotofizikai átmenetek leggyakoribb időtartama 28 12. táblázat A mérésekhez használt vegyszerek és tisztaságuk 35
13. táblázat A cink- és réz-porfirinek alap- és/vagy legkisebb energiájú szingulett gerjesztett állapotainak
ν=1 és ν=0 vibrációs energia különbségei, toluol oldószerben 43 14. táblázat A Zn(TPP) és Zn(OEP) elnyelési- és kisugárzási színképeinek jellemző adatai és a gerjesztett
állapotú molekula fotofizikai állandói 45
15. táblázat A Cu(TPP) és Cu(OEP) elnyelési- és kisugárzási színképeinek jellemző adatai toluolban, 25°C-
on 51
16. táblázat MRA futtatás eredménye Zn(TPP) és piridin rendszerre 52 17. táblázat PSEQUAD input fájlban megadott összetétel mátrix Zn(TPP) és piridin rendszer esetén 53 18. táblázat A Zn(TPP) (a) és a Zn(OEP) (b) elnyelési színképének jellemző adatai toluol oldószerben és
toluol/bázis oldószer elegyekben 59-60
19. táblázat Irodalomban közölt értékek a Cu(TPP) és a Zn(TPP) piridin és piridin származékokkal képzett
ötös-koordinációjú komplexének képződésére, különböző hőmérsékleten és oldószerekben 60 20. táblázat A Cu(TPP) és Cu(OEP) piridinnel (p), 3-pikolinnal (3p) és 4-pikolinnal (4p) alkotott
komplexeinek egyensúlyi állandói, Kt, 10-60°C között, és a komplex képződésre jellemző termodinamikai paraméterek
61
21. táblázat A Zn(TPP) 20, 30, 40, 50 és 60°C hőmérsékleten mért, különböző Lewis-féle bázisokkal alkotott komplexeinek egyensúlyi állandói, Kt, és a komplexek képződésére jellemző termodinamikai paraméterek
66
22. táblázat A Zn(OEP) 20, 30, 40, 50 és 60°C hőmérsékleten mért, különböző Lewis-féle bázisokkal alkotott komplexeinek egyensúlyi állandói, Kt, és a komplexek képződésére jellemző termodinamikai paraméterek
67
23. táblázat A Zn(TPP) és Zn(OEP) N-bázisokkal képzett komplexeinek kialakulását jellemző termodinamikai paraméterek és az ötös-koordinációjú alap- és gerjesztett állapotú komplexek 25°C-ra számított egyensúlyi állandói a bázisok erősségével
68
24. táblázat A Cu(TPP) és a Cu(OEP) lumineszcencia élettartamai 10-70°C között 70 25. táblázat Folytonos megvilágításos és lézervillanófény fotolízis technikával meghatározott kioltási
sebességi együtthatók a Cu(TPP)-re, toluolban 20-60°C 76 26. táblázat Folytonos megvilágításos és lézervillanófény fotolízis technikával meghatározott kioltási
sebességi együtthatók a Cu(OEP)-re, toluolban 20-60°C
76 27. táblázat A gerjesztett komplex, Cu(TPP) és Cu(OEP) 20-60°C között mért kioltási sebességi
együtthatóiból számolt aktiválási paraméterek 78
KIVONAT, ABSTRACT,
AUSZUG
Magyar nyelvű kivonat
A cink(II)- és a réz(II)-tetrafenil- és oktaetil-porfirinek fotofizikai sajátságai, komplexképzésük és kioltásuk nitrogéntartalmú donor molekulákkal
A szerző a cink(II)-oktaetil- (Zn(OEP)), a cink(II)-tetrafenil- (Zn(TPP)), a réz(II)-oktaetil- (Cu(OEP)) és a réz(II)-tetrafenil- (Cu(TPP)) porfirinek nitrogéntartalmú elektrondonor molekulákkal alkotott ötös koordinációjú komplexeinek képződési állandóit határozta meg spektrofotometriás módszerrel. Tekintettel a réz(II)-porfirinek gyenge komplexképző hajlamára, e porfirinek egyensúlyi vizsgálatait piridin, 3-pikolin és 4-pikolin molekulák jelenlétében tudta elvégezni a szerző míg a cink(II)-porfirinek esetében a már felsorolt három elektron donoron kíívül még 2-pikolin, 2,6-lutidin, acetonitril és benzonitril is viszonylag jó komplexképzőnek bizonyult. Az egyensúlyi állandókat különböző hőmérsékleten (10-60°C) is megmérte, amely adatokból a penta-koordinált komplex termodinamikai paramétereit számította ki. A porfirintől és az axiális ligandumtól függően az entrópia értéke -81 és -92 J/molK illetve -127 és -61 J/molK míg az entalpiájé -16 és -19 kJ/mol illetve -49 és -24 kJ/mol között változik a réz(II)- illetve a cink(II)- porfirinekre nézve.
Elektron donor molekulák hatására a cink(II)-porfirinek (Zn(P)) fluoreszcenciaszínképe a kisebb energiák irányába tolódott, izosztilbikus pontok megjelenésével. A lumineszcencia spektrumsorozatok lehetővé tették a gerjesztett állapotú komplexek egyensúlyi állandóinak kiszámítását is.
A réz(II)-porfirinek trip-multiplett állapotainak lumineszcencia kioltását a szerző, a hőmérséklet függvényében, folytonos megvilágításos és lézervillanófény- fotolízis technikával egyaránt elvégezte. A mérések eredményeként kapott kioltási állandókból az átmeneti komplex aktiválási paramétereit számolta, ahol az ∆S≠ -46 és -72 J mol-1 K-1 míg az ∆H≠ 1,6 és 11,2 kJ mol-1 között változott.
Komplexképző tulajdonságának köszönhetően a Zn(TPP) egyensúlyi állandóit számos bázis jelenlétében, több hőmérsékleten is meghatározták már, míg a réz-porfirinek közül csak a Cu(TPP) szobahőmérsékleten mért egyensúlyi állandója található az irodalomban. A megfelelő oktaetil származékokkal kapcsolatban pedig semilyen adat nem állt rendelkezésre. Így a disszertáció célja elsősorban az volt, hogy a vizsgálat tárgyát képező négy metalloporfirin
nitrogéntartalmú donor molekulák jelenlétében kialakuló ötös koordinációs számú komplexeinek stabilitási állandóit meghatározza és egymással összevesse. A réz-porfirinek sajátos energiaszerkezete adta a második célkitűzést, nevezetesen a Cu(TPP) és Cu(OEP) kioltási állandóinak meghatározását a hőmérséklet függvényében. A mérési adatok a négy vizsgált porfirin fotofizikai tulajdonságainak összehasonlítását tették lehetővé.
Angol nyelvű kivonat
ABSTRACT
Photophyisical characterization of zinc(II)- and copper(II)- tetraphenyl- and octaethyl- porphyrins, their complex formation and queching with nitrogen containing donor molecules
Five coordinate complex formation of copper(II)-tetraphenylporphyrin (Cu(TPP)), copper(II)-octaethylporphyrin (Cu(OEP)), zinc(II)-octaethylporphyrin (Zn(OEP)) and zinc(II)- tetraphenylporphyrin (Zn(TPP)) have been studied in the presence of nitrogen containing electron donor molecules. Stability constants in toluene were determined at various temperature ranged between 10 and 60°C by spectrophotometric method from absorption spectra and in case of the zinc(II)-porphyrins also from steady state fluorescent measurements from which thermodynamic parameters were determined.
The same electron donors were used to quench the luminescent trip-multiplet manifold of the copper(II)-porphyrins. These measurements were carried out at five different temperatures (20-60°C) by two different techniques: (1) steady state luminescence and (2) laser flash photolysis.
Német nyelvű kivonat
AUSZUG
Photophysikalische Eigenschaften von Zink(II)- und Kupfer(II)-Tetraphenyl- und Octaethylporphyrinen, und ihre Komplexbildung und Löschung mit stickstoffhaltigen Donor- Molekülen.
Fünffach-koordinierte Komlexbildung von Kupfer(II)-Tetraphenylporphyrin (Cu(TPP)), Kupfer(II)-Octaethylporphyrin (Cu(OEP)), Zink(II)-Octaethylporphyrin (Zn(OEP)) und Zink(II)-Tetraphenylporphyrin (Zn(TTP)) wurden mit stickstoffhaltigen Elektronendonor- Molekülen untersucht. Bildungskonstanten wurden im Toluol bei verschiedenen Temperaturen im Bereich von 10 bis 60 °C durch spektrophotometrische Titration bestimmt. Im Fall von den Zink(II)-Porphyrinen wurden auch stationäre Fluoreszenz-Messungen durchgeführt, die Berechnung von termodynamischen Parametern ermöglichten.
Dieselbe Elektronendonor-Moleküle wurden für Lumineszenz-Löschung der Trip-Multiplett- Zustände von Kupfer(II)-Porphyrinen benutzt. Diese Messungen wurden bei fünf verschiedenen Temperaturen (im Bereich 20 bis 60 °C) durch zwei verschiedene Methoden durchgeführt: (1) stationäre Lumineszenz und (2) Laser-Blitzlichtphotolyse.
1. BEVEZETÉS, CÉLKIT Ű ZÉS
A porfirinvegyületek, illetve ezek fémionokkal képzett komplexei, az úgynevezett metalloporfirinek alapvető jelentőségű molekulái, az élő szervezetek számára nélkülözhetetlen folyamatoknak, mint a fotoszintézis (klorofill) vagy az O2-CO2 anyagcsere (hemoglobin).
Vizsgálatuk, tervezésük és fejlesztésük fontos feladat napjainkban is: a porfirin-kémia jelentősebb kutatási és alkalmazási területei közé tartozik a napcellák készítése, a mesterséges fotoszintézis modellezése, valamint a tumor sejtek pusztítása (Fotodinamikus Terápia, röviden:
PDT) [1-3]. A napcellákban a látható tartományon belüli széles és intenzív fényelnyelésüket kihasználva az aktív reakciócentrum felületére adszorbeálva fotoérzékenyítőként alkalmazzák a porfirineket [4-6]. A fotoszintézis modelleknél az antennának nevezett porfirinszármazék kovalens kötéssel kapcsolódik az elektrondonor molekulához, úgynevezett híd- vagy távtartómolekulán keresztül [7-17]. A PDT kísérleti és alkalmazott rendszereiben viszont a porfirin spontán egyensúlyi folyamatban koordinálódik a DNS megfelelő bázis molekuláihoz [18-28]. Ez utóbbi kutatási terület adta az ötletet, hogy megvizsgáljam néhány fémközpontú porfirin egyensúlyi folyamatait nitrogén tartalmú elektrondonor molekulák jelenlétében.
A síknégyzetes metalloporfirinek erős elektrondonor molekulákkal - mint amilyen a piridin és származékai - vegyesligandumú komplexeket alkotnak. A porfirin központi fématomjától függően bipiridin- (pl. Fe(II) és Ni(II) [29,30]), illetve monopiridin-komplex jön létre, mint pl.
Zn(II), Cu(II) és Hg(II) [29-31] centrum esetén. A Mg(II)-porfirinek mono- és bipiridin- komplexeket egyaránt képeznek [32].
A réz(II)- és cink(II)-porfirinek abban hasonlóak, hogy elektrondonor molekulákkal csak 1:1 összetételű adduktumot képeznek, az ötös-koordinációjú komplexeik stabilitása, illetve a négyes-koordinációjú metalloporfirinek lumineszcencia tulajdonságai azonban jelentősen eltérnek egymástól. A lezárt alhéjú, diamágneses fémionokkal képzett porfirinkomplexek szingulett gerjesztett állapota intenzíven fluoreszkál [5,33,34], míg a nem teljesen feltöltött alhéjú, paramágneses fémionnal alkotott komplexek a gerjesztést követően nem, vagy csupán gyenge, leggyakrabban foszforeszenciaként definiált sugárzást mutatnak [35-39]. A különbség magyarázata a paramágneses központi atom okozta sajátos eredő spinmultiplicitásban rejlik:
ugyanis a fématom és a porfirinváz spinmultiplicitásának „keveredése” következtében úgynevezett trip-multiplett állapotok alakulnak ki [36,40,41]. A réz(II) központi atom két kevert, egymással termikus egyensúlyban lévő, spin állapotot hoz létre: a trip-dublettet (2T1) és a trip-kvartettet (4T1). A nagyobb energiájú 2T1 állapot spinmultiplicitása formálisan megegyezik az ún. szing-dublett (2S0) alapállapotéval, aminek a következtében a gerjesztett állapotú molekula spin-megengedett folyamat révén – elsősorban belső konverzióval (IC) – kerülhet vissza alapállapotba. A réz(II)-porfirinek további érdekessége, hogy a trip-multiplett
állapotokéhoz hasonló energiájú, ún. kioltó állapotukat (2Q) is azonosították, amelynek természete ugyan vitatott [37,42-49], de spinmultiplicitása egybehangzóan az alapállapotú komplexével megegyezően szing-dublett. Neve onnan ered, hogy az eredeti négyes- koordinációs számú komplex 2Q állapotának energiaszintje a penta-koordinált komplex kialakulásának következtében valószínűleg alacsonyabb energiaszintre kerül [37] (2PQ), és a spin megengedett (IC) átmenet révén, a trip-multiplett állapotok relaxációjánál sokkal hatékonyabb energiavesztési utat biztosít. Ennek következtében a porfirin lumineszcencia intenzitása csökken és már viszonylag kis donor koncentrációnál meg is szűnik [38,39].
A Cu(II) és Zn(II) porfirinek fotofizikai sajátságaik különbözőségén kívül abban is eltérően viselkednek, hogy nitrogén tartalmú Lewis bázisokkal képzett komplexeik egyensúlyi állandói között több nagyságrend különbség van. Valamely bázis Zn(II)-porfirinnel alkotott komplexének egyensúlyi állandója öt nagyságrenddel nagyobb, mint a megfelelő Cu(II) komplexé. Jó komplexképző tulajdonságának köszönhetően a Zn(TPP) (TPP: tetrafenil- porfirin) egyensúlyi állandóját számos bázis jelenlétében, több hőmérsékleten is meghatározták [30,31,50-54], illetve lásd 19. táblázat. A réz-porfirinek közül csak a Cu(TPP) piridinnel alkotott komplexének szobahőmérsékleten mért egyensúlyi állandóját találtam egy viszonylag régi, 1952-ben megjelent közleményben [31]. Az adatok hiányosságát jól jelzi az is, hogy Kim és társai egy több, mint harminc évvel később (1984) megjelent cikkben [44] még mindig ugyanerre az értékre hivatkoznak. A Zn(OEP) és a Cu(OEP) (OEP: oktaetil-porfirin) nitrogén bázisokkal alkotott komplexeinek egyensúlyi értékeire sem a kísérleti munkát megelőző, sem pedig az azt végigkísérő részletes irodalmi feldolgozás során nem találtam adatokat. Egyrészről az adatok hiányossága tett kiváncsivá, másrészről pedig az, hogy a már említett fotodinamikus terápiában is számos Zn(II)- és Cu(II)-porfirinvegyületet alkalmaznak, amelyek kötődése a DNS lánchoz alapfeltétele a terápiának. A koordináció a porfirin központi fématomja és a DNS nukleinbázisainak nitrogén-, illetve oxigénatomjai között alakul ki.
Mindezek alapján vizsgálataim céljául azt tűztem ki, hogy a Zn(TPP), a Zn(OEP), a Cu(TPP) és a Cu(OEP) nitrogén tartalmú donor molekulákkal alkotott komplexeinek egyensúlyi állandóit meghatározzam a hőmérséklet függvényében és így információt szerezzek a koordinálódó ligandumok számáról, a koordináció erősségéről és a koordináció fémporfirin fotofizikájára gyakorolt hatásáról. A réz(II)-porfirinek sajátos energiaszerkezete adta második célkitűzésemet, a Cu(TPP) és Cu(OEP) kioltási állandóinak meghatározását a hőmérséklet függvényében. A mérési adatok a négy vizsgált porfirin fotofizikai és fotokémiai tulajdonságainak összehasonlítását tették lehetővé.
2. IRODALMI ÁTTEKINTÉS
2.1 Általános tudnivalók a porfirinekről
2.1.1 A porfinváz szerkezete és nevezéktana
A porfirineket formálisan a porfinvázból, a pirrol nitrogénekkel közvetlen kapcsolatban nem lévő szénatomok közül néhány vagy az összes szubsztitúciójával származtatjuk.
Az 1. ábra magát a származtatási alapot képező porfinvázat, illetve annak klasszikus nomenklatúráját ismerteti.
HN NH N
N
1 4
D C
B
γ
A
β
8
α
7
δ
6 5 3 2
1. ábra. A porfinváz triviális nevezéktana [56a].
A pirrol nitrogénekkel közvetlen kapcsolatban nem lévő szénatomokat, mint az oldallánc szubsztitúció potenciális helyeit, attól függően, hogy pirrolgyűrűhöz tartoznak, vagy pirrolgyűrűket kapcsolnak össze, két fő csoportba sorolhatjuk. Ez alapján beszélünk pirrolközti és periférikus helyzetű szénatomokról. A pirrolközti helyzet – amelyet szokás meso helyzetnek is nevezni – α, β, γ, δ görög betűkkel jelölt, míg a periférikus helyzet 1-től 8-ig számozott. A pirrolgyűrűket A, B, C, D betűkkel szokás jelölni, tehát a periférikus szénatomok közül az 1 és 2 az „A”-, a 3 és 4 a „B”-, az 5 és 6 a „C”-, míg a 7 és 8 a „D”- gyűrű tagja. Az 1. táblázatban néhány gyakori porfirin triviális nevét és szerkezetét foglaltam össze, amelyek közül az összes lehetséges izomert egyedül az etioporfirin esetében tüntettem fel. Az etioporfirinek periférikus szénatomjaihoz 4 metil és 4 etil csoport kapcsolódik, amely négy lehetséges izomert jelent. Az izomerek egyes fajtáit a triviális nevezéktan a porfirin nevéhez elválasztójellel kötött római számmal jelöli: etioporfirin-III. A porfirin pontos szerkezetéről a szisztematikus elnevezés ad felvilágosítást; így az etioporfirin-III szisztematikus elnevezése az 1. táblázat alapján 2, 4, 6, 7- tetraetil-1, 3, 5, 8-tetrametil-porfirin.
1. táblázata
Gyakori porfirinek triviális neve és szerkezete
Porfirin 1 2 3 4 5 6 7 8
Etioporfirin-I Me Et Me Et Me Et Me Et
Etioporfirin-II Me Et Et Me Me Et Et Me
Etioporfirin-III Me Et Me Et Me Et Et Me
Etioporfirin-IV Me Et Et Me Et Me Me Et
Oktaetil-porfirin Et Et Et Et Et Et Et Et
Deuteroporfirin-IX Me H Me H Me P P Me
Mesoporfirin-IX Me Et Me Et Me P P Me
Protoporfirin-IX Me V Me V Me P P Me
Koproporfirin-I Me P Me P Me P Me P
Koproporfirin-III Me P Me P Me P P Me
Uroporfirin-I A P A P A P A P
Uroporfirin-III A P A P A P P A
Klorokruoroporfirin Me CHO Me V Me P P Me Rodoporfirin-XV Me Et Me Et Me CO2H P Me Az oldalláncok rövidítései: Me= Metil; Et= Etil; V= Vinil; P= CH2CH2CO2H; A= CH2CO2H
a Ref. [56a].
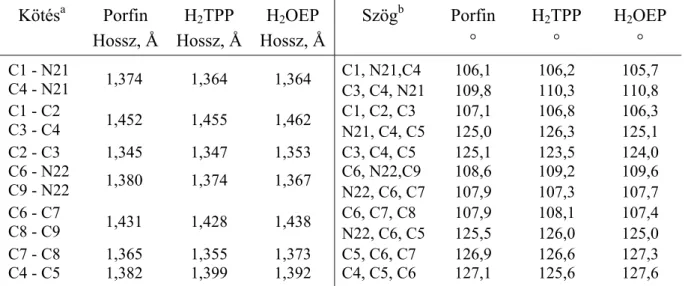
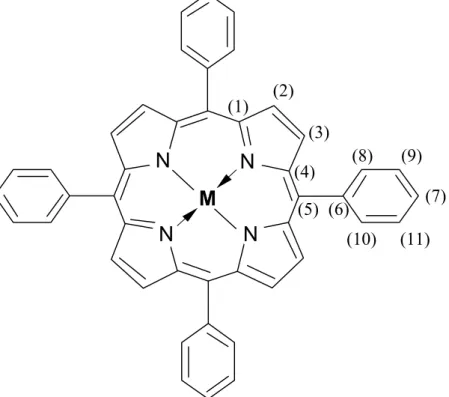
A hetvenes évektől kezdve új nevezéktan használata alakult ki, amely a porfirinek sokféleségének következtében közel sem mondható egységesnek, abban azonban valamennyi jelölési mód megegyezik, hogy az egyes atomokat kizárólag számozással különböztetik meg egymástól. A 2.3.1 fejezetre előre tekintve, a porfinváz napjainkban is használatos számozási sémái közül ebben a fejezetben a Webb és Fleischer szerinti jelölést [57] mutatom be, 2. ábra. A triviális nevezéktant szemléltető ábrából ezt úgy származtathatjuk, hogy az 1. ábra α és γ jelű szénatomjainak összekötésével nyert tengely körül a porfirinvázat 180°-kal elforgatjuk és az eredeti jelölés szerinti C1 és Cδ közötti szénatomot nevezzük el C1-nek, majd C1-től az óramutató járásával ellentétes irányban számozzuk a porfinváz minden egyes szénatomját: C1- C20. A nitrogénatomokat, a C1 szénatomot tartalmazó gyűrűből kiindulva, szintén az óramutató járásával ellentétes irányba számozzuk: N21-N24. Az új nevezéktan alapján a H2TPP teljes neve 5,10,15,20-tetrafenil-21H,23H-porfirin, míg a H2OEP neve 2,3,7,8,12,13,17,18-oktaetil- 21H,23H-porfirin. Fémporfirin esetében a fém neve a porfirin szó elé kerül, így a ZnTPP neve 5,10,15,20 tetrafenil-21H,23H-cink-porfirin.
N24 N22 N21
N23
2 3
1 5 4
6 7 8
9 10
16 17
18 19
20 11
12 13
14 15
2. ábra. A porfin számozási sémája Webb és Fleischer [57] alapján.
2.1.2 A porfinváz alapvető jellemzői
A porfinváz tulajdonságainak összefoglalásakor két fő sajátságot kell szem előtt tartani; a váz alakját és elektronszerkezetét.
A porfinváz stabil, sík gyűrűs szerkezet, amely koordinációs kémiai szempontból merev, négyfogú, meghatározott „belső terű” ligandumként jellemezhető. A ligandum merev és zárt szerkezetéből következik, hogy a komplexálódó fémion méretére nézve szelektív (ideális fémion átmérő: 120-160 pm), a megfelelő méretű fémekkel viszont nehezen disszociáló komplexeket képez (metalloporfirinek).
A porfin makrociklust konjugált elektronrendszer és számos rezonanciaforma jellemzi. A makrociklus 22 π-elektront tartalmaz, amelyből a konjugációban 18 vesz részt. A Hückel szabály (4n+2) értelmében megállapítható, hogy a porfin gyűrű aromás jellegű. Az aromás jelleget a Hückel szabályon kívül röntgendiffrakciós [58,59] és NMR vizsgálatok [56] valamint az aromás vegyületekre tipikusan jellemző elektrofil szubsztitúciós reakciók (nitrálás, halogénezés, szulfonálás, acilezés és formilezés) is alátámasztják. A röntgendiffrakciós vizsgálatok a porfinváz sík szerkezetét bizonyítják, ami az aromás jelleg szintén alapvető ismérve. Az NMR vizsgálatok pedig az aromás gyűrűáramot igazolják, hiszen a leárnyékolt NH porfin protonok jele csak nagy mágneses térerősségnél jelentkezik (14-15 Tesla), míg a gyűrűáram által le nem árnyékolt külső mezo-protonok jele már zérus Tesla körül észlelhető. A kiterjedt konjugált elektronrendszer eredményeként a porfirinek a látható fény tartományában kiváló elnyelési sajátságokkal rendelkeznek (széles tartomány, intenzív sávok), valamint elektron- és energia-transzfer (ET) folyamatok hatékony résztvevői.
2.1.3 Metalloporfirinek létrejöttének feltétele és a SAT komplexek Ahogyan azt az előző fejezetben már említettem, a porfinváz négy nitrogénatomja egy merev, adott átmérővel rendelkező teret biztosít a vele kapcsolatba kerülő komplexképző fémionok számára. Mivel a váz mérete adott, a metalloporfirin létrejöttének esélye, valamint a keletkező komplex stabilitása elsősorban a fémion méretétől függ (lásd 2. táblázat). Ha a fémion átmérője túl kicsi, akkor erős kötés kialakulására nem nyílik lehetőség és a fémion gyakorlatilag „átesik” a porfinváz közepén. Ha a fémion átmérője túl nagy, akkor a fémion nem fér be a négy nitrogén közé, csupán a porfinváz síkja felett, pontosabban az eredetileg sík vázat meghajlítva egy úgynevezett sitting-atop vagy röviden SAT (magyarul „tetején ülő”-nek fordítható) komplexet hoz létre [60-63]. A SAT komplex esetén a fémion a meghajlított porfinvázon ül, két pirrol nitrogénhez kapcsolódva, míg a másik két pirrol nitrogén továbbra is kovalens kötésben marad a hidrogénatomokkal [64]. Nagy fémionkoncentrációnál létrejöhet úgynevezett szendvics komplex is, ha a nyeregfelületté torzult porfinváz másik oldalához is koordinálódik fémion [65].
2. táblázat
Fémionok illeszkedése a porfinvázba Fémion Méret, pm
(átmérő) Illeszkedés Fémion Méret, pm
(átmérő) Illeszkedés
Be2+ 90 kicsi Zn2+f 148 nagy
Al3+ 106 kicsi Mn2+ 164 nagy
Co2+a 130 megfelelő Cd2+ 190 SAT
Fe3+ 130 megfelelő Hg2+ 204 SAT
Ni2+b 138 megfelelő Bi3+ 206 SAT
Mg2+c 144 megfelelő Ag+ 230 SAT
Cu2+d 146 nagy Sn2+ 236 SAT
Fe2+e 156 nagy Pb2+ 238 SAT
a pl. kobalamin.
b pl. F430 koenzim; Ni-N távolság: 196 pm [59].
c pl. klorofill.
dCu-N távolság: 198 pm [59].
e pl. hemoglobin; Fe-N távolság: 203 pm [59].
f Zn-N távolság: 204 pm [59].
2.1.4 Porfirinvegyületek stabilitása
A porfirinek stabilitásán elsősorban hővel, vegyszerekkel (savak, oxidáló- és redukáló- szerek) és fénnyel szemben tanúsított ellenálló képességüket értjük, a metalloporfirinek esetében a porfinváz stabilitásán kívül természetesen a fémkomplex stabilitása is mérvadó.
Falk [66] és Philips [67] a metalloporfirineket protikus savakkal szemben mutatott reakciókészségük alapján a 3. táblázatban összefoglalt öt különböző stabilitási osztályba sorolja.
3. táblázata
Metalloporfirinek stabilitási osztályai, savakkal szembeni ellenálló képességük alapján Stabilitási osztály Reagens (25°C, 2 h) Viselkedés
I 100% H2SO4 Nem teljes fémvesztés
II 100% H2SO4 Teljes fémvesztés
III HCl / H2O - CH2Cl2 Fémvesztés
IV 100% CH3COOH (jégecet) Fémvesztés
V H2O - CH2Cl2 Fémvesztés
a Ref. [56b].
Szokás még a központi fémionok stabilitását is jellemezni, amelyet az úgynevezett stabilitási indexszel (Si) lehet megtenni. A központi fémion stabilitási indexe a következő összefüggés alapján számolható: Si = (EN/ri)×100×Z, ahol Si maga a stabilitási index, EN a kation elektronegativitása, ri a kation sugara pikométerben, Z pedig az adott kation oxidációs száma.
A porfirinek stabilitási osztályai és a központi fémionok stabilitási indexei között az esetek döntő többségében korreláció tapasztalható (4. táblázat).
A karboxilos oldallánccal rendelkező porfirinek hő hatására bomlani kezdenek, így olvadásponttal nem rendelkeznek, viszont észtereik és néhány fém komplexük bomlás nélkül, a 200-300°C tartományban olvad meg. Esetenként a porfirinek tisztítására szublimációt alkalmaznak. Tudománytörténeti jelentősége van a müncheni klasszikus porfirin kémiai iskola olvadásponton alapuló analízisének [68], amely napjainkban is a porfirinek azonosításának nagyra értékelt módszere, bár olykor téves eredményre vezethet [69,70].
4. táblázata
Metallo-oktaalkil-porfirinek stabilitási indexei (Si) és stabilitási osztályai
Z Me EN ri EN/ri Si Stabilitási osztály
(fém) (pm) ×100 Jó illeszkedés Rossz illeszkedés
2 Pd 2.20 64 3.44 6.88 I
Ni 1.91 60 3.18 6.37 II Cu 1.90 62 3.06 6.12 II
Pt 2.28 78 2.92 5.85 I
Co 1.88 65 2.89 5.78 II Fe 1.83 77 2.38 4.76 III Zn 1.65 74 2.23 4.46 III Pb 2.33 118 1.97 3.95 IV Hg 2.00 102 1.96 3.92 IV Ca 1.00 100 1.00 2.00 V
3 Ru 2.2 68 3.24 9.71 I
Al 1.61 53 3.04 9.11 I Fe 1.83 64 2.86 8.58 II
Cr 1.66 62 2.68 8.03 I
Mn 1.55 65 2.38 7.15 II Bi 2.02 102 1.98 5.94 III Sc 1.36 73 1.86 5.59 IV
4 Si 1.90 40 4.75 19.00 I
Ge 2.01 54 3.72 14.89 I Sn 1.96 69 2.84 11.36 I Ti 1.54 60 2.57 10.27 II Zr 1.33 72 1.85 7.39 II
5 As 2.18 50 4.36 21.80 I
W 2.36 62 3.81 19.03 I
Mo 2.16 63 3.43 17.14 II
Sb 2.05 61 3.36 16.80 I Re 1.9 61 3.11 15.57 I
a Ref. [56c].
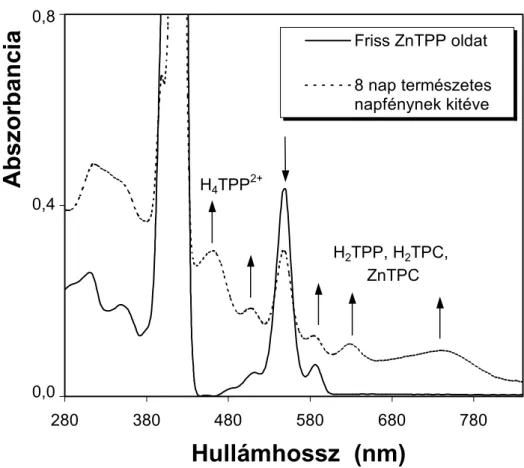
Maga a porfinváz stabil a koncentrált kénsavval és a tiszta trifluor-ecetsavval szemben, ami azért fontos, mert e két sav használatos a központi fématom eltávolítására. A perklórsav, a krómsav vagy a permanganát viszont bontja a porfinvázat is. A porfirinek általában fotokémiailag viszonylag instabilak. A vinilcsoportot tartalmazó porfirinek, mint amilyen a protoporfirin-IX is, gyorsan fotooxidálódnak. Aszkorbinsav, glutation vagy tercier-aminok jelenléte a porfirinek gyors fotoredukcióját eredményezi. Redukált termékként az úgynevezett florinokat kapjuk, amelyek enyhe oxidációjával visszajuthatunk a kiindulási porfirinekhez. A florinok a porfirinek olyan redukált származékai, amelyekben a porfinváz klasszikus nevezéktana szerinti γ pirrolközti szénatom telített. A ZnTPP fotokémiai instabilitását a 3. ábra szemlélteti.
0 0.4 0.8
280 380 480 580 680 780
Hullámhossz (nm)
Abszorbancia
Friss ZnTPP oldat 8 nap természetes napfénynek kitéve
H4TPP2+
H2TPP, H2TPC, ZnTPC 0,8
0,4
0,0
3. ábra. A ZnTPP fotodegradációja metilén-klorid oldószerben.
2.2 Metalloporfirinek koordinációs kémiája
Kísérleti munkám jelentős részében a vizsgált metalloporfirinek komplexképződési sajátságaival foglalkoztam, ezért fontosnak tartom, hogy a porfirinvegyületekre jellemző kémiai folyamatokat röviden vázoljam.
A porfirinek koordinációs kémiai reakcióit három főbb alcsoportra oszthatjuk:
I. A makrociklus változásai, de nem fémionok hatására (pl. protonálódás, deprotonálódás, dimerizáció).
II. A makrociklusba fém központi atom épül be, vagy lép ki, ide értve a fémkicserélődési reakciókat is.
III. Maga a metalloporfirin komponensnek tekinthető és a központi fématom vegyértékpályái révén, különböző donor ligandumokkal, a porfirinvázra merőleges tengely irányában koordinatív kötés alakul ki.
A fém be-, illetve kilépési, valamint a fémkicserélődési (transzmetalláció) reakciókat szokás sztatikus koordinációs folyamatoknak is nevezni, míg a többi reakciót a porfirinek dinamikus koordinációs kémiájának tárgykörébe sorolni [56d,56e]. Ez a besorolás nem tűnik túl
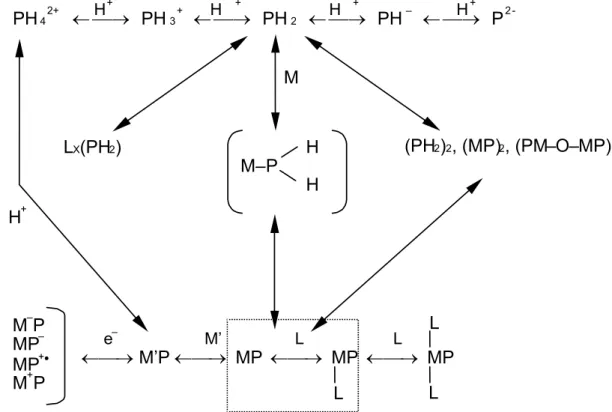
szerencsésnek, hiszen, ha az izotópkicserélődési reakciókat tekintjük, akkor láthatjuk, hogy bizonyos fématomok esetében a szabad fémion koncentráció dinamikus egyensúly eredménye és nem egy sztatikus állapotot tükröző beépülés utáni – nevezzük így – „maradék koncentráció”. Ezért ezt a felosztást csak megemlítettem, de e fejezetben használni nem fogom, helyette az általam javasolt hármas tagolást használom. Az egyes reakciótípusok ismertetése előtt, azok összefoglalását a 4. ábra mutatja be, ahol a szaggatott vonallal bekeretezett részlet kísérleti munkám tárgykörét jelöli.
M
(PH 2) 2, (MP) 2, (PM – O – MP) PH 42+
← H → PH 3+
←
H → H PH 2 ← → + PH – ← H→
+ + +
P 2-
M –P MP– MP +• M +P
e– M’ L L
← → M’P ← → MP ← → MP ← → MP L X(PH 2) H
M – P H H +
L
L L
4. ábra. Porfirinek és metalloporfirinek koordinácós kémiai kölcsönhatásainak általános összefoglalása Az egyértelműség kedvéért a jelölések: P – porfirin, M – fém, L – ligandum,
H – hidrogén, O – oxigén. [56e].
A fejezet elején ismertetett három alcsoportba, a porfirinek következő koordinációs kémiai reakció típusai tartoznak.
I.
1. Sav-bázis sajátságok,(protonálódás, deprotonálódás):
PH42+ ↔ PH3+ ↔ PH2 ↔ PH– ↔ P2- (1) A töltés nélküli szabad porfirin bázis két proton felvételével mono- és dikationná, míg két
proton leadásával mono- és dianionná alakul. Az egyes protonálódási, illetve deprotonálódási lépcsők a látható tartományban (Q-sávok) élesebben elválnak egymástól, egyensúlyi állandóik abszorpciós spektrofotometriás mérésekkel megadhatók.
2. Dimerizáció:
2 PH2 ↔ (PH2)2 (2)
2 MP(OH)–X ↔ O–(MP–X)2 (3)
A dimerképződés egyensúlyi állandóját, többek között, hígításos mérésekből (cP∼10-4–10-7 M) is meg lehet határozni. A dimerek általában kisebb moláris elnyelési együtthatóval és nagyobb sávszélességgel jellemezhetők, mint a megfelelő monomerek. Amennyiben maga a porfirin monomer fluoreszkál a dimerképződés egyensúlyi állandója fluoreszcencia mérésekből is kiszámítható, hiszen a porfirin dimerek általában nem fluoreszkálnak.
II.
3. Fém beépülése a makrociklusba:
M2+ + PH2 ↔ M(P) + 2H+ (4)
A metalloporfirin stabilitása elsősorban a fémion méretétől függ, a beépülés köztiterméke (esetleg átmeneti komplexe) az ún. SAT komplex, lásd 2.1.3 fejezet.
4. Izotópcsere:
MA + MA″(P) ↔ MA″ + MA(P) (5)
Az érdekesség kedvéért két konkrét példa: a Fe(III)TPP csekély mértékben ugyan, de adja az izotópcsere reakciót, míg a Zn(TPP) piridinben vagy dimetil-formamidban egyaránt teljes inertséget mutat. Ez utóbbi fémporfirin esetében joggal beszélhetünk sztatikus koordinációról, hiszen a központi, izotópjelzett fémion beépülése a makrociklusba olyan nagy stabilitási állandóval jellemezhető, hogy a folyamat kinetikailag egyirányúnak tekinthető.
5. Fémkicserélődés, (Elektrofil szubsztitúció):
MA + MB(P) ↔ MA(P) + MB (6)
A kísérleti tapasztalatok alapján a következő fémkicserélődési sorrend írható fel: (Cu, Zn) >
(Hg > Pd) > (Li > Na > K).
6. Metalloporfirin és szabad porfirin reakciója:
M(PA) + PBH2 ↔ M(PB) + PAH2 (7)
7. A fémkomplex bomlása sav hatására (Sav szolvolízis):
M(P) + 4H+ ↔ PH42+ + M2+ (8)
Szokás a metalloporfirineket savakkal (H2SO4 → H2O) szembeni ellenálló képességük alapján ún. stabilitási osztályokba sorolni (lásd 2.1.4 fejezet 3. táblázata). Általánosan
elmondható, hogy a háromértékű fémionok inertebbek, mint a kétértékűek és az utóbbiakra, illetve az egyértékű katinokra a következő stabilitási sorrend írható fel: Pt(II) > Pd(II) > Ni(II)
> Co(II) > Ag(II) > Cu(II) > Fe(II) > Zn(II) > Mg(II) > Cd(II) > Li2 > Na2 > Ba(II) > K2. III.
8. A porfirin makrociklus síkjára merőleges koordináció (ligandum axiális koordinációja):
M(P) + L ↔ L–M(P) + L ↔ L–M(P)–L (9) 9. Elektron átadási folyamatok, (Redoxi reakciók):
M(III)P + Redukálószer ↔ M(II)P + Oxidálószer (10) Ilyen típusú folyamatokról részletesebben a 2.5.2 fejezet számol be.
10. Ligandumcsere:
(P)M–LA + LB ↔ [(P)M–LA···LB] ↔ (P)M–LB + LA (11)
2.3 Porfirinek és metalloporfirinek sztereokémiája
A legmagasabb rendű szimmetria, amellyel egy porfirinvegyület rendelkezhet a D4h
szimmetria, ami például a következő két fémporfirin esetében teljesül: az ón-oktaetil-porfirin- diklorid nitrometánnal alkotott monoklin kristálya, Sn(OEP)Cl2 · 2 CH3NO2 [71] és a nikkel- oktaetil-porfirin triklin kristálya, Ni(OEP) [72]. E két vegyület azért is érdekes, mert az ón(IV) a legnagyobb, míg a nikkel(II) a legkisebb ion, amely méreténél fogva még, illetve már képes teljesen beilleszkedni a porfinvázba. Mivel a pirrol nitrogénekhez kapcsolódó hidrogén atomok következtében, már maga a porfin sem mondható planárisnak, a D4h szimmetriát elméletileg csak a szimmetrikusan szubsztituált porfirinek fémközpontú származékainak négyes- pl.
M(TPP), M(OEP) és hatos- koordinációjú pl. M(TPP) L2, M(OEP)L2 komplexei vehetik fel. Ez esetben a porfinváz planaritása elsősorban a központi fémion méretétől függ, hiszen a négy nitrogén által körülhatárolt „belső lyuk” mérete gyakorlatilag állandó, a sugár a torzítatlan fémporfirin esetében 2,01 Å [73]. Hoard megfigyelései alapján [74] a legkisebb fémionsugár, amely esetében a porfinváz még planáris maradhat 1,96 Å. Amennyiben a fémion sugara ennél kisebb, a „lyuk” méretének is csökkennie kell, ami a porfinváz torzulását eredményezi, és a nyereg felületre emlékeztető D2d szimmetriájú szerkezet kialakulásához vezet. A nagyméretű fémionokkal létrejövő SAT komplexek esetében is sérül a porfinváz planaritása, ugyanis a vázra ráülő fémion általában szintén a D2d alacsonyabb szimmetriájú [60] nyereg konformációba hajlítja a vázat. Amennyiben a metalloporfirin központi fémionjához axiális ligandum is koordinálódik, azaz ötös koordinációjú komplex jön létre, a szimmetria ismét
megváltozik. Ilyenkor a fémion kiemelkedik a nitrogénatomok által meghatározott alapsíkból, ami a horizontális tükörsík és a kétértékű forgástengelyek megszűnéséhez vezet, megmarad viszont az axiális ligandum és a fématom közötti kötés által kijelölt, a porfin alapsíkra merőleges négyértékű forgástengely és a négy tükörsík. Az ötös koordinációjú komplex a C4v
szimmetriának megfelelő geometriájú (5. ábra). C4v szimmetriával rendelkeznek a Fe(TPP)Cl, az Fe(TPP)SCN vagy a Zn(TPyP)pi (cink(II)-tetra-4-piridil-porfirin monopiridinát) [73,75]
komplexek. Bár a megfelelő szimmetria hiányában előfordulhat, hogy az ötös koordinációjú porfirinkomplexeknél a nitrogénatomok által meghatározott átlag sík (PN) és a porfinvázat alkotó 24 atom által meghatározott átlagsík (PC) nem teljesen párhuzamosak egymással, a mag nettó kiemelkedésének mértéke az M···PC és az M···PN (M···PN = M···Ct) vagy a Ct···PC távolságok megadásával egyértelműen jellemezhető. A nettó kiemelkedés értéke általában <0,5 Å. Amennyiben az axiális ligandum aromás bázis, a porfinváz 24 atomjának átlagos kimozdulása a PC átlag síkból nagy valószínűséggel nagyobb értéknek adódik, mint a nettó kiemelkedésé.
X
Ct
M
N
N N
N
5. ábra. Az ötös koordinációjú metalloporfirinekre használt idealizált négyzetes-piramisos koordinációs csoport (C4v) X: axiális ligandum, M: központi fématom, Ct: planáris váz központja [73].
Bár a D4h szimmetria viszonylag kevés esetben érvényesül egyértelműen a porfirinek geometriájában, a tapasztalat azt mutatja, hogy a torzult porfinvázszerkezetek bármelyike számos tulajdonságot közelítőleg vagy teljesen megtart a D4h porfinváz jellemzői közül. Ilyen
„megőrzött” szerkezeti tulajdonságok a következők: 1) a pirrolgyűrűk planaritása; 2) a hídfő helyzetű (1, 4, 6, 9, 11, 14, 16, 19) szénatomok körüli trigonális kötés rendszer planaritása;
valamint 3) a meso-helyzetű (5, 10, 15, 20) szénatomok körüli trigonális kötés rendszer planaritása. A már említett C4v és D2d geometria esetében mind a három jellemző érvényesül.
Az eddigiekben már tárgyaltam mindazon szimmetriákat, amelyek a porfirineket jellemezhetik. Természetesen a fémionok méretén és a koordinációs számon kívül számos más tényező is befolyásolhatja a molekula geometriáját, így például a halmazállapot vagy a
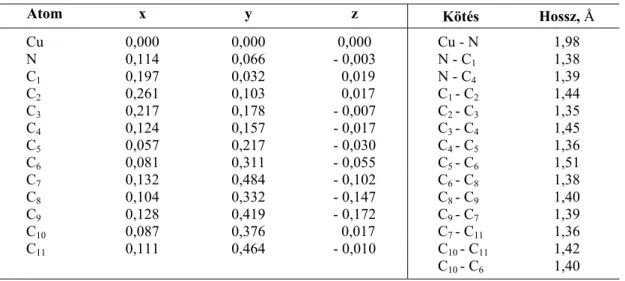
kristályforma (triklin, monoklin stb.), valamint az elemi cellán belüli elrendeződés, vagyis az elemi cellán belüli szomszédos molekulák torzító hatása. Cullen és Meyer [72] vizsgálatai kiválóan szemléltetik a nikkel-oktaetil-porfirin, különböző kristályformáira jellemző geometriai eltéréseket. E cikkben a Ni(OEP) triklin és tetragonális kristálymódosulatainak szerkezeti összehasonlításáról olvashatunk. A két legszembetűnőbb különbség (1) a Ni-N kötések távolságában és a (2) makrociklus planaritásában mutatkozik. A két Ni-N kötéstávolság a triklin szerkezetben 1,959 és 1,957 Å, a N-Ni-N kötésszög pedig 90,15°. A Ni- N kötéshossz a tetragonális szerkezet esetében jelentősen kisebb 1,929 Å, amely érték az addig közölt eredmények közül a legkisebb metalloporfirin fém-nitrogén kötéshossz érték is egyben.
Ezen kívül a tetragonális kristályforma kifejezetten nem planáris, úgynevezett „fodros”
szerkezetű, ahol a szomszédos pirrol vázak síkjai 32,8° szöget zárnak be egymással, míg a Ni(OEP) triklin módosulata központosan szimmetrikus és gyakorlatilag planáris, a szomszédos pirrol vázainak síkjai egymással 2,1° szöget zárnak be. A legtöbb planárisnak nevezett porfirin vázában a szomszédos pirrol vázak síkjai által bezárt szög 3-5° között van.
Szigorúan véve a porfirin gyűrű csak néhány esetben mondható planárisnak. A sík szerkezettől való eltérés mértékét az egyes atomok és az alap „horizontális” átlagsík közötti távolsággal lehet jellemezni, ilyen adatokat tartalmaz az 5. táblázat. Az értékekből kitűnik, hogy az adott molekula a planáris konfigurációhoz képest több esetben is erősen torzult.
A továbbiakban, a nagyrészt 60-as és 70-es években végzett, olyan röntgendiffrakciós kutatások eredményeit foglalom össze, amelyek rendre a porfin, a H2TPP, a H2OEP, a CuTPP és ZnTPP szerkezetének feltárásával foglalkoznak.
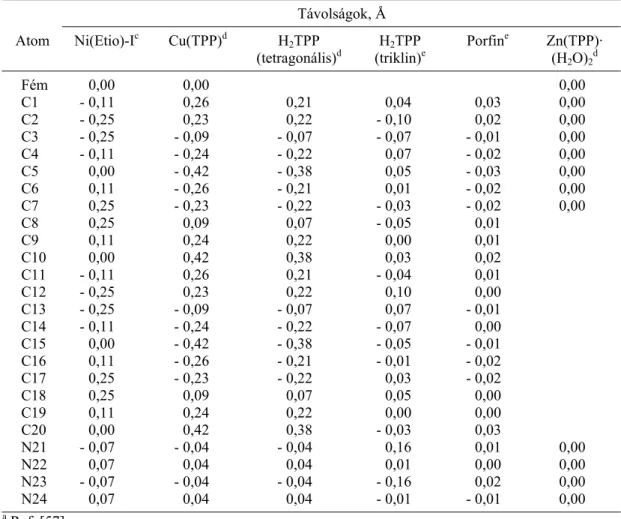
5. táblázata,b
Porfirinek eltérése a teljes planaritástól (számozás a Webb-Fleischer nomenklatúra szerint)
Távolságok, Å
Atom Ni(Etio)-Ic Cu(TPP)d H2TPP
(tetragonális)d H2TPP
(triklin)e Porfine Zn(TPP)·
(H2O)2d
Fém 0,00 0,00 0,00
C1 - 0,11 0,26 0,21 0,04 0,03 0,00
C2 - 0,25 0,23 0,22 - 0,10 0,02 0,00
C3 - 0,25 - 0,09 - 0,07 - 0,07 - 0,01 0,00 C4 - 0,11 - 0,24 - 0,22 0,07 - 0,02 0,00
C5 0,00 - 0,42 - 0,38 0,05 - 0,03 0,00
C6 0,11 - 0,26 - 0,21 0,01 - 0,02 0,00
C7 0,25 - 0,23 - 0,22 - 0,03 - 0,02 0,00
C8 0,25 0,09 0,07 - 0,05 0,01
C9 0,11 0,24 0,22 0,00 0,01
C10 0,00 0,42 0,38 0,03 0,02
C11 - 0,11 0,26 0,21 - 0,04 0,01
C12 - 0,25 0,23 0,22 0,10 0,00
C13 - 0,25 - 0,09 - 0,07 0,07 - 0,01 C14 - 0,11 - 0,24 - 0,22 - 0,07 0,00 C15 0,00 - 0,42 - 0,38 - 0,05 - 0,01 C16 0,11 - 0,26 - 0,21 - 0,01 - 0,02 C17 0,25 - 0,23 - 0,22 0,03 - 0,02
C18 0,25 0,09 0,07 0,05 0,00
C19 0,11 0,24 0,22 0,00 0,00
C20 0,00 0,42 0,38 - 0,03 0,03
N21 - 0,07 - 0,04 - 0,04 0,16 0,01 0,00
N22 0,07 0,04 0,04 0,01 0,00 0,00
N23 - 0,07 - 0,04 - 0,04 - 0,16 0,02 0,00
N24 0,07 0,04 0,04 - 0,01 - 0,01 0,00
a Ref. [57].
b Ref. [59].
c Merőleges távolságok a (008) síktól.
d Merőleges távolságok a (001) síktól.
e Merőleges távolságok a 24 atom magja által meghatározott átlag síktól.
2.3.1 A porfin kristályszerkezete
Számos porfirin porfinvázának szerkezete planaritást illetve kvázi-planaritást mutat gáz halmazállapotban, míg néhány porfirin kristály esetében az elemi cellán belüli elrendeződés következtében jelentős „fodrozódás” figyelhető meg. Egészen a 60-as évekig, amíg csupán kétdimenziós röntgen-felvételek elkészítésére volt mód, a porfint, mint legegyszerűbb porfirinvegyületet, és a többi porfirinvegyületet is egyértelműen planárisnak tartották. Pontos háromdimenziós röntgendiffrakciós meghatározások azonban alapjaiban döntötték meg ezt az elképzelést, és a porfinváz konfigurációjának számos variációját határozták meg [57-60,70,72,76-83]. A sokféle molekuláris konfiguráció a molekula könnyű deformálhatóságát jelzi, amely szerkezeti sajátságot a biológiai rendszerekben betöltött fontos szerepük teszi jelentőssé.
A 2.1.1 fejezetben már említettem, hogy a porfirinekre napjainkban alkalmazott nevezéktan nem egységes, ami a szerkezeti vizsgálatoknál alkalmazott jelölések esetében különösen igaz, hiszen nehéz egyetlen, olyan számozási rendszert kitalálni, amely valamennyi szubsztituált komplexre nézve célszerűnek mondható, ezért a szerkezeti meghatározással foglalkozó munkák az esetek többségében először, az adott porfirinvegyületre, illetve vegyület csoportra jellemző, legcélszerűbb számozási jelölést ismertetik [57-59,73,78,80].
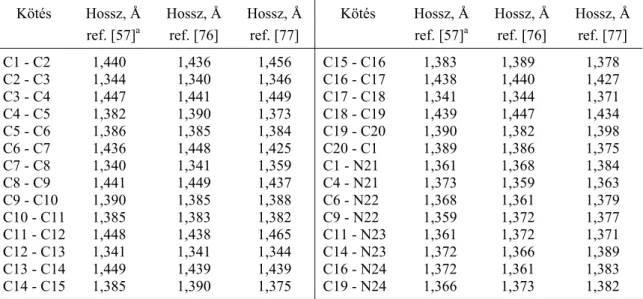
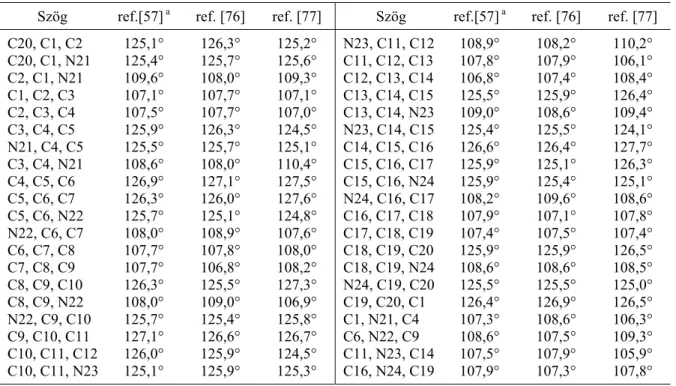
A Webb és Fleischer szerinti számozási sémát a 2.1.1 fejezet 2. ábrája, míg a Webb és Fleischer szerinti számozással megjelölt atomok közötti távolságokat és kötésszögeket e fejezet 6. és 7. táblázata mutatja be. A két táblázat három egymástól független mérés eredményeit tartalmazza.
A felsorolt kötéshossz és kötésszög értékek és a kvázi planaritás alapján a porfin molekula statisztikus szimmetriája nagyon közel esik a legmagasabb szimmetriájú D4h geometriához.
Kvázi planaritás alatt az értendő, hogy a porfin valamennyi szén- illetve nitrogénatomjának az átlag horizontális síktól való távolsága mindössze 0,01 és 0,04 Å között változik. Bár a porfin kristályra elfogadható a D4h statisztikus szimmetria, a külön álló, egyedi molekulára a C2h
szimmetria jellemző, illetve jó közelítéssel a D2h szimmetria is elfogadható, mely utóbbi esetében a tükörsíkok a pirrolgyűrűket szelik ketté [76,77]. A porfin molekula kristályai monoklin kristályok, elemi cellánként négy molekulát tartalmaznak, az elemi cella méretei pedig: a = (12,36 ± 0,01) Å, b = (12,12 ± 0,02) Å, c = (10,272 ± 0,002) Å; β = (102,1 ± 0,1)°
[76], ρ = 1,336 g/cm3 [59].
6. táblázat
Kötéshosszak a porfin molekulában (számozás a Webb-Fleischer nomenklatúra szerint) Kötés Hossz, Å
ref. [57]a
Hossz, Å ref. [76]
Hossz, Å ref. [77]
Kötés Hossz, Å ref. [57]a
Hossz, Å ref. [76]
Hossz, Å ref. [77]
C1 - C2 1,440 1,436 1,456 C15 - C16 1,383 1,389 1,378 C2 - C3 1,344 1,340 1,346 C16 - C17 1,438 1,440 1,427 C3 - C4 1,447 1,441 1,449 C17 - C18 1,341 1,344 1,371 C4 - C5 1,382 1,390 1,373 C18 - C19 1,439 1,447 1,434 C5 - C6 1,386 1,385 1,384 C19 - C20 1,390 1,382 1,398 C6 - C7 1,436 1,448 1,425 C20 - C1 1,389 1,386 1,375 C7 - C8 1,340 1,341 1,359 C1 - N21 1,361 1,368 1,384 C8 - C9 1,441 1,449 1,437 C4 - N21 1,373 1,359 1,363 C9 - C10 1,390 1,385 1,388 C6 - N22 1,368 1,361 1,379 C10 - C11 1,385 1,383 1,382 C9 - N22 1,359 1,372 1,377 C11 - C12 1,448 1,438 1,465 C11 - N23 1,361 1,372 1,371 C12 - C13 1,341 1,341 1,344 C14 - N23 1,372 1,366 1,389 C13 - C14 1,449 1,439 1,439 C16 - N24 1,372 1,361 1,383 C14 - C15 1,385 1,390 1,375 C19 - N24 1,366 1,373 1,382
a A megadott hibák < 0,004 Å.
![2. ábra. A porfin számozási sémája Webb és Fleischer [57] alapján.](https://thumb-eu.123doks.com/thumbv2/9dokorg/874321.47044/22.892.325.594.104.356/ábra-porfin-számozási-sémája-webb-fleischer-alapján.webp)