Pannon Egyetem Műszaki Informatikai Kar Nanotechnológia Tanszék
BIOKATALITIKUS BAEYER-VILLIGER OXIDÁCIÓK Doktori (PhD) értekezés
Készítette:
Muskotál Adél
Környezettudományok Doktori Iskola
Témavezető:
Dr. Vonderviszt Ferenc egyetemi tanár
Veszprém
2008.
BIOKATALITIKUS BAEYER-VILLIGER OXIDÁCIÓK
Értekezés doktori (PhD) fokozat elnyerése érdekében
Írta:
Muskotál Adél
Készült a Pannon Egyetem Környezettudományok Doktori Iskolája keretében
Témavezető: Dr. Vonderviszt Ferenc Elfogadásra javaslom (igen / nem)
……….
(aláírás) A jelölt a doktori szigorlaton …... % -ot ért el,
Az értekezést bírálóként elfogadásra javaslom:
Bíráló neve: Skodáné dr. Földes Rita igen /nem
……….
(aláírás) Bíráló neve: dr. Gál Péter igen /nem
……….
(aláírás) A jelölt az értekezés nyilvános vitáján …...% - ot ért el.
Veszprém,
……….
a Bíráló Bizottság elnöke A doktori (PhD) oklevél minősítése…...
………
Az EDT elnöke
T
ARTALOMJEGYZÉKK
ÖSZÖETYILVÁÍTÁS5
Kivonat 6
Abstract 7
Auszug 8
1. Bevezetés, célkitűzés 9
2. Irodalmi áttekintés 11
2.1. A Baeyer-Villiger monooxigenázok működése 11
2.1.1. Az enzim szerkezete és a katalízis 13
2.2. A ciklohexanon-monooxigenáz biokatalitikus alkalmazása 16 2.2.1. Hattagú, heteroatomot nem tartalmazó ketonok biotranszformációja 17 2.2.2. Hattagú, heteroatomot tartalmazó ketonok biotranszformációja 20 2.3. A szubsztrátumok előállításához szükséges reakciók irodalmi háttere 23 2.4. Izolált enzimek vagy élő sejtes rendszerek használata 26
2.5. Filamentáris enzimrendszerek 27
2.5.1. A flagellin és a flagelláris filamentum jellemzése 27
2.5.2. Flagelláris display-technológiák 29
2.5.3. A flagellin-enzim fúziós fehérjék létrehozása 29
3. Kísérleti rész 31
3.1. Felhasznált anyagok és módszerek 31
3.1.1. Cirkuláris dikroizmus 33
3.1.2. E.coli TOP10 kompetens sejt készítési eljárás 33 3.1.3. Salmonella SJW2536 elektrokompetens sejt készítési eljárás 34
3.2. Általános sémák 35
3.3. [[[[4+3]]]] cikloaddíció 37
3.3.1. Cu/Zn katalizátor és pirrol-1-karbonsav-metilészter (1c) előállítása 37 3.3.2. Általános módszer ultrahangos fürdőben kivitelezett reakciókhoz 37 3.3.2.a. 2,4-dibróm-biciklo [[[[3,2,1]]]] okt-6-én-3-on (2a) előállítása 38 3.3.2.b. 2,4-dibróm-8-oxabiciklo [[[[3,2,1]]]] okt-6-én-3-on (2b) előállítása 38 3.3.2.c. 2,4-dibróm-8-metoxikarbonil-8-azabiciklo [[[[3,2,1]]]] okt-6-én-3-on (2c)
előállítása 39
3.4. Debrómozás 39
3.4.1. Általános módszer debrómozáshoz 39
3.4.1.a. Biciklo [[[[3,2,1]]]] okt-6-én-3-on (3a) előállítása 40 3.4.1.b. 8-oxabiciklo [[[[3,2,1]]]] okt-6-én-3-on (3b) előállítása 40 3.4.1.c. 8-metoxikarbonil-8-azabiciklo [[[[3,2,1]]]] okt-6-én-3-on (3c) előállítása 40
3.5. Gyűrűnyitási metatézisek 41
3.6. Katalitikus hidrogénezés 41
3.7. Általános módszer kémiai Baeyer-Villiger oxidációkhoz 42
3.8. Biológiai Baeyer-Villiger oxidációk 42
3.8.1. Biotranszformációk 42
3.8.2. Általános módszer a biotranszformációkhoz 43
3.8.2.a. 1,4-dioxepan-5-on előállítása 43
3.8.2.b. Cisz-2,7-dimetil-1,4-dioxepan-5-on előállítása 43
3.8.2.c. Cisz-2,7-dietil-1,4-dioxepan-5-on előállítása 44 3.8.2.d. Cisz-2,7-divinil-1,4-dioxepan-5-on előállítása 44
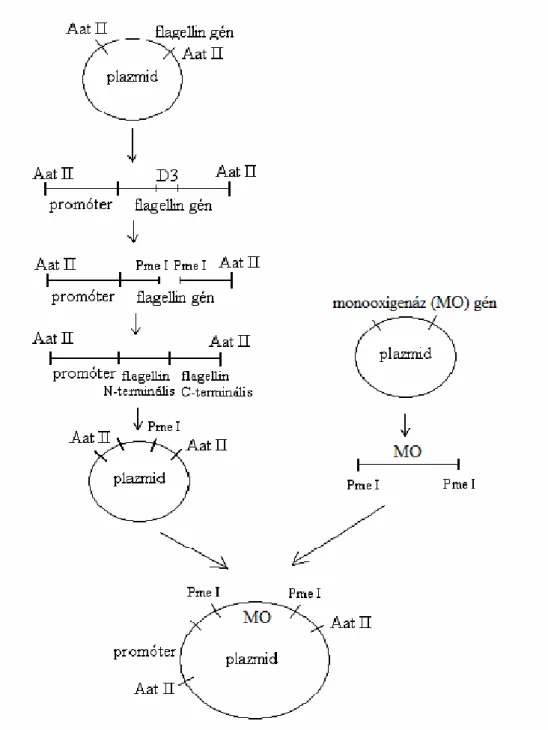
3.9. Flagellin-enzim fúziós fehérjék létrehozása 45
3.9.1. DS konstrukciók tervezése 45
3.9.2. DS konstrukciók előállítása 47
3.9.2.1. D3-deléciós plazmid 47
3.9.2.2. Fúziós DS konstrukciók 49
3.9.3. D3-deléciós flagellin fehérje 51
3.9.3.1. Fehérjetermeltetés 51
3.9.3.2. A D3-deléciós flagellin emésztési vizsgálata tripszinnel 52 3.9.3.3. Denaturációs hőmérséklet meghatározása CD-vel 52
4. Eredmények és következtetések 53
4.1. Szerves reakciók, szubsztrátumok előállítása 53
4.2. Biotranszformációk 57
4.3. Flagellin-enzim fúziós konstrukciók létrehozása 61
4.3.1. D3-deléciós flagellin előállítása 61
4.3.2. Flagellin-enzim DS konstrukciók létrehozása 68
Összefoglalás 71
Új tudományos eredmények 73
Major results 75
Mellékletek 77
1. Melléklet: Rövidítések jegyzéke 77
2. Melléklet: A reakciók adatai 78
3. Melléklet: Az előállított vegyületek MR-adatai 79
Irodalomjegyzék 84
K
ÖSZÖETYILVÁÍTÁSMindenekelőtt hálás köszönetemet szeretném kifejezni témavezetőmnek, Dr.
Vonderviszt Ferencnek, aki megismertette velem a molekuláris biológia tudományát, támogatott és tanácsaival segítette munkámat.
Kutatómunkámban jelentős segítséget jelentett Dr. Marko D. Mihovilovic támogatása, aki a Bécsben eltöltött idő alatt irányította a munkámat. Külön köszönöm neki, hogy az Európai Unió Marie Curie ösztöndíján keresztül lehetőséget biztosított számomra a szakmai fejlődésre.
Kutatásaim elvégzéséhez Dr. Mészáros Ernő, a Környezettudományok Doktori Iskola vezetője is hozzájárult. Fontos volt számomra, hogy folyamatosan kereste a lehetőséget kutatási témám befejezéséhez.
A munkám alapját képező génsebészeti alaptechnikák elsajátításában Dr. Gál Pétert tekintem mesteremnek. Az Ő tanításait alkalmazom a munkám során. Tanácsai mindig hasznomra váltak. Külön köszönöm a bírálat során tett értékes megjegyzéseit.
Köszönöm Skodáné Dr. Földes Rita bírálatát, lelkiismeretes és segítőkész munkájával nagymértékben hozzájárult disszertációm végleges formájához.
Köszönöm Sebestyén Anettnek, hogy a hosszú évek alatt mindig készségesen segített és támogatott.
Köszönet illeti Gugolya Zoltánt, aki a Fizika Tanszéken munkatársamként segítségemre volt.
A Deák Ferenc Ösztöndíj megpályázásához és a disszertáció megírásához nyújtott önzetlen segítségéért és támogatásáért rendkívül hálás vagyok Dr. Seregélyes Csabának.
Munkámat nagyban segítette Dr. Tóth Judit a disszertációm szerves kémiával kapcsolatos részéhez nyújtott konzultációjával.
Több éves kutatómunkám befejezéséhez az Oktatási és Kulturális Minisztérium Deák Ferenc Ösztöndíja biztosította a hátteret.
Köszönöm Dr. Friedler Ferencnek a Műszaki Informatikai Kar dékánjának, hogy támogatást nyújtott a disszertációm befejezéséhez.
Hálával tartozom Radka Snajdrova, Florian Rudroff, Joanna Rydz, Krzysztof Kolodziejczyk és Radoslav Flasik szakmai és baráti segítségéért, valamint Parrag Tamásnak és Prettl Zsoltnak, hogy a disszertáció írása alatt megkönnyítették munkámat a laborban és Zsoltnak külön köszönöm az eredmények kiértékeléséhez nyújtott segítségét.
Köszönöm a kitartó támogatást és bíztatást Családomnak, Barátaimnak és Férjemnek.
Kivonat
Munkám célja volt, hogy egy egyszerű módszert dolgozzak ki karbo- és hetero- biciklusos oktanonok előállítására és ezen molekulák gyűrűnyitási metatézisére gázhalmazállapotú olefin reakciópartnerek közreműködésével. Az így előállított ketonok enantioszelektív Baeyer-Villiger oxidációját rekombináns E. coli sejtekkel kiviteleztem. A munka másik részében génsebészeti eljárások segítségével eltávolítottam a bakteriális filamentum monomer fehérjéjének (flagellin) D3 doménjét abból a célból, hogy helyére különböző monooxigenáz enzimeket beépítve enzimaktivitással és polimerizációs képességgel rendelkező nanoszerkezeteket lehessen megalkotni.
Eredményeim azt mutatják, hogy a β-cisz diszubsztituált heteroatomot is tartalmazó biciklusos molekulák előállításának ultrahangos módszere egyszerű és megfelelő hozamú eljárás az eddig nehezen preparálható ketonok előállítására. Ezekből a termékekből difunkcionált hattagú cikloketonokat sikerrel preparáltam gyűrűnyitási metatézissel.
Kísérleteim során megállapítottam, hogy az előállított perhidro-piron molekulák alkalmasak sejtes biotranszformációkra, a várt termékek keletkeztek kiváló optikai tisztasággal. Igazoltam a korábbi hipotézist, miszerint a Baeyer-Villiger oxidációt katalizáló monooxigenáz enzimeket a katalizált reakcióik alapján két csoportba lehet osztani. A flagellin-enzim fúziós konstrukciók létrehozása érdekében megalkotott D3- deléciós flagellin vizsgálataiból kiderült, hogy a mutáns fehérje ugyanolyan mennyiségben termelődött, mint a vad, és a mutáns filamentum stabilitása nagyon hasonló a természeteséhez. A D3-deléciós flagellinekből felépített filamentumok jó alapot nyújtanak a továbbfejlesztésre váró flagellin-enzim fúziós konstrukciók létrehozásához. Munkám során elkészítettem a flagellin-monooxigenáz DNS konstrukciókat.
Biocatalytic Baeyer-Villiger oxidations Abstract
The aim of my study was to develop a simple method for preparing carbo- and heterobicyclic octanones and for ring opening metathesis of these molecules by means of gaseous olefinic reaction partners. The enantioselective Baeyer-Villiger oxidation of the formulated ketones was achieved by recombinant E. coli cells. In the other part of the investigation, the D3 domain of monomeric protein of bacterial filament was removed by genetic engineering in order to create nanostructures with enzyme activity and polimerization capacity after inserting in various monooxygenase enzymes.
The ultrasonic protocol for synthetizing β-cis bicyclic molecules containing heteroatom, allows access to elusive and poorly described ketones without elaborate work- up in yield comparable to previous methods. Difunctionalized sixmembered cycloketones were successfully prepared from these products by ring opening metathesis. I stated that the formulated perhydropyran-type ketones were suitable for whole-cell biotransformations, and the expected products were synthetized with excellent optical purities. The former hypothesis was confirmed that monooxygenases those catalyzing Baeyer-Villiger oxidation could be divided into two groups on the basis of catalyzed reactions. The investigations of D3 deleted flagellin, that was prepared to the flagellin- enzyme fusion constructs, suggested that the mutant protein was produced in the same amount as the wild one, and the stability of the mutant filament was very similar to the natural one. The filaments built from the D3 deleted flagellins are suitable bases for producing the flagellin-enzyme fusion constructions, but they need further experiments.
The flagellin-monooxygenase DNA constructs were prepared in this work as well.
Biokatalisierte Baeyer-Villiger Oxidationen Auszug
Das Ziel meiner Arbeit war, eine einfache Methode zur Herstellung von karbo- und heterobicyclischen Oktanen und zur ringöffnenden Metathese dieser Moleküle auszuarbeiten, mit Hilfe von Olefinreaktionspartnern mit gasförmigem Aggregatzustand.
Die enantionselektive Baeyer-Villiger Oxidation der so hergestellten Ketonen wurde mit rekombinanten E. Coli-Zellen durchgeführt. Im anderen Teil der Arbeit entfernte ich den D3-Domain des monomeren Eiweißes des bakteriellen Filamentums mit Hilfe genchirurgischer Verfahren, um an seine Stelle verschiedene monooxygenase Enzyme einbauend Nanostrukturen mit Enzymaktivität und Polimerisationsfähigkeit gestalten zu können.
Meine Ergebnisse zeigen, daß die Ultraschallmethode bei der Herstellung der auch β-zis disubstituiertes Heteroatom enthaltenden bicyclischen Moleküle ein einfaches Verfahren mit entsprechendem Ertrag zur Herstellung der bisher schwer präparierbaren Ketonen ist. Aus diesen Produkten präparierte ich erfolgreich difunktionierte sechsgliedrige cyclische Ketonen mit ringöffnender Metathese. Im Laufe meiner Versuche stellte ich fest, daß die hergestellten Perhydropyron- Moleküle zu Zellenbiotransformationen fähig sind, es entstanden die erwarteten Produkte mit ausgezeichneter optischer Reinheit. Ich bestätigte die frühere Hypothese, nach der die die Baeyer-Villiger- Oxidation katalisierenden monooxigenasen Enzyme aufgrund ihrer katalisierten Reaktionen in zwei Gruppen geteilt werden können. Aus der Untersuchung des im Interesse der Gestaltung der Flagellin-Enzym-Fusionskontruktionen hergestellten D3-Deletionsflagellins ging hervor, daß das mutante Eiweiß in derselben Menge produziert wurde, wie das wilde, und daß die Stabilität des mutanten Filamentums der des natürlichen ähnlich ist. Die aus den D3-Deletionsflagellinen aufgebauten Filamenten bilden eine gute Basis für die Produktion der Flagellin-Enzym-Fusionskonstruktionen, die aber noch weiterentwickelt werden sollen. Im Laufe meiner Arbeit stellte ich die Flagellin- Monooxygenases-DNA- Konstruktionen her.
1. Bevezetés, célkitűzés
A biokémiai rendszerekben rejlő lehetőségeket a kémiában már régen felismerték és alkalmazzák: mikrobiológiai, fermentációs módszerekkel biológiailag aktív vegyületeket állítanak elő vagy módosítanak. A hagyományos kémiai módszerek mellett napjainkban a környezetvédelem fontossága miatt fokozatosan előtérbe kerülnek a biokatalitikus eljárások mind laboratóriumi, mind ipari méretekben. A biokatalízis, biotranszformáció céljaira felhasználható rendszerek: enzimek, mikroorganizmusok számos előnyös tulajdonsággal rendelkeznek. Számtalan kémiai reakciónak megtalálható az enzimatikus megfelelője, így széles körben alkalmazhatóak a biokatalizátorok, melyeknek szelektivitása és hatékonysága vonzó lehet a szintetikus kémiában. Nem elhanyagolható az a tény sem, hogy az enzimek viszonylag enyhe körülmények között működnek, ez fontos lehet a szubsztrátum és a termék stabilitása szempontjából is.
Mindemellett az enzimek királis katalizátorok, sok esetben elkerülhető velük a mérgező, vagy a környezetet súlyosan károsító melléktermékek képződése is. Napjainkban mikroorganizmusok egyszerű reagensként történő felhasználása is terjedőben van, elsősorban olyan enzimatikus folyamatok esetében, amikor az enzim izolált formában nem hozzáférhető, érzékeny, és a kívánt átalakítás multienzimatikus (Poppe et al., 1991).
Királis laktonok, mint az enantioszelektív szintézisek értékes prekurzorainak környezetbarát előállítására hatékony módszert kínál a Baeyer-Villiger oxidáció, amellyel lehetőség nyílik szén-szén kötések felszakítására egy oxigénatom beékelődésével.
Baktériumokból származó monooxigenáz enzimek képesek katalizálni a Baeyer-Villiger oxidációt. A monooxigenáz enzimcsaládba tartozó fehérjékkel végzett biotranszformációk széles szubsztrátum-specificitást és jó enantioszelektivitást mutatnak. Számos természetben előforduló biológiailag aktív vegyület rendelkezik oxigén- és nitrogéntartalmú heterociklusos szerkezetekkel. A karbo- és heterobiciklusos ketonok Baeyer-Villiger oxidációja ígéretes, megfelelő optikai tisztaságú enantiomert tartalmazó intermediereket szolgáltatna a gyógyszerek szintéziséhez, de közvetlen biotranszformációja nem játszódik le a szintetikus kémiában felhasználható konverzióval (Taschner et al., 1992). Megoldást jelentene a gyűrűnyitás-biooxidáció-gyűrűzárás reakciók egymás utáni kivitelezése, hiszen így a szubsztrátum-hasznosítás szélesítésén túl jobb konverzió és enantioszelektivitás is elérhető lenne.
Napjainkban egyre nagyobb az igény a sztereoizomerek - legfőképpen a királis anyagok adott enantiomerjének - tiszta formában történő szintézisére és az összetett, biológiailag aktív anyagok gazdaságos előállítására. A gyógyszer-piacon új termékként ma már csak tiszta enantiomer gyógyszer hatóanyag engedélyeztethető, és hasonló a helyzet a növényvédőszerek piacán is, hiszen ebben az esetben fontos környezetvédelmi szempont, hogy a nem hatásos enantiomert szennyezőanyagként ne juttassák ki a természetbe. A biológiai rendszerek molekuláris szintű megismerése, a génsebészet fejlődése kedvezően hatott a biotranszformáció felhasználási területeinek szélesedésére, hiszen a biokatalitikus
folyamatok fejlesztése mindinkább célzottá és tervezhetővé válik.
Génsebészeti technikákat felhasználva monooxigenáz enzimek fúziós konstrukcióit kívánom létrehozni a polimerizációs képességgel rendelkező flagellin fehérjének, mint a baktériumok flagelláris filamentumait felépítő legfőbb alegységének a segítségével. A flagellin központi része, amely a filamentumok külső részét adja, nagyon variábilis, génsebészeti eszközökkel módosítható, az alegységek citoplazmából való kijutásának és a polimerizációs képességének károsodása nélkül. Célom a flagellin variábilis D3 doménjének lecserélése monooxigenáz enzimekre, és ezeknek a fúziós fehérjéknek (flagzim) a felhasználásával változatos filamentáris nanoszerkezetek létrehozása. Az in vivo flagelláris filamentumok felépülésének eredményeképpen a baktériumok felületén az adott enzim nagy sűrűségben fordulna elő. Ezek a génmódosított baktériumok hordozzák azt a lehetőséget, hogy újszerű mikrobiális biokatalizátorokként működjenek és közvetlenül alkalmazhatóak legyenek biokonverzióknál. Másrészt a tisztított flagzimek használhatóak lennének filamentáris nanoszerkezetek felépítésére, melyek felületén működőképes enzimek több ezer példánya lenne található.
Munkám elsődleges célja, hogy gyűrűnyitási metatézist dolgozzak ki különböző heteroatomot is tartalmazó β- cisz biciklusos rendszerekre, majd vizsgáljam az ily módon előállított ketonok Baeyer-Villiger oxidációját rekombináns Escherichia coli sejtekkel.
További feladatom a biotranszformációk során keletkező szimmetrikusan szubsztituált heterociklusos laktonok tisztítása, és a tiszta termékek enantiomer-tisztaságának jellemzése. A biotechnológiai folyamatok leegyszerűsítésének érdekében olyan flagellin- enzim fúziós fehérje konstrukciók tervezése és előállítása a célom, amelyek enzimaktivitással és polimerizációs képességgel is rendelkeznek. Génsebészeti eljárások segítségével a flagellin variábilis D3 doménjét eltávolítva annak helyére különböző monooxigenázokat kívánok beépíteni.
2. Irodalmi áttekintés
2.1. A Baeyer-Villiger monooxigenázok működése
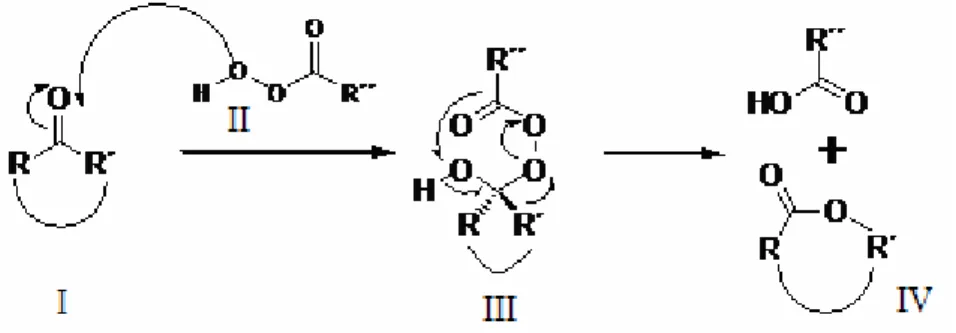
A Baeyer-Villiger (BV) oxidációt 1899-ben Adolf Baeyer és Victor Villiger fedezte fel (Baeyer et al., 1899). A mechanizmust először Criegee (1948) írta le egy kétlépéses folyamattal (1. ábra), melynek első lépése a karbonilcsoport nukleofil támadása peroxiddal (I,II). Ez egy tetraéderes intermediert eredményez (III), amely átrendeződésen megy keresztül a megfelelő észter kialakulásáig (IV).
1. ábra: A Baeyer-Villiger oxidáció mechanizmusa (Criegee, 1948).
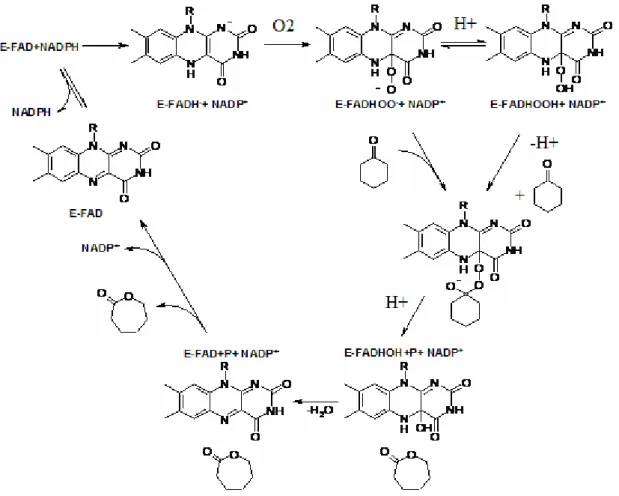
A Baeyer-Villiger reakció széles körben alkalmazott oxidálószerei: az m-klór- perbenzoesav, a trifluor-peroxisav és a hidrogén-peroxid. Ezen persavak biokatalitikus megfelelői az oxigenáz enzimcsaládba tartozó monooxigenázok. A monooxigenázok különböző oxidációs reakciókat katalizálhatnak, mint pl. alifás és aromás alkoholok hidroxilezését, alkének epoxidációját, és Baeyer-Villiger transzformációkat. Az oxidáció típusa általában az enzim prosztetikus csoportjától függ: a citokróm P450 típusú fém-függő monooxigenázok hidroxilezést és epoxidációt, a flavin-függő enzimek a Baeyer-Villiger oxidációt katalizálják. A Baeyer-Villiger monooxigenázok (BVMO) általánosan elfogadott működése az Acinetobacter calcoaceticus baktérium ciklohexanon monooxigenáz (CHMO) enzimével kapcsolatos vizsgálatokon alapul. Ez az enzim egy flavin-adenin- dinukleotid (FAD) molekulával, mint prosztetikus csoporttal rendelkezik, emellett nikotinamid-adenin-dinukleotid-foszfát (NADPH)- és oxigén-függő. Walsh (1980) javasolt egy reakcióutat az oxidáció folyamatára (2. ábra).
2. ábra: A Baeyer-Villiger biokatalízis mechanizmusa (E: enzim) (Mihovilovic et al., 2002).
A biokatalízis folyamata a szorosan kötött FAD redukciójával kezdődik a NADPH segítségével. A következő lépés egy gyors oxidáció a molekuláris oxigénnel, melynek terméke a flavin–4a-peroxid anion. Ez az intermedier szolgál oxidáló molekulaként az ezt követő Baeyer-Villiger oxidációban. A flavin-4a-peroxid anion, amely elsőként keletkezett, szubsztrátum hiányában flavin-4a-hidroperoxid stabil molekulává alakul.
Szubsztrátum jelenlétében a peroxid nukleofilként viselkedik, a szubsztrátum karbonil- csoportját támadja, kialakítva a „klasszikus” tetraéderes Criegee intermediert. Az intermedier átrendeződése után keletkezik a lakton és a 4a-hidroxiflavin. A katalitikus kör a víz eliminációjával, FAD keletkezésével, a termék leadásával zárul.
A CHMO-k működési mechanizmusa modellként szolgál a többi BVMO enzim működésének értelmezéséhez, néhány különbséggel, amelyek lényeges mechanizmusbeli változást nem okoznak. Ilyen különbségek pl. hogy a FAD prosztetikus csoportot helyettesítheti flavin mononukleotid (FMN), és kofaktorként működhet a NADH is a NADPH mellett.
2.1.1. Az enzim szerkezete és a katalízis
Napjainkig számos Baeyer-Villiger monooxigenáz enzimet termeltettek és tisztítottak, de eddig csak egy enzimből, a fenilaceton-monooxigenázból (PAMO) sikerült olyan kristályokat előállítani, amelyek megfelelőek voltak röntgen-krisztallográfiás mérésekhez. Ez a 62 kDa-os, monomer fehérje a Thermobifida fusca termofil baktériumban a fenilacetont alakítja át fenilacetáttá. A PAMO aminosavsorrendje nagy homológiát mutat számos ismert és tanulmányozott Baeyer-Villiger monooxigenázzal, ezért is jelent előrelépést a PAMO háromdimenziós szerkezetének ismerete (Malito et al., 2004). A PAMO és a CHMO szekvencia-azonossága 40,3 %, ami lehetővé tette, hogy Bocola és munkatársai (2005) megalkossák a CHMO homológia modelljét, a PAMO háromdimenziós szerkezetét alapul véve (3. ábra).
3. ábra: A PAMO szerkezetének és a CHMO homológia-modelljének összehasonlítása (Bocola et al., 2005).
Mindkét fehérje a FAD-kötő és a NADP-kötő doménből áll, és mindegyik domén az általános dinukleotidkötő szerkezettel rendelkezik. A PAMO enzimen pontmutációkat végezve derítették fel a katalízishez nélkülözhetetlen aminosavakat. A kísérletek során derült fény a 337-es arginin központi szerepére is. A kristályos szerkezetben ez az arginin nem egy fix, meghatározott konformációban van, hanem két különböző állapotot képes felvenni. „Bekapcsolt” állapotban stabilizálja a flavin-peroxid intermediert a katalízis során, „kikapcsolt” állapotban helyet ad a nikotinamid gyűrűnek a kofaktor redukálásához.
A katalízis során létrejövő konformáció-változások, a doménrotáció, a NADP nikotinamid gyűrűjének be/ki mozgásával és a vele egyidejűleg ellentétes, ki/be mozgást végző 337-es arginin oldallánc (ami szintén a NADP-kötő doménhez tartozik) mozgásával jön létre.
A legszembetűnőbb különbség a PAMO és a CHMO modellek között az aktív centrum közelében található argininnel (PAMO-nál a 337. arginin, a CHMO-nál a 327.) kölcsönható hurokrégióban van (3. ábra), a PAMO esetében ez a hurokrégió tartalmaz egy, az arginin felé kinyúló részt (Ser-441- Ala-442- Leu-443), amely a CHMO esetében hiányzik. Bocola és munkatársai igazolták, hogy ez a kitüremkedő régió akadályozza meg a PAMO esetében (a CHMO-val ellentétben), a ciklusos szubsztrátumokat átalakítását, mivel ez a rész sztérikusan körülfogja a 337. arginint, és így nem jut elég hely a ciklusos vegyületekből keletkező intermedierek stabilizálására az enzimreakció során.
A CHMO korábbi mutagenezis-vizsgálataiban már bebizonyosodott, hogy a 432.
pozícióban lévő fenilalanin nagyon fontos az enzimműködés szempontjából. Ezen a helyen történt mutációt követően drámaian megváltozott a BV reakciók enantioszelektivitásának iránya és mértéke. A homológia modellből megállapítható, hogy a 432. fenilalanin a CHMO-ban megfelel a PAMO 443. leucinjának, ahol a hurokrégióban az arginin felé kidomborodó rész kezdődik. Ezt az ismeretet alapul véve sikerrel állítottak elő olyan mutáns PAMO enzimet, amely képes volt gyűrűs szubsztrátumot átalakítani, ezt úgy érték el, hogy az argininnel kölcsönható hurokrégióban lévő kinyúló részben egyedül a 443.
leucint hagyták meg, a másik kettő aminosavat kivágták. Mutagenezis-vizsgálatokkal azt is megmutatták a PAMO esetében, hogy a 173. helyen lévő hisztidin aminosav elengedhetetlenül szükséges a katalízishez és a FAD-kötéshez. Ez a hisztidin a CHMO enzimben is szinte pontosan ugyanezen a helyen található. Megállapították, hogy a 173-as hisztidinnek a katalízis során a doménforgásokban, a konformáció-változásokban van főszerepe és nem a szubsztrátum megkötésében.
Négy pontban foglalták össze a PAMO katalízisének molekuláris modelljét, ami a krisztallográfiai analízisen és a katalitikus reakció kinetikai adatain alapul, ezt a modellt egyúttal használhatjuk a CHMO esetében is annyi különbséggel, hogy a PAMO 337.
argininje a CHMO 327. argininjével állítható párhuzamba (4. ábra) (Malito et al., 2004):
1. A reakció a NADPH megkötésével kezdődik, amely így megfelelő helyzetbe kerül, hogy redukálja a flavint. Ekkor még a 337-es arginin „kikapcsolt” helyzetben van.
2. A redukált enzim reagál az oxigénnel és létrejön a flavin-peroxid intermedier.
Ekkor a domén-forgás összekapcsoltan működik a 337-es arginin és a szomszédos oldalláncok konformáció-változásával, annak érdekében, hogy az arginin megfelelő közelségbe („bekapcsolt helyzet”) tudjon kerülni a peroxid intermedierhez, hogy stabilizálja azt.
3. A flavin oxidálja a bekötődött szubsztrátumot, a 337-es arginin részt vesz a Criegee intermedier stabilizálásában is, úgy, hogy a flavin peroxocsoportja kölcsönhatásba lép a szubsztrátummal.
4. Az enzim hármas komplexe (enzim/NADP+/termék) disszociál, és a terméket leadja.
Ezzel a modellel az enzim működése molekuláris szinten is ismertté, érthetőbbé vált.
4. ábra: Sematikus ábra a katalízis során végbemenő konformáció-változásokról (E:
enzim) (Malito et al., 2004).
2.2. A ciklohexanon-monooxigenáz biokatalitikus alkalmazása
Az élőlényekben lejátszódó Baeyer-Villiger oxidációs lépések fontosak különböző természetes vegyületek szintézisekor, mint pl. az aflatoxinok előállítása a gombáknál, különféle toxinok a kagylóknál, illetve a növények esetében számos allergiát kiváltó vegyület keletkezésekor. Ezeken kívül baktériumfajoknál is megfigyelték a Baeyer- Villiger oxidációt. Turtiff 1948-ban használt először élő sejteket a szteroidok „A”
gyűrűjének Baeyer-Villiger oxidációjára, majd 1953-ban kettő kutatócsoport is foglalkozott a progeszteron, illetve a tesztoszteron oxidálásával BVMO-kat termelő sejtek segítségével (Mihovilovic et al., 2002). Mióta 1976-ban Donoghue és munkatársai (1976) tisztították és jellemezték az Acinetobacterből származó 61 kDa-os (542 aminosavból álló) monomer CHMO-t, azóta ez az enzim a legrészletesebben tanulmányozott BVMO. A CHMO enzim az Acinetobacterben a ciklohexanol lebontásában játszik szerepet (5. ábra).
5. ábra: A ciklohexanol biológiai lebontása (Mihovilovic et al., 2002).
Eredetileg a CHMO termelődését az Acinetobacter olyan tápoldatban való növesztésével érték el, amelyben egyedüli szénforrásként kizárólag ciklohexanol volt jelen.
A CHMO génjét 1988-ban klónozták és szekvenálták, és mivel az Acinetobacter patogén, különböző expressziós rendszereket fejlesztettek ki egyszerűbb használatára, élesztő- és nempatogén baktériumfajokkal.
A természetben betöltött szerepe mellett a BVMO alkalmas, amint az az eddigi kutatásokból kiderült, száznál is több különböző szubsztrátum átalakítására: prokirális ketonok oxidálására éppúgy, mint racém prekurzorok enantioszelektív lebontására (Donoghue et al., 1975; Iwaki et al., 1999; Cheng et al., 2000). Kísérleti úton az enzim aktív centrumának modelljét a szubsztrátum-specificitás, tér- és polaritás-szükségletek tanulmányozásával próbálják felállítani. Az itt bemutatásra kerülő biotranszformációkhoz – legyenek azok izolált enzimmel, vagy rekombináns sejtekkel (élesztő, vagy/és E. coli) végzett kísérletek – csak kis mennyiségű kiindulási vegyületet használtak, a terméket nem tisztították, a konverzió és enantioszelektivitás adatokat gázkromatográfiás mérésekkel
határozták meg. A táblázatokban „–” jellel jelöltem azokat az adatokat, ahol nem játszódott le a reakció, vagy amelyeket nem tudtak meghatározni, vagy a keletkezett molekula optikailag nem aktív. A biotranszformációk során keletkezett termékek számozása a 6.
ábrán látható. A továbbiakban is az itt megadott számozások az érvényesek. A konverzió a reakció során a kiindulási anyag átalakulása %-ban, ennek meghatározása gázkromatográfiával történt. Hozam a tisztítás utáni tiszta termék mólszáma és a kiindulási anyag mólszámának a hányadosa.
6. ábra: A keletkező laktonok számozása.
2.2.1. Hattagú, heteroatomot nem tartalmazó ketonok biotranszformációja
A CHMO enzim enantioszelektivitás-eredetének tanulmányozása érdekében összehasonlították a 4-mono, és 4, 4-diszubsztituált ketonok rekombináns sejtekkel végzett biotranszformációkból kapott eredményeit (7. ábra, 1. táblázat).
7. ábra: 4-mono, és 4, 4-diszubsztituált ketonok biotranszformációja.
Megfigyelték, hogy a metil- és etilcsoportokkal diszubsztituált szubsztrátumok térbelileg nem gátolták az enzim katalitikus képességét, spirogyűrűs rendszerek esetében is lejátszódott a reakció (1. táblázat).
O O O
O O
1 2 3 5 4 6
8 7 9
2 1 3
4 5 6
8 9
7
R’ R’’ Konverzió (%) Enantiomer felesleg (%)
Me H 61 >98
Me Me 61 -
Et H 91 97
Et Me 91 75
Et Et 60 -
Ciklo-CH2CH2 74 -
Ciklo-OCH2CH2O 40 -
1. táblázat: 4-mono, és 4, 4-diszubsztituált ketonok biotranszformációinak eredményei (Mihovilovic et al., 2002).
A két különböző oldalláncot tartalmazó szubsztrátum esetében (R’=Et, R”=Me) a termék optikai tisztasága alacsonyabb lett, mint monoszubsztituált terméknél. A termodinamikailag kedvező konformáció esetében a 4-alkilcsoport ekvatoriális helyzetben van, így az ellentétes konformációk között jelentős az energiakülönbség. A szubsztituensek közelebbi azonossága miatt az energiakülönbség csökken, akár annyira, hogy a lehetséges Criegee intermedierek között elhanyagolható is lehet, aminek következményeként mindkettő szerkezet (enantiomer) kialakulhat a biotranszformáció során. Példaként megemlítem, hogy a metil- és etilcsoportokkal szubsztituált terméknél a kisebb enantiomer felesleg (ee.) az átmeneti állapotok közötti kis (1,2 kcal/mol) szabadenergia-különbséggel magyarázható.
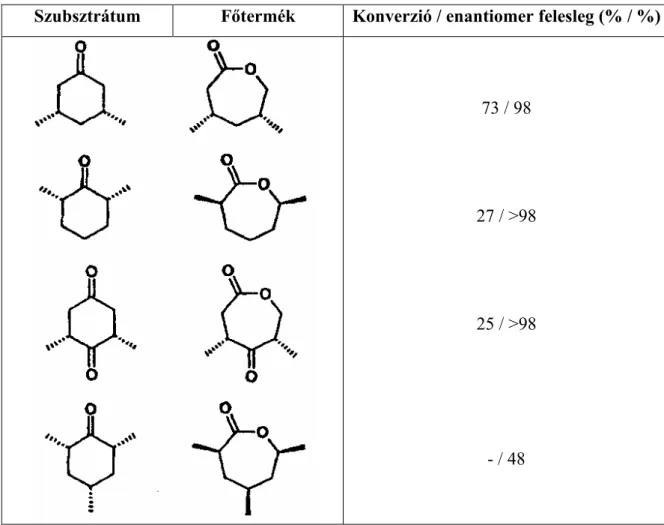
Izolált enzimekkel végzett kísérletekből kiderült (Schwarz-Linek et al., 2001), hogy diszubsztituált ciklohexanonokat szubsztrátumként használva, a termék enantioszelektivitása megfelelő volt, viszont a konverzió értéke az oldallánc helyzetétől nagymértékben függött (2. táblázat).
Szubsztrátum Főtermék Konverzió / enantiomer felesleg (% / %)
73 / 98
27 / >98
25 / >98
- / 48
2. táblázat: Ciklohexanonok biotranszformációinak eredményei az oldalláncok helyzetének függvényében (Mihovilovic et al., 2002).
A következő Baeyer-Villiger oxidációt Brevibacteriumból származó CHMO-val végezték cisz-3,5-dimetil-ciklohexanonon (8. ábra).
8. ábra: A dimetil-ciklohexanon biotranszformációja.
Jellemzően egy baktériumban csak egy CHMO enzim van, de a Brevibacteriumban kettőt találtak. Amikor párhuzamosan végezték a biotranszformációkat ezzel a két enzimmel (3. táblázat), azt tapasztalták, hogy hozam és az enantioszelektivitás értékei nagyon hasonlóak, de amíg a Brevi I enzim a negatív előjelű optikai forgatóképességgel rendelkező terméket állította elő, addig a Brevi II épp az ellenkező enantiomert. Tehát
O
O O
érdemes ennek a kettő enzimnek a működését tanulmányozni, hiszen azokkal akár elő lehetne állítani egy adott szubsztrátum kettő megfelelő tisztaságú enantiomerjét.
Enzim Hozam (%) Enantiomer
felesleg (%) [α]D20 (CHCl3) Abszolút konfiguráció
Brevibacterium I 61 97 -10,7 4R, 6S
Brevibacterium II 56 99 +9,6 4S, 6R
3. táblázat: Cisz-3,5-dimetil-ciklohexanon biotranszformációjának eredményei (Mihovilovic et al., 2003a).
2.2.2. Hattagú, karbociklusos és heteroatomot tartalmazó ketonok biotranszformációja
Walsh és munkatársai fedezték fel, hogy a CHMO képes heteroatomot tartalmazó molekulákat is oxidálni (Ryerson et al., 1982; Branchaud et al., 1985). A 4-szubsztituált- ciklohexanon prekurzorok esetében a CHMO jó szelektivitást mutatott S laktonok előállításában (9. ábra és 4. táblázat).
9. ábra: 4-szubsztituált-ciklohexanonok biotranszformációja.
Az izolált enzimmel és a rekombináns sejtekkel végzett biotranszformációk mind a hozam, mind az enantioszelektivitás tekintetében általában összevethető eredményeket adtak (Stewart et al., 1996). Három szénatomos egyenes szénlánc esetében a szubsztrátum megfelelően illeszkedett az aktív centrumba, nagyobb oldalláncok esetében viszont (pl.
butil) megfordult a reakció sztereoszelektivitása. Az enzim érzékeny a sztérikus gátlásokra, a terc-butil oldallánc esetében a térbeli nagyság maximumát meghaladta a szubsztrátum, amit a jelentősen lecsökkent hozam értéke mutat (4. táblázat). A CHMO jól tolerálja a különböző funkciós csoportokat, mint pl. a kettős kötéseket a szubsztituensben (Stewart et al., 1998), ezenkívül még metoxi- és halolaktonok előállítására is sikerrel alkalmazták (Taschner et al., 1988; Mihovilovic et al., 2001a).
O
R
O O
R
R Konfiguráció Konverzió / enantiomer felesleg (% / %) izolált
enzimmel
Konverzió / enantiomer felesleg (% / %) rekombináns
sejttel
H S - 79 / - (élesztő)
Me S 80 / >98 83 / >98 (élesztő)
61 / >98 (E.coli)
Et S 83 / >98 74 / >98 (élesztő)
91 / 97 (E.coli)
Pr S 80 / >98 63 / 92 (élesztő)
Bu R 70 / 52 -
iPr S 60 / >98 60 / >98 (élesztő)
tBu S 17 / >98 -
Allyl S - 62 / 95 (élesztő)
OMe S 76 / 75 84 / 78 (E.coli)
Br S - 63 / 97 (E.coli)
I S - 60 / 97 (E.coli)
4. táblázat: 4-szubsztituált-ciklohexanonok biotranszformációinak eredményei (Mihovilovic et al., 2002).
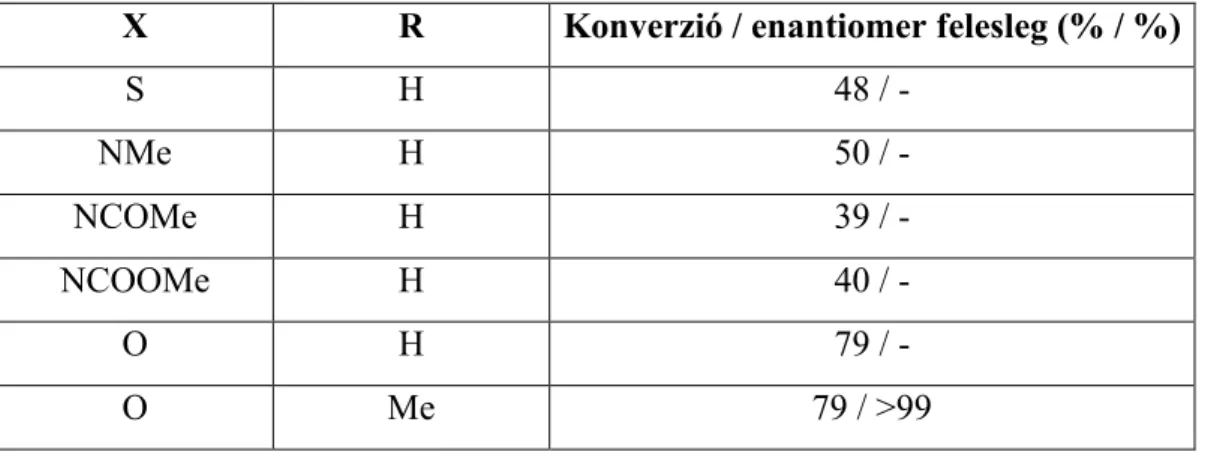
Walsh és munkatársai (Mihovilovic et al., 2001b összefoglaló cikkben) által CHMO-val végzett biotranszformációknál az első hattagú, heterociklusos szubsztrátum kenet tartalmazott. Napjainkra azonban már a heteroatomot tartalmazó szubsztrátumok száma kibővült például nitrogénatomot tartalmazó szubsztrátumokkal is (10. ábra, 5.
táblázat).
10. ábra: Heteroatomot tartalmazó hattagú gyűrűs molekulák biooxidációja.
X O
R R
O
X O
R R
X R Konverzió / enantiomer felesleg (% / %)
S H 48 / -
NMe H 50 / -
NCOMe H 39 / -
NCOOMe H 40 / -
O H 79 / -
O Me 79 / >99
5. táblázat: Heteroatomot tartalmazó szubsztrátumok biooxidációinak eredményei (Mihovilovic et al., 2002).
Szintén Acinetobacterből származó CHMO-val katalizált oxidáció során azt vizsgálták (Mihovilovic et al., 2003b) hattagú, oxigént tartalmazó rendszerekkel, hogy az enzim milyen oldallánc esetén képes még a katalízisre (6. táblázat).
Szubsztrátum Hozam (%)
80
90
19
Termék csak nyomokban található
Termék nem keletkezik
6. táblázat: Pironok Baeyer-Villiger oxidációjának eredményei (Mihovilovic et al., 2003b).
A metil- és etil- oldalláncok esetén az oxidáció jó konverzióval játszódott le, míg n- propilcsoport esetében alacsony volt az átalakítás. Izopropil- és butil- oldalláncokkal nem ment végbe számottevően a reakció, az oldalláncok már túl nagynak bizonyultak ahhoz, hogy az enzim aktív centrumában lejátszódjon a katalízis.
Korábban Mihovilovic és munkatársai (2005) és Iwaki és munkatársai (2002) is vizsgálták különböző laktonok antipódjainak előállítását a BVMO enzimcsalád néhány képviselőjével. Ezekkel a kísérletekkel a CHMO és CPMO (ciklopentanon monooxigenáz) enzimek sztereospecificitását kutatták. A felhasznált BVMO-k a következő baktériumfajokból származtak: Acinetobacter, Arthrobacter, Brachymonas, Brevibacterium (I és II), Comamonas (CPMO), Rhodococcus (I és II). A kísérletek eredményeiből felállították azt a hipotézist, mely szerint a felhasznált BVMO-kat két csoportba lehet sorolni. A BVMO-k fő csoportjába tartozó enzimek (a CHMO típusúak) a vizsgált szubsztrátumokból az ellentétes optikai forgatóképeséggel rendelkező laktonokat állították elő, mint a CPMOComa és a CHMOBreviII. Ez az általános tendencia egyedül a CHMOBreviI
enzimnél nem volt megfigyelhető, a sztereospecificitást illetően a CHMO típusúak közé tartozott, viszont nem alakított át olyan ketonokat, amit a csoport tagjai igen.
2.3. A szubsztrátumok előállításához szükséges reakciók irodalmi háttere
A biciklusos rendszerek előállítása szempontjából a [4+3] cikloaddíció az érdeklődés középpontjában áll. Ezzel a reakcióval előállítható biciklo [3,2,1] ketonok értékes molekulák, hiszen ezek a vegyületek fontos építőkövek a szerves kémiában, és a farmakológiailag aktív molekulák széles skálájának prekurzorai (Hoffmann, 1984). Ebben a ciklizációban a perbróm-keton oxiallil vegyületet hoz létre. Az α-α’-dehidrohalogénezés az ikerionos oxiallil kation keletkezését idézi elő, amely elektrofilként viselkedik a cikloaddícióban. Az oxiallil kation elektrofil reakcióképességének felfedezése, és a keletkező heteroszubsztituált kationoknak három szénatomos komponensekként való felhasználása a cikloaddíciós reakciókban fontos újítást jelentenek (Fort, 1962).
Nem szubsztituált enonok előállítása rendkívüli módon nehéz. Korábban publikált eredményekből kiderül, hogy oxigén-tartalmú biciklusos rendszerek – mint különböző természetes vegyületek prekurzorai – előállításához eddig toxikus (Noyori, 1979), pirofór (Carrel et al., 2000), drága (Sato et al., 1978) reagenseket, katalizátorokat használtak.
Hoffmann (1984) furánt, 2-metoxi-allil-bromidot és katalizátorként ezüst-trifluór- acetátot használt a biciklusos molekula előállítására (11. ábra). A ciklizációs reakciókban közvetlenül keletkező dibróm (vagy tribróm) intermedierek kevésbé stabilak, így nagy
gondot fordítottak ezek azonnali redukálására.
O O O
Br OMe
+
AgOCOCF3
11. ábra: Cikloaddíció ezüst-tartalmú katalizátorral (Hoffmann, 1984).
Ezt a módszert továbbfejlesztve Hoffmann és munkatársa (2000) már a következő reakcióval állította elő furánból a terméket, tetrabróm-aceton, trietil-borát és aktivált cink alkalmazásával (12. ábra).
O O
Br Br O
Br Br
Br Br
O
O O
Br Br Br
+
Zn, B(OEt)3+
12. ábra: Cikloaddíció aktivált cinkkel (Hoffmann et al., 2000).
Ezzel a 2,5 órás termikus eljárással a dibróm- és a tribróm-biciklusos molekula is keletkezett. A metanolban oldott intermediereket Cu/Zn katalizátor és ammónium-klorid segítségével redukálták -78 °C-on.
Montana és munkatársa (2001) [4+3] cikloaddíciós reakciókon végeztek összehasonlító vizsgálatot termikus és szonokémiai feltételek mellett (13. ábra). Ultrahang használatával nagyon enyhe körülmények szükségesek a heterogén reakciókban (Bremner, 1994).
O O
X X z
X X
O
+
X=Br, I Z=CH2, O, NCOOMe
Cu/Zn
13. ábra: Cikloaddíció réz-cink katalizátorral (Montana, 2001).
Megállapították, hogy az ultrahang használatával jelentősen lerövidültek a reakcióidők: dibróm-aceton reakciópartnerrel 90 percre, dijód-acetonnal pedig 7 percre.
Ezekből a kísérletekből az is kiderült, hogy a brómozott reakciópartnerrel lényegesen jobb hozam érhető el. A halogénezett intermedierek redukálása Fe2(CO)9 (80°C, 18 óra) vagy Cu/NaI (60°C, 4 óra) katalizátorokkal történt. Az előző cikkek alapján alkottam meg a nem szubsztituált enonok szintézisét ultrahangos módszerrel.
2005-ben a kémiai Nobel-díjat Yves Chauvin, Robert H. Grubbs és Richard R.
Schrock tudósok kapták „a szerves szintézisekben alkalmazott olefin metatézis módszerének kifejlesztéséért”. Eredményeik lehetővé tették, hogy az olefin metatézis fontos és meghatározó módszerré váljon, és bekerüljön a szerves kémikusok eszköztárába.
A díjazottak a metatézis mechanizmusának tisztázása mellett hatékony katalizátorokat is kifejlesztettek (többek között az általam is használt Grubbs, Ru-tartalmú katalizátorokat) ezeknek a reakcióknak a kivitelezéséhez. A katalitikus metatézissel a szintézisek lerövidülnek és kevesebb felesleges melléktermék keletkezik. Az olefin metatézis az egyetlen szénlánc rekonfigurációs reakció, amelyben a C-C kötések fémtartalmú karbén- komplexek jelenlétében átrendeződnek (Grubbs et al., 1998; Fürstner, 2000; Grubbs, 2003).
Az elmúlt években a polimer kémiában kifejlesztettek egy sokoldalú, hatékony módszert: a gyűrűzárási metatézist, amely makrociklusok előállításához, számos természetes vegyület, és bioaktív termék szintézisére használható (Felpin et al., 2003;
Ramachandran et al., 2003; Prunet, 2003; Fuerstner, 2003). Azonban a gyűrűnyitási metatézist (ROM), amely hasznos módszer lenne terminális diolefinek előállításához, és funkcionális gyűrűk szintéziséhez, mint komplementer reakciót eddig még nem dolgozták ki megfelelő alapossággal (Weeresakare et al., 2004; Connon et al., 2003; Hofle et al., 2003). Eddig gyűrűnyitási metatézist, csak „nagyon” feszített biciklusokkal, mint pl.
norbornénekkel és ciklobutadiénekkel végeztek (Randall et al., 1995; Randall et al., 1997;
Tallarico et al., 1997; Schneider et al., 1996).
Wright és munkatársai (2001) biciklo[3,2,1]okt-6-én-3-on típusú molekulákon végeztek már gyűrűnyitási reakciókat Ru-tartalmú katalizátorokkal (14. ábra), és Veldhuizen és munkatársai (2005) Ru- és Ag-tartalmú katalizátorokkal ill. Gillingham és munkatársai (2004) szerkezetileg hasonló vegyületekkel tanulmányoztak egy aszimmetrikus gyűrűnyitási reakciót sztirollal és szintén Ru-tartalmú katalizátorokkal.
O O
R O
O
R 14. ábra: Gyűrűnyitási reakció Wright (2001) alapján, R= Ph-, o-BrPh-,
CH3(CH2)3-, BrCH2-, BrCH2CH2-, MeO2C-, EC-.
A gyűrűnyitási metatéziseket tárgyaló irodalmakból kiderül az is, hogy gázhalmazállapotú olefineket használva, azok polimerizációja nem figyelhető meg a reakciók során.
2.4. Izolált enzimek vagy élő sejtes rendszerek használata
A monooxigenáz enzimek használata a szintetikus kémiában a kofaktorok miatt bonyolult és drága. A FAD prosztetikus csoport általában szorosan kötődik az enzimhez és a katalitikus körben regenerálódik. A NADPH viszont az enzimatikus transzformáció során elfogy, így a költségtakarékos biotranszformáció eléréséhez a kofaktorokat vissza kell forgatni. Ennek a problémának a megoldására kettő lehetőség kínálkozik: izolált enzimek használata a kofaktorok regenerálásának megoldásával, vagy élő sejtes rendszerekkel végzett biotranszformációk.
Izolált enzimek felhasználásakor a legjobb és a legszélesebb körben elterjedt módszer a NADH visszaforgatásához a formát-dehidrogenáz (FDH) enzim alkalmazásával, amely katalizálja a formát oxidációját szén-dioxiddá (Wichmann et al., 1981), a NADPH regenerálásához pedig a glükóz-6-foszfát (G6P)/glükóz-6-foszfát dehidrogenáz (G6PDH) rendszer lehet segítségünkre (Wong et al., 1981).
Az élő sejtekkel végzett biokatalízis elegáns megoldást nyújt a kofaktorok problémájára, hiszen az élő organizmusok természetes visszaforgató rendszerrel rendelkeznek az összes szükséges faktorhoz. Mindemellett ebben az esetben elkerülhetők a bonyolult fehérjetisztítási eljárások, melyek izolált enzimek használatakor igencsak megnehezítik és megdrágítják a reakciót, és az enzim instabilitása sem korlátozza annak alkalmazhatóságát. A legtöbb esetben a sejtek könnyen növeszthetők és tárolhatók.
Negatívumként viszont meg kell említeni egyrészt, hogy a mikroorganizmusokkal végzett reakciók esetében általában a termék kinyerése okozza a legfőbb gondot a híg, nagytömegű sejtet tartalmazó fermentléből, másrészt pedig az izolált enzimekkel szemben az egész sejtes rendszerek az enzimek sokaságát tartalmazzák, amelyek növelik a rendszer összetettségét. Ez a probléma kiiktatható, ha speciális génmanipulált rendszereket fejlesztünk ki.
2.5. Filamentáris enzimrendszerek
2.5.1. A flagellin és a flagelláris filamentum jellemzése
A flagellumok a baktériumok mozgásszervei. A bakteriális flagellum hosszú helikális filamentumai a sejtmembrán felszínén találhatóak és flagellin fehérjék (FliC) több tízezer példányából épülnek fel (Namba et al., 1997). A flagelláris filamentumok önszerveződő rendszerek, azaz megfelelő körülmények között a flagellin monomerek spontán képesek összeállni a natív filemantum szerkezetével megegyező filamentummá. A flagellin alegységek polimerizációja könnyen ellenőrizhető és a képződött filamentumok fizikai, kémiai hatásokkal és proteázokkal szemben ellenállóak, szerkezetét atomi szinten ismerjük (Samatey et al., 2001; Yonekura et al., 2003).
A Salmonella typhimurium baktériumból származó flagellin 494 aminosavból áll.
Különböző baktériumfajokból származó flagellinmolekulák aminosavsorrendjét összevetve nagyfokú homológia állapítható meg a terminális régiók esetében, - amely alatt Salmonella typhimurium esetében kb. 66 aminosavnyi N-terminális és 44 aminosavnyi C-terminális rész értendő -, azonban a fehérjék központi része nagyon variábilis (Wilson et al., 1994).
Különböző eredetű flagellinek molekulatömege tág határok között változik (28-65 kDa), ezek a különbségek a központi rész eltérő méreteiből adódnak.
A flagellin alegységek a sejt belsejében szintetizálódnak és a flagellum-specifikus exportapparátus segítségével jutnak el beépülési helyükre, a filamentum végére (Macnab 2004; Muskotál et al., 2006). A részlegesen kitekeredett monomerek feltételezhetően a flagellum keskeny központi csatornáján (25-30 Å) keresztül szállítódnak. Ismertté vált, hogy a konzerválódott N-terminális 22 aminosav hosszúságú szegmense szükséges ahhoz, hogy a flagelláris exportrendszer felismerje a szállítandó fehérjét (Végh et al., 2006; Gál et al., 2006).
A konzerválódott terminális régióknak is fontos szerepük van a flagellin önszerveződésében (Vonderviszt et al., 1991), hiszen a polimerizálódás során α-helikális kötegekké rendeződve stabilizálódnak és így alkotják a filamentumok központi részét (Mimori-Kiyosue et al., 1997). A flagellin monomerek proteázokkal könnyen emészthetők, pl. tripszinnel is gyorsan megtörténik a rendezetlen terminális régiók eltávolítása és létrejön egy viszonylag stabil 40 kDa-os molekula, amely csak lassan emésztődik tovább egy 27 kDa-os molekulává. A polimerizáció során a rendezetlen terminális régiókból kialakult α-helikális kötegektől erősödik a szerkezet, így a filamentum már ellenálló a tripszinnel szemben is (Vonderviszt et al., 1989).
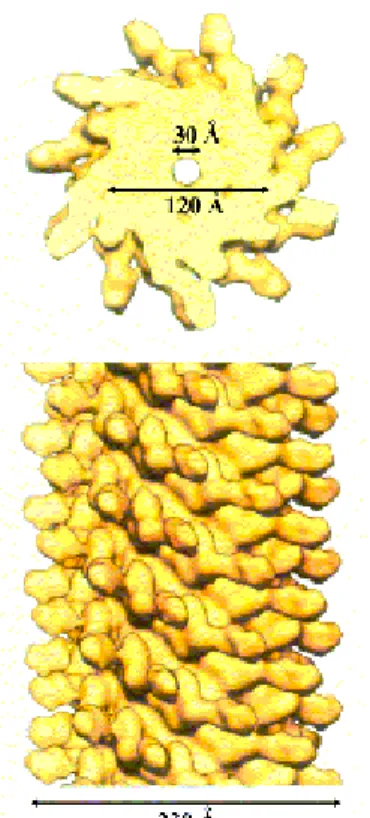
A flagellin alegységek 11 protofilamentumba rendeződve alkotják a flagelláris filamentumot, amelyben a monomerek erős kölcsönhatásban vannak egymással (15. ábra).
Csak a flagellin alegységek konzerválódott terminális régiói vesznek részt a filamentum felépítésében, a variábilis központi részük a D3 domént alkotja, amely a filamentum felszínén helyezkedik el (16. ábra).
15. ábra: A flagellin alegységek 11 protofilamentumba rendeződve építik fel a flagelláris filamentumok szerkezetét. (Samatey, et al., 2001).
16. ábra: (a) A flagellin alegységek szerkezete. (b) A flagellin alegységek elhelyezkedése a flagelláris filamentumokban. (Yonekura et al., 2003).
(a) D (b)
D
A D3 domén nem lép kölcsönhatásba a szomszédos alegységekkel és nincs lényeges szerepe a filamentáris szerkezetek felépítésében (12. ábra). A D3 domén a génsebészeti eljárások célpontja lehet, mivel könnyen módosítható a flagellin alegységek önszerveződésének és szállítódásának károsodása nélkül.
2.5.2. Flagelláris display-technológiák
Kuwajima (1988) már 1988-ban állított elő olyan E.coli flagellin mutánsokat, amelyeknek variábilis központi részén végeztek deléciókat. A legkisebb deléciós mutáns csupán az N-terminális 193 és a C-terminális 117 aminosavát tartalmazta. Azóta a flagellin központi variábilis régiója jelenti a célpozíciót az idegen eredetű fehérjék génjeinek beillesztéséhez, hogy így azok megjelenhessenek a flagellumok felületén. A flagelláris displayt leggyakrabban az új rekombináns vakcinákkal kapcsolatos kutatásokban használják (Luna et al., 1997), emellett random peptid könyvtárak tesztelésére is alkalmazható, a fág-display technika egyik alternatívájaként. Lu és munkatársai (1995) létrehoztak egy olyan fúziós fehérjét, amelyben az E. coli thioredoxinjának teljes génjét építették be a flagellin gén cserélhető régiójába. Ezaki és munkatársai (Ezaki et al., 1998) szintén E. coli sejtek felszínére juttattak ki eltérő hatékonysággal rekombináns fehérjéket a flagellin gén segítségével. A fúziós fehérjék felszínre jutása az inszert nagyságától és szekvenciabeli helyétől függött, ezeken kívül még számos fel nem derített tényező is áll ennek hátterében.
2.5.3. A flagellin-enzim fúziós fehérjék létrehozása
A flagelláris display esetében demonstrálták, hogy a flagellin variábilis részének nagy fragmentumai eltávolíthatóak és idegen peptideket vagy fehérjéket lehet beültetni erre a helyre úgy, hogy azokat az E. coli vagy a Salmonella baktériumok termeljék (Luna et al., 1997; Lu et al., 1995; Ezaki et al., 1998). Ezeknél az első próbálkozásoknál az eltávolított régiókat véletlenszerűen választották ki nagyfelbontású szerkezeti információk hiányában.
2001-ben viszont sikerült a Salmonella typhimurium flagelláris filamentumának atomi szerkezetét meghatározni (Samatey et al., 2001). Ennek alapján a Salmonella typhimurium flagellinjének egy szerkezetileg független régióját lehet módosítani, amely pontosan a D3 domén, a 190-284. aminosavig terjedő rész. Ezt a régiót kívánom lecserélni monooxigenáz enzimek (CHMO és CPMO) génjeire.
A flagellin-enzim fúziós fehérjék egyik lehetséges nagy előnye az lenne, hogy
különböző filamentáris szerkezetek létrehozására felhasználhatók. A polimerizációs folyamat precíz ellenőrzésével a szükséges méretű filamentumok (0,1µm-20 µm) előállíthatók, amelyek az alegységek ezreit tartalmazzák. Monomer flagellinek oldatában a filamentumképződés elindítható precipitálószerek mint pl. ammónium-szulfát felhasználásával, vagy rövid filamentumok, mint magok, hozzáadásával (Asakura, 1970). Már az egyféle fúziós fehérjéből előállított filamentáris szerkezetek is szolgálhatnak néhány előnnyel: ezeknek a filamentumoknak a felületén nagyon nagy sűrűségben lennének jelen a katalitikus egységek, jellemzően 5 nm-es távolságban egymástól. A filamentáris szerkezetekben az alegységeknek azonos a lokális környezete. Szobahőmérséklethez közeli hőmérsékleten a flagelláris filamentumok hosszú időn át stabilak, és ellenállóak a proteázokkal szemben. Az egyetlen tény, ami veszélyezteti épségüket, az a filamentumok végein található alegységek lassú depolimerizációja, ami alacsony ionerősség mellett következik be. Amennyiben a flagellin- enzim fúziós fehérjék képesek lennének exportálódni és filamentumot formálni a baktérium felületén, ezzel egyidejűleg a felületen enzimek nagy mennyiségben jelennének meg. Ezek a baktériumok, mint új mikrobiális biokatalizátorok hatékonyan alkalmazhatóak lennének biokonverziók esetében. Az ilyen felületek létrehozása egy egyszerű módja a rögzített enzimek előállításának és ez a módszer a gyakorlatban megszüntetné az enzimtisztítás szükségességét.
Az előzőekben említett eljárásnak viszont vannak nyilvánvaló korlátozó tényezői, mint pl. a vizes közeg és a fiziológiai körülmények szükségessége. Ennek az egyfajta enzimet tartalmazó nanoszerkezetnek is több előnye van a már ismert rendszerekhez képest. Segítségével létrehozhatunk például olyan baktériumokat, amelynek a felszínén biokatalízisre képes filamentumok nőnek, és a reakció végeztével ezek a struktúrák könnyen eltávolíthatók, mivel az enzim fúziós fehérjeként vesz részt a flagellumok kialakításában, nem önmagában van jelen a katalízis során. Az ilyen filamentáris multienzim-szerkezetek a következő előnyökkel rendelkeznének a különböző biotechnológiai alkalmazásokban: hordozók nélkül alkalmazhatók, könnyen elválaszthatók a terméktől centrifugálással vagy ultraszűréssel, amely összehasonlítva a manapság használatos biokatalitikus enzimreakciókkal, elegáns és egyszerű megoldást jelentene, és használhatóak olyan körülmények között is, ami az élő sejtekre ártalmas lehet.
A jövőben érdemes lenne továbbfejleszteni a filamentáris enzimszerkezeteket kapcsolt reakciókat katalizáló enzimek használatával, vagy az egyéni enzimeket a kofaktor-regeneráló enzimek együttes alkalmazásával. Ezen az irányvonalon elindulva a molekuláris biológia és biotechnológia modern eszközeivel olyan enantioszelektív és környezetbarát eljárásokat lehet kidolgozni a későbbiekben, amelyek a szerves vegyipari és gyógyszeripari alkalmazások alapját képezhetik.
3. Kísérleti rész
A különböző alfejezetekben az azonos típusú reakciók kivitelezéséhez szükséges összetevők előállítását tárgyalom, megadok egy általános eljárást a reakciók elvégzéséhez, majd egy–egy adott molekula előállításához szükséges vegyszereket, azok mennyiségét, illetve a körülményeket ismertetem. A vegyületek előállításánál részletesen csak azt a reakciót fejtem ki, amellyel a legjobb kitermelést értem el.
A biciklusos vegyületek előállítására szolgáló ultrahangos fürdőben kivitelezett [4+3] cikloaddíciós reakcióval, majd az így kapott termékek debrómozásával állítottam elő a biciklusos molekulákat. Ezt követően a biciklusos vegyületek gázhalmazállapotú olefinekkel kivitelezett gyűrűnyitási metatézisei következnek. Ezzel a reakcióval előállított molekulákat vagy tisztítás után közvetlenül felhasználtam a biotranszformációkhoz, vagy katalitikus hidrogénezésnek vetettem alá, és ezután került sor a mikrobiális Baeyer-Villiger oxidációra. A biológiai oxidációk kontrolljaként elvégeztem a kémiai Baeyer-Villiger oxidációkat is, a kapott termékek NMR (magmágnes-rezonancia) és gázkromatográfiás (GC) adatait felhasználtam a biotranszformációkkal előállított termékek azonosítására. A kémiai Baeyer-Villiger oxidációkat részletesen nem kívánom kifejteni, csak az általános módszert írom le. Ebben a fejezetben a biológiai oxidációk kivitelezését is tárgyalom, a lejátszódott biooxidációk adatait táblázatba foglalva az Eredmények és következtetések című fejezetben adom meg. Az Eredmények és következtetések című fejezetben részletesen nem tárgyalt reakciók eredményei, a keletkezett termékek analitikai adatai a mellékletben találhatók.
3.1. Felhasznált anyagok és módszerek
A munkám során felhasznált szerves oldószereket használat előtt desztilláltam. Az ultrahangos reakciók során Bandelin Sonorex super RK102H ultrahangos fürdőt használtam. A termékek tisztítását szilikagél 60 (40-63 µm, Merck) töltettel kiviteleztem.
A GC vizsgálatok ThermoQuest Trace GC 2000 készülékkel készültek, DB5 (30 mm x 0.32 mm ID) és BGB 175 (30 mm x0,25 mm ID, 0,25 µm film) oszlopokkal. Az enantiomer felesleget (e.e.) a királis oszlopon végzett GC adatokból határoztam meg. Az NMR spektrumok felvétele CDCl3 oldószerben, Me4Si belső standarddal, Bruker AC 200 (200 MHz) és Bruker Avance Ultrashield 400 (400 MHz) spektrométeren történt. A fajlagos optikai forgatóképességet ([α]D20
, 20°C-on, a nátrium D vonalára, 589 nm-re
vonatkoztatva) Perkin Elmer Polarimeter 241 műszerrel határoztam meg a következő összefüggést használva:
[ ]
l
D c
⋅
= ⋅α
α 20 100 ; α:: a polariméterrel mért érték, a polarizációs sík elforgatásának szöge [°]; c: koncentráció [g/100 mL]; l: az oldat rétegvastagsága [dm].
Reakcióim kivitelezése során vékonyréteg kromatográfiát használtam a konverziók ellenőrzéséhez.
A biotranszformációk során felhasznált E. coli expressziós rendszereket Dr. Pierre E. Rouviere (E.I. Dupont Company) –től, és Prof. Margaret M. Kayser (University of New Brunswick) –től kaptam. A BVMO géneket tartalmazó plazmidokkal transzformált E. coli DH5α baktériumokat ampicillin tartalmú Luria-Bertani (LB) táptalajon növesztettem –80
°C-on tárolt glicerines kultúrákból, a reakciókhoz a táptalajról különálló baktériumtelepeket választottam ki.
A flagellin-enzim fúziós fehérjék létrehozásához a pKOT-1 plazmidot használtam, melyet a Magyar Tudományos Akadémia (MTA) Szegedi Biológiai Központ (SZBK) Enzimológiai Intézete bocsátott rendelkezésemre. Ez a plazmid pBR322 alapú, a flagellin promóterét és génjét EcoRI helyen tartalmazza. Az Acinetobacter CHMO génjét a pDR01 és a Comamonas CPMO génjét a pDR05 plazmidokból PCR-eztem (PCR: polimeráz láncreakció), amelyeket a Bécsi Műszaki Egyetemről Dr. Marko D. Mihovilovic felajánlásával használok. Plazmidok megsokszorozására minden esetben E. coli TOP10 sejteket alkalmaztam. A plazmidok tisztításához Omega E.Z.N.A. Plasmid Mini Kit II-t (általában 10 ml baktériumkultúrából preparáltam plazmidot és 50 µl steril deszt. vízzel eluáltam), PCR termékek gélből izolálásához és DNS fragmentumok emésztése után Promega Wizard SV PCR-Clean-up kitet használtam. A DNS-eket a New England Biolabs Inc. restrikciós endonukleázaival emésztettem, az emésztésekhez az enzimeknek megfelelő standard protkollokat alkalmaztam, a PCR reakciókat KOD polimerázzal végeztem. A PCR-ekhez és a szekvenáltatáshoz felhasznált primereket a MTA SZBK Nukleinsav Szintézis Laboratóriumából rendeltem. A ligálásokhoz a Fermentas Rapid DNA Ligation Kit-jét használtam az ajánlott előirattal. Az emésztett plazmid defoszforilálására SAP (Shrimp Alkaline Phosphatase, Promega) enzimet alkalmaztam az enzimhez tartozó leírás alapján. A DNS fragmentumok detektálására és izolálására agaróz gélelektroforézist végeztem. A DNS konstrukciók szekvenálását az MTA SZBK Szekvenáló Laborjában végezték. Az elkészült plazmidokat fehérjetermeltetés érdekében Salmonella SJW2536 flagellin-deficiens baktériumokba elektroporáltam. A baktériumok úszóképességét sötétlátóterű mikroszkóppal (Olympus BX FLA, UPlan FI 40x/0,75 objektívvel) és Malapaka és munkatársai (2007) által leírt motilitás teszttel vizsgáltam. A fehérjeminták
töményítéséhez Microcon oszlopot (30000 MWCO, Millipore, Bedford, MA, USA) használtam. A fehérjéket SDS (Sodium dodecylsulfate) gélelektroforézissel detektáltam, a fehérjekoncentrációkat Unicam Helios α fotométer segítségével határoztam meg a 280nm- en mért értékekből a fehérjék extinkciós koefficienseit felhasználva (Ɛ280=17880 M-1cm-1 a vad flagellin esetében és Ɛ280=10430 M-1cm-1 a D3-deléciós flagellin esetében (EXPASY)).
A vad flagellin és a D3-deléciós flagellin preparálását Vonderviszt és munkatársai (1989) alapján kiviteleztem. Cirkuláris dikroizmus (CD) mérésekhez a MTA SZBK Enzimológiai Intézetében lévő Jasco-720 spektropolarimétert használtam.
3.1.1. Cirkuláris dikroizmus
A Cirkuláris dikroizmus (CD) spektroszkópia a polarizált fény és egy optikailag aktív anyag (esetemben fehérje) kölcsönhatásán alapulnak, a fehérjeoldat elforgatja a rajta keresztülbocsátott polarizált fény síkját. A CD spektroszkópiával gyorsan nyerhetünk információt a fehérjék szerkezetéről. A távoli ultraibolya tartományban (180-260nm) felvett CD spektrumból következtethetünk a másodlagos szerkezeti elemek (α-hélix, β- lemez, rendezetlen/random coil láncok) meglétére, illetve ezek arányára a fehérje térszerkezetében, míg a közeli UV tartomány (260-320 nm) az aromás oldalláncokról, azok egymáshoz viszonyított térbeli orientációjáról, vagyis a harmadlagos szerkezetről ad információt. A műszer felhasználható fehérjék különböző környezeti behatások (pl.: pH változás, hődenaturáció) során bekövetkező konformációs változások nyomon követésére is (http://esr.elte.hu/~noemi/labor/cd/cd.html). Munkám során fehérjék denaturációs hőmérsékletének meghatározására alkalmaztam. A CD mérésekből kapott görbék inflexiós pontjainak meghatározása Qtiplot program felhasználatával készült.
3.1.2. E.coli TOP10 kompetens sejt készítési eljárás
20 ml folyadék tápoldatba 50 µl előző éjjel 1 telepről felnövesztett baktériumkultúrát oltottam és felnövesztettem 37 ̊C-on, míg a 600 nm-en mért abszorbanciája elérte a 0,6-ot (kb. 3-4 óra). A sejteket 4 ̊C-on 4000 rpm-mel 10 percig centrifugáltam, innentől a baktériumcsapadékot a preparálás során jégen tartottam. Először 10 ml 0,1M MgCl2-vel óvatosan mostam a csapadékot, majd ismét kiülepítettem a sejteket, és másodszor 700 µl 0,1M CaCl2-be vettem fel. A sejtszuszpenziót 1 órán keresztül inkubáltam jégen, ezután az elkészült kompetens sejtekből 200 µl-t használtam transzformálásra. A kompetens sejtet a transzformálni kívánt plazmiddal jégen inkubáltam
1 órán át, majd 2 perc hősokk következett 42 ̊C-on. Ezt követően ismét lehűtöttem a sejteket és 800 µl folyékony LB tápoldatot adtam hozzá, amiben 37 ̊C-on 45 percig növesztettem. Ezután a transzformált sejteket kikentem a megfelelő antibiotikumot tartalmazó táptalajra.
3.1.3. Salmonella SJW2536 elektrokompetens sejt készítési eljárás
200 ml folyadék tápoldatot beoltottam 1 ml előző éjjel 1 telepről felnövesztett 20 ml-es starterkultúrából és növesztettem 37 ̊C-on, míg a 600 nm-en mért abszorbanciája elérte a 1,0-t (kb. 3 óra). Centrifugálás előtt a kultúrát 5 percig jégen inkubáltam, majd 4 ̊C- on 4000 rpm-mel 10 percig fugáltam. A felülúszót leöntöttem, és a csapadékot 40 ml 4 ̊C- os steril 15%-os glicerinnel felszuszpendáltam. Ezt követően ismét centrifugáltam, és megismételtem az előző mosási lépést. A harmadik centrifugálást követően 20 ml 4 ̊C-os steril 15%-os glicerinnel mostam a csapadékot, majd ismét centrifugáltam. A csapadékot 800 µl 4 ̊C-os steril 15%-os glicerinbe vettem fel, és 40 µl-ként szétosztottam steril eppendorf csövekbe. Az így elkészített elektrokompetens sejtek -80 ̊C-on tárolhatók a felhasználásig. Az elektroporálást 3 kV-tal kiviteleztem 1-2 µl plazmid és 40 µl elektrokompetens sejt felhasználásával. Ezt követően 500 µl folyékony LB-ben növesztettem az elektroporált sejteket 37 ̊C-on 1 órán keresztül, majd kikentem a sejtszuszpenziót a megfelelő antibiotikumot tartalmazó táptalajra.
3.2. Általános sémák
N H
N COOMe
Br
Br X
O
O X O
Br Br
Br Br
O Br Br
Br Br
O Br Br
Br Br
O
X=CH2 (a) X=O (b)
X=NCOOMe (c) 2
1c 3
+
+
+
O
O
O
O 3a
4a
4b
4c
O
O O
O
O
O
O O
O
O
O O
O O
O O
O
O O
O O
O O
O O O
O N-COOMe
O
N COOMe
O
N COOMe
O
N COOMe
5d 6d
5e 6e
4f
6'f
4h 3b 4g
5f 6f
3c
4i
4j
4k