A flagellin fehérje polimerizációjának jellemzése
Doktori (PhD) értekezés
Készítette:
Gugolya Zoltán okleveles fizikus
Készült a Pannon Egyetem Kémia Doktori Iskolájához tartozóan
Fizika Intézet 2008
A flagellin fehérje polimerizációjának jellemzése
Értekezés doktori (PhD) fokozat elnyerése érdekében a Pannon Egyetem Kémia
Doktori Iskolájához tartozóan.
Írta:
Gugolya Zoltán
A jelölt a doktori szigorlaton …... % -ot ért el.
Az értekezést bírálóként elfogadásra javaslom:
Bíráló neve: …... …... igen /nem
……….
(aláírás)
Bíráló neve: …... …... igen /nem
……….
(aláírás)
A jelölt az értekezés nyilvános vitáján …...% - ot ért el.
Veszprém, ……….
a Bíráló Bizottság elnöke
A doktori (PhD) oklevél minősítése…...
………
Az EDT elnöke
Kivonat
Egyes baktériumok flagellumok segítségével mozognak. A flagellumok egy, a sejtmembránba ágyazódó motorból és a hozzá kapcsolódó 5-10 μm hosszúságú filamentumból állnak, amelyet flagellinmolekulák építenek fel. A Salmonella typhimuriumból származó flagellinmolekula terminális régiói monomer állapotban rendezetlenek. A feltételezések szerint ezek a régiók vesznek részt a filamentumok belső csatornájának felépítésében, fontos szerepet játszanak az önszerveződő képesség szabályozásában.
A flagellumok felépülésekor szinte valamennyi fehérjének keresztül kell jutnia a citoplazma membránján és néhánynak még a külső membránon is. Ez a folyamat a flagellumspecifikus export. Az exportrendszer tagjai közül a FliS dajkafehérje a flagellin fehérje szintetizálódása után meggátolja annak polimerizálódását a citoplazmában és elszállítja az exportrendszerhez. A FliI fehérje az exportálandó molekulát megköti és ATP bontással nyert energiával segíti annak membránon való átjutását. A FliH a FliI ATP-áz aktivitását szabályozza.
A kutatásoknak célja, hogy a flagellinmolekula önszerveződőképességét alaposan megismerve és ezeket az ismereteket felhasználva, genetikailag módosított flagellinekből olyan filamentumokat építhessünk, amelyek különböző molekulák felismerésére és megkötésére képesek. A kötőhelyek a filamentum felületén több ezer példányban is megjelenhetnek. Az így létrehozott stabil filamentumok a későbbiekben bioszenzorok alapelemeiként szolgálhatnak.
A disszertációban limitált proteolízissel előállított, különböző mértékben csonkított, fluoreszcens festékkel jelölt flagellin fragmentumokkal, fluoreszcencia rezonancia energia transzfer segítségével a szerző megmutatja, hogy a flagellin N- és C-terminálisai pontosan hogyan alakítják ki a filamentum belső szerkezetét.
A szerző izotermális titrációs kaloriméterrel jellemezte a FliI-FliH kölcsönhatást és kimutatta, hogy a FliH igen erős, specifikus Zn2+-ion és foszfátkötő tulajdonsággal rendelkezik, valamint a FliH foszfolipáz-C enzim aktivitást mutat.
A szerző izotermális titrációs kaloriméterrel kimutatta a FliS-flagellin 1:1 arányú kötődését és igazolta a flagellin C-terminálisának szerepét e komplex kialakulásában.
Abstract
Characterization of the flagellin protein polymerization
Bacteria swim by means of flagella. Helical filaments of bacterial flagella are constructed from subunits of a single protein, flagellin, by a self-assembly process. Terminal regions of flagellin have no ordered tertiary structure in the monomeric form. They belong to the most conserved parts of the molecule and are thought to be essential in assembly regulation. There is a growing interest in understanding the role of unstructured protein segments in controlling macromolecular recognition and self-assembly.
External flagellar proteins, lying beyond the cytoplasmic membrane, are synthesized in the cell and exported by the flagellum-specific export apparatus from the cytoplasm to the site of assembly through the central channel of the flagellar filament. FliS acts as a substrate- specific chaperone facilitating the export of flagellin. FliI is an ATPase whose enzymatic activity is necessary to drive the export process, while FliH is believed to function as a negative regulator of FliI.
Various terminally truncated fragments of flagellin were prepared and their polymerization ability was investigated. FRET was used to monitor binding of truncated flagellin fragments to the end of flagellar filaments.
FliI–FliH complex was quantitatively characterized by isothermal titration calorimetry (ITC) to determine stoichiometry and binding enthalpy. The FliI–FliH interaction is too weak to allow effective binding in the physiological concentration range. Isothermal titration calorimetry was used to show, that FliH can specifically bind zinc atoms and FliH is a phosphate binding protein. The phospholipase C activity of FliH was demonstrated with spectrofluorimeter experiments.
Interaction of FliS with flagellin was characterized by isothermal titration calorimetry producing an association constant and a binding stoichiometry of 1:1. Experiments with truncated FliC fragments demonstrated that the C-terminal disordered region of flagellin is essential for FliS binding.
Zusammenfassung
Die Charakterisierung der Polymerisation des Flagellin-Protein
Durch Flagellen sind Bakterien beweglich. Das bakterielle Filamentum besteht aus Flagellinmolekülen. Die terminalen Regionen des Flagellinmoleküls des Salmonella typhimuriums sind in monomerem Zustand ungeordnet. Nach der Hypothese nehmen.diese Regionen am Aufbau des inneren Kanals des Filamentums teil, sie spielen eine wichtige Rolle bei der Regelung der selbstorganisatorischen Fähigkeit.
Beim Aufbauen des Flagellums muß fast jedes Protein durch die Membran des Cytoplasmas transportiert werden, einige sogar durch die äußere Membran. Dieser Prozeß ist der flagellumspezifische Export. Das Chaperon FliS verhindert die Polymerisation des Flagellinproteins im Cytoplasma, und transportiert es zum Exportapparat. Das FliI-Protein bindet das zu exportierende Molekül, und hilft mit der Energie der ATP-Hydrolyse dessen Export durch die Membran. Die Aktivität der FliI-ATPase wird durch FliH geregelt.
Das Flagellin wurde mit limitierter Proteolyse hergestellt, in verschiedenem Maße verkürzt, und mit fluoreszierender Farbe gezeichnet. Mit Hilfe von FRET wird präsentiert, wie durch die N- und C-Terminale des Flagellins die innere Struktur des Filamentums genau gestaltet wird.
Die FliI-FliH-Interaktion wurde mit isothermaler Titrationskalorimetrie (ITC) charakterisiert und es wurde nachgewiesen, daß FliH über eine sehr starke, spezifische Zn2+- Ion- und phosphatbindende Eigenschaft verfügt, sowie daß FliH eine Phospholipase C Enzymaktivität zeigt.
In der Dissertation wurde mit Hilfe von ITC die 1:1 Bindung zwischen FliS und Flagellin gezeigt, sowie die Rolle der C-terminalen Region des Flagellins bei der Entsehung dieses Komplexes nachgewiesen.
Tartalomjegyzék
Kivonat ... 4
Abstract ... 5
Zusammenfassung... 6
Tartalomjegyzék... 7
1. Bevezetés... 8
2. Irodalmi áttekintés... 10
2.1. A bakteriális flagellum szerepe és felépülése ... 10
2.2. A flagellumspecifikus exportrendszer komponensei ... 14
2.3. A flagellinmolekula szerkezete ... 17
3. Alkalmazott módszerek, felhasznált anyagok... 21
3.1. Fotometria ... 21
3.2. Oszlopkromatográfiás technikák... 23
3.2.1. Gélszűrés ... 23
3.2.2. Ioncserés kromatográfia ... 24
3.2.3. Affinitási kromatográfia... 25
3.3. Dialízis ... 26
3.4. A poliakrilamid gél elektroforézis (PAGE) ... 26
3.5. Izotermális titrációs kaloriméter (ITC) ... 29
3.6. Spektrofluoriméter ... 33
3.6.1. Fluoreszcencia rezonancia energia transzfer (FRET) ... 34
3.7. Felhasznált anyagok ... 34
4. Kísérleti eredmények... 38
4.1. A flagellin tisztítása... 38
4.2. A flagellin fragmentumok előállítása... 40
4.2.1. F49 és F46 fragmentum... 40
4.2.2. F48 fragmentum ... 44
4.2.3. F40 fragmentum ... 45
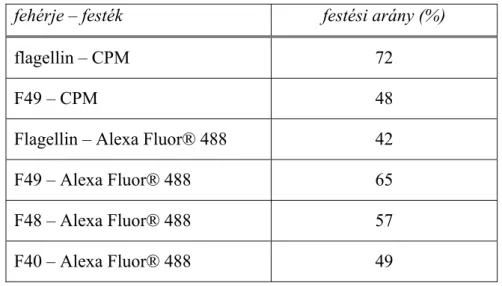
4.3. Jelölés fluoreszcens festékekkel... 46
4.4. Filamentum törzsoldat készítése ... 48
4.5. Fragmentumok kötődésének vizsgálata spektrofluoriméterrel ... 49
4.6. A FliH fehérje szerepe... 53
4.6.1. FliH fehérje tisztítása affinitás kromatográfiával... 53
4.6.2. A FliH-FliI kölcsönhatás jellemzése ITC méréssel... 56
4.6.3. A FliH fehérje kötési tulajdonságainak vizsgálata... 57
4.6.4. A FliH fehérje foszfolipáz C aktivitása... 61
4.7. FliS – flagellin kölcsönhatás ... 64
5. Összefoglalás... 67
Irodalomjegyzék... 71
1. Bevezetés
Egyes baktériumok flagellumok segítségével mozognak. A flagellumok egy, a sejtmembránba ágyazódó motorból és a hozzá kapcsolódó filamentumból állnak, amelyet flagellinmolekulák építenek fel.
A filamentumok külső részének szerkezetét röntgendiffrakciós mérések révén már atomi pontossággal ismerjük, a belső rész felépítéséről azonban keveset tudunk. A Salmonella typhimuriumból származó flagellinmolekula terminális régiói monomer állapotban rendezetlenek. A feltételezések szerint ezek a régiók vesznek részt a filamentumok belső csatornájának felépítésében, s fontos szerepet játszanak az önszerveződőképesség szabályozásában.
A baktériumok flagelláris rendszerének felépülésekor, a filamentumot felépítő szinte valamennyi fehérjének keresztül kell jutnia a citoplazma membránján és néhánynak a külső membránon is. Ez a folyamat a flagellumspecifikus export, ami sok hasonlóságot mutat a fertőző baktériumok mérgező fehérjéinek kijuttatásával és szintén a III-as típusú exportrendszer csoportjába tartozik.
Az exportrendszer tagjai közül az eddigi ismereteink szerint a FliI fehérje az exportálandó molekulát megköti és ATP bontással nyert energiával segíti annak membránon való átjutását. Feltevések szerint a FliH a FliI ATP-áz aktivitását gátolja, amíg az exportrendszer képessé nem válik az exportálandó molekulák továbbítására a citoplazma membránon át, hogy azok beépüljenek a növekvő flagelláris szerkezetbe.
A flagellumspecifikus exportrendszer egyik tagjának, a FliS dajkafehérjének a feladata az, hogy a flagellin fehérje riboszómán történő szintetizálódása után meggátolja annak polimerizálódását a citoplazmában és elszállítsa az exportrendszerhez.
Munkám során arra a kérdésre kerestem választ, hogy a szomszédos flagellin alegységek N- és C-terminálisai pontosan hogyan alakítják ki a filamentum belső szerkezetét. Szeretném kísérleti eredményekkel alátámasztani azt a hipotézist, miszerint az axiális irányban szomszédos flagellin alegységek N- illetve C-terminális régiói egymásba fonódva építik fel a filamentumok belső gyűrűjének szerkezetét.
A FliI-FliH komplexet eddig csak affinitás blottolással, illetve gélszűréssel vizsgálták, a FliI-FliH kötés erősségéről csak kevés információval rendelkezünk. Szeretném precízen jellemezni a FliI-FliH kölcsönhatást. Munkám során szeretném tisztázni a FliH fehérje szerepét a flagellumspecifikus exportrendszer működésében, mert a FliI ATP-áz
aktivitása csupán tizedére csökkent a FliH nagy feleslegű hozzáadásának hatására, noha időnként a FliI működésének teljes gátlására is szükség van.
Szeretném a flagellinmolekula és a FliS fehérje közötti kölcsönhatás sztöchiometriáját és energetikáját izotermális titrációs kaloriméterrel jellemezni, a kölcsönhatást kialakító flagellin régiót lokalizálni.
Ezeknek a kutatásoknak azért lehet jelentősége, mert a flagellinmolekula önszerveződőképességét alaposan megismerve és ezeket az ismereteket felhasználva, genetikailag módosított flagellinekből olyan filamentumokat építhetünk, amelyek különböző molekulák felismerésére és megkötésére képesek. A kötőhelyek a filamentum felületén több ezer példányban is megjelenhetnek. Az így létrehozott stabil filamentumok a későbbiekben bioszenzorok alapelemeiként szolgálhatnak, amelyek a környezetvédelmi analitikában, gyógyszeriparban széleskörű alkalmazásra számíthatnak
2. Irodalmi áttekintés
2.1. A bakteriális flagellum szerepe és felépülése
Egyes baktériumok az életben maradáshoz helyváltoztatással keresik meg a számukra legkedvezőbb feltételeket. Érzékelik a hőmérséklet változását, egyes vegyületek jelenlétét a környezetükben, és ezeknek a függvényében változtatják mozgási irányukat a számukra kedvező feltételeket biztosító hely felé. Mozgásszervük a bakteriális flagellum, melynek segítségével úsznak (2.1. ábra). A Salmonella typhimurium törzsbe tartozó baktériumok is számos flagelláris filamentummal rendelkeznek. Ezek a filamentumok haladó mozgáskor egyetlen helikális köteggé állnak össze, és összehangolt forgásukkal propellerként hajtják előre a baktériumot 20-30 μm/s-os sebességgel [1]. A filamentumok vastagsága 23 nm, hosszúsága 15 μm is lehet. A filamentum a flagellin fehérje több tízezer példányából épül fel. A flagelláris filamentumok több figyelemre méltó tulajdonsággal rendelkeznek. Az egyik érdekes tulajdonságuk az önszerveződő képesség, azaz a flagellin monomerek megfelelő körülmények között spontán módon képesek polimerizálódni a natívval megegyező szerkezetű filamentumokká. Másik figyelemre méltó sajátosságuk, hogy a környezeti tényezőktől függően, egymástól jól megkülönböztethető helikális formákba képesek átrendeződni reverzibilis módon. Ez a jelenség a polimorfizmus. A helikális szerkezeti átrendeződéseket előidézheti a hőmérséklet, az ionerősség vagy a pH megváltoztatása, de mechanikai erőhatás is kiválthatja őket [1].
Minden egyes filamentum egy sejtmembránba ágyazott 50 nm átmérőjű protongradienssel hajtott motorból indul ki, amely akár 90000-es percenkénti fordulatra is képes. A motor forgásiránya néhány másodpercenként egy rövid időre (0,1 s) megfordul, ennek hatására a helikális köteg szétválik, egymástól függetlenül mozognak a filamentumok.
Ekkor létrejön egy „bukdácsoló” mozgás, ami rövid ideig tart az egyenes irányú mozgáshoz képest, majd a motor forgásiránya újra megfordul és a baktérium véletlenszerűen irányt változtatva tovább úszik (2.2. ábra) [1].
2.2. ábra
Sematikus rajz, illetve sötétlátóterű mikroszkóppal készített felvétel a baktérium úszási mintájáról [1]
A motor tengelye és a flagelláris filamentumok közti kapcsolatot a kampó (hook) biztosítja, amely erősen görbült szerkezetű. A kampó hossza 50 nm, vastagsága 20 nm körül
2.1. ábra
Elektronmikroszkópos felvétel a Salmonella typhimurium baktériumról, amelyen jól láthatók a flagelláris filamentumok [1]
nem a motor tengelye körül, hanem arra közel merőlegesen a baktérium hossztengelye körül forognak. A kampó szintén egy fehérjéből, a hook fehérje 120 példányából épül fel. A filamentumok és a kampó között a kapcsolatot egy másik fehérjecsoport, a HAP fehérjék biztosítják. A HAP1 és a HAP3 fehérjék egy átmeneti réteget hoznak létre a két rész között.
Fontos szerepe van a harmadik HAP típusú fehérjének, a HAP2-nek, mely a filamentumok végeit lezáró „sapkaként” működik. A HAP2 jelenléte nélkülözhetetlen a flagellin monomerek számára, melyek a citoplazmában szintetizálódnak, keresztülhaladnak a flagellum központi csatornáján, és a filamentum végére polimerizálódnak. A HAP2 hiányában a flagellin monomerek egyszerűen kidiffundálnának a külső környezetbe [2]. A HAP2 sapka speciális módon kötődik a filamentum végéhez, mivel ez a kötődés egyrészt nagyon erős, másrészt az egyes flagellin alegységek beépülésekor a sapka mégis képes elengedni azt a részét a filamentumnak, ahová a flagellin monomer beépül (2.3. ábra) [1].
A bakteriális flagellum kialakulása egy lépésről-lépésre történő felépülési folyamat, amit különböző mutáns baktériumok által létrehozott flagelláris szerkezeteket vizsgálva tanulmányoztak. Először a bazális testet felépítő szerkezetek alakulnak ki, majd a különböző szerkezeti egységek egymást követő sorrendben. Az építkezés a sejtből kifelé haladva történik, kivéve az L és a P gyűrűt, és mindig a növekvő filamentum végére épül be a következő fehérje monomer [1].
Az axiális fehérjéknek tehát, amelyek a sejtben szintetizálódnak, át kell jutniuk a citoplazma membránon, néhánynak pedig a külső membránon is. Szerkezeti vizsgálatok már a 60-as években megmutatták, hogy a filamentum nem tömör, hanem egy belső csatornával rendelkezik és ma már az is ismert, hogy a kampó is hasonló szerkezetű. Az axiális fehérjék a kampó, majd a filamentum belső üreges részén keresztül jutnak el annak távolabbi végébe, ahol beépülnek a növekvő szerkezetbe [3].
2.3. ábra
A bakteriális flagellum szerkezete
A flagellumot felépítő különböző fehérjekomponenseket más színek jelölik. A filamentum belső csatornáját szaggatott vonal jelzi
A sejtből kijuttatott axiális fehérjék három alcsoportba sorolhatók. A helikális filamentumokat felépítő flagellin elsődleges szerkezete szerint a HAP3 fehérjével mutat rokonságot. A hook fehérje nem hasonlít a flagellinhez, de terminális régióit tekintve nagymértékű hasonlóságot mutat a motor tengelyét alkotó rod fehérjékkel, és a HAP1 fehérjével. A harmadik alcsoportba a HAP2 fehérje tartozik, amely egyik axiális fehérjével
méretű rendezetlen terminális régiókkal rendelkeznek [4]. Az egyes csoportokon belül a szekvenciális hasonlóság a rendezetlen terminális régiókban a legnagyobb. A flagelláris filamentumot felépítő flagellinnél és a többi axiális fehérje esetén is hasonló jellegzetességeket mutattak ki. A terminális rendezetlen régiók a leginkább konzerválódottak, ami fontos szerkezeti és funkcionális szerepükre utal.
2.2. A flagellumspecifikus exportrendszer komponensei
Ahhoz, hogy a sejtben termelődő axiális fehérjék eljussanak beépülési helyükre, szükséges egy exportrendszer, amely felismeri az exportálandó fehérjéket, megkülönböztetve azokat a sejtplazmában található más fehérjéktől, és elvégzi a kijuttatásukat a sejtmembránon keresztül [5]. Ez a rendszer fontos szerepet játszik a filamentáris rendszer felépülése szempontjából, ennek ellenére sokáig csak a filamentum szerkezetének a meghatározásával foglalkoztak. Az időközben felfedezett flagelláris gének sokasága azt mutatta, hogy létezik a sejtben egy olyan rendszer, amelynek a funkciója még nem tisztázott. A gének funkcióinak a megismerésével vált lehetővé később az exportrendszer egyes komponenseinek azonosítása, majd működésük alaposabb megismerése [6,14].
Morfológiai vizsgálatok alapján feltételezik, hogy az exportrendszer tagjai a bazális test citoplazmikus oldalán a C gyűrű belsejében, illetve a sejtmembránban helyezkednek el.
Az exportrendszert felépítő fehérjék (2.4. ábra) a FlhA, FlhB, FliH, FliI, FliO, FliP, FliQ és FliR [15]. A rendelkezésre álló ismeretek szerint a FliO, FliP, FliQ és FliR valószínűleg integrális membránfehérjék, a FliI és a FliH citoplazmikus, vizes közegben működő fehérjék, míg a FlhA és a FlhB perifériális membránfehérjék, amelyek egy kisebb membránba ágyazott és egy nagyobb citoplazmikus doménből állnak. Az egyes fehérjék szerepének meghatározására különböző mutáns baktériumokkal végeztek kísérleteket és azt találták, hogy a FlhA, FliH és FliI fehérjéknek van meghatározó jelentőségük az exportfolyamatban [15].
Az exportrendszerrel kapcsolatosan azt is megfigyelték, hogy különböző patogén baktériumok virulens fehérjéinek a sejtből való kijuttatása nagy hasonlóságot mutat a flagelláris fehérjék exportjával. Nyolc olyan fehérjét is azonosítottak, amelyek homológiát mutatnak a flagellumspecifikus exportrendszerben megtalálható fehérjékkel. Ez a rendszer szintén a III-as típusú exportrendszerbe tartozik, amelyben a kijuttatott fehérjék nem rendelkeznek semmiféle szignálszekvenciával vagy lehasítható szignálpeptiddel, ami jelként
szolgálna a membránon való átjuttatás során. Jelenleg sem pontosan ismert, hogy hogyan kerülnek az axiális fehérjék a lumenbe, és jutnak el a flagellum szűk csatornáján keresztül a beépülési helyükre [1, 14 ,15].
2.4. ábra
A flagellumspecifikus exportrendszer feltételezett modellje [15]
Meghatározták az exportrendszer legtöbb elemét, és azok helyét a sejtben (2.4. ábra).
A membránba ágyazott fehérjék (FlhA, FlhB, FliO, FliP, FliQ, és FliR) helye valószínűleg az MS gyűrű központi üregében van a flagelláris bazális testben, az FlhA, és FlhB fehérjék hidrofil doménjei pedig benyúlnak a motor C gyűrűjének az üregébe. Feltételezték, hogy a chaperon fehérjék (FliS, és FliJ) a FliI-vel és a FliH-val lépnek kölcsönhatásba, de ezt nem tudták eddig közvetlen módon bizonyítani [15].
A kutatások szerint a FliI-nek szerepe van a flagelláris fehérjék kijuttatásában, mivel katalizálja az ATP-hidrolízist, az így nyert energia az axiális fehérjék sejtből való kijuttatását fedezi [16, 17]. Ezt támasztja alá az is, hogy a FliI fehérje aminosavszekvenciája hasonlóságot mutat egyes baktériumok virulens fehérjéinek szekréciójára specializálódott
megmutatták, hogy ez a funkció csak egy multikomplex rendszerben jelentkezik, mint az F0F1 ATP-áz β alegysége esetén is [18]. Azt vizsgálták, hogy kölcsönhatásba lép-e a FliI fehérje az axiális fehérjék reprezentánsaként választott flagellinnel és a kampó (hook) fehérjével, valamint, hogy ennek milyen hatása van a fehérje ATP-áz aktivitására.
Enzimaktivitás mérésekkel azt találták, hogy a flagellin, vagy a hook fehérje jelenléte stimuláló hatással van a FliI ATP-áz aktivitására [16].
A FliI 456 aminosavból álló fehérje. Limitált proteolízisével meghatározták azon részeit, amelyek felelősek az ATP-áz funkcióért, valamint egyéb fehérjékkel való kölcsönhatásért. A FliI fehérje két szakaszra osztható. A fehérje N-terminális végének kb. 110 aminosavból álló része a flagellinmolekula N-terminálisára specifikus régió, valószínűleg ez a rész felelős a FliH fehérjével való kölcsönhatásért is. A 110-456 aminosavnyi rész a C-terminális szakasz, amely a fehérje ATP-áz aktivitásáért felelős [19].
Azt találták, hogy a 235 aminosavból álló FliH gátolja a FliI ATPáz aktivitását [19, 20]. Eddigi ismereteink szerint a FliH dimer molekulákat képez oldatban, míg a FliI monomerként fordul elő, a kialakult komplex pedig egy heterotrimer molekula lesz.
Megállapították, hogy a kialakult (FliH)2FliI komplex ATP-áz aktivitása tízszer kisebb lett, mint a monomer FliI fehérjénél mért aktivitás [19].
Az axiális komponensek monomer formában szállítódnak, és csak a flagellum távolabbi végén épülnek be, ezért kell lennie valamilyen mechanizmusnak, ami meggátolja a sejten belüli polimerizációt. Nagyon fontos, hogy ezek a komponensek ne a sejten belül polimerizálódjanak, hanem a megfelelő helyen, ahol betöltik funkciójukat. Feltételezések szerint a polimerizációt a rendezetlen terminális régiók akadályozzák meg. Mivel a rendezetlen terminális régiójú monomer molekulák nem képesek egymáshoz kapcsolódni, nem indul meg a polimerizáció. Publikációk alapján feltételezhetjük, hogy a sejten belüli polimerizáció megakadályozásában a segítő vagy chaperon fehérjék is közreműködnek, melyek a monomer állapotú axiális fehérjék rendezetlen terminális régióihoz kapcsolódnak és megakadályozzák a fehérje monomerek polimerizációját [3]. Ilyen chaperon a FliS fehérje, amely a flagellumspecifikus exportrendszer részeként a flagellin alegységekhez kötődik, és meggátolja azok sejten belüli összekapcsolódását [6].
A FliS 135 aminosavból álló 14,7 kDa molekulatömegű fehérjéről [21] a kutatások egyértelműen kiderítették, hogy a flagellin fehérjék specifikus transzportját végzi [22]. A FliS azáltal, hogy a flagellinmolekula terminális régióihoz kötődik, meg tudja akadályozni a flagellin alegységek degradációját, aggregációját és polimerizációját a citoplazmában.
Gélszűrő kromatográfiával vizsgálva azt tapasztalták, hogy a FliS az oszlopról 14,7 kDa helyett körülbelül 30 kDa-nak megfelelő helyen jött le, ebből azt a következtetést vonták le, hogy a FliS stabil dimereket képez. Szintén ezzel a módszerrel kimutatták, hogy ez a dimer képes kötődni a flagellin monomerhez [22].
A flagellinmulekula különböző mértékű limitált proteolízisével végzett kísérletek eredményei szerint a flagellin C-terminális régiójának (rendezetlen C-terminális régió és még 40 aminosav) fontos szerepe van a FliS-hez való kötődésben [23].
2.3. A flagellinmolekula szerkezete
A flagellinmolekula polimerizációs tulajdonságait vizsgálva többen megfigyelték, hogy a filamentum kialakulása során a flagellinmolekula nagymértékű konformációs átrendeződésen megy keresztül. Ennek szerkezeti okát kutatva limitált proteolízissel és spektroszkópiai mérésekkel kimutatták, hogy a Salmonella typhimuriumból származó flagellin 494 aminosavból álló, 52 kDa molekulatömegű fehérje terminális régiói, 66 N- terminális és 44 C-terminális aminosavnyi rész, oldatban nem rendelkeznek kompakt, stabilis térszerkezettel [1]. Ezek a részek proteolitikus enzimekkel nagyon gyorsan leemészthetők, ami azt mutatja, hogy ezek a peptidláncok az emésztő enzimek számára szabadon hozzáférhetőek. A terminális régiók eltávolítása után egy viszonylag stabil, kb. 40 kDa molekulatömegű fragmentum (F40) marad vissza, amely igen lassan tovább emészthető egy 27 kDa-os fragmentummá (F27). Az F27 fragmentumról kimutatták, hogy az F40 fragmentumhoz képest 112 N-terminális és 28 C terminális aminosav hiányzik róla [6].
COOH NH2
(67) (179) (418) (446)
F27 F40 2.5. ábra
Az F40 és F27 fragmentumok elhelyezkedése a flagellinmolekulában [6]
Az F40 és F27 fragmentumok hődenaturációja reverzibilis, ami azt mutatja, hogy önálló térszerkezet kialakítására képes egységek (domének) alkotják őket. Kalorimetriás olvadásgörbékből megállapították, hogy a flagellin molekula magja 3 doménből épül fel. Az F27 fragmentumnak megfelelő régió két erős kölcsönhatásban álló doménből áll (G1, G2),
míg a harmadik (G3) domén nem folytonos, a 66-177 és a 423-450 szakaszok együttesen alkotják (2.5. ábra). Másodlagosszerkezet-jóslással és CD-spektrumok analízisével kimutatták, hogy az F27 fragmentum doménjei β-szerkezetűek, míg a G3 domén helikális és β-szerkezetet egyaránt tartalmaz. A G3 domén helikális szerkezete meghatározó szerepet játszik a filamentumok struktúrájának kialakításában [7].
A terminális régiókról 1H-NMR-spektroszkópiás vizsgálatokkal kimutatták, hogy gyors, termikus fluktuációkat végeznek. Pásztázó mikrokalorimetriás eredmények szerint ezen régiók belső stabilitása elhanyagolható [4]. A terminális régiók azonban mégsem teljesen rendezetlenek, CD-spektroszkópiás mérésekkel igazolták, hogy nagy mennyiségű a- helikális szerkezeti elemeket tartalmaznak, amit a másodlagosszerkezet-jóslások is megerősítettek [7].
2.6. ábra
A flagellinmolekula szerkezeti egységei [7]
A flagellin molekula rendezetlen terminális régiói a molekula legkonzervatívabb részét képezik, ami a polimerizációban játszott fontos szerepükre utal. Ennek tisztázása nagy specifitású enzimekkel végzett irányított emésztéssel történt. Az oldatbeli rendezetlenségüknél fogva a terminális régiók enyhe emésztési körülmények között, nagy specifitású proteázokkal tervezett módon csonkíthatók. Az Endoproteináz Lys-C-nek (ELC) és az Endoproteináz Glu-C-nek (V8) egyaránt két hasítási helye található a rendezetlen terminális régiókban. Az ELC enzim az N terminálison hasít a 19. és az 58. helyen álló lizin után, így létrejöhet egy 49 (F49) és egy 46 kDa-os (F46) fragmentum. A V8 enzim első hasítóhelye a C-terminálison a 461. helyen álló, a második az N-terminálison a 29. helyen álló glutaminsav után található. V8 enzimmel történő limitált emésztés során egy 48 (F48) és egy 44 kDa-os (F44) fragmentum kapható. Tripszin segítségével a rendezetlen terminális
régiók teljesen eltávolíthatók, így a 40 kDa-os (F40) fragmentum, a flagellinmolekula kompakt stabil magja állítható elő. Az így kapott különböző méretű terminálisan csonkított fragmentumok FPLC ioncserélő kromatográfiás eljárással tisztíthatók [8].
A fragmentumok polimerizációs tulajdonságait vizsgálva azt tapasztalták, hogy többségük képes volt ammónium-szulfát jelenlétében filamentumokat létrehozni, ezek stabilitása azonban a hiányzó szegmensek méretétől függően kisebb volt, mint az eredeti flagellinből felépülő filamentumoké. A teljesen csonkított F40 fragmentum semmilyen körülmények között sem volt képes filamentumot alkotni. A csonkított fragmentumokból előállított filamentumok gyakorlatilag elvesztették polimorfikus képességüket, sem a pH, sem az ionerősség változtatásával nem sikerült polimorfikus átmeneteket előidézni a szerkezetükben. A fragmentumok polimerizációs viselkedése szempontjából hasonlónak bizonyult, hogy a C-terminális vagy az N-terminális régiók tartalmazzák a csonkítást. Ez arra utal, hogy a két régió együtt vesz részt a filamentum felépülésében. Ezek a kísérletek azt mutatták, hogy a terminális régiók jelentős része nem szükséges a filamentáris szerkezet kialakításához, de meghatározó szerepük van a stabilizálásban, az önszerveződésben és a polimorfikus képességben [8].
A filamentumok röntgendiffrakciós és elektronmikroszkópos szerkezetanalízisével kimutták, miként építi fel a flagellinmolekula a filamentum szerkezetét. A filamentumok magját két koncentrikus gyűrű alakú struktúra alkotja. A különböző baktériumfajokból származó flagellinek aminosavsorrendjének összehasonlító elemzése azt mutatta, hogy a molekula kb. 180 N-terminális és kb. 100 C-terminális aminosavnyi része a legkonzerválódottabb. A csonkított fragmentumokból képzett filamentumok szerkezetvizsgálata azt mutatta, hogy a monomer állapotban rendezetlen terminális régiók egymással erős kölcsönhatásban elsősorban a belső gyűrű felépítésében vesznek részt. Ez a kölcsönhatás alapvető fontosságú a filamentumok polimorfikus tulajdonságai szempontjából.
Már néhány terminális aminosav hiánya is a filamentum belső magjának rendezetlenségét és a polimorfikus tulajdonság elvesztését okozza [9].
A külső gyűrűt elsősorban a G3 domént alkotó konzerválódott régiók építik fel, de a rendezetlen régió N-terminális 30-65 szegmense is fontos szerepet játszik. A filamentumok külső részét az F27-es fragmentum G1 és G2 doménjei építik fel, de ezek a régiók alig járulnak hozzá a filamentumok stabilizálásához [10].
2.7. ábra
A filamentum szerkezete elektronmikroszkópos és röntgendiffrakciós mérések alapján [11]
A mindkét terminálisán erősen csonkított 41 kDa-os (F41) fragmentum kristályosítása és röntgendiffrakciós vizsgálata révén meghatározták a filamentum szerkezetét [12]. A filamentumok külső gyűrűje tehát már atomi precizitással ismert, belső gyűrűjének felépüléséről azonban csak sejtések vannak. A feltételezések szerint a flagelláris filamentumok képződése során az axiálisan szomszédos egységek között az α-hélix képző N- és C-terminális régiók egymással kölcsönhatásba lépve, együtt képeznek helikális kötegeket. A helikális kötegek egymásba fonódó láncolata eredményezi a filamentum szerkezetének kialakulását úgy, hogy a filamentum szabad végén lévő molekula N-terminális végéhez kapcsolódik a következő flagellinmolekula C-terminális része [13].
3. Alkalmazott módszerek, felhasznált anyagok
3.1. Fotometria
A spektrofotometriás analízis egyike a leggyakrabban használt analitikai eljárásoknak.
A módszer igen alkalmas kismennyiségű anyag gyors, egyszerű, rutinszerű mérésére. A mérés akkor alkalmazható, ha a vizsgált anyagnak a színkép valamelyik pontján abszorpciós maximuma van.
A spektrofotometriás mennyiségi mérések az oldatok fényelnyelésére vonatkozó Lambert-Beer-törvényen alapulnak. A fényelnyelés nagyságából az abszorbeáló komponens koncentrációjára lehet következtetni.
Ha a beeső fény I0 intenzitása a közeg l vastagságú rétegén áthaladva I-re csökken, akkor a Lambert-Beer-törvény értelmében:
= log
= 0 l
I
E I β ⋅ ,
ahol β a közeg Bunsen-féle extinkciós koefficiense, amely az anyag minőségétől és az alkalmazott fény hullámhosszától függ. A törvény kizárólag csak adott hullámhosszú monokromatikus fény esetén érvényes. A
I I0
log kifejezést extinkciónak (E) vagy abszorbanciának (A) nevezzük. Az abszorbeáló anyagok oldatának extinkciós koefficiense annál a hullámhossznál, amelynél az oldószernek nincs abszorbciója, a Lambert-Beer-törvény szerint arányos az oldat koncentrációjával, ha az oldott anyag a hígítás alkalmával nem megy át molekuláris változáson:
c
=ε⋅
β ,
ahol ε az oldott anyag koncentrációjától független állandó, a moláris abszorptivitás (moláris extinkciós koefficiens).
A moláris extinkciós koefficiens megadja, hogy adott hullámhosszon 1 cm-es rétegvastagság esetén, 1 mol/1-es oldatnak mekkora extinkció felel meg. Értéke az adott anyagra jellemző, de függ az oldószertől és a hőmérséklettől.
A fenti összefüggések alapján tehát a fényabszorpció mértékéből a koncentráció kiszámítható:
= log
= 0 c l
I
E I ε⋅ ⋅
Fehérjék esetén ez a módszer azért alkalmazható, mert a fehérjéket felépítő aminosavak közül az aromás aminosavak (tirozin-Tyr, triptofán-Trp, fenilalanin-Phe), és kisebb mértékben a cisztein (Cys) UV tartományban jelentős elnyelést mutatnak (3.1. ábra). Mivel nem kell a méréshez a fehérjéket kémiai reakcióba vinni, ezt az eljárást használják fehérjék kromatográfiás elválasztásának folyamatos követésére is. Mivel az egyes fehérjék különböző
arányban tartalmaznak aromás aminosavakat, inkább csak ugyanazon fehérje különböző oldatainak összevetésére alkalmas, nem abszolút módszer.
250 270 290 310 330 350
λ (nm) A
3.1 ábra
Aromás aminosavak abszorpciós spektruma
Triptofán (kék), tirozin (lila), fenilalanin (sárga) abszorpciós spektruma [27]
A spektrofotométer abszorbancia mérésére alkalmas műszer, amely egy általunk meghatározott hullámhosszúságú fényt állít elő, a fény keresztülhalad a mintán és megméri az átjutó fénysugár intenzitását.
A rácsos monokromátor feladata az említett fényforrások folytonos spektrumából egy adott hullámhosszúságú fény kiválasztása. A monokromátorból kilépő fény nem szigorúan monokromatikus, de egy viszonylag szűk hullámhossz tartománnyal jellemezhető. A monokromátorban a be- és kilépő fény réseken halad keresztül, melyek szélessége meghatározza a sávszélességet. Minél szélesebb a rés, annál szélesebb a kilépő fény hullámhossz tartománya. A rés szűkítésével a sávszélesség ugyan csökkenthető, de ezzel a fényintenzitás is csökken, tehát a rés megfelelő beállításával optimumot keresünk a spektrális feloldás és a kellő fényintenzitás között [24].
Az általam használt készülék (Helios-Unicam) egysugaras, azaz egy küvetta befogadására alkalmas. A küvetta minősége és állapota a mérés kritikus tényezője. A küvetta készülhet műanyagból, üvegből vagy kvarcból. A műanyag és üveg küvetták olcsóbbak, de az ultraibolya tartományban a nagy elnyelésük miatt nem használhatók. Mivel a fehérjék abszorpcióját 280 nm-nél mértem, ezért ezekhez a mérésekhez kvarcküvettát használtam. A fehérjeminta mérése előtt a puffer oldattal a készüléket nullázni kell, ettől kezdve a minta
abszorbanciájából automatikusan kivonja a referencia oldat abszorbanciáját. A fényforrás az UV tartományban deutérium lámpa, a látható tartományban pedig wolframszálas izzó, mérés előtt beállítható, hogy melyik hullámhossznál történjen a lámpacsere.
A kijelzőegységen grafikus formában megjelenő eredményből kurzor segítségével leolvasható a minta elnyelése egy hullámhosszon. A fehérjék koncentrációját a 280 nm-nél mért abszorpcióból számoltam. Az abszorpcióból a moláris extinkciós koefficiens ismeretében a fehérjék koncentrációja meghatározható. A fehérjék extinkciós koefficiensét az irodalomból ismerhetjük. A gyakorlatban sokszor az 1 %-os oldat (1 %= 1g/100 ml=10 mg/ml) extinkciós koefficiensét szokás megadni 280 nm-nél. Ebből az
(mg/ml)
10 fehérje
% 1 280
A c
= ε ⋅
képlet alapján kapjuk az oldat fehérje koncentrációját. Flagellin esetén az ε1280% = 3,6, míg az F40-é 4,3 [8]. A többi fragmentumra ebből a két értékből a következő összefüggéssel számíthatjuk ki az ε1280% értékeket:
( )
40
% 40 1
40 , 280
% 1
, 280
% 1
40 , 280
% 1
,
280 M M
M M
F fr F
F F
fr −
⋅ −
− +
=ε ε ε
ε
ahol Mfr a kérdéses fragmentum, MF a flagellin, M40 az F40 molekula tömege [8].
Abban az esetben ha a fehérje extinkciós koefficiense nem ismert, az aminosav összetételéből közelítő értéket kaphatunk az alábbi képlettel [32]:
125 1490
5500+ ⋅ + ⋅
⋅
=nTrp nTyr nCys
ε ,
ahol n a fehérjében található aminosavak számát jelenti.
3.2. Oszlopkromatográfiás technikák
A szennyező fehérjék többségétől megtisztított, de még nem kellően homogén preparátumot általában valamilyen oszlopkromatográfiás módszer segítségével tisztítottam tovább.
3.2.1. Gélszűrés
A gélszűrés molekulák méret és alak szerinti szeparálására alkalmas módszer. Gélszűrő kromatográfiás oszlop töltete egy finom szemcsés, 10-300 µm átmérőjű gömbökből álló porózus, hidrofil gél. Ennek hatására a kromatográfiás oszlopban két különböző folyadéktér alakul ki. Az egyik a gélszemcséken kívüli szabadon mozgó mobil fázis, a másik a gélszemcsék belsejében levő korlátozott mozgású folyadéktér. Az oldatba lévő molekulák mozgása egyrészt függ a mobil fázis áramlási sebességétől, másrészt a diffúziótól, ami lehetővé teszi, hogy az oldott molekulák, ha méretük engedi, átjárják a gélszemcsék belsejét.
Egy molekulakeverék szétválasztása azon alapul, hogy egy adott mérettartománnyal rendelkező gél esetén egyes molekulák méretüknél fogva nem férnek be a gélszemcsék belsejébe, ezek számára csak a mobil fázis áll rendelkezésre, ezért gyorsan keresztül folynak
gélszemcsék belsejében levő folyadéktérben töltenek, ezért lassabban jutnak keresztül a kromatográfiás oszlopon [24].
3.2.2. Ioncserés kromatográfia
A töltéssel rendelkező molekulák elválasztására az egyik leghatékonyabb módszer az ioncserés kromatográfia. Fehérjék szeparálására térhálósított dextrán gél alapú (Sephadex) ioncserélő tölteteket használtam. Anion-cserélők esetében a hordozóhoz kapcsolt ionos csoport rendszerint dietil-aminoetil (DEAE származékok), vagy kvaterner aminoetil csoport (QAE származékok). Ez utóbbi erősebben bázikus. Kationcserés kromatográfiára karboximetil (CM), foszfoetil (PE), illetve szulfopropil (SP) csoportokat tartalmazó ioncserélőket használnak.
Az ioncserés kromatográfiához használt oszloptöltetek egy oldhatatlan hordozó (mátrix) felszínéhez kovalens kötéssel kötött töltött csoportokat tartalmaznak. A vizes oldatban szuszpendált mátrix töltött csoportjai körül az ellentétes töltésű ionok ionfelhőt képeznek. Az ionfelhőben az ionok reverzibilisen kicserélődhetnek, a mátrix jellegének és tulajdonságainak megváltoztatása nélkül.
A mátrix töltött csoportjai lehetnek pozitív vagy negatív töltésűek. A pozitív töltésű mátrix az oldatból negatív töltésű ionokat, anionokat köt, ezért anioncserélőnek nevezzük. A kationcserélő mátrixok töltése negatív.
A fehérjék töltési sajátossággal bírnak, jellemző értékük a nettó töltés. Ezt úgy kapjuk, hogy a pozitív töltések számából levonjuk a negatív töltések számát. A nettó töltés mellett lényeges a fehérje térfogatán belüli töltéseloszlása is, ami befolyásolhatja a kötődést és az elúciót is. A fehérjét töltését tekintve fontos az izoelektromos pont (pI), ami az a pH érték, amelynél a molekula nettó töltése zérus. Az izoelektromos pontnál savanyúbb oldatban a fehérje pozitív töltésű lesz, lúgosabb pufferben pedig negatív.
A legtöbb ioncserés kísérletet öt fő fázisra lehet osztani (3.2 ábra). Az első és az ötödik fázis az ioncserélő oszlopnak az ún. induló pufferrel történő egyensúlyba hozása, a kísérlet kezdeti körülményeinek (pH és ionerő) beállítása. Az ioncserélő töltött csoportjaihoz ebben a fázisban könnyen kicserélhető egyszerű ionok (klorid vagy nátrium) kapcsolódnak.
A második fázis a minta felvitele és reverzibilis megkötése az oszlopon. Amennyiben a mintában található szennyező anyagok egy része nem kötődik az oszlophoz, ezeket az induló pufferrel történő mosással eltávolítjuk.
A harmadik és negyedik fázis az elúció, a kötött molekulák deszorpciója, amit az eluáló puffer összetételének megváltoztatásával érünk el. Az elúció legegyszerűbb formája az ionerő, azaz a jelenlévő ellenionok koncentrációjának növelése. A deszorpció másik módja az eluáló puffer pH-jának változtatása. A leghatékonyabb módszer az ionerő illetve a pH folyamatos változtatása, az ún. gradiens elúció. Ennek során az oszlopról először a kisebb nettó töltésű, gyengébben kötődő molekulák válnak le, majd a nagyobb nettó töltésűek [24].
+ +
++ ++
+ +
+ +
+ +++ +
+ + +
+++ +
+
+ +++ +
+ +
ellenionok az induló pufferben szétválasztandó ionok
ionok a gradiensben
3.2. ábra
Az ioncserés kromatográfia fázisai (só gradiens elúció) 3.2.3. Affinitási kromatográfia
Az affinitás kromatográfia a fehérjék valamilyen biológiai specifitását használja ki. A módszer alapja az, hogy kovalens kötéssel szilárd hordozóhoz kötnek olyan molekulákat, melyekkel az izolálni kívánt fehérje specifikus kölcsönhatásba lép − enzim esetén ez a szubsztrát vagy egy kompetitív inhibitor, receptor esetében pedig az effektor. A szilárd hordozó lehet a gélszűréshez felhasznált bármely oszloptöltet, leggyakrabban a Sepharose gél [24].
Munkám során az IMAC módszert használtam, ami nem olyan szelektív, mint a többi affinitás kromatográfiás módszer. A fém kelátképző csoport (általában imido-diacetát) rögzítve van az állófázishoz, és ehhez koordinálódik a fémion (Cu2+, Zn2+, Ni2+, Co2+, vagy Fe2+) úgy, hogy egy vagy több koordinációs hely alakul ki a fehérje számára. Az imido- diacetát a fémionokat három helyen köti meg, a többi koordinációs hely szabad marad az izolálandó molekula számára [25].
Néhány, a fehérje felszínén elhelyezkedő aminosav, különösen a hisztidin, specifikusan kötődik ezekhez a szabad koordinációs helyekhez. Így a hisztidinek számától függően elválaszthatók az egyes fehérje molekulák. A fehérjében genetikailag kódolt „His-Tag” (több hisztidint tartalmazó peptidlánc), alkalmas arra, hogy ez alapján affinitás kromatográfiával tisztítani tudjuk. Az állófázisra kötött fémként Ni2+ ionokat alkalmaztam. Az IMAC módszer esetén gradiens elúciót alkalmazunk a molekulák elválasztására. Én a kísérletekben az imidazol koncentráció gradienst alkalmaztam.
1 2 3 4 5
3.3. Dialízis
Gyakran van szükség arra, hogy a fehérje oldatok ionösszetételét megváltoztassuk, illetve a fehérje mellől kis molekulasúlyú anyagokat eltávolítsunk. Ez a feladat megoldható gélszűréssel is, de nagyobb térfogatok esetén vagy ha fontos, hogy a fehérje oldat térfogata ne növekedjen jelentősen, a dialízis a legegyszerűbb módszer. A fehérjét, vagy más makromolekula oldatát féligáteresztő hártyából (módosított cellulóz) készült, két végén lezárt csőbe (dialízis zacskó) helyezzük, majd a csövet nagy térfogatú puffer oldatba merítjük. A kis molekulák szabadon áramlanak a dializáló membrán pórusain keresztül, míg a makromolekulák a csőben maradnak. A puffer oldat keverésével az egyensúly beállásához szükséges idő lerövidíthető [24].
A dialízishez hegesztetlen cellulóz dialízis csövet (Sigma) használtam, amit használat előtt 2% NaHCO3 2mM EDTA oldatban, majd desztillált vízben főztem. A csövek egyik végének lezárását követően betöltöttem a fehérje oldatokat, majd a felső végét is zártam. A puffert általában 12 óra elteltével egyszer cseréltem egy minta dialízise során.
3.4. A poliakrilamid gél elektroforézis (PAGE)
A különböző fehérjék egy adott pH-n más-más töltéssel rendelkeznek. Ha vizes oldatban elektromos erőtér alkalmazásával a fehérjéket vándorlásra késztetjük, az egyes fehérjék eltérő relatív töltésük (egységnyi molekulatömegre eső töltések száma) miatt különböző sebességgel mozognak, így ezen különbség alapján egymástól elválaszthatók.
Fehérjék elektroforetikus elválasztására a leginkább elterjedt, rendkívül hatékony módszer a poliakrilamid gélben végzett elektroforézis. Az akrilamid vizes oldatban, megfelelő katalizátorok és iniciátorok jelenlétében gyökös polimerizációra képes, és a reakció során nagymólsúlyú lineáris polimer, ún. poliakrilamid keletkezik. Ez utóbbi vizes oldata rendkívül nagy viszkozitású. Ha megfelelő keresztkötő ágenst, N,N-metilén-bisz-akrilamidot is alkalmazunk, a hosszú poliakrilamid láncok között "hidak" képződnek, és térhálós szerkezetű gél jön létre. Az elektroforézis során a fehérjéket ebben a gélben vándoroltatjuk.
Az eljárás különlegesen nagy felbontóképességgel rendelkezik. Ennek az az oka, hogy a relatív töltések különbségén alapuló szeparálással egyidőben a gélben a molekulák méret és alak szerint is elválnak egymástól, a gél mintegy molekulaszűrőként viselkedik. Ezt a molekulaszűrő hatást a gél átlagos pórusmérete szabja meg, ami viszont az akrilamid monomer koncentrációjának és a térhálósító metilén-bisz-akrilamid százalékos arányának alkalmas megválasztásával tág határok között változtatható. A gél mechanikus tulajdonságai kb. 4-20% akrilamid koncentráció-tartományban kedvezőek. A keresztkötő metilén-bisz- akrilamid mennyisége az alkalmazott akrilamid monomernek rendszerint 1-3%-a. A poliakrilamid számos előnyös tulajdonsággal rendelkezik. Erősen hidrofil, ugyanakkor nem tartalmaz töltéssel rendelkező csoportokat, melyek az elektroforetikus szeparálást károsan
specifikus kölcsönhatásban, nem zavarja a fehérjék detektálására szolgáló festési reakciókat, kompatibilis a legtöbb általánosan használt pufferrendszerrel.
A poliakrilamid gél úgy készül, hogy a megfelelő koncentrációjú akrilamid/metilén- bisz-akrilamid oldathoz megfelelő pH-jú pufferoldatot keverünk, majd a gyökös polimerizációt egy alkalmas katalizátor és iniciátor hozzáadásával indítjuk el. A katalizátor általában peroxidiszulfát, mely vizes közegben spontán bomlik, ezáltal szabad gyökök keletkeznek. Ezek a szabad gyökök azonban önmagukban nem képesek az akrilamid molekula kettős kötését felhasítva elindítani a gyökös polimerizációt, viszont gerjesztik az iniciátor molekulákat. Ez utóbbiakból ekkor szabad gyökök alakulnak ki, melyek már kiváltják a polimerizációt. A használt iniciátor a tetrametil-etilén-diamin (TEMED). A katalizátor és az iniciátor koncentrációját úgy választjuk meg, hogy a polimerizáció, így a gélesedés 10-30 perc alatt teljes mértékben végbemenjen. Az iniciátorral összekevert akrilamid / metilén-bisz-akrilamid oldatot két, egymással párhuzamos üveglap közé töltjük.
Így egy gél lemez alakul ki, amelyben egyidejűleg, egymás mellett, azonos körülmények között számos mintát futtathatunk, melyek ily módon egymással könnyen összehasonlíthatók.
Fehérjék esetén rendszerint az izoelektromos pontnál magasabb pH-n dolgozunk. Ekkor a fehérjék negatív töltésűek, így az anód felé vándorolnak. A puffer szerepe nemcsak abban áll, hogy az elektroforézis ideje alatt a pH-t állandó értéken tartja, hanem a puffer ionjai vezetik az áramot is. Normális esetben a fehérjeionok az áram vezetésében csak elhanyagolható mértékben vesznek részt.
A futtató (más néven szeparáló) gél fölé egy ún. koncentráló gélt polimerizálunk. Ennek akrilamid koncentrációja a futtató gélénél jóval alacsonyabb, olyannyira, hogy itt a molekulaszűrő hatás még nem érvényesül. Tank pufferként olyan pufferrendszert alkalmaznak, melynek anion komponense egy gyenge sav savmaradéka, pl. glicinát anion. A tankpufferben a pH 8.3. A kis térfogatú fehérje mintát a koncentráló gél felszínére rétegezzük.
Feszültség hatására a fehérje ionok és a tank puffer anionjai belépnek a koncentráló gélbe. A koncentráló gélben a pH 6.5-6.8 között van. Ilyen pH-n a glicin ikerionos állapotban van, elektroforetikus mobilitása lecsökken, így lokálisan csökken a töltéssel rendelkező molekulák koncentrációja. Ez helyileg megnöveli az elektromos ellenállást. Minthogy az elektromos körben az áramerősségnek állandónak kell lenni, Ohm törvényének megfelelően az ellenállással arányosan megnő a térerő is, ezért a fehérjék vándorlása felgyorsul, míg el nem érik az ionokban gazdag klorid ion frontot. Minthogy a klorid ion frontban az ellenállás, és így a térerő kicsi, a fehérjék sebessége csökken, és a front mögött mintegy összetorlódva igen vékony sávban vándorolnak a futtató gél felszínéig.
A futtató, vagy más néven szeparáló gélben a helyzet megváltozik. Mivel a szeparáló gél pH-ja 8.8-9.0 között van, a glicin össztöltése itt negatív, ezért mobilitása megnövekedik.
Így a töltéshiányból eredő koncentráló hatás megszűnik, a fehérjék a továbbiakban különböző
már úgy választjuk meg, hogy a molekulaszűrő hatás is érvényesüljön, és a gél az elválasztani kívánt fehérjék mérettartományában a lehető legnagyobb mértékben szeparáljon.
Az elektroforetikus eljárások többségénél a futtatás során jelzőfestéket alkalmazunk, amit a mintába keverünk. Ez a kis molekulatömegű, negatív töltésű festék gyorsabban vándorol a gélben mint a fehérjék, és mintegy láthatóvá teszi a futási frontot, így egyértelművé válik, mikor tekinthető az elválasztás befejezettnek.
A poliakrilamid gélelektroforézis egyik leggyakrabban használt változata az SDS (Na- dodecil-szulfát) poliakrilamid gélelektroforézis. A fehérjeoldathoz hozzáadott SDS elhasítja a hidrogén hidakat, semlegesíti a fellépő hidrofób kölcsönhatásokat, és végeredményben kitekeri a fehérjét. A polipeptid lánchoz kötődő SDS hatására a fehérje molekuláknak az aminosavak számával arányos nagy negatív töltésük lesz.
A futtatás után a fehérjéket a gélben valahogy láthatóvá kell tennünk. Számos olyan vegyület van, mely nagy hatékonysággal kötődik fehérjékhez. Ezek használatakor célunk az, hogy lehetőleg az összes fehérjét kimutassuk a gélben. Én a Coomassie Brilliant Blue-t használtam, segítségével a gél keresztmetszetétől és az adott fehérje speciális festődési tulajdonságától függően akár már 0.1μg fehérje is jól detektálható.
Ha a mintánkat ismert molekulatömegű fehérjékkel azonos gélben futtatjuk, a standard fehérjék futása alapján a mintában lévő fehérjék molekulatömege leolvasható. Az SDS poliakrilamid gél elektroforézis a leginkább elfogadott módszer annak eldöntésére, hogy egy fehérjepreparátum homogén-e [24].
Az alábbi táblázat azt mutatja, hogy különböző akrilamid koncentrációjú gélek esetén milyen mérettartományban teljesül a relatív mobilitás és a molekulatömeg logaritmusa között előbb említett összefüggés.
Akrilamid koncentráció (%)
Az elválasztás tartománya (kDa)
15 12-43 10 16-68 7.5 36-94 5.0 57-212
2.1. táblázat
Mivel a flagellin molekulatömege 52 kDa, ezért munkám során a flagellin és fragmentumainak tisztaságának ellenőrzésére 10 %-os SDS poliakrilamid gélt használtam. Az SDS gélelektroforézis megvalósításához felhasznált vegyszerek: APS [ammonium-persulfate]
(Biorad), mintapuffer (Biorad), ecetsav és etanol (Reanal), Fixing solution (Sigma), Coomassie Blue R250 festék (Merck), kis molekulatömegű standardek (Biorad, Sigma).
3.5. Izotermális titrációs kaloriméter (ITC)
Az izotermális titrációs kaloriméter igen érzékeny eszköz, amivel két molekula kölcsönhatásakor felszabaduló vagy elnyelődő hőt mérhetünk, és ebből következtethetünk különböző számunkra fontos paraméterekre, mint a kötési állandó (K), a kötési sztöchiometria (n), a kémiai reakció entalpiaváltozása (ΔH). Az ITC mérés előnye, hogy egy valódi oldatban alkalmazható módszer. A reagáló komponenseken nem szükséges változásokat létrehoznunk, vagy jelölő molekulákat hozzákötnünk, mint pl. fluoriméteres vizsgálatok esetében.
Gyorsabb, mint más analitikai vizsgálatok, pl. ultracentrifugás mérések, amelyek akár napokig is tarthatnak, míg egy ITC-s mérés legfeljebb néhány órát vesz igénybe. Mérhetünk vele fehérje-fehérje vagy fehérje-ligandum kölcsönhatást.
Munkám során Microcal VP-ITC (Microcal Inc.) típusú készüléket használtam, ami két fő részből áll: egy termosztált, adiabatikus cellapárból, és egy injektor egységből, amellyel adott mennyiségekben adagolhatjuk a tűben lévő egyik komponenst a cellában lévő másik komponenshez. (3.3. ábra)
referencia cella belső szigetelés végállás érzékelő
végállás érzékelő
külső szigetelés keverés dugattyú adagoló menetes orsó
minta cella
3.3. ábra
Izotermális titrációs mikrokaloriméter
A mintát tartalmazó cella mellett található a referencia cella, amely a referencia oldatként használt desztillált vizet tartalmazza. A készülék a két cella között a titrálás eredményeként kialakuló hőmérsékletkülönbség megszüntetéséhez szükséges fűtési teljesítményt méri.
A továbbiakban feltételezzük, hogy az M makromolekula a cellában lévő oldatban az első titrálás előtt Mt0 koncentrációban van, és a hozzá kötődő X ligandum koncentrációja a cellában 0. A munkatérfogata a cellának V0, a i-edik titrálás térfogata ΔVi, a teljes térfogat, amit egy adott pontban a mintához hozzáadtunk ΔV, egyenlő az egyes ΔVi térfogatok összegével. A kísérlet elején a cella és a vékony betöltési cső is tartalmaz makromolekulákat de kalorimetriai szempontból csak a V0 térfogat számít. A makromolekula koncentrációja a cellában a titrálások során hozzáadott folyadék térfogata miatt csökken. Az átlagos makromolekula koncentráció a ΔV térfogatban a számtani közepe lesz a kezdeti Mt0
koncentrációnak és az aktuális Mt koncentrációnak. A tömegmegmaradás miatt:
V M M V
M V
Mt = t + ( t + t )Δ 2
1 0
0 0
0 ,
ebből Mt kifejezve kapjuk:
⎟⎟
⎟⎟
⎠
⎞
⎜⎜
⎜⎜
⎝
⎛ + Δ
−Δ
=
0 0 0
1 2 1 2
V V V
V M
Mt t .
Hasonló gondolatmenettel megkaphatjuk az aktuális ligandkoncentrációt is:
⎟⎟⎠
⎜⎜ ⎞
⎝
⎛ − Δ
=
0 0
1 2 V X V
Xt t .
Abban az esetben, ha a makromolekulánk a ligandra nézve n db azonos típusú kötőhelyet tartalmaz, ha K a kötési állandó, Θ az X ligand által elfoglalt kötőhelyek aránya akkor:
[ ]
XK (1−Θ)
= Θ
[ ]
tt X n M
X = + Θ .
A két egyenletből kapjuk:
1 0
2 1 ⎥+ =
⎦
⎢ ⎤
⎣
⎡ + +
Θ
− Θ
t t t
t t
nM X nKM
nM
X . (1)
A teljes Q hőmennyiség a V0 térfogatban
Q = nΘ MtΔHV0, (2)
Az (1) másodfokú egyenletet megoldva Θ-ra, és a megoldást behelyettesítve (2)-be kapjuk:
⎥⎥
⎦
⎤
⎢⎢
⎣
⎡ ⎟⎟ −
⎠
⎜⎜ ⎞
⎝
⎛ + +
− +
Δ +
=
t t t
t t t
t t t
nM X nKM
nM X nKM
nM X HV
Q nM 1 4
1 1 2 1
2
0 .
A fenti képlettel Q értékét K, n és ΔH ismeretében ki lehet számolni minden titrálás után. Az egyes titrálások során kapott csúcs alatti területek egyenlők lesznek a titrálások során mért teljes hőfelszabadulással vagy hőelnyeléssel. A mérési eredményekhez legjobban illeszkedő elméleti görbe paramétereit iterációs módszerrel határozza meg a kaloriméterhez mellékelt gyári szoftver.
Ha a makromolekulánk két különböző kötőhelye van a ligandra nézve, akkor az előbbi jelöléseket használva:
[ ]
X K (1 1)1
1 −Θ
= Θ K
[ ]
X) 1
( 2
2
2 −Θ
= Θ
[ ]
+(
1Θ1+ 2Θ2)
= X M n n
Xt t
A első két egyenletbőlΘ-kat kifejezve és a másodikba behelyettesítve kapjuk:
[ ] [ ]
[ ] [ ]
[ ]
222 1
1 1
1
1 X K
K X M n K X
K X M X n
Xt t t
+ + + +
= (3)
Átrendezve[X]-re harmadfokú egyenletet kapunk:
[ ]
X + p[ ]
X +q[ ]
X +r= 3 2
0 (4)
ahol
t
t X
M n K n
p= K1 + 1 +( + ) −
2 1 2 1
2 1 2
1 2
2 1
1 1 1 1
K X K
K M K
K n K
q n t ⎟⎟⎠ t +
⎜⎜ ⎞
⎝
⎛ +
⎟⎟ −
⎠
⎜⎜ ⎞
⎝
⎛ +
=
2 1K K r −Xt
=
A teljes Q hőmennyiség egy injektálás után most a V0 térfogatban
Q = MtV0(n1Θ1 ΔH1+ n2Θ2 ΔH2) (5)
A titrációs görbe illesztésénél (3),(4) és (5) egyenletek numerikus megoldásával ebben az esetben 6 paraméterünk lesz n1, n2, K1, K2, ΔH1 és ΔH2
A titrálásokhoz tartozó hőmennyiségeket ábrázolva a ligandum és a fehérje moláris arányának a függvényében, egy kötődési izotermát kapunk, amely a kölcsönhatásra lesz
alakját. Kritikus paraméter, amely meghatározza a kötési izoterma alakját, a c érték, amely függ a K kötési állandótól, a cellában lévő fehérje teljes koncentrációtól (Mt), és a sztöchiometriai paramétertől (n).
c = KMtn
Ha c értéke nagyon nagy, az izoterma nagy meredekségű lesz, és ΔH, valamint n pontosan meghatározhatók, de K nem. c túl alacsony értékénél pedig gyakorlatilag ellaposodik a görbe, ilyenkor ΔH, valamint n meghatározása lesz pontatlan. A gyakorlatban meg kell találni egy optimumot, ezért olyan makromolekula koncentrációt kell alkalmaznunk, amelynél a c konstans értéke 5 és 500 közé esik. Ez a tartomány az ún. „kísérleti K ablak”.
3.4. ábra
Paraméterek hatása a titrációs görbére
A kísérlethez használt fehérjekoncentráció megfelelő megválasztása függ egyrészt a kísérlet céljától (pl.: csak ΔH-t akarjuk meghatározni, vagy ezzel együtt a sztöchiometriát és K értékét is), másrészt figyelemmel kell lennünk a készülék érzékenységének a határára is, ami kb. 0,1 μCal. Egy precíz méréshez tehát legalább 3-5 μCal-nak kell felszabadulnia vagy elnyelődnie [26].
3.6. Spektrofluoriméter
Az olyan fénykibocsátást, ahol a fénykibocsátó anyag gerjesztése a hőmérséklet emelkedése nélkül megy végbe (pl. UV vagy látható fénnyel megvilágítjuk) lumineszcenciának nevezzük. Ha a fény kibocsátása a megvilágítás után még hosszabb ideig (~ms-s) megmarad, akkor foszforeszkálásról, ha a megvilágítás megszűnése után azonnal (~10-9s) leáll a sugárzás is, akkor fluoreszcenciáról beszélünk. (Az elnevezés arra utal, hogy ilyennel először és jellemző módon foszfor-, illetve fluortartalmú vegyületekben találkoztak.) A fluoreszcencia jellemzője, hogy a kisugárzott fény mindig azonos, vagy nagyobb hullámhosszú (kisebb frekvenciájú, kisebb energiájú), mint az elnyelt fény. A fluoreszcens fény nem monokromatikus, mert mindegyik gerjesztett molekula egyedi módon tér vissza az alapállapot valamelyik rezgési szintjére, és így kialakul egy maximummal rendelkező emissziós spektrum. A fluoreszcencia mérésére szolgáló eszköz a spektrofluoriméter.
Felépítése hasonlít a spektrométerhez, de ebben két monokromátor van. Az egyik a megvilágító fény hullámhosszának a kiválasztására, a másik pedig a fluoreszcens fény vizsgálatára szolgál. További különbség, hogy a spektrofluoriméterben a fotodetektor a megvilágító fényre merőlegesen helyezkedik el, hogy a küvettán áthaladó megvilágító fény ne befolyásolja a mérést (3.5. ábra).
Méréseimhez Fluoromax-2 (Jobin-Yvon) számítógéppel vezérelt spektrofluorimétert használtam.
monokromátor
monokromátor fotodetektor erősítő és kijelző mintatartó
fényforrás
3.5. ábra
Spektroflouriméter vázlatos felépítése
Híg oldatok esetén a fluoreszcens fény intenzitása arányos az oldat koncentrációjával:
F= k I0 ε c,
ahol c az oldat koncentrációja, ε a besugárzás hullámhosszán érvényes moláris abszorpciós koefficiens, I0 a besugárzó fény intenzitása, k pedig a kvantumhasznosítást összegző küvettára, műszerre és a mintára jellemző állandó.
A fehérjék fluoreszcenciája lehet saját vagy külső. A saját fluoreszcencia az aromás gyűrűt tartalmazó aminosavaktól származik. Ezek a triptofán, tirozin és a fenilalanin. Ezen aminosavak fluorszcenciája erősen függ a környezetüktől, ezért ezek fluoreszcenciájának mérésével például fehérjék konformációs változását is nyomon lehet követni. A fehérjékhez külső fluorofor vegyületek is köthetők, elsősorban a lizin és arginin aminosavak NH2
oldalláncain, valamint a cisztein SH csoportján keresztül.
3.6.1. Fluoreszcencia rezonancia energia transzfer (FRET)
A fluoreszcencia rezonancia energia transzfer egy sugárzás nélküli energiaátadást jelent a gerjesztett (donor) molekula és egy akceptor molekula között. Az energiaátadás az akceptor és a donor között fellépő nagy hatótávolságú dipól-dipól kölcsönhatás eredménye.
Az energiatranszfer hatásfoka a Förster elmélet szerint:
6 6 0
6 0
r R E R
= + ,
ahol R0 az úgynevezett Förster távolság, ahol az energia transzfer hatásfoka 50 %-os. Az R0 a következő kifejezéssel adható meg:
λ λ λ ε π λ
κ F d
Nn
R QD D A 4
0 4 5
2 6
0 ( ) ( )
128 ) 10 (ln
9000
∫
∞= ,
ahol QDa donor fluoreszcencia kvantumhatásfoka, n az oldat törésmutatója (biomolekulák vizes oldata esetén általában ez 1,4), N az Avogadro szám, κ az orientációs faktor (véletlenszerű donor-akceptor dipól orientáció esetén
3
2 = 2 κ ).
Két kromofor között a fentiek szerint akkor jöhet létre FRET, ha az akceptor abszorpciós spektruma átfed a donor emissziós spektrumával, és a két molekulának megfelelő közelségbe kell kerülnie a távolság 6. hatványával való fordított arányosság miatt.
3.7. Felhasznált anyagok
Az FRET mérésekhez az általam kiválaszott festékek a ciszteinen keresztül képesek a felérjemolekulákhoz kötődni. A Salmonella typhimurium SJW1103 vad típusú flagellin molekula nem tartalmaz ciszteint, ezért a fluoreszcens mérésekhez egy olyan pontmutációval létrehozott flagellin molekulát használtam, amelynek aminosavláncában a központi, variábils