Nanotechnológia Tanszék
FLAGELLINALAPÚ MOLEKULÁRIS OBJEKTUMOK LÉTREHOZÁSA
Doktori (PhD) értekezés
A Környezettudományok Doktori Iskola keretében készítette:
Sebestyén Anett
Témavezető:
Dr. Vonderviszt Ferenc egyetemi tanár
Veszprém
Értekezés doktori (PhD) fokozat elnyerése érdekében Írta:
Sebestyén Anett
Készült a Pannon Egyetem Környezettudományok Doktori Iskolája keretében Témavezető: Dr. Vonderviszt Ferenc
Elfogadásra javaslom (igen / nem) ………
(aláírás) A jelölt a doktori szigorlaton …... % -ot ért el,
Az értekezést bírálóként elfogadásra javaslom:
Bíráló neve: Dr. Gál Péter (igen /nem)
………
(aláírás) Bíráló neve: ifj. Dr. Kellermayer Miklós (igen /nem)
……….
(aláírás)
A jelölt az értekezés nyilvános vitáján …...% - ot ért el.
Veszprém, ……….
a Bíráló Bizottság elnöke A doktori (PhD) oklevél minősítése…...
………
Az EDT elnöke
TARTALOMJEGYZÉK
KIVONAT-ABSTRACT-AUSZUG
1. BEVEZETÉS, CÉLKITŰZÉS 9. OLDAL
2. IRODALMI ÁTTEKINTÉS
2.1. A baktériumok flagelláris filamentumai 11. OLDAL
2.2. A flagellin monomer 16. OLDAL
2.3. Flagellinalapú filamentáris receptorok 19. OLDAL
3. ANYAGOK ÉS MÓDSZEREK
3.1. A klónozás és a génamplifikációs eljárások 22. OLDAL
3.2. Irányított mutagenezis 29. OLDAL
3.3. Gélelektroforézis 31. OLDAL
3.4. Ioncserélő és affinitás kromatográfia 32. OLDAL 3.5. Izotermális Titrációs Mikrokalorimetria (ITC) 36. OLDAL 3.6. Felületi Plazmon Rezonancia Spektroszkópia (SPR) 38. OLDAL 3.7. Differenciális Pásztázó Mikrokalorimetria (DSC) 39. OLDAL 3.8. Cirkuláris Dikroizmus Spektroszkópia (CD) 41. OLDAL
4. EREDMÉNYEK ÉS ÉRTÉKELÉSÜK
4.1. Nehézfém-kötő flagellinvariánsok létrehozása 44. OLDAL
4.2. Mutánsok termeltetése, tisztítása 49. OLDAL
4.3. A Ni- és As-kötő flagellin fémkötő képességének vizsgálata 52. OLDAL 4.4. Rekonstruált filamentumok előállítása és felületi rögzítése 56. OLDAL 4.5. A Ni-kötő filamentum fémkötő képességének vizsgálata 63. OLDAL 4.6. D3 domén vázfehérje klónozása és vizsgálata 65. OLDAL 4.6.1. Klónozás, fehérjeexpresszió és tisztítás 65. OLDAL 4.6.2. A D3 domén vizsgálata DSC-vel, CD-vel és proteolízissel 66. OLDAL
ÚJ TUDOMÁNYOS EREDMÉNYEK / TÉZISEK 72. OLDAL
NEW SCIENTIFIC RESULTS / THESES 74. OLDAL
KÖZLEMÉNYEK 76. OLDAL
IRODALOMJEGYZÉK 79. OLDAL
KÖSZÖNET 84. OLDAL
KIVONAT
Flagellinalapú molekuláris objektumok létrehozása
A hagyományos bioszenzorok illetve fehérje chipek antitesteket, vagy azok alkalmas részegységeit alkalmazzák érzékelő elemként. Ezek előállítása költséges, preparálásuk bonyolult, stabilitásuk sokszor elégtelen, a hordozó felülethez kötve könnyen elveszítik natív térszerkezetüket, működőképességüket. Az antitestek kiváltása más fehérje alapú receptorokkal mindenképpen kívánatos.
A bakteriális flagellumok helikális filamentumai polimerizálódásra képes flagellin fehérje több tízezer kópiájából épülnek fel. A flagelláris filamentumok önszerveződő rendszerek, azaz a flagellin monomerek spontán módon képesek összeállni a natívval megegyező szerkezetű filamentumokká megfelelő körülmények között. A flagellin polimerizációja könnyen kontrollálható, a kialakuló filamentumok a fizikai-kémiai behatásokkal szemben stabilisak, szerkezetük atomi precizitással ismert. A különböző fajokból származó flagellin fehérjék szekvenciáinak összehasonlításából adódóan ismeretes az is, hogy a molekula centrális szegmensei nagymértékben variábilisak, nem vesznek részt a szerkezetépítésben, éppen ezért különféle kötőhelyek alakíthatók ki ebben a régióban a polimerizáció megzavarása nélkül.
Ennek tudatában a szerző, egyfelől számítógépes molekulatervezés és génsebészeti eszközök segítségével, Ni- és As-kötő flagellinvariánsokat állított elő, amelyek az adott nehézfémion felismerésére és erős megkötésére képesek. A flagellin alapú receptorok számos előnyt hordoznak, miszerint baktériumokkal nagy mennyiségben olcsón termeltethetők, a sejtek feltárása nélkül könnyen tisztíthatók, emellett még a flagellin polimerizációs képességénél fogva rendkívül nagy felületi kötőhely sűrűségű filamentáris objektumok építésére is alkalmazhatók.
Másfelől megmutatta, hogy a flagellin variábilis D3 doménjét kifejezve, a domén stabil önálló fehérjeként működik, amely lehetővé teszi, hogy mesterséges kötő fehérjék vázelemeként alkalmazható legyen.
Későbbiekben, ezek a módosított filamentáris receptorok, vagy a módosított D3 domén önmagában, ivóvizek nehézfémekkel való szennyezettségének mérésére szolgáló optikai szenzorok alapeleméül szolgálhatnak.
ABSTRACT
Creating of flagellin-based molecular objects
Biosensors and protein-chips usually apply antibodies as recognition elements.
However, these proteins are expensive, poorly stable and hard to prepare. It is highly desirable to replace antibodies with other kind of sensing molecules.
Flagellin, the subunit protein of bacterial flagellar filaments, is a protein polymerizable to form long filaments. The helical filaments of bacterial flagella are made of several tens of thousands copies of the flagellin protein. Flagellar filaments are self-assembling systems, i.e.
under suitable conditions flagellin monomers can spontaneously assemble into filaments with a structure identical to that of the native filaments. Polymerization of flagellin subunits can be controlled easily, and the obtained filaments are resistant to physical and chemical effects, resistant to proteases and their structure is well known at the atomic level. The central portion of the amino acid sequence of flagellin, which forms the outer part of the filament, is highly variable, and can be modified by genetic engineering or chemical treatment without affecting polymerization ability.
The author has created Ni- and As-binding flagellin mutants by molecular graphics and genetic engineering. These modified flagellins can be used capable of recognizing and binding desired heavy metal ions. Flagellin-based receptors can be produced easily and inexpensively by bacteria, and purified with an ease without lysing the cells, and flagellins, due to their polymerization ability, can be used to build filamentous structures with a very high binding site density on their surface.
Moreover she has presented, that the variable D3 domain of flagellin has small size and stable structure makes it a promising protein scaffold for the development of artificial binding proteins.
Further these filamentous receptors or the D3 domain alone may serve as basic recognition units of optical sensors to measure heavy metal contamination of fresh waters.
AUSZUG
Das Zustandebringen von auf Flagell basierenden Molekülobjekten
Die Autorin hat aus Flagellineiweissen, die für ben Aufbau des Flagellfilamentums von Bakterien zuständig sind, mit Hilfe von Mitteln der Computermolekülplanung und Genchirurgie Ni-und As bindende Flagellvarianten hergestellt, die fähig sind das gegebene Schwermetallion zu erkennen und binden. other kind of sensing molecules.
Weiterhin hat sie gezeigt, indem der variabel D3 Domen des Flagellins zum Ausdruck gebracht wurde, dass der Domen als stabiles, selbstständiges Eiweiss funktioniert, welches ermöglicht, dieses als Skelettelement der künstlichen Bindeiweissen anzuwenden.
Der Vorteil der auf Flagellin basierenden Rezeptoren ist es, dass sie mit Bakterien in grösseren Menge günstig zu produzieren sind und können ohne Eröffnung der Zellen leicht gereinigt werden. Wegen der Polymerisationsfähigkeit des Flagellins ist die Dichtheit ihres grossen Oberflächenbindeplatzes auch für den Bau von filamentaren Objekten verwendbar.
Ausserdem können diese als Grundelement optischer Sensoren dienen, die zur Messung der nachfolgend, in der Dissertation dargelegten modifizierten filamentaren Rezeptoren oder des modifizierten D3 Domen selber, bzw. vom Trinkwasser mit Verschmutzung von Schwermetallionen zu gebrauchen sind.
1. BEVEZETÉS, CÉLKITŰZÉS
A technológiai fejlődés eredményeként egyre inkább a nanoméretű objektumok előállítása felé indult el a világ. Ebben a nanométeres mérettartományban lehetővé válik az a megközelítés, hogy atomokból és molekulákból irányítottan építhetők fel a kívánt objektumok. Az élő szervezetekben fehérjékből felépülő nanoméretű önszerveződésre képes molekuláris gépezetek működnek, szerteágazó feladatokat ellátva. Ezeknek a molekuláris gépezeteknek a működését felderítve, majd tulajdonságaiknak génsebészeti eszközökkel történő célzott módosításával egy olyan úton indulhatunk el, amely végül a fehérjékből álló szupramolekuláris rendszerek tudatos tervezésén alapuló technológia megjelenéséhez vezet.
Mindez várhatóan a mérnöki tudományok szinte valamennyi ágára hatással lesz majd, a vegyipartól az elektronikáig, a környezetvédelemtől az energetikáig.
A szenzorok (érzékelők) fejlesztése az analitikai kémia egyik legdinamikusabban fejlődő, legvirágzóbb és legváltozatosabb tudományterülete. Az élő szervezetekben számtalan példát láthatunk arra, hogy a fehérjék rendkívül specifikus molekulafelismerési sajátságokat mutatnak. Számos mikroorganizmusban találhatók olyan fehérjék, amelyek átmeneti és nehézfém ionok erős és szelektív megkötésére, azok közegbeli koncentrációjának precíz érzékelésére képesek. Sok fémkötő fehérje esetében ismertek azok a szerkezeti motívumok, amik meghatározó szerepet játszanak az adott célmolekula felismerésében és megkötésében.
Doktori munkám célja, hogy ezeket az ismereteket felhasználva, a flagellin fehérjét számítógépes molekulatervezés, majd génsebészeti eljárások segítségével megfelelően módosítva olyan mesterséges receptorokat hozzak létre, amelyek Ni- és As-ionok felismerésére és erős megkötésére képesek. A későbbiekben, a Ni- és As- kötő flagellinekből, azok könnyen kontrollálható polimerizációját kihasználva, megfelelő méretű filamentáris receptorok építhetők, felületükön több ezer példányban megjelenő az adott célmolekulára specifikus kötőhellyel, annak hatékony megkötését eredményezve. Emellett egy másik irányvonalon elindulva, célom, hogy a flagellin molekula centrális D3 doménjét klónozzam és vizsgálatokat végezzek rajta, arra keresve választ, hogy önmagában a domén feltekeredett, stabil szerkezettel bír-e. A flagellinből kiragadott D3 domén kis mérete és reményeim szerint stabil szerkezete lehetőséget teremt, hogy mesterséges kötő fehérjék vázelemeként alkalmazható legyen.
A flagellinalapú receptorok előnye, hogy baktériumokkal nagy mennyiségben olcsón termeltethetők, a sejtek feltárása nélkül könnyen tisztíthatók, és emellett még a flagellin polimerizációs képességénél fogva rendkívül nagy felületi kötőhelysűrűségű filamentáris objektumok építésére is alkalmazhatók. A D3 domén alapú receptorok előnye pedig kis méretükben rejlik, olyan esetekben kaphatnak szerepet, ahol a felületi rögzítés során a filamentáris struktúra mérete nem felel meg a hordozónak (pl. pórusus szilícium).
A jövőben a módosított filamentáris receptorok, vagy a módosított D3 domén magában, ivóvizek nehézfémekkel való szennyezettségének mérésére szolgáló optikai szenzorok alapeleméül szolgálhatnak.
2. IRODALMI ÁTTEKINTÉS
2.1 A baktériumok flagelláris filamentumai
A flagellumok a baktériumok mozgásszervei, olyan kis molekuláris gépezetek, amelyek számos figyelemre méltó tulajdonsággal rendelkeznek. A bakteriális flagellumok sejtmembránba ágyazott része magában foglal egy 50 nm átmérőjű, protonok által hajtott motort. Minden egyes motorhoz egy-egy 5-10 μm hosszúságú helikális filamentum (2. ábra) csatlakozik, amely flagellinfehérjék tízezreiből épül fel. Ezek a helikális filamentumok a baktérium úszása (1. ábra) során egyetlen nagy helikális köteggé állnak össze, és összehangolt forgásukkal mintegy propellerként hajtják előre a baktériumot 20-30 μm/s-os sebességgel [MACNAB, 1995;NAMBA &VONDERVISZT, 1997].
1. ábra: A baktériumok mozgása[NAMBA &VONDERVISZT, 1997].
A motor egy álló és egy forgó részből áll. Az álló részt a MotA és MotB fehérjék alkotják, ezek rögzítik szerkezetet a belső sejtmembránban, illetve a peptidoglükán rétegben [DEAN ÉS MTS., 1984; SHARP ÉS MTS., 1995; ZHOU ÉS MTS., 1995]. A MotA fehérje egy protoncsatornát alkot a sejtmembránon keresztül, amelynek a motor forgási mechanizmusában van fontos szerepe [BLAIR & BERG, 1990]. A motor forgó részét (rotor) szintén gyűrű alakú komplexek alkotják. Részei a FliF fehérjékből álló MS gyűrű, [JONES ÉS MTS., 1990; SOSINSKY ÉS MTS., 1992; UENO ÉS MTS., 1992] amihez erősen kapcsolódik FliG fehérjékből álló másik gyűrű is [FRANCIS ÉS MTS., 1992]. A FliG, FliM és FliN fehérjék a C- gyűrű részei, amely az MS gyűrű citoplazmatikus oldalán helyezkedik el, és együttesen az
úgynevezett kapcsoló komplexet alkotják [DRIKS & DEROSIER, 1990; KHAN ÉS MTS., 1992;
FRANCIS ÉS MTS., 1992; 1994], amely a motor forgásának irányát határozza meg.
A rotorhoz kapcsolódik a flagellum axiális része, elsőként a tengely vagy rúd (rod), amelyet öt fehérje alkot, a FliE, FlgB, FlgC, FlgF, FlgG [HOMMA ÉS MTS., 1990, SAIJO-
HAMANO ÉS MTS., 2004]. Ezt az L és P gyűrűk veszik körül (FlgH és FlgI fehérjék), amelyek csapágyként rögzítik a rudat a külső membránban, és a peptidoglükán rétegben [DEPAMPHILIS
&ADLER, 1971;JONES ÉS MTS., 1990;SOSINSKY ÉS MTS., 1992].
A motor tengelyét a külső helikális filamentumokkal az erősen görbült szerkezetű kampó (hook) köti össze, ez képes a forgástengely irányának megváltoztatására. A filamentumok ugyanis nem a motor tengelye körül, hanem arra közel merőleges irányban elhelyezkedő saját hossztengelyük körül forognak. A kampót a FlgE fehérje mintegy 130 példánya alkotja, amelyek 55±6 nm hosszú [HIRANO ÉS MTS., 1994] helikális struktúrát képeznek [KAGAWA ÉS MTS., 1979]. A kampó felépülése kezdetén in vivo, egy FlgD alegységekből álló sapkaszerű segédfehérje kerül a rúd végére, amely a központi csatornán át újonnan érkező kampófehérje monomerek beépülését segíti [OHNISHI ÉS MTS.,1994]. Amikor a kampó elkészült, az FlgD alegységek leválnak a filamentum végéről, hogy helyet adjanak a további komponensek ráépülésének. A kampó érdekes tulajdonsága, hogy nagyfokú polimorfizmusra képes -a filamentumokhoz hasonlóan- a környezeti körülmények megváltozása esetén egymástól lényegesen eltérő helikális formákat vesz fel [KATO ÉS MTS., 1984].
A kampó és a filamentum között egy rövid összekötő szakasz található, amit két kampó asszociált fehérje alkot: a HAP1 (FlgK) és a HAP3 (FlgL) [IKEDA ÉS MTS., 1987].
Ehhez kapcsolódik a flagelláris filamentum, amely a kampóhoz hasonlóan szintén helikális polimer és amelyet flagellin (FliC) molekulák alkotnak. A filamentum külső átmérője 20 nm körüli, hossza pedig átlagosan 10 mm, amelynek felépítéséhez mintegy 30000 flagellin alegységre van szükség. A filamentumok in vitro is képesek a spontán önszerveződésre, in vivo szerkezetkialakításuk azonban csak a HAP2 (FliD) fehérje jelenlétében megy végbe. Ez az „intelligens” kötődésre képes sapka teszi lehetővé, hogy a citoplazmából a filamentumok belsejében lévő csatornán keresztül szállítódó flagellinalegységek beépülhessenek a filamentumok végére, és ne diffundáljanak szét az extracelluláris közegben. A HAP2 sapka
végéhez, de emellett képes arra is, hogy megfelelő pillanatban lokálisan elengedje a filamentumok végét, hogy lehetővé tegye az újonnan odaérkező flagellinalegységek beépülését [NAMBA &VONDERVISZT, 1997].
A motor tengelyét felépítő fehérjéket, a kampó fehérjét, a flagellint és a HAP fehérjéket együttesen axiális fehérjéknek nevezik. Az axiális fehérjék a citoplazmában szintetizálódnak, majd egy speciális exportmechanizmus segítségével, a filamentum belsejében található csatornán keresztül jutnak el beépülési helyükre [NAMBA &
VONDERVISZT, 1997;VONDERVISZT ÉS MTS., 1992;MACNAB ÉS MTS., 2004;BLOCKER ÉS MTS., 2003; VÉGH ÉS MTS., 2006]. A baktérium számára létfontosságú, hogy a flagelláris fehérjék csak a megfelelő helyen és ne a sejten belül polimerizálódjanak. Ebben úgynevezett dajkafehérjék segédkeznek; a flagelláris exportban a FliS dajkafehérjék akadályozzák meg a nagy mennyiségben szintetizálódó, a bakteriális flagellumok helikális filamentumait alkotó flagellinmolekulák sejten belüli összekapcsolódását [MUSKOTÁL ÉS MTS., 2006].
2. ábra: A flagellumok keresztmetszeti rajza.
A filamentumok vastagsága 23 nm, hosszúságuk akár 10-20mm is lehet [NAMBA &VONDERVISZT, 1997].
A flagelláris filamentumok érdekes tulajdonsága, hogy önszerveződő rendszerek, azaz a flagellin monomerek megfelelő körülmények között spontán módon össze tudnak állni a natívval megegyező szerkezetű filamentumokká. A filamentumok 60 oC-on hőkezelve, vagy sav (pH=2.5) hatására monomerjeikre esnek szét, de ezekből a monomerekből, rövid filamentumok (magok) vagy precipitálószerek (pl. ammónium-szulfát) hozzáadásával újra felépülnek a filamentumok [ASAKURA, 1970].
Másik figyelemre méltó sajátosságuk pedig, hogy a környezeti körülményektől függően, reverzibilis módon különféle, egymástól jól megkülönböztethető helikális formákba,
szerkezeti átrendeződések előidézhetők a hőmérséklet, az ionerősség vagy a pH változtatásával, de mechanikai erőhatás is kiválthatja őket [NAMBA &VONDERVISZT, 1997].
A flagelláris filamentumok röntgendiffrakciós és elektronmikroszkópiás szerkezetanalízisével megmutatták, hogy az alegységek közötti kölcsönhatások a filamentum centrális részére korlátozódnak, ezek eredményeként a filamentumok magját két koncentrikus gyűrű alakú struktúra építi fel [YAMASHITA ÉS MTS., 1995; YAMASHITA ÉS MTS., 1998]. A filamentumok radiális tömegeloszlását tekintve és más predikciós eredményeket felhasználva, megállapították, hogy a flagellinmolekula monomer állapotban rendezetlen terminális régiói elsősorban a belső gyűrű felépítésében vesznek részt (3. ábra).
3. ábra: A filamentum szerkezete[YONEKURA ÉS MTS., 2003].
ASalmonella typhimurium flagelláris filamentumai térszerkezetének felderítése során ismertté vált, hogy a filamentumok flagellin alegységei 11 protofilamentumba rendeződnek [NAMBA ÉS MTS.,1989; HOMMA ÉS MTS., 1990; NAMBA & VONDERVISZT, 1997; YONEKURA ÉS MTS., 2003], amelyek egymással szoros kölcsönhatásban alakítják ki a filamentumok szerkezetét.
2.2 A flagellin monomer
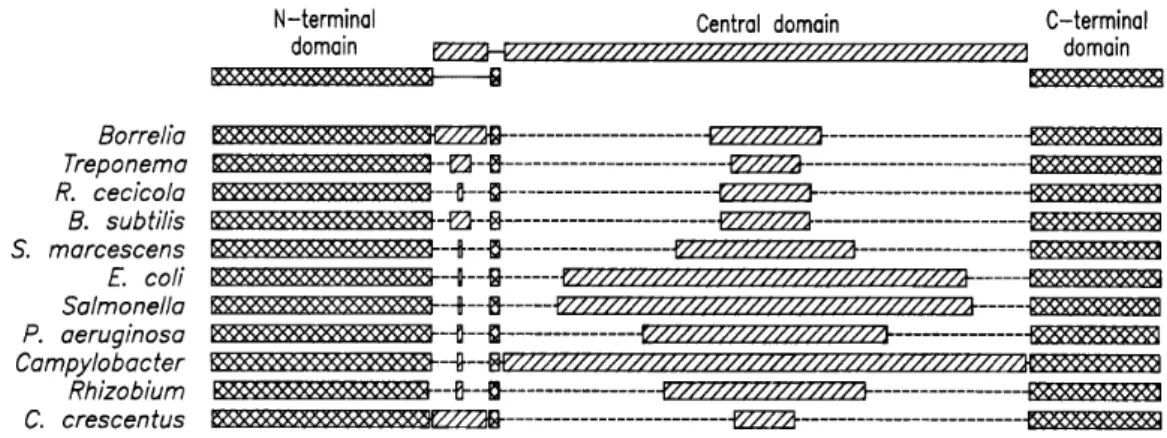
A Salmonella typhimurium baktérium flagellinje 494 aminosavból áll [KANTO ÉS MTS., 1991]. Az aminosavszekvenciák összehasonlító vizsgálata felfedte (4. ábra), hogy a közel 180 N-terminális és 100 C-terminális aminosavat magukba foglaló terminális régiók erős szekvenciális homológiát mutatnak, míg a centrális szegmensek nagymértékben variábilisak [WILSON, 1993; BEATSON ÉS MTS., 2006]. A különböző eredetű flagellinek molekulatömege széles határok között változik (28-65 kDa), a különbségek a centrális régió eltérő méretéből adódnak.
Mostanra számos fajhoz, és azokon belül esetenként több változathoz tartozó flagellin aminosav szekvenciáját meghatározták, a fehérjét kódoló fliC gén szekvenciájával együtt.
Ismert flagellin szekvenciákkal történő összerendezés után az új szekvenciák esetében is jellemzően megkülönböztethetők voltak a nagyobb mértékű homológiát mutató konzervatív, terminális régiók és a centrális elhelyezkedésű variábilis régió [JOYS 1985;WEI &JOYS, 1985;
SCHOENHALS &WHITEFIELD, 1993].
4. ábra:A különböző baktériumokból származó flagellinek szekvenciális hasonlósága
A terminális régiók konzerválódottsága fontos szerkezeti és funkcionális szerepükre utal. A flagellinmolekula polimerizációs tulajdonságait vizsgálva többen felfigyeltek arra, hogy a filamentáris szerkezet kialakulása során a molekula nagymértékű konformációs átrendeződésen megy keresztül. A polimerizáció eredményeképpen rendeződő régiók után kutatva limitált proteolízis, spektroszkópiás és kalorimetriás módszerek kombinált alkalmazásával megmutatták, hogy aSalmonella typhimuriumból származó, 494 aminosavból álló flagellinmolekula terminális régiói, 66 N-terminális és 44 C-terminális aminosavnyi rész, oldatban nem rendelkeznek kompakt, stabilis térszerkezettel [VONDERVISZT ÉS MTS., 1990;
VONDERVISZT ÉS MTS., 1989; AIZAWA ÉS MTS., 1990]. A feltételezések szerint, ezek a rendezetlen terminális régiók (a korábban említett FliS chaperonok) akadályozzák meg a sejten belüli polimerizációt, mivel a rendezetlen végű alegységek nem képesek egymáshoz kötődni, a régiók nem képesek egymást rendezni, ezért nem is indul meg in vitro körülmények között a filamentumok kialakulása precipitálószerek nélkül [NAMBA &
VONDERVISZT, 1997;VONDERVISZT ÉS MTS., 1992].
Ma már ismeretes, hogy a flagellinmolekulának van egy stabil, kompakt magja, amely a rendezetlen terminális régiók teljes eltávolításával állítható elő tripszin segítségével, ez az F40-es fragmentum (40 kDa), amely lassan továbbemészthető egy 27 kDa-os fragmentummá [VONDERVISZT ÉS MTS., 1991; VONDERVISZT ÉS MTS.,1990].
A legújabb kutatások egy mindkét terminálisán csonkított 41 kDa-os (F41) fragmentum kristályosítása és röntgendiffrakciós vizsgálata révén meghatározták a filamentum szerkezetét (5.ábra) [SAMATEY ÉS MTS.,2001].
5.ábra: 41 kDa-os fragmentum[SAMATEY ÉS MTS., 2001].
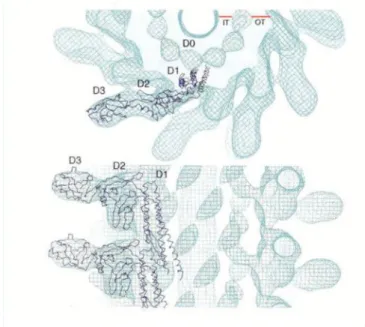
Az F41 fragmentum három fő részből a D1, D2 és D3 doménből áll. A D1 domént három a-hélix alkotja, melyek a filamentum külső gyűrűjét építik fel. A D2 domén főleg b- lemezekből áll, de található benne két rövid hélix is. Két aldoménre osztható, a D2a-ra, amely az N-terminálist foglalja magába és a D2b-re, amely a C-terminálist tartalmazza.
A D3 domén pedig, egy rövid helikális rész kivételével b-lemezekből áll. A D2 és D3 domén a filamentum felszínén található, míg a D0 domén a filamentum szerkezetének belső gyűrűjét alkotja (6. ábra).
6. ábra: A flagellin alegységek elhelyezkedése a flagelláris filamentumokban
[SAMATEY ÉS MTS.,2001].
Felfedezték, hogy a flagellinmolekulák (a többi axiális fehérjével megegyezően) terminális régiói hidrofób aminosavak hetes ismétlődéseit tartalmazzák, ami arra utal, hogy a térszerkezet kialakítása során ezek a régiók α-helikális kötegeket képeznek. [HOMMA ÉS MTS., 1990]. Továbbá a távoli UV-ban felvett CD spektrum is ezt igazolta, miszerint a flagellinmolekulák polimerizációja során a rendezetlen régiók α-helikális szerkezetet vesznek fel. Ilyen hidrofób aminosav ismétlődéseket más fehérje-kölcsönhatásokban is megfigyeltek.
Ezért azt feltételezték, hogy a flagelláris filamentumok képződése során a szomszédos alegységek N- és C-terminális régiói egymással helikális kötegeket formálnak, és a helikális kötegek egymásba fonódó láncolata eredményezi a folytonos filamentáris szerkezet
filamentum végén lévő szabad N-terminálishoz kötődik a következő alegység C-terminálisa [IINO ÉS MTS.,1969; URATANI ÉS MTS.,1972; MIMORI-KIYOSUE ÉS MTS.,1997].
2.3 Flagellinalapú filamentáris receptorok
Korábbi vizsgálatok megmutatták, hogy csupán a flagellinalegységek konzerválódott terminális régiói vesznek részt a filamentum építésben [VONDERVISZT ÉS MTS., 1991; MIMORI-KIYOSUE ÉS MTS., 1997]. Ugyanakkor centrális részük a filamentumok felszínén található, kívülről könnyen hozzáférhető D3 domént alkotja. A D3 domén a szomszédos alegységekkel nincs kontaktusban [SAMATEY ÉS MTS., 2001; YONEKURA ÉS MTS., 2003], a filamentáris szerkezet kialakításában nem játszik szerepet. A D3 domén jó célpontot nyújt a génsebészeti beavatkozások számára, az önszerveződés megzavarása nélkül könnyen módosítható.
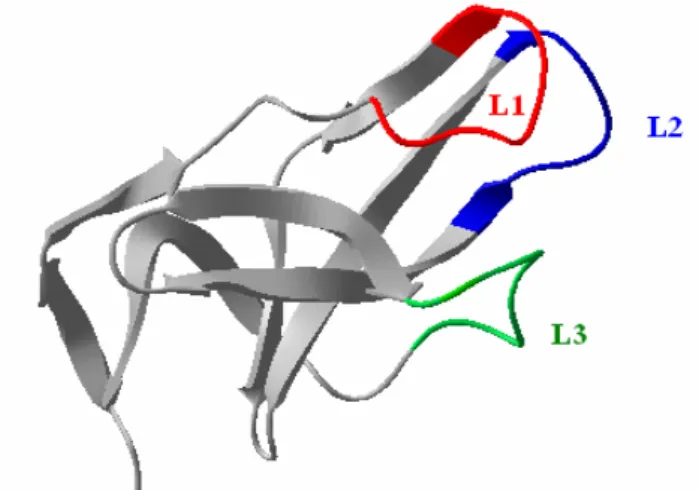
A D3 domén felépítésében a Salmonella typhimurium flagellinjének 190-284 aminosav szekvencia szegmense vesz részt. Ez egy szokatlan β-hordó szerkezetű domén, amely négy β- láncból és egy rövid α-helikális szegmensből épül fel [SAMATEY ÉS MTS., 2001; YONEKURA ÉS MTS., 2003]. A külső közeg felé néző- a filamentum tengelyével legtávolabbra eső- felszínét három hurokrégió alakítja ki, nevezetesen a 205-213 (L1), a 236-244 (L2) és a 261-270 (L3) szegmensek (7. ábra). Ezen hurokrégióknak aminosavszekvenciáit megváltoztatva, a D3 domén felületi tulajdonságai módosíthatók, ezáltal ott specifikus kötőhelyek (töltésmintázatok, topográfia) kialakítására nyílik lehetőség.
7. ábra: A D3 domén polipeptidvázának szerkezete a flagellin fehérjében.
A domén külső közeg felé néző felszínét a 205–213 (L1), a 236–244 (L2) és a 261–270 (L3) hurokrégiók alakítják ki.
A flagellin polimerizációs képességét megőrizve, a D3 domén módosításával kívánunk létrehozni flagellinalapú mesterséges receptorokat. A D3 domént vázszerkezetként alkalmazva mesterséges receptorok többféle módon is előállíthatók:
1. az L1, L2, L3 hurokrégiók aminosavszekvenciáit módosítva mesterséges evolúciós eljárások (18–21) alkalmazásával;
2. a L1, L2, L3 hurokrégiók kötési tulajdonságainak célzott megváltoztatásával, fehérjetervezés alkalmazásával, más fehérjékben megfigyelt kötőszegmensek, illetve kívánt tulajdonságú oldalláncok beépítésével;
3. specifikus kötési tulajdonságú molekulák, fehérjék D3 domén felületére való rögzítésével.
A gyógyszeriparban, az orvosi diagnosztikában, vagy a környezetvédelmi vizsgálatokban gyakori feladat komplex elegyek egyes komponenseinek megbízható kimutatása. A kutatások egyre inkább a bioszenzorok irányába mutatnak, amelyek egy molekuláris felismerést biztosító biológiai eredetű felismerő részből és egy fizikai-kémiai jelátvivő egységből állnak.
A fehérjék rendkívül specifikus molekula felismerésre képesek, amelynek fontos szerepe van az élő szervezetek környezettel való kommunikációjában és az idegen anyagok elleni védekezésben is. Számos mikroorganizmusban találhatók olyan fehérjék, amelyek átmeneti és nehézfém ionok erős és szelektív megkötésére, azok közegbeli koncentrációjának precíz érzékelésére képesek. Sok fémkötő fehérje esetében ismertek azok a szerkezeti motívumok, amik meghatározó szerepet játszanak az adott célmolekula felismerésében és megkötésében. [BUSENLEHNER,PENELLA &GIEDROC, 2003;ROMERO-ISART &VASÁK, 2002].
A magasabb rendűek immunrendszerének működése pedig azon alapul, hogy az antitestek, közöttük az immunglobulin G (IgG) molekulák nagyon sokféle idegen anyagot képesek megbízhatóan felismerni, ugyanis a természet több millió IgG variánst generál, amelyek csak a kötőrégiójuk szerkezetében térnek el egymástól [METZGER, 1990]. A tapasztalat azt mutatja, hogy a sok variáns között mindig van olyan, amely specifikusan tud kötődni a szervezetbe kerülő idegen anyag valamelyik felületi régiójához.
A hagyományos bioszenzorok illetve fehérje chipek általában antitesteket (immunglobulin molekulákat) vagy azok alkalmas részegységeit alkalmazzák érzékelő elemként [ZHU & SNYDER, 2003]. Ezek előállítása költséges, preparálásuk bonyolult,
térszerkezetüket, működőképességüket. Az antitestek kiváltása más fehérje alapú receptorokkal mindenképpen kívánatos.
Ismeretesek már sikeres próbálkozások, hogy az IgG-doméneknél megfigyelt alapelveket alkalmazva más, eredetileg receptor tulajdonságokkal nem rendelkező fehérjék felületén alakítsanak ki adott célmolekulára specifikus kötőhelyeket [XU ÉS MTS., 2002; SKERRA, 2001; NYGREN & UHLEN, 1997]. Xu és munkatársai a 3-as típusú fibronektin domén felületi hurokrégiói aminosavszekvenciáinak variálása révén nagyszámú mutánst létrehozva, irányított evolúciós eljárások alkalmazásával állítottak elő TNF-α fehérje specifikus megkötésére alkalmas receptorokat [XU ÉS MTS., 2002] Hasonlóképpen Skerra és munkatársai a lipocalin fehérjéből kiindulva hoztak létre különféle receptorokat [SKERRA, 2001]. Viszont az eddig ismert fehérjealapú receptorok előállítása továbbra is költséges és munkaigényes.
Kívánatos lenne egy, az eddig ismerteknél egyszerűbben és olcsóbban előállítható, nagymértékű variábilitást biztosító receptorcsalád megalkotása. Különösen előnyös volna olyan receptorok előállítása, amelyekkel különféle szupramolekuláris szerkezetek építése is lehetővé válik. A baktériumok flagelláris filamentumai, mint ilyen szupramolekuláris rendszerek megoldást kínálnának erre a problémára. Egy új megközelítésben tekintve, ha a flagellinen megfelelő kötőrégiót alakítanak ki, akár maguk a flagellinek, de akár csak a D3 doménjük izolált formában különféle célmolekulák felismerésére és megkötésére képes receptorként alkalmazhatók. Sőt a módosított flagellinalegységekből rekonstruált filamentumok építhetők, és hordozóhoz kötve fehérjechipként használhatók. A flagellinreceptorok nagy előnye, hogy az antitesteknél és más eddig ismert fehérjereceptoroknál lényegesen egyszerűbben és olcsóbban a baktérium sejtek feltárása nélkül előállíthatók. Mindemellett a flagellin polimerizációja könnyen kontrollálható [ASAKURA, 1970; ASAKURA ÉS MTS., 1964], a kialakuló filamentumok a fizikai-kémiai behatásokkal szemben stabilisak, a proteázokkal szemben ellenállóak, és szerkezetük atomi precizitással ismert.
Fontos megemlíteni, hogy a flagellinreceptor megjelölés, itt nem a hagyományos értelemben vett receptornak felel meg, ugyanis a biológiai receptorok olyan biomolekulák specifikus megkötésére alkalmas peptidek, fehérjék, melyeknél a receptor-ligandum közötti kölcsönhatás konformációs átalakulásokat eredményez a receptor szerkezetében. Ezek a konformációváltozások pedig bizonyos sejtválaszt indukálnak, mint például egy ioncsatorna megnyitását vagy egy bizonyos enzim aktiválását. A mi értelmezésünkben a receptor olyan fehérjét jelöl, amely egy vagy több célvegyület specifikus felismerésére és megkötésére képes.
3. ANYAGOK ÉS MÓDSZEREK
A következő fejezetekben azokat a kísérleti módszereket foglalom össze és ismertetem, amelyeket munkám során alkalmaztam. Az egyes módszereket követően röviden írok a felhasznált anyagokról, de a részletes kísérleti körülményeket a 4. Eredmények és értékelésük c. fejezetben tárgyalom.
3.1. A klónozás és a génamplifikációs eljárások
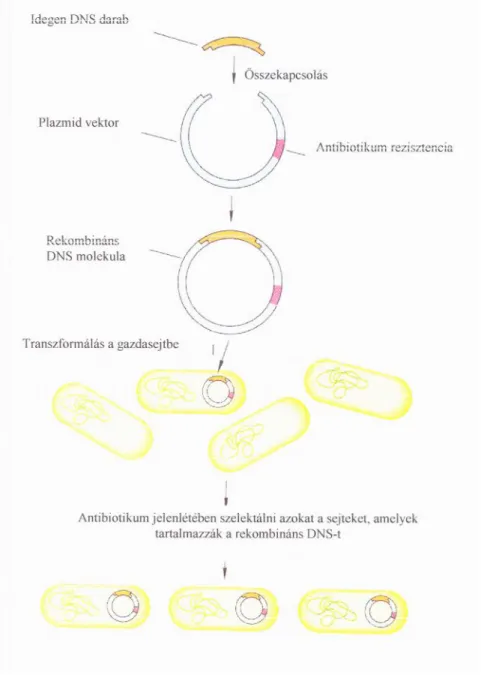
Bármilyen klónozási eljárás célja, hogy egy ún. klónt, azaz tökéletesen egyforma szervezetek csoportját állítsa elő. A génklónozási kísérletekben rendszerint baktériumsejtbe viszik be az idegen gént, majd a módosított baktériumok szaporításával klónt hoznak létre. A klónozott sejtek mindegyike tartalmazza a bevitt idegen gént, és amíg biztosított a gén replikációja, a gazdasejt klónozásával klónozzák a gént is [WEAVER & HEDRICK 2000]. A génsebészetben használt klónozó vektorok sokfélék lehetnek, bakteriofágok, mesterséges kromoszómák, plazmidok és ezek hibrid származékai, a kozmidok.
A baktérium gazdasejt esetében a vektorok általában 3-6 kilobázis nagyságú extrakromoszómális, gyűrű alakú DNS-molekulák (plazmidok) lehetnek. A plazmidok a kromoszómától függetlenül, önállóan replikálódni képes cirkuláris DNS molekulák, amelyek nagyon sok baktériumfajban természetes módon előfordulnak. Általában olyan különleges tulajdonságokat kódoló géneket hordoznak, amelyek a környezethez való jobb alkalmazkodást segítik, de nem szükségesek minden körülmények között a gazdaszervezet életben maradásához (nehézfém rezisztencia, toxintermelés, antibiotikum rezisztencia, speciális anyagcsere utak, restrikciós-modifikációs rendszerek, patogenitás). Kis méretük miatt viszonylag könnyű a sejtekből láncszakadás, összetöredezés nélkül kinyerni őket. Egy sejtben a plazmidból általában több példány, akár több száz kópia is lehet, ettől függően nevezik őket kis vagy nagy kópiaszámú plazmidoknak. Napjainkban számtalan, in vitro rekombináns DNS technikával mesterségesen "összeállított" plazmid létezik, amelyek a génizolálás, a DNS szekvenálás, a génexpresszió vizsgálata vagy fehérjék termeltetése terén egyaránt hasznos eszközök.
A géntechnológia másik legfontosabb eszközei a restrikciós endonukleázok, amelyek specifikus, úgynevezett palindrom (elölről és hátulról olvasva azonos) szekvenciákat hasítanak. A restrikciós endonukleázok felfedezéséért W. Arber, H. Smith és D. Nathans részesült Nobel-díjban (1978). E. coliban figyelték meg őket, nevüket arról kapták, hogy megakadályozzák az idegen DNS invázióját, a molekula feldarabolásával. A restrikciós enzimek legfőbb előnye, hogy reprodukálhatóan, mindig ugyanott vágják el a DNS-t és a restrikciós fragmensek jellegzetes ujjlenyomatot alkotnak, ráadásul sokuk nem egymással szemben vágja el a DNS-szálat, hanem kissé eltolódva, tehát egyfonalas túlnyúló szálakat képez ún. ragadós végeket, így ezek könnyen összekapcsolódnak egymással [BÁLINT 2000].
A plazmid vektorba is ezeknek a ragadós végeknek a segítségével építik be az idegen DNS-darabot, mégpedig úgy, hogy a plazmidot adott helyen megfelelő restrikciós endonukleázokkal elhasítják, ilyenkor a plazmid egy helyen hasad, és komplementer ragadós végek keletkeznek. Ha a beillesztendő DNS-darabot is ilyen restrikciós enzimmel kezelik, akkor annak is ugyanilyen ragadós végei lesznek, majd a hasadási helyeken elvágott láncok a DNS ligázok segítségével újra egyesíthetők. A DNS-ligáz enzim feladata, hogy létrehozza a foszfodiészterkötést, és kialakítsa a folyamatos DNS szálat. Így a két enzim együttes alkalmazása lehetőséget teremt a gének „szabására-varrására”, sőt mi több, új, tetszőleges DNS-szakaszok beépítésére is. Berg (Nobel-díj, 1980), Boyer és Cohen úttörő munkássága a hetvenes évek elején a rekombináns DNS technika kifejlesztéséhez vezetett. Ennek lényege az, hogy új génszakaszok és gének állíthatók elő laboratóriumi körülmények között. Az új génkombinációk klónozhatók –vagyis megsokszorozhatók– megfelelő sejtekben a gazdasejt saját DNS-szintetizáló mechanizmusa révén, az új gének átírhatók és a transzlációt követően új fehérjék állíthatók elő.
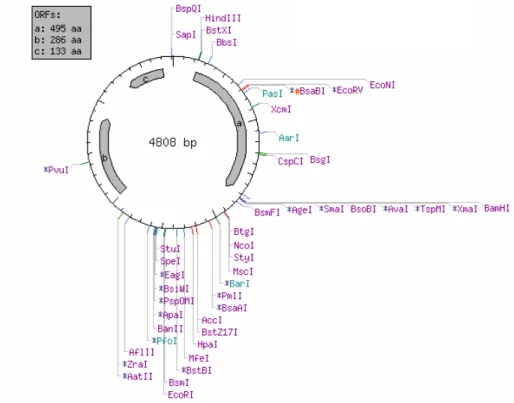
8. ábra: A pGFP-fliC vektor térképe a NebCutter programmal tervezve, afliC HindIII-BamHI helyen aza jelű 495 aminosavnyi részt kódoló szegmens.
A kísérleteimben használt egyik plazmid a pGFP, egy pUC alapú vektor volt, melyben a fliC gén a HindIII- BamHI (New England Biolabs) helyre van beligálva (8. ábra). A D3 domén génjét pedig egy pET21c nevű (Novagen) vektorba klónoztam NheI-NotI (Fermentas) restrikciós enzimek segítségével.
Ahhoz, hogy a genom egy, kitüntetett szakaszát vizsgálni tudják (pl. szekvenálni), a megfelelő DNS-szakasznak nagy kópiaszámban kell rendelkezésre állnia. Kismennyiségű DNS felszaporítása kétféle stratégiával történhet. Az egyik in vivo módszer, melyben a vizsgálandó DNS vektorba építhető, majd baktériumban megsokszorozható. A másik módszer a polimeráz láncreakció (PCR), amelyben egy kívánt DNS-szakasz rendkívüli hatékonysággal in vitro rendszerben szaporítható fel.
A transzformáció (9. ábra) a genetikai rekombinációnak az a formája, melynek során a sejt a környezetéből idegen DNS-t vesz fel és a rajta elhelyezkedő géneket, beépíti saját genetikai anyagába. A sejt az így szerzett új jelleget tovább örökíti. Transzformáció során a baktériumok aktív, energiaigényes mechanizmussal veszik fel környezetükből a DNS-t.
Kiderült, hogy nem minden sejt képes felvenni DNS-t csak az ún. kompetens sejtek, a kompetenciaállapot a sejtnek azt a fizikai állapotát jelöli, melyben fel tudja venni a DNS-t.
9. ábra:A transzformáció folyamatábrája.
A génsebészeti technikák kifejlesztésében nagy szerepe volt az E. coli transzformáció kidolgozásának. Ca2+ ionok hatására az E. coli sejtfelszín lipopoliszacharid rétege változásokat szenved, de hogy milyen módon jut a DNS a gazdasejtbe, még ma sem igen ismert mechanizmus. A Salmonella esetében a lipopoliszacharid réteg viszont a nem Ca2+
ionok, hanem elektroporáció hatására válik átjárhatóvá. A transzformánsok szelekciója azon alapul, hogy a plazmid DNS-t felvett sejtek szelektálható markert, pl. antibiotikum
rezisztenciagént tartalmaznak, ezért képesek növekedni antibiotikum tartalmú táptalajon is, ahol a nem transzformált sejtek elpusztulnak.
Kísérleteim során a transzformációhoz E. coli TOP10 (Invitrogen), XL1-Blue (Stratagene), BL21 (DE3) pLysS és Salmonella SJW2536 flagellin deficiens törzseket használtam. A transzformációt az E. Coli törzsek esetén CaCl2-os kezeléssel [SAMBROOK &
RUSSEL, 2000], a Salmonella esetében elektroporációval végeztem elektroporátor készülék segítségével (BioRad Gene Pulser).
Egy kívánt génszakasz homogén formában történő szaporítása klónozás útján hosszú, munkaigényes folyamat. De létezik egy olyan módszer, amely nagyon gyorsan automatizálva is képes egy kívánt DNS-szakasz akár milliószoros mennyiségre történő sokszorosítására (10.ábra), ha annak szekvenciája legalább az elején és a végén ismert, ez a polimeráz láncreakció (PCR), melynek módszerét 1984-ben Kary Mullis fedezte fel [BÁLINT, 2000].
A szekvencia ismeretében DNS-szintetizátorban két olyan 20-25 tagú egyszálú oligonukleotidot (primer) készítenek, amelyek komplementerek a kérdéses DNS-darab egyik illetve másik láncának 3’-végével, ezek töltik be a primer szerepét. A reakcióelegy tartalmazza a sokszorosítani kívánt DNS-mintát, a nagy moláris feleslegben levő primereket és a négy dezoxi-ribonukleozid-trifoszfátot (dNTP) és egy olyan DNS-polimerázt, amely igen nagy hőmérsékletű hőforrásokban élő baktériumból származik (Taq polimeráz, Pfu polimeráz) és ezért nagy a hőtűrése. Aktivitását megőrzi olyan hőmérsékleten is, amikor a DNS denaturálódik. A DNS-polimeráz a primereket képes folytatni, ehhez a DNS egy-egy szálát használja mintaként, aminek irányítása alatt elkészülnek az új DNS-szálak. Az egymás után beépülő nukleotidok kiválogatása a templát szál segítségével a Watson-Crick bázispárosodás törvényei alapján történik. Így az újonnan képződő DNS-szál a templát DNS- sel kettős hélixet alkot. Minden ismert DNS-polimeráz a 3’OH-hoz tud dNTP-t hozzákapcsolni (a dNTP-ből pirofoszfát kihasadása mellett), ezért a láncnövekedés mindig 5’→3’ irányú [BÁLINT, 2000].
A reakcióelegy hőmérsékletét körülbelül 95 oC-ra emelve a DNS denaturálódik, két lánca elválik egymástól. A reakcióelegyet alacsony hőfokra hűtve a nagy moláris feleslegben levő szintetikus primer molekulák hibridizálnak a megfelelő lánccal. A reakcióelegyet a polimeráz aktivitásának megfelelő hőmérsékleten tartva az enzim megszintetizálja a primerek folytatását képező láncokat, és így az eredeti DNS megkétszereződik.
Egy újabb ciklus elindítható a reakcióelegy ismételt felmelegítésével. Ekkor az újonnan szintetizált DNS-molekulák ismét denaturálódnak és így az eredetinél már kétszer több mintát (templát) szolgáltatnak a reakcióhoz. Hűtés után a nagy feleslegben jelen levő primer ismét hibridizál a megfelelő láncokkal és a polimeráz láncreakció végbemegy, ennek végén a DNS mennyisége ismét megkétszereződik. A ciklus 20-25-ször ismételhető meg, a folyamat végén a DNS mennyisége 2n-szeresére növekszik (n a ciklusok száma).
10. ábra:A PCR folyamatábrája.
A polimeráz láncreakciót ma már rutinszerűen használják a diagnosztikában és az igazságügyi orvosi gyakorlatban. Esetemben a reakciót a D3 domént és a flagellint kódoló DNS amplifikálására, illetve az irányított mutagenezishez használtam, a részletes körülményeket a kísérletek leírásánál ismertetem.
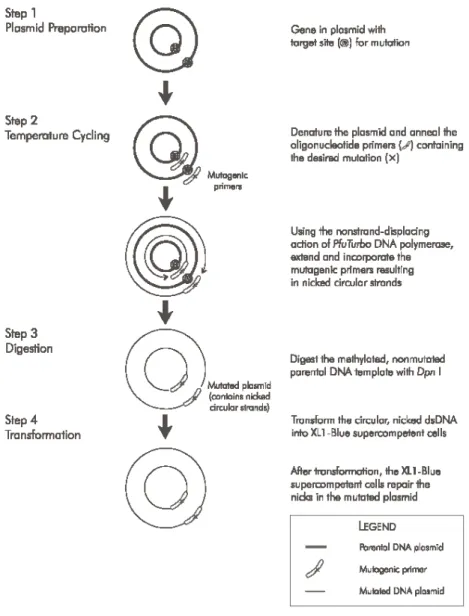
3.2. Irányított mutagenezis
Ha egy fehérje génjének klónja már rendelkezésre áll, tetszőlegesen lehet mutációkat, deléciót (törlés), inzerciót (beépítés), szubsztitúciót (helyettesítést) végezni rajta. Ezzel bármilyen klónozott DNS-darabot bármilyen kívánt szakaszra ki lehet cserélni. A mesterségesen irányított mutagenezis módszer lényege, hogy egyesszálú rövid DNS-darabot szintetizálnak (primert), amely tartalmazza a kívánt mutációt, egyébként teljesen komplementer a fehérjét kódoló génszakasszal (11. ábra). Ezt a primert hibridizáltatják a klónozott kettősszálú DNS-sel, a primerek folytatását a DNS-polimeráz végzi, a dNTP-k felhasználásával, az új láncon keletkező rést pedig a transzformálás során az XL1-Blue sejtek szüntetik meg. A lemezen kinőtt telepek nagy arányban a mutáns plazmidokat tartalmazzák, de szekvenálással pontosan meghatározható, hogy ott van-e a kívánt mutáció.
Munkám során a pGFP vektorba illesztett fliC génben helyettesítettem -megfelelő távolságban elhelyezkedő- aminosavakat hisztidinekkel, ehhez használtam az irányított mutagenezis módszert. A kísérletekben QuikChange Site-Directed Mutagenesis Kitet (Stratagene) használtam, benne a PfuTurbo polimerázt, DpnI enzimet, E. coli XL1-Blue törzset, az oligonukleotidokat pedig az MTA SZBK munkatársai készítették. A mutagenezis pontos körülményeiről a kísérletek leírásakor írok.
11. ábra:A QuikChange mutagenezis folyamatábrája.
Nem csupán irányított, de véletlen (random) mutációk is indukálhatók. A mai legmodernebb sejtmentes fehérjeszintetizáló és szelekciós módszerekkel, mint a riboszóma display vagy mRNS display óriási számú, 1012 – 1015 variáns előállítására és szelektálására (tesztelésére) nyílik lehetőség [AMSTUTZ ÉS MTS., 2001]. Ez az úgynevezettin vitro (irányított) molekuláris evolúció ma már széles körben, szinte rutinszerűen alkalmazott laboratóriumi technikává vált. A módszer három lényeges lépése a következő (1.) véletlenszerű pontmutációk generálása, (2.) véletlenszerű rekombináció előidézése a mutáns DNS- molekulák között (shuffling) és (3.) kívánt tulajdonságú fehérjét kódoló génvariánsok szelekciója (vagy szűrése).
Az irányított evolúció módszerét, olyan génkönyvtár létrehozásában kívánjuk
flagellinvariáns génjét tartalmazza, és amelyből a későbbiekben ki tudjuk választani az előállított variánsok közül azokat, amelyek egy-egy célmolekula megkötésére a legalkalmasabbak. Addig azonban, míg a könyvtár elkészül, természetben megfigyelt kötőszegmensek beépítésével kívántunk létrehozni flagellinalapú receptorelemeket, amelyekkel a felületi rögzítés és a későbbiekben alkalmazandó mérési módszer fejlesztése elkezdhető [AQUANAL PROJECT].
A génmutáció pontos tervezéséhez fontos, hogy a fehérje szerkezete harmad-, illetve negyedleges struktúrája minél részletesebben ismert legyen. Röntgendiffrakciós és elektronmikroszkópiás szerkezetanalízis segítségével egyértelmű információk kaphatók erről, és szekvencia-homológia keresésével is jó eredmény érhető el. Emellett ha ismert a fehérje térszerkezete és az aminosavak sorrendje, számítógépes grafikával, modellezéssel megkereshetők a mutagén beavatkozásra legmegfelelőbb helyek.
Esetemben az irodalomból ismeretes szekvencia homológia vizsgálat alapján látható, hogy a kialakítandó mutációk legmegfelelőbb helye a flagellinmolekula hipervariábilis régiójában, a D3 doménben lenne. Így a flagellin atomi koordinációinak ismeretében a Protein Explorer program segítségével választottam ki a D3 doménben megfelelő távolságban elhelyezkedő aminosavakat.
3.3. Gélelektroforézis
A gélelektroforézis alapelve az, hogy a töltéssel rendelkező molekulák az össztöltésüknek megfelelően elektromos térben az ellentétes töltéssel rendelkező elektród felé vándorolnak.
Az agaróz gélelektroforézis a DNS azonosítására használható, a DNS molekula foszfátcsoportjai miatt negatív össztöltéssel rendelkezik, feszültség hatására a pozitív pólus felé vándorol. A gélközeg ellenállása miatt a kisebb méretű DNS gyorsabban a nagyobb méretű lassabban fog vándorolni a gélben, így lehetővé válik a méret szerinti elkülönítés. A gélelektroforézis során az azonos molekulatömegű DNS-darabok sávokba rendeződnek. Ezek láthatóvá tétele úgy történik, hogy a géllapot planáris aromás kationok oldatába merítik (pl.
etídiumbromid-oldatba). Ezek a festékek az egymás után következő bázisok síkja közé rétegződnek, ezáltal megnő az ultraibolyafényben mutatott fluoreszcenciájuk a szabad
festékhez képest [BÁLINT, 2000]. Általánosan alkalmazott agaróz koncentráció 1 %, ez a legtöbb plazmid és PCR-termék számára is megfelelő.
Kísérleteimben a PCR termékek izolálásához, emésztések ellenőrzéséhez használtam az agaróz gélelektroforézist. A hozzá felhasznált vegyszerek a következők voltak: Agarose (Sigma, Seakem), TAE (40 mM Tris/acetát, 1 mM EDTA, pH = 8,5) puffer, 1 kb DNA- Ladder (Fermentas), stopoldat (Sigma), festékként etídium-bromid (Merck).
A DNS-nél lényegesen nagyobb méretű fehérjék elválasztásákor nem agaróz, hanem poliakrilamid gélt alkalmaznak. A fehérjéknek nátrium-dodecil-szulfát (SDS) maszkírozás hatására lesz nagy negatív össztöltése, és a módszerrel a fehérje minták tisztasága megállapítható.
Kísérleteimben, a módszert flagellinmolekula és a D3 domén azonosításához, és tisztaságának ellenőrzéséhez használtam. Az alkalmazott vegyszerek a következők voltak:
poliakrilamid, nátrium-dodecil-szulfát (SDS), ammónium-perszulfát (APS, Biorad), NNN’N’- tetra-metil-etilén-diamin (TEMED, Bio-Rad) mintapuffer (Fluka), trisz-(hidroximetil)-amino- metán (Tris), glicin, ecetsav és etanol (Reanal), Coomassie Stain festék (Biorad), kis molekulatömegű markerek (Biorad, Sigma).
3.4. Ioncserélő és affinitás kromatográfia
Kromatográfia néven foglalhatók össze mindazok az elválasztás technikai módszerek, amelyekben két fázis közötti megoszlás eredményeként válik szét valamilyen elegy komponenseire. A két fázis közötti anyagátadás alapulhat adszorpción, ionos kölcsönhatáson, diffúzión, affinitás-kromatográfia esetén pedig különleges kölcsönhatásokon. Minden kromatográfiás eljárásnak közös vonása, hogy az egyik fázis folyamatosan áramlik a másik, ún. álló fázissal szemben. Az álló fázis halmazállapota lehet szilárd vagy folyadék, a mozgó fázis pedig folyadék vagy gáz. A folyadék mozgófázisú kromatográfiás módszereket a kivitelezés módjától függően feloszthatjuk oszlop és réteg kromatográfiás módszerekre.
A kromatográfiás módszereknek nagy jelenőségük van a biológiai eredetű molekulák elválasztása során. A fehérjék tisztítására töltésük (ami a közeg pH-jának változtatásával szabályozható) alapján, jól alkalmazható az ioncserélő kromatográfia. Affinitás
enzim-inhibitor, receptor-ligandum, antigén-antitest) használható fel úgy, hogy a specifikusan kölcsönható pár egyik komponense a szilárd fázishoz van rögzítve, és képes kikötni egy oldatból a kölcsönható partnert. Az oldat egyéb komponensei ezután mosással eltávolíthatók, majd a mozgó fázis paramétereinek változtatásával a specifikus kölcsönhatást megszűntetve az elválasztandó anyag tisztán lemosható az oszlopról.
A fehérjék ioncserélő kromatográfiával történő szétválasztása a molekulák felületi töltéseinek különbözőségén alapul. Az ioncserélő kromatográfia széles körben elterjedt a fehérjék tisztításánál, izolálásánál, ugyanis a mérsékelt kötő- és leoldási feltételek mellett sértetlen, biológiailag aktív fehérjék választhatók szét egymástól nagy hatásfokkal.
Az ioncserélő töltet kötött fázisa vagy pozitív (anioncserélő), vagy negatív töltésű (kationcserélő) funkciós-csoportokat tartalmaz. Az elektrosztatikus kölcsönhatás a különböző töltésű csoportok között a kromatográfiás töltet felszínén jön létre, ahol a kötőmolekulák viszonylag szorosan egymás mellett helyezkednek el. Az ionos kötés olyankor következik be, amikor a mozgó fázis ionerőssége egy bizonyos pont alá csökken, ilyenkor az oszlop töltetén levő töltött csoportokhoz hozzákötődnek az ellentétesen töltött molekulák. Az elúció akkor következik be, amikor a mozgó fázis ionerőssége elegendően nagyra nő, amit nagyobb ionkoncentrációjú oldattal érnek el (12.ábra). A sóionok a kötött molekulákkal helyet cserélnek, amelyek így visszakerülnek a mozgó fázisba [BIOMOLECULE CHROMATOGRAPHY
PERSEPTIVE BIOSYSTEM,1996].
A fehérjék töltéseit figyelembe véve az izoelektromos pont (pI) egy fontos tulajdonságuk, ami az a pH- érték, amelynél a negatív töltések száma megegyezik a pozitív töltésekével, vagyis amikor a nettó töltés egyenlő nullával. Ha egy molekula magas izoelektromos ponttal jellemezhető, akkor semleges pH mellett pozitív töltésűvé válik és az alacsony izoelektromos pontú pedig negatív töltésűvé.
12. ábra:Az ioncserélő oszlop működése.
Mivel a flagellinmolekula pI értéke 5,5, kísérleteimben a mutáns flagellinek tisztítását ioncserélő kromatográfiás rendszer (Biorad) segítségével végeztem XK16 (Pharmacia Biotech) 25 ml-es anioncserélő oszlopon, a minták beinjektálása automatikus mintaadagoló (Biorad) segítségével történt. Vivőpufferként 20mM-os Tris (A) puffert, elúciós pufferként 20 mM Tris 150mM NaCl (B) puffert alkalmaztam.
Az affinitás kromatográfia kiválóan alkalmas biomolekulák, többek között fehérjék, antitestek elválasztására (13. ábra). Az elválasztás alapja az állófázison megkötött ligandum, és a mozgófázisban lévő minta között létrejövő specifikus kötés. Az állófázison való rögzítéshez különböző technikákat alkalmaznak, mivel fontos, hogy a ligandum kellő távolságra legyen az állófázistól, ami biztosítja a ligandum jó hozzáférhetőségét a mintamolekula számára. Az állófázisra kötött ligandum változtatásával sokféle szelektív rendszert tudnak kialakítani. Így létrehozható egy olyan rendszer, amelyben az állófázis csak a számunkra fontos fehérjemolekulát köti meg. A specifikus elválasztáshoz fontos, hogy a hordozó ne kösse meg az oldatban lévő molekulákat. Ezért hordozónak olyan anyagokat használnak, amelyek hidrofóbok, és nincs ionos töltésük.
13. ábra:Kötési, és elúciós mechanizmus az affinitás kromatográfiában.
Munkám során megkötött fémet alkalmazó (IMAC) módszert használtam, itt a fémkelátképző csoport van rögzítve az állófázison (általában imido-diacetát), és ehhez koordinálódik a fémion (Cu2+, Zn2+, Ni2+, Co2+, vagy Fe2+) úgy, hogy egy, vagy több koordinációs hely alakul ki a fehérje számára. Az imidodiacetát a fémionokat három helyen köti meg, a többi koordinációs hely szabad marad az izolálandó molekula számára. Az elválasztás elve minden fémnél azonos ugyan, de a koordinációs hely geometriája és a kötés erőssége fémenként változik. Így a fémion hatással lesz az elválasztás szelektivitására. A kötéserősség alapján a következő sort állítható fel:
Cu2+>Ni2+>Zn2+~Co2+
Néhány, a fehérje felszínén elhelyezkedő aminosav különösen a hisztidin specifikusan kötődik a szabad koordinációs helyekhez. Így a hisztidinek számától függően elválaszthatók az egyes fehérje molekulák. Az elúció alapja bármely olyan folyamat, amely megszünteti a ligandum-ligandum kölcsönhatást, a legelterjedtebb az imidazol koncentráció gradiens alkalmazása. Az imidazol kötődik az állófázishoz, így leszorítja a molekulát onnan, annál később eluálódik egy molekula, minél erősebben koordinálódik az állófázishoz [BIOMOLECULE CHROMATOGRAPHYPERSEPTIVE BIOSYSTEM,1996].
Ezt a módszert használtam a D3 domén tisztításakor, ahol a D3 doménhez csatolt His6- tag, egy 6 hisztidint tartalmazó peptidlánc a hatékony alapja az elválasztásnak. A munkához 5ml-es HisTrap HP (Amersham Pharmacia Biotech) oszlopot használtam, az állófázisra kötött fémion Ni2+ion volt, amit gyakran alkalmaznak His6-tages fehérjék tisztításakor. A felkötésnél alkalmazott puffer 20mM PB, 150mM NaCl pH=7.4 az elúciós puffer pedig növekvő (50, 100, 150, 200mM) imidazol koncentrációval 20mM PB, 150mM NaCl pH=7.4.
3.5. Izotermális Titrációs Mikrokalorimetria (ITC)
Az izotermális titrációs mikrokalorimetria egy olyan módszer, amely segítségével két molekula kölcsönhatásakor felszabaduló vagy elnyelődő hőmennyiség tanulmányozható, és ebből olyan paraméterekre lehet következtetni, mint a kötési állandó (Ka), a kötési sztöchiometria (n), entalpia (DH), és hőkapacitás (DCp) [www.microcalorimetry.com]. A műszer állandó hőmérsékleten működik, miközben lehetőség van a mérőcellában levő mintához adott mennyiségekben valamilyen reaktánst injektálni. Ha az injektált anyag reakcióba lép a mérőcellában levő oldat valamely összetevőjével, akkor a folyamat során fellépő hőcserét a készülékkel regisztrálni lehet.
A műszer a két cella fűtőköre közötti teljesítménykülönbséget (DP, differential power) méri az idő függvényében. Így ha a mintában exoterm (hőtermelő) reakció történik, a DP jel lecsökken, endoterm (hőelnyelő) reakció esetén pedig megnövekszik. Az ITC mérések hagyományos alkalmazása ligandum-receptor kötések vizsgálata, a kötőhelyek számának és a kötés termodinamikai paramétereinek meghatározása. Ehhez egy titrációs görbét vesznek fel, vagyis a receptor kötőhelyeit ligandumok befecskendezésével fokozatosan betöltik. Az injektálások során kapott egyes csúcs alatti területek egyenlők lesznek az injektálások során mért teljes hőfelszabadulással. Ezt ábrázolva a hozzáadott ligandum moláris arányának a függvényében, a kölcsönhatásra jellemző kötődési izoterma kapható meg, amelyből a kötési állandó (Ka), a kötési sztöchiometria (n), entalpia (DH), és hőkapacitás (DCp) egy kiértékelő program segítségével könnyen meghatározhatók.
Ha n darab ligandum hozzákötődik egy makromolekulához, az a következőképpen írható le:
M + X = MX MX + X = MX2
. .
MXn-1 + X = MXn
Ahol X ligandum kötődik az n azonos kötőhellyel rendelkező M makromolekulához. A folyamatra jellemző egyensúlyi állandó:
és
DG0 = -RTlnK = DH0-TDS0
ahol,DG0,DH0 ésDS0 a szabadenergia, entalpia és entrópiaváltozás egykötőhelyes reakciónál.
ITC-vel tehát a termodinamikai paraméterek viszonylag egyszerűen meghatározhatók.
Számolható a hőkapacitás változás is különböző hőmérsékleteken végzett kísérletek alapján, ami jól jelzi a kötéskor bekövetkező hidrofób kölcsönhatások megváltozását. Negatív az értéke, ha hidrofób kötések alakultak ki, és pozitív, ha ezek felbomlanak.
DCp =
1 2
01 02
T T
H
HT T
- D - D
A készülék két részből, egy termosztált, adiabatikus cellapárból, és egy injektorból áll, amellyel megadott mennyiségű ligandum injektálható a cellában lévő reaktánshoz. A készülék az injektálás eredményeként kialakuló, temperáláshoz szükséges fűtési teljesítményt méri. A hőmérséklet állandó értéken tartásához a mérő- és a referenciacella között a fellépő hőmérséklet különbséget ki kell egyenlíteni. [VP-ITC MICROCALORIMETER USER’S
MANUAL,1998].
A módszert, az előállított Ni- és As-kötő flagellinvariánsok kvantitatív kötési jellemzőinek mérésére használtam. A műszer egy nagyon érzékeny Microcal VP-ITC készülék volt. A Ni-kötő flagellinvaránsnál 10mM HEPES 150mM NaCl pH=7.0 puffert alkalmaztam, hozzá 0.2mM NiSO4,10mM HEPES 150mM NaCl pH=7.0 oldatot injektáltam.
Az As-kötő flagellin esetében szintén 10mM HEPES 150mM NaCl pH=7.0 puffert alkalmaztam, hozzá 0.2mM PAO, 10mM HEPES 150mM NaCl pH=7.0 oldatot injektáltam, illetve a molekulán belüli diszulfid-hidak megakadályozása érdekében 1mM TCEP-t (Trisz(2- karboxi-etil)foszfin) adtam hozzá.
3.6. Felületi Plazmon Rezonancia Spektroszkópia (SPR)
A felületi plazmon rezonancia spektroszkópia (SPR) olyan detektálási módszer, amellyel egy fémfelület közelében bekövetkező törésmutató változást lehet nagyon pontosan nyomon követni [VAN DER MERWE, 2000; MYSZKA, 2000]. A módszer elve, hogy ha a felületre valamilyen anyag felkötődik, vagy arról leválik, a törésmutató megváltozik, így a módszer a felületi koncentráció vizsgálatára alkalmas. A szenzorchip felületén levő fémben úgynevezett felületi plazmonok (kollektív elektrongerjesztések) vannak jelen, amelyek optikai úton gerjeszthetők. Ha a fémfelületet egy monokromatikus fénynyalábbal világítják meg, valamilyen q beesési szöggel, és amikor a nyaláb hullámszámának felület irányú komponense (k*sin(q)) megegyezik a felületi plazmonok hullámszámával (adott frekvencia mellett), létrejöhet a gerjesztés. A csatolás során a fény energiát és impulzust adhat át a fémnek, és így a visszavert fény intenzitása lecsökken. Ezt mérve megkereshető az a szög, amelynél a visszavert fény intenzitása minimális, ez lesz a rezonanciához tartozó beesési szög (qspr). Az SPR bioszenzorok ezt a rezonancia szöget mérik az idő függvényében.
Visszaverődéskor a fény kis mértékben behatol a fém belsejébe, és ott a távolsággal exponenciálisan lecsengő amplitúdójú elektromos teret hoz létre. Ennek a tartománynak a vastagsága (a behatolás mélysége) tipikusan a fény hullámhosszának nagyságrendjébe esik.
Az SPR szenzorokban a fémfelület olyan vékony (tipikusan 50 Å), hogy a lecsengő elektromágneses tér túlnyúlik a fém másik oldalára, ide helyezik a vizsgálandó oldatot. A detektálási módszer lényege az, hogy a lecsengő elektromágneses tér tartományában levő oldat törésmutatója befolyásolja a plazmon rezonanciához tartozó hullámszámot, illetve a rezonancia szöget (qspr). Ha a felületre az oldatból anyag kötődik, akkor a felület mentén a törésmutató megnövekszik, ami a rezonancia szögben is növekedést okoz. A rezonancia szög mérésével, a koncentrációval arányos jel mérhető, 1 kRU (response unit) jelemelkedés nagyjából 1 ng/mm2 koncentrációemelkedésnek felel meg [PHARMACIA BIOSENSOR AB, 1994].
Az SPR bioszenzorokat kétmolekulás ligandum-receptor, vagy antigén-antitest kölcsönhatások reakciókinetikájának és termodinamikájának feltérképezésére alkalmazzák, a két komponens közül az egyiket a felületre kötik fel (immobilizálják), a másik komponenst pedig oldat formájában áramoltatják a felkötött anyag felett. Ha a két anyag stabil komplexet képez egymással, akkor a felületen a tömegkoncentráció megnövekszik, és detektálható. A
módszer előnye, hogy rendkívül érzékeny, a mérésekhez kevés anyag (1-50 mg) elegendő, és kis molekulatömegű összetevők is közvetlenül detektálhatók.
A mérés egy 1 nl-es folyadékcellában történik, amelynek egyik falát egy speciálisan felületkezelt, kb. 1 mm2-es aranylemez (szenzorchip) képezi. Az aranylapka másik oldala egy prizmával érintkezik. A fényt az optikai rendszer ék alakban fókuszálja az aranyfelületre, egy detektorsor pedig a visszavert fény intenzitását méri a visszaverődési szög függvényében. A műszer meghatározza azt a szöget, amelyből minimális a visszavert fény intenzitása, és ez a szög érték lesz a rezonancia (SPR) jel, amely az idő függvényében regisztrálható. A módszert a Ni-kötő mutáns filamentumok Ni-kötő képességének optikai úton való detektálásához használtam. Az immobilizáció filamentum formában, aminocsoportokon keresztül, egy dextránmátrix nélküli szenzorchip (Pioneer C1) karboxilcsoportjaihoz történt kovalensen. Az injektálások alkalmával különböző koncentrációjú NiSO4 oldatot áramoltatva vizsgáltam a rezonancia szög változását. A mérésnél alkalmazott puffer 10 mM HEPES, 150 mM NaCl pH=7.0 volt.
3.7. Differenciális Pásztázó Mikrokalorimetria (DSC)
Fehérjék térszerkezetének változásait termodinamikai paraméterek, entrópia (S), entalpia (H), hőkapacitás (Cp) változása kíséri. Ezek mérésére szolgál a differenciális pásztázó mikrokalorimetria (DSC), melynek segítségével tanulmányozható különböző fehérjék hőstabilitása, valamint a natív háromdimenziós térszerkezetükből való letekeredésük. Ezáltal a molekulán belüli (intramolekuláris) kölcsönhatások erősségére (van der Waals erők, H- hidak, stb.), a molekula kompaktságára, a kooperatív egységek (domének) számára lehet következtetni.
Egy termodinamikai rendszert véve:
dH=TdS+Vdp+mdN (entalpia alakot használva),
aholT a hőmérséklet,V a térfogat,p a nyomás,m a kémiai potenciál,N a részecskeszám.
Ha a nyomás és a részecskeszám állandó (p=áll.,N=áll.), akkor a hőkapacitás a
C T dS
p dT
p N
= æèç ö
ø÷ , definíció alapján:
C dH
p dT
p
= æèç ö ø÷
Az entalpiafüggvény pedig:
( ) ( ) ( )
H T H T C T dTp
T T
= 0 +
ò
0
A kalorimetriás mérések során a minta (adott fehérje pufferben oldva) és a referenciaként használt puffer hőkapacitás-különbsége mérhető a hőmérséklet függvényében, egy adott hőmérséklettartományban „pásztázva”. Fehérjék esetében a külön-külön gyenge intramolekuláris kötőerők között együttműködés van (kooperatív kölcsönhatás), így a fehérjék sokáig megőrzik intakt szerkezetüket emelkedő hőmérséklet mellett. Azonban egy jól definiált hőmérsékletnél hirtelen elveszítik, és másodfajú fázisátalakuláson mennek át. A hőkapacitás görbéje Gauss-görbéhez hasonló, egy vagy több éles csúcsból áll.
A hőkapacitás görbék maximumhelyei, az átalakulási hőmérséklet a molekulára jellemző. A hőindukált folyamat entalpiaváltozása a hőkapacitás görbe alatti területtel (Qt) egyenlő. Meghatározásánál figyelembe kell venni, hogy a natív és a denaturált fehérje hőkapacitásai eltérnek egymástól, amelynek oka nagyrészt a natív állapotban eltemetett hidrofób csoportok felszínre kerülése.
Az úgynevezett kalorimetrikus entalpiaváltozás:
DHcal =Q Mt (M: a molekulasúly)
Az átalakulás lehet egylépcsős, ekkor kétállapotú rendszerről van szó, amely például kisméretű globuláris fehérjékre jellemző, és lehet többlépcsős, amely nagyméretű globuláris (multidomén) fehérjéknél fordul elő, és ekkor a denaturáció több intermedieren keresztül valósul meg. Az előbbi esetben D
D H
H
Vant Hoff cal
' =1 , vagyis a Van't Hoff entalpia megegyezik a kalorimetrikus entalpiával, az utóbbiban pedig jelentős eltérések tapasztalhatók a két entalpia érték között (5-10 %-os eltérés már többlépcsősnek tekinthető).
![1. ábra: A baktériumok mozgása [N AMBA & V ONDERVISZT, 1997 ] .](https://thumb-eu.123doks.com/thumbv2/9dokorg/874033.47026/11.892.120.755.500.789/ábra-baktériumok-mozgása-n-amba-amp-v-onderviszt.webp)

![3. ábra: A filamentum szerkezete [Y ONEKURA ÉS MTS., 2003 ].](https://thumb-eu.123doks.com/thumbv2/9dokorg/874033.47026/15.892.239.408.493.1033/ábra-filamentum-szerkezete-y-onekura-mts.webp)