PANNON EGYETEM MÉRNÖKI KAR
Vegyészmérnöki és Anyagtudományi Doktori Iskola
AZ ANÓDFOLYAMATOK LABORATÓRIUMI ÉS ÜZEMI VIZSGÁLATA AZ ALUMÍNIUMELEKTROLÍZISBEN
DOKTORI (Ph.D.) ÉRTEKEZÉS
Készítette:
Dr. HORVÁTH JÁNOS
Veszprém 2013
DOI: 10.18136/PE.2014.529
AZ ANÓDFOLYAMATOK LABORATÓRIUMI ÉS ÜZEMI VIZSGÁLATA AZ ALUMÍNIUMELEKTROLÍZISBEN
Értekezés doktori (PhD) fokozat elnyerése érdekében
A Pannon Egyetem Vegyészmérnöki és Anyagtudományi Doktori Iskolájához tartozóan
Írta:
Dr. Horváth János
A jelölt a doktori szigorlaton……….…..%-ot ért el.
Az értekezést bírálóként elfogadásra javaslom:
Bíráló neve:………..igen/nem ………
(aláírás)
Bíráló neve:……….).igen/nem ……….
(aláírás)
Bíráló neve:………) igen/nem ………..
(aláírás)
A jelölt az értekezés nyilvános vitáján………..%-ot ért el.
Veszprém/Keszthely, ……….
a Bíráló Bizottság elnöke
A doktori (PhD) oklevél minősítése……….
Az EDHT elnöke
TARTALOMJEGYZÉK
KIVONAT ... 5
BEVEZETÉS ... 9
1. IRODALMI ÁTTEKINTÉS ... 12
1.1 AZ ALUMÍNIUMELEKTROLÍZIS KÉMIAI ALAPJAI ... 12
1.2 AZ ÁRAMHATÁSFOKOT CSÖKKENTŐ REAKCIÓK KINETIKÁJA... 17
1.3A REOXIDÁCIÓS FOLYAMAT VESZTESÉGEI ... 18
1.4 IPARI ELEKTROLIZÁLÓ KÁDAK ÁRAMHATÁSFOKÁNAK MEGHATÁROZÁSA ... 22
1.5ELEKTROKÉMIAI KOMPONENSEK A CELLAFESZÜLTSÉGBEN ... 24
1.5.1 Elektrokémiai reakció az anódon ... 25
1.5.2 Másodlagos elektrokémiai folyamatok az anódon ... 27
1.5.3 Elektrokémiai reakció a katódon. ... 28
2. KISÉRLETI EREDMÉNYEK ... 33
2.1 LABORATÓRIUMI VIZSGÁLATOK ... 33
2.1.1 Az alumínium és nátrium tartalom meghatározása ... 35
2.1.2 A visszaoldódott alumínium és nátrium kölcsönhatása a CO2-vel ... 38
2.1.3 Az anódos áramveszteség meghatározása ... 43
2.1.4 Az áramveszteség a katódfolyamatban ... 48
2.2 ÜZEMI VIZSGÁLATOK AZ ELEKTROKÉMIAI KOMPONENSEK MEGHATÁROZÁSÁRA ... 54
2.2.1 Mérési módszer az extrapolált feszültség meghatározására ... 55
2.2.2 Az extrapolált feszültség függése a kádak technológiai paramétereitől ... 62
2.2.3 Az extrapolált feszültség különböző konstrukciójú és üzemvitelű cellákon ... 68
2.2.4. Az extrapolált feszültség kapcsolata a folyamatszabályozással ... 75
2.2.5 A kád stabilitási tartományának meghatározására ... 76
3. ÖSSZEFOGLALÁS ... 79
4. IRODALOMJEGYZÉK ... 82
5. A LEGFONTOSABB TÉZISPONTOK (MAGYAR ÉS ANGOL NYELVEN) ... 87
5.1.AZ ÁRAMHATÁSFOK FOLYAMATTANI ALAPJAINAK VIZSGÁLATA TERÉN ELÉRT EREDMÉNYEK ... 87
5.2.AZ ALUMÍNIUMELEKTROLIZÁLÓ KÁDAK ELEKTROKÉMIAI KOMPONENSEINEK MEGHATÁROZÁSA ... 88
5.3.AZ ELÉRT EREDMÉNYEK GYAKORLATI HASZNOSÍTÁSA ... 90
6. ÁBRAJEGYZÉK ... 95
7. TÁBLÁZATJEGYÉK ... 96
8. KÖSZÖNETNYILVÁNÍTÁS ... 97
9. MELLÉKLETEK ... 98
Kivonat
Az anódfolyamat laboratóriumi és üzemi vizsgálata az alumíniumelektrolízisben
Az alumínium előállítása rendkívül energiaigényes technológia. Két lehetőség kínálkozik az energiafelhasználás csökkentésére; egyik lehetőség az áramhatásfok növelése, másik lehetőség a kádfeszültség csökkentése. Bármelyik megoldási lehetőségben is elért kis eredmény - figyelembevéve a megtermelt fém alumínium mennyiségét - nagy gazdasági előnyt biztosít. Ezért a szerző azt a célt tűzte ki, hogy folyamattani alapokból, kémiai és elektrokémiai folyamatokból meghatározza az áramhatásfokot csökkentő tényezőket, valamint az általa kidolgozott elektrokémiai komponensek méréséből lehetőséget tárjon fel a kádfeszültség csökkentésére.
A szerző elemezte a kémiai és az elektrokémiai folyamatok hozzájárulását az áramhatásfok veszteséghez a Hall-Heroult szerinti alumíniumelőállítás során.
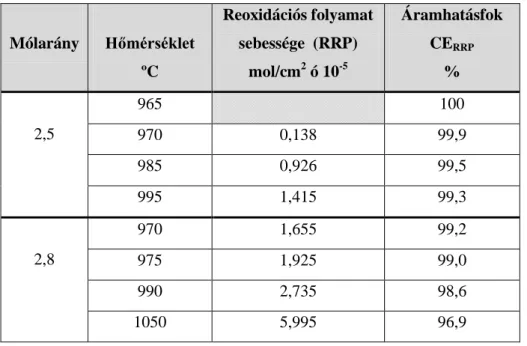
A laboratóriumi vizsgálatok során a kémiai reakciót vizsgálta a visszaoldódott fémek és a CO2 között. A visszaoldódott nátrium és alumínium reoxidációs sebességét határozta meg és számolta ezen reakció hozzájárulását az áramhatásfok veszteséghez, az elektrolit hőmérséklet, az összetétel és az anód-katód távolság függvényében. Új mintavételi és analitikai módszert vezetett be a visszaoldódott nátrium és alumínium tartalom meghatározására a kriolit-timföld olvadékban.
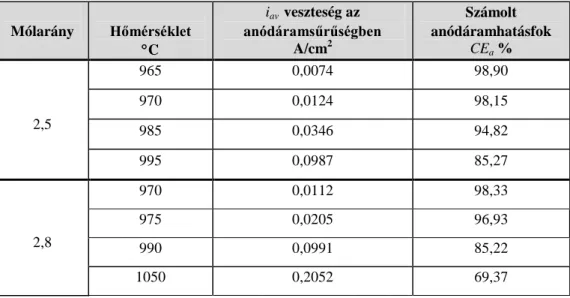
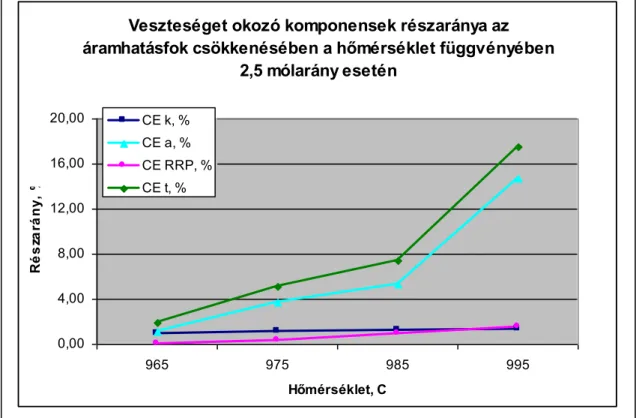
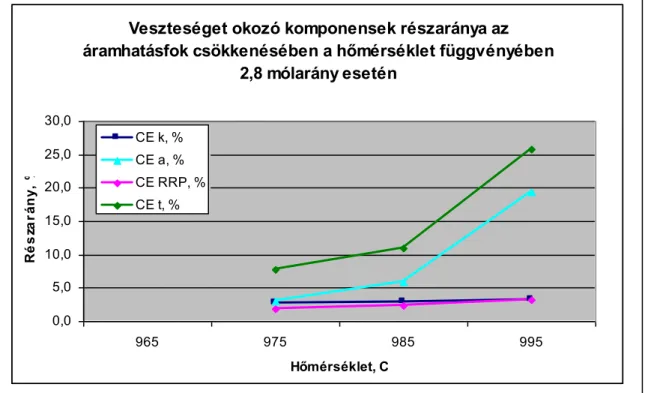
A elektrokémiai méréseket végzett, hogy kimutassa a visszaoldódott fémtartalom (nátrium és alumínium) hatását az elektródfolyamatokra. A vizsgálatok során mérte a visszaoldódott alumínium és nátrium hatását az anód- és a katódáramsűrűségben okozott veszteségre. A mérési eredmények alapján számolta a kémiai és a másodlagos elektrokémiai reakciók okozta áramhatásfok veszteségeket. Megadta a veszteségek részarányait az áramhatásfok csökkenésben.
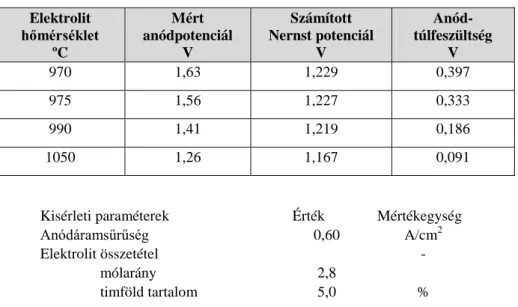
Az üzemi mérések arra irányultak, hogy meghatározza a működő alumíniumelektrolizáló kádak elektrokémiai komponenseit. A disszertáció egyik fő eredménye, hogy az elektrokémiai komponensek meghatározására üzemben is alkalmazható mérési módszert ír le. A mérési módszer a szériaáram és cellafeszültség közötti összefüggésen alapult. Szerző meghatározta az I=0 kA áramerősségre extrapolált feszültséget Vext, ami magában foglalja a Nernst potenciált és a túlfeszültségeket. A számított elektromotoros erő és a mért extrapolált feszültség Vext értékeit összehasonlította és úgy találta, hogy az extrapolált feszültség Vext mindig kisebb volt, mint a számított elektromotoros erő a 3-8% szokásos üzemi timföldtartalomnál az elektrolitban.
Az elektromotors erő (EME) és a Vext közötti különbség magyarázatára bizonyította a visszaoldódott alumíniummonofluorid részecskék depolarizációs hatását az anód reakcióban.
Megállapította, hogy a visszaoldódott alumínium depolarizációja csökkentette a számolt elektromotoros erő értékét. A depolarizációs hatás nagyságrendje arányos volt az áramhatásfok csökkenésével, ezért azt alkalmazta, mint egy indikátort, az áramhatásfok becslésére. Ezt az összefüggést igazolta különböző cella konstrukcióra és üzemvitelre.
3%-nál kisebb üzemi timföldkoncentrációnál az anód diffúziós túlfeszültségének köszönhetően, közel az anódeffekt tartományhoz, a Vext magasabb volt, mint a számított elektromotoros erő. Ilyenkor fluorid képződik, ami eltolja az elektódpotenciált és megnehezítette az I=0kA-re történő extrapolációt.
A stabil üzemviteli tartomány meghatározására üzemi mérések történtek különböző anód- katód távolságoknál és az eredményeket összehasonlította a korábban, tapasztalati úton kapott áramhatásfok vs. pólustávolság görbével. Jó egyezést kapott, igazolva, hogy az extrapolált feszültség Vext az áramhatásfok indikátora.
A disszertáció végül bemutatja az alumíniumelektrolízis áramhatásfokának meghatározására kifejlesztett gyors és hatékony mérési módszert, aminek segítségével az üzemi technológiai paraméterek úgy változtathatók, hogy lehetővé válik a villamosenergia felhasználás csökkentése. Az eredmények bizonyításra kerültek és hasznosultak hazai és számos külföldi kohóban.
Abstract
Laboratory and Plant Measurements on Anode Process in Aluminum Electrolysis
The contribution of chemical and electrochemical processes resulting in losses of current efficiency in the Hall-Heroult aluminium production process was analysed.
The chemical process taking place between the dissolved metal and the anode gas CO2 was studied under laboratory conditions. A new sampling and analytical technique was introduced to determine the dissolved sodium and aluminum content in cryolite-alumina melts.
The reaction rate of the dissolved sodium and aluminum with CO2 was determined and their contribution to the loss of current efficiency was calculated as a function of electrolyte temperature, composition and the „anode-cathode distance”.
Electrochemical measurements were carried out to detect the effect of dissolved metal content (sodium and aluminum) on the carbon anode. The principal objective of these measurements was to determine the effect of the dissolved aluminium and sodium on the losses associated with the anode and cathode current density. The current efficiency as a function of the losses - which are caused by the secondary electrochemical processes on the anode and the cathode was calculated.The rate of the different types of losses (chemical and electrochemical) in the current efficiency was given.
The plant measurements were carried out to determine the electrochemical components of the operating aluminum electrolysis cells. The measurement method based on the relationship between the cell current and cell voltage as well as their curves extrapolated from the change of the current to the zero current. This extrapolated voltage Vext includes the Nernst-potential and overvoltages. The calculated EMF (electromotive force) and Vext
were compared. It was found that the Vext was always less than the calculated EMF at 3-8%
alumina concentration range within the cell.
The difference between the EMF and Vext. is explained by the depolarisation effect of the dissolved aluminium-monofluoride in the anode reaction. It was concluded that the
Содержание (Извлечение)
Лабораторные и промышленные исследования анодных процессов в электролизе алюминия
Проводили анализ роли химических и электрохимических процессов в потери выхода по току при производстве алюминия по способу Холла- Хероля.
Лабораторными способами исследовали химические процессы между анодными газами СО2 и металлами, обротно-растворимыми. Определили скорость реоксидации обратно- растворимых натрия и алюминия с газами СО2, рассчитали долей этих процессов в потере выхода по току в зависимости от температуры и состава электролита и от расстоянии между катодом и анодом. Вводили новый способ отбора проб для определения содержание обратно растворимого натрия и алюминия в криолито- глинозёмных расплавах.
Для показания влияние обратно растворимых металлов (натрий, алюминий) на электродные процессы проводили электрохимические измерения.
Главной целю проводимых измерений было определение влияния обратно- растворимого натрия и алюминия в потере в анодном и катодном плотности тока. Рассчитали потери выхода по току, возникающие в следствиях вторичных электрохимических процессов на аноде и на катоде, в зависимости от температуры и состава электролита. Определили проценты химических и электрохимических составляющих в уменьшении выхода по току.
Заводские измерения были направлены на определение электрохимических составляющих алюминиевых электролизёров. Способ измерения было основано на взаимосвязи между силой тока и напряжения электролизных ванн, определяя с экстраполяцией напряжение при I=0. Это напряжение
Vexт содержит потенциал Нернста и перенапряжение. Сопоставили
численные значения рассчитанных э.д.с. (электродвижущие силы) и напряжений полученных экстраполяцией Vexт. Оказалось, что при содержании 2-8% глинозёма в электролите, Vexт всегда меньше чем рассчитанные э.д.с. В области низких глинозёмных концентрации (< 2%
содержания глинозёма в электролите) и близко к области анодного эффекта, Vexт было больше чем рассчитанные э.д.с.
Доказали достоверность объяснения разницы менжду э.д.с. и Vexт, участием обратно растворимых алюминомонофлюоридовых частиц в анодных процессах.
Определили, что величина э.д.с. была снижена от действия деполяризации обратно-растворимого алюминия. Поскольку порядок влияния деполяризации был пропорциональным с уменьшением выхода по току, это показатель был использован индикатором оценки выхода по току. Этот зависимость было оправдано при разных условиях работы, и у разных конструкции электролизёров.
Bevezetés
Az alumíniumelektrolízisre, mint egy olvadékban végbemenő elektrokémiai folyamatra tekintettem, amelyben kémiai és elektrokémiai folyamatok mennek végbe és meghatározzák az elektrolízis folyamatát és annak hatékonyságát.
A kutatói munka két fő területre terjedt ki: üzemi vizsgálatokkal, üzemi mérésekkel támogatni az alumíniumkohók technológiai fejlesztéseit, illetve laboratóriumi módszerekkel vizsgálni az elektrolízis folyamattani alapjait, hozzájárulva az elektrolízis során végbemenő folyamatok megismeréséhez, adatokat és ismereteket szolgáltatva az elektrolizáló kádak üzemvitelének fejlesztéséhez.
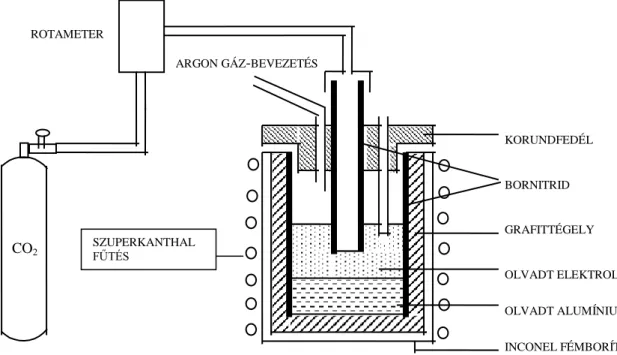
A Fémipari Kutató Intézetben, majd a későbbi Alumíniumipari Tervező és Kutató Intézet Alumíniumkohászati Osztályán intenzív és magas színvonalú laboratóriumi kutatómunka folyt, elsősorban a kriolit-timföld olvadékok fizikai-kémiai tulajdonságainak meghatározására. Ezzel egyidőben folytak az üzemi kísérletek és vizsgálatok a villamosenergia felhasználás csökkentésére és az áramhatásfok javítására.
Mivel az alumíniumkohászati fejlesztések igényelték az elektrolízis folyamattani alapjainak a vizsgálatát, ezért az volt a feladat, hogy vizsgáljuk az elektrolizáló kádakban végbemenő folyamatokat, a gyakorlati igények és elvárások figyelembevételével. Hamar nyilvánvalóvá vált, hogy elsősorban elektrokémiai módszerek alkalmazása jöhet számításba, mert nincs más lehetőség arra, hogy a folyamatokról közvetlenül a kriolit- timföld olvadékból kapjunk információt. Ezért az elvégzett mérések döntően elektrokémiai módszerek alkalmazásán alapultak, nagyteljesítményű potenciosztát és memória-oszcilloszkóp alkalmazásával. Kezdetben a mérések nagy technikai akadálya az volt, hogy nem rendelkeztünk a kriolit-timföld olvadéknak 1000 ºC-ig ellenálló szerkezeti anyaggal. Ez utóbbit sikerült megoldani bornitrid beszerzésével, amely ellenáll az agresszív fluorid olvadéknak és szigetelő tulajdonságot is mutat ezen a magas hőmérsékleten.
Az elektrolízis folyamattani vizsgálata voltammetriás vizsgálatokkal kezdődtek, grafit anódon polarizációs görbék felvételével. Ezzel párhuzamosan megkezdődtek az áramhatásfok folyamattani alapjainak vizsgálata és mérése is.
Laboratóriumi cella készült az elektrolízis során az áramhatásfok mérésére. Több cellaváltozatot is kipróbálásra került, de be kellett látni, hogy laboratóriumi körülmények között - a számos mellékreakció miatt - nem lehetséges olyan eredményeket elérni, amelyek összevethetőek az ipari eredményekkel és tapasztalatokkal. Azt is be kellett látni, hogy részelemekből kell összerakni a laboratóriumi áramhatásfok modellt. Tisztázni kellett, hogy az áramhatásfokot csökkentő folyamatok az elektródreakciókban résztvesznek-e, továbbá, hogy az oldódási folyamatok elektródreakció nélkül okozhatnak- e csökkenést az áramhatásfok értékében. Igy lényegében az áramhatásfokcsökkenést okozó folyamatokat a laboratóriumi vizsgálatok során három részelemre kellett bontani:
fém oldódás kriolit olvadékban és kölcsönhatása a széndioxiddal,
visszaoldódott fém anódós oxidációja,
visszaoldódott fém katódos redukciója.
Kísérleteket végeztünk üzemi kádak áramhatásfokának meghatározására néhány kádon az anódgáz összetételének mérése alapján, de a mért áramhatásfok adatok és a megfigyelt üzemi adatok összevetése nem volt meggyőző a módszer alkalmazhatóságáról.
Dolgoztunk a higításos technikával, réz-alumínium előötvözet illetve 198Au izotóp felhasználásával, de ez utóbbi felhasználásával is csak 2-3 napos időszakra lehetett az áramhatásfokot 1%-os pontossággal meghatározni.
Az elektrolizáló kádak folyamatszabályozásának előkészítése kapcsán az elektrolizáló kádak villamos paramétereinek teljes körű mérésére került sor. Ekkor nyílt lehetőség nagyszámú mérés lefolytatására az alumíniumelektrolizáló kádak áram-feszültség karakterisztikájából származtatható extrapolált feszültség meghatározására.
Az elektrolizáló kádak feszültségkomponenseinek 40-45%-át kitevő elektrokémiai komponensek mérése, összefüggésük vizsgálata az elektrolízis technológiai paramétereivel nagy gyakorlati és elméleti jelentőséggel bír, de üzemi mérési adat, mérési módszer nem állt rendelkezésre. Az irodalomban üzemi kádra vonatkozó mérési eredmények, tekintettel azok közvetlen technológiai kapcsolatára, sajnos nem találhatók, ezért az elvégzett méréseknek nagy gyakorlati jelentőség tulajdonítható.
Az elektrolízis folyamatszabályozása egy képzett ellenállás érték mérésén alapul, az elektrolizáló kádban végbemenő elektrokémiai reakciókat kisérő feszültségkomponenseket, az egyensúlyi potenciált, az anód-katód túlfeszültségeket az elektrolízis paramétereitől függetlennek tekintik, eredőjét 1,55V-1,75V közötti intervallumban konstans értékre állítják be a különböző üzemekben.
Laboratóriumi vizsgálataim során a felvett polarizációs görbékből megállapítható, hogy az anódpotenciál értéke 1,18V és 2,56V között változott. Jogos a feltételezés, hogy ez a mintegy 1,5V-os változásnak meg kell jelennie az extrapolált feszültség értékében is. Az a feltételezés is ésszerűnek tűnt, hogy összefüggés állapítható meg a feszültség változás és az elektrolízis paraméterei között. Az elektrokémiai komponensek változnak az idő függvényében és a változásuk trendjének meghatározása alkalmas lesz az elektrolízis folyamat ellenőrzésére.
Ennek érdekében üzemi vizsgálatokat végeztünk és módszer kidolgozására került sor az elektrolizáló kádak extrapolált feszültségének meghatározására a szériaáram többlépcsős csökkentésével. Az extrapolált feszültség függése az elektrolízis folyamat paraméterektől leherővé tette a rendellenes üzemviteli állapotok korai kimutatását.
Az alumíniumkohászati célra kifejlesztett mérésadatgyűjtő- és feldolgozó rendszerünkkel lehetőség nyílt arra is, hogy mérések végezzünk, külföldi megbízásaink keretében, - különböző konstrukciójú és -üzemvitelű elektrolizáló kádakon az extrapolált feszültség meghatározására. A kapott extrapolált feszültségek alkalmasak: a technológia minősítésére, az áramhatásfok becslésére, és az üzemvitel stabil tartományának meghatározására.
A számított elektromotoros erő és a mért extrapolált feszültség közötti eltérés okai igazoltnak tekinthető. Erre a laboratóriumi vizsgálatok eredményei adták az alapot. A visszaoldódott alumínium anódos oxidációjának depolarizációs hatása az ok, amelynek következtében az extrapolált feszültség mindig kisebb, mint a számított elektromotoros erő értéke 3-8% közötti üzemi timföldkoncentráció tartományban.
A kádellenállás változása az idő függvényében is elemzésre került és tapasztaltuk, hogy a szériaáram kismértékű ingadozását a kádellenállás nem követi az Ohm törvény szerint.
Az eltérés lehetséges okait elemezve az a köverkeztetés vonható le, hogy a szériaáram- erősségében már egy kismértékű (10-15%) ingadozás is felhasználható az üzemvitel ellenőrzésére elsősorban a timföldadagolás szabályozására, az anódeffektek számának csökkentésére, valamint a rendellenes működés korai kimutatására.
1. Irodalmi Áttekintés
1.1 Az alumíniumelektrolízis kémiai alapjai
Nagyszámú könyv jelent meg az alumíniumelektrolízis témakörében, amelyek áttanulmányozása az első lépés ahhoz, hogy megértsük az alumíniumelektrolízis alapjait.
Az ebben leírtakat kell ismerni, mind az elméleti alapokat, mind az elektrolízis gyakorlatát ahhoz, hogy kérdéseket tegyünk fel és a problémákat megérthessük. Az első tudományos igényű könyvnek az „Aluminium Electrolysis - Chemistry of Hall-Heroult Process” című, 1977-ben megjelent könyvet tekinthetjük. Ezt hamarosan követte a második kiadás, mely 1982-ben jelent meg (2). E könyv (monográfia) legnagyobb érdeme az, hogy a korábban szinte valamennyi, az alumíniumelekrolízis folyamataival foglalkozó közleményt feldolgozza a kezdetektől 1982-ig. Az elméleti- és kutatómunkákat az olvadékok fizikai-kémiájában és elektrokémiájában alaposan elmélyülő kémikusok nézőpontjából tekintették át. Ez a könyv mértékadó és kiindulási pontnak tekinthető az alumíniumelektrolízis kémiájának megértésében, a folyamatok vizsgálatában és magyarázásában. Valamennyi, az elektrolizáló kádban végbemenő folyamatot tárgyalja oly módon, hogy a gyakorlati elektrolízisről szó sem esik. Részletes elméleti alapok után írták meg a szerzők az elektrolízis gyakorlati kérdéseit bemutató könyvet „Aluminium Smelter Technology” címmel, amelyben a korábbi empirikus alapokra épülő tárgyalási mód helyett az előző könyvben tárgyalt kémiai alapokra építve mutatták be az alumíniumelektrolízis gyakorlatát (3).
E fenti két kiváló könyvet 1986-ban követte az “Understanding the Hall-Heroult Process for Production of Aluminium” című könyv (4). A szerzők célja az volt, hogy áttekintést adjanak arról, hol tart a Hall-Heroult eljárás elméleti alapjainak kutatása. Bemutatták a termokémia, a szénkémia, az olvadt sók kémiája és elektrokémiája terén elvégzett kutatómunka eredményeit, és azt is, hogy miként hasznosultak azok a gyakorlati elektrolízisben az idők során.
E fenti három könyv egymásra épül, mérföldkőnek tekinthetők abban az értelemben is, hogy a továbbiakban már nem lehetett empirikus alapon tárgyalni az alumíniumelektrolízis gyakorlatát. A könyv megjelenése után a jelenségek, a gyakorlati megfigyelések magyarázatát a könyvben leírt fizikai-kémiai és elektrokémiai elvek, módszerek alapján kell és szabad megközelíteni. A szerzők további érdeme, hogy szinte a század elejétől megjelent valamennyi publikációt feldogozták, azokat próbálták értékelni
Az irodalmi feldolgozás során csak azokra a közleményekre hivatkozunk, amelyek túlmutatnak e könyvekben leírtakon, de ha mélyebb magyarázatot tartunk indokoltnak, megadjuk a kiindulási forrásokat is, különösen akkor, ha van kapcsolódó hazai kutatási eredmény.
A Hall-Heroult eljárásra vonatkozó alapvető ismereteket, folyamatokat, cella- konstrukciókat nem tárgyaljuk, mert azok hozzáférhetők a www.world-aluminium.org (5) oldalain.
A végbemenő fontosabb kémiai reakciók, amelyek meghatározzák az energia felhasználást:
Az elektrolízis elsődleges folyamata:
f C sz Al f CO g
O
Al2 3 3 4 3 2
2
Ennek a reakciónak az energiaszükséglete termodinamikai adatokból kiszámítható.
Feltételezve a telített timföldtartalmat és azt, hogy a fenti reakció kvantitative megy végbe, a képződési entalpia az alábbi egyenlettel számolható (6,7):
nF GE0 0
/
ahol: Érték Mértékegység
E0 reverzibilis, standard potenciál - V
G0 a képződési szabadentalpia - kJ/mol
n elektronszám változása 12 -
F Faraday állandó 96500 J/V
A képződési szabadentalpia a fenti reakcióra (8):
2
0
2 3
0
0 G CO G Al O
G
A Nernst egyenlet módosítja a standard, reverzibilis potenciált az aktuális aktivitásokkal az alábbi egyenlet szerint:
e
e E RT nF K
E 0 / ln
ahol: Mértékegység
Ee egyensúlyi reverzibilis potenciál
V
R gázállandó -
Az adott értekekkel számolva az egyensúlyi reverzibilis potenciál Ee értéke -1,23V.
Az alumínium, a CO2 és a szén (karbon) közel vannak a standard állapotukhoz, aktivitásuk egynek tekinthető. A timföld aktivitását meghatározták kísérleti úton, az alábbi egyenlettel számolták (9,10).
2 3 2 3
2.773
2 aktuálisAl O /telítésiAl O aAL O
Fontosnak tartjuk megemlíteni, hogy gyakran ezt az egyensúlyi reverzibilis (Nernst) potenciált Ee, mint kémiai munkát azonosítják az EAl értékkel, amely annak a reakciónak a feszültség ekvivalense, amely során az alumíniumot előállítják.
A feszültség ekvivalenst az alumínium előállítására az áramhatásfok ismeretében a következő egyenlet szerint lehet számolni:
x
CO
x
CO Alx C O
xAl
3
4 2
3 2
1
6 1
2
2 3 2ahol: Érték Mértékegység
x x=1 esetén az áramhatásfok 100 %
nF CE H EAl * /
ahol: Érték Mértékegység
H a fenti reakció entalpia változása 845 kJ/mol
CE áramhatásfok - %
Bevezetve az áramhatásfokot megkaphatjuk az aktuális feszültség igényt. A CO illetve a CO2 tartalom kiszámítható az áramhatásfokból a Beck egyenlet felhasználásával, amely a Pearson-Waddington egyenlet módosításának tekinthető (11).
CE
GCO
200 2 % 8 /
%
CO CO
100 %
%
2 ahol: Érték
G állandó, blokkanód esetén 1,05 G állandó, Söderberg anód esetén 1,19
A fentiek alapján az alumínium-előállításának feszültségigénye számolható a következő egyenlettel:
2
2
% 2
%
/ 0002847 .
0 300 . 2
% 0005099
. 0 7000 . 3
% 100
%
CO CO
T CO
T CO
CE
EAl b b
ahol: Mértékegység
E Al Al előállítás feszültségigénye V
CE áramhatásfok %
Tb elektrolit hőmérséklete °C
Az alumínium előállításának feszültségigénye nem mérhető, nem jelenik meg az elektrolizáló kád feszültségkomponensei között, ezért gyakran helytelenül használják fel, mert keverik a feszültségmérlegben megjelenő feszültségkomponensekkel (6). Az alábbi Táblázat I-ben bemutatjuk a Hall –Heroult kád feszültség komponenseit.
Táblázat I A Hall –Heroult cella feszültségkomponensei
Feszültségkomponensek Közelítő
feszültségérték V
Al2O3 bontási feszültsége 2,2
A szénanód depolarizációja 1,1
Al2O3 bontási feszültsége szénanódon 1,1
Az anódos túlfeszültség (reakció) 0,5
Az anódos túlfeszültség (diffúzió) 0,02
A katódos túlfeszültség 0,08
Elektromotoros erő 1,7
Az elektroliton eső feszültség 1,65
A gázbuborékok által okozott feszültségesés 0,2
Feszültségesés az anódon 0,25
Feszültségesés a katódon 0,5
Feszültségesés az áramvezetőkön 0,25
A timföld bontási feszültségét el kell érni, amelynek értéke 2,2V. Szénanódot alkalmazva a bontásra csak 1,1V elektrokémiai munka áll rendelkezésre. Az elektrolízis során a konstans áram fenntartásánál túlfeszültségek lépnek fel, amely túlfeszültségek és az egyensúlyi potenciál összegét nevezzük elektromotoros erőnek (EME).
A Táblázat I-ben látható, hogy az elektromotoros erő értéke 1,7V, amelyet szintén és gyakran tévesen az alumíniumelőállítás feszültségigényével azonosítanak. Erősítette ezt a téves felfogást az a tény is, hogy az alumíniumelektrolizáló kádak folyamat- szabályozásának alapjául szolgáló kádellenállás érték számításánál az alábbi egyenletet használják:
V EME
IR cella
/
ahol: Mértékegység
R kádellenállás µΩ
V cella kádfeszültség V
EME elektromotoros erő V
I szériaáram kA
Ebben az egyenletben is az EME értékét konstansnak tételezik fel és gyakran összekeverik az alumíniumelőállítás feszültségigényével. A feltételezett EME-ből számolt energia nem elegendő a timföld bontásához, ezért a bontáshoz szükséges többlet energia- igényt az elektrolízis folyamata az elektrolitból vonja el.
A képződési energiából számolt alumíniumelőállítás összes energiaigénye (Hö) meghatározható az alábbi egyenlettel (2):
91 , 4 / 43 ,
1
Hő x
ahol: Érték Mértékegység
∆Hö képződési entalpia - kWh/kgAl
x x=1 esetén az áramhatásfok 100 %
100%-os hatásfok esetén (x=1) az elméleti érték 6,34 kWh/kgAl értéknek adódik.
Az elektrolízis folyamat energiahatásfoka (EE) az alábbi egyenlettel határozható meg:
EE = energiafelhasználás az Al előállítására/ össz energia felhasználás
ahol: Mértékegység
EE energiafelhasználás hatásfoka %
Az energiafelhasználás hatásfoka (EE) viszonylag alacsony érték (35-45%), ez főképpen a nagy hőveszteségnek tulajdonítható (12).
Az áramhatásfok befolyásolja a fajlagos energiafelhasználást, amely a következő egyenlet szerint számolható:
CE V
Eef
2 , 98
cella/
ahol: Érték Mértékegység
Eef villamosenergia felhasználás - kWh / kgAl
Vcella kádfeszültség - V
CE áramhatásfok - %
Faraday ekvivalens 2,98 -
Ebből az összefüggésből következik, hogy az energiafelhasználás csökkentésének módja a kádfeszültség csökkentése és/vagy az áramhatásfok növelése.
Az alacsony energia hatásfok javítására két lehetőség kínálkozik: javítjuk az áramhatásfokot, vagy csökkentjük a cellafeszültséget.
Ezzel összhangban a munkám során azt a célt tűztem ki, hogy feltárjam az áramhatásfok folyamattani alapjait, továbbá ipari alkalmazásra is alkalmas módszert dolgozzak ki az elektrolizáló kádak feszültségkomponenseinek 40-45%-át kitevő elektrokémiai komponensek meghatározására.
1.2 Az áramhatásfokot csökkentő reakciók kinetikája
Az alumíniumelektrolízis hatásfokát Faraday törvénye határozza meg. A ténylegesen előállított/termelt fém mennyisége minden esetben kisebb, mint az elméletileg lehetséges, mert másodlagos reakciók is lejátszódnak. E másodlagos reakciók csökkentik az áramhatásfokot.
Az általánosan elfogadott álláspont, hogy a fő veszteség az elektrolízis áramhatásfokában az a reakció, amely során a CO2 gáz reagál az alumíniummal.
Ha feltételezzük, hogy a CO2 az elsődleges anódtermék, akkor az áramhatásfokot, a CE értékét kiszámíthatjuk a Pearson- Waddington egyenlet segítségével is az alábbiak szerint:
2 /
% 50 2 /
%
100
CO CO2CE
Az tény, hogy ez az egyenlet mind laboratóriumi, mind üzemi körülmények között csak közelítéssel adja meg az áramhatásfok értékét azért mutatja, hogy a visszaoldódott fém reoxidációja a CO2 –vel a veszteség fő komponense (11).
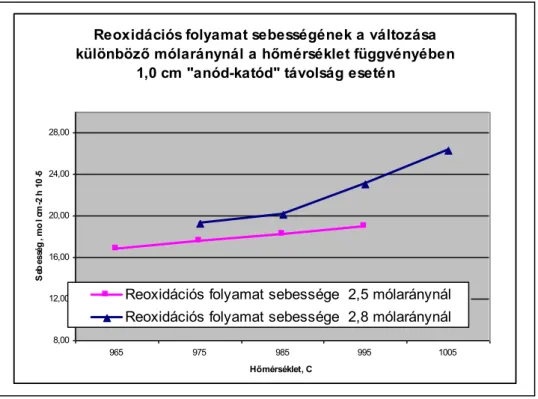
1.3 A reoxidációs folyamat veszteségei
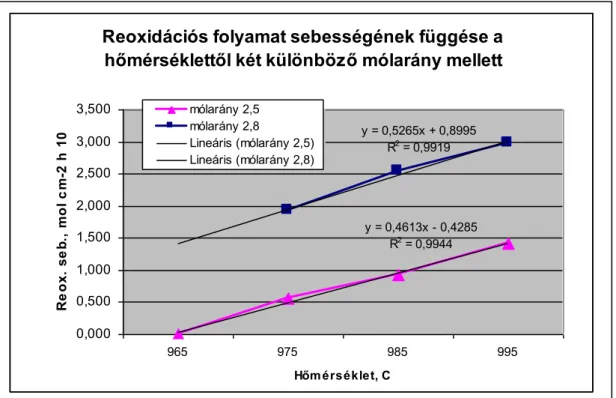
A reoxidációs folyamat az anód és a katód termékek rekombinációjával megy végbe, különböző mechanizmusok szerint és a végbemenő folyamatok kinetikája is különböző lehet attól függően, hogy laboratóriumban vagy üzemi kádban vizsgáljuk.
Az olvadt alumínium reagál az elektrolittal az alumínium/elektrolit határfelületen. Van olyan nézet (12), hogy az oldódó részecske kolloidális, vagy finoman eloszlott alumínium formában megy át az olvadékba. Termodinamikailag, gőznyomás mérésekre alapozottan kimutatták (13), hogy nátrium (Na) és alumínium-monofluorid (AlF) fog képződni az alábbi egyensúlyi reakciók szerint:
3
33
NaF Na AlF Al AlF AlF
Al
3
2
3Az alumínium vagy az alumínium által redukált részecskék diffúziós transzport révén az elektrolit/fém határrétegen keresztül jutnak át az elektrolitba.
A reoxidációs folyamat következő lépése az, hogy a konvektív transzport elmozdítja ezeket a redukált részecskéket a határfelületről. A széndioxid buborékok konvektív transzport révén kilépnek az anódból és oldódnak az elektrolitban. Redukált részecskék találkoznak CO2-vel az anód katód térben és meghatározzák a kémiai reakció zónáját.
Megállapították (12), hogy CO2 oldhatósága sokkal kisebb, mint a fém oldhatósága az elektrolitban. Azt is valószínűsítették, hogy a kémiai reakció az anód határrétegben megy végbe a gázbuborék határfelületén. Ennek következtében ez a hatás megnöveli a CO2
oldódási sebességét. A kémiai reakció révén ismét oxid keletkezik, amelynek oldódni kell és transzport révén az elektrolitba kell jutnia.
A keletkezett CO gáz következtében csökken a CO2 gáz aktivitása is. Az alumínium és/vagy a redukált részecskék egyensúlyi oldhatósága függ az elektrolit összetételétől és hőmérsékletétől.
Amikor az alumínum érintkezik az elektrolittal, az elektrolit opálossá válik, diszpergált részecskék keletkeznek és kilépnek az olvadt alumínium felületéről; az ily módon visszaoldódott alumíniumot kolloidális fémködnek nevezték el.
Számos kutató megfigyelte és a lehűtött mintákból kimutatta, hogy az olvadékba visszaoldódott fém-cseppecskék átmérője 1-15m között változik. Azt is megállapították, hogy ezek a méretek túl nagyok ahhoz, hogy azok az alumíniumfluorid diszproporcionális reakciójából keletkezzenek a hűtés során (14). Számos vizsgálatot végeztek a Fémipari Kutató Intézetben (15,16) és a Veszprémi Vegyipari Egyetemen is (17) - megelőzve Bratland eredményeit - és jutottak hasonló következtetésre.
A diszpergált alumínium cseppek az elektrolitban nem oxidálódtak, amikor oxigént, argont vagy CO2 gázt vezettek be az elektrolitba (18).
A CO2 oldhatóságának vizsgálata kapcsán Bratland (13) arra a további következtetésre jutott, hogy a diszpergált alumínium cseppek jelen vannak a Hall- Heroult cellában, de az oxidációs folyamat csak akkor mehetne végbe, ha az alumínium és a CO2 oldódási folyamata is végbemenne. A CO2 mért oldhatósága az elektrolitban egy nagyságrenddel kisebb, mint az alumínium oldhatósága, ezért az oldott CO2 csak nagyon korlátozottan képes reagálni a csak fizikailag oldott alumíniummal. Így jogos az a feltételezés, hogy a redukált részecskéknek oldódniuk kell, mielőtt kémiai reakcióba lének a CO2-vel. Kvande (12) vizsgálati eredménye szerint a nátrium és az alumínium-monofluorid reagál a CO2- vel.
Nincs még egyetértés abban, hogy mely részfolyamat a sebességmeghatározó a teljes reoxidációs folyamatban. A hazai vizsgálatok szerint (17) a folyamat sebesség- meghatározó lépésének az elektrolit/fém határfelületén végbemenő tömegátadási folyamatot tekintették.
Gerlach és Weber (18) azt állítja, hogy a kémiai reakciók sokkal nagyobb sebességgel mennek végbe, mint a tömegátadási folyamatok.
A reakció sebességmeghatározó lépését azért nehéz meghatározni, mert a határfelületeken a koncentrációgradienseket nem ismerjük, azokat kísérleti úton meghatározni igen nehéz.
M.Arthur (19) megkísérelte a koncentrációgradiensek meghatározását üzemi elektrolizáló kádban, olymódon, hogy mintát vett az elektrolitból, a mintákat lehűtötte, és HCl-dal
Nagy koncentrációgradienst talált a fém/elektrolit határfelületen, aztán csökkent a visszaoldódott fém koncentrációja, míg az anódhoz közeledve és az anód határfelületén ismét nagy koncentrációváltozást tapasztalt.
Thonstad és Rolseth (20,21) platina elektródot használtak a koncentrációprofil meg- határozására. A határfelületeken nagy koncentrációváltozást tapasztaltak, míg az elektrolitban mérhető különbségeket nem mutattak ki a visszaoldódott fém koncentrációjában.
Az áramhatásfok meghatározására laboratóriumi körülmények között számos vizsgálatot végeztek a paraméterek függvényében. Az egyik megoldás szerint egy alumíniummal bevont wolfram elektródra, mint katódra választották le az alumíniumot hosszú idejű elektrolízissel, majd a katód mennyiségi növekedéséből határozták meg az áramhatásfokot (22,23). Nagy szórással kaptak laboratóriumi mérési eredményeket az áramhatásfok értékére, mert az elektrolízis kísérletek során más tranziens jelenségek is végbemennek a laboratóriumi cellában. A nátrium adszorpciója játszódik le a grafittégelyben, egészen annak telítődéséig, lényegében az egész kísérlet során. A kisérleti cellákban eltérnek a tömegátadási és a keveredési körülmények az üzemi viszonyoktól. Megállapítható volt, hogy laboratóriumi vizsgálatokkal nem sikerült oyan megbízható adatokat kapni, amelyek összevethetők az ipari adatokkal.
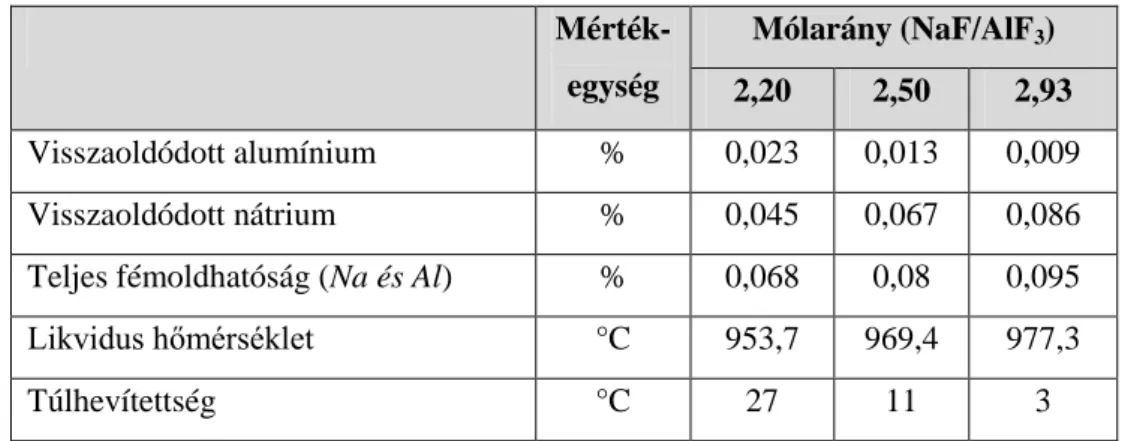
Az áramhatásfok laboratóriumi meghatározásának reprodukálhatóságát vizsgálta Balázs (24,25,26,27) a paraméterek függvényében. Négy-négy párhuzamos mérést végzett és a relatív értékeket hasonlította össze. Ezzel a módszerrel állapította meg, hogy az áramhatásfok függ az ún. túlhevítettségtől, amelyet az adott összetételű elektrolit likvidusz hőmérséklete és az elektrolit tényleges hőmérsékletének különbségeként határozott meg. A túlhevítettség növelésével az áramhatásfok lineárisan csökkent. A kapott áramhatásfok adatok nagyon alacsony értékűek voltak, de a módszer alkalmasnak bizonyult arra, hogy tendenciákat határozzanak meg az áramhatásfokot befolyásoló tényezőkre (28,29).
Áttekintve a laboratoriumi áramhatásfok-vizsgálatok ereményeit megállapítható, hogy a kiterjedt vizsgálatok ellenére a tényleges áramhatásfokot egy kísérlettel nem lehet meghatározni, mivel másodlagos tranziens folyamatok is végbemennek a laboratóriumi kísérleti cellában. Sajnos emiatt a kísérleti adatok jelentős szórást mutattak.
Tekintettel arra, hogy nem volt egyértelmű kép az áramhatásfokot befolyásoló tényezőkről, megpróbálták számítógépes modellezés révén megközelíteni az áramhatásfok értékét.
Robl, Lillebuen és Evans (30,31,32) fejlesztettek ki matematikai modelleket a reoxidációs folyamat leírására.
Robl (30) azt tételezte fel, hogy a visszaoldódott, vagy diszpergált fém transzportja az olvadt fémből és a CO2 transzportja az anód felületéről kiindulva diffúzióval és konvekcióval megy végbe. A diffúziós transzport az elektrolitban minden egyes határfelületen egy vékony filmrétegben játszódik le mind a fém, mind a CO2 esetén. A konvekciós transzportfolyamatot számította és ekkor az elektromágneses erők okozta fém áramlási sebességet vette figyelembe.
Lillebuen (31) feltételezte, hogy a konvekció az elektrolitban gyors, abban koncentrációgradiensek nem alakulnak ki. A koncentrációgradiensek csak a határfelületeken: a fém/elektrolit és a gázbuborék/elektrolit határfelületen alakulnak ki.
Feltételezte a továbbiakban azt is, hogy a redukált részecskék reoxidációs folyamata gyorsan megy végbe az olvadékban. Igy lényegében filmelméletet használt a komponenstranszportok leírására.
Evans (32) az elektromágneses terek által okozott erőhatásokat hasonló módon számolta ki, mint Robl, de elhanyagolta a gázok által okozott erőhatásokat az elektrolit áramlásának számításában. Azt mutatta ki, hogy az olvadt alumínium transzportját a határfelületen a felületi feszültség határozza meg. Azt tételezte fel, hogy a redukált részecskék tömegátadási transzportja a fém/elektrolit határfelületén a sebességmeghatározó folyamat.
Megitélésünk szerint a Robl-modell jól kezeli a konvektív transzportot, de a határrétegben kialakult koncentrációviszonyokat és a transzport folyamatokat a határfelületeken leegyszerűsíti. A Lillebuen-modell viszont jól kezeli a határrétegben kialakult transzportfolyamatokat, de nem számol a konvekció hatásaival. Bevezette a sebesség-különbségi tényezőt, amelyet az elektrolit és a fém alumínium áramlási sebességének különbségeként definiált.
A fent ismertetett három feltételezés alapján úgy gondolom, hogy Robl és Lillebuen modelljének kombinációja adna egy jobb megoldást az áramhatásfokot befolyásoló transzportfolyamatok leírására.
Feltételezhető, hogy a fém reoxidációs folyamata a következő lépésekben megy végbe:
1. a fém oldódása a fém/ elektrolit határfelületen,
2. az oldott fémet tartalmazó elektrolit tömegátadása a gáz/elektrolit határfelületre,
A reakció sebességét meghatározó lépés kimérése mind laboratóriumi, mind üzemi körülmények között nehézségekbe ütközik a nehéz kísérleti körülmények miatt.
Ezen területen végzett nagyszámú kísérlet alapján néhány tendencia azonban megállapítható:
olyan körülmények között, amikor keverés, vagy konvekció következtében az anyagtranszport korlátozott, akkor a határfelületi reakció a sebességmeghatározó;
amikor nagy intenzitású keverés következtében gyors a tömegtranszport, akkor a fém beoldódásának a sebessége a meghatározó;
normál esetben a fém visszaoxidálásának sebessége arányos az alumínium aktivitásával, illetve a fém oldhatóságával.
1.4 Ipari elektrolizáló kádak áramhatásfokának meghatározása
Két módszer ismert az ipari kádak áramhatásfokának meghatározására:
1. higításos módszer, nyomjelző alkalmazásával, 2. az anódgázok összetételének meghatározása.
A higításon alapuló módszernél réz előötvözetet használtak nyomjelzőként, hogy az olvadt alumíniumban 0,007% réztartalom legyen a kiindulási koncentráció. Ennek eredményeképpen 30 napos időszakra‚ 1%-os pontossággal kaptak eredményeket az áramhatásfok értékére (33).
A módszer pontosságának növelésére több más nyomjelző anyagot is alkalmaztak.
198Au izotópot alkalmazott nyomjelző anyagként Winkhaus (33). Egy egyhetes periódusra tudta meghatározni az áramhatásfokot ± 1% -os pontossággal.
A legjobb eredményt az ipari áramhatásfok meghatározására Grjotheim és munkatársai (34) értek el, akik már 2-3 napos intervallumra tudták meghatározni az áramhatásfokot
1%-os pontosággal. Ehhez nagyszámú mintavételre és elemzésre volt szükség ahhoz, hogy a kádban levő fémmennyiség-idő összefüggés meredekségéből az óránkénti termelt mennyiséget meg lehessen határozni.
Ezt a mérési módszert adaptáltuk mi is és felhasználtuk kísérleti kádak áramhatásfokának a meghatározására. A kapott fémmennyiség-idő diagramokból, azok meredekségéből számoltuk a napi termelési mennyiségeket, valamint az áramhatásfokot (35).
Az anódgázok összetételének meghatározása egy kézenfekvő megoldásnak tűnt az
A laboratóriumi cellákban az áramhatásfokot úgy határozzák meg, hogy a kísérlet során felszabaduló teljes gázmennyiséget összegyűjtik és elemzik. Azzal a feltételezéssel számolják az áramhatásfok értékét, hogy a timföldből az oxigéntartalom teljes egészében CO-dá és CO2-dá alakul át. Az alumínium veszteséget kizárólag az alumínium oxidációja okozza, ami pedig a CO képződésével arányos. Az ipari elektrolizáló kádakra csak becsülni lehet a felszabaduló gázok mennyiségét. A kilépő gázok egy részét lehet csak elemezni, feltételezve azt, hogy ez az összetétel jellemzi az anódgáz összetételt az egész kádra vonatkozóan.
A mintavétel során az anódgázok levegővel higulhatnak, számos mellékreakció is lejátszódik a CO2 és a szén (karbon) között CO képződésével. A szénanódból felszabaduló gázok is befolyásolják a CO2 és a CO arányt és így az áramhatásfok értékét is.
A nagy gyakorlati jelentőségre való tekintettel korrekciós faktorokkal, tapasztalati tényezőkkel módosították a Pearson-Waddington egyenletet az áramhatásfok számítására.
Mindezek ellenére az áramhatásfok csak nagy szórással határozható meg, csak a tendenciák felismerésére alkalmas, de nem teszi lehetővé pontos összefüggések megismerését. Ezt a megállapítást McMinn (36) is megerősítette az üzemi vizsgálatok eredményeire hivatkozva.
Tabereaux és munkatársai (37) összefoglalták az összes vizsgálati eredményt és a korrekciós tényezőket, amelyeket üzemi kádak áramhatásfok értékére és az anódgázok összetételére kaptak. Az áramhatásfokot a Pearson-Waddinton egyenlet különböző faktorokkal történt módosításával kapták meg és értékelték az üzemi adatokkal történő összehasonlításban. Az a megállapításuk, miszerint az ily módon végzett áramhatásfok meghatározások csak tendenciák kimutatására alkalmasak, teljes mértékben elfogadható.
Söderberg cellák esetén nem mindig kaptak jó korrelációt az üzemi paraméterekkel, az anódgáz összetételének elemzése alapján meghatározott áramhatásfok értékek is csak korlátozottan használhatók fel, elsősorban trendek és optimalizálási feladatok megoldására.
Meg kell említeni, hogy az Aluterv-FKI-ban is folytattunk kísérleteket az ipari elektrolizáló kádak anódgáz összetételének a meghatározására Hartmann-Braun infravörös gázelemző URAS-2T felhasználásával, amelyet speciálisan ipari alkalmazásra fejlesztettek ki. Azonban az agresszív HF gáz szűrése és a porleválasztás után, a higulás
1.5 Elektrokémiai komponensek a cellafeszültségben
Az elektrokémiai komponensekből és az ohmikus komponensekből a következő kádfeszültség adódik (6):
a c ex
a k
cella E I R x L AB R R
V 0
*
1 / * /
a k
E
EME 0
ahol: Mértékegység
V cella kádfeszültség V
Eo egyensúlyi potenciál V
a anódos túlfeszültség V
k katódos túlfeszültség V
I szériaáram kA
Ra anód ellenállása µΩ
κ az elektrolit vezetõképessége Ω-1 cm -1 L anód-katód távolság (pólustávolság) cm AB az elektrolit keresztmetszeti felülete cm2
Rc katód ellenállása µΩ
Rex a sinezési ellenállás µΩ
EME elektromotoros erő V
A teljes kádfeszültség magában foglalja az egyensúlyi potenciált (Nernst potenciált), valamennyi túlfeszültséget, az ohmikus feszültségesést az anód katód térben, valamint a külső szerkezeti elemeken eső feszültségeket. Az anód katód térben a feszültségesés alapvetően két részből áll, az elektroliton eső, valamint a gázbuborékok által okozott feszültségesésből.
1.5.1 Elektrokémiai reakció az anódon
Alacsony timföldtartalom és alacsony mólaránynál az alábbi kémiai reakció megy végbe:
Al2O3 +4AlF6
3- 3Al2OF6 2- +6 F-
Magas timföldtartalom és mólarány esetén viszont az alábbi reakció megy végbe:
2Al2O3 +2 AlF63- 3Al2O2F42-
A formálisan az anódreakciót az alábbi egyenlettel írhatjuk le, C + 2O2- = CO2 + 4e
de megállapították, hogy az oxigén csak komplex formában van jelen az olvadékban.
Sterten (39) kötési energiákat számolt és megállapította, hogy a két oxigén atomot tartalmazó komplexből könnyebben szabadul fel az oxigén, mint a három oxigén atomot tartalmazó komplexből, ebből kiindulva az alábbi két anódreakciót tételezte fel:
2Al2O3F4
4- + 2C 2CO2 + 2Al2OF4 + 4e- 2Al2O2F4
2- + C CO2 + 2Al2OF4 + 2e-
Voltammetriás vizsgálatokkal igazolást nyert korábban (40), hogy az alábbi reakciók is végbemennek az anódon a megjelölt egyensúlyi potenciál értékekkel jellemezve:
Végbement reakciók Egyensúlyi potenciál
2Al2O3
3
C3
CO24
Al E0 = 1,16VAl NaF COF
C O Al AlF
Na
3 3 6 4
2
3 6 2 3 2 E0 = 1,80VAl NaF CF
C AlF
Na
3 3 12 4
4
3 6 4 E0 = 2,55VA COF2 tartalom az anódgázokban hagyományos gázelemző készülékekkel nem mutatható ki. A COF2 képződés csak elektrokémiai módszerrel azonosítható voltammetriás mérések során: A CF4 képződés egyik lehetősége a COF2 spontán elbomlása, vagy annak a nedvességtartalommal való reakciója során HF képződése az alábbi reakciók szerint:
Végbement reakciók Szabad entalpia
2 4
2
COF2 CO CF G 1020 C = 2,5 kJ/mol
G
Amikor az elektrolitban lecsökken a timföldtartalom, a kádfeszültség hirtelen megnő, közel tízszeresére. Elektrokémiai magyarázata ennek a jelenségnek az, hogy a koncentrációs túlfeszültség megnövekszik, biztosítva a következő anion részvételét az anódfolyamatban.
A fluorid tartalmú anion az, amely CF4 illetve C2F6 formában az anódeffektet kiváltja. A timföld koncentráció az anódeffekt állapotban 0,5%-3,0% között változik. A CF4
képződése a korábban leírt reakció eredménye.
A legtöbb kutató egyetért abban, hogy az oxigén tartalmú ionoknak a kettős rétegen keresztüli transzportjához és az elektron átlépési folyamathoz kis túlfeszültség szükséges (1). Azt gondolták, hogy az anód felületén az oxigén kemiszorpció révén megkötődik stabil CxO komplex formában. A CxO komplexben a kémiai kötés felbontása és átalakulása a lassú és egyben a sebességmeghatározó folyamat. Ez a reakció túlfeszültséggel írható le. Ennek okán az anódtúlfeszültség döntően magas (0,4V–0,6V) és értékét a reakció túlfeszültsége határozza meg az üzemben használatos áramsűrűség tartományban.
Thonstad és munkatársa (41) folytatott legintenzívebben kutatásokat az anódfolyamat sebesség meghatározó lépésének a meghatározására az üzemileg is alkalmazott áramsűrűség tartományban.
Munkájának a legnagyobb érdeme, hogy a reakció túlfeszültségére vonatkozóan - módosítva a Vetter-i egyenletet- számszerűsítette a reakciós túlfeszültségét egyenletét, amely az alábbi:
/
0ln
* /
npF i ir RT
ahol Érték Mértékegység
η r reakció túlfeszültség - V
R gázállandó 1,987 -
T hőmérséklet - K
n elektronszámváltozás 2 -
p a reakció rendje 0,57 -
F Faraday állandó 23062 -
i áramerősség - A
i0 a reakció határáramsűrűsége 0,0039 -0,0850 A/cm2
A reakció túlfeszültsége nem írja le az anódon végbemenő folyamatot az alacsony timfölkoncentráció tartományban, mert ebben a tartományban a diffúziós túlfeszültség válik meghatározóvá. A diffúziós túlfeszültséget (ηd) az alábbi egyenlet írja le:
i i i F
RT c c
d
/ 2 * ln /
ahol: Mértékegység
ic kritikus áramsűrűség, ill. diffúziós határáram A/cm2
i üzemi áramsűrűség A/cm2
A kritikus áramsűrűség laboratóriumban potenciál kontrollált módszerrel határozható meg. A kritikus áramsűrűséget úgy tekinthetjük, mint az oxigéntartalmú ionok diffúziós határáramát, amelyet a fluorid ion leválása követ. Ebben az esetben az áram hirtelen közel nulla értékre esik le. Ezt a nulla közeli állapotot nevezzük az anódeffekt állapotának. A koncentrációs határáram függ a timföldtartalomtól, amelyet ki lehet használni az alumíniumoxid tartalom meghatározására (42).
Üzemi körülmények között a kritikus áramsűrűséget nem tudjuk meghatározni, mert egy elektrolizáló kád egy galvanosztatikus cellának tekinthető. Ebben a cellában az anód- effekt állapot úgy jelentkezik, hogy a kád feszültsége 30V-ra, vagy annál magasabb értékre nő.
Egyik megközelítés az anódeffekt magyarázatára az, hogy az egy koncentrációs túlfeszültség eredménye, amelynek során az anódpotenciál növekszik és elérve egy kritikus értéket alakul ki az anódeffekt. A másik megközelítés pedig az, hogy megnövekszik az anódgázokban a CO tartalom és az anódeffekt állapotban megjelennek a CF4 és a C2F6 gázok is (3).
1.5.2 Másodlagos elektrokémiai folyamatok az anódon
Tapasztalat, hogy az elektrolízis folyamata Pt anód és alumínium katód között tartósan fenntartható a timföld bontási feszültségénél alacsonyabb feszültség esetén is (40). Grafit anódon a polarizációs görbék felvételekor is tapasztaltuk, hogy alacsony áramsűrűség tartományban megjelenik egy törési pont a polarizációs görbén (40).
Számos közlemény is rámutat arra, hogy a visszaoldódótt komponensek egy része ionos természetű. M.M Vetjukov (44) két platina elekród között alacsony potenciálnál alumíniumot adagolt az olvadékba és mérhető áramok alakultak ki.
Barat és Coursier (45,46) stacionárius áramot mért a timföld bontási feszültségénél alacsonyabb potenciálon, a stacionárius áramsűrűséget 0,037A/cm2–nek mérték.
Dewing és munkatársa (47) a visszaoldódott fém anódos oxidációját tanulmányozta grafit anódon. Anódos határáramot mértek és n=1 elektronszám változással járó átlépési folyamatot azonosítottak. A szerzők az oxidálható részecskék teljes oldhatóságát 0,11%- ra becsülték kriolit olvadékban.
Thonstad és Rolseth (48,49,50,) is megvizsgálta a visszaoldódott fém oxidációját Pt- elektródon timfölddel telített kriolit olvadékban. A Pt elektród felületén Al–Pt vegyületeket mutattak ki. A határáram értéke 2-4 mólarány közötti intervallumban nőtt, de a legfontosabb megállapításuk az volt, hogy a határáram az alumínium aktivitásától függ. Ebből azt a következtetést vonták le, hogy az olvadékban létezik egy ionos állapotban levő részecske, amelynek koncentrációja az olvadékban az alumínium aktivitásától függ.
Berecz és munkatársai (44) széleskörűen vizsgálták a visszaoldódott részecskék anódos oxidációját Pt elektródon. Az áramhatásfok modellünk kialakításához támaszkodtunk eredményeikre.
Az alumínium aktivitását Al-Cu ötvözet felhasználásával módósítottuk, bornitrid tégelyeket használtunk az egyéb mellékrekciók elkerülésére. Egyértelműen megállapítottuk, hogy létezik egy alumínium tartalmú részecske, amely oxidálható. Az anódon diffúziós jellegű határáramokat mértünk. Két elektron átlépésű reakciót azonosítottunk az anódreakcióban.
Grafit, vagy szénalapú anódon Barat és munkatársainak (46) sikerült anódos határáram szakaszokat mérni. Ez utóbbi fontos megállapítás volt, mivel a gyakorlati elektrolízisben az anódfolyamat szénanódon megy végbe.
1.5.3 Elektrokémiai reakció a katódon.
A gyakorlatban egy elektrolizáló kád szén bélésanyagát, a vasszerkezettel és a sínezéssel együtt nevezik katódnak, de elektrokémiai szempontból az olvadt alumíniumot kell csak katódnak tekinteni. A katódfolyamatot gyakran nagyon leegyszerűsített formában fejezik ki:
elektrolit
e Al
olvadt
Al3