Doktori (PhD) értekezés
Gerjesztett trisz-diimin-ruténium(II)-komplexek alapállapotú ezüstionnal képzett exciplexeinek
fotofizikai és fotokémiai vizsgálata
Készítette Fodor Lajos
Témavezető Dr. Horváth Attila
Veszprémi Egyetem Kémia Doktori Iskola
Általános és Szervetlen Kémia Tanszék Veszprém, 2004.
Gerjesztett trisz-diimin-ruténium(II)-komplexek alapállapotú ezüstionnal képzett exciplexeinek fotofizikai és fotokémiai vizsgálata
Értekezés doktori (PhD) fokozat elnyerése érdekében Írta:
Fodor Lajos
Készült a Veszprémi Egyetem Kémia Doktori Iskolája keretében Témavezető: Dr. Horváth Attila
Elfogadásra javaslom (igen / nem)
...
(aláírás) A jelölt a doktori szigorlaton ... % -ot ért el,
Veszprém, ...
...
a Szigorlati Bizottság elnöke Az értekezést bírálóként elfogadásra javaslom:
Bíráló neve: ... igen /nem
...
(aláírás) Bíráló neve: ... igen /nem
...
(aláírás) Bíráló neve: ... igen /nem
...
(aláírás) A jelölt az értekezés nyilvános vitáján... % - ot ért el
Veszprém, ...
...
a Bíráló Bizottság elnöke A doktori (PhD) oklevél minõsítése...
...
Az EDT elnöke
Tartalomjegyzék
Kivonat ... 5
Bevezetés... 7
1. Irodalmi áttekintés ... 9
1.1 Polipiridil-ruténium(II)-komplexek rövid története ... 9
1.2 Ruténium-diimin-komplexek fotofizikája ... 10
1.3 Trisz-bipiridil-ruténium(II)-komplexek energiaátadási folyamatai... 15
1.4 Trisz-bipiridil-ruténium(II) fotokémiája... 17
1.4.1 Ru(bpy)32+ fotokémiai stabilitása ... 17
1.4.2 Elektronátadás ... 18
1.4.2.1 Mágneses tér hatása a Ru(bpy)32+ – MV2+ rendszerben ... 20
1.4.3 Exciplexképződés... 25
1.4.3.1 Ru-polipiridil-komplexek ezüstionnal képzett exciplexei ... 26
2. Kísérleti rész... 30
2.1 Felhasznált anyagok ... 30
2.2 Eszközök és módszerek... 30
3. Eredmények és értékelésük ... 35
3.1 Lumineszcencia színképek és élettartamok szobahőmérsékleten ... 35
3.2 A lumineszcencia élettartam függése a hőmérséklettől és az ezüstion-koncent- rációtól... 37
3.2.1 Gerjesztett komplexek és exciplexek fotofizikája... 40
3.2.2 Paraméterillesztési modell... 42
3.2.3 Lumineszcencia színképek, élettartamok ... 45
3.2.4 Sebességi együtthatók, potenciálgátak és termodinamikai paraméterek becslése 47 3.2.5 Exciplex stabilizáció és termodinamika ... 48
3.3 Oldószer hatása az exciplex kialakulására és energiavesztési folyamataira ... 49
3.4 Időfelbontott elnyelési színképek... 52
3.5 Ru(bpy)32+ oxidatív kioltása MV2+-nel ... 53
3.5.1 Kioltási kísérletek eredményeinek értékelése ... 54
3.6 Gerjesztett [Ru(bpy)n(CN)6-2n](2n–4)+ komplexek elektronátadásának vizsgálata külső mágneses térben... 56
3.6.1 Eredmények... 56
3.6.2 Magnetokinetikai paraméterek becslése... 60
3.6.3 Elektronátadásos kioltás ... 63
3.6.4 Kiszabadulás az oldószerkalitkából... 67
3.6.5 Spinrelaxáció és oldószerburkon belüli viszont-elektronátadás... 69
3.7 A [Ru(LL)3]Agn(n+2)+ exciplexek kioltási reakciójának tanulmányozása külső mágneses térben... 70
3.7.1 Eredmények... 70
3.7.2 Ionerősség hatása... 73
3.7.3 Exciplexképződés hatása... 75
4. Összefoglalás... 76
5. Felhasznált irodalom... 78
6. Tézisek... 83
7. Thesis... 86 Függelék ... F–1 Melléklet...M–1
Kivonat
A jelölt célja annak bizonyítása, hogy a gerjesztett [Ru(LL)3]2+ komplexek (LL: bpy = 2,2’-bipiridil, phen = 1,10-fenantrolin) alapállapotú Ag+ ionnal exciplexet képeznek, valamint a keletkező sugárzó részecskék energiavesztési és egyensúlyi folyamatainak megismerése.
A szerző elnyelési, lumineszcencia kisugárzási és gerjesztési színképek elemzésével, valamint lumineszcencia élettartamok hőmérséklet- és ezüstionkoncentráció-függésével bizo- nyította, hogy a [Ru(LL)3]2+ komplexek ezüstionnal (0-1,5 M) bi- és termolekulás exciplexet képeznek.
Az adatok kiértékelésére felállított modell alapján három különböző oldószerben (H2O, D2O és propilén-karbonát) meghatározta a [Ru(LL)3]2+ komplexeknek és az azokból képződő bi- és termolekulás exciplexek energiavesztési folyamatainak sebességét, nevezetesen az alapállapotra irányuló sugárzásos és sugárzásmentes folyamatok sebességi együtthatóinak összegét, valamint a 3d-d állapoton keresztül bekövetkező energiavesztés potenciálgátját és frekvenciatényezőjét. Mindhárom oldószerben meghatározta a bi- és termolekulás exciplexek képződésével járó entalpia és entrópiaváltozásokat. Az eredmények azt sugallják, hogy a bi- molekuláris exciplex a diimin ligandum π* molekulapályájának, valamint az ezüstion üres 5s0 atompályájának átfedése révén alakul ki. A szerző valószínűsítette, hogy a termolekulás exciplex kialakulásakor Ag2+ részecske kapcsolódik a gerjesztett komplex egyik diimin ligandumához. A termodinamikai adatokból a kölcsönhatás töltésátviteli jellegére, illetve gyenge asszociátum képződésére következtetett.
Időfelbontott elnyelési mérésekből meghatározta a *Ru(LL)3|Agn(2+n)+ (n=0, 1, 2) exciplexek és metil-viologén (MV2+) közötti elektronátadási reakciók sebességi együtthatóit és a reakciók során keletkező triplett állapotú gyök-ion párból a dublett gyökök kiszabadulá- sának hatékonyságát. Ezüstiont 0 M és 1,5 M koncentrációban tartalmazó mintákra – mágne- ses térben (0-3,3 T) végzett kinetikai mérésekből – becsülte a kioltási reakció során keletkező dublett állapotú gyök-ion pár kiszabadulásának és viszont-elektronátadási reakciójának sebes- ségi együtthatóját, valamint a gyök-ion pár spinrelaxációs idejét. Hasonló méréseket végzett vízben, nehézvízben és metanolban [Ru(bpy)n(CN)6-2n](2n-4)+ (n=1, 2, 3) vegyesligandumú komplexekre. A kapott eredmények összehasonlításával alátámasztotta az exciplexek kiala- kulását a [Ru(bpy)3]2+ – Ag+ rendszerben.
A doktori munka részét képezi egy lézervillanófény-fotolízis berendezés számítógépes vezérlésének megoldása Windows 9x alatt futó programmal, amely lehetővé teszi a mérések automatizálhatóságát és egyszerű kivitelezését.
Abstract
Characterization of exciplexes generated by excited tris-diimine- ruthenium(II) complexes and silver(I) ion of ground state
Luminescent emission spectra and temperature-dependent lifetime measurements in H2O, D2O and propylene carbonate revealed that *Ru(LL)32+ (LL: bpy = 2,2’-bipyridine, phen = 1,10-phenanthroline) form bi- and termolecular exciplexes with Ag+. The characteristic pa- rameters of deactivation pathways of the excited species and the thermodynamic data of the formation of exciplexes have been estimated. The data suggest that the bimolecular exciplexes are formed as a result of the overlapping of the π* orbital of the diimine ligand possessing the promoted electron and the empty 5s orbital of Ag+. Relative magnetic field effect on the reac- tion of Ru(bpy)32+ – Ag+ system and [Ru(bpy)n(CN)6-2n](2n-4)+ complexes with methylviologen was also investigated. Characteristic rate constants of forward and backward electron transfer were determined.
Auszug
Charakterisierung der Exciplexen gebildet von angeregten
Tris(diimin)ruthenium(II)-Komplexen mit Silber(I)-Ion im Grundzustand Emissionsspektren und temperaturabhängige Lebensdauermessungen in H2O, D2O und Propylenkarbonat enthüllten, daß Ru(LL)32+ (LL: bpy = 2,2’-Bipyridin, phen = 1,10- Phenanthrolin) mit Ag+ bi- und termolekularische Exciplexen bilden. Die charakteristischen Parameter der Desaktivierungsprozesse für die angeregten Spezies und die thermodynamischen Dateien für die Bildung der Exciplexen wurden bestimmt. Diese Dateien hinweisen darauf, daß die bimolekularischen Exciplexen als Folge der Überlappung von dem π*-Orbital des Diimin-Liganden und einem leeren 5s-Orbital des Ag+ -Ions bilden. Der relative Magnetfeldeffekt an die Reaktion des Ru(bpy)32+Ag+-Systems und der Komplexen [Ru(bpy)n(CN)6-2n](2n-4)+ mit Methylviologen wurde auch untersucht. Charakteristische Geschwindigkeitskonstanten für Hin- und Rück-Elektrontransfer wurden bestimmt.
Bevezetés
Miért oly népszerű a trisz-bipiridil-ruténium(II)-komplex tanulmányozása a szervetlen fotokémikusok körében? Ha erre a kérdésre keressük a választ, először készítsünk egy híg ol- datot a komplexből, és világítsuk meg látható fénnyel egy elsötétített helyiségben. Nagyon szép narancsvörös fénykibocsátást láthatunk. Az így észlelt lumineszcencia jellemzőinek il- letve a komplex különböző gerjesztett állapotainak megismerése ösztökélte a kutatókat az 1960-as és 70-es években a Ru(bpy)32+ vizsgálatára. Ezekben az években a komplex számos kedvező tulajdonságát fedezték fel, mint pl. a kémiai stabilitás, látható fény tartományában mutatott széles és intenzív elnyelés, gerjesztett állapotának kedvező redoxi tulajdonságai, hosszú lumineszcencia élettartam valamint könnyű előállíthatóság. A Ru(II)-polipiridil ve- gyületcsalád egyre intenzívebb vizsgálatát eredményezte e komplexeknek a napenergia kémi- ai átalakítására és tárolására alkalmazott rendszerekben mutatott kiváló fotoérzékenyítő tulaj- donsága. A ruténium(II)-polipiridil-komplexek még ma is kulcsszerepet játszanak a fotofizika, fotokémia, fotokatalízis, fotoelektrokémia, biokémia valamint a kemi- és elektro- kemilumineszcencia vizsgálatok fejlődésében. A Grätzel-cellákon kívül számos területen al- kalmazzák, így pl. fotokatalízis vagy analitika (lumineszcenciás oxigén- ill. pH-érzékelők).
Széleskörű felhasználásuk miatt sokan foglalkoztak már e komplexek fotofizikai folya- matait és elektronátadási reakcióit jellemző paramétereinek meghatározásával. Ez utóbbiak közül azonban a kutatások rendszerint csak a könnyebben vizsgálható három elemi folyamat sebességi állandójára irányulnak: a triplett MLCT gerjesztett Ru(II)-komplex és alapállapotú elektrondonor vagy akceptor molekulák között lejátszódó bimolekulás elektronátadási reakció kfet sebességi állandójára, a viszont-elektronátadási folyamatéra (kbet) és a redoxi termékek ki- szabadulásának sebességére az oldószerburokból. Másrészről általában nincsenek figyelem- mel arra, hogy a komplexek fotoaktív és alapállapotának különböző a spinmultiplicitása, így a viszont-elektronátadás valójában két lépésből áll. A folyamatok további részletezésére ad le- hetőséget az elektronátadási reakcióban képződő szabad gyökök kvantumhasznosítási ténye- zőjének mágneses térben bekövetkező változásának tanulmányozása.
Kevesen vizsgálták e vegyületek exciplexeit is, ami szintén fontos, mivel számos foto- kémiai reakció köztitermékeiként keletkeznek. Kimutatták, hogy egyes energiavesztési fo- lyamatok sebességét csökkenti, másokét pedig növeli az exciplexek kialakulása, így felhasz- nálásukkal fotokémiai reakciók hatékonyságát javíthatjuk, illetve nem kívánatos mellékreak- ciók hozamát csökkenthetjük. Tanulmányozásuk jelentős segítséget nyújthat reakciómecha- nizmusok megismerésében.
Az említettek alapján PhD munkám elsődleges céljaként a *Ru(LL)32+ (LL=bpy, phen) komplexek alapállapotú Ag+ ionnal képzett exciplexeinek vizsgálatát tűztem ki. Feladatom
volt az exciplexképződés minél több oldalról történő bizonyítása, az exciplexek fotofizikai sajátságainak megismerése, a képződésük termodinamikai paramétereinek meghatározása, valamint annak feltárása, hogy milyen hatással van az exciplex kialakulása a komplexek elektronátadási reakcióira.
1. Irodalmi áttekintés
1.1 Polipiridil-ruténium(II)-komplexek rövid története
Paris és Brandt 1959-ben a Ru(bpy)32+ 77 K-en mutatott lumineszcenciájáról számolt be [1]. Ez volt az első eset, amikor egy átmenetifém kelátkomplexének MLCT1 gerjesztett álla- potáról bekövetkező lumineszcenciájáról írtak. Korábban csak ligandumon belüli elektronát- menethez, ill. néhány ritkaföldfém kelátkomplexének f-f átmenetéhez rendelhető luminesz- cenciájáról olvashattunk [2, 3]. Megállapították, hogy UV-VIS tartományban bármely elekt- ronátmenetet gerjesztve színképileg hasonló emisszióhoz jutnak, vagyis a fénykibocsájtás a legkisebb energiájú gerjesztett állapotról következik be, de nem tértek ki a sugárzó állapot spinmultiplicitására. Az 1960-as évek végén Crosby és munkatársai [4] jellemezték néhány Ir-, Rh- és Ru-polipiridil komplex – köztük a Ru(bpy)32+ – lumineszcencia tulajdonságait.
1972-ben Gafney és Adamson a (3CT)Ru(bpy)32+ [Co(NH3)5Cl]2+ komplexszel lejátszó- dó oxidatív kioltásáról számoltak be [5]. Ennek a Gafney-Adamson cikknek – csakúgy, mint a csoport egyéb cikkeinek – nagy hatása volt a fotokémikusok munkájára, ugyanis abban az időben még a szerves fotokémia területén sem volt általános a gerjesztett állapotú részecskék elektronátadási reakcióinak tanulmányozása. E cikk megjelenését követően számos kutató- csoport mutatott érdeklődést a (3CT)Ru(bpy)32+ reagensként történő alkalmazása iránt [6-9].
Néhány évvel később kiderült, hogy ez a komplex a kémiai stabilitás, a kedvező redoxi tulaj- donságok, a gerjesztett állapot reaktivitásának és a gerjesztett állapot lumineszcenciájának pá- ratlan „ötvöződését” mutatja. Nem sokkal ezután felismerték, hogy (a fotoredoxi tulajdonsá- gok miatt) a trisz-bipiridil-ruténium(II) fotokatalizátorként viselkedhet a víz bontásánál [10].
Ezt követően a Ru-polipiridil-komplexek fotokémiája iránti érdeklődés jelentősen megnőtt. V.
Balzani és Carassiti 1970-ben kiadott a koordinációs vegyületek fotokémiáját tárgyaló mo- nográfiájában [11] a Ru(bpy)32+ komplexet csak mint lumineszkáló anyagot említi meg, nem pedig mint egy fotoreaktív vegyületet. A Ru- ill. az Os-komplexek fotokémiájáról összesen kevesebb, mint egy oldalt írtak. Ezzel szemben 51 oldalt szenteltek a Cr- valamint 52 oldalt a Co-vegyületeknek. Néhány évvel későbbi fotokémiáról szóló terjedelmes mű [12] rövid em- lítést tesz a Ru(bpy)32+ fotoindukált energia- ill. elektronátadási reakcióiról. 1983-ban a J.
Chem. Educ. kifejezetten fotokémiával foglalkozó különszámában már külön cikk jelent meg a Ru-polipiridilekről [13], valamint a Ru(bpy)32+ energia- [14] ill. elektronátadási [15] reakci- óiról. Az elmúlt évtizedekben a Ru-polipiridil-komplexek vizsgálata a fotokémia egyik fő té- májává vált [16].
1 a központi fématomról a ligandumra irányuló töltésátmenet (metal to ligand charge transfer)
1.2 Ruténium-diimin-komplexek fotofizikája
A fotokémiai és fotofizikai folyamatok első lépése mindig a fényelnyelés, így nagyon fontos a vizsgálandó vegyületek elnyelési színképeinek ismerete.
A ruténium(II)-polipiridil-komplexek alapállapota – hasonlóan a többi kisspinszámú d6- os oktaéderes komplexhez – 1A1g termszimbólummal „jellemezhető”. Az oldataik UV-VIS elnyelési színképeiben rendszerint egy széles, néhány ezer és néhány tízezer M-1cm-1 közötti moláris elnyelési együthatójú (ε) sávot találunk a 400-500 nm hullámhossztartományban, amely a fém központi atomról a ligandumra irányuló (1MLCT) átmenethez rendelhető. Ennél valamivel intenzívebb a 230–260 nm közötti, a nagyobb energiájú MLCT gerjesztett állapot- nak megfelelő elektronátmenet. A legnagyobb moláris elnyelési együttható rendszerint az aromás polipiridil ligandumok π Æ π* (ILCT2) átmenetéhez tartozik. Az általam használt komplexek elnyelési színképi és lumineszcencia adatait néhány oldószerre az 1. táblázatban foglaltam össze. További több, mint 300 Ru-polipiridil-komplex legfontosabb spektrális ada- tai találhatók V. Balzani az 1988-ban megjelent cikkében [17]. Kifejezetten a Ru(bpy)32+
spektroszkópiájával foglalkozik Krausz és Fergusson közel 100 oldalas cikke is [18].
1. táblázat. Az általam vizsgált diimin-ruténium(II) komplexek elnyelési színképeinek maximuma (λAb), a hozzá tartozó elnyelési együtthatók (ε), lumineszcencia színképeik maximumának helye (λEm), luminesz- cencia élettartamuk (τ) és a lumineszcencia kvantumhasznosítási tényezőjük (ΦPh) 25°C-on.
Komplex Oldószer λAb, nm ε, M-1cm-1 λEm, nm τ, ns ΦPh Irod.
[Ru(bpy)(CN)4]2– EtOH H2O H2O
457 400
401 3130
671 602
25 101 125
0,0068 0,008
19 19 20 [Ru(bpy)2(CN)2] H2O
MeOH MeOH
431 457 458
5900 8400
635 653 636
270 400
390 0,038
21 21 17 Ru(bpy)32+ H2O
MeOH propilénkarbonát
452 453
14600 14650
613 620 620
600 750
850 0,04
22 23 24 [Ru(bpy)3]Cl2 MeOH
H2O
449 452, 286, 243
14000, 81400, 25500
609 628
720 650
0,045 0,042
25 26
Ru(phen)32+ H2O D2O
447 19000 605 920
1090
22 27
2 ligandumon belüli töltésátmenet (intraligand charge transfer)
Komplex Oldószer λAb, nm ε, M-1cm-1 λEm, nm τ, ns ΦPh Irod.
[Ru(phen)3]Cl2 H2O 447, 420, 262, 222
18100, 17400, 108000,
78900
604 0,058 26
Természetesen, mint ahogy a magas ε értékek is mutatják, a fentiek mind spin- és szimmetriamegengedett (szingulett-szingulett) elektronátmenetek. Mint jól ismert, a fényel- nyelés valószínűsége akkor nagy, ha a keletkező gerjesztett állapot spinmultiplicitása meg- egyezik az alapállapotéval (spinmegengedett). Ugyanakkor azoknál a molekuláknál, ahol a központi atom elektronkonfigurációja t2g6 – mint a Ru(II)-polipiridil-komplexeknél – az alap- állapot szingulett, míg a legkisebb energiájú gerjesztett állapot triplett, így azt közvetlen fotogerjesztéssel nem lehet elérni, azonban egy nagyobb energiájú szingulett gerjesztett álla- potból spinváltó átmenet révén elérhető (1. ábra).
1. ábra. Ru-polipiridil-komplexek egyszerűsített Jablonski diagramja.
A Ru(bpy)32+ fotogerjesztése révén tehát szingulett gerjesztett állapot keletkezik [28, 29], amelyből egy gyors [30] és hatékony (ΦISC ≈ 1) spinváltó átmenet révén sugárzó 3MLCT gerjesztett állapot alakul ki, amely főként triplett jellegű [31-35]. Mindez megdöbbentő lehet, ha arra gondolunk, hogy a 1MLCT Æ 3MLCT átmenet spintiltott, és így nagyságrendekkel lassabbnak kellene lennie, mint a vele versengő sugárzásos (fluoreszcencia) vagy sugárzás- mentes (belső konverzió, IC3) spinmegengedett fotofizikai folyamatok. Az 1970-es évek óta számtalan irodalom foglalkozott a d6-os elektronkonfigurációjú központi atomot tartalmazó polipiridil komplexek triplett gerjesztett állapotának kialakulásával. A spinváltó átment egy-
3 A szakirodalom a belső konverziót az angol „internal crossing” kifejezésből IC-vel jelöli.
Alapállapot (1A1g)
3MLCT hν
1MLCT
ISC
kr knr
ségnyi kvantumhatásfokát4 (ηISC) többen is igazolták fotokémiai reakciók kvantumhasznosítá- si tényezőjét mérve [36, 37], MO számításokkal [33, 34] illetve energiaátadás vizsgálatával5 [38]. Valamennyien arra a következtetésre jutottak, hogy a spin-pálya csatolás miatt a spinváltás tilalma jelentősen lecsökken, így sebessége olyannyira megnő, hogy nagyságren- dekkel gyorsabb lesz a vele versengő energiavesztési folyamatokénál. McCusker és társai fs- os lézerkinetikai módszerrel vizsgálták a Ru(bpy)32+ abszorbanciájának változását a lézerger- jesztést követő 50-5000 fs tartományban [30]. Megállapították, hogy a *Ru(bpy)32+ színképe 300 fs-t követően már nem változik, és megegyezik a ns-os technikával mértekkel [35].
Az 1960-as és ’70-es években még eltérő vélemények születtek a Ru(bpy)32+ így kiala- kuló legkisebb energiájú gerjesztett állapotáról, valamint az ebből származó fénykibocsájtás jellegéről. 1959-ben Paris – a korábban már említett cikkében – töltésátviteli (CT) fluoresz- cenciának jellemezte az emissziót [1], 1964-ben Porter és munkatársa d-d foszforeszcenciáról [39], egy évvel később Crosby és társai d-d fluoreszcenciáról [40], 1968-ban Kasha és cso- portja pedig CT fluoreszcenciáról írtak [41]. Ez utóbbival közel egyidőben jelent meg Demas és Crosby azon cikke, amelyben először jellemzik triplett MLCT-ként a Ru(bpy)32+ legkisebb energiájú gerjesztett állapotát [42]. Az ezt követő évtizedben még megoszlottak a vélemé- nyek, de egyre több bizonyíték született, amelyek Demas és Crosby állítását támasztották alá.
Számos kutatócsoport vizsgálta a Ru-polipiridil-komplexek lumineszcencia élettar- tamának6 hőmérsékletfüggését, amelyek fontos információkkal szolgáltak a különböző ger- jesztett állapotokról, illetve azok energiavesztési folyamatairól. E téren Hager és Crosby vé- geztek úttörő munkát a 70-es évek közepén [32-34]. A trisz-bipiridil-ruténium(II)-komp- lexnek és két származékának mérték a lumineszcencia élettartamát (τ) és a lumineszcencia kvantumhasznosítási tényezőjét (Φ) poli-metil-metakrilátban (PMM) 4,2 K és 77 K közötti tartományban, ahol a 3T1 gerjesztett állapot egyes alszintjeit tudták jellemezni. Eredményeiket Azumi, O’Donnell és McGlynn által megadott (1) és (2) egyenletek alapján becsülték [43].
( ) ( )
(
E k T) (
E k T)
T k E k
T k E k
k
T B B
B B
/ exp
/ exp
2 1
/ exp
/ exp
2 )
( 1
2 1
2 2
1 1
0
∆
− +
∆
− +
∆
− +
∆
−
= +
τ , (1)
( ) ( )
(
E k T) (
E k T)
T k E k
T k E k
T k
B B
B r
B r
r
/ exp
/ exp
2 1
/ exp
/ exp
) 2 (
2 1
2 2
1 1
0
∆
− +
∆
− +
∆
− +
∆
−
= +
Φ , (2)
ahol ki az egyes gerjesztett állapotok lecsengési állandóinak a preexponenciális együtthatói, kir
az egyes sugárzásos sebességi állandók preexponenciális együtthatói, ∆Ei az i-edik gerjesztett állapot és a legkisebb energiájú gerjesztett állapot közötti potenciálgát, míg kB a Boltzmann
4 Mivel a spinváltás a gerjesztést követő elsődleges reakciólépés, így itt a kvantumhatásfok (η) és a kvantum- hasznosítási tényező (Φ, az egymást követő részlépések kvantumhatásfokainak szorzata) megegyezik.
5 ld még 1.3. fejezet
6 lumineszcencia élettartamnak nevezzük a sugárzó gerjesztett állapot eltűnését eredményező folyamatok bruttó sebességi együtthatójának reciprokát.
állandó. A második tag előtt szereplő 2-es együttható az adott energiaszint (E) kétszeres de- generációja miatt szerepel.
Mindhárom vizsgált komplexre hasonló eredményeket kaptak: a hosszú élettartamú (~200 µs) legalacsonyabb gerjesztett állapot (A1) felett kb. 10 cm-1-el létezik egy második szint, amelynek az energiavesztési sebességi állandója közel tízszer nagyobb, mint az elsőé.
Korábbi szimmetria analízisük [44], ill. MO-számításaik alapján [34] ezt az energiaszintet a kétszeresen elfajult E szinthez rendelték. A harmadik szint (A2) energiája ~60 cm-1-el na- gyobb, mint a legkisebb energiájú (A1), és a lecsengése 25-30-szor gyorsabb, mint a másodi- ké. Még nagyobb különbséget tapasztaltak a sugárzásos folyamatok sebességében. A második ill. a harmadik energiaszintről 12-szer ill. 400-700-szor gyorsabb, mint a legkisebb energiájú A1 szintről. A lumineszcenciát mindhárom szintről elsőrendű kinetikával írták le. A kis ener- giagátak miatt a két legalacsonyabban lévő szint (A1, E) – a gyakorlatilag azonos Boltzmann betöltöttség miatt – 50-70 K fölött már megkülönböztethetetlenné válik. A második legala- csonyabb gerjesztett állapot lecsengése is hőmérsékletfüggetlen lesz, és így az illesztések so- rán e két állapot eltűnése egyetlen konstanssal vehető figyelembe. Hasonlóképpen a harmadik (A2) szint is csak ~200 K alatt mérhető.
Kemp és munkatársai 77-143 K és 178-370 K között vizsgálták Ru(bpy)32+ és Ru(phen)32+ vizes oldatát 9 M ionerősség mellett (LiCl) [45]. Az alacsonyabb hőmérséklet- tartományban egyetlen exponenciális taggal le tudták írni a lumineszcencia élettartam válto- zását. Az energiagát értékének 50-60 cm-1-et kaptak, ami összhangban van Crosby és munka- társai eredményével. A hőmérséklet emelésével egy újabb energiavesztési csatorna megnyílá- sát tapasztalták. A legkisebb energiájú gerjesztett állapot felett (amit a szerzők szingulett A1
állapotnak gondoltak) ~4000 cm-1-gyel egy újabb termikusan aktiválható energiaszint jelen- létét figyelték meg (3A2, 3E), amelyből az előzőekkel szemben tisztán sugárzásmentes átmenet mehet végbe igen nagy hatékonysággal (1013 s-1-nél is nagyobb frekvencia tényezővel). Ez az eredmény összhangban van Van Houten és Watts munkájával, akik 0-90°C tartományban vizsgálták a Ru(bpy)32+ vizes oldatát [46]. Ők a triplettnek elfogadott legalacsonyabb ger- jesztett állapot felett 3600 cm-1-el lévő szintet a triplett d-d állapothoz rendelték. Ezzel ma- gyarázni tudták a Ru(bpy)32+ magas hőmérsékleten bekövetkező ligandumvesztési reakcióit.
A ligandumok környezetében ily módon bekövetkező elektronsűrűség-csökkenés számos egyéb ligandumcsere reakció magyarázatául szolgál. [47, 48]
A Ru(bpy)32+ fotogerjesztését követően kialakuló állapotokat ill. a lejátszódó folyama- tokat a 2. ábrán látható Jablonski diagramban foglaltam össze, míg a legkisebb energiájú triplett gerjesztett állapot és a 3d-d ill. a 4. MLCT gerjesztett állapotok közötti energiakülönb- séget és az egyes alszintek energiavesztési folyamatainak sebességi együtthatóit a 2. táblá- zatban tüntettem fel.
2. táblázat. *Ru(bpy)32+ és *Ru(phen)32+ energiavesztési folyamatainak kinetikai adatai.
Vegyület Közeg Hőmérséklet-
tartomány, K
10–6×k0, s-1
10–13×k1, s-1
∆E1, cm-1
10–6×k2, s-1
∆E2, cm-1
Irod.
PC 210-295 0,61 0,35 3270 49
H2O 278-363 1,29 1 3559 — — 46
D2O 278-363 0,635 1 3568 — — 46
Ru(bpy)32+ 9M LiCl 178-370 1,635 6,6±2,1 4100±80 3,15±0,17 160±8 45
H2O 77-143 — — — 0,69±0,03 53±3 45
178-370 1,018 4,3±1,8 4000±100 1,62±0,21 136±22 45 9M LiCl
D2O 77-143 — — — 0,47±0,01 55±2 45
[Ru(bpy)3](PF6)2 CH2Cl2 230-310 0,411 4,5 3563 — — 48
[Ru(bpy)3](SCN)2 CH2Cl2 245-295 0,430 3,2 3520 — — 48
H2O 245-355 1,130 2,9±2,4 3630±220 2,27 350 45
178-370 0,781 11,1±6,9 4020±150 4,09±0,72 220±110 45 9M LiCl
H2O 77-143 — — — 0,22±0,01 38±2 45
178-370 0,639 6,4±1,1 3900±40 0,28±0,07 62±42 45
Ru(phen)32+
9M LiCl
D2O 77-143 — — — 0,21±0,05 45±2 45
[Ru(phen)3](PF6)2 CH2Cl2 0,140 3,1 3185 — — 48
Ru(bpy)32+ PMM 4-75 5,46×10–3* 5,3×10–9* 10,1* 1,47 61,2 32
* A ∆E1 a többi sortól eltérően itt az A1 és E triplett állapotok közötti energiakülönbség, ennek megfelelően más a hozzá tartozó k1 ill. k0 is..
Mj.: Ahol nem számoltak ∆E2-t, ott az illesztett k0 a 2. ábra jelöléseit használva k0 + k2 · exp(–∆E2/RT) összegnek felel meg
Az 1980-as, de főként a ´90-es években több kutatócsoport is vizsgálta, hogy a Ru-, ill.
az Os-diimin-komplexek esetében a 3MLCT gerjesztett elektron delokalizáltan helyezkedik-e el a három diimin ligandumon, vagy egyetlen ligandumon lokalizált. Legközvetlenebb bizo- nyítékot a gerjesztett állapot időfelbontott Raman színképe nyújtotta, melyből megállapítot- ták, hogy szobahőmérsékleten vizes oldatban mind a Ru(bpy)32+, mind pedig az Os(bpy)32+
esetében egyetlen ligandumon lokalizált a gerjesztett elektron, bár kétségtelen, hogy gyors folyamatban átmehet egyik ligandumról a másikra [50]. Meyer és munkatársai hasonló ered- ményt kaptak a trisz-bipiridil- ill. a trisz-fenantrolin-ruténium(II) komplexek acetonitriles ol- datára 25°C-on [51, 52]. McCusker és csoportja kísérletileg igazolta, hogy Ru(bpy)32+ ger- jesztését követően a gerjesztett elektron eredetileg delokalizált, de kevesebb, mint 1 ps alatt lokalizálódik [53]. A fenti eredmények számos fotokémiai elektronátadási és exciplex- képződési folyamat mechanizmusának megfejtéséhez adhatnak jelentős segítséget.
2. ábra. – Ru(bpy)32+ triplett gerjesztett állapotainak Jablonski diagramja
Ha a molekulán belüli dezaktiválódás nem túl gyors, azaz a gerjesztett állapot élettarta- ma kielégítően hosszú (legalább 1 ns), akkor a gerjesztett részecskének lehetősége van az ol- datban egy másik molekulával ütközni. Átmenetifém komplexeknél ezt a feltételt általában a legkisebb energiájú spintiltott gerjesztett állapot teljesíti. Az ilyen, rendszerint diffúzióellen- őrzött, folyamatok eredményeképpen egy gerjesztett részecskepár (exciplex) képződik, ame- lyet követően számos fotofizikai és fotokémiai folyamat játszódhat le. Az exciplex legjelentő- sebb unimolekulás folyamatai a sugárzásos ill. sugárzásmentes energiavesztés, az izomerizá- ció, a disszociáció és az ionizáció. A bimolekulás folyamatok közül az energia- és az elekt- ronátadási folyamatokat ismertetem – az utóbbi magában foglalhatja mind a gerjesztett állapot oxidációját, mind pedig a redukcióját –, de ezeken túl fizikai kioltás vagy addíció is lejátszód- hat.
1.3 Trisz-bipiridil-ruténium(II)-komplexek energiaátadási folyamatai A triplett MLCT gerjesztett Ru(bpy)32+ komplexnek – az elektronátadás mellett – az egyik legjobban vizsgált folyamata az energiaátadás. Mivel PhD munkám során nem végez- tem energiaátadási vizsgálatokkal, itt csak röviden ismertetem a folyamat alapjait egy egysze- rű példával.
Energiaátadás ütközéses reakcióban akkor játszódhat le, ha az átalakulás adiabatikusan megy végbe (a reaktánsok és a termékek energia-felületei átmetszik egymást, ugyanakkor je-
ligandumcsere reakciók
Alapállapot (1A1g)
3MLCT A2
AE1 1,3MLCT
3d-d (A2, E)
~10 cm–1
∆E2
600–800 cm–1
∆E1
2500–4500 cm–1
elektronátadási reakciók
k0 k2 k1
40–70 cm–1
lentős a két potenciálfelület közötti csatolás), és teljesül az ún. elektronspin-korrelációs sza- bály ill. az energia-feltétel [54]. Az előbbi szerint a folyamat akkor megengedett, ha a reaktánsokból és a termékekből legalább egy azonos spinmultiplicitású átmeneti komplex ke- letkezhet. Egy A + B Æ C + D reakcióra az átmeneti komplex lehetséges spinmultiplicitásai rendre a következők lehetnek: |SA + SB|, |SA + SB| – 1, …, |SA – SB| illetve |SC + SD|, |SC + SD| – 1, …, |SC – SD|. Az energia-feltétel akkor teljesül, ha a folyamat a kiindulási gerjesztett ré- szecske energiájánál kisebb vagy alig nagyobb energiájú termékhez vezet. Mindhárom feltétel teljesül a diimin-ruténium(II)- és Cr(III)-komplexeket tartalmazó rendszerekben, amelyekben talán a leggyakrabban vizsgálták a Ru(II) komplexek energiaátadási tulajdonságait. Erre példa az a közlemény is, amelyben Balzani és csoportja az 1970-es évek elején először számoltak be triplett MLCT gerjesztett Ru(bpy)32+ energiaátadási reakciójáról [8]. Kimutatták, hogy a ger- jesztett Ru-komplex energiát ad át a Cr(CN)63– alapállapotú részecskének. Hasonló folyamatot felhasználva határozták meg Ru-komplexek 1MLCT Æ 3MLCT spinváltó átmenetének kvan- tumhatásfokát [38]. Egy ilyen rendszer egyszerűsített Jablonski diagramja látható az alábbi ábrán (3. ábra).
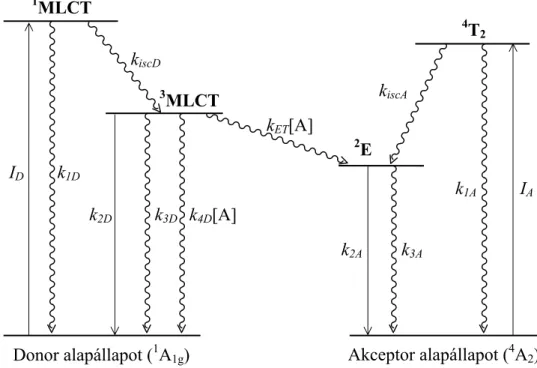
3. ábra. Diimin-ruténium(II) (donor) és Cr(III)-komplexek (akceptor) között lejátszódó energiaátadás mechanizmusának szemléltetése.
A triplett gerjesztett Ru-komplex – a már ismertetett sugárzásos (k2D) és sugárzásmentes (k3D) folyamatok mellett – két új energiavesztési csatornán juthat vissza az alapállapotába. A
4A2 termszimbólummal jelölt alapállapotú Cr(III)-komplexszel ütközve kioltódhat mind elekt- ronátadással (k4D·[A]), mind pedig energiaátadás révén (kET·[A]), melynek során az alapálla- potú Ru(II)-komplex mellett a Cr(III)-komplex legkisebb energiájú gerjesztett állapota kelet-
Donor alapállapot (1A1g)
1MLCT
ID
k3D k4D[A]
kiscD
3MLCT
Akceptor alapállapot (4A2) kiscA
4T2
2E
IA
k1A
k2A k3A
kET[A]
k2D
k1D
kezik (2E). Ez a dublett állapot 7-800 nm között mutat néhány száz ns-os élettartammal jelle- mezhető emissziót, ami jól megkülönböztethető a Ru-komplexek 600 nm körül mérhető fénykibocsájtásától. A 3. ábra jelöléseit használva az akceptor molekula (Cr-komplex) emisz- szió intenzitását (EA) a (3) egyenlettel fejezhetjük ki abban az esetben, ha csak akceptort tar- talmazó mintát gerjesztünk annak elnyelési maximumában. Ha tisztán a donor részecskét gerjesztjük egy olyan oldatban, amely mindkét komplexet tartalmazza, és ismét az akceptor emisszió intenzitását (EAET) vizsgáljuk, akkor a (4) egyenlethez jutunk.
A iA A
A GI
E = η η2 , (3)
A ET iD D ET
A GI η η η
E = 2 , (4)
ahol G a geometriai elrendezéstől függő állandó, ami azonos mérési körülmények esetén nem változik, ηiA és ηiD rendre az akceptor és a donor molekula spinváltó átmenetének kvantum- hatásfoka (ηi = kisc/(kisc + k1)), η2A az akceptor foszforeszcencia kvantumhatásfoka, ηET = kET[A]/(k2D + k3D + k4D[A] + kET[A]), ID és IA pedig rendre a donor és az akceptor komplexek elnyelt fényhányada a gerjesztés hullámhosszán. Azokra a rendszerekre, ahol az elektronát- adással járó kioltás elhanyagolható az energiaátadás mellett (kET >> k4D) az ηET könnyen meg- határozható Stern-Volmer egyenes mérésével (ld. 2.2. fejezet). Felírva a kétféle emisszió in- tenzitás hányadosát látható, hogy az egyik ηi ismeretében a másik vegyületre az kiszámolható.
Az ütközéses energiaátadás mellett egyre több kutatócsoport számol be molekulán be- lüli energiaátadásról [55]. Ehhez természetesen szükséges, hogy a részecske legalább két kü- lön-külön is gerjeszthető un. kromofór csoportot tartalmazzon. Ilyen esetekben is teljesülnie kell a spin-korrelációs szabálynak és az energia-feltételnek.
1.4 Trisz-bipiridil-ruténium(II) fotokémiája
1.4.1 Ru(bpy)32+ fotokémiai stabilitása
Egy vegyület kémiai reakcióinak vizsgálatához elengedhetetlen feltétel a vegyület sta- bilitásának ismerete az adott körülmények között. Fotokémiai vizsgálatok esetén az alapálla- poton túl a gerjesztett állapotra is ki kell terjeszteni ismereteinket.
Houten és Watts 1976-ban megállapította, hogy a Ru(bpy)32+ 0,1 M HCl-as oldatában sem 25 °C-on 5 órás besugárzás hatására, sem pedig 95°C-on 7 órai sötétben állás után nem tapasztalható kémiai átalakulás, de 95°C-on 436 nm-es fénnyel besugározva már egy óra után is észlelhető a változás az elnyelési színképen [46]. A Ru(bpy)32+-re jellemző 450 nm hullám- hossznál mérhető sáv 500 nm-re tolódik el. Egy későbbi munkájukban [47] 25 és 70°C-on
erős savat különböző koncentrációban tartalmazó vizes oldatban határozták meg a bomlás kvantumhasznosítási tényezőjét. Néhány eredményüket a 3. táblázatban tüntettem fel.
3. táblázat. Ru(bpy)32+ átalakulásának kvantumhasznosítási tényezője különböző oldatokban.
Közeg Hőmérséklet, °C 104×Φ
H2O 70 0,1a
0,01 M HCl 70 0,44
0,1 M HCl 70 2,93
0,1 M HCl (O2 mentes) 70 1,0
0,1 M HNO3 70 2,1
0,1 M HCl + 0,9 M NaCl 70 11
1,0 M HCl 70 18
1,0 M HCl 25 1,9
1,0 M HCl (O2 mentes) 25 0,72
a Az érték megegyezik a szerzők által megadott hibahatárral.
Megállapítható, hogy még erősen savas oldatban 70 °C-on is kevesebb, mint 0,002 a Ru(bpy)32+ bomlásának kvantumhasznosítási tényezője, ami oxigénmentesítés hatására közel harmadára csökken. A szerzők a változást egy kloridion vagy víz molekula (HNO3 esetén) ligandumként történő koordinálódásával magyarázták. Ekkor az egyik bipiridil ligandum egy- fogúként kötődik. Az így kialakuló [Ru(bpy)2Cl(bpy)]+ vagy [Ru(bpy)2(H2O)(bpy)]2+ ré- szecske igen labilis, könnyen visszaalakulhat a kiindulási trisz-bipiridil komplexszé. E mun- kákból arra következtethetünk, hogy a trisz-bipiridil-ruténium(II)-komplex nemcsak alapálla- potban stabil, hanem gerjesztett állapotban is, különösen nem túl savas oldatban.
Balzani és Juris 2001-ben megjelent összefoglaló cikkében arról ír, hogy a Ru(bpy)32+
sötétben és fotogerjesztést követően is elég stabil, azonban acetonitrilben kismértékű ligandumcsere játszódik le 2×10-5-es kvantumhasznosítással [16].
1.4.2 Elektronátadás
A (3CT)Ru(bpy)32+ elektronátadási reakcióinak kutatása terén Gafney és Adamson [5]
cikke jelentett nagy áttörést; [Co(NH3)5Cl]2+ komplexszel reagáltatva a megfelelő Co(II) és Ru(III) vegyületeket kapták. E munka ösztökélte V. Balzani csoportját, hogy más közelítés- móddal vizsgálják a (3CT)Ru(bpy)32+ reaktivitását, így 1974-ben a 3Ru(bpy)32+ Tl3+-mal leját- szódó oxidatív kioltásáról számoltak be. Érdekességként azt tapasztalták, hogy e fotoreakció kvantumhasznosítási tényezőjének határértéke 2, ami azt sugallta, hogy az eredetileg keletke- ző Tl2+ oxidálja az alapállapotú Ru(bpy)32+-t. Ez volt az első bizonyítéka annak, hogy a foto-
gerjesztést követően keletkező (1CT)Ru(bpy)32+ egységnyi kvantumhatásfokkal alakul át spinváltó átmenet (ISC) révén (3CT)Ru(bpy)32+ reaktív gerjesztett állapotú részecskévé [36].
A diimin-ruténium(II) komplexek fotoindukált elektronátadási reakcióinak vizsgálatá- hoz további lendületet adott az a felismerés, miszerint ennek a vegyületcsaládnak több tagja hatékony fotoérzékenyítőnek bizonyult a napenergia tárolására és átalakítására kifejlesztett mesterséges rendszerekben [56-62]. Nagy előnyük – a látható tartományban mutatott széles és intenzív elnyelés mellett – az , hogy míg az alapállapotú Ru(II)-diimin-komplexek ellenállóak mind oxidálószerekkel, mind pedig redukálószerekkel szemben, addig a 3MLCT gerjesztett állapotuk igen kedvező redoxi tulajdonságokat mutat. Az általam vizsgált Ru(II)-komplexek redoxi potenciáljait a 4. táblázatban tüntettem fel.
4. táblázat. Néhány trisz-diimin-ruténium(II) komplex ciklikus voltametriával normál hidrogén elektród mellett szobahőmérsékleten mért redoxi potenciálja.
Komplex Oldószer ERu2+/Ru+, V ERu3+/Ru2+, V E*Ru2+/Ru+, V ERu3+/*Ru2+, V Irod.
[Ru(phen)3]2+ H2O –1,36 1,26 0,77 –0,87 63
[Ru(bpy)3]2+ H2O –1,28 1,26 0,84 –0,86 15
[Ru(bpy)2(CN)2] MeCN H2O
–1,60
—
0,86 0,90
0,51
—
–1,25 –1,30
64 65 [Ru(bpy)(CN)4]2– H2O
DMF
— –1,95
0,78 0,20
— 0,08
–1,60 –1,83
65
A gerjesztett trisz-diimin-ruténium(II) komplexeknek számos elektronátadási reakciójá- ról számolnak be, amelyek egyaránt lehetnek reduktív (a gerjesztett komplex redukálódik), ill.
oxidatív (gerjesztett komplex oxidálódik) kioltási reakciók. Elektrondonor kioltókra példa le- het az Eu2+ ion [69] vagy haloanilinek [66-68], míg az elektronakceptorok közül a méréstech- nikai szempontból fontos molekuláris oxigént valamint az egyik leggyakrabban alkalmazott metil-viologén kationt (MV2+: 1,1’-dimetil-4,4’-bipiridínium) említem meg. Az O2 molekula szobahőmérsékleten igen hatékony kioltó az általam használt oldószerekben (Ru(bpy)32+ vizes oldatára kq = 3,3×109 M–1cm–1 [7], metanolos oldatára pedig kq = 1,7×109 M–1cm–1 [70]), így a lumineszcencia élettartamot és a lumineszcencia intenzitást jelentősen csökkenti7. Az ilyen mellékreakció kiküszöbölése végett a Ru(II)-komplexek lumineszcencia tulajdonságainak vizsgálatát rendszerint oxigénmentesített mintákkal végzik.
A Ru(II) komplexek körében talán a leggyakrabban alkalmazott kioltó a MV2+, aminek kloridja vízben nagyon jól oldódó stabil vegyület. Nem reagál az alapállapotú Ru(II) komple- xekkel (vízben EMV2+/·MV+ = –0,45 V [72]), de a 3MLCT gerjesztett részecskékkel ütközve
7 A Ru(bpy)32+ levegővel telített vizes oldatában szobahőmérsékleten a az O2 kioltási hatékonysága: ηq,O2 =
= kq[O2]/(kq[O2] + k0) ≈ 35 % [71]
gyors reakció játszódik le, amelynek eredményeképpen a megfelelő Ru(III)-komplex mellett
·MV+ keletkezik (5). Az utóbbi redoxi terméknek a látható tartományban két elnyelési sávja van. Egy éles sáv jelenik meg 395 nm-nél (ε = 39100 M–1cm–1 [73]), valamint egy széles sáv 600-605 nm-nél (ε = 11300 M–1cm–1 [61, 62]). Figyelembe véve, hogy a MV2+-nak gyakorla- tilag nincs elnyelése a látható tartományban, a ·MV+ jól nyomon követhető tranziens abszorp- ciós mérésekkel. A reakciókban keletkező Ru(III) komplexek és a metilviologén gyökkation reagálnak egymással, így néhány száz µs alatt visszakapjuk az alapállapotú Ru(II) komplexe- ket és a MV2+-t (6).
3Ru(bpy)32+ + MV2+ k→q
Ru(bpy)33+ + ·MV+ (5) Ru(bpy)33+ + ·MV+ → Ru(bpy)32+ + MV2+ (6) Lézerkinetikai és lumineszcencia spektroszkópiai módszerekkel igen könnyen tudjuk mérni a kioltási állandókat (kq) és a ·MV+ redoxi termék keletkezésének kvantumhasznosítási tényezőjét (ηce). Meg kell azonban jegyeznünk, hogy az (5) egyenlet egy bruttó reakciót ír le, amelynek részlépéseire az említett mérések nem adnak elegendő információt. A reakció me- chanizmusának megismeréséhez és az egyes részfolyamatok sebességi együtthatójának meg- határozásához azonban lehetőséget nyújt a redoxi termékek hozamának mérése külső mágne- ses térben különböző térerősségnél.
1.4.2.1 Mágneses tér hatása a Ru(bpy)32+ – MV2+ rendszerben
A mágneses térnek a kémiai reakciók sebességére gyakorolt hatását már a XX. sz. kö- zepén felismerték [74, 75], de a jelenséget csak a mag- és elektronspin polarizáció felfedezése és megértése után tudták értelmezni [76-79]. Az 1970-es évektől kezdődően többféle elmélet is született, amelyek közül azt a két alapvető mechanizmust ismertetem, amelyeket az általam is vizsgált Ru(bpy)32+ – MV2+ rendszer leírására is alkalmaztak [66, 80, 81].
Ahhoz, hogy a mágneses tér hatással legyen egy folyamat sebességi együtthatójára szükséges feltétel, hogy a reaktáns(ok) és a termék(ek) spinmultiplicitása különböző legyen.
A két különböző spinmultiplicitású állapot közötti közvetlen átmenet (spinváltás) azonban spintiltott folyamat. A két elmélet – az ún. triplett illetve gyökpár mechanizmus – abban kü- lönbözik egymástól, hogy milyen hatások teszik lehetővé a spintiltott folyamatok lejátszódá- sát, és melyek azok a részlépések, amelyeknek a sebességét megváltoztatja a külső mágneses tér. A részletesebb ismertetések előtt vizsgáljuk meg, hogy az (5) egyenlet milyen részlépé- sekből állhat. A triplett gerjesztett Ru(bpy)32+ és a MV2+ ionok ütközését követően a reaktánsok közös oldószerburokba kerülnek, ahol megtörténhet az elektronátadás (7). A ke- letkező redoxipár – mindkét elmélet szerint – triplett állapotú, amelyben a három alszint kez- deti betöltöttsége megegyezik. Energetikai okok miatt ez a redoxipár rendszerint nem alakul-
hat vissza gerjesztett állapotú részecskéket eredményezve8, így a rekombinációnak csak egyetlen útja lehetséges, amelyben a reaktánsok szingulett alapállapotát kapjuk vissza (8).
Mivel ez a folyamat spintiltott, gyakran a vele versengő folyamat dominál, amely az oldó- szerburokból kiszabadult szabad gyököket (Ru(bpy)33+ és ·MV+) eredményezi (9)9.
3Ru(bpy)32+ + MV2+ →kq
3{Ru(bpy)33+…MV·+} (7) {Ru(bpy)33+…MV·+} →kbet
Ru(bpy)32+ + MV2+ (8) {Ru(bpy)33+…MV·+} →kce
Ru(bpy)33+ + MV·+ (9) A fenti egyenletek jelöléseit használva a ·MV+ gyökkation oldószerburokból történő kiszaba- dulásának kvantumhatásfoka (ηce), a jól ismert (10) egyenlet szerint számolható.
bet ce ce ce
k k
k
= +
η . (10)
A gyökpár mechanizmus szerint (1. vázlat) az elektronátadási folyamatban keletkező triplett gyökpár, 3{Ru(bpy)33+…MV·+}, különválhat az oldószerburkon belül: 3{2Ru(bpy)33+ +
2MV·+}, és így már megengedett a spinváltás szingulett-korelállt állapottá: 1{2Ru(bpy)33+ +
2MV·+}. Mindkét spinállapotú gyökpárból azonos valószínűséggel végleg kiszabadulhatnak a gyökök, illetve ezzel a folyamattal versengve szingulett gyökpár keletkezését követően bekö- vetkezhet a rekombináció, amelyben a szingulett alapállapotú reaktánsokat kapjuk vissza. A viszont-elektronátadás lejátszódásának valószínűsége nagymértékben függ a spinváltás sebes- ségétől, ami függ a külső mágneses tértől. Ha a mágneses tér növeli a spinváltás sebességét, akkor ez kedvez a rekombinációnak, és egyben csökkenti a gyökök kiszabadulásának haté- konyságát.
1. vázlat. A gyökpár mechanizmus sémája Ru(bpy)32+ – MV2+ rendszerre.
8 A (6) reakció standard szabadentalpiaváltozása –165 kJ/mol, ugyanakkor a hasonló, de gerjesztett Ru- komplexet eredményező reakció hajtóereje +30 kJ/mol.
9 Az indexben használt „ce” és „bet” rövidítések az angol nyelvű „cage escape” és „back electron transfer” kife- jezésekből adódnak.
3Ru(bpy)32+ + MV2+ 3{Ru(bpy)33+…MV·+} 3{2Ru(bpy)33+ + 2MV·+}
1{Ru(bpy)33+…MV·+} 1{2Ru(bpy)33+ + 2MV·+}
2Ru(bpy)33+ + + 2MV·+
Ru(bpy)32+ + MV2+
kce
kq
B0 B0
kbet
A gyökpárban a spinváltást alapvetően három tényező határozza meg; a spinek precesz- sziós (Larmor) mozgása, az elektron- és a magspin un. hiperfinom kölcsönhatása és az elektronspin irányultságának relaxációja. Mielőtt részletezem az említett hatásokat nézzük meg hogyan is szemléltethetjük az egyes spinállapotokat. Szingulett állapotban a redoxi párt alkotó két gyök párosítatlan elektronjának spinmomentum vektorai ellentétes irányúak, így eredőjük zérus (ld. 4. ábra). A triplett állapotnak három alszintje van, amelyeket T+, T0 és T–
szimbólumokkal jelölünk. A T0 spinállapot csupán abban különbözik a szingulettől, hogy az egyik gyök elektronspinje 180°-kal eltérő fázisban precesszál, amiből következik, hogy ez a két állapot átalakulhat egymásba, ha a két gyökben a párosítatlan elektronok Larmor-frekven- ciája eltér. A T+ és T– alszintek esetében a két elektron precessziós mozgásának irányultsága, azaz a spinek mágneses térerősség vektorra10 eső vetületének előjele, azonos. Ez eltérés az S és a T0 spinállapotoktól, így köztük csak spinátfordulással11 valósulhat meg az átalakulás.
A spinváltás sebességének egyik meghatározó tényezője az elektronspin precessziós (Larmor) frekvenciája (ω0), ami az alábbi egyenlet szerint számolható:
/h
0 gµBB
ω = , (11)
ahol g a gyök g-tényezője, µB a Bohr-magneton, ħ = h/2π, h pedig a Planck állandó. A képletben szereplő B a mágneses tér indukciója az elektron környezetében, ami a külső mágneses tér (B0) és az egyes atommagok hiperfinom csatolásaiból származó mágneses tér (Bhfc) indukcióinak vektoriális összege. A precessziós mozgás tengelye egybeesik a mágneses indukció vektorral.
A spinváltást a két elektron Larmor frekvenciájának illetve a precessziós mozgás irányának különbsége eredményezheti. A frekvenciában – különösen a nagy rendszámú atomokat tar- talmazó gyökpárok esetén – jelentős eltérést (∆ω0) okozhat az egyes gyökök g-faktorainak különbsége (∆g- vagy Zeeman-mechanizmus). Ez a hatás a mágneses tér növelésével növeli a
∆ω0-t, és így a triplett-szingulett (elsősorban a T0 ↔ S) spinváltást is (5. ábra). Mindez növeli a rekombináció valószínűségét, és így csökkenti a kiszabadulás hatékonyságát (ηce), azaz ne- gatív relatív mágneses hatást eredményez, aminek abszolút értéke szigorúan monoton nő és csak nagy mágneses indukciónál (több tesla) ér el telítési értéket, ami több 10% is lehet12.
A precessziós mozgás irányultságában csak akkor következhet be változás (spinátfor- dulás), ha megváltozik az eredő mágneses tér iránya. Ekkor az elektron spinkvantumszáma
2 /
±1 -ről 2m1/ -re változik, ami a spinmegmaradás törvénye értelmében csak akkor lehetsé- ges, ha ezzel együtt a magspin is megváltozik. Ahhoz, hogy a magspin és az elektronspin köl-
10 Az elektron által érzékelt mágneses tér, ami külső mágnes hiányában az atommag mozgásából származó mág- neses tér.
11 Spinátfordulásnál („spin-flip”) a spin irányultsága változik meg, ez a folyamat nem jár szükségszerűen spinváltással, azaz az eredő spinmomentum megváltozásával (ld. T0 ↔ T+, T– átalakulások)
12 Abban az esetben, ha kioltás során keletkező gyökpár szingulett lenne és az alapállapot lenne triplett, akkor ellentétes előjelű hatást tapasztalnánk. Ugyanez a megállapítás érvényes a későbbiekben tárgyalt esetekre is.
csönhatása (hiperfinom csatolás) következtében lejátszódjon a spinátfordulás, az is szükséges, hogy a két állapot energiája közel azonos legyen. A triplett alszintekre ez a feltétel a nulla mágneses térerősség közelében teljesül, így itt a T+, T– és T0 állapotok átalakulhatnak egy- másba (ld. 4. ábra). A mágneses tér növelésével egyre inkább a B0 lesz a domináns a Bhfc-vel szemben, és így a hiperfinom kölcsönhatásból származó mágneses tér irányának változása egyre kevésbé tudja megfordítani az eredő mágneses indukciót, a két spin precessziójának iránya egyre inkább egybe esik, így ezzel a mechanizmussal a spinátfordulás nem megenge- dett. Ennek ellenére T+, T– és T0 állapotok közötti átalakulás nagy mágneses indukcióknál is lehetséges a gyökök forgásából adódó un. relaxációs mechanizmussal. Mivel ez független a mágneses tértől, így a két hatás eredőjeként a mágneses tér növelése növeli a triplett alszintek közötti egyensúly beállásának idejét, csökkentve a szingulett gyökpár kialakulásának sebessé- gét. Mindez azt jelenti, hogy pozitív relatív mágneses hatást (R = ηce(B)/ηce(B=0)) tapaszta- lunk, ami arányosan nő a mágneses térerőséggel, és viszonylag kis indukciónál telítési értéket ér el. Steiner szerint a Ru(bpy)32+ – MV2+ rendszerben néhány 10 G-nál már elérjük a telítést, ami kisebb, mint 1% [66].
4. ábra. A gyökpár spinállapotainak energiája a külső mágneses tér függvényében [75], és az egyes gyökök párosítatlan elektronjainak precessziós mozgását szemléltető vektorok a gyökpár különböző állapotaiban
Hasonlóképpen megvizsgálhatjuk a hiperfinom csatolás hatását a T– (T+) Æ S átalaku- lásra. Ha az egyes alszintek energiáit ábrázoljuk a mágneses indukció függvényében (4. ábra), akkor láthatjuk, hogy a mágneses térerősség növelésével elérünk egy olyan értéket (B2J), ahol a Zeeman-felhasadás következtében a T– (vagy a T+) alszint energiája eléri a szingulett állapot energiáját. Az ábrán a J-vel jelölt érték az ún. kicserélődési integrál, amelynek értéke a gyö- kök távolságának növekedésével közel exponenciálisan csökken [79a]. Eszerint a szinglet- triplet átalakulás akkor valósulhat meg, ha a két alszint energiája a hiperfinom csatolásból származó energiahozzájárulás „sávszélességén” belül megközelítik egymást. Ennek a hatás-
Ehfc
Ehfc
T+
T0
S T–
Ehfc
2J
Ehfc
B0
B2J
E


 2 vizes oldatának szobahőmérsékleten 3 M ionerősségnél (NaNO 3 ) felvett elnye- elnye-lési (—), gerjesztési ( ) és kisugárzási (Ο) színképei különböző ezüstion-koncentrációknál](https://thumb-eu.123doks.com/thumbv2/9dokorg/872762.46949/35.892.194.708.568.1041/oldatának-szobahőmérsékleten-ionerősségnél-gerjesztési-kisugárzási-színképei-különböző-koncentrációknál.webp)



![7. táblázat. A *[Ru(LL) 3 ]Ag n (n+2)+ részecskék (n = 0, 1, 2) gerjesztett állapotának energiavesztését jellemző paraméterek vizes oldatban 3 M ionerősségnél.](https://thumb-eu.123doks.com/thumbv2/9dokorg/872762.46949/47.892.105.797.496.731/táblázat-részecskék-gerjesztett-állapotának-energiavesztését-jellemző-paraméterek-ionerősségnél.webp)

![9. táblázat. A *[Ru(LL) 3 ]Ag n (n+2)+ részecskék (n = 0, 1, 2) gerjesztett állapotának energiavesztési folyama- folyama-tait jellemző paraméterek vizes, nehézvizes és propilénkarbonátos oldatban.](https://thumb-eu.123doks.com/thumbv2/9dokorg/872762.46949/49.892.112.793.929.1078/táblázat-részecskék-gerjesztett-állapotának-energiavesztési-paraméterek-nehézvizes-propilénkarbonátos.webp)