Pannon Egyetem
Vegyészmérnöki Tudományok Doktori Iskola
IONOS FOLYADÉKOK ALKALMAZÁSA KATALITIKUS REAKCIÓK KÖZEGEKÉNT
DOKTORI (PH.D.) ÉRTEKEZÉS Készítette:
Fráter Tamás okl. környezetmérnök
Témavezető:
Dr. Gubicza László tudományos főmunkatárs
Pannon Egyetem
Műszaki Kémiai Kutatóintézet
2007
IONOS FOLYADÉKOK ALKALMAZÁSA KATALITIKUS REAKCIÓK KÖZEGEKÉNT
Értekezés doktori (PhD) fokozat elnyerése érdekében Írta: Fráter Tamás, okleveles környezetmérnök
Készült a Pannon Egyetem Vegyészmérnöki Tudományok Doktori Iskolája keretében
Témavezető: Dr. Gubicza László, tudományos főmunkatárs Elfogadásra javaslom (igen / nem)
………
(aláírás)
A jelölt a doktori szigorlaton………. % -ot ért el
Az értekezést bírálóként elfogadásra javaslom:
Bíráló neve: ………. ………. igen /nem
……….
(aláírás)
Bíráló neve: ………. ………. igen /nem
……….
(aláírás)
Bíráló neve: ………. ………. igen /nem
……….
(aláírás)
A jelölt az értekezés nyilvános vitáján………% - ot ért el Veszprém, ……….
a Bíráló Bizottság elnöke
A doktori (PhD) oklevél minősítése…...
………
Az EDT elnöke
TARTALOMJEGYZÉK
Kivonat ... 5
Abstract... 6
Auszug ... 7
Bevezetés ... 8
1. Irodalmi összefoglaló... 9
1.1. Ionos folyadékok ... 9
1.1.1. Az ionos folyadékok jelentősége, szerkezete... 9
1.1.2. Az ionos folyadékok kifejlesztésének rövid története ... 10
1.1.3. Az ionos folyadékok fizikai-kémiai tulajdonságai... 12
1.1.4. Az ionos folyadékok környezeti kockázata ... 15
1.2. Enantioszelektív hidrogénezés ionos folyadékokban ... 20
1.2.1. Az enantioszelektív hidrogénezés jelentősége, katalizátorai ... 20
1.2.2. Az enantioszelektív hidrogénezés mechanizmusa ... 22
1.2.3. Ionos folyadékokban végzett enantioszelektív hidrogénezés... 23
1.3. Enzimkatalitikus folyamatok ionos folyadékokban... 34
1.3.1. A biokatalízis és az enzimek ipari alkalmazása ... 34
1.3.2 Enzimes reakciók ionos folyadékokban... 34
1.3.3. Az enzimek aktivitása és stabilitása ionos folyadékokban ... 43
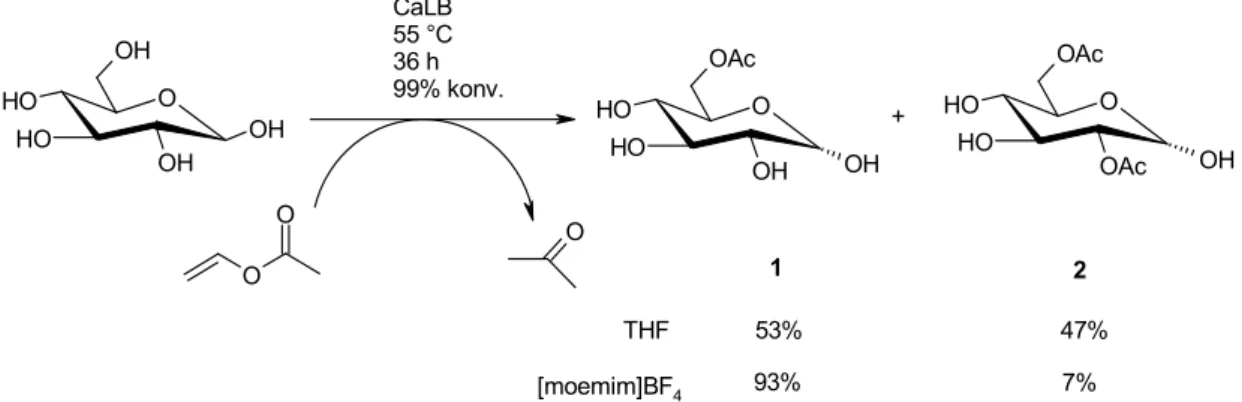
1.3.4. Az etil-acetát enzimes előállítása... 46
1.3.5. A 2-klór propionsav enzimes észterezése n-butanollal ... 47
2. Anyagok és módszerek ... 49
2.1. Enantioszelektív hidrogénezés ionos folyadékokban ... 49
2.1.1. Anyagok... 49
2.1.2. Módszerek ... 50
2.2. Etil-acetát előállítása szakaszos rendszerben ... 52
2.2.1. Anyagok... 52
2.2.2. Módszerek ... 53
2.3. Etil-acetát előállítása folyamatos rendszerben ... 57
2.3.1. Anyagok... 57
2.3.2. Módszerek ... 57
2.4. 2-Cl propionsav észterezése n-butanollal ... 62
2.4.1. Anyagok... 62
2.4.2. Módszerek ... 62
2.5. A mérések pontossága ... 68
2.5.1. Enantioszelektív hidrogénezés... 68
2.5.2. Etil-acetát enzimes előállítása szakaszos rendszerben ... 68
2.5.3. Etil-acetát enzimes előállítása folyamatos rendszerben ... 70
2.5.4. 2-klór-propionav enzimes észterezése n-butanollal ... 71
3. Eredmények ... 73
3.1. Enantioszelektív hidrogénezés ionos folyadékokban ... 73
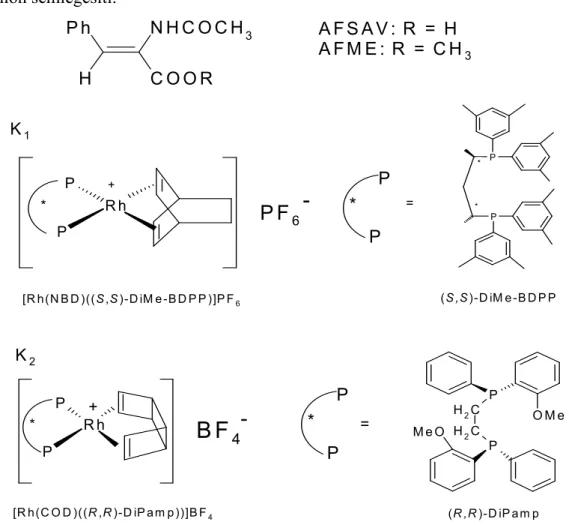
3.1.1. Az AFSAV hidrogénezése [Rh(NBD)((S,S)-DiMe-BDPP)]PF6 (K1) katalizátorral [bmim]BF4/izopropanol kétfázisú rendszerben ... 73
3.1.2. Az AFSAV és az AFME hidrogénezése [Rh(COD)((R,R)-DiPamp))]BF4 (K2) katalizátorral ionos folyadék/izopropanol kétfázisú rendszerben ... 74
3.1.3. A [Rh(COD)((R,R)-DiPamp))]BF4 (K2) katalizátor újrahasznosításának vizsgálata az AFSAV hidrogénezése esetén [bmim]BF4/izopropanol kétfázisú rendszerben ... 78
3.1.4. A kísérleti eredmények összehasonlítása az irodalmi adatokkal ... 80
3.2. Az etil-acetát enzimes előállítása ionos folyadékokban ... 82
3.2.1. A reakcióközeg hatása ... 82
3.2.2. Az enzimkoncentráció hatása ... 84
3.2.3. Az alkohol- és a savfelesleg hatása... 86
3.2.4. A hőmérséklet hatása ... 88
3.2.5. A víztartalom hatása ... 90
3.3. Az etil-acetát előállítása [bmim]PF6 ionos folyadékban, folyamatos rendszerben ... 93
3.3.1. Membránok fluxusának és szelektivitásának mérése „vak” modellelegyekkel ... 93
3.3.2. Szakaszos kísérletek pervaporációval... 95
3.3.3. Folyamatos rendszer kiépítése ... 96
3.4. 2-Cl-propionsav enzimes észterezése n-butanollal ionos folyadékokban ... 100
3.4.1. Reakcióközeg hatása... 100
3.4.2. Konverzió növelése pervaporációs vízeltávolítással... 103
4. Definíciók és rövidítések ... 110
5. Irodalomjegyzék ... 114
Tézisek... 120
Theses ... 123
Publikációk és proceedingek... 126
Publikációkra való hivatkozások ... 130
Köszönetnyilvánítás... 133
KIVONAT
Az ionos folyadékok szobahőmérsékleten folyékony, rendkívül alacsony gőznyomású sószerű vegyületek. Mivel gyakorlatilag nem párolognak, ígéretes környezetbarát reakcióközegnek bizonyulnak az illékony –emiatt tűzveszélyes és egészségkárosító–
hagyományos szerves oldószerek kiváltására. Doktori munkám során az ionos folyadékok alkalmazását kétféle enzimes észterezési, valamint egy fém-organikus katalitikus hidrogénezési reakcióban vizsgáltam.
Az egyik enzimes észterezési reakció egy aromaészter, az etil-acetát előállítása volt. Ezt a reakciót ionos folyadékban eddig még nem vizsgálták. Kísérleteim során a reakció optimális paramétereit vizsgáltam rázatott lombikos kísérletekben, majd egy laboratóriumi méretű, pervaporációval integrált berendezésben az észter előállítását folyamatossá tettem.
A másik vizsgált enzimes észterezés egy enantioszelektív reakció, a 2-klór-propionsav n-butanollal való észterezése volt. Kísérleteim során az enzimaktivitás csökkenését hasonlítottam össze hagyományos szerves oldószerben (n-hexánban) valamint egy ionos folyadékban. Az optimális víztartalom fenntartására egy pervaporációval integrált berendezésben távolítottam el a reakcióban keletkező vizet.
Enantioszelektív reakciókat nemcsak enzimek, hanem fém-organikus katalizátorok is képesek katalizálni. Kísérleteim során prokirális olefinek hidrogénezését végeztem. A reakciót kétfázisú rendszerben hajtottam végre, melyben az egyik fázist az ionos folyadék alkotta (ez tartalmazta a katalizátort), míg a másik fázis izopropanol volt, mely mint ko-szolvens a szubsztrátumokat tartalmazta oldott állapotban. Ez a kétfázisú rendszer az ionos folyadék révén lehetővé tette a költséges katalizátor visszanyerését, amit homogénkatalitikus eljárással csak rendkívül bonyolult módon lehet megvalósítani.
ABSTRACT
The use of ionic liquids were investigated in two enzymatic esterifications and a metal- catalyzed asymmetric hydrogenation.
The optimal reaction parameters of ethyl acetate synthesis were determined by shake- flask experiments, then a laboratory-scale setup integrated with a pervaporation unit was built for the continuous synthesis of the ester.
The decrease of enzyme activity was studied in enzymatic synthesis of butyl 2- chloropropionate using [bmim]PF6 ionic liquid as reaction media. An experimental set- up integrated with pervaporation was used for the removal of the excess water from the reaction mixture.
Enantioselective hydrogenation of enamides catalyzed by rhodium complexes were investigated in an ionic liquid containing biphasic system. This system - due to the ionic liquid- allowed the reuse of the catalyst, which can be hardly achieved by homogenous catalysis.
AUSZUG
Die Verwendung von ionischen Flüssigkeiten wurde in zwei enzymkatalytischen Reaktionen und in einer metallkatalysierten Reaktion untersucht.
Die optimalen Reaktionsparameter der Herstellung von Ethylazetat wurden in einem Schüttelinkubator bestimmt, dann wurde eine Anlage im Labormassstab verkoppelt mit einer Pervaporationsanlage zur kontinuierlichen Produktion des Esters ausgebildet.
Die Verminderung der Enzymaktivität wurde während der enzymatischen Synthese von Butyl-2-chlorpropionat in [bmim]PF6 ionischer Flüssigkeit als Lösungsmittel untersucht. Ein integriertes System bestehend aus einem Bioreaktor und einer Pervaporationsanlage wurde zur Entfernung des gebildeten Wassers aus dem Reaktionsgemisch verwendet.
Die enantioselektive Hydrierung von Enamiden durch Rhodium-Komplexe wurde in einem ionische Flüssigkeit enthaltende Zweiphasensystem studiert. Dieses System – infolge der Verwendung der ionischen Flüssigkeit – ermöglichte die Wiederverwendung des Katalysators, was in homogener Katalyse kaum möglich war.
Bevezetés
Napjainkban a vegyipar mind a hatóságok, mind a közvélemény részéről erős nyomás alá került, hogy tisztább alternatívákat keressen az illékony, mérgező és gyúlékony szerves oldószerek (ún. VOC = Volatile Organic Compounds, azaz illékony szerves vegyületek) használata helyett. Az 1970-es években új, környezettudatos szemlélet alakult ki, mely mára ahhoz vezetett, hogy új ipari technológiák jöttek létre, melyek környezetterhelése jóval kisebb, mint a hagyományos technológiáké. Kialakult a
„zöld kémiá”-nak („green chemistry”) nevezett kutatási irány. A zöld kémiai kutatások egyik kiemelt területe a szerves oldószerek kiváltása a légkört kevésbé szennyező, könnyen visszaforgatható, kevésbé toxikus anyagokkal. Alternatívaként az oldószermentes szintézisek elterjesztése, oldószerként víz vagy szuperkritikus folyadékok használata és –nem utolsó sorban– az ionos folyadékok alkalmazásba vétele kínálkozott.
Az ionos folyadékok szobahőmérsékleten folyékony, rendkívül alacsony gőznyomású sószerű vegyületek, melyek a szerves oldószerekhez hasonlóan oldják a szerves anyagok jelentős részét. A párolgás hiánya miatt azonban ezek az anyagok nem jutnak a légkörbe, így nem szennyezik a levegőt, és robbanásveszéllyel sem kell számolni. Az eddig megjelent szakirodalom alapján az ionos folyadékok számos szerves kémiai reakciókban (hidrogénezés hidroformilezés, epoxidáció, Heck reakció stb.) alkalmasak a szerves oldószer reakcióközeg kiváltására. Ezeken túlmenően kiderült, hogy a biokatalizátorok (enzimek), sőt sejtkultúrák is jól tolerálják az ionos folyadékokat, így biokatalitikus reakciók közegeként is alkalmasak.
Kutatásaim során az ionos folyadékok többféle alkalmazási lehetőségét is vizsgáltam. Prokirális olefinek aszimmetrikus hidrogénezése során tanulmányoztam a reakció lejátszódását olyan kétfázisú rendszerekben, melyekben az ionos folyadék segítségével újra felhasználható a fémkomplex katalizátor. Ezen túlmenően kétféle enzimes észterezési reakciót, köztük egy enantioszelektív észterezést vizsgáltam ionos folyadékokban különböző reakcióparaméterek mellett. Az enzimes reakció termékeinek in situ kinyerésére elsőként alkalmaztam integrált rendszert, mellyel folyamatos eljárást alakítottam ki.
1. Irodalmi összefoglaló
1.1. Ionos folyadékok
1.1.1. Az ionos folyadékok jelentősége, szerkezete
Az ionos folyadékok („ionic liquids; ILs”) szerves kationból és szerves vagy szervetlen anionból álló szintetikus sószerű vegyületek, melyek szobahőmérsékleten (vagy annak közelében) közepes viszkozitású folyadékok. A hagyományos értelemben vett „sók” magas olvadáspontjával szemben (pl. NaCl esetében 800 °C) az ionos folyadékok lényegesen alacsonyabb hőmérsékleten is folyékonyak (Wilkes, 2002).
Ennek oka az, hogy a kation és az anion nagy méretéből eredően az ionok közötti elektrosztatikus kölcsönhatás olyan kicsi, hogy szobahőmérsékleten nem alakul ki kristályszerkezet. Az ionos folyadékokban leggyakrabban előforduló kationokat és anionokat az 1.1.1. ábra mutatja. Elnevezésük, rövidítésük a „Definíciók és rövidítések”
c. fejezetben található.
N
R2 N R1 N
R
N R R R
R P
R R
R R
SO3
N S S
O
O O
O
CF3 CF3
+
Imidazolium
+
Piridinium
+
Ammónium
+
Foszfónium
PF6 BF4
KATIONOK: ANIONOK:
NO3 CF3SO3
- -
- -
-
-
1.1.1. ábra: Az ionos folyadékokat felépítő legfontosabb ionok
Az elmúlt kb. tíz évben az ionos folyadékok egyre inkább felkeltették a figyelmet mint korszerű, környezetbarát oldószerek, illetve reakcióközegek. Ennek a legfőbb oka az, hogy gőznyomásuk igen alacsony, melynek köszönhetően gyakorlatilag kizárhatók a párolgásból eredő környezeti és biztonságtechnikai problémák és veszteségek (Welton, 1999). Szintén előnyük, hogy a kation és az anion megfelelő módosításával széles körben variálhatók, „hangolhatók” bizonyos tulajdonságaik, mint polaritás, hidrofób jelleg valamint más oldószerekkel való elegyedés („designer solvents”, Freemantle,
1998). Ez igen kedvező, mivel kísérleti tapasztalatok és/vagy molekulamodellező szoftverek segítségével meghatározható, hogy egy adott célra (pl. extrakció, szerves katalitikus reakció stb.) milyen típusú ionos folyadékok felelhetnek meg. Ezek után pedig (pl. az alkil lánc változtatásával) tovább finomítható az optimalizálás (Huddleston, 2001; Anderson, 2002; Dzyuba, 2002). Az ionos folyadékok főbb tulajdonságai ma már internetes adatbázisokban is fellelhetők (1.1.5. fejezet).
Az ionos folyadék oldószerek jól alkalmazhatók számos szerves reakcióban (pl.
Heck reakció, hidroformilezés, hidrogénezés, Diels-Alder és Friedel-Crafts reakciók, epoxidáció, aminok szintézise stb.) (Borbigou, 2002; Jain, 2005). Ionos folyadékokat alkalmaznak az elektrokémiában is (de Souza, 2003), valamint az analitikán belül a folyadékkromatográfiában (Poole, 1986), a gázkromatográfiában (Armstrong, 1999), a kapillár-elektroforézisben (Yanes, 2001) valamint folyadék-folyadék extrakcióknál (Carda-Broch, 2003). Végül, de nem utolsó sorban az ionos folyadékok enzimes reakciók oldószereként is alkalmasak (részletesen az 1.3-1.4. fejezetekben).
Ma már több gyártónál is (pl. Solvent Innovation GmbH, www.solvent- innovation.com) komplett ionos folyadék készleteket, „kiteket” szerezhetünk be, melyeket egy adott célnak megfelelően állítanak össze (pl. „elektrokémiai kit” vagy
„biotechnológiai kit” stb.).
1.1.2. Az ionos folyadékok rövid története
Az ionos folyadékok felfedezésének története még a 19. századba nyúlik vissza. A benzol klór-metánnal történő Friedel-Crafts alkilezése során a reakcióelegyben a toluol termék mellett egy „vörös olaj”-nak nevezett mellékterméket is találtak, ami külön fázist alkotott. Ennek összetételét csak jóval később, az NMR spektroszkópia megjelenésével tudták meghatározni. Ekkor kiderült,
hogy az „olaj” egy olyan folyékony halmazállapotú só, melynek anionja a heptakloro- aluminát, kationja pedig a Friedel-Crafts reakció során átmeneti termékként keletkező σ-komplex (1.1.2. ábra) (Wilkes, 2002).
R H
+ Al2Cl7-
1.1.2. ábra: A „vörös olaj”
konstitúciós képlete
A 20. század elején publikálták elsőként, hogy bizonyos szerves sók –mint például az etil-ammónium-nitrát– szobahőmérsékleten is folyékonyak (Walden, 1914) Az első, mai ionos folyadékok „ősének” számító ionos folyadékokat, a klór-aluminátokat az 1940-es években fedezte fel Hurley és Wier (Hurley és Wier, 1951). Ők az alkil-piridin- kloridot és az alumínium-kloridot elegyítették, melynek során tiszta, színtelen folyadékot kaptak, melyben ionok voltak: alkil-piridinium kation és tetrakloro-aluminát anion. Felfedezésük kémiai kuriózumnak számított, de évtizedekre feledésbe merült.
Az 1980-as években Wilkes, Seddon és Hussey kutatócsoportja számos alkil- piridinium- és alkil-imidazolium kationt és tetrakloro-aluminát aniont tartalmazó ionos folyadékot állított elő (Fannin, 1984; Hitchcock, 1986). Az 1980-as évek közepétől kísérletek kezdődtek ezen ionos folyadékok Friedel-Crafts reakcióban való alkalmazására. A kutatóknak nem kellett csalódniuk: ionos folyadék közegben a Friedel-Crafts acilezés a hagyományos oldószerekhez képest nagyobb sebességgel és jobb szelektivitással ment végbe (Boon, 1986).
A klór-aluminátok legnagyobb hátránya, hogy a nedvesség hatására reakcióba lépnek, melynek során korrózív sósav is keletkezik. 1992-ben Wilkes és Zaworotko nedvességre érzéketlen ionos folyadékokat fejlesztett ki tetrafluoro-borát, a hexafluoro- foszfát, szulfát, nitrát és acetát anionokkal (Wilkes és Zaworotko, 1992).
A környezetvédelem előtérbe helyeződésével az utóbbi években az ionos folyadékok a gyúlékony és egészségkárosító szerves oldószerek alternatívájaként igen jelentős érdeklődésre tettek szert a szerves- és elektrokémia területén. A publikációk száma 1998-1999 óta rohamosan nő (1.1.3. ábra). Az ionos folyadékok ipari alkalmazása szempontjából azonban ma még nagy hátrányt jelent a költség, az oldószerek viszonylag magas ára. Szerencsére azonban az utóbbi 10 évben az ionos folyadékok ára a forgalmazó cégeknél (Solvent Innovation GmbH, Io-Li-Tech, Merck stb.) jelentősen, kb. 1/5-ére csökkent. Az ionos folyadékok árában megfigyelhető csökkenő tendencia fennmaradni látszik, így könnyen elképzelhető, hogy néhány éven belül a finomvegyipar több ága számára is gazdaságos lehet az ionos folyadékok alkalmazása.
Ionos folyadékokat pari méretben először a BASF alkalmazott a Német Innovációs Nagydíjjal kitüntetett BASIL® (BASIL = Biphasic Acid Scavenging utilizing Ionic Liquids) eljárásban (Freemantle, 2003).
0 200 400 600 800 1000 1200
Publikációk száma
1997 1998 1999 2000 2001 2002 2003 2004 2005 2006 Év
1.1.3. ábra: Az „ionos folyadék” kifejezést tartalmazó publikációk száma az elmúlt években (Forrás: Web of Science, www.eisz.hu)
1.1.3. Az ionos folyadékok fizikai-kémiai tulajdonságai
Az ionos folyadékok elegyedési (oldószer-) tulajdonságai az iparban alkalmazott illékony szerves oldószerekéhez hasonlóak, azonban számos tulajdonságuk (pl.
oktanol/víz megoszlás) ettől jelentősen eltér. Amennyiben egy adott kémiai reakcióhoz oldószert szeretnénk választani, a legfontosabb paraméterek közé tartozik, hogy milyen hőmérsékleti határok között stabilak (lehet velük dolgozni), valamint mekkora a komponensek oldhatósága az oldószerben. Ezen oldószer tulajdonságokról mindezidáig az egyik legjobb összefoglaló Reichard kézikönyvében jelent meg (Reichard, 2003, bővített kiadás). Az ionos folyadékok egyéb tulajdonságairól, mint sűrűség, viszkozitás, hőkapacitás szintén nagy mennyiségű irodalom áll rendelkezésre, ezek összefoglalóan Wilkes tanulmányában találhatók meg (Wilkes, 2004). Mindezen túlmenően Carda- Broch és Poole publikált igen részletesen az ionos folyadékok paramétereiről (Carda- Broch, 2003; Poole, 2004), de mivel ezek döntően csak adatok, részletes ismertetésükről itt (helyszűke miatt) eltekintek, helyette csak igen röviden, és összefoglalóan ismertetem az ionos folyadékok legfontosabb tulajdonságait. Néhány ionos folyadék jellemző adatát az 1.1.1-1.1.2. táblázatban tüntettem fel.
1.1.1. táblázat: [bmim]+ kationt tartalmazó ionos folyadékok néhány fizikai-kémiai tulajdonsága (Carda-Broch, 2003)
Anion Olvadáspont (°C)
Sűrűség (kg/dm3)
Törésmutató Viszkozitás (cP, 20 °C)
Vezetőképesség (S/m) BF4-
-82 1,17 1,429 233 0,17
PF6-
-8 1,36 1,411 312 0,14
Cl- 65 1,10 szilárd szilárd szilárd
CF3COO- -40 1,21 1,449 73 0,32
CF3SO3- 16 1,29 1,438 90 0,37
(CF3SO2)N- -4 1,43 1,427 52 0,39
C3F7COO- -40 1,33 1,414 182 0,10
C4F9CO3-
20 1,47 1,405 373 0,045
1.1.2. táblázat: Néhány Tf2N- aniont tartalmazó ionos folyadékok néhány fizikai-kémiai tulajdonsága (Carda-Broch, 2003)
Kation Olvadás-
pont (°C)
ρ (kg/dm3)
Törés- mutató
Viszkozitás (cP, 20 °C)
Λ (S/m)
1,3-dimetil-imidazolium+ 22 1,56 1,422 44 0,84
1-etil-3-metil-imidazolium+ -3 1,52 1,423 34 0,88
1,3-dietil-imidazolium+ 14 1,45 1,426 35 0,85
1-butil-3-metil-imidazolium+ -4 1,43 1,427 52 0,39
1-metoxietil-3-metil- imidazolium+
30 1,50 1,429 54 0,42
1-metil-2-metil-3-etil- imidazolium+
20 1,51 1,430 88 0,32
1-etil-3-etil-4-metil- imidazolium+
-22 1,43 1,430 36 0,62
Olvadáspont
Az ionos folyadékok olvadáspontja tág határok között mozog. Definíció szerint olyan sók esetében beszélhetünk „ionos folyadék”-ról, melynek olvadáspontja 100 °C alatt van, míg az alsó határ kb. -100 °C, ennél alacsonyabb olvadásponttal csak kivételes esetben találkozhatunk.
Sűrűség
A legtöbb ionos folyadék sűrűsége a víznél nagyobb, többnyire 1,1-1,5 kg/dm3 között változik. Bizonyos esetekben a sűrűség 1-nél kisebb, pl. néhány tetraalkil- ammónium só esetében. Azonos anion mellett az alkil szubsztituensek méretével arányosan kissé csökken a sűrűség (1.1.1-1.1.2. táblázat)
Viszkozitás
A legtöbb ionos folyadék viszkozitása 50 és 500 cP közé esik (1 cP = 1 mPa × s), ami a víz viszkozitásának (0,89 cP) kb. 60-600-szorosa. A viszkozitás erősen függ a hőmérséklettől. A [bmim]oktil-szulfát viszkozitása például 20 °C-on még 900 Cp körül van, 100 °C-on viszont már csak 25 körüli érték, (1.1.4. ábra). A függvény alakján látszik, hogy a vizsgált hőmérséklet-tartományban az ionos folyadék viszkozitása jól követi a newtoni folyadékokra vonatkozó szabályt (lnη = A + B/RT).
10 100 1000
20 30 40 50 60 70 80 90 100
T (°C)
Viszkozitás (mPa×s)
1.1.4. ábra: A [bmim]oktil-szulfát viszkozitásának változása a hőmérséklet függvényében 20-100 °C között (Wasserscheid, 2002)
Hőmérsékleti stabilitás
A legtöbb ionos folyadék 250-300 °C-ig stabil, azonban a hexafluoro-foszfát illetve tetrafluoro-borát anionok jelenléte jelentősen limitálhatja az alkalmazott hőmérsékletet:
itt már 70-80 °C-on káros HF bomlástermék keletkezhet az anionokból (Swatloski, 2003).
Polaritás
Az ionos folyadékok általában erősen poláros oldószerek. Az oldószer polaritást a szolvatokromikus festék (olyan festékanyag, melynek látható tartományban mért
elnyelési maximuma az oldószer polaritásától függ) abszorpciós maximuma alapján definiálják. (Deye, 1990; Reichard, 1994). Az ionos folyadékok polaritása kb. 0,6-0,7 azon a normál polaritás skálán, melyen a tetrametil-szilán polaritása 0, a vízé pedig 1,0.
Így az ionos folyadékok polaritása a kis móltömegű alkoholok illetve a formamid tartományába esik. Az imidazolium-gyűrűn lévő alkil csoport (C4-C8), illetve az anion csak kis mértékben befolyásolja a polaritást (Carmichael, 2000; Aki, 2001).
Elegyedés szerves oldószerekkel és vízzel
Az ionos folyadékok az apoláros, kis dielektromos állandójú oldószerekkel (hexán, éterek) általában nem, a polárosakkal (aceton, metanol, THF) jól elegyednek (Poole, 2004). Néhány ionos folyadék leggyakoribb oldószerekkel való elegyedését az 1.1.3.
táblázat mutatja.
1.1.3. táblázat: Néhány oldószer elegyedése ionos folyadékokkal (Poole, 2004) [bmim]
BF4
[bmim]
PF6
[bmim]
Tf2N
[bmim]
oktil-szulfát
Oktil-metil- ammónium Tf2N
Víz + - - p +
Etil-acetát p + + p +
Toluol p p p p +
Acetonitril + + + + +
n-Hexán - - - p p
1-Oktanol p p p + +
Kloroform + p + + +
+ = elegyedik; - = nem elegyedik; p = parciálisan elegyedik
Az ionos folyadékok vízzel való elegyedésének mértéke nagymértékben függ az aniontól (1.1.5. ábra, Visser, 2002; Kragl, 2003).
1.1.5. ábra: Az ionos folyadékok anionjának hatása a vízzel való elegyedésre (Kragl, 2003)
Teljes elegyedés Nincs elegyedés
A szuperkritikus szén-dioxid (sc.CO2) nem elegyedik pl. a [bmim]PF6 ionos folyadékokkal, de igen nagy mennyiségben elnyelődik az ionos folyadék fázisban (akár 0,7 móltörtig is). Ionos folyadék nem kerül be a CO2 fázisba. Ennek akkor van nagy jelentősége, amikor a terméket sc.CO2-dal extrahálják ki az ionos folyadékból (Blanchard, 2001).
Analízis
Az ionos folyadékok hagyományos kromatográfiás módszerekkel csak nehezen elemezhetők, UV-spektroszkópiával viszont nagy érzékenységgel kimutathatók; az imidazolium-bázisú ionos folyadékok elnyelési maximuma például a 240-250 nm-es tartományban van (Koel, 2000). Az ionos folyadékok jól elemezhetők IR spektroszkópiával is, amivel elsősorban tisztaságuk határozható meg (Koel, 2000, Csihony, 2001). Az ionos folyadékok tisztasága, hőstabilitása termikus analízissel (DT, DTA, DTG) is meghatározható. Mindezen túlmenően az ionos folyadékok NMR spektroszkópiával is jól vizsgálhatók (Durazo és Abu-Omar, 2002).
1.1.4. Az ionos folyadékok környezeti kockázata
Az ionos folyadékok legfontosabb környezeti előnye a többi oldószerrel szemben egyértelműen a rendkívül alacsony gőznyomás. A párolgás hiánya miatt az ionos folyadékok alkalmazása egészség- és tűzvédelmi szempontból egyértelműen előnyös lehet, azonban nem szabad megfeledkezni egyéb úton történő expozícióról (orális, dermális) sem, illetve arról, hogy az ionos folyadékok alkalmazása során keletkezhet-e mellékreakcióban környezetre káros anyag. Emiatt alapvető az ionos folyadékok toxicitásának valamint biztonságtechnikai szabályainak (pl. milyen védőruházatra van szükség, mi a teendő bőrfelületre fröccsenés vagy lenyelés esetén stb.) ismerete. Egy másik nagyon fontos kérdés, hogy a hulladékba kerülő ionos folyadékok hogyan semmisíthetők meg, lehetséges-e biológiai degradációjuk.
Az anionokkal kapcsolatban jelentős probléma lehet, hogy számos anion halogéntartalmú komplex, ami viszont magában hordozza a bomlás veszélyét. A tetrakloro-aluminát ion például vizes közegben hidrolizál, melynek során korrózív és egészségkárosító HCl keletkezik. A fluortartalmú komplexekről sokáig úgy tartották, hogy teljesen stabilak, ennek ellenére később bebizonyosodott, hogy például a hexafluoro-foszfát anionból (főleg magasabb hőmérsékleten) lassú folyamatban HF
szabadul fel (Wasserscheid, 2002, Swatloski, 2003). A probléma kiküszöbölhető olyan anionok alkalmazásával, melyek nem tartalmaznak fluort (pl. szulfát, metil-szulfonát, toloul-szulfonát, acetát, laktát…). Wasserscheid kutatócsoportja foglalkozott fluormentes ionos folyadékok kifejlesztésével, 2002-ben például egy ígéretes fluormentes ionos folyadék, a [bmim]oktil-szulfát kifejlesztéséről számoltak be. A [bmim]oktil-szulfát olcsó alapanyagokból előállítható, hőmérsékletileg igen stabil (csak 340 °C-on kezd el bomlani), emellett a hidrolízisnek is ellenáll. A szerzők az általuk kifejlesztett ionos folyadékot sikeresen alkalmazták az 1-oktén hidroformilezése során (Wasserscheid, 2002).
Mint az 1.1.1. fejezetben is említettem, az ionos folyadékokban sokféle kation és anion fordulhat elő, melyekből csak néhány kiragadott példa látható az 1.1.1. ábrán. Az ionokból így igen nagy számú kombináció lehetséges, ami igen fontos előny a felhasználásnál, mivel egy adott célra „testre szabható” az ionos folyadék tulajdonsága, azonban minden egyes ionos folyadéknak „külön-külön” történő (öko)toxikológiai vizsgálata igen nehézkes vállalkozás. Ehelyett a vizsgálatok nemcsak az egyes ionos folyadék-típusok toxikológiai elemzésére irányulnak, sokkal inkább az egyes ionok szerkezete és biológiai hatása között keresnek összefüggéseket, melyek alapján képet kaphatunk arról, hogy egy ionstruktúra mennyire előnyös vagy hátrányos az élő szervezetre („structure-activity relation” = SAR, Jastroff, 2003). Az ionos folyadékok toxicitásának SAR vizsgálatáról Jastroff kutatócsoportja már 2003-ban kiadott egy tanulmányt, 2005-ben pedig további eredményeket ismertetett. Ezen SAR vizsgálatok során ionos folyadékok négy fő paraméterét vizsgálták (Jastroff, 2005), melyeket az alábbiakban mutatok be.
1. A kation mag típusának (pl. imidazolium v. piridinium) és biológiai hatásának összefüggése
A különböző kationokat tartalmazó ionos folyadékok biológiai hatásait – természetesen azonos anion mellett– patkánysejteken (Promyleocytic leukemia sejtek túlélése) és az acetilkolin észteráz aktivitásának változása alapján vizsgálták. A sejteket olyan környezetbe helyezték, melyben különböző ionos folyadék koncentrációknak voltak kitéve, majd vizsgálták a sejtek túlélését (WST-analízis). A túlélést a koncentráció logaritmusának függvényében ábrázolták, melyek során szigmoid típusú görbéket kaptak. Az eredmények alapján azt a következtetést vonták le, hogy az
imidazolium kation mag kevésbé toxikus az adott sejtre ill. enzimre, mint a pirrolidium, illetve piridinium.
2. A kation magon található alkil láncok hatása
A kation magján található alkil láncok hatását már 2004-ben is vizsgálta Swatloski kutatócsoportja, melyben a Caenorhabditis elegans hengeresféreg (nematóda) mortalitását vizsgálta különböző hosszúságú alkil-láncot tartalmazó ionos folyadékban ([bmim]Cl: 4 szénatom, [omim]Cl: 8 szénatom, tertadecil-metil-imidazolium-klorid: 14 szénatom) (Swatloski, 2004). A toxicitásvizsgálat során egyértelmű összefüggést állapítottak meg az alkil lánc hossza és a nematódák pusztulása között: minél hosszabb az imidazolium-gyűrűn lévő alkil lánc, annál toxikusabb az ionos folyadék. A 14 szénatomos alkil lánc esetében már 1 g/dm3 esetén 99%-os volt a mortalitás a nematódák között, addig a [bmim]Cl esetében még 5 g/dm3 IL koncentrációnál sem volt számottevő a pusztulás. Az eredmények alapján a [bmim]Cl és az [omim]Cl nem bizonyult akut toxikusnak, a tertadecil-metil-imidazolium-klorid viszont enyhén toxikusnak bizonyult (10 mg/dm3 < LC501
< 100 mg/ dm3).
Jastroff és munkatársai hasonló összefüggést állapítottak meg a [bmim]BF4 és az [omim]BF4 toxicitásának összehasonlítása során. A Lemna minor mikroorganizmus tenyésztése során [omim]BF4 expozíció esetén már 10 mg/dm3 IL koncentrációnál 87%- os telepszám-csökkenést figyeltek meg, míg [bmim]BF4 esetében ennél a koncentrációnál még nem volt szignifikáns a csökkenés. A kerti zsázsa (Lepidium sativum) [omim]BF4 expozíciója során már 100 mg/kg koncentrációnál teljesen kipusztult a növény, míg [bmim]BF4 esetén a teljes pusztulást csak 1000 mg/kg expozíció esetén figyelték meg.
3. Anion hatása
Jastroff kutatócsoportja több mint 20 anion hatását vizsgálta azonos kation ([bmim]) mellett. Az anion variálásával az LC50 kb. 1 nagyságrenden belül változott.
4. Metabolitok hatása
A szerzők azt az esetet is modellezték, melyben az ionos folyadék lebomlása megkezdődik, és különböző bomlástermékek, metabolitok jönnek létre, melyek
1 LC50 = „félhalálos koncentráció”, a pontos definíció a „Definíciók és rövidítések” c. fejezetben található
toxicitása fokozatosan csökken. Az 1.1.6. ábra az [omim] kation feltételezett metabolitjait, és ezek hatását (EC501) mutatja be.
Az ionos folyadékok biológiai hatásairól (pl. szem-és bőrizgató hatás) további irodalmi adatok találhatók a 2004-ben Masten által kiadott tanulmányban (Masten, 2004). Az ionos folyadékok toxicitásáról a jelenlegi legfrissebb adatbázis 2006-ban jelent meg Chiappe kutatócsoportjától (Pretti, 2006). A szerzők többféle imidazolium-, piridinium-, pirrolidium- és ammóniumion kationt tartalmazó ionos folyadék ökotoxicitását vizsgálták zebrahalon (Danio rerio). A vizsgált ionos folyadékok többsége nem bizonyult akut toxikusnak (LC50 > 100 mg/dm3), azonban két, ammóniumbázisú kationt tartalmazó ionos folyadék esetében az LC50 értéke 1 és 10 mg/dm3 között volt (közepesen toxikus kategória).
N N
N N OH
N N O
O
N N
N N
+
+
+ -
EC50 = 62 × 10-3 mM
EC50 > 3 mM
EC50 > 2 mM
EC50 = 158 × 10-3 mM
1.1.6. ábra: Az [omim]+ kation feltételezett metabolizmusa, és a metabolitok citotoxicitása (Jastroff et. al., 2005)
1.1.5. Adatbázisok
Az igényt, hogy az ionos folyadékokkal kapcsolatban létrejöjjön egy jól áttekinthető, gyors internetes adatbázis, már 2000-ben megfogalmazták (Rogers, 2000).
Ebben felvetette, hogy egy olyan adatbázisra van szükség, melyben az ionos folyadékok fizikai és fizikai-kémiai adatai mellett a biztonságtechnikai, toxikológiai, és környezeti
1 A pontos meghatározás a „Definíciók és rövidítések” c. fejezetben található
hatásai (bioakkumuláció, biodegradáció stb.) is elérhetők legyenek, valamint hogy gazdaságossági és életciklus-elemzéseket is készítsenek az ionos folyadékok alkalmazásáról.
A világhálón jelenleg (2007 tavaszán) föllelhető ionos folyadék adatbázisok közül kettőt mutatok be részletesebben: a IUPAC Ionic Liquids IL-Thermo-t valamint a Merck világcég adatbázisát. Mindkét weblap szabadon elérhető.
IUPAC Ionic Liquids IL Thermo
(http://ilthermo.boulder.nist.gov/ILThermo/mainmenu.uix)
Az IL Thermo adatbázis a NIST kémiai adatbázisra épül. A NIST adatbázisban a vegyületek fizikai és kémiai tulajdonságai találhatók, melyet a világszerte megjelent irodalmi adatok alapján táplálnak be és frissítenek.
Az igen felhasználóbarát adatbázis nyitólapja az 1.1.7. ábrán látható. A nyitólapról linkes kapcsolatban elérhetők a IUPAC ionos folyadék adatbázis projekt, a Temodinamics Research Center valamint a National Institute of Standards and Technology weblapjai. Ezen kívül feltüntették a legutóbbi frissítés időpontját is.
A nyitólapról tiszta ionos folyadékok, valamint ionos folyadékokat tartalmazó biner és terner rendszerek adataira kereshetünk rá. Mind az ionos folyadékok, mint a többkomponensű rendszerek a következőképpen azonosíthatók a keresés során:
Az ionos folyadék alapján (összegképlet, CAS szám, molekulatömeg, elnevezés, szerkezet) A keresőt úgy alkották meg, hogy amennyiben csak az egyik ion (anion vagy kation) kerül megadásra, a rendszer automatikusan felkínálja az adatbázisban található valamennyi ionos folyadékot, amiben megtalálható az adott ion.
Az ionos folyadék alapján (összegképlet, CAS szám, molekulatömeg, elnevezés, szerkezet)
Tulajdonságok alapján (Pl. olvadáspont < 10°C stb.)
Irodalmi hivatkozások alapján (Publikáció címe, megjelenés vagy szerzők) Mindegyik ionos folyadék esetén fel van tüntetve, hogy az adott ionos folyadék milyen forrásból, milyen kiszerelés mellett szerezhető be, illetve ha kereskedelmi úton még nem került forgalomba, elnavigálhatunk ahhoz a publikációhoz, ahol a szerzők ismertetik az ionos folyadék szintézisét, esetleg a kereskedelemben beszerzett ionos
folyadék további tisztításának módszerét, illetve az analitikai módszereket (kalorimetria, NMR stb.)
1.1.7. ábra: Az „IL Thermo” internetes adatbázis nyitólapja
Biner rendszerek esetén az ionos folyadékok más komponensekkel (víz, alkoholok, alifás, ciklusos és aromás szénhidrogének, CO2 stb.) való elegyedéséről kapunk információt, míg terner rendszer választásakor megtalálható pl. a [bmim]PF6/víz/etanol rendszer vezetőképessége vagy viszkozitása, vagy például a policiklusos aromás szénhidrogének megoszlása különböző kétfázisú, ionos folyadék/víz rendszerekben.
Az adatbázisban a megadott numerikus adatok mellett ismertetik a forrást, a rendelkezésekre álló adatpontok számát valamint az adat szórását (megbízhatóságát) is.
Merck adatbázis (http://ildb.merck.de/ionicliquids/en/startpage.htm)
A Merck adatbázis struktúrája hasonlít az IL Thermo adatbáziséhoz, a nyitólapról lehetőségünk van egy gyors és egy kibővített keresés indítására. Ez utóbbiban –az IL Thermo-hoz hasonlóan– kiválasztható az ionos folyadék tulajdonsága (pl.
molekulatömeg < 300 g), és a találati listán csak ezen ionos folyadékok jelennek meg.
Természetesen beállítható az is, hogy a teljes ionos folyadék lista megjelenjen egy listán, melyekből a kiválasztottakra kattintva adatlap jelenik meg (1.1.8. ábra) Az adatbázis igen jól áttekinthető, felhasználóbarát, hátránya azonban, hogy a fellelhető ionos folyadékok száma jóval kisebb, mint az IL Thermo-ban föllelhetőké, valamint számos ionos folyadék adatlapja nem teljes.
A Merck adatbázis szintén számos további publikáció elérhetőségét kínálja fel, melyek segítségével a felhasználó további információhoz juthat.
1.1.8. ábra: A Merck ionos folyadék adatbázisa
1.2. Enantioszelektív hidrogénezés ionos folyadékokban
1.2.1. Az enantioszelektív hidrogénezés jelentősége, katalizátorai
Az enantioszelektív szintézisek egyik leghatékonyabb és legelterjedtebb módja az enantioszelektív hidrogénezés, melynek alkalmazásával nagy tisztasággal állíthatók elő gyógyszerek (vagy gyógyszer prekurzorok), mint például a β-laktám alapú antibiotikumokat felépítő β-aminosavak (Tang, 1999) vagy a Naproxen® (Monterio, 1997), illetve előállíthatók illatanyagok is (Scrivanti, 2006). Az enantioszelektív hidrogénezés első, gyógyszeripari jelentőségű alkalmazása az L-DOPA szívgyógyszer egyik intermedierének előállítása volt, melyet Knowles kutatócsoportja dolgozott ki 1977-ben (1.2.1. ábra) (Vineyard, 1977).
NHCOMe OAc OMe
HOOC
OAc OMe
NHCOMe HOOC
O H
O H
NH2 COOH Rh(COD)2BF4
(R,R)-DIPAMP H2, MeOH 3 bar, 50°C S/C > 10.000
L-DOPA 96% ee
1.2.1. ábra: L-DOPA előállítása
Az enantioszelektív hidrogénezés során egy prokirális olefin enantioszelektív hidrogén-addíciója játszódik le. A prokirális olefinek olyan alkének, melyekben a szén- szén kettős kötés hidrogén-addíciója (hidrogénezése) során egy királis vegyület keletkezik.
Az enantioszelektív hidrogénezés során a katalizátor a hidrogénezés reakciósebességét irányítottan növeli: a termék valamelyik enantiomere a másikhoz képest nagyobb mennyiségben keletkezik. A prokirális olefinek hagyományos kémiai módszerekkel jól előállíthatók, ezek aszimmetrikus hidrogénezésével pedig optikailag többé-kevésbé tiszta terméket nyerünk. Ma már számos nagy stabilitású és szelektivitású hidrogénező katalizátor áll rendelkezésre, melyekből kiválasztható, melyik a legalkalmasabb egy adott feladatra. Az aszimmetrikus hidrogénezés katalizátorai királis átmenetifém (többnyire Rh-, vagy Ru-)-komplexek, melyekben a királis ligandum legtöbbször egy vagy több aszimmetrikus foszfin (mono vagy difoszfin), ritkábban szulfin. A történeti szempontból legfontosabb hidrogénező katalizátorokat az 1.2.2. ábrán, a jelenleg alkalmazottakat az 1.2.3. ábrán mutatom be.
P MePr Ph
C O H3
C H3
O
CH2PPh2 CH2PPh2 H
H
R1 P
R2R3 R1 P
R2 R2
P P
P P
R
P P
OMe OMe
P
CH3 P H
C H3
H (S)-(+)-MPPP (Horner) (R,R)-(-)-DIOP (Kagan)
(R,R)-DIPAMP (Knowles) (S,S)-CHIRAPHOS (Bosnich)
A
*
*
* *
* B
C
D
* * * *
*
*
*
1.2.2. ábra: Az enantioszelektív hidrogénezés legjelentősebb korai foszfinligandumai és az aszimmetrikus (di)foszfinok fő csoportjai (a vegyületek elnevezése a „Definíciók és Rövidítések” c. fejezetben található)
P P PPh2
PPh2
(R,R) Et-DUPHOS (R,R) BINAP
1.2.3. ábra: Az enantioszelektív hidrogénezés korszerű foszfinligandumai (a vegyületek pontos elnevezése a Definíciók és Rövidítések c. fejezetben található)
Mint az 1.2.2. ábrán is látható, a foszfin ligandumoknak sokféle változata létezik, a rendszerezés megkönnyítésére ezeket négy csoportba sorolják (1.2.2. ábra, jobb oldal).
Az „A” csoportba tartoznak azok a királis foszfinok, melyekben a kiralitáscentrum maga a foszforatom. Ilyenek a legkorábban felfedezett foszfin ligandumok, melyeket sikeresen alkalmaztak enantioszelektív hidrogénezésre, mint például a Horner által kifejlesztett (S)-(+)-metil-fenil-propil-foszfin (MPPP) (Horner, 1968), ami csak szerény (15%) enantioszelektivitást produkált, mégis nagy áttörést jelentett, mivel ez volt az első királis foszfin ligandum. A „B” csoportba az olyan foszfinvegyületek tartoznak, melyekben a foszforhoz kapcsolódó valamelyik csoport királis, így az egész foszfin is az. A „C” és „D” csoportba olyan difoszfinvegyületek tartoznak, melyekben a kiralitáscentrum szintén vagy a foszforatomon (C típus) vagy a két foszfint összekötő hídon (D típus) található. Előbbiekhez a Knowles kutatócsoportja által kifejlesztett
(R,R)-1,2 bisz(2-metoxifenil-fenil-foszfino)etán (DIPAMP) tartozik (Vineyard, 1977), míg utóbbiakra az (R,R)-2,2 dimetil-4,5 bisz(difenil-foszfino)1,3-dioxolán (DIOP) (Kagan és Dang, 1971) vagy az (S,S)-2,3 bisz(difenil-foszfino)bután (CHIRAPHOS) (Fryzuck és Bosnich, 1977) nevezhető meg példának.
A jelenleg alkalmazott foszfin ligandumok közül két család terjedt el széles körben.
Az 1,2 bisz(2,5-dietil-foszfoláno)benzolt (DUPHOS) Burk kutatócsoportja fejlesztette ki (Burk, 1995), származékai Rh-komplexek elterjedt hidrogénező ligandumai (1.2.3.
ábra, bal oldal). A 3,5 bisz(difenil-foszfino)1,1-binaftil (BINAP) alapvázát Noyori kutatócsoportja állította elő (Takaya, 1987), származékait Ru-komplexekben alkalmazzák (1.2.3. ábra, jobb oldal).
1.2.2. Az enantioszelektív hidrogénezés mechanizmusa
Az enantioszelektív hidrogénezés mechanizmusát egy példán mutatom be, ahol a hidrogénezésre kerülő prokirális olefin a Z-α-acetamido-fahéjsav (AFSAV). A hidrogénező katalizátor egy királis komplex (az ábrán a két foszfort összekötő hídhoz csillag jelölést tettem). A komplex összegképlete jelen esetben [Rh(DIPAMP)COD]BF4. Ennek központi atomja egy Rh(I) atom, amelynek egyik oldalához a „DIPAMP” királis difoszfin ligandum (1.2.2. ábra) két foszforatomja, másik oldalról pedig ciklooktadién (COD) kapcsolódik koordinative a ródium(I) atomhoz. A katalízis szempontjából lényeges az oldószer is (S’), jelen esetben a folyamat izopropanol (S’= IPA) közegben játszódik le (1.2.4. ábra).
Az enantioszelektivitás szempontjából a sebességmeghatározó második lépés, azaz a hidrogén oxidatív addíciója a legfontosabb. Halpern 31P[1H]NMR segítségével vizsgálta a 2. lépésben keletkező diasztereomerek mennyiségét a reakcióelegyben, és azt tapasztalta, hogy azon diasztereomer koncentrációja, amiből a nagyobb mennyiségű enantiomer keletkezne, lényegesen alacsonyabb („nem kedvezményezett diasztereomer”), mint a másiké („kedvezményezett diasztereomer”). A kinetikai vizsgálatok ugyanakkor kimutatták, hogy habár a “nem kedvezményezett” (S) diasztereomer van jelen kisebb koncentrációban ([(S)diaszt]<[(R)diaszt]), ez viszont lényegesen nagyobb reakciósebességgel is alakul át, mint a “kedvezményezett”, azaz k(S)>>k(R). Mivel az (S) diasztereomer koncentrációja lényegesen gyorsabban csökken, mint a másiké, a tömeghatás értelmében az első lépésben az egyensúlyok úgy tolódnak el, hogy több “nem kedvező” (S) diasztereomer keletkezzen, azaz (S) termék képződjön
nagyobb arányban. Ennek következtében alakulhat ki a termékelegyben, hogy túlnyomórészt az (S) konfigurációjú telített vegyületet tartalmazza. Az ábrán a szemléletesség kedvéért a nagyobb reakciósebességet vastagabb nyíllal, a magasabb koncentrációban jelen lévő komplexet nagyobb mérettel jelöltem.
P C H2
C H2
P O Me MeO
P P
HN CH2Ph
CH3 O
H O O C H N H C OC H3
H Ph
C OOH
Rh P
P O CH3
NH Ph H OOC
N H
Ph Rh
O P
P
C H3
C O O H
O NH C H3
CH2Ph
H C O OH
RhP P S'
S' RhP
P R h
P P S'
S'
R h P
P H
H O CH3
NH Ph H OOC
Rh O
H P P
NH
COO H
Ph CH3
S'
* N
H
C OOH
Ph R h H P O
P
C H H3
Rh H S' O P
P CH3 N
H
Ph HOOC
* =
* * +
N em kedvezm ényezett diasztereom er
(R) M ellékterm ék (S)
Fõterm ék [H2]
[H2]
* +
* +
+ 2 H2 IPA (S')
* +
1.
*
S'
Kedvezm ényezett diasztereom er
*
*
+
+
+
+ +
+
S' 2.
S' S'
1.2.4. ábra: Az enantioszelektivitás eredete Halpern szerint (Halpern, 1982)
Újabb kutatások kimutatták, hogy a Halpern-féle mechanizmus csak a hidrogénezési reakciók egy részére igaz, ma már több eset is ismert, melyben a reakció eltérő mechanizmus alapján játszódik le (Gridnev, 2000).
1.2.3. Ionos folyadékokban végzett enantioszelektív hidrogénezés
Az enantioszelektív hidrogénezés környezetbarátabbá tétele szempontjából is igen fontos lépés az illékony oldószerek (legalább részbeni) helyettesítése más, kevésbé
párolgó vagy veszélyes oldószerekkel. Az enantioszelektív hidrogénezésben az illékony szerves oldószerek kiváltásának egyik irányvonala különböző vízoldható katalizátorok kifejlesztése, melynek köszönhetően vizes oldatban is végre lehet hajtani enantioszelektív hidrogénezést (Amrani, 1989; Ahlquist, in press). A vízoldhatóság szempontjából a legnehezebb kérdés, hogy a nagyméretű foszfin ligandumok is vízoldhatók legyenek, ennek egyik módja, ha a ligandum nagyszámú hidrofil (pl. – SO3H vagy –OH csoportot) tartalmaz. A víz, mint oldószer a lehető
„legkörnyezetbarátabb” és legolcsóbb, azonban a vizes közegű hidrogénezés esetében ma még jelentős hátrány a vízoldható foszfinligandumok magas ára (Zhao, 2002).
Megfelelő alternatívát jelenthet az ionos folyadék közegű katalízis (Baudequin, 2003). A legelterjedtebben alkalmazott Rh-és Ru- bázisú hidrogénező katalizátorok (Rh-DIOP, Rh-DUPHOS, Ru-BINAP…) ionos jellegüknél fogva kiválóan oldódnak az ionos folyadékokban.
Az ionos folyadék közegű katalízisnek egy másik fontos előnye is van. A katalízis során igen fontos követelmény a költséges katalizátor visszanyerése, ez viszont homogén rendszerben csak igen bonyolult módon valósítható meg (pl. nanoszűréssel).
Ionos folyadékkal kétfázisú katalitikus rendszer hozható létre, ami lényegesen egyszerűsíti a katalizátor visszanyerését (1.2.5. ábra).
1.2.5. ábra: Kétfázisú rendszer ionos folyadék felhasználásával (IL = ionos folyadék, KSZ = koszolvens, S = szubsztrátum, T = termék, K = katalizátor, il = koszolvensbe átoldódott ionos folyadék, k = koszolvensbe átoldódott katalizátor, t = ionos folyadékba átoldódott termék, ksz = ionos folyadékba átoldódott koszolvens) (Wolfson, 2005/b)
A kétfázisú rendszer lényege, hogy a rendszerben az ionos folyadék (IL) mellett egy másik (az ionos folyadékkal nem elegyedő) oldószer, koszolvens (KSZ) is jelen van.
Míg az ionos folyadék jó oldószere a szintén ionos jellegű katalizátorkomplexnek (K), addig a koszolvens a szubsztrátumot (S) oldja jól. A reakció indításakor homogenizálni kell a rendszert (keverés, rázatás). A reakció lejátszódása után a kevertetést megszüntetik, ekkor a két fázis magától szétválik. Ekkor a koszolvens az extrakciós oldószer szerepét is betölti, azaz a termék (T) a koszolvens fázisban foglal helyet, ami így dekantálással könnyen kinyerhető. Ezzel szemben a katalizátor az IL fázisban marad, ami a teljes ionos folyadék fázissal együtt újabb reakcióciklusban ismét felhasználhatóvá válik. A reális rendszerekben természetesen az ionos folyadék tartalmaz(hat) valamennyi terméket (t) illetve átoldódott ko-szolvenst (ksz), a koszolvens dekantálásával pedig az ionos folyadék egy része (il), valamint a katalizátor egy része (k) is elveszik („katalizátor átoldódás; catalyst leaching”). Az optimális koszolvens csak nagyon kis mértékben oldja az ionos folyadékot (il), és nagyon jól a terméket (T). Az egyik legáltalánosabban alkalmazott koszolvens az izopropanol.
(Wolfson, 2005/b).
Az ionos folyadék közegben végzett aszimmetrikus hidrogénezés szakterületén eddig megjelent irodalomból a legjelentősebbeket összefoglalóan az 1.2.1. táblázat mutatja be.
A legelső ionos folyadékban végzett aszimmetrikus hidrogénezést 1995-ben közölte Chauvin (Chauvin, 1995). Ennek során α-acetamido-fahéjsavat hidrogéneztek [bmim]SbF6/IPA (3:8) összetételű kétfázisú rendszerben [Rh-(COD)(-)DIOP]PF6 katalizátorral. Az aszimmetrikus hidrogénezés során 64% ee (S)1 enantioszelektivitást tapasztaltak. A kétfázisú rendszer lehetővé tette a termékek és a katalizátor egyszerű és kvantitatív szétválasztását és így a katalizátor (és az ionos folyadék) visszanyerését.
1997-ben Monterio és munkatársai a 2-fenil-akrilsav aszimmetrikus hidrogénezését vizsgálták különböző konfigurációjú Ru-BINAP komplexekkel (Monterio, 1997). A hidrogénezési reakciót 25-100 bar (2,5 × 106 – 107 Pa) hidrogénnyomás mellett, szoba- hőmérsékleten hajtották végre, az S/C arány2 20 és 80 között változott. A kísérleteket tiszta alkoholokban (metanol, IPA) valamint [bmim]BF4/IPA kétfázisú rendszerben is elvégezve azt tapasztalták, hogy a 20 óra reakcióidő alatt a konverzió minden esetben elérte a 99-100%-ot, az enantioszelektivitás azonban az ionos folyadékot is tartalmazó kétfázisú rendszerekben magasabb volt, mint tiszta alkoholokban. Az ionos folyadék fázist –a benne oldott katalizátorral együtt– további 3 cikluson keresztül újra
1 ee = „enantiomeric excess” (enantiomerfelesleg). Részletesen a „Definíciók és rövidítések” c. fejezetben
2 S/C arány = szubsztrátum/katalizátor mólarány