Pannon Egyetem
Vegyészmérnöki Tudományok és Anyagtudományok Doktori Iskola
TEJSAV ENZIMATIKUS ÉSZTEREZÉSE IONOS FOLYADÉKOKBAN ÉS SZUPERKRITIKUS
SZÉN-DIOXIDBAN
DOKTORI (PH.D.) ÉRTEKEZÉS
Készítette:
Németh Gergely
okleveles környezetmérnök
Témavezető:
Dr. Gubicza László Egyetemi tanár
Pannon Egyetem
Biomérnöki, Membrántechnológiai és Energetikai Kutató Intézet
2013.
TEJSAV ENZIMATIKUS ÉSZTEREZÉSE IONOS FOLYADÉKOKBAN ÉS SZUPERKRITIKUS SZÉN- DIOXIDBAN
Értekezés doktori (PhD) fokozat elnyerése érdekében Írta: Németh Gergely, okleveles környezetmérnök
Készült a Pannon Egyetem Vegyészmérnöki Tudományok és Anyagtudományok Doktori Iskolája keretében
Témavezető: Dr. Gubicza László, egyetemi tanár Elfogadásra javaslom (igen / nem)
………
(aláírás)
A jelölt a doktori szigorlaton………. % -ot ért el
Az értekezést bírálóként elfogadásra javaslom:
Bíráló neve: ………. ………. igen /nem
……….
(aláírás)
Bíráló neve: ………. ………. igen /nem
……….
(aláírás)
Bíráló neve: ………. ………. igen /nem
……….
(aláírás)
A jelölt az értekezés nyilvános vitáján………% - ot ért el Veszprém, ……….
a Bíráló Bizottság elnöke
A doktori (PhD) oklevél minősítése…...
………
Az EDT elnöke
TARTALOMJEGYZÉK
KIVONAT ... 5
ABSTRACT ... 6
AUSZUG ... 7
Jelölésjegyzék ... 8
Bevezetés ... 10
1. Irodalmi összefoglaló ... 12
1.1. A tejsav, mint megújuló nyersanyag ... 12
1.2. Tejsav származékai ... 14
1.2.1. Politejsav ... 14
1.2.2. Etil-laktát ... 15
1.3. Enzimatikus reakciók ... 18
1.3.1. Tejsav enzimes észterezéséhez alkalmazott lipázok ... 18
1.3.2. Tejsav enzimes észterezése ... 20
1.3.2. Enantioszelektivitás ... 21
1.3.3. Enantioszelektív reakciók ... 26
1.3.4. Tejsav enantioszelektív reakciói... 29
1.4. Enzimkatalízis nem konvencionális közegekben ... 30
1.4.1. Ionos folyadékok jellemzése ... 30
1.4.2. Enzimek ionos folyadékokban ... 32
1.4.3. Szuperkritikus CO2 ... 35
1.4.4. Szuperkritikus CO2 és ionos folyadék mátrix ... 37
1.4.5. Tejsav lipázos észterezése nem konvencionális közegekben ... 38
1.5. Észterezési reakciót befolyásoló paraméterek ... 39
1.5.1. Sav/alkohol mólarány ... 39
1.5.2. A víz szerepe és eltávolításának lehetőségei ... 40
1.6. Kísérlettervezés ... 42
Célok ... 43
2. Anyagok és módszerek ... 44
2.1. Felhasznált anyagok ... 44
2.2. Alkalmazott készülékek ... 46
2.3. Alkalmazott egyenletek ... 47
2.4. Analízis ... 47
2.4.1. GC analízis ... 47
2.4.2. Víztartalom meghatározás... 48
2.5. Kísérleti módszerek ... 49
2.5.1. Rázóinkubátoros kísérletek ... 49
2.5.2. Vízeltávolítás... 50
2.5.3. Szuperkritikus CO2-dal végzett kísérletek ... 52
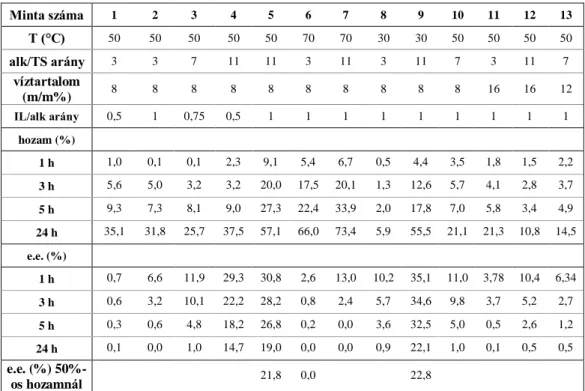
3. Eredmények és értékelés ... 54
3.1. Enzimek aktivitásának mérése ... 54
3.2. Enantioszelektivitás vizsgálata szerves oldószerekben ... 54
3.2.1. n-Hexán ... 54
3.2.2. Etanolfelesleg (oldószermentes) ... 57
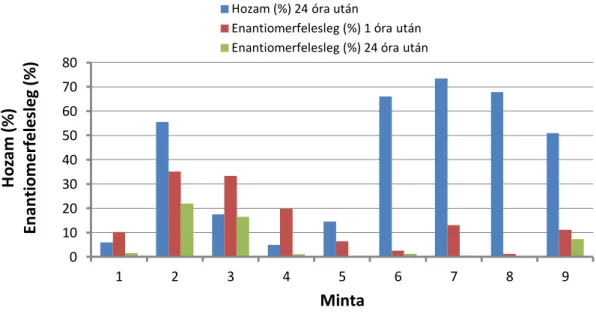
3.3. Ionos folyadékok katalizátor hatásának vizsgálata... 59
3.4. Enantioszelektivitás vizsgálata ionos folyadékokban... 63
3.4.1. Cyphos 103, 105, 109 és 110 ionos folyadékokban végzett kísérletek ... 64
3.4.2. Cyphos 104 ... 65
3.5. Candida antarctica lipáz B és Candida rugosa enzimek tulajdonságainak összehasonlítása
Cyphos 104 ionos folyadékban ... 70
3.5.1. Enantioszelektivitás és hozam vizsgálata CALB enzimmel ... 70
3.5.2. Enantioszelektivitás és hozam vizsgálata Candida rugosa enzimmel ... 72
3.6. Szuperkritikus CO2-ban végzett kísérletek ... 75
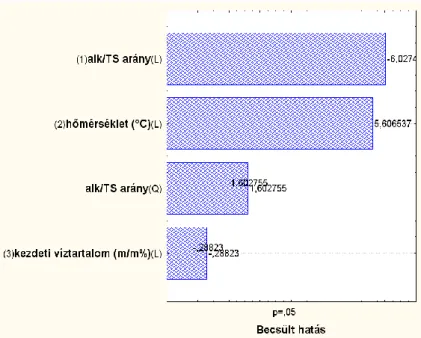
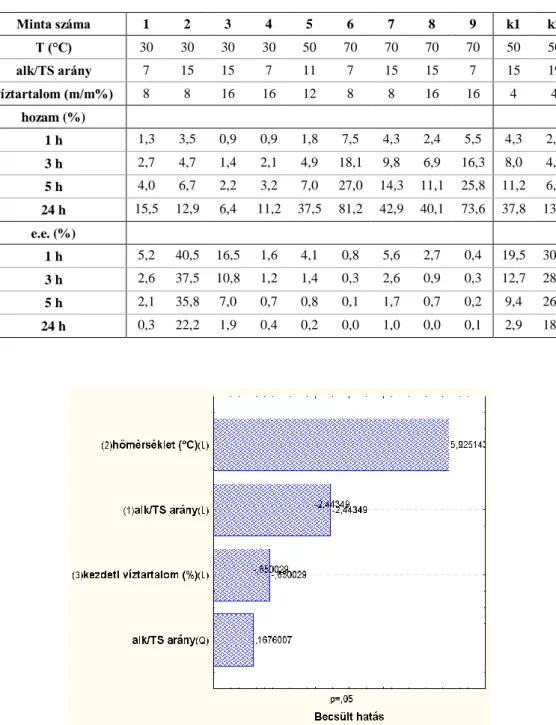
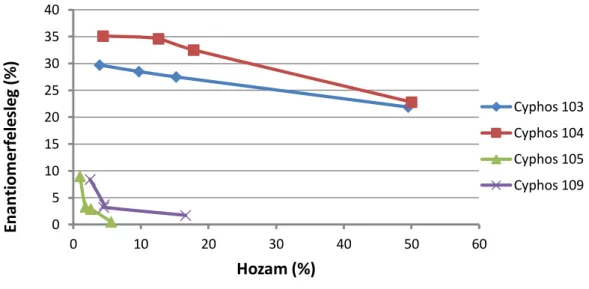
3.7. Cyphos 104-ben mért optimális paraméterek a maximális enantiomerfelesleg és hozam eléréséhez ... 79
3.8. Vízeltávolítás ... 83
3.8.1. Zeolittal történő vízeltávolítás ... 84
3.8.2. Pervaporációval történő vízeltávolítás ... 86
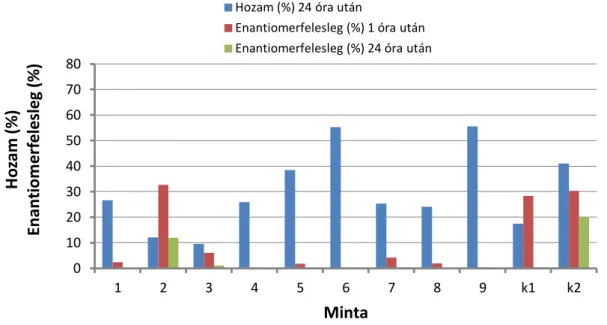
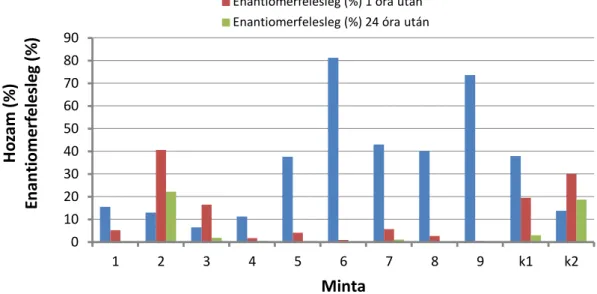
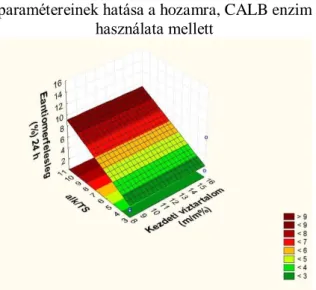
3.9. Kinetikus rezolválás, termék újbóli reakcióba vitele... 88
3.10. Az enzim újrahasználata ... 94
4. Összefoglalás ... 97
Tézispontok ... 101
Theses ... 104
Irodalomjegyzék ... 107
Saját publikációk listája ... 116
Köszönetnyilvánítás ... 118
Függelék: ... 119
KIVONAT
A mérések célja racém tejsavból olyan anyag előállítása, mely megfelelő alapanyagként szolgál biológiailag lebontható műanyag előállításához. A doktori munka során végzett mérések azt kutatták, hogy milyen feltételek mellett észterezhető úgy a (D,L)-tejsav, hogy a képződött termék (etil-(L)-laktát) enantiomerfeleslege a maximális legyen. A vizsgálatok során a szakirodalomban részletezett befolyásoló paraméterek hatásainak optimalizálása történt.
A kezdeti mérések rázatott lombikos kivitelben, konvencionális reakcióközegben történtek, majd különféle foszfónium-típusú ionos folyadékokban. A szerző a kísérleteket megelőzően meghatározta, mely Cyphos-típusú ionos folyadék katalizálja önmagában a legkevésbé a tejsav etanolos észterezését. Az ötféle ionos folyadék további vizsgálatát követően kétféle lipáz enzim (Candida antarctica lipáz B és Candida rugosa) enantioszelektivitásának összehasonlítása is megtörtént. A mérések tervezését és kiértékelését többfaktoros kísérlettervezéssel végezte el. A megfelelő oldószer és biokatalizátor kiválasztása után különböző reakciót befolyásoló tényezők optimális értékének megadására irányultak a mérések. A hőmérséklet, az alk/TS arány, az ionos folyadék/alk arány és a kezdeti víztartalom értékeinek beállításával elérhető volt az eddigiek során mért legnagyobb enantiomerfelesleg érték és észterhozam.
A korábbiakban megszerzett tapasztalatok felhasználásával szuperkritikus CO2-ban és szuperkritikus CO2/ionos folyadék kettős rendszerében történtek kísérletek az e.e. növelése céljából. A kapott eredmények sikeresen összevethetők a korábbi irodalmi adatokkal.
A mérési elegy meghatározó víztartalmának csökkentését zeolittal és pervaporációs technológiával is csökkentette a szerző, annak érdekében, hogy az észterhozam és az enantioszelektivitás további növelésének lehetőségét vizsgálja.
A legalkalmasabb mérési körülményeket felhasználva átfogó kísérletek folytak a képződött termék visszaforgatásával történő e.e. érték növelésére céljából. A munka befejező lépéseként a kiválasztott ionos folyadék kedvező hatásait bizonyította a szerző.
ABSTRACT
The aim of the doctoral work was to produce an initial material for one type of biodegradable plastic. During this work the optimal parameters were investigated for obtaining the highest enantiomeric excess (e.e.) during the esterification of (D,L)-lactic acid with ethanol.
The initial experiments were carried out in shaking incubator to select the suitable solvent for the measurements. The first goal of the author was to find a solvent where the e.e. values and the ester yield are high, furthermore, the solvent has no catalyzing effect on the reaction.
Enantioselectivity of two enzymes (Candida antarctica lipase B and Candida rugosa) were investigated. By the application of the selected ionic liquid solvent and enzyme the temperature, substrate excess, initial water content and solvent amount were optimised.
Also the supercritical CO2 and supercritical CO2/ionic liquid systems were investigated to enhance the ester yield. Partial removal of the water content during the reaction was achieved using zeolite and pervaporation with the aim of increasing the e.e. value and the ester yield.
Using the parameters for the best results the enantiomeric excess was increased by the recycling of the reaction product. At the end of the work the beneficial effects of the ionic liquid in regard to the enzyme were proved.
AUSZUG
Das Ziel der Doktorarbeit war die Herstellung eines geeigneten Ausgangsmateriales für bioabbaubare Kunstoffe. Während der Arbeit wurden die optimalen Parameter für den höchsten Enantiomerenüberschuss (e.e.) bei der Veresterung von (D,L)-Milchsäuere mit Ethanol bestimmt.
Die ersten Versuche wurden in einem Schüttelinkubator durchgeführt, um das geeignete Lösungsmittel für die Messungen auszuwählen. Das erste Ziel des Verfassers war ein Lösungsmittel zu finden, wo die e.e.-Werte und die Esterausbeute hoch sind, wobei das Lösungsmittel keinerlei katalytische Aktivität auf die Reaktion aufzeigt. Die Enantioselektivität der beiden Enzyme (Candida antarctica lipase B und Candida rugosa) war untersucht. Durch Anwendung der ausgewählten ionischen Flüssigkeit und Enzym wurden die optimalen Werte für die Temperatur, Überschuß an Substrat, Ausgangswassergehalt und die Menge des Lösungsmittels bestimmt.
Auch die Systeme überkritisches CO2 und überkritisches CO2/ ionische Flüssigkeit wurden untersucht, um den Umsatz zu erhöhen. Wasserentfernung durch die Reaktion wurde mit Hilfe von Molekularsieben und Pervaporation durchgefürt, um die e.e-Werte bzw. die Esterausbeute zu verbessern. Bei Verwendung der besten Versuchsparameter sind die e.e.- Werte mit dem Recycling des Reaktionsproduktes erhöht. Am Ende der Arbeit konnten die vorteilhafte Eigenschaften der ionischen Flüssigkeiten bewiesen werden.
Jelölésjegyzék
PLA – politejsav (Polylactic acid)
PLLA – poli-(L)-tejsav (Poly-(L)-lactic acid) CALA/CALB – Candida antarctica lipáz A/B LCA – életciklus elemzés (Life Cycle Analysis) IL – ionos folyadék (Ionic Liquid)
scCO2 – szuperkritikus szén-dioxid
GC – gázkromatográf (Gas Cromatograph)
HPLC – folyadékkromatográf (High Performance Liquid Cromatograph) rpm – rázógép fordulatszáma (rotate per minute)
m/m% – tömegszázalék M – moláris koncentráció pKa – savassági állandó Cx – szénlánc hossza
kx – reakciósebességi állandó
e.e. – enantiomerfelesleg* (enantiomeric excess) *(fordítható enantiomertöbbletnek is, ám a szaknyelv az előbbit használja)
ees – szubsztrát enantiomerfeleslege eep – termék enantiomerfeleslege A/B – A/B szubsztrát koncentrációja
A0/B0 – A/B szubsztrát kiindulási koncentrációja P/Q – a reakció A/B szubsztrátjából képződött termék
EA/EB/EP/EQ – az enzimes reakció során az aktuális komponens enzimhez kapcsolódva SS/R – S/R szubsztrát
PS/R – S/R szubsztrátból képződött termék y – hozam
c – konverzió
E – enantiomer arány Kx – egyensúlyi állandó Vx – reakciósebesség
R – egyetemes gázállandó (8,314 J/mol/K) T – hőmérséklet (°C)
H# – standard entalpiaváltozás
S# – standard entrópia változás D25 – optikai forgatóképesség
(D)/(L) / (S)/(R) / (+/-) – balra/jobbra forgató enantiomer
(D,L) / (±) – mindkét enantiomert 50-50%-ban tartalmazó elegy (racém elegy) – szerkezettől függő molekula módosulat
O – orto
R – metilcsoport EtOH – etil-alkohol
BF4 – tetrafluoro-borát (anion) PF6 – hexafluoro-foszfát (anion)
NTf2 – (trifluorometilszulfonil)imid (anion) CF3 – trifluoro-metil (anion)
NO3 – nitrát (anion) SO3 – szulfit (anion)
[EMIM][NTf2] – 1-etil-3-metilimidazólium-bisz(trifluorometilszulfonil)imid [BMIM]BF4 – 1-butil-3-metilimidazólium-tetrafluoro-borát
[BMIM]PF6 – 1-butil-3-metilimidazólium-hexafluoro-foszfát [BMIM]Cl – 1-butil-3-metilimidazólium-klorid
[MEBu3P][NTf2] – 2-metoxietil(tri-n-butil)foszfónium bisz(trifluoro-metánszulfonil)imid
Bevezetés
Az 1800-as évektől fogva egyre növekszik az iparban és a társadalom mindennapjaiban felhasznált vegyszerek mennyisége [Wenda, 2011]. Ebből adódóan a növekvő vegyszerigény szükségessé tette a hatékonyabb előállítási folyamatok kifejlesztését, az utóbbi években viszont főként a már meglévők optimalizálására fókuszálnak, habár ennek ellenpéldája is előfordul. A klasszikus termelési folyamatoknak köszönhetően nagy mennyiségű hulladék keletkezett, ezért az elmúlt két évtizedben láthatóvá vált, hogy a vegyipar jelentős környezeti problémákat okoz, ezért a környezetbarát fejlesztések egyre inkább előtérbe kerülnek [Dunn, 2010]. A hulladékmennyiség növekedése mellett egy másik negatív tény, hogy toxikus reagenseket és veszélyes oldószereket alkalmaznak a szintézisek elvégzéséhez. Az ipar célja egyre inkább a zöldebb vegyipar fejlesztése, melyben a zöld kémia 12 alapelve érvényesül [Anastas, 2002]. A zöld kémia egyik fő szempontja, hogy olyan eljárásokat fejlesszünk, melyekben a reagenseket gazdaságosan és környezetbarát módon használjuk, ezzel elkerülhetjük a nagy mennyiségű hulladék keletkezését.
A folyamatok átalakítása és a hulladékprobléma megoldása érdekében a megújítható/megújuló nyersanyagok felhasználása egyre elterjedtebb. Ilyen széles körben alkalmazott alapanyagok a tejsav és észterei, melyeket az élelmiszeripar konzerválószerként, aromaanyagként, emulgeálószerként alkalmaz, továbbá a gyógyszeripar és kozmetikai ipar is felhasználja, valamint a biológiailag lebomló polimerek előállítása során is alapanyagként szolgál [Bousquet, 1999]. A tejsav mezőgazdasági termékek (főként a kukorica) biofinomítóban történő feldolgozása során kinyerhető vegyület. A tejsav egyik észtere az etil- laktát, mely biológiai úton lebontható „zöld oldószer”, helyettesítheti a halogénezett és a toxikus kőolaj alapú oldószerek egy részét. A vegyiparban kénsavas katalizátorral történő szintézis során állítják elő [Pereira, 2009]. A tejsav egy különleges származéka a poli-tejsav, mely „zöld műanyagnak” is nevezhető, mivel mikroorganizmusok által bontható.
A tejsav észterezési reakciói nagy érdeklődésnek örvendenek a tudományos világban, többek között azért, mivel ez egy hatékony tisztítási módszer, mellyel elválasztható a fermentáció során képződött más szerves savaktól. A fermentált tejsav tisztításához sokrétű tisztítási módszer szükséges, mely elkerülhető enzimes észterezési reakciók lejátszatásával. Ehhez a módszerhez olyan rövid szénláncú alkoholokat alkalmaznak, mint metanol, etanol, izopropanol és butanol [Data, 2006].
Az ipari folyamatok átalakításához biokatalizátorok alkalmazhatók, melyekkel a hagyományosan alkalmazott fém- vagy savkatalizátorok helyettesíthetők. Ezek segítségével az energiaszükséglet is csökken, mivel alacsonyabb hőmérsékleten is végbemegy a reakció.
Esetünkben a lipázok a legalkalmasabb enzimek, melyek a hidrolázok csoportjába tartozó biokatalizátorok. Széles körben alkalmazzák őket a biotechnológiai folyamatokhoz, mint például gyógyszerek, mezőgazdasági vegyszerek előállításához [Jaeger, 1997]. Alkalmazásuk más szempontból is lényeges, mivel rendkívüli tulajdonságaiknak köszönhetően enantio-, regio- és kemoszelektív reakciók kivitelezésében is nagy szerepet játszanak [Jaeger, 2001]. A biotechnológiában való felhasználásukon kívül a mosószergyártásban, olajfinomításban, tejiparban és az orvosdiagnosztikában is elterjedt a használatuk. A fenti eljárások reakcióit képesek olyan nem konvencionális közegekben katalizálni, mint a szuperkritikus fluidumok, ionos folyadékok és különféle szerves oldószerek, de hagyományos vizes oldatokban is felhasználhatók.
Az oldószerek tekintetében is változások figyelhetők meg. Az átalakítások során használt konvencionális oldószerek (hexán, fenol, tetrahidrofurán) olyan gyorsan párolgó vegyületek, melyek a környezetet is szennyezik, és az anyagveszteség is jelentős lehet, ha nem küszöbölik ki ezt a problémát. A kiküszöbölés nemcsak a jól tömített reaktorokra érthető, hanem az oldószerek kiváltására is, melyeket kevésbé illó vagy környezetre ártalmatlan anyagokkal lehet helyettesíteni. A helyettesítő oldószerek követelménye az is, hogy a környezetbe kerülve elkerülhető legyen a káros intermedierek képződése, vagy ne mérgezzék a környezeti egységeket, hanem biológiai úton lebonthatók legyenek.
Doktori témámban vizsgált reakció a kémiai szintézissel előállított racém tejsav etanollal történő enantioszelektív észterezése, melyhez kétféle lipáz enzimet (Candida antarctica lipáz B, Candida rugosa) alkalmaztam különféle oldószerekben és reakciókörülmények között. A felhasznált oldószerek (ionos folyadékok, szuperkritikus CO2) olyan környezetbarát vegyületek, melyeknek az a jellemzőjük, hogy összetételük vagy a reakciókörülmények változtatásával befolyásolhatók az oldószertulajdonságaik. Az említett reakció vizsgálata egy teljesen új terület, melyről még csak minimális irodalmi adat áll rendelkezésre. A kutatások célja az optimális reakciókörülmények meghatározása, melyek mellett a tejsav hozam és a képződött észter enantiomer tisztasága is maximális értéket mutat. A számos reakcióparaméter közül a hőmérséklet, a szubsztrátfelesleg és a kezdeti víztartalom hatásait vizsgáltam különböző nem konvencionális oldószerekben.
1. Irodalmi összefoglaló
1.1. A tejsav, mint megújuló nyersanyag
Az elmúlt években a kőolajon alapuló nyersanyagok népszerűsége némileg csökkent, e helyett megnőtt a biológiailag megújítható anyagok iránti kereslet, így ma már a biobázisú anyagok jelentik a fenntartható gazdaság egyik fő pillérét. A természet évente 170 milliárd tonna biomasszát termel fotoszintézissel, melynek 75%-a a szénhidrátok közé tartozik, ám az emberiség ennek a mennyiségnek csupán a 3-4%-át használja fel. A szénhidrátok bőségesen rendelkezésre álló megújuló nyersanyagok, melyekre fontos nyersanyagként tekintenek a jövő zöld kémiájában. Ebben a jövőben a biofinomítók válhatnak az új bioipar pilléreivé, melyek működése hasonló a kőolaj finomítókéhoz, azzal a különbséggel, hogy biomasszából nyerik a nyersanyagokat, melyeket vegyszerekké, alapanyagokká, üzemanyagokká és energiává alakítanak át [Röper, 2002].
A tejsav (2-hidroxi-propionsav) egy fontos pontja a biológiailag megújítható forrásokon alapuló gazdaságnak. Olyan alfa-hidroxi-sav, mely hidroxil csoportot tartalmaz egy karboxil funkciós csoport szomszédságában. Két optikailag aktív konfigurációban létezik, az (L)- és a (D)-izomerek formájában [Holten, 1971].
A kémiai úton történő előállítás (1. ábra) nagy mennyiségű racém tejsavat termel [Kricheldorf, 1996], melyből az optikailag tiszta (L)-tejsav elválasztása gazdaságilag előnytelen. Következésképpen az (L)-tejsav előállítása nyereségesebb fermentáció útján.
Bakteriális úton előállítható mind az (L)-, mind a (D)-izomer, az utóbbira viszont még nem létezik gazdaságos technológia. A leggyakoribb kereskedelmi tejsav polimer elsősorban (L)- laktidot tartalmaz kis mennyiségű (D)- és mezo-laktid mellett, melynek szerepe a megfelelő rugalmasság és mechanikai szilárdság biztosítása [Corma Canos, 2007]. Ezért szükséges a két izomer külön-külön történő előállítása, hogy a polimerizációt megelőzően megfelelő arányt lehessen beállítani. Németh [Németh, 2011] régóta foglalkozik az (L)-tejsav előállításával, de a (D)-izomer bakteriális szintézisére is indított kutatásokat Lactobacillus coryniformis baktériumtörzs alkalmazásával. Mivel a (D)-tejsav előállítási technológiája még nem kiforrott, ezért a racém tejsav enantioszelektív észterezése során előállított (L)- és (D)-tejsav elegy szintézise egyszerűbbnek tűnik, mint a két izomer külön-külön történő fermentációja.
1. ábra: A tejsav kőölajból illetve megújuló nyersnyagokból történő előállításának lépései [Wee, 2006].
A tejsav legnagyobb mennyisége szénhidrátok fermentációjából származik, mint pl. glükózból (keményítőből), maltózból (specifikus enzimatikus keményítő átalakításból), szacharózból (szirupokból, gyümölcslevekből, melaszból) vagy laktózból (élesztővel) [Benninga, 1990;
Corma Canos, 2007].
A tejsav fermentációs folyamatok osztályozása az alapján történik, hogy milyen baktériumtörzset alkalmaznak. A heterofermentatív módszerben 1 mol hexózból 1,8 molnál kisebb mennyiségű tejsav képződik, ezen felül jelentős mennyiségű metabolit, mint pl.
ecetsav, etanol, glicerin, mannitol és szén-dioxid is keletkezik. A homofermentatív módszerben átlagosan 1,8 mol tejsav képződik 1 mol hexózból, és kis mennyiségű más metabolit termelődik. Mivel a második előállítási forma kevesebb mellékterméket és nagyobb tejsav hozamot eredményez, főként ezt használják az iparban [Kharas, 1994]. A fermentációs műveletekhez nagyrészt Lactobacilli nemzetséget alkalmaznak, mely nagy tejsav hozamot eredményez. Ha a tejsavat gyógyszerészetben vagy élelmiszeriparban használják fel, akkor desztilláció útján megtisztítandó.
Előállításához alternatív nyersanyagokat is alkalmaznak. Az elmúlt években fűből is fermentáltak tejsavat [Thang, 2005], pl. Brandenburgban fűlével kevert hidrolizált gabonákból [Venus, 2007] vagy 2008-ban Utzenaichban fűsiló préslevéből tejsavat és aminosavakat választottak el [Mandl, 2010]. Jelenleg a kereskedelmi forgalomban lévő tejsavat glükóz fermentációjával állítják elő. A legfontosabb lépések egyike a termelésben a fermentlétől való elválasztás. A szeparációs és tisztítási lépések képviselik a teljes előállítási költség körülbelül 50%-át. A membrános szeparációban történt fejlesztések − különösen a
mikro- és ultraszűrésben valamint az elektrodialízisben − olyan eljárásokat hoztak létre, melyek csökkenthetik a tejsav előállítás költségeit [Wasewar, 2004]. Az éves termelés 350 ezer tonna körül mozog, és előreláthatóan évente 12-15% növekedéssel számolhatunk világszerte.
A tejsav két funkciós csoportjának (hidroxil és karboxil csoport) köszönhetően intermolekuláris észterezés következik be 20 m/m%-osnál töményebb oldatában, mikoris lineáris dimerré és oligomer savakká alakul [Vu, 2005]. Egy 88%-os tejsav oldat 43,5 mol%
monomert, 9,2 mol% dimert, 1,8 mol% trimert és kb. 45 mol% vizet tartalmaz. A 20 m/m%- os vizes tejsav oldat csak monomerből és vízből áll, melyben az oldat monomer aránya 5,6 mol% [Asthana, 2006]. A savkoncentrációval együtt növekszik az önésztereződésre való hajlam is. Ez teszi bonyolulttá a reaktánsként való felhasználását pl. az etil-laktát szintézise során, mivel ha nagy a tejsav koncentráció, akkor az oligomerek aránya is magas lesz, melyek észterekké alakulnak, és szimultán hidrolizálódnak, átésztereződnek, ezzel egy olyan elegyet képezve, ami tartalmaz savat és észtert is monomer és oligomer formában is.
1.2. Tejsav származékai
Számos olyan terméket származtatnak tejsavból, melyek vagy új vegyipari termékek vagy már létező vegyületek, és hagyományosan kőolajból állítják elő. Ezek közül talán a legérdekesebbek az akrilsav és a politejsav. Az előbbit polimer termékek nyersanyagaként használják felület bevonásnál, textíliáknál, ragasztóknál, papírkezelésnél, mosószereknél, szuperabszorbens anyagoknál; az utóbbit csomagolásnál, mezőgazdasági termékeknél, és széles körben gyógyításban, gyógyszerészetben és sebészetben [Xu, 2006; Fan, 2009]. Egy másik tejsavból előállítható vegyület a propilén-glikol, melyet pillanatnyilag nagyjából olyan áron állítanak elő tejsavból, mint kőolajból, de a nyersolaj árának emelkedésével és a tejsav előállítás továbbfejlesztésével gazdaságosabb lesz a biomassza alapú előállítása [Haveren, 2008].
1.2.1. Politejsav
A polilaktid (PLA) egy olyan polimer, mely tejsavból állítható elő. A PLA előállítása számos előnnyel jár: megújuló mezőgazdasági forrásból nyerhető, emiatt szén-dioxidot fogyaszt, energiatakarékos, újra felhasználható és komposztálható, a fizikai és mechanikai tulajdonságai pedig befolyásolhatók a polimer szerkezetével [Hiljanen-Vainio, 1996].
Széles körben tanulmányozzák az orvosi alkalmazhatóságát, mivel az emberi testben felszívódik, így varratok alapanyagaként használható [Tsuji, 2001]. Számításokkal is
igazolták, hogy a PLA csomagolóanyagként való felhasználása − műanyagpohár, fedőfólia, zöldségtároló [Hiljanen-Vainio, 1996] − gazdaságosan megvalósítható [Bogaert, 2000].
Általánosságban három módszer létezik nagy molekulatömegű (100000 Dalton) PLA előállítására: a direkt kondenzációs polimerizáció, az azeotróp dehidratációs kondenzáció és a laktid formáción át történő polimerizáció. A laktid formáción át történő polimerizációt a Cargill Inc. szabadalmaztatta 1992-ben [Drumright, 2000], és mindent összevetve ez a jelenlegi legjobb módszer PLA előállításra. A direkt kondenzációs polimerizáció a legkevésbé költséges módszer, annak ellenére, hogy nehéz kinyerni az oldószermentes, nagy molekulatömegű PLA-t. Itt a láncpárosító szerek és segédanyagok használata növeli a költségeket és a módszer bonyolultságát [Hyon, 1997].
1.2.2. Etil-laktát
Az etil-laktát egy egybázisú észter, mely ismert tejsav-etilészter néven is (IUPAC: etil-2- hidroxipropanoát), molekulaképlete C5H10O3. Színtelen vagy halványsárga folyadék, mely a természetben kis mennyiségben is megtalálható olyan élelmiszerekben, mint a bor, csirke és számos gyümölcs. Felhasználható mint parfüm alkotóanyag, aromaanyag, gyógyszerészeti segédanyag, lágyítószer és környezetbarát oldószer, melynek hatékonysága hasonló a kőolaj- alapú oldószerekéhez [Weissermel, 1997]. A világon évente mintegy 15000 tonna oldószert állítanak elő, melyben az etil-laktát jelentős részt képvisel. Olyan vegyipari árucikknek tekintendő, mely egyre több figyelmet kapott az elmúlt években amiatt, hogy a tejsav és az etanol észterezési reakciója során állítják elő, ahol mindkét kiindulási reakciópartner biomasszából fermentálható, megújuló nyersanyag. Az etil-laktát előfordul levo (L) és dextro (D) formában, de a vegyiparban racém formában állítják elő egy reverzibilis folyamat során.
Etil-laktát képzése, majd hidrolízise az egyik módszer a tiszta tejsav fermentléből történő kinyerésére [Barve, 2009; Inaba, 2009].
Weis és Visco [Weis, 2010] számítógépes molekulatervező programmal elemezték az etil- laktátot, és megállapították, hogy a vegyület és annak előállítási folyamata esetén legalább 8 érvényesül a zöld kémia alapelvei közül:
1. Az etil-laktát előállítható megújuló nyersanyagokból, mely sokkal környezetbarátabb alternatíva, mint a petrolkémiai oldószerek alkalmazása (7. alapelv)
2. 100%-ban biodegradábilis, könnyű újra felhasználni, nem korrozív, nem karcinogén és nem ózonfogyasztó [Clark, 2006]. Az amerikai élelmiszer és gyógyszer igazgatóság jóváhagyta az élelmiszeripari felhasználását (3., 4., és 10. alapelv).
3. Etil-laktát előállítható heterogén katalízissel a reaktánsok feleslegének használata nélkül.
Az ásványi sav katalizátorok helyettesítésével kiküszöbölhetjük a korrozív vegyületek használatát, és ezzel együtt elkerülhető azok semlegesítése is (1. és 9. alapelv).
4. Előállítható hibrid technológiákkal is, ahol a termék képzése és szeparációja egy egységben játszódik le, ezzel kiküszöbölve az oldószert, mely csökkenti a költségeket (kevesebb szeparációs egység szükséges), és így kevesebb energiát is igényel (5. és 6. alapelv).
Az etil-laktát alkalmazási területei
A legnépszerűbb zöld oldószerek a víz (vizes kétfázisú), a szuperkritikus CO2 (scCO2) és az ionos folyadékok [Sheldon, 2005]. A növekvő érdeklődés ellenére kis figyelmet tulajdonítanak a bio-bázisú oldószereknek, mint a tejsavnak [Yang, 2012] és a laktát- észtereknek [Aparicio, 2008], melyek közül legfontosabb az etil-laktát. Főként a bevonat iparban népszerű a nagy oldóképességének, magas forráspontjának, alacsony gőznyomásának és kis felületi feszültségének köszönhetően. Jól alkalmazható fa, polisztirén és fémek bevonásához, és nagyon hatásos festékek lehántásához vagy graffiti eltávolításához [Nikles, 2001], fémek felületének tisztításához, mivel hatékonyan távolítja el a zsírokat, olajokat, ragasztókat, továbbá képes eltávolítani a talajban lévő rézszennyezést [Pereira, 2011]. Olyan oldószereket is helyettesíthetünk vele, mint az n-metil-pirrolidin, a toluol, az aceton és a xilol, ezzel biztonságosabb munkakörnyezetet teremtve [Reisch, 2008].
Az oldószerek jelentős hányadát a gyógyászati szerek előállítási folyamataihoz használják, mivel e termékek közel 80%-ához szükséges oldószer felhasználása [Jiménez-González, 2004]. A fő szempont, hogy a szintetikus folyamatokat áttervezzék, azzal a céllal, hogy csökkentsék a felhasznált oldószerek mennyiségét, és helyüket nemtoxikus, veszélytelen anyagokkal váltsák fel, melyeket könnyű visszaforgatni és újra felhasználni. Ebből a szempontból az etil-laktát a gyógyszeriparban is használható oldószerként/diszpergálószerként különféle biológiailag aktív szerekhez, anélkül, hogy a hatóanyag gyógyászati aktivitását befolyásolná [Pereira, 2011]. Használták már többek között aril-aldiminek [Bennett, 2009], szinparvolid B [Pereira, 2011] és vatiriol [Srinivas, 2010] zöld szintézisénél is.
Az etil-laktát szintézise
Az aromaésztereket karbonsavak és alkoholok reakciójával állítják elő. A reakció során képződött két termék az észter és a víz. Az észterek enzimatikus szintézisénél általánosságban négy fő paramétert kell szem előtt tartani: a megfelelő enzim használatát, a legmegfelelőbb
oldószer kiválasztását, a szubsztrátinhibíció elkerülését és a termékinhibíció kiküszöbölését.
[Gubicza, 2000].
A laktátok előállításához általában homogén katalizátorokat használnak (foszforsav, kénsav és a vízmentes sósav). A heterogén katalizátorok (zeolit, ioncserélő gyanta) egyértelmű előnye, hogy azokat könnyebb elkülöníteni a reakcióelegytől, hosszú az élettartamuk, nagyobb terméktisztaság érhető el (a mellékreakciók elkerülhetők vagy kevésbé szignifikánssá tehetőek), és elkerülhető a korrozív környezet [Pereira, 2008].
Az etil-laktát hagyományos előállítási módja a tejsav etanollal történő észterezése, melyhez savkatalizátort használnak. Az etil-laktát szintézisével foglalkozó kinetikai tanulmányok közül néhányan 20 m/m%-os tejsav oldatot használtak azért, hogy elkerüljék az oligomerek képződését, de nagyobb koncentrációjú tejsav esetében is általában elhanyagolható az oligomerek jelenléte [Asthana, 2006].
Az észterezések autokatalitikus reakciók, mivel a parciálisan disszociált karbonsavból felszabadult hidrogén-kation szolgál katalizátorként a reakciónál. Ennek ellenére egy megfelelő katalizátor használata kézenfekvőbb a reakciósebesség növeléséhez, mert az autokatalizált reakció kinetikája rendkívül lassú, a sebessége a karboxil csoport autoprotolízisétől függ. Például a tejsav savassági állandója 25 °C-on pKa=3,86, ezért egy 85%-os (kb 10,8 M) vizes tejsav oldat pH-ja 1,4.
Ipari etil-laktát előállítási módszerek
Számos szabadalmaztatott etil-laktát előállítási technológia létezik, de a legtöbb közülük a tejsav etanollal történő egyensúlyi észterezése, melyet követően a terméket desztillációval eltávolítják a reakcióelegytől. Ahhoz, hogy túllépjék az egyensúlyi pontot, etanolfelesleget alkalmaznak erős savkatalizátor mellett, mely leggyakrabban foszforsav [Pereira, 2011].
Egy francia vegyipari cég, az Arkema fejlesztett ki két szabadalmaztatott eljárást az etil-laktát folyamatos észterezéssel történő előállítására, ahol a tejsav és etanol közötti reakció katalizátoraként kénsavat használt. Az első lényege, hogy a tejsav részleges átalakulási fokánál a reakcióközegből egy etil-laktátot, etanolt, vizet és különféle nagy móltömegű terméket tartalmazó elegyet extrahálnak, majd az elegyet betáplálják egy csökkentett nyomású desztilláló egységbe, melynek a fejterméke egy etil-laktát, etanol és víz elegy, melyet desztillációval történő frakcionálásnak vetnek alá. A másik eljárás során a reakcióelegyből egy közel azeotróp víz-etanol gázelegyet extrahálnak ki, majd ezt molekulaszűrőn víztelenítik, így két áram jön létre: egy gázfázisú etanol áram, melyet a reakcióelegybe recirkuláltatnak, és egy víz-etanol elegy áram, ami egy desztilláló oszlopra kerül. Az első
eljárásnál 95%-osnál nagyobb terméktisztaságot értek el 2,5-szörös moláris etanolfelesleggel 80 °C-on, ahol a szeparátort 85 °C-on és 50 mbar-on üzemeltették (a frakcionáló fej- és fenékhőmérséklete 77,2 °C illetve 155 °C), mialatt a második eljárással 97%-nál nagyobb tisztaságot valósítottak meg [Pereira, 2011].
A hatásfok javítása érdekében alkalmazhatnak multifunkcionális reaktorokat, melyekben a reakció és a szeparáció egy egységben megy végbe, ahonnan az egyik terméket folyamatosan el lehet távolítani. A limitáló termék (víz) eltávolításával növelhető a hozam és a terméktisztaság. Szeparációhoz membrán reaktort, reaktív desztillációt és kromatográfiás reaktorokat is tanulmányoztak.
1.3. Enzimatikus reakciók
1.3.1. Tejsav enzimes észterezéséhez alkalmazott lipázok
Az enzimkatalitikus eljárások alkalmazása nemcsak a hulladékproblémára ad megoldást, hanem energiatakarékos, és kevesebb nyersanyagot is igényel, ezáltal környezetbarát megoldásnak számít [Dunn, 2010]. A biokatalizátorok használata az ősi időkre nyúlik vissza, de tudatosan csak a 20. század elejétől használták őket, az 1930-as évektől pedig már az ipari termelésben is szerepet kaptak [Liese, 2006]. Az enzim felhasználáson alapuló biotechnológiai alkalmazások száma egyre növekszik, az alkalmazás pedig a speciális vegyületek szintézisétől egészen a tömegtermelési méretekig kiterjed [Straathof, 2002;
Schmid, 2001].
Az ipari méretű biotechnológiai megvalósítások fő hajtóereje a főként gyógyszerészeti ágazatokban szükséges enantioszelektivitás és funkcionalitás, valamint a technológiai fejlődés és a fenntarthatóság igénye [Meyer, 2009]. Néhány szempont, hogy miért is előnyös a biotechnológia a kémia fenntarthatóságára nézve, és a biokatalizátorok miért nevezhetők zöld technológiai alkalmazásnak [Buchholz, 2005; Rozzell, 1999; Ghisalba, 2010; Wohlgemuth, 2010 a; Wohlgemuth, 2010 a]:
Az enzimek nemtoxikus katalizátorként működnek.
Nagy szelektivitásúak és nagytisztaságú terméket produkálnak.
Alkalmazásukkal csökken a hulladék mennyisége.
Mérsékelt működési körülmények mellett (hőmérséklet, nyomás, pH) csökken az energiafelhasználás.
A biotranszformációk során főként vizes közeget alkalmaznak, mely nem minősül toxikusnak.
A biokatalízis alkalmazása csökkenti az előállítás idejét a nemkatalitikus reakcióhoz képest.
Elkerülhető a nehézfémek és a szerves oldószerek használata.
Természetes katalizátorok lévén úgy tekinthetők, mint megújuló forrásból előállított anyagok.
A tejsav észterezéshez használt biokatalizátorok a lipázok. A lipázok közös jellemzője, hogy aktív helyük három aminosavból épül fel: szerinből, aszparaginsavból vagy glutaminsavból és hisztidinből, melyeket katalitikus triádnak is neveznek [Ghanem, 2007].
A lipázok mindenütt jelen lévő enzimek, melyek a szerin hidrolázok családjába tartoznak.
Megtalálhatók állatokban, növényekben, gombákban és baktériumokban [Beisson, 2000]. Az enzimeket általában arról a reakciótípusról nevezik el, amelyet katalizálnak, ezért a lipázokat hivatalosan karboxilészterázoknak nevezik, melyek hosszú szénláncú acil-glicerinek reakcióit katalizálják, más szavakkal: zsírhasító, erjesztő anyagok. Ezek alapján nevezik őket triglicerid hidrolázoknak is [Ghanem, 2007].
Mivel a szerin hidrolázok csoportjába tartoznak, és nincs szükségük kofaktorokra, használhatók szabad vagy immobilizált állapotban is. A lipid-víz határfelületen fejtik ki hatásukat, ezért nem vízoldható szubsztrátok katalízisét is elvégzik. A többi hidrolitikus enzimtől az a tulajdonságuk különbözteti meg őket, hogy hidrofób közegben is aktívak. A szerves szintézisekben mérsékelt körülmények között alkalmazhatók (szobahőmérsékleten, semleges körüli pH-n) [Schoffers, 1996]. Az említett hasznos tulajdonságaik mellett a lipázok a többi enzimhez hasonlóan környezetbarátnak minősülnek és biológiai úton lebonthatók [Ghanem, 2007].
A Candida antarctica lipáz B (CALB) a leggyakrabban használt enzim a lipázok közül. A Candida antarctica gombából két fajta lipáz nyerhető ki: a CALA és a CALB, melyek eltérő tulajdonságokkal rendelkeznek [Kirk, 2002]. A CALB-ra jellemző reakciók az észterek, tioészterek, fehérjék, epoxidok, alkil-halogenidek hidrolízise és a hidroxil-nitrilek szénkötéseinek hasítása [Ollis, 1992]. Aktív centrumában katalitikus triádként Ser105- His224-Asp187 található, ahol egy sztereospecifikus zseb is helyet kap, mely a nagy enantioszelektivitásért felelős. Mivel a másodrendű alkoholok ezt a zsebet csak bizonyos konformációval tudják megközelíteni, a reakciók során főként (R)-izomer képződik [Magnusson, 2005].
A Candida rugosa enzimet, melyet az azonos nevű élesztőgomba termel, az 1960-as években izolálták talajból. Eme enzimnek a természetben katalizált reakciói a nagy szénatom számú
zsírsavak glicerinnel képzett észtereinek reverzibilis lebontása. Az aktív centrumban Ser209- His449-Glu341 található. Az aktív centrum mellett fontos egység az oxoanion gödör, mely aminosavainak NH-csoportjai stabilizálják az acil-donor szubsztrátmolekula karboxilcsoportjának oxoanionját azáltal, hogy H-híd kötést alakítanak ki vele [Gubicza, 2008 b].
1.3.2. Tejsav enzimes észterezése
Tejsav lipázos észterezését Rhizomucor miehei (Lipozyme IM20) lipázzal és sertés hasnyálmirigyből kinyert lipáz enzimmel Kiran és Divakar [Kiran, 2001] végezték el. A reakciók rázatott lombikos kivitelben és laborméretben is megtörténtek. Az optimális reakciókörülmények megismeréséhez olyan paramétereket vizsgáltak, mint az oldószer, a hőmérséklet, a szubsztrát és az enzim koncentráció, a puffer mennyiségének hatása, a víz mennyisége. A rázatott lombikos kísérletek során az etil-metil-keton bizonyult a leghatásosabb oldószernek, a laborméretű reakciókban pedig a kloroform. Palmitinsavval és sztearinsavval részletes kísérletek történtek, ahol a rázatott lombikos kísérletek 37,5% és 40%-os hozamot mutattak Lypozyme IM20 enzim mellett, mialatt a laborméretű kísérletek során 85,1% illetve 99%-os hozam mutatkozott. A C2-től C18-ig felhasznált savak közül csak a laurinsavas, a palmitinsavas és a sztearinsavas kísérletek mutattak 50% feletti hozamot.
Torres és Otero [Torres, 2001] 4 féle lipáz enzimmel (CALB, Lypozyme, Candida rugosa, Pseudomonas sp.) és különböző zsírsavakkal vizsgálták a tejsav észterezésének körülményeit.
Kísérleteik alapján megállapították, hogy CALB enzimmel érhető el a legnagyobb hozam, ezért ezzel végezték a további reakciókat. Vizsgálták, hogy n-hexán, aceton, dioxán, acetonitril és oldószermentes közegben milyen észterhozam érhető el. Számításaik szerint a felhasznált tejsav monomer tartalma 68% volt. (Az észterhozamot a bemért tejsav elegyből számolták, nem a monomer mennyiségéből.) Megállapították, hogy kaprilsavval történő észterezés esetén n-hexán közegében mutatkozott a legnagyobb hozam, mely 4 nap alatt 30%- os volt. A továbbiakban vizsgálták a tejsav : zsírsav arányának hatását 60 °C-os reakcióhőmérsékleten. A tejsav mennyiségét konstans értéken tartották (35 mg/0,38 mmol), míg a kaprilsav mennyiségét 10-szeres feleslegig növelték. Kimutatták, hogy a hozam a zsírsav mennyiségének emelésével 55%-ra növekedett, de a savmennyiség 10-szeres érték feletti növelése nem eredményezett további hozamnövekedést. Kaprilsav, laurinsav és palmitinsav összehasonlításakor megállapították, hogy a reakciók hozama közel azonos volt.
Hasegawa és társai [Hasegawa, 2008] Novozym 435 mellett vizsgálták az etanollal történő tejsav észterezést. A reakcióelegyek meghatározott mennyiségű tejsavat, etanolt (1 : 1 illetve
1 : 2 arányban) és szerves oldószereket tartalmaztak 1 ml teljes elegytérfogatban. Az enzimet 1 mg/ml koncentrációban adták a reakcióelegyhez, melyet 30 °C-on, 24 óráig reagáltattak rázógépen 100 rpm intenzitáson. A reakciót n-hexánban, oldószermentes közegben, éterekben és ketonokban vizsgálták. Az oldószermentes vizsgálatoknál további hozzáadott etanollal pótolták a szerves oldószert. n-Hexán esetében a rendszer kétfázisú volt, melyben nagyon alacsony hozamot figyeltek meg. A tejsav mennyiségének növekedésével még inkább csökkent az észterhozam, valószínűleg a megnövekedett sav-inhibíciónak köszönhetően, mely az elegy poláris fázisában erősebben hatott. Oldószermentes közegben az elegy egyfázisú volt, és nagyobb hozamot mutatott, mint n-hexánban, de az észterhozam 1 mol/dm3-es tejsav koncentrációnál elkezdett csökkenni, mely ugyancsak a sav inhibíciójának tudható be. Az etanol mennyiségének növelése hozamnövekedést eredményezett, mivel reakciópartner lévén megváltoztatta a reakció egyensúlyát. Éterekben és ketonokban is sikerrel hajtották végre az észterezést, és azt figyelték meg, hogy az enzim 2 mol/dm3-es tejsav koncentrációnál, és valamelyest felette, mutatja a maximális észterhozamot. A di-izopropil-éter és a di-n-propil- keton esetében ekvimoláris tejsav-etanol aránynál mutatkoztak a legjobb hozamok.
1.3.2. Enantioszelektivitás
A kinetikai rezolválás a IUPAC megfogalmazása szerint a következő: Ha egy reakció sebessége az egyik enantiomer esetében lényegesen eltérő a másik enantiomerétől, akkor az egyik sztereoizomer túlsúlyát kapjuk. A rezolválás az enantiomerek szétválasztását jelenti. A kinetikai rezolválás lehet részleges vagy teljes, mely a racém elegyben lévő enantiomerek egyenlőtlen reakciósebességéből adódóan valósítható meg. A két enantiomer eltérő reakciósebessége egy királis reakciópartnernek köszönhető, pl. katalizátor, oldószer, stb.
[Moss, 1996]. A kinetikai rezolválás legegyszerűbb esetében a szubsztrát enantiomerek egy királis reagenssel vagy katalizátorral lépnek reakcióba, mely során két diasztereomer átalakulás játszódik le. Ezen versengő átalakulási állapotok szabadentalpiája befolyásolja a lassan és gyorsan reagáló komponens sebességi állandóját, ahol a kgyors/klassú határozza meg a termékek arányát.
A lipázokkal történő kinetikai rezolválást Dalkin [Dalkin, 1903] vizsgálta elsőként. Ő sertésmájból kivont lipázzal végezte a racém etil-mandalát hidrolízisét. Eredményei megmutatták, hogy az enzimek nem tökéletesen enantioszelektívek, ezért számításba kell venni a relatív reakciókészséget és a konverzió mértékét is.
A racém elegyekből enantiomer tiszta termék előállításához a hagyományos módszer a kinetikai rezolválás, ám ennek van egy lényeges korlátja. Még ideális esetben is meg kell
állítani a reakciót 50%-os konverziónál, mikor az összes reaktív enantiomer termékké alakult, vagyis mikor az enantiomer tiszta termék konverziója megtörtént. Sok esetben a konverzió még nem éri el az 50%-ot, de a reakciót mégis le kell állítani kisebb konverziónál, vagy amikor a két enantiomer reakciósebességének különbsége már nem elég nagy ahhoz, hogy megfelelő enantioszelektivitást biztosítson. Ezen felül az el nem reagált komponensek közül történő termékelválasztás is további problémákat vet fel. Az el nem reagált összetevők problémájára több megoldás is létezik: pl. prokirális szubsztrátok vagy mezo vegyületek használatával [Schoffers, 1996], a nemkívánt enantiomer sztereokémiájának megfordításával (sztereoinverzió) [Stecher, 1997], a visszamaradt szubsztrát racemizáció utáni visszaforgatásával vagy dinamikus kinetikai rezolválással. A legutóbbi eljárásban a nemkívánt enantiomereket in situ racemizálják, és folyamatosan termékké alakítják [Dijksman, 2002].
A kinetikai rezolválás és a dinamikus kinetikai rezolválás (2. ábra) esetében egyaránt a gyorsabban reagáló (R)-szubsztrát (R)-termékké alakul. Az egyetlen különbség a két eljárás között az, hogy hagyományos esetben a lassan reagáló (S)-szubsztrát visszamarad el nem reagált komponensként, míg dinamikus rezolválás esetében az (S)-szubsztrát folyamatosan racemizálódik, így az (R)- és (S)-szubsztrát ismét egyensúlyba kerül. Ez teszi lehetővé, hogy a minden kiindulási anyag (R)-termékké alakuljon [Dijksman, 2002].
2. ábra: A kinetikai és dinamikus kinetikai rezolválás folyamata [Dijksman, 2002].
Kazlauskas és társai [Kazlauskas, 1991] elmélete szerint minden lipáznak ugyanolyan affinitása van bizonyos szubsztrátokhoz, de más enantioszelektivitással. Ennek magyarázatára dolgozott ki egy modellt, melyben kifejti, hogy minden lipáz két különböző méretű „zsebbel” rendelkezik, egy nagy és egy kisméretűvel. A szubsztrátokra kifejtett enantioszelektivitás az alkoholok kisebb és nagyobb szubsztituenséből származik. A gyorsan reagáló enantiomer a 3. ábra bal oldalán mutatott aktív helyhez kapcsolódik. Ha a másik
enantiomer lép reakcióba a lipázzal, akkor arra van kényszerítve, hogy a nagyobb szubsztituenst illessze a kisebbik zsebbe (3. ábra jobb oldal). Ez alapján a szubsztituens és a zseb közötti sztérikus taszítás megrepeszti a katalitikus triádot, mellyel magyarázható az alacsonyabb reakciósebesség. A reakció irányától függetlenül, vagyis észterezés és hidrolízis esetén is az (R)-enantiomer reagál gyorsabban.
3. ábra: A gyorsan (bal) és lassan reagáló (jobb) enantiomerek kapcsolódása az enzim „zsebeihez”
[Kazlauskas, 1991].
Chen és munkatársai alkottak modellt és írták le kvantitatív módszerekkel az irreverzibilis [Chen, 1982] és reverzibilis [Chen, 1987] enantioszelektív reakciókat. Összekapcsolták a reakciók három kulcsparaméterét: a racém szubsztrát konverziójának mértékét (c); az optikai tisztaságot; melyet enantiomerfeleslegben fejezünk ki (ee) a termékre vagy a fennmaradó szubsztrátra nézve; és az enantiomer arányt (E).
Egy irreverzibilis reakció esetén A és B a gyorsan és a lassan reagáló enantiomerek, melyek az enzimnek ugyanazon helyéhez kapcsolódnak. Egy egyszerű háromlépéses kinetikus mechanizmushoz felírtak egy egyenletet, ahol a reakció irreverzibilis és nincs termékinhibíció:
(1)
(2)
(3) (4)
Q P
Q P P
ee( ) (5)
0 0
1 A B
B c A
ahol
kx: reakciósebességi állandó c: a konverzió mértéke
ee(P): a termék enantiomerfeleslege Va/Vb: reakciósebesség A/B enantiomerre Ka/Kb: A/B enantiomer egyensúlyi állandója A/B: A/B enantiomer koncentrációja
A0/B0: A/B enantiomer kezdeti koncentrációja P/Q: P/Q termék koncentrációja
Reverzibilis rendszereknél az enzimes rezolválás kinetikájában a következő figyelhető meg: a reakció kezdeti szakaszában az enzim kedvezően támadja a gyorsan reagáló (A) enantiomert és termékké (P) alakítja. A nagy enantiospecifikusság a két versengő reakció nagy nettó sebességkülönbségéből adódik. Ahogy a gyorsan reagáló komponens megközelíti az egyensúlyi állapotot, a nettó sebesség fokozatosan csökken, mialatt a lassan reagáló (B) enantiomer átalakulása is elkezdődik. Mikor a gyorsan reagáló komponens egyensúlya beáll (sebesség=0), a visszamaradt szubsztrát (eeS) és a képződött termék (eeP) optikai tisztasága elkezd esni a lassan reagáló komponens koncentrációjának növekedésének köszönhetően. A megfigyeléseket a következő egyenletekkel írták le:
(6)
(7) (8) (9)
Enantiomerek enzimes kinetikai rezolválása során, ha a két versengő reakció irreverzibilis, akkor a szubsztrát és termék optikai tisztasága a konverzió mértékétől (c) és az enantiomer aránytól (E) függ. Azonban reverzibilis biokatalitikus rendszereknél az eeS és eeP (a c-n és E- n kívül) a K egyensúlyi állandótól is függ. Végső soron a visszamaradó szubsztrát nagy optikai tisztasága (eeS>=0,98) nem valósítható meg 50%-on túlmenő konverzióval. A 4. ábrán látható grafikus ábrázolások lehetővé teszik E és K érték meghatározása után, hogy precízen megbecsüljük, mikor állítsuk meg a kinetikus rezolválást ahhoz, hogy maximáljuk a kémiai és
Q B P K A
optikai hozamot. A rezolválás befejezésének optimális időpontját akkor érjük el, ha a gyorsan reagáló enantiomer eléri az egyensúlyt. Kézenfekvő, hogy magas enantiospecifikus észterezés végrehajtásához elengedhetetlen, hogy a víztartalmat a szerves közegben minimális értéken tartsuk, hogy elkerüljük a reverz hidrolitikus folyamatot [Chen, 1987].
A kinetikus rezolválás során keletkezett termékek (P>Q) hidrolizálhatók, mellyel visszanyerjük a kiindulási A és B komponenst. A kinyert frakció optikai tisztasága további reakcióban növelhető az első reakcióban használt reakciókörülmények mellett. A visszaforgatásos kísérletekben az ee0 (a kiindulási komponensekre vonatkoztatott enantiomerfelesleg) értéke nagyobb 0-nál.
4. ábra: Enantiomerfelesleg a konverzió függévényében különböző E és K értékeknél (E: 1 (1000, 2 (100), 3 (10), K: a (0), b (0,1), c (0,5), d (1), e (5)) [Chen, 1987].
Az enantioszelektivitás mérésére különböző módszereket használnak. A leggyakoribb technika egy racém szubsztrát elegy reakciójának vizsgálata, ahol a reakció hozamát és a szubsztrát vagy termék enantiomerfeleslegét mérik meghatározott reakcióidő után [Chen, 1982; Chen, 1987]. Az E érték feltételezhetően konstans a reakció lefutása alatt, de vannak utalások arra, hogy ez nem mindig igaz. Ennek a viselkedésnek a fő oka a reakció reverzibilitása, mely az idővel csökkenti az enantioszelektivitást. Egy másik módszer az
enantioszelektivitás meghatározására a két enantiomer specificitási konstansa arányának számolása két különálló reakcióban [Wehtje, 1997]. A harmadik módszer szerint az enzim aktivitásának mérésére különböző enantiomer arányú szubsztrátokkal lehetséges [Högberg, 1993]. A két utóbbi technika az egyik enantiomer tiszta formáját igényli.
1.3.3. Enantioszelektív reakciók
A sztereoszelektivitást az egyes enantiomerek előállítása során használják ki, mely egyre fontosabbá válik a gyógyszeriparban és az agrokémiai iparban. Főként azért van szükség az enantioszelektív módszerekre, mivel csak az egyik enantiomer rendelkezik a kívánt hatással, míg a másik hatástalan vagy nem kívánt mellékreakciókat okoz.
A sztereoszelektív reakciókban a leggyakrabban használt enzimek a lipázok. Ezek a reakciók olyan paraméterektől függhetnek, mint pl. az enantiotrópok és enantiomerek differenciálódása, a szubsztrátok típusa, a szubsztrát és az enzim biokémiai kölcsönhatása, a szubsztrátok sztérikus interakciója, két különböző szubsztrát versengése, a sztereoszelektív reakció aktív helyének természete és elérhetősége, víz jelenléte és az oldószerek természete [Fan, 2010].
A számos reakciókörülmény közül elengedhetetlen a reakcióközeg vizsgálata. Ezek lehetnek vizes közegek, szerves oldószerek, kétfázisú rendszerek, melyek nagyban befolyásolhatják az enantioszelektivitást. Számos kutató alkalmazza az oldószermérnökség tudományát [Rotticci, 2000]. Azt is bebizonyították, hogy a CALB és Pseudomonas cepacia enzimek enantioszelektivitása számos szekunder alkohol esetében lényegesen növelhető ionos folyadék jelenlétében [Bornscheuer, 2002].
A hőmérséklet bizonyítottan hatással van az enantioszelektivitásra, és a kinetikai rezolválás során a következő egyenlet érvényes [Rotticci, 2000]:
RT H R
E S
#
#
ln (10)
R – egyetemes gázállandó (8,314 J/mol/K) T – hőmérséklet (°C)
H# – standard entalpiaváltozás S# – standard entrópiaváltozás
Az enantioszelektivitás csökkenhet vagy növekedhet is a hőmérséklet függvényében az entrópia és az entalpia hatásaként. A legtöbb reakcióban a hőmérséklet csökkenésével fordított arányosságban növekszik az enantioszelektivitás [Rotticci, 2000]. Persson és társai [Persson, 2002] a 2-fenil-propionsav 1-heptanollal történő észterezése során kimutatták, hogy
más vizsgált lipázokhoz képest (Rhizopus oryzae, Candida rugosa, Rhizomucor miehei) a CALB az (R)-enantiomert részesíti előnyben, valamint az E-érték a többi esethez képest növekedés helyett csökkent a hőmérséklet csökkenésével. Ez azt jelenti, hogy mind a 4 fajta vizsgált lipáz enzim esetében a hőmérséklet csökkenése az (S)-enantiomer felé tolta el az enantiomer arányt.
A szubsztrátok koncentrációja is nagyban befolyásolja az enantioszelektivitást, pl. lipázos észterezés esetében ez az egyensúlyi ponttól való távolság. Az enzim a termékképződés és a hidrolízis során is ugyanazt az enantiomert részesíti előnyben. Ha az egyensúlyi pontot a termékképzés irányába toljuk el, az a konverziót és az enantioszelektivitást is növeli. Ilyenkor viszont az alkohol inhibícióval kell számolni. Kisebb alkohol mennyiségek alkalmazásánál minden esetben nagyobb volt az enantioszelektivitás [Berglund, 2001].
Az oldószer víztartalma gyakran befolyásolja a reakciósebességet és az enantioszelektivitást is. A nagyszámú vizsgálat ellenére nem létezik általános szabály az enzim enantioszelektivitásának optimalizálásához. Ez valószínűleg a természetben előforduló számos enzimtípusnak köszönhető, de ugyanez elmondható enzimtípusokon belülre is [Rotticci, 2000]. Az enzim hidratáltsága nagyban meghatározza a protein rugalmasságát és ez által a katalitikus aktivitását. Az alacsony hidratáltság kevésbé rugalmas enzimhez vezet, mely általában kevésbé aktív. Néhány tanulmány szerint a rugalmas enzimnek kisebb lehetősége van a két enantiomer között választani. Ennek ellenére, ha a merevebb enzim kevésbé tudna idomulni a gyorsabban reagáló enantiomerhez, mint a lassúhoz, akkor alacsony hidratáltsági foknál elvesztené az enantioszelektivitását. Tanulmányok igazolják, hogy a növekvő víztartalom növeli az enantioszelektivitást [Kitaguchi, 1990], de néhány esetben csökken [Bodnár, 1990], vagy épp semmi hatása nincs a víz hozzáadásának [Bovara, 1993], de e kísérletek mindegyikét más típusú enzimmel és szubsztráttal végezték. Persson és társai [Persson, 2002] kísérleteket végeztek a víztartalom szerepének vizsgálatára, ahol 4 féle lipáz enzimet használtak a 2-fenil-propionsav heptanollal történő észterezésénél. Megállapították, hogy a lipázok többségének enantioszelektivitására nem volt hatással a víztartalom. Az egyetlen kivétel az egyik fajta Candida rugosa volt, mely esetében az enantioszelektivitás csökkent a vízaktivitás növekedésével. A vinil-butirát 1-butanollal történő észterezését vizsgálták Lozano és társai [Lozano, 2002] CALB enzimet felhasználva. Az enzim vizes oldatát [EMIM][NTf2] ionos folyadékban feloldották, a reakciót pedig különböző hőmérsékleteken scCO2-ban játszatták le. Kimutatták, hogy az alacsony víztartalomnak (<4 m/m%) köszönhetően nagy szelektivitás mutatkozott (>95%). Az enantioszelektivitást ezen
felül előnyösen befolyásolta még a hőmérséklet emelése. 40-ről 100 °C-ra emelve a reakció hőmérsékletét a szelektivitás 96%-ról 99%-ra emelkedett.
Végső soron megállapítható, hogy az előbb említett két paraméter hatásai nem egyértelműek, ezért az enantioszelektivitásra gyakorolt hatásukat nem tudjuk biztosan megjósolni.
Számos tanulmány foglalkozik az enzimes úton történő aszimmetrikus észterezési reakciókkal. Ilyen például a (±)-mentol enantioszelektív észterezése [Zhang, 2008], a (D,L)- fenilglicin-metil-észter hidrolízise [Lou, 2006], a racém ibuprofén észterezése [Ikeda, 2002].
Tejsav enzimatikus enantioszelektív észterezésével alig néhányan foglalkoztak, viszont a tejsavhoz hasonló, egy funkciós csoportban különböző molekula, a 2-klór-propionsav rezolválását vizsgálták Bodnár és munkatársai [Bodnár, 1990]. Ez a vegyület a herbicid gyártásban jelentős vegyület, de csak az (R)-enantiomer bizonyult hatásosnak. A reakciók során az oldószer-polaritás, a sav : alkohol mólarány, az alkohol szerkezet, a hőmérséklet és a reakcióelegy víztartalmának hatását vizsgálták Candida rugosa enzim használata esetén. A reakcióelegy 0,01 mol racém savat, 0,06 mol alkoholt és 50-100 cm3 vízmentes oldószert tartalmazott, melyhez 0-200 mg vizet adtak. Az oldószer vizsgálata során kiderült, hogy a legnagyobb, közel 80%-os konverziót az 1-butanollal való észterezés során n-hexán és metil- ciklohexán közegében érték el, 6 óra reakcióidő után. Az enantioszelektivitás kevéssé függött az oldószerektől, 42%-os konverziónál 62% és 74% közötti enantiomerfelesleg értékeket mértek. A víztartalom vizsgálatakor kimutatták, hogy a konverzió kisebb víztartalom esetén (0,25 m/m%) mutatta a maximumot. A termék enantiomer tisztasága 0,4 m/m% kezdeti víztartalom felett kezdett el csökkenni. Végeztek kísérleteket különböző szénlánc hosszúságú alkoholokkal, C8-ig, de metanollal és etanollal nem játszódott le észterezés. Kimutatták, hogy a legnagyobb hozamot 1-butanollal lehet elérni. Enantioszelektivitás szempontjából szintén az 1-butanol esetében mérték a legnagyobb értékeket (e.e.=74%, y=42%), de az 1- és 2-propanol is közel 70%-os enantiomerfelesleg értékeket hozott. Vizsgálták továbbá a sav : alkohol mólarányt, ahol az értékeket 1 : 1 és 1 : 10 tartományban változtatták. Az alkohol kis feleslege a reakciót lassúvá tette, de a felesleg növelése a reakciósebességet is növelte, a maximumot pedig 1 : 6 aránynál érte el. Az arány további növelésével a hozam csökkenni kezdett, viszont az enantiomer tisztaság ekkor érte el a maximumát. Ennek magyarázata az lehet, hogy az alkoholfelesleg növelése megváltoztatja a víz eloszlását a folyadék és szilárd (enzim) fázis között, így a növekvő alkohol mennyiség a folyadék fázisban csökkenti az enzim vízburkát. A hőmérséklet vizsgálata során 20 és 50 °C közötti értékeken mozogtak. A hozam 30 °C-on volt a legnagyobb.
Ulbert és munkatársai [Ulbert, 2004] a 2-szubsztituált-propionsavat szelektíven észterezték butanollal Candida rugosa enzim segítségével. A reakcióközegek n-hexán és [BMIM]PF6
ionos folyadék voltak. Sikeres enantioszelektív észterezést hajtottak végre klór, bróm, metoxi, etoxi, propoxi, izopropoxi és fenoxi szubsztituens esetében. A legnagyobb hozamot a 2-klór- propionsavval érték el, és az enantioszelektivitás is ennél a savnál érte el a legnagyobb értékeket.
1.3.4. Tejsav enantioszelektív reakciói
A tejsav enzimes rezolválását alig néhány szerző vizsgálta. Torres és Otero [Torres, 2001], akik kaprilsavval történő enzimes észterezés során Novozym 435-tel végeztek enantioszelektív kísérleteket. Az észterezési reakciókat 4-szeres alkoholfeleslegben hajtották végre, ahol D25=224,2 és 223,5 forgatóképességet mértek. A lipáz 35% körüli hozamot mutatott (moláris arányokkal számolva) a tejsav enantiomerre nézve, mely igen jó eredménynek számít, tekintve, hogy a bemért tejsav elegy monomer tartalma 68%-os volt.
Inaba és munkatársai vizsgálták CALB enzim jelenlétében az (L)-, (D)- és (D,L)-tejsav észterezését etanollal [Inaba, 2009]. A reakcióelegy 50 mg enzimet, 500 mM etanolt, 10 mM (L)-, (D)- és (D,L)-tejsavat tartalmazott vízzel telített heptánban, 50 °C-on. Az (L)-, (D)-tejsav kezdeti reakciósebessége közel ugyanaz volt, de az észter szintézis hatásfoka a (D)-tejsavra nézve nagyobb volt. A reakció nem volt kivitelezhető vízmentes oldószerben, mivel a tejsav nem oldódott vízmentes heptánban. Etanol feleslegének alkalmazásakor a reakciósebesség megnőtt, savfeleslegben pedig csökkent. A reakció hőmérsékletfüggése megmutatkozik abban, hogy 30 °C-on volt a legkisebb, 50 °C-on pedig a legnagyobb a konverzió.
Oldószermentes közegben, alkohol feleslegében a konverzió elmaradt a vizes heptánban mértekhez képest, mely az alkohol inhibíciónak tudható be.
A tejsav kinetikus rezolválását Ohara és társai vizsgálták. Munkájukban [Ohara, 2011] a butil- (L)- és (D)-laktát optikai rezolválását immobilizált lipáz enzimmel végezték. A kísérlet során Novozym 435 (0,2 g) jelenlétében 2 g butil-(D,L)-laktátot reagáltattak, 80 °C-on. Folyamatos keverés mellett a butil-(D)-laktát oligomerizációja végbement, a butil-(L)-laktát viszont nem lépett reakcióba. Az enzimes reakció után a reakcióelegy 90,4% butil-(L)-laktátot és 9,6%
butil-(D)-laktátot tartalmazott. A reakcióidő növelésével a butil-(L)-laktát tisztasága 95,2%-ra, majd 98,3-ra növekedett a reakcióelegyben 48 illetve 72 óra után. Az elegyből a nem kívánt reagensek eltávolításához 110 °C-on desztillációt alkalmaztak, és fokozatosan 30-ról 1 Hgmm-es vákuum alá helyezték. Az elvégzett kísérletek folyamatát az 5. ábra szemlélteti.
5. ábra: A butil-(D,L)-laktát enantioszelektív oligomerizációjának folyamata [Ohara, 2011]
1.4. Enzimkatalízis nem konvencionális közegekben 1.4.1. Ionos folyadékok jellemzése
Az ionos folyadékok olyan sók, melyek szobahőmérsékleten folyékony halmazállapotúak. Az első előállított ionos folyadékot 1914-ben mutatták be ([EtNH3]NO3). Azóta jó néhány fajtáját előállították (6. ábra), melyeket számos iparterületen felhasználnak, mint pl. az energiaiparban, bevonatkészítésben, biotechnológiában (7. ábra). A biokatalízisben a legelterjedtebben használt ionos folyadékok az imidazólium bázisúak, mint pl. a [BMIM]PF6
(1-butil-3-metilimidazólium-hexafluoro-foszfát). Széles körű kutatások folynak arra, hogy az ionos folyadékok zöld alternatívái legyenek a szerves oldószereknek, melyekhez képest elsődleges különbség, hogy gyakorlatilag nincs gőznyomásuk, ezáltal könnyebb az újrafelhasználhatóságuk [Park, 2003]. Az ionos folyadékokat „méretre szabható molekuláknak” is nevezik, mivel könnyen változtatható a szerkezetük, ezáltal az oldószer tulajdonságaik is. Például az 1-alkil-3-metilimidazóliumban lévő alkil szubsztituens kis változtatásaival a szubsztrát oldhatósága, ezáltal a regioszelektivitás és a hozam is növelhető [Park, 2001].
6. ábra: Az ionos folyadékok típusai [Pham, 2010].
7. ábra Az ionos folyadékok felhasználási területei [Pham, 2010].
![1. ábra: A tejsav kőölajból illetve megújuló nyersnyagokból történő előállításának lépései [Wee, 2006]](https://thumb-eu.123doks.com/thumbv2/9dokorg/876589.47172/13.892.129.752.121.429/ábra-tejsav-kőölajból-megújuló-nyersnyagokból-történő-előállításának-lépései.webp)