Pannon Egyetem
Vegyészmérnöki- és Anyagtudományok Doktori Iskola
GÁZSZEPARÁCIÓ IONOS FOLYADÉKKAL KÉSZÍTETT TÁMASZTÓRÉTEGES
FOLYADÉKMEMBRÁNNAL
DOKTORI (PH.D.) ÉRTEKEZÉS Készítette:
Cserjési Petra
okleveles környezetmérnök Témavezető:
Bélafiné Dr. Bakó Katalin egyetemi tanár
Pannon Egyetem
Biomérnöki, Membrántechnológiai és Energetikai Kutatóintézet
2011
GÁZSZEPARÁCIÓ IONOS FOLYADÉKKAL KÉSZÍTETT TÁMASZTÓRÉTEGES FOLYADÉKMEMBRÁNNAL
Értekezés doktori (Ph.D.) fokozat elnyerése érdekében Írta: Cserjési Petra, okleveles környezetmérnök
Készült a Pannon Egyetem Vegyészmérnöki- és Anyagtudományok Doktori Iskolája keretében
Témavezető: Bélafiné Dr. Bakó Katalin, egyetemi tanár Elfogadásra javaslom (igen / nem)
………
(aláírás)
A jelölt a doktori szigorlaton………. % -ot ért el
Az értekezést bírálóként elfogadásra javaslom:
Bíráló neve: ………. ………. igen /nem
……….
(aláírás)
Bíráló neve: ………. ………. igen /nem
……….
(aláírás)
Bíráló neve: ………. ………. igen /nem
……….
(aláírás)
A jelölt az értekezés nyilvános vitáján………% - ot ért el Veszprém, ……….
a Bíráló Bizottság elnöke
A doktori (Ph.D.) oklevél minősítése…...
………
Az EDT elnöke
TARTALOMJEGYZÉK
KIVONAT ... 5
ABSTRACT... 6
AUSZUG ... 7
Bevezetés ... 7
1. Irodalmi összefoglaló... 9
1.1. Ionos folyadékok... 9
1.1.1. Ionos folyadékok rövid története ... 9
1.1.2. Ionos folyadékok szerkezete, fizikai-kémiai tulajdonságai ... 10
1.1.3. Ionos folyadékok lehetséges felhasználási területei ... 15
1.2. Membránszeparáció ... 17
1.2.1. Membrános műveletek, membránok rövid története ... 18
1.2.2. Membrános műveletek jellemzése... 19
1.2.3. Gázszeparáció ... 21
1.2.3.1. Gázszeparáció polimer membránokkal... 23
1.2.3.2. Gázszeparáció folyadékmembránokkal ... 29
1.3. Gázszeparáció ionos folyadékkal készített támasztóréteges folyadékmembránokkal ... 32
1.3.1. Tiszta gázok vizsgálata ... 33
1.3.2. Gázelegyek vizsgálata... 36
1.4. Célkitűzések... 39
2. Anyagok és módszerek ... 41
2.1. Felhasznált anyagok... 41
2.2. Alkalmazott készülékek... 42
2.3. Módszerek... 43
2.3.1. Támasztóréteges folyadékmembrán készítése ... 43
2.3.2. Vizsgálatok szakaszos rendszerben ... 44
2.3.2.1. Kísérleti rendszer ... 44
2.3.2.2. Kísérleti módszerek tiszta gázok vizsgálatára ... 47
2.3.3. Vizsgálatok folyamatos rendszerben ... 49
2.3.3.1. Kísérleti rendszer ... 49
2.3.3.2. Kísérleti módszerek tiszta gázok vizsgálatára ... 51
2.3.3.3. Kísérleti módszerek gázelegyek vizsgálatára ... 52
2.3.4. Gázpermeáció meghatározása, gázelemzés ... 52
2.3.5. Gázoldhatóság vizsgálata ionos folyadékokban ... 54
3. Kísérleti eredmények ... 55
3.1. Támasztóréteges folyadékmembrán készítése ... 55
3.1.1. Membránkészítési módszer kiválasztása ... 55
3.1.2. A membránkészítési módszer reprodukálhatósága... 57
3.1.3. A támasztóréteges ionos folyadékmembránok jellemzése ... 57
3.2. Szakaszos rendszer - tiszta gázok vizsgálata ... 59
3.2.1. Permeabilitás vizsgálat ... 59
3.2.2. Permeabilitás vizsgálat reprodukálhatósága ... 62
3.2.3. Látszólagos szelektivitás vizsgálat ... 63
3.2.4. Szén-dioxid hatásának vizsgálata ... 64
3.2.5. Hőmérséklet és nyomás hatásának vizsgálata ... 67
3.3. Folyamatos rendszer - tiszta gázok vizsgálata... 71
3.3.1. Permeabilitás vizsgálat ... 71
3.3.2. Permeabilitás vizsgálat reprodukálhatósága ... 73
3.3.3. Látszólagos szelektivitás vizsgálat ... 73
3.3.4. Szén-dioxid hatásának vizsgálata ... 75
3.3.5. Víz hatásának vizsgálata... 76
3.3.6. Hőmérséklet és nyomás hatásának vizsgálata ... 77
3.3.7. A támasztóréteges folyadékmembránok élettartamának vizsgálata ... 79
3.4. Folyamatos rendszer - gázelegyek vizsgálata... 80
3.4.1. Permeabilitás vizsgálat ... 80
3.4.2. Szelektivitás vizsgálat... 82
3.4.3. A gázelegy összetétel hatásának vizsgálata ... 83
3.4.4. Víz hatásának vizsgálata... 84
3.5. Gázoldhatóság vizsgálata ionos folyadékokban ... 87
4. Összefoglalás ... 89
5. Irodalomjegyzék ... 92
Tézisek ... 105
Theses ... 108
Publikációs lista ... 111
Függelék... 114
Köszönetnyilvánítás... 120
KIVONAT
A doktori munka során ionos folyadékkal készített támasztóréteges folyadékmembránok nitrogén, hidrogén, metán és szén-dioxid tiszta gázokra, illetve ezeknek a gázoknak kettő-, három- és négykomponensű gázelegyeire vonatkozó gázszeparációs tulajdonságait vizsgáltam.
A kísérletsorozat első lépéseként kiválasztottam a legjobb minőségű membránt eredményező membránkészítési módszert, majd négy jól ismert és széles körben kutatott, valamint tíz, hasonló célból még nem vizsgált ionos folyadékot felhasználva támasztóréteges ionos folyadékmembránokat készítettem.
Ezután kiépítettem egy szakaszos és egy folyamatos működtetésű gázpermeációs és gázszeparációs rendszert.
A szakaszos rendszerben meghatároztam a membránok gázpermeabilitását, látszólagos szelektivitását, valamint a CO2 membránra gyakorolt esetleges negatív hatását, amik alapján kiválasztottam a membránkészítésre legalkalmasabb négy ionos folyadékot. Az ismert ionos folyadékokkal végzett kísérletek mérési adatait sikeresen összevetettem a hasonló mérőrendszerekben kapott, korábban már publikált eredményekkel. Továbbá tanulmányoztam a kiválasztott ionos folyadékokat tartalmazó membránok élettartamát, permeabilitásának és ideális szelektivitásának hőmérséklet- és nyomásfüggését, aminek ismerete elengedhetetlen az esetleges ipari felhasználás előtt.
A fotoakusztikus gázelemző készülékkel összekötött folyamatos rendszerben meghatároztam a tiszta gázok permeabilitását és ideális szelektivitását, a CO2 és a gázáram vízgőztartalmának, továbbá a hőmérsékletnek és a nyomásnak a membránok gázszeparációs tulajdonságaira gyakorolt hatását, valamint a membránok élettartamát a két rendszer működésének összehasonlítása céljából.
A gázelegyek esetében vizsgálatokat végeztem a permeabilitásra, a valódi szelektivitásra, a gázáram vízgőz tartalmának és a gázkeverék összetételének a gázszeparációra gyakorolt hatására vonatkozóan is, majd tanulmányoztam a tiszta gázok és a gázkeverékek esetében kapott eredmények közti hasonlóságokat és eltéréseket.
A kutatómunka befejező lépéseként meghatároztam a folyadékfázis gázoldhatóságát, kiszámítottam a kapcsolódó diffúziós állandó és Henry állandó értékeket is.
Végül az eredmények alapján megállapítottam, hogy ezek a folyadékmembránok a közeli jövőben alkalmasak lehetnek hosszabb távú, ipari alkalmazásra is.
ABSTRACT
In this PhD work the gas separation properties of supported liquid membranes prepared with ionic liquids were studied for pure nitrogen, hydrogen, methane and carbon dioxide and for the binary, ternary and quaternary mixtures of these gases.
First the best membrane preparation method was selected and supported liquid membranes were prepared using fourteen kinds of ionic liquids. Four of them were well-known and studied ones, while the rest have never been studied for similar purposes.
Then both a batch and a continuous gas permeation and gas separation system were built.
In the batch system the permeability and ideal selectivity results of the membranes and the possible negative effects of CO2 on the gas permeation were determined and the four most adequate ionic liquids for membrane preparation were selected. The data of the experiments based on the well-known ionic liquids were successfully compared to the previously published results, which were achieved in analogous systems.
Furthermore the stability and the temperature and pressure dependence of the gas permeability and ideal selectivity of the membranes prepared with the selected ionic liquids were studied since this information is indispensable before considering an industrial application.
In the continuous system, which were connected to a photoacustic gas analyzer, the single gas permeabilities, ideal selectivities, the effect of CO2 and the water vapour content of the gas streams on gas permeation, the membrane stability and the temperature and pressure dependence of the gas separation were determined in order to compare the effectiveness of the two systems.
Moreover the permeability, permselectivity and the effect of the water vapour content of the gas streams and the gas composition of the mixtures on the gas separation properties were studied in the case of the gas mixtures to evaluate the differences between single gas and gas mixture experiments.
In the last step the gas solubilty of the liquid phase was investigated, the diffusion coefficients and the Henry coefficients were calculated.
Finally, it was stated that these liquid membranes could be suitable for long term industrial applications in the near future.
AUSZUG
In der Doktorarbeit wurden die Gasseparationseigenschaften von mit ionischen Flüssigkeiten hergestellten gestützten Flüssigkeitsmembranen für reine Gase wie Stickstoff, Wasserstoff, Methan und Kohlendioxyd sowie die Zwei-, Drei- und Vierkomponentengemische deren untersucht.
In der ersten Arbeitspakete wurde die beste Membranherstellungsmethode ausgewählt, dann wurden mit Anwendung von vier gut bekannten und breit untersuchten sowie zehn ähnlichen, aber aus diesem Zweck noch nicht untersuchten ionischen Flüssigkeiten gestützte ionische Flüssigkeitsmembranen hergestellt. Danach wurde ein diskontinuierliches und ein kontinuierliches Gaspermeations- und Gasseparationssystem ausgebaut.
In dem diskontinuerlichen System wurden die Gaspermeabilität, die scheinbare Selektivität der Membranen, sowie die mögliche negative Wirkung des Kohlendioxyds auf die Membran bestimmt, wonach die für Membranherstellung am besten geeigneten vier ionische Flüssigkeiten ausgewählt wurden. Die Messdaten der mit bekannten ionischen Flüssigkeiten durchgeführten Versuche wurden erfolgreich mit den in ähnlichen Messsystemen erhielten, früher schon publizierten Ergebnissen verglichen. Weiterhin wurde die Dauerhaftigkeit, die Temperatur- und Druckabhängigkeit der Permeabilität und idealen Selektivität der die ausgewählte ionische Flüssigkeiten erhaltenden Membranen studiert, deren Kenntnis für die eventuelle industrielle Verwendung unerforderlich ist.
Um die Wirkung der beiden Systeme zu vergleichen, wurden die Permeabilität und die ideale Selektivität der reinen Gase, die Wirkung des Kohlendioxyds, des Wasserdampfgehaltes von Gastrom sowie der Temperatur und des Druckes auf die Gasseparationseigenschaften der Membranen in mit einem photoakustischen Gasanalysator verbundenem kontinuerlichem System bestimmt.
Im Falle der Gasgemische wurden die Wirkung des Wasserdampfgehaltes von Gastrom und der Zusammensetzung des Gasgemisches auf die Permeabilität und die ideale Selektivität untersucht, dann wurden die Ähnlichkeiten und Unterschiede bei der Anwendung von reinen Gasen und Gasgemischen erhielten Ergebnisse studiert.
Als letzter Schritt der Forschungsarbeit wurden die Gaslösigkeit der Flüssigkeitsphase bestimmt, die Werte der Diffusions- und Henry-Konstante ermittelt.
Zum Schluss, aufgrund der Ergebnisse wurde festgestellt, dass diese Flüssigkeitsmembranen in der näheren Zukunft auch für langfristige industrielle Anwendung geignet werdet können.
Bevezetés
A membrános gázszeparáció napjaink egyik legintenzívebben kutatott, leggyorsabban fejlődő szeparációs eljárása. Ez igazán nem meglepő, ha figyelembe vesszük a hagyományos elválasztási technikákkal szembeni számos előnyét, mint például kompakt felépítés, egyszerű működtetés, könnyű méretnövelés és méretcsökkentés, nagy energiahatékonyság, szobahőmérsékleten, alacsony nyomáson történő működtetés, valamint jobb minőségű termékek és kis környezetterhelés.
Segítségével megvalósítható többek között a szintézisgázok összetételének beállítása, a földgáz tisztítása, a fermentáció során keletkező gázelegy szeparációja a biohidrogén koncentrációjának növelése érdekében, továbbá a szén-dioxid eltávolítása füstgázból, csökkentve ezzel az üvegházhatású gáz emisszióját. A membránok nagyméretű, ipari alkalmazása tehát nemcsak gazdasági, de környezetvédelmi szempontból is igen jelentős. Az ipari szektor, valamint a környezetvédelmi szabályozás folyton változó követelményei miatt a piacot több, mint harminc éve uraló pórusos és pórusmentes polimer gázszeparációs membránok fejlesztése illetve kiváltása napjainkban elengedhetetlenné vált.
Támasztóréteges ionos folyadékmembránok alkalmazásával például sokkal nagyobb permeabilitás és szelektivitás értékeket, azaz nagyobb gázszeparációs hatékonyságot érhetünk el. Ezek valójában szilárd, pórusos membránok, melyek pórusaiban rögzítjük az elválasztásra alkalmas folyadékfilmet, a manapság egyre nagyobb népszerűségnek örvendő, gyakran „zöld oldószerként” is emlegetett kationból és anionból álló ionos folyadékot. Az ionos folyadékok olyan különleges tulajdonságainak köszönhetően, mint az alacsony gőznyomás, vagy az ionok megfelelő kiválasztásával változtatható fizikai- kémiai jellemzők, igen stabil membránokat kapunk, melyek felhasználása során garantáltan magas hatékonyság mellett gyakorlatilag kizárhatók a párolgásból eredő környezeti és biztonságtechnikai problémák és veszteségek.
Kutatómunkám során korábban még nem vizsgált ionos folyadékokkal támasztóréteges folyadékmembránokat készítettem és meghatároztam az iparban leggyakrabban jelenlévő tiszta gázokra és gázelegyekre vonatkozó permeabilitásukat és szelektivitásukat az általam kialakított szakaszos és folyamatos működtetésű gázszeparációra alkalmas rendszerben. Vizsgáltam továbbá a szén-dioxid, a hőmérséklet, a nyomás és a gázáram víztartalmának gázszeparációra gyakorolt hatását, a membránok élettartamát, valamint a gázok oldhatóságát a folyadékfázisban.
1. Irodalmi összefoglaló 1.1. Ionos folyadékok
Ionos folyadéknak (IF) nevezzük azokat a szerves vagy szervetlen kationból és anionból álló sószerű vegyületeket, amelyek olvadáspontja nem haladja meg a 100°C hőmérsékletet [Welton, 1999].
1.1.1. Ionos folyadékok rövid története
Az IF-ok korántsem újak, történetük egészen a XIX. századig nyúlik vissza, amikor a benzol metil-kloriddal történő Friedel-Crafts alkilezése során a kívánt toluol termék mellett egy “vörös olaj”-nak elnevezett vegyület is keletkezett. A vegyület összetételének meghatározása az NMR spektroszkópia megjelenéséig váratott magára, ekkor derült ugyanis ki, hogy az “olaj” valójában egy olvadt só, mely heptakloro-aluminát anionból és a
Friedel-Crafts reakcióban inter- medierként szereplő σ komplex kationból épül fel (1.1. ábra) [Wilkes, 2002].
R H
+ Al2Cl7-
1.1. ábra: A “vörös olaj” szerkezete
Az IF-okat először 1914-ben Walden jellemezte, aki etil-ammónium nitrátot állított elő, melynek olvadáspontja mindössze 12°C volt [Walden, 1914]. 1934-ben az IF-ok egy szabadalomban is megjelentek [Graenacher, 1934], ám ezután nagyjából a II.
Világháború végéig a feledés homályába merültek. 1951-ben Frank Hurley és Tom Wier publikálták cikküket, melyben az alkil-piridin-klorid és alumínium-klorid elegyítésével előállított, szobahőmérsékleten folyékony, alkil-piridinium kationból és tetrakloro-aluminát anionból álló sószerű vegyületről számoltak be [Hurley, 1951].
Két évtizedes szünet után az IF-okkal kapcsolatos kutatások újult erővel indultak meg, miután a tudósok felismerték Hurley és Wier munkájának jelentőségét. Míg az 1970-es években elsősorban az IF-ok elektrokémiai alkalmazását vizsgálták, addig az 1980-as években felvetődött a szerves kémiai szintéziseknél használt oldószerek IF-kal való helyettesítése is [Fry, 1986]. Az 1990-es évektől kezdve egyre szélesedett azon reakciók palettája, amikben IF-ot használtak oldószerként, a lehetőségek száma pedig tovább nőtt 1992-től, amikor Wilkes és Zaworotko újfajta, levegő és víz hatásának ellenálló IF-ok előállításáról és vizsgálatáról számolt be [Wilkes, 1992].
Az IF-ok felhasználása és jellemzése egyre intenzívebben kutatott terület, a kapcsolódó publikációk száma 1997 és 2006 között több, mint a százszorosára nőtt [Fráter, 2007]. Az iparban 1996 óta vannak jelen, először az Eastman Chemical Company alkalmazta őket 3,4-epoxi-1-butén 2,5-dihidrofuránná történő izomerizációja során [Plechkova, 2008]. A szakirodalom szerint az előállításra és alkalmazásra kerülő IF-ok száma meghaladja az ötszázat, kedvező tulajdonságainak egyre szélesebb körű ismeretével azonban ez a szám folyamatosan nő [Marsh, 2004].
1.1.2. Ionos folyadékok szerkezete, fizikai-kémiai tulajdonságai
Az IF-ok szinte bármelyik, az erre a célra alkalmas anionból és kationból felépíthetők, így a lehetséges variációk száma roppant nagy, Earle és Seddon szerint akár az egy milliárdot is elérheti [Earle, 2000]. A leginkább vizsgált és a leggyakrabban használt anionok és kationok az 1.1. táblázatban láthatók. Bővebb lista a Függelék 6.
táblázatában található.
1.1. táblázat: A leggyakrabban használt anionok és kationok
Kationok Anionok Elnevezés (Rövidítés) Szerkezeti képlet Elnevezés (Rövidítés) Szerkezeti képlet Ammónium
(N)
Tetrafluor-borát (BF4)
Foszfónium
(P) Hexafluor-foszfát
(PF6) Szulfónium
(S)
Trifluor-metán- szulfonát (CF3SO3) Imidazolium
(Im)
Metil-szulfát (MeSO4)
Piridinium (Py)
Toluol-szulfonát (ToS)
Pirrolidinium (Pyr)
Bisz (trifluor-metil)- szulfonil-imid (NTf2)
Az IF-ok fizikai és kémiai tulajdonságait az őket felépítő anionok és kationok határozzák meg, elsősorban kölcsönös illeszkedésük, méretük, geometriájuk és a töltés eloszlásuk szerint [Huddleston, 2001]. Az anion és kation megfelelő kiválasztásával, illetve módosításával az IF-ok egyes fizikai-kémiai tulajdonságai széles körben variálhatók, az adott felhasználási célra “hangolhatók” [Koel, 2008].
Gyakorlati szempontból meglehetősen fontos és hasznos tulajdonságuk, hogy gőznyomásuk igen alacsony, melynek köszönhetően felhasználásuk során gyakorlatilag kizárhatók a párolgásból eredő környezeti és biztonságtechnikai problémák és veszteségek [Endres, 2008].
Az IF-ok jóval alacsonyabb olvadásponttal rendelkeznek, mint a hagyományos értelemben vett sók, aminek oka abban keresendő, hogy a nagyméretű aszimmetrikus kation és a valamivel kisebb anion között olyan kicsi az elektrosztatikus kölcsönhatás, hogy nem tud kialakulni kristályszerkezet így szobahőmérsékleten is folyékony halmazállapotúak [Keskin, 2007]. Az olvadáspontot nagy mértékben befolyásolja a kation szerkezete, méretének növelésével csökken, az alkil láncán található elágazások számának növelésével pedig nő az IF-ok olvadáspontja [Chiappe, 2005].
Viszkozitásuk 50 és 5000 mPas közé esik, ez viszonylag magas érték, a vízéhez képest mintegy három nagyságrenddel nagyobb. A hőmérséklet növelésével csökken [Okoturo, 2004], a kation alkil-lánc hosszának növelésével pedig nő a viszkozitás [Bonhôte, 1996].
A legtöbb ismert IF sűrűsége 1 és 1,6 g/cm3 érték között mozog és a hőmérséklet növekedésével valamint a kation alkil-lánc hosszának növelésével csökken [Van Valkenburg, 2005].
Az IF-ok polaritásának meghatározására szolvatokromatikus és fluoreszkáló festéket is használnak, mivel ezeknek a festékeknek a látható tartományban mért elnyelési maximuma az oldószer polaritásától függ [Deye, 1990]. Ezek alapján az IF-ok nagy többsége erősen poláros oldószer, polaritásuk 0,6-0,7 közé esik azon a normál skálán, ahol a vízé 1,0 és a tetrametil-sziláné 0 [Carmichael, 2000].
Stabilitásuk ismerete elengedhetetlen a megfelelő felhasználás szempontjából. A napjainkban előállított IF-ok meglehetősen nagy stabilitással rendelkeznek, általában ellenállnak a levegő és a víz károsító hatásainak is [Gan, 2006 (a)]. A termikus stabilitás meghatározásához termogravimetriás analízist használnak, ez alapján állapították meg, hogy egyes IF-ok akár 800°C hőmérsékleten is még stabilak, mivel esetükben alig vagy
Az IF-ok vízzel való elegyedését az anion határozza meg, így egyes IF-ok, mint például a NO3-, SO4-, Ac- és Cl- iont tartalmazók, teljes mértékben elegyednek vízzel, addig a PF6-, C4F9SO3- valamint a (CF3SO3)2N- anionból felépülők esetében egyáltalán nincs elegyedés, a víz és az IF két külön fázist alkot [Welton, 2004]. A BF4- és a CF3SO3- anionnal rendelkező IF-ok valahol a két eset között helyezkednek el, ezek elegyedését vízzel a kation alkil láncának hossza határozza meg, ha a láncot felépítő C atomok száma nagyobb, mint négy, akkor kétfázisú rendszert kapunk, ennél rövidebb szénlánc esetében pedig teljes elegyedés figyelhető meg [Seddon, 2000].
Tisztaságuk ismerete is meglehetősen fontos, hiszen nagy mértékben befolyásolja fizikai-kémiai tulajdonságaikat, különböző mennyiségű szennyezőanyag hatására például nagy eltérés lehet az adott IF esetében mért olvadáspontok között. Ez jól megfigyelhető az [emim][BF4] IF-nál, aminek olvadáspontja a publikációk szerint 5,8°C-nak [Holbrey, 1999] és 15°C-nak [Wilkes, 1992] adódott azonos meghatározási módszer használata mellett. Fontos tehát az IF felhasználásakor pontosan tudni, hogy milyen és mekkora mennyiségű szennyezőket tartalmaz.
A gázszeparációhoz használt IF-ok esetében elengedhetetlen a gázok oldódásának vizsgálata. A gázok fizikai oldódását a Henry-Dalton törvény írja le ideális gázok esetében (1.1.), ami kimondja, hogy a folyadékkal reakcióba nem lépő gáz oldhatósága, C1 egyenesen arányos a gáznak a folyadék felszíne feletti (gázelegy esetében parciális) nyomásával, p1:
1
1 Hp
C = (1.1.)
Az arányossági tényező, H a Henry állandó, ami a gáz és a folyadék minőségétől, valamint a hőmérséklettől függ.
Zárt rendszerben az oldódás dinamikus egyensúlyhoz vezet, ekkor a gázból a folyadékba lépő molekulák száma megegyezik a folyadékból a gáztérbe kilépő molekulák számával. Az így elért telítési koncentráció nem más, mint a gáznak a folyadékban való oldhatósága, ami a hőmérséklet csökkenésével és a parciális nyomás növelésével nő. Általában nagy Henry állandóhoz kicsi, míg kis Henry állandóhoz nagy oldhatóság tartozik [Wasserschied, 2007].
A gázok oldhatóságának mérése, amit legtöbbször állandó hőmérsékleten, változó nyomásértékek mellett hajtanak végre, a folyadékfázis párolgása és a gázfázis kondenzációja miatt nem mindig egyszerű feladat. Szerencsére az IF-ok alacsony gőznyomása miatt permanens (szobahőmérséklet alatti kritikus hőmérséklettel rendelkező, meglehetősen nagy nyomáson sem kondenzálódó) gázok esetében ezek a
problémák nem jelentkeznek és a gázoldhatóság viszonylag könnyen meghatározható az alábbi három módszerrel:
Sztöchiometrikus: adott térfogatú cellába ismert térfogatú folyadék és gáz kerül, a gázfázis térfogat méréséből az oldott gázmennyiség számolható.
Nyomáseséses: egy zárt berendezés egyik felében ismert mennyiségű folyadék, a másikban ismert mennyiségű gáz található egymástól elzárva. A két oldalt egymástól elválasztó szelep megnyitásakor a gáz a folyadékba kerül a gázoldali nyomás csökkenéséből pedig a folyadékban oldódó gáz mennyisége számolható.
Gravimetrikus: adott mennyiségű folyadékon gázt buborékoltatunk át. A folyadék mennyiségét a kísérlet előtt, illetve alatt tömegállandóságig mérjük, a két érték közötti tömegnövekedésből a gáz mennyisége egyszerűen számolható [Koel, 2008].
Az elmúlt tíz évben N2, H2, CO2 és CH4 oldhatóság szempontjából leginkább vizsgált IF-okat a Függelék 1. táblázata tartalmazza.
Az egyik legegyszerűbben megvalósítható gázoldhatóság és diffúziós állandó egyidejű meghatározására alkalmas (nyomáseséses) rendszer, aminek elvi sémáját az 1.2. ábra mutatja be, Camper és Noble nevéhez fűződik.
1.2. ábra: Gázoldhatóság mérésére alkalmas rendszer elvi sémája
A temperálható rendszer két fő része, amit három szelep választ el egymástól, az ismert térfogatú referencia- és a cellatérfogat. Az előbbi a vizsgálandó gázt, az utóbbi pedig az ionos folyadékot tartalmazza. A gáz elnyelődésének sebességét nyomásváltozásra visszavezetve a folyadék keverése nélkül a diffúziós állandó (1.2.), folyamatos keverés mellett pedig az oldhatóság (1.3., 1.4.) határozható meg az alábbi egyenletek alapján [Camper, 2006]:
ε
π kt π D
C D x dt
D C
M x t
t
x
t ⎥=
⎦
⎢ ⎤
⎣
⎡ −
⎟ =
⎠
⎜ ⎞
⎝
⎛
∂
∂
=
=
∫
= 2 0 1 210
0 (1.2.)
. . old
egy IF
n p
H =V (1.3.)
S H1
= (1.4.)
ahol D – diffúziós állandó [cm2/s]
Mt – t idő alatt egységnyi átadási felületen az IF-ba diffundált gáz mennyisége [mol/cm2]
Cx=t=0 – kezdeti felszíni gázkoncentráció [mol/cm3] x – helykoordináta [cm]
t – idő [s]
k – felszíni gázkoncentráció időbeli változása [mol/(cm3s)]
ε – gázkoncentráció időbeli változását kifejező paraméter [mol s/cm3] nold. – IF-ban oldódott gáz mennyisége [mol]
VIF – IF mennyisége [L]
pegy. – egyensúlyi állapotban mért nyomás [atm]
H – Henry állandó [(Latm)/mol]
S – gázoldhatóság [mol/(Latm)]
A kísérleti berendezés állandó hőmérsékleten tartása elengedhetetlen a pontos mérés szempontjából, mivel a hőmérsékletváltozás hatására bekövetkező legkisebb viszkozitás változás miatt jelentős eltérés adódhat a diffúziós állandó értékében [Camper, 2006].
A legtöbb IF gőznyomása igen kicsi, így párolgás útján csak kis valószínűséggel kerülnek ki a környezetbe [Welton, 1999]. Azonban mivel egy részük vízoldható, az egyéb úton (orális, dermális) történő expozícióról sem szabad megfeledkezni [Ranke, 2009]. Az IF-ok toxicitását, enzimaktivitásra, sejtre és mikroorganizmusokra gyakorolt hatását általában az 1.2. táblázatban feltüntetett Hodge és Sterner skála alapján osztályozzák [Hodges & Sterner, 1956].
1.2. táblázat: Hodge és Sterner skála LC50 (mg/L) Vegyület toxicitása
≤ 10 Erősen toxikus 10-100 Toxikus
100-1000 Mérsékelten toxikus 1000-10000 Részben nem toxikus
Ez a skála a vegyületeket az LC50 (az a koncentráció, ahol a vizsgált élőlények 50%-a elpusztul) értékük alapján különböző toxikussági osztályba sorolja be.
A leginkább alkalmazott ammónium-, foszfónium-, imidazolium- és piridinium- kationnal rendelkező IF-ok ökotoxikológiai vizsgálatát Wells és Coombe végezte el Daphnia magna és Pseudokirchneriella subcapitata fajokon [Wells, 2006].
A tanulmány szerint a legnagyobb toxicitás értékkel rendelkező IF-ok mintegy négy nagyságrenddel voltak toxikusabbak, mint a legkisebb értékkel rendelkező IF, aminek a toxicitása nagyjából a toluoléval egyezett meg. Összefüggést figyeltek meg továbbá a toxicitás és a kation alkil-láncának hossza között: míg a négy C atom számú alkil-láncú rendelkező IF csak mérsékelt toxicitást mutatott, addig a tizenkettő és annál több C atomból álló alkil-láncú IF-ok erősen toxikusak voltak.
További vizsgálatokat végeztek zöldalgákon (Scenedesmus obliquus, Chlorella ellipsoidea) [Ma, 2010], vízibolhákon (Daphnia magna) [Pretti, 2009], (Daphnia longispina) [Ventura, 2010] és fonálférgeken (Caenorhabditis elegans) [Swatloski, 2004], valamint zebrahalakon (Danio rerio) [Pretti, 2006] és patkányokon is [Landry, 2005]. Az elvégzett toxikológiai vizsgálatok alapján a legelterjedtebb IF-ok nem, vagy mérsékelt toxicitással rendelkeznek (LC50> 100 mg/L), egyes ammónium-kationt tartalmazó IF-ok pedig erősen toxikusnak (LC50< 0,5-10 mg/L) bizonyultak [Phuong, 2009]. Zöld mikroalgával (Selenastrum capricornutum) folytatott kísérletek alapján azonban kiderült, hogy bizonyos fajok esetében egyes IF-ok akár két nagyságrenddel is nagyobb toxicitással rendelkezhetnek, mint a metanol, vagy a propanol [Cho, 2008].
A toxicitás mellett fontos megemlíteni, hogy a legtöbb, korábban előállított és felhasznált IF biológiai lebontása szinte lehetetlen, ami tovább növeli a környezetre gyakorolt esetleges káros hatásukat [Garcia, 2005]. Éppen ezért, az elmúlt években egyre inkább előtérbe került a biológiailag lebontható, nem toxikus IF-ok szintézise és alkalmazása [Stasiewicz, 2008].
1.1.3. Ionos folyadékok lehetséges felhasználási területei
Amint azt az 1.3. ábra is mutatja, az IF-ok lehetséges felhasználási területe legalább olyan sokrétű, mint a számtalan anionból és kationból felépülő szerkezetük, színük és egyéb fizikai-kémiai tulajdonságaik. Elsősorban gyúlékony, toxikus szerves oldószerek kiváltására alkalmazzák és “zöld oldószer”-ként emlegetik őket [Mutelet, 2006], mivel alacsony gőznyomással rendelkeznek [Berthod, 2008] így többek között könnyen regenerálhatók, nem gyúlékonyak [Wasserscheid, 2007], továbbá a legtöbb szerves és
szervetlen anyag jól oldódik bennük, a megfelelő ionok kombinációját kiválasztva pedig biológiailag lebontható, környezetbarát vegyületek lehetnek [Park, 2003].
1.3. ábra: Ionos folyadékok lehetséges alkalmazási területei [Plechkova, 2008]
A néhány ismert ipari alkalmazást - aminek száma növekvő tendenciát mutat - leszámítva azonban az IF-ok használata még csak kísérleti fázisban van, illetve laboratóriumi méretre korlátozódik [Olivier-Bourbigou, 2010]. Első, az indulás után azonnal nyilvánosságra hozott ipari alkalmazásukat a BASF cég kezdte meg 2003-ban BASIL® (BASIL = Biphasic Acid Scavenging utilizing Ionic Liquids) eljárásában [Tundo, 2007], ahol alkoxi-fenil-foszfin fotoiniciátor prekurzor előállításához használt, a folyamat során nehezen kezelhető és szeparálható sűrű oldhatatlan masszát, trietil- ammónium-kloridot képező trietilamin oldószer kiváltására használták. Az 1-metil imidazolium IF a reakcióban 1-metil imidazolium-kloriddá alakult, ami külön fázist képezve könnyen eltávolítható az elegyből, lehetővé téve ezzel kevesebb hulladék keletkezését, valamint kisebb reaktortérfogat alkalmazását [Maase, 2003]. A BASF cég ezen kívül jelenleg azeotrópok megtöréséhez, foszgén helyettesítésére, cellulóz feloldására [Plechkova, 2008] és alumínium bevonatokhoz használ IF-okat [Bukowski, 2002].
A Degussa cég hidroszililáláshoz, lítium-ion akkumulátorok előállításához, festék adalékként [Hoff, 2004] és erősen reaktív gázok tárolására használ IF-okat [Tempel, 2006]. Az IoLiTec elsősorban IF-ok előállításával foglalkozik, viszont érdekelt azok élelmiszer- és gyógyszer analítikában, valamint antisztatikus tisztítószerként történő
felhasználásukban is [Plechkova, 2008]. Továbbá a Linde cég gáz kompresszióhoz [Adlerand, 2006], a British Petrol [Keim, 2000], ExxonMobil [Saleh, 2000], Chevron [Hope, 2006], PetroChina [Liu, 2004] és EliLilly [Schmid, 2004] pedig szerves katalítikus reakciók oldószereként és/vagy katalizátoraként alkalmaznak jelenleg IF- okat.
1.2. Membránszeparáció
A membránszeparáció legfontosabb, nélkülözhetetlen eleme kétség kívül maga a membrán, ami az 1985-ben nemzetközileg elfogadott nomenklatúra és definició szerint permszelektív gát két fázis között. Ez egyrészt azt jelenti, hogy a membrán egyszerre permeábilis, vagyis átjárható (bizonyos komponensek képesek átjutni rajta), és szelektív, így szeparációra alkalmas. Másrészt mindenképpen akadályt, ellenállást jelent a transzport lejátszódásánál [Bélafiné, 2002].
1.4. ábra: A membránszeparáció elvi sémája
A membrános műveletek azon az elven működnek, hogy a membrán két részre osztja a betáplált anyagáramot, a koncentrátum, vagy retentát áramra és a permeátum áramra (1.4. ábra), ami lehetővé teszi az anyagáram különböző komponenseinek egymástól való elválasztását.
Az elválasztás alapja tehát a molekulák membránon keresztül kialakuló passzív transzportjának sebességbeli különbsége. A transzport minden esetben valamilyen hajtóerő, azaz kémiai potenciálkülönbség következtében játszódik le, ami lehet
nyomáskülönbség, koncentrációkülönbség, elektromos potenciálkülönbség vagy hőmérsékletkülönbség [Mulder, 1996].
A membránok teljesítményének jellemzésére használt két legfontosabb paraméter a permeabilitás és a szelektivitás. A permeabilitás, P a membrán áteresztőképességéről ad információt és nem más, mint a membránvastagság és hajtóerő által normalizált fluxus [Yampolskii, 2006]. A szelektivitás, α a membrán képessége arra, hogy a komponenseket egymástól elválassza és ideális esetben a gyorsabb és a lassabb komponens permeabilitásának a hányadosaként adható meg [Strathmann, 2006].
1.2.1. Membrános műveletek, membránok rövid története
A membránszeparáció és az ozmózis (két egymással érintkező, kémiai potenciálkülönbséggel rendelkező oldat között fellépő kiegyenlítődési folyamat, ami során az oldott anyag kémiai potenciálja a töményebb oldatban csökken, a kisebb koncentrációjú oldatban pedig megnő) első vizsgálata Nollet nevéhez fűződik, aki a XVIII. század közepén fedezte fel, hogy a disznó húgyhólyagja, melynek egyik oldala víz-etanol oldattal, a másik pedig tiszta vízzel érintkezett, az etanolt az oldatból a vízzel érintkező oldalra engedte át [Nollet, 1752].
Az első mesterséges, vas-cianid bevonatú vékony porcelán membránt Traube készítette az 1800-as évek közepén [Traube, 1867]. Ebben az időben indult meg a már korábban felismert ozmotikus jelenség és a membránokon át fellépő anyagtranszport vizsgálata is. Az elméleti alapok lefektetésében fontos szerepet játszott Fick, aki a folyadékokban fellépő diffúziót a koncentráció gradiens függvényeként értelmezte [Fick, 1855], továbbá van t’Hoff, aki termodinamikai szempontból adott magyarázatot az ozmotikus nyomásra [van’t Hoff, 1887], valamint Nernst és Planck, akik bevezették a koncentráció- és elektromos potenciálkülönbség, mint hajtóerő hatására az elektrolitokban fellépő fluxus kiszámítására alkalmas egyenleteket [Nernst, 1888;
Planck, 1890]. Donnan membrán-egyensúlyra és -potenciálra vonatkozó kísérleteinek köszönhetően a XX. század elejére a membrántudomány legtöbb alapjelenségére kielégítő magyarázatot találtak, és elméleti értelmezésük is megtörtént [Donnan, 1911].
A szintetikus membránok előállítási módszerének kidolgozása Bechhold nevéhez fűződik, aki jéghideg ecetsavban szűrőpapírt impregnált nitrocellulóz oldattal [Bechhold, 1908]. Ezzel a felfedezéssel a membrántudomány egy új szakaszába lépett, hiszen az ilyen módon készített membránok nemcsak bármikor a megfelelő
pontossággal reprodukálhatóak voltak, de a nitrocellulóz és az ecetsav mennyiségének változtatásával lehetőség nyílt különböző tulajdonságú membránok előállítására is [Strathmann, 2006].
Az 1950-es évektől, a szintetikus polimer membránok elterjedésével, amelyek specifikus transzport tulajdonságokkal, kiváló mechanikai szilárdsággal és hőstabilitással rendelkeztek egyre inkább előtérbe került a membránok ipari alkalmazása. Nagy áttörést jelentett a cellulóz-acetát alapú membránok kifejlesztése, amikkel megvalósíthatóvá vált a tengervíz sótalanítása [Reid, 1959]. Az újabb és újabb fajta szintetikus polimer (poliamid, poliszulfon, polietilén, stb.) membránok megjelenése, a membránmodulok kifejlesztése, valamint a méretnövelési problémák megoldása egyre bővítette a membránok ipari alkalmazásának lehetőségeit. Ennek eredményeként a membrános világpiac 2006-ban 5 milliárd USD nagyságrendű volt és azóta is folyamatosan növekszik [Ulbricht, 2006].
1.2.2. Membrános műveletek jellemzése
A membrános műveletek pontos jellemzése, az elválasztási technológiákon belül betöltött szerepének és fontosságának meghatározása folyamatos fejlődésük és multidiszciplináris karakterük miatt meglehetősen bonyolult feladat.
Mindenképpen elmondható azonban, hogy a hagyományos elválasztási technikákhoz képest, mint például desztilláció, ab/adszorpció, extrakció [Göttlicher, 1997], számos előnnyel és esetenként ugyanennyi hátránnyal is rendelkeznek, amiket a teljesség igénye nélkül a következőkben foglaltam össze;
Előnyök
- egyszerű, kompakt felépítés [Ito, 2001]
- egyszerű működtetés [Stern, 1994]
- egyszerű méretnövelés és csökkentés [Atchariyawut, 2006]
- nagy energiahatékonyság [Acharya, 2008]
- jobb minőségű termékek nyerhetők [Jönsson, 1999]
- könnyen csatlakoztatható más műveleti egységekhez [Wang, 2005]
- szobahőmérsékleten, alacsony nyomáson működtethető [Porter, 1990]
- környezetterhelése kicsi (nincs jelentős mennyiségű veszélyes anyag felhasználás) [Soni, 2009]
Hátrányok
- membráneltömődés (fouling) [Mulder, 1996]
- anyagok előkezelést igényelhetnek [Howell, 1990]
- magas beruházási és üzemeltetési költség [Yan, 2008]
- nem megfelelő mechanikai szilárdság [Li, 1992]
- hosszútávú megbízhatósága még nem bizonyított [Baker, 1991]
- tervezettől eltérő üzemeltetés könnyen károsíthatja [Strathmann, 2006]
- kicsi a szelektivitás vagy a fluxus [Bélafiné, 2002]
A membrános műveletek sokféle szempont szerint csoportosíthatók (elválasztás célja, hajtóerő, elválasztás elve, stb.), leggyakrabban azonban az elválasztás hajtóereje alapján szokás rendszerezni őket (1.3. táblázat) [Matsuura, 1994; Kocherginsky, 2007;
Nath, 2008].
1.3. táblázat: A membrános műveletek csoportosítása
Hajtóerő Elválasztás elve Alkalmazási területek gyümölcslevek, sörök szűrése
mikroszűrés
szennyvíztisztítás tejpor előállítása Ultraszűrés
emulziók szeparálása
gyümölcslé, tej, kávé koncentrálása Nanoszűrés
oldószertisztítás tengervíz sótalanítása Nyomáskülönbség
fordított ozmózis
ultratiszta víz előállítása hemodialízis
Dialízis
alkoholmentes sör előállítása aromaanyagok koncentrálása pervaporáció
szerves szennyezők kinyerése H2S eltávolítása földgázból gázszeparáció
NOx, SO2 eltávolítása füstgázból gőzpermeáció alkohol vízmentesítése
kationok kinyerése vivőanyagos transzport
szerves anyagok elválasztása Koncentráció/aktivitás
különbség
membrán kontaktor növényvédő-szerek kinyerése ivóvíz nitrát-mentesítése Elektromos
potenciálkülönbség elektrodialízis
kazántápvíz előállítása sótalanítás
membrán desztilláció
savas oldatok töményítése Hőmérsékletkülönbség
membrán kontaktor telített/telítetlen szénhidrogének elválasztása
1.2.3. Gázszeparáció
Az első feljegyzett membrános gázszeparációs kísérletet Thomas Graham végezte 1829-ben [Yampolskii, 2006], és már ekkor kijelentette, hogy a levegő természetes gumi membrán használatával oxigénben dúsítható [Stern, 1994], illetve, hogy egy gázelegy pórusos membránnal szétválasztható a gázok eltérő molekulasúlya alapján [Graham, 1833]. Az ő nevéhez fűződik továbbá a pórusmentes membránnal végrehajtott gázszeparációt jellemző oldódásos-diffúziós folyamat egyenletének felírása is [Kawai, 1997].
A polimer membránok gázszeparációs képességére nem sokkal később, 1831-ben Mitchell által derült fény, aki hidrogén – szén-dioxid gázelegyet választott szét és megállapította, hogy az egyes gázok különböző sebességgel permeálódnak [Kohl, 1997].
Az 1910-es években a membrános gázszeparáció nagy méretű megvalósítására irányuló kísérletek sajnálatos módon azzal a keserű tapasztalattal zárultak, hogy ami a laboratóriumban sikeresen végrehajtható, az nem biztos, hogy ipari méretben is gazdaságosan kivitelezhető [Koros, 1993].
A kezdeti kudarcokat azonban, az 1970-es években a Loeb és Sourirajan által 1960- ban kifejlesztett nagy szelektivitással és permeabilitással rendelkező aszimmetrikus cellulóz-acetát membránnak köszönhetően [Stern, 1994], számos sikeres ipari alkalmazás követte [Car, 2008], mint például hidrogén – szén-monoxid arány beállítása szintézisgázban [Lu, 2007], vagy hidrogén elválasztása ammóniagyártás során [Pandey, 2001].
Az 1980-as években virágzásnak indult membrán gyártó cégek (Dow, DuPont, Air Products, Allied Signal, Ube, stb.) lehetővé tették a membránok kereskedelmi forgalomba hozatalát, aminek hatására fellendült a membrános gázszeparációra irányuló ipari és akadémiai kutatás, ami azóta is töretlen erővel folyik [Robeson, 2008]. Nem véletlen, hogy napjaink egyik leggyorsabban növekvő szeparációs technikája nem más, mint a membrános gázszeparáció [Ismail, 2008], amit jól mutat a membrános gázszeparáció néhány jelenlegi, ipari és lehetséges, intenzíven kutatott alkalmazási területét tartalmazó 1.4. és 1.5. táblázat is.
1.4. táblázat: Membrános gázszeparáció jelenlegi, ipari alkalmazási területei Elválasztandó
komponensek Alkalmazási terület
H2/NH3 át nem alakult H2 visszanyerése ammóniagyártás során [Keshavarz, 2008]
H2/N2 át nem alakult H2 visszanyerése ammóniagyártás során [Meindersma, 1996]
H2/CO szintézisgáz H2 tartalmának beállítása, metanol- és ammóniagyártás során [Tessendorf, 1999]
N2/CH4, CO2, H2S földgáz N2 tartalmának csökkentése [Lokhandwala, 2010]
N2/O2 N2 előállítás [Ulbricht, 2006]
O2 dús (orvosi) levegő előállítás [Koros, 1993]
H2O/levegő levegő dehidratálás [Hinchliffe & Porter, 2000]
H2O/szénhidrogének szénhidrogén-, földgáz dehidratálás [Strathmann, 2006]
H2O/NH3 ammónia visszanyerés [Strathmann, 2006]
szénhidrogének/levegő légszennyezés csökkentés
szerves oldószer, monomer visszanyerés [Car, 2008]
CO2/CH4, H2S, O2, N2, nemesgázok
földgáztisztítás, földgáz koncentrálás [Robeson, 1994]
hulladéklerakón képződő gáz koncentrálása [Peer, 2008]
1.5. táblázat: Membrános gázszeparáció lehetséges alkalmazási területei Elválasztandó
komponensek Kutatott felhasználási terület
CO2/füstgáz füstgáz CO2 tartalmának csökkentése [Figueroa, 2008]
CO2/ gázáram antropogén CO2 kibocsátás csökkentése [Paul, 2008]
CO2/ CH4, H2S, O2, N2,
nemesgázok földgáztisztítás, földgáz koncentrálás [Carlisle, 2010]
CO2/N2/H2/NH3/H2S/CH4 hulladéklerakón képződő gáz koncentrálása [Stern, 1994]
biogáz koncentrálás [Harasimowicz, 2007]
CO2/gázáram CO2 eltávolítás élelmiszer csomagolásnál [Husken, 2010]
H2/szénhidrogének H2 visszanyerés kőolajfinomítókban [Wang, 2007]
H2/szintézisgáz H2 előállítás (kőolajfinomításhoz) [Yang, 2008]
H2/CO2 tüzelőanyag cellához szükséges H2 koncentrálása [Yegani, 2007]
N2/O2 N2, O2 dús levegő előállítása [Arora, 2007]
N2/O2, CO2, NOx, SOx N2 kinyerése (csővezeték tisztításra) füstgázból [Feng, 2000]
H2O/levegő levegő dehidratálása [Peter, 2009]
H2O/földgáz földgáz dehidratálása, szárítása [Baker, 2001]
alkán/olefin alkán/olefin elegyek olcsó elválasztása [Baker, 2001]
VOC/levegő légszennyezés csökkentés [Kumar, 2008]
VOC/VOC vegyipari szerves gőz/gáz áramok szeparációja [Jiang, 2008]
N2/CO2/CO/Ar/HCN... cigarettafüst analízis [Jönsson, 2000]
A gázszeparációra alkalmas membránok anyaguk szerint lehetnek természetesek (pl.
sejtfal, liposzóma) és szintetikusak, ez utóbbin belül pedig szervetlenek (pl. kerámia, fém, üveg) és szervesek (polimer) [Bélafiné, 2002].
Számos hátrányuk ellenére a legnagyobb kereskedelmi sikert, a membrános piacot több, mint két évtizede uraló, polimer membránok mondhatják magukénak [Shao, 2009]. Ennek oka, hogy alacsony áruk [Acharya, 2008], könnyű gyárthatóságuk és hosszú élettartamuk [Sadrzadeh, 2009] mellett nemcsak kiváló mechanikai-, kémiai- és hőstabilitással, valamint nagy permeabilitás és szelektivitás értékekkel rendelkeznek [Dhingra, 1998], hanem az intenzív kutatásuknak köszönhetően számos fajtájuk létezik, ami lehetővé teszi széleskörű alkalmazásukat is [Hu, 2003].
1.2.3.1. Gázszeparáció polimer membránokkal
A gázszeparáció hajtóereje alapvetően a koncentrációkülönbség, azonban fontos szerepe van a membrán két oldala között fellépő nyomáskülönbségnek is.
Mechanizmusa szerint a gázok elválasztására használt polimer membránok két csoportra oszthatók, a pórusos és a pórusmentes membránokra.
A pórusos membránok jól meghatározott pórusszerkezettel rendelkeznek, ami az előállításuktól függően lehet sűrűn vagy kevésbé összekötött, illetve nagy vagy kis tortuozitású [Scott, 1996].
A pórusokon át fellépő gáztranszport és gázszeparáció az alábbi (sok esetben egyazon időben, egymás mellett párhuzamosan lejátszódó) mechanizmusokon keresztül valósulhat meg:
Felületi diffúzió: A gázmolekulák affinitása nagy a membránnal szemben így adszorbeálódnak a pórusfalon, az erősen eltérő mértékben adszorbeálódó gázok pedig elválaszthatók egymástól.
Mikropórusos diffúzió: Olyan felületi diffúzióként értelmezhető, ahol az elválasztandó molekulák valamelyikének átmérője, dg,i és a pórusátmérő, d egy nagyságrendben van.
Az elválasztás hatékonysága itt elsősorban a molekulák átmérőjétől, alakjától, valamint a pórusfal és a gázmolekulák közötti kölcsönhatásoktól függ [Javaid, 2005].
Molekuláris diffúzió: A gázmolekulák közepes szabad úthossza, λ kisebb, mint a pórusok átmérője, a diffúzió főleg a molekulák közti ütközések révén alakul ki.
Amennyiben λ sokkal kisebb, mint d, a membrán két oldala között fellépő
nyomáskülönbség hatására szeparáció nélküli viszkózus áramlás jön létre a Poiseuille egyenletnek megfelelően [Beuscher, 1998].
Knudsen diffúzió: A gázmolekulák közepes szabad úthossza nagyobb, mint a pórusok átmérője, a diffúzió kialakulásáért a molekulák és a pórusfal közti ütközések a felelősek, mivel a molekulák sokkal nagyobb valószínűséggel ütköznek a pórusfallal, mint egymással [Javaid, 2005].
1.5. ábra: A Knudsen diffúzió elve
A gázok egymástól való elválasztásában az 1.5. ábrán [Baker, 2004] szemléltetett Knudsen diffúziónak van a legnagyobb szerepe, aminek árama az 1.5. egyenlettel írható le [Mason, 1983].
π π RTl
p D Ji r kΔ
= 2 (1.5.)
ahol Ji – i komponens fluxusa [mol/s]
r – pórus sugara [m]
l – membránvastagság [m]
π – 3,14
Δp – nyomáskülönbség [Pa]
R – gázállandó [8,314 J/molK]
T – hőmérséklet [K]
τ – tortuozitás [m/m], a pórus valódi hosszának és a membrán vastagságának arányát adja meg
Dk – Knudsen diffúziós koefficiens [m2/s], aminek értékét szabályos henger alakú pórust feltételezve az alábbi módon szokták megadni:
w
k M
r RT
D π
66 8 ,
=0 (1.6.)
ahol Mw – moláris tömeg [g/mol] [Knudsen, 1909].
Az egyenletek jól mutatják, hogy adott membrán és nyomáskülönbség esetén az áramlás fordítottan arányos a molekula négyzetgyökével, így végsősoron két gáz szeparációját, vagyis a szelektivitást a két molekulatömeg négyzetgyökének aránya határozza meg [Baker, 2004]. Ez például CO2 és H2 gázpárra nézve azt jelenti, hogy a szelektivitás ideális esetben 441/2/21/2 = 4,7, ami igen alacsony érték.
Sokkal magasabb ideális szelektivitás értékeket érhetünk el pórusmentes membránok alkalmazásakor. A pórusmentes membránokon keresztül fellépő gáztranszportot és gázszeparációs mechanizmust, amit leggyakrabban oldódásos- diffúziónak neveznek, az 1.6. ábra mutatja be [Baker, 2004].
A gázmolekulák transzportja ebben az esetben három lépésben játszódik le, ezek:
1. gázmolekulák szorpciója a membránfelületen, a membrán nagyobb nyomású oldalán 2. gázmolekulák diffúziója a membránon keresztül a koncentrációgradiens mentén 3. gázmolekulák deszorpciója a membránfelületről, a membrán kisebb nyomású oldalán
A második, sebességmeghatározó lépés során a gázmolekulák a polimer termikus mozgása hatására a polimerláncok között nagyon rövid ideig megjelenő résekben, azaz szabad térfogatelemekben véletlenszerű mozgással haladnak előre [Freeman, 2004].
1.6. ábra: Az oldódásos-diffúzió elve
Az így kialakult gázáram legegyszerűbben Fick I. törvényével írható le [Tremblay, 2006] ami a fluxus, J és a hajtóerő,
x C
∂
∂ (hely szerinti koncentrációváltozást kifejező derivált a membrán keresztmetszetén) között teremt kapcsolatot a diffúziós koefficiens, D segítségével:
x D C
J ∂
− ∂
= (1.7.)
Állandósult állapotban, amikor a gáz áramlási sebessége és koncentrációja állandó lesz a membrán egész felülete mentén, az 1.7. egyenlet a membránvastagságra integrálható:
l C DC
J = B − P (1.8.)
ahol CB – gázkoncentráció a membrán nagyobb nyomású (betáplálás) oldalán [mol/cm3]
CP – gázkoncentráció a membrán kisebb nyomású (permeátum) oldalán [mol/cm3] l – membránvastagság [m] [Baker, 2004].
Alacsony gáznyomás mellett i komponens membránbeli koncentrációját a Henry törvény alapján felírt alábbi egyenlet adja meg, ahol Si a gáz oldhatósági állandója a
membránban [Osada, 1992]: Ci =Sipi (1.9.)
Az 1.9. egyenletet az 1.8. egyenletbe behelyettesítve kapjuk i komponens fluxusát:
l p S p
D
Ji i i i,B − i,P
= (1.10)
Ez alapján megállapítható, hogy a pórusmentes membránon keresztül fellépő anyagtranszportot és a gázkomponensek egymástól való elválasztását a molekulák diffúziója és oldódása együttesen határozza meg, míg a D kinetikai, addig az S termodinamikai faktorként értelmezhető [Hu, 2003].
Ha elfogadjuk azt a feltételezést, hogy D és S állandók függetlenek a nyomástól és a gázkoncentrációtól, azaz adott hőmérsékleten állandó az értékük [Dhingra, 1998], akkor egy új paramétert, a permeabilitási állandót (röviden permeabilitást), P vezethetünk be, amit a diffúziós és az oldhatósági állandó szorzataként kapunk: P=DS (1.11.) Az i komponens fluxusa így:
l P p l
p P p
Ji i iB iP i Δ
− =
= , , (1.12.)
Az egyenletből világosan kitűnik, hogy a gázkomponensek fluxusa egyenesen arányos a membrán két oldala között fellépő nyomáskülönbséggel és fordítottan arányos a membrán vastagságával [Bélafiné, 2002].
A permeabilitás tehát az adott vastagságú membránon, adott hajtóerő hatására egységnyi membránfelületen időegység alatt átjutó, azaz permeálódó gáz mennyiségét adja meg, mértékegysége pedig:
sHgcm cm
cm STP cm
2
3( )
Egyre inkább elterjedt azonban a Barrer mértékegység használata, ami:
sHgcm cm
cm STP Barrer cm2
3
10 ( )
1 10
= −
Amennyiben pontos ismerete hiányában nem vesszük figyelembe a membrán vastagságát, akkor az alkalmazandó mértékegység a GPU (Gas Permeation Unit, gázpermeációs egység) [Búcsú, 2008]:
sHgcm cm
STP GPU cm2
3
6 ( )
1 10
= −
Abban az esetben, amikor feltételezzük, hogy az egyes gázkomponensek nem befolyásolják egymás permeációját (ami a gyakorlatban leginkább csak a tiszta gázokat tartalmazó rendszerekre igaz) a már korábban említett ideális szelektivitás, α* aminek értéke definició szerint egynél mindig nagyobb, i és j kétkomponensű gázelegyre, az egyes gázok permeabilitásából az alábbi képlettel számolható [El-Azzami, 2008]:
j i j i j j i
i S
S D D P
P =
=
*
α / (1.13.)
Az ideális (látszólagos) szelektivitás tehát a diffúziós szelektivitás,
j i
D
D és az
oldhatósági szelektivitás,
j i
S
S szorzataként is megadható [Stern, 1994]. Ez előbbi a
kisebb, mobilisabb gázmolekuláknak kedvez, mint például a H2, az utóbbi pedig a nagyobb oldhatósággal rendelkező, jobban kondenzálható gázoknak, mint például a CO2 [Yampolskii, 2006].
A valóságban azonban egy membrán szelektivitása mindig alacsonyabb az így kapott értéknél, hiszen nemcsak egymásra hatnak az egyes gázok, de kölcsönhatásba lépve a membránnal megváltoztathatják annak gázszeparációs tulajdonságait is, például plaszticizáció révén [Koros, 1993].
Ha egy gáz plaszticizálja a membránt, azaz megnöveli a polimer láncok mobilitását, aminek következtében több szabadtérfogat kialakulását teszi lehetővé, akkor a diffúzió növekedés hatására megnő a permeabilitás is, ami a szelektivitás csökkenését eredményezi. Ez leggyakrabban nagy nyomású CO2 esetében fordul elő [Car, 2008].
A látszólagos szelektivitás értéke nemcsak a valódi szelektivitástól tér el, de adott membrán esetében a nyomás és a hőmérséklet hatására is megváltozhat. Nagyobb betáplálás oldali nyomás, illetve az ebből adódó nagyobb nyomáskülönbség például a
permeabilitás növekedését és a szelektivitás csökkenését idézi általában elő [Koros, 1993].
A magasabb hőmérséklethez pedig nagyobb diffuzivitás és kisebb oldhatóság tartozik, így olyan gázok esetében, amik permeációja elsősorban a diffúziótól függ a permeabilitás nő a szelektivitás párhuzamos csökkenésével. Amennyiben a permeációt az oldhatóság határozza meg, úgy magasabb hőmérséklethez alacsonyabb permeabilitás és esetenként nagyobb szelektivitás fog tartozni [Koros, 1993].
A kevert gázokat tartalmazó rendszereket jellemző "valódi" szelektivitást az alábbi
egyenlet adja:
j B i B
j P i P
j i
C C
C C
, ,
, ,
/ =
α (1.14.)
ahol CP, i és CP, j – a két gázkomponens koncentrációja a permeátumban
CB, i és CB, j – a két gázkomponens koncentrációja a betáplálásban [Koros, 1993].
Az ideális gázszeparációs membrán tehát az, ami nagy permeabilitással és szelektivitással rendelkezik lehetővé téve nagy mennyiségű gázelegyek hatékony elválasztását. A polimer membránok legnagyobb hátránya azonban éppen az, hogy a két legfontosabb gázszeparációs tulajdonságuk között fordított arányosság figyelhető meg, azaz nagy szelektivitáshoz alacsonyabb, míg kis szelektivitáshoz magasabb permeabilitás értékek tartoznak [Robeson, 1991].
Ennek a jelenségnek az intenzív tanulmányozása Robeson nevéhez fűződik, aki a gázszeparációra használt polimer membránok permeabilitását és látszólagos szelektivitását vizsgálta a leggyakrabban elválasztandó kétkomponensű gázelegyek;
O2/N2, CO2/CH4, H2/N2, H2/CO2, H2/CH4, H2/CO, He/N2, He/H2 és He/CH4 esetében. A látszólagos szelektivitás értékeknek a gyorsabban permeálódó gázkomponens permeabilitás értékeinek függvényében logaritmikus koordináta rendszerben ábrázolva megállapította, hogy a polimer membránok gázszeparációs teljesítménye egy úgynevezett felsőhatárral („upper bound”) rendelkezik, ami az alábbi egyenlettel írható le [Robeson, 2009]: Pi =kuαin,uj (1.15.)
ahol nu – felsőhatár egyenes meredeksége ku – első tényező, ami αi, j=1 esetén, ku=Pi
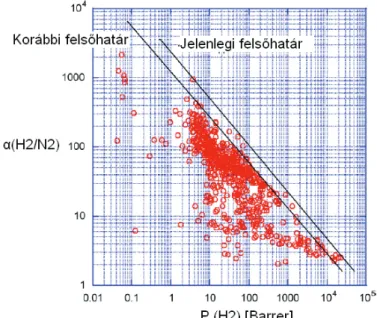
A Robeson féle ábrázolásmód nemcsak az egyes membránok teljesítményének összehasonlítására alkalmas, de ahogyan a H2/N2 gázpárra vonatkozó 1.7. ábrán is látható, igen jól szemlélteti azt is, hogy a membránok fejlesztésével, gázszeparációs
tulajdonságaik javulásával hogyan tolódik ki a felsőhatár egyenese a meredekség változása nélkül [Robeson, 2008].
1.7. ábra: Polimer membránok felsőhatár egyenesei H2/N2 gázpárra
A gazdaságos ipari felhasználás szempontjából a végső cél természetesen olyan membránok fejlesztése, amik a mindenkori felsőhatárt meghaladó értékekkel rendelkeznek, mint például egyes folyadékmembránok, amik permeabilitása és szelektivitása között egyenes arányosság figyelhető meg.
1.2.3.2. Gázszeparáció folyadékmembránokkal
A folyadékmembránok általában a folyadék-folyadék extrakció alapján kialakított, két fázist egymástól elválasztó folyadékfilmként értelmezhetők [Chakrabarty, 2009]. A gázmolekulák transzportja és szeparációja a pórusmentes membránokhoz hasonlóan itt is az oldódásos-diffúziós folyamat szerint játszódik le, így nemcsak nagy szelektivitás, hanem egyúttal nagy permeabilitás értékek is jellemzik ezeket a membránokat, hiszen a gázok diffuzivitása a folyadékokban nagyságrendekkel nagyobb, mint a szilárd polimerekben [Chakma, 1995].
Ahogyan azt az 1.8. ábra szemléletesen bemutatja, a folyadékmembránok kialakításuk szerint két csoportra oszthatók, amiken belül több típust különböztethetünk meg [Krull, 2008].
1.8. ábra: Folyadékmembránok csoportosítása
A támaszték nélküli folyadékmembránok előállítása, amihez általában két egymással nem elegyedő folyadékfázisra van szükség, meglehetősen bonyolult feladat.
Továbbá stabilitási problémákkal rendelkeznek, hiszen míg a tömb folyadékmembrán hosszútávú stabilitása túl kicsi, addig az emulziós folyadékmembrán megbontása és az elválasztandó komponens kinyerése okozhat gondot. Éppen ezért, felhasználásuk nem igazán terjedt el a gyakorlatban sem [Dâas, 2010].
A támasztékkal rendelkező folyadékmembránok közül számos kedvező tulajdonságának köszönhetően az irodalomban főként támasztóréteges folyadékmembránként említett típus tett szert nagy népszerűségre.
A támasztóréteges folyadékmembránok olyan pórusos membránként is felfoghatók, amik pórusaiban kapilláris erők révén rögzített folyadékfilm, általában valamilyen szerves folyadék található [Ravanchi, 2010]. A megfelelő gázszeparációs tulajdonságú, nagy stabilitású membrán kialakításához elengedhetetlenül szükséges egy nagy porozitású, kis pórusméretű, jó mechanikai és kémiai stabilitású, olcsó, kellően vékony és lehetőség szerint hidrofób támasztóréteg, amihez általában polimer membrán alapú lap, cső, spirál tekercs vagy kapilláris membránmodult használnak [Amiri, 2008].
A polivinil-difluorid (PVDF) membrán, aminek kémiai szerkezetét az 1.9. ábra mutatja be [Eisenmenger, 1999], kitűnően alkalmas arra, hogy támasztórétegként használják, hiszen kémiai- és hőstabilitása kiváló [Xua, 2008], továbbá még a legkorrozívabb vegyületek, szerves savak, lúgok, oxidálószerek és halogének kémiai
támadásának, valamint a fizikai és kémiai öregedésnek is képes ellenállni [Vollmert, 1973]. Porozitása igen nagy, pórusai pedig könnyen tölthetők folyadékkal, ezért nagy hatékonysággal alkalmazzák különböző gázok szeparációjára [Atchariyawut, 2006].
Nagy előnye, hogy hidrofób tulajdonsága miatt képes a pórusaiban tartani a szerves-, illetve az egyéb hidrofób fázist, például egyes ionos folyadékokat, ugyanakkor nem engedi át a vízgőzt, aminek következtében alkalmas egylépcsős gáz- és vízgőz szeparációra [Jönsson, 1999].
Hátránya, hogy nincs definiált és egységes pórusmérete. Általában csak pórusméret eloszlással rendelkezik [Wang, 1999].
1.9. ábra: A PVDF kémiai szerkezete Azon túl, hogy a támasztóréteges folyadékmembránok elegáns megoldást kínálnak gázok elválasztására, számtalan előnnyel is rendelkeznek a hagyományos, polimer membránokkal szemben [Jönsson, 1999]. A megfelelő folyadékfázis kiválasztása mellett igen magas permeabilitás [Ilconich, 2007] és szelektivitás értékek [He, 2008]
érhetők el. Drága, jóminőségű folyadékok is használhatók, hiszen ezekből nagyon kis mennyiségre van szükség [Adebayo, 2008], valamint extrakció, sztrippelés és
"oldószer" regenerálás valósítható meg egy lépésben [Poliwoda, 2007]. Továbbá nem szükséges nagy nyomás alkalmazása, és így egyszerűen összeköthetők analítikai műszerekkel [Jönsson, 1999].
Egyetlen hátrányuk, hogy az elválasztás során a szerves folyadék a gázzal, illetve párolgás révén [Teramoto, 2001], valamint a nyomás hatására [Zheng, 2009] távozik a pórusokból. Az oldószerveszteség okozta kis stabilitásuk miatt élettartamuk tehát igen rövid [Figoli, 2001], ami általában a hosszútávú felhasználásuk alatt bekövetkező szignifikáns permeabilitás változásban nyilvánul meg [Hill, 1996].
A stabilitás növelésére tett olyan kísérletek közül, mint például a felületi polimerizáció [He, 2008], a felület beborítása vékony gélréteggel [Kemperman, 1998]
vagy vékony polimerréteggel [Yang, 1997], a folyadékfázis gélesítése [Naim, 2002], illetve ionos folyadékkal történő helyettesítése, ez utóbbi, azaz a támasztóréteges ionos folyadékmembránok előállítása bizonyult a legsikeresebbnek. Ebben az esetben ugyanis nem kell sem a vastagság növekedésből, sem pedig a diffuzivitás csökkenésből származó permeabilitás csökkenéssel számolni.
![1.3. ábra: Ionos folyadékok lehetséges alkalmazási területei [Plechkova, 2008]](https://thumb-eu.123doks.com/thumbv2/9dokorg/874977.47092/16.892.288.672.200.526/ábra-ionos-folyadékok-lehetséges-alkalmazási-területei-plechkova.webp)