PANNON EGYETEM
VEGYÉSZMÉRNÖKI TUDOMÁNYOK ÉS ANYAGTUDOMÁNYOK DOKTORI ISKOLA
OLDÓSZERMÉRNÖKSÉG
ALKALMAZÁSA IZOAMIL-ACETÁT ENZIMATIKUS ELİÁLLÍTÁSÁRA
D
OKTORI(P
H.D.)
ÉRTEKEZÉSK
ÉSZÍTETTE:
F EHÉR E RIKA
OKLEVELES VEGYÉSZ
T
ÉMAVEZETİ:
D R . G UBICZA L ÁSZLÓ
TUDOMÁNYOS FİMUNKATÁRS
PANNON EGYETEM
MŐSZAKI KÉMIAI KUTATÓ INTÉZET
2008
OLDÓSZERMÉRNÖKSÉG ALKALMAZÁSA IZOAMIL-ACETÁT ENZIMATIKUS ELİÁLLÍTÁSÁRA
Értekezés doktori (Ph.D.) fokozat elnyerése érdekében Írta: Fehér Erika, okleveles vegyész
Készült a Pannon Egyetem
Vegyészmérnöki Tudományok és Anyagtudományok Doktori Iskolája keretében
Témavezetı: Dr. Gubicza László
Elfogadásra javaslom (igen / nem) ………
(aláírás)
A jelölt a doktori szigorlaton …... % -ot ért el,
Az értekezést bírálóként elfogadásra javaslom:
Bíráló neve: …... igen /nem ………
(aláírás) Bíráló neve: …... igen /nem ……….
(aláírás)
A jelölt az értekezés nyilvános vitáján …...% - ot ért el.
Veszprém, ……….
a Bíráló Bizottság elnöke
A doktori (Ph.D.) oklevél minısítése…...
………
Az EDT elnöke
KIVONAT
A disszertációban egy természetes aromaanyag, az izoamil-acetát elıállítása kerül bemutatásra ecetsav és izoamil-alkohol szubsztrátokból kiindulva, rögzített Candida antartica lipáz B enzim katalizátor jelenlétében, háromféle nem-konvencionális környezetbarát reakcióközegben.
A szerzı elıször rázatott lombikos kísérletek alapján optimális paraméter tartományt állapított meg, mely a legnagyobb észter hozamot eredményezi (~92%) a legrövidebb idı alatt (5 h). Ezeket az eredményeket alapul véve azonos körülmények között vizsgálta a reakció lefutását ionos folyadékban, oldószermentes rendszerben és szuperkritikus CO2- ban. A két legjobb reakcióközeg közül (ionos folyadékos és oldószermentes) az enzim hıstabilitásának vizsgálata és modellezése alapján a kétfázisú ionos folyadékos rendszert találta a legmegfelelıbbnek a szintézis kivitelezésére enzimstabilitási szempontokat is figyelembe véve.
A reakciót egy kismérető biorektorban is végrehajtotta, majd ezt követıen magasabb hımérsékleten (50 °C) az ionos folyadékot és az enzimet együttesen 10 cikluson keresztül újrahasznosította. E közben sem az ionos folyadék, sem az enzimmennyiségében nem tapasztalt veszteséget, ami a kétfázisú rendszer alkalmazásának köszönhetı.
A reakcióelegy feldolgozására kétféle eljárást dolgozott ki. Az elsıben zeolitos adszorpció és pervaporáció kombinálásával az azeotróp reakcióelegybıl kinyerte a tiszta izoamil-acetátot (96,4 m/m%) és visszakapta a reagálatlan izoamil-alkoholt. Második módszerként az extraktív desztillációt alkalmazta, ahol az azeotróp elegyet különbözı ionos folyadékok felhasználásával bontotta meg.
ABSTRACT
The enzymatic production of a natural flavour, isoamyl acetate, was studied using immobilized Candida antartica lipase B from acetic acid and isoamyl alcohol as substrates in three non-conventional, environmentally friendly media. After finding optimal parameters producing high yield in short time, the reaction was investigated in ionic liquids, in a solvent-free system and in supercritical CO2. Based on initial reaction rate, final yield and enzyme stability, the ionic liquid system was found to be the best medium. In a scale up reaction the enzyme and the ionic liquid were reused 10 times. For purification of isoamyl acetate, the azeotropic mixture was disrupted either by the combination of zeolite adsorption and pervaporation, which in addition also recovered the unreacted alcohol, or by extractive distillation using several ionic liquids as entrainers.
ZUSAMMENFASSUNG
Die enzymatische Synthese des Geschmackstoffs Isoamylacetat wurde mit Hilfe von immobilisierter Lipase B aus Candida antartica, Essigsäure und Isoamylalkohol in nichtkonventionellen, umweltfreundlichen Lösemitteln untersucht. Nach der Optimierung der Reaktionsparameter wurde die Reaktion in ionischen Flüssigkeiten, einem lösemittelfreien System und in superkritischem CO2 untersucht.
Bezogen auf die Reaktionsgeschwindigkeit, Ausbeute und Enzymstabilität erwiesen sich die ionischen Flüssigkeiten als das beste System. In einem deutlich größeren Reaktionsansatz wurden das Enzym und die ionische Flüssigkeit zehnmal wiederverwendet. Isoamylacetat wurde aus der azeotropen Mischung entweder durch eine Kombination aus Zeolithadsorption und Pervaporation oder durch Extraktivdestillation unter Verwendung von ionischen Flüssigkeiten als Entrainer gewonnen.
TARTALOMJEGYZÉK
Bevezetés ...1
1. Irodalmi összefoglaló ... 4
1.1. Környezetbarát reakcióközegek enzimes reakciókra...4
1.1.1. Ionos folyadékok...4
1.1.2. Szuperkritikus folyadékok ...11
1.1.3. Oldószermentes és szilárd-gáz rendszerek ...15
1.1.4. Kombinált technológiák...16
1.2. A Candida antartica lipáz B enzim szerkezete, mőködése...17
1.3. Az izoamil-acetát enzimes elıállítása nem konvencionális közegekben ...20
1.3.1. Az izoamil-acetát enzimes elıállítása szerves oldószerben...20
1.3.2. Az izoamil-acetát enzimes elıállítása oldószermentes közegben...24
1.3.3. Az izoamil-acetát enzimes elıállítása szuperkritikus folyadékban ...26
1.3.4. Az izoamil-acetát enzimes elıállítása ionos folyadékben ...28
1.4. Enzimek stabilitása, inaktivációja...28
1.4.1. Stabilitás szerves oldószerben és ionos folyadékokban...28
1.4.2. Stabilitás szuperkritikus folyadékokban ...29
1.4.3. Újrafelhasználás, kombinált eljárás ...30
1.4.4. Termikus inaktiváció ...31
1.5. Elválasztási technikák a termék kinyerésére ...35
1.5.1. Membrános eljárások...35
1.5.2. Extraktív desztilláció ...37
1.6. Célkitőzés...39
2. Anyagok és módszerek... 40
2.1. Anyagok ...40
2.1.1. Alkalmazott enzim...40
2.1.2. Vegyszerek...40
2.1.3. Ionos folyadékok...41
2.1.4. Membránok ...43
2.2. Analízis...43
2.2.1. Gázkromatográfiás elemzés ...43
2.2.2. Savtartalom meghatározása titrálással ...45
2.2.3. Víztartalom meghatározása...46
2.2.4. Megoszlás vizsgálata ...46
2.3. Kísérleti módszerek ...46
2.3.1. Reakció rázóinkubátorban ...46
2.3.2. Az enzim hıstabilitásának vizsgálata ...47
2.3.3. Ionos folyadékok regenerálása...47
2.4. Kísérleti berendezések ...48
2.4.1. Reakció bioreaktorban, visszaforgatás vizsgálata ...48
2.4.2. Membrános szeparáció ...48
2.4.3. Reakció szuperkritikus szén-dioxidban ...49
2.4.4. Extraktív desztilláció ...50
3. Eredmények ... 51
3.1. Oldószermérnökség ...51
3.1.1 Izoamil-acetát enzimatikus elıállítása ionos folyadékokban...51
3.1.1.1. A megfelelı ionos folyadék kiválasztása...52
3.1.1.2. A szubsztrátok és termékek megoszlásának vizsgálata a két fázis között....54
3.1.1.3. Az enzim-koncentrációjának hatása a reakció lefutására ...55
3.1.1.4. A hımérsékletfüggés vizsgálata, az aktiválási energia meghatározása ...56
3.1.1.5. Alkohol - sav mólarány befolyása a reakcióra...58
3.1.1.6. Alkohol - ionos folyadék térfogatarány vizsgálata ...60
3.1.1.7. Kezdeti víztartalom hatása a reakció lefutására...61
3.1.1.8. Rázatási intenzitás vizsgálata...62
3.1.1.9. A hozam és a kezdeti reakció-sebesség szempontjából optimális paraméterek ionos folyadékos közegben ...64
3.1.2 Izoamil-acetát enzimatikus elıállítása oldószermentes közegben...64
3.1.3 Izoamil-acetát enzimatikus elıállítása szuperkritikus szén-dioxidban és kombinált eljárásban ...66
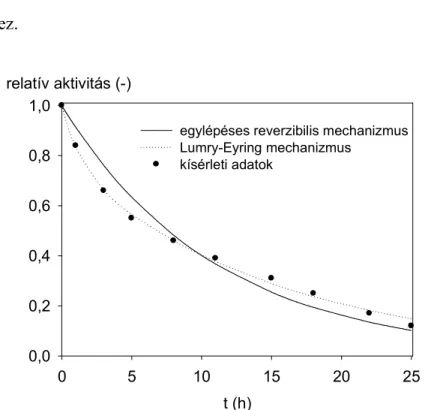
3.1.4. Az enzim hıstabilitásának vizsgálata ...69
3.1.5. A keverési sebesség és a visszaforgatás hatásának vizsgálata...75
3.2. A termék kinyerése ...77
3.2.1. Membrános elválasztás ...77
3.2.2. Extraktív desztilláció ionos folyadékokkal...82
4. Ionos folyadékok jegyzéke... 86
5. Összefoglalás ... 87 6. Irodalomjegyzék ... 90
Tézisek Theses
Publikációk és proceedingek Köszönetnyilvánítás
Bevezetés
Hosszú évtizedeken keresztül az volt a tudományos álláspont, hogy az enzimek csak természetes környezetükben (híg vizes oldatbaban, atmoszférikus nyomáson és közel testhımérsékleten) képesek mőködni. Kilbanov úttörı munkájának köszönhetıen 1986 óta tudjuk, hogy az enzimek szerves oldószerben is kiválóan mőködnek, sıt gyakran még jobban, mint természetes, vizes közegükben [Kilbanov, 1986]. Ebben a környezetben a hımérséklet és a nyomás addig extrémnek tartott értékeket is felvehet.
Ennek köszönhetıen az enzimek felhasználása mind a kutatási szférában, mind az iparban és kereskedelemben évrıl évre növekszik.
A szerves oldószerek alkalmazásával a vízben nem oldható szubsztrátok is felhasználhatóak lettek enzimatikus reakciókhoz, valamint csökkent a nem kívánatos hidrolitikus mellékreakciók száma és könnyebb lett a termék(ek) kinyerése is. 1994-ben jelent meg Halling igen fontos közleménye arról, hogy nem konvencionális közegekben az enzimek hidratáltsági fokát a vízaktivitással lehet meghatározni [Halling, 1994]. Így egy enzim képes mőködni nem poláris közegben (log P > 2), azonban hidrofil szerves oldószerekben (log P < 2) denaturálódik, mert az oldószer elvonja az enzim mikrokörnyezetébıl az aktív forma felvételéhez szükséges monomolekuláris rétegnyi vizet.
Mindamellett tehát, hogy számos szerves oldószer egészségre ártalmas és tőzveszélyes, az oldhatósági skála széles spektrumát (poláris, protikus oldószerek) nyitva hagyták az enzimkatalízis számára. Éppen ezért az elmúlt évtizedek egyik intenzív kutatási területe volt az olyan reakcióközegek keresése, amelyek betöltik az oldhatósági skálán található őrt és emellett környezetbarátok, a szerves oldószerekhez képest kevésbé veszélyesek, valamint ipari eljárásokban is elınyösen alkalmazhatóak.
Ezeknek a kritériumoknak a reakcióközegek két új csoportja felel meg: az ionos- és a szuperkritikus folyadékok.
Az ionos folyadékok tulajdonságai könnyen változtathatóak a kívánt reakció- paramétereinek megfelelıen, az ıket felépítı kationok és anionok variálásával. Ahhoz azonban, hogy a teljes eljárás „zöld” legyen, meg kell oldani a visszaforgatásukat és a termék(ek) szerves oldószer nélküli kinyerését. Ezt nagymértékben megkönnyíti az ionos folyadékok gıznyomásának hiánya, de elınyös eljárás lehet a szuperkritikus folyadékokkal való kombinálásuk is, ahol az ionos folyadékban végbemenı reakció termékét szuperkritikus folyadékkal extraháljuk.
Említésre méltó reakcióközeg még, az egyik szubsztrát feleslegében lejátszódó oldószermentes reakció ill., egy gyorsan fejlıdı, igen ígéretes új terület, a gázfázisú biokonverziót [Cantone, 2007].
Napjainkban növekvı igény mutatkozik a természetes aromák elıállítására, fıképpen az élelmiszeripar, de kisebb mértékben a kozmetikaipar részérıl is. Ezek az aromaanyagok adják a gyümölcsök, zöldségek, főszerek és egyéb növények, állatok kellemes ízét, illatát, színét. Habár kis koncentrációban vannak jelen a gazdarendszerben, de illékonyságuk miatt jelentıs hatást váltanak ki érzékszerveinkben.
Egy adott aroma igen bonyolult összetételő, általában több ezer vegyület összességét jelenti. Ezen anyagok számát azonban le lehet csökkenteni kb. 70÷100-ra, ha csak néhány jellemzı anyagot veszünk figyelembe. Ezen vegyületek többsége döntıen valamilyen alkohol, sav, aldehid vagy észter származék.
Az ember által elıállított aromákat három osztályba sorolhatjuk: mesterséges, természetazonos és természetes aromák. A természetes aromákat megfelelı fizikai (desztillációval, oldószeres kivonással) vagy enzimes illetve mikrobiológiai módszerrel, emberi fogyasztásra alkalmas nyers,- vagy szokásos élelmiszer-technológiai eljárásokkal (pl.: szárítás, pörkölés, fermentálással) nyerik ki a feldolgozott növényi vagy állati eredető anyagokból. A természetazonos aromát vegyi szintézissel vagy olyan elkülönítéssel állítják elı, hogy az így kapott vegyület kémiailag azonos legyen a növényi vagy az állati eredető anyagban természetes tartalomként jelen lévı aromaanyaggal. A mesterséges aromát olyan vegyi szintézissel készítik, amely a növényi vagy állati eredető anyagban természetes tartalomként jelen levı aromaanyagoktól kémiailag eltérı anyagot eredményez [FVM, 2007]. A természetes aromák iránti növekvı kereslet az árukban is megnyilvánul, hiszen eladási áruk tízszerese vagy akár százszorosa is lehet a természetazonos megfelelıjüknek. Például a mesterséges benzil-butirát ára 2007-ben 30 $/kg volt, míg a természetes változata 970
$/kg-ba került. Ugyanezen összegek dekanalra 40 és 365 $/kg, γ-decalaktonra 75 és 3783 $/kg (!), kumarin-aldehidre 30 és 125 $/kg volt [Cruz, 2007].
A rövid szénláncú savakból és alkoholokból álló észterek jelentıs része, gyümölcsökben fellelhetı aromaanyagok komponensei. Így például az etil-acetát, izoamil-acetát, etil-laktát számos gyümölcsben megtalálható, úgymint alma, narancs, banán, barack, szılı stb. Ebbıl következıen a borban is megtalálhatóak, bár koncentrációjuk csökken a bor öregedésével [Plata, 1998]. Az izoamil-acetát a banán aromájának fı alkotóeleme. Széles körben kerül alkalmazásra az élelmiszeripar és a
kozmetikai iparág részérıl, éves felhasználása egy 1989-es közlemény alapján csak az USA-ban mintegy 74000 kg/év volt [Welsh, 1989].
A Mőszaki Kémiai Kutató Intézetben régóta intenzíven vizsgált kutatási terület a természetes aromaanyagok elıállítása. Kezdetben szerves oldószerben állítottak elı különbözı aroma észtereket [Gubicza, 1992; Gubicza, 2000], majd környezetvédelmi megfontolások alapján oldószermentes közegben [Bélafi-Bakó, 2003] és ionos folyadékban is [Fráter, 2008] végeztek vizsgálatokat.
Kutatásaim során egy természetes aroma, az izoamil-acetát, enzimatikus elıállítását tőztem ki célul ecetsav és izoamil-alkohol szubsztrátokból kiindulva. A szintézist különbözı, nem hagyományos, környezetbarát reakcióközegekben kívántam megvizsgálni (ionos- és szuperkritikus folyadék, oldószermentes közeg), majd eljárást kidolgozni a termék kinyerésére.
1. Irodalmi összefoglaló
1.1. Környezetbarát reakcióközegek enzimes reakciókra
1.1.1. Ionos folyadékok
„IONOS FOLYADÉKOK (OLVADT SÓK) DEFINÍCIÓJA: OLYAN ANYAGOK, AMELYEK CSAK IONOKBÓL ÉPÜLNEK FEL, SEMLEGES MOLEKULÁKAT NEM TARTALMAZNAK ÉS ALACSONY
AZ OLVADÁSPONTJUK (ÁLTALÁBAN KEVESEBB, MINT 100°C).”
[HAGIWARA ÉS ITO,2000]
Az ionos folyadékok olyan szerves sók, amelyek alacsony olvadásponttal rendelkeznek és akár 300-400 °C-ig folyékony halmazállapotúak maradnak. Különleges jellemzıjük, hogy nem illékonyak, nem tőzveszélyesek és kiváló a termikus és kémiai stabilitásuk [Yang és Pan, 2005]. Az 1.1.1.a. táblázatban a szerves oldószerek és az ionos folyadékok elemzı összehasonlítását találhatjuk, alátámasztva azt a feltételezést, hogy egy környezetbarát alternatívát jelentenek a hagyományos szerves oldószerekkel szemben.
Táblázat 1.1.1.a.: A szerves oldószerek és az ionos folyadékok összehasonlítása [Plechkova és Seddon, 2008]
TULAJDONSÁG Szerves oldószer Ionos folyadék
SZÁMUK >1000 >1000000
ALKALMAZHATÓSÁG egyfunkciós többfunkciós
KATALITIKUS KÉPESSÉG gyenge gyakori, variálható
KIRALITÁS gyenge gyakori, variálható
GİZNYOMÁS Clausius-Clapeyron egyenlet
alapján
elhanyagolható
GYÚLÉKONYSÁG ált. tőzveszélyes ált. nem tőzveszélyes
SZOLVATÁCIÓ gyengén szolvatál erısen szolvatál
POLARITÁS hagyományos megközelítés kérdéses a megközelítés
VARIÁLHATÓSÁG limitált korlátlan
ÁR olcsó drága, csökkenı
tendencia
VISZKOZITÁS (CP) 0,2÷100 22÷40000
SŐRŐSÉG (G/CM3) 0,6÷1,7 0,8÷3,3
REFRAKTÍV INDEX 1,3÷1,6 1,5÷2,2
Az ionos folyadékokat felépítı anionok és kationok száma igen nagy, ráadásul ezek tetszılegesen kombinálhatóak egymással, így szinte korlátlan számban állíthatóak elı.
Az 1.1.1.a. és 1.1.1.b. ábrákon feltüntettem néhány jellemzı kation és anion típust és
szubsztituálási lehetıségeiket, de korántsem az összest [van Rantwijk és Sheldon, 2007;
Jain, 2005]*.
[NRxH(4-x)] + [SRxH(3-x)] + [PRxH(4-x)] + Li+
N
N R2
R1 +
N R N +
S
R1 R2
R3 R4
+
N N N
R2 R1
R5 R4
+
N O
R4 R3 R2 R1
+
N N R1
R2 R3 R4 R5
+
N
R1 R2
+
1 2 3 4
5
6
7
8
9
10 11
1.1.1.a. ábra: Az ionos folyadékok leggyakoribb kationjai 1. lítium-, 2. ammónium-, 3. szulfónium-, 4. foszfónium, 5. triazolium-, 6. imidazolium-, 7.
pirazolium-, 8. thiazolium-, 9. pirrolidínium-, 10. oxazolium-, 11. piridinium-ionok különbözı mértékben szubsztituálva, ahol Rx lehet: H, CH3(CH2)n- (n:0, 1, 2, 3,…), aril-, stb.
Vízoldható Nem vízoldható
[PF6]-
[(CF3SO2)2N]-
[BR1R2R3R4]-
[CF3(CF2)3SO2]-
[CF3(CF2)3CO2]-
[BF4]- [CF3SO2]-
[N(CN)2]-
[CF3CO2]- [CH3CO2]-
[NO3]- [Al2Cl7]- [AlCl4]- [Cl]- [Br]- 1
2 3 4 5
6 7 8
9 10
11 12 13 14 15
1.1.1.b. ábra: Az ionos folyadékok leggyakoribb anionjai vízoldhatóságuknak megfelelıen csoportosítva
Ennek a nagy számú variálási lehetıségnek köszönhetıen az ionos folyadékok tulajdonsági megfelelıen alakíthatóak, variálhatóak. Ma már arra is van lehetıség, hogy egy feladat elvégzése elıtt különbözı modellezı szoftverek segítségével kiválasszuk, egy adott problémára valószínőleg legmegfelelıbb ionos folyadékok körét [Jork, 2005].
Az ionos folyadékok alkalmazhatóak szerves szintézisekben [Jain, 2005], biokatalízisben [van Rantwijk és Sheldon, 2007], elektrokémiában [Souza, 2003], folyadékkromatográfiában [Poole, 1986], gázkromatográfiában [Armstrong, 1999], kapilláris elektroforézisben [Yanes, 2001], desztillációban [Arlt, 2002] és végül, de nem utolsó sorban folyadék-folyadék extrakcióknál [Marták és Schlosser, 2006]. Újabb nagy, ma már intenzíven vizsgált kutatási terület nyílt meg 2000-ben, amikor az elsı közlemény megjelent ionos folyadékban lejátszódó enzimes reakcióról [Erbeldinger, 2000]. Azóta több kitőnı összefoglalót publikáltak az ionos folyadékok enzimkatalízis területén történı alkalmazásáról [Park és Kazlauskas, 2003; van Rantwijk és Sheldon, 2007]. Nagy elınyük, hogy többszöri alkalommal újra felhasználhatók akár az enzim tisztítása nélkül, mert az enzim az ionos folyadékos fázisban marad, ha kétfázisú rendszerrıl van szó. Ez nagymértékben csökkenti relatív költségüket egy folyamat során. A termékek kinyerése a hagyományos extrakciós, desztillációs technikák mellett szuperkritikus folyadékok ill. membránok alkalmazásával is lehetséges [Gubicza, 2000;
Bélafi-Bakó, 2002; Garcia, 2004].
Mivel mind a kutatásban [Jain, 2005; van Rantwijk és Sheldon, 2007], mind az iparban, széles körben alkalmazzák az ionos folyadékokat [Plechkova és Seddon, 2008], a velük foglalkozó közlemények és szabadalmak száma évrıl-évre növekszik (1.1.1.c.
ábra).
1.1.1.c. ábra: Az ionos folyadékok felhasználásávról megjelent közlemények A publikációk (bal oldal) és szabadalmak száma (jobb oldal) 1998-tól fogva exponenciálisan növekszik [Plechkova és Seddon, 2008].
Széleskörő elterjedésük miatt, egyre több kutatócsoport foglalkozik az ionos folyadékok toxicitásának, bomlásának vizsgálatával [Ngo, 2000; Wasserscheid, 2002;
Swatloski, 2003; Jastorff; 2003; Jastorff; 2005; Pretti; 2006]. Mivel az ionos folyadékok száma nagy variálhatóságuk miatt óriási, ezért nem egyesével, hanem típusokra bontva
tanulmányozták a szerkezetük és a biológiai hatásuk közötti összefüggéseket. Ezen információk alapján következtetéseket vonták le arról, hogy az adott ion-kombináció milyen hatást fejthet ki az élıszervezetekre. Jastorff és munkatársai az alábbi négy csoport szerint vizsgálta az ionos folyadékok toxicitását: (1) a kation mag, (2) a kation alkilláncai, (3) az anion és (4) a metabolitok biológiai hatása [Jastorff; 2005].
Általánosságban elmondható, hogy a vizsgált ionos folyadékok döntı többsége nem bizonyult toxikusnak, kevés kivétel pedig a közepesen toxikus kategóriába sorolható [Jastorff; 2005; Pretti; 2006]. Magas hımérsékleten az ionos folyadékok bomlanak [Ngo, 2000; Wasserscheid, 2002; Swatloski, 2003]. A kationokat tekintve elmondható, hogy az imidazolium sók stabilabbak, mint a tetraalkil-ammónium ionos folyadékok. A vizsgált anionok relatív stabilitása a következı: BF4-
≈ bisz(triflát)-amin > trisz(triflát)- amin ≈ PF6-
≈ AsF6-
> I- ≈ Br- ≈ Cl-. A bomlási hımérséklet értéke az oxigén tartalomtól függ. Nitrogén atmoszféra alatt az ionos folyadékok termikus stabilitása növekedett, valamint az imidazolium győrő H-atomjainak metilezése is fokozza a hımérséklettel szembeni stabilitást [Ngo, 2000].
Az ionos folyadékok növelik az enzim aktivitását, stabilitását és enantioszelektivitását [Yang és Pan, 2005; Jain, 2005; Machado, 2005; Ulbert, 2005;
Lozano, 2005; Okochi, 2007]. Ezen hatások szerkezetvizsgálati tanulmányozása az utóbbi években került elıtérbe. Kezdetben Park és Kazlauskas az ionos folyadékok fehérje stabilizáló képességét a polaritásukkal hozta összefüggésbe [Park és Kazlauskas, 2003], amelyet a Reichardt-polaritási skálával és a H-kötések bázikusságával jellemeztek. A nagy polaritású oldószerek növelik a poláris szubsztrátok oldhatóságát, ami gyorsabb reakcióhoz és a szelektivitás változásához vezet. Az ionos folyadékok és az enzimek közötti kapcsolat azonban ennél bonyolultabbnak tőnik. Számos egyéb tényezı, úgymint az anion nukleofilitása, a H-kötések bázikussága, szennyezık, pH, az enzim-szubsztrát-közeg egésze és immobilizált enzimek esetén a hordozó is erısen befolyásolja az aktivitást és a stabilitást.
Hidrofil ionos folyadékok vizes oldatában az enzim-stabilitása a szervetlen sókhoz hasonlóan a Hofmeister-sorozatot követi, de hidrofób vagy vízmentes hidrofil ionos folyadékokban még bonyolultabbak az összefüggések [Zaho, 2005]. Általában hidrofil ionos folyadékokban a kationok és anionok szerepe a fehérjék és enzimek stabilizálásában azonos, ha van jelen víz. Enzim-stabilitási szempontból hidrofil ionos folyadékok elıállítására a legkedvezıbb a kaotrópikus (gyengén hidratált) kation és kozmotrópikus (erısen hidratált) anion kombinálása. Az ionok kozmotrópikus
sorrendjét megállapíthatjuk a viszkozitási β-koefficiens és számos egyéb paraméter alapján, úgymint hidratációs entrópia, hidratációs térfogat, hıkapacitás, NMR β’- koefficiens vagy ionmobilitás. Hidrofób vagy vízmentes hidrofil ionos folyadékok nem követik a Hofmeister-sorozatot fehérje stabilizálási tulajdonságukban. Három különbözı módon fejtik ki hatásukat: (1) kölcsönhatnak a szubsztrátokkal és/vagy termék(ek)kel, (2) a szerves oldószerekhez hasonlóan elvonják az enzim mikrokörnyezetébıl a vizet és (3) elektrosztatikus kölcsönhatásba lépnek az enzimmel.
Ezeknek a hatásoknak az összessége a meghatározó effektus hidrofób vagy vízmentes ionos folyadékokban.
N N
H
H
H
P F
F F F
F
F
P F F F
F
F PF
F F F
F
F
N N
H
H H H
H
H
H H
H
P F
F F F
F
F
N N
H
H
H
P F
F F F
F
F
N N
H
H H
N N
H
H
H
P F
F F
F
F
N N
H
H H
P F
F F F
F
F
H
H H
+ +
+ -
- -
+ +
+ -
+
- -
-
1.1.1.d. ábra: A [bmim]PF6 ionos folyadék kétdimenziós szerkezete A két- és háromdimenziós szerkezetben egy összefüggı H-kötés hálózat található. Az imidazolium győrő három H-atomja kötést hoz létre a nemkötı elektronpárral rendelkezı PF6-
-ion nagy elektronegativitású F-atomjaival. A kötés létrehozásában fıleg az egyenlítıi F-atomok vesznek részt. Így, ebben az esetben, minden egyes PF6-
- iont három imidazolium-kation vesz körül és vice versa [Fehér, 2007].
Az 1,3-dialkil-imidazolium típusú ionos folyadékoknak erısen rendezett háromdimenziós szerkezetük van, amiben a kationok és anionok kiterjedt hálózatot alkotnak H-kötéseken keresztül [Dupont, 2004]. Ez kétdimenziós monomer egységekre lebontva úgy néz ki, hogy egy imidazolium kationt az ionos folyadék típusától függıen legalább három anion vesz körül és fordítva (1.1.1.d. ábra). A legerısebb H-kötés a győrő 2. pozícióján lévı H-atommal alakul ki, mert a közvetlen szomszédságában lévı N-atomok nagy elektronelszívó képessége itt a legkifejezettebb. Ennek a hatásnak
kevésbé kitett másik két H-atom a 4. és 5. pozícióban, valamint az N-alkil láncok H- atomjai közel azonos savassággal rendelkeznek (1.1.1.e. ábra). A PF6-
-ionnak az egyenlítıi F-atomjai a kedveltek a H-kötés létrehozásában, míg a BF4-
-ionnak a négybıl csak három F-atomja vesz részt a kötések kialakításában.
N N
H4 H5
H H6
H6 H6
H8 H7 +
2
X1
X2 X3 1.1.1.e. ábra: Az imidazolium-kation
szerkezete A legsavasabb H atom a 2.
pozicióban található (pKa=23,0). A H4, H5, H6, H7, H8 atomok által létrehozott H-kötések erıssége gyenge vagy közepes, a H……X kötések hosszúsága nagyobb, mint 2,2 Å. X:
BF4, PF6, CF3SO3, NTf2 [Fehér, 2007].
Röntgen spektroszkópiával imidazolium győrők láncolatát fedezték fel 1,3-dialkil- imidazolium típusú ionos folyadékokban. További vizsgálatok során kiderült, hogy a felszínen az imidazolium-ionok vízszintes orientációban találhatóak, valamint sem az anion, sem a kation nem dúsul a felszínen (1.1.1.f. ábra).
H H H H
H H H H
H H H H
H H H H
H H H H
H H H H
H H H H
H H H H
1.1.1.f. ábra: Visszaszórás spektroszkópiai eredmények az imidazolium-győrők felszíni elhelyezkedésérıl Az imidazolium-győrők lapjukra elrendezıdve, vízszintesen helyezkednek el, így képezve a győrőkbıl és az alkil-csoportokból egy összefüggı apoláris láncolatot a felszínen. Az anion töltéssel rendelkezı részei és a H-kötéssel kapcsolódó kationok befelé orientálódnak. Ezen rendezett felszín létrehozásában Coulomb és van der Waals kölcsönhatások is szerepet játszanak, amelyek az ábrán nincsenek feltüntetve [Fehér, 2007].
Tömeg- és infravörös spektroszkópiával megállapították, hogy a H-kötés erıssége a következıképpen változik az anionoknál: CF3CO2-
> BF4-
> PF6-
> BPh4-
. Szilárd fázisú NMR spektroszkópiával is azt találták, hogy az imidazolium típusú ionos folyadékok nagyon erısen rendezettek. Ez a rendezettség a következı képlettel jellemezhetı:
{[(DAI)x(X)x-n]n+[(DAI)x-n(X)x]n-}n, ahol DAI az 1,3-dialkil-imidazolium-kation és X az anion. Folyadék fázisban is ehhez hasonló szerkezeti összefüggést találtak, az ion-ion és atom-atom távolságok szilárd és folyékony halmazállapotban is hasonlóak voltak. Sıt, még gáz fázisban is kimutatták a fent bemutatott egybefüggı hálózat klasztereit [Dupont, 2004].
1.1.1.g. ábra: Enzimstabilizáció ionos folyadékok H-kötései által létrehozott rendezett struktúrában Az ionos folyadékok körülzárják az enzimet és a körülötte lévı monomolekuláris rétegnyi vizet, így erıs stabilizáló hatást fejtenek ki hı- és egyéb hatásokkal szemben. Az enzimek és bármilyen egyéb makromolekulák csapdába esnek az ionos folyadékok alkotta H-kötés hálóban, létrehozva különbözı poláris és apoláris régiójú nanoszerkezeteket, amelyekben sztérikus és elektorsztatikus kölcsönhatások alakulnak ki [Fehér, 2007].
Lozano és kutatócsoportja szintén vizsgálta az ionos folyadékok szerkezete és funkciója közötti kapcsolatot cirkuláris dikroizmussal és belsı fluoreszcens spektroszkópiával [Lozano, 2005; de Diego, 2005]. Vizsgálataikban a Candida antartica lipáz B (CALB) és az α-kimotripszin enzimeket nagyon erısen stabilizálta az alkalmazott két ionos folyadék (l. részletesebben 1.4. fejezet). A szerkezetvizsgálati
mérések kimutatták, hogy az ionos folyadékok az enzim aktív szerkezetét stabilizálják a H-kötések alkotta hálóval, így védve meg az enzimet a klasszikus termikus
inaktivációtól (1.1.1.g. ábra). A stabilizáció oka fıképp a {[(DAI)x(X)x-n]n+[(DAI)x-n(X)x]n-}n nanostruktúra által létrehozott elektrosztatikus és
sztérikus hatások.
1.1.2. Szuperkritikus folyadékok
Habár a 20. század eleje óta folyamatosan alkalmazzák a szuperkritikus folyadékokat (s.k.F.) az ipari termelésben, alkalmazásuk bonyolultabb szerves molekulák, speciális anyagok szintézisére csak nemrég kezdıdött el. Jóllehet még messze vagyunk attól, hogy megértsük szuperkritikus oldószerek által kiváltott hatásokat, az utóbbi húsz év intenzív kutatásainak köszönhetıen sokat fejlıdött a tudomány ezen területe. A s.k.F.-ok alternatívát jelentenek a folyadék halmazállapotú oldószerekkel szemben, de korántsem alkalmazhatóak az egyszerő helyettesítésükre.
gõz gáz
SF folyadék
szilárd
T (K) p (bar)
100'000
0,1
0 Tc 1000
pc
1.1.2.a. ábra: Szuperkritikus folyadékok fázisdiagramjai Bal oldalon a s.k.F.-ok általános fázisdiagramja széles hımérséklet-tartományban és extrém magas nyomásokon látható. A kritikus és hármas pont vastag pöttyel jelezve. A kritikus pont körüli négyzet a magas kompressziótőrési és hıkapacitású régiót jelzi [Jessop és Leitner, 1999]. A jobb oldalon a CO2 fázisdiagramja található alacsony hımérsékleti és nyomású zónában, a szubkritikus tartományt is jelezve [Cantone és Basso, 2007].
Szuperkritikus anyagok vagy keverékek, definíciójuk szerint, a kritikus nyomásuk és hımérsékletük felett, de a szilárd állapot eléréséhez szükséges nyomás alatt léteznek (1.1.2.a. ábra). A s.k.F.-okat gyakran a folyadék – gáz köztes állapotként jellemzik.
Nem minden tulajdonságukra igaz azonban, hogy az a folyadék- és gázállapot közötti
értéket venne fel. Így például kompressziótőrésük és hıkapacitásuk lényegesen magasabb a szuperkritikus pontban és a körül, mint folyadék- ill. gáz-, vagy akár a szuperkritikus ponttól távoli szuperkritikus állapotban. A kritikus hımérséklethez közeli, de még alatta lévı folyadékokat „szubkritikus folyadékoknak”, míg a kritikus nyomás alatti, de ahhoz közeli gázokat „szubkritikus gázoknak” nevezik [Jessop és Leitner, 1999; Cantone és Basso, 2007].
Az 1.1.2.a. táblázatban a leggyakrabban használt szervetlen és szerves s.k.F.-ok és azok árai vannak feltüntetve. Habár a feltüntetett árak 1998-ból valók, azt azért láthatjuk, hogy a s.k. CO2 és s.k. NH3 a két legolcsóbb anyag, áruk legalább egy, de néhány esetben három nagyságrenddel kisebb a többihez viszonyítva. A tisztaság nagymértékben befolyásolja az árat, mert már alacsony koncentrációjú szennyezıknek is nagy befolyása lehet s.k.F.-ok viselkedésére. Néhány anyagnak, fıleg a magasabb szénatomszámú szénhidrogéneknek az ára nagyon nagy tisztaságban megfizethetetlenül drága, éppen ezért a 1.1.2.a. táblázatban feltüntetett árak változó tisztaságra értendıek.
Táblázat 1.1.2.a.: Néhány közkedvelt szerves és szervetlen s.k.F. és azok árai 1998-ban [Jessop és Leitner, 1999]
NÉV (ÖSSZEGKÉPLET) Ár
($/kg)
NÉV (ÖSSZEGKÉPLET) Ár
($/kg)
argon (Ar) 6a trifluor-metán (CHF3) 125
szén-dioxid (CO2) 3a difluoro-metán (CH2F2) n.a.
hidrogén-klorid (HCl) 20a metán (CH4) 80
hidrogén-bromid (HBr) 50a metanol (CH3OH) 18b
hidrogén-jodid (HI) n.a. etén (C2H2) 16c
víz (H2O) n.a. etán (C2H6) 100
ammónia (NH3) 3a dimetil-éter (C2H6O) 15
dinitrogén-oxid (N2O) 50a etilén-diamin (C2H8N2) 200c
kripton (Kr) 3000a propén (C3H6) 9c
szulfur-hexafluorid (SF6) 50a propán (C3H8) 10c
xenon (Xe) 4000a n-bután (C4H10) 15c
benzin (C6H6) 30b i-bután (C4H10) 15c
n-hexán (C6H14) 300c n-pentán (C5H12) 30c
n.a.: nincs adat
a: 99,99%; b:99,9%; c: 99,5% tisztaság
Miért is alkalmaznak tehát s.k.F.-okat? Mi a motiváló tényezı, fıképp ipari alkalmazásoknál? Erre a kérdésre a válasz, részben az 1.1.2.b. táblázatban található, ahol is a s.k.F.-ok potenciális elınyeit összegezik négy fı kategóriában:
környzetvédelmi, egészségvédelmi és biztonságtechnikai, eljárástechnikai és kémiai elınyök. A környezetvédelmi megfontolások közzé tartozik, hogy habár a CO2 (és sok
más s.k.F. is) üvegházhatású gáz, az eljárás nem növeli a CO2 emissziót, sıt lehetıséget kínál a hulladék CO2 visszaforgatására. A felhasznált CO2 nagy része az ammónia- és hidrogén gyártás mellékterméke, valamint energianövények füstgázaiból történı elválasztására is növekvı számú kísérlet létezik már. A két legfontosabb s.k.F. a H2O és a CO2 nem karcinogén, nem toxikus, nem mutagén, nem gyúlékony és termodinamikailag stabil. Technikai szempontból fontos, hogy sok energia takarítható meg a hagyományos desztillációs eljárással szemben, ha a reakció végén a nyomás csökkentésével az oldószert egyszerően kigázosítjuk a reakcióelegybıl. Másfelıl a gáz összenyomása nagy energiaigényő folyamat. A nagy diffúziós sebesség, az alacsony viszkozitás és a köztes sőrőség érték a s.k.F.-okat különösen alkalmassá teszi folyamatos rendszerben való alkalmazásra. Például gyors reakciók esetén egy kismérető, nagy áramlási sebességgel mőködı reaktor igen elınyös lehet. Éppen ezért a s.k.F.-okat alkalmazó reakciók méretnövelése legtöbbször nem a térfogat növelését jelenti, hanem egy folyamatos rendszer kiépítését.
Táblázat 1.1.2.b.: A s.k.F.-ok alkalmazásának elınyei a hagyományos folyadék halmazállapotú reakcióközegekkel szemben [Jessop és Leitner, 1999]
KATEGÓRIA Elıny Melyik s.k.F.?a
nem járul hozzá a szmoghoz legtöbb nem pusztítja az ózonpajzsot legtöbb nincs akut ökotoxicitása CO2, H2O KÖRNYEZETVÉDELEM
nincs folyékony hulladéka CO2, illékony s.k.F.-ok
nem karcinogén legtöbb
(kivéve benzin)
nem toxikus legtöbb
EGÉSZSÉGVÉDELEM ÉS
BIZTONSÁGTECHNIKA
nem gyúlékony CO2, H2O, N2O, Xe, Kr, CHF3
nincs oldószer maradék CO2, illékony s.k.F.-ok egyszerő, gyors termékkinyerés CO2, illékony s.k.F.-ok
gyors diffúzió mind
alacsony viszkozitás mind
változtatható sőrőség mind
ELJÁRÁSTECHNIKA
olcsó CO2, H2O, NH3, Ar, CxHy
magas oldhatóság gázokkal mind
variálható dielektromos állandó poláris s.k.F.-ok
nagy kompressziótőrés mind
sőrőség fluktuáció mind
gyors diffúzió mind
KÉMIA
váltakozó rácsenergia mind
a: Az 1.1.2.a. táblázatban feltüntetett anyagok közül.
A s.k.F.-ok extrakciójáról és az oldási képességeikrıl sok információ halmozódott már fel, ami megkönnyítheti egy ipari eljárás során fellépı szeparálási és tisztítási problémák megoldását. Például heterogén katalizátorok „in situ” regenerációját végzik s.k.F. extrakcióval, eltávolítva a gázfázisú reakcióból a pórusokat eltömı kátrányt és viaszt. Ezentúl s.k.F.-okkal lehet polimerek molekula tömegét ellenırizni a polimer lánc növekedése során kicsapással, valamint szelektív kicsapással vagy extrakcióval intermedierek izolálhatóak, megakadályozva a további reakciót vagy esetleges bomlást.
Illékonyságuknak köszönhetıen, a drága és energiaigényes szárítási eljárásokat kiküszöbölve, a termékbıl könnyen eltávolíthatóak. A maradékoldószer mentes termékeknek különös fontossága van a kozmetika-, gyógyszer-, élelmiszeriparban és az elektronikában. Kémiai szemszögbıl nézve nagyon fontos, hogy bizonyos reakciók sebességét növelik. Például diffúzió által kontrollált reakciók esetén, gyors diffúziójuk révén még gyorsabbá tehetik a reakciót. Szintén elınyös tulajdonság, hogy nagyon sok gáz s.k.F.-ban kiválóan oldódik. Ez itt is a reakció-sebességének növekedéséhez vezet, ha az oldott gáz koncentrációja a kinetika egyenletben nem nulladrendő. Homogén katalízisben, heterogén katalízisben, ahol szilárd és folyadék fázis közötti anyagtranszport a meghatározó lépés vagy diffúzió limitált enzimkatalíziseknél is jól alkalmazhatók. Végül bizonyos esetekben a s.k.F. közvetlenül részt vehet a reakcióban, mint reagens vagy szubsztrát ill. aktív centrum módosító hatásával. Emellett a s.k.F.- nak hatása lehet egy reakció kémiai-, régió- és sztereoszelektivitására is a hangolható kompresszibilitása, dielektromos állandója és a kémiai reaktivitása által.
Táblázat 1.1.2.c.: Példák a s.k.F.-ok ipari alkalmazására [Jessop és Leitner, 1999]
REAKCIÓ TERMÉK S.K.F. ÁLLAPOT CÉG
oxidáció SCWO* H2O termelés Huntsman
Chemical
polimerizáció LDPE** C2H4 termelés ICI
hidrogénezés ammónia H2/N2 termelés BASF
hidrogénezés metanol H2/CO/CO2 termelés ICI
hidratálás alkoholok C2H4, C3H6, C4H8
termelés Shell, BP, Erdöl-Chemie, Hibernia-Chemie áthidrogénezés esztradion tetralin kísérleti üzem Schering
hidrogénezés változatos CO2 kísérleti üzem Degussa, Thomas Swan Ltd.,
Poul Moller Cons.
nitrálás energia CO2 kísérleti üzem US Naval Surface Warfare Center
*SCWO: szuperkritikus víz oxidáció, **LDPE: alacsony sőrőségő polietilén
Kétségtelen, hogy a s.k.F.-ok alkalmazásához szükséges megfelelı berendezés drága, de ha egy adott eljárásban mind környezetvédelmi, egészségvédelmi és biztonságtechnikai, eljárástechnikai és kémiai területen is kedvezı elınyök érhetıek el, akkor érdemes megfontolni az alkalmazásukat. Ehhez részletes költségelemzés szükséges, amely a reakció „nettó” költségei mellett figyelembe veszi a feldolgozást, hulladékkezelést, visszaforgatási lehetıségeket is. Mi sem bizonyítja jobban a s.k.F.-ok elınyeit, mint hogy az iparban már a 20. század kezdete óta alkalmazzák ıket számos eljárásnál (1.1.2.c. táblázat).
1.1.3. Oldószermentes és szilárd-gáz rendszerek
Az oldószermentes rendszerek szintén nagyon közkedveltek szerves reakciók és biokatalízisek kivitelezéséhez [Yahya, 1998; Güvenc, 2002; Ghamgui, 2006; Güvenc, 2007]. Ebben az esetben az egyik reaktáns feleslege mőködik oldószerként [Welton, 2006]. Mivel nem viszünk be új anyagot a rendszerbe, az oldószer eltávolítására nem kell egy újabb eljárást kidolgozni, ami jelentıs költségcsökkentést jelent. Külön elınyt jelent még ez az élelmiszer- és gyógyszergyártásban is, ahol nagyon szigorú szabályozások vannak egy új oldószer bevezetésére és a megengedhetı maradékoldószer mennyiségére egy adott termékben. Az emelt szubsztrát mennyiségének köszönhetıen a reakció során folyamatosan változik a reakcióközeg összetétele és így a tulajdonsága is. Nem elınyös ezt a rendszert nagy viszkozitású reaktáns esetén alkalmazni, mert rossz kevertetést, ezáltal alacsony reakció-sebességet eredményezne. Természetesen inhibiáló szubsztrátból sem célszerő felesleget alkalmazni (lásd ecetsav felesleg hatása lipázos észterezésben 1.3. fejezet). Selmi és munkatárasai trikaprilin oldószermentes közegben történı elıállítása során, a szubsztrát szilikagélre történı immobilizációjával védték ki a poláris glicerol abszorpcióját az enzimrészecskékre, valamint így kontrollálták a lipáz regioszelektivitását [Selmi, 1997].
Nyers és izolált enzimek egyaránt mőködésre képesek szilárd-gáz határfelületen, ezért szilárd-gáz biokatalízis napjaink egyik ígéretes technológiája. Nagy elınye, hogy a rendszer termodinamikailag teljes mértékben kontrolálható. Már egy miniüzemben is fokozott konverzió és reakció-sebesség érhetı el, a hatékony anyagátadás, a gáz kicsi viszkozitásából következı csökkentett diffúziós limitáció miatt, valamint az enzim és a kofaktorok stabilitása is magas. Az oldószeres fázis hiánya miatt a feldolgozás egyszerőbb, továbbá méretnövelés is könnyen végrehajtható [Lamar, 2004]. Az évek
folyamán egyre több enzim bizonyult mőködıképesnek szilárd-gáz rendszerekben:
alkohol dehidrogenáz alkohol és aldehid termelése során [Pulvin, 1986], Pichia pastoris alkohol oxidáz etanol oxidációja során [Barzan, 1989], Candida rugosa lipázos észterezésben [Ross, 1991], liofilizált Saccharomyces cerevisiae sejtek aldehidek redukciójában [Maugard, 2001] és Rhodococcus erythropolis dehalogenáz alkil- halogenidek dehalogénezése során [Erabel, 2005].
1.1.3.a. ábra: Szilárd-gáz biokatalízis töltött reaktorágyon A belépı gázt a hımérséklettel (Tbe), nyomással (pbe) és a reaktáns parciális nyomásával (pX), a kilépı gázt szintén a hımérséklettel (Tki), nyomással (pki) és a termék parciális nyomásával (pY) lehet jellemezni. ∆p: nyomásesés a katalizátor ágyon, X: szubsztrát(ok), Y: termék(ek).
A szilárd-gáz bioreaktorok sematikus ábrája az 1.1.3.a. ábrán látható. A szilárd fázisú reaktorágyon a biokatalizátor immobilizált vagy nyers formájában is jelen lehet.
Ezen a töltött ágyon halad keresztül a reaktánsokat tartalmazó gáz, amit a következı paraméterekkel lehet jellemezni: moláris összetétel, teljes nyomás és hımérséklet. A reaktánsok bejutatása a hordozógázba kétféleképpen történhet: telítéssel vagy elpárologtatással. Ez utóbbi technika alkalmazásával a moláris áramlási sebesség jobban kontrollálható [Cantone és Basso, 2007].
A szilárd-gáz technológia úgynevezett tiszta technológia, mert a szerves oldószerek felhasználását nullára lehet redukálni. Ennek és termodinamikai kontrolálhatóságának köszönhetıen már az iparban is alkalmazzák: aromaanyagokat állítanak elı etanol és rövid szénláncú savak reakciójával Novozym 435 enzimmel [Lamare, 2001].
1.1.4. Kombinált technológiák
Mivel az ionos folyadékok, s.k.F.-ok, oldószermentes és szilárd-gáz rendszerek környezetbarát alternatívát kínálnak biokatalízisek kivitelezéséhez, ezért érdemes akár együttesen alkalmazni ıket. Egyelıre még az ionos folyadékok és s.k.F.-ok együttes alkalmazását vizsgálták meg. Az ionos folyadék-s.k. CO2 kétfázisú rendszer meglehetısen szokatlanul viselkedik: (1) míg a CO2 könnyen oldódik ionos
folyadékban (csökkentve ezzel viszkozitását), addig s.k. CO2 kétfázisú rendszert képez vele, (2) az ionos folyadék térfogata nem növekszik még akkor sem, amikor igen nagy koncentrációban tartalmaz s.k.F.-ot. Ezeket a bináris rendszereket háromféleképpen alkalmazzák biokonverziókban. Az elsı esetben kihasználják, hogy a s.k.F.-oknak jó az extraktív képessége, ezáltal képes szerves anyagok kioldására ionos folyadékból [Lozano, 2002; Reetz, 2002; Reetz, 2003; Lozano, 2004]. Létrehoznak egy munkafázist, ami ionos folyadékban oldott enzim oldat, valamint egy extraktív fázist, ami a szubsztrátok és termékek nagy részét tartalmazza (1.1.4.a. ábra).
1.1.4.a. ábra: Az ionos folyadékok és a s.k.F.- ok két fázisú rendszere A példán az alkohol és észter szubsztrátok a s.k. CO2-os fázisból folyamatosan beoldódnak az ionos folyadékba, a CALB enzimet tartalmazó ionos folyadékos munkafázisban lejátszódik az átészterezés, majd a termék extrahálódik a s.k. fázisba. A rendszer folyamatos üzemeltetésre kiválóan alkalmas [Lozano, 2002].
A második variáció a kombinált eljárásra, amikor a s.k.F. extrakciójával az ionos folyadék és a szerves oldószer szeparációja érhetı el [Scurto, 2002]. Végül a harmadik módszerben az ionos folyadékot az enzim immobilizációja során használják fel. Ekkor az enzim ionos folyadékkal, mintegy köpennyel van körülvéve, ezáltal megnövelve az élettartamát [Hernández, 2006; Lozano, 2007] (lásd 1.4.3. fejezet).
Nem biztos, hogy az itt bemutatott környezetbarát nem-konvencionális reakcióközegek használata, minden esetben jobbnak bizonyul a hagyományos szerves oldószeres eljárásokkal szemben, sıt bizonyos esetekben az áruk is drágább lehet. A piac azonban folyamatosan reagál az egészségre ártalmatlan, környezetbarát technológiával készülı termékek iránt mutatkozó növekvı igényekre, hiszen elég valószerőtlen, hogy egy vásárló a diklór-metánnal koffeinmentesített kávét szívesen megvásárolná és valóban meginná.
1.2. A Candida antartica lipáz B enzim szerkezete, mőködése
A biokatalítikus reakciókban leggyakrabban alkalmazott enzimek a hidrolázok, amelyeknek egyik legismertebb alcsoportja a lipázok. A lipázok legnagyobb ipari felhasználója a mosószeripar (a teljes enzim piac 30%-át teszi ki), de az élelmiszer-,
papír-, kozmetika- és gyógyszeripar is széles körben alkalmazza ezt az enzimtípust [Houde, 2004; Sharma, 2001]. A CALB az egyik leggyakrabban alkalmazott lipáz enzim, habár a titoktartási szabályozások miatt kevés ipari alkalmazását hozták még nyilvánosságra. Az egyik ismert kozmetikaipari felhasználása az izopropil-mirisztát elıállítása [Houde, 2004].
A CALB a hidroláz enzimek osztályába (E.C.3) tartozik. Észter kötéseken (E.C.3.1), ezen belül is karboxil-észterek kötésein fejti ki hatását (E.C.3.1.1). Triacil-glicerineket hidrolizál zsírsavvá, glicerinné, mono- és diacil-glicerinné (E.C.3.1.1.3).
A Candida antarctica gombából kétféle lipáz enzim izolálható, a CALA és a CALB [Kirk és Christensen, 2002], amelyek azonban eltérı tulajdonságokkal bírnak. A CALA határfelületi aktivitást mutat ellentétben a CALB-vel, amit éppen ezért nem tekintenek valódi lipáznak. Ez azt jelenti, hogy a CALA egy „fedı” szerkezettel rendelkezik, amely az enzim aktív állapotában „nyitott” és hozzáférést enged a szubsztrátnak az aktív centrumhoz. Ez a „fedı” struktúra hiányzik vagy nagyon kicsi a CALB-ben. Az enzim teljes szerkezetét Uppenberg és munkatársai tárták fel (1.2.a. ábra) [Uppenberg, 1994;
Uppenberg, 1995].
1.2.a. ábra: A CALB enzim szerkezete és aktív centruma Pirossal az α-hélixek, halvány zölddel a β-redık, sötét zölddel az enzim felülete van jelölve. Középen az aktív centrum szők bejárata látható, benne az acil- és alkohol láncokkal [Magnusson, 2005].
A CALB az α/β-hidrolázok szupercsaládjába tartozik [Ollis, 1992]. Képes hidrolizálni észtereket, tioésztereket, fehérjéket, epoxidokat, alkil-halogenideket, valamint hasítani hidroxil-nitrilek szénkötéseit. 317 aminosavból épül fel, molekula tömege 33 kDa.
Aktív centrumában a szerin hidrolázokban megszokott Ser105-His224-Asp187 katalítikus hármas található. Ezen kívül tartalmaz még egy oxianionos lyukat, amely stabilizálja az átmeneti állapotot és az intermediereket (1.2.b. ábra). Ebben a lyukban három H-kötés donor hely (Thr40 oldallánc, GLn106 és Thr40 amidok) meghatározott
térbeli elrendezıdésben található. Az aktív centrumban egy sztereospecifikus zseb is van, amely az enzim nagymértékő enantioszelektivitását magyarázza. Ezt a zsebet a másodrendő alkoholok csak egy adott orientációval tudják megközelíteni, ezért királis reakciók során fıképp az R izomer képzıdik [Magnusson, 2005].
A CALB által katalizált acil-csoport transzfer reakciók a ping-pong bi-bi mechanizmus szerint játszódnak le [Magnusson, 2005; Nemestóthy, 2008; Romero, 2005a] az 1.2.b. ábrán látható folyamat szerint.
A 1.2.b. ábrán szereplı R-csoprtoktól függıen a reakció lehet hidrolízis, észterezés, átészterezés, ha a második szubsztrát amin, akkor aminolízis, valamint átészterezés során az elsı acil-szubsztrát lehet tioészter is [Magnusson, 2005].
A CALB-rıl megjelent nagyszámú irodalmi közleményekre és a Mőszaki Kémiai Kutatóintézetben végrehajtott kutatási eredményekre alapulva, a CALB enzim egyértelmő és sikeres választás volt mint katalizátor, az izoamil-acetát ecetsavból és izoamil-alkoholból történı enzimes elıállítására.
1.2.b. ábra: A CALB által katalizált reakciók ping-pong bi-bi mechanizmusa A szabad enzimbıl (balra fent) az elsı szubsztráttal egy teraéderes intermedier képzıdik (jobbra fent). Az elsı termék távozása után létrejön egy acil-enzim átmeneti állapot (jobbra lent). A második szubsztrát érkezésével, egy újabb második tetraéderes intermedier képzıdik (balra lent), majd a második termék távozása után az enzim készen áll egy újabb katalitikus ciklusra [Magnusson, 2005].
1.3. Az izoamil-acetát enzimes elıállítása nem konvencionális közegekben
1.3.1. Az izoamil-acetát enzimes elıállításaszerves oldószerben
Annak ellenére, hogy már 1989-ben is több tonna izoamil-acetátot állított elı és használt fel az ipar [Welsh, 1989], a 80-as 90-es években kevés sikert értek el ezen anyag biokatalízise terén. Csak maximum 80%-os hozamot tudtak elérni igen magas enzimkoncentráció mellett is [Gillies, 1987; Langrand, 1988; Langrand, 1990; Welsh, 1990; Razafindralambo, 1994].
1997-ben jelent meg Vija és munkatársainak igen korszerő, bár nagyon szőkszavú közleménye az izoamil-acetát elıállításáról mind szerves közegben, mind s.k. CO2-ban.
Szubsztrátként ecetsavat használtak n-hexán oldószerben, Novozym 435 enzim alkalmazása mellett. A kapott termék hozama erısen függött a szubsztrátok koncentrációjától és csak az ipari szempontból alkalmatlan, alacsony koncentrációknál értek el magas hozamot (95%). Kidolgoztak egy folyamatos eljárást, ahol a reagenseket folyamatosan áramoltatták n-hexánban oldva egy, az enzimet tartalmazó kolonnán.
Sajnos a cikk rövid és nem közöl részletesebb eredményeket vagy folyamatábrát a n- hexános mérésekrıl.
Látván az izoamil-acetát enzimatikus elıállításának sikertelenségét és a lezajlódó folyamat megértése terén felmerült őrt, Hari Krishna és csoportja részletesebb vizsgálatba fogott, amelyet két egymást követı évben megjelent publikációjukban közöltek [Hari Krishna, 2000; Hari Krishna, 2001]. Elsı publikációjukban ecetsavat alkalmaztak szubsztrátként n-heptán oldószerben immobilizált Mucor miehei lipáz enzim segítségével. Vizsgálták az enzim és a szubsztrát-koncentrációk változtatásának és az inkubációs idınek a hatását a reakcióra. RSM („respons surface methodology” = többparaméteres kísérlettervezés”) statisztikai módszerrel, a kísérleti eredményekkel jó egyezést mutató modellt dolgoztak ki arra, hogy a hozam hogyan változik 20% és 99,6% között a fenti paraméterek függvényében. Azt találták, hogy akárcsak n- hexánban [Vija, 1997], 80% feletti hozamot csak alacsony szubsztrát-koncentrációnál (<0,1 M) és hosszú reakcióidı után (72 h) értek el, míg 0,18 M-nál nagyobb koncentrációk esetén a hozam igen kicsi értékeket vett fel (1.3.1.a. ábra).
1.3.1.a. ábra: Az izoamil-acetát hozam függése a szubsztrátok koncentrációjától és az inkubációs idıtıl RSM-val meghatározva Híg oldatban rövidebb reakcióidı alatt magas (bal alsó sarok), míg tömény oldatban hosszú idı alatt is alacsony észterezési fok érhetı el (jobb felsı sarok). Bal tengely: inkubációs idı;
alsó tengely: sav és alkohol koncentrációk; jobb tengely: észterezési fok [Hari Krishna, 2000].
Ugyanezen kutatócsoportnak a következı cikkében [Hari Krishna, 2001] egy sokkal átfogóbb vizsgálatát találhatjuk az izoamil-acetát Rhizomucor miehei-vel történı elıállításáról. Vizsgálták az enzim és a szubsztrát-koncentráció, az oldószer típus, az acil-donor, az alkohol - sav mólarány és a hozzáadott puffer hatását, valamint többszöri felhasználás után az enzim aktivitásában bekövetkezı változásokat. Akárcsak elızı cikkükben [Hari Krishna, 2000], itt is megállapították, hogy a szubsztrát-koncentráció növelésére a hozam drasztikusan csökkent, így a 0,06 M sav és alkohol koncentrációknál elért 95%-os hozam 12%-ra csökkent 0,3 M-nál. Ennek valószínő okaként az ecetsav inhibícióját jelölték meg, az enzim mikrokörnyezeti vízben történı disszociáció révén. Ez az állítás könnyen alátámasztható, hiszen az ecetsav a lipázok ismert inhibitora, „dead-end” inhibíciót okozva az aktív centrum szerin aminosavával történı reakciója által [Segel, 1975]. További eredményeik szerint az enzim- koncentrációjának emelésével jelentısen megnövelték a hozamot (95%), bár a reakció- sebessége így nagymértékben lecsökkent, ami a reakcióidı növekedését okozta (72 h). 3 g/l enzim-koncentrációnál (0,06 M sav és alkohol mennyiség mellett) egy kritikus értéket találtak, amely fölé növelve az enzimmennyiségét további lényeges reakció- sebesség növekedést már nem értek el. Ezt azzal indokolták, hogy az enzim aggregálódik és nem minden aktív centrum kerül érintkezésbe a szubsztrátokkal. Ez az érvelés azonban immobilizált enzimek esetén nem biztos, hogy helytálló. A megfelelı szerves oldószer kiválasztásának érdekében is részletes vizsgálatokat végeztek. Hétféle szerves oldószert teszteltek (izooktán, n-heptán, n-hexán, ciklohexán, kloroform, diklór-
metán, dioxán), amelyek a polaritási skála széles tartományát ölelték fel (log P:
-1,1÷4,5). Azt találták, hogy a 3-nál magasabb log P-vel rendelkezı oldószerekkel
kiváló hozamot lehet elérni (95%, 48 h, ciklohexán), míg az ettıl kisebb log P-jő oldószerek alacsony hozamot eredményeztek (1,6%, 72 h, dioxán). Ennek magyarázataként itt is az ecetsav fokozódó disszociációját jelölték meg, valamint az oldószer polaritásának növekedésével (diklór-metán, dioxán) az enzim mikrokörnyezetében lévı víz elvonása miatt bekövetkezı inaktivációt. A legjobb oldószernek a n-hexán bizonyult. A savi inhibíció visszaszorításának érdekében kipróbálták, hogy puffert adtak a rendszerhez az alábbi két módon:
a. vizes puffer oldat hozzáadása a kiindulási reakcióelegyhez, b. a szerves oldószer telítése pufferrel.
Az a. esetben nem értek el kedvezı hatást. Kevés vizes puffer oldat hozzáadására (0,005-0,01 V/V%) a hozam 10%-al, sok puffer hatására (0,01 V/V% felett) 40%-al csökkent a hozam, ráadásul az enzim aggregációját is tapasztalták. Mivel a gyártó adatai alapján ismert, hogy aznalkalmazott Lipozyme IM-20 enzim készítmény eleve 10 m/m% vizet tartalmaz, sıt teljesen vízmentes közegben is aktív, a negatív eredmény teljesen érthetı. A b. módszerrel azonban sikeresen védték meg az enzimet az ecetsav inhibíciójától, mert így képesek voltak az enzim mikrokörnyezeti vizét pufferálni. Erıs hozamnövekedést értek el, amely ráadásul a problémás nagyobb szubsztrát- koncentrációnál volt kifejezettebb. Ezzel azonban még nem oldották meg a nagy koncentrációknál fellépı alacsony termelékenység problémáját, hiszen így is max. 40%
volt csak a hozam 0,17 M felett. Emellett megállapították, hogy a reakciót erısen befolyásolja az acil-donor természete. Az ecetsavanhidrid lényegesen jobb szubsztrátnak bizonyult az ecetsavhoz képest részben azért, mert nem csökkenti az enzim vizes mikrokörnyezetének pH-ját, részben pedig azért, mert disszociációja egyben az acil-csoportok forrása is. Hasonló eredményre jutottak Rizzi és munkatársai is, akik az ecetsavnál az etil-acetátot találták jobb kiindulási anyagnak az izoamil-acetát elıállítás kinetikai vizsgálata során [Rizzi, 1992].
Az acil-csoport forrás hatását Romero és kutatócsoportja is vizsgálta n-hexán szerves oldószerben [Romero, 2005a]. Négyféle szubsztrátot megvizsgálva az alábbi sorrendet állították fel: ecetsavanhidrid > etil-acetát > ecetsav > ammónium-acetát, tehát az eddigiekkel megegyezı módon [Rizzi, 1992; Hari Krishna, 2001], itt is az ecetsavanhidrid bizonyult a legjobb acil-donor szubsztrátnak. Emellett megállapították, három, a kereskedelmi forgalomban könnyen elérhetı, közkedvelt lipáz enzim közül (Novozym 435 Candida antarctica-ból, Lipozyme RM-IM Rhizomucor miehei-bıl, Lipozyme TL-IM Thermomyces lanuginosus-ból) a Novozym 435-ös készítmény
![Táblázat 1.1.1.a.: A szerves oldószerek és az ionos folyadékok összehasonlítása [Plechkova és Seddon, 2008]](https://thumb-eu.123doks.com/thumbv2/9dokorg/875103.47106/13.892.140.802.649.1001/táblázat-szerves-oldószerek-ionos-folyadékok-összehasonlítása-plechkova-seddon.webp)
![Táblázat 1.1.2.a.: Néhány közkedvelt szerves és szervetlen s.k.F. és azok árai 1998-ban [Jessop és Leitner, 1999]](https://thumb-eu.123doks.com/thumbv2/9dokorg/875103.47106/21.892.155.787.613.946/táblázat-közkedvelt-szerves-szervetlen-árai-ban-jessop-leitner.webp)
![Táblázat 1.1.2.b.: A s.k.F.-ok alkalmazásának elınyei a hagyományos folyadék halmazállapotú reakcióközegekkel szemben [Jessop és Leitner, 1999]](https://thumb-eu.123doks.com/thumbv2/9dokorg/875103.47106/22.892.145.786.609.1120/táblázat-alkalmazásának-elınyei-hagyományos-folyadék-halmazállapotú-reakcióközegekkel-leitner.webp)
![Táblázat 1.1.2.c.: Példák a s.k.F.-ok ipari alkalmazására [Jessop és Leitner, 1999]](https://thumb-eu.123doks.com/thumbv2/9dokorg/875103.47106/23.892.153.785.803.1129/táblázat-példák-f-ok-ipari-alkalmazására-jessop-leitner.webp)