Néhány X–CH
2–CH(NH
2)COOH típusú aminosav heterogén fotokatalitikus bomlása
Doktori (PhD) értekezés
Pannon Egyetem
Kémiai és Környezettudományi Doktori Iskola
Készítette
Szabóné dr. Bárdos Erzsébet okleveles vegyészmérnök
Témavezető Dr. Horváth Attila
egyetemi tanár
Pannon Egyetem, Kémia Intézet
Általános és Szervetlen Kémia Intézeti Tanszék
Veszprém, 2013
„Álmainkért küzdeni kell, a cél eléréséhez összpontosítanunk kell, erőfeszítéseket kell tennünk.
Ám arról se feledkezzünk meg, hogy az élet apró örömök szövete, amit azért kapunk, hogy bátorítsanak.” (P. C.)
Kivonat
A heterogén fotokatalitikus rendszerek hatékonyságát alapvetően a félvezető részecskék kvantumhasznosítási tényezője határozza meg, aminek növelése különböző módszerekkel valósítható meg. Egyik lehetséges eljárás a katalizátor felületének módosítása nemes- vagy átmeneti fémekkel. Ilyen fotokatalizátorok előállítása céljából réz(II)- és ezüst(I)ionokat re- dukáltunk oxálsavat, mint „önfeláldozó” elektrondonort és TiO2-ot tartalmazó vizes szusz- penzió besugárzásával. Megállapítottuk, hogy az oxálsav fotokatalitikus bomlásának sebessé- ge jelentősen megnő, miután a fémek leválnak a nanorészecskék felületére. A fémklaszterek hatására a félvezető elnyelési színképe a nagyobb hullámhosszak felé tolódik, s ezért megnő az abszorbeált fényhányad. A felületre leválasztott fém elektroncsapdaként viselkedik, ami a fotogenerált {ecb-, hvb+} pár rekombinációjának valószínűségét csökkenti, azaz megnöveli a részecskepár élettartamát.
Részletesen vizsgáltuk néhány aminosav adszorpcióját és fotokatalitikus bomlását Degussa P25 TiO2 félvezetőt használva. A kinetikai és az egyensúlyi adatok pH függése kö- zötti szoros kapcsolat igazolja a felületi komplexképződés kulcsfontosságú szerepét a szubszt- rátok fotokatalitikus degradációjában. Az aminosavak TiO2 jelenlétében lejátszódó reakcióit összehasonlítottuk az ezüsttel módosított TiO2-ot tartalmazó szuszpenziókban bekövetkező változásokkal. A modellvegyületek bomlási sebessége minden esetben nagyobb az Ag–TiO2- ot tartalmazókban, a növekedés mértéke függ a szubsztrát szerkezetétől. Azoknak a reaktánsoknak a bomlási sebessége nő jelentősen az ezüsttel módosított felületű titán- dioxidon, amelyek fotokatalitikus degradációjának sebességmeghatározó lépése a gerjesztett félvezető felületén lejátszódó elsődleges elektronátadások valamelyike.
Az oxálsavat és aminosavat is tartalmazó reakcióelegyekben a két komponensből képződő gyökök reakciója következtében mindkét vegyület bomlása lényegesen lassabbá válik. A gyök-gyök reakció által előidézett inhibíció az aminosav bomlásánál nagyobb, mint az oxál- sav bomlásánál. A kölcsönös inhibíció mértéke Ag–TiO2 felületén csökken. Valamennyi meg- figyelt jelenséggel összhangot mutató mechanizmust javasoltunk. Megállapítottuk, hogy az ezüstleválasztás és az oxálsav együttes alkalmazásával nyert eredmények hozzájárulhatnak a fotokatalitikus reakciók pontosabb megismeréséhez.
A fenilalanin és a benzolszulfonsav fotodegradációját anaerob és aerob körülmények kö- zött tanulmányoztuk. Kimutattuk, hogy inert rendszerekben az aromás gyűrű hidroxileződik, de gyűrűfelnyílás nem történik. Ezzel szemben levegővel kevert szuszpenziókban bekövetke- zik a vegyületek teljes mineralizációja. Különböző köztitermékeket azonosítottunk gondosan kivitelezett vizsgálatok és megfelelő analitikai eljárások kombinációjával. Az eredményeket figyelembe véve valószínűsítettük, hogy a dihidroxiszármazékok és az aktív oxigéntartalmú részecskék (HO2•/O2•- és/vagy O2(1∆g)) reakciója vezet a gyűrű felnyílásához. Javaslatot tet- tünk a modellvegyületek bomlási folyamatának meghatározó reakció lépéseire.
Abstract
The efficiency of the heterogeneous photocatalytic systems is fundamentally determined by quantum yield of the semiconductor nano-particles that can be enhanced by various methods. One of the effective procedures is the deposition of noble or transition metal clusters onto the surface of cata- lysts. To obtain metal deposited photocatalysts copper(II) and silver(I) ions have been reduced by irra- diation of aqueous suspension in the presence of oxalic acid as sacrificial electron donor. It has been found that the rate of photocatalytic decomposition of oxalic acid has considerably been increased in suspensions after the deposition of the metals on the surface of the nano-particles. The metal clusters deposited on the surface of TiO2 particles resulted in a red shift in the absorption spectrum of the semiconductor particles providing an increase in the absorbed light fraction. Moreover, the metal clus- ters act as electron traps at the surface of the excited nanoparticles that leads to a significant reduction in the probability of recombination of the photogenerated {ecb
-, hvb
+} and an increase in lifetime of this pair.
Adsorption and photocatalytic decomposition of several amino acids has been studied by using Degussa P25 TiO2. The strong correlation between the pH dependence of the adsorbed mole fraction and the rate of photocatalytic decomposition of amino acids confirms the key role of the formation of surface complex in the photocatalytic reaction of these substrates. The photocatalytic reactions of amino acids occurring over bare TiO2 semiconductors have been compared to that of taking place over adequate Ag–TiO2 particles. The rate of decomposition of amino acids has been found to be higher over Ag–TiO2 than over bare TiO2 and the enhancement depends on the structure of the substrate.
Significant enhancement is caused by silver clusters on photoactivity of TiO2 for substrates that de- compose with a mechanism in which one of the primary electron transfer reactions is the rate deter- mining step.
In reaction mixtures containing oxalic acid and amino acid the decomposition rate of both sub- strates is slower than that of observed for suspension having either oxalic acid or amino acid due to the reaction of radicals formed by primary reaction of oxalic acid and amino acid respectively. The inhibi- tion caused by this radical-radical reaction is significantly stronger for amino acid than for oxalic acid.
The mutual inhibition is reduced over silver modified TiO2 photocatalyst. A reasonable mechanism has been proposed that is in accordance with all observations. It has been concluded that using oxalic acid as hole scavenger and/or silver ion as net one electron acceptor in the study of photocatalytic de- composition of a substrate can be useful in revealing the mechanism of photoinduced reactions of the substrate.
Photocatalytic degradation of phenylalanine and benzenesulfonic acid has been studied in anaero- bic and aerobic conditions. It has been pointed out that hydroxylation of aromatic ring occurs but ring opening does not undergo in anaerobic condition. On the other hand the complete mineralization of these substrates takes place in aerobic systems. Various intermediates have been identified by careful measurements combined with suitable analytical procedures. Considering the results of these experi- ments it has been suggested that the reaction of dihydroxy derivatives of phenylalanine and benzene- sulfonic acid with very reactive oxygen containing radicals or excited molecules, such as HO2
•/O2
•-
and/or O2(1∆g) lead to ring opening reaction of these aromatic compound. Significant reaction step of the decomposition process of model substances have been proposed.
Tartalomjegyzék
1. Bevezetés 7
2. Célkitűzés 9
3. Irodalmi áttekintés 10
3.1. Nagyhatékonyságú oxidációs eljárások 10
3.2. Heterogén fotokatalízis 11
3.2.1. A heterogén fotokatalízis alapelvei 12
3.2.2. A fotokémiai rendszerekben használt félvezetők 13
3.2.3. Gerjesztett félvezetőn lejátszódó folyamatok 15
3.2.4. A heterogén fotokatalízis kinetikája 19
3.3. Az oxálsav fotooxidációja 20
3.4. A TiO2 fotokatalitikus hatékonyságának növelése 22
3.4.1. Fotokatalízis ezüstionok jelenlétében 24
3.4.2. Fotooxidáció réz(II)ionokat tartalmazó fotokatalitikus rendszerekben 26
3.5. Aminosavak fotokatalitikus lebontása 27
3.5.1. A vizsgált aminosavak rövid jellemzése 28
3.6. Aromás vegyületek bontása 30
4. Kísérleti rész 32
4.1. Felhasznált anyagok 32
4.2. A fotoreaktorok 32
4.3. A fotokatalitikus kísérletek kivitelezése 35
4.4. A minták analízise 35
4.4.1. Az oxálsav-koncentráció meghatározása 35
4.4.2. Az ezüstion-koncentráció mérése 36
4.4.3. A réz(II)ion-koncentráció meghatározása 36
4.4.4. Az aminocsoport aktuális koncentrációjának meghatározása 36
4.4.5. A széntartalom mérése 37
4.4.6. Az ammóniatartalom meghatározása 37
4.4.7. A nitritionok és a nitrátionok koncentrációjának mérése 38
4.4.8. A kéntartalom meghatározása 38
4.4.9. Fényelnyelési és emissziós színkép felvétele 38
4.4.10. HPLC-MS vizsgálatok 38
4.4.11. Adszorpciós vizsgálatok 39
4.4.12. Hatásspektrum felvétele 39
4.4.13. DRIFT spektrumok felvétele 39
4.5. A kezdeti sebesség meghatározása 39
5. Eredmények 41
5.1. A fotokatalizátor felületének módosítása fémionok leválasztásával 41
5.1.1. Előkísérletek 41
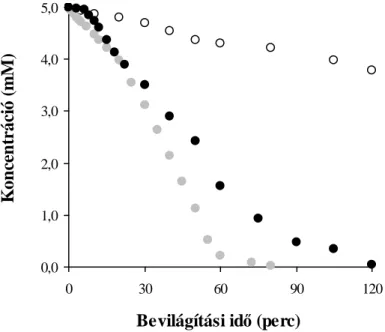
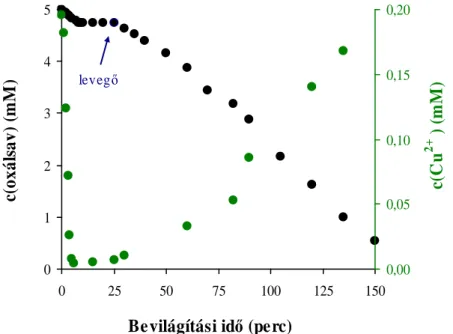
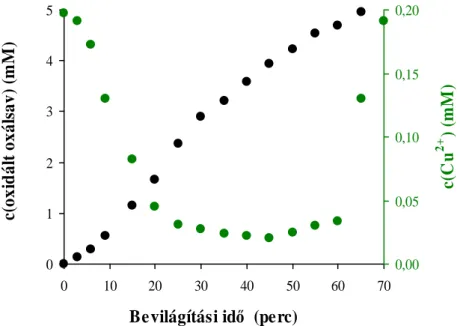
5.1.2. Az oxálsav fotooxidációja Ag+ és Cu2+ ionokat tartalmazó szuszpenziókban 41 5.1.2.1. Az oxálsav fotodegradációja ezüstionok jelenlétében 43 5.1.2.2. A modellvegyület fotooxidációja réz(II)ion-tartalmú szuszpenziókban 46 5.1.2.3. A fémmel módosított katalizátorok hatékonyságának összehasonlítása 48
5.1.3. Az Ag–TiO2 katalizátorok kettős szerepe 50
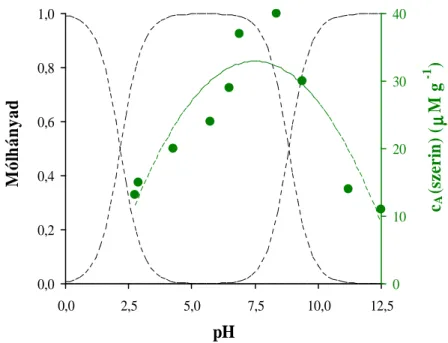
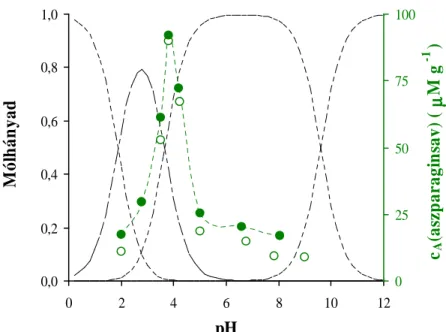
5.2. Aminosavak fotokatalitikus bomlásának vizsgálata 51
5.2.1. A reakcióelegy pH-jának hatása a felületi komplexképződésre 51 5.2.2. A reakcióelegy pH-jának hatása a kezdeti bomlási sebességre 54 5.2.3. Közti- és végtermékek keletkezése az aminosavak fotobomlásakor 57 5.2.3.1. Bomlástermékek az aszparaginsav fotodegradációjakor 57
5.2.3.2. A cisztein degradációjának nyomonkövetése 59
5.2.4. Az aminosavak fotokatalitikus reakciói Ag–TiO2-on 63 5.2.5. Fotokatalitikus reakciók különböző katalizátorokon 67 5.2.6. Versengő fotokonverzió a TiO2 és az Ag–TiO2 felületén 71
5.2.6.1. A versengő fotokonverzió nyomonkövetése 76
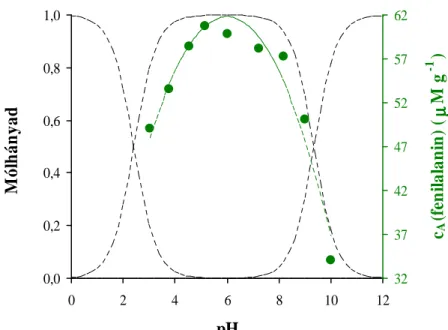
5.2.7. Az L-fenilalanin fotokatalitikus reakciói 78
5.2.7.1. Spektrális változások az L-fenilalanin heterogén fotokatalízisekor 79 5.2.7.2. Az L-fenilalanin fotokatalitikus bomlásának nyomon követése 81 5.2.7.3. Köztitermékek azonosítása HPLC-MS vizsgálatokkal 83
5.2.7.3.1. Hidroxileződött intermedierek 84
5.2.7.4. Az L-fenilalanin fotobontása különböző elektron- és lyukbefogók jelenlétében 87 5.2.8. Az aminosavak fotokatalitikus bomlásának mechanizmusa 91
6. Összefoglalás 97
7. Tézisek 99
8. Theses 105
9. Irodalomjegyzék 111
10. Mellékletek 118
1. Bevezetés
Az utóbbi évtizedekben egyaránt megfigyelhető bolygónk ivóvízforrásainak apadása és a hidroszféra – különösen az édesvizek – növekvő mértékű elszennyeződése. Magyarország felszíni vizeinek állapotát döntően az határozza meg, hogy folyóvizeink 95%-a külföldről érkezik, így vízkészletünk minősége nagymértékben függ a szomszédos országokban végzett beavatkozásoktól. Szennyezett vizeink kezelése, tisztítása kulcsfontosságú környezetvédelmi feladat. A háztartási, az ipari és a mezőgazdasági eredetű szennyvizek nagy része ugyan haté- konyan tisztítható a hagyományos biológiai, fizikai-kémiai eljárásokkal, azonban az élővizek- be egyre nagyobb mennyiségben jutnak olyan toxikus (elsősorban ipari eredetű) anyagok, amelyek nem távolíthatók el ezekkel a módszerekkel. Szükséges a kémiai úton végrehajtott víztisztítási technológiák fejlesztése, majd gyakorlati alkalmazásuk. Fontos, hogy a módsze- rek gazdasági, technológiai és egészségügyi okok miatt csak korlátozott számú és mennyiségű kémiai adalékot használjanak fel, főként olyanokat, amelyeknek bomlástermékei természetes anyagok. További elvárás, hogy kis energiafelhasználás mellett a szennyezők széles skálájá- val szemben eredményesen bevethetők legyenek.
Ezeknek a kihívásoknak megfelelnek az ún. nagyhatékonyságú oxidációs eljárások (Advenced Oxidation Processes). Közös jellemzőjük, hogy a napenergia vagy más energia felhasználásával oxidatív szabadgyököket, főként hidroxilgyököket generálnak, amelyek a szerves anyagok széles körét oxidálják.
A nagyhatékonyságú oxidációs eljárások közé tartozó heterogén fotokatalízis a 20. század végén vált intenzív kutatási területté. Napjainkban számos kutatócsoport vizsgálja mind labo- ratóriumi, mind félüzemi kísérletekben a félvezető anyagok fotoaktivitásán alapuló módszert.
Céljuk egyrészt, hogy feltárják a fénnyel gerjesztett reakciók mechanizmusát, s az eredmé- nyeket alkalmazzák a környezeti problémák megoldásakor, másrészt, hogy megvalósítsák a napenergia átalakítását, raktározását.
A fotokémiai tisztítási módszerek mellett szól, hogy a szennyezések számos esetben a természetben is fotokémiai reakciókban bomlanak le. A heterogén fotokatalízis előnye, hogy napenergiával is működhet a rendszer, aminek következtében nemcsak a költsége, hanem a környezetet terhelő kibocsátások is csökkenthetők. A fénysugárzás egyfelől tiszta energia, másfelől tiszta reagens, a környezetbarát katalizátor az eljárás végén visszanyerhető.
A katalizátornak kémiailag és biológiailag inertnek, fotokatalitikusan aktívnak, könnyen gyárthatónak és nem utolsó sorban olcsónak kell lennie. A félvezetők közül leginkább a TiO2
sávja, s így a napfénynek csak kis hányadát hasznosítja. Különböző módszereket dolgoztak ki, hogy kiterjesszék az elnyelési színképét a látható tartományba, növelve ezzel fotoaktivitását.
Egyik lehetséges megoldás: a félvezető felületét fényérzékenyítőkkel vagy átmeneti fémio- nokkal módosítani. Az utóbbi eljárás kedvező esetben nem is igényli további adalékok (fém- sók) bevitelét, mivel az átmeneti fémionok megtalálhatók az ipari szennyvizekben és a termé- szetes vizekben is.
Napjainkban egyre nagyobb figyelmet fordítanak a biológiailag aktív molekulák fotoké- miai vizsgálatára. Az orvostudományban elterjedtek a különféle sugárkezelési módszerek, ezért fontos tudni, hogy a szervezetünket felépítő anyagok hogyan viselkednek a különböző hullámhosszúságú fény hatására. A fehérjék építőkövei, az aminosavak a környezetre nem ártalmas anyagok, így kiválóan alkalmazhatók modellvegyületként. Az aminosavak degradá- ciójának vizsgálatakor célul tűztük ki a fotobomlás mechanizmusának feltérképezését, hogy az új ismeretek birtokában hatékony módszert dolgozzunk ki a szerves reaktánsok, közöttük az aromás vegyületek mineralizációjára.
2. Célkit ű zés
A heterogén fotokatalitikus rendszerekben vizsgált félvezetők közül több szempontból is a TiO2 bizonyult a legelőnyösebbnek, azonban az egyes vegyületek lebontásakor elérhető haté- konyság – melyet a töltéspár rekombinációja és a vele versengő folyamatok sebessége határoz meg – igen kicsi. A katalizátor aktivitása növelhető az elektron-lyuk rekombináció valószínű- ségének csökkentésével. Az egyik lehetséges eljárás felületének módosítása különböző ne- mes- vagy átmeneti fémekkel. Az ilyen irányú vizsgálatokhoz modellvegyületként a legegy- szerűbb szerkezetű dikarbonsavat, az oxálsavat választottuk, amely különböző ipari folyama- tok (fémkohászat, textilipar) melléktermékeként a szennyvizekben előfordulhat. Jellemző tulajdonsága, hogy a fémionokkal komplex vegyületeket alkot, amelyek megnehezíthetik az egész víztisztítási folyamatot. Ugyanakkor ismeretes az is, hogy számos fémionnal képzett komplexe fényérzékeny, amelyek már a látható fény hatására is nagy kvantumhasznosítási tényezőjű fotoredoxi reakciókban átalakulnak. Ezen ismeretek birtokában fordítottuk figyel- münket a szennyvizekben is előforduló fémionok fotooxidációt befolyásoló hatásának tanul- mányozására. Már az előkísérletek alapján is egyértelművé vált, hogy az oxálsav fotokémiai oxidációját a félvezető TiO2 részecskéket is tartalmazó heterogén rendszerben leginkább a réz(II)- és az ezüst(I)ionok gyorsítják. Ezért a kutatás céljaként a Cu(II)- és az Ag(I)ionokat tartalmazó reakcióelegyek fotokémiai lebomlásának részletes vizsgálatát jelöltük meg.
Az aminosavak a fotokatalitikus reakciók szempontjából kitüntetett sajátságúak, mindkét funkciós csoportjuk reakcióba léphet a katalizátor gerjesztésekor képződő reaktív részecskék- kel. Részletesen vizsgálni kívántuk az X–CH2–CH(NH2)COOH (X= –OH, –SH, –COOH, –C6H5) képlettel jellemezhető vegyületek fotokatalitikus bomlását, és a közeg pH-jának a felületi komplexképződésre, valamint a fotoreakció sebességére gyakorolt hatását. Ezzel igyekeztünk megoldást keresni a szakirodalomban fellelhető ellentmondásokra. Gyakran elté- rő sebességi együtthatókat adnak meg, ennek egyik oka, hogy nem veszik figyelembe a folya- dékfázis pH-ját. Hatékony lyukbefogó (oxálsav) és elektronbefogó (ezüst(I)ionok) külön- külön és együttes alkalmazásával az aminosavak bomlási mechanizmusának pontosítása is szerepelt céljaink között. Anaerob és aerob vizsgálatokkal, valamint különböző adalékok (pl.
H2O2) használatával arra a kulcsfontosságú kérdésre is választ szándékoztunk adni, hogy mely részecskék felelősek az aromás vegyületek fotoindukált gyűrűfelhasadásáért, azaz ez a folya- mat mely részlépések eredménye.
3. Irodalmi áttekintés
3.1. Nagyhatékonyságú oxidációs eljárások
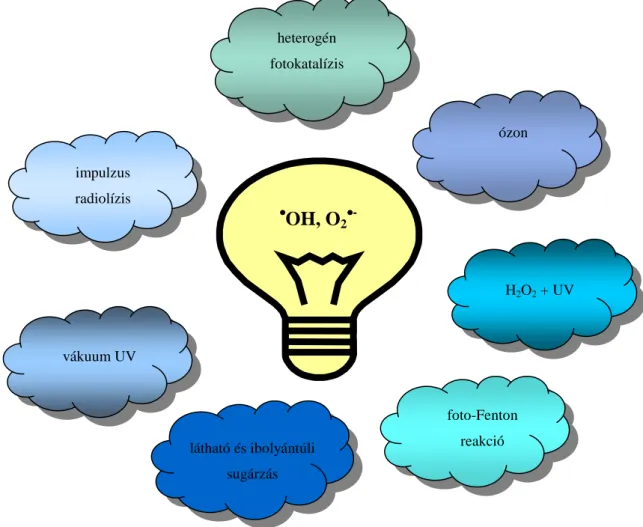
A nagyhatékonyságú oxidációs eljárások („Advanced Oxidation Processes”) közös jel- lemzője, hogy a környezetet terhelő szennyező anyagok mineralizációja a különböző módsze- rekkel generált nagy oxidációs potenciálú gyökökkel lejátszódó reakciók eredményeként va- lósítható meg [1].
1. ábra: A reaktív gyökök generálásán alapuló eljárások.
A szerves szennyezőket az aktív gyökök többlépéses reakciókban szén-dioxiddá és vízzé, valamint heteroatomot tartalmazó vegyületek esetében a kérdéses elemmé (pl. N2) vagy annak egyszerű szervetlen vegyületévé, ionjává (pl. NO3-) bontják le, illetve oxidálják.
A természetben fellelhető energiaforrások közül kiemelkedő jelentőségű a Földünkön
impulzus radiolízis
ózon
••••OH, O2••••-
vákuum UV
H2O2 + UV heterogén
fotokatalízis
foto-Fenton reakció látható és ibolyántúli
sugárzás
elegendően nagy mennyiségben áll rendelkezésre. Tekintettel arra, hogy bizonyos félvezető anyagok napsugárzással is gerjeszthetők, a heterogén fotokatalízis a nagyhatékonyságú oxidá- ciós eljárások intenzíven kutatott területe.
3.2. Heterogén fotokatalízis
Fujishima és Honda 1972-es publikációjukban számoltak be úttörő munkájukról: vizet bontottak fényenergia felhasználásával [2]. A fotoelektrokémiai cellában anódként TiO2-ot, katódként Pt elektródot alkalmaztak, s az anódot fénnyel gerjesztve oxigén és hidrogén fejlő- dését tapasztalták.
A közlemény megjelenése egy új tudomány terület megszületését és rohamos fejlődését eredményezte. A kutatások középpontjában ma már nemcsak a napenergia kémiai energiává alakítása áll, hanem fontos a szerves szennyezők lebontását célzó kísérletek eredményeinek felhasználása a környezetvédelemben is.
Főbb állomások a TiO2 fotoindukált folyamatainak megismerésében:
• 1972 Vízbontás fotoelektrokémiai cella segítségével, anód: rutil TiO2 [2].
• 1977 A TiO2 alkalmazása a környezetvédelemben: Frank és Bard a CN- és a SO32-
oxidációját vizsgálták vízben napfény hatására [3].
• 1977 Shrauzer és Guth végrehajtották a molekuláris nitrogén redukcióját ammóniává vassal módosított TiO2 alkalmazásával [4].
• 1979 Inuoe és munkatársai a szén-dioxidot fotokatalitikusan redukálták [5].
• 1978 Megvalósították az első szerves fotoszintézis reakciót, amely egy alternatív fotoindukált Kolbe reakció [6].
• 1983 Pruden és munkatársa először mineralizáltak félvezető érzékenyített reakcióval szerves szennyezőket [7].
• 1985 A TiO2-ot mikrobaölő anyagként használták különböző baktériumok fotoindukált megsemmisítésében [8].
• 1986 A heterogén fotokatalízist tumor sejtek elpusztítására alkalmazták [9].
• 1991 O’Regan és Grätzel hatékonyan működő napcellájában a katalizátor nanoméretű TiO2 [10].
• 1998 Wang és munkatársai nagy hidrofilicitású TiO2 felületet állítottak elő, amely kitűnő öntisztító tulajdonságú [11].
Az elmúlt évtizedek kutatásai bebizonyították, hogy a laboratóriumi heterogén
gének, alkoholok, aminok, szerves savak, fenolok, klórozott vegyületek – lebonthatók egysze- rű szervetlen végtermékekké, azaz mineralizálhatók [12-16]. Az eljárás ipari megvalósítása kissé nehézkes, mivel a szuszpendált katalizátor visszanyerése (szűrése, mosása, regenerálása) a megtisztított folyadékfázisból drágítja a technológiát. E probléma kiküszöbölhető, ha a kata- lizátort megfelelő felülethez rögzített filmek formájában alkalmazzák [17].
A kereskedelmi forgalomban különböző beltéri és kültéri célokra használatos, TiO2-dal bevont termékek jelentek meg, amelyekben a félvezető alapú fotokémia területein – fotomineralizáció, fotosterilizáció, fotoindukált szuperhidrofilitás – elért eredmények ötvö- ződnek [18].
3.2.1. A heterogén fotokatalízis alapelvei
A fotokémiai rendszerekben alapvetően három különböző típusú fotokatalitikusnak neve- zett reakció játszódhat le [19]:
(i) fotoindukált katalitikus reakció: az elsődleges fotokémiai reakcióban katalitikusan aktív részecske keletkezik,
(ii) fotoindukált érzékenyített reakció: a gerjesztett félvezető és a felületén adszorbeált alapállapotú molekula reakciója a folyamat első lépése,
(iii) katalizált fotokémiai reakció: az alapállapotú félvezető a felületén adszorbeált ger- jesztett molekula reakciójában katalizátorként működik.
Szilárd félvezető részecskéket tartalmazó heterogén rendszerben csak akkor állapítható meg, hogy érzékenyített vagy katalizált fotokémiai reakció játszódik le, ha pontosan ismert a reakció mechanizmusa. Alapvető fontosságú a folyamatok megismerése, az egymást követő és párhuzamos reakciók rendszerének „feltérképezése”.
A félvezetők sajátságos viselkedését speciális sávszerkezetük magyarázza. A betöltött – általában kötő molekulapálya karakterű – vegyértéksávot (valence band, vb) meghatározott, az anyagi minőségre jellemző energiaszélességű tiltott sáv választja el a betöltetlen – többnyi- re nemkötő molekulapálya karakterű – vezetési sávtól (conduction band, cb). Ha a gerjesztés fénnyel történik, a foton energiájának el kell érnie a vegyértéksáv és a vezetési sáv energia- szintjének különbségét (Eg, 2. ábra). Ebben az esetben a foton abszorpcióját követően elektron kerül a vegyértéksávból a vezetési sávba (ecb-), miközben a vegyértéksávban visszamarad egy elektronhiányos hely (lyuk, hvb+). Az elektron-lyuk pár gyors rekombinációja a félvezető bel- sejében és a felületén is bekövetkezhet, ekkor hő termelődik. Ha csak ezek a folyamatok ját- szódnak le, a félvezető nem mutat fotoaktivitást. A rekombinációval a felületen lejátszódó
elektronátadás verseng. A vezetési sáv alsó energia szintje az elektron aktuális redukciós po- tenciálját, míg a vegyértéksáv felső energiaszintje a lyuk oxidáló képességét határozza meg.
Az adszorbeált molekulát a vezetési sáv elektronja redukálhatja, ha a redoxipotenciálja pozití- vabb, mint a vezetési sáv potenciálja. A lyuk akkor oxidálhat (vehet fel elektront), ha negatí- vabb az adszorbeált anyag redoxipotenciálja, mint a vegyértéksáv potenciálja.
2. ábra: A gerjesztett félvezető részecskén lejátszódó folyamatok [20].
A gerjesztett félvezető fotoindukált redoxireakcióinak kvantumhasznosítási tényezője ak- kor nagy, ha a heterogén rendszerben erős elektrondonor (D) és elektronakceptor (A) moleku- la egyaránt megtalálható, azaz a redoxireakciók hatékonyan versenyezhetnek a részecske felü- letén lejátszódó rekombinációval.
3.2.2. A fotokémiai rendszerekben használt félvezetők
Gyakorlati szempontokat is figyelembe véve a félvezetőnek az alábbi tulajdonságokkal kell rendelkezni [19, 20]:
• fotoaktivitás – képes legyen a látható és/vagy az UV fény hasznosítására,
• biológiai és kémiai inertség,
• fotostabilitás,
• alacsony ár.
Eg Vezetési sáv (cb)
Vegyértéksáv (vb) hν
Akceptor
Akceptor
Donor Redukció
Oxidáció Energia
Donor
Leggyakrabban egyszerű oxid és szulfid félvezetőket alkalmaznak: ha az áramot túlnyomó részt az elektronok vezetik, n-típusú (TiO2, ZnO, CdS), ha pedig döntően a lyukak, akkor p- típusú (NiO, Cr2O3, Cu2O) a félvezető [1]. A ZnO kis pH-jú vizes oldatokban fény hatására instabillá válhat. A WO3 gerjesztési küszöbenergiája kisebb, mint a TiO2-é, de aktivitása is kisebb [21]. A kis gerjesztési küszöbenergiájú félvezetők általában nem stabilak, a fotokatalízis alatt elbomlanak, beoldódnak a vizes fázisba. A szulfid típusú félvezetők a fotokorrózióval szemben nem ellenállók. Az általános tapasztalatok azt mutatják, hogy a TiO2
az egyik legmegfelelőbb katalizátor, ugyanis a fent említett szempontokat kielégíti [22].
Egyetlen hátrányos tulajdonsága, hogy a tiltott sáv szélessége viszonylag nagy, ezért a félve- zető részecskék a Nap Föld felszínére érkező sugárzásának csak kis hányadát nyelik el.
A titán-dioxid három kristály módosulata található meg a természetben:
(i) anatáz: Hauy adta ezt a nevet 1801-ben a görög anatasis (kiterjesztett) szóból. Rácsa különleges felépítésű, az oktaéderek valamennyi szomszédjukhoz közös élen csatlakoznak, egy oktaéderhez azonos módon négy másik kapcsolódik [22].
(ii) rutil: 1803-ban Werner fedezte fel, neve a latin rutilus (piros) szóból származik, ami arra utal, hogy mély piros szín figyelhető meg néhány darabjában, ha fényt nyel el. Elemi cellája térben centrált, melyben a hat anion átlós helyzetű. Ezek közül négy csak félig, kettő pedig egészen a cellához tartozik oktaédert alkotva [22].
(iii) brookit: felfedezése Levy (1825) nevéhez fűződik, elnevezése az angol geológus, Brooke emlékét őrzi. Rácsszerkezetében az oktaéderek három közös éllel három másikhoz kapcsolódnak. Ezek közül kettőnek azonos az orientációja, így a c kristálytani tengellyel pár- huzamosan váltakozva megtört, zegzugos lefutású lánc jön létre. A harmadik oktaéder az előbbiekhez ugyancsak éllel csatlakozik, hálózattá fűzve össze a láncokat [22].
A módosulatok közül termodinamikailag a rutil a legstabilabb, a másik kettő hevítve rutil- lá alakul. A brookit előállítása költséges, ezért fotokémiai vizsgálatokhoz általában csak az anatázt és a rutilt használják. Az anatáz minimális gerjesztési energiája 3,23 eV (λ=384 nm), a rutil TiO2-é 3,02 eV (λ=411 nm) [23]. Az anatáz általában nagyobb fotoaktivitást mutat a legtöbb rendszerben, mint a rutil [24]. Ennek oka, hogy az anatáz Fermi szintje nagyobb, ki- sebb az O2-adszorpciós képessége, nagyobb a felületi hidroxilcsoportok sűrűsége. A kutatók olyan fotokémiai rendszerekről is beszámoltak, amelyekben a rutil kristályforma bizonyult hatékonyabbnak [25, 26], illetve olyan reakciók is ismeretesek, amelyek mindkét fázisra azo- nos fotoaktivitást mutatnak [27, 28]. Gyakran használnak keverék katalizátort, a fotoaktivitás jelentősen függ az anatáz/rutil aránytól. A kereskedelmi forgalomban kapható katalizátorok
fotokatalitikus aktivitással, jelenleg ez az elfogadott standard a környezetvédelmi technológi- ákban [29, 30].
Különböző előállítási módszerek ismeretesek, amelyekkel por, kristályos vagy vékony film formában kaphatjuk meg a katalizátort néhány nm-es nagyságtól egészen néhány µm-ig.
Az oldatfázisú szintézis előnye: ellenőrizni lehet a sztöchiometriát, homogén anyag képződik.
Hátránya: a költséges prekurzorok, a hosszú előállítási folyamat. Lehetséges eljárások: csapa- dék képződéses [31], szolvotermikus [32], különböző szol-gél [33, 34], mikroemulziós [35] és elektrokémiai módszer [36]. Gázfázisú eljárásokkal legtöbbször vékony katalizátor filmet állítanak elő [37, 38].
A titán-dioxiddal a mindennapi életben is gyakran találkozunk élelmiszerekben, gyógy- szerekben és festékekben fehérítőszerként. Kimutatták, hogy a nanoméretű TiO2 rágcsálókban tüdőrákot okoz. A kisméretű, nagy fajlagos felületű részecskék könnyen bediffundálnak a szövetekbe, és ott katalizálják a szabadgyökök hatékony keletkezését, amelyek oxidatív DNS- károsodást okozhatnak a sejtekben [39]. Naihao és munkatársai a naptejekben lévő TiO2 bőr- re gyakorolt hatását tanulmányozták [40]. A bőrbetegségek egyik okozója lehet a 3- nitrotirozin. A kutatók különböző katalizátorokon vizsgálták nitrit-tartalmú oldatokban – a verítékhez hasonló összetételűekben – a tirozin fotokatalitikus nitrálását. A 100% anatáz-, illetve a Degussa P25 TiO2-tartalmú szuszpenziókban semleges pH-tartományban jelentős, míg a 100% rutil-tartalmúakban kismértékű fotoaktivitást tapasztaltak. Eredményeik alapján megállapítható, hogy UV sugárzás hatására a bőr fotokatalitikus sérülést szenvedhet, azaz vigyázni kell a TiO2-tartalmú naptejek használatakor.
Az öntisztuló felületek megoldást jelenthetnek a fertőtlenítésre az egészségügyben. Az el- járás során 5-10 nm átmérőjű ezüst és titán-dioxid részecskéket alkalmaznak, amelyekből kolloid állapotú nanodiszperz rendszer keletkezik. Tömör, vékony filmréteget alakítanak ki a különböző felületeken, pl. acélon, üvegen, kerámián. A titán-dioxidot tartalmazó filmréteg ultraibolya sugárzásban gazdag fény hatására bármely további vegyi anyag használata nélkül elpusztítja a baktériumokat [17].
3.2.3. Gerjesztett félvezetőn lejátszódó folyamatok
A heterogén fotokatalitikus rendszerekben lejátszódó legfontosabb fizikai és kémiai lépé- sek [41]:
• a katalizátor felületére irányuló anyagtranszport
• a szuszpenzióban oldódott anyagok adszorpciója a félvezető felületén
• elektron-lyuk párok keletkezése megfelelő hullámhosszúságú foton elnyelésekor:
TiO2 + hν → TiO2(ecb- + hvb+) (1)
• a fotogenerált {ecb-
, hvb+
} párok gyors rekombinációja a félvezető belsejében:
TiO2(ecb-
+ hvb+
) → TiO2 + hő (2)
• az elektronok és a lyukak vándorlása a felülethez
• a részecskepár rekombinációja a katalizátor felületén:
TiO2(ecb- + hvb+) → TiO2 + hő (3)
• az elektronok és a lyukak szétválasztása (befogása) a félvezető felületén található
„csapdák” révén
• az elválasztott töltések redoxifolyamatai a felületen adszorbeált anyagokkal:
TiO2(ecb-) + O2ads → TiO2 + O2•-ads (4)
TiO2(ecb-
) + Aads → TiO2 + A•-ads (5)
TiO2(hvb+
) + H2Oads → TiO2 + •OHads + H+ (6)
TiO2(hvb+) + OH-ads → TiO2 + •OHads (7)
TiO2(hvb+
) + Dads → TiO2 + D•+ads (8)
• a keletkezett termékek deszorpciója és a felület rekonstrukciója
• a deszorbeálódott részecskék folyadék- vagy gázfázisú reakciói
A fotogerjesztéshez kapcsolódó elsődleges folyamatok és a hozzájuk tartozó időtartamok megismerését lézer villanófény fotolízissel elvégzett kísérletek tették lehetővé [42]. A felületi töltésátvitel kvantumhatásfokát a rekombináció (ps) és a befogás (ns) közötti verseny, vala- mint a befogók rekombinációja (µs) és a felületi töltésátvitel közötti verseny (ms) határozza meg.
A szerves vegyületek oxidációja – ami a szubsztrát teljes mineralizációjához vezethet – gerjesztett katalizátor jelenlétében különböző mechanizmusok szerint mehet végbe:
• Közvetlen oxidáció: a katalizátor gerjesztését követően keletkező pozítív lyukak és a szerves molekulák közötti reakció (8). Itt kell megjegyezni, hogy a rendszerben jelen- lévő oldott oxigén nemcsak elektronbefogóként jelentős, hanem előidézheti a szerves anyag oxidációját is.
• Közvetett oxidáció: a gerjesztést követően az elsődleges, illetve a másodlagos reakció- ban képződő reaktív, oxigéntartalmú részecskék – hidroxilgyök, szuperoxid- gyökanion, hidroperoxilgyök, hidrogén-peroxid és a szingulett oxigénmolekula – ho-
mogén fázisban lejátszódó reakciói a szerves molekulákkal. A primer gyökök reaktivi- tása a következő sorrendben változik: •OH>>O2•-
>HO2•.
Hidroxilgyök: A legelfogadottabb nézetek szerint a heterogén fotokatalízis kulcsfontossá- gú szereplője. Az elsődleges elektronátadási folyamatokban (6 és 7), illetve az azokat (4) kísé- rő termikus reakciókban képződhet a félvezető felületén vagy a folyadékfázisban. Rövid élet- tartamú, elektrofil karakterű, különösen erős, nem szelektív oxidáló ágens (oxidációs potenci- álja 2,8 eV, csak a fluoré nagyobb) [43], detektálása nagy reakciókészsége miatt nehéz. Fon- tos információ lehet a reakció mechanizmusának tisztázása, valamint a katalizátor fotoaktivitásának megítélése szempontjából, ha tudjuk az adott körülmények között képződő hidroxilgyök mennyiségét. Ishibashi és munkatársai kumarint használtak hidroxilgyök- befogóként [44, 45]. A keletkező 7-hidroxi-kumarin intenzív emissziót mutat, mennyisége a fluoreszcencia intenzitásának mérésével könnyen nyomon követhető, az eredményekből meg- határozható a reaktív gyök képződésének sebessége és mennyisége. Czili és munkatársa meg- határozták a •OH-mérés optimális koncentrációviszonyait az általunk is alkalmazott kísérleti körülményekre [46].
Az oxidáló részecske vagy a felületen kötött formában, vagy diffúzió révén bekerülve a homogén fázisba reagálhat a szerves anyaggal (R). Lehetséges reakciók:
hidrogénelvonás: •OH+ RH → H2O + R• (9)
addíció: •OH+R → ROH• (10)
elektronátmenet: •OH+ Rn+ → OH- + R(n+1)+ (11)
rekombináció: •OH+R• → ROH (12)
A szerves molekulából képződő széncentrumú gyökre (R•) oldott oxigént tartalmazó olda- tokban O2 addicionálódhat:
R• +O2 → ROO• (13)
A peroxilgyökök (ROO•) uni- vagy bimolekuláris reakciókban alakulhatnak át, jellemző reakcióik: szerves peroxidokat eredményező hidrogénelvonás, különböző intra- és intermolekuláris gyökaddíció, töltésátvitel, valamint a gyökrekombináció, amelynek során labilis tetroxidok keletkeznek [1].
Szuperoxid-gyökanion, hidroperoxilgyök: A fotogenerált elektron reakciójában (4) hatásos oxidáló ágens (O2•-) képződik. Létezését fotokatalitikus rendszerekben ESR spektroszkópiá- val igazolták [47]. Nosaka és munkatársai a luminol kemilumineszcenciáján alapuló új, érzé-
keny módszert javasoltak kimutatására [48]. A gyökanion rekombinációja kis sebességgel játszódik le, gyakorlatilag elhanyagolható, savas pH-tartományban viszont gyorsan protonálódik (pKa(HO2•
/O2•-
)=4,8 [49]), a hidroperoxilgyök oxidációs potenciálja (pH=0) 1,7 V [43]. A gyökök (O2•-/HO2•) további reakcióiban erélyes oxidáló részecskék keletkezhetnek [50]:
gerjesztett oxigénatom:
O2•-ads+ TiO2(ecb-) → TiO2 +2O−ads (14)
O−ads + TiO2(hvb+) → TiO2 + O* (15)
hidrogén-peroxid:
HO2• + TiO2(ecb-) + H+ → H2O2 + TiO2 (16)
HO2• +HO2• →H2O2 + O2 (17)
szingulett oxigén:
HO2• +htr+
→ O2(1∆g) + H+ (18)
ahol: htr+ a csapdázott lyuk, oxidációs hajtóereje kisebb, mint a hvb+-é.
A szuperoxid-gyökanion deszorpciója savas vagy enyhén savas szuszpenzióban a pozitív töltésű félvezető felületéről – ellentétben a hidroxilgyökkel – nem kedvezményezett. Egyes kutatók szerint nem járul hozzá közvetlenül az oldatban végbemenő oxidációhoz [51], más szerzők viszont eredményeik alapján valószínűsítik, hogy reagálhat a kiindulási anyaggal, az átalakulás során képződő köztitermékekkel, illetve a peroxilgyökökkel is [50]. A gyökaniona szerves vegyületek közül a kinonokkal reagál viszonylag nagy reakciósebességi együthatóval, egyébként kisebb reaktivitású részecskének tekinthető [52]. Jellemző reakciói: hidrogénabszt- rakció, gyökaddíció, illetve a töltésátviteli reakciók.
Hidrogén-peroxid: Az elsődleges fotokémiai reakciókban képződő aktív gyökök termikus reakcióiban keletkezik (16, 17 és 19):
•OH + •OH → H2O2 (19)
A H2O2 változatos reakcióiban további oxidatív gyökök képződnek [53]:
H2O2 + TiO2(ecb-
) → TiO2 + •OH + OH- (20)
H2O2 + TiO2(hvb+) + 2OH- → TiO2 + O2•- + 2H2O (21)
H2O2 + •OH → HO2• + H2O (22)
HO2• + H2O2 → •OH + H2O + O2 (23)
A H2O2 megfelelő energiájú ibolyántúli sugárzás hatására szinte maximális kvantumhasz- nosítással (φ=1) hidroxilgyökké alakul [54]:
H2O2 + hν → 2•OH (24)
3.2.4. A heterogén fotokatalízis kinetikája
Valamely anyag átalakulásakor a kémiai reakció sebességét (az egymást követők közül) a leglassúbb elemi reakciólépés sebessége határozza meg. Katalizátort tartalmazó, jól kevert szuszpenziókban a reakciósort indító, töltésátmenettel járó folyamatoknak hatékonyan kell versenyezni az elektron-lyuk pár rendkívül gyors rekombinációjával (ps), hogy a kémiai át- alakulás megtörténjen. Egyes szerzők feltételezik a töltéscsapdázó részecskék (elektronakceptorok, pl: O2, fémionok; elektrondonorok, pl: vízmolekulák, hidroxidionok, szerves szubsztrátok) adszorpcióját a katalizátor felületén, azaz a mért (látszólagos) sebesség- ben az adszorpciós folyamatok is jelentős szerepet játszanak [55]. Ugyanakkor más tanulmá- nyok szerint nem feltétlenül szükséges az adszorpció, mivel a hidroxilgyök könnyen diffundál az oldatba [56, 57]. Mindazonáltal a kinetikai adatokat többnyire az adszorpciós modellek alapján értékelik. A leggyakrabban alkalmazott Langmuir-Hinshelwood modell (L-H), amit folyadék és gázfázisú katalitikus rendszerekben is használnak [58, 59], azon a feltevésen ala- pul, hogy a reaktáns és a termék diffúziójának nincsen sebességmeghatározó szerepe, a felüle- ten szorpciós egyensúly áll be. Az L-H összefüggés alakja egyszerű rendszer esetén:
Kc kKc dt
r dc
= +
−
= 1 (25)
ahol: r – a szerves anyag lebomlásának kezdeti sebessége, mol dm−3 s−1 c – az anyag kezdeti koncentrációja, mol dm−3
k – a látszólagos sebességi együttható, mol dm−3 s−1
K – a reaktáns adszorpciós egyensúlyi állandója, dm3 mol−1
A fotokatalitikus degradáció sebessége egyaránt függ k és K értékeitől. Ezzel magyarázha- tó, hogy a nagyobb adszorpciós állandó nem jelent mindig nagyobb reakciósebességet, illetve, hogy a fotokatalikus oxidáció sebessége a hőmérséklet kismértékű változtatásakor alig válto- zik. A hőmérséklet növelése domináns lehet a vezetési sávból az oxigénmolekulára irányuló elektronátadásra, valamint az intermedierek deszorpciója is kedvezményezetté válhat, ami a reakciósebesség növekedéséhez vezet. Ugyanakkor a hőmérséklet növelése a szubsztrát de- szorpciójának is kedvez, ami a reakciósebesség csökkenését eredményezi, azaz a fotooxidáció
sebességét meghatározó látszólagos sebességi együttható (k) és az adszorpciós egyensúlyi állandó (K) ellentétes irányba változik a hőmérséklet függvényében.
A reakciósebesség több működési paraméter függvénye: ilyen pl. a katalizátor mennyisé- ge, a szennyezőanyag koncentrációja, a hőmérséklet, az oldott oxigén mennyisége, a fény- áram sűrűsége, az áramlási sebesség és a reakcióelegy pH-ja [22].
3.3. Az oxálsav fotooxidációja
A fotokatalizátor hatékonyságát vizsgáló kísérleti munkában modellvegyületként a dikarboxilsavak közé tartozó oxálsavat választottuk. Különböző ipari folyamatok (fémkohá- szat, textilipar) mellékterméke, így a szennyvizek gyakori komponense. TiO2 jelenlétében végzett fotokémiai lebontásakor stabil intermedier képződése nélkül szén-dioxiddá és vízzé alakul, bomlási mechanizmusa egyszerű, ezért más kutatók is szívesen alkalmazzák:
(i) különböző módszerrel előállított katalizátorok hatékonyságának vizsgálatára [60], (ii) módosított felületű katalizátorok – arannyal [61], platinával [62], vassal [63] – tesztelésére,
(iii) a nagyhatékonyságú oxidációs eljárások (pl. heterogén fotokatalízis és Foto-fenton) kombinálásakor [64],
(iv) különböző geometriájú reaktorok teszteléséhez [65],
(v) napfénnyel működő berendezések műveleti paramétereinek optimalizálásához [66, 67].
Fahmi és munkatársai részletesen tanulmányozták az oxálsav, a hidrogén-oxalát ion és az oxalát anion adszorpcióját anatáz és rutil módosulatokon [68]. Megállapították, hogy az anatáz módosulaton nagyobb az adszorpciós energia, mint a rutilon. Termodinamikailag a legkedvezőbb elrendeződés, amikor az oxalát anion két oxigénatomja két fémionhoz kapcso- lódik. Roncaroli és munkatársa FTIR-ATR technika alkalmazásával vizsgálták különböző fajlagos felületű és szemcseméretű katalizátorokon az oxálsav adszorpciójának kinetikáját [69].
A vegyület fotokatalitikus bomlására javasolt mechanizmusok:
(i) Hermann és munkatársai szerint a lebontást a katalizátor felületén adszorbeálódott oxigénmolekulából keletkező (4, 14 és 15) gerjesztett oxigénatomok végzik [70]:
O* + H(COO)2-
→ O = C(OH)O− + CO2 (26)
O = C(OH)O− + H+ → CO2 + H2O (27)
(ii) Kosanić a lebomlást a CO2 képződésének követésével vizsgálta [71]. Eredményei alapján a TiO2 gerjesztésekor keletkező lyuk és a felületen adszorbeálódott H2O/OH- reakció- jában képződő hidroxilgyökök (6 és 7) támadják meg a C-C kötést, a keletkező •COOHoxi- génnel reagálva tűnik el:
HC2O4− + •OH→ HO− + •COOH + CO2 (28)
•COOH + O2 → HO2• + CO2 (29)
A HO2• gyökök rekombinációja hidrogén-peroxid keletkezéséhez vezet (17). Ezt Kosanić nem tudta kimutatni, ami azzal magyarázható, hogy a H2O2 reakcióba léphet az elektronokkal (20), a lyukakkal (21) és a hidroxilgyökökkel (22) is [53].
(iii) Az oxálsav hatékony lyukbefogó, a hidrogén-oxalát ionról a fotogenerált lyukra irá- nyuló elektronátadás szén-dioxid gyökanion képződéséhez vezet, a reakció előfeltétele a HC2O4− adszorpciója a katalizátor felületén [72, 73]:
HC2O4− +TiO2(hvb+
) → TiO2 + •CO2-
+ CO2 + H+ (30)
A keletkezett •CO2- is reagálhat a lyukkal,
•CO2-
+ hvb+
→ CO2 (31)
illetve bimolekuláris reakcióban átalakulhat hidrogén-oxaláttá, 2•CO2-
+ H+ → HC2O4− (32)
vagy diszproporcióval szén-dioxiddá és formiátionná:
2•CO2- + H+ → HCO2− + CO2 (33)
A formiátion további reakcióiban (34 és 35) is szén-dioxid gyökanion keletkezik [74, 75]:
HCOO- + •OH → •CO2- + H2O (34)
HCOO- + hvb+
→ •CO2-
+ H+ (35)
A H2C2O4 fotoelektrokémiai viselkedését anatáz TiO2 felületén vizsgálták, kezdeti kon- centrációja és a mért áram közötti lineáris összefüggés bizonyítja, hogy az oxálsav közvetle- nül reagál a lyukkal [76, 77].
Sebesta és munkatársai részletesen tanulmányozták a dikarbonsav fotooxidációját TiO2
felületén [78]. Vizsgálták a levegőáramnak, a katalizátor mennyiségének, a hőmérsékletnek és a közeg pH-jának hatását. A katalizátor koncentrációjának növelésével a lebontás hatékony- sága is nő egy, a rendszer egyéb paramétereitől is függő maximális értékig, majd csökken. A vegyület degradációjának sebessége kb. 3,0-as pH-értékig nő, a lúgos tartomány felé haladva
3.4. A TiO
2fotokatalitikus hatékonyságának növelése
A szerves vegyületek heterogén fotokatalitikus oxidációjának hatékonysága viszonylag kicsi. Ahhoz, hogy az eljárás a gyakorlati életben felmerülő problémák megoldására is alkal- mas legyen a katalizátorok aktivitásának növelése szükséges. Ennek lehetséges útjai:
(i) a fotoindukált töltésszétválás hatékonyságának növelésével az elektron-lyuk pár re- kombinációjának csökkentése, illetve
(ii) a nagy sávszélességű félvezetők (∆E>3eV) gerjeszthetőségének kiterjesztése a látha- tó fény tartományára.
A fotoaktivitás növelésére irányuló törekvéseket az alábbiakban mutatom be:
(i) Különböző félvezetők összekapcsolása: Az SnO2–TiO2 együttes alkalmazásakor je- lentősen megnő a rodamin-B fotobomlásának sebessége, ugyanis csökken a töltés- rekombináció valószínűsége: a fotogenerált lyukak a TiO2 (Ecb= -0,34 eV, Evb=2,87 eV), míg az elektronok az SnO2 (Ecb=0,7 eV, Evb=3,67 eV) felületén halmozódnak fel [79]. A TiO2 és a CdS (Ecb= -1,0 eV, Evb=1,67 eV) kombinálásakor a lyukak a CdS felületén, az elektronok a TiO2 felületén halmozódnak fel, és az oxigén általi hatékony elektronbefogás következtében megnő a szuperoxid-gyökanion képződésének valószínűsége [80]. A CdS korróziójának meg- előzése céljából erős elektrondonort (szulfid- vagy szulfitiont) adagolnak a szuszpenzióba [81].
(ii) Érzékenyítés szerves vegyületekkel vagy szervetlen fémkomplexekkel: A katalizátor felületének módosítása különböző festékekkel és komplexekkel a fényelnyelés vörös eltolódá- sát eredményezheti. Hilal és munkatársai 2,4,6-trifenilpirilium hidrogén-szulfáttal módosított TiO2-ot alkalmaztak fenol és benzoesav fotodegradációjakor [82]. Gilma és munkatársai a fenol bomlását Zn(II)- és Co(II)tetra-karboxi-ftalocianinnal érzékenyített platinázott TiO2
felületén vizsgálták [83]. A gerjesztett (λ=670 nm) érzékenyítőről elektronátvitel történik a TiO2 vezetési sávjába, megnő a szuperoxid-gyökanion képződésének a valószínűsége.
(iii) TiO2 módosítása fémionokkal: Mind a természetes, mind a szennyvizekben előfor- duló fémionok jelentősen befolyásolhatják a fotokémiai reakciók sebességét és hatékonyságát.
A kísérleti munkában az egyszerű átmeneti fémionokkal módosított fotokatalizátorokat része- sítik előnyben [84-95]. A kapott eredmények igen változatosak, ugyanis a katalizátor haté- konyságát jelentősen befolyásolja a preparálás módja, a beépített ionok fizikai és kémiai tu- lajdonságai. Sykora és munkatársai megállapították, hogy az egyik alapvető paraméter a fém- ion/fém párok standardpotenciálja [87, 88]. A fémion csak akkor redukálható a gerjesztett
jánál. A katalizátor rácsába „beépített” szennyezők növelhetik a hibahelyek számát, ezáltal hatékonyabbá válhat az elektron- és lyukcsapdázás. A fémionok közül azok alkalmazásától várható aktivitást növelő hatás, amelyek elektron-, valamint lyukcsapdaként is működnek. A vas(III)ionból elektronbefogással Fe2+, lyukbefogással Fe4+ képződik. Mindkettő ion instabil, könnyen adnak át elektront a felületen adszorbeálódott oxigénnek, valamint lyukat a hidroxilcsoportnak, azaz csökken a részecskepár rekombinációjának valószínűsége [96].
Lantanoida ionokkal (pl. Th4+) módosított katalizátor aktivitás-növekedésének okai: (a) inten- zív abszorpciós sávok a látható tartományban (460-482 nm), (b) megnő a katalizátor fajlagos felülete, azaz kedvezményezetté válik a szennyező anyagok adszorpciója a felületen, ugyanis könnyen képezhetnek komplexet a fémion üres f pályáival [97]. A mesterségesen beépített szennyezők nemcsak a félvezető elektroneloszlását módosíthatják, hanem megnövelhetik a felület savasságát is (pl. a Mo6+), így megnő a reaktánsok adszorpciója, hatékonyabbá válnak a felületi töltésátviteli folyamatok [98]. Murakami és munkatársai Fe3+, Cu2+, Ni2+, Cr3+ io- nokkal módosított katalizátorok aktvitását vizsgálták acetaldehid oxidációjakor [99]. Megál- lapították, hogy a fémionok a TiO2 felületén UV besugárzás során elektronakceptorként, míg a látható tartományban elektrondonorként viselkednek. A fotooxidáció sebességét a fémionok nemcsak heterogén úton növelhetik, hanem részt vehetnek homogén Fenton-típusú reakciók- ban is, amelyek során hidroxilgyökök keletkeznek.
(iv) TiO2 módosítása nemfém ionokkal: Khan és munkatársai szénnel szennyezett rutil TiO2-ot állítottak elő, a katalizátor gerjesztési küszöbenergiája 3,0 eV-ról 2,3 eV-ra csökkent [100]. Nagaveni és munkatársai kísérleteikben a glicerint alkalmazták szénforrásként, az így előállított C–TiO2 megnövelte a metilénkék degradációjának sebességét [101]. A felületmó- dosítás hatására nőtt a katalizátor fajlagos felülete, valamint a felületen a hidroxil- és a savas csoportok száma. Hidrotermikus kezeléssel glükóz oldatból előállított katalizátor 13-szor na- gyobb aktivitást mutatott a 4-klórfenol degradációjára, mint a tiszta katalizátor [102]. N-nel történő módosítás megnöveli mind a metilénkék [103], mind a rodamin-G [104]
fotooxidációjának sebességét. A fotoaktivitás növekedésének oka a látható tartománybeli ab- szorpció és a töltéshordozók mobilitása. Li és munkatársai nagy fotokatalitikus aktivitást mu- tató, fluorral módosított katalizátort állítottak elő H2TiF6 oldatából [105].
(v) Kettős módosítás: Két vagy több ionnal végzett felületmódosításkor jelentős szinergikus hatás érhető el. A Fe3+–Ho3+–TiO2 esetében a vas(III)ionok széles abszorpciós sávja megnöveli a TiO2 fényhasznosítását, a holmium(III)ionok gátolják a szemcseméret nö- vekedését és megakadályozzák a töltéshordozók rekombinációját [106]. A N–F–TiO2 katali-
fotooxidációjának sebességét növelte meg [107]. A La–I–TiO2 katalizátor eredményesen al- kalmazható az oxálsav degradációjakor [108]. A La2O3 gátolja a töltéshordozó részecskék rekombinációját, a jodidion „beépítése” kiterjeszti a fényelnyelést a látható tartományba.
(vi) Fémmel módosított TiO2: Ha a katalizátor felületét nemesfémmel módosítjuk, akkor a kirakódott fém elektroncsapdaként viselkedik, az elektron akkumulálódik a fémlerakódás felületén. A fém Fermi szintje a negatív potenciálok felé tolódik, ami jobb töltésszeparációt és reduktívabb tulajdonságot okoz. Másrészt a „színes” katalizátor fényelnyelése megnő a látha- tó tartományban. Pt–TiO2 hatását vizsgálták víz-metilalkohol elegyekből történő H2- fejlesztéskor: a platinázott anatáz hatékonysága nőtt, míg a Pt–rutilé nem [109]. Ugyanakkor a Pt–rutil nagyobb fotoaktivitást mutatott, mint a Pt–anatáz a triklórecetsav degradációjában inert atmoszférában, míg levegő jelenlétében ellentétes tendencia tapasztalható. Fe3+–TiO2
katalizátor felületét arannyal módosították, s szinergikus hatás lépett föl. A jelenséget azzal magyarázták, hogy a vas(III)ionok kiterjesztik az abszorpciót a látható tartományba, míg az aranyleválás elektroncsapdaként viselkedik [110].
(vii) Felületi töltésátviteli folyamatok sebességének növelése: Ha a katalizátor felületi hidroxilcsoportjait fluoridionra cseréljük, akkor a gerjesztés hatására képződött lyukak a víz- molekulákkal reagálnak, a fő oxidálóágens a szabad hidroxilgyök lesz [111]. F–TiO2–Pt kata- lizátoron jelentősen megnő a 4-klórfenol bomlási sebessége: a fluorral bevont felületen szabad hidroxilgyök képződik, míg az elektron a platinázott rész által fogódik be.
(viii) Oxidálószer adagolása: Az oxidálószerek (pl. H2O2, S2O82-) növelik a befogott elektronok számát, ezáltal csökken az {ecb-, hvb+} rekombinációjának valószínűsége, több sza- badgyök képződik, s ennek következtében megnő az intermedierek oxidációjának sebessége is [112]. A perszulfátion jobb elektronbefogó, mint a molekuláris oxigén, a befogással keletke- zett szulfát-gyökanion stabilabb, mint a hidroxilgyök. Másik fontos tényező, hogy megnő a felület savassága, ezáltal kedvezményezetté válik a szennyezőanyagok adszorpciója [113].
3.4.1. Fotokatalízis ezüstionok jelenlétében
Az első kísérletek a fém leválasztására irányultak: ezüst(I)sók TiO2 vagy ZnO katalizátort tartalmazó vizes oldatát UV fénnyel világították meg, oxigén fejlődését, ezüst lerakódását és az oldat savasodását figyelték meg [114-116]:
4Ag+ + 2H2O → 4Ag0 + O2 + 4H+ (36)
Othani és munkatársai is hasonló eredményekről számoltak be [117-119]. Megállapítot-
szorpció miatt), illetve a különböző szervetlen anionok jelenlétében a következő sorrend sze- rint változott: ClO4-<NO3-~SO42-<F-~PO43-. Clark és munkatársa infravörös spektroszkópiai vizsgálatok alapján arra következtettek, hogy a félvezető felületére lerakódott anyag fém ezüst [114], más szerzők viszont Ag–O–Ti típusú „képződmény”-ként azonosították, ami az ezüst(I)ionok kemiszorpciója révén keletkezik [117]. Nemcsak a lerakódott ezüst típusát, ha- nem méretét tekintve is eltérőek a vélemények. Hermann és munkatársai gömbszerű, 20 Å átmérőjű ezüstöt találtak [120]. Az alkalmazott félvezető fajtája nagymértékben befolyásolja a lerakódás természetét. Sclafani kutatócsoportja fenol és nitro-fenol fotodegradációját vizsgál- ta „ezüstözött” TiO2 katalizátor felületén [121]. Megállapították, hogy az ezüst hatékony elektronbefogóként viselkedik, megnő a félvezető fotokatalitikus aktivitása. Transzmissziós elektron mikroszkópos (TEM) méréseik szerint a Degussa P25 típusú TiO2 felületén kiváló ezüst homogén eloszlású és 2-8 nm nagyságú részecskékből áll, míg BDH TiO2 alkalmazása- kor különböző méretű és alakú agglomerálódott részecskék találhatók a felületen [122].
Jól ismert fotokatalitikus reakció az alifás karbonsavak Pt–TiO2 jelenlétében végzett anae- rob dekarboxilezése, melynek végterméke rendszerint szénhidrogén és CO2, valamint kis mennyiségű hidrogén. Sakata és munkatársai Ag(I)ionok jelenlétében nagy sebességnöveke- dést tapasztaltak hidrogén képződése nélkül [123]. Ez a jelenség arra utalt, hogy nem a proto- nok, hanem az ezüst(I)ionok fogyasztják az elektront, ezáltal a rekombináció sebességét jelen- tősen lecsökkentik.
Ag–TiO2-ot tartalmazó szuszpenziókban jelentős sebességnövekedés figyelhető meg a fe- nol [124], a 4-klórfenol [125], 2,4,6-triklórfenol [126] és különböző azofestékek [127]
fotooxidációjakor.
Tran és munkatársai célja a katalizátor felületére leválasztott ezüst szerepének kiderítése volt [95]. Ehhez számos szerves vegyület (szénhidrátok, karbonsavak, alkoholok fenolok) fotodegradációját tanulmányozták. Megfigyeléseik szerint a felületmódosítás hatására az al- koholok és a fenolok – az előzőekkel [121, 124] ellentétes megállapítás – esetében nincs je- lentős sebességnövekedés, míg a karbonsav- és a szénhidrát-tartalmú reakcióelegyekben a mineralizáció sebessége megnő. A katalizátor felületére leválasztott ezüst elektroncsapdaként működik, csökken az elektron-lyuk rekombináció valószínűsége, megnő a lyukak száma is.
Véleményük szerint az ezüstözés elsősorban azoknak a szerves vegyületeknek a mineralizáci- óját növeli meg, amelyek a lyukak által oxidálódnak (például: oxálsav, maleinsav).
A kutatási eredmények egyértelműen mutatják, hogy az ezüstion számos szerves vegyület TiO2-dal katalizált fotooxidációját meggyorsítja. Ugyanakkor mind a TiO2 szerkezete, mérete


![Megvizsgáltuk mindkét rendszer hatásszínképét 350 és 450 nm között (10. ábra), melye- melye-ket összehasonlítva a következő megállapításokat tehetjük [164]:](https://thumb-eu.123doks.com/thumbv2/9dokorg/874217.47039/49.892.248.638.687.1024/megvizsgáltuk-mindkét-rendszer-hatásszínképét-összehasonlítva-következő-megállapításokat-tehetjük.webp)