MTA Doktori Értekezés
A H-faktor molekulacsalád tagjainak élettani funkciója és szerepük komplement-közvetítette betegségekben
Józsi Mihály
MTA-ELTE „Lendület” Komplement Kutatócsoport Eötvös Loránd Tudományegyetem, Immunológiai Tanszék
Budapest, 2017
Tartalomjegyzék
Rövidítések jegyzéke ………... 2
1. Bevezetés ... 3
2. Tudományterületi háttér ...………...……... 4
A komplementrendszer aktivációja és működésének szabályozása ……… 4
A H-faktor molekulacsalád tagjai és szerepük betegségekben ..……….. 9
3. Célkitűzések ...………...…... 18
4. Anyagok és alkalmazott módszerek ... 19
5. Eredmények és megbeszélésük ... …………..… 23
5.1. A H-faktor szerepe a komplementaktiváció gátlásában és ennek összefüggése atípusos hemolítikus urémiás szindrómával ... 23
5.2. H-faktor autoantitestek funkcionális jellemzése ...……… 35
5.3. Az FHR molekulák funkciója ... 54
5.4. Rekombináns mini H-faktor előállítása, jellemzése ………...…... 75
6. Összefoglalás és kitekintés ... 83
Az új tudományos eredmények összefoglalása ……….... 83
Kitekintés, jövőbeni tervek .…...………..…... 85
7. Hivatkozások ... 86
7.1. Saját közlemények ... 86
Az értekezés alapjául szolgáló közlemények ... 86
Az értekezés témájához kapcsolódó közlemények ... 88
7.2. Irodalmi hivatkozások ... 89
8. Tudománymetriai adatok ... 98
9. Köszönetnyilvánítás ... 99
10. Függelék ... 101
Rövidítések jegyzéke
aHUS atípusos hemolitikus urémiás szindróma (atypical hemolytic uremic syndrome) AMD időskori makuladegeneráció (age-related macular degeneration)
BVVS birka vörösvérsejt C1-INH C1-inhibítor C3G C3-glomerulopátia
C4BP C4b-kötő fehérje (C4b-binding protein) CCP complement control protein domain
CFH a H-faktort és az FHL-1 fehérjét kódoló gén CFHR H-faktorral rokon fehérjét kódoló gén CR complement receptor
CR1 1-es típusú komplement receptor CRP C-reaktív fehérje (C-reactive protein) mCRP monomer vagy módosult CRP
pCRP natív, pentamer CRP
DAF lebomblást gyorsító faktor (decay accelerating factor) DDD dense deposit disease
ELISA enzim-kapcsolt immunszorbens esszé (enzyme-linked immunosorbent assay) FHL-1 H-faktor-szerű fehérje 1 (factor H-like protein 1)
FHR H-faktorral rokon (factor H-related) fehérje
HUVEC emberi köldökzsinór-véna endotél sejt (human umbilical vein endothelial cell) MCP membrán kofaktor fehérje (membrane cofactor protein)
MPGN membranoproliferatív glomerulonefritisz PNH paroxizmális nokturnális hemoglubinuria PTX3 pentraxin 3
SLE szisztémás lupusz erithematózusz
1. Bevezetés
Immunrendszerünk részeként az ún. veleszületett immunitás biztosítja az azonnali hatékony védelmet a kórokozó mikroorganizmusok ellen, valamint számos más élettani folyamatban is fontos szerepet tölt be. A veleszületett immunitás egyik legfontosabb, testszerte jelen lévő és működő molekuláris eleme a komplementrendszer. A fertőzések elleni védelmen kívül fontos szerepet játszik többek között az elpusztult sejtek, illetve sejttörmelékek eltakarításában, gyulladásos folyamatokban, és befolyásolja a veleszületett és az adaptív immunrendszer sejtjeinek aktiválódását. Régóta ismert, hogy a komplement számos betegség kialakulásában vagy lefolyásában is szerepet játszik. Az utóbbi években azonban egyre több szisztémás és szervspecifikus betegséggel hozták a komplementrendszert kapcsolatba, elsősorban annak túlzott aktivációját, nem megfelelő szabályozását. A komplementaktiváció mértékének és időtartamának megfelelő szabályozása alapvetően fontos ugyanis a szervezetünk sejtjeit, szöveteit károsító hatás megelőzésében, hiszen a rendszer egy potenciálisan nagyon hatékony pusztító mechanizmust biztosít. Mindezek miatt a komplementrendszer nem megfelelő működése, a komplementaktiváció szabályozásának zavarai számos gyulladásos és autoimmun betegségben kimutathatóak. A kutatók érdeklődése mellett a klinikum részéről is egyre nagyobb az igény a komplementdiagnosztikai és célzott terápiás eljárások fejlesztésére, amire válaszul már megjelent az első, komplementet célzó gyógyszer is a piacon.
A komplementrendszer, elsősorban az alternatív komplementaktivációs út szabályozásában a H-faktor nevű szérumfehérjének kitüntetett szerepe van, emiatt több betegség kapcsán is az érdeklődés középpontjába került. A H-faktor és öt ún. H-faktorral rokon (FHR) fehérje – a H-faktor fehérjecsalád tagjai – genetikai vizsgálatok alapján szerepet játszanak többek között a vaksággal járó időskori makuladegeneráció (AMD), valamint a vesét érintő számos megbetegedés (atípusos hemolitikus urémiás szindróma [aHUS], C3 glomerulopátiák [C3G], CFHR5 nefropátia, IgA nefropátia, szisztémás lupusz eritematózusz [SLE]) kialakulásában, de befolyásolják a Neisseria meningitidis által okozott fertőzésre való hajlamot is. A betegségekkel való funkcionális összefüggések azonban csak kevéssé, vagy egyáltalán nem ismertek, főként az FHR fehérjék szerepéről van kevés ismeretünk.
Kutatómunkám során a fehérjék funkciójának részletesebb megismerését, az egyes betegségekben játszott szerepük lehetőség szerinti tisztázását tűztem ki fő célul. Az MTA doktori értekezésem a H-faktor molekulacsalád kutatása során elért eredményeket összegzi.
2. Tudományterületi háttér
A komplementrendszer aktivációja és működésének szabályozása
A komplementrendszer több mint 40 molekulából áll, melyek között plazma fehérjék, a testfolyadékokban és sejtek felszínén expresszálódó szabályozó fehérjék és az egyes molekulákat vagy azok fragmentumait megkötő receptorok találhatók. Az ide sorolható fehérjék egy része mintázatfelismerő funkcióval rendelkezik, azaz bizonyos testidegen (pl.
patogén mikrobák felszínén megtalálható, de a saját sejtjeinkre nem jellemző) molekuláris mintázatokat, köztük mikrobák sejtfalában található jellegzetes szénhidrátcsoportokat, vagy a saját szervezetünkben csak bizonyos körülmények között (pl. szöveti sérülés, sejthalál esetén) hozzáférhetővé váló molekulákat ismer fel, azokhoz kötődik. A felismerő molekulák általában enzimatikus aktivitású komplementfehérjékkel kapcsolódnak, amelyek azután bizonyos komplement komponenseket képesek hasítani. Az így aktivált komponensek teszik egyrészt lehetővé a kaszkád tovább vitelét és felerősítését, másrészt különböző biológiai funkciókat közvetíthetnek (Ricklin et al., 2010).
A komplementrendszer három fő útvonalon aktiválódhat (1. ábra). A klasszikus út aktiválódását a C1 molekulakomplex aktivációja indítja el, melynek során a C1q komponens immunkomplexben lévő immunglobulinhoz, vagy egyes mintázatfelismerő molekulákhoz, így például pentraxinokhoz kötődik, de a C1q kötődhet többek között extracelluláris mátrix fehérjékhez is, vagy közvetlenül az apoptotikus/nekrotikus sejtek vagy mikrobák felszínéhez.
A lektin utat a mannózkötő lektin (MBL) vagy a fikolinok szerin proteázokkal alkotott komplexének bizonyos szénhidrátcsoportokhoz, illetve acetilált molekulákhoz való kötődése aktiválhatja. A klasszikus és a lektin utak aktivációja több lépésben a C4b2b enzimatikus aktivitású komplex, a klasszikus C3 konvertáz kialakulásához vezet, amely a központi komplement komponens, a C3 hasítását végzi C3a és C3b fragmentumokra. Az alternatív út aktivációja kis mértékben folyamatosan, spontán zajlik, melynek során a C3 molekulában található tioészter kötés hidrolízise révén megváltozik a molekula konformációja, és a folyadék fázisban képessé válik a B-faktor megkötésére. Ezáltal kialakulhat az alternatív út ún. kezdeti C3 konvertáz enzime, amely a C3(H2O)Bb komplex (2. ábra). Ez az enzim – hasonlóan a klasszikus és lektin út aktivációja során kialakuló C4b2b C3 konvertázhoz – C3 molekulákat képes hasítani. A C3 molekulát a konvertáz enzimek a kisebb méretű C3a fragmentumra és a nagyobb méretű C3b fragmentumra hasítják. A keletkező C3b reaktív
tioészter kötése révén képes szénhidrátokhoz vagy fehérjékhez kapcsolódni észter, illetve amid kötéssel, ezáltal kovalensen kötődhet a környezetében található molekulákhoz vagy sejtekhez. A C3b a B-faktor megkötése révén kialakíthatja az alternatív út C3bBb C3 konvertáz enzimét, ami további C3 molekulákat hasít. Ezáltal az alternatív út jelentősen felerősítheti a komplementaktivációt, és annak zömét adhatja, bármely úton indult is el eredetileg a rendszer aktiválódása. Másfelől a C3b molekula kapcsolódása a C4b2b és C3bBb enzim komplexekhez lehetővé teszi, hogy az immár C4b2b3b és C3bBb3b enzimek a C5 molekulát hasítsák, és ezáltal elinduljon a terminális út, amely végül elvezethet a C5b-9 molekulakomplex felépüléséhez. A C5b-9 komplex a felépülése során a sejtmembránba ágyazódva pórust alakít ki, és a célsejt oldódását, lízisét okozhatja.
1. ábra. A komplementrendszer aktivációs útjainak és az aktiváció fő funkcionális következményeinek sematikus bemutatása. Mindhárom komplementaktivációs út – C3 konvertáz enzimek képződése révén – a központi molekula, a C3 hasításához vezet. Az alternatív út felerősíti a komplementaktivációt a – bármely út aktiválódása során – képződő C3b fragmentumok általi visszacsatolás révén („amplification loop”).
2. ábra. Az alternatív út C3bBb C3-konvertáz enzimének kialakulása és az alternatív út fő szabályozó molekulái. Az enzimatikus aktivitással rendelkező molekulákat csillag jelöli. A szabályozó hatásokat szaggatott nyíl jelzi. A properdin stabilizálja a C3bBb konvertázt (pozitív regulátor), míg a H-faktor, az 1-es típusú komplement receptor (CR1) és a lebomlást gyorsító faktor (DAF) destabilizálják azt (negatív regulátorok). A H-faktor, a CR1 és a membrán kofaktor fehérje (MCP) az I-faktor kofaktoraiként hatva lehetővé teszik a C3b I- faktor általi enzimatikus hasítását, ezáltal – a komplementaktiváció szempontjából – inaktív iC3b molekula kialakulását.
A komplementrendszer aktiválódása során keletkező kis molekulatömegű fragmentumok közül a C3a és különösen a C5a tölt be fontos szerepet C3a-, illetve C5a- receptoron hatva a gyulladási folyamatokban, sejtek aktiválásában. A C3 hasításakor keletkező C3b fragmentum az aktiváló sejtek felszínére lekötődve a C3bBb konvertáz kialakítása révén helyileg fokozhatja a komplementaktivációt, valamint a C3b és annak további enzimatikus feldolgozása során keletkező, a komplementaktivációs kaszkád szempontjából már inaktív fragmentumai (iC3b, C3d) receptorokhoz kötődve fokozhatják a célsejt fagocitózis útján történő eltávolítását (ún. opszonikus hatás, ill. opszonofagocitózis), illetve immunsejtek aktivációját befolyásolhatják. A C5 hasításakor keletkező C5b fragmentum a terminális út beindításához szükséges.
Mivel ez a rendszer a mikroorganizmusok mellett a szervezet saját sejtjeire és szöveteire is potenciális veszélyt jelent, több mechanizmus biztosítja a komplementaktiváció megfelelő szabályozását. A testfolyadékokban az egyes aktivációs utak különböző pontjain ható szabályozó molekulák vannak jelen, valamint sejtjeink felszínén szintén kifejeződnek szabályozó fehérjék, amelyek gátolhatják a rendszer aktivációját vagy a membránkárosító C5b-9 komplex létrejöttét (3. ábra). További biztosíték az aktív C3b molekulában található tioészter kötés gyors hidrolízise, amely során a molekula elveszti a kovalens kapcsolódás lehetőségét, tehát az „időablak”, amikor a C3b valamihez hozzákötődhet, rövid. Ugyanakkor
fontos megjegyezni, hogy a C3b molekula önmagában nem tud különbséget tenni saját és nem-saját között, tehát bármely, megfelelő közelségben lévő molekulához vagy sejthez hozzákötődhet.
3. ábra. A komplementaktiváció szabályozása. A szabályozó (főként gátló hatású) molekulák a komplementaktiváció különböző pontjain hatva megakadályozhatják az aktiváció kezdeti lépéseit, befolyásolhatják a C3-konvertázok kialakulását vagy stabilitását, a C3b inaktiválását, az anafilatoxinok és a C5 konvertázok, a terminális út működését. A H-faktor az alternatív út fő szabályozó fehérjéje, ami a C3b molekulán hatva gátolja a komplementaktivációt, a C3b- komponensű C3- és C5 konvertázokat, ezáltal az amplifikációt és a terminális utat is. A gátló molekulák piros színnel vannak feltüntetve, a C3bBb konvertázt stabilizáló properdin kékkel.
Amennyiben nem megfelelő felszínen, vagy nem megfelelő ideig (tehát térben és időben nem megfelelően korlátozva) megy végbe a komplementrendszer aktivációja, különböző fertőző és gyulladásos betegségek alakulhatnak ki (1. táblázat) (Zipfel et al., 2006;
Ricklin and Lambris, 2013). Orvosi beavatkozások során, „természetellenesen” is aktiválódhat a komplementrendszer, amely komoly problémát és kockázatot jelenthet. Erre
példa a vérkeringés lokális leállítása, majd szervek újra perfundálása során, a beültetett vagy ideiglenesen behelyezett mesterséges anyagok felszínén (pl. kanülök, sztentek), vagy a szervezetbe juttatott gyógyszerek és segédanyagok (pl. liposzomális és micelláris gyógyszerhordozók, kontrasztanyagok) által kiváltott komplementaktiváció (Ricklin et al., 2016; Szebeni, 2014).
1. táblázat. Példák a komplement szerepére különböző betegségekben.
Komplement szerepe Érintett szerv Betegség komplementgén
polimorfizmusok és gén- mutációk, deficienciák (C3, CFH, CFHR1, CFHR3, CFB, CFI, MCP)
szem időskori makula degeneráció (AMD)
vese atípusos hemolitikus urémiás szindróma, C3 glomerulopátiák, szisztémás lupusz
eritematózusz, IgA nefropátia komplement ellenes
autoantitestek (H-faktor, C3bBb, B-faktor, C1q)
vese atípusos hemolitikus urémiás szindróma, C3 glomerulopátiák, szisztémás lupusz
eritematózusz
C3 hiány vese, kiserek vaszkulitiszek, glomerulonefritiszek
CR3, C1q agy Alzheimer-kór, prion betegségek
C1q ízületek reumatoid artritisz
Mannózkötő lektin (MBL) deficiencia
keringési rendszer
szív-érrendszeri betegségek C1-inhibitor hiány herediter angioneuroticus oedema MBL deficiencia bakteriális fertőzésekre való hajlam CD55 és CD59 csökkent
expressziója
paroxizmális nokturnális hemoglobinuria Properdin, terminális
komponensek hiánya, CFH-CFHR3-CFHR1 H3 haplotípus
Neisseria meningitidis fertőzés
CR3/CR4 deficiencia Neutrofil adhézió és opszonofagocitózis elégtelen volta miatt opportunista fertőzések Túlérzékenységi reakció: CARPA
(complement activation-related pseudoallergy)
A szabályozó molekulák közül a properdin pozitív regulátorként működik, a C3bBb konvertázhoz kötődve azt stabilizálja. A szabályozó molekulák többsége azonban gátló hatású. A C1-inhibitor a C1r és C1s, illetve MASP enzimekhez kötődve gátolja a klasszikus és lektin utak aktivációját. A szolubilis szabályozó fehérjék közül a C4b-kötő molekula elsősorban a klasszikus/lektin út konvertázainak stabilitását csökkenti a C4b-kötő képessége révén, valamint az I-faktor kofaktoraként segíti a C4b enzimatikus hasítását, ezáltal inaktiválását. Az I-faktor másik fiziológiás liganduma a C3b, aminek inaktiválását szintén kofaktorok jelenlétében képes elvégezni. Az alternatív út fő szolubilis kofaktor fehérjéje a H- faktor, ami a C4b-kötő fehérjével analóg módon C3b-kötése révén segíti az alternatív út konvertázainak destabilizálását és a C3b enzimatikus hasítását. Ezen kívül több, sejtmembránban található fehérje segíti a sejtfelszínre kötődő konvertázok szétbomlását (decay accelerating factor, DAF) vagy a C3b, illetve C4b molekulák I-faktor általi hasítását (membrán kofaktor fehérje, MCP). A terminális utat és a membránkárosító komplex kialakulását gátolja a CD59 molekula, a klaszterin, valamint a vitronektin (3. ábra).
A H-faktor molekulacsalád tagjai és szerepük betegségekben
Számos, komplementszabályozó molekulát, illetve komplement receptort kódoló gén az emberi 1-es kromoszóma hosszú karján egy csoportban, az RCA (regulators of complement activation) génklaszterben található. Az itt kódolt komplement fehérjékre jellemző egy globuláris domén, az ún. complement control protein (CCP) domén előfordulása (Sushi- domén és SCR – short consensus repeat – domén néven is ismert), mely különböző számban található meg – esetenként más domén típusokkal együtt – ezekben a molekulákban. A génklaszter sorozatos duplikációk eredményeként jött létre, emiatt a molekulák szerkezetileg és funkcionálisan is egymás rokonai: többük képes a C3b és/vagy a C4b molekula megkötésére, ezáltal a komplementszabályozó, illetve -receptor funkció betöltésére (Krushkal et al., 2000). Hat gén elkülönülve a többi komplementgéntől egy kis csoportot alkot ebben a régióban: ezek a H-faktor molekulacsalád tagjait kódoló gének.
A H-faktort fehérje szinten 1965-ben azonosították (Nilsson and Müller-Eberhard, 1965), később leírták a molekula fő funkcióját a komplementrendszer aktivációjának szabályozásában (Weiler et al., 1976; Whaley and Ruddy, 1976). Részletes funkcionális jellemzése, az egyes domének szerepének a vizsgálata csak a H-faktor klónozása és
rekombináns fehérjeként való előállítását követően vált lehetővé. Ennek során fedezték fel a H-faktor mRNS-éhez nagyon hasonló mRNS-eket, illetve a H-faktor ellen termeltetett ellenanyagokkal való keresztreakció révén szérumban kimutatható kisebb molekulatömegű fehérjéket, amelyekről egy idő után nyilvánvalóvá vált, hogy nem a H-faktor enzimatikus hasítással keletkező fragmentumai, hanem önálló génekről átíródó, H-faktor-szerű vagy H- faktorral rokon fehérjék (Vik et al., 1990; Zipfel and Skerka, 1994).
A H-faktor egy 155 kDa molekulatömegű glikoprotein, amely a C3b-vel kölcsönhatva három mechanizmus révén tölti be a komplementaktivációt gátló szerepét. Egyrészt a C3b-hez kötődve a B-faktorral való kompetíció révén gátolja a C3bBb konvertáz létrejöttét. Másrészt a már kialakult konvertázról le tudja szorítani az enzimatikus aktivitással bíró Bb fragmentumot, ezzel gyorsítja a C3bBb konvertáz enzim egyébként magától is megtörténő szétesését („convertase decay accelerating activity”). Harmadrészt, az I-faktor nevű plazma szerin proteáz egyik kofaktoraként szolgál a C3b molekula hasításában, inaktiválásában („cofactor activity”) (Rodríguez de Córdoba et al., 2004; Ferreira et al., 2010). A H-faktor 20 CCP doménből épül fel, melyek közül az N-terminális 4 CCP domén felelős a komplementaktivációt gátló hatásokért (Gordon et al., 1995; Kühn et al., 1995; Wu et al., 2009; Forneris et al., 2016). Egyes további doméneknek leírták a H-faktornak különböző ligandumokkal, pl. C3b-vel, heparinnal való kölcsönhatásában betöltött szerepét (pl. a C- terminális CCP19-20 doménekben), de a kutatások kezdetben főleg a komplementregulációs szerepre koncentráltak (2. táblázat) (Kopp et al., 2012).
A H-faktor génjének létezik egy alternatív splicing útján keletkező másik fehérje terméke is, mely a H-faktor CCP1-7 doménjeit tartalmazza, valamint 4 egyedi aminosavat a C terminuson (Zipfel and Skerka, 1999). Ennek megfelelően ez az FHL-1-nek (factor H-like protein 1) elnevezett, 42 kDa molekulatömegű glikoprotein is képes a komplementaktiváció gátlására. A H-faktorhoz képest kisebb szérum koncentrációban fordul elő, és a H-faktorhoz hasonlóan többféle sejt, illetve szövet is képes termelni (Friese et al., 1999). Bár az FHL-1-ről kevés adat található a szakirodalomban, feltehetőleg fontos szerepe lehet bizonyos körülmények között. Újabb vizsgálatok alapján feltételezik, hogy a szemben a retina pigment epitélsejtjei alatti Bruch-membránon mérete miatt nem a H-faktor, hanem az FHL-1 képes átjutni, és az alapmembránhoz kötődve a komplement aktivációt helyileg szabályozni (Clark et al., 2014).
2. táblázat. A H-faktor főbb ismert ligandumai, azok kötőhelyei, és a kölcsönhatások szerepe. (Kopp et al., 2012a alapján)
Ligandum Kötőhelyek Funkció
C3 fragmentumok C3b CCP 1-4, 6-8 Komplementaktiváció szabályozása
C3c CCP 12-14
C3d CCP 19-20
Polianionos természetű molekulák
Heparin
(glükózaminoglikánok, sziálsav)
CCP 7, 19-20 Kötődés saját sejtek felszínéhez Pentraxinok C-reaktív protein
(CRP)
CCP 7, 8-11, 19-20 H-faktor aktivitásának
“irányítása”, pl. sejtek felszínéhez Pentraxin 3 (PTX3) CCP 7, 19-20
Apoptotikus és nekrotikus sejtek
Annexin-II DNS Hisztonok
CCP 6-8 CCP 6-8, 19-20 CCP 1-4, 6-8, 8-15
“Clearance” elősegítése, autoimmunitás elleni
védelem Extracelluláris
mátrix
Fibromodulin Osteoadherin Chondroadherin
CCP 6-8
?
?
gyulladás szabályozása (pl.
rheumatoid artritiszben)
Malondialdehid CCP 7, 20 oxidatív stressz elleni
védelem
Prion protein ? a komplementszabályozás
zavara fokozhatja a gyulladást az agyban Adrenomedullin CCP 8-11, 15-20 adrenomedullin funkciók
befolyásolása
A H-faktorral rokon fehérjéket öt, a H-faktor génje mellett közvetlenül található gén kódolja, melyek részleges génduplikációk révén jöttek létre. Ezeket felfedezésük sorrendjében nevezték el FHR-1, FHR-2, FHR-3, FHR-4 és FHR-5 molekuláknak. Közülük az FHR-1-nek két allélikus változata, az FHR-4-nek a domének számában is különböző két formája alakult ki, de a glikoziláltság mértékében eltérő FHR-1, FHR-2 és FHR-3 izoformák (glikoformák) is léteznek. Az FHR fehérjék a H-faktorhoz hasonlóan kizárólag CCP doménekből állnak.
Általánosan jellemző rájuk, hogy a H-faktor CCP 6-9 és CCP 18-20 doménekkel homológ doméneket tartalmaznak; az FHR-5 ezen túlmenően a H-faktor CCP 10-14 doménjeivel homológ doméneket is tartalmaz (4. ábra). Az FHR fehérjékből tehát hiányoznak a komplementgátló aktivitásért felelős H-faktor CCP 1-4 domének. Azonosításukat követően az
FHR fehérjéket alig vizsgálták, és a H-faktorhoz hasonló funkciójú, de kevésbé fontos fehérjéknek tekintették őket (Zipfel and Skerka, 1994).
4. ábra. Az emberi H-faktor molekulacsalád. (A) Az 1q32 régióban, a H-faktort kódoló gén (CFH) mellett tandem elrendeződésben található az öt FHR fehérjét kódoló gén (CFHR), melyek részleges génduplikációk útján alakultak ki. (B) Az FHR fehérjék kizárólag CCP doménekből állnak. Az FHL-1 molekula a CFH gén alternatív átiratának terméke, az FHR-1 stb. fehérjék a CFHR1 stb. gének által kódoltak. A CFHR4 gén két FHR-4 izoformát kódol. A színek az egymással azonos, vagy közel azonos homológ doméneket jelzik. A számok az egyes domének fölött a H-faktor homológ doménjeivel való, százalékosan kifejezett aminosav-szekvencia azonosságot mutatják. CRP, C-reaktív protein; PTX3, pentraxin 3;
MDA, malondialdehid.
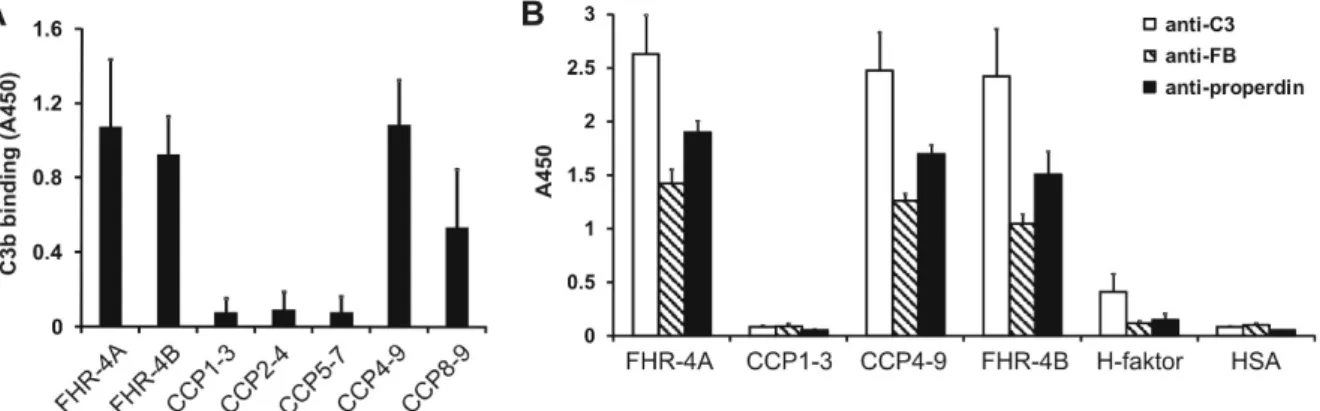
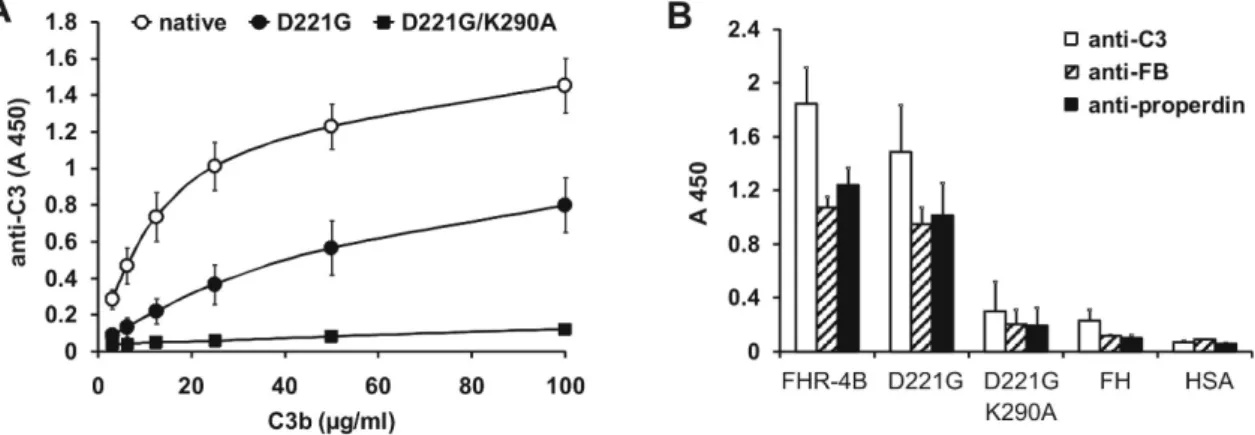
A homológ domének révén az FHR fehérjék kötődhetnek a H-faktor egyes ismert ligandumaihoz is, például C3b-hez, heparinhoz és C-reaktív proteinhez (CRP), illetve bizonyos bakteriális fehérjékhez. Az erre vonatkozó adatok szintén azt a prekoncepciót erősítették, hogy az FHR-ek „ugyanazt csinálják” mint a H-faktor, tehát nem különösebben érdekesek. A szerkezeti hasonlóság miatt nem álltak rendelkezésre olyan specifikus ellenanyagok, amelyek csak ezeket a fehérjéket ismernék fel, ezért a pontos szérum koncentrációjukat sem ismerték, valamint tisztításuk is nehézségekbe ütközött. Bár rekombináns FHR-3, FHR-4 és FHR-5 esetében leírtak gyenge, a H-faktoréhoz hasonló kofaktor aktivitást, ez azonban csak nagy mennyiségek alkalmazása esetében volt kimutatható (Hellwage et al, 1999; McRae et al. 2005). Később az FHR-1-ről a C5 molekulához való kötődést és a terminális út gátlását írták le (Heinen et al., 2009), azonban ez a funkció is ellentmondásos (Goicoechea de Jorge et al., 2013; Tortajada et al., 2013).
Az utóbbi évek adatai, elsősorban genetikai betegség-asszociációs vizsgálatok viszont egyértelműen arra utalnak, hogy ezeknek a fehérjéknek fontosabb szerepe lehet, mint korábban gondolták (Rodríguez de Córdoba and Goicoechea de Jorge, 2008; Boon et al., 2009). A H-faktor és az FHR-ek egyes génváltozatait több betegséggel is kapcsolatba hozták.
A H-faktor N-terminális doménjeit érintő mutációk miatti funkcionális, vagy a H-faktor szekréciójának zavarát okozó mutációk miatti kvantitatív H-faktor deficiencia a vérplazmában az alternatív út kontrollálatlan aktiválódásához és glomerulonefritiszhez vezet (Ault et al., 1997; Licht et al., 2006; Wong et al., 2014). Warwicker és munkatársai kimutatták, hogy a H- faktor génje kapcsolatba hozható egy másik ritka vesebetegséggel, az atípusos hemolítikus urémiás szindrómával (aHUS) is (Warwicker et al., 1998). Nem volt világos azonban, hogy milyen módon játszik szerepet ez a molekula a betegség kialakulásában. Korábban úgy gondolták, hogy a H-faktor szerepe a testfolyadékokban zajló komplementaktiváció szabályozására korlátozódik, hiszen a sejtek felszínén találhatók komplementgátló membránfehérjék. Az aHUS betegekben talált H-faktor mutációk nagy része azonban nem a molekula komplementaktiváció gátlásáért felelős N-terminális doménjeiben (CCP 1-4), hanem a molekula C-terminális CCP 18-20 doménjeiben található (Caprioli et al., 2001;
Pérez-Caballero et al., 2001; Richards et al., 2001; Neumann et al., 2003). Az aHUS-ban szenvedő betegek kb. 30%-ában azonosíthatók H-faktor mutációk, amelyek általában heterozigóta formában fordulnak elő és a H-faktor C-terminális doménjeit érintik, tehát a molekula képes marad a komplementaktiváció szabályozására. A mutációk azonban
hajlamosítanak a vese glomerulusokban fokozott helyi komplementaktivációra, endotélsejtek és vérlemezkék aktivációjára, ami végső soron a veseendotél károsodásához és mikrotrombusok kialakulásához, következményes akut veseelégtelenséghez vezethet (Nester et al., 2015). Ezekben a vesebetegségekben H-faktor ellenes autoantitesteket is leírtak (Meri et al., 1992; Dragon-Durey et al., 2005). A C3 glomerulopátiák közé sorolható DDD esetében egy betegben írtak le H-faktor ellenes autoantitesteket, melyek a molekula CCP3 doménjéhez kötődve gátolták a komplementszabályozó aktivitását (Meri et al., 1992; Jokiranta et al., 1999). Dragon-Durey és munkatársai három gyermek aHUS betegben írták le H-faktor ellenes autoantitestek jelenlétét, azok részletes funkcionális jellemzése nélkül (Dragon-Durey et al., 2005). A CFHR5 gén változatait ugyancsak kapcsolatba hozták C3 glomerulopátiával, CFHR5 nefropátiával és aHUS-sal is (Abrera-Abeleda et al., 2006; Monteferrante et al., 2007;
Gale et al., 2010; Nester et al., 2015; Zipfel et al., 2015). A H-faktor Y402H polimorfizmusa pedig a világszerte kb. 50 millió embert érintő időskori makuladegeneráció (AMD) rizikófaktora (Edwards et al., 2005; Hageman et al., 2005; Haines et al., 2005; Klein et al., 2005).
Mivel a H-faktort és az FHR molekulákat kódoló gének számos, nagymértékben hasonló (akár több, mint 99%-ban azonos) szekvenciát tartalmaznak, ezért ez a genom régió hajlamos génátrendeződésekre. Ezek következtében génkonverzió, illetve bizonyos szakaszokon géndarabok (ezáltal hibrid gének létrejötte) vagy teljes gének kiesése, illetve duplikálódása történhet (5. ábra). Mutáció analízis és génkópiaszám-meghatározás segítségével a betegekben és egészséges egyénekben is számos génváltozatot és különböző génátrendeződéseket mutattak ki ebben a génklaszterben. Különösen gyakori a CFHR3- CFHR1 kettős géndeléció, ami több betegség esetében is előfordul hajlamosító (aHUS, SLE) vagy védő (IgA nefropátia, AMD) tényezőként (3. táblázat). Ez a géndeléció az európai populáció kb. 4%-ában fordul elő, de más populációkban ennél jóval gyakoribb is lehet, pl.
Afrikában átlagosan kb. 16% (de Nigériában kb. 30%) (Holmes et al., 2013).
5. ábra. Példák a H-faktor génklaszterben történő génátrendeződésekre. A nagyfokú szekvencia-hasonlóság miatt (pl. B1 és B2 között lezajló) nem-allélikus homológ rekombináció következtében a töréspontoktól függően géndeléciók (a másik allélon duplikáció), illetve hibrid gének jöhetnek létre.
A komplementrendszer betegségekben játszott szerepének utóbbi években történt részletesebb megismerése révén egyre több kutatás irányul a komplementrendszer működésébe való célzott beavatkozási lehetőségek feltárására és kihasználására (Morgan and Harris, 2015). Kézenfekvő lehetne például a hiányzó vagy hibás komplementfehérje (pl.
mutáns H-faktor) pótlására vérplazmából tisztított vagy mesterségesen előállított fehérjét alkalmazni. Mivel a komplementrendszer egy komplex fehérjehálózat, amely más plazma enzim rendszerekkel is kapcsolatban van, valamint az egyes betegségekben más-más mechanizmussal és mértékben járul hozzá a patológiás folyamatokhoz, többféle célpont elleni és különböző hatásmechanizmusú hatóanyagok kifejlesztése szükséges. Jelenleg egyetlen engedélyezett, a komplement rendszert célzó terápiás szert használnak. Az eculizumab nevű anti-C5 monoklonális ellenanyag a C5 molekulához kötődve annak C5 konvertázok általi hasítását, ezáltal a terminális út aktiválódását akadályozza meg. Több betegségben ezért, ahol a terminális út gátlása fontos (pl. a vörösvérsejtek lízisével járó paroxizmális nokturnális
hemoglobinuria és aHUS), sikerrel alkalmazzák ezt a terápiás antitestet. A proximális komplement utakat, így a C3 aktivációját és a C3 fragmentumokkal történő opszonizációt azonban az eculizumab nem gátolja. Jelenleg számos gyógyszerjelölt van a fejlesztés és a klinikai kipróbálás különböző stádiumaiban (Morgan and Harris, 2015).
3. táblázat. CFH és CFHR génváltozatok és génátrendeződések kapcsolata különböző betegségekkel.
Betegség Génvariáns Atípusos hemolítikus urémiás
szindróma (aHUS)
CFH génváltozatok
CFHR3-CFHR1 gének deléciója (hajlamosít) CFH::CFHR1 hibrid gén
CFHR1::CFH reverz hibrid gén CFH::CFHR3 hibrid gén CFHR1*B allél
CFHR3 génváltozat CFHR5 génváltozatok C3 glomerulopátia CFH génváltozatok
CFHR3::CFHR1 hibrid gén
CFHR1 mutáció (dimerizációs domének duplikációja) CFHR2::CFHR5 hibrid gén
CFHR5::CFHR2 hibrid gén
CFHR5 nefropátia CFHR5 mutáció (dimerizációs domének duplikációja) IgA nefropátia CFHR3-CFHR1 gének deléciója (véd)
Időskori makuladegeneráció (AMD)
CFH génváltozatok
CFHR3-CFHR1 gének deléciója (véd) Szisztémás lupusz (SLE) CFHR3-CFHR1 gének deléciója (hajlamosít)
A komplementrendszer normális és patológiás működésének felderítése tehát nemcsak alapkutatási szempontból izgalmas, hanem az érintett betegek és kezelőorvosaik számára is reményekkel kecsegtet. Jelenleg a komplementrendszer kutatása újabb reneszánszát éli, ami a vonatkozó szakirodalom bővülésében is jól tükröződik (6. ábra). A komplementszabályozó H-faktor és a H-faktorral rokon FHR fehérjék genetikai vizsgálatok alapján egyértelműen kapcsolatba hozhatók egyes fertőző, gyulladásos és autoimmun betegségekkel, szerepük
azonban nem pontosan ismert és több esetben ellentmondásos. Mindezek miatt tehát fontos megismernünk ezeknek a molekuláknak a funkcióját, mert így jobban megérthetjük az említett betegségek kialakulását, és akár új terápiás beavatkozási lehetőségeket ismerhetünk meg.
a rendszer (fő funkciója) felfedezése komponensek, „új” utak betegségek, felfedezése, jellemzése terápia
6. ábra. A komplement/komplementrendszer reprezentációja a PubMed publikációs adatbázisban. Az ábra a PubMed adatbázisban található, „complement” vagy „complement system” kulcsszót tartalmazó publikációk számát mutatja éves bontásban. Látható, hogy az utóbbi években – a komplementrendszer különböző betegségekben betöltött szerepének fel-, illetve jobb megismerésével – jelentősen megnőtt az iránta való érdeklődés a kutatók, orvosok és a gyógyszeripar részéről is.
3. Célkitűzések
Az előzőekben bemutattam, hogy a komplementrendszer különböző kóros folyamatokhoz járulhat hozzá, betegségenként eltérő mechanizmussal és mértékben. A komplementaktivációt szabályozó H-faktor és a H-faktorral rokon fehérjék különösen érdekesek ebből a szempontból, hiszen számos betegséggel hozták őket kapcsolatba. Az FHR fehérjék funkciójáról ráadásul nagyon keveset tudunk. Kutatásaim során ezért elsősorban a H-faktor molekulacsalád szerepének vizsgálatával foglalkoztam. Az alábbi fő kérdéseket, célokat fogalmaztuk meg:
1. Mi a szerepe a H-faktor C-terminális doménjeinek?
2. Van-e szerepe a H-faktornak az endotélsejtek védelmében, a sejtfelszínen zajló komplementaktiváció gátlásában?
3. A C-terminális mutációk hogyan befolyásolják a H-faktor funkcióját és hogyan járulhatnak hozzá atípusos hemolítikus urémiás szindróma kialakulásához?
4. Célul tűztük ki a H-faktor ellenes autoantitestek kötőhelyének meghatározását, az autoantitestek funkcionális hatásának vizsgálatát, biológiai jellemzőik (izotípus, aviditás) meghatározását, illetve annak vizsgálatát, hogy mutatnak-e keresztreakciót FHR molekulákkal.
5. Célunk volt annak vizsgálata, hogy mi az emberi FHR fehérjék élettani és patológiás szerepe, befolyásolják-e a H-faktor működését, illetve van-e szerepük a komplementrendszer szabályozásában.
6. A H-faktorról nyert ismereteket összegezve és felhasználva célul tűztük ki egy olyan módosított H-faktor molekula előállítását és jellemzését, amelyet – potenciális mesterséges komplementgátló fehérjeként – terápiás célokra lehetne alkalmazni.
4. Anyagok és alkalmazott módszerek
Az egyes felhasznált anyagok és módszerek részletes leírása a saját közleményekben található meg, itt csak egyes általánosabb és speciális anyagokat, valamint az alkalmazott fontosabb módszereket sorolom fel. Zárójelben, római számokkal feltüntettem az egyes módszereket tartalmazó saját publikációimat (ld. 7.1. fejezet).
Komplement fehérjék
A kísérletek során felhasznált speciális komplement kötődési és aktivitási esszékben a legtöbb esetben kereskedelmi forgalomban kapható, tisztított komplement fehérjéket használtunk. Az emberi szérumból tisztított H-faktor, C3, C3b, iC3b, C3d, B-faktor, D-faktor, P-faktor (properdin), I-faktor, C1q, rekombináns CRP általában a Merck (Darmstadt, Németország), illetve a Complement Technologies (Tyler, Texas, USA) cégektől került beszerzésre.
Rekombináns fehérjék előállítása
A H-faktor fragmentumok, mutánsok és FHR fehérjék klónozásához és expressziójához PCR és irányított mutagenezis technikákat használtunk (III-V, VII-IX, XI-XV, XIX). A felhasznált primerek, körülmények és DNS-konstrukciók leírása az egyes publikációkban részletesen leírva megtalálhatók. Egyes esetekben (FHL-1, FHR-1, FHR-4B, FH CCP1-4, CCP1-7, CCP8-14, CCP15-20, mini H-faktor) kodon-optimalizált szekvenciákat szintetizáltattunk (GenScript, Piscataway, NJ, USA) (XII, XV, XIX). Az irányított mutagenezist a QuikChange II XL site-directed mutagenesis kit (Stratagene, Amsterdam, Hollandia) segítségével végeztük (III, XII, XV). A fehérje expresszióhoz a pBSV-8His bakulovírus vektort használtuk (Kühn and Zipfel, 1995). A kísérletekhez Sf9 rovarsejtekben expresszáltunk rekombináns H-faktor fragmentumokat, FHR fehérjéket és azok fragmentumait (II-IX, XII-XVII, XIX-XX). A hisztidin-címkével ellátott fehérjék tisztítása nikkel-affinitás kromatográfia segítségével történt. A megfelelő pufferbe dializált, tisztított fehérjéket gélben ezüstfestéssel, valamint Western blot technikával is ellenőriztük.
Antitestek
A specifikus komplement komponensek kimutatására általában a kereskedelemben kapható, ismert specificitású és jól jellemzett poliklonális és monoklonális elleanyagokat használtunk.
Így a H-faktor, C3b, C3d, iC3b, B-faktor, properdin, CRP, PTX3, C1q ellenes ellenanyagokat az egyes cikkekben megjelölt cégektől és forgalmazóktól szereztük be (Merck; Dako; R&D System; MP Biomedicals; Quidel; Sigma-Aldrich). Egyes ellenanyagokat (köztük számos, humán H-faktor ellenes egér monoklonális ellenanyagot) kollaborációs partnereink bocsátottak rendelkezésre (I, II, IV-VI). FHR-4 ellenes nyúl ellenanyagot az általunk expresszált és tisztított, rekombináns FHR-4A CCP2-4 fehérje – melyről a hisztidin-címkét enterokináz segítségével eltávolítottuk – felhasználásával a BioGenes (Berlin, Németország) állította számunkra elő (XII). Az egyes másodlagos, torma peroxidázzal vagy fluoreszcens festékekkel konjugált ellenanyagokat különböző gyártóktól szereztük be; ezek az egyes közleményekben jelezve vannak.
Specifikus komplement aktivációs termékek (C3a, C5a, SC5b-9) kimutatására kereskedelmi forgalomban kapható ELISA kiteket használtunk (Quidel, San Diego, USA).
Pufferek
Az egyes biokémiai, molekuláris biológiai és immunológiai alapmódszerek esetében a szokásos puffereket használtuk (Erdei A, 2006), ezek egy részét (pl. DPBS Ca2+ és Mg2+
nélkül, DPBS-EDTA stb.) különböző cégektől szereztük be (ezek a publikációkban fel vannak tüntetve). Speciális vizsgálatokhoz, például a C3bBb konvertáz in vitro felépítéséhez, komplement aktiváció méréséhez használt pufferek részletes összetételét és az alkalmazott körülményeket az egyes publikációk tartalmazzák (II, IV, V, XII-XVII, XIX, XX).
Sejtek
A munkáinkban felhasznált sejtvonalakat az ATCC-től szereztük be (American Type Culture Collection, Rockville, Maryland, USA).
Az emberi köldökvéna endotélsejtek (HUVEC) tenyésztésére DMEM médiumot használtunk, amely 10% FCS-t, penicillint (100 U/ml), streptomycint (100 μg/ml), Fungizone-t (250 ng/ml) és L-glutamint tartalmazott. A sejteket 5% CO2-t és megfelelő páratartalmat biztosító inkubátorban 37ºC-on tenyésztettük (I-III).
Egyes esetekben a HUVEC sejtek által termelt extracelluláris mátrixot használtuk fel fehérjék kötődésének kimutatására és komplementaktiváció mérésére. Ennek során 10 mM EDTA tartalmú DPBS-sel inkubálva távolítottuk el a sejteket, majd az extracelluláris mátrixot tartalmazó sejttenyésztő lemezt használtuk a vizsgálatokhoz (XV, XVII).
A Jurkat, Raji, U937, THP-1 sejteket 10% FCS-t, penicillint, streptomycint és L- glutamint tartalmazó RPMI-1640 médiumban tenyésztettük 37ºC-on, 5% CO2 és megfelelő páratartalom mellett. Apoptózist staurosporin kezelés segítségével, nekrózist hőkezeléssel váltottunk ki (XIII). Az apoptózis és nekrózis ellenőrzésére Annexin-V és propidium jodiddal történő festést, és az áramlási citofluorimetria módszerét használtuk.
A birka és nyúl vörösvérsejteket kereskedelmi forrásból szereztük be. A vörösvérsejteket Alsever-oldatban tároltuk, a kísérleteknél a megfelelő pufferben mostuk és szuszpendáltuk fel őket (IV, V, VII, XIX).
A H-faktor és az FHR fehérjék szérumból való kötődését, valamint a rekombináns vad típusú és mutáns fehérjék sejtekhez (HUVEC, apoptotikus és nekrotikus Jurkat sejtek, birka vörösvérsejtek) kötődését áramlási citometria, Western blot és mikroszkópos vizsgálatok segítségével végeztük (I-III, VII, XIII).
Fehérje kölcsönhatások és funkcionális vizsgálatok
A módszerek általános leírásai megtalálhatók az egyetemi tankönyvekben, jegyzetekben, szakkönyvekben, és a szakterületemen általánosan ismertek, ezért azokat nem tartom szükségesnek itt ismertetni. Mivel adott módszer esetében is különböző körülmények és reagensek alkalmazásával történtek a kísérletek, ezek leírása meghaladná az értekezés kereteit. Az egyes speciális ELISA, Western blot, mikroszkópos és áramlási citofluorimetriás kísérletek részletes leírása megtalálható a hivatkozott közleményekben. Az alábbiakban csak röviden felsorolom a végzett főbb vizsgálatokat.
Kofaktor aktivitást és konvertáz lebomlást gyorsító aktivitást Western blot és ELISA segítségével mértünk (II, XII, XIX).
Fehérje kölcsönhatásokat ELISA, felszíni plazmon rezonancia és Western blot segítségével vizsgáltunk (II-IV, VII-IX, XII-XV, XVII, XVIII). Ligandum kötőhelyek meghatározásához membránon immobilizált átfedő peptidsorozatokat és mutagenezis vizsgálatokat végeztünk (III, XII, XIV, XV).
A H-faktor autoantitesteket ELISA módszerrel detektáltuk; az autoantitestek kötőhelyének meghatározásához rekombináns fehérje fragmentumokat és mutáns fehérjéket használtunk (IV-IX, XV). Szérumok hemolitikus hatását birka és nyúl vörösvérsejtek segítségével mértük (IV, V, VII, XIX, XX). Az immunkomplexeket ELISA és Western blot, az antitestek aviditását ELISA segítségével mértük (V, VII-IX).
Komplementaktivációt ELISA (C3, C4, C5b-9 lerakódás), birka vörösvérsejtek lízise (a kiszabaduló hemoglobin mérésével), sejteken pedig áramlási citometria és Western blot segítségével vizsgáltunk (II, XII-XIV, XVI, XVII, XIX, XX).
Statisztikai analízis
Az adatok értékelésére, az egyes kezelések során kapott különbségek szignifikanciájának meghatározására a megfelelő statisztikákat alkalmaztuk, GraphPad Prism program segítségével (GraphPad Software, San Diego, CA). A p < 0,05 értékeket tekintettük statisztikailag szignifikánsnak.
Ábrák szerkesztése
Az adatokból a GraphPad Prism vagy Excel programok segítségével készítettük el a grafikonokat. A képként exportált grafikonok, mikroszkópos felvételek, beszkennelt gél- és Western blot képek további szerkesztését, feliratozását, ábrákba rendezését, valamint a rajzokat a Paint, Adobe Photoshop és CorelDraw programok segítségével végeztük, illetve készítettük el.
5. Eredmények és megbeszélésük
(A római számok az értekezés alapjául szolgáló, a 7.1. fejezetben felsorolt saját közlemények sorszámát jelölik.)
A dolgozatban a PhD fokozat megszerzése óta a H-faktor fehérjecsalád tagjainak élettani és patológiás szerepének vizsgálatára irányuló kutatásaim során elért eredmények egy részét mutatom be. Az értekezéshez felhasznált publikációkban meghatározó szerepet játszottam: az elsőszerzős közleményeknél mind a kísérletes munkát, mind a szellemi hozzájárulást és a cikkek megírását illetően, illetve az utolsó szerzős közleményeknél a saját kutatócsoport és több esetben a más laboratóriumokkal való kollaboráció irányítását, valamint a cikkek megírását tekintve. A kísérletek megtervezése, kivitelezése és az eredményekből született közlemények végső formába öntése a diákjaimmal, kollégáimmal és az együttműködő partnerekkel való közös munka eredménye volt, ezért az értekezésben – ahogy az eredeti közleményekben is – a többes szám első személyt használom.
Az ismertetett eredmények részben a jénai Leibniz-Institut für Naturstoff-Forschung und Infektionsbiologie – Hans-Knöll-Institut kutatóintézetben végzett posztdoktori tanulmányaim során (2002–2005), valamint később az ott vezetett kutatócsoportomban (2006–2012), részben pedig hazatérésem óta (2012–) az általam vezetett MTA-ELTE
„Lendület” Komplement Kutatócsoportban születtek. A kutatások hazai és nemzetközi együttműködések keretében valósultak meg, munkánkat számos szervezet (pl. Alexander von Humboldt-Stiftung, Deutsche Forschungsgemeinschaft, OTKA, MTA) támogatta.
5.1. A H-faktor szerepe a komplementaktiváció gátlásában és ennek összefüggése atípusos hemolítikus urémiás szindrómával
Mivel az endotélsejtek aktivációjának és károsodásának szerepe van az aHUS patomechanizmusában, továbbá aHUS-betegekben számos H-faktor mutációt írtak le, melyek elsősorban a molekula C-terminális doménjeiben találhatók, vizsgáltuk, hogy mi a C- terminális domének fiziológiás szerepe, milyen kölcsönhatás játszódhat le a H-faktor és az endotélsejtek között, illetve ez hogyan magyarázhatja a mutációk összefüggését a betegséggel.
5.1.1. A H-faktor C-terminális doménjeinek szerepe a molekula endotélsejtekhez való kötődésében, és a komplementaktiváció H-faktor általi gátlása a sejtek felszínén
Ismert volt, hogy a komplementszabályozó funkciókért a H-faktor molekula N-terminális doménjei (CCP1-4) felelősek (Gordon et al., 1995; Kühn et al., 1995). Az aHUS betegekben azonosított mutációk zöme azonban meglepő módon a molekula C-terminális doménjeit érinti (Caprioli et al., 2001; Pérez-Caballero et al., 2001; Richards et al., 2001; Neumann et al., 2003). Ismert volt továbbá állatmodellekből, hogy a H-faktor hiánya a plazmában történő kontrollálatlan komplementaktivációhoz, és egy másik betegséghez, DDD-hez vezet (Høgåsen et al., 1995; Pickering et al., 2002). Mindezek miatt arra gondoltunk, hogy az aHUS esetén az endotélsejtek felszínén lehet szerepe a H-faktornak a komplementaktiváció gátlásában. Ez azonban ellentmondott annak az uralkodó felfogásnak, miszerint a H-faktor szerepe a testfolyadékokban való komplementszabályozó szerepre korlátozódik, a sejteken pedig a sejtmembránban kifejeződő komplementszabályozó molekulák gátolják a komplementaktivációt.
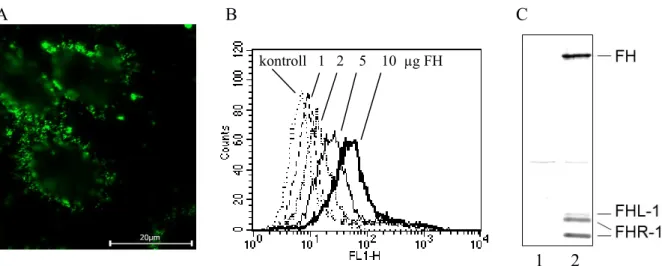
Elsőként a H-faktor sejtekhez való kötődését vizsgáltuk. Áramlási citofluorimetriás és mikroszkópos vizsgálatokkal sikerült kimutatnunk, hogy a tisztított H-faktor kötődik a modellként használt emberi köldökzsinórvéna eredetű endotélsejtekhez (HUVEC-hez) (I). A sejteket emberi szérumban inkubálva, majd mosva és lizálva, a szérum H-faktor kötődését is kimutattuk Western blot technikával (7. ábra). Emellett azt is bizonyítottuk, hogy a C- terminális doméneknek lényeges szerepük van a H-faktor endotélsejtekhez való kötődésében.
Ehhez a humán H-faktor ellen egy kollaborációs partnerünk (Prof. Oppermann, Göttingen) által előállított egér monoklonális antitestek kötőhelyét rekombináns H-faktor fragmentumok felhasználásával meghatároztuk (Oppermann et al., 2006). Az így már ismert kötőhelyű monoklonális antitestek jelenlétében H-faktorral inkubálva az endotélsejteket azt találtuk, hogy a C18 jelű, a H-faktor CCP20 doménjében kötődő antitest gátolta a tisztított H-faktor HUVEC-hez kötődését (8. ábra) (I). Áttekintő közleményünkben a H-faktor sejtekkel való kölcsönhatásának fontosságára hívtuk fel a figyelmet, rámutatva ennek az újonnan felismert szerepének a betegségekben, köztük elsősorban az aHUS-ban játszott valószínű szerepére.
Feltételeztük, hogy bizonyos körülmények között, a komplementrendszer túlzott aktivációjától védheti – a sejtmembránban található gátló molekulák funkcióját kiegészítve – a H-faktor a sejteket (9. ábra) (I).
A B C
1 2
7. ábra. A H-faktor kötődése endotélsejtekhez. (A) A HUVEC sejteket sejttenyésztő kamrában tenyésztettük, majd egy éjszakán át szérummentes médiumban tartottuk. Tisztított H-faktorral való inkubálást követően H-faktor specifikus poliklonális ellenanyaggal és fluoreszcens festékkel konjugált másodlagos ellenanyaggal jelöltük, fluoreszcens mikroszkóppal vizsgáltuk. (B) Tisztított H-faktor (FH) dózisfüggő kötődése HUVEC sejtekhez áramlási citofluoriméterrel mérve. Reprezentatív hisztogram. Az x-tengelyen a relatív fluoreszcencia intenzitás, az y-tengelyen pedig a sejtszám van feltüntetve. (C) Emberi szérumból kötődő H-faktor és FHL-1, valamint az FHR-1 izoformák kimutatása HUVEC sejtek lizátumából H-faktor antiszérum segítségével, Western blot technikával. A HUVEC sejteket 20% szérumban inkubáltuk, majd mostuk és lizáltuk. 1: HUVEC, 2: HUVEC + szérum. Józsi et al., Histology and Histopathology 2004, 19:251-258. (I) alapján.
8. ábra. A H-faktor a C-terminális doménjével kötődik endotélsejtekhez. HUVEC sejteket (106 sejt 100 µl DPBS-ben szuszpendálva) 10 µg tisztított H-faktorral (FH) inkubáltunk, 5 µg C18 jelű monoklonális antitest jelenlétében vagy antitest nélkül. Ez az antitest a H-faktor CCP20 doménjében kötődik (Oppermann et al., 2006). A H-faktor kötődését áramlási citofluorimetriás módszerrel mértük, H-faktor specifikus poliklonális antitest és FITC- konjugált másodlagos antitesttel való inkubálás után. Reprezentatív hisztogram. Az x- tengelyen a relatív fluoreszcencia intenzitás, az y-tengelyen pedig a sejtszám van feltüntetve.
Józsi et al., Histology and Histopathology 2004, 19:251-258. (I) alapján.
kontroll C18 + FH FH
kontroll 1 2 5 10 µg FH
9. ábra. A sejtfelszínen kötődő H-faktor hozzájárulása az endotélsejtek komplement- aktivációtól való védelméhez. A H-faktor egyrészt a vérplazmában működik komplement- gátló fehérjeként, mivel elősegíti a képződő C3b molekulák I-faktor (FI) általi hasítását a kofaktor aktivitása révén, ezáltal csökkentve a sejteken lekötődő C3b mennyiségét. Másrészt glikán felismerő képessége révén a H-faktor hozzájárul a sejtfelszínen is a C3b enzimatikus inaktiválásához, ezáltal a felszínen zajló komplementaktiváció gátlásához. A H-faktor ugyanakkor az esetlegesen kialakuló C3bBb konvertázokat is gátolja (nincs az ábrán feltüntetve). Megjegyzendő, hogy jelenlegi ismereteink szerint a H-faktor elsősorban a sejtfelszínre rakódott C3b és glükózaminoglikánok együttesét ismeri fel CCP19-20 doménjei segítségével, tehát ekkor kötődik erősebben a sejtfelszínre. A HUVEC sejteken nem expresszálódik a CR1, ezért ez a molekula nem szerepel az ábrán, de más sejtek esetében a CR1 is gátolja a komplementaktivációt. DAF: decay accelerating factor; MCP: membrane cofactor protein. Józsi et al., Histology and Histopathology 2004, 19:251-258. (I) alapján.
Kimutattuk, hogy a H-faktor viszonylag gyengén kötődik a sejtek felszínéhez (polianionos természetű molekulákon keresztül, mint például a glükózaminoglikánok), viszont komplementaktiváció esetén a lerakódó C3b miatt fokozódik a H-faktor kötődése (10.
ábra) (II). A C-terminális doménekben kötődő antitestek nemcsak a H-faktor szérumból HUVEC-hez való kötődését, hanem immobilizált C3b-hez való kötődését is gátolták. A kontrollként használt C21 jelű antitest, ami a H-faktor CCP 15-18 doménjeiben kötődik, nem gátolta a H-faktornak sem a sejtekhez, sem a C3b-hez való kötődését. A folyadék fázisban, ahogy az várható is volt, egyik vizsgált antitest sem gátolta a H-faktornak a C3b I-faktor általi enzimatikus inaktiválását segítő képességét, azaz kofaktor aktivitását (11. ábra).
10. ábra. A H-faktor kötődése HUVEC sejtekhez. (A) HUVEC sejteket (5 × 105 sejt / 50 µl) 10 µg/ml tisztított H-faktorral (FH) inkubáltunk, PBS-ben vagy 0,5x PBS-ben. A H-faktor kötődését a sejtekhez áramlási citofluoriméterrel mértük. Az ábrán a medián fluoreszcencia intenzitások (MFI) átlaga és a szórás van feltüntetve, 3 kísérlet adataiból. A hígított PBS-ben (vagyis alacsonyabb ionerejű pufferben) mérttel szemben, PBS-ben csak kismértékű H-faktor kötődést tapasztaltunk. (B) A sejteket anti-HUVEC antiszérummal előinkubáltuk, majd PBS- ben hígított, 10% normál humán szérumban való inkubálást követően a C3-fragmentumok és a H-faktor mennyiségét a megfelelő antitestek segítségével, áramlási citofluoriméterrel mértük. Az antitest-kezelés hatására jelentősen fokozódott a C3-fragmentumok lerakódása a sejteken, amivel párhuzamosan nőtt a sejtfelszínen kötődött H-faktor mennyisége is. Az ábra három mérésből a medián fluoreszcencia intenzitások (MFI) átlagát és szórását mutatja. Józsi et al., Molecular Immunology 2007, 44:2697-2706. (II) alapján.
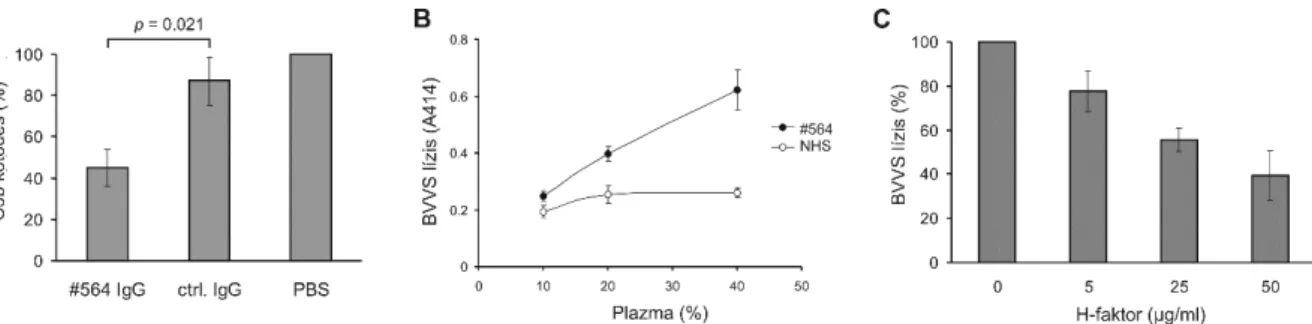
A C3b molekula különböző részeit felismerő ellenanyagok segítségével nyomon tudtuk követni a sejtfelszínre komplementaktiváció során kovalensen kötődő C3b hasítását. A C3b hasításakor a C3d fragmentum a sejtekhez kovalensen kötődve marad, a C3c molekularész pedig lehasítódik. A C18 és az E14 antitestek jelenlétében a szérumból az endotélsejtekre kötődő C3b degradációja csökkent mértékű volt, amit a kezeletlen kontrollhoz és a C21 antitest jelenlétében inkubált sejtekhez képest nagyobb C3c/C3d arány mutatott. Ez azzal magyarázható, hogy több intakt C3b molekula maradt a C18 és az E14 jelenlétében (vagyis kevesebb, sejtekre kötődött H-faktor esetében) a sejteken (12. ábra). H-faktor depletált szérumot használva kimutattuk, hogy amennyiben visszaadjuk a H-faktort a szérumba, fokozott H-faktor kötődést és csökkent C3 és terminális komplement komplex (C5b-9) lerakódást detektálhatunk a sejteken. Normál humán szérumban, a H-faktor C- terminálisán kötődő – annak sejtekhez kötődését gátló – antitestek jelenlétében fokozott C5b- 9 lerakódást mértünk a sejteken (12. ábra). Azt vizsgálandó, hogy szérumban mennyire járul hozzá a H-faktor az endotélsejteknek a komplement károsító hatása elleni védelméhez, részben leemésztettük a sejtekről a GPI-horgonyzott CD55 és CD59 komplementszabályozó molekulákat. Az így kezelt sejteket normál szérumban és H-faktor depletált szérumban
inkubálva bizonyítottuk, hogy H-faktor jelenlétében a sejtek komplement általi lízise gátolt (12. ábra) (II).
Mindezek az eredmények arra utaltak, hogy a H-faktor C-terminális doménjének vagy doménjeinek korábban alulbecsült, ám alapvetően fontos szerepe van abban, hogy a sejtekhez és más felszínekhez (pl. extracelluláris mátrix) kötődve a H-faktor hozzá tudjon járulni a komplementaktiváció megfelelő kontroll alatt tartásához. A membránkötött komplement- szabályozó fehérjék mellett tehát a H-faktor is szerepet játszhat az endotélsejtek komplement általi károsodásának megakadályozásában.
11. ábra. A H-faktor kötődése endotélsejtekhez és C3b-hez. (A) A kísérletekben használt H- faktor specifikus monoklonális antitestek kötőhelyei a H-faktor molekulán (Oppermann et al., 2006 és Józsi et al., 2007 [II] alapján). (B) H-faktor kötődése 20% normál humán szérumból HUVEC sejtekhez különböző, H-faktor specifikus monoklonális antitestek (C18, C21, E14, MH10) jelenlétében (10 µg antitest), áramlási citofluoriméterrel mérve. Az ábra a kezeletlen szérumból való H-faktor kötődés százalékában mutatja az egyes antitestek jelenlétében mért H-faktor kötődés mértékét. Öt kísérlet átlaga a szórásokkal. (C) H-faktor (2 µg/ml) kötődése ELISA-lemezeken immobilizált C3b-hez a különböző monoklonális antitestek (40 µg/ml) jelenlétében. Négy kísérlet átlaga a szórásokkal. (D) H-faktor kofaktor aktivitásának vizsgálata folyadék fázisban.C3b-t és I-faktort (1) inkubáltunk H-faktorral ellenanyag nélkül (2) és a feltüntetett antitestek jelenlétében (3-7) 10 percig 37ºC-on, majd a mintákat redukáló SDS-PAGE gélen való szeparálás és blottolás után anti-C3-mal hívtuk elő. Józsi et al., Molecular Immunology 2007, 44:2697-2706. (II) alapján.
12. ábra. A H-faktor endotélsejtekhez kötődésének funkcionális következményei. (A) HUVEC sejteket 5 percig inkubáltunk 20% humán szérumban, az ábrán jelzett H-faktor- specifikus monoklonális ellenanyagokkal (10 µg) vagy ellenanyag nélkül. A sejtekre kötődött C3b hasítódását C3c- és C3d-specifikus antitestekkel mutattuk ki áramlási citométer segítségével. Az ábra a C3c- és C3d-specifikus fluoreszcencia intenzitások arányát (C3c/C3d) mutatja, négy kísérlet átlagából, a szórások feltüntetésével. (B) HUVEC sejteket 10% H- faktor-depletált szérummal (FH-depl. NHS) inkubáltunk. Párhuzamos kísérletekben visszaadtuk a szérumba a H-faktort (fekete oszlopok). Az ábra a sejteken kötődött H-faktort (FH), C3-fragmentumokat és membránkárosító komplexet (MAC; C5b-9) mutatja. MFI:
medián fluoreszcencia intenzitás. Négy kísérlet átlaga a szórásokkal. (C) A sejteken 20%
szérumból lerakódó C5b-9 terminális komplex kimutatása a különböző H-faktor specifikus antitestek (mAb) jelenlétében, C5b-9 specifikus ellenanyaggal, áramlási citofluorimetriával.
EDTA: 20 mM EDTA-t tartalmazó szérummal inkubált sejteken mért fluoreszcencia jel.
Négy kísérlet átlaga a szórásokkal. (D) HUVEC sejteket 10% H-faktor depletált humán plazmában inkubálva, az alternatív út aktivációját lehetővé tevő Mg2+ ionok jelenlétében, csak kismértékű sejtlízist tapasztaltunk, amit a felülúszóban az előzőleg fluoreszcens festékkel feltöltött sejtekből kiszabaduló kalcein segítségével mutattunk ki. Amennyiben enzimatikus kezeléssel (PI-PLCγ segítségével) eltávolítottuk a sejtmembránról a GPI-horgonyzott CD55 és CD59 komplementszabályozó molekulák jelentős részét, fokozott sejtlízist mértünk. A H- faktor depletált plazmába a H-faktort visszaadva, a CD55 és CD59 molekulák hiánya ellenére is jelentősen csökkent sejtlízis volt mérhető. Négy kísérlet átlaga a szórásokkal. AFU:
artificial fluorescence unit; n.d.: not determined. Józsi et al., Molecular Immunology 2007, 44:2697-2706. (II) alapján.
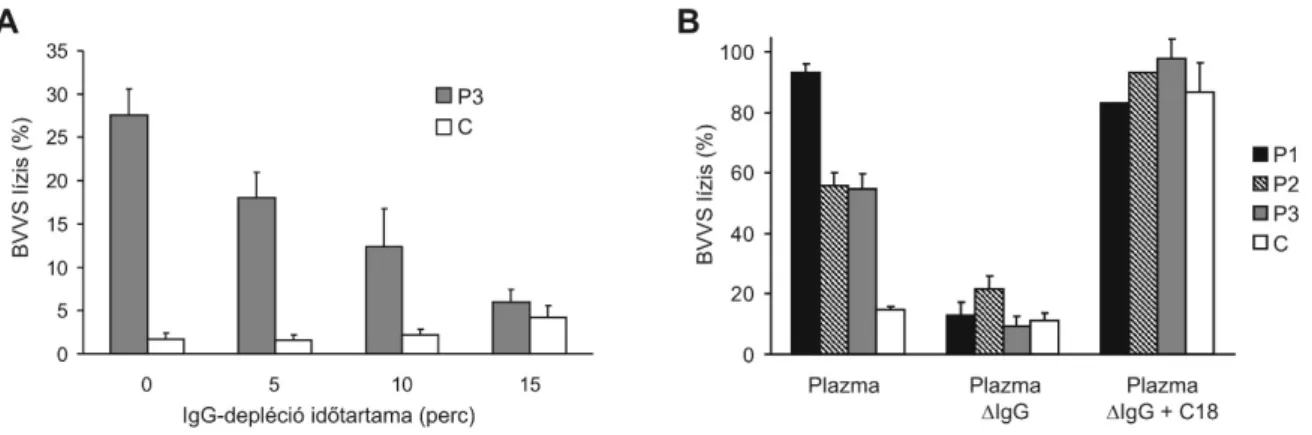
Eredményeinket további vizsgálatokban mi is (Jokiranta et al., 2005; Oppermann et al., 2006) és más munkacsoportok is megerősítették. Saját publikációnkkal egyidőben egy spanyol kutatócsoport szintén kimutatta a H-faktor szerepét a sejtek védelmében. Hemolitikus teszttel igazolták, hogy C-terminális H-faktor mutációt hordozó aHUS betegek szérumában a birka vörösvérsejtek lízise figyelhető meg (Sánchez-Corral et al., 2004). Később amerikai kutatók is kimutatták, hogy a H-faktor a C-terminális doménjeivel tud vörösvérsejtekhez kötődni. Ők a H-faktor rekombináns C-terminális fragmentumát (CCP19-20) használták kompetíciós kísérletekben, és azt találták, hogy a rekombináns CCP19-20 a szérumba adva dózisfüggően fokozza birka vörösvérsejtek lízisét, valamint emberi vörösvértestek lízisét is, amennyiben előzetesen a CD55 és CD59 membránkötött komplementgátló fehérjéket ellenanyagokkal blokkolják (Ferreira et al., 2006).
A saját vizsgálatainkat mindazonáltal lényegesnek gondolom abból a szempontból is, hogy endotélsejteken zajlottak, így in vitro bizonyítékot szolgáltatnak arra, hogy a H-faktor hozzájárul a sejtek védelméhez, feltehetően a veseendotél esetében is. A H-faktor kölcsönhatása különböző sejtekkel és más felszínekkel azóta már szélesebb körben elfogadott, mi is és mások is vizsgálták például apoptotikus sejtekhez és az extracelluláris mátrixhoz való kötődésének funkcionális jelentőségét (Trouw et al., 2007; Mihlan et al., 2009; Kopp et al., 2012; Banda et al., 2013).
5.1.2. H-faktor mutációk funkcionális vizsgálata
A H-faktor aHUS-ban játszott szerepének vizsgálata során a betegekben leírt mutációinak a funkcionális következményeit is tanulmányoztuk. Mivel a H-faktor CCP 19-20 doménjeit aHUS esetében mutációs „hot spot”-ként azonosították, az ezeket a doméneket lefedő átfedő peptidek segítségével vizsgáltuk egyes ligandumok, így a heparin mint polianion, valamint a C3b és a C3d mint komplement ligandumok kötődését. A peptideket hordozó membránokat a különböző ligandumok oldatában való inkubálás után megfelelő reagensekkel előhívtuk. Az eredmények alapján több ligandumkötő régiót azonosítottunk, melyek részben azonosak voltak a heparin, C3b és C3d esetében is (13. ábra) (III). Ezt az magyarázza, hogy ezek a kötőhelyek a CCP domének felszínén levő hurok régiók területére esnek. A mutációk egy része ezekben a felszíni aminosavakban található, más részük a domén belsejében, és a doménszerkezetet befolyásolhatják.
A
B
C
13. ábra. Lineáris ligandumkötő motívumok azonosítása a H-faktor C-terminális doménjeiben. (A) A H-faktor CCP19 és CCP20 doménjeit lefedő, 13 aminosav hosszúságú, 10 aminosavnyi átfedést tartalmazó peptideket szintetizáltattunk nitrocellulóz membránon. A membránokat jelölt heparinnal, tisztított humán C3b-vel és C3d-vel inkubáltuk; ez utóbbiak kötődését antitestek segítségével detektáltuk. Az így azonosított kötőhelyeket keretezés jelöli.
(B) Egyes, aHUS-ban leírt mutációk, ezek közül a kísérleteinkben vizsgált aminosavak (pirossal karikázva) és a peptid scan segítségével azonosított, C3b-kötésben részt vevő aminosavak (zöld háttérrel kiemelve) helyzete a H-faktor CCP19 és CCP20 doménjeiben. (C) Ugyanezek az aminosavak a domének térbeli modelljén mutatva. A rózsaszínnel jelzett aminosavak nem a domén felszínén találhatók. Józsi et al., Journal of the American Society of Nephrology 2006, 17:170-177. (III) alapján.
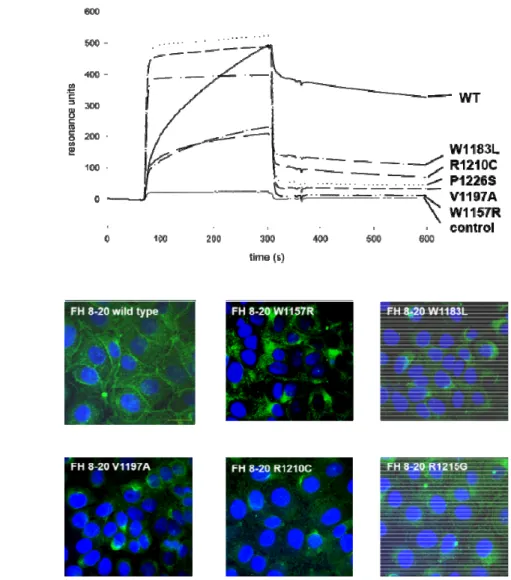
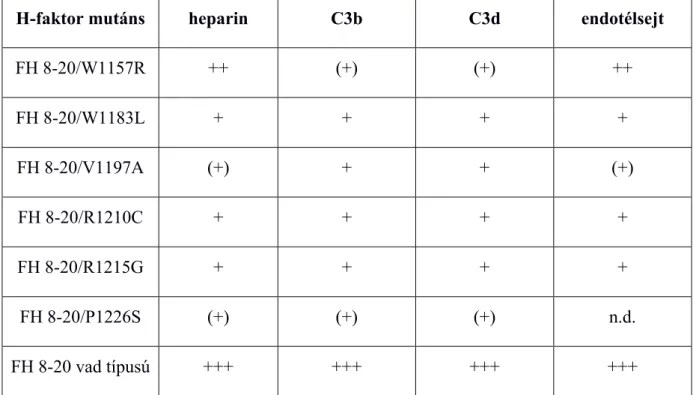
Az aHUS-ban leírt C-terminális mutációk (W1157R, W1183L, V1197A, R1210C, R1215G és P1226S) vizsgálatához a H-faktor CCP8-20 fragmentumát (FH 8-20) és annak mutagenezissel előállított változatait expresszáltuk. A rekombináns mutáns fehérjéket affinitás kromatográfiával vizsgálva azt találtuk, hogy azok különböző mértékben, de csökkent kötődést mutattak heparinhoz, valamint mikroszkóppal vizsgálva az endotélsejtekhez is. A vizsgált mutánsok közül a W1157R mutatta a legkisebb funkciókárosodást a heparinhoz és HUVEC-hez való kötődésben, ugyanakkor ez a mutáns (a P1226S-sel együtt) a többihez képest gyengébben kötődött C3b-hez és C3d-hez is (14. ábra és 4. táblázat) (III).
A
B
14. ábra. Egyes aHUS-ban leírt H-faktor mutációk funkcionális jellemzése. (A) A mutáns fehérjék a vad típusú H-faktorhoz (WT) képest gyengébb C3b kötődést mutatnak felületi plazmon rezonancia vizsgálatban. (B) Vad típusú és mutáns H-faktor CCP8-20 fragmentumok kötődése HUVEC-hez, mikroszkópos vizsgálattal. Zöld szín: H-faktor (poliklonális antitest és Alexa 488-cal konjugált másodlagos antitesttel festve), kék szín: DAPI sejtmag festés. Józsi et al., Journal of the American Society of Nephrology 2006, 17:170-177. (III) alapján.
4. táblázat. A vizsgált H-faktor mutánsok heparinhoz, C3b-hez, C3d-hez és HUVEC sejtekhez való kötődési jellemzőinek összegzése.
H-faktor mutáns heparin C3b C3d endotélsejt
FH 8-20/W1157R ++ (+) (+) ++
FH 8-20/W1183L + + + +
FH 8-20/V1197A (+) + + (+)
FH 8-20/R1210C + + + +
FH 8-20/R1215G + + + +
FH 8-20/P1226S (+) (+) (+) n.d.
FH 8-20 vad típusú +++ +++ +++ +++
A kötődés erősségét a + jelek száma jelzi; n.d.: nem volt meghatározva. Józsi et al., Journal of the American Society of Nephrology 2006, 17:170-177. (III) alapján.
További H-faktor mutációk más munkacsoportok és saját munkacsoportunk általi jellemzése is hasonló eredményekre vezetett (Manuelian et al., 2003; Heinen et al. 2007;
Sánchez-Corral et al., 2002).
Az egyik, aHUS-ban leírt H-faktor mutáció korai stop kodont eredményez (E1172Stop), ezáltal a mutáns fehérjének gyakorlatilag hiányzik a CCP20 doménje. A beteg plazmájából el lehetett különíteni a mutáns molekulát, mivel jóval gyengébben kötődött heparinhoz. A tisztított, mutáns H-faktor csökkent mértékű kötődést mutatott C3b-hez, C3d- hez és endotélsejtekhez is, és emiatt a sejtfelszíni kofaktor aktivitása is lényegesen gyengébb volt (Manuelian et al., 2003; Heinen et al., 2007).
Egy másik érdekes mutáció az R1210C, ami a beteg szérumában Western blot vizsgálattal kisebb mobilitású fehérjecsíkként azonosítható. Ennek az a magyarázata, hogy a cisztein oldallánc révén a szérum albuminhoz kovalensen kötődik a mutáns molekula. Ennek következtében a mutáns H-faktor sztérikus okok miatt nem tud a ligandumaihoz kötődni (Sánchez-Corral et al., 2002; Recalde et al., 2016).
Két munkacsoport részletesen vizsgálta a H-faktor heparin- és C3b-kötő helyeit, ami megerősítette a C-terminális domének döntő szerepét ezekben a kölcsönhatásokban (Schmidt et al., 2008; Ferreira et al., 2009). Ferreira és munkatársai azt találták, hogy egyes mutációk még növelhetik is a H-faktor heparinhoz vagy C3b-hez való kötődésének erősségét;
ugyanakkor a fiziológiás helyzethez közelebb álló sejtes (hemolízis) esszében a mutáns fehérjék kevésbé tudták leszorítani a natív H-faktort a sejtekről. Ebből arra következtettek, hogy valójában a sejtfelszíni polianionos jellegű molekulák és a sejtekre kötődött C3b együttesének felismerése teszi lehetővé, hogy a H-faktor a sejtekhez kötődve kifejtse komplementgátló hatását (Ferreira et al., 2009).
A C-terminális domének (FH19-20) és a C3d komplexének szerkezetét két csoport is meghatározta (Kajander et al., 2011; Morgan et al., 2011). Ezek egyrészt megerősítették a korábbi eredményeket, miszerint a H-faktor a komplementrendszer aktiválódása során sejtfelszínre lekötődött C3b-hez, vagy annak C3d fragmentumához úgy tud kötődni, hogy egyidejűleg a saját sejteken megjelenő polianionos molekulákhoz is kötődik. Ez a kettős felismerés biztosítja a saját és nem-saját H-faktor általi megkülönböztetését. Másrészt az adatok az egyes aHUS-asszociált H-faktor mutációk hatását is megmagyarázzák.
A heparin ugyanakkor nem feltétlenül jó modell minden mutáció esetében, hiszen más polianionos jellegű molekulák is fontosak lehetnek a H-faktor kötődésében, sőt, valószínűsíthetően más glükózaminoglikánokon keresztül kötődik a H-faktor a sejtek felszínére. Kollaboráció keretében részletesen jellemeztük a H-faktor C-terminálisán található glükózaminoglikán-kötő hely szerepét az endotélsejtekhez való kötődésben (Jokiranta et al., 2005). Egy nemrég publikált tanulmányban a H-faktor sziálsavval való kölcsönhatását vizsgálták részletesebben, és kimutatták, hogy az aHUS-ban leírt H-faktor mutációk egy része a sziálsav-kötő helyet érinti (Blaum et al., 2015).
Összefoglalva elmondhatjuk, hogy a C-terminális doménekben létrejött mutációk következtében megváltozik a H-faktor sejtfelszíni polianionos molekulákkal és/vagy a lekötődött C3b-vel, vagy annak C3d fragmentumával való kölcsönhatásának természete. Ez a sejtek felszínén csökkent H-faktor aktivitást eredményez, ami megmagyarázhatja ezen mutációk szerepét a betegség kialakulásában. A H-faktor túl erős kötődése, amely egyes mutánsok esetében megfigyelhető, ugyanúgy a komplementszabályozás zavarához vezet, mint a gyakrabban megfigyelhető gyengébb kötődés a komplement támadás alatt álló sejtek felszínén (Lehtinen et al., 2009; Kajander et al., 2011).