*(25*,.210(= *$='$6È*78'20È1<,.$5
KESZTHELY Növényvédelmi Intézet
Növénykórtani és Növényvirológiai Tanszék
Növénytermesztési és Kertészeti tudományok Doktori Iskola
'RNWRULLVNRODYH]HW
Dr. Horváth József az MTA rendes tagja
TémaYH]HW
Dr. Gáborjányi Richard egyetemi tanár
PAPRIKA ENYHE TARKULÁS VÍRUS (PEPPER MILD MOTTLE VIRUS, PMMoV) IZOLÁTUMOK PATOLÓGIAI,
SZEROLÓGIAI ÉS MOLEKULÁRIS BIOLÓGIAI JELLEMZÉSE
Készítette:
KÁLMÁN DÓRA
Keszthely 2003
PAPRIKA ENYHE TARKULÁS VÍRUS (PEPPER MILD MOTTLE VIRUS, PMMoV) IZOLÁTUMOK PATOLÓGIAI,
SZEROLÓGIAI ÉS MOLEKULÁRIS BIOLÓGIAI JELLEMZÉSE
Értekezés doktori (PhD) fokozat elnyerése érdekében Írta:
Kálmán Dóra
Készült a Veszprémi Egyetem Növénytermesztési és Kertészeti tudományok Doktori iskolája keretében
7pPDYH]HW 'U*iERUMiQ\L5LFKDUG
Elfogadásra javaslom (igen/nem) ……….
A jelölt a doktori szigorlaton ……… % -ot ért el,
Keszthely, …...………
A Szigorlati Bizottság elnöke Az értekezést bírálóként elfogadásra javaslom:
Bíráló neve: Dr. Kazinczi Gabriella igen/nem
………..………
Bíráló neve: Dr. Takács András Péter igen/nem
………..
A jelölt az értekezés nyilvános vitáján ……. %-ot ért el
Keszthely, …….……….
A Bíráló Bizottság elnöke
$GRNWRUL3K'RNOHYpOPLQ VtWpVH«««««««««
...……….
Az EDT elnöke
TARTALOMJEGYZÉK
RÖVIDÍTÉSEK JEGYZÉKE KIVONAT
ABSTRACT
ZUSAMMENFASSUNG
1. BEVEZETÉS 8
2. IRODALMI ÁTTEKINTÉS 10
2.1. A paprika termesztése 2.2. A paprikavírusok
2.3. A Tobamovirus nemzetség 2.3.1. A tobamovírusok evolúciója 2.3.2. A tobamovírusok patotípusai 2.3.3. A tobamovírusok csoportosítása
2.3.4. $] HJ\HV SDSULNiW IHUW ] WREDPRYtUXVRN UpV]OHWHVHEE
jellemzése
2.3.5. A tobamovírusok nukleotid szekvenciája és replikációja 2.3.6. A tobamovírusok terjedése
2.3.7. $WREDPRYtUXVRNHOOHQLYpGHNH]pVOHKHW VpJHL
2.3.7.1. Biológiai módszerek a tobamovírusok elleni védekezésben 2.3.7.2. Biotechnológiai módszerek a tobamovírusok elleni védekezésben 2.3.7.3. Agrotechnikai eljárások a tobamovírusok elleni védekezésben 2.3.7.4. A tobamovírusok elleni rezisztencianemesítés hazai eredményei
3. ANYAG ÉS MÓDSZER
3.1. Tesztnövény vizsgálatok 3.1.1. Vizsgálati anyag
3.1.2. Vizsgálati módszer
3.2. Szerológiai és elektronmikroszkópos vizsgálatok 3.3. Molekuláris virológiai vizsgálatok
3.3.1. Össz-nukleinsav kivonás és tisztítás
3.3.2. DNS másolat készítése reverz transzkripcióval 3.3.3. Polimeráz láncreakció (PCR)
3.3.4. Gélelektroforézis
3.3.5. 5HNRPELQiQVSOD]PLGRNHO iOOtWiVD
3.3.6. A rekombináns plazmidok bejuttatása baktérium sejtekbe 3.3.7. A rekombináns plazmidok felszaporítása
3.3.8. A plazmidok tisztítása
3.3.9. A nukleotid sorrend meghatározása
3.4. A paprika enyhe tarkulás vírus (Pepper mild mottle virus, PMMoV) izolátumok összehasonlító
vizsgálata
3.4.1. Szekvencia analízis
3.4.2. 5HVWULNFLyVHQ]LPDQDOt]LVpVNHYHUWIHUW ]pVHVNtVpUOHW
3.5. A paprika enyhe tarkulás vírus (Pepper mild mottle virus, PMMoV) növényen belüli terjedésének vizsgálata
4. EREDMÉNYEK
4.1. Tesztnövény vizsgálatok
4.2. Szerológiai és elektronmikroszkópos vizsgálatok 4.3. Molekuláris virológiai vizsgálatok
4.4. A paprika enyhe tarkulás vírus (Pepper mild mottle virus, PMMoV) izolátumok összehasonlító vizsgálata
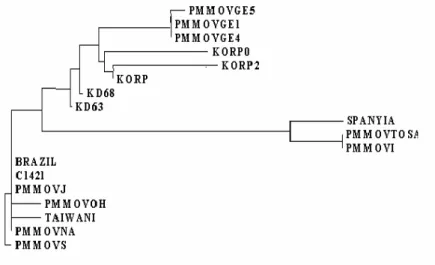
4.4.1. Szekvencia analízis
4.4.2. Restrikciós enzim analízis ésNHYHUWIHUW ]pVHVNtVpUOHW
4.5. A paprika enyhe tarkulás vírus (Pepper mild mottle virus, PMMoV) növényen belüli terjedésének vizsgálata
5. KÖVETKEZTETÉSEK, JAVASLATOK 6. ÖSSZEFOGLALÁS
7. ÚJ TUDOMÁNYOS EREDMÉNYEK 8. NEW RESULTS
9. KÖSZÖNETNYILVÁNÍTÁS 10. IRODALOMJEGYZÉK
AZ ÉRTEKEZÉS TÉMAKÖRÉBEN KÉSZÜLT KÖZLEMÉNYEK
RÖVIDÍTÉSEK JEGYZÉKE
A260/280 = abszorpciós spektrum minimum és maximum aránya AMV = Alfalfa mosaic virus, lucerna mozaik vírus
Asn = asparagin, aszparagin
BBWV = Broadbean wilt virus, lóbab hervadás vírus BMV = Brome mosaic virus, rozsnok mozaik vírus
BpeMV = Bell pepper mottle virus, harang alakú paprika tarkulás vírus
BTH = 1,2,3-benzotiadiazol-7-trikarboxi-S-metilészter cDNS = copy DNS, DNS másolat
CGMMV = Cucumber green mottle mosaic virus, uborka zöld tarkulás mozaik vírus
CMV = Cucumber mosaic virus, uborka mozaik vírus CP = coat protein, köpenyfehérje
ELISA = Enzyme Linked Immuno Sorbent Assay, Enzimhez kötött Immunoszorbens Vizsgálat
DAS-ELISA = Double Antibody Sandwich Enzyme Linked Immuno SorbeQW$VVD\.HWW V$QWLWHVW6]HQGYLFV(Q]LPKH]
kötött Immunoszorbens Vizsgálat
DYFV = Dulcamara yellow fleck virus, csucsor sárga foltosság vírus GS = gene silencing, „géncsendesítés”
HeMV = Henbane mosaic virus, beléndek mozaik vírus HR = hypersensitive reaction, hiperszenzitív reakció INA = 2,6-dikloro-izonikotinsav
ICTV = International Committee on Taxonomy of Viruses, Nemzetközi Vírus Taxonómiai Bizottság
kD = kilodalton
Met = methionine, metionin
MP = movement protein, mozgásfehérje nt = nukleotid
ObPV = Obuda pepper virus, Óbuda paprika vírus ORF = open reading frame, nyitott leolvasási keret
PaMMV = Paprika mild mottle virusI V]HUSDSULNDHQ\KHWDUNXOiV
vírus
PCR = polimerase chain reaction, polimeráz láncreakció
PMMoV = Pepper mild mottle virus, paprika enyhe tarkulás vírus PPV = Plum pox virusV]LOYDKLPO YtUXV
PVX = Potato virus X, burgonya X vírus PVY = Potato virus Y, burgonya Y vírus SA = salicylic acid, szalicilsav
SoMV = Sowbane mosaic virus, Chenopodium mozaik vírus TAV = Tomato aspermy virus, paradicsom magtalanság vírus TEV = Tobacco etch virus, dohány karcolatos vírus
TMGMV = Tobacco mild green mosaic virus, dohány enyhe zöld mozaik vírus
TMV = Tobacco mosaic virus, dohány mozaik vírus ToMV = Tomato mosaic virus, paradicsom mozaik vírus tRNS = transzfer RNS
TSWV = Tomato spotted wilt virus, paradicsom bronzfoltosság vírus
KIVONAT
Paprika enyhe tarkulás vírus (Pepper mild mottle virus, PMMoV) izolátumok patológiai, szerológiai és molekuláris biológiai jellemzése
$ GLVV]HUWiFLy D SDSULNDWHUPHV]WpVEHQ MHOHQW V NiURNDW RNR]y
tobamovírusok, azon belül a hazai paprika enyhe tarkulás vírus (Pepper mild mottle virus, PMMoV) izolátumok részletes vizsgálatával foglalkozik.
$V]HU] ND]pVN|]|WWJ\ MW|WW0DJ\DURUV]iJNO|QE|]
WHUOHWHLU O V]iUPD]y PLQWiNEDQ WDOiOW WREDPRYtUXVRN D]RQRVtWiViW WHV]WQ|YpQ\HN IHUW ]pVpYHl, DAS-ELISA vizsgálatokkal, elektronmikroszkópos eljárással és polimeráz láncreakcióval (PCR) végezték. A molekuláris biológiai vizsgálatok során univerzális tobamovírus és vírus-specifikus primereket (TMV-U1, PMMoV, ObPV) terveztek a hazánkban leggyakrabEDQ HO IRUGXOy WREDPRYtUXVRN
azonosítására. A primereket saját és autentikus izolátumokkal tesztelték. A hazai PMMoV izolátumok köpenyfehérje gén szakaszának részletét klónozták és szekvenálták. Az így kapott szekvenciákat egybevetették az adatbankban található külföldi PMMoV izolátumok szekvenciáival, ennek alapján filogenetikai törzsfát szerkesztettek. A magyar PMMoV izolátumokat összehasonlították a spanyol PMMoV izolátumokkal
UHVWULNFLyV HQ]LP DQDOt]LV NHYHUW IHUW ]pVHV NtVpUOHW pV XQ WLVVXH SULQWLQJ
módszer segítségével.
A munka során bizonyítást nyert a PMMoV P1,2 patotípusú
L]ROiWXPiQDN KD]DL HO IRUGXOiVD DPHO\HW PLQG SDWROyJLDL V]HUROyJLDL
elektronmikroszkópos, mind molekuláris biológiai módszerekkel alátámasztottak. A hazai PMMoV izolátumok nagyfokú homológiát mutattak (95-100 %-RV HJ\H] VpJ DPLQRVDY V]LQWHQ D NOI|OG|Q OHtUW
300R9 L]ROiWXPRNNDO $ ILORJHQHWLNDL W|U]VIiEDQ D I FVRSRUWWyO
elkülönültek, legközelebb egyes koreai és japán izolátumokhoz álltak. A magyar és spanyol izolátumok összehasonlításakor a viselkedésükben hasonlóságokat és eltéréseket is megfigyeltek.
$ IHOPpUpVHN VRUiQ D V]HU] N D 31,2 patotípusú tobamovírus izolátumok elterjedését, ugyanakkor a P0 és P1 patotípusú izolátumok visszaszorulását figyelték meg. A disszertáció felhívja a figyelmet arra, hogy a rezisztens fajták alkalmazásával hazánkban is végbementek a
WREDPRYtUXVRNUD MHOOHP] YiOWR]iVRN (V]HULQW D WREDPRYtUXVRN LG U O-
LG UH iWW|ULN D UH]LV]WHQFLiW HJ\UH SDWRJpQHEEW|U]VHLN MHOHQQHN PHJ ÒJ\
W QLN D] DODFVRQyabb patogenitású tobamovírus izolátumokat Magyarországon is sikerült visszaszorítani, ezek inkább házikertekben,
HOKDQ\DJROW iOORPiQ\RNEDQ QHP UH]LV]WHQV IDMWiNDW WHUPHV]W WHUOHWHNHQ
maradtak fenn. Ezzel párhuzamosan elterjedtek az agresszívebb, magasabb patogenitású törzsek. A PMMoV hazai jelenléte új járványtani kérdéseket
YHW IHO PLYHO D YtUXV EHOV PDJiWYLWHOOHO LV WHUMHG UiDGiVXO J\DNUDQ FVDN QDJ\RQJ\HQJHWQHWHNHWRNR]DOHYHOHNHQYDJ\WQHWPHQWHVDIHUW ]pV$
terméseken ugyanakkor nekrózis, GHIRUPiFLyILJ\HOKHW PHJDPLDWHUPpVW
eladhatatlanná teszi, és így nagyon komoly károkat okoz a paprikatermesztésben.
ABSTRACT
Pathological, serological and molecular biological characterization of Pepper mild mottle virus (PMMoV) isolates
The authors identified the tobamoviruses found in the samples collected from different parts of Hungary between 1999 and 2001, using host-plant tests, DAS-ELISA method, electrone microscope assay and polymerase chain reaction (PCR). Universal tobamovirus and virus-specific (TMV-U1, PMMoV, ObPV) primers were designed to detect the most important tobamoviruses in Hungary. A fragment of the CP gene of the Hungarian PMMoV isolate was cloned and sequenced. The sequence was compared to the sequences of other PMMoV isolates from the databank and a phylogenetic tree was created. A comparison was made between the Hungarian and the Spanish isolates adopting restriction enzyme analysis, mixed infections and tissue printing methods.
The Hungarian isolates showed a great similarity to other PMMoV isolates (95-100 % similarity in amino acid level). In the phylogenetic tree they separated from the 3 main group and were closest to certain Japanese and Korean isolates.
The results indicate the changes which can be observed in Hungary with the use of the resistant pepper varieties, as the tobamovirus isolates of P0 and P1 pathotypes are forced back, while those with higher pathogenicity (P1,2) come to the front.
The presence of the PMMoV of P1,2 pathotype in Hungary raises new problems, as the virus can spread by internal seed-transmission as well, and often causes slight symptoms on the pepper leaves or no symptoms at all.
On the fruits occurs deformation and necrosis which makes the crop unmarketable causing great economic losses.
ZUSAMMENFASSUNG
Patologische, serologische und molekular biologische Charakteristik der Pepper mild mottle virus (PMMoV) Isolaten
Die Autoren identifizierten die Tobamoviren die sie in den Proben aus verschiedenen Teilen von Ungarn zwischen 1999 und 2001 gesammelt haben mit Testpflanzen, DAS-ELISA Methode, Elektronmikroskopische Untersuchung und Polymerasenkettenreaktion.
Um die Identifizierung von dem wichtigsten Tobamoviren in Ungarn haben sie universalische Tobamovirus und virus-spezifische (TMV-U1, ObPV, PMMoV) Primers geplant. Ein Abschnitt des Kapseleiweiß Gens des Ungarischen PMMoV Isolates wurde geklont und sequenziert. Die Sequenz wurde vergleicht mit der Sequenzen der anderen PMMoV Isolaten aus der Dateienbank und ein filogenetischer Baum wurde konstruirt. Es wurde zwischen den Ungarischen und Spanischen Isolaten ein Vergleich gemacht mit Restriktionenzym Analyse, gemischte Infekzionen und „tissue printing” Methode.
Die Ungarischen Isolaten bezeigten große Ähnlichkeit zu anderen PMMoV Isolaten (95-100 % Ähnlichkeit auf der Ebene der Aminosäuren).
In dem filogenetischen Baum separierten sie sich von den 3 wichtigsten Gruppen und standen am nächsten zu einigen Japanischen und Koreanischen Isolaten.
Die Ergebnisse zeigen die Wandlungen welche in Ungarn beobachtet werden können, die im Zusammenhang sind mit dem Gebrauch des
widerstandsfähigen Paprikasorten stehen. Die Tobamovirus Isolaten mit P0
und P1 Pathotypus treten in Hintergrund während die Isolaten mit höcher Pathogenität kommen in den Vordengrund.
Die Gegenwart des Isolaten PMMoV des P1,2 Pathotypus in Ungarn wirft auf neue Probleme, weil das Virus kann sich auch mit inneren Kornübertragung verbreiten und kann auf den Paprika blättern oft schwache oder garkeine Symptome herbeiführen. An den Früchten kann sich Deformation und Nekrosis entwickeln, was die Früchte unverkäuflich macht und damit große wirtschaftliche Schäden verursacht.
1. BEVEZETÉS
A Tobamovirus nemzetség tagjai a Nidovirales rend merev, pálcika alakú, kb. 300 nm hosszúságú, helikális szimmetriájú vírusai. A világ minden részén komoly gazdasági problémát jelentenek a
SDSULNDWHUPHV]WpVEHQMHOHQW VNiURNDWRNR]QDNPLQGDV]DEDGI|OGLPLQGD
fólia alatt termesztett kultúrákban. Hazánkban az 1950-HV pYHNW O NH]G G HQ V]iPRV PDJ\DU NXWDWó foglalkozott a Tobamovirus
QHP]HWVpJJHO GH D PDJ\DURUV]iJL HO IRUGXOiVXNUyO MHOHQW VpJNU O pV D W|U]VHN HONO|QtWpVpU O QHP NpV]OW iWIRJy GROJR]DW ÈOWDOiQRVDQ LVPHUW MHOHQVpJKRJ\DWREDPRYtUXVRNLG U O-LG UHiWW|ULNDUH]LV]WHQFLiWpVHJ\UH
patogénebb törzseik jelennek meg. Az utóbbi két évtized is ezt igazolta: a korábban „egyeduralkodó” P0 patotípusú dohány mozaik vírus (Tobacco mosaic virus, TMV) U1 törzse szinte teljesen kiszorult, megjelent a P1,2
patotípusú paradicsom mozaik vírus (Tomato mosaic virus, ToMV) Ob törzs (amelyet újabban önálló vírusként tartanak nyílván Obuda pepper virus, ObPV néven), majd a P1,2 illetve P1,2,3 patotípusú paprika enyhe tarkulás vírus (Pepper mild mottle virus, PMMoV) izolátumok terjedtek el.
A PMMoV különös veszélyessége abban rejlik, hogy csak gyenge tüneteket okoz a leveleken - tJ\ QHKH]HQ pV]UHYHKHW - pV EHOV PDJiWYLWHOOHO LV
terjed.
0XQNiQN VRUiQ FpOXO W ]WN NL D KD]iQNEDQ SDSULNiQ HO IRUGXOy
tobamovírus törzsek azonosítását és jellemzését. Ennek érdekében több
pYHQ NHUHV]WO PLQWDJ\ MWpVW IRO\WDWWXQN D] RUV]iJ NO|QE|] WHUOHWHLQ
*D]GDViJL MHOHQW VpJH pV ~MV]HU VpJH PLDWW D IHOPpUpVHN VRUiQ OHtUW KD]DL
PMMoV izolátumokat különféle módszerekkel vizsgáltuk. Tesztnövény- kísérletek, szerológiai vizsgálatok, elektronmikroszkópos eljárások és molekuláris biológiai módszerek segítségével kívántuk a magyar PMMoV
L]ROiWXPRNDW MHOOHPH]QL &pONLW ]pVHLQN N|]W V]HUHSHOW D KD]DL 300R9
izolátumok köpenyfehérje gén (coat protein, CP) részletének klónozása és szekvenálása. Vizsgálataink kiterjedtek a meghatározott szekvenciarészlet és a más országokban korábban leírt PMMoV izolátumok szekvenciájának összehasonlítására, valamint a filogenetikai rokonság megállapítására. A magyar izolátumokat részletesebben összehasonlítottuk a tulajdonságaikban közel álló spanyol izolátumokkal.
2. IRODALMI ÁTTEKINTÉS
2.1. A paprika termesztése
A világon több mint 1 millió hektáron termesztenek paprikát (Green és Kim 1991), ideértve a Capsicum nemzetség PH[LNyL IHNHWH FVtS V ERJ\yWHUPpV SDSULNiLW XJ\DQ~J\ PLQW D NDORFVDL I V]HUSDSULNiW
Magyarország a szabadföldi paprikatermesztés északi határa. Az étkezési paprika üzemi vetésterülete 4- H]HU KHNWiU H]HQNtYO MHOHQW V D Ki]LNHUWL
terület. A termésátlag 123 mázsa/hektár, a termésmennyiség a házikerti
WHUPHV]WpVQpONONEH]HUWRQQD0H] JD]GDViJL6WDWLV]WLNDLeYN|Q\Y
2000).
2.2. A paprikavírusok
.|]LVPHUW KRJ\ D SDSULND EHWHJVpJHL N|]|WW D YtUXVRNQDN MHOHQW V
szerep jut. Eddig több, mint 45 víUXVUyO tUWiN OH KRJ\ D SDSULNiW IHUW ]L HEE O-öt izoláltak természetes körülmények között (Horváth 1981, 1983, 1986a, 1986b, 1986c, Horváth és Beczner 1983, Green és Kim 1991, Green és Kalloo 1994, Edwardson és Christie 1997). Ezeket a vírusokat a tünetek
DODSMiQ GLDJQRV]WL]iOQL OHKHWHWOHQ KLV]HQ HJ\ YtUXV NO|QE|] WQHWHNHW RNR]KDWLOOHWYHKDVRQOyWQHWHNLVV]iUPD]KDWQDNNO|QE|] NyURNR]yNWyO
$ SDSULNDNXOW~UiN YtUXVIHUW ]|WWVpJHWiJ KDWiURN N|]|WW PR]RJKDW D
vegetáció alatt akár a 100 %-ot is elérheti (Benner és Kuhn 1985). Tóbiás et al. DUUyO V]iPROWDNEH KRJ\ D SDSULND YtUXVIHUW ]|WWVpJH NH]GHWEHQ
15- N|]|WW LQJDGR]RWW D WHQ\pV]LG V]DN YpJpUH D -ot is megközelíthette. Kajati és Kádár (1972) felmérése alapján a
YtUXVIHUW ]|WWVég a szentesi körzetben átlagosan 60,3%-os volt, de akadt olyan adatfelvételi hely, ahol 95%-osnak bizonyult.
$SDSULNiWIHUW ] YtUXVRNMHOHQW VpJHpVHO IRUGXOiVLDUiQ\DHOWpU D
YLOiJNO|QE|] UpV]HLQMilbrath és Cook (1971) Hawaii-on 1970-71-ben, a termesztett paprikák közt végeztek virológiai felmérést és gyakorinak találták a burgonya Y vírust (Potato virus Y, PVY), a TMV-t, de gyakran
HO IRUGXOW D GRKiQ\ NDUFRODWRV YtUXV Tobacco etch virus, TEV) és a paradicsom bronzfoltosság vírus (Tomato spotted wilt virus, TSWV) is.
Makkouk és Gumpf (1974) szerint 1971-73-ban, Kaliforniában a PVY és a
7(9IRUGXOWDNHO OHJJ\DNUDEEDQDSDSULNiQNLVHEEPpUWpNEHQDEXUJRQ\D
X vírus (Potato virus X, PVX), az uborka mozaik vírus (Cucumber mosaic virus, CMV), a TSWV és a TMV is jelen voltak. Egy másik felmérés szerint az Egyesült Államokban a paprika vírusbetegségei közül a TEV volt
D GRPLQiQV H] D NyURNR]y (XUySiEDQ QHP IRUGXO HO GH D &09 LV
QDJ\PpUWpNEHQ IHUW ]|WW D V]DEDGI|OG|Q Benner és Kuhn 1985). Conti és Masenga (1977) adatai alapján Észak-Nyugat Olaszországban, fóliás termesztésben a TMV volt a legelterjedtebb, szabadföldön pedig a CMV. A lucerna mozaik vírus (Alfalfa mosaic virus, AMV) és a PVY inkább a konyhakertekben jelent meg.
Az eddigi felmérések szerint Magyarországon leggyakrabban a TMV
pV D &09 IRUGXOWDN HO pV D OHJQDJ\REE WHUPpVYHV]WHVpJHW LV H]HN D
vírusok okozták (Kajati és Kádár 1972, Tóbiás és Molnár 1983).
Gáborjányi et al. (1998a, 1998b) vizsgálatai alapján fólia alatt és üvegházban a ToMV, a CMV, a PVY, a TSWV bizonyultak a
OHJMHOHQW VHEEQHNZatykó (1982) a PVY és a paradicsom magtalanság vírus (Tomato aspermy virus, TAV) veszélyességére is felhívta a figyelmet.
Gáborjányi et al. DGDWDL V]HULQW D V]DEDGI|OGL SDSULNiW IHUW ]
vírusok gyakorisága 1996-EDQ D N|YHWNH] NpSSHQ DODNXOW D PLQWiN %-
ában): CMV 77%, AMV 83%, TMV és ToMV 27%, PVY 44%, PVX 44%, beléndek mozaik vírus (Henbane mosaic virus, HeMV) 61%,Chenopodium mozaik vírus (Sowbane mosaic virus, SoMV) 27%. Egyes adatok szerint
0DJ\DURUV]iJRQHO IRUGXOPpJDSDSULNDViUJDpUPR]DLNEHWHJVpJSHSSHU
yellow vein mosaic disease), melynek rendszertani hovatartozása eddig
PpJ QHP WLV]Wi]RWW GH IHOWHKHW HQ YtUXVRV HUHGHW Salamon et al. 1982, Szürke és Salamon 1986, Gáborjányi et al. 1997).
Hazánkban eddig összesen 13 paprikapatogén vírust izoláltak (1.
táblázat), melyek között 4 tobamovírust is találunk. Salamon (1985) megemlíti a dohány enyhe zöld mozaik vírust (Tobacco mild green mosaic virus 70*09 LV PLQW 0DJ\DURUV]iJRQ HO IRrduló tobamovírust, erre vonatkozólag azonban több adatot és újabb bizonyítékokat nem találtunk.
1. táblázat. A Magyarországon eddig leírt paprikapatogén vírusok (Gáborjányi et al. 1998a,b nyomán)
Paprikapatogén vírusok (OV OHtUiV
Uborka mozaik vírus (Cucumber mosaic virus, CMV)
Szirmai 1941
Lucerna mozaik vírus (Alfalfa mosaic virus, AMV)
Szirmai 1944
Dohány mozaik vírus (Tobacco mosaic virus, TMV)
Szirmai 1950
Burgonya X vírus (Potato virus X, PVX)
Szirmai 1950
Burgonya Y vírus (Potato virus Y, PVY) Horváth 1967 Paradicsom magtalanság vírus (Tomato
aspermy virus, TAV)
Beczner et al. 1979
Lóbab hervadás vírus (Broadbean wilt virus, BBWV)
Salamon et al. 1980
Paradicsom mozaik vírus (Tomato mosaic virus, ToMV)
Horváth és Beczner 1973
Óbuda paprika vírus (Obuda pepper virus, ObPV)
Csilléry és Ruskó 1980, Csilléry et al.
1983 Csucsor sárga foltosság vírus (Dulcamara yellow fleck virus, DYFV)*
Salamon et al. 1987, Salamon és Beczner 1987
Paradicsom bronzfoltosság vírus (Tomato spotted wilt virus, TSWV)
Gáborjányi et al. 1995ab
Beléndek mozaik vírus (Henbane mosaic virus, HeMV)
Gáborjányi et al. 1997
Libatop mozaik vírus (Sowbean mosaic virus, SoMV)
Gáborjányi et al. 1997
Paprika enyhe tarkulás vírus (Pepper mild mottle virus, PMMoV)
Tóbiás és Csilléry 1983, Salamon 1993, Kiss 1996, Kálmán et al. 2000
* = az ICTV által hivatalosan nem jegyzett faj
Tóbiás et al. V]HULQW D 709 IHUW ]pVH N|YHWNH]WpEHQ D]
HOV RV]WiO\~WHUPpVPHQQ\LVpJHFVDND]|VV]WHUPpV-a volt. Feldman et al. (19 NtVpUOHWHL DODSMiQ D 709 MHOHQW VHQ FV|NNHQWHWWH D WHUPpVPHQQ\LVpJHW OHJDOiEELV KD D IHUW ]pV D NLOWHWpVW O V]iPtWRWW
napon belül bekövetkezett. A korai paprikák esetében kb. 80 %-os, a
NpV LHNQpO NE -os termésveszteséget figyeltek meg. Általánosságban
HOPRQGKDWy KRJ\ PLQpO NRUDLEE IHQROyJLDL VWiGLXPEDQ pUL D IHUW ]pV D
növényt, annál súlyosabb kártétellel illetve termésveszteséggel számolhatunk.
2.3. A Tobamovirus nemzetség
2.3.1. A tobamovírusok evolúciója
Az evolúcióval foglalkozó kutatók szerint a tobamovírusok kb. 120-
PLOOLy pYHVHN PLNpQW ]iUYDWHUP JD]GiLN PHO\HNNHO IHOWHKHW HQ HJ\WW IHMO GWHN Gibbs $ WREDPRYtUXVRN VH -600 millió éve jelenhetett meg. Génszekvenciájuk és a génekben kódolt fehérje motívumok alapján a Tobra-, a Hordei- és a talaj-által közvetített gabona mozaik vírussal (Soil-borne wheat mosaic virus) állnak rokonságban, a köpenyfehérjéjük alapján a furovírusokkal is rokonok. Az RNS-polimeráz génjük alapján a tobamovírusok egy nagy csoportba, az alpha-like víruscsoportba tartoznak. Jelenleg a tobamovírusokat a replikációs stratégiájuk, genomfelépítésük, transzlációs mechanizmusuk, stb. alapján a Sindbisvírusokhoz hasonló növényvírusok „szupercsaládjába” sorolják. A
709 HUHGHWL KD]iMD IHOWHKHW HQ YDODKRO 3HUX %ROtYLD %UD]tOLD WHUOHWpQ
volt (Gibbs 1999).
$ WREDPRYtUXVRN LJHQ YiOWR]pNRQ\DN QpKiQ\ MHOOHP] MN
PHJYiOWR]KDW KD NO|QE|] K PpUVpNOHWHNHQ YDJ\ NO|QE|]
gazdanövényeken hoVV]~ LG Q NHUHV]WO WDUWMXN IHQQ NHW $ 709 L]ROiWXPRN YiOWR]pNRQ\DEEQDN EL]RQ\XOWDN NO|Q|VHQ D] 516 HOV IHOH
mint a TMGMV izolátumok (Fraile et al. 1997). Az ausztrál TMV
SRSXOiFLyEDQSpOGiXOD]LG NVRUiQDQXNOHRWLGFVHUpNV]iPDQ|YHNHGHWWGH
inkább azoké, amelyek nem változtatták meg az aminosav sorrendet (Gibbs 1999). A dohány enyhe zöld mozaik vírus (Tobacco mild green mosaic virus 70*09 SRSXOiFLyN YLV]RQW PHJOHKHW VHQ KDVRQOyDN HJ\PiVKR]
bár a kaliforniai és krétai populációk – PHO\HN VLEEQHN W QQHN- kétszer olyan változékonyak, mint az ausztrál és a spanyol populációk.
Fraile et al. (1997) közel 100 év tobamovírus izolátumait – köztük
KHUEiULXPL Q|YpQ\HNU O V]iUPD]yNDW LV - vizsgálták Ausztráliában.
Kezdetben Ausztráliában a TMGMV és a TMV is jelen volt - Nicotiana glauca-UyO PLQGNHWW W L]ROiOWiN HO WW-, majd az utóbbi kiszorult, és
XWiQPiUFVDN70*09L]ROiWXPRNIRUGXOWDNHO (QQHNRNDKRJ\D
TMV kevésbé volt versenyképes, mint a TMGMV, valamint kevert
IHUW ]pVEHQ D 709 FVDN NE WL]HGQ\L PHQQ\LVpJEHQ IRUGXOW HO D] HJ\HGL IHUW ]pVKH] NpSHVW (] D] RND DQQDN LV KRJ\ D 709 V]LQWH WHOMHVHQ HOW QW
Amerikából. Rekombinációkat is találtak a tobamovírusokon belül, pl. egy herbáriumon talált izolátum két szekvenciarészletét választották ki
YpOHWOHQV]HU HQ YL]VJiODWUD D] L]ROiWXP -1250 nukleotidig (nt) TMV, 3461-3769 nt-ig TMGMV szekvenciájúnak bizonyult. A TMV
„kihalásának” magyarázata a Muller-féle „záróretesz” (Muller’s rachet) vagy mutációs „beolvadás”: a populáció létszáma egy küszöbérték alá esik, melyben a deléciós mutációk eltávolítása rendkívül nehézzé válik (Lynch et al. 1993).
A tobamovírusok evolúcióját és variabilitását vizsgálták azok a spanyol kutatók, akik 26 PMMoV-S izolátum RNS-ét hasonlították össze az RNAseT1 „ujjlenyomatuk” (fingerprint) alapján (Rodríguez-Cerezo et al. 1989). A kétdimenziós elektroforézis vizsgálat során az RNAse T1-el való emésztés után kapott oligonukleotidokat poliakrilamid gélben futtatták. Az izolátumokat bizonyos oligonukleotidok megléte vagy hiánya alapján 10 csoportba (haplotípus) sorolták. A vizsgálat eredményeit úgy összegezték, hogy a PMMoV-6$OPpULiEDQPHJOHKHW VHQVWDELOSRSXOiFLyW
alkotott, de a változatosságot is fenntartotta. Egy uralkodó haplotípus volt,
DPHO\E O N|]HOL URNRQ YDUiációk keletkeztek, amik azonban nem
KHO\HWWHVtWHWWpN D]W $ PDJDV VWDELOLWiV D PHJOHKHW VHQ N|W|WW
nukleotidsorrend következménye. A legnagyobb eltérést a II-es és X-es
haplotípus között találták. A haplotípusokon belül 2 alcsoportot különítettek el, az eOV EHD],-es és a II-es haplotípus; a másodikba a III-X- es haplotípusok tartoztak. Leggyakoribbnak a VI-os haplotípus bizonyult, egy másik törzsfa viszont a IV-HVWtSXVWMHO|OWHPHJN|]SRQWLNpQWPHO\E O DW|EELWtSXVNLIHMO G|WW$]- N|]WJ\ MW|WW mintákban az I-es és II-
HVKDSORWtSXVIRUGXOWHO DPLDUUDXWDOWKRJ\H]HN VLEEWtSXVRNPHO\HNHW D]WiQ IHOYiOWRWWDN D] ~MDEEDN (]HN V]HULQW VL WtSXVQDN UHOLNWXPQDN WHNLQWKHW SpOGiXOD-es PMMoV-S izolátum (P78/84).
2.3.2. A tobamovírusok patotípusai
$ WREDPRYtUXVRN IHUW ]pVpYHO V]HPEHQ W|EE HOOHQiOOyViJRW EL]WRVtWy
rezisztenciagént azonosítottak.
A paradicsomban a Tm-1 gén visszaszorította a ToMV replikációját (Motoyoshi és Oshima 1977), de a ToMV replikáz génjében bekövetkezett mutáció a Tm-1 gén által biztosított rezisztencia áttörését eredményezte (Meshi et al. 1988). A Tm-2 gén ugyancsak megvédte a növényt a
YtUXVIHUW ]pVW OMotoyoshi és Oshima 1975, 1977), de ez a rezisztencia is
PHJV] QWHWKHW YROWDN'PR]JiVIHKpUMpEHQLQGXNiOWPXWicióval (Meshi et al. 1989). Ezek a megfigyelések arra utaltak, hogy a Tm-1 rezisztenciagén a vírusreplikáció, a Tm- D YtUXVPR]JiV V]LQWMpQ P N|GLN
(Sanfaçon et al. 1993).
Sokkal kevésbé ismerjük a Nicotiana glutinosa-ból származó N és a Nicotiana sylvestris-E O V]iUPD]yN’ UH]LV]WHQFLDJpQ P N|GpVpW $ 709
CP-jében történt mutációk módosították az N’ gént tartalmazó növények hiperszenzitív reakcióját (Knorr és Dawson 1988, Saito et al. 1987, 1989).
Az N gént tartalmazó dohányokban a YiODV] K PpUVpNOHW-IJJ nek bizonyult. Az inokulált leveleken 25°& DODWW ORNiOLV Op]LyN IHMO GWHN PtJ
28°C felett a tünetek szisztemizálódtak (Samuel 1931). Az N gén
P N|GpVpQHNKiWWHUpWNLWHUMHGWHQNXWDWWiN1RKDV]iPRVDQWLYLUiOLVIHKpUMpW
azonosítottak (Loebenstein és Gera 1981, Spiegel et al. 1989, Edelbaum et al. 1990), egyik sem volt bizonyíthatóan összefüggésben az N gén aktivitásával. Eddig egyetlen tobamovírusról jelentették, hogy áttöri az N rezisztenciagént, ez a ToMV-Ob volt (Csilléry és Ruskó 1980, Csilléry et al. 1983). Az áttörés azonban nem minden esetben következett be, a
K PpUVpNOHWW OIJJ|WW )HOWpWHOH]pVHN V]HULQW OHJDOiEE NpW UpV]E OiOO D]N gén által biztosított védekezési mechanizmus: a vírus terjedésének visszaszorításából (ezt tudja áttörni a ToMV-Ob), és a nekrózis
NLDODNXOiViEyODPLWEiUPHO\LNWREDPRYtUXVIHUW zése aktivál (cf. Szilassy et al. 1999).
Az egyes paprikapatogén tobamovírusok patológiai megkülönböztetésének alapja a vad Capsicum IDMRN IHUW ]KHW VpJH pV
ellenállóképessége. Az ellenállóképességet a Capsicum fajokban öt, azonos
OyNXV]RQ OpY GRPLQiQVDQ |U|NO G D IHUW ]pVW QHP WHOMHVHQ LQNRPSOHWW
módon) lokalizáló L gén (L+, L1, L2, L3, L4) biztosítja. Ezzel szemben a vírusnak 4 patotípusa létezik (P0, P1, P1,2, P1,2,3). A 2. táblázat azt mutatja be, hogy a paprika-vírus kapcsolat mikor inkompatibilis, és mikor kompatibilis. Abban az esetben, ha az L+ rezisztenciafokú paprikát
EiUPHO\LN SDWRWtSXVVDO IHUW ]]N D] IRJpNRQ\ JD]GD-parazita kapcsolatot eredményez. Az L1 rezisztenciagén viszont rezisztenciát biztosít a P0
patotípussal szemben, az L2 a P0 és a P1 patotípussal szemben, stb.
2. WiEOi]DW$NO|QE|] UH]LV]WHQFLDIRN~SDSULNDIDMWiNpVD
NO|QE|] SDWRWtSXV~WREDPRYtUXVRN kapcsolata (Rast 1979, 1988, Boukema et al. 1980, Tóbiás et al. 1982 és Boukema 1984 alapján)
Patotípus P0
(TMV, ToMV, TMGMV)
P1 (TMGMV, PaMMV
P1,2 (ObPV, PMMoV)
P1,2,3 (PMMoV)
L+ S S S S
L1 R S S S
L2 R R S S
L3 R R R S
Rezisztenciagén
L4 R R R R
S = susceptibility (fogékonyság), R = resistance (rezisztencia)
De la Cruz et al. (1997) az L2 gén által biztosított rezisztencia mechanizmusát tanulmányozták. Ennek érdekében kimérákat készítettek az L2 gén által biztosított rezisztenciát iWW|U 300R9-S (P1,2) és a
UH]LV]WHQFLiWiWW|UQLQHPNpSHVI V]HUSDSULNDHQ\KHWDUNXOiVYtUXVPaprika mild mottle virus, PaMMV) (P1 JHQRPMiQDN IHOKDV]QiOiViYDO $] HOV
hibrid (THG1) 5’ vége a PMMoV-6 JHQRPMiQDN HOV UpV]pE O ¶YpJH
pedig a PaMMV [30 kilodalton (kD) fehérjét kódoló rész C vége + CP + 3’nemkódoló régió] JHQRPMiQDN PiVRGLN IHOpE O V]iUPD]RWW $ gazdanövényeken a hibrid a PMMoV-S-hez hasonló tüneteket okozott. Az L2 UH]LV]WHQFLDIRN~ ¶7DEDVFR¶ SDSULNiQ YLV]RQW D IHOV QHP LQRNXOiOW
levelekben sem a hibrid, sem a PaMMV nem volt kimutatható (a PaMMV-
UH MHOOHP] KRJ\ QHP V]LV]WHPL]iOyGLN D] /2
rezisztenciagént hordozó
SDSULNiEDQ 0LQGH]HN DUUD XWDOWDN KRJ\ D UH]LV]WHQFLipUW IHOHO V UpV] D]
utolsó 1000 nukleotidban helyezkedett el. Ezt követ HQ PHJDONRWWiN D
THG2 hibridet, amely kizárólag a CP-t tartalmazta a PaMMV-E O pV D
THG1-hez hasonlóan viselkedett. Egy újabb hibridet készítettek (THG3), aminek CP génjében frameshift (kereteltolásos) mutációt indukáltak, hogy
HOG|QWKHW OHJ\HQDUH]LV]WHQFLipUWIHOHO VUpV]PDJiEDQD&3-ben vagy az RNS-ben található-e. Ez a nem a teljes CP-W WHUPHO KLEULG QHP LQGXNiOW KLSHUV]HQ]LWtY UHDNFLyW +5 D IHUW ]|WW Q|YpQ\HNHQ (] D]W MHOHQWL KRJ\
PDJDD&3IHOHO VD+5NLYiOWiVipUWQHPD]516$7+*NLPpUa, mely csonka CP-W NyGROW NpSHV YROW V]LV]WHPLNXVDQ IHUW ]QL D] /2 UH]LV]WHQFLDJpQW WDUWDOPD]y SDSULNiW pV H]]HO NL]iUWD DQQDN OHKHW VpJpW
hogy az RNS molekula aktív szerepet játszana a HR indukálásában. A THG3 L2 UH]LV]WHQFLD iWW|U WXODMGRQViJD D]W Ls bizonyítja, hogy a rezisztenciához egy vírus által kódolt fehérje termelése szükséges. Az L2
UH]LV]WHQFLD iWW|UpVH QHP HJ\ PiU PHJOpY Q|YpQ\L YpGHNH]pVL
mechanizmus elnyomásának eredménye.
Berzal-Herranz et al. (1995) szerint az L3 gén által biztosított rezisztencia gén-Gy]LV IJJ QHN W QLN $ KHWHUR]LJyWD Q|YpQ\HNEHQ pV
bizonyos körülmények között – D KRPR]LJyWiNQiO WDSDV]WDOKDWy WQHWHNW O HOWpU HQ- pUPHQWL pV DSLNiOLV QHNUy]LV IHMO G|WW D 300R9-, IHUW ]pVpUH
Mint ismeretes, a P1,2 patotípusú PMMoV-S HR-t indukál az L3 rezisztenciagént tartalmazó paprikákon, míg a P1,2,3 patotípusú PMMoV-I áttörve ezt a rezisztenciát, szisztemikus tüneteket okoz. A PMMoV-S és a PMMoV-, NOyQRNEyO NO|QE|] KLEULG YtUXVW NpV]tWHWWHN $] HOV NOyQ
(THI-1) 5’ vége PMMoV-S, 3’ vége PMMoV-I szekvenciát tartalmazott. A
NOyQQDOIHUW ]|WWSDSULNDQ|YpQ\HNHQV]LV]WHPLNXVWDUNXOiVMHOHQWPHJDPL DUUD XWDOW KRJ\ D . JpQW O ¶ LUiQ\EDQ WDOiOKDWy D UH]LV]WHQFLD
iWW|UpVppUW IHOHO V UpV] (]XWiQ RO\DQ NOyQRNDW NpV]tWHWWHN PHOyek egyre kisebb szakaszokat tartalmaztak a PMMoV-I-E O (]HN VHJtWVpJpYHO PHJiOODStWRWWiN KRJ\ D UH]LV]WHQFLD iWW|UpVppUW IHOHO V UpV] D] XWROVy
nukleotidban helyezkedik el. A kérdéses régióban 6 különbség van a PMMoV-S és a PMMoV-I nukleotid sorrendjében, ez 2 aminosav különbségben jelentkezik. A 138. helyen található metionin (Met) –
DV]SDUDJLQ $VQ D] HJ\HWOHQ QHP NRQ]HUYDWtY FVHUH (] D NLHPHONHG MHOHQW VpJ DPLQRVDY D &3 WpUV]HUNH]HWpW WHNLQWYH NLWHWW KHO\HQ HJ\ EpWD
UHG Q DOID KpOL[KH] NDSFVROyGYD KHO\H]NHGLN HO (ONpS]HOKHW KRJ\ H]
az aminosav közvetlen szerepet játszik a gazdanövény rezisztencia faktorával való kapcsolatban. Újabb klónok készítésével megállapították, hogy egyetlen aminosavcserével a PMMoV-I már nem tudta áttörni a rezisztenciát. Az L3 gén által biztosított rezisztencia áttöréséért, a HR
NLDODNXOiVipUWD&3pVQHPD]516YROWIHOHO V
Culver et al. a tobamovírusok CP-jében egy „elicitor régiót”
azonosítottak (Culver és Dawson 1991, Culver et al. 1991). Az N gént tartalmazó dohánynövénybe jutott TMV CP-MpEHQ W|UWpQ
aminosavváltozások ebben az „elicitor régió”-ban indukáltak rezisztenciaválaszokat. Újabb munkájukban Culver et al. (1994) kimutatták, hogy a jelenség magyarázata a TMV CP szerkezet
IHOERPOiViEDQNHUHVHQG H]Wa folyamatot képes felismerni a gazdanövény.
A Berzal-Herranz et al. (1995) által leírt aminosavcsere is ebben az
„elicitor régió”-ban található. A PMMoV-I CP-jében tehát egyetlen aminosav cseréje is (Asn-0HW D KHO\HQ HOHJHQG QHN EL]RQ\XOW D +5
indukiOiViKR]pVDYtUXVIHUW ]pVORNDOL]iOiViKR]DCapsicum chinense (L3) növényekben. Hasonló eredményre jutottak japán kutatók (Tsuda et al.
DNLN SRQWPXWiFLyW WDUWDOPD]y PXWiQVRNDW iOOtWRWWDN HO $ KHO\HQOpY DPLQRVDYFVHUpMHPHOOHWWHJ\PiVLNOHKHW VpJHWLVIHOYi]ROWDND UH]LV]WHQFLD iWW|UpVpUH H] SHGLJ HJ\ NHWW V PXWiFLy D pV D]
DPLQRVDY KHO\HQ $] HOV YiOWR]DWUD WHUPpV]HWHV SpOGD D 300R9-I
L]ROiWXP PtJ D PiVRGLN OHKHW VpJ D 300R9-Ij izolátum példájával bizonyítható. Mindkét izolátumot az L3 UH]LV]WHQFLiW iWW|U WHUPpV]HWHV
mutációnak tartják.
2.3.3. A tobamovírusok csoportosítása
A tobamovírusokat tekintélyes létszámuk miatt igen nehéz rendszerbe foglalni. Legelterjedtebbek a gazdanövénykör alapján felállított csoportosítások.
Van Regenmortel D N|YHWNH] NpSSHQ FVRSRUWRVtWRWWD D
tobamovírus törzseket:
TMV-közönséges törzs ToMV törzsek
ÒWLI W|U]VHN
Hüvelyes törzsek Kabakos törzsek Orchidea törzsek U2 törzs
Egyéb törzsek, melyek között az Argentínában izolált „pepper unusual strain” (Feldman és Oremianer 1972) is szerepelt.
Tóbiás et al. (1982) több tobamovírus izolátumot megvizsgálva 3
FVRSRUWRW iOOtWRWWDN IHO $ V]HUROyJLDL pV D WHV]WQ|YpQ\YL]VJiODWRN HOWpU
csoportosítást eredményeztek. A Capsicum WHV]WQ|YpQ\HNHQ IHMO G|WW
tünetek értékelése alapján az 1. csoportba a WU1, A1, FOizolátumok, a 2.
csoportba a P14, SL izolátumok, a 3. csoportba a P8, P11, Ob izolátumok
WDUWR]WDN$V]HUROyJLDLYL]VJiODWRNDODSMiQD]L]ROiWXPRNDN|YHWNH] NpSS
voltak csoportosíthatóak: 1. csoport: WU1 izolátum, 2/a. csoport: A1, FO izolátumok, 2/b. csoport: P14, SL, P8 izolátumok, 3. csoport: P11, Ob izolátumok.
Feldman és Oremianer (1972) az alábbi rendszerbe foglalták a tobamovírusokat:
Keresztesvirágú törzsek
Kabakos törzsek Hüvelyes törzsek Orchideafélék törzsei
ÒWLI W|U]VHN
Burgonyafélék törzsei Nicotiana glauca törzsek Paprika törzsek
Burgonya törzsek Dohány törzsek Paradicsom törzsek
Feldman és Oremianer (1972) felsorolták a listából kihagyott, egyéb TMV törzseket: batáta mozaik törzs (Elmer 1960, Still et al. 1960), kaktusz törzs (Sammons és Chessin 1961, Martin 1968), alma izolátumok (Kirpatrick és Lindner 1964, Gilmer és WilksUpSDOLODOHYHO VpJYtUXVCappor és SharmaV] O L]ROiWXPRNGilmer és Kelts 1965, 1968, Bercks 1967, 1968, Jankulova 1970), páfrány törzs (Faccioli 1966) Lychnis alba törzs (Chessin et al. 1967) Asparagus officinalis törzs (Faccioli és Paul 1967) Rhoeo discolor törzs (Thompson és Corbett 1970) Boerhaavia diffusa törzs (Khurana és Singh 1971), TMV törzsek t|OJ\U O pV UR]VUyO Yarwood és Hecht-Poinar 1970, Nienhaus 1971), valamint lisztharmat konídiumokból kivont TMV törzsek (Yarwood 1971a, 1971b, Nienhaus 1971).
Fukuda et al. (1980) szerint a tobamovírusok két nagy csoportba
VRUROKDWyDN D] HOV FVRSRUW WDJjai a kabakosokat vagy a hüvelyeseket
IHUW ]LN D] LGH WDUWR]y YtUXVRNEDQ D] |VV]HpSOpVpUW IHOHO V UpV] D &3-n
EHOOYDQ$PiVRGLNFVRSRUWEDWDUWR]yYtUXVRNQiOD]|VV]HpSOpVpUWIHOHO V
rész a mozgásfehérjén (movement protein, MP) belül található.
2.3.4. $] HJ\HV SDSULNiW IHUW ] WREDPRYtUXVRN UpV]OHWHVHEE
jellemzése
A Tobamovirus nemzetség (ICTV kód 00.071.0.01) tagjai merev, pálcika alakú, helikális szimmetriájú virionok. Méretük kb. 300×15-18 nm, molekulatömegük 2×106, a köpenyfehérjéjük molekulatömege 17-18×103. Izoelektromos pontjuk 3,16-4,64 pH; A260/280 arányuk 0,63-1,33;
K LQDNWLYiOiVL SRQWMXN -95 °C. A vírusok genomja pozitív, lineáris,
HJ\V]iO~ 516 $ QHP]HWVpJEH WDUWR]y YtUXVRN HU VHQ LPPXQRJpQHN $ IHUW ]|WW VHMWHNEHQ ]iUYiQ\RNDW KR]QDN Optre, melyek lehetnek kristályosak (a citoplazmában), szabálytalan alakúak vagy amorf X-testek. A legtöbb faj gazdanövényköre korlátozott, vektor nélkül, mechanikailag vagy oltással terjednek. (J\HGO D SDSULNiW QHP IHUW ] XERUND ]|OG IROWRVViJ PR]DLN
vírusról (Cucumber green mottle mosaic virus, CGMMV) ismert a rovarvektorral való terjedés. Egyes vírusfajok terjedésében fontos szerepe
YDQ D PDJJDO W|UWpQ YtUXViWYLWHOQHN $ WREDPRYtUXVRN D] HJpV] YLOiJRQ
elterjedtek. A nemzetségbe az ICTV nyilvántartása szerint 17 állandó és 2 feltételezett vírusfaj tartozik (a VIDE vírus adatbázis további 3 fajt is
LGHVRURO $ QHP]HWVpJ |VV]HV WDJMD V]HUROyJLDLODJ NO|QE|] PpUWpNEHQ
rokon. A tobamovírusokat újabban a Nidovirales rendbe sorolják (Pringle 1998, Van Regenmortel et al. 2000).
A nemzetség típustagja a dohány mozaik vírus (Tobacco mosaic virus, TMV, 00.071.0.01.001, génbank szekvencia: J02415, X68110, D63809, P0 patotípus), ami 5 % nukleinsavat és 95% fehérjét tartalmaz. A vírus szinonim nevei: TMV-U1, TMV típustörzs (TMV-type), TMV vulgáris törzs (TMV-vulgare), TMV közönséges törzs (TMV common strain). A TMV-W HO V]|UNicotiana tabacum-ról írták le, az Egyesült Államokban és Oroszországban (Mayer 1886, Iwanowski 1892).
0DJ\DURUV]iJUyO HO V]|ULinhart és Mezey jelentették (1890). A vírus
PHFKDQLNDLODJ pV PDJJDO iWYLKHW GH SROOHQQHO QHP *D]GDQ|YpQ\N|UH
LJHQ NLWHUMHGW IHUW ]L SO D SDSULNiW D SDUDGLFVRPRW D GRKiQ\W Tóbiás et al. 1978, Wetter et al.$709IHUW ]pVDSDSULNDOHYHOHLQHUHNN|]WL
mozaikfoltosságot, tarkulást, nekrotikus léziókat, levélhullást okozhat,
HO IRUGXO KRJ\ D OHYHOHN pV D WHUPpVHN NLVHEEHN D Q|YpQ\ J\HQJpEEHQ
IHMO GLN W|USO eU]pNHQ\HEE IDMWiNRQ QHNURWLNXV WHUPpVFVtNRVViJRW
szárnekrózist, és a virágok elsárgulását figyelhetjük meg. Világszerte elterjedt, több törzse ismert, így pl. a japán közönséges törzs (Japanese common strain); a maszkírozott M törzs (masked strain M); a TMV fehér mozaik törzs (TMV white mosaic strain), amelyet Johnson izolált 1928-ban Kentuckyban, és a sárga mozaik törzs (yellow mosaic strain, yellow mosaic type B), amit McKinney izolált 1929-ben a Kanári-szigeteken (McKinney 1929, Johnson 1930, Wetter 1984).
$ I V]HUSDSULND HQ\KH WDUNXOiV YtUXV(Paprika mild mottle virus, PaMMV, 00.071.0.01.006, X72586, patotípus P1) korábbi szinonim neve a TMV-3 YROW $ YtUXVW HO V]|U +ROODQGLiEyO tUWiN OHCapsicum annuum- ról, melyen enyhe mozaikot okozott (Rast 1979). ValóV]tQ OHJ PDJJDO LV
terjed, és elterjedt az eurázsiai régióban.
A paprika enyhe tarkulás vírus (Pepper mild mottle virus, PMMoV, 00.071.0.01.007) korábbi szinonim nevei voltak: a dohány mozaik vírus látens törzse (latent strain of tobacco mosaic virus); a dohány mozaik vírus Samsun látens törzse (Samsun latent strain of tobacco mosaic virus); paprika mozaik vírus (pepper mosaic virus), P8-as izolátum, P14-es izolátum, SL-TMV (McKinney 1952, Greenleaf et al. 1964). Pares (1985) a Capsicum mozaik nevet javasolta a vírus elnevezésére, ez azonban nem
NHUOWHOIRJDGiVUD(OV NpQWMcKinney izolálta 1952-ben, Dél-Karolinában, a TMV látens törzseként (McKinney 1952). McKinney NpV EE
megállapította, hogy a Samsun látens törzs rokona a TMV-U1-nek, de nem azonos vele. A rokonság bizonyítékait az alábbiakban határozta meg: 1.
szerológiai rokonság; 2. az UV spektrum görbe hasonlósága; 3. morfológiai hasonlóság; 4. a TMV teljesen képes blokkolni a nekrotikus lokális léziók
PHJMHOHQpVpW D OiWHQV W|U]]VHO W|UWpQ IHOOIHUW ]pV HVetén. A vírus pálcika alakú, kb. 312× QP D IHUW ]|WW Q|YpQ\ SUpVQHGYH -8
higításban) 10 perces, 95°C-RQ W|UWpQ KHYtWpV XWiQ YHV]WL HO D IHUW ] NpSHVVpJpW
(McKinney 1952, Wetter 1984). A paprikában a vírus számos zárványt formál a citoplazmában, amelyeket szöget bezáró UpWHJHNE O IHOpSO
csoportosulások alkotnak. A partikulumok ezen csoportok hosszanti tengelyére átlósan helyezkednek el. A vírus partikulumok sík rétegei a
N|YHWNH] UpWHJJHO NE IRNRV V]|JEHQ V]HPEHIRUGXOWDN $ 709 8-es törzsére jHOOHP] KH[DJRQiOLV NULVWiO\RN LV PHJMHOHQKHWQHN $ 300R9 PHFKDQLNDL ~WRQ N|QQ\HQ iWYLKHW PDJJDO LV WHUMHG LVPHUW URYDUYHNWRUD
nincs. Különösen üvegházakban és fóliasátrakban okoz nagy gazdasági
NiURNDW $ OHYpOHQ J\HQJH WQHWHN PR]DLN WDUNXOiV IHMO dnek, vagy tünetmentesek maradnak, a termésen klorotikus tarkulást, csökkent növekedést, ráncosodást, deformációt, esetenkéntnekrózist okoz. A Datura stramonium-on, a Nicotiana glutinosa-n, a Nicotiana plumbaginifolia-n és a Nicotiana tabacum cv. Xanthi-nc GRKiQ\RQ D 300R9 IHUW ]pV HVHWpQ NLVHEE ORNiOLV Op]LyN IHMO GQHN pV ODVVDEEDQ PLQW D 709 YDJ\ D 7R09 IHUW ]pVQpO$300R9QHPIHUW ]LDSDUDGLFVRPRW9DOyV]tQ OHJDWDODMD YtUXV OHJIRQWRVDEE PHJ U] MH (OWHUMHGW W|EEHN N|]W eV]DN-Amerikában, Ausztráliában, Ázsiában, Dániában, Izlandon, Angliában, Franciaországban, Görögországban, Olaszországban, Hollandiában és Spanyolországban (McKinney 1952, Greenleaf et al. 1964, Arteaga és Ortega 1981, Selassie et al. 1981, Nagai et al. 1981, Betti et al. 1982, Paludan 1982, Wetter et al. 1984, Pares 1985, Avgelis 1986, Tanzi et al.
1989, Lim et al. 1997, Tsuda et al. 1998). A vírus P1,2 vagy P1,2,3 patotípusú lehet.
A PMMoV spanyol izolátuma (PMMoV-S,
00.071.0.01.007.00.001.001, M81413) általában P1,2 -es patotípusú (Arteaga és Ortega 1981), de beszámoltak P1,2,3 patotípusú izolátumok
HO IRUGXOiViUyO LV Tenllado et al. 1997). A PMMoV-S-t 1980-ban írták le Spanyolországban (Arteaga és Ortega 1981), fóliás termesztésben, ahova
IHOWHKHW OHJ IHUW ]|WW PDJJDO MXWRWW EH 982-85 között Spanyolország
GpONHOHWL UpV]pQ $OPpULiEDQ D 300R9 RNR]WD D OHJQDJ\REE IHUW ]pVW D SDSULNiEDQDIHUW ]|WWVpJHW-100 %-ra becsülték (Alonso et al. 1989).
A dohány enyhe zöld mozaik vírus (Tobacco mild green mosaic virus, TMGMV, 00.071.0.01.011, M22483, patotípus P0 vagy P1) (Green és Kim 1991) szinonim nevei: zöld paradicsom atipikus mozaik vírus (green- tomato atypical mosaic virus); a TMV gyengetörzse (mild strain of TMV); para-dohány mozaik vírus (para-tobacco mosaic virus); a TMV dél- karolinai gyenge tarkulás törzse (TMV-South Carolina mild mottling strain); a TMV U2-es törzse (TMV strain U2); a TMV U5-ös törzse (TMV U5 törzs); paradicsom atipikus mozaikot és zöld tarkulást okozó törzs (tomato atypical mosaic green mottling strain) (Köhler és Panjan 1943, Johnson 1947, McKinney 1952, Siegel és Wildman 1954, Miller és Thornberry 1958, Knight et al. 1962, Wetter $ YtUXVW HOV NpQW
McKinney írta le a Kanári-szigeteken (McKinney 1929). $ONDORPV]HU HQ IRUGXOW HO D] (J\HVOW ÈOODPRNEDQ ps Olaszországban, Németországban dohányon találták meg (Wetter et al. 1984). Az 1990-es években
7DLZDQEDQ LV L]ROiOWiN IHOWHKHW HQ D] HJpV] YLOiJRQ HOWHUMHGW Green és Kim 1991). Általában nekrózist okoz a paprikákon. Bizonyos fajtákat szisztemikusan is fHUW ] DPL D Q|YpQ\HN SXV]WXOiViKR] YH]HW
Magátvitellel nem terjed.
A paradicsom mozaik vírust (Tomato mosaic virus, ToMV, 00.071.0.01.013, X02144, P0 SDWRWtSXV HO V]|U D] (J\HVOW ÈOODPRNEDQ
Lycopersicon esculentum-ról írták le (Clinton 1909), melyen mR]DLNIROWRVViJRW pVWpOHQOHYpONHVNHQ\HGpVWRNR]RWW +D]iQNEDQ HOV NpQW
Horváth és BecznerV]iPROWDNEHPHJMHOHQpVpU O$YtUXVPDJJDOLV WHUMHGKHW I NpQW NOV PDJiWYLWHOOHO 9DOyV]tQ OHJ D] HJpV] YLOiJRQ
elterjedt. Több törzse ismert, így pl. a paradicsom aukuba törzs (tomato aucuba strain), a paradicsom enációs tarkulás (tomato enation mottle) és a dahlemense törzs (dahlemense strain) (Hollings és Huttinga 1976). A ToMV a paprikán mozaikot, nekrotikus lokális léziókat, szárnekrózist, szisztemikus levélnekrózist, szisztemikus klorózist, levélhullást,
Q|YpQ\SXV]WXOiVW RNR]KDW 1DJ\ JD]GDViJL MHOHQW VpJJHO EtU D] (J\HVOW
Államokban, Franciaországban és Olaszországban (Wetter et al. 1984).
Csilléry et al. új tobamovírus törzset izoláltak paprikáról 1978-ban, Óbudán (Csilléry és Ruskó 1980, Csilléry et al. $ SDSULND IHOV
levelei sárgultak, vagy sárga foltosak voltak. A szerológiai és szimptomatológiai vizsgálatok alapján az új izolátumot a ToMV egy új törzseként (ToMV-Ob) azonosították. Az Ob s]LV]WHPLNXVDQIHUW ]WHD]/1 UH]LV]WHQFLDJpQW WDUWDOPD]y SDSULNiNDW (] YROW D] HOV RO\DQ WREDPRYtUXV
mely áttörte az L1 rezisztenciagént. A vírus által okozott tünetek a Nicotiana tabacum cv. Xanthi-nc-n és a Nicotiana glutinosa-n a
K PpUVpNOHWW OIJJ|ttek: 18-20°C-RQQHNURWLNXVORNiOLVOp]LyIHMO G|WW- 28°C-on illetve 30-32°C-RQ D] LQRNXOiOW OHYHOHNHQ ViUJD YDJ\ J\ U V]HU IROWRNMHOHQWHNPHJQHNUy]LVQHPIHMO G|WW$V]LV]WHPLNXVOHYHOHNHQV|WpW
sárga mozaik volt látható. A vírus szekvenciáját Ikeda et al. (1993), valamint Padgett és Beachy (1993) határozták meg, és Obuda pepper virus (ObPV) néven az ICTV által bejegyzésre került (00.071.0.01.018, L11665, D13438, patotípus P1,2).
Akadnak olyan, a tobamovírusok közé besorolt vírusok, melyeket az ICTV hivatalos nyilvántartásában nem ismer el önálló vírusfajként.
Ilyen például a harang alakú paprika tarkulás vírus (Bell pepper mottle virus, BpeMV) melyet Feldman és Oremianer izolálták Argentínában 1968-ban, harang alakú paprikáról (Capsicum annuum), mint egy addig ismeretlen TMV törzset (’TMV unusual strain’) (Feldman és Oremianer $ IHUW ]|WW HSLGHUPLV]EHQ H] D W|U]V QHP NpS]HWW ;- testeket, csak kevés hexagonális kristályt, és ritkán csoportos kristályokat.
$ YtUXVQDN HJ\ WRMiVJ\P|OFV|W IHUW ] törzsét (A1 törzs) Hollandiában izolálták (Rast 1985).
Salamon et al. (1987) a Solanum dulcamara-ról izoláltak egy vírust, amely a tobamovírus csoport addig ismeretlen tagjának bizonyult. A vírust csucsor sárga foltosság vírusnak nevezték el (Dulcamara yellow fleck virus, DYFV), majd 1993-ban Sanfaçon et al. Solanum dulcamara yellow fleck Ob-ra nevezték át. A természetes flórában végzett vizsgálatok megállapították, hogy a Solanum dulcamara közönséges, gazdájához nagymértékben adaptálódott vírusáról van szó, mely a Tisza magyarországi
IHOV V]DNDV]iQ J\ MW|WW YDJ\ RWW IHUW ] G|WW pV YLUROyJLDLODJ QHP
HOOHQ U]|WWSolanum dulcamara növényekkel kerülhetett az ország más területeire (Budakalász, Vácrátót). A vírus a paradicsomot szisztemikusan
IHUW ]WH DNiUFsak a Solanum dulcamara-t. Az L1 rezisztenciafokú paprikákon szisztemikus tüneteket okozott, melyek olyan súlyosak voltak, hogy gyakran a növény pusztulásához vezettek (Green és Kim 1991, Salamon és Kaszta 2000). A DYFV két mutánsát (LB és XII) egy korábban ToMV-Ob-YDO MHO]HWW SDSULNiUyO V]iUPD]y WREDPRYtUXV NRPSOH[E O L]ROiOWiN (J\ NpV EEL PXQNiMiEDQSalamon arról számolt be (Salamon
KRJ\ D '<)9 HJ\LN L]ROiWXPD ;0 YDOyV]tQ OHJ N|]HO D]RQRV D
korábban ToMV-2E W|U]VNpQW PHJKDWiUR]RWW 2E MHO]pV WRbamovírussal,
PHO\ IHOWHKHW HQ D '<)9-Sd spontán mutánsa. Egy nemrég megjelent munkájában pedig Salamon és KasztaPiVV]HU] NNHOHOOHQWpWEHQD
DYFV-t P1 patotípusúnak határozta meg, mivel az az L2 paprikákat
ORNiOLVDQ IHUW ]WH 8J\DQLWW D '<)9-nek V]iPRV W|U]VpU O V]iPROW EH pV
ide sorolta az Ob törzset is.
Marthur et al. (1966) CPO törzs néven írták le a TMV egyik törzsét.
(]DW|U]VFKLOLSDSULNiQIRUGXOWHO ,QGLiEDQJ\HQJHPR]DLNRWRNR]YD
Igwegbe D709 OHYpOKXOOiVW HO LGp] GHIROLDWLon) törzsének
PHJMHOHQpVpU O V]iPROW EH DPHO\HW 1LJpULiEDQ L]ROiOWDN SDSULNiUyO - ben a paprikanövényeken komoly satnyulást, levél tarkulást, csökkent
WHUPpVW pV WHUPpVN|W GpVW ILJ\HOWHN PHJ 7RYiEEL YL]VJiODWRN V]HULQW
(Igwegbe és Ogungbade 1985) a szisztemikus tünetek a mozaiktól,
WDUNXOiVWyODQ|YpQ\SXV]WXOiViLJWHUMHGWHNÈOWDOiEDQD]LG VHEEQ|YpQ\HN MREEDQ W~OpOWpN D IHUW ]pVW PLQW D ILDWDODEEDN - QDSSDO D IHUW ]pV XWiQ
nekrotikus lokális léziók jelentek meg, amit 3- QDSSDO D IHUW ]pV XWiQ OHYpOKXOOiVN|YHWHWW$N|YHWNH] V]LV]WHPLNXVWQHWHNIRUGXOWDNPpJHO D W~OpO SDSULNiNRQ QHNURWLNXV IROWRN FV~FVV]iUDGiV pUQHNUy]LV FVtNRN
zöld érkivilágosodás, általános klorózis, érsárgulás, ráncok, érközti klorózis, levélnekrózis, levéldeformáció, rügybarnulás, koncentrikus
QHNURWLNXV IROWRN VDWQ\XOiV YLUiJHOU~JiV ERV]RUNiQ\VHSU V|GpV
terméshullás. 65 tesztelt paprikafajtából 8 rezisztensnek, 41 mérsékelten rezisztensnek, és 16 nagyon fogékonynak bizonyult (Igwegbe és Ogungbade 1985).
Alexandre et al. (2000) Brazíliában TMV-p néven egy új
WREDPRYtUXVW|U]VHWtUWDNOHPHO\DSHW~QLiWIHUW ]WH(]DW|U]VDSHW~QLiQ ViUJD PR]DLNRW RNR]RWW pV YHOH V]HPEHQ D YL]VJiOW WHV]WQ|YpQ\E O
fogékonynak bizonyult, köztük a Solanaceae család tagjai. Az elektronmikroszkópos vizsgálatok során úgy tapasztalták, hogy a vírus
partikulumok 295-305 nm hosszúak, a virionok az epidermisz, a mezofillum és a parenchima sejtekben kristályréteget vagy tömeget, helyenként X-testeket alkottak. A partikulumok a mitokondriális mátrixban
LVPHJMHOHQKHWWHNH]DYtUXVUDMHOOHP] HJ\HGLWXODMGRQViJ$709-p és a
709 N|]W QDJ\REE PpUWpN V]HUROyJLDL URNRQViJRW PXWDWWDN NL PLQW D
TMV-p és ToMV között (az SDI érték TMV-p és TMV közt 0,5; TMV-p és ToMV közt 1,0). A TMV-p köpenyfehérjéjének aminosav szekvenciájában 4 különbséget találtak a TMV-hez viszonyítva (95%-os hasonlóság). A ToMV-vel 75,5%-os volt a hasonlóság.
$ WiEOi]DW D] ,&79 iOWDO MHJ\]HWW D SDSULNiW IHUW ] WREDPRYtUXVRN NO|QE|] WHV]WQ|YpQ\HNHQ RNR]RWW WQHteit foglalja össze irodalmi adatok alapján.
3. táblázat. Paprikapatogén tobamovírusok által a gazdanövényeken okozott tünetek (Tóbiás et al. 1982, Tóbiás és Csilléry 1983, Csilléry és Ruskó 1980, Csilléry et al. 1983, Wetter et al. 1984, Avgelis 1986, Alonso et al. 1989, Green és Kim 1991 alapján)
Vírusok
Gazdanövény TMV-U1 ToMV (D/H)
ObPV TMGMV PMMoV PaMMV
Capsicum annuum L+
-/N, Mo * l/s
-/N, Mo
* -/Mo -/Mo
C. annuum L1 NtL, Ab/-
NtL, Ab/- L/Mo -/Mo -/Mo -/Mo
C. frutescens Tabasco L2
NtL, Ab/-
NtL, Ab/- NtL, Ab/N * CLN, Ab/Mo NtL,Ab/-
C. chinense Miscucho L3
NtL, Ab/-
NtL, Ab/- NtL, Ab/- l/-
* CLN, Ab/Mo NtL,Ab/-
Chenopodium amaranticolor
NtL/- CL
NtL/Mot CL/Mo
NtL/- CL CL
NtL/-
NtL/-
Chenopodium quinoa
NtL/- CL
NtL/- CL/Mo
L/- CL CL
NtL/-
NtL/-




![7. ábra. A KD-141 PMMoV L]ROiWXPIHUW ]pVpWN|YHW HQNEKpW](https://thumb-eu.123doks.com/thumbv2/9dokorg/866749.46652/78.918.286.674.531.779/ábra-a-kd-pmmov-roiwxpihuw-pvpwn-yhw-hqnekpw.webp)
![10. ábra. A KD- 300R9L]ROiWXPPDOIHUW ]|WW Nicotiana tabacum cv. Samsun növények tünetmentesek (balra), a Nicotiana tabacum cv](https://thumb-eu.123doks.com/thumbv2/9dokorg/866749.46652/79.918.256.638.109.367/roiwxppdoihuw-nicotiana-tabacum-samsun-növények-tünetmentesek-nicotiana-tabacum.webp)