DOKTORI (Ph. D.) ÉRTEKEZÉS
CSEH ESZTER
PANNON EGYETEM GEORGIKON KAR
KESZTHELY
2012
Doktori (Ph. D.) értekezés
Szılıvírusok elıfordulása Magyarországon, valamint a hazai Grapevine leafroll- associated virus 1 és 3 izolátumok molekuláris vizsgálata
Cseh Eszter Okleveles növényorvos
Növénytermesztési és Kertészeti Tudományok Doktori Iskola Pannon Egyetem
Georgikon Kar
Témavezetık
Dr. Gáborjányi Richard professor emeritus
Dr. Takács András Péter egyetemi docens
Keszthely
2012
SZİLİVÍRUSOK ELİFORDULÁSA MAGYARORSZÁGON, VALAMINT A HAZAI GRAPEVINE LEAFROLL- ASSOCIATED VIRUS 1 ÉS 3 IZOLÁTUMOK
MOLEKULÁRIS VIZSGÁLATA
Értekezés doktori (Ph. D.) fokozat elnyerése érdekében
Írta:
Cseh Eszter
Készült a Pannon Egyetem Növénytermesztési és Kertészeti Tudományok Doktori Iskolája keretében
Témavezetık:
Dr. Gáborjányi Richard
Elfogadásra javaslom (igen / nem)
Dr Takács András Péter
Elfogadásra javaslom (igen / nem)
A jelölt a doktori szigorlaton ...%-ot ért el, Az értekezést bírálóként elfogadásra javaslom:
Bíráló neve: …... …... igen /nem
……….
Bíráló neve: …... …... igen /nem
……….
A jelölt az értekezés nyilvános vitáján …...%-ot ért el.
Keszthely, ……….
a Bíráló Bizottság elnöke
A doktori (PhD) oklevél minısítése…...
………
Az EDHT elnöke
Tartalomjegyzék
Rövidítések... 6
Kivonat ... 8
Abstract ... 10
Zusammenfassung ... 12
1. Bevezetés és célkitőzés ... 14
2. Irodalmi áttekintés... 16
2.1. A magyarországi szılıvirológiai kutatások történeti áttekintése... 16
2.2. A Magyarországon elıforduló szılı vírusbetegségek és kórokozóinak áttekintése... 17
2.2.1. Szılı korai vírusos leromlás ... 18
2.2.1.1. Grapevine fanleaf virus - Szılı fertızı leromlás vírus (GFLV) ... 19
2.2.1.2. Arabis mosaic virus - Arabis mozaik vírus (ArMV)... 20
2.2.1.3. Grapevine chrome mosaic virus - Szılı krómmozaik vírus (GCMV) ... 21
2.2.1.4. Tomato black ring virus - Paradicsom fekete győrős vírus (TBRV) ... 21
2.2.1.5. Grapevine Bulgarian latent virus - Szılı bolgár látens vírus (GBLV) ... 21
2.2.2. Levélsodródás tünetcsoport... 22
2.2.2.1. Grapevine leafroll-associated virus 1 - Szılı levélsodródás vírus-1 (GLRaV-1)... 24
2.2.2.2. Grapevine leafroll-associated virus 2 - Szılı levélsodródás vírus-2 (GLRaV-2)... 25
2.2.2.3. Grapevine leafroll-associated virus 3 - Szılı levélsodródás vírus-3 (GLRaV-3)... 26
2.2.2.4. Grapevine leafroll-associated virus 4, 5, 6, 7 - Szılı levélsodródás vírus -4, -5, -6,-7 (GLRaV-4, -5, -6; -7) ... 27
2.2.2.5. A 70 kDa nagyságú hısokk fehérje homológ (HSP70h) jellemzése ... 27
2.2.3. Látens foltosság... 28
2.2.3.1. Grapevine fleck virus - Szılı foltosodás vírus (GFkV) ... 28
2.2.4. Szılı faszöveti barázdáltság ... 29
2.2.4.1. Rupestris stem pitting-associated virus - Rupestris faszöveti barázdáltság vírus (RSPaV) ... 30
2.2.4.2. Grapevine virus A - Szılı A vírus (GVA) ... 30
2.2.4.3. Grapevine virus B - Szılı B vírus (GVB) ... 31
2.2.5. Szılı vonalas és győrős mintázottság ... 32
2.2.5.1. Alfalfa mosaic virus - Lucerna mozaik virus (AMV) ... 32
2.2.6. Szılı vonalas mintázottság ... 33
2.2.6.1. Grapevine line pattern virus - Szılı vonalas mintázottság vírus (GLPV) ... 33
2.2.7. Vírusszerő betegségek, még pontosan nem azonosított kórokozók ... 34
2.2.7.1. Szılı enáció ... 34
2.2.7.2. Szılı érnekrózis ... 34
2.2.7.3. Szılı érmenti mozaik... 34
2.3. A vírusrezisztencia kialakításának lehetıségei a Vitis fajokban ... 35
3. Anyagok és módszerek... 38
3.1. A mintavételezés és a lágyszárú bioteszt módszertana ... 38
3.1.1. Növényi minta győjtése... 38
3.1.2. Lágyszárú bioteszt... 39
3.2. Szerológiai módszer ... 39
3.3. Molekuláris módszerek ... 40
3.3.1. Össznukleinsav kivonás ... 41
3.3.2. Polimeráz láncreakció ... 41
3.3.3. Gélelektroforézis ... 43
3.3.4. A PCR termék izolálása gélbıl ... 43
3.3.5. Ligálás és transzformálás ... 43
3.3.6. A plazmid tisztítása és az inzert ellenırzése ... 44
3.3.7. A vírusgenomról készült cDNS nukleotid szekvenciájának meghatározása ... 45
3.3.8. A nukleotid és aminosav szekvenciák vizsgálata... 45
3.3.9. Statisztikai analízis ... 45
3.4. Közönséges farkasalma (Aristolochia clematitis L.) levélminta vizsgálata... 45
4. Eredmények... 47
4.1. Mintavételezés és lágyszárú bioteszt eredményei ... 47
4.1.1. Tünettani vizsgálat eredményei... 47
4.1.2. Lágyszárú bioteszt eredménye ... 53
4.2. Szerológiai vizsgálatok eredményei ... 54
4.3. Molekuláris vizsgálat eredményei... 60
4.4. A közönséges farkasalma (Aristolochia clematitis L.) levélminta vizsgálatának eredménye ... 70
5. Következtetések, javaslatok ... 73
6. Összefoglalás... 78
7. Új tudományos eredmények... 81
8. New results ... 82
9. Irodalomjegyzék... 83
10. Köszönetnyilvánítás ... 95
11. Publikációk, elıadások... 96
12. Melléklet... 99
Rövidítések
AMV: Alfalfa mosaic virus – Lucerna mozaik vírus ArMV: Arabis mosaic virus - Arabis mozaik vírus Bp: basepair- bázispár
CLRV: Cherry leafroll virus - Cseresznye levélsodródás vírus CP: coat protein - köpenyfehérje
CPm1: minor coat protein 1. copy - a köpenyfehérje kisebb molekulatömegő 1. másolata CPm2: minor coat protein 2. copy - a köpenyfehérje kisebb molekulatömegő 2. másolata DAS-ELISA: Double Antibody Sandwitch Enzime Linked Immunosorbent Assay - Kettıs
ellenanyag szendvics – enzimhez kötött immunválasz eljárás EDTA: Ethylenediaminetetraacetic-acid – Etilén-diamin-tetraecetsav GBLV: Grapevine bulgarian latent virus - Szılı bulgáriai látens vírus GCMV: Grapevine chrome mosaic virus - Szılı króm mozaik vírus GFkV: Grapevine fleck virus - Szılı foltosodás vírus
GFLV: Grapevine fanleaf virus - Szılı fertızı leromlás vírus
GLPV: Grapevine line pattern virus - Szılı vonalas mintázottság vírus
GLRaV 1, 2, 3, 4, 5, 7: Grapevine leafroll-associated virus 1, 2, 3, 4, 5, 7 - Szılı levélsodródás vírusok 1,-2,-3,-4,-5,-7 csoportjai
GRSPaV: Grapevine rupestris stem pitting associated virus – Szılı rupestris faszöveti barázdáltság vírus
GYSVd-1: Grapevine yellow speckle viroid-1 - Szılı sárga foltosság viroid-1 GVB: Grapevine virus B - Szılı B vírus
GVA: Grapevine virus A - Szılı A vírus GVC: Grapevine virus C – Szılı C vírus HEL: helicase - helikáz enzim
HP: Homing protein - önvezérlı fehérje
HSP70h: 70 kDa heat shock homologue protein - 70 kDa hısokk fehérje homológ HSP90h: 90 kDa heat shock homologue protein - 90 kDa hısokk fehérje homológ IPTG: isopropyl- beta- D- thio- galactoside – izopropil- beta- D- tio- galaktozid Kb: kilobase - kilobázis
LB: Luria- Bertani medium – Luria- Bertani táptalaj MET: methyltransferase - metiltranszferáz enzim
M-MuLV: Moloney Murine Leukemia Virus reverse transcriptase - Moloney Murine Leukemia Virus reverz transzkriptáz enzim
NaOH: Sodium- hydroxide – Nátrium hidroxid ORF: Open reading frame – Nyílt leolvasási szakasz P30: P30 like protein - p30 szerő fehérje
PEG: polyethylene glycol - polietilén-glikol
P-PRO: papain like protease - papain szerő proteolitikus fehérje RBDV: Raspberry bushy dwarf virus - Málna bokros törpülés vírus
RdRp: RNA dependent RNA polymerase - RNS függı RNS polimeráz enzim RpRSV: Raspberry ringspot virus - Málna győrősfoltosság vírus
RSPaV-1: Rupestris stem pitting-associated virus 1 - Szılı faszöveti barázdáltság vírus RT-PCR: reverse transcription - polymerase chain reaction – reverz transzkripciós
polimerizáción alapuló láncreakció
SDS: sodium- dodecil- sulphate – nátrium- dodecil- szulfát sgRNS: szubgenomi RNS
SLRSV: Strawberry latent ringspot virus - Szamóca látens győrősfoltosság vírus TBE: Tris- borate- EDTA buffer – Tris-borát- EDTA puffer
TBRV: Tomato blackring virus - Paradicsom fekete győrős vírus
TEM: transmission electron microscopy - transzmissziós elektron-mikroszkópia TGB: triple gene block - hármas génblokk
TRIS: Tris-hydroxymethyl-aminomethane – Tris- hidroximetil- aminometán
TRIS-HCl: Tris-hydroxymethyl-aminomethane hidrochlorid – Trisz- amino metán- hidroklorid
TRSV: Tobacco ringspot virus - Dohány győrősfoltosság vírus TSWV: Tomato spotted wilt virus - Paradicsom bronzfoltosság vírus ToRSV: Tomato ringspot virus - Paradicsom győrősfoltosság vírus
X-Gal: 5-bromo- 4 chloro- 3- indolyly- beta- D- galactoside – 5-bromo- 4 kloro- 3 indolil- beta- D- galaktozid
VPg: virus genome linked protein - vírus genomhoz kötött fehérje
Kivonat
Szılıvírusok elıfordulása Magyarországon, valamint a hazai Grapevine leafroll- associated virus 1 és 3 izolátumok molekuláris vizsgálata
A disszertáció a Magyarországon eddig leírt szılıvírusok molekuláris vizsgálati eredmények alapján történı új rendszerezésének bemutatásával, a hazánkban elıforduló vírusok termıültetvényekben való elterjedésének vizsgálatával, valamint egy szılı levélsodródás 1 vírus (Grapevine leafroll-associated virus 1, GLRaV-1) és négy szılı levélsodródás 3 vírus (Grapevine leafroll-associated virus 3, GLRaV-3) hazai izolátum 70 kDa nagyságú hısokk fehérje homológ (HSP70) gén szakaszának molekuláris jellemzésével, aminosav sorrendjének meghatározásával és külföldi izolátumok genetikai összehasonlításával foglalkozik.
A 2007. és 2010. között 17 borvidék 31 termıültetvényét érintı virológiai vizsgálata során a szimptomatológailag fertızöttnek ítélt tıkékrıl 277 levélminta begyőjtésére, majd DAS-ELISA módszerrel vírusok kimutatására került sor. Megállapítást nyert, hogy a szerológia vizsgálat sokkal kevesebb, 76 mintában adott a vizsgált vírusok közül kilencre pozitív eredményt, mint az a tapasztalt tünetek alapján feltételezhetı volt. A korábban jelentısnek tartott nepovírusok, elsısorban szılı fertızı leromlás vírus (Grapevine fanleaf virus, GFLV), arabis mozaik vírus (Arabis mosaic virus, ArMV), paradicsom fekete győrős vírus (Tomato black ring virus, TBRV), szılı króm mozaik vírus (Grapevine chrome mosaic virus, GCMV) egyenként kisebb arányban voltak jelen, de együtt hasonló arányt képviseltek, mint a szılı levélsodródás 1, 2 és 3 (Grapevine leafroll associated virus 1, 2, 3, GLRaV 1, 2, 3) szerológiai csoportok. Továbbá nagyarányú fertızöttség volt tapasztalható szılı foltosodás vírus (Grapevine fleck virus, GFkV) esetében. Jelenléte az eredmények alapján az ország észak-keleti részén és Közép- illetve Nyugat Dunántúlon volt kimutatható elsısorban.
Tizennégy minta esetében két-két vírus együttes jelenléte igazolódott. A vizsgálat eredményeibıl feltételezhetı, hogy más kórokozók pl. fitoplazma, vagy anyagcserezavarok, esetleg tápanyaghiány is szerepet játszhat a vírusfertızésre hasonlító tünetek kialakulásában.
A munka további részében molekuláris (RT-PCR) vizsgálat tárgyát képezte egy GLRaV-1, és négy GLRaV-3 hazai izolátum. A vizsgálathoz használt, a HSP70-es génszakasz 500 bp hosszúságú szekvenciájának kimutatására alkalmas primerek tervezésének
alapjai GLRaV-1 esetében az AF195822 génbanki számú szekvencia, a GLRaV-3 esetében pedig az AF037268 nyilvántartási számú NY1 izolátum szekvencia voltak.
Az így nyert szekvenciák génbanki adatok alapján összevetésre kerültek külföldi izolátumokkal. Az elkészített dendrogrammokból látható, hogy a korábban GLRaV3 esetében öt csoportra osztott izolátumok közé beilleszthetık a magyarországi izolátumok. A 3.5, a 2.2 és a 4.2-es izolátumok a 2. számú csoportba, a 1.4-es izolátum a 4. számú csoportba tartoznak.
A 6.4.1-es GLRaV-1 izolátum a dendrogram szerint az „E” jelzéső csoportba tartozik. Az izolátumok szekvencia adatai HE794021-HE794025 nyilvántartási számokkal elsıként kerültek be a Génbankba a magyarországi szılı levélsodródás vírus izolátumok közül.
Abstract
Occurrence of grapevine viruses in Hungary and molecular studies of some Hungarian Grapevine leafroll- associated virus 1 and 3 isolates
The task of this work was to survey the occurrence of grapevine viruses in Hungarian vineyards, its classification on recent molecular base. Further aim was the characterization and sequencing the HSP70h gene of one Grapevine leafroll- associated virus 1 (GLRaV-1) and three Grapevine leafroll- associated virus 3 (GLRaV-3) isolates and their comparison with other isolates, found in gene bank of National Centre for Biotechnology Information (NCBI).
The first aim of the present study was the examination of frequency of virus infection in thirty one Hungarian vineyards. Symptoms bearing leaf samples were collected from seventeen wine growing regions from 2007. to 2010. Among 277 samples, seventy- six gave positive results in the serological tests. These numbers were much lower, than it might be supposed on the basis of symptoms. Among the Nepovirus group four viruses could be detected, but the occurrence of Grapevine fanleaf virus, Arabis mosaic virus, Tomato black ring virus and Grapevine chrome mosaic virus were not so frequent, than it was thought earlier. The ratio of the Grapevine leafroll- associated virus 1, -2 and -3 was similar, as in case of Nepoviruses.
High infection of Grapevine fleck virus was detected. This virus was mostly present in the North-East part of Hungary and in the Middle-West part of Transdanubian region. Complex infections were found in fifteen samples. These results indicate that other pathogens can also induce similar symptoms, like phytoplasmas, other viruses or deficient of nutrition and disorders of plant metabolism.
The second aim was to characterize one GLRaV-1 and three GLRaV-3 isolates from the earlier collected and serological positive samples by molecular ways. Five hundred bp fragments were encompassed and purified in case of both viruses 70 kDa heat shock homologue protein (HSP70h) genes. The primer pairs were designed on the bases of nucleic sequence of isolate GLRaV-3 NY1 (Gene Bank accession number AF037268) and GLRaV-1 according the Gene Bank accession number AF 195822.
The molecular data were run in a phylogenetic analysis in which the HSP70h genes of a large number of isolates from elsewhere in the world. The phylogenetic trees showed that the four Hungarian isolates 2.2, 3.5 and 4.2 isolates could be inserted into the earlier classified five
groups of foreign GLRaV-3 isolates, into the group Nr. 2., but the isolate 1.4 belonged to the group Nr. 4. The GLRaV-1 6.4.1 isolate could be classified into the earlier created group “E”.
These sequence data of Hungarian Grapevine leafroll-associated virus isolates have been registered in the Gene Bank, under accession numbers of HE794021, HE794022, HE794023, HE794024 and HE794025.
Zusammenfassung
Das Vorkommnis der Rebenviren in Ungarn und molekulare Untersuchungen einiger ungarischer Grapevine leafroll- associated virus 1 und 3 Isolaten
Die Dissertation beschäftigt sich mit der Vorstellung des neuen Systems der Viren und Viruskrankheiten der Rebe in Ungarn. Weitere Zielsetzung war die molekulare Charakteristik eines Abschnittes des Genes HSP70h einer Grapevine leafroll- associated virus 1 (GLRaV-1) und vier Grapevine leafroll- associated virus 3 (GLRaV-3) aus Ungarn, sowie die Bestimmung der Aminosäurenreihenfolge und der Vergleich mit ausländischen Isolationen.
Zweihundertsiebenundsiebzig Blattmuster wurden zwischen 2007 und 2010 gesammelt, die nach Fachliteratur symptomatisch vorkommen haben. Diese Muster stammen von dreißig Weintraubenplantagen des siebzehn Weingebietes. Die Viren wurden serologisch, mit der ELISA Methode untersucht.
Nach den Ergebnissen ist festzustellen, dass nur in sechsundsiebzig Mustern Viren gefunden wurden und damit weniger Virusinfektion als vermutet, verglichen mit den Symptomen. Die früher bedeutenden Nepoviren, sowie Grapevine fanleaf virus, Arabis mosaic virus, Tomato blackring virus und Grapevine chrome mosaic virus, sind einzeln im Verhältnis weniger als früher, aber zusammen sind diese vier Viren soviel wie die GLRaV1-3 serologische Gruppe.
Großzügige Grapevine fleck virus Infektionen konnten auch in Erfahrung gebracht werden.
Dieser Virus ist konzentriert auf dem nordöstlichen Teil des Landes und im mittelwestlichen Transdanubien gefunden worden. Im Fall von fünfzehn Mustern sind gleich zwei Viren gleichzeitig anwesend. Nach den Ergebnissen zu urteilen, können die Virusinfektion ähnliche Symptome anderer Krankheitserreger, wie z.B. Phytoplasmen, anderer Viren, eventuell Stoffwechselstörungen oder Nährstoffmangel verursachen.
Der andere Teil der Arbeit hat molekulare mit Polymerasenkettenreaktion Methode einer gesammelten GLRaV-1 und vier GLRaV-3 Isolationen gebildet. Ein 500 bp langer Genabschnitt der beiden Viren konnte hervorgehoben und vermehrt werden. Primere haben zu der Untersuchung nach bei GLRaV-1 unter der Datenbank Registernummer AF195822 Sequenz, bei GLRaV-3 unter Nummer AF037268 geplant werden. Die Sequenzen sind danach
mit der Datenbank NCBI verglichen und ausländische Isolationen sowie phylogenetische Bäume konstruiert worden.
Im Fall der GLRaV-3 Isolate konnten die ungarischen Daten in die früher in fünf aufgeteilten Gruppen angepasst werden. Die Isolaten 3.5, 2.2 und 4.2 gehen in die zweite Gruppe, aber die Isolate CSE.1.4 wurde der vierten Gruppe zugeordnet.
Nach dem Ergebnis und der phylogenetischen Analyse nach zu urteilen, gehört die GLRaV-1 und die 6.4.1 Isolation in die sogenannten Gruppe „E“.
Diese Sequenzdaten von Ungarn werden vorerst in der internationalen Datenbank unter Registernummern HE794021, HE794022, HE794023, HE794024 und HE794025 eingegeben.
1. Bevezetés és célkit ő zés
A vírusmentes szılı szaporítóanyag használata alapvetıen fontos tényezı a megfelelı termésmennyiség és minıség elérése érdekében.
A vírusbetegségek gazdasági következményei: a fokozott tıkeleromlás és elhalás, a hozamok csökkenése és a minıség romlása, a tıkék produktív idıszakának megrövidülése, az oltványkészítés eredményességének csökkenése, a szaporítóanyag gyökeresedı képességének romlása, a beteg tıkék környezeti tényezıkkel szembeni ellenálló képességének csökkenése (Lehoczky, 1965). Az elmúlt két évtizedben több vírusbetegség leírására és a kórokozók hagyományos virológiai módszerekkel történt azonosítására is sor került. A kórokozók rendszertani megítélésében történt változások ugyanakkor számos félreértésre is alapot adtak.
Célszerő volt ezért a hazai eredményeket egységes rendszerbe foglalni és megemlíteni azokat a kórokozókat is, amelyek rövid idın belül megjelenhetnek Magyarországon.
Az utóbbi 50 évben jelentıs eredmények születtek a szılıvírusok szabadföldi körülmények között történı kutatásában. Ennek alapján azonosították a kórokozókat és alakították ki a szaporítóanyagok vírusfertızöttségét ellenırzı programot. Hazánkban ez idáig a szılırıl 15 vírusbetegséget írtak le és rendeltek hozzá kórokozót (Lázár, 1996). A vizsgálatokat hagyományosnak tekinthetı lágyszárú és fás szárú teszteléssel végezték, valamint Lehoczky János által elıállított antiszérumok segítségével szerológiai módszert is alkalmaztak.
Napjainkban az országok közötti kereskedelem és szaporítóanyag csere miatt fennáll a veszélye Magyarországon eddig még le nem írt, új kórokozók behurcolásának. Indokolttá vált az elızetes felmérések adatai alapján vírusizolátumok győjtése, génbankban való elhelyezése a további molekuláris vizsgálatok elvégzéséhez.
A kimutatási módszerek fejlıdésével elıtérbe kerültek a molekuláris módszerek.
Elınyük, hogy kisebb víruskoncentrációnál is megbízhatóan alkalmazhatók, olyan vírusok kimutatására is használhatók, amelyek esetében nem áll rendelkezésre antiszérum.
Segítségükkel, sokkal pontosabb képet kaphatunk a vírusgenom szerkezetérıl, tulajdonságairól, a kódolt fehérjék szerepérıl, továbbá információkat nyerhetünk arról is, hogy egyes vírusok mely más hazai, esetleg más országban megtalált és molekulárisan jellemzett izolátumokhoz hasonlítanak, illetve állnak rokonságban vagy honnan származnak.
E módszerek hátránya, hogy a szerológiai és más hagyományos módszereknél drágábbak, így tömeges ellenırzésre nem alkalmasak (Weber és mtsai, 2002).
A külföldön már használatos molekuláris módszerek adatai alapján, a korábban ismert nevezéktani rendszer is javításra szorul. Ezek alapján a szimptomatológiai alapú, külön elnevezéső vírusbetegség- korokozó rendszerezést meg kellett újítani.
A dolgozat elkészítésének célkitőzései:
• A hazánkban leírt szılıpatogén vírusok eddig használt rendszerezésének aktualizálása
• A vírusbetegségek és kórokozóik azonosítása
• Magyarország szılıterületein virológiai felmérés végzése
• A begyőjtött vírusizolátumok molekuláris jellemzésének megindítása és génbankba történı elhelyezése.
2. Irodalmi áttekintés
2.1. A magyarországi sz ı l ı virológiai kutatások történeti áttekintése
A szılıt károsító vírusok elıfordulásának vizsgálatát Dr. Lehoczky János és munkatársai kezdték meg az 1960-as években Magyarországon a kecskeméti a Szılészeti és Borászati Kutatóintézetben. Külföldi kutatóintézetekbıl megkezdıdött a virológiai szőrésben nemzetközileg használt indikátorfajták behozatala és felszaporítása a Kecskeméti Szılészeti és Borászati Kutatóintézet miklóstelepi, majd katonatelepi állomásán (Lehoczky és mtsai, 1992). A vírusfertızött egyedek fenntartására ugyancsak Kecskeméten létrehozták a Patológiai Kertet, olyan vírus génbankot, amely a vírustesztelési munka alapját képezte a külföldi kutatóintézetekbıl behozott és felszaporított fás szárú indikátorokkal.
A szılıfajták rendszeres virológiai szőrése 1972- ben kezdıdött. A ma is használatos rendszer három szőrési módszeren alapul: tüneti vizsgálat, biológiai tesztelés és szerológiai ellenırzés (Lázár, 1998; Lázár és mtsai, 2002). Az elsı évben a vírustüneteket nem mutató tıkéket kell kiválasztani és megjelölni. Ezeket a tıkéket egy vegetációs periódus alatt kétszer (virágzás körül és szeptember második felében) kell vizsgálni. Az elsı szelekció idejében mintát kell győjteni ELISA tesztelés elvégzéséhez. 1985 óta többször módosult az ELISA teszteléssel vizsgálandó vírusok köre, a jelenleg érvényben lévı szılı szaporítóanyagok forgalomba hozataláról szóló 87/2006. (XII. 28.) FVM rendelet szerint a következı jelentıs szılıpatogén vírusokra kötelezı a rendszeres tesztelés: szılı fertızı leromlás vírus (Grapevine fanleaf virus, GFLV), arabis mozaik vírus (Arabis mosaic virus, ArMV), a szılı foltosodás vírus (Grapevine fleck virus, GFkV), szılı levélsodródás vírus 1 és 3 (Grapevine leafroll-associated virus 1, 3, GLRaV 1, 3), szılı A, B és D vírusok (Grapevine virus A, B, D, GVA, GVB, GVD). Novemberben azokat a vesszıket kell begyőjteni további vizsgálatok elvégzéséhez, amelyek a felméréskor tünetmentesnek bizonyultak és a szerológiai tesztelés sem mutatta ki kórokozó jelenlétét. A mintákat célszerő mőanyag zacskókba győjteni és 2-3
oC-on tárolni. A második év tavaszán, az elıbbi módon teleltetett vesszıket 8 indikátorfajta segítségével, szövet-oltással (chip-transmission) kell vizsgálni szabadföldön: ezek az ’FS-4’
(’Siegfriedrebe’), Vitis rupestris cv. St. George, Vitis vinifera cv. Pinot noir és Chardonnay, V.
berlandieri x V. riparia Teleki Kober 5 BB, ’Couderc 1613’ x V. berlandieri LN 33, V.
riparia cv. Gloire de Montpellier, V. rupestris x V. berlandieri 110 Richter.
A szabadföldi tesztelı-iskolába kitelepített dugványokon jelentkezı tüneteket júniusban és szeptemberben kell vizsgálni. A második év tavaszán az átteleltetett vesszıket esetenként biológiai teszteléssel, mechanikai átvitellel, lágyszárú növényeken is tesztelni kell.
Erre a célra használhatók a Chenopodium quinoa, C. amaraticolor, Cucumis sativus
“Delicates”, Gomphrena globosa, Nicotiana clevelandii, N. tabacum cv. “Samsun”, N.
glutinosa, Phaseolus vulgaris cv. “Beautiful” fajok illetve fajták. A harmadik évben is két alkalommal kell elvégezni az értékelést. A vizsgálat végére a kijelölt, és minden indikátoron, minden esetben negatív eredményt adó növények vírusmentesnek tekinthetık (Baracsi, 1999, Lázár és mtsai, 2002). A szerológiai vizsgálat megbízható eredményt ad, hátránya, hogy nem minden vírus kimutatására alkalmas. A rupestris faszöveti barázdáltság vírus (Rupestris stem pitting-associated virus, RSPaV) fertızöttség kimutatása ELISA módszerrel jelenleg még nem, PCR vizsgálattal azonban kimutatható. Ezért nagyon fontos a három módszer (fásszárú, lágyszárú teszt és szerológia) együttes alkalmazása.
Az újabb eredmények szerint a legérzékenyebb módszer mégis a molekuláris genetikai vizsgálatok használata, de az elızı módszerekhez képest drágább, így ennek használata csak kivételes esetekben javasolt (Weber és mtsai, 2002). Azokhoz a vírusokhoz, amelyek elıször kerülnek meghatározásra, a leírásához szükség van elektronmikroszkópos felvételek készítésére is.
A vírusok növénybe jutása passzív folyamat, így szükséges annak ismerete, hogy milyen úton kerülhet a kórokozó a növénnyel kapcsolatba. Ez lehet állatvektorokkal vagy állatvektor nélküli egyéb módokon, például oltással, mechanikailag, vegetatív szaporítószervekkel, esetleg maggal, pollennel (Pribék, 1999).
2.2. A Magyarországon el ı forduló sz ı l ı vírusbetegségek és kórokozóinak áttekintése
Hazánkban ez idáig a szılırıl 15 vírusbetegséget írtak le (Lázár, 1996). Ezek a tünetek alapján alkotott hét csoportba sorolhatók: 1) szılı korai vírusos leromlás (grapevine degeneration), 2) levélsodródás (grapevine leafroll), 3) látens foltosság (grapevine fleck), 4) vonalas és győrős mintázottság (grapevine yellow mottle) 5) vonalas mintázottság (grapevine line pattern) és 6) faszöveti barázdáltság (grapevine rugose wood). A hetedik csoportba azokat a vírusszerő betegségeket soroljuk, amelyek kórokozói feltehetıen vírusos eredetőek, de pontosan még nem kerültek meghatározásra. A víruscsoportok és tagjainak általános
genomjellemzéséhez használt ábrák a Swiss Institute of Bioinformatics Expert Protein Analysis System adatbázisában (http://expasy.org/viralzone/) található ábrák és szakirodalmi adatok alapján készültek.
2.2.1. Szılı korai vírusos leromlás
A szılı korai vírusos leromlását, mint általános elnevezést több víruskórokozóra vezetik vissza. A Nepovirus nemzetségbe tartozó vírusok, nevezetesen a szılı fertızı leromlás vírusa (Grapevine fanleaf virus), a szılı tıkesatnyulás A és T vírusbetegséget okozó Arabis mosaic virus (ArMV) és Tomato black ring virus (TBRV), a szılı bolgár látens vírus (Grapevine bulgarian latent virus), és a szılı króm mozaik vírus (Grapevine chrome mosaic virus) okozzák. A nemzetség a nevét a Nematode transmitted- polihedral (NEPO) rövidítésbıl kapta, azaz fonalféreggel terjedı izometrikus vírusok csoportja (Horváth, 1972). Világszerte elterjedt kórokozók is vannak közöttük. Egyes vírusok erıs tüneteket idéznek elı, mások enyhébbeket. Akár 80%-os termésveszteséget is okozhatnak (Martelli, 1993; Pompe-Novak és mtsai, 2007). Jóllehet némelyik külön-külön is nagyobb kárt képes okozni helyenként, viszont nem túl nagy területen terjedt el, így kevésbé van gazdasági jelentısége. Leggyakrabban a szılı ültetvény korai pusztulását okozzák (Bovey és mtsai, 1980). A szılı vírusos leromlását elıször 1865-ben figyelte meg és írta le Cazalis és Allut Franciaországban (Martelli és Boudon-Padieu, 2006). A kórokozó és két törzse által okozott tünetek hazai megjelenésérıl, pedig Sárospataki (1964) és Lehoczky (1965) számoltak be. A leromlást okozó vírusok elkülönítése késıbb következett be, ezért, ezek a vírusok külön is részletezésre kerülnek. A nepovírusok izometrikus virionjai 25-30 nm átmérıjőek osztott, kétkomponensőek - B és M -, pozitív egyszálú RNS genommal rendelkezık. Az elıbbi mérete 7,5 kb, az utóbbié 3,9 kb. Az 5’ végeiken VPg vírusgenomhoz kötött fehérjét tartalmaznak, 3’ végük poliadenilált (Andret- Link és mtsai, 2004a). Az RNS1-en (B komponens) az elsı nyílt leolvasási szakasz a proteáz kofaktor (P1A), a következı a helikáz (HEL) enzimet, a vírusgenomhoz kötött fehérjét (VPg), a proteáz (Pro) és az RNS függı RNS polimerázt (POL) kódolja (1. ábra). A 2. RNS szál (M komponens) az ún. homing protein- „önvezérlésért” felelıs fehérjét (P2A), melynek pontos funkciója nem ismert, a mozgási fehérjét (MP) és a köpenyfehérjét (CP) kódolja (Vigne és mtsai, 2008).
Rövidítések:5’ VPg - vírusgenomhoz kötött fehérje, a genom 5’ végén, P1A - proteináz kofaktor, HEL - helikáz enzim, Pro - proteáz enzim, POL - RNS függı RNS polimeráz enzim, P2A - ún. homing protein - önvezérlésért felelıs fehérje, MP - mozgási fehérje, CP - köpenyfehérje: 3’polyA - a genom poliadeninlált 3’ vége, RNS-1 - a vírusgenom 1. komponense, RNS-2 - a vírusgenom 2. komponense
1. ábra. A Nepovirus nemzetség genomszervezıdése
A nepovírusok jelenleg rendszertanilag a Picornavirales rend, Secoviridae család Comovirinae alcsalád, Nepovirus nemzetségének tagjai (Carstens, 2010). A legtöbbjük fonálféreg vektora ismert, A szılı gyökerének szívogatása által veszik fel a virionokat és adják tovább. A fonálférgek a kórokozót még néhány hónapig hordozhatják, bár ezen az úton nagy távolságokra nem terjed.
2.2.1.1. Grapevine fanleaf virus - Szılı fertızı leromlás vírus (GFLV)
A szılı fertızı leromlás kórokozója a szılı fertızı leromlás vírus (Grapevine fanleaf virus, GFLV). Két törzsét különböztetik meg tünettanilag: a sárga mozaik törzs (Grapevine fanleaf virus - yellow mosaic strain, GFLV-YM) és az érmenti szalagosodás törzs (Grapevine fanleaf virus - vein banding strain, GFLV-VB) (Lázár, 1996). A GFLV-ról és a törzseirıl szóló elsı áttekintéseket, Vuittenez, Dias és Taylor írták le (Frazier, 1970). A sárga mozaik törzzsel fertızött tıkék krómsárga elszínezıdést mutatnak, ami már kora tavasszal megjelenik. Az érmenti és érközi területeken kiterjedt foltok jelennek meg, vagy teljesen elsárgul a levélzet (Martelli, 1993). Az érmenti szalagosodás törzsre a sárga foltok, illetve az ér mentén megjelenı, és az ér mellett végigfutó, hosszanti, sárga, szalagszerő lefutású, klorotikus mintázat jellemzı (Goheen és Hewitt, 1962). Szychowski és munkatársainak (1995) eredményei szerint az érmenti szalagosodás tünet a szılı páfránylevelőség vírus (GFLV) és egy viroid, a Szılı sárga foltosság viroid-1 (Grapevine yellow speckle viroid-1, GYSVd-1) komplex fertızésének következménye. Különösen nyáron és ısszel látszanak jól a tünetek. Ez a kórokozó a világ minden szılıtermesztı területén megjelent. A szılı egyik legelterjedtebb vírusa, ami az összes fajtát képes fertızni. A vírusfertızés hatással van a szılı
produktivitására és a tıke élettartamára (Andret-Link és mtsai, 2004b). A tünetek rendkívül változatosak és egyszerre több törzse is jelen lehet egy növényben. A fertızés következtében a tıke vagy nagyon gyorsan elpusztul, vagy néhány éven belül leromlik. A vesszıkön megjelenı tünetek a következık: rövid ízközök, villás elágazás, szalagos, ellaposodott hajtás és fürt.
A levélerek futása páfránylevélre emlékeztetı, a levéllemez aszimmetrikus, erısen fogazott a levélszél és gyakori a klorotikus foltok megjelenése. A sárga mozaik és az érmenti szalagosodás törzs csak enyhe levél deformációt okoz, amelyeken világossárga elszínezıdés látható. Ha a sárgulás csak az erek mentén jelentkezik, akkor érmenti szalagosodásról beszélünk. A vírusfertızött leveleken klorotikus győrők, pontok, foltok jelennek meg. A fertızött tıkéken a rügyek kisebbek és számuk is kevesebb, mint az egészséges növényeken.
A bogyók gyakran kiszáradnak, összeaszalódnak, kicsik maradnak, vagy magtalanok (Sárospataki, 1964). A GFLV elsısorban Xiphinema index és X. italie fonalférgekkel terjed nem cirkulatív, szemiperzisztens módon (Demangeat és mtsai, 2005). Ezen kívül ismert szaporítóanyaggal, szövetoltással (Hewitt és mtsai, 1962) és maggal (Lázár és mtsai, 1990) történı átvitele is. Fás szárú indikátorai: Vitis rupestris cv. St. George, Vitis vinifera cv.
Chardonnay, ’FS 4’ (’Siegfriedrebe’) (Kölber és mtsai, 1981). Lágyszárú tesztnövénye elsısorban Chenopodium quinoa, amelyen szisztemikus klorotikus pontokat, levéldeformációt, ritkán lokális léziókat idéz elı (Bashir, 2007).
2.2.1.2. Arabis mosaic virus - Arabis mozaik vírus (ArMV)
Az Arabis mozaik vírus (Arabis mosaic virus, ArMV) az A típusú tıkesatnyulás betegség kórokozója szerológiailag a GFLV-sal rokon. A volt Jugoszlávia területén találták meg elıször (Panjan és Saric 1963). Hazánkban Martelli és Lehoczky (1968) írták le szılırıl.
A kórokozó által elıidézett tünetek nagyon hasonlóak a fertızı leromláshoz, általában együtt fertıznek meg egy-egy tıkét (Wetzel és mtsai, 2004). Az ArMV-nak nagyon széles a gazdanövényköre, ide tartoznak különbözı gyomnövények is (Jenser és mtsai, 1979). Szintén fonálférgek terjesztik, elsısorban a Xiphinema diversicaudatum, X. coxi, Longidorus caespiticola, és ezen kívül ismert az oltással, fertızött szaporítóanyaggal és a maggal történı terjedése is. Legfontosabb tesztnövénye a Nicotiana glutinosa, amelyen feltőnı klorotikus győrőzöttséget és pettyeket okoz. Fás szárú indikátorai: Vitis rupestris cv. St. George, Vitis vinifera cv. Pinot noir, ’FS 4’ (’Siegfriedrebe’) (Baracsi, 1999).
2.2.1.3. Grapevine chrome mosaic virus - Szılı krómmozaik vírus (GCMV)
A szılı krómmozaik betegséget okozó vírust, a szılı krómmozaik vírust (Grapevine chrome mosaic virus, GCMV) hazánkban a Balaton-felvidék egyik ültetvényében találták meg elıször a világon (Martelli és mtsai 1966; Lehoczky és mtsai, 1984b). A betegség tünetei: a levelek krómsárgára színezıdése, illetve a vegetáció során történı kifehéredése, rövid ízközök, kettıs nóduszok kialakulása. Néhány izolátuma a levélen deformációkat és klorotikus foltokat is okozott. Ismertek olyan törzsek is, amelyek látható tüneteket nem idéznek elı. A vírus fonálféreg vektora egyelıre nem ismert, de talajban terjedését feltételezik. Ezen kívül fertızött szaporítóanyaggal és oltással is átvihetı. Lágyszárú tesztnövényei: Chenopodium quinoa, Nicotiana occidentalis, N. clevelandii és a Cucumis sativus. Fás indikátorai: Vitis vinifera cv. Chardonnay, V. vinifera cv. Pinot noir, V. vinifera cv. Jubileum 75 és az ’FS 4’ (Le Gall és mtsai, 1997).
2.2.1.4. Tomato black ring virus - Paradicsom fekete győrős vírus (TBRV)
A paradicsom fekete győrős vírust (Tomato black ring virus, TBRV) elıször Stellmach és Bercks (1963) írták le szılırıl. Hazánkban a kórokozót 1981-ben izolálták elıször (Lehoczky és Burgyán, 1986). Az általa elıidézett betegség a tıkesatnyulás T típusa.
A fertızés a tıkék növekedését gátolja, az idısebb leveleken apró foltokat és a levélszélek sárgulását okozza. A frissen fertızött növények levelén klorotikus foltok és győrők is kialakulhatnak. A vírus Longidorus attenuatus fonálféreg vektoron kívül oltással és maggal is terjed (Joñczyk és mtsai, 2004). Lágyszárú tesztnövénye a Nicotiana tabacum cv. ’Samsun’ és a Chenopodium quinoa. Vitis vinifera cv. Chardonnay, Vitis vinifera cv. Pinot noir, Vitis rupestris cv. St. George és ’FS 4’ fás szárú indikátorfajták segítségével vizsgálható (Baracsi, 1999).
2.2.1.5. Grapevine Bulgarian latent virus - Szılı bolgár látens vírus (GBLV)
A szılı bolgár látens foltosságot okozó szılı bolgár látens vírust (Grapevine Bulgarian latent virus, GBLV) Martelli és munkatársai (1977) írták le Bulgáriában, és
jellemezték elıször, hazánkban Pocsai (1981) találta meg. A vírus a szılı fajtákat általában látensen fertızi. A fertızésére utaló tünetek lehetnek a kései rügypattanás, a vesszık megnyúlása, egyenetlen fürtképzés, növekedésgátlás, illetve GFLV fertızéséhez hasonló tünetek kialakulása. Vektora még nem ismert, de fertızött szaporítóanyaggal és maggal képes terjedni (Martelli, 1993). Lágyszárú tesztnövénye Chenopodium quinoa, fásszárú tesztnövénye az ‘FS-4’, Vitis vinifera cv. Pinot noir és a Vitis riparia cv. Gloire de Montpellier (Baracsi, 1999). Már korábban is a Nepovirus nemzetség feltételezett tagjaként tartották számon, Elbeaino és munkatársainak (2011) munkája alapján ma már ismerjük a vírus teljes szekvenciáját.
2.2.2. Levélsodródás tünetcsoport
A szılı levélsodródás tüneteit részben a szılı levélsodródás vírus csoport tagjai, részben a viroid és fitoplazma fertızések okozzák. Az utóbbi két kórokozó csoport az értekezés tárgyát nem képezi.
A szılı levélsodródását több, egymáshoz hasonló tulajdonságú vírus külön-külön, vagy együttesen is elıidézheti. Ez idáig külföldi szakirodalmak 9, szerológiailag különbözı csoportot írtak le, amelyek összefüggésben állnak a betegséggel (Meng és mtsai, 2005). Ezek a Grapevine leafroll-associated virus 1-9 típusai. A jelenleg érvényben lévı International Commitee of Virus Taxonomy (továbbiakban ICTV) által közzétett hivatalos rendszertani besorolás és lista szerint 4 különálló víruscsoport maradt meg. A kórokozók a Closteroviridae család tagjai, ezen belül új vírusnemzetség jelent meg a Closterovirus nemzetség mellett, - melybe jelenleg a Grapevine leafroll-associated virus 2 (GLRaV-2) tartozik-, ez az Ampelovirus nemzetség. Tagjai a Grapevine leafroll-associated virus 1 (GLRaV-1), Grapevine leafroll-associated virus 3 (GLRaV 3) és a Grapevine leafroll-associated virus 5 (GLRaV-5) (Komínek és mtsai, 2005).
Egyes felmérések szerint a vírusbetegség 20-40%-os (Routh és mtsai, 1998), mások szerint, akár 62%-os termésveszteséget is okozhat (Walter és Martelli, 1997). A mennyiségbeli romláson túl Brar és mtsai (2008), Lee és mtsai (2009), valamint Lee és Martin (2009, 2010) vizsgálták Vitis vinifera ’Crimson Seedless’ és ’Pinot noir’ fajtáknál a bogyók beltartalmi értékének minıségbeli változásait is, elsısorban a GLRaV-3 fertızés hatására.
Méréseik alapján, a vírusfertızött tıkékrıl származó bogyóknál az antocianin, a szerves savak
közül az almasav és egyes aminosavak (valin, metionin) és a fenoltartalom mennyiségének csökkenését figyelték meg az egészséges kontrollhoz képest. Az alany és nemes kombinációk esetében ezek az eltérések nagy változatosságot mutatnak. Egyértelmően nem lehet számszerősíteni ezen összetevık csökkenését, mert egyéb befolyásoló tényezık pl. tıkék kora, a vírusfertızöttség idıtartama hatására is számítani kell.
A Closteroviridae család tagjaira jellemzı a pozitív egyszálú RNS genom, és a 12 nm átmérıjő, 1800-2200 nm hosszú, flexibilis, fonál alakú virion (Regenmortel és mtsai, 2004).
A betegség Olaszországban tapasztalt tünetére elıször 1906-ban Sannino tesz említést (Martelli és Boudon-Padieu, 2006). Magyarországon Lehoczky és munkatársai (1969) figyeltek fel rá. A GLRaV -1, -2, -3 és -4 víruscsoportjainak elıfordulását nálunk Lehoczky kezdte el vizsgálni, jelenlétüket Lázár és munkatársai (1994) igazolták.
Magyarországról származó mintákból is kimutattak szerológiai vizsgálattal egy azidáig ismeretlen vírust, amely hasonlóságot mutatott az okozott tünetek tekintetében és szerológiai tulajdonságaiban a levélsodródást okozó vírusokkal. Western blot vizsgálat eredményeként Choueiri és mtsai (1996) szerint ez a vírus feltételezhetıen GLRaV-7.
További adatok errıl a vírusról és hazai elterjedésérıl nem állnak rendelkezésre.
A ma érvényes ICTV által közzétett adatbázisban már a GLRaV-4, -6 és -7 nem szerepelnek (Carstens, 2010).
A betegségre jellemzı a bogyók alacsony cukortartalma, késıi bogyóérés, rendellenesen megvastagodó és lefelé sodródó, és a vörösbort adó szılıfajtáknál vörösre színezıdı levéllemez (Little és Rezaian, 2006). A tünetek a vegetációs idıszak vége felé láthatók a legjobban (Meng és mtsai, 2005).
Rövidítések: 5’- a genom 5’ vége, ORF1a - elsı nyílt leolvasási szakasz a része, ORF1b - az elsı nyílt leolvasási szakasz b része, ORF2 - második nyílt leolvasási szakasz, HSP70h - 70 kDa nagyságú hısokk fehérje homológ, HSP90h - 55 kDa nagyságú HSP90 hısokk fehérje, CP - köpenyfehérje, CPm1 - köpenyfehérje egy részének 1.másolata, CPm2 - köpenyfehérje egy részének 2.másolata, ORF8 és ORF9 - nyolcadik és kilencedik, ismeretlen funkciójú fehérjéket kódoló nyílt leolvasási szakaszok, 3’ - vírusgenom 3’vége
2a ábra
Rövidítések: 5’- a genom 5’ vége, ORF1a - elsı nyílt leolvasási szakasz a része, ORF1b - az elsı nyílt leolvasási szakasz b része, HSP70h - 70 kDa nagyságú hısokk fehérje homológ, p55 - 55 kDa nagyságú HSP90h hısokk fehérje, CP - köpenyfehérje, CPm - köpenyfehérje egy részének másolata, p6, p5, p21, p19, p20, p4 és p7 - ismeretlen funkciójú fehérjék, 3’ - vírusgenom 3’vége
2b ábra
2. ábra. Az Ampelovirus nemzetség tagjainak, a (2a) Szılı levélsodródás vírus 1 (Grapevine leafroll- associated virus 1, GLRaV-1) és a (2b) Szılı levélsodródás vírus 3 (Grapevine leafroll-
associated virus 3, GLRaV-3) vírusok genom szerkezete
2.2.2.1. Grapevine leafroll-associated virus 1 - Szılı levélsodródás vírus-1 (GLRaV-1) A szılı levélsodródás 1-es típusú vírusnak (Grapevine leafroll-associated virus 1, GLRaV-1) renszertani helye a Closteroviridae család Ampelovirus nemzetsége (2a ábra).
17,6 kb nagyságú genommal rendelkezik a 3’ vég polyA struktúrát, míg az 5’ vég feltehetıleg metilált ún. cap struktúrát tartalmaz. Little és munkatársainak (2001) közleménye alapján 10 nyílt leolvasási szakaszát (Open reading frame, ORF) ismerjük, amelyek több fehérjét kódolnak. Az ORF1 replikációhoz szükséges enzimeket kódoló szakasz két részre osztható. Az ORF1a kódolja a Papain-szerő proteázt, metiltranszferázt és a helikázt. Az ORF1b az RNS függı RNS polimeráz domént tartalmazza, az ORF2-es egy 7 kDa nagyságú ismeretlen funkciójú hidrofób fehérjét kódol, Fazeli és Rezaian (2000) szerint a vírusgenom 3’ vég polyA struktúrájának kialakításában játszik szerepet. Az ORF3 a HSP70h fehérje, míg az ORF4 a HSP90–es 55 kDa nagyságú fehérje doménje. Az ORF5 kódolja a CP-t, míg a
következı két szakasz két eltérı köpenyfehérje (CP) másolatot kódol. A többi nyílt leolvasási szakasz (ORF8, ORF9) által kódolt fehérjék funkciója ismeretlen.
A kórokozó oltással, fertızött szaporítóanyaggal és közönséges teknıs pajzstetvekkel (Parthenolecanium corni), valamint egyéb, viaszos pajzstető fajok, Heliococcus bohemicus, Phenococcus aceris közvetítésével is terjedhet (Komínek és mtsai, 2005). Magyarországon az utóbbi két faj fordul elı leginkább a szılıben (Jakab és Szendrey, 1989). A vírust terjesztheti még a Planococcus citri is, nem propagatív módon (Cid és mtsai, 2007). Egyéb rovarátvitelt is megfigyeltek már, például a Planococcus ficus, Pseudococcus longispinosus, és más Pseudococcus fajok esetében is (Cabaleiro és Segura, 2006).
2.2.2.2. Grapevine leafroll-associated virus 2 - Szılı levélsodródás vírus-2 (GLRaV-2) A szılı levélsodródás 2-es típusú vírusa (Grapevine leafroll associated-virus 2, GLRaV-2) a Closteroviridae család Closterovirus nemzetség tagja (3. ábra). Genomja nyolc nyílt leolvasási szakaszt kódol. Az ORF1 ab, az Ampelovirus nemzetségéhez hasonlóan a replikációhoz szükséges polipeptidet kódol. Az ORF1a metiltranszferázt, proteázt, helikáz enzimet, az ORF1b egy RNS függı RNS polimeráz enzimet kódol. Az ORF3 HSP70 homológ fehérjét kódol. Az 5-ös és 6-os nyílt leolvasási szakasz egy kisebb és egy nagyobb molekulatömegő köpenyfehérje (CP, CPm) leolvasási helyei. AZ ORF2, 4, 7 és 8 ismeretlen funkciójú, (p6) 25 kDa, (p64) 63 kDa, (p20) 19 és (p21) 24 kDa nagyságú ismeretlen funkciójú fehérjék doménjei (Meng et al, 2005). Természetes vektora nem ismert, a terjedését vegetatív szaporításkor és oltáskor figyelték meg. Lágyszárú tesztnövénye a Nicotiana benthamiana és a N. clevelandii. Fásszárú tesztelésnél Vitis vinifera fajták alkalmazhatók, különösen a ’Pinot noir’, ’Cabernet franc’ és a ’Merlot’ (Beuve és mtsai, 2007; Martelli, 1993).
Vizsgálatok folynak a vírus pontos meghatározására. Masri és munkatársai (2006) publikációjában egy jelenleg a Vitivirus nemzetséghez tartozó Szılı C vírusaként ismert (Grapevine virus C, GVC) kórokozóval való azonosságát feltételezi. A fıleg Vitis vinifera
’Red Globe’ és ’Pinot noir’ fajtánál megfigyelt oltáskor fellépı inkompatibilítás és hirtelen fellépı tıkepusztulás tünetekért ugyancsak a GLRaV-2 vírust, és annak két törzsét (GLRaV-2 RG, GLRaV-2 PN) nevezi meg (Meng és mtsai, 2005).
Rövidítések: 5’ - 5’ vég, ORF1a - elsı nyílt leolvasási szakasz a része, ORF1b - az elsı nyílt leolvasási szakasz b része, HSP70h - 70 kDa nagyságú hısokk fehérje homológ, CP - köpenyfehérje, CPm - köpenyfehérje egy részének másolata, p6, p64, p21, és p20 - ismeretlen funkciójú fehérjék, 3’ - vírusgenom 3’vége
3. ábra. Closterovirus nemzetség genom felépítése
2.2.2.3. Grapevine leafroll-associated virus 3 - Szılı levélsodródás vírus-3 (GLRaV-3) A kórokozó az Ampelovirus nemzetség tagja, virionja 19,5 kb hosszúságú flexibilis (Kominek és mtsai, 2005). Genomja 12 nyílt leolvasási szakaszt tartalmaz (2b ábra).
Az ORF1a kódolja a Papain-szerő proteázt, metiltranszferázt és a helikázt. Az ORF1b az RNS függı RNS polimeráz domént tartalmazza, az ORF2-es és 3-as egy 6 és egy 5 kDa nagyságú ismeretlen funkciójú fehérjét kódol, az ORF4 a HSP70h fehérje, míg az ORF5 a HSP90h-t, amely egy 55 kDa nagyságú fehérje doménje. Az ORF6 és 7 két különbözı tömegő CP-t kódol az utóbbi a kisebb molekulatömegő, ez az eredeti CP egy részének másolata. A nagyobb molekulatömegő köpenyfehérje a viriont burkolja, a kisebb valószínősíthetıen a virion 5’ végét. A többi nyílt leolvasási szakasz által irányított p21, p20, p20 p4 és p7 fehérjék funkciója mindezidáig ismeretlen (Maree és mtsai, 2010).
GLRaV-3 vektora Dél-Afrikában és Olaszországban a Planococcus ficus (Engelbrecht és Kasdorf, 1990), Izraelben a Pseudococcus longispinosus faj, és Kaliforniában a Ps. affinis (Petersen és Charles, 1997).
A szılı levélsodródás 1-es és 3-as vírusok átvitelével kapcsolatba hoztak teknıs pajzstető (Pulvinaria vitis, Neopulvinaria innumerabilis) fajokat (Sforza és mtsai, 2003).
Kozár (2005) beszámolt arról, hogy hazánkban, a szakirodalmakban a szılı levélsodródás vírusok vektoraiként ismert fajok közül Magyarországon, szabadföldön a Parthenolecanium corni, Heliococcus bohemicus, Phenacoccus aceris, Planococcus citri és Pulvinaria vitis vannak jelen, továbbá üvegházakban igazolták Pseudococcus longispinosus megjelenését is.
2.2.2.4. Grapevine leafroll-associated virus 4, 5, 6, 7 - Szılı levélsodródás vírus -4, -5, -6,-7 (GLRaV-4, -5, -6; -7)
A szılı levélsodródás 4-es és 6-os típusú vírusának (Grapevine leafroll-associated virus 4, 6) jelenlétérıl hazánkban szerológiai vizsgálattal Lázár és munkatársai (1994 és 1995a) valamint Lázár és Bisztray (2011) számoltak be.
A szılı levélsodródás 5-ös (Grapevine leafroll-associated virus 5, GLRaV-5) szintén Ps. longispinosus vektorral terjed (Golino és mtsai, 2002, Martelli és Boudon-Padieu, 2006).
A vírus magyarországi jelenlétérıl nincs információ.
A szılı levélsodródás 7-es típusú vírus (Grapevine leafroll-associated virus 7, GLRaV-7) jelenleg a család feltételes tagja. Magyarországról származó levélmintában (Choueiri és mtsai, 1996) kimutatták a kórokozót.
2.2.2.5. A 70 kDa nagyságú hısokk fehérje homológ (HSP70h) jellemzése
A HSP70-nel homológ fehérje 70 kDa-os hısokk fehérje. A Closteroviridae az egyetlen olyan víruscsalád, amely ilyen típusú fehérjét kódol. Funkciója a sejtrıl sejtre terjedésben van elsısorban (Premyslov és mtsai, 1999). A HSP70 gént használják leginkább a Closteroviridae család tagjainál a molekuláris jellemzés kezdı lépéseként és a genetikai diverzitás meghatározásához (Kominek és mtsai, 2005).
A HSP70h gén 70 kDa nagyságú hısokk fehérje, mely egy chaperon, ún. dajkafehérje.
Ideiglenes, nem kovalens kötı helyet tartalmaz, ezáltal összegombolyít vagy/és szétbont más polipeptideket vagy RNS molekulákat. Transzport és oligomerizációs folyamatokban is szerepet játszik. Újraburkolja azokat a fehérjéket vagy RNS molekulákat, amelyek stresszhatásra denaturálódtak. Noha részt vesznek ezekben a folyamatokban, a chaperonok nem szerves részei ezeknek a funkcionális molekuláknak (Agranovski és mtsai, 1991; Aranda és mtsai, 1996).
A HSP70h gént kódoló szekvencia adatok és ezek alapján felállított filogenetikai elemzés eredményeként GLRaV-3 esetében öt genetikai variáns csoport alakítható ki a génbankban megtalálható izolátumokból (Fuchs és mtsai, 2009, Jooste és mtsai, 2010). Négy csoport kismértékő genetikai varabilitást mutat. Ebbe a négy csoportba tartozó izolátumok a NY-1 (AF037268 génbanki azonosítószámú) Amerikai Egyesült Államok területérıl izolált vírushoz viszonyítva, több mint 90 %-os hasonlóságot mutatnak. Az ötödik csoport egyetlen izolátumot tartalmaz, mégpedig a GLRaV-3 NZ-1 (új- zélandi EF508151 azonosítójú)
izolátumát, amely a legnagyobb mértékő különbséget mutatja az öt csoport közül. A NY-1 izolátumhoz viszonyítva csupán 74,1%-os a hasonlóság (Maree, 2010).
GLRaV-1 esetében Kominek és mtsainak (2005) munkája alapján két variánscsoport különböztethetı meg, melyekbe a csehországi, szlovák, Amerikai Egyesült Államokból való és Ausztráliából származó vírusizolátumok HSP70h gén szekvencia adatai filogenetikai elemzésének eredményeként.
2.2.3. Látens foltosság
Ebbe a tünetcsoportba azok a vírusbetegségek tartoznak, amelyek a Vitis vinifera fajtákon látensek, de más módszerekkel (indikátor fajták) kimutathatók. E csoportba a hazánkban ismert vírusok közül a szılı látens foltosságát okozó szılı foltosodás vírus (Grapevine fleck virus, GFkV) tartozik.
2.2.3.1. Grapevine fleck virus - Szılı foltosodás vírus (GFkV)
A kórokozó rendszertani helye a Tymovirales rend, Tymoviridae család, Maculavirus nemzetség (Abou-Ghanem-Sabanadzovic és mtsai, 2003). Az általa okozott megbetegedést elıször Kaliforniában Hewitt és munkatársai (1962) írták le. Hazánkban Lehoczky és Farkas (1981) találta meg. A Grapevine fleck virus (GFkV) virionjai izometrikusak, 30 nm átmérıjőek. A vírus genom pozitív egyszálú RNS. Az 5’ végen cap struktúrával rendelkezik, a 3’ vég poliadenilált.
Az elsı nyílt leolvasási szakasz a vírusreplikációjához szükséges poliproteint kódolja, amelynek egyik része az RdRp enzim. Sabanadzovic és munkatársai (2001) szerint az ORF1 poliprotein további három fehérje doménje: a metiltranszferáz, papain szerő proteáz és a helikáz. A második nyílt leolvasási szakasz a köpenyfehérjét, a 3. és 4. pedig 1-1 prolinban gazdag, de ismeretlen funkciójú fehérjét kódolja (4. ábra).
Rövidítések: 5’ cap - a vírusgenom 5’ vége „cap” struktúrával, ORF1 poliprotein - vírusreplikációjához szükséges poliprotein, CP - köpenyfehérje ORF3 - hármas számú nyílt leolvasási szakasz, ORF 4 - négyes számú nyílt leolvasási szakasz, 3’ polyA- a genom 3’poliadenilált vége
4. ábra. A Maculavirus nemzetség genom szervezıdése
Kimutatása Vitis rupestris ’St. George’ fajtán lehetséges, amelyre oltással vihetı át. A Vitis vinifera fajtákon a fertızés látens, innen származik a kórokozó neve is (Schieber és mtsai, 1997). A betegség tünetei érkivilágosodás, a harmad- és negyedrendő erek közelében áttetszı foltok megjelenése, amelyek akkor láthatók a legjobban, ha a fény felé tartjuk ıket.
Az ilyen intenzíven foltosodó levelek ráncosodnak, torzulnak, és felfelé pöndörödnek. A vírus a floémben lokalizálódik, mechanikailag nem terjed. A betegséget kísérletes úton aranka fajok átviszik, és fertızött szaporítóanyaggal is terjed (Martelli, 1993; Martelli és mtsai, 2002).
2.2.4. Szılı faszöveti barázdáltság
A szılı fás részeinek, oltással átvihetı vírusbetegség komplexét nevezzük faszöveti barázdáltságnak, amely az egész világon elterjedt. A tıke farészénél gödröket és barázdákat lehet megfigyelni. Négy elváltozás hozható kapcsolatba a faszöveti barázdáltsággal: a Rupestris stem pitting (Rupestris faszöveti barázdáltság), a Kober stem grooving (Kober faszöveti barázdáltság), az LN 33 stem grooving (LN 33 faszöveti barázdáltság) és a corky bark (parakérgőség). A tüneteket elıször Hewitt (1954) írta le, Olaszországban „érdes kéreg”
tünetként. Magyarországon Martelli és munkatársai (1967) figyelték meg, majd Lázár munkatársai (1995b) fásszárú tesztelés segítségével különítette el az egyes változatokat.
Ez a betegség felelıs az oltásoknál kialakuló összeférhetetlenségért, a kései rügyfakadásért, a tıkék leromlásos tüneteiért és késıbbi pusztulásáért. A betegség etiológiája még nem teljesen tisztázott, valószínősíthetı, hogy a Grapevine virus A (GVA), a Grapevine virus B (GVB) és a Rupestris stem pitting-associated virus (RSPaV) kapcsolatba hozható a faszöveti barázdáltság betegséggel.
2.2.4.1. Rupestris stem pitting-associated virus - Rupestris faszöveti barázdáltság vírus (RSPaV)
A Rupestris stem pitting betegséget a rupestris faszöveti barázdáltság vírus, Rupestris stem pitting-associated virus (RSPaV), ma hivatalosan használandó néven Grapevine rupestris-associated virus (GRSPaV) ismert (Carstens, 2010). A kórokozó korábban a Flexiviridae család Foveavirus nemzetségéhez tartozott (Nolasco és mtsai, 2006), ma hivatalosan Tymovirales rend, Betaflexiviridae család, Foveavirus nemzetségéhez tartozik.
Virionjai burokkal nem rendelkezı, flexibilis, 800 nm hosszú, 12-13 nm átmérıjő fonál alakúak. Az 5’ végen „cap”, a 3’ végen polyA struktúrával rendelkezik. (5. ábra). Genomja pozitív, egy szálú RNS, mely 5 fehérjét kódol. Az elsı rész a replikációhoz szükséges polipeptidet kódolja, melynek részei a metiltranszferáz, helikáz, és RNS függı RNS polimeráz enzimek. A következı 3 szakasz a mozgási fehérje (TGB) 3 komponensét, az azt követı pedig a köpenyfehérjét (CP) kódolja (Rebelo és mtsai, 2008). A vírus mechanikailag nem vihetı át, és eddig természetes vektorát sem találták meg (Nakaune és mtsai, 2008).
Jelenlétét Vitis rupestris cv. St. George indikátor fajtán lehet kimutatni. Ezen a fajtán az oltás helye alatt, a farészen, sávosan gödröcskék láthatók, de esetenként bárhol máshol a farészen láthatók gödrök és barázdák (Zhang és mtsai, 1998, Meng és mtsai, 1999). Krónikus fertızés tünete a törpülés (Lima és mtsai, 2006).
Rövidítések: 5’cap - vírusgenom 5’ vége cap struktúrával, polipeptid – replikációhoz szükséges fehérjék, TGB1, TGB2, TGB3 - mozgási fehérje 3 komponense, CP - köpenyfehérje, 3’ polyA- a genom 3’ poliadenilált vége
5. ábra. A Foveavirus nemzetség genomszervezıdése 2.2.4.2. Grapevine virus A - Szılı A vírus (GVA)
A szılı A vírus (Grapevine virus A, GVA) a szılı háncsrészében található kórokozó, melynek 800 nm hosszú fonál alakú virionja van. Genomja pozitív, egyszálú RNS. 5’ végen
„cap”, 3’ végen polyA struktúrával rendelkezik (6. ábra). A genom 5 fehérjét kódol: a replikációhoz szükséges poliproteint, egy ismeretlen funkciójú fehérjét (p20), egy TGB típusú mozgási fehérjét (MP), egy köpenyfehérjét (CP) és egy géncsendesítést feloldó fehérjét (NB) (Minafra és mtsai, 1997). A GVB-vel együtt a Flexiviridae új nevén Betaflexiviridae család
Vitivirus nemzetségéhez tartozik (Murolo és mtsai, 2008). A GVA-t a Kober faszöveti barázdáltsággal hozzák összefüggésbe. Biológiai indexelése a Vitis berlandieri x Vitis riparia cv. Kober 5BB indikátoron történik (Lázár, 1996). Különbözı pajzstetvekkel (Pseudococcus longispinosus, Ps. affinis, Planococcus ficus, Pl. Citri) terjed, további vektorai Heliococcus bohemicus és Neopulvinaria innumerabilis lehetnek (Minarfa és mtsai, 1997). A közönséges teknıspajzstetőrıl vagy akácpajzstetőrıl (Parthenolecanium corni) is kimutatták vektor szerepét. A vírus kimutatására Nicotiana benthamiana, N. clevelandii és a Gomphrena globosa lágyszárú tesztnövények alkalmasak (Haviv és mtsai, 2006).
Rövidítések: 5’ cap- a vírusgenom 5’ vége „cap” struktúrával, polipeptid – replikációhoz szükséges fehérjék, p20 - ismeretlen funkciójú fehérje, MP - mozgási fehérje, CP - köpenyfehérje, NB - Nukleinsavhoz kötött fehérje, 3’
polyA – genom 3’ vége polyA struktúrával
6. ábra. A Vitivirus nemzetség génszerkezete 2.2.4.3. Grapevine virus B - Szılı B vírus (GVB)
A szılı B vírus (Grapevine virus B, GVB) a parakérgőség (corky bark) kórokozójaként ismerik. Ugyancsak a Vitivirus nemzetséghez tartozik. A virion alakja és felépítése ugyanolyan, mint a GVA esetében. A betegség tünetei a Vitis rupestris cv. St.
George és’Couderc 1613’ x Vitis berlandieri cv. LN 33 fajtákon vizsgálhatók (Kuniyuki és mtsai, 2006). A vírust a Pseudococcus longispinus terjeszti. Lágyszárú tesztnövénye a Nicotiana benthamiana és N. occidentalis (Saldarelli és mtsai, 2005). A környezı országok közül, Szlovéniában Tomazič és munkatársai (2005) folytattak vizsgálatokat a szılı vírusfertızöttségével kapcsolatban, de elıfordulását nem tudták igazolni. Horvátországban viszont Voncina és munkatársai (2011a) viszonylag nagyszámú szılı mintában igazolták a GVB elıfordulását molekuláris és szerológiai vizsgálatokkal is. Hazánkban fásszárú teszteléssel feltételezik a vírus jelenlétét (Lázár és mtsai, 1995b), de a vírus leírásáról nem jelent meg közlemény.
A negyedik típusú elváltozásról, az LN 33 stem groovingról nagyon keveset tudunk.
Fásszárú tesztnövénye a ’Couderc 1613’ x Vitis berlandieri cv. LN 33 (Lázár, 1996).
2.2.5. Szılı vonalas és győrős mintázottság
2.2.5.1. Alfalfa mosaic virus - Lucerna mozaik virus (AMV)
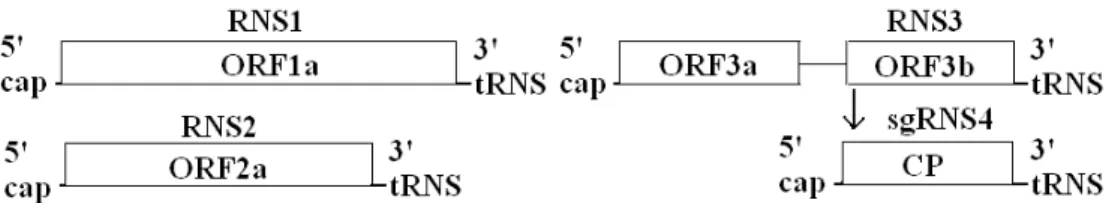
A lucerna mozaik vírus (Alfalfa mosaic virus, AMV) a szılı vonalas és győrős mintázottság betegség - Grapevine yellow mottle- kórokozójaként ismert. Virionjai bacillus alakúak, 18 nm átmérıjőek, a pozitív, egyszálú 3 komponenső RNS genom, külön víruspartikulumban található meg (7. ábra). Az egyes RNS-ek 3’ végükön tRNS, az 5’
végükön „cap” struktúra található. Az RNS1 a vírusgenom elsı komponense. 3,6 kb nagyságú és az RNS replikációhoz szükséges poliproteint kódolja. Az RNS2 a vírusgenom második komponense 2,6 kb nagyságú. Az RNS3- a vírusgenom harmadik komponense 2 kb nagyságú.
Az itt található nyílt leolvasási szakasz a mozgási fehérjét kódolja, míg a 3b nyílt leovasási szakasz (ORF3b) egy szubgenomi RNS-en (sgRNS4) át kódolja a köpenyfehérjét (Vlot és mtsai, 2001). Gazdanövényköre rendkívül széles. A fertızött tıkék lombozata különbözı mintázatú sárga elszínezıdéseket mutat. A sárgulás nem terjed át az erekre, azok zöldek maradnak. A mozaikos foltok nyáron kifehéredhetnek, de nem maszkírozódnak. A kórokozó a Bromoviridae család, Alfamovirus nemzetségének típustagja. A vírus, oltással, mechanikailag, fertızött szaporítóanyaggal és levéltetvekkel terjed (Martelli, 1993).
A vírusbetegséget szılırıl elıször Németországban írták le Bercks és munkatársai (1973) majd hazánkban is megtalálták, és kezdték el vizsgálni (Lehoczky és Beczner, 1980, Beczner és Lehoczky, 1980). Fásszárú tesztnövényeinek köre széles, a szılıfajták közül a Vitis vinifera cv. Chardonnay, V. vinifera cv. Pinot noir és a Vitis rupestris cv. St. George használhatók kimutatására. Lágyszárú tesztnövényei: Chenopodium quinoa, Ch.
amaranticolor, Phaseolus vulgaris, Nicotiana tabacum és N. glutinosa (Beczner és Lehoczky, 1981).
Rövidítések: RNS1 - a vírusgenom elsı komponense, RNS2 - a vírusgenom második komponense, RNS3 - a vírusgenom harmadik komponense, 5’ cap- a vírusgenom 5’ vége „cap” struktúrával, ORF1a - elsı nyílt leolvasási szakasz, ORF2a - második nyílt leolvasási szakasz, ORF3b - harmadik nyílt leovasási szakasz „b”
része, ORF3a - a harmadik nyílt leolvasási szakasz „a” része, sgRNS4 CP - 4-es számú szubgenomi RNS-en át keletkezı köpenyfehérje, 3’ tRNS – a vírusgenom 3’ vége, amely egy „tRNS” struktúrával záródik
7. ábra. A lucerna mozaik virus (Alfalfa mosaic virus, AMV) genom szervezıdése 2.2.6. Szılı vonalas mintázottság
2.2.6.1. Grapevine line pattern virus - Szılı vonalas mintázottság vírus (GLPV)
A betegség kórokozójaként a Grapevine line pattern virus (GLPV) néven ismert, szerológiai tulajdonságai miatt a Bromoviridae család Ilarvirus nemzetségének feltételezett tagja. Elsıként Lehoczky és munkatársai (1987) számoltak be róla Magyarországon.
Multikomponenső, 24 nm átmérıjő, izometrikus vírus (Brunt és mtsai, 1996). A vírusbetegség csak Magyarországon fordul elı. A beteg levelek világos, juharfalevélre emlékeztetı mintázatot, szétszóródva pontokat vagy foltokat mutatnak.
Üvegházi, lágyszárú tesztelésre a Chenopodium quinoa, Ch. amaranticolor, Phaseolus vulgaris, Nicotiana glutinosa és Cucumis sativus lágyszárú tesztnövények alkalmazhatók.
Fásszárú indikátora a Vitis vinifera cv. Jubileum 75 (Lehoczky és mtsai, 1987).
A 2010-ben kiadott ICTV hivatalos vírus nevezék- és rendszertannal foglalkozó testület listáján valószínősíthetıen a kórokozó újabb elfordulása és molekuláris tulajdonságokról szóló adatok hiányában nem szerepel (Carstens, 2010).
2.2.7. Vírusszerő betegségek, még pontosan nem azonosított kórokozók
2.2.7.1. Szılı enáció
A betegség németországi elıfordulásáról elıször Buchenau 1891-ben számolt be (Martelli és Boudon-Padieu, 2006). Magyarországon Lehoczky (1965) írta le. A tünetek kései rügyfakadás, lassú növekedés, bokrosodás, és hosszanti vagy győrő alakú kinövések a vesszık alapjához közeli nyolc-tíz levél fonákán. Vektora nem ismert, fertızött szaporítóanyaggal terjed. Kimutatására egyetlen módszer az ’LN 33’ indikátorra történı oltás, bár eredményessége gyakran bizonytalan (Martelli, 1993).
2.2.7.2. Szılı érnekrózis
1973-ban Legin és Vuittenez találta meg és írta le elıször ezt a vírus jellegő megbetegedést Franciaországban (Martelli és Boudon-Padieu, 2006). Magyarországon Lehoczky és munkatársai (1986) jelezték elıfordulását. A kórokozó nem ismert, a betegség fertızött szaporítóanyaggal és oltással terjed. Fásszárú indikátora Vitis rupestris x Vitis berlandieri cv. 110 R. A tesztnövényen betegség tünetei, a levél fonákán jól látható levélerek nekrózisa. Elıször az idısebb leveleken jelenik meg, aztán a hajtás növekedésével a fiatalabbakra is átterjed. Ezzel egy idıben, nekrotikus pontok is megjelennek a levél színén.
Néhány esetben megfigyelhetı a kacs és a zöld hajtás elhalása is (Martelli, 1993). A növekedés teljes leállása is megfigyelhetı, és az indikátor ki is pusztulhat. Mechanikai átvitelre még nem ismert megfelelı lágyszárú tesztnövény (Martelli és Boudon-Padieu, 2006).
Bouyahia és munkatársainak (2005) közleményében a tünetek kialakulásában szerepet játszó kórokozóként a korábban már említett Grapevine rupestris stem pitting associated virus-t említi.
2.2.7.3. Szılı érmenti mozaik
1966-ban Vuittenez és munkatársai olyan mozaikos foltosságot találtak szılın, amely teljesen független volt a szılı vírusos leromlásától (Martelli és Boudon-Padieu, 2006). Ez volt az érmenti mozaikról szóló elsı leírás a világon. Magyarországon Lehoczky és mtsai (1984) írták le. A fertızött növények levelén halványzöld mozaikosság mutatkozik az elsı- és