Multiparametrikus MR vizsgálat prognosztikai és prediktív faktorokat meghatározó szerepe fej-nyaki tumoroknál,
valamint a kismedence főbb daganat csoportjaiban
Doktori értekezés
Dr Gődény Mária
Budapest
2015. december
TARTALOM
Rövidítések jegyzéke... 7
1. KÉPALKOTÓK SZEREPE DAGANATOS BETEGEKNÉL ... 10
Bevezető ... 10
Képalkotók feladatai ... 11
Képalkotó módszerek ... 11
Ultrahang (UH) ... 12
Komputertomográfia (CT) ... 12
Mágneses rezonancia vizsgálat (MRI)... 12
Funkcionális MRI mérések, molekuláris információt nyújtó MR technikák ... 14
Diffúzió súlyozott MRI (DW-MRI) ... 14
Multifázisos kontrasztanyagos MRI (M-DCE-MRI) ... 15
Perfúziós, dinamikus kontraszthalmozáson alapuló MRI (P-DCE-MRI) ... 15
MR spektroszkópiás képalkotás (MRSI) ... 16
Pozitronemissziós komputertomográfia (PET/CT) ... 17
Pozitronemissziós komputertomográfia-MR (PET/MR) ... 17
2. CÉLKITŰZÉSEK ... 18
3. FEJ-NYAKI DAGANATOK ... 20
Epidemiológiai adatok ... 20
A 7. TNM stádiumait meghatározó prognosztikai faktorok ... 20
Új terápiás stratégia, komplex onkoterápia ... 22
SAJÁT KUTATÁSUNK - Az indukciós kemoterápia (ICT) után alkalmazott chemo- radio-terápia (CRT) hatékonysága és toxicitása összehasonlítva a standard CRT-val ... 23
Képalkotó vizsgáló módszerek fej-nyaki daganatoknál ... 24
A hagyományos röntgen-vizsgálati módszerek ... 25
Ultrahang vizsgálat (UH) ... 25
Komputertomográfiás vizsgálat (CT) ... 25
SAJÁT ESET TANULMÁNY – Zygomaticus ívben elhelyezkedő ritka csont tumor - aneurysmás csontcysta (ACsC) - CT és MRI összehasonlító tanulmánya ... 26
Mágneses rezonancia vizsgálat (MRI)... 27
Funkcionális MRI mérések, molekuláris információt nyújtó MR technikák ... 29
Diffúzió-súlyozott MRI (DW-MRI) ... 29
Perfúziós, dinamikus kontraszthalmozáson alapuló MRI (P-DCE-MRI) ... 32
MR spektroszkópiás képalkotás (MRSI) ... 32
Pozitron-emissziós komputertomográfiás CT (PET/CT) ... 33
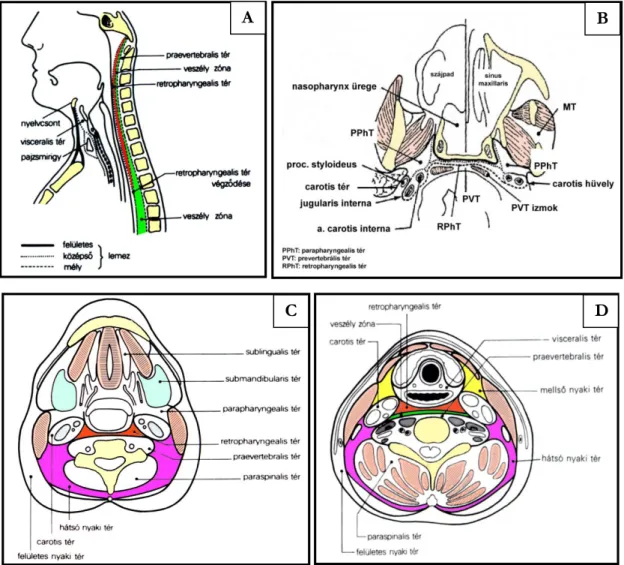
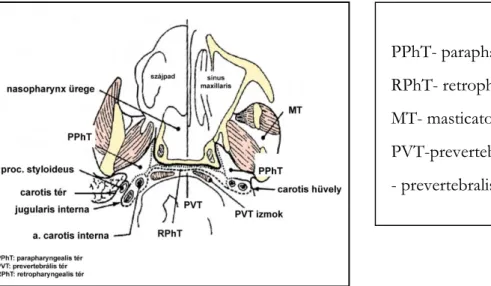
Tumor terjedés szempontjából fontos nyaki anatómia ... 34
Nyaki terek ... 35
A fej-nyaki régió rosszindulatú daganatainak képalkotása ... 37
Orr- melléküreg rosszindulatú daganatai ... 37
Orrgarat daganata (OG) ... 41
SAJÁT KUTATÁS - Az orrgarat daganatainak vizsgálata képalkotókkal, a daganat terjedésének meghatározása, a CT és az MRI szerepe ... 45
Betegek és az alkalmazott vizsgálati módszer ... 46
Eredmények ... 47
Megbeszélés ... 49
Megállapítások ... 54
SAJÁT KUTATÁS – Orrgarat (OG) - low-grade adenocarcinoma ... 54
SAJÁT KUTATÁS - Orrgarat (OG) carcinoma helyi kiújulásánál alkalmazott újabb sugárkezelés ... 55
Szájüregi carcinoma ... 57
Fontos szempontok előrehaladott „T” stádium értékelésekor ... 58
Szájgarat daganatai ... 60
Fontos szempontok előrehaladott “T” stádium értékelésekor ... 61
Algarat (AG) daganatai ... 62
Fontos szempontok előrehaladott “T” stádium értékelésekor ... 63
Gége tumorok ... 64
Fontos szempontok előrehaladott “T” stádium értékelésekor ... 65
Nyálmirigy daganatok ... 67
Pajzsmirigy malignus daganatai ... 69
SAJÁT KUTATÁS - Képalkotók szerepe örökletes pajzsmirigy rákban ... 71
SAJÁT KUTATÁS - Az angiográfia szerepe a medulláris pajzsmirigy carcinoma máj metasztázisainak kimutatásában ... 72
Metasztatikus nyirokcsomók ... 74
Nyirokcsomó drenázs útjai különböző daganat lokalizációkban ... 77
Képalkotók szerepe az N státusz meghatározásában ... 78
A fej-nyaki daganatok postterápiás státusának értékelése nem sebészi kezeléseknél ... 79
A diffúzió-súlyozott képalkotás szerepe a daganatok változásainak értékelésében, nem sebészi kezeléseknél ... 81
SAJÁT KUTATÁS - Neoadjuváns lokális immunbiológiai kezelés hatása szájüregi laphámráknál, multicentrikus fázis II klinikai vizsgálat ... 84
SAJÁT KUTATÁS - A dinamikus kontraszthalmozó MR paraméterek, biomarkerek értékelése fej-nyaki lézióknál, kemoradioterápia után, 3 Tesla MR berendezéssel ... 87
Betegek, alkalmazott vizsgálati módszerek ... 87
Eredmények ... 90
Megbeszélés ... 93
Megállapítások ... 97
Posztterápiás szövődmények ... 97
SAJÁT KUTATÁS - Radiogén myelopathia esete és szokatlan késői klinikai regressziója ... 99
Ismeretlen primer tumor ... 100
SAJÁT KUTATÁS - Ismeretlen primer tumor (IPT) képalkotói diagnosztikája, összehasonlítva a 3T MP-MRI és az FDG-PET/CT eredményeit ... 101
Betegek, alkalmazott vizsgálati módszerek ... 102
Eredmények ... 103
Megbeszélés ... 110
Megállapítások ... 112
Javasolt CT és MRI irányelvek fej-nyaki daganatoknál ... 112
Multidetektoros CT (MD-CT)... 112
Mágnesen Rezonanciás vizsgálat (MRI ≥1.5T)... 113
Javasolt multimodális onco-radio-diagnosztikus algorithmusok – fej-nyaki daganatoknál ... 115
Összefoglalás ... 122
4. NŐGYÓGYÁSZATI DAGANATOK ... 124
Képalkotók szerepe a nőgyógyászati daganatok vizsgálatában ... 124
Ultrahang (UH) vizsgálat ... 124
Komputertomográfiás (CT) vizsgálat ... 124
Mágneses rezonanciás vizsgálat (MRI) ... 125
Funkcionális MR mérések, molekuláris információt nyújtó MR technikák ... 125
DW-MRI ... 125
Multifázisos kontrasztanyagos MRI (M-DCE-MRI) ... 128
Perfúziós-dinamikus MRI (P-DCE-MRI) ... 128
Mágneses rezonancia spektroszkópiás vizsgálat (MRSI) ... 129
FDG-PET/CT ... 129
A PET/MR ... 130
Az MRI értékelése nőgyógyászati daganatoknál ... 130
Ovarium carcinoma (OC) ... 130
Cervix carcinoma (CC) ... 131
Endometrium carcinoma (EC) ... 134
SAJÁT KUTATÁS - A preoperatív MR vizsgálat pontosságának értékelése az endometrium carcinoma lokális stádiumának megítélésében ... 137
Betegek, alkalmazott vizsgálati módszerek ... 137
Eredmények ... 138
Megbeszélés ... 145
Megállapítások ... 147
Javasolt multimodális onko-radio-diagnosztikus algoritmusok endometrium carcinománál ... 148
5. RECTUM CARCINOMA ... 149
Epidemiológiai tényezők ... 149
Új tényezők a rectum carcinoma 7. TNM beosztásban ... 149
Új terápiás szemlélet ... 150
Képalkotó módszerek a rectum carcinoma vizsgálatára ... 151
A transrectalis UH (TRUH) ... 151
A multidetektoros CT (MDCT) ... 151
A Multiparametrikus MRI (MP-MRI) ... 151
Funkcionális MRI mérések, molekuláris információt nyújtó MR technikák ... 152
DW-MRI ... 152
A Perfúziós dinamikus kontrasztanyagos MRI (P-DCE-MRI) ... 152
A mágneses rezonancia spektroszkópiás vizsgálat (MRSI) ... 152
Az FDG-PET-CT ... 152
Rectum carcinoma tumor stádiumának meghatározása MRI-vel ... 154
Rectum carcinoma nyirokcsomó stádiumának meghatározása MRI-vel ... 156
Rectum carcinoma posztterápiás statusának felmérése MRI-vel... 157
Anus carcinoma (AC) ... 163
Epidemiológiai tényezők ... 163
Az anus anatómiája és az anus carcinoma terjedésének sajátosságai ... 163
Az anus carcinoma hisztológiája ... 164
Az anus carcinoma stádium meghatározása ... 165
Az anus tumorok kimutatása ... 166
Az anus carcinoma terápiája ... 166
Az anus carcinoma követése (Follow-up) ... 166
Képalkotók szerepe anus tumoroknál ... 167
Ultrahang vizsgálat (UH) szerepe... 167
Mágneses rezonancia vizsgálat (MRI) szerepe ... 167
SAJÁT KUTATÁS – MRI szerepe az anus carcinoma (AC) stádiumának meghatározásában és a terápia megválasztásában ... 168
Betegek, alkalmazott vizsgálati módszerek ... 168
Eredmények ... 169
Megbeszélés ... 174
Megállapítások………..177
Kutatás alapján kidolgozott új MRI irányelvek rectum carcinománál ... 177
6. ÖSSZEFOGLALÁS ... 180
7. ÚJ EREDMÉNYEK, MEGÁLLAPÍTÁSOK... 183 Irodalomjegyzék – hivatkozott
Dr. Gődény Mária közleményei és könyvfejezetei Köszönet nyilvánítás
Rövidítések jegyzéke 3T-MR 3Tesla térerejű MR készülék
5-FU 5-fluorouracil
AC anus carcinoma
ACC pontosság
ACT elülső nyaki tér
ACsC aneurysmás csontcysta ADC apparent diffusion coefficient
AG algarat
AIN analis intraepithelialis neoplasia AJCC American Joint Committee of Cancer APCRT all post chemoradiotherapy
AT anus tumor
BT buccalis tér
CAD computer assisted diagnosis
CC cervix carcinoma
CE-T1-FS kontrasztanyagos T1-súlyozott zsírelnyomással készült MR kép CEA carcino-embrionalis antigén
CRM circumferenciás rezekciós margin
CRT chemo-radio-terápia
CT carotis tér
CT komputertomográfia
DW-MRI diffúzió súlyozott MR képalkotás
e-ADC exponential Apparent Diffusion Coefficient
EC endometrium carcinoma
EGFR epidermalis növekedési faktor receptor
EPCRT kemoterápia utáni korai státus (early post chemoradiotherapy) ESMO European Society for Medical Oncology
ESUR European Society of Urogenital Radiology
F+ false positive
F- false negative
FDG-PET/CT [18F] fluorodeoxyglucose PET/CT
FMPC familiáris medullaris pajzsmirigy carcinoma FOI fissura orbitalis inferior
FOV field of view
FPP fissura pterygopalatina
FR foramen rotundum
FSPGR fast spoiled gradiens echo sequentia Gy az irradiáció dózis egysége
1H-MRS hidrogén spektroszkópia
HIV emberi immunhiány vírusa
HPV humán papilloma vírus
HR-MR nagy felbontású MR (High Resolution MRI) HSV herpes simplex vírus
I gyulladás (inflammation)
ICT indukciós kemoterápia
LI leukocyta interleukin injekció IMRT intenzitás modulált radioterápiával
IPT ismeretlen primér tumor
IU nemzetközi egység
IV. intravénás
IVIM-DWI intravoxel incohaerent motion diffusion-weighted imaging
KRAS gén
Ktrans kapilláris permeábilitás mértéke
LPCRT kemoterápia utáni késői státus (late post chemoradiotherapy) LRTC locoregionális tumor control
LTC localis tumor control
M-DCE-MRI multifázisos kontrasztanyagos MR képalkotás
MACRT kemoterápia utáni malignus elváltozás (malignant after chemoradiotherapy)
MDCT multidetektoros CT
MIBG Meta-131J-Iodobenzylguanidine MP-MRI multiparametrikus MR képalkotás MPC medullaris pajzsmirigy carcinoma MRI mágneses rezonanciás képalkotás MRSI MR spektroszkópiás képalkotás
MS masticator tér
MSCT multi-slice spirál CT
Nex number of excitations
NHL Non Hodgkin Lymphoma
NM új malignus elváltozás (new malignant)
NphCA nasopharynx carcinoma
NPV negatív prediktív érték
NYCS nyirokcsomó
OC ovarium carcinoma
OG orrgarat
OOI Országos Onkológiai Intézet OS teljes túlélés (overall survival)
31P-MRS foszfor spektroszkópia
P-DCE-MRI perfúziós, dinamikus kontraszthalmozáson alapuló MR képalkotás PACS picture archiving and communication system
PCT hátsó nyaki tér
PET/CT pozitronemissziós komputertomográfia
PET/MR pozitronemissziós komputertomográfia-MR képalkotás PMT pharynx nyálkahártya tér (pharyngeal mucosal space)
PPT parapharyngealis tér
PS parotis tér
PVT perivertebralis tér
RECIST Response Evaluation Criteria In Solid Tumors
RME a kontraszthalmozás maximuma (relative maximum enhancement) ROI mérésre kiválasztott régió (region of interest)
RND radical neck dissection RPhS retropharyngealis tér
RTG röntgen
RWO a kontrasztanyag kimosódásának mértéke (relative wash-out)
SC sinus cavernosus
SCC squamous cell carcinoma
SHN nyelvcsont feletti régió SIend jelintenzitás a mérés végén SImax jelintenzitás maximum
SND szelektív nyaki nyirokcsomó disszekció (selective neck dissection)
SP specificitás
SPECT single photon emission CT STD sexually transmitted disease
STIR zsírelnyomásos MR szekvencia (short tau inversion recovery) SUV standardized uptake value
SV szenzitivitás
szsz. szükség szerint
T+ true positive
T- true negative
T2-w T2-súlyozott
TAH+BSO abdominalis hysterectomia (TAH) és kétoldali adnexectomia (BSO) TAUH transanalis ultrahang
TE echo idő
TEM transanalis endoscopos mucosectomia TIC átlag jelintenzitást szemléltető görbe TME totális mesorectalis excisio
TNM tumor stádium beosztás
TPV teljes prediktív érték
TR repetíciós idő
TRUH transrectalis ultrahang vizsgálat
TTP az idő, ami alatt a kontraszthalmozás maximuma létrejött (time to peak)
UH ultrahang vizsgálat
UICC International Union Against Cancer
UKCCR Egyesült Királyságban a Rákkutatást Koordináló Tanács USPIO RES specifikus MR kontrasztanyag (ultra-small-part-iron-oxid)
VS visceralis tér
VZ veszély zóna
wash-in kontrasztanyag beáramlás wash-out kontrasztanyag kimosódás
yT terápia utáni tumor stádium
MEGJEGYZÉS:
Az axiális és coronális síkú rétegeken a kép betűjelének helye mutatja a JOBB oldalt
1. KÉPALKOTÓK SZEREPE DAGANATOS BETEGEKNÉL Bevezető
A rák nemcsak Magyarországon, de a világ többi országában is népbetegség, társadalmi és nemzetgazdasági terheinek csökkentése közös érdekünk. Magyarországon évente 65 ezer körüli az újonnan regisztrált daganatos megbetegedések száma és 2011-ben több mint 33 ezren haltak meg rákos betegségben. (Molnár 2012)
Az aktív életszakasz meghosszabbítása, az életminőség és munkaképesség javítása, és nem utolsó sorban a daganatos megbetegedések halálozásának csökkentése az egyén érdekén túl társadalmi és népgazdasági jelentőséggel bír. A korszerű, számos esetben komplexen alkalmazott terápia jelentősen javítja a beteg élet esélyeit. A korszerű terápia korszerű diagnosztikát igényel, a betegség korai felismerése mellett a betegség mindenkori stádiumának pontos felmérését, a terápia hatékonyságának követését. (Kásler 2005, 2008, 2008, 2011)
A radiodiagnosztika utóbbi években ugrásszerűen megnőtt klinikai jelentősége egyrészt a rákbetegség incidenciájának növekedésével függ össze, másrészt a terápiás módszerek változásával, a komplex terápia és azon belül az agresszív kemoterápia alkalmazásával, ami képalkotó módszerek kontrollja mellett történik. (Gődény 2009 IME, 2012 IME)
Az onco-radio-diagnosztika a radiológián belül speciális terület, egyre nagyobb a társadalmi jelentősége, az onkológiai diagnosztikus és terápiás algoritmus minden fázisában részt vesz. (Gődény 2004 Magy. Onk.) A képalkotó diagnosztika gyors, dinamikus fejlődése alatt alkalmazkodnia kell a kutatások eredményeihez, a daganat stádium beosztás változáshoz, melyek megváltoztatják a terápia menetét. (Gődény 2004 Magyar Onk., Kórház Szaklap, Magy.
Rad., 2005 Magyar Tudomány)
Fontos, hogy ismerjük a változások logikáját, a stádium meghatározó szisztéma szempontjait az átlagos és az átlagtól eltérő daganatokat is. A tumor kiterjedés jelenősége anatómiai régióként és szövettani típusonként más és más. Bizonyos tumor típusoknál, pl.: malignus lymphomáknál az anatómiai kiterjedést speciális szempontok szerint értékeljük, máshogyan, mint a többi tumornál. Az anatómiai kiterjedés mellett a hisztológiai osztályozás és a szövettani grading szintén fontos prognosztikai meghatározók a betegség stádiumában, befolyásolják a választandó kezelést, így a vizsgálatra alkalmas diagnosztikus módszert is.
(Bragg 2002, Rubin 2001, Gődény 2011 Medicina, Az onkológia alapjai tankönyvben)
Az onko-radio-diagnosztikával foglalkozó radiológusnak tájékozottnak kell lenni az epidemiológiában, ismerettel kell rendelkeznie a tumor patogenezisében, hisztológiájában. Annak érdekében, hogy a megfelelő vizsgálati módszert válassza ki, megfelelő klinikai információval is rendelkeznie kell. Csak ezen ismeretek birtokában lehet helyesen kijelölni a vizsgálandó régiót, meghatározni a célravezető metodikát és a vizsgálati paramétereket. Standard protokollokra, standard minőségre, megfelelő tudásra, állandó képzésre és a szakemberek együttműködésére van szükség ahhoz, hogy a képalkotói diagnosztika a megfelelő terápia kiválasztását segítse.
Képalkotók feladatai
A képalkotó vizsgáló módszerek tumor morfológiai prognosztikai faktorokat határoznak meg, a tumor méretét, a tumoros invázió mélységét a környező szövetek érintettségét, a nyirokcsomók állapotát és a távoli metasztázisokat.
A daganat diagnosztika első lépése a tumor detektálása és a diagnózis fölállítása. Stádium meghatározáskor a primer tumort és környezetét (T) analizáljuk, a regionális nyirokcsomóáttétek (N) régióit vizsgáljuk és a távoli áttétek (M) kimutatására törekszünk.
A terápia hatékonyságának értékelésekor a daganat térfogatának, keringésének, sejt tartalmának, anyagcseréjének változását kell terápiás válaszként értékelnünk. A rákbetegség kezelésének követése a radiológia egyik legdinamikusabban fejlődő területe. (Eckhardt 2003, Rubovszky 2013) Olyan módszerekre van szükség amely, fel tudja mérni a terápia hatékonyságát abból a célból, hogy a nem kielégítő terápiát minél hamarabb meg lehessen változtatni. A terápia utáni státust rögzítő vizsgálat jelenti az alapot a követéses vizsgálatok értékeléséhez. A diagnosztika feladata, hogy kövesse a betegséget (follow-up vizsgálat), a terápia utáni státust a valóságnak megfelelően értékelje, a tumor reziduumot a posztterápiás maradványtól elkülönítse. Feladata az is, hogy minél korábban kimutassa a recidív daganatot és újabb stádiumot (restaging) határozzon meg. (Gődény 1995, Bragg 2002, Husband 2009, Rubin 2001, Gődény 1996, 2001 Gyógyforrás, 2002, 2004 Háziorvos, 2004 Kórház Szaklap, 2004 Magy. Onk. 2007 Lit. Med., 2009, 2011 Medicina Az onkológia alapjai, 2012 IME) KÉPALKOTÓ MÓDSZEREK
A technika fejlődésével a daganat képalkotói diagnosztikája nagy fejlődésen ment át a terápiájukhoz hasonlóan. A digitális képalkotó módszerek közül a komputertomográfia (CT), ultrahang-(UH), mágneses rezonanciás-vizsgálat (MRI) és a pozitron emissziós tomográfia- CT (PET/CT) hatalmas lehetőségek az onkológiai diagnosztikus és terápiás algoritmus minden fázisában. (Gődény 2001 Akadémia Kiadó, Gődény 2002 Medicina, Husband 2009, Gődény 2001 LAM., 2002, 2005 Magyar Tudomány, 2011 Medicina Az onkológia alapjai tankönyvben) A hagyományos röntgenvizsgálatok (RTG) jelentősége a nagy digitális réteg képalkotók birtokában csökkent. A képek digitális kiértékelése, archiválása, elektronikus továbbítása a digitális konzultáció lehetőségei tovább szélesítik az onkológiai diagnosztika lehetőségeit. A fejlődés az ún. film nélküli radiológia felé vezet (PACS, Picture Archiving and Communication System). Komputeres értékelő programok, ún. CAD (Computer Assisted Diagnosis) módszerek segítik a vizsgálatok értékelését, pl. emlő-, tüdőgócok, vastagbél polypok megtalálását. (Gődény 2011 Medicina Az onkológia alapjai tankönyvben)
Az anatómiai képalkotó módszerek (RTG, angiográfia, UH, CT, MRI) jobbára csak előrehaladott tumoros folyamatot tudnak sokszor detektálni. Az angiográfia szerepe megváltozott, diagnosztikus feladata csökkent, terápiás alkalmazása (katéteres kemoperfúzió, kemoembolizáció, sztentek behelyezése) egyre gyakoribb. Az anatómiai képalkotók lehetőséget adnak arra, hogy vezérlésükkel a kérdéses elváltozásból mintavételt végezzünk.
(Bak 2013) A mintavétel történhet aspirációval cytológiára vagy szövethenger (core) biopsziával hisztológiára. A funkcionális képalkotó módszerek (izotóp, Single Photon Emission CT=SPECT, PET/CT, MR-spektroszkópia, Dynamikus-MRI, Diffúziós-MRI, stb.) a metabolikus elváltozások molekuláris szinten zajló biokémiai folyamatainak
megjelenítését teszik lehetővé. A jövőbe tekintve, új lépésként az orvosi képalkotó módszerek az in vitro megközelítésről áttérnek az in vivo képalkotásra. A közeljövőben a molekuláris és mikroszkopikus képalkotók feladata lesz a daganatok individuális folyamatainak ábrázolása.
A funkcionális, molekuláris képalkotói technikák (főleg az MRI funkcionális mérései és a PET/CT a különböző szövet specifikus radiofarmakonokkal) klinikai validálása és rutinba állítása napjaink kutatásának legforróbb témái közé tartozik. (Husband 2009, Gődény 2011 Medicina Az onkológia alapjai tankönyvben, 2013 Zafir Press, 2014 Magy. Onk. Bidlek 2015, Jederán 2015)
Ultrahang (UH)
Az UH számos szerv daganatos elváltozásának felismerésében az első vizsgáló módszer és sok esetben a folyamat rendszeres, rutin ellenőrzésére is alkalmas. Csaknem minden szervünk vizsgálható UH-val, kivéve a csont és a légtartó tüdő. Az UH közismert előnye, hogy nem- ionizáló sugárzással dolgozik, akárcsak az MRI, korlátja, hogy kevéssé standardizálható, mint a CT vagy az MRI, valamint nem ad átfogóan dokumentálható képet. (Gődény-Harkányi 2011 Medicina Az onkológia alapjai tankönyvben)
Komputertomográfia (CT)
Az eljárás alapvetően új térbeli szemléletet hozott a radiológiába és új anatómiai tájékozódást is igényel. (Hopper 2000, Gődény 1995, 2002, 2011 Medicina Az onkológia alapjai tankönyvben) A korszerű berendezés multi-detektoros-, vagy multi-slice spirál CT (MDCT, MSCT, 4, 6, 8, 10, 16, 64 vagy még több detektorsoros). Ezek a másodperc töredéke alatt készítenek szeleteket (egyszerre négyet, nyolcat, tizenhatot, stb.). A nagymennyiségű, térfogatban gyűjtött homogén adathalmazból kitűnő minőségű, tetszőleges síkú akár 0,5 -1 mm vastagságú képrekonstrukciók is készíthetők, ezáltal az anatómiai felbontás, valamint a térbeli ábrázolás feltételei kiválóak. A CT annak ellenére, hogy biológiailag negatív (ionizáló röntgensugár) sugárzás abszorpcióján alapszik, jelen képalkotók között a legjobb tulajdonságokat egyesíti magában: gyors időbeli, kiváló térbeli és jó lágyrész felbontása kitűnő képalkotást biztosít, standard módon, mindezt a beteg számára kevéssé megterhelően nyújtja.
A CT-vizsgálat az onkológiában új karrierjét a PET berendezésekkel együtt futja napjainkban.
(Borbély 2011, 2014)
Mágneses rezonancia vizsgálat (MRI)
Az MRI lágyrész-felbontása kontrasztanyag alkalmazása nélkül is jobb, mint a CT-é, multiplanáris képalkotása pedig a módszer további, vitathatatlan előnye. Az MRI lágyrész- felbontó képességét a paramagnetikus kontrasztanyagok alkalmazása tovább növelte.
Ionizáló sugárzás nélküli vizsgálat, mely ismereteink szerint nem jelent a szervezetre káros biológiai hatást.
Az MR kép a hidrogén atomok vizsgálatán alapszik, a szövetekben lévő hidrogén atomok megoszlásáról és kötöttségi állapotáról ad tájékoztatást. A protonok gerjesztése és a mágneses rezonanciás jel mérése sokféleképpen történhet, a különböző mérési módok (szekvenciák) értékelésekor szöveti jellemzők határozhatók meg. Az MRI azokban az esetekben is hasznos,
amikor a CT vizsgálat kontraszt-érzékenység miatt nem végezhető el. Az MRI jelintenzitás az elváltozás sejt, víz, fehérje, fém, mésztartalmától, viszkozitásától, valamint vaszkularizációtól függ. Bár az esetek többségében szövettani pontosságú meghatározásra az MR sem alkalmas, vannak olyan jellegzetes MR morfológiai jelek, melyekkel az elváltozás jóindulatúságáról, vagy rosszindulatúságáról vélemény mondható. (Husband 2009, Gődény 1995, 2001 LAM, 2002, 2004 Magy. Onk., 2005, 2011 Medicina Az onkológia alapjai tankönyvben, Gődény 2011 Medicina online Gődény 2012 Orv. Hetilap, Horváth-Gődény 2012 Zafir Press, Gődény 2013 Zafir Press, Gődény 2015 Medicina)
Az MR technika nyújtja a legszélesebb platformot, ahol ugyanazon a készüléken ionizáló sugárzás nélkül, egyszerre többféle mérésmód alkalmazásával a kiváló anatómiai felbontás mellett szöveti analízis is végezhető, és a tumor eredetére, összetételére, vonatkozó biológiai folyamatok mérhetők, akár kontrasztanyag adása nélkül is. (Láng-Gődény 2003, Sala 2013, Brocker 2011, Kotlán-Gődény 2015)
A daganatok MR vizsgálatára magas térerejű berendezés szükséges (≥1,5 Tesla), szigorúan meghatározott technikai feltételek mellett alkalmazva. A magas mágneses térerő javítja a jel- zaj viszonyt, ezáltal a térbeli felbontást is, valamint csökkenti a vizsgálati időt. (Gődény 2014 Cancer Imag., Magy. Onk., Léránt-Gődény 2015, Horváth-Gődény 2015, Jederán-Gődény 2015, Bidlek- Gődény 2015)
A 3-T alkalmazásakor a magas térerőnek hátránya, hogy növekszik a mágnességből adódó műtermékek száma, ami a vizsgálat pontosságát csökkenti. A folyamatos hardware és software fejlesztések, a felbontást növelő antennák (sok csatornás tekercsek) és a parallel képalkotó technika tovább javítja a képminőséget.
A kiváló morfológiát nyújtó konvencionális szekvenciák mellett új, speciális MR mérésmódokat is alkalmazhatunk, melyek funkcionális, molekuláris információval szolgálnak, valamint a szövet specifikus kontrasztanyagok (pl. hepatocyta-, RES specifikus) alkalmazásával a vizsgálat diagnosztikus pontossága javítható. (Láng-Gődény 2003, Gődény 2011 Medicina Az onkológia alapjai tankönyvben, 2012 Orv. Het., 2013 Magy. Onk., 2013 Zafir Press, 2013 Cancer Imag., Magy. Onk., Jederán-Gődény 2015, Horváth-Gődény 2015, Bidlek-Gődény 2015)
A több mérésen alapuló multiparametrikus MRI (MP-MRI) fontos prognosztikai faktorokat határoz meg, a tumor stádiumát, valamint térképet ad a sebésznek, sugárterapeutának, tájékoztat a kezelés hatékonyságáról és segítségével pontosítani lehet a mintavétel helyét is. (Horváth-Gődény 2015, Jederán-Gődény 2015, Gődény 2014 Magy. Onk.) Az MR korlátja, hogy a korszerű CT-hez viszonyítva a vizsgálati idő hosszabb, a módszer költségesebb, ezáltal nehezebben hozzáférhető és a betegek egy része nehezen viseli el a CT- nél zártabb vizsgálati alagutat. Egyes, a testbe épített mágnesezhető fémek (pl. pacemaker, agyi aneurysma clip, cochlealis implantátum és régi típusú szívbillentyű, stb.) a vizsgálatot kontraindikálhatják és számolnunk kell a fém zavaró műtermékével is.
A magasabb mágneses térerő fokozott veszélyt jelenthet azoknál a betegeknél, akiknek fém van a szervezetükben.
Funkcionális MRI mérések, molekuláris információt nyújtó MR technikák Diffúzió súlyozott MRI (DW-MRI)
DW-MRI képalkotás a vizsgálandó szövetben a vízmolekulák random diffúziós mozgását vizsgálja és alkalmas arra, hogy noninvazív módon az élő szövetekben zajló vízmolekulák mozgásának mértékéről tájékoztasson a mágneses mező gradiensek alkalmazásával. A sejt szinten zajló mikrostruktúrális elváltozások módosítják a vízmolekulák mozgását (1. ábra), ez a diffúziós képeken normálistól eltérő jelintenzitással mutatkozik. (Thoeny 2010, 2012, Gődény 2014, Bidlek-Gődény 2015, Jederán-Gődény 2015, Horváth-Gődény 2015).
Az emberi test szöveteiben a vízmolekulák mozgása környezetük által befolyásolt, a sejtmembránok és makromolekulák által korlátozott. Minél sejtdúsabb egy szövet annál korlátozottabb a vízmolekulák mozgása, ezzel szemben minél sejtszegényebb a szövet vagy, ha a sejteket elhatároló sejtmembránok integritása sérült, annál szabadabban mozoghatnak a vízmolekulák. A daganatok kimutatása a sejtsűrűségen, differenciáldiagnosztikájuk a hypercellularitás különbözőségén alapszik.
A DW-MRI mérés eredendően T2-súlyozott szekvencia, melyet az MR gradiens a diffúzió kimutatására érzékenyített. Daganatoknál a diffúzió súlyozott rétegeket axiális síkokban, echoplanáris szekvenciákkal, parallel képalkotás alkalmazásával készítjük.
1. ábra A vízmolekula mozgásának lehetőségei különböző szöveti környezetben A diffúzió mérésére számos modellt ajánlanak, és számos méréssel kísérleteznek. Az Apparent Diffusion Coefficient (ADC) kvantitatív paraméter, biomarker, mely a szövetek víz-diffúzióját méri, a diffúziógátlás mértékét 10-3 mm2/sec egységben fejezi ki. A mérés szenzitivitását a szekvencia diffúzió súlyozottságának mértékét az alkalmazott „b” érték fejezi ki, ez az MR gradiens bizonyos faktoraitól függ, mely a gradiens időtartamára és amplitúdójára vonatkozik. Amennyiben minimum két b-értéket (rendszerint b=0 vagy 50 és b = 800 vagy 1000 s/mm2) használunk, a diffúzió gátlás által okozott jelintenzitás változást kvantitatívan mérni lehet. A környező szövetekhez viszonyított magas jelintenzitás a magas b-értékű képeken és annak csökkent ADC értéke gátolt diffúzióra utal, melyet a tumor magas cellularitása eredményez.
A DW-MRI értékelése egyrészt kvalitatív módon, a képeken látható jelintenzitás elemzésével, másrészt kvantitatív módon, az ADC mérések (Apparent Diffusion Coefficient) kiszámításával történik. A módszerrel nyert adat jellegzetes lehet az elváltozás tumoros vagy nem tumoros eredetére. A malignitásra típusos lézió a magas b-értékkel készült DW rétegen magas jelintenzitású és a hozzá tartozó, kalkulált ADC kép a hypercelluláris lézió által okozott gátolt diffúzió miatt alacsony jelintenzitású. A DW-MRI fontos kiegészítő információval szolgál a stádium meghatározásához, és nagyon hasznos lehet a chemo-radio-terápia (CRT)
utáni posztterápiás reziduum és a daganat reziduum ill. recidíva elkülönítésében, valamint a terápia hatékonyságának vizsgálatában is.
Nehézséget jelent, hogy nincs olyan daganat, melynél meghatározható lenne az az ADC határérték, melynek alapján a malignitás pontosan kimondható. Kérdéses, hogy az ADC érték szolgálhat-e biomarkerként a tumor malignitás fokának, agresszivitásának meghatározásában.
(Thoeny 2010, 2012)
Csapdát jelent az ADC értékek átfedése miatt a magas cellularitású normál szövetek-, a benignus tumorok diffúzió gátlása, a rosszul differenciált, nekrotikus daganatok, a jól differenciált rákok értékelése. (Sala 2013) A pontos tájékozódáshoz segítséget nyújt a magas (>1000s/mm2) b-érték alkalmazása és a kontrasztanyagos, valamint T2-súlyozott képekkel való összevetés (Thoeny 2010, 2012, Sala 2013, Levy 2011), azaz a MP-MRI komplex értékelése.
A csapdák és nehézségek ellenére a diffúzió súlyozott képalkotás az MP-MRI egyik fontos mérésmódja, rutinszerű alkalmazása javasolt. Alapvető fontosságú, hogy az értékelésben a DW-MRI képeket a morfológiai képekkel mindig összevessük, és komplex módon értékeljük A teljes test diffúzió súlyozott MRI (WB-DWI-MRI) kiváló korrelációt mutat az FDG- PET/CT-vel a távoli metasztázisok meghatározásában. Összehasonlítva a CT-vel, magas pontosságú a primer tumor karakterizálásában és szóródásának kimutatásában is.
Retroperitoneális nyirokcsomó metasztázis kimutatására a DW-MRI és az FDG-PET-CT pontossága egyaránt 87%, a CT-é 71%. (Michielsen 2014) A módszer rutinszerű alkalmazását a megnyúlt vizsgálati idő nehezíti.
Multifázisos kontrasztanyagos MRI (M-DCE-MRI)
A többfázisú kontrasztanyagos MR vizsgálat során, mely nem tévesztendő össze a perfúziós kontrasztos vizsgálattal, az eltérő halmozású fázisok miatt a tumorok jobban elkülöníthetők a környezetüktől és a különböző vaszkularizációjuk miatt differenciál diagnosztikai előnyökhöz is juthatunk. A vizsgálatkor 3D gradiens echo T1-súlyozott sorozatokat készítünk, az első mérés natív, majd a kontrasztanyag intravénás alkalmazása után 1 percen belül, majd 2, 3 és 5 perc elteltével készülnek a mérések. A korai kontrasztos fázisban látszanak legjobban a hypervascularisált tumorok, a későbbi sorozatokon a máj áttétek nagy része, az apró, peritonealis, serosán lévő áttétek különíthetők el jól. (Gődény 2011 Medicina, 2013 Zafir Press, 2015 Medicina, Horváth 2014, 2015)
Perfúziós, dinamikus kontraszthalmozáson alapuló MRI (P-DCE-MRI)
A perfusiós-dinamikus MRI vizsgálat alkalmával az intravénásan alkalmazott gadolinium- kelát paramágneses kontrasztanyag által okozott jelintenzitás növekedést az idő függvényében vizsgáljuk, és jellegzetes farmakokinetikus adatokat nyerhetünk, azáltal, hogy a tumoros erek áteresztőképessége eltér a normális erekétől. A P-DCE-MRI alkalmával készített T1-súlyozott mérésekkel az extravascularis, extracellularis tér értékelése történik, a kontrasztanyag által létrehozott jelintenzitás változást lehet analizálni, mely az elváltozás erezettségéről, az erek permeábilitásáról, a patológiás erezettség terápia hatására bekövetkezett változásáról informál. A T2* mérés alkalmazásakor a képek a szöveti perfúzióról és a vér volumenről tájékoztatnak.
A kontrasztanyag daganaton belüli halmozódásának és kimosódásának üteme a daganat aktuális vaszkularizációjára jellemző biomarker, mely kvalitatív, szemikvantitatív és kvantitatív módon elemezhető. A kvalitative elemzéskor a kontrasztanyag halmozódásának mértékét a T1-súlyozott rétegeken a jelintenzitás fokozódásával, homogenitásával illetve inhomogenitásával jellemezzük.
A mérésmódok gyorsulásával a kontrasztanyag eloszlás dinamikus megítélése javul és az információgyűjtés egyre jobb térbeli-, kontraszt- és időbeli felbontás mellett válik lehetővé.
Az idő-intenzitás görbét T1-súlyozott gyors gradiens echo mérésekkel készítjük, szemikvantitatív módon analizáljuk. A néhány másodperces mérések sora több percen át, 80- 100 dinamikus fázisban, egyenként kb. 20 szelettel történik, a vizsgálat időfelbontása pusztán néhány másodperc. (Léránt-Gődény 2015) A kontrasztanyag halmozás mértéke és időbeli lefutása több paraméter szerint értékelhető és ez alapján az elváltozás karakterizálható. A mérésre kiválasztott régióban (region of interest: ROI) leggyakrabban a kontraszthalmozás maximumát (relative maximum enhancement: RME), valamint azt az időt, ami alatt a halmozás maximuma létrejött (time to peak: TTP), és a kontrasztanyag kimosódásának mértékét (relative wash-out: RWO, a görbe alatti területet jelenti) analizáljuk. (Furukawa 2013, Lodder 2012, Chikui 2011, Bisdas 2010, Léránt-Gődény 2015)
A malignus daganatok rapid wash-in és wash-out jelenséget mutatnak kontrasztanyag alkalmazásakor, de a nekrotikus daganatok hypoxiásak, a rossz perfúzió miatt a kontrasztanyagot nem halmozzák.
A T1 relaxáció változásából kvantitative kinetikai paraméterek is nyerhetők, melyet a kontrasztanyag koncentráció időbeli változásából számíthatunk, matematikailag illesztett farmakodinamikai modellek segítségével. A legismertebb farmakodinamikai modell a Tofts- Ketty féle modell. (Tofts 1999)
A perfúziós MRI egyik indikációja a kemoterápiás kezelés hatékonyságának mérése lehet, hatékony terápia esetén a tumor véráramlásának változása már a daganat méretének csökkenése előtt felismerhető. A kutatások arra is utalnak, hogy a P-DCE-MR ígéretes módszer a terápia utáni reziduális tumor vagy recidíva vizsgálatára is. (Gődény 2013 Zafir Press, 2014 Magy. Onk., Metcalfe 2013, Chikui 2012, Léránt-Gődény 2015)
MR spektroszkópiás képalkotás (MRSI)
A mágneses rezonancia spektroszkópiás képalkotás (MRSI) a szövetek metabolizmusáról olyan biokémiai információt nyújt, mely a daganatokra jellemző metabolikus biomarkereket kvantitatíve méri és a szövetek molekuláris összetételét in vivo, noninvazív módon értékeli.
A kis molekulasúlyú metabolitok (cholin, kreatinin, laktát, stb.) meghatározásával a sejtfunkciós folyamatok végtermékét vizsgálja, mely az adott fehérje enzimatikus működését kvantitatívan jellemzi. (Metcalfe 2013) Leggyakrabban a hidrogén spektroszkópiát (1H-MRS) használjuk, de a foszfor, fluor és a szén spektroszkópiás vizsgálata is a kutatások tárgyát képezi. (Bisdas 2007, King 2004, King 2005, King 2010)
Az MRI és az MRS között az a fő különbség, hogy az MRI térbeli felbontása a víz proton- jelének eloszlásán alapszik és anatómiai információval szolgál, ezzel ellentétben az 1H-MRS elnyomja a víz jelét azért, hogy kémiai információt nyerjen az alacsony koncentrációban lévő is. Az MRSI adatait rendszerint vonalas spektrumként analizáljuk. A proton spektroszkópia (1H-MRS) a cholin szint kimutatásán alapszik, mivel annak emelkedése a sejtmembrán
pusztulás biomarkere. (Razek 2013) A cholin a sejtmembrán alapvető alkotó része, szintje a sejtmembrán integritásának, megújulásának függvénye, így változik apoptosis, necrosis során.
Kutatások folynak a sugárterápia hatékonyságának MRSI-vel történő korai meghatározására, az ionizáló sugárzás által okozott cytotoxicitás kimutatására agresszív tumorok esetén, például az anaplasztikus pajzsmirigy carcinománál. Az ionizáló sugárzás által okozott cytotoxicitás magas térbeli és időbeli felbontást nyújtó MRSI-vel real time vizsgálható.
(Sandulache 2014)
Számos kutatás bizonyítja, hogy a tumor szövet hypoxia fontos szerepet játszik a szolid tumorok sugárkezelésre adott válaszreakciójában és lehetséges, hogy a kemoterápia hatékonyságát is befolyásolja. Az eredmények azt mutatják, hogy a tumor oxigenizációjának mérésével előre meghatározható lenne, hogyan reagál a daganat a sugárkezelésre. A tumor oxigenizációjának mérése nehéz feladatot jelent, számos metodikával kísérleteznek: laser, doppler, flow metriával, oxigénelektróda mérésekkel, stb. A foszfor spektroszkópia (31P- MRS) a hypoxia mérésének noninvazív alternatívája, a foszfor és a béta-ATP arányával in vivo méri a tumor oxigén státuszát. A 31P-MRS a terápiás hatás prediktálására is alkalmas lehet. Továbbá a daganat aciditása is mérhető, mely alapján a daganat oxigenizációja megbecsülhető. Protonspektroszkópiával a tejsav kimutatása a hypoxia jele. A tejsav az anaerob glikolízis végproduktuma, rossz vérellátású, hypoxiás daganatokban koncentrációja megemelkedik, egészséges szövetekben nem mutatható ki. (Adalsteinsson 1998)
MR képalkotás új metodikái szinte kivétel nélkül az agyi vizsgálatokban kerülnek bevezetésre, mivel a koponya jól rögzíthető, mozgási műtermék nem akadályozza az értékelést.
Napjainkban az MRSI az agydaganatok metabolikus elemzésére a rutin diagnosztika részévé vált. Az extracranialis daganatok diagnosztikájában az MRSI alkalmazását elősegíti a 3T-MR készülékek elterjedése, és ezen vizsgálatok klinikai validálása most folyik.
A fent leír kutatási eredmények ellenére megállapítható, hogy bár az MRSI segít a normál és a daganatos szövet elkülönítésében, de a malignus és a benignus régió differenciálásában napjainkban még korlátokkal rendelkezik.
Pozitronemissziós komputertomográfia (PET/CT)
A PET anyagcsere folyamatokban résztvevő farmakonokat jelöl izotóppal (például cukor-, aminosav-anyagcsere stb.). A PET magas szenzitivitású és specificitású funkcionális képalkotó módszer, a radiofarmakon a megnövekedett anyagcseréjű tumor szövetbe fokozottan épül be. Leggyakrabban a glükóz anyagcserét vizsgáljuk, és glükóz analóg farmakont (2-fluoro-2-deoxy-D-glucose – FDG) használunk.
A PET és a CT software és hardware fúziója (PET/CT) a metabolikus eltéréseket kiváló anatómiai megjelenítéssel társítják, ezzel az anyagcsere folyamatok jelzésére alkalmas radiofarmakon a CT és az MR „szövet specifikus felbontását” javítja. A PET/CT érzékeny módszer számos daganat megtalálásában, a terápia hatékonyságának mérésében, a metasztázis, recidív tumor kimutatásában. Fontos szerepet játszik a kezelés után kialakult hegesedés, a recidíva elkülönítésében és a besugárzás tervezésben is. (Borbély 2011, 2014, Lővey 2007 Magyar Onkológia 51/4, Magyíar Onkológia 51/3)
Pozitronemissziós komputertomográfia-MR (PET/MR)
Napjainkban a PET és az MR hardware kombinációjával megjelent PET/MR készülékek klinikai értékelése zajlik, a kezdeti eredmények biztatóak. (Zaidi 2011, Eiber 2012, Heusch 2014, Kitajima 2014, Loeffelbein 2012, Vargas 2013, Borbély 2014)
2. CÉLKITŰZÉSEK
1. Alapvető célom volt, hogy hatékony multimodális képalkotó vizsgálati irányelveket dolgozzak ki minden daganat csoportban, az onkológiai diagnosztikus és terápiás algoritmus fázisai szerint, mely a daganatos betegek ellátását, a számukra legkedvezőbb terápia kiválasztását a nemzetközi elvárásoknak megfelelően szolgálja.
Ezen cél érdekében végeztem kutatásaimat.
2. Kerestem a magas effektív felbontást nyújtó HR-MR vizsgálatok technikai feltételeit, rutinszerű alkalmazásának lehetőségeit. Alapvető feladatomnak tekintettem, hogy a megbízható képalkotói protokollok standard működtetésével a rutin betegellátás eredményeit a nemzetközileg elfogadott, magas szakmai szinten üzemeltessem.
3. Kutattam az új képalkotói módszerek-, elsősorban a folyamatosan megújuló multiparametrikus MRI mérésmódok szerepét, korszerű alkalmazását. A technikailag kidolgozott vizsgálati módszereket először klinikai kutatásokban vizsgáltam, és felmértem alkalmazhatóságukat a rutin beteg ellátásban is.
4. Célom volt, hogy a képalkotók szerepét új területeken is megvizsgáljam és saját tapasztalatot gyűjtsek a módszerek statisztikai értékeiről, több daganat csoportban, kiemelten kezelve a fej-nyaki- és a kismedencei daganatokat.
5. A mindennapi gyakorlatban fontos kérdés a terápia hatékonyságának illetve hatástalanságának korai megállapítása, a posztterápiás residuum illetve a residuális tumor elkülönítése. Ezen kérdések megoldására kerestem a multimodális képalkotói diagnosztika és a funkcionális információval is szolgáló multiparametrikus MRI alkalmazásával azokat a képalkotói markereket, melyek alapján a daganatok molekuláris szinten elemezhetők és a daganat sejtbiológiai folyamataira is válasz adható - különös tekintettel a fej-nyaki- és a kismedencei daganatokra.
6. Tanulmányozni szándékoztam a diffúzió súlyozott MRI (DW-MRI) alkalmazását különböző daganat csoportokban, különböző szempontok szerint. Kutattam, hogy mely klinikai kérdés megválaszolásánál növeli a diagnosztikus biztonságot a DW- MRI?
7. Fontosnak tartottam, hogy a daganatok vascularizáción alapuló tulajdonságait is megvizsgáljam és az MR kontrasztanyag halmozásának jellegzetességei alapján javítsam a differenciál diagnosztika lehetőségeit. Kutattam a több fázisú dinamikus MRI alkalmazásának előnyeit.
8. A perfúziós dinamikus MRI (P-DCE-MRI) alkalmazásával a kontrasztanyag által nyújtott kvalitatív eltéréseken túl vizsgáltam a daganatos erek permeábilitás változásán, eltérő perfúzióján alapuló adatokat és a daganat halmozását az idő függvényében semiquantitatíve elemeztem.
9. Kutatásaimban fontos kérdésnek tartottam, hogy a funkcionális MR mérés módok (DW-MRI, P-DCE-MRI) beilleszthetők-e kompromisszum nélkül a rutin MRI
protokollokba, mivel alkalmazhatóságukat a diagnosztikus hasznosságuk mellett ez is befolyásolja.
10. Célom volt, hogy olyan onko-radio-diagnosztikai osztályt szervezzek, melynek tagjai azonos feltételek alapján működnek, azonos szakmai elveket képviselnek, mivel csak ez által válik lehetővé, hogy a klinikus kollégák a beteg számára megfelelő onco- terápiás irányelveket alkalmazzák.
11. Igen fontosnak tartottam, hogy a képalkotó szakemberek multidiszciplináris onko- teamben betöltött szerepe megalapozott tudás által erősödjön és stabil legyen.
12. Feladatomnak tartottam, hogy a folyamatos önképzés, konzultáció és továbbképzés alapján megszerzett tudással egy olyan megbízható szakmai közeget biztosítsak, mely hitelesen képviseli és gyakorolja az onco-radio-diagnosztikai ismeretek átadását, terjesztését – intézeten belül és kívül, konferenciákon, rendszeresen szervezett továbbképző kurzusokon.
3. FEJ-NYAKI DAGANATOK Epidemiológiai adatok
Európában mind a férfiak mind a nők körében Magyarországon a legmagasabb a fej-nyak rák morbiditása és mortalitása, férfiaknál a harmadik leggyakoribb daganatos halálok. (Remenár 2009)
A fej-nyak területén előforduló rosszindulatú daganatok több mint 90%-a a szájüreg, száj- és algarat, valamint a gége nyálkahártyájáról kiinduló laphám rák. A világ ranglistán fej-nyaki rákok közül leggyakoribb a szájüregi nyálkahártyából kiinduló laphámrák 11-ik, a garat laphámrákja a 20-ik helyen áll, évente több százezer új eset fordul elő. (Gaudi 2002) A magyar betegek többnyire előrehaladott stádiumban kerülnek orvoshoz. Kelet-Közép Európa országaiban három-tízszeresére emelkedett ezen daganatoknak az incidenciája egy generáció alatt. (Boyle 2003) Az elmúlt ötven évben a mortalitási adatok is jelentős változáson mentek át, Európában a fej-nyaki laphám rákos halálozás megkétszereződött, hazánkban az ajak, szájüreg és garat rák meghatszorozódott. (Boyle 2005, Kásler 2005)
A szájüregi rákok előfordulási gyakorisága Magyarországon 1970 és 2000 között 265 százalékkal növekedett, amely a dohányzásnak, ill. a nagymértékű alkoholfogyasztásnak tulajdonítható. A fej-nyaki laphám rák jelentős férfi dominanciával, a tüdőrákhoz hasonlóan, olyan egyénekben alakul ki, akik hosszú idő óta rendszeresen dohányoznak és alkoholfogyasztók. (Ostoros 2012) Relatíve ritka a nőkben, a férfi-nő arány 10:1. Eredetüket tekintve két csoportba sorolhatjuk őket, a nagyobbik csoport külső karcinogén - leggyakrabban dohányzás és alkohol - hatására alakul ki (Ottó 2002), kisebb részükben pedig a humán papilloma vírus (HPV) fertőzésnek tulajdonítanak szerepet. (Szentirmay 2002, 2005) Egy multicentrikus tanulmánya kimutatta, hogy a szájüregi- és a garat rákok esetében a HPV DNS incidenciája 18,3 %. Az esetek 97,4 %-ban a HPV 16-os magas rizikójú törzse játszik szerepet. (Herrero 2003)
Az elmúlt években a fej-nyaki laphám rákok egyre alacsonyabb korosztályokat érintenek, korábban döntően 40 év felett fordultak elő. Mivel fiatalabb nem dohányzó, alkoholt nem fogyasztó emberekben is kialakulhat fej-nyak rák, felmerül a genetikai prediszpozíció, valamint az individuális érzékenységbeli különbségek lehetősége is.
A fej-nyaki daganatokra jellemző, hogy a primer tumor megjelenését követően öt éven belül második, synchron vagy metachron tumorok gyakran alakulnak ki.
A 7. TNM stádiumait meghatározó prognosztikai faktorok Felkért referátum
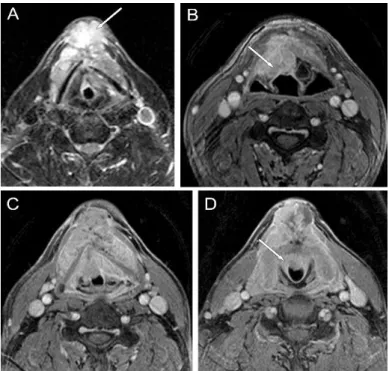
Gődény M. Prognostic factors in advanced pharyngeal and oral cavity cancer; significance of multimodality imaging in terms of 7th edition of TNM. Cancer Imaging,14(1):15,2014, DOI: 10.1186/1470-7330- 14-15
Számos kutatás foglalkozik mind a tumor függő, mind a nem tumor függő, a beteg sorsát, túlélését befolyásoló prognosztikai faktorok értelmezésével, alkalmazásukkal a TNM rendszerben. (American Joint Commitee 2010, Takes 2010) A beteg túlélését alapvetően befolyásolja a szövettani diagnózis, a tumor differenciáltsága (grade), lokalizációja, lokális
terjedése, mérete, a nyirokcsomók státusa, a távoli metasztázis megléte (Chong 2007 American Joint Commitee 2010, Sobin 2009) és a beteg általános állapota is.
A metasztatikus nyirokcsomók jelenléte mellett, számuk, méretük, pozíciójuk és az extracapsularis tumor terjedés szintén fontos prognosztikai faktorok. (Nakamura 2007) A mediastinalis nyirokcsomók áttétei távoli metasztázisok, kivételt képeznek azok, melyek a VII. nyirokrégióban helyezkednek el. A távoli metasztázis a legmagasabb tumor stádiumba emeli az esetet, rizikója jobban függ az „N” stádiumtól, mint a „T” státustól. Fej-nyaki daganatoknál a távoli metasztázisok leggyakrabban a tüdőben, csontban jelennek meg, ritkábban a májban és az agyban.
Az irodalmi adatok szerint az újonnan diagnosztizált fej-nyaki laphám carcinomáknál előforduló tüdő metasztázis - CT-vel diagnosztizálva - 16-19 % gyakoriságú. (De Bree 2001, Loh 2005) A nasopharyngealis és az adenoid cysticus carcinomák fokozott rizikót jelentenek távoli metasztázis kialakulására.
A tumor terápia előtti pontos feltérképezése az aktuális, kollaboratív TNM rendszerek (AJCC 2010) szerint történik. A besorolás figyelembe veszi a tumor nagyságát, lokalizációját, terjedésének mértékét, a nyirokcsomók daganatos érintettségét és a távoli áttéteket. A TNM beosztást periodikusan revízió alá veszik (6-8 évente), módosítják a klinikai adatok szerint, melyek az új terápiás stratégiákra reflektálnak, és a rák biológiai tulajdonságait és a prognózist befolyásoló faktorokat egyre növekvő mértékben veszik figyelembe. A 7. TNM, mely 2010.
január 01. óta érvényes, továbbra is döntően a tumor anatómiai kiterjedését veszi figyelembe.
(AJCC Cancer 2009, Sobin 2009, Takes 2010) Az osztályozás csak négy domináns változót tartalmaz: tumor mérete, tumor lokális terjedése, nyirokcsomó- és távoli metasztázisok. A szövettani grading, a beteg kora és a daganat helye szintén fontos kiegészítő faktorok, melyek jelentősége kutatás tárgyát képezi és feltételezhető, hogy a jövőben szintén stádium meghatározó faktorok lehetnek.
Fej-nyaki daganatoknál a T4-es tumorok T4a és T4b csoportba osztása a szerint történik, hogy az elváltozás operábilis-e, avagy nem, hogy a tumor lokális kiterjedése mérsékelten vagy nagyon előrehaladott-e. Az a tumor, mely destruálja a koponyabázist, infiltrálja a bázis alatti mély nyaki lágyrészteret (infratemporális/masticator teret), az agyidegeket, átlépi a retropharyngeális-prevertebrális mély nyaki fasciát, vagy körbeveszi a carotis-, illetve mediastinális ereket, a legújabb TNM beosztás szerint a T4b stádiumba sorolandó és nem operálható. (Hermans 2006, 2012, Som 2011)
A klinikai prognosztikai stádium IVA alcsoportja mérsékelten előrehaladott tumoros folyamatot jelez, mely sebészetileg még rezekálható. A IVB stádium nagyon előrehaladott, sebészileg nem rezekálható, mert a tumor vitális szempontból fontos anatómiai struktúrákat infiltrál és rezekciója technikailag nem kivitelezhető, de radio-kemoterápiával gyógyítható. A IVC stádium, melybe a metasztatikus folyamatok tartoznak, csak palliatív kemoterápiára és/vagy radioterápiára alkalmas.
Az ESMO guidelines/2010 figyelembe veszi az új terápiás lehetőségek által vezérelt 7. TNM beosztást és új diagnosztikus és terápiás stratégiát fogad el. (Grégorie 2010)
Új terápiás stratégia, komplex onkoterápia
Hasonlóan más daganatokhoz a beteg sorsa, a betegség prognózisa nagyban függ a daganatos betegség kiterjedtségétől, mivel a kezelést döntően a tumoros folyamat stádiuma határozza meg. (Knegjens 2011)
Korainak, I vagy II klinikai stádiumúnak tartjuk a T1 vagy T2 stádiumú daganatot, amennyiben nincs nyirokcsomó áttéte, ilyenkor a kezelés műtét, vagy sugárterápia (külső forrásból vagy brachyterápia, Takácsi-Nagy 2013). Előrehaladott III-IV stádiumú a daganatos betegség, ha a primer tumor T3 vagy T4 vagy ha bármely stádiumú primer tumor mellett nyirokcsomó és/vagy távoli áttét is kimutatható. Ha a daganat operábilis, standard kezelés a műtét, a daganat eltávolításával, rekonstrukcióval és posztoperatív sugárterápiával.
Az előrehaladott fej-nyaki daganatok kezelésében a nem sebészi kezelési formák alkalmazása, a szerv és a funkció megtartása az által válhatott fontos szemponttá (Remenár 2011 Remenár- Gődény 2007), hogy a kemoterápia és a sugárterápia fejlődése, kombinációjának sikeres alkalmazása révén nem romlottak a beteg túlélési esélyei a nagy radikalitású, csonkoló műtétek eredményeihez viszonyítva. A fej-nyaki tumoros betegek megközelítőleg 60 %-a részesül sugárterápiában, ami lehet kizárólagos vagy chemo-radio-terápia (CRT, cisplatinnal vagy cetuximabbal), illetve műtéttel kombinált. Amennyiben a patológiai lelet alapján magas rizikójú a beteg (nyirokcsomó áttét tokáttöréssel és/vagy a rezekció széle tumorhoz közeli, R1 rezekció) műtét után CRT-t is alkalmaznak.
Az utóbbi tíz év prospektív és randomizált klinikai vizsgálatai megerősítették a komplex onkoterápia második komponensének, a sugárterápiának a központi szerepét a fej-nyak rákok kezelésében. (Mendenhalls 2006) A korszerű diagnosztikus eszközök alkalmazásával, a sugárterápia fejlődésével, a 3D konformális és az intenzitás modulált radioterápiával (IMRT) lehetőség nyílt arra, hogy a tumor céltérfogatára jobban fókuszálhassunk, a környező normál szöveteket pedig megkímélhessük. (Nuyts 2007, Fodor 2007) A daganat lokális kiújulását a dózis emelésével lehet csökkenteni. A dózis eszkaláció egyik biztonságos módszere az intersticiális brachy-terápia (BT). Az Ir-192 intersticiális, lokálisan nagy dózis teljesítményű BT-t az OOI-ben az elsők között vezettük be a nyelvgyök-rák kezelésében. (Polgár 2007, Takácsi Nagy 2004)
A nagydózisú, definitív sugárkezelést egyedül vagy kemoterápiával kombinálva egyre gyakrabban alkalmazzák, mint szerv- és funkció megőrző kezelést a csonkító műtétek helyett.
Az utóbbi években a szájüregi, garat és gége tumorok, köztük különösen a nyelvgyökrák esetében is a szervmegőrzést hangsúlyozzák, mert a nyelvgyöknek kritikus szerepe van a beszédben, nyelésben és a légút formálásában is. (Takácsi Nagy 2004)
A gyógyszeres kezelésre és a sugárterápiára azonban nem minden beteg reagál egyformán, vannak daganatok, melyekre a kezelés nem vagy csak kevéssé hatékony. Ezekben az esetekben úgynevezett második vonalbeli eljárást, un. salvage műtétet végeznek, nagy radikalitást és rekonstrukciót alkalmazva. (Goodwin 2000)
Helyi recidíva, regionális nyaki, vagy távoli áttét jelentkezésekor a lehetőségektől függően sebészi kezelés, reirradiáció, vagy palliatív kemoterápia (cetuximab + cisplatin vagy carboplatin + 5-FU) mérlegelése történik.
Előrehaladott fej-nyaki daganatoknál az egy időben alkalmazott CRT a standard kezelési forma. Az utóbbi néhány évben a fej-nyaki daganatok ellátásában a sugárkezelés- vagy a műtét előtt alkalmazott indukciós kemoterápia (taxán-platina-5-fluorouracil kombináció) szerepét számos kutató csoport értékelte. (Remenár-Gődény 2011, Ma 2013, Takácsi Nagy 2015)
SAJÁT KUTATÁSUNK - Az indukciós kemoterápia (ICT) után alkalmazott chemo-radio-terápia (CRT) hatékonysága és toxicitása összehasonlítva a standard CRT-val (Takácsi Nagy 2015)
Takacsi-Nagy Z, Hitre E, Remenar E, Oberna F, Polgar C, Major T, Godeny M, Fodor J, Kasler M.
Docetaxel, cisplatin and 5-fluorouracil induction chemotherapy followed by chemoradiotherapy or chemoradiotherapy alone in stage III-IV unresectable head and neck cancer: Results of a randomized phase II study. Strahlenther. und Onkol. 191(8):635-641, 2015
Az Országos Onkológiai Intézetben fázis II. randomizált vizsgálatban hasonlítottuk össze az indukciós kemoterápia (ICT) után alkalmazott CRT hatékonyságát és toxicitását a standard CRT-val. Hatvanhárom betegnél (30 ICT+CRT és 33 CRT) értékeltük a localis tumor control (LTC), a locoregionális tumor control (LRTC), a teljes túlélés (overall survival = OS), a progresszió mentes túlélés (progression free survival= PFS) és a toxicitás adatait.
Minden betegnél a diagnózis felállításához, a stádium meghatározására fizikális, endoszkópos, CT vagy MRI vizsgálat, valamint szövettani verifikálás történt. CT-t vagy MRI- t készítettünk az ICT hatékonyságának mérésére, majd 8-12 héttel a CRT után, valamint follow-up vizsgálatként 6 havonta. A túlélő betegek általános követési ideje 63 hónap volt (53-82 hónap).
A radiológiai komplett remisszió arányát 63%-nak találtuk ICT+CRT után és 70 %-nak CRT után. Nem volt szignifikáns különbség az ICT+CRT és a standard CRT 3 éves értékelésekor sem az LCT (56% vs. 57%), LRTC (42% vs. 50%), OS (43% vs. 55%) sem a PFS (41% vs.
50%) értékelése alapján. Azonban a grade 3-4 neutropenia szignifikánsan magasabb volt az ICT+CRT csoportban, mint a standard CRT csoportban (37%-12%, p=0.024). A késői toxicitás (grade 2 - 3 xerostomia) az ICT+CRT csoportban 59%-ban, a CRT alkalmazása után 42%-ban fordult elő. Az ICT+CRT csoportban fellépő 3 haláleset felhívta a figyelmet arra, hogy ICT alkalmazásánál igen fontos a megfelelő beteg szelekció.
Az irodalomban az ICT eredményeként a nem műtéti kezelés hatékonyságának prognosztizálását, elősegítését, és a távoli metasztázisok kockázatának csökkentését fogalmazták meg. Amennyiben az ICT vagy a CRT nem kellően sikeres, salvage műtétet kell mérlegelni. (Ma 2013)
Megállapítások
Eredményeink alapján megállapítható volt, hogy az ICT+CRT alkalmazása nem jelentett előnyt a CRT-hoz képest, de a kedvezőtlen mellékhatások gyakrabban fordultak elő, ezért igen fontos a megfelelő beteg szelekció.
Az eddigi tapasztalatok szerint az ICT egyértelmű feladata az ICT hatására regressziót mutató betegek kiválasztása, mivel náluk a személyre szabott szervmegtartó kezeléstől, a CRT-tól hatékonyság várható.
A terápia előtt a tumor stádium meghatározására, majd a terápia hatékonyságának megítélésére CT vagy MRI szükséges.
A korábbi kutatások eredményei alapján bizonyított, hogy a komplex onkológiai kezelés viszonylag új lehetősége az immunterápia, relatíve specifikus daganatellenes kezelés, melyben
az immuneffektor mechanizmusok aktiválása révén érjük el a daganatsejtek pusztulását.
(Tímár 2004, 2005)
Az új terápiás lehetőségek a képalkotók felé azzal az igénnyel léptek fel, hogy a tumor széleket és a tumor volument, valamint a biológiai céltérfogatot pontosan határozzuk meg.
Megnövekedett annak jelentősége, hogy a kezelés előtti tumor felmérés megbízható legyen, és hogy a klinikai és képalkotói stádium az aktuális patológiai stádiumnak feleljen meg.
(Gődény 2013 Magy. Onk., 2014 Cancer Imag., 2014 Magy. Onk.) A korszerű beteg ellátásnak elengedhetetlen feltétele az is, hogy a nem műtéti kezelés hatására létrejött változásokat a képalkotó pontosan kövesse.
KÉPALKOTÓ VIZSGÁLÓ MÓDSZEREK FEJ-NYAKI DAGANATOKNÁL A fej-nyak régió bonyolult anatómiája, a kóros elváltozások régiónként változó formái, azok komplex morfológiai és patológiai kapcsolatai miatt a radio-diagnosztika speciális területe. A radiológus feladata, hogy precízen feltérképezze a lézió kiterjedését, pontos anatómiai és patológiai képi információt nyújtson. (Gődény 2003 Springer, Gődény 2005 Melánia, Gődény 2006 Melanis Onco Update, Gődény 2011 Medicina online) Részletes képi analízis szükséges ahhoz, hogy a daganat stádiumát az onkológiai diagnosztikus és terápiás algoritmus minden fázisában meghatározhassuk, annak érdekében, hogy a sebész, a sugárterapeuta vagy a klinikai onkológus a legjobb terápiás módszert választhassa, tisztában legyen a terápia hatékonyságával és pontosan informálhassa a beteget a beavatkozás várható, majd elért eredményességéről, a várható következményekről, esetleges szövődményekről.
A fej-nyaki daganatok klinikai stádium meghatározása elsődlegesen a fizikális vizsgálaton, a megtekintésen, tapintáson, valamint az indirekt és a direkt endoszkópos vizsgálaton alapszik.
A klinikai vizsgálatok a nyálkahártya felszín megítélésére kiválóan alkalmasak, de nem tudják megítélni a mélyben zajló elváltozásokat. Abban az esetben, ha a tumor stádium meghatározása pusztán a klinikai vizsgálaton alapul, a stádiumot gyakran alábecsülik. (Gődény 2007 Cancer Imag. absztrakt)
A képalkotó technikák rohamos fejlődésével egyre pontosabbá váltak a daganat kimutatásának módszerei. Az onko-radio-diagnosztika a radiológián belül speciális területté fejlődött, a daganatok multidiszciplináris ellátásának szerves részévé vált.
A képalkotók feladata, hogy meghatározzák a daganat méretét, terjedésének mértékét, a daganatos betegség stádiumát, ezáltal vezérlik a klinikust a terápia kiválasztásában, majd a terápia hatékonyságának megítélésében, a beteg követésében és a recidív tumor megtalálásában is. (Gődény 2006 Canc. Imag.) A képalkotók stádium meghatározó felelőssége az által is megnőtt, mert a nem sebészi terápia alkalmazásakor nem történik patológiai stádium felmérés. Az a törekvésünk, hogy a klinikai vizsgálatokkal, valamint a képalkotókkal felmért stádium közelítse meg a valós, patológiai tumor stádiumot. A korszerű, un.
konformális besugárzás tervezéséhez is nélkülözhetetlenek a modern képalkotó vizsgálatok.
Számos lehetőség közül kell kiválasztanunk az optimális módszert és technikát, mellyel a vizsgálatot meghatározott protokoll szerint, standard módon végezzük el. (King 2007 Cancer Imag., Kösling 2011, Som 2011, Hermans 2012, Gődény 1993 Springer, 2004 Magyar Onk., 2005 LAM, 2005 Melania, 2007 Magy. Rad., 2010, 2011 Medicina online, 2013 Magy. Onk., 2014 Magy.
Onk., 2014 Cancer Imag.)