BUDAPESTI KÖZGAZDASÁGTUDOMÁNYI ÉS ÁLLAMIGAZGATÁSI EGYETEM
ASZÚBOGYÓK ÉLESZTŐ- ÉS PENÉSZBIOTÁJÁNAK TANULMÁNYOZÁSA TOKAJ-HEGYALJÁN
Doktori értekezés
BENE ZSUZSANNA
Készült a Budapesti Közgazdaságtudományi és Államigazgatási Egyetem Borászati Tanszékén
BUDAPEST, 2004
A doktori iskola
megnevezése: Élelmiszer-tudományi Doktori Iskola tudományága: Élelmiszertudomány
vezetője: Dr. Fekete András egyetemi tanár, DSc BKÁE, Élelmiszertudományi Kar Fizika-Automatika Tanszék
Témavezető: Dr. Magyar Ildikó egyetemi docens, PhD BKÁE, Élelmiszertudományi Kar
Borászati Tanszék
Az iskola- és témavezető jóváhagyó aláírása:
A jelölt az Egyetem Doktori Szabályzatában előírt valamennyi feltételnek eleget tett, az
értekezés műhelyvitájában elhangzott észrevételeket és javaslatokat az értekezés átdolgozásakor figyelembe vette, ezért az értekezés nyilvános vitára bocsátható.
--- --- Az iskolavezető jóváhagyása A témavezető jóváhagyása
TARTALOMJEGYZÉK
1. BEVEZETÉS... 4
2. IRODALMI ÁTTEKINTÉS... 6
2.1. NEMESPENÉSZES, TÖPPEDT BOGYÓBÓL KÉSZÜLT BOROK A VILÁG BORVIDÉKEIN... 6
2.1.1. Ausztria... 6
2.1.2. Németország... 6
2.1.3. Franciaország... 6
2.1.4. Magyarország... 7
2.2. NEMESROTHADÁS... 10
2.2.1. Az aszúsodás folyamata... 10
2.2.2. A nemesrothadás okozta kémiai változások... 12
2.2.3. Az aszúbogyó mikroflórája... 15
2.2.4. A különböző élesztőfajok szerepe a tokaji aszú erjesztésében... 20
2.3. AZ ASZÚBOGYÓN ELŐFORDULÓ PENÉSZGOMBA TÖRZSEK ANTIBIOTIKUM TERMELÉSE... 25
2.3.1. Penicillinek... 25
2.3.2. A Botrytis cinerea antibiotikum termelése... 28
3. KISÉRLETI CÉLKITŰZÉS... 30
4. KISÉRLETI ANYAGOK ÉS MÓDSZEREK... 32
4.1. A BOTRÍTISZES SZŐLŐ MIKROFLÓRÁJÁNAK TANULMÁNYOZÁSA... 32
4.1.1. Mintavétel, mintaelőkészítés... 32
4.1.2. Élesztő- és penészgombaszám meghatározás... 32
4.1.3. Élesztőgombák identifikálása... 33
4.1.4. Penészgombák vizsgálata... 34
4.1.5. Aszúbogyó tárolási kísérlet... 35
4.2. A PENICILLIN – TARTALOM MEGHATÁROZÁSA... 36
4.2.1. Mintavételezés, mintaelőkészítés... 36
4.2.2. Analízis... 37
4.2.3. Kalibrációs egyenes felvétele... 38
5. KISÉRLETI EREDMÉNYEK ÉS ÉRTÉKELÉSÜK... 40
5.1. A MIKROORGANIZMUSOK MENNYISÉGI ALAKULÁSA AZ ASZÚBOGYÓK FELÜLETÉN... 40
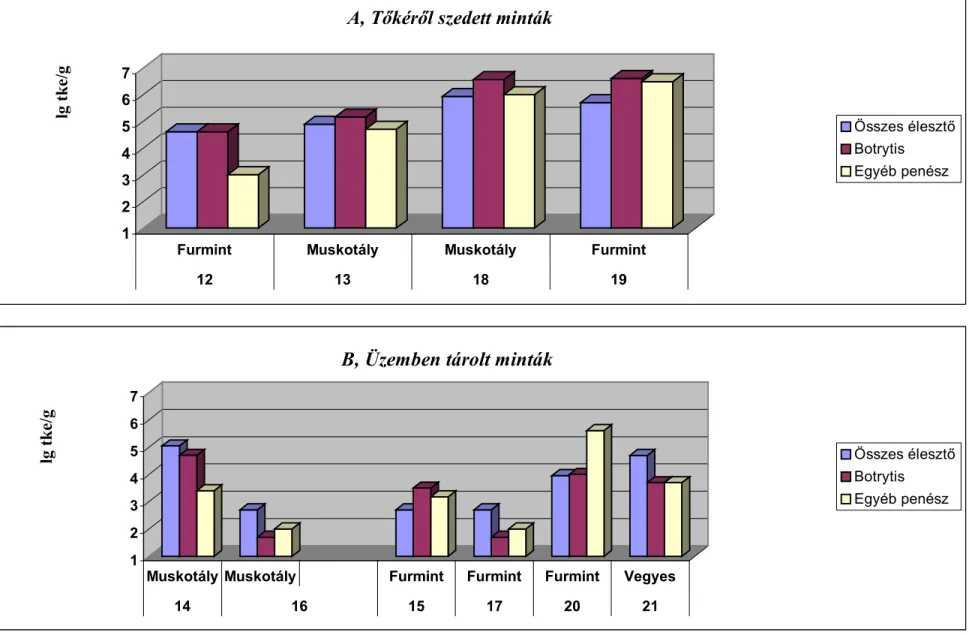
5.1.1. Az 1998 -as évjáratban végzett vizsgálatok eredményei... 40
5.1.2. Az 1999 -es évjáratban végzett vizsgálatok eredményei... 48
5.1.3. A 2000 –es évjáratban végzett vizsgálatok eredményei... 50
5.1.4. A 2001 –es évjáratban végzett vizsgálatok eredményei... 53
5.1.5. A négy évjárat összehasonlító értékelése... 60
5.2. AZ ÉLESZTŐFLÓRA TAXONÓMIAI ÖSSZETÉTELE AZ ASZÚBOGYÓK FELÜLETÉN... 65
5.2.1. A morfológiai és fiziológiai tulajdonságok alapján azonosított nemzetségek és fajok... 65
5.2.2. Az aszúbogyók élesztőflórájában bekövetkező változások a tárolás hatására... 70
5.3. ASZÚBOGYÓ TÁROLÁSI KÍSÉRLETEK EREDMÉNYEI... 72
5.3.1. A kénezés hatása az élesztő- és penészbiotára... 73
5.3.2. A tárolási hőmérséklet hatása az élesztő- és penészbiotára... 74
5.3.3. Az élesztőbiota minőségi változása a tárolás során... 74
5.3.4. Az illósavtartalom változása a tárolás során... 75
5.4. AZ ASZÚSODÁS MECHANIZMUSÁNAK ELEKTRONMIKROSZKÓPOS TANULMÁNYOZÁSA... 81
5.5. TOKAJI ASZÚBOGYÓK ÉS TOKAJI BORKÜLÖNLEGESSÉGEK PENICILLIN –TARTALMÁNAK VIZSGÁLATA... 84
5.5.1. Aszúbogyók... 84
5.5.2. Tokaji borkülönlegességek... 86
5.6. ÚJ TUDOMÁNYOS EREDMÉNYEK... 88
5.7. AZ EREDMÉNYEK TOVÁBBFEJLESZTÉSI ÉS HASZNOSÍTÁSI LEHETŐSÉGEI... 90
6. ÖSSZEFOGLALÁS... 93
6. SUMMARY... 98
MELLÉKLET... 103
FELHASZNÁLT IRODALOM... 119
1. BEVEZETÉS
Tokaj – Hegyalját az Unesco-döntést követően 2002-ben a Világörökség részévé nyilvánították, így a borvidéken készített borkülönlegességek, pincék, a borvidék történelmi múltja, az alkalmazott borkészítési eljárások a világon egyedülállóak, elidegeníthetetlenül magyar nemzeti kincsek. A borvidék leghíresebb terméke a tokaji aszú, amelynek készítése egyike a legnagyobb és legnemesebb borászati kihívásoknak. Az aszú a tőkén töppedt, a Botrytis cinerea nevű gomba előnyös közreműködésével nemesrothadáson átesett szőlőbogyókból készül.
Az aszúszemeket megfelelő arányban különleges minőségű tokaji musttal vagy kierjedt borral extrahálják, majd a préselés során nyert nagy cukortartalmú keveréket alacsony hőmérsékleten erjesztik, ezt követően tölgyfahordóban érlelik. Történetileg az aszú puttonyszáma attól függött, hogy egy gönci hordó mennyiségű borba hány puttonynyi aszútésztát kevertek, ma azonban az aszút beltartalmi értéke szerint sorolják az egyes kategóriákba.
A világ több borvidékén is készítenek töppedt, nemesrothadáson átesett szőlőből nemes édes borokat, azonban a tokaji aszú ezektől a boroktól lényegesen eltér. Egyedi jellegét elsődlegesen a szőlőfajták, a talajtípusok, az éghajlati adottságok összhangja, másodlagosan a sajátos borkészítési eljárás, harmadlagosan a tölgyfahordós érlelés adja meg.
Az aszúkészítési technológiának kritikus lépése az aszúbogyók áztatását követő alkoholos erjedés, amely legtöbb pincészetnél gyakorlatilag irányítatlanul, spontán módon, a természetes mikrobiotára támaszkodva történik, de az élesztők számára rendkívül nehéz körülmények között zajlik. Az utóbbi években egyes pincészetekben egyre inkább felmerült az erjedés irányításának igénye. Ehhez azonban szükséges a nyers aszúk erjedés előtti természetes élesztőflórájának ismerete, amely jelentős részben az aszúszemek élesztőflórájából tevődik össze. A botrítiszes szőlő mikroflóráját a világ néhány borvidékén tanulmányozták már, de a Tokaj-hegyaljai borvidékre vonatkozóan csak az utóbbi években indultak meg az ilyen irányú vizsgálatok.
Az aszúbogyókat a feldolgozást megelőzően rövidebb-hosszabb ideig tárolják, a tárolási paraméterek optimalizásához azonban szükség van a tárolási időtartam során a mikrobiotában, elsősorban a penész- és élesztőflórában bekövetkező változások nyomonkövetésére különböző tárolási körülmények függvényében.
Az aszúszemek minőségi osztályokba történő besorolása is alapvető fontossággal bír a különböző aszúkészítési eljárásokban, jelenleg hiányzik még egy olyan objektív átvételi rendszer, amely során a kiválasztott paraméterek mérésével egyértelműen meggyőződhetnénk az aszúbogyók minőségéről és adott kategóriákba besorolhatnánk.
Régóta vitatott a tokaji aszúborok gyógyhatása. Manapság egyre inkább szükség van arra, hogy a tokaji aszúkat a világ egyéb nemes édes boraitól megkülönböztessük, rangjukat emeljük.
Mindezidáig a penicillin – tartalomra vonatkozóan nem történtek vizsgálatok, pedig az aszúk antibiotikum tartalmának kimutatása fontos megkülönböztető paraméter lehetne.
A felsorolt problémák megoldására, a gyakorlati alkalmazás megvalósításához a Budapest Corvinus Egyetem Élelmiszertudományi Karának Borászati Tanszékén hosszú távú kutatómunkát indítottak, kísérleti munkáim ezekhez a kutatásokhoz kapcsolódnak. Vizsgálataim tárgyát Tokaj-hegyaljáról származó aszúszemek, nyersaszúk, aszúborok, illetve az ezekről izolált élesztőtörzsek képezték.
2. IRODALMI ÁTTEKINTÉS
2.1. Nemespenészes, töppedt bogyóból készült borok a világ borvidékein 2.1.1. Ausztria
A burgenlandi nemes, elsősorban édes borokat nagyon eltérő szőlőfajtákból készítik. Elsősorban Scheurebe és a Fűszeres tramini az uralkodó szőlőfajta, de szerepet játszanak az Olaszrizling, Chardonnay, Fehér burgundi, Muskotály és Sauvignon blanc szőlőfajták. A termelt bormennyiségek fajlagosan alacsonyak. Kiemelkedő bortípusuk a ruszti aszú, amelyet Ausbruch elnevezéssel látnak el. Az Ausbruch nemesrothadáson átesett, túlérett, illetve beszáradt bogyók mustjából készült bort jelöl. Minimálisan 12 v/v% az alkoholtartalma, a cukor mennyisége pedig 80-150 g/l. Fahordókban érlelik. A helyiek szerint az ideális az, ha 5 %-ban túlérett szőlőbogyót, 40%-ban csaknem mazsolaszerűre aszott bogyót és 55%-ban pedig botrítiszes bogyót lehet szüretelni (BOTOS, 2001).
2.1.2. Németország
Jelentős mennyiségben készítenek Beeren- és Trockenbeerenauslese- ket. Túlérett, szemenként gyűjtött, legtöbbször nemesrothadáson átesett bogyókból készült borok, de ez utóbbi nem elengedhetetlen követelmény. A nyert lének minimum 110-128° Oechsle (25°KMF) a Beerenauslese esetében, a Trockenbeerenauslese készítéséhez 150-153 ° Oechsle (30°KMF) szükséges. Rajnai rizling, Müller-Thurgau, Ruländer, Silvaner szőlőfajtából készülnek a Rheingau-i, Mosel-Saar-Ruwer-i, Nahe-i és Pfalz-i borvidéken. A borokat alacsony alkoholtartalom (6-9 v/v%), magas extrakt jellemzi, ízérzetben az édesség dominál (SAILER, 2001).
2.1.3. Franciaország
A Bordeaux-i régión belül található Sauternes-Barsac-i borvidéken készítenek nagy mennyiségben nemesédes borokat. A borvilágban való ismertségük alapján a legnagyobb vetélytársat jelentik a tokaji aszúk számára. Az óceáni klíma és a csapadékos ősz optimális feltételeket teremt a nemesrothadás kialakulásához. A szőlőbogyók hamar elérik a túlérett állapotot, a B. cinerea a sok nedvességnek köszönhetően jól tud növekedni. Sémillon szőlőfajtából készülnek ezek a borok. Elsősorban nem az édesség dominál, mint a Trockenbeerenauslese- k esetében, hanem az elegancia, a cukor-alkohol-sav harmónia formálja a borokat (ALKONYI, 2000).
Az elzászi borvidéken is hagyomány a nemesédes borok készítése. Fűszeres traminiből készülnek, a nemesrothadás jelenléte nem előírás. Gazdag aromával rendelkező borok.
2.1.4. Magyarország
A Tokaj-hegyaljai borvidék szőlőfajtái, talajviszonya és éghajlati adottsága teremtenek optimális feltételeket az aszúsodás kialakulásához. Kizárólag fehérbort adó borvidék. Jelenlegi szőlőterület 5446 ha, ebből termő szőlő 5215 ha (ROHÁLY, 2001). Kontinentális a klíma, a nagy felszíni tagoltság és a vízfelület (Tisza, Bodrog) jelenléte miatt jól elkülönülő mikroklímával rendelkező területekkel. A fő talajtípusok a kovasav tartalmú riolit- és andezitkőzetek, vulkáni törmelék, zeolit, nyiroktalaj, lejtőlösz.
2.1.4.1. Tokaji borok technológiája
Tokaj - hegyalján a négy alapbor mellett (Furmint, Hárslevelű, Sárga Muskotály, Orémus) nemes borkülönlegességeket is készítenek, ezek alapozták meg a borvidék világhírét. A Tokaji borkülönlegességekhez tartozik a Tokaji szamorodni (száraz és édes), aszú (3-6 puttonyos), aszúeszencia, eszencia, fordítás és máslás. Ezeket a kategóriákat és meghatározásokat a magyar bortörvény (1997.évi CXXI.törvény) rögzíti.
Tokaji szamorodni
A tőkén aszúsodott szőlőbogyókat is tartalmazó, túlérett, válogatás nélkül szedett szőlőfürtök feldolgozásával nyert mustból származó tokaji bor, amely jellemző ászkolási illattal és zamattal rendelkezik.
Tokaji aszú és aszúeszencia
Az a 3-6 puttonyos aszú és aszúeszencia, amely a Tokaj-hegyaljai borvidék zárt területén termett, a Botrytis cinerea hatására nemesen rothadt, tőkén aszúsodott, töppedt, szüretkor külön szedett szőlőbogyókra (aszúszemekre) vagy feltárt anyagára öntött, meghatározott termőhelyről származó musttal vagy borral áztatott, alkoholos erjedés útján nyert tokaji borkülönlegesség, amely készítési módra jellemző aszú és érlelési illattal, valamint zamattal rendelkezik.
A puttonyszámtól függően meghatározott mennyiségű cukormentes extraktot, valamint cukrot tartalmaz.
A forgalomba hozatal előtt, tokaj - hegyaljai pincében három évig –a tokaji aszúeszenciát öt évig-, ebből a tokaji aszút legalább két évig, a tokaji aszúeszenciát legalább három évig fahordóban kell érlelni.
A Tokaji aszú puttonyszám szerint lehet
- 3 puttonyos, amely legalább 60g/l természetes cukrot és 25g/l cukormentes extraktot, - 4 puttonyos, amely legalább 90g/l természetes cukrot és 30g/l cukormentes extraktot, - 5 puttonyos, amely legalább 120g/l természetes cukrot és 35g/l cukormentes extraktot, - 6 puttonyos, amely legalább 150g/l természetes cukrot és 40g/l cukormentes extraktot tartalmaz.
A Tokaji aszúeszencia a kiemelkedő minőségű, kiválóan alkalmas területről és évjáratból származó aszúbor, amely legalább 180g/l természetes cukrot és 45g/l cukormentes extraktot tartalmaz (MAGYAR BORKÖNYV tervezet, 2002).
Az aszúkészítés az aszúbogyók feltárásával kezdődik, amelyhez az aszúszemeket külön gyűjtik hagyományosan csappal ellátott, álfenekes kádakba. Az összegyűjtött szemek egymásra nyomódása következtében nagy (350-800 g/l) cukor- és extrakttartalmú, illat- és zamatgazdag lé préselődik ki. Ez a nyers eszencia, amelyből lassú erjedéssel keletkezik a Tokaji eszencia borkülönlegesség, de többnyire nem önállóan kerül forgalomba, hanem az aszúborokhoz házasítják.
Az aszúbogyó feltárása az egyik legfontosabb mozzanat. Hagyományos módja az aszútészta készítése volt, amelyet hajdanán taposással, később a húsdaráló elvén működő, elektromos meghajtású géppel végeztek. Lényeges szempont, hogy a fizikai feltárás során a szőlőmagvak ne sérüljenek. Az aszútészta készítésének és egyidejűleg borral történő összekeverésének korszerűbb és kíméletesebb módja a csökkentett fordulatszámú Mohno – csigaszivattyús feltárás, amelynél a megnövelt saválló acél garatba öntött aszúbogyókat folyamatosan ráöntött borral mossák a szivattyúházba.
Az aszúbor készítésének hagyományos mértékegysége a gönci hordó (136-140 l) és a tokaj- hegyaljai puttony (25-27 kg aszúszem befogadásához). Az aszúkészítés puttonyszámát az határozta meg, hogy egy gönci hordónyi borhoz (musthoz) hány puttony aszútésztát adtak. Ma a klasszikus mértékegységek helyett a hektolitert és puttonyegységenként 20 kg-ot számítanak.
További munkafolyamat az aszútészta és a bor többszöri összekeveréséből, 24-36 órás áztatásból és préselésből áll (EPERJESI, 1998).
A következő lépés az erjesztés, amely az aszúkészítési technológia kritikus fázisa, irányítása még nincs kidolgozva. Az élesztőknek magas cukortartalommal, Botrytis okozta tápanyaghiánnyal, megváltozott mustösszetétellel, és amennyiben újborral történt az extrahálás, 6-8 % kezdeti alkoholtartalommal kell szembe nézniük. Mindezek következtében különösen a nagy puttonyszámú aszúborokban az erjedés nehezen indul be, általában több hónapig elhúzódik, vagy csak több részletben, évek alatt fejeződik be. Az is előfordulhat, hogy az erjedési folyamat nem fejeződik be a kívánt pontban, hanem 15-16 v/v% etanol tartalomig folytatódik, de az erjedés után a borban lévő, ki nem erjedt cukor az adott aszúkategóriában elfogadható szint alá csökken.
1. ábra
Tokaji borok készítésének technológiája
A lassan beinduló, hónapokig elhúzódó erjedés mellett tehát problémát jelent az erjedés megállítása a kívánt alkoholtartalom elérése után, amelynek eszköze lehet a pasztőrözés, a szűrési eljárások, kénezés és hűtés kombináció. Ezeknek a technikáknak a kidolgozása a jelenlegi fejlesztések másik legsürgetőbb feladata az irányított erjesztés megvalósítása mellett.
Tokaji fordítás
Az aszútésztára vagy a szamorodni törkölyére felöntött mustból vagy borból készült tokaji bor, amely jellegzetes ászkolási illattal és zamattal rendelkezik. Az aszúborokhoz hasonlóan több évig fahordóban érlelik.
Tokaji máslás
A szamorodni vagy az aszú seprőjére felöntött mustból vagy borból készült tokaji bor, amely jellegzetes ászkolási illattal és zamattal rendelkezik. Önállóan nem kerül forgalomba, de házasításhoz használható (EPERJESI, 1998).
A különböző bortípusok készítésének technológiáját az 1. ábra mutatja be.
2.2. Nemesrothadás
2.2.1. Az aszúsodás folyamata
A botrítiszes nemesrothadás, azaz aszúsodás kialakulásához legalább három alapvető feltételnek kell együttesen teljesülnie: a gombafertőzést indukáló nedves időjárás a szőlőt teljes érésben érje, ugyanakkor a bogyók épek, sérülésmentesek legyenek, a néhány napos csapadékos - párás időszak után pedig hosszú száraz periódus következzen (MAGYAR, 1998).
Maga a Botrytis részben szkleróciumok formájában telel át és már a virágzatot látens módon megfertőzi, másrészt konídiumok formájában kerül át egyik bogyóról a másikra. A növekedés száraz periódusban megakad, elegendő nedvességet biztosító körülmények között azonban a gomba csíratömlőt képez a vegetatív szövetek felületén a gázcserenyílások (sztómák) mentén. A különböző szőlőfajtáknak változatos számú gázcserenyílása lehetséges, amelyek a szőlőbogyó érési folyamatának csak kezdeti szakaszában működnek. A zsendülést megelőzően nekrózist szenvednek, és amint a bogyó növekedni kezd, az ezeket a nyílásokat körülvevő zónák felrepedeznek. Igy a szemmel láthatóan egészséges szőlőbogyók kutikulájában valójában 10 - 100 µm széles mikrosérülések találhatóak, amelyeken keresztül a hifák csíratömlői be tudnak hatolni a héjba, illetve a héj alá. A fertőzést a szőlőhéj felületén lévő tápanyagok megkönnyítik azáltal, hogy magas cukortartalmú kiszáradt nedvet lehet a mikrosérülések mentén találni, amelyből a Botrytis konídiumai növekedni tudnak. A szőlő úgy reagál a támadásra, hogy fitoalexineket, gomba gátló vegyületeket termel, amelyek korlátozzák a micélium növekedését.
A bogyóhéj alatt növekedő micéliumtömeg átszúrja a kutikulát, illetve átszövi azokat a réseket, amelyeket a behatoláshoz használt. Ekkorra a növényi szövetek sejtfala olyan nagy mértékben módosul, hogy már nem képes többé funkcionálni, vizet felvenni, a bogyó barnáskék, illetve csokoládé árnyalatúvá válik (DONECHE, 1993).
A bogyóhéj roncsolásában fontos szerepet játszanak a B. cinerea által termelt extracelluláris enzimek: endopoligalakturonáz, exopoligalaktoronáz, pektin-metil-észteráz, liáz. A bogyó összetételének megváltozásához más enzimek is hozzájárulnak: citáz, celluláz, glükozidáz, észteráz, oxidáló enzimek, proteáz, foszfolipáz (POPOVA, 1958).
A roncsolt és enzimesen fellazított bogyóhéjon keresztül a bogyó sok vizet veszít és értékes anyagai bekoncentrálódnak.
2. ábra: A Botrytis megtelepedése és növekedése 3.ábra: Beszövött nyílás, a bogyó mikrorepedés mellett, enzimes belsejéből kiszivárgó „könny-
szövetroncsolás csepp”
Fotó: Tátrai (személyes közlés) Fotó: Tátrai (személyes közlés)
A megnövekedett micélium-, fonaltömeg azonban nem fér el a bogyó belsejében, így a héj több helyen is felreped, a Botrytis fonalak a felszínre törnek (2. ábra). A fonalakról lefűződnek a konídiumok és megfertőzik a szomszédos bogyókat, ezáltal a nemesrothadásos folyamat terjedésnek indul.
A nemesrothadást tehát a gomba metabolizmusának biokémiai folyamatai, valamint a szőlő tőkén való száradásának, töppedésének fizikai változásai együttesen eredményezik (MAGYAR,1998).
Az aszúsodásnak a szívós bogyóhéj, a nyitott, laza szőlőfürt kedvez. Ilyen körülmények között a gombanövekedés korlátozott és a gomba metabolizmusa szabályozott módon megy végbe (JACKSON, 1994).
4. ábra: B.cinereá val fertőzött fürt a 5. ábra: Az aszúsodásban előrehaladt barnásszürke konídiumokkal, és állapotú töppedt szőlőbogyók, a dehidratált bogyókkal. a B.cinerea már nem nő.
Fotó: Mészáros (Disznókő Rt. közlése) Fotó: Mészáros (Disznókő Rt. közlése)
2.2.2. A nemesrothadás okozta kémiai változások 2.2.2.1. Cukortartalomban bekövetkező változások
A penészgomba anyagcseréjének következtében az abszolút cukormennyiség 34-45 % -os veszteséget szenved (EDELÉNYI, 1978). Ennek ellenére, a bogyó cukorkoncentrációjában a párolgás következtében nagyon jelentős növekedés tapasztalható. Mivel a Botrytis a glükózt előnyben részesíti a fruktózzal szemben, a glükóz:fruktóz arány 1 alá csökken (MAGYAR, 1998). A gomba a poliszacharidok és a pektinanyagok lebontásával jelentősen megnöveli egyéb hexózok (ramnóz, galaktóz, mannóz), a pentózok (arabinóz, xilóz), valamint a galakturonsav mennyiségét (DITTRICH és SPONHOLZ, 1985).
2.2.2.2. A szőlő szerves sav tartalmában bekövetkező változások
A Botrytis a must szerves savait jelentősen csökkenti, de a betöményedés következtében a titrálható savtartalom összességében csak kismértékben változik, általában nő. A gomba borkősav – felhasználása az aszúsodás során abszolút mennyiségben a 70-90 % -ot is elérheti, ami miatt a pH általában növekszik (MAGYAR, 1998). A gomba kisebb mértékben az almasavat is felhasználja, de az almasav koncentráció a vízvesztés következtében gyakran növekedést mutat (EDELÉNYI, 1978; FLAK, 1993).
A nemesrothadásos szőlőből készült borok egyik legjellemzőbb alkotórésze a glükonsav, amely a glükóz direkt oxidációjából keletkezik (DONECHE, 1993). A glükonsavat az élesztőgombák nem erjesztik, ezért a borokban is kimutatható. Annak ellenére, hogy a B. cinerea képes glükonsav termelésére, lehetséges, hogy az aszúbogyón található Gluconobacter oxydans ecetsavbaktérium termeli a glükonsav nagy részét (DITTRICH és SPONHOLZ, 1985).
A galakturonsav tartalomban bekövetkező növekedést is megfigyelték Botrytis fertőzött szőlőbogyók esetén (DITTRICH és SPONHOLZ, 1984). A sejtfalakban a pektin vegyületek enzimatikus hidrolíziséből származik ez a sav, amely átalakulhat enzimatikus oxidáció révén nyálkasavvá, melynek mennyisége a mustokban elérheti a 2 g/l értéket is (DONECHE, 1993). A galaktársav kalciumsója (nyálkasavas kalcium) jellegzetes, tű alakú, apró kristályokat képez, amelyek gyakorlatilag csak botritiszes borokban találhatók.
A nemesrothadás során az ecetsavtartalom általában 100-400 mg/l –rel növekszik, de ez nem a Botrytis, hanem a kísérő mikroflórában felszaporodó ecetsavbaktériumok tevékenységének eredménye (MAGYAR, 1998).
A botritiszes mustokra jellemző a kénessavat megkötő ketosavak nagy mennyisége. A piroszőlősav átlagosan másfélszerese, a 2-ketoglutársav pedig több mint kétszerese a közönséges mustokban mérhető értékeknek (DITTRICH, 1987). A botrítiszes must erjedése során a tiaminhiány következtében a ketosavak mennyisége tovább növekszik, ezért a botrítiszes borok kénessavmegkötő képessége nagyon magas.
2.2.2.3. Többértékű alkoholok
A megnövekedett glicerintartalom a nemesrothadásos mustok és borok igen fontos jellemzője, indikátora a botrítiszes tevékenységnek (EDELÉNYI, 1978). A glicerin is glükózból képződik, termelése változó a különféle B.cinerea törzsek esetén. A B.cinereá –n kívül más szőlőparazita penész fajok is képesek a glicerinképzésre: a Penicillium és Aspergillus törzsek esetében már 1962-ben megfigyelték a glicerinképzést (MÜHLBERGER és GROHMANN, 1962).
Az erjedés során keletkező glicerinmennyiség tág határok között ingadozik. Közönséges (nem botrítizált) borok esetében a glicerin tartalom átlag értékének a végső alkoholtartalom 8-10 %-át lehet tekinteni (DITTRICH, 1974), de a botrítizált borok esetében jóval magasabbak ezek az értékek. A közeg pH-ja nagymértékben befolyásolja a glicerin –termelést: az alacsonyabb pH a kedvezőbb. Az egészséges szőlő mustja csak nyomokban tartalmaz glicerint, de a nemesrothadásos szőlő mustjában a glicerin tartalom általában meghaladja az 5 g/l értéket. Mivel az erjedés során a glicerin tartalom tovább növekszik, az aszúsodott szőlőből készült borok glicerintartalma általában 10 g/l fölött van (DITTRICH és SPONHOLZ, 1975), de a tokaji aszúban gyakran a 20-30 g/l értéket is meghaladja. A glicerin a borok testességét és telt ízét
növeli, amelyhez egyidejűleg más poliolok képződése is hozzájárulhat: arabit, eritrit, mannit, mezo-inozit, szorbit, xilit (JACKSON, 1994).
2.2.2.4. Polifenolok
Különböző nyers aszúk kezelés előtti ún. összes polifenol-, katechin-, és leukoantocianin- tartalmát mutatja a 6. ábra. Ezeknek a polifenol –vegyületeknek antioxidáns, szabad gyökfogó tulajdonságuk következtében pozitív élettani hatást tulajdonítanak az orvosok.
Nyers aszúk kezelés előtt
0 200 400 600 800 1000 1200 1400
"Alapbor"
1998
minta mg/l
összes polifenol
katechin
leukoantocianin
6. ábra: Nyers aszúk különböző polifenol – vegyület tartalma (KÁLLAY, 2001)
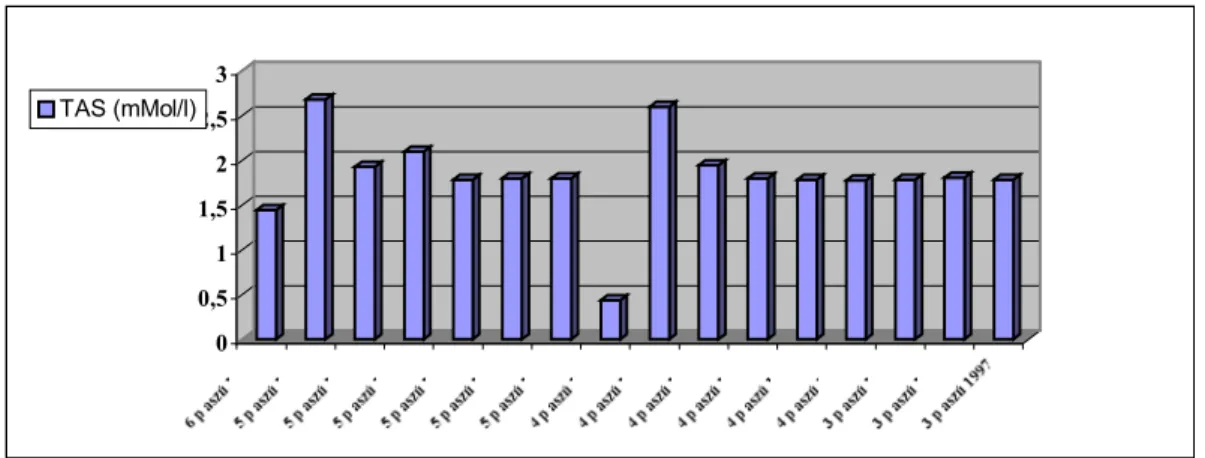
A vizsgált adatokból megállapítható, hogy a nyers aszúkban a polifenol - koncentráció magasabb, mint ami a fehérborokban általában előfordul, és inkább a vörösborok polifenol- koncentrációjához áll közelebb (KÁLLAY, 2001). Megmutatkozik ez a különbség a polifenolokhoz kapcsolható ún. teljes antioxidáns státusban (TAS – értékek) is. A 7. ábra mutatja be a különböző tokaji aszúborok antioxidáns státusát.
0 0,5 1 1,5 2 2,5 3 TAS (mMol/l)
7. ábra: Néhány vizsgált tokaji aszúbor TAS-értéke (KÁLLAY, 2001)
A tokaji aszúk antioxidáns státusa a 1.5-3 közötti értéket mutatja, ami 2-3 –szorosa a fehérborokénak, de még alacsonyabb, mint a vörösboroké. Elmondható, hogy a tokaji borkülönlegességek a fehérboroknál erősebb antioxidáns tulajdonságokkal rendelkeznek (KÁLLAY, 2001).
2.2.2.5. Aromaanyagok és egyéb összetevők
Az aromaanyagok nagymértékben módosulnak a nemesrothadás során. A gomba által termelt glükozidázok hidrolizálják a terpén-glikozidokat (GUNATA et al., 1989), továbbá bizonyos aldehidek alkohollá alakulnak át (BOCK et al., 1986). A B. cinerea számos illékony vegyületet képez: furfurolt, benzaldehidet, fenilacetaldehidet, benzilcianidot és az ún. gomba –alkoholt (1- oktén-3-ol). Az aszúborok mézre emlékeztető illatában kulcsszerepe van a szotolon nevű laktonnak (JACKSON, 1994). Ezen kívül több olyan észter típusú vegyületet is kimutattak (oxo-, hidroxi- és dikarbonsavas etilészterek), amelyek egészséges szőlőkben alig találhatók (KERÉNYI, 1976). KERÉNYI GC-MS technikával a neutrális aromaanyagok közül 118 komponenst azonosított. A botritisz aminosav-felhasználása következtében viszonylag alacsony volt a C3-C5 alkoholok mennyisége, és feltűnő a terpénalkoholok hiánya, amelyeket a botritisz lebont.
Sok más gombához hasonlóan a B. cinerea egy extracelluláris enzimet, a p-difenol-oxigén- oxidoreduktázt, a lakkázt termeli, amely oxidál több fenolos vegyületet. A fehér szőlők fenolos vegyületeit kinonokká alakítja át, melyek hajlamosak a barna vegyületek képződésével járó polimerizációra. Ezek a folyamatok a botrítiszes mustok és borok színének barnulását eredményezik. Az aszúsodott mustban a magas cukortartalom korlátozza az oxigén beoldódását, gátolja a lakkáz-aktivitást (DONECHE, 1993).
A B. cinerea tevékenységének következtében átlagosan 40 % -kal csökken a must aminosavtartalma, további 27-45 % -os csökkenés következik be mind az egészséges, mind a botrítiszes must erjesztésekor (DITTRICH és SPONHOLZ, 1975).
A vitaminok közül a nemesrothadás folyamatára jellemző a piridoxin és főleg a tiamintartalom nagymértékű csökkenése.
Az egyszerű nitrogénvegyületek nagymértékű csökkenése mellett az aszúmustok fehérjetartalma jelentősen növekedhet, ami a poliszacharidokkal együtt megnehezíti a bor stabilizálhatóságát.
2.2.3. Az aszúbogyó mikroflórája
Elvileg feltételezhető, hogy a nemesrothadásos szőlő mikroflórája nagymértékben eltér az egészséges szőlő felületén megtalálható mikroorganizmus - összetételtől. Az ép, egészséges
szőlőbogyó összetételét a felületén található szaprofita élesztő-, és penészgombák, valamint baktériumok gyakorlatilag nem befolyásolják, hiszen a bogyóhéjon keresztül nem férhetnek hozzá a bogyóhúsban lokalizált musthoz. A Botrytis által enzimesen fellazított, illetve elpusztult epidermisz-szövet azonban már átjárhatóvá válik a must, illetve a felületi szaprobionta mikroflóra számára, így a B. cinerea tevékenysége a korábban ismertetett minőségjavulás mellett a társult mikroflóra összetételében is változást idéz elő (MAGYAR, 1998).
2.2.3.1. Penészgomba-összetétel
A tokaji aszúszemek penészgomba flóráját KALMÁR és munkatársai (1999) vizsgálták. Az egyes szőlőfajták aszúszemeinek penészflóra összetételéről a 1. táblázat ad felvilágosítást.
1. táblázat: Az 1998-as évjárat érési időszakában képződött aszúszemek penészgomba flórája (KALMÁR et al., 1999). A táblázatban közölt számok az izolált penészgomba telepek számát jelölik.
Szőlőfajták Hárslevelű Furmint Sárga musk. Hárslevelű Furmint Mntázás
időpontja
Október 8. Október 8.
Október 8. Október 29. Október 29.
ÖSSZES
Mucor mucedo 1 1 2
M. circinelloides 1 1
Aspergillus repens 1 1
A. nidulans 1 1
A. tereus 1 1 2
A. niger 1 2 1 1 5
Aspergillus sp. 1 1 2
Penicillium albidum 1 1 2
P. notatum 2 1 1 4
Penicillium sp. 3 2 1 2 8
Botrytis cinerea 2 3 1 2 2 10
Botrytis sp. 2 1 1 1 5
ÖSSZES 15 9 5 9 5 43
• Botrytis cinerea
A penészgomba flóra összetevői között a legnagyobb részt a B. cinerea teszi ki. Ez a faj taxonómiai szempontból egy aszkospórás gomba, a Botryotinia fuckeliana konídiumos formája, amely a Discomycetes sorozat, Helotiales rendjének Sclerotiniaceae családjához tartozik (DONECHE, 1993). Fakultatív parazita penészgomba, tehát nemcsak a növényen, hanem élettelen szerves anyagon is szaporodik. Többnyire súlyos kártevő (szürkerothadás), de speciális körülmények esetén a korábban ismertetett nemesrothadást okozza. Mikotoxinokat nem termel.
Ivartalan szaporodása blasztokonídiumokkal történik, amelyek egyszerű, elágazó tartók végén, gömb alakú csoportokban, szabadon helyezkednek el (8. ábra). A konídium - csoportok alakja
gyakran a szőlőfürthöz hasonlít, amely nyomán kapta a gomba tudományos nevét a görög szőlőfürt szóból (JACKSON, 1994). A nagy tömegű konídium makroszkóposan vattaszerű, barnásszürke színű (9. ábra).
8. ábra: A B. cinerea blasztokonídium 9. ábra: A B. cinerea konídiumtermelő
elhelyezkedésének telepének makroszkópos képe
elektronmikroszkópos felvétele Fotó: Tátrai (személyes közlés) Fotó: BKÁE, Elektronmikroszkóp labor
• Penicillium és Aspergillus fajok
Az aszúbogyó felületén számos más penészgomba faj is megtalálható annak ellenére, hogy a B. cinerea fékezi más gombák növekedését. A Penicillium és Aspergillus fajok imperfekt, konídiumos penészgombák, amelyek perfekt alakjai az aszkospórás gombák különböző nemzetségein belül találhatóak. Nagyon elterjedt szaprofiton fajok.
A Penicillium alaknemzetség fajaiban a fialid típusú konídiogén sejtek ecsetszerűen elágazó tartókon helyezkednek el (10. ábra). A szőlőbogyón a B.cinerea után a leggyakrabban előforduló penészgomba fajok (RADLER és THEIS, 1972). A P. notatum és P.chrysogenum fontos, az aszúbogyón is megjelenő fajok, antimikrobás anyagcseretermékük a penicillin.
Az Aspergillus alaknemzetség fajaiban a konídiumláncokat képező fialidok bunkószerűen kiszélesedő konídiumtartókon, radiálisan helyezkednek el. A szőlő rothadási folyamataiban nem játszanak aktív szerepet, bár a társuló mikroflórában kimutathatóak elég nagy számban (1.
táblázat).
10. ábra: A Penicillium alaknemzetség
Fotó: Fifth Kingdom Online, http://www.mycolog.com
A Penicillium és Aspergillus fajok tevékenysége kellemetlen íz- és illatanyagok kialakulásához vezet. Például, a Penicillium frequentans műanyag és penészes illatot idéz elő a sztirén (JOURET et al., 1972) szintézisén keresztül. Továbbá ezek a fajok több mikotoxin képződéséért felelőssé tehetők, amelyek közül különös figyelmet érdemel az Ochratoxin-A, mert ez a mikotoxin a must savas pH-ján is képződhet. Az Ochratoxin-A több Aspergillus, valamint Penicillium faj által termelt mikotoxin, amelyet korábban csak takarmányból, állati vérből, valamint kis vízaktivitású élelmi anyagból (kávé, gabona) mutattak ki, de az utóbbi években borban való előfordulásáról is beszámoltak külföldi források. KÁLLAY és MAGYAR vizsgálataik során több Botrytis cinerea és Penicillium törzset izolált tokaji aszúbogyók felületéről, és steril mustra oltva vizsgálták a törzsek esetleges toxintermelését. OTA termelést két hét alatt nem tapasztaltak. Üzemi körülmények között feldolgozott és frissen kiáztatott nyers aszúban az OTA kis koncentrációban kimutatható volt, de az erjedés során ez az érték lényegesen lecsökkent jóval az EU országokban előírt határérték (1 µg/l) alá (KÁLLAY és MAGYAR, 2000).
• Egyéb penészgombák
A rothadásos folyamatok társ-mikroorganizmusai között rendkívül elterjedtek a sporangiospórás penészgombák. Rendszertanilag a Zygomycota tagozatba tartozó gombák, ivaros szaporodásuk ún. zigospóra- (járomspóra-) képzéssel megy végbe. A Botrytis, Penicillium, Aspergillus fajoktól eltérően nem konídiumokkal, hanem endogén, ivartalan spórákkal történik a vegetatív szaporodás, amelyek jellegzetes, nyélen ülő sporangiumban fejlődnek (MAGYAR, 1998).
Leggyakoribb képviselőjük az aszúbogyókon a Mucor nemzetségbe sorolható. Gyorsan növekvő, laza, többnyire fekete telepeket képeznek (fejespenészek) és kellemetlen, dohos szagot okoznak.
2.2.3.2. Élesztőflóra
Nagyszámú vizsgálat eredménye igazolta világszerte, hogy az egészséges, ép szőlőbogyón nem a Saccharomyces fajok, sokkal inkább a Hanseniaspora és Kloeckera fajok dominálnak.
Európában a legnagyobb számban a Kloeckera apiculata detektálható. Kisebb előfordulási gyakorisággal Hansenula anomala (érvényes név: Pichia anomala), Metschnikowia pulcherrima és Pichia membranifaciens fordul elő (LAFON - LAFOURCADE, 1979), de ezek mellett számos egyéb fajt is izoláltak, Candida, Kluyveromyces, Rhodotorula, Cryptococcus fajokat (FLEET, 1993).
Az aszúbogyók természetes élesztőflórájának összetételét és borászati jelentőségét lényegesen kevesebben tanulmányozták.
A C. stellata dominánssá válását a szőlőbogyókon gyakran összefüggésbe hozzák a Botrytis cinereá –val történő fertőzéssel (FLEET és HEARD, 1993). DOMERCQ 1957-ben Franciaországban végzett vizsgálatai alapján megállapította, hogy az aszúsodott szőlőn a Candida stellata (syn. Torulopsis stellata, T. bacillaris) dominál, a Kloeckera populáció visszaszorul. GANDINI (1973) vizsgálatai megerősítették azt az eredményt. A botrítiszes szőlő mustjában domináns élesztőfaj a C. stellata, emellett Kloeckera apiculata és C. vini volt megtalálható. A Mediterrán–övezet borvidékein és Ausztráliában végzett vizsgálatok azonban a C. stellata nagy sejtszámban történő előfordulásáról számolnak be az egészséges szőlő esetében is (MORA et al., 1988, MARTINEZ et al., 1989, FLEET és HEARD, 1993).
MAGYAR és munkatársai (1996) két Tokaj-hegyaljai pincészetben (Mádon és Sárospatakon) vizsgálták az élesztő populációt és annak változását aszúkészítés során. Az aszúbogyó mintákat nem az ültetvényről, hanem az üzemből vették. A Mádon végzett vizsgálatok azt az eredményt mutatták, hogy a nemesrothadásos szőlőbogyók felületén C. stellata és egyéb Candida fajok voltak a legnagyobb számban detektálhatóak, utánuk következett nagyságrendben a cukortűrő Zyg. rouxii. A továbbiakban detektálható mennyiségben T’spora delbrueckii és a Zyg. bailii volt jelen. Közvetlenül a bogyóról nem sikerült Saccharomyces fajokat izolálni.
Amint a vizsgálatok mutatják, a C. stellata (11. ábra) egyes borvidékeken a szőlőbogyón nagyon elterjedt élesztő, a szürkerothadásos, illetve aszúsodott szőlő mikroflórájában azonban domináns szerepet tölthet be. Hártyát nem képez, így nem tekinthető virágélesztőnek. Apró sejtű, cukortűrő, viszonylag jó erjesztőképességű faj, ezért a borok spontán erjedésében hosszú ideig szerepet játszhat.
A Candida fajok másik jellgzetes képviselője a Candida pulcherrima (teleomorf alakja a Metschnikowia pulcherrima) (12. ábra), amely az aszúbogyókon gyakran megjelenik, valamint mustokban is elterjedten megtalálható (MAGYAR, 1998). Jellegzetessége, hogy szilárd
táptalajon nem karotinoid típusú, piros festékanyagot termel. Különleges, tű alakú meiospórákat képez. Gyengén erjeszt, egyes törzsei hártyát is képezhetnek.
11. ábra: Aszúszemről izolált C. stellata 12. ábra: Aszúszemről izolált C. pulcherrima mikroszkópos felvétele mikroszkópos felvétele
2.2.4. A különböző élesztőfajok szerepe a tokaji aszú erjesztésében
Az aszúszemeken található élesztőbiota borászati jelentőségét két pontban lehet összefoglalni:
1. A felületi élesztőbiota lényeges hatást gyakorolhat az aszúszemek tárolása során a bogyóban lezajló kémiai változásokra, azaz befolyásolhatja a feldolgozásra kerülő aszúszem kémiai összetételét.
2. Az aszúszemek élesztőbiotája az aszúborkészítés során átkerül a nyers aszúba, és –főleg spontán erjedés esetén –elméletileg lényeges szerepet játszik az aszúerjesztésben, illetve annak kezdeti szakaszában.
Kísérleti munkám kezdetekor az 1. pontban említett változásokról gyakorlatilag nem találtam publikált adatokat a szakirodalomban.
Az aszúerjesztés mikrobiológiai hátteréről már található néhány publikáció, bár a téma részletesebb feltárása kísérleti munkámmal párhuzamosan folyik a SZIE Borászati Tanszékén, Mikrobiológia és Biotechnológia Tanszékén, valamint a Debreceni Egyetem Genetikai és Molekuláris Biológiai Tanszékén.
Az aszúalapok erjesztéseinek nehézségei (2.1.4.1. fejezet) a nagy cukortartalomra, a kezdeti magas alkohol koncentrációra, az egyes rendelkezésre álló tápanyagok korlátozott mennyiségére,
a Botriticin gátló hatására, valamint az élesztőbiota összetételére vezethetők vissza. A nagy cukorkoncentráció szignifikánsan csökkenti a kierjeszthető cukor mennyiségét és növeli az élesztőgombák ecetsavtermelését. Az aszúborokban a nagy cukortartalom és a már kezdetben is jelen lévő alkoholtartalom gátló hatása szinergensen felerősítik egymást (FLEET, 1989). Az élesztők számára hasznosítható nitrogéntartalmú vegyületek (elsősorban az aminosavak), valamint a vitaminok (tiamin, piridoxin) mennyisége a B. cinerea tevékenységének következtében csökken, ami lassú, vontatott erjedéshez vezet. A Botriticin egy olyan poliszacharid, amely az erjedést gátolja, emellett fokozza, stimulálja a borélesztők ecetsav termelését az erjedés végső fázisában (DONECHE, 1993).
Az aszúborkészítés során az erjedést legnagyobb mértékben az élesztőpopuláció összetétele, aktivitása, valamint változása befolyásolja.
2.2.4.1. A spontán aszúerjesztés élesztőflórájának alakulása
MINARIK és munkatársai (1963) vizsgálatokat végeztek arra vonatkozóan, hogy a Tokaj- hegyaljai borvidék szlovákiai részén a fehér borokra jellemző mikroflórától az aszúszemeket tartalmazó édes borok élesztőflórája különbözik-e. Az élesztőket már kierjedt, (kétszer fejtett) 2 éves óborokból izolálták, ezért az adatokból az erjedés során bekövetkezett változásokra nem lehet következtetni. Megállapították, hogy az alapvető különbség abban áll, hogy az aszúborokban dominánsan előforduló Saccharomyces fajok mellett más élesztőgombák, elsősorban Candida fajok is előfordultak (a taxonok a Lodder – Kreger-van-Rij 1952-es értelmezést jelölik). Ezeket az élesztőket viszonylag jó glükóz erjesztés jellemezte. A normál borokban csak spóraképző fajok (elsősorban Saccharomyces oviformis, S. vini, S. bayanus és S.
carlbergensis) voltak megtalálhatóak.
MIKLÓS és munkatársai (1994) tokaji aszúbor illetve aszúeszencia utóerjedéséért felelős élesztőgombákat izoláltak és identifikáltak. Az izolált törzsek a Saccharomyces cerevisiae különböző fiziológiai változataiba (S. capensis, illetve S. aceti) tartoztak és genetikailag meghatározottan nagy ozmotoleranciával (ezzel párhuzamosan normális alkoholtoleranciával) rendelkeztek. A közleményből azonban nem lehet következtetni a vizsgált törzsek eredetére, sőt a szerzők azt sugallják, hogy ezek a törzsek nem az aszúbogyó természetes mikroflórájából származnak, hanem „szennyező” élesztőként kerültek be a borba, közelebbről meg nem nevezett forrásból.
MAGYAR (1996) két pincészetnél vizsgálta az aszúkészítés és aszúerjesztés természetes élesztőflóráját Sárospatakon és Mádon. Kutatásainak egyik célja a spontán aszúerjesztés
mikrobiológiai hátterének tanulmányozása volt, a vizsgálatok másik célja olyan jó tulajdonságú helyi élesztőtörzsek szelektálására irányult, amelyek alkalmasak lehetnek az aszúerjesztés irányítására. A kísérleti munka során számos helyi borélesztő törzset izoláltak és szelektáltak spontán erjedésű aszúborokból.
Az aszúfeldolgozás, illetve erjesztés különböző fázisaiban az élesztőflóra összetételének változását mutatja a 2. táblázat (az aszúszemek áztatását teljesen kierjedt, száraz újborral végezték.
2. táblázat: Az élesztőflóra összetételének változása az aszúfeldolgozás és erjesztés különböző fázisaiban (MAGYAR, 1996). A táblázatban szereplő taxonómiai elnevezések a Lodder – Kreger-van-Rij (1952) monográfia értelmezését jelölik.
Fázis Alkohol, v/v% Izolált nemzetség
vagy faj
Nagyságrend, sejt/cm3
Azonosított izolátumok száma
Aszúbogyó - Candida stellata
Candida spp.
Zygosaccharomyces rouxii
Torulaspora delbrueckii Zygosaccharomyces bailii
106 105 104
102 101
5 2 3
2 1
12.9 Saccharomyces cerevisiae Sacch. cer. var. bayanus Candida spp.
102 101 100
3 2 1
Aszúalapbor 8.65 Candida stellata Zygosaccharomyces rouxii
Candida magnoliae Sacch. cer. var. bayanus Zygosaccharomyces bailii
104 104
103 102 101
2 2
1 2 2
Erjedő aszú 2 hét 8.89 Zygosacch. rouxii Candida stellata Candida spp.
Zygosacch. bailii
104 103 103 101
3 2 3 1
4 hét 9.78 Sacch. cer. var. bayanus Sacch. cerevisiae Candida stellata Candida spp.
106 105 102 102
4 3 2 1
6 hét 15.91 Sacch. cer. var. bayanus Sacch. cerevisiae Candida stellata
106 104 101
4 2 1
A kísérletek során megállapította, hogy amennyiben az aszúborok áztatását óborral vagy teljesen kierjedt újborral végzik, a kezdeti élesztőflórában nem-Saccharomyces élesztők, elsősorban C.
stellata, Torulaspora és Zygosaccharomyces fajok dominálnak, amelyek az aszúszemről kerülnek a nyers aszúba, de a mérhető erjedést már az időközben felszaporodó Saccharomyces törzsek végzik. Ezeket az eredményeket későbbi vizsgálatok is megerősítették (KARDOS, 1998;
MAGYAR et al., 1999a; MARÁZ et al., 2000). Hagyományos módszerekkel végzett identifikálás alapján az aszúborokat ténylegesen erjesztő Saccharomyces törzsek a S. cerevisiae faj különböző változatainak bizonyultak.
A spontán erjedő aszúborok élesztőflóráját az áztatáshoz felhasznált közeg (must vagy bor) nagymértékben befolyásolja (MAGYAR, 1996; MAGYAR et al., 1999b). Amennyiben az áztatást erjedő musttal (vagy nem teljesen kierjedt borral) végzik, a Saccharomyces törzsek már az erjedés kezdetétől túlsúlyban vannak és az aszúszemről származó élesztőket gyorsan visszaszorítják. Megfigyelték, hogy amíg az utóbbi borokból elsősorban a Saccharomyces cerevisiae galaktózt hasznosító változatai izolálhatók, addig a száraz borokkal vagy óborral extrahált aszúkban nagyobb a Saccharomyces törzsek diverzitása, és elsősorban galaktóz negatív változatok (S. cerevisiae var. bayanus, aceti, heterogenicus) fordulnak elő. Elektroforézises kariotipizálás alapján ezek a törzsek a S. cerevisiae fajba sorolhatók. A fenti szerzők a mai értelmezés (MARTINI és MARTINI, 1998) szerint önálló Saccharomyces bayanus fajba tartozó élesztőket csak ritkán izoláltak erjedő tokaji aszúborokból, bár az izolátumok molekuláris biológiai analízisét eddig csak részben végezték el.
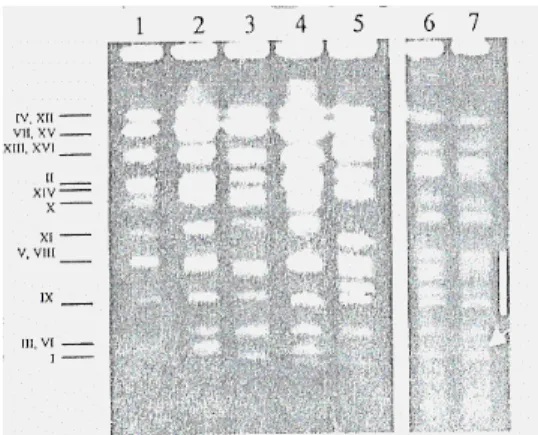
Más szerzők ugyanakkor a Sacch. bayanus fajt a Tokaj-hegyaljai borélesztők tipikus képviselőjének találták. SIPICZKI és munkatársai (2001) részlegesen (10 % -ban) aszúsodott Furmint spontán erjedését tanulmányozták. A vizsgálataik során az erjedés különböző fázisaiból élesztőtörzseket izoláltak, majd azonosították őket. A Saccharomyces sensu stricto fajok (S.
bayanus, S. cerevisiae, S. paradoxus) jellemző karotípusait az élesztőgombák kromoszómás DNS-molekuláinak elektroforézises elválasztásával (RFE – módszerrel) határozták meg (13.
ábra).
A három izolált Saccharomyces sensu stricto faj genetikai stabilitását, alkohol, réz és kén-dioxid ellenálló képességét vizsgálták, valamint az optimális szaporodási hőmérsékleti tartományokat és a másodlagos anyagcsere termékek képzését. A vizsgálatok a következő eredményre vezettek: az erjedés első fázisában a nem-Saccharomyces élesztőfajok (Debaryomyces (22%), Hanseniaspora (30%), Rhodotorula (8%), Torulaspora (1%)) domináltak, az aszúkészítéshez felhasznált aszúbogyóról származó élesztőtörzsek. Saccharomyces fajok 39 %-ban voltak jelen. Az erjedés további fázisaiban gyorsan felváltotta a nem-Saccharomyces fajokat egy heterogén
Saccharomyces populáció, majd pedig az erjedés végére a Saccharomyces bayanus vált dominánssá (90 %).
13. ábra: A standard törzsek és az izolátumok elektroforézises karotípusai: (1) S.cerevisiae S288c típusú standard törzs, (2) 227 jelzésű erjedő borból izolált élesztőtörzs, (3) S.paradoxus CBS 432, (4) 2317 jelzésű izolált élesztőtörzs, (5)-(6) 2422 jelzésű izolált élesztőtörzs, (7) S.bayanus CBS 380. A függőleges vonal a 7-es oszlopban a S. bayanus jellemző kromoszóma régióját jelölik (SIPICZKI, 2001).
NAUMOV és munkatársai (2002) régi, Minárik professzor által Szlovákia területén izolált Tokaj-hegyaljai borélesztők, valamint újabb izolátumok kariotipizálása során azt találta, hogy a S. bayanus var. uvarum előfordulása a borvidéken gyakori. Meg kell jegyezni, hogy a vizsgált izolátumok itt sem aszúerjesztési fázisokból származtak. A szlovákiai törzsek pontos eredetét nem közlik, a tokaji törzsek kisebb részét Tokaji Eszenciából, nagyobb részét üzemben tárolt aszúbogyók felületéről vagy Furmint borból izolálták.
2.2.4.2. Kísérletek élesztő starterkultúrák alkalmazására
A spontán aszúerjedés populáció dinamikájának tanulmányozása mellett több kísérletet végeztek a természetes élesztőflórára ráoltott starterkultúrákkal is (MAGYAR et al., 1999a, b;
MARÁZ et al., 2002). A helyi élesztőflórából szelektált starterkultúrák általában lényegesen gyorsították az erjedést és gyorsan elnyomták a nem-Saccharomyces fajokat, de egyébként a spontán erjedéshez hasonló borminőséget eredményeztek (TÓTH-MÁRKUS et al., 2002;
MAGYAR et al., 2003). A C. stellata –ról, illetve a C. zemplinina –ról azonban megállapították, hogy jelentős csíraszámban viszonylag hosszú ideig részt vehetnek az erjedésben. Bár az eddigi vizsgálatok a C. zemplinina tiszta illetve kevert tenyészeteivel arra utalnak, hogy ez az élesztő
nagyon kevés cukrot használ fel (JUHÁSZ, 1997; TAMASKÓ, 1999; MARÁZ et al., 2000) és nem termel speciális aromaanyagokat (TÓTH-MÁRKUS et al., 2002), a vizsgálatokat tovább kell folytatni a vadélesztő flóra, köztük az aszúbogyóról származó élesztők tényleges szerepének feltárására.
Fontos megjegyezni, hogy az utóbbi kísérletekben Candida stellata –nak tekintett törzsről (PM 602) a közelmúltban megállapították, hogy kariotípusa lényegesen különbözik a C. stellata típustörzsétől (POMÁZI et al., 2003), ellenben megegyezik a SIPICZKI és munkatársai (2003) által új fajként leírt Candida zemplinina –val.
2.3. Az aszúbogyón előforduló penészgomba törzsek antibiotikum termelése 2.3.1. Penicillinek
Több mint 70 évvel ezelőtt, 1929-ben Fleming felfedezése a Penicillium notatum baktériumnövekedés-gátló anyagcseretermékére, a penicillinre vonatkozóan megteremtette a modern antimikróbás kemoterápia alapjait.
Számos Penicillium (29)- és Aspergillus (10) -faj anyagcseretermékként penicillin-t termel, elsősorban a Penicillium notatum és a Penicillium chrysogenum (Clarke et al., 1949). A penicillin kettős, béta-laktám- és tiazolidingyűrű, melynek 6-os szénatomjához oldallánc kapcsolódik (14. ábra).
14. ábra: A penicillinek kémiai szerkezete (GRABER, 1993)
Az aszúszemek felületén nagy mennyiségben, 102-104 sejt/g bogyó nagyságrendben, illetve a konídiumos növekedésnek kedvező nedves évjáratokban 103-106 sejt/g mennyiséget is elérő számban fordulnak elő Penicillium - törzsek. Felmerül annak kérdése, hogy ezek a törzsek termelnek-e penicillint.
A penicillin a baktériumsejt falára ható antibiotikum, a hatásmód valamennyi részlete nem ismert. A sejtfal peptidoglikánvázának felépítését gátolja több támadásponton keresztül (ABRAHAM, 1981). A baktérium-sejt szilárd vázát keresztkötésekkel összekapcsolt peptidláncok alkotják, felépítésüket, azaz a peptido-glükánok hálósodását, enzimek végzik. A penicillin ezekhez a peptidázokhoz kötődik (peptido-glükáz-transzpeptidáz, D-alanin-karboxi- peptidáz), és inaktiválja azokat. A baktérium penicillin-érzékenységét ezek a penicillinkötő fehérjék (penicillin-binding proteins, PBP) határozzák meg. A penicillin kis koncentrációban a sejt morfológiai változását, torz formák, óriássejtek kialakulását okozza, nagyobb koncentrációban a baktérium feloldódik, elpusztul. A Gram-pozitív baktériumok penicillinérzékenységének oka, hogy faluk peptidoglikánja a penicillin számára hozzáférhető, amíg a Gram-negatívokét fehérjeréteg védi (GRABER, 1993).
A penicillin még 1:50 – 1:100 milliószoros hígításban, tehát 1 – 0.01 γ/ml töménységben is képes érzékeny baktériumok osztódását megakadályozni. Hatékony sztafilokokkuszok, sztreptokokkuszok, gonokokkuszok, szpirochéták ellen. A penicillin csak növekedésben levő baktériumok ellen hatékony, nyugvó állapotban levő baktériumspórák ellen hatástalan;
megakadályozza például növekvő Staphylococcus aureus tenyészetek ribonukleinsav-szintézisét, glutaminsav-felhalmozó és guanozin-oxidáló képességét. A glutaminsav-anyagcsere megzavarásával megakad a penicillinnel kezelt baktériumok fehérjeszintézise is. Más esetekben azt gyanítják, hogy a penicillin megzavarja fontos nukleotidok foszforilációját a baktérium testében (RÖMPP, 1961).
Az elmúlt 60 évben több baktérium esetében is hirtelen rezisztencia fejlődött ki a béta-laktám antibiotikumokkal szemben (ABRAHAM és CHAIN, 1940). Ezt a bakteriális ellenállást több tényező is kiválthatja (GHUYSEN, 1980), a legjelentősebb a béta-laktamáz enzim termelődése.
A penicillin érzékeny savas és bázikus közegre egyaránt, az antibakteriális aktivitás mindezek függvényében nagymértékben változik. A béta –laktám gyűrű könnyen felhasad, így a béta- laktamázt (penicillinázt) termelő mikroorganizmusok könnyen rezisztenssé válhatnak, mert bontják a gyűrűt. Akárcsak egyes szulfonamidok esetében, várható, hogy a penicillin hatékonysága a jövőben fokozatosan csökkenni fog (jelenleg is ismeretesek olyan gonokokkusz- törzsek, amelyek a penicillinnek ellenállnak), minthogy az ellenálló baktériumtörzsek száma erősen nő, és sok ellenállóbb baktériummutáció keletkezik.
Minden antibiotikumnak van antibakteriális spektruma és aktivitásának mértéke. Spektrum vagy hatásszélesség alatt azt értjük, hogy az adott szer melyik baktérium- (illetve vírus-, gomba-, protozoon-) species ellen hatékony; az aktivitás ennek számszerű kifejezése: milyen töménység szükséges a kórokozó gátlására, illetve elölésére (MIC: minimális inhibitor koncentráció). A penicillinre érzékeny mikroorganizmusok esetében általában 2 mg/l a MIC –érték. Világszerte észlelték azonban rezisztens törzsek megjelenését (MIC 2 mg/l fölött), ami bizonytalanná teszi az egyes penicillin – származékok hatékonyságát.
A 6-os szénatomhoz kapcsolódó oldalláncok szerint a Penicillin-F (pentenylpenicillin), Penicillin-K (heptylpenicillin), Penicillin-N, Penicillin-G (benzylpenicillin), Penicillin-V (fenoximetilpenicillin) a természetesen képződő származékok (15. ábra).
A csekély számú utalás szerint (ARNSTEIN és MORRIS, 1960, FLYNN et al., 1962, CHAN et al., 1976, ELANDER és AOKI, 1982) a Penicillium chrysogenum és Penicillium notatum törzsek enzimrendszere képes termelni a felsorolt penicillin-származékokat megfelelő prekurzorok jelenléte esetén. P. notatum –ot izoláltak már aszúbogyó felületéről KALMÁR és társai 1999 –ben (2.2.3.1. fejezet). Az aszúbogyó belsejében, valamint az aszúborokban jelen vannak különböző illófenolok, ánizsaldehidek, fahéjsav-származékok, valamint a cisztein, és a valin aminosavak, amelyekből a ß –laktám gyűrűt tartalmazó penicillin-származékok kialakulhatnak. A különböző penicillin-vegyületek említett érzékenységüknél fogva sav és lúg hatására bomlanak, egyedül a penicillin-V (C16H18N2O5S) áll ellen a savaknak. Ebből következik tehát, hogy az aszúborok savtartalma miatt elméleti alapja csak ezen vegyület vizsgálatának van.
A világ borászati szakirodalmában mindeddig nem találtunk adatokat arra vonatkozóan, hogy tartalmaznak-e az aszúbogyók és aszúborok penicillin-t, pedig elméletileg van rá lehetőség.
15. ábra: Természetes penicillin származékok (GRABER, 1993)
2.3.2. A Botrytis cinerea antibiotikum termelése
A B. cinerea nemcsak lebontani, hanem szintetizálni is képes poliszacharidokat, amelyeknek eddig két típusát különítették el. A botrítiszes glükán ß-D-térállású glikozidos kötésekkel kapcsolódó, nagy molekulatömegű glükóz-polimer, amely a borok szűrhetőségét lényegesen rontja. A másik vegyületcsoportot kisebb molekulájú, galaktózban és mannózban gazdag heteropoliszacharid alkotja, amely az alkoholos erjedést gátolja, valamint az ecetsavképződést fokozza az alkoholos termelés rovására az erjedés során. Ez utóbbi poliszacharidot a Botrytis termelte antibiotikumnak tartották és „botryticin” -nek nevezték (RIBÉREAU-GAYON,1979).
A Botrytis cinerea a mai ismeretek alapján nem termel antibiotikumot.
3. KISÉRLETI CÉLKITŰZÉS
Kísérleti munkámat két nagyobb részre lehet elkülöníteni. Első részében a botrítiszes szőlő mikroflórája állt a vizsgálataim középpontjában, másik részében az aszúbogyók, nyersaszúk és aszúborok penicillin- tartalmának meghatározása volt a feladat.
A tokaji aszúborokat ma általánosan spontán erjesztéssel készítik, de az utóbbi években egyes pincészetekben egyre inkább felmerült az erjedés irányításának igénye. Az irányított erjesztés lehetőségének mérlegeléséhez alapvető ismeretek hiányoznak a természetes élesztőflóra taxonómiai összetételére vonatkozóan. Kísérleti témám borászati jelentőségét elsősorban az adja, hogy a spontán erjedést részben az aszúbogyóról származó fajoknak kell megindítani.
Jelenlétükkel, esetleges versenyképességükkel a fajélesztős beoltás esetén is számolni kell.
Mindezeket figyelembe véve a vizsgálataim során az alábbi kérdésekre kerestem a választ:
- Az aszúszemek mikrobiotájában az élesztő- és penészgombák milyen mennyiségben fordulnak elő?
- Hogyan alakul az összes élesztőszámhoz viszonyítva az erjesztőképes élesztőszám?
- Milyen az élesztőflóra faji diverzitása?
- Az élesztőflóra összetétele hogyan alakul az évjárat függvényében?
- A tárolás során milyen változások következnek be az élesztő-, és penészgomba flórában?
- Melyek azok az aszúszemről izolált élesztőgomba törzsek, amelyek jelenlétével fajélesztős beoltás esetén is számolnunk kell?
- Az aszúsodás mechanizmusa mikroszkópikusan nyomon követhető-e?
A Botrytis cinerea okozta sérülések a bogyók felületén szabad utat biztosítanak egyéb penészgombák behatolásához a bogyó belsejébe, elsősorban Penicillium és Aspergillus fajok számára. A szőlőszemek és aszúborok nagy mennyiségben tartalmaznak cisztein és valin aminosavakat, illófenolokat, így megfelelő enzimrendszer segítségével kialakulhatnak penicillin – származékok. A penészgombák termelte antibiotikum képződés azonban az aszúbogyók és aszúborok esetében mindezidáig nem került tanulmányozásra. A Borászati Tanszéken végzett kutatómunkánk során az alábbi szempontokat vettük figyelembe:
- Az aszúbogyón jelen lévő számos Penicillium faj valamelyike a jelen levő prekurzorokból termel- e másodlagos anyagcseretermékként penicillint? Az évjáratbeli különbségek hogyan befolyásolják a kimutatható penicillin – tartalmat?
- Amennyiben mérhető az aszúbogyók esetében penicillin-koncentráció, lebomlik-e az aszúkészítés során, vagy mérhető koncentrációban megtalálható a kész aszúborokban is?
A kérdésfelvetések esetleges megválaszolása alapján munkám további feladata, hogy javaslatot tegyek az aszúszemek optimális tárolására vonatkozóan, valamint az aszúbogyók minőségi besorolására alkalmas paraméterek kiválasztására.
4. KISÉRLETI ANYAGOK ÉS MÓDSZEREK 4.1. A botrítiszes szőlő mikroflórájának tanulmányozása
4.1.1. Mintavétel, mintaelőkészítés
Az aszúszemeket a tőkéről, illetve a borászati üzemekben lévő tárolóedényzetből steril csipesszel, steril edénybe gyűjtöttem és a vizsgálatokig hűtőszekrényben tároltam. Az aszúbogyók felületén tapadt sejteket alapos rázással steril vízbe mostam be (5 g aszúbogyó+50 cm3 steril víz), majd hígitással és lemezöntéssel meghatároztam az egyes mikrobacsoportok élősejtszámát.
4.1.2. Élesztő- és penészgombaszám meghatározás
A leoltásokat a hígitási sor megfelelő tagjaiból 0,1 cm3 mintával, felületi szélesztéssel végeztem, hogy a további vizsgálatokhoz a jellemző telepek megkülönböztetését, illetve izolálását lehetővé tegyem.
Az összes élesztőszámot és penészszámot brómkrezolzöld indikátort tartalmazó táptalajon (BKZ) vagy savanyítással (pH 3,5 - 4) szelektívvé tett élesztőkivonat-glükóz (ÉG) agaron határoztam meg 1998 -ban és 1999 -ben. 2000 –ben és 2001 –ben az összes élesztő- és penészszám meghatározására diklorán-bengálrózsa-klorámfenikol (DRBC)-, illetve diklorán- glicerin (DG18) –agarokat (Merck készítmények) használtam, eltérően a korábban alkalmazott élesztőkivonat-pepton-glükóz agartól. A diklorán tartalom következtében a penészszám növekedése lassabb mértékűvé vált, valamint egyes diffúz kolóniát képző penésztörzsek (pl.
Mucor) telepképzése nem tette lehetetlenné a különféle élesztőtörzsek izolálását. A tenyésztést 28 °C - on három napig végeztem.
Az 1998 –as évjáratban az összes élesztőszámon belül az erjesztőképes élesztők számát is vizsgáltam oly módon, hogy a fent említett táptalajokra leoltott Petri–csészéket szénsav- atmoszférás körülmények közé helyeztem.
A nagy sav- és cukortűrő képességgel rendelkező fajok kimutatására a Borászati Tanszéken kidolgozott EGA táptalajt (ecetsav-glükóz agar) alkalmaztam. A vizsgálataim során Zygosaccharomyces bailii és Zygosaccharomyces bisporus jelenlétét, illetve hiányát próbáltam így meghatározni, amely fajok 1 % ecetsavtartalom mellett is növekszenek (KURTZMANN és FELL, 1998).
A penészszámon belül a Botrytis cinerea és az egyéb penészgombák számának elkülönítését a telepek megjelenési formája alapján végeztem el.
Az élősejtszámokat minden felsorolt mikroba csoport esetén az aszúbogyó minta 1 grammjára vonatkoztattam. A módszer kimutatási határa 102 sejt/1g bogyó volt.
A táptalajok összetételét a 1. Mellékletben adom meg.
4.1.3. Élesztőgombák identifikálása
A mennyiségi vizsgálatok során kitenyésztett mikrobatelepek közül a jellemző élesztőtörzseket izoláltam, szélesztéssel tisztítottam, majd klasszikus morfológiai és fiziológiai vizsgálatok alapján nemzetség illetve faj szintig identifikáltam Kurtzmann és Fell (1998) monográfiájának határozókulcsai alapján.
Az azonosítási vizsgálatokhoz 24-48 órás ferde agar tenyészeteket használtam.
A tápközegek összetételét a 1. Melléklet tartalmazza.
Meghatározáskor a következő vizsgálatokat végeztem:
4.1.3.1. Alaktani vizsgálatok
Az alaktani vizsgálatok közül mikroszkópos módszereket alkalmaztam. Egyszerű, natív mikroszkópos készítményben vizsgáltam a sejtek alakját, szaporodási módját táplevesben, illetve szilárd táptalajon, valamint a valódi- és álhifa képződést kukoricaliszt agaron.
4.1.3.2. Élettani vizsgálatok
• Ivaros spóraképzés
A spóráztatást acetát-, maláta-, és kukoricaliszt agaron végeztem. Mikroszkóppal figyeltem meg az esetleges konjugációt, spórák jelenlétét, alakját, számát, valamint a sporangiumfal tartósságát.
• Erjesztési próba
A glükóz erjesztését Durham - csövet tartalmazó táplevesben vizsgáltam. A csövek leolvasása kétnaponként történt, feljegyeztem a gáz-, sav-, gyűrű-, illetve hártyaképződést.
• Szénforrás asszimiláció
A szénforrás asszimilációt auxonográfiás módszerrel vizsgáltam, Wickerham - féle vitaminoldattal kiegészített C-alapagaron.
Vizsgált szénforrások: galaktóz, szacharóz, maltóz, cellobióz, trehalóz, raffinóz, xilóz, eritrit, mannit, inozit, melibióz, keményítő, laktóz,α-metil-D-glükozid, ramnóz.
• Nitrogénforrás asszimiláció
A vizsgálatot szintén auxonográfiás módszerrel végeztem, vitaminkeverékkel kiegészített N – alapagaron nitrogénforrásként szolgáló szubsztrátumok felhasználásával (16. ábra).
Vizsgált nitrogénforrások: lizin, etilamin, kálium-nitrát, ammónium-szulfát (kontroll).