MTA Doktori Pályázat Rövid értekezés
¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯
Az aszkorbát (C-vitamin) bioszintézise és
szerepei a fotoszintézisben és a zöldalgák hidrogéntermelésében
Tóth Szilvia Zita
SZEGEDI BIOLÓGIAI KUTATÓKÖZPONT NÖVÉNYBIOLÓGIAI INTÉZET
SZEGED, 2021
Nothing happens quite by chance.
It's a question of accretion of information and experience.
Jonas Salk
TARTALOMJEGYZÉK
Rövidítések jegyzéke 4
I. ÁLTALÁNOS BEVEZETÉS 6
I. 1. A C-vitamin (aszkorbát) antioxidáns és más élettani szerepei 6
I. 2. Az aszkorbát metabolizmusa magasabb rendű növényekben és a zöldalgákban 9
I. 3. Aszkorbát-transzporterek 11
I. 4. A magas aszkorbát-koncentráció lehetséges negatív hatásai növényekben 13
II.CÉLKITŰZÉSEK 15
III.ALKALMAZOTT ANYAGOK, MÓDSZEREK 16
III. 1. Arabidopsis thaliana és Chlamydomonas reinhardtii mutánsok, vonalak 16
III. 2. Módszerek 16
IV.EREDMÉNYEK ÉS MEGVITATÁSUK 17
IV. 1. Az aszkorbát a II. fotokémiai rendszer alternatív elektrondonora 17
IV. 2. Az aszkorbát alternatív elektrondonorként lassítja donor-oldali fotoinhibíciót 21
IV. 3. Az aszkorbát hosszan tartó sötétségben inaktiválja a vízbontó komplexet 25
IV. 4. Az aszkorbát bioszintézisének szabályozása zöldalgákban 29
IV. 5. Az aszkorbát szerepe az algák nem-fotokémiai kioltásában 33
IV. 6. Az aszkorbát hatása a zöldalgák hidrogéntermelésére 37
V.FŐBB KUTATÁSI EREDMÉNYEK ÖSSZEFOGLALÁSA 43
VI.IRODALOMJEGYZÉK 44
VII. SAJÁT KÖZLEMÉNYEK 54
VII. 1. Az értekezés alapjául szolgáló saját közlemények 54
VII. 2. Egyéb, első vagy utolsó szerzős közlemények 56
VIII. TUDOMÁNYMETRIAI ÖSSZESÍTÉS 58
IX.KÖSZÖNETNYILVÁNÍTÁS 59
X.FÜGGELÉK 60 Podmaniczki és mtsai (2021) Physiol Plantarum 171: 232-245
Vidal-Meireles és mtsai (2020) Plant Physiol 182: 597-611 Tóth és Yacoby I (2019) Trends Biotechnol 37: 1159-1163 Nagy és mtsai (2018) Plant J 94: 548-561
Tóth és mtsai (2018) Antiox Redox Signal 29: 1516-1533 Vidal-Meireles és mtsai (2017) New Phytol 214: 668-681 Nagy és mtsai (2016) Plant Cell Environ 39: 1460-1472 Fernie és Tóth (2015) Molecular Plant 8: 674-676 Tóth és mtsai (2013) Physiol Plantarum 148: 161-175 Nagy és mtsai (2012) Int J Hydrogen Energy 37: 8864-8871 Tóth és mtsai (2011) Plant Physiol 156: 382-392
Tóth és mtsai (2009) Plant Physiol 149: 1568-1578
Rövidítések jegyzéke
2-ODD 2-oxoglutarát-függő dioxigenázok APX aszkorbát-peroxidáz
AO aszkorbát-oxidáz
AtPHT4;4 Arabidopsis thaliana aszkorbát-foszfát transzporter 4;4 cit b6f citokróm b6f
CP43, CP47 a II. fotokémiai rendszer belső fénybegyűjtő antenna komplexei
csz citoszol
D1, D2 a II. fotokémiai rendszer reakciócentrum fehérjéi (más néven PsbA és PsbD) DCMU 3-(3,4-diklorofenil)-1,1-dimetilurea
DHA dehidro-aszkorbát
DHAR dehidro-aszkorbát reduktáz DPC difenilkarbazid
Fd ferredoxin
Fo, Fm a klorofill-a fluoreszcencia indukció kezdeti és maximális értéke Fv változó fluoreszcencia (Fm-Fo)
GC gázkromatográfia
GDH L-galaktóz dehidrogenáz GGP GDP-L-galaktóz foszforiláz GLDH L-galaktono-lakton dehidrogenáz GME GDP-mannóz-3’,5’-epimeráz GMP GDP-mannóz pirofoszforiláz GPP L-galaktóz-1-foszfát foszfatáz HydA [Fe-Fe]-típusú hidrogenáz
kp kloroplasztisz
LM linkomicin
m mitokondrium
MDA monodehidro-aszkorbát
MDAR monodehidro-aszkorbát reduktáz
Mn-centrum a vízbontó komplex aktív centruma, amely négy Mn-, egy Ca- és egy Cl-iont tartalmaz
MV metilviologén
n nukleusz
n. d. nem detektálható
NDH NAD(P)H dehidrogenáz enzim
NPQ nemfotokémiai kioltás (non-photochemical quenching) OEC vízbontó komplex (oxygen evolving complex)
OJIP gyors klorofill-a fluoreszcencia indukció
P680 a II. fotokémiai rendszer elsődleges elektrondonora P700 az I. fotokémiai rendszer elsődleges elektrondonora
PC plasztocianin
pm plazmamembrán
PQ plasztokinon
PSBO a vízbontó komplex 33 kDa-os külső fehérjéje PSI I. fotokémiai rendszer (photosystem I) PSII II. fotokémiai rendszer (photosystem II) QA a II. fotokémiai rendszer első kinon akceptora QB a II. fotokémiai rendszer második kinon akceptora r. e. relatív egység
RB Rose Bengal
ROS reaktív oxigénformák
SSTF egy töltésszétválasztást indukáló telítési fényimpulzus (saturating single turnover flash)
TAP Tris-acetát-foszfát tartalmú tápoldat zöldalgák neveléséhez TL termolumineszcencia
TyrZ tirozin Z , a D1 fehérje redox aktív aminosava
v vakuólum
VDE violaxantin-deepoxidáz
VTC2 GDP-L-galaktóz foszforilázt kódoló gén
I. ÁLTALÁNOS BEVEZETÉS
I. 1. A C-vitamin (aszkorbát) antioxidáns és más élettani szerepei
Az aszkorbát (Asc) az egyik legismertebb vitamin, ismertsége ellenére azonban még számos kérdés vár tisztázásra a bioszintézisét, degradációját és a sejtben betöltött szerepeit illetően. Az Asc az eukarióta szervezetek számára élettani szempontból nélkülözhetetlen, azonban érdekes módon egyes állatfajok és az ember szervezete nem képes termelni. Így, mi, emberek a növények által termelt Asc-ra vagyunk utalva.
Reaktív oxigénformák semlegesítése
Hidrofil jellege miatt az Asc vízben nagyon jól oldódik, kevésbé oldódik etanolban, és nem oldódik olajokban, zsírokban és zsíros oldószerekben. Egy elektron átadása egy redox partner számára monodehidroaszkorbát (MDA) gyök képződését eredményezi, amelyet aszkorbilcsoportnak is neveznek. A MDA diszmutációjával Asc és dehidro-aszkorbát (DHA) képződik (1. ábra; Smirnoff, 2018).
1. ábra. Az Asc redoxreakciói (zölddel jelölve) és lebomlása (pirossal jelölve); Smirnoff (2018) nyomán.
Növényekben az Asc legismertebb szerepe a fotoszintézis során a kloroplasztiszokban és a mitokondriumokban a légzés melléktermékeként képződött reaktív oxigénformák (ROS) felhalmozódásának megakadályozása (Foyer, 2018; Waszczak mtsai, 2018; Foyer és mtsai, 2020; 2. ábra). Az MDA-gyök gyenge reaktivitása miatt az Asc kiválóan alkalmas a ROS-ok semlegesítésére. Nem enzimatikus antioxidánsként az Asc képes semlegesíteni a szinglet
O
O— OH HO O
HO O
O• O—
HO O HO
O
O O HO O O HO
OH
O OH OH O
HO
MDA
DHA (biciklikus) DHA Asc
2,3-diketo-L-gulonát
D-xilulóz 5-P L-eritrulóz + oxálsav 4-oxalil L-treonsav
L-treonsav + oxálsav L-tartársav + glikolaldehid
APX/ AO MDAR
H2O DHAR
MDA Asc
oxigént (1O2), a hidroxilcsoportot (OH•), a tokoferol-gyököket, valamint a lipid-peroxilgyököket (Munné-Bosch, 2005). Emellett hatékonyan semlegesíti az aminosav-gyököket (tirozin, triptofán; Domazou és mtsai, 2009; Gebicki és mtsai, 2010).
Az Asc alapvető szerepet játszik a ROS-ok enzimatikus semlegesítésében is. A kloroplasztiszban a Mehler reakció során szuperoxid (O2-) keletkezik az I. fotokémiai rendszer (PSI) akceptor oldalán, az O2 ferredoxin (Fd) általi redukciója által (Asada, 2006). A O2--t a szuperoxid-diszmutáz H2O2-dá redukálja, amit az Asc-peroxidáz (APX) vízzé alakít. Az MDA-t a Fd vagy az Asc-glutation ciklus alakítja vissza Asc-tá. A monodehidro-aszkorbát reduktáz (MDAR) és a dehidro-aszkorbát reduktáz (DHAR) NADPH-t használ az Asc regenerálására növényekben (Asada, 2006; Foyer és Shigeoka, 2011) és mikroalgákban egyaránt (Curien és mtsai, 2016).
Az aszkorbát enzimatikus reakciókban betöltött szerepei
A ROS mennyiségének szabályozásában játszott szerepe mellett az Asc számos enzimatikus reakcióban vesz részt a növényi sejtben (2. ábra). Működhet chaperone-ként az enzimek aktív centrumában található Fe2+-centrumokat stabilizálva, katalitikus szereppel bírhat, vagy szubsztrátként vehet részt a különböző enzimatikus reakciókban.
A 2-oxoglutarát-függő dioxigenázok (2-ODD) aktív centrumában Fe található, amelyet az Asc chaperonként stabilizál (Myllyharju és Kivirikko, 1997). A 2-ODD enzimek szerepet játszanak a kollagén bioszintézisében, ezért alakul ki az emberben Asc hiányában skorbut (Myllyharju, 2003). Újabban pedig felfedezték, hogy 2-ODD enzimek részt vesznek a hiszton és DNS demetilációban, ezáltal a génexpresszió epigenetikus szabályozásában (Monfort és Wutz, 2013; Young és mtsai, 2015; Blaschke és mtsai, 2013; Camarena és Waszczak, 2016).
A növényekben számos 2-ODD enzim található, amelyek részt vesznek az etilén (Bassan és mtsai, 2006; Smith és mtsai, 1992; McGarvey és Christoffersen, 1992) az abszcizinsav és a giberrelinek bioszintézisében (López-Carbonell és mtsai, 2006; Pastori, 2003), valamint az auxin degradációjában (Palmieri és Giovinazzi, 1982; Porco és mtsai, 2016). A 2-ODD enzimek részt vesznek különböző szekunder metabolitok, mint például az antocianinok (Page és mtsai, 2012) és a glükozinolátok bioszintézisében is (Kliebenstein és mtsai, 2001).
A violaxantin-deepoxidáz (VDE) a kloroplasztisz tilakoid lumenjében található enzim, amely a violaxantin zeaxantinná történő, fényfüggő átalakítását végzi (Hallin és mtsai, 2016).
Magasabb rendű növényekben a VDE enzim által katalizált folyamatban az Asc redukálószerként vesz részt. A zeaxantin felhalmozódása növeli a fotoprotektív szereppel bíró hődisszipáció mértékét (nem-fotokémiai kioltás, NPQ; Ballottari és mtsai, 2014; Holt és mtsai, 2005; Niyogi és mtsai, 1998), valamint a zeaxanthin a ROS-ok semlegesítésében is részt vesz (Dall’Osto és mtsai, 2010; Dall’Osto és mtsai, 2012). Felfedeztük, hogy a magasabb rendű növényekkel ellentétben a zöldalgák VDE enzime nem igényel redukálószerként Asc-ot (ld. IV. 5.
fejezet; Függelék: Vidal-Meireles és mtsai, 2020).
2. ábra. Az Asc növényekben betöltött szerepei (Tóth és mtsai, 2018).
Az Asc Fe3+-redukciós képessége arra utal, hogy jelentős szerepet játszhat a vas felvételében. A vas felvétele során első lépésben a FRO (ferric reduction oxidase) a Fe3+-at redukálja, amelyet az IRT (iron-regulated transporter) vas-transzporter általi Fe2+-felvétel követ.
Ez a folyamat extracelluláris savasodással jár a H+-ATP szintáz aktivitása és citromsav-kiáramlás révén. Kimutatták, hogy vasfelvétel során Asc-kiáramlás is történik, és az Asc részt vesz az Fe3+
redukciójában (Grillet és mtsai, 2014). Az Asc-nak hasonló szerepe lehet zöldalgákban is, ugyanis vashiány esetén drasztikus Asc koncentráció-emelkedés figyelhető meg (Urzica és mtsai, 2012a).
Az aszkorbát hatása a II. fotokémiai rendszer működésére
A vízbontó komplex (OEC) károsodása esetén (amely felléphet hőstressz hatására), redukáló tulajdonságainak köszönhetően az Asc képes elektronokat szolgáltatni a II. fotokémiai rendszer (PSII) számára (Tóth és mtsai, 2007; Tóth és mtsai, 2009; IV. 1. fejezet). Az Asc-tól a PsbA (D1) fehérje redox aktív tirozin Z (TyrZ+) aminosaváig terjedő elektronátadás folyamata élettani szempontból releváns, ugyanis lelassítja a PSII reakciócentrumok inaktiválódását és lehetővé teszi a hőstresszből történő gyorsabb felépülést (részletesen a IV. 2. fejezetben;
Függelék: Tóth és mtsai, 2011). Emellett az Asc elektronokat szolgáltat a PSII-höz és a PSI-hez a NADP-almasav enzim típusú C4 növények hüvelyparenchima sejtjeiben, amelyek vízbontó képessége mérsékelt. Ennek a folyamatnak az élettani szerepe valószínűleg az, hogy PSI ciklikus elektrontranszportot és ezáltal az ATP szintézist tart fenn a hüvelyparenchima sejtekben (Ivanov és mtsai, 2007).
Az aszkorbát jeltátvitelben és epigenetikai szabályozásban betöltött szerepei
Az Asc jelentősen befolyásolja a H2O2 koncentrációját, aminek köszönhetően közvetett módon részt vesz a különböző jelátviteli folyamatokban, mint pl. az abszciszinsav-jelátvitelben (López-Carbonell és mtsai, 2006; Pastori, 2003), a retrográd jelátvitelben (Exposito-Rodriguez és mtsai, 2017), valamint szerepet játszik a sztómazáródás szabályozásában (Chen és Gallie 2004; Fotopoulos és mtsai, 2008; Shi és mtsai, 2012).
Fotoszintézis alternatív elektrondonora
Szabadgyökök semlegesítése Redox jelátvitel
Sejtosztódás Sejtfal bioszintézis
Génexpresszió szabályozása
Enzimaktivitás szabályozása Fénystressz elleni védelem
Az Asc kulcsszerepet játszik az epigenetikai szabályozásban azáltal, hogy fokozza a Jumonji-C domént tartalmazó hiszton-demetilázok és a TET fehérje aktivitását (Camarena és Wang, 2016), valamint a Chlamydomonas reinhardtii zöldalgában egy TET homológ, a 5mC- módosító enzim (CMD) Asc-ot használ szubsztrátként (Xue és mtsai, 2019). E folyamatok révén az Asc befolyásolhatja az embriófejlődést, a sejtek megnyúlását és a sejtciklust is (Chen és Gallie, 2012), illetve közvetett módon a fotoprotektív folyamatokat (Xue és mtsai, 2019).
I. 2. Az aszkorbát metabolizmusa magasabb rendű növényekben és zöldalgákban
Az aszkorbát bioszintézise
Az Asc bioszintézise a magasabb rendű növényekben a Smirnoff-Wheeler útvonalon zajlik (Wheeler és mtsai, 1998; 3. ábra). A folyamat során a citoplazmában a D-glükóz-6-P különböző intermediereken keresztül GDP-L-galaktózzá alakul. Ezt követi az Asc-bioszintézis első elkötelezett lépése, amelyet a VTC2 és VTC5 gének által kódolt enzim, a GDP-L-galaktóz foszforiláz (GGP) katalizál. A képződött L-galaktóz 1-P ezután L-galaktózzá, majd L-galaktono- 1,4-laktonná alakul a citoplazmában. Az utolsó lépés a mitokondriumban történik meg, ahol az I. mitokondriális komplexhez kapcsolódó L-galaktono-1,4-lakton-dehidrogenáz az L-galaktono- 1,4-lakton Asc-tá történő oxidációját katalizálja (Millar, 2003).
3. ábra. Az Asc-bioszintézis lépései magasabb rendű növényekben nagyrészt a citoszolban történnek, kivéve az utolsó lépést, mely a mitokondriumban játszódik le. GMP, GDP-D-mannóz pirofoszforiláz;
GME, GDP-D-mannóz-3’,5’-epimeráz; GGP, GDP-L- galaktóz foszforiláz; GPP, L-galaktóz-1-foszfát foszfatáz; GDH, L-galaktóz dehidrogenáz; GLDH, L- galaktono-1,4 lakton dehidrogenáz.
Növényekben a Smirnoff-Wheeler útvonalon kívül létezhet három, csekély jelentőségű alternatív útvonal: i) az L-gulóz útvonal (Wolucka és Van Montagu, 2007), ii) a galakturonát útvonal (Cruz-Rus és mtsai, 2010), (iii) és mio-inozitol útvonal (Lorence és mtsai, 2004).
D-mannóz-1-P
GDP-D-mannóz
GDP-L-galaktóz
L-galaktóz-1-P
L-galaktóz
L-galaktono-lakton
L-aszkorbát GMP
GME
GGP
GPP
GDH
GLDH
citoszolmitokondrium
Elképzelhető, hogy a galakturonát (más néven pektin-lebontó) útvonal szerepet játszik a termések érése során (Badejo és mtsai, 2012). Növényi levelekben azonban egyik alternatív útvonalra sem találtak egyértelmű bizonyítékot, sőt, A. thaliana VTC2/VTC5 dupla mutánsok csak Asc-tal kiegészített táptalajon képesek a túlélésre (Dowdle és mtsai, 2007), bizonyítva, hogy a Smirnoff-Wheeler útvonal elengedhetetlen a fiatal növények túléléséhez.
Az Asc-bioszintézis sebességét a GDP-L-galaktóz-foszforilázt kódoló VTC2 gén expressziós szintje nagy mértékben meghatározza, amely erősen függ a fényintenzitástól, és áttételesen a fotoszintetikus elektrontranszporttól (Kiyota és mtsai, 2006); e folyamat részletei azonban nem ismertek. Magasabb rendű növényekben az erős fényintenzitás (Dowdle és mtsai, 2007; Müller-Moulé és mtsai, 2003) mellett UV-B (Gao és Zhang 2008), ózon (Caregnato és mtsai, 2013), és sóstressz (Huang, 2005) hatására is mintegy két-háromszorosára nő az Asc- tartalom néhány nap leforgása alatt. Emellett magasabb rendű növényekben a VTC2 gén expresszióját és ezáltal az Asc-bioszintézist a cirkadián óra is szabályozza (Dowdle és mtsai, 2007).
Jótékony élettani hatásai miatt régóta folynak próbálkozások a növények Asc- tartalmának fokozására. Ennek a legkézenfekvőbb módja az, hogy a bioszintézisében részt vevő enzimeket túlexpresszálják. A. thaliana esetében különböző Asc-bioszintézis gének konstitutív expressziójával a levél Asc-tartalma kb. 2.5-szeres növekedését mutatott (Lisko és mtsai, 2014);
viszont átmeneti expressziós rendszerek esetén (pl. a kivi GGP, és a GME kifejeztetése dohánylevelekben) az Asc-tartalom akár nyolcszoros növekedése is megfigyelhető volt (Bulley és mtsai, 2009). A bioszintézis útvonal génjeinek konstitutív túlexpresszáltatása által elért mérsékeltebb növekedés legvalószínűbb oka az Asc által a VTC2 expressziójára (Dowdle és mtsai, 2007) és a GGP transzlációjára gyakorolt erőteljes visszacsatolási mechanizmus lehet (Laing és mtsai, 2015).
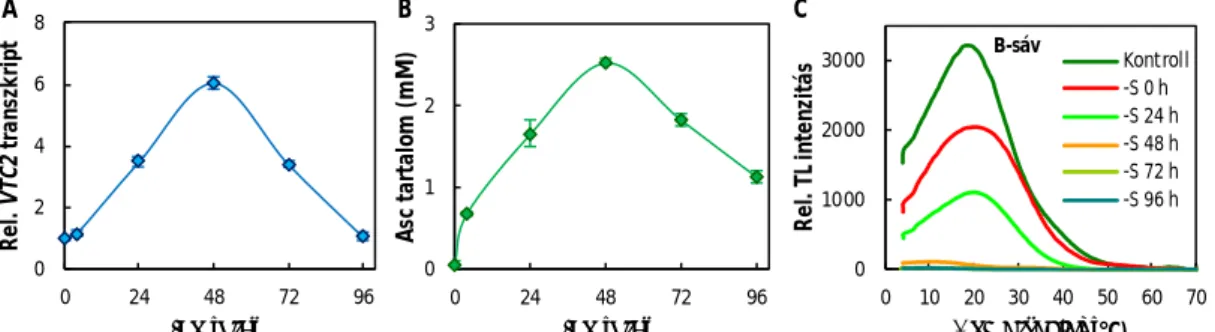
Az Asc bioszintézise és szabályozása kevésbé ismert nem edényes növényekben. A mohák és a zöldalgák mintegy századannyi Asc-ot tartalmaznak, mint a magasabb rendű növények (Gest és mtsai, 2013; Wheeler és mtsai, 2015), ezért felmerül a kérdés, hogy ezek a fajok hogyan tudnak megbirkózni a környezeti stresszhatásokkal ilyen alacsony Asc-tartalom mellett. Bizonyítottuk, hogy az Asc-bioszintézis a zöldalgák esetében is a Smirnoff-Wheeler útvonalon történik, valamint kimutattuk, hogy az élettani Asc-koncentrációtartományban nem működik negatív visszacsatolási mechanizmus, sőt, pozitív visszacsatolási (feedforward) szabályozás révén az Asc-bioszintézis nagyon gyors és többszörös növekedést mutat stresszkörülmények között zöldalgákban (részletesen a IV. 4. fejezetben; Függelék: Vidal- Meireles és mtsai, 2017).
Az aszkorbát regenerációja
Az Asc mennyiségét nem csak a bioszintézise, hanem annak regenerációja is szabályozza.
Az Asc különféle reakciókban, például ROS-ok semlegesítésekor, a violaxantin deepoxidációja
során a tilakoid lumenben, illetve a PSII felé történő elektronátadás során MDA-vá oxidálódik.
Az MDA a kloroplasztisz sztrómában a Fd-nal vagy MDAR-rel történő reakcióban visszaalakulhat Asc-tá (Asada, 2006). Az MDA a tilakoid lumenben (Fd és MDAR hiányában), spontán módon Asc-tá és a DHA-vá alakul, majd a DHA ezidáig nem azonosított Asc transzporterek útján a tilakoid lumenen keresztül átjut a sztrómába (Mano és mtsai, 2004). A DHAR alapvető szerepet játszik az Asc-koncentráció kívánt szintjének fenntartásában mind a kloroplasztiszban, mind más sejtkompartmentumokban: ha a DHA nem redukálódik, visszafordíthatatlan hidrolízisen megy keresztül (1. ábra), amelynek eredményeként az Asc mennyisége csökken. Mivel az Asc fontos redukálószer a növényekben, a DHAR hozzájárul a sejtek redox állapotának szabályozásához is.
A DHAR túltermeltetésével az Asc-tartalom megközelítőleg háromszoros növekedése érhető el magasabb rendű növényekben, ami jobb növekedést és nagyobb hőstresszel és metilviologén (MV) kezelésel szembeni toleranciát eredményezett (Wang és mtsai, 2010).
Viszont a DHAR túltermelő növények érzékenyebbek voltak a szárazságstresszre, mivel a DHA/Asc arány csökkenése folytán a H2O2 szignálmolekula mennyisége lecsökkent, ami által a sztómazáródás szabályozása nem volt megfelelő (Chen és Gallie, 2004).
Az aszkorbát lebontása
A növények Asc-tartalmát annak lebontása is szabályozza (1. ábra). A magasabb rendű növényekben az Asc lebomlása elsősorban DHA-n keresztül történik, amelynek a végtermékei az L-treonát és az oxalát, melléktermékként pedig H2O2 képződhet; a szőlőfélék (Vitaceae) családjában az Asc az L-tartarát útvonalon is bomlik (Green és Fry 2005; Truffault és mtsai, 2017). [14C] Asc jelölést használva, Truffault és mtsai (2017) megállapították, hogy az Asc lebomlása sötétben fokozottabb, mint fényben, és naponta a teljes Asc-tartalom mintegy 63%- a bomlik le. Megjegyzendő, hogy az Asc lebomlása az érés során fokozódik, és a keletkezett H2O2 és hidroxil gyök (OH•) hozzájárulnak a sejtfalak fellazulásához (Dumville és Fry, 2003).
Felfedeztük, hogy a zöldalgákban az Asc lebontása nagyon gyors: fény-sötét átmenet során az Asc fél-életideje mintegy 2 óra (Függelék: Vidal-Meireles és mtsai, 2017); viszont az Asc lebomlási útja ismeretlen és még az is tisztázásra vár, hogy vajon az Asc lebontásának sebessége zöldalgákban szabályozott módon zajlik-e.
I. 3. Aszkorbát-transzporterek
Mérete és negatív töltése miatt az Asc nem tud szabadon átdiffundálni a biológiai membránokon, és valószínűleg a semleges DHA sem elegendően lipofil ahhoz, hogy egyszerű diffúzióval hatékonyan átjusson a lipid membránokon (Rose, 1988). Az Asc bioszintézisének utolsó lépése a mitokondriumokban történik, ezért az Asc transzporterek valószínűleg nélkülözhetetlenek az Asc optimális koncentrációjának (mM tartomány) fenntartásához a
különféle sejkompartmentumokban, beleértve a kloroplasztiszt, a sejtmagot, a citoszolt, a sejtfalat és a vakuólumot, valamint az apoplasztot (4. ábra, Fernie és Tóth, 2015).
Ezidáig növényekben molekuláris szinten egyetlen Asc transzportert azonosítottak, a kloroplasztisz burkolómembránjában található, a foszfát-transzporterek családjába tartozó AtPHT4;4 fehérjét (Miyaji és mtsai, 2015). Az AtPHT4; 4 knockout mutánsok kloroplasztiszaiban az Asc-szint alacsonyabb volt, mint a vad típusban, aminek következtében az NPQ lecsökkent.
A növény növekedését és a fotoszintézis hatékonyságát azonban nem befolyásolta az AtPHT4;4 hiánya, ami arra utal, hogy az AtPHT4;4 mellett létezik más Asc-transzporter is a kloroplasztiszban burkolómembránjában (Fernie és Tóth, 2015).
4. ábra. Azonosított és feltételezett Asc-transzporterek a növényi sejtben. Az Asc-bioszintézis utolsó lépése a mitokondriumban játszódik le, ahonnan az Asc az összes többi sejtorganellumba szállítódik. A következő Asc-transzporterek ismertek: 1) DHA transzporter a plazmamembránban, 2) egy DHA transzporter a mitokondriumban, amely valószínűleg a glükóz transzporterekhez hasonló, 3) AtPHT4;4 a kloroplasztisz burkolómembránjában. Az ábrán láthtó a többi feltételezett, de még nem jellemzett és azonosított Asc- és DHA-transzporter. Rövidítések: csz, citoszol; kp, kloroplaszt; m, mitokondrium; n, nukleusz; v, vakuólum (Fernie és Tóth, 2015).
A DHA plazmamembránon keresztül történő felvételét transzporterek végzik, amelyek a korábbi feltételezésekkel ellentétben nem glükóz-carrierek (Szarka és mtsai, 2013). Emellett anion-csatornán át történő Asc-effluxot is kimutattak (Makavitskaya és mtsai, 2018), valamint a mitokondriumban DHA transzporter-aktivitást mértek, amely hasonlóságot mutat a glükóz transzporterekével (Szarka és mtsai, 2004). E transzporterek molekuláris azonosítása azonban még nem történt meg. Ezen kívül nagyon valószínű, hogy Asc- és DHA-transzporterek találhatók a tilakoid membránban is, amelyek lehetővé teszik a DHA hatékony regenerálódását és a folyamatos Asc-ellátást a tilakoid lumenben (Fernie és Tóth, 2015). Miyaji és mtsai (2015) feltételezték, hogy az AtPHT4;1 egy tilakoid membránban lokalizált Asc transzporter lehet, ám később kiderült, hogy ez valószínűleg téves hipotézis volt (Karlsson és mtsai, 2015). A
Asc n
v
kp m csz
zöldalgákban és az egyéb egysejtű fotoszintetizáló fajokban eddig nem azonosítottak egyetlen Asc-transzportert sem.
I. 4. A magas aszkorbát-koncentráció lehetséges negatív hatásai növényekben
Sokáig úgy gondolták, hogy a ROS-ok negatívan befolyásolják a sejtek működését és a növények életképességét. Az utóbbi években paradigmaváltás történt, ugyanis egyre több eredmény igazolja, hogy a ROS-ok jelentős szerepet játszanak a környezeti akklimatizációban és az ahhoz szükséges jelátvitelben (Foyer és Noctor, 2016; Loiacono és De Tullio, 2012;
Inupakutika és mtsai, 2016; Mittler, 2017). A ROS-ok emellett szükségesek a fehérje transzlációhoz, és befolyásolják a sejtek redoxpotenciálját, amelyek hatással van a különböző redox-érzékeny fehérjék működésére.
Az Asc mennyisége meghatározza a kloroplasztiszban található APX-ok aktivitását, amely közvetlen hatással van a H2O2 szintre, amely retrográd szignálként működik (Maruta és mtsai, 2016). A DHAR fentebb említett túltermeltetése az Asc-tartalom többszörös növekedését eredményezte, de ennek következtében a növények kevésbé alkalmazkodtak az szárazságstresszhez a csökkent H2O2-jelátvitel miatt (Chen és Gallie, 2004). Ebben az összefüggésben a növényi antioxidáns rendszer szerepe a ROS mennyiségének szabályozása vagy szükség esetén csökkentése, nem pedig annak teljes semlegesítése. Ez azt is jelentheti, hogy a növények különféle szabályozási mechanizmusokat fejleszthettek ki az antioxidánsok túltermelésének elkerülésére, mint például az Asc által a VTC2 expressziójára és transzlációjára gyakorolt negatív visszacsatolási mechanizmust (Dowdle és mtsai, 2007; Laing és mtsai, 2015).
A magas Asc-tartalmú növények előállítását illetően ez azt jelentheti, hogy még ha sikerül is kiküszöbölni az Asc-bioszintézis szabályozására szolgáló visszacsatolási mechanizmusokat, a növények valószínűleg nem mutatnának növekedett stressz-toleranciát, hanem e helyett az akklimatizációs válaszok hatékonysága csökkenne. A megoldás a feltételezett vakuoláris Asc transzporterek (Dumville és Fry, 2003) túltermeltetése lehet az Asc-bioszintézisben részt vevő enzimek túltermeltetése mellett, amely lehetővé tenné az Asc felhalmozódását a vakuólumban, a többi sejtkompartmentumban az élettani Asc koncentrációk fenntartása mellett (Tóth és mtsai, 2018).
Az Asc feltételezett negatív szerepeit illetően figyelembe veendő az Asc redukáló tulajdonsága. A reduktánsok felhalmozódása megváltoztathatja a sejtek redox egyensúlyát, ami rendkívül fontos a redox-függő szabályozás alatt álló enzimek számára. A redox egyensúly megváltozása a kloroplasztiszban zajló fotoszintetikus elektrontranszport folyamatokat is megzavarhatja, amely végső soron fotoinhibícióhoz vezethet (Scheibe és mtsai, 2005;
Zaffagnini és mtsai, 2019). Felfedeztük, hogy a zöldalgák kénmegvonása során az Asc olyan mértékben felhalmozódhat (a ≅100 µM-osról a mM-os tartományba), hogy redukálja és inaktiválja az OEC Mn-klaszterét (részletesen a IV. 6. fejezetben, Függelék: Nagy és mtsai, 2016;
Nagy és mtsai, 2018). Magasabb rendű növények tilakoid lumenjében néhány mM-os koncentrációban található meg Asc, melynek redukáló hatása ellen az OEC-t a külső fehérjék védik; viszont hosszú sötétadaptálásnak kitett növények esetében ez a védőhatás nem érvényesül kellő mértékben, és az OEC inaktiválódik (részletesen a IV. 3. fejezetben, Függelék:
Podmaniczki és mtsai, 2021).
Az Asc speciális esetekben prooxidánsként is viselkedhet. A Fenton-reakció izolált tilakoid membránokban felléphet (Upham és Jahnke, 1986). Az apoplasztban pedig hozzájárul a poliszacharidok nem enzimatikus vágásához, ami a sejtfal meglazulásához vezet a gyümölcsök érése (Dumville és Fry, 2003; Fry és mtsai, 2001; Müller és mtsai, 2009; Schopfer és mtsai, 2002) és a sejtek expanziója során (KC és mtsai, 2005; Muñoz-Montesino és mtsai, 2014).
Az Asc lebomlása során H2O2 is képződik (Green és Fry 2005, Kärkönen és Fry, 2006), ami szintén hozzájárulhat az Asc prooxidáns hatásához. Ezért stresszkörülmények között (amikor az Asc oxidációja nagyobb sebességgel zajlik, mint a regenerációja) előfordulhat, hogy az Asc oxidációja során jelentős mennyiségű H2O2 képződik, és így a stresszállapot tovább súlyosbodhat.
Az Asc tehát sokkal több, mint antioxidáns. Az Asc változatos élettani szerepei és lehetséges káros hatásai alapján úgy tűnik, hogy koncentrációjának megfelelő tartományban történő fenntartása nagy élettani jelentőséggel bír a növények számára.
Az Asc-koncentráció emelése ezért nem csak a bioszintézis fokozásával, hanem további szabályozási pontként az Asc lebomlásának és transzportjának a módosításával érhető el;
mindkét mechanizmus megértése, megismerése még további vizsgálatokat igényel, amelyek végső soron elvezethetnek a mezőgazdasági termények Asc-tartalmának jelentős fokozásához.
II.CÉLKITŰZÉSEK
A PhD dolgozatom (2006) megvédését követően tudományos munkásságom egyik fő célja az Asc növényekben és zöldalgákban betöltött szerepeinek és metabolizmusának alaposabb felderítése volt. Ebben a témakörben levelező szerzőként leközölt cikkeim célkitűzései a következők voltak:
1. A PSII alternatív elektrondonorának azonosítása (IV.1. fejezet; függelék: Tóth és mtsai, 2009).
2. Az Asc alternatív PSII elektrondonorként betöltött élettani szerepének meghatározása (IV.
2. fejezet; függelék: Tóth és mtsai, 2011; összefoglaló cikk: Tóth és mtsai, 2013).
3. Az Asc vízbontó komplex működésére gyakorolt hatásának vizsgálata sötét-indukált szeneszcencia során (IV. 3. fejezet; függelék: Podmaniczki és mtsai, 2021).
4. A zöldalgák Asc-bioszintézisének vizsgálata (IV. 4. fejezet; függelék: Vidal-Meireles és mtsai, 2017; összefoglaló cikk: Tóth és mtsai, 2018).
5. Az Asc szerepének meghatározása a zöldalgák NPQ folyamataiban (IV. 5. fejezet; függelék:
Vidal-Meireles és mtsai, 2020).
6. Az Asc szerepének feltárása a zöldalgák H2-termelésében (IV. 6. fejezet; függelék: Nagy és mtsai, 2012; Nagy és mtsai, 2016; Nagy és mtsai, 2018; összefoglaló cikk: Tóth és Yacoby, 2019).
III. ALKALMAZOTT ANYAGOK, MÓDSZEREK
III. 1. Arabidopsis thaliana és Chlamydomonas reinhardtii mutánsok, vonalak
A magasabb rendű modellszervezetünk a lúdfű (Arabidopsis thaliana) volt.
Kísérleteinkhez Asc-deficiens (vtc2-1, vtc2-3, vtc2-4) mutánsokat, Asc-túltermelő (miox-4) transzgénikus vonalakat, valamint psbo1 és psbr mutáns A. thaliana növényeket használtunk fel.
A növényeket növénynevelő kamrában, standard körülmények között neveltük. A stresszkezelések magukban foglaltak magas fényintenzitáson történő rövid vagy hosszú időtartamú kezeléseket, valamint rövid idejű hőstresszt. A biofizikai mérések legnagyobb részben intakt leveleken történtek, egyes esetekben tilakoid membránokat izoláltunk.
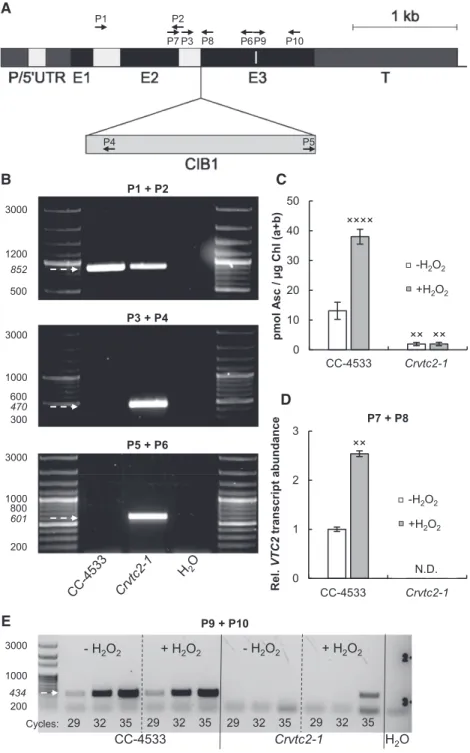
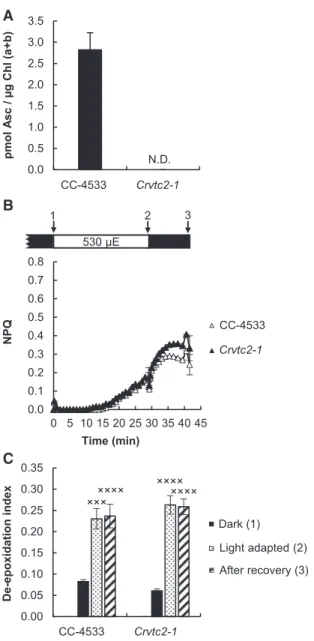
A zöldalga-modellszervezet a Chlamydomonas reinhardtii volt, amelynek a következő törzseit használtuk a kísérleteinkhez: CC-124, CC-849, CC-400, CC-409, CC-125 (www.chlamycollection.org), valamint az S-01 jelű vonalon (Nagy és mtsai, 2012, 2015) is végeztünk kísérleteket. Ezek mellett a Chlamydomonas Library Project (CLiP)-ben azonosítottunk egy Asc-deficiens inszerciós mutánst, amelyet Crvtc2-1-nek neveztünk el, illetve magunk állítottunk elő vtc2-amiRNS vonalakat.
A C. reinhardtii-t mixotróf vagy fotoautotróf módon neveltük a kísérletek céljainak megfelelő fényintenzitásokon. A H2-termelés megindításához az algakultúrákat kénmegvonásnak tettük ki.
III. 2. Módszerek Biofizikai módszerek
A fotoszintetikus aktivitás mérésére a következő biofizikai módszereket használtuk:
gyors (OJIP) és modulált klorofill-a fluoreszcencia, 820 nm-en mért abszorbancia, 520 nm-en mért abszorbancia, illetve használtunk egy saját készítésű termolumineszcencia-mérő készüléket is.
Analitikai módszerek
A legjelentősebb analitikai módszereink: Folyadékkromatográfia (HPLC) az Asc és egyes karotenoidok mennyiségének meghatározására, gázkromatográfia (GC) a H2 és O2
mennyiségének meghatározására, keményítőtartalom meghatározása, különböző fotoszintetikus alegységek szemikvantitatív meghatározására western blot analízis segítségével.
Molekuláris biológiai módszerek
DNS és RNS izolálás, PCR, qRT-PCR, klónozás, transzformálás, amiRNS C. reinhardtii vonalak létrehozása, genetikai komplementálás.
IV. EREDMÉNYEK ÉS MEGVITATÁSUK
IV. 1. Az aszkorbát a II. fotokémiai rendszer alternatív elektrondonora
Bevezetés: A hőstressz fotoszintetikus elektrontranszportra gyakorolt hatása
A növények és a fotoszintetizáló mikroorganizmusok végzik a napfény energiájának átalakítását, melynek során megkötik a légköri CO2-t, O2-t termelnek, valamint cukrokat és más értékes tápanyagokat állítanak elő. Az évmilliók alatt, a fotoszintézis során képződött biomassza a fosszilis energiahordozók forrása is, melyet ma olyan mértékben használunk fel, hogy az ezzel együtt járó CO2-emissziót a Földet borító növényzet nem képes kompenzálni, ami által a légköri CO2 koncentráció és a Föld átlaghőmérséklete folyamatosan emelkedik. A növények és a fotoszintetizáló mikroorganizmusok felelősek a primér biomassza termeléséért is, amely lehetővé tette a heterotróf szervezetek és végső soron az emberi faj kialakulását a Földön.
Az O2-fejlődésért a PSII egyik fő komponense, az OEC a felelős, amely a kloroplasztisz tilakoid membrán rendszerében, annak lumen felőli oldalán helyezkedik el (5. ábra). Az OEC központi eleme a Mn-klaszter, amelyet négy Mn-ion, egy Ca2+ és egy Cl- alkot, amelyet a lumen felőli oldalon fehérje alegységek (növényekben és zöldalgákban PSBO, PSBP, PSBQ, PSBR) vesznek körbe (Allahverdiyeva és mtsai, 2013; Bricker és mtsai, 2012). A PSII reakciócentrumban lezajló töltésszeparációk hatására a Mn-klaszter S0 kiindulási állapotból S1,
5. ábra. A magasabb rendű növények fotoszintetikus elektrontranszportja. A kloroplasztiszban kódolt polipeptid alegységek zöld színnnel, a nukleuszban kódolt alegységek sárga színnel jelöltek.
Rövidítések: cytb6f: citokróm b6f komplex; Fd: ferredoxin; Lhc: klorofill a/b fénybegyűjtő pigment- protein komplexek; PC: plasztocianin; PQ: plasztokinon, PSI: I. fotokémiai rendszer; PSII: II.
fotokémiai rendszer; P680: a PSII elsődleges elektrondonora; P700: a PSI elsődleges elektrondonora;
QA: a PSII elsődleges kinon akceptora. Forrás: Allen és mtsai (2011).
S2, S3, S4 oxidációs állapotba kerül, ami a pozitív töltések összegyűjtését szolgálja a vízbontás számára. Az oxigén felszabadulása az S4 állapotnál következik be, amely során az S4 állapot S0- ba alakul át, majd a vízbontó komplexbe két H2O molekula kötődik be, és ezzel helyreáll az S0
állapot (összefoglaló cikk: Lubitz és mtsai, 2019; Najafpour és mtsai, 2020). Az vízbontó komplexből az elektronok 0,1-0,8 ms alatt jutnak el az oxidált állapotú TyrZ-re, majd innen kb.
20 ns alatt a PSII reakciócentrumba, pontosabban a P680+-hoz (5. ábra).
A fotoszintézis folyamata számos környezeti stresszhatás során szenvedhet károsodást.
Hőstressz hatására az OEC külső fehérjéi (elsősorban a PSBO) leválnak a komplexről (Nash és mtsai, 1985; Enami és mtsai, 1994), amely együtt jár két Mn-ion, a Cl--ion, valamint a Ca2+-ion elvesztésével (Barra és mtsai, 2005; Popelkova és mtsai, 2011), ami végül az OEC teljes inaktivációját eredményezi. Hőstressz hatására a PSII akceptor oldalán zajló elektrontranszport lelassul (Ducruet és Lemoine 1985), valamint a PsbA (D1) és PsbD (D2) fehérjék is degradálódhatnak (De Las Rivas és Barber, 1997; Yoshioka és mtsai, 2006).
Rövid idejű hősokk hatására (40 s, 50°C-os vízfürdőben) a vízbontó komplexek teljes mértékben inaktiválódnak, ennek ellenére számottevő elektrontranszport-aktivitást figyeltünk meg a kezelt levelekben (Tóth és mtsai, 2005). Kimutattuk, hogy ilyen körülmények között a vízmolekulák helyett nagy mennyiségben jelenlévő, alternatív elektrondonorok juttatnak elektronokat a PSII-höz (Tóth és mtsai, 2007).
In vitro kísérletek alapján ismert volt, hogy számos vegyület képes PSII elektrondonorként viselkedni, mint pl. Asc, Mn2+, hidroxilamin, N,N,N’,N’-tetramethyl-p- phenylenediamine (Katoh és San Pietro, 1967; Yamashita és Butler, 1968). Mano és mtsai (1997) kimutatták, hogy kémiai kezelésnek (TRIS-mosás) kitett izolált tilakoid membránokban a difenil-karbazid (DPC) és az Asc alternatív elektrondonorként hatnak, és folyamatos elektrontranszportot fenntartva védik a PSII reakciócentrumot a fotoinhibícióval szemben. Az is ismert volt, hogy aktív OEC-vel rendelkező izolált PSII reakciócentrumok számára az Asc alacsony hatékonysággal szolgáltat elektronokat (Mano és mtsai, 2004). Mindezek alapján feltételeztük, hogy az Asc a PSII alternatív elektrondonora in vivo. Hipotézisünk vizsgálatára hőstressznek kitett Asc-hiányos (vtc2-1 mutáns; Conklin és mtsai, 2000; Giacomelli és mtsai, 2006; Dowdle és mtsai, 2007) és Col-0 vad típusú A. thaliana növények elektrontranszport folyamatait hasonlítottunk össze.
Eredmények
A fotoszintetikus elektrontranszport folyamatok tanulmányozására a gyors klorofill-a fluoreszcencia indukciós görbét (OJIP) használtuk (Lazár, 2006; Schansker és mtsai, 2014; Tóth és mtsai, 2020). A fotoszintetikus apparátus fénnyel történő gerjesztésének hatására fluoreszcencia intenzitása a kezdeti F0 (O) értékről mintegy 300 ms alatt éri el maximális intenzitását (P vagy FM), a J és az I közbülső lépéseken keresztül, amelyek kb. 2 és 30 ms-nál alakulnak ki (6. ábra).
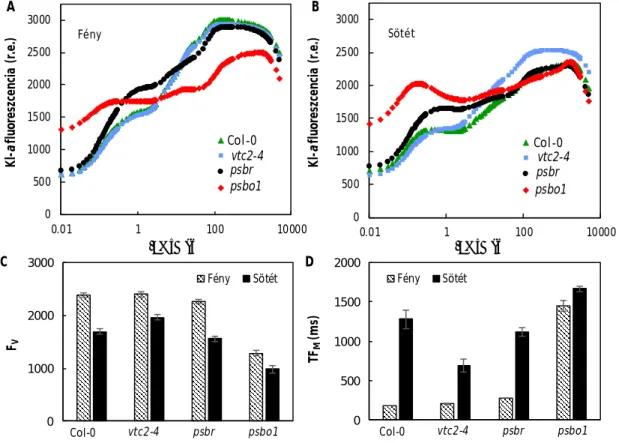
6. ábra. Hőkezelt (49°C, 40 s) és kezeletlen vad típusú (Col-0) és Asc-hiányos (vtc2-1) A. thaliana levelek gyors klorofill-a fluoreszcencia (OJIP) tranziensei. Az O szint a minimális (F0) fluoreszcenciát jelzi, a J és az I két közbülső lépés, a P érték pedig a maximális fluoreszcencia (FM) értéke. Az 1000 ms-nál megjelenő fluoreszcencia intenzitás-emelkedés az Asc-függő PSII- elektrontranszport jelenlétét mutatja.
Hőkezelés hatására az OJIP kinetika jelentősen megváltozik: A vízbontó komplex inaktivációját jelzi a K-lépés kb. 300 µs-nál, majd 1000 ms-nál megjelenik egy második csúcs, amelynek az intenzitása alacsonyabb az Asc-hiányos vtc2-1 mutánsban, mint a vad típusban, tehát intenzitása függ a levelek Asc-tartalmától (6. ábra; Tóth és mtsai, 2009).
Kidolgoztam egy dupla fényimpulzuson alapuló módszert, amellyel inaktív vízbontással rendelkező mintákban meghatározható az elektronátadás félideje (t1/2) az alternatív donor és a TyrZ+ között. Vad típusú A. thaliana növényekben a t1/2 kb. 25 ms-nak, míg a vtc2-1 mutánsban kb. 55 ms-nak adódott (7. ábra). Az eredmények alapján kijelenthető, hogy az Asc a PSII alternatív elektrondonora in vivo.
7. ábra. Az Asc-tól a PSII-höz történő elektronátadás félidejének meghatározása hőkezelt (49°C, 40 s) A.
thaliana levelekben a K lépés regenerációjának segítségével. Az első 5 ms-os fényimpulzust 2,3 ms-tól 200 ms-ig tartó sötétperiódus, majd a 2. fényimpulzus követi (A). A K lépés regenerációját a F20µs/F300µs
értékek alapján számoltunk ki vad típusú (Col-0) és Asc-hiányos (vtc2-1) növényekben (B). A K lépés regenerációja (vagyis az Asc-PSII elektronátadás sebessége) külsőleg hozzáadott Asc-tal (20 mM) növelhető (C).
Következtetéseinket 820 nm-es abszorbanciamérések is alátámasztották, valamint termolumineszcencia mérések segítségével megállapítottuk, hogy az Asc-tól az elektronok a PSII-höz a TyrZ+ közvetítésével jutnak el (függelékben: Tóth és mtsai, 2009).
0 500 1000 1500 2000 2500
0.01 0.1 1 10 100 1000 10000 WT
vtc2-1 WT 49°C vtc2-1 49°C
K (F300ms)
O (F20ms)
J (F2ms) P
P (FM)
I (F30ms)
Idő(ms)
Klorofill-afluoreszcencia (r.e.)
Col -0 Col -0 49°C vtc2-1 vtc2-1 49°C
450 550 650 750 850 950
0.01 0.1 1 10
1. fényimpulzus 2.3 ms 16.9 ms 38.8 ms 100 ms 200 ms
0.5 0.6 0.7 0.8 0.9 1
0 100 200 300 400 500
WT vtc2-1 t1/2≈55 ms
t1/2≈25 ms
0.5 0.6 0.7 0.8 0.9 1
0 100 200 300 400 500
WT+ Asc vtc2-1+ Asc t1/2≈32 ms
t1/2≈22 ms F20µs/F300µs
Időintervallum (ms) Időintervallum (ms)
A B C
F20µs/F300µs
Kl-afluoreszcencia(r.e.)
Idő(ms) K (F300µs)
O (F20µs)
vtc2-1 49°C Col-0 49°C
vtc2-1 49°C +Asc Col-0 49°C +Asc
Összefoglalás
Megállapítottuk, hogy az OEC hővel történő inaktivációját követően a vízmolekulák helyett az Asc szolgáltat elektronokat a PSII számára. Az Asc-PSII elektrontranszport folyamatos, vad típusú növényekben kb. 25 ms-os félidővel játszódik le.
A fejezet alapjául az alábbi levelező szerzős közlemény szolgált, mely szerkesztői ajánlással jelent meg:
Tóth SZ, Puthur JT, Nagy V, Garab G (2009) Experimental evidence for ascorbate- dependent electron transport in leaves with inactive oxygen-evolving complexes. Plant Physiol 149: 1568-1578.
IV. 2. Az aszkorbát alternatív elektrondonorként lassítja a donor-oldali fotoinhibíciót
Bevezetés: A donor-oldal által indukált fotoinhibíció
A természetben a hőstressz sokszor együtt jár a fénystresszel. Ez a két stresszfaktor együttesen a PSII inaktivációját és fotooxidációját okozhatják (Havaux, 1993; Abrego és mtsai, 2008). Amennyiben hőstressz által inaktiválódik az OEC, a PSII reakciócentrumban erősen oxidáló komponensek, P680+, TyrZ+, szuperoxid (Chen és mtsai, 1995), hidroxilgyökök (Spetea és mtsai, 1997) halmozódnak fel, aminek következtében a PSII reakciócentrum teljes mértékben inaktiválódhat (Callahan és mtsai, 1986; Blubaugh és Cheniae, 1990; Jegerschöld és Styring, 1996; Pospíšil, 2016). Ezt a folyamatot donor oldal által indukált fotoinhibíciónak nevezzük.
Célunk az Asc PSII alternatív elektrondonorként a donor oldali fotoinhibícióban betöltött élettani szerepének tanulmányozása volt.
Eredmények
Feltételeztük, hogy az Asc alternatív elektrondonorként védi a PSII reakciócentrumot azáltal, hogy megakadályozza a P680+ felhalmozódását, amely oxidatív stresszhez, és végső soron a reakciócentrumok inaktivációjához vezet. Feltételezésünk bizonyítására vad típusú, Asc-deficiens (vtc2-3; Conklin és mtsai, 2000) és egy Asc-túltermelő MIOX4 transzgénikus vonalat (Lorence és mtsai, 2004) használtunk. A vtc2-3 mutáns a vtc2-1-hez hasonlóan EMS mutagenezissel előállított pontmutáns (Conklin és mtsai, 2000). A MIOX4 vonal esetében a feltételezett mio-inozitol Asc-bioszintézis útvonal egyik első lépését katalizáló enzimet, a mio- inozitol oxigenázt kifejeztették, amelynek eredményeképpen a növények Asc-tartalma jelentősen megemelkedett (Lorence és mtsai, 2004; Nepal és mtsai, 2019). Bár eme útvonal élettani jelentősége máig vitatott (Wheeler és mtsai, 2015), az Asc, mint alternatív elektrondonor szerepének tanulmányozására a MIOX4 Asc-túltermelő vonal megfelelő volt.
Az Asc-túltermelő kissé nagyobb, míg az Asc-hiányos vtc2-3 mutáns kb. 30%-al kisebb a vad típusú növényhez képest (Müller-Moulé és mtsai, 2004; Függelék: Tóth és mtsai, 2011). A növények klorofillra vonatkoztatott Asc-tartalma a vtc2-3 mutánsban kb. 75%-kal alacsonyabb, míg a MIOX4 esetében kb. 60%-kal magasabb a vad típushoz képest (Függelék: Tóth és mtsai, 2011).
Az Asc élettani szerepének vizsgálatához a korábbi rövid és magas hőmérsékleten végzett hőkezelés (49°C, 40 s, IV. 1. fejezet) helyett a növények leveleit 40°C-on 15 percig kezeltük vízfürdőben, sötétben. Bár 40°C-os hőmérséklet érheti a természetben a növényeket (Burghardt és mtsai, 2008; Shahenshah és Isoda, 2010), még ez a hőkezelés sem élettani;
azonban fontos szempont volt a hőmérséklet és a fény hatásának elkülönítése, valamint hogy a leveleket egyenletesen, pontosan meghatározott időtartamig érje a magas hőmérsékleti stressz, és teljes mértékben szűnjön meg a vízbontó komplex aktivitása. A B TL sáv eltűnése jól mutatja, hogy ez mindhárom genotípus esetében megtörtént (Függelék: Tóth és mtsai, 2011).
A hőkezelés hatására a tilakoidmembrán permeabilitása csak kis mértékben emelkedett (Függelék: Tóth és mtsai, 2011). A kezeletlen vad típusú, Asc-hiányos és túltermelő A. thaliana levelek Fv/Fm értéke és OJIP kinetikája azonos volt. Hőkezelt (40°C, 15 perc) növények esetében az Asc-függő csúcs intenzitása (ld. 6. ábra az előző fejezetben) a vtc2-3 mutáns esetében kisebb, mint a vad típus esetében, a MIOX4 transzgénikus növény esetében pedig nem volt jelentős különbség (Függelék: Tóth és mtsai, 2011).
A hőkezelést követően a növényeket közepesen erős megvilágításnak tettük ki (300 µmól foton m-2s-1), hogy megvizsgáljuk a reakciócentrumok inaktivációjának sebességét. A kezelés hatására eltűnt az OJIP görbe K lépése és az Asc-függő csúcs (8. ábra). A K lépés intenzitása a fénykezelés idejének függvényében exponenciálisan csökkent. A K lépés 50%-os csökkenéséhez szükséges megvilágítási idő (t1/2) a vad típusú levelekben 2,8 perc, a vtc2-3 mutáns estében 1,2 perc , a MIOX4 transzgénikus növény esetében pedig 4,1 perc volt (8. ábra).
8. ábra. Vad típusú (Col-0), Asc-hiányos (vtc2-3) és Asc-túltermelő (MIOX4) A. thaliana növényeken mért OJIP tranziensek 3-(3,4-diklorofenil)-1,1-dimetilurea (DCMU) nélkül (A) és DCMU jelenlétében (C); a K lépés (F300µs-F20µs) csökkenésének félideje (B) és a DCMU jelenlétében mért FM érték csökkenése (D), hőkezelést (40°C, 15 perc) és folyamatos fénykezelést (fehér fény, 300 µmol m-2 s-1 fényintenzitás) követően (Tóth és mtsai, 2011).
A működőképes PSII reakciócentrumok relatív mennyiségét meghatároztuk oly módon, hogy a hő- és fénykezelés után a leveleket 3-(3,4-diklorofenil)-1,1-dimetilurea (DCMU)- kezelésnek tettük ki, amely által biztosítható a QA teljes redukciója a fluoreszcencia mérés
0 500 1000 1500 2000
0.01 1 100 10000
Kontroll (Col-0) 40°C 0 perc fény 40°C 10 perc fény 40°C 4 óra fény
0 500 1000 1500 2000
0.01 1 100 10000
kontroll (Col-0) 40°C 0 perc fény 40°C 10 perc fény 40°C 4 óra fény
Idő(ms) Idő(ms) Kl-afluoreszcencia(r.e.)Kl-afluoreszcencia(r.e.)
A
C
O
K J
I P
P
550 600 650 700 750 800
0 5 10 15 20
WT miox4 vtc2-3
1100 1300 1500 1700
0 20 40 60
WT miox4 vtc2-3
Kezelés időtartama (perc) F300µs-F20µsFM (DCMU)
D B
MIOX-4; t1/2≈4.1 min vtc2-3; t1/2≈1.2 min
Col-0; t1/2≈2.8 min
Kezelés időtartama (perc) MIOX-4; t1/2≈51 min
vtc2-3; t1/2≈10 min Col-0; t1/2≈23 min
során, inaktív OEC mellett is. A hőkezelés önmagában mintegy kb. 15%-os FM-érték csökkenést idézett elő (8.C ábra), majd a fénykezelés hatására a hőkezelt levelek FM értéke tovább csökkent. Az FM érték csökkenése szignifikánsan gyorsabb volt a vtc2-3 mutánsok esetében, mint a vad típusban (t1/2 kb. 10 ill. 23 perc), és a különbség még kifejezettebb az Asc-túltermelő transzgénikus növények esetében (t1/2 kb. 51 perc, 8. ábra). Hasonló félidőket kaptunk a kloroplasztisz fehérjeszintézis-gátló linkomicin (LM) jelenlétében is (Tóth és mtsai, 2011), ami bizonyítja, hogy kísérlet időtartama alatt nem történt jelentős fehérjeszintézis. Emellett a fénykezelés hatására a fluoreszcencia-kinetika DCMU jelenlétében lelassult (8.C ábra). A K lépés intenzitásának gyors csökkenése és a fluoreszcencia-kinetika lassulása arra enged következtetni, hogy a donor-oldali fotoinhibíció első lépéseként lelassul a TyrZ-P680+ közötti elektrontranszport, amit a PSII reakciócentrumok teljes inaktivációja követ.
Az Asc ROS-kioltó tulajdonsága jól ismert (Asada 2006, I. 1. fejezet), amely hozzájárulhat a hő-és fénystresszel szembeni védekezéshez. Annak bizonyítására, hogy az Asc nemcsak ROS- kioltóként, hanem alternatív elektrondonorként is védi a reakciócentrumokat, DPC-kezelést végeztünk, amely egy mesterséges PSII elektrondonor. A 2 mM-os DPC oldattal kezelt vtc2-3 mutáns növények reakciócentrumaiba ugyanolyan sebességgel érkeztek az elektronok, mint a vad típusban (adatok: Tóth és mtsai, 2011). A hőstresszt követő fénykezelés hatására a DPC oldatban inkubált vtc2-3 levelekben a K lépés amplitudója hasonló sebességgel csökkent (t1/2
2,5 perc), mint a vad típusban (t1/2 2,8 perc). Ez az eredmény bizonyította, hogy az Asc nem csak ROS-kioltóként, hanem PSII alternatív donorként is véd a fotoinhibícióval szemben.
Magas fényintenzitás hatására a PSII reakciócentrumok inaktiválódhatnak, amelyet a reakciócentrumok degradációja, különösen a PsbA protein mennyiségének csökkenése követ (Schuster és mtsai, 1988; Aro és mtsai, 1993; van Wijk és mtsai, 1994). Hőstressz hatására is csökkenhet a PsbA mennyisége, illetve szintézisének a gátlása is figyelhető volt (Yoshioka és mtsai, 2006; Yamashita és mtsai, 2008). Ezzel összhangban megfigyeltük, hogy a vad típusú hőkezelt növényekben a PsbA fehérje mennyisége kb. 20%-kal csökkent. A hőkezelést követő megvilágítás hatására 1 óra után további kb. 40%-kal, míg 4 óra elteltével kb. 65%-kal csökkent a PsbA mennyisége (9. ábra). Emellett a hőkezelt levelek 4 órás fénykezelése alatt a CP43 fehérje 70%-a, míg a PSBO 80%-a degradálódott. Tehát a PSII reakciócentrumok a hőkezelést követő fénykezelés hatására fokozatosan leépülnek.
Megvizsgáltuk az Asc hatását a PSII aktivitásának hőkezelést követő helyreállására, nevelési fényintenzitáson (100 μmol foton m-2 s-1). Csakúgy, mint a magasabb (300 μmol foton m-2 s-1) fényintenzitáson, itt is megfigyelhető a K lépés amplitúdójának csökkenése az első néhány órában, azonban 24 óra alatt jelentős helyreállás történik (Függelék: Tóth és mtsai, 2009). Megállapítottuk, hogy a helyreállás mértéke és sebessége jóval nagyobb a vad típusú és az Asc-túltermelő növényekben, mint az Asc-hiányosban. Megjegyzendő, hogy sötétben nem figyelhető meg helyreállás (Tóth és mtsai, 2005), magas fényintenzitáson pedig nagyon lassan, vagy egyáltalán nem történik meg.
9. ábra. A PsbA, CP43 és PSBO fehérjék mennyiségének relatív változása hő- (40°C, 15 perc) és fénykezelést (300 µmol foton m-2 s-1) követően vad típusú (Col-0) A. thaliana növényekben western blot analízis alapján (A) és denzitometrálással számszerűsítve (B).
Összefoglalás
Megállapítottuk, hogy hő- és fénykezelés hatására néhány perc alatt lelassul a TyrZ- P680+ elektrontranszfer, amit a PSII reakciócentrumok teljes inaktivációja és degradációja követ. Az inaktiválódás mértéke és sebessége Asc-függő. A hőkezelést követő helyreállás szintén Asc-függő, alátámasztva, hogy az Asc alternatív elektrondonorként jelentős fotoprotektív szerepet tölt be.
A fejezet alapjául az alábbi, levelező szerzős közlemények szolgáltak:
Tóth SZ, Nagy V, Puthur JT, Kovács L, Garab G (2011) The physiological role of ascorbate as photosystem II electron donor: protection against photoinactivation in heat-stressed leaves.
Plant Physiol 156: 382-392
Tóth SZ, Schansker G, Garab G (2013) The physiological roles and metabolism of ascorbate in chloroplasts. Physiol Plantarum 148: 161-175 (összefoglaló cikk)
IV. 3. Az aszkorbát hosszan tartó sötétségben inaktiválja a vízbontó komplexet
Bevezetés: Szeneszcencia a növényekben
A levelek öregedése egy kontrollált, aktív folyamat, amely transzkripciós és metabolikus szabályozás révén lehetővé teszi a tartaléktápanyagok lebontását, szállítását és újrahasznosítását a magvakban és más növényi szervekben (Maillard és mtsai, 2015; Liebsch és Keech, 2016). Lefolyása és mértéke függ a növények korától, bár számos környezeti tényező is befolyásolja, mint például a fényintenzitás, a vízellátottság és a kórokozók jelenléte (Jing és mtsai, 2009; Sade és mtsai, 2018). Az öregedés vizsgálatára gyakran alkalmazott kísérleti modellrendszer a növények több napig tartó sötétkezelése (Buchanan-Wollaston és mtsai, 2005), amellyel a szeneszcencia folyamatai szinkronizálhatók és egyszerűsíthetők. Hosszan tartó sötétségben az átmeneti keményítőtartalékok viszonylag gyorsan kimerülnek (Smith és Stitt 2007). A következő fázisban a lipidek és aminosavak felhasználása teszi lehetővé az anyagcsere fenntartását a sötétségben (Usadel és mtsai, 2008; Kunz és mtsai, 2009; Fan és mtsai, 2017). A sötétség hatására bekövetkező szeneszcencia kezdeti lépései között szerepel a hormonszint, a cukortartalom, és a redox homeosztázis változása, valamint szabadgyökök által indukált stresszhatás (Jing és mtsai, 2008; Zentgraf és Hemleben, 2008; Rosenwasser és mtsai, 2011).
A hosszan tartó sötétségben bekövetkező élettani változások egyike a fotoszintetikus aktivitás csökkenése, amelyet az FV/FM és a fotokémiai kioltási (qP) paraméterek csökkenése jelez, amely az OEC inaktiválódásának tulajdonítható (pl. Sobieszczuk-Nowicka és mtsai, 2018).
Később megkezdődik a fotoszintetikus komplexek - a PSII, a PSI, a cytb6f és az ATP szintáz - degradációja (Yamazaki és mtsai, 2000, Kunz és mtsai, 2009, Barros és mtsai, 2017). A kloroplasztisz szerkezetével kapcsolatban azt figyelték meg, hogy a tilakoid membránok néhány napos sötétség után megduzzadnak, megnő a plasztoglobulusok száma, majd a kloroplasztiszok szétesnek (Sobieszczuk-Nowicka és mtsai, 2018; Niu és Guo, 2012), ezt követően pedig a klorofill lebomlása figyelhető meg. A sötét-indukált szeneszcencia folyamatában az autofágia igen jelentős szerepet játszik (Barros és mtsai, 2017; Avin- Wittenberg és mtsai, 2018; Elander és mtsai, 2018; Fan és mtsai, 2019).
Az alábbiakban vad típusú (Col-0), Asc-hiányos (vtc2-4), psbo1, kettős psbo1 vtc2 és psbr1 mutáns A. thaliana mutánsok segítségével tanulmányoztuk a vízbontó komplex hosszan tartó sötétség történő inaktiválódását.
Eredmények
Korábbi in vitro kísérletekben kimutatták, hogy amennyiben az OEC külső fehérjéit kémiai kezelésekkel eltávolítják, az Asc redukálhatja a vízbontó komplexet (Tamura és mtsai, 1990). Arról azonban nem állt rendelkezésre információ, hogy az Asc in vivo is képes-e inaktiválni az OEC-t. E kérdés vizsgálatához Asc-deficiens A. thaliana mutánst használtunk, a