PANNON EGYETEM
SZERVES KÉMIA INTÉZETI TANSZÉK
CFC ÉS HCFC VEGYÜLETEK ÁTALAKÍTÁSA ÁTMENETIFÉM- KOMPLEXEK JELENLÉTÉBEN
Doktori (PhD) értekezés
Készítette: Simon Ottó Balázs okleveles vegyész
Témavezető: Dr. Sisak Attila tudományos főmunkatárs
VESZPRÉM
2008
Kutatási téma megnevezése:
CFC és HCFC vegyületek átalakítása átmenetifém-komplexek jelenlétében
Témavezetõ:
Dr. Sisak Attila
tud. fõmunkatárs, kém. tud. kand.
Tudományterület:
Szerves kémia, fémorganikus kémia
Kutatási fõirány:
Kutatóhely:
Szerves Kémia Tanszék
A kutatási téma ismertetése:
A korábban nagy mennyiségben alkalmazott, ózonkárosító klór-fluor-karbon (CFC) vegyületeket az elmúlt két évtizedben sikerült környezetbarát anyagokkal helyettesíteni. A veszélyes hulladékká vált freonok (pl.
diklór-difluor-metán, R12) környezetre ártalmatlan anyagokká alakítására is számos, elsõsorban heterogén katalitikus eljárást fejlesztettek ki, a leggyakrabban alkalmazott módszer a hidrodeklórozás [1]. Bár CFC és HCFC vegyületek homogén katalitikus hidrodeklórozására eddig mindössze néhány próbálkozás történt [2], a reakció egyes feltételezett részlépéseit átmenetifém-komplexekkel modellezték [3]. Saját vizsgálataink során azt találtuk, hogy [RhCl3(py)3] és in situ generált [Pd(PiPr3)3] homogén katalizátorok hatásosabbak a leggyakrabban vizsgált heterogén katalizátornál, a Pd/Al2O3-nál a CF3CHFCl CF3CH2F-ná történõ átalakításában. CF2Cl2 esetében az Rh- and Pd-tartalmú rendszerek aktivitása és a szelektivitása erõsen függ az alkalmazott adalékoktól [4].
A jelölt feladata, hogy feltérképezze a CCl2F2, a CHClF2 és a CF3CHClF hidrodeklórozására alkalmas átmenetifém-komplexek körét, a ligandumoknak és a reakció egyéb paramétereinek megfelelõ megválasztásával megtalálja az egyes szubsztrátumok redukciójára optimális körülményeket. Megfelelõ modell esetén reakciókinetikai méréseket is kell végeznie a reakció mechanizmusának felderítése céljából.
Kísérletek végzendõk a katalitikus reakciók intermedierei mibenlétének megállapítására, a részlépések modellezésére. A hidrodeklórozáson kívül tanulmányozandó a vegyületek deklórozása és redisztribúciója homogén katalizátorok jelenlétében.
A kutatási téma elõzményei:
[1] A. Wiersma, E.J.A.X. v. d. Sandt, M.A. d. Hollander, H. v. Bekkum, M. Makkee, J.A. Moulijn, J. Catal., 177 (1998) 29, és az ott hivatkozott munkák.
[2] R.T. Baker, C.S. Kellner, L.E. Manzer, V.N.M. Rao, B.R. Williams, 210th ACS National Meeting, Chicago, IL, Book of Abstracts, CHED-111 (1995). H.S. Kim, O.J. Cho, I.M. Lee, S.P. Hong, C.Y. Kwag, B.S. Ahn, J.
Mol Catal. A: Chem., 111 (1996) 49.
[3] (a) D. Huang, P.R. Koren, K. Folting, E.R. Davidson, K.G. Caulton, J. Am. Chem. Soc. 122 (2000) 8916.
(b) R. P. Hughes, S. Willemsen, A. Williamson, D. Zhang, Organometallics, 21 (2002) 3085.
[4] Heil B., Sisak A., Az ózonréteget nem károsító freonhelyettesítõ anyagok gyártástechnológiájának kutatásai, Kutatási zárójelentés, Veszprém, 1995. A. Sisak, O.B. Simon, K. Nyíri, J. Mol. Catal. A: Chem., 213 (2004) 163.
Megjegyzés:
Témavezetõ aláírása:
Kutatóhely vezetõje véleménye és aláírása [a témát fogadni tudja / nem tudja fogadni].
A Doktori Iskola Tanács a kutatási témát [elfogadta / nem fogadta el]. Doktori Iskola vezetõjének aláírása:
CFC ÉS HCFC VEGYÜLETEK ÁTALAKÍTÁSA ÁTMENETIFÉM-KOMPLEXEK JELENLÉTÉBEN
Értekezés doktori (PhD) fokozat elnyerése érdekében
Írta:
Simon Ottó Balázs
Készült a Pannon Egyetem Kémia Doktori Iskolájának keretében.
Témavezető: Dr. Sisak Attila Elfogadásra javaslom (igen / nem)
………
(aláírás) A jelölt a doktori szigorlaton …... % -ot ért el.
Veszprém,………... ...………
Szigorlati Bizottság elnöke Az értekezést bírálóként elfogadásra javaslom:
Bíráló neve: …... …... igen /nem
……….
(aláírás) Bíráló neve: …... …...igen /nem
……….
(aláírás) Bíráló neve: …... …... igen /nem
……….
(aláírás) A jelölt az értekezés nyilvános vitáján …...% - ot ért el.
Veszprém,……… ……….
Bíráló Bizottság elnöke
A doktori (PhD) oklevél minősítése…...
………
Az EDT elnöke
KIVONAT
A klór-fluor-karbon (CFC) és hidrogén-klór-fluor-karbon (HCFC) vegyületeket a hűtőipar a legutóbbi időkig nagy mennyiségben alkalmazta. A 70-es évek vége óta tudjuk, hogy ezek az anyagok károsak a magaslégköri ózonrétegre. A legveszélyesebbnek tartott vegyületek (pl. CCl2F2, CCl3F) gyártását és felhasználását nemzetközi egyezmények tiltják. Így a néhány évtizede még millió tonnás nagyságrendben termelt freonok mára veszélyes hulladékká váltak.
A freonok környezetbarát vegyületekké alakításának egyik legígéretesebb módszere a katalitikus hidrodeklórozás. A feladatra heterogén katalizátorokat (általában Pd-ot) használnak, homogén rendszerek alkalmazására alig van példa.
A doktori munka keretében megtörtént a CFC- és HCFC-vegyületek katalitikus hidrodeklórozása irodalmának feldolgozása. Vizsgáltam a környezetre ártalmas CCl2F2 és CHClF2 freongázoknak, valamint a „zöld” hűtőanyag CF3CH2F intermedierének, a CF3CHClF-nak a hidrodehalogénezését (ez utóbbit gázelegy formájában). A legfontosabb eredményeim a következők:
A fenti vegyületek hidrogenolízisét homogén katalizátorok jelenlétében én tanulmányoztam és írtam le először.
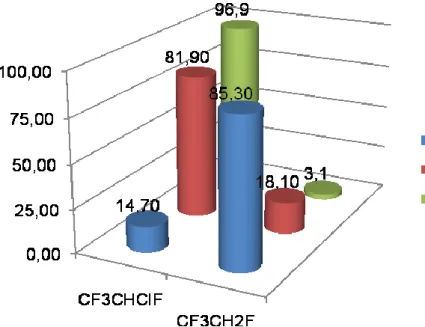
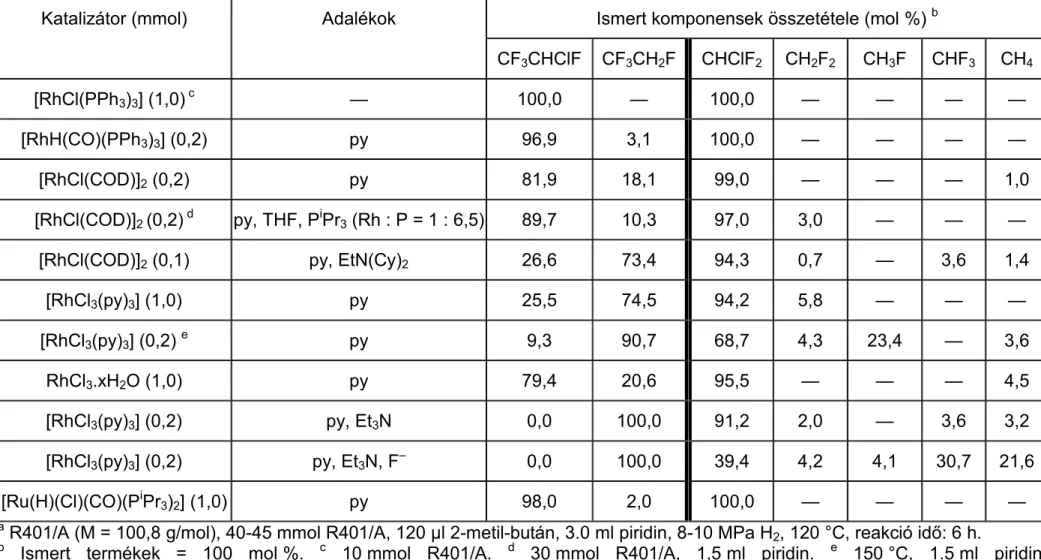
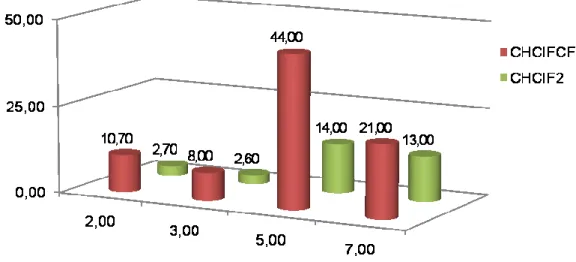
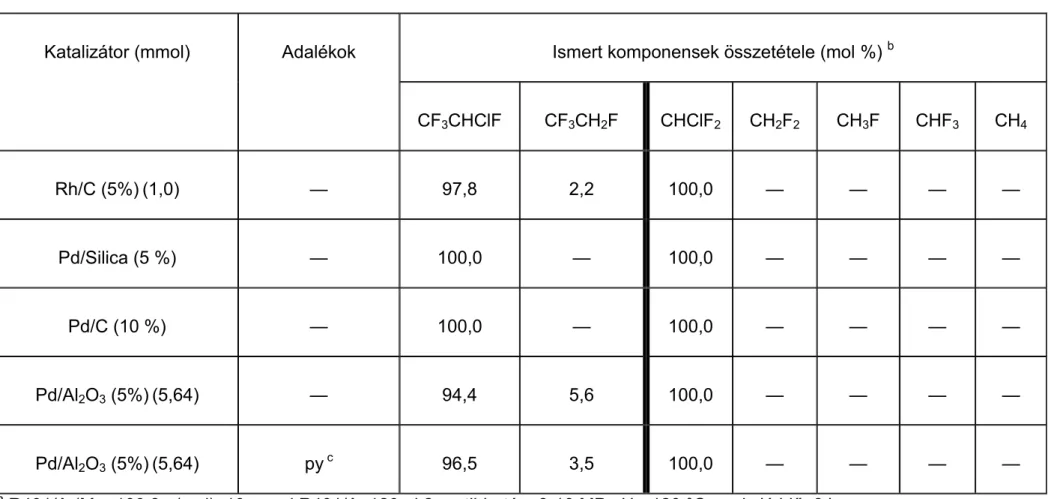
A [RhCl3(py)3] komplex feleslegben alkalmazott nitrogénbázis jelenlétében, valamint a Pd(II)-acetátból és PiPr3-ból in situ képződő [Pd(PiPr3)3] komplex aktívabb dehalogénező katalizátornak bizonyult, mint az irodalomban leírt heterogén katalizátorok.
A CF3CHClF-ból szelektíven CF3CH2F, a CCl2F2-ból a reakciókörülményektől függően CHClF2, vagy CH2F2 képződött főtermékként metán mellett. A CHClF2 a [RhCl3(py)3]/amin/F¯ katalizátorrendszerrel hidrogenolizálva CHF3-ná és metánná alakult.
A CCl2F2 kétfázisú rendszerben, Zn/H2O reduktáns, valamint Pd(0)-, illetve Ni(II)- komplex katalizátorok jelenlétében CH2F2-t adott főtermékként metán mellett.
Eredményeimet analóg irodalmi adatokkal összehasonlítva javaslatot tettem a fenti dehalogénezési reakciók mechanizmusára.
ABSTRACT
Until recent times, chlorofluorocarbons (CFC-s) and hydrogenchlorofluorocarbons (HCFC-s) have been used in huge amounts as refrigerants. Since the late seventies, it is known, however, that these materials damage the stratospheric ozone. The production and use of the most dangerous compounds (e.g. CCl2F2, CCl3F) were prohibited by international agreements. Thus, freons which have been manufactured in a magnitude of million tons became dangerous wastes by today.
Catalytic hydrodechlorination is one of the most promising methods to transform freons into environmentally friendly compounds. This process uses generally heterogeneous catalysts (like Pd/Al2O3), there are only rare examples for the application of homogeneous ones.
The PhD work compiled the literature of the hydrodechlorination of CFC and HCFC compounds. Experiments have been carried out for the hydrodehalogenation of the environmentally dangerous freons, CCl2F2, CHClF2, as well as for hydrodechlorination of CF3CHClF, an intermediate of the „green refrigerant”, CF3CH2F. The most important statements are as follows:
Homogeneous hydrodehalogenation of the above freons was studied and described at first by me.
The complexes [RhCl3(py)3] − in the presence of an excess of a nitrogen base —, and [Pd(PiPr3)3] — formed in situ from Pd(II)-acetate and PiPr3 — proved to be more effective in the reactions studied than the heterogeneous catalysts generally used.
CF3CHClF was hydrodechlorinated selectively to CF3CH2F, while CCl2F2 gave mainly CHClF2, CH2F2, or methane depending on the conditions of the hydrogenolysis. CHClF2 was hydrogenolyzed to a mixture of CHF3 and methane by the system [RhCl3(py)3]/amine/F¯.
CCl2F2 was transformed into CH2F2 and methane in a two-phase system containing Zn/H2O as a reductant, as well as Pd(0) and Ni(II) complex catalysts, respectively.
Comparing the results with literature data, reaction mechanisms for the dehalogenations studied have been proposed.
AUSZUG
Die Kühlindustrie wendete die Chlorfluorkohlenstoff- und die Wasserstoffchlorfluorkohlenstoffverbindungen (CFC-s und HCFC-s) in riesigen Mengen bis zur jüngsten Zeit an. Wir wissen aber seit dem Ende der siebzigen Jahre, dass diese Verbindungen sind schädlich für die hochatmosphärischen Ozonschicht. Herstellung und Anwendung der am gefährlichsten gehaltenen Verbindungen (z. B. CCl2F2, CCl3F). sind heute durch internationalen Vereinbarungen verboten. So Freonen, die einigen Jahrzehnten her noch in der Größenordnung von Millionen Tonnen produziert worden sind, gelten heute als gefährliche Abfälle.
Die katalytische Hydrodechlorierung ist eine der viel versprechenden Methode für die Umwandlung der Freons zu umweltfreundlichen Verbindungen. Für diese Zwecke werden heterogene Katalysatoren (wie Pd/Al2O3) angewandt, homogene Systeme wurden aber kaum untersucht.
In meiner Doktorarbeit bearbeitete ich die Literatur der katalytischen Hydrodehalogenierung der CFC- und HCFC-Verbindungen. Ich erforschte die Hydrogenolyse der umweltschädlichen Freongase, CCl2F2, CHClF2 und die des CF3CHClF,Zwischenproduktes des „grünen Kühlstoffs” CF3CH2F. Meine wichtigsten Resultate sind die folgende:
Die Hydrodehalogenierung der erwähnten Freons erforschte und publizierte zuerst ich.
In diesen Reaktionen waren [RhCl3(py)3] (mit im Überschuss angewandten Stickstoffbase) und [Pd(PiPr3)3] (gebildet in situ aus Pd(II)-acetate und PiPr3) aktiver als die allgemein gebrauchten heterogenen Katalysatoren.
CF3CH2F bildete sich selektiv von CF3CHClF. Im Falle von CCl2F2 waren CHClF2
oder CH2F2 die Hauptprodukte neben Methan abhängig von den Reaktionsbedingungen. CHClF2 wurde zum Gemisch von CHF3 und Methan mit dem System [RhCl3(py)3]/Amine/F¯ hydrogenolysiert.
CCl2F2 wurde zu CH2F2 und Methan in einem zweiphasigen System mit Zn/H2O als Reduktant und Pd(0) oder Ni(II) Komplexen als Katalysatoren umwandelt.
Reaktionsmechanismen wurden vorgeschlagen nach dem Vergleich der eigenen Daten mit den Literaturangaben.
Tartalomjegyzék
KIVONAT ... 4
ABSTRACT ... 5
AUSZUG ... 6
Tartalomjegyzék ... 7
Rövidítések ... 9
1. Bevezetés ... 10
3. Irodalmi összefoglaló ... 15
3.1 A homogén katalitikus (hidro)dehalogénezésről általában ... 15
3.2 Katalitikus dehalogénezés különböző redukálószerekkel ... 16
3.2.1 Katalitikus dehalogénezés molekuláris hidrogénnel ... 17
3.2.2 Katalitikus dehalogénezés egyszerű és összetett fém-hidridekkel 19 3.2.3 Katalitikus dehalogénezés hidroszilánokkal ... 20
3.2.4 Katalitikus dehalogénezés nem hidrides hidrogén donorokkal ... 21
3.2.5 Biomimetikus dehalogénezés ... 21
3.2.6 Elektrokémiai redukció ... 21
3.2.7 Vegyes reduktív eljárások... 22
3.3 Megfontolások a homogén katalitikus hidrodehalogénezés mechanizmusáról ... 23
3.3.1 A C-X kötés aktiválása oxidatív addícióval ... 23
3.3.2 A redukálószer szerepe a katalitikus ciklusban ... 25
3.3.3 A termék kialakulása ... 26
3.4 CFC és HCFC vegyületek heterogén katalitikus hidrodehalogénezése ... 26
3.5 CFC és HCFC vegyületek homogén katalitikus hidrodeklórozása ... 29
3.6 CFC-k hidrodeklórozásának modellezése ... 30
4. Kísérleti rész ... 32
4.1 Kísérleti eredmények ... 32
4.1.1 Hidrodeklórozási kísérletek ... 32
4.1.1.1 R401/A gázelegy klórtartalmú komponenseinek hidrodeklórozása ... 33
4.1.1.2 CCl2F2 hidrodeklórozása ... 40
4.1.1.3 CHClF2 hidrodeklórozása ... 47
4.2 A katalitikus reakciók modellezése ... 54
4.3 A kísérletek értékelése ... 55
4.3.1 A homogén katalitikus hidrodehalogénezés mechanizmusa ... 55
4.3.2 A heterogén és a homogén katalitikus hidrodehalogénezés összehasonlítása... 65
5. Metodikai rész ... 67
5.1 A kísérletek során használt anyagok ... 67
5.2 Műszeres analízis ... 67
5.2.1 A gázkromatográfiás felvételek kiértékelése ... 68
5.2.2 A termékek azonosítása ... 70
5.3 Katalitikus hidrodeklórozási kísérletek... 70
5.4 Kísérlet N-(difluormetil)-piperidin előállítására ... 74
5.5 Atmoszférikus hidrogénezési kísérletek... 75
5.6 [PdI(CH2CF3)(PiPr3)2] előállítása és jellemzése ... 75
Összefoglalás és kitekintés ... 77
Irodalomjegyzék ... 79
Köszönetnyilvánítás ... 88
Rövidítések
A dolgozatban előforduló rövidítések:
CFC : klór-fluor-karbon CFC-12 : diklór-difluor-metán CFC-22 : klór-difluor-metán COD : ciklookta-1,5-dién Cp : 5-(ciklopenta-1,3-dienil)
Cp* : 5-(1,2,3,4,5-pentametil-ciklopenta-1,3-dienil) dba : 1,5-difenil-penta-1,4-dién-3-on
DBU : 1,8-diaza-biciklo[5.4.0.]undec-7-én DMA : N,N-dimetil-acetamid
DMF : N,N-dimetil-formamid dppe : 1,2-bisz(difenilfoszfino)etán dppf : 1,1'-bisz(difenilfoszfino)ferrocén HCFC : hidrogén-klór-fluor-karbon
HCFC-124a : 1,1,1,2-tetrafluor-2-klór-etán HFC-134a : 1,1,1,2-tetrafluor-etán
NBD : biciklo[2.2.1]hepta-2,5-dién NHC : N-heterociklusos karbén pc : ftálocianáto
PTC : fázistranszfer katalizátor, fázistranszfer katalízis py : piridin
THF : tetrahidrofurán
TMEDA : N,N,N',N'-tetrametil-etiléndiamin
1. Bevezetés
A klór-fluor-karbon (CFC) és a hidrogén-klór-fluor-karbon (HCFC) vegyületek — ismert márkanevükön freonok — mesterséges anyagok, a természetben nem fordulnak elő. Ilyen vegyületeket elsőként a Du Pont cég állított elő 1928-ban az első ismert katalitikus eljárással (katalizátor: SbCl5). A CFC- és HCFC-vegyületek előnyös tulajdonságaik, mint a nagy stabilitás, nem éghető, nem toxikus voltuk révén hamar elterjedtek, és sokrétű felhasználásra találtak. Sikerrel alkalmazták őket hűtőgépekben, tűzvédelmi berendezésekben, aeroszolos spray-kben, oldószerként, talajfertőtlenítésre és egészségügyi készülékekben, hogy csak néhányat említsek felhasználási lehetőségeik közül.
A freonok mégsem bizonyultak hosszú távon alkalmazhatónak. 1973-ban Jim Lovelock kimutatta, hogy felhalmozódnak a troposzférában, mivel élettartamuk több száz év is lehet. 1974-ben Mario Molina és Sherry Rowland a Nature-ban publikálták felfedezésüket, miszerint a freonok, illetve a belőlük napfény hatására képződő klórgyökök reakcióba lépnek a sztratoszférikus ózonnal. Közölték a reakció feltételezett mechanizmusát is.
A freonok a sztratoszférába jutva UV-B sugárzás hatására bomlanak és a klóratomok szilárd felületen (pl. por-, jégszemcse) felszabadulnak. Az így kialakuló klórgyökök — mint a gyökök általában — rendkívül reakcióképesek, és az ózonnal azonnal reakcióba lépnek. A folyamat a következő lépések során játszódik le [1a]:
CCl3F + h (UV) Cl + CCl2F (1)
Cl + O3 ClO + O2 (2)
ClO + O Cl + O2 (3)
Így a freonmolekulából felszabaduló egyetlen klórgyök akár százezer ózonmolekulát is bonthat, mire lánczáró lépésben egy másik gyökkel találkozik. Ez rosszabb esetben lehet a freongyök, amiből újra felszabadulhat. Ha két klórgyök találkozik, klórgáz képződik, amely már nem bomlik a sztratoszférikus körülmények között.
A CFC-vegyületek élettartama az atmoszférában nagy (l. 1. táblázat), ezért
A magaslégköri ózonnak jelentős szerepe van a légkör hőháztartásában.
Részben, illetve teljesen elnyeli a káros ibolyántúli sugárzásokat, amelyek egyébként komoly károkat okoznának az élővilágban. Az UV-B és UV-C sugárzás az immunrendszert, a bőrt károsítja, és akár halálhoz is vezethet.
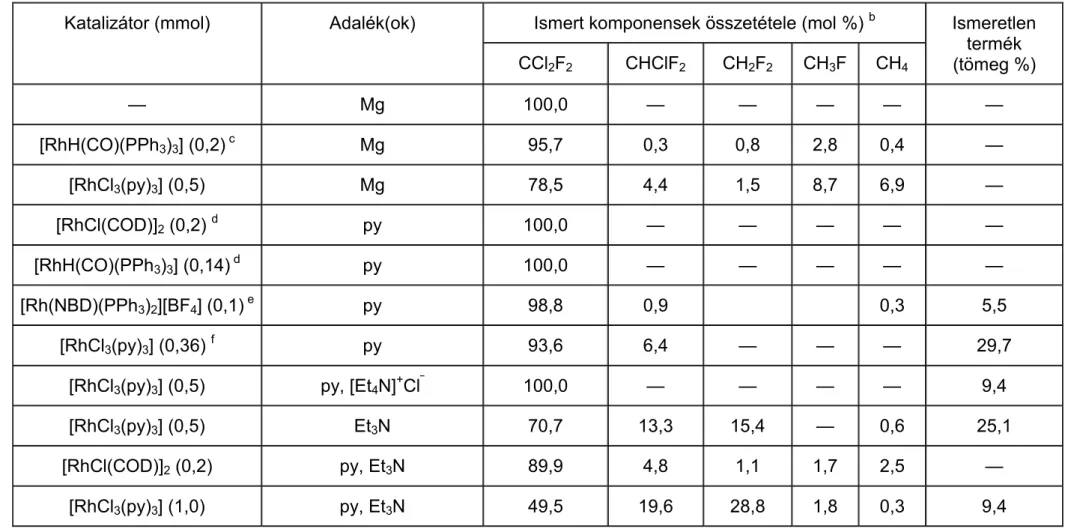
1. táblázat. Néhány halogénezett szénhidrogén hatása az ózonrétegre [1a]
Név Képlet Tartózkodási idő
(év)
Relatív ózonbontó képesség (CFC 11=1,00)
CFC-11 CCl3F 77 1,00
CFC-12 CCl2F2 139 1,00
CFC-113 C2F3Cl3 92 0,80
Szén-tetraklorid CCl4 76 1,06
Metil-kloroform CCl3CH3 8,3 0,10
HCFC-22 CHClF2 22 0,055
HFC-134a CF3CH2F 10 0,00
Halon 1301 CBrF3 101 11,40
Halon 1211 CBrClF2 12,5 2,70
Az Angol Antarktiszi Mérőszolgálat a Halley Bay mérőállomás felett ózoncsökkenést regisztrált 1984-ben. Később az Antarktisz felett „lyuk” keletkezett, amin a kutatók 50 %-nál nagyobb ózonritkulást értenek. A radikális ózonfogyás globális katasztrófával fenyegetett. A freonok hozzájárulnak az üvegházhatáshoz is.
Elkerülhetetlen volt tehát egy világméretű összefogás a freonok gyártásának visszaszorítására, majd megszüntetésére, és ez által az ózonmennyiség csökkenésének megállítására, visszafordítására.
1987. szeptember 16-án létrejött a Montreali Egyezmény, amelynek elsődleges célja az 1986-os kibocsátási szint visszaállítása volt az ezredforduló előtt. Kötelezte az aláíró országokat a freonok használatának csökkentésére, illetve beszüntetésére.
Az ózonkárosító anyagok kiváltásának a Montreali Egyezményben kijelölt ütemét gyorsították annak 1990-es londoni és 1992-es koppenhágai módosításával, valamint bővítették a szabályozás alá vont ózonkárosító anyagok listáját. A Montreali Egyezmény aláírásának napja (szeptember 16.) az Ózonréteg Védelmének Világnapja lett.
Az utóbbi idők vizsgálatai bizonyították, hogy az ózonréteg ismét vastagodni kezdett, köszönhetően a betartott egyezményeknek. E század közepére az ózon mennyisége nagy valószínűséggel eléri a normális, elfogadható szintet. Ez a kedvező fejlemény köszönhető annak is, hogy a kutatók előállítottak néhány, az ózonkárosító vegyületeket helyettesítő anyagot. Ezek közül néhányat (pl. az R134a szimbólummal jelölt 1,1,1,2-tetrafluor-etánt) ma már az ipar is gyárt. A jelenleg is folyó kutatómunka másik célja, hogy a raktáron levő veszélyes anyagok légkörbe jutását megakadályozzák, úgy hogy azokat a környezetre ártalmatlan anyagokká alakítják át. Ez utóbbi feladatra a legmegfelelőbb módszernek a katalitikus eljárások bizonyultak [1b-2].
Amint az 1. táblázatból is kitűnik, a freonokat speciális jelöléssel illetik. A nevezéktan szerint például a CF3CCl2F-t (1,1,1,2-tetrafluor-2,2-diklór-etán), CFC- 114a-nak nevezik. Az elnevezés a következő szabályok szerint történik:
1. Az első szám a molekulában lévő szénatomok száma –1
2. A második szám a molekulában lévő hidrogénatomok száma +1 3. A harmadik szám a molekulában lévő fluoratomok száma
4. Kisbetűvel az izomereket különböztetik meg [1b].
1. Célkitűzés
A Pannon Egyetem Szerves Kémia Intézeti Tanszékén közel 15 éve foglalkoznak a CFC- és HCFC-vegyületek katalitikus átalakításával. Megállapították, hogy ezen anyagok molekuláris hidrogénnel történő deklórozása (hidrodeklórozása) nemcsak heterogén, hanem egyes homogén katalizátorok jelenlétében is végrehajtható.
Elsődleges célom a freonok (hidro)deklórozása, azaz a molekulában lévő klóratom(ok) hidrogénatom(ok)ra való cseréje, mivel a környezetkárosító hatást a molekulában lévő klóratom(ok) hordozzák. A fluortartalmú szénhidrogének nem lépnek reakcióba az ózonnal, a környezetre csupán esetleges üvegházhatásuk miatt jelenthetnek mérsékelt veszélyt.
Az 4-6. egyenletek illusztrálják azon feltételezett reakciókat, amelyek az általam vizsgált freonokból az irodalomból ismert, főként heterogén katalitikus eredmények alapján a kívánt termékekhez vezetnek:
CF3CHClF , H2 CF3CH2F
-HCl (4)
CCl2F2 , H2
CH2F2
-2HCl (5)
CHClF2 , H2
CH2F2
-HCl (6)
Főbb célkitűzéseim a következők:
Doktori munkám céljául tűztem ki, hogy a (hidro)deklórozás — illetve részben az általánosabb dehalogénezés — irodalmát feldolgozzam.
Kísérleti munkámban vizsgálni kívántam a diklór-difluor-metán (CFC-12), az 1,1,1,2-tetrafluor-2-klór-etán (HCFC-124a) és a klór-difluor-metán (CFC-22) hidrodehalogénezését. (A CFC-12 a hűtéstechnikában korábban általánosan
alkalmazott veszélyes freon; a HCFC-124a a „zöld hűtőanyag” CF3CH2F-á (HFC- 134a) alakítható át; a CFC-22 a CFC-12 helyettesítője, korábban elsősorban hajtógázként használták).
Feladatul tűztem ki, hogy az irodalomban leggyakrabban alkalmazott átmenetifémeket (Pd, Rh, Ru) és azok komplexeit kipróbáljam a fenti freonok homogén katalitikus hidrodeklórozásában, valamint hogy a ligandumoknak és a reakció egyéb paramétereinek megfelelő megválasztásával megtaláljam az egyes szubsztrátumok redukciójához optimális körülményeket.
A kapott eredmények alapján össze kívántam hasonlítani a homogén, illetve a heterogén katalitikus hidrodehalogénezés jellegzetességeit.
Reakciókinetikai méréseket terveztem a reakciók mechanizmusának felderítésére. Modellkísérletekkel a katalitikus ciklusok intermediereiről és a részlépésekről kívántam információt szerezni.
2. Irodalmi összefoglaló
Johannes G. de Vries professzor, a holland DSM Pharma vezető kutatója felkérésére témavezetőmmel, Dr. Sisak Attila tudományos főmunkatárssal összeállítottuk a Handbook of Homogeneous Hydrogenation Dehalogenation Reactions című fejezetét. A könyv a Wiley-VCH kiadónál 2006 őszén jelent meg. A következő alfejezetekhez (3.1 – 3.3) ebből a munkánkból merítettem anyagot [3], amelyet kiegészítettem a legújabb irodalom adataival.
2.1 A homogén katalitikus (hidro)dehalogénezésről általában
A reduktív dehalogénezés az egyik legrégebbi reakció, amelyről a szerves kémiai irodalomban beszámoltak. Jelentősége a nyolcvanas években nőtt meg, amikor számos halogénezett — főként a klórozott — szénhidrogén-származék környezetkárosító tulajdonságai ismertté váltak. Nagy kihívást jelentett a kémia számára, hogy megtalálja a betiltott, veszélyes anyagok (pl.: poliklór-bifenilek, CFC- k) környezetre ártalmatlan, ugyanakkor esetleg hasznosítható vegyületekké való átalakításának módszereit. Az utóbbi két évtizedben főleg heterogén, kisebb mértékben homogén katalitikus eljárások révén próbálták ezt a problémát megoldani.
Ebben az időszakban lényeges előrelépés történt e reakciók szerves szintetikus eljárásokban való alkalmazásában is.
A hidrodehalogénezés, azaz a szén-halogén kötés hidrogenolízise a kötés felszakítását és a halogénatom hidrogénatomra való cseréjét jelenti:
C X redukáló ágens C
[LnM] H
(X = F, Cl, Br, I; [LnM] = átmenetifém-komplex) (7) Ez a reakciót különféle átmenetifémek és komplexeik katalizálják számos redukálószer jelenlétében. A redukálószerek a teljesség igénye nélkül a következők lehetnek:
molekuláris hidrogén,
fém- és félfém-hidridek,
szerves redukálószerek,
amelyeket a legkülönbözőbb reakciókörülmények között alkalmaznak. A reakciók megvalósításának speciális körülményei alapján beszélhetünk továbbá
biomimetikus dehalogénezésről,
elektrokémiai és fotokémiai dehalogénezésről és
vegyes redukciós eljárásokról is.
A szén-halogén kötés reakcióképessége számos tényezőtől függ, így a
halogénatom minőségétől,
a halogénatom környezetétől,
valamint a redukálószertől és a reakció körülményeitől [4].
A C–X kötés reakcióképessége (általában: I > Br > Cl > F) annak erősségétől függ. Vizsgálták például a fenil-halogenidek disszociációs energiáját (DPh–X) 25 °C- on, és 528, 402, 339, illetve 272 kJ/mol-nak találták rendre, ha X = F, Cl, Br és I.
Mivel a C–F kötés a legerősebb, katalitikus defluorozásról az irodalomban viszonylag ritkán esik szó. Az eltérő reakcióképesség lehetőséget ad két különböző C–X kötést tartalmazó vegyület szelektív dehalogénezésére: az erősebb kötés a molekulában érintetlen marad, a gyengébb kötés pedig felszakad.
2.2 Katalitikus dehalogénezés különböző redukálószerekkel
A következőkben áttekintem a homogén katalitikus hidrodehalogénezés a legfontosabb irodalmi eredményeit redukálószerek szerint tárgyalva. Bővebben a dihidrogénnel való redukciót fogom ismertetni, mivel a munkám során főként ezt alkalmaztam. A többi redukálószernél csak a legfontosabb eredményeket mutatom be.
2.2.1 Katalitikus dehalogénezés molekuláris hidrogénnel
A hidrogénezés e formáját általában valamely szerves vagy szervetlen bázis jelenlétében hajtják végre a melléktermékként keletkező hidrogén-halogenidek semlegesítése céljából. A publikált eredmények során katalizátorként elsősorban ródiumkomplexeket alkalmaztak, de gyakran használtak palládium- és ruténium- tartalmú vegyületeket is katalizátorként.
Az első próbálkozások már a hatvanas években megtörténtek. Kwiatek és munkatársai [5] számos halogénezett alkánt, alként és alkint redukáltak pentaciano- kobaltát(II) lúgos oldatával atmoszférikus hidrogénnyomáson 25 °C-on [5-6].
Roček és munkatársai [7] összehasonlították a különböző átmenetifém- komplexek aktivitását 5-jodouracil hidrodehalogénezése során atmoszférikus nyomáson és 70-80 °C-on. A vizsgált komplexek többsége fémmé redukálódott, de a [CoCl2(PPh3)2] és a [RuCl2(PPh3)3] DMA-ban oldott állapotban maradt.
Love és McQuillin [8] vizsgálatai szerint a [RhCl3py3]/NaBH4 (1:1) rendszer DMF- ben aktívnak bizonyult a különböző alkil- és aril-halogenidek halogén-hidrogén cseréjében atmoszférikus nyomáson. Érdekes, hogy ebben az esetben a reaktivitási sorrendek a várakozással szemben a következők voltak: C6H5Cl > C6H5Br és PhCH2Cl > PhCH2Br.
Aril-kloridok hidrogénezését tanulmányozták Pd(0)- [9], és Rh(III)- [10] komplexek jelenlétében is. Ben-David és munkatársai [9] a szubsztrátumot poláris oldószerben, erős bázis jelenlétében, különböző foszforligandumokkal módosított Pd- komplexekkel hidrodeklórozták. A legnagyobb átalakulást az 1,3-bisz(diizopropil- foszfino)propán és NaOH bázis jelenlétében érték el. Ha a bázis/kiindulási anyag arányt 2-re növelték, az átalakulás elérte a 100 %-ot. Vizsgálták az aril-klorid para- helyzetű szubsztituenseinek hatását. 100 °C-on, 20 órás reakcióidő esetén a formil- és nitril-helyettesített származékokkal a reakció teljes mértékben lejátszódott, ugyanakkor hasonló eredmény eléréséhez a para-metil- és -metoxi-klór-benzol esetében 150 °C-ra volt szükség.
Markó és munkatársai [11] különböző alkil- és benzil-halogenideket, valamint halobenzolokat (X = Cl, Br, I) dehalogéneztek [RhCl(1,5-hexadién)]2/PPh3/Et2NH rendszerrel p-xilol/víz közegben 50 °C-on és atmoszférikus H2 nyomáson. Grushin és Alper [12] klórarének hidrogenolízisét vizsgálta toluol/40 % NaOH oldószer- rendszerben, [Rh(H)Cl2L2] (L = PCy3, PiPr3) és benzil-trietil-ammónium-klorid
fázistranszfer katalizátor jelenlétében, enyhe körülmények (25-100 °C, 0,1 MPa) között. Módszerük számos funkciós csoportot (R, OR, CF3, COAr, COOH, NH2) tartalmazó származékra is alkalmazhatónak bizonyult, néhány klórtartalmú heterociklus szintén jól dehalogéneződött. Vizsgálták az 1-fluor-naftalin C–F kötésének hasítását az előzőhöz hasonló katalitikus rendszerrel 95 °C-on és 0,5 MPa nyomáson [12]. Az egyfázisúhoz képest a kétfázisú körülmények között javult a katalizátor visszanyerhetősége [12-13].
Setti és Mascaretti [14] magas kemo- és sztereoszelektívitást értek el (pivaloyloxy)metil-6,6-dihalopenicillanát [RhCl(PPh3)3]-mal katalizált hidrodehalogénezésében, EtOAc és/vagy MeOH oldószerek és atmoszférikus H2
nyomás alkalmazásával.
Ferrughelli és Horváth [15] klórozott aromás vegyületeket alakított át a megfelelő telített szénhidrogénné [RhCl2(Cp*)]2 katalizátorral, Et3N és 2-propanol jelenlétében, 4,1 MPa H2 nyomáson és 75 °C-on. Aizenberg és Milstein [16] néhány polifluorozott arén hatékony és szelektív hidrogenolíziséről számolt be. 95-100 °C-on, 0,6 MPa H2
nyomáson és bázis jelenlétében [RhYL3] (L = PMe3, Y = C6F5 vagy H) komplexekkel a C6F6-t, vagy a C6F5H-t ≥92 %-os szelektivitással alakították át eggyel kevesebb fluoratomot tartalmazó származékokká. Jones és csoportja megvalósította a hexafluor-benzol kvázikatalitikus hidrogenolízisét: [Rh(H)2(Cp*)PMe3] és C6F6 elegyét 25 napon át 135 °C-on és 0,1 MPa H2 nyomáson kevertetve sikerült előállítaniuk a ródium-komplexre vonatkoztatva 1,4 ekvivalens mennyiségű pentafluor-benzolt [17].
Angeloff, Brunet és munkatársaik [18] a [Pd(PPh3)4] komplexet hatékonynak találták a 2,3-diklór-nitrobenzol szelektív (>90 %) átalakításában 3-klór-nitrobenzollá 120 °C-on és atmoszférikus hidrogén nyomáson. Nolan, Grubbs és munkatársaik [19] vizsgálták a [RuH2(H2)2(PCy3)2] és az in situ előállított [Ru(H)Cl(H2)2L2] ([RuCl2(COD)]x és 2L, L = PCy3 vagy PiPr3) katalizátorokat aril-kloridok hidrogenolízisében alkoholos oldószerekben 80 °C-on 0,3 MPa H2 nyomáson. A [Ru(H)Cl(H2)2(PCy3)2] kiemelkedően aktív volt a klórarének deklórozása során is szek-butanol oldószerben. A rendszer figyelemre méltó funkcióscsoport-toleranciát mutatott.
Heterogenizálás révén megkíséreltek egyes, haloarének hidrogenolízisében aktív átmenetifém-organikus katalizátorok visszanyerését és újrafelhasználását. Blum és csoportja [20] RhCl3·3H2O, Aliquat 336 és Si(OMe)4 prekurzorokból szol-gél állapotú
hatékonynak bizonyult aril-fluoridok és -kloridok hidrogénezésekor 80 °C-on és 1,6 MPa H2 nyomáson. Angelici és munkatársai [21] a [Rh(COD)(1)]BF4 és a [Rh(COD)(2)]BF4 komplexeket rögzítettek Pd/SiO2 katalizátor felületén. Fluorbenzolt és 1,2-difluorbenzolt redukáltak enyhe körülmények között (0,4 MPa H2, 70 °C) NaOAc jelenlétében. Katalizátoraik sokkal aktívabbak voltak, mint a Pd/SiO2 vagy a kiindulási Rh-komplexek önmagukban. Kantam és kollégái [22] Pd(II)-t vittek fel MCM-41/szililamin (MCM-41: molekulaszűrő) hordozóra, és vizsgálták aril- halogenidek hidrodehalogénezését atmoszférikus nyomáson. A katalizátor újra felhasználható volt, az egyes ciklusokban állandó aktivitással.
N CH
PPh2
(CH2)3Si(OCH3)3
N
N
C(O)NH(CH2)3Si(OC2H5)3
C(O)NH(CH2)3Si(OC2H5)3
1 2
2.2.2 Katalitikus dehalogénezés egyszerű és összetett fém- hidridekkel
Az egyszerű és összetett fém-hidridek nukleofilitásuknál fogva alkalmasak szerves halogenidek redukálására. Hatékonyságuk jelentősen növelhető, ha katalitikus mennyiségben adagolt különféle átmenetifém-komplexekkel együtt használjuk őket. A hidrideket kezdetben egyszerű fémsókkal (stabilizáló ligandumok nélkül) kombinálták. Kérdéses azonban, hogy ezek a katalitikus rendszerek ténylegesen homogének-e, vagy inkább heterogénnek kell-e tekintenünk őket a gyakori fémkiválás miatt (l. pl. Egli [23], King [24] és Collman [25] munkái). Hasonló problémák merülnek fel az egyszerű fémsók más redukálószerekkel együtt való alkalmazása során is.
Főként halogénezett aromásokat redukáltak fém-hidridekkel. Minden esetben enyhe körülmények (25-70 °C) között történt a dehalogénezés. A legáltalánosabban a következő hidrideket használták: NaH, NaAlH4, NaBH4, MgH2 és LiAlH4.
Elsősorban DMF vagy THF volt az oldószer, katalizátorként leggyakrabban Ni(0)- és Pd(0)-tercier foszfán komplexeket vagy ezen átmenetifémek sóit alkalmazták [26-39]
((8) egyenlet), azonban előfordult a titán [40-46], ritkább esetben a ruténium, a ródium [47-49] és a lantanoidák [50-51] is.
ArX + NaBH4 + 1/2 TMEDA "Pd(dppf)"
THF
ArH + NaX + 1/2 TMEDA 2BH3
(8)
2.2.3 Katalitikus dehalogénezés hidroszilánokkal
A hidroszilánok gyenge hidrid vagy hidrogénatom donorok, viszont nagyon jó redukálószerek, ha átmenetifém-komplexekkel kombinálják őket [52a]:
R'X + R3SiH R'H + R3SiX
[LnM] (9)
Elsősorban ródium-, valamint palládium- és platinakomplex katalizálják a (9) reakciót. A publikált eredmények között dominál a debrómozás és deklórozás, Aizenberg és Milstein [52b] azonban szelektív defluorozásra alkalmas rendszert fejlesztett ki ((9a) egyenlet):
F
H
F F F
F
+ (EtO)3SiH
H
H
F F F
F
+ (EtO)3SiF [(PMe3)3RhC6F5]
90 °C
(9a)
2.2.4 Katalitikus dehalogénezés nem hidrides hidrogén donorokkal
Számos reagens viselkedhet hidrogén donorként (pl. a formátok, egyes ciklikus aminok és alkoholok), amelyek ligandumok jelenlétében és/vagy bázikus közegben reagálnak alacsony oxidációfokú átmenetifémekkel. A hidrogén transzfer a fémhez koordinált donorcsoportról úgy az alkoholok, mint a fém-alkilok esetében végbemegy [53a] (l. 3.3.2 fejezet). Legáltalánosabban tercier foszfánnal módosított nemesfémkomplexeket alkalmaznak katalizátorként, de előfordulnak az N- heterociklusos karbének (NHC) mint korszerű stabilizáló ligandumok is (l. pl. [53b]).
2.2.5 Biomimetikus dehalogénezés
A halokarbon vegyületek a termőtalajt, a felszíni vizek üledékét és a talajvizet szennyezik, közöttük számos toxikus és mutagén vegyületet találunk [54-55]. Bár egyes anaerob mikroorganizmusok le tudják bontani ezeket a vegyületeket, a folyamatok gyakran igen lassúak, másrészt a magas szennyezőanyag-koncentráció miatt maguk a baktériumok is megmérgeződnek. Így a probléma megoldására a biokatalízis helyett inkább a biomimetikus katalízis tűnik jobb megoldásnak [56]. A szerves halogenidek redukcióját tanulmányozták átmenetifém-tartalmú koenzimek jelenlétében (pl. vitamin B12 (Co, 3), F430 (Ni, 4), hematin (Fe, 5) és rokon komplexek) a legtöbb esetben korrinoidokat alkalmaztak [57]. A termék összetétele erősen függhet az alkalmazott redukálószertől, amely leggyakrabban Ti(III)-citrát [56, 58-61], ditiotreitol [56, 60], cisztein és szulfidok [60, 62-63] volt.
2.2.6 Elektrokémiai redukció
Az elektrokémiai módszer a szerves halogenidek közvetlen dehalogénezésére korlátozott mértékben használható. Fluoridok és monokloridok általában nem redukálhatók [4]. Átmenetifém-komplex mint mediátor esetén ugyanakkor a halokarbonok elektrolízise nagy hatékonysággal és szelektivitással végrehajtható [64-67] (vö. 3.3.1 fejezet).
CH3 H3C
CONH2 N
N CONH2
N
CH3
CH3
CONH2 H2NOC
H3C H3C
N H
H2NOC
CH3
HN O
O H3C
H P O
O- CH3 Co
O N
N
CH3
CH3
CH2OH OH CN
O
CONH2
+
3
N N
N N
Ni+
O HO2C
CO2H CH3
HN O
H H3C
CO2H
CO2H H
H H2NOC
CO2H X-
N H3C
N
N CH3
N H3C
Fe
CH3
CO2H HO2C
+ OH-
4 5
2.2.7 Vegyes reduktív eljárások
Főként alkil-halogenideket hidrogenolizáltak karbonilezés körülmények között és/vagy fém-karbonilok jelenlétében. Kobalt- [68], vas- [69-70] és Pd-komplexeket [71] alkalmaztak. Megállapították, hogy néhány funkciós csoportra nézve toleráns a redukció.
Buijs és munkatársai [72] Cu(I)-benzoátot alkalmaztak a Dow-féle fenolszintézis körülményei között poliklórozott és polibrómozott aromás szénhidrogének dehalogénezésében:
Ar'COOH + ArX + H2O Cu(I) Ar'OH + ArH + HX + CO2
(10)
Starichenko és kollégái [73-75] vizes közegben, Ni-komplex/Zn/PTC rendszerben regioszelektíven dehalogénezték a polihalogénezett (F, Cl) aromás vegyületeket.
2.3 Megfontolások a homogén katalitikus hidrodehalogénezés mechanizmusáról
A hidrodehalogénezés szubsztrátumainak, a hidrogénforrásoknak és az alkalmazott katalizátoroknak a köre rendkívül változatos. Ennek ellenére tehető néhány általános megállapítás a lehetséges reakcióutakra vonatkozólag.
2.3.1 A C-X kötés aktiválása oxidatív addícióval
Az aktiválás e leggyakoribb típusát behatóan tanulmányozták [76-78]. A következőkben az oxidatív addíciós reakciók néhány típusát mutatom be.
Az SN2 és az SNAr reakciókban a fématom megtámadja azt az alifás vagy aromás szénatomot, amelyhez a halogén kapcsolódik. Az erősen nukleofil fém és a jó kilépő X csoport (I > Br > Cl > F) megkönnyíti az SN reakciókat, viszont az R-csoport a sztérikus gátlása lassítja azt [77-78]. Az SNAr reakció kedvezményezett, ha például a 4-YC6H4X vegyületekben elektronszívó az Y szubsztituens [76]. Általában SN2 [71, 79-83] és SNAr [9, 24, 26, 34-39, 53b, 84-86] mechanizmust javasoltak az olyan 0 oxidációfokú d10 komplexek esetében, mint az [MLn] (M = Ni, Pd, Pt; L = tercier foszfán; n = 2,3,4). Például:
[Pd(PPh3)3] + ArX [(PPh3)2Pd(X)Ar] + PPh3 (11)
Sikerült hidrodehalogénezés reakcióelegyeiből néhány palládiumot [34] és nikkelt [24] tartalmazó oxidatív addíciós terméket kinyerni és szerkezetüket meghatározni.
Az aril-halogenideknél az alkalmazott fém aktivitása Ni > Pd > Pt sorrendben csökkent. Megállapították, hogy a sztérikus és elektronikus tulajdonságok, a ligandumok száma és a keláteffektus is fontos szerepet játszik [37, 78, 87-88].
Például a bázikus, kelátképző foszfánok Pd(0)-komplexei könnyebben lépnek reakcióba klór-benzollal, mint azok nem kelátképző analogonjai [9, 76, 88]. A katalitikus dehalogénezés során az oxidatív addíció SN2 vagy SNAr típusát valószínűsítették az irodalomban a következő alacsony oxidációfokú fémek komplexei esetében is: Ti [89-90], Zr(II) [91], Ru(II) [19, 92-94], Rh(I) [17, 80, 93, 95- 96] és Pt(II) [97-98].
A d7 konfigurációjú komplexek esetében tipikusan atom transzfer játszódik le: a fémkomplex letépi a halogénatomot az RX-ről. Ezután a képződő gyök egy másik d7 komplexhez kapcsolódik. Klasszikus példa erre a mechanizmusra a pentacianokobaltát(II) által katalizált hidrodehalogénezés [5-6], de újabban hasonló reakcióutat javasoltak a Co(II)-korrin által katalizált szén-tetraklorid dehalogénezésre, ha a redukálószer tiol volt [60]:
BCoII + CCl4 BCoIIICl + CCl3 (12) BCoII + CCl3 BCoIIICCl3... (13)
Az egy-elektron átmenet (SET) és az SN2 mechanizmusok között gyakran alig tehető különbség, mivel a két reakcióút főterméke azonos, eltekintve a szénatom sztereokémiájától (racemizáció játszódik le inverzió helyett). Ha a képződő gyökök az oldószerkalickán belül könnyen rekombinálódnak, akkor belső szférás elektronátmenetről beszélünk [70, 76-78]. Ez általában a koordinatíve telítetlen részecskékre jellemző ((14) séma):
[HFe(CO)5] + PhI [HFe(CO)5 , PhI ] [HFe(CO)5 , Ph , I ]
[HFePh(CO)5 , I ] (14)
Koordinatíve telített komplexek külső szférás elektronátmenettel redukálják a halokarbon vegyületeket [65-66, 77-78, 99-100]. Például aril-halogenidek [Zn(pc)]
mediátor jelenlétében végzett elektrokémiai redukciójának egyik feltételezett lépése a következő [99]:
[Zn(pc)] + ArX [Zn(pc)] + [ArX] [Zn(pc)] + Ar + X (15)
2.3.2 A redukálószer szerepe a katalitikus ciklusban
A homogén katalitikus hidrodehalogénezésben két fontos szerepe lehet a redukálószernek:
az átmenetifém-komplex átalakítása úgy, hogy az képes legyen a szubsztrátum aktiválására;
az M-H kötés kialakítása, amely — közvetlen, vagy közvetett módon — a szubsztrátum C-X kötésének felszakítására alkalmas [53a, 100].
Nem feltétlenül része mindkét fenti lépés minden egyes katalitikus ciklusnak [92, 102]. Az első folyamat ahhoz szükséges, hogy a prekurzor komplexet katalitikusan aktív formába vigye — általában redukálja [2, 19, 37, 42, 53b, 76, 80, 102-104].
Példa erre következő reakcióegyenlet (a képződő HCl megkötésére lúgot adagoltak):
[L2Rh(H)Cl2] + H2 + NaOH [L2Rh(H)2Cl] + NaCl + H2O (20) ahol L = PCy3, PiPr3 [12].
A második folyamat általában a szubsztrátum aktiválását követi a hidrodehalogénezés ciklusában, de ismert ellenpélda is [2, 97, 105-106].
Az M–H kötés kialakulásának sajátossága, hogy erősen függ a használt redukálószertől. A dihidrogén [12-13, 16, 19, 80, 102] és hidroszilán [52b, 93, 97]
legtöbbször oxidatív addícióval reagál [77, 107-108]. Példa erre a következő reakció terméke, amelyet sikerült elkülöníteni, és a szerkezetét röntgendiffrakcióval meghatározni [52b]:
[L3RhC6F5] + (EtO)3SiH [L3RhH(C6F5)Si(OEt)3]
(21) ahol L = PMe3.
A dihidrogén heterolitikus aktiválásánál kell, hogy a rendszer bázikus ligandumot (pl. piridin) tartalmazzon [17, 80, 107].
Az egyszerű és összetett fémhidridek mint erős nukleofilok hidrid transzfer során könnyen lehasítják a katalizátor központi atomjához kötött halogént [34-39, 42, 89].
Alkoholátok [2, 9, 53b, 94, 109], formátok [9, 105, 110-111] és fém-alkilek [82, 90-91]
is helyettesíthetik a halogént. Ezt a lépést az alkoxi-, formáto- vagy alkilligandumokról a központi fémre történő hidrogén transzfer követi [9, 53a, 94, 105, 112].
2.3.3 A termék kialakulása
A hidrogénezett termék legtöbbször reduktív elimináció során alakul ki. A d8 fémek (Ni(II), Pd(II)), vagy a d6 fémek (Ru(II), Rh(III)) esetében az R–H termék könnyen eliminálódik [88]. Valószínű, hogy ezek a reakciók háromcentrumos átmeneti állapoton keresztül mennek végbe [77-78, 113]:
LnM(H)R LnM H
R
LnM + RH
(22)
2.4 CFC és HCFC vegyületek heterogén katalitikus hidrodehalogénezése
A CFC-k környezeti ártalmainak kiküszöbölésére az irodalmi adatok alapján két lehetőség van:
új, klórmentes hűtőanyagok szintézise,
Hidrodehalogénezést használnak például a legismertebb „zöld” hűtőanyag, a CF3CH2F (R134a) szintézisének utolsó lépésében is, amennyiben azt CF3CHClF-on (R124a) keresztül állítják elő.
Az eddigi kutatások során átmenetifémeket alkalmaztak hidrodeklórozó katalizátornak. Főképp a metán és az etán klórozott és fluorozott származékai hidrogénezését vizsgálták. A katalizátorra jellemző annak fémkomponense és a hordozó minősége (kémiai összetétele, porozitása, stb., l. pl. [114]). A leggyakrabban használt fém a palládium.
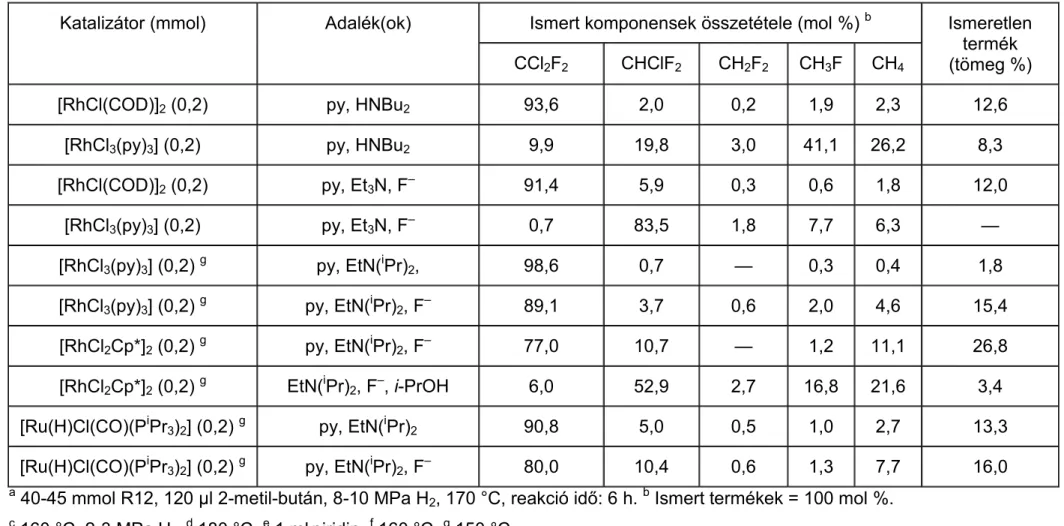
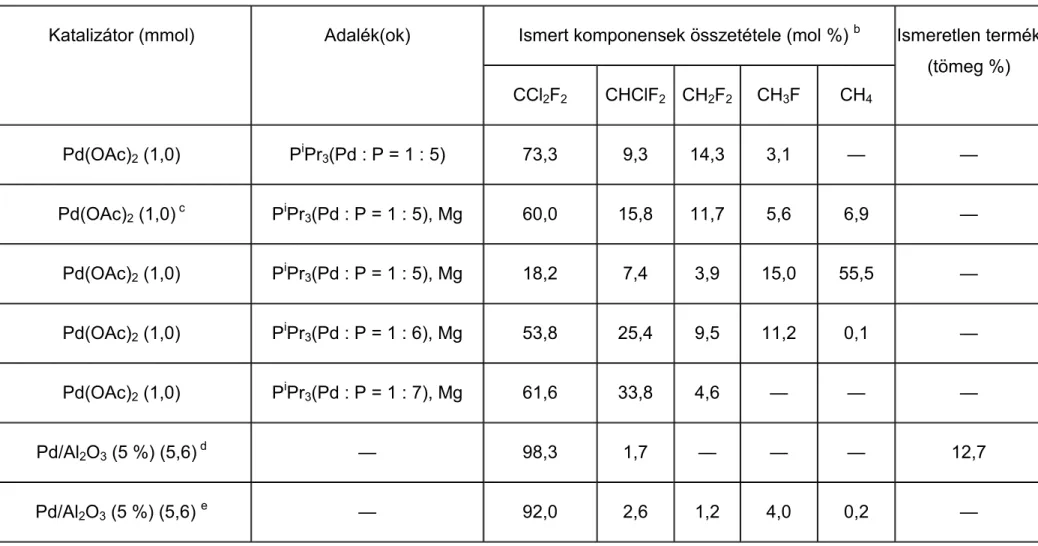
A palládium katalizátor minden szubsztrátum esetében (CCl2F2, CF3CCl2F, CF3CCl3, CF3CHClF, stb.), és minden hordozón főtermékként teljesen deklórozott vagy egyszeresen klórozott termékeket adott a vizsgálatok során 0-10 MPa hidrogénnyomáson és 150-300 °C-on, különbség csak a termék szelektivitásában, a katalizátor aktivitásában, a melléktermékek mennyiségében és minőségében volt [115-124]. A katalizátor minősége mellett természetesen a körülmények is befolyásolták az eredményeket. Megállapítható, hogy a hőmérséklet emelésével a melléktermékek aránya megnőtt a kívánt termékek kárára, ezzel párhuzamosan pedig csökkent a főtermék szelektivitása [115-116, 118-119, 121, 125-126]. A közleményekből kiderült az is, hogy a katalizátor aktivitása csökken a feleslegben alkalmazott H2 hatására, másrészt pedig a reakció során keletkező karbid [119], HCl, klór „mérgezi” a katalizátort csökkentve az aktív helyek számát [1, 10, 123, 125-126].
Azonos fém esetében a különböző hordozók a szelektivitásra, termékarányokra és a melléktermékekre vannak hatással, de ez döntő változással a főtermékek minősége szempontjából nem jár. A katalizátor felületi tulajdonságai és koncentrációja erősen befolyásolja az átalakulás mértékét. A palládiumkatalizátor esetében kettős kötéses termékek csak ritkán jelennek meg [1, 115-122, 124-125, 127-128]. CCl2F2-t Pd/γ- Al2O3-on 300 oC-on hidrodeklórozva azt az eredményt kapták, hogy alacsonyabb (W
= 0,5 %) fémkoncentráció esetében nagyobb az aktivitás és az átalakulás, mint például a W = 5 %-os értéknél, az optimum pedig W = 1 %-nál van [120-121].
Vizsgálták a szén–klór kötés felszakításának energiáját fluor-klór-etánokban [129- 131]. Mivel hogy a C–Cl kötés energiája kisebb, mint a C–F kötésé, főleg deklórozott termékek keletkeztek, bár előfordultak defluorozott melléktermékek is magasabb hőmérsékleten [117-118, 121].
Több kutató valószínűsítette, hogy CCl2F2 Pd-tartalmú katalizátorok jelenlétében elvégzett hidrogénezése során keletkeznie kell egy difluor-karbén részecskének. Ezt
a feltevést alátámasztja a reakció során keletkező főtermék (CH2F2) [132]. A :CF2
részecske termodinamikai stabilitása viszonylag nagy lehet [118], de élettartama igen kicsi nagy reakcióképessége miatt [117]. Jelentős befolyásolással bír a H2/CCl2F2
(mol/mol) aránya az átalakításra és a szelektivitásra. Ha növekszik az arány, növekszik az átalakulás és a CH2F2 szelektivitása is [115].
Más átmenetifém-katalizátorok esetében az CCl2F2 hidrogénezése során hasonló eredményeket kaptak. A különféle nemesfémek aktivitását és szelektivitását összehasonlító közleményben megállapították, hogy lényeges különbség tapasztalható abban, hogy mely fémek estében mi a főtermék [123]. Amíg a félig deklórozott termékre nézve a ruténium és az irídium legszelektívebb és a palládium a legkevésbé, addig a teljesen deklórozott termékre nézve ez pont fordítva van. A többi vizsgált átmenetifém köztes helyet foglal el a szelektivitási sorban. A rénium esetében a CCl2F2 átalakulása nem játszódott le. A melléktermékek mennyisége csak a ruténiumnál és az irídiumnál volt számottevő. A szelektivitás a CH3F-re nézve nőtt a katalizátor elhasználódásával az irídium és ródium esetében. A kísérletsorozat alatt csak az irídium és platina nem dezaktiválódott. A kívánt termék (difluor-metán) szelektivitása palládium esetében végig magas volt. A metánra nézve a szelektivitás mindegyik katalizátor esetében alacsony volt, és csökkent az elhasználódás során, viszont a CHClF2 szelektivitása minden katalizátornál nőtt eközben.
Ruténiumkatalizátorokkal vizsgálva a CCl2F2 hidrodeklórozását megállapították, hogy a főtermékek a CH4, CH2F2, CHClF2. A kísérletek során dimerizált termékek is keletkeztek [133].
Morato és munkatársai [134a] a CCl2F2 és a CHClF2 hidrodeklórozása esetében nikkelkatalizátort alkalmazva a teljesen deklórozott származékot és a metánt kapták főtermékként. Magas volt a melléktermékek mennyisége (keletkeznek kettőskötésű vegyületek is). A Ni-katalizátorok is mérgeződtek kloriddal. A CHClF2/H2 aránnyal nőtt a CH2F2 és a CH3F szelektivitása, ugyanakkor a metán és etilén szelektivitása csökkent. Megfigyelték, hogy a hőmérséklet emelésével csökken a CH2F2
szelektivitása, viszont a CH3F-é és a difluor-etilénné növekszik. A szerzők különböző eloszlású Pd-hidrotalcit katalizátor hatásosságát is vizsgálták ugyanezen szubsztrátumok hidrodehalogénezési reakcióiban, 15 perces, illetve 20 órás reakcióidővel, 180-220 °C hőmérsékleten [134b]. A főtermékek ugyanazok voltak, mint a nikkelnél, de a reakciókörülmények és a katalizátor Pd-tartalmának megfelelő
megválasztásával szelektivitásuk nőtt. Emellett a CCl2F2-ből kevés CHClF2, CHClF2- ből viszont jelentősebb mennyiségű CHF3 is képződött.
A katalizátor előállítási módja, körülményei nagyban befolyásolják a kapott eredményeket (l. pl. [133]). A közlemények alapján általánosnak tekinthető, hogy a több különböző fémkomponenst tartalmazó „vegyes” katalizátorokkal a főtermékekre nézve jobb szelektivitás és/vagy átalakulás érhető el (l. pl. [127]).
CBrClF2 (Halon 1211, a CCl2F2 rokonvegyülete) hidrodehalogénezését a nikkelcsoport γ-aluminíum-oxid hordozóra felvitt átmenetifémeivel vizsgálták Yu és munkatársai [135]. A hőmérsékletet és a H2 : halon arányt változtatva tanulmányozták a termékösszetétel, szelektivitás és a konverzió alakulását. A palládium és a platina sokkal aktívabbnak bizonyult a nikkelnél. A főtermék a palládiumnál CH2F2, a platina esetében CH4, a nikkelnél pedigCH3F volt.
2.5 CFC és HCFC vegyületek homogén katalitikus hidrodeklórozása
A freonok homogén katalitikus átalakítását az utóbbi 15 évben kezdtek el tanulmányozni [9-10], így annak a megfelelő heterogén reakciókénál jóval kisebb irodalma van.
Roundhill és munkatársai [102] a széntetraklorid és a triklór-fluor-metán átalakításával foglalkoztak [RuCl2(PPh3)3] és [RuCl2(dppe)2] katalizátorok jelenlétében 25 °C-on és 0,11 MPa nyomáson. Mingos és Vilar [79, 103] újszerű klasztereket állított elő, például a [Pd2(dba)3]-ból, PtBu3-ból és CYCl3-ból (Y = H, F) a [Pd4(3-CY)(-Cl)3(PtBu3)4]-ot. A fluorokarbin-klaszter toluol oldószerben, Et3N hozzáadásával kiválóan katalizálta a CFCl3 hidrodehalogénezési reakcióját CH3F-á és CHFCl2-é atmoszférikus H2 nyomáson. Hasonló körülmények közt a [Pd(PtBu3)2] katalizátorral szelektíven CHFCl2 volt a termék.
A CFC-vegyületek közül a CF3CCl3 (CFC-113a) és a CClF2CCl2F (CFC-113) homogén katalitikus hidrodeklórozását részletesen tanulmányozták különböző átmenetifém-komplexek jelenlétében [136a-b]. A kevéssé poláris THF-es oldatban, 80-150 °C-on és 1 MPa körüli H2 nyomáson az előbbi szubsztrátum szelektíven CF3CHCl2-ná, utóbbi — kevés CClF=CF2 mellett — CClF2CHClF-ná alakult át. A legaktívabbnak talált [RhCl(PPh3)3] esetében részletes kinetikai vizsgálatot végeztek
a szerzők, és tanulmányozták a feleslegben adagolt PPh3 és egyes adalékok (aminok és halogenidionok) hatását is. A foszfán P : Rh 6 : 1 arányig kis mértékben csökkentette, ezen arány felett jelentősen megnövelte a reakciósebességet. Míg aminok különböző mértékben, de lassították a reakciót, a halogenidionok közül kiemelkedett a klorid sebességnövelő hatása, bár kis relatív koncentrációban Br– és I– is gyorsította a folyamatot. A szerzők feltételezése szerint a semleges vagy anionos Rh-tartalmú részecske mint nukleofil támadja meg a CFC molekulát, és a mechanizmusban egy, a CF3CCl3-ból és PPh3-ból képződő foszfóniumsónak is jelentős szerepe van.
A 2000-es évek elején leírták, hogy a ftalocianáto-palládium különböző hordozókra felvíve gázfázisú reakcióban a konvencionális Pd-katalizátorokkal összehasonlítható aktivitást és szelektivitást mutatott CCl2F2
hidrodehalogénezésében [137]. Bár spektroszkópiai módszerekkel kimutatták, hogy a ftalocianinligandum a Pd koordinációs övezetében van, nagy valószínűséggel finom eloszlású fém-palládium fejti ki a katalitikus hatást. A fentieken kívül a CFC- vegyületek homogén katalitikus hidrodeklórozására vonatkozólag egy szűkszavú konferenciaanyag-összefoglalót találtam, amely elektrondús átmenetifém-komplexek alkalmazását említi [138].
2.6 CFC-k hidrodeklórozásának modellezése
A CFC-k hidrodeklórózásának komplexkémiai modellezéséről csupán a legutóbbi időben született néhány közlemény. Ez némiképp meglepő annak tükrében, hogy például átmenetifémek difluor-karbén-komplexei több évtizede ismertek [139-140].
Bár e komplexek nagyobb részét nem CFC-kből és analogonjaikból állították elő, legújabban CBr2F2 és Na2[Fe(CO)4], illetve Na2[Fe2(CO)8] reakciójában sikerült [Fe2(CO)6(-CO)(3-n)(-CF2)n] (n = 1, 2) komplexeket szintetizálni [141]. Ez utóbbi eredmény arra utal, hogy CFC-vegyületek és analogonjaik is szolgáltathatnak difluor- karbén-komplexeket.
Caulton és munkatársai [142] [MCF2(H)(F)(CO)L2] (M = Ru, Os; L = PiPr3, PtBu2Me) típusú komplexek szintézisét és reakcióit vizsgálták. Megállapították, hogy M = Ru esetben a komplexek THF-ben már szobahőmérsékleten [MCHF2(F)(CO)L2]-
má alakulnak át. Ez a reakció azért érdekes, mert a heterogén katalizátorok felületén képződő :CF2 hidrogéneződésének modelljéül szolgálhat.
Hughes és munkatársai [143a-b] perfluoretil-irídium-komplexek hidrogénezését vizsgálták. A [Ir(CF2CF3)(Cp*)(H2O)(PMe3)]BF4 atmoszférikus H2 hatására CF3CH2F-t és CF3CH3-t adott. A termékek képződését modellezték [Ir(CF2CF3)H(Cp*)(PMe3)] és CH3CO2D, valamint [Ir(CF2CF3)D(Cp*)(PMe3)] és CH3CO2H kölcsönhatásának vizsgálatával. Az egyik -helyzetű C-F kötés hidrogéneződött a reakció során, és HF lépett ki a molekulából. A szerzők karbén-típusú intermedier fellépését valószínűsítették mindkét folyamat során. Ugyanez a munkacsoport [144] perfluor- alkilirídium-komplexek α- és/vagy β-helyen lejátszódó defluorozását vizsgálta 2e--os redukcióval. Elektronforrásnak nátrium-naftalinidet vagy kálium-grafitot alkalmaztak.
Arra a megállapításra jutottak, hogy ha van α-helyen fluoratom, akkor csak az defluorozódik az alkalmazott kísérleti körülmények közt. Viszont ha az α-helyen nincs fluoratom, akkor a β-helyen lévő szénatom is defluorozódik.
Braun és munkatársai [145a-b] hexafluoro-propént hidrogéneztek foszfántartalmú hidridoródium-komplexekkel amin adalék jelenlétében. A reakció első lépésében szelektíven aktiválódott a trifluor-metil-csoporthoz képest transz-helyzetű C–F kötés.
A köztitermékként kialakuló ródiumkomplex további hidrogénezése során 1,1,1- trifluor-propán képződött.
3. Kísérleti rész
3.1 Kísérleti eredmények
3.1.1 Hidrodeklórozási kísérletek
Kísérleti munkám során háromféle gázállapotú freonkészítmény hidrodeklórozását vizsgáltam:
1. 1,1,1,2-Tetrafluor-2-klór-etán (CF3CHClF, HCFC-124a, R124a), amely az R401/A jelzésű gázkeverék komponenseként volt beszerezhető. A gázkeverék összetétele a következő volt (tömeg %):
HCFC-22 (CHClF2): 53 %
HCFC-124a (CF3CHClF): 13 %
HFC-152a (CHF2CH3): 34 %
E gázelegyből kiindulva tehát az eredetileg vizsgálni kívánt HCFC-124a-n kívül még egy klórtartalmú komponens (a HCFC-22) hidrodeklórozása is lehetséges volt.
2. Diklór-difluor-metán (CCl2F2, CFC-12, R12).
3. Klór-difluor-metán (CHClF2, HCFC-22, R22). Ez a gáz komponense az R401/A gázelegynek, de tiszta formájában is vizsgáltam hidrodehalogénezési reakcióit.
A kísérletek során különböző átmenetifémet (Rh, Ru, Pd és Ni) tartalmazó homogén és heterogén katalizátorokat teszteltem zárt rendszerben. Különböző ligandumokat és/vagy adalékokat adtam az elegyhez (pl.: nitrogénbázisok, foszfánok). A nitrogénbázist gyakran a melléktermékként képződő HCl közömbösítése céljából adagoltam (vö. pl. [15, 79, 103]). Oldószert a kísérletek
![1. táblázat. Néhány halogénezett szénhidrogén hatása az ózonrétegre [1a]](https://thumb-eu.123doks.com/thumbv2/9dokorg/874037.47030/11.892.103.793.311.804/táblázat-halogénezett-szénhidrogén-hatása-ózonrétegre-a.webp)