Gyomirtószerek szorpciójának tanulmányozása különböző talaj – oldat rendszerekben
Doktori (PhD) értekezés
Írta: Ertli Tímea
Témavezető: Dr. Földényi Rita, egyetemi docens
Készült a Veszprémi Egyetem
Környezettudomány Doktori Iskolája keretében Környezetmérnöki és Kémiai Technológia Tanszék
Veszprém 2005.
GYOMIRTÓSZEREK SZORPCIÓJÁNAK TANULMÁNYOZÁSA KÜLÖNBÖZŐ TALAJ – OLDAT RENDSZEREKBEN
Értekezés doktori (PhD) fokozat elnyerése érdekében Írta:
Ertli Tímea
Készült a Veszprémi Egyetem Környezettudomány Doktori Iskolája keretében Témavezető: Dr. Földényi Rita, egyetemi docens
Elfogadásra javaslom (igen / nem)
...
aláírás A jelölt a doktori szigorlaton …... % -ot ért el.
Az értekezést bírálóként elfogadásra javaslom:
Bíráló neve: …... …... igen /nem
……….
aláírás Bíráló neve: …... …... igen /nem
……….
aláírás A jelölt az értekezés nyilvános vitáján…...% - ot ért el.
Veszprém, ……….
a Bíráló Bizottság elnöke A doktori (PhD) oklevél minősítése…...
………
Az EDT elnöke
Tartalomjegyzék
Kivonat... 5
Abstract... 7
Zusammenfassung... 8
Az alkalmazott rövidítések jegyzéke és fogalmak magyarázata ... 9
1. Bevezetés... 11
2. Irodalmi áttekintés... 12
2.1. Az adszorpció jelensége szilárd/folyadék (S/L) határfelületen ... 12
2.1.1. Adszorpció híg, vizes oldatokból... 12
2.1.1.1. Adszorpciós izotermák... 13
2.1.1.2. Adszorpciós izotermaegyenletek ... 14
2.1.1.2.1. A Langmuir-izoterma...14
2.1.1.2.2. A Freundlich-izoterma ...15
2.1.1.2.3. Czinkota és munkatársai által levezetett izotermaegyenlet...16
2.1.1.3. Adszorpció elektrolitoldatokból... 17
2.2. A talaj... 20
2.2.1. A talaj mint sokoldalú környezeti szféra... 20
2.2.2. A talaj felépítése... 20
2.2.2.1. A talajok ásványi alkotórészei ... 21
2.2.2.2. A talaj szerves alkotói ... 21
2.2.2.3. A talajkolloidok és szerepük ... 24
2.2.2.3.1. Asszociációs kolloidok ...27
2.2.2.4. A talajoldat... 28
2.2.3. A talaj kémhatása ... 28
2.2.3.1. A savas esők és a műtrágyázás hatása... 29
2.2.4. Talajok növényvédőszer-érzékenysége... 30
2.2.5. Fajlagos felület meghatározására szolgáló módszerek... 31
2.2.5.1. BET-módszer ... 31
2.2.5.2. Fajlagos felület meghatározása színezékkel... 32
2.3. A növényvédőszerek ... 33
2.3.1. A növényvédőszerek általános jellemzése ... 33
2.3.2. Peszticidek a talajban, sorsuk a környezetben ... 34
2.3.3. Néhány herbicidcsoport és gyomirtószer bemutatása, jelenlétük a talajban ... 37
2.3.4. Növényvédőszerek formálása ... 40
2.3.4.1. Formázószerek hatása ... 41
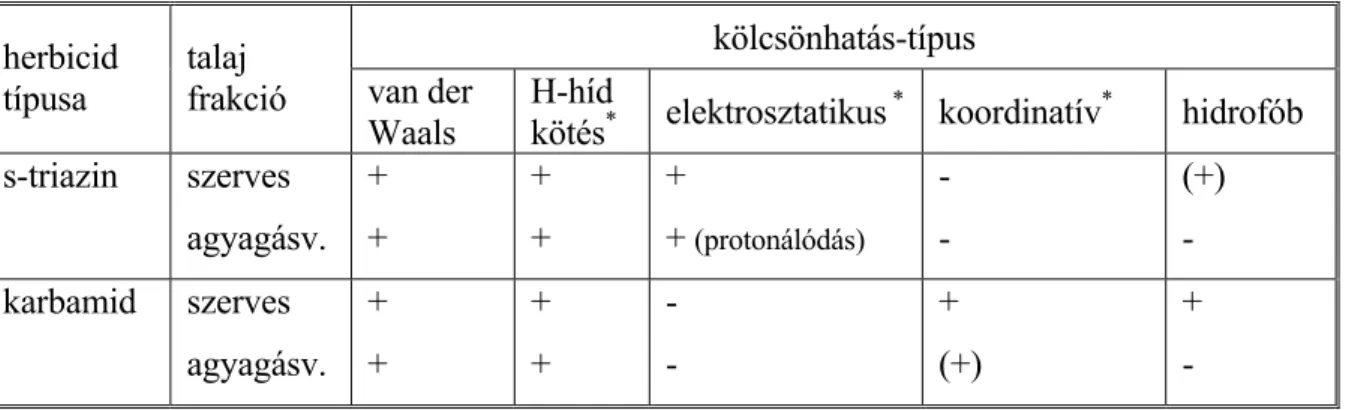
2.3.5. A növényvédőszerek szorpciós kölcsönhatásai... 42
2.3.6. Növényvédőszerek analitikai meghatározása és a herbicid-talaj adszorpció tanulmányozására alkalmas analitikai módszerek... 45
3. Célkitűzés ... 47
4. Kísérleti rész... 49
4.1. Felhasznált anyagok ... 49
4.1.1. Mintaelőkészítéshez és elemzéshez szükséges anyagok... 49
4.1.2. Gyomirtószerek és formázószerek ... 49
4.1.2.1. Növényvédőszer-hatóanyagok ... 49
4.1.2.2. Szerformátum... 53
4.1.2.3. Formázószerek ... 54
4.1.3. Vizsgált talajok ... 54
4.1.4. Talajalkotók ... 56
4.1.4.1. Kvarc... 56
4.1.4.2. Fulvosav... 57
4.2. A kísérletek kivitelezése és analitikai módszerek ... 57
4.2.1. A közeg kialakítása ... 57
4.2.2. Növényvédőszer-oldatok készítése ... 58
4.2.3. Sztatikus egyensúlyi kísérletek kivitelezése ... 59
4.2.4. Az adszorpció kivitelezése adott mennyiségű szerves anyag jelenlétében ... 59
4.2.5. Bomlásvizsgálat kivitelezése ... 60
4.2.5.1. A bomlástermékek vizsgálatához szükséges extrakció megvalósítása ... 60
4.2.5.1.1. A szilárd fázis extrakciója...61
4.2.5.1.2. A folyadék fázis extrakciója ...61
4.2.6. pH mérése és a talajoldatok pH- értékeinek beállítása... 61
4.2.7. Nagy hatékonyságú folyadékkromatográfia... 61
4.2.8. UV-spektrofotometria ... 62
4.2.9. Összes szerves szén meghatározása ... 63
4.2.10. Bomlástermékek vizsgálata tömegspektrometriával... 64
5. Eredmények, értékelés... 65
5.1. Az adszorbensek fajlagos felületének meghatározása... 65
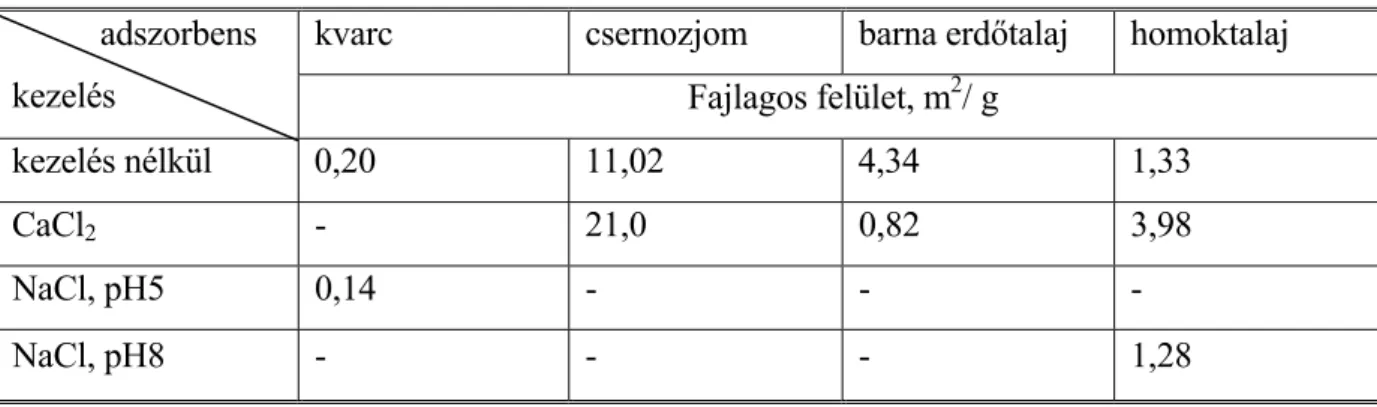
5.1.1. Fajlagos felület meghatározása N2-adszorpcióval – A közeg sótartalmának hatása az adszorbens szerkezetére ... 65
5.1.2. Fajlagos felület meghatározása metilénkék festékkel ... 66
5.2. A kísérleti körülmények hatása az adszorpcióra ... 68
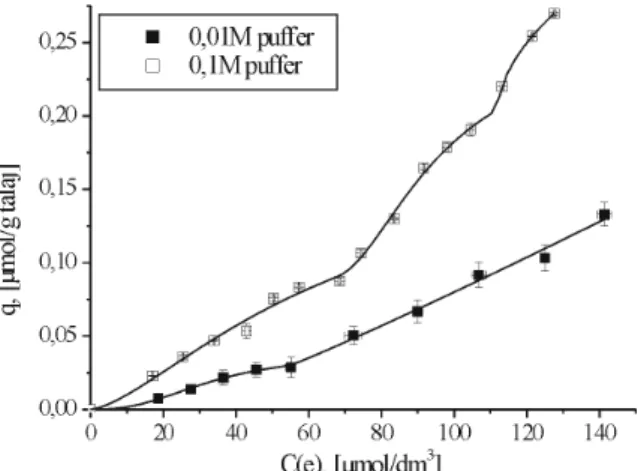
5.2.1. A foszfát-puffer hatása (jelenléte és koncentrációja) az adszorpcióra ... 68
5.2.2. A dinamikus egyensúly beálltának ellenőrzése... 71
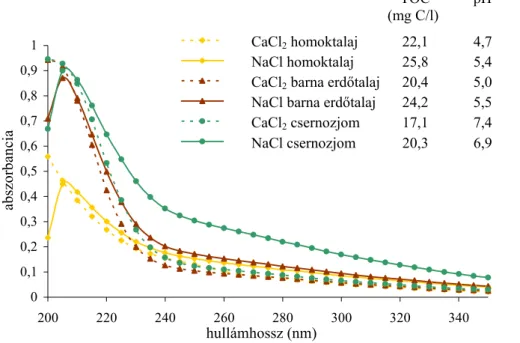
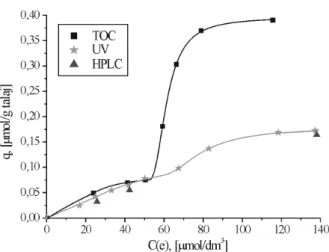
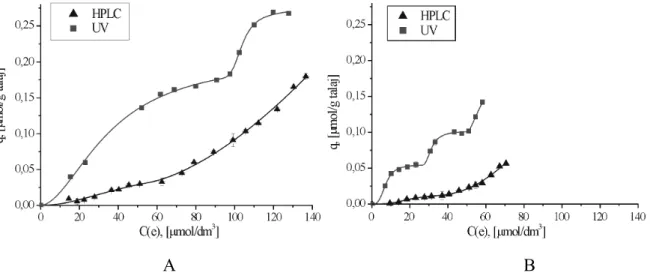
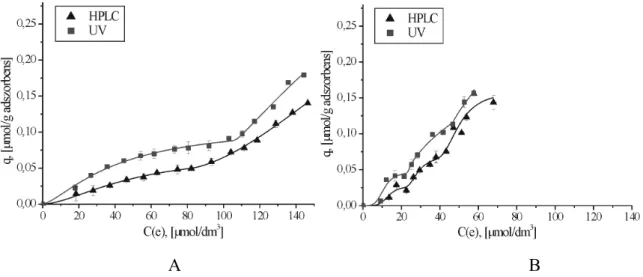
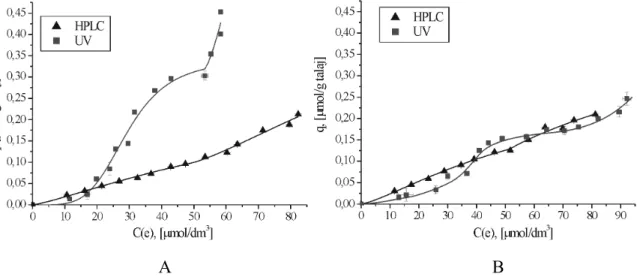
5.3. Az adszorpció tanulmányozása különböző analitikai módszerekkel ... 72
5.4. Az izotermák alakjából kapott információk ... 76
5.5. Az izotermák Henry-tartományának vizsgálata ... 80
5.6. Az adszorpciós izotermák illesztésével nyert paraméterek ... 82
5.7. Az adszorpció pH-függésének vizsgálata - A hatóanyagok megkötődése azonos adszorbensen, különböző pH-értékeken - ... 85
5.7.1. Az izoproturon adszorpciójának pH-függése... 86
5.7.2. A prometrin adszorpciójának pH-függése... 89
5.7.3. Az izoproturon és prometrin pH-függésének elemzése a talaj/talajoldat szempontjából.... 90
5.8. A hatóanyagok megkötődése különböző adszorbenseken és azonos pH-értékeken ... 92
5.8.1. Izoproturon vizsgálata... 92
5.8.2. A prometrin vizsgálata ... 94
5.8.3. A klórszulfuron adszorpciójának tanulmányozása... 95
5.8.3.1. A hatóanyag és szerformátumának vizsgálata ... 95
5.8.3.2. Vizsgálatok formázószerekkel ... 96
5.8.4. A hatóanyagok megkötődésének összehasonlítása azonos adszorbensen és pH-értéken ... 97
5.8.5. Hozzáadott szerves anyag hatása az adszorpcióra ... 100
5.8.5.1. Fulvosav hatása az izoproturon kvarcon történő adszorpciójára ... 100
5.8.5.2. Hozzáadott DOM hatása az izoproturon homoktalajon történő adszorpciójára... 101
5.8.6. Az izoproturon bomlásának vizsgálata ... 102
5.8.6.1. Kinetikai jellemzés... 102
5.8.6.2. Bomlástermékek vizsgálata GC-MS-sel ... 103
6. Összefoglalás... 104
Irodalomjegyzék... 107
Tézisek... 117
Theses... 119
Függelék ... 121
Kivonat
A növényvédőszerek (peszticidek) környezetterhelésének tanulmányozása fontos és sürgető feladat, hiszen a peszticidek gyakori, diffúz formában jelentkező talaj- és vízszennyezők. Sorsu- kat vizsgálni kell a bioszféra minden közegében, főként a kijuttatással közvetlenül érintkező talajban és a talaj – víz rendszerekben, ahol viselkedésüket számtalan biotikus és abiotikus tényező befolyásolja. Ilyen abiotikus tényező például a talajon bekövetkező megkötődés, amely erősen függ a talaj tulajdonságaitól, szerves anyagának összetételétől és az oldat kémiai jellemzőitől. Jelen dolgozat ezen tényezők hatásával foglalkozik gyengén poláris és mérsékelt vízoldhatóságú gyomirtószerek talaj – oldat rendszerekben történő megkötődésének példáján.
A hazánkban is nagy mennyiségben felhasznált izoproturon és prometrin sztatikus egyensúlyi kísérletek során lejátszódó adszorpciójának vizsgálatára három eltérő szervesanyag-tartalmú talajon (csernozjom, barna erdőtalaj, homoktalaj), illetve talajalkotók (kvarc, hozzáadott kioldott szerves anyag, fulvosav) jelenlétében került sor. A kísérletekben változtatott paraméter a vizes közegben oldott só minősége, a pH (pH=5, pH=7, pH=8) és vizes fázis szervesanyag-tartalma. A formázószerek adszorpcióban betöltött szerepének vizsgálatához a nagyon kis dózisban kijuttatandó klórszulfuron semleges kémhatás mellett kivitelezett adszorpciójának, a kereskedelmi forgalomban is kapható Glean® 75DF készítmény és a klórszulfuron hatóanyag egy-egy formázószerrel (Supragil illetve Borresperse) létrehozott keverékének adszorpciójának összehasonlítása történt meg.
A minták elemzése különböző analitikai módszerekkel (összes szerves szén meghatározás, UV-spektrofotometria), de zömmel folyadékkromatográfiás módon (HPLC) zajlott. A kapott mérési pontokra egy – a megkötődésben jelentkező lépcsőket is jól kezelő – egyenlettel izoterma illeszthető. Az izotermák értelmezésénél a szerző az egyenlet fizikai-kémiai jelentéssel bíró paramétereinek számértékét is felhasználta a talajkémiai és molekulaszerkezeti információk mellett, valamint különös tekintettel volt a kioldódó szerves anyag (DOM) szerepére.
A kapott izotermák többlépcsősek, az egyes lépcsők eltérő kötőhelyeket, más asszociáció fokú képződmények kialakulását jelzik. Az izoproturon és a prometrin adszorpciója pH-függő, amit a különböző pH-értékeken az egyes lehetséges kölcsönhatás-típusok (hidrofób kölcsönhatás, hidrogénhíd-kötés, elektrosztatikus kölcsönhatás) eltérő dominanciája okoz. Savas körülmények között mindkét hatóanyag esetén nagyobb a fajlagos adszorbeált mennyiség, mint lúgos pH-n. Prometrinből minden adszorbensen és pH-értéken több kötődött meg, mint
izoproturonból, ami jelzi, hogy esetében jobban dominál a hidrofób kölcsönhatás, illetve izoproturonra jobban érvényesül a kioldódó szerves anyag szolubilizáló hatása.
A klórszulfuron megkötődése nem függ a talaj szervesanyag-tartalmától, megkötődése nemcsak a különböző adszorbenseken, hanem szerformátumával, a Gleannel is hasonló mértékű. Az eltérő funkciójú (nedvesítőszer és diszpergálószer) adalékanyagok hatására a klórszulfuron adszorpciója eltérő, kisebb mértékű a megkötődés a diszpergálószer jelenlétében.
Az izoproturon különböző körülmények között követett bomlásánál a nagyobb szervesanyag-tartalmú talajon nagyobb a bomlás mértéke, de pH-függés egyik vizsgált rendszerben sem tapasztalható. A legintenzívebb bomlást eredményező csernozjom talaj esetén GC-MS módszerrel olyan bomlástermékeket sikerült kimutatni, amelyek jelenlétét a szakirodalom eddig csak UV-fény besugárzás hatására közölte.
Study of the sorption of herbicides in different soil – solution systems
Abstract
The clarification of the environmental impact of pesticides is an important and urgent task due to their soil and water contamination. Their fate is influenced by many biotic and abiotic factors like the adsorption on the soils. The adsorption of isoproturon and prometryn being weakly polar and moderately soluble herbicides was studied here in different soil–solution systems.
Static equilibrium experiments were carried out on three soils with different organic matter content (chernozem, brown forest and sandy soil) and in the present of soil constituents (quartz and extra humic substance content). The variable factors of the experiments were the quality of the electrolytes, the pH (pH=5, pH=7, pH=8) and the dissolved organic matter (DOM) content. To get to know the role of the additives in the process the adsorption experiments were carried out at neutral pH with the herbicide Glean® 75DF with its active ingredient chlorsulfuron and with mixtures made of chlorsulfuron and two different additives (Supragil and Borresperse).
The analytic methods used were mainly liquid chromatography (HPLC) and in certain cases total organic carbon determination and UV-spectrophotometry. The adsorption isotherms were fitted with a special equation which represents the steps very well. The parameters of this equation having exact physicochemical meaning were used for the interpretation of the adsorption. Special attention was paid to the role of the dissolved organic matter.
Each step of the multi-step isotherms represents different kind of binding places and different graded associates. The adsorption of isoproturon and prometryn was found to be pH dependent. In acidic solutions the specific adsorbed amount was significantly higher than in alkaline solutions. The specific adsorbed amount of prometryn was higher than that of isoproturon at each adsorbent and at each pH it can be concluded that the hydrophobic interaction is more dominating and on the other hand isoproturon is more easily solubilized by the dissolved organic matter. The adsorption of chlorsulfuron was found to be independent of the organic matter content of the soils and its specific adsorbed amount is very similar to that of its formed herbicide Glean.
The degradation of isoproturon was faster on soils having higher organic matter content but it was independent of pH. On chernozem two metabolites of isoproturon were identified which
Die Untersuchung der Sorption von Herbiziden in verschiedenen Boden – Lösung Systeme
Zusammenfassung
Die Untersuchung der Sorption von Herbiziden ist eine wichtige Verpflichtung, da sie alle oft umweltschädlich sind. Ihre Reaktion im Boden wird von zahlreichen biotischen und abiotischen Faktoren – unter anderem von der Sorption der Herbizide - beeinflusst.
In der vorliegenden Arbeit wurde die Sorption der weniger polarisierten und ermäßigt wasserlöslichen Herbiziden (Isoproturon: IPU; Prometryn: PR) mit statischen Gleichgewichtsexperimenten untersucht. Die Experimente wurden mit drei Böden (schwarze Erde, brauner Waldboden sowie Sandboden) und Bodenkomponenten (Quarz und dazugegebenen natürlichen organischen Materialien) durchgeführt. Bei den Proben wurden die Qualität der gelösten Salze, der pH-Wert (pH=5, pH=7, pH=8) und der Gehalt an natürlichen organischen Materialien in der Wasserphase (DOM) verändert. Um die in der Adsorption vorgewiesene Rolle der Additiven bestimmen zu können, wurde die Adsorption des Chlorsulfurons unter pH=7 mit der Adsorption vom Glean® 75DFund mit einer Mischung des Wirkungsstoffes Chlorsulfuron je mit einem Additiv (Supragil und Borresperse) verglichen.
Die Proben wurden manches Mal mit organischen kohlenbestimmenden Methoden, UV- Spektrofometrie und vor allem mit Hochdruckflüssigkeits-Chromatographie analysiert. Zu den Messpunkten wurde mit Hilfe von einer Gleichung, die auch in der Adsorption auftretenden Stufen gut behandelt, eine Isotherme gepasst. Bei der Analyse der Isothermen wurden auch die Zahlwerte der physisch-chemischen Parameter der Gleichung in Betracht gezogen, sowie die Rolle von DOM. Die Isothermen sind mehrstufig, die einzelnen Stufen stellen unterschiedliche Verbindungspunkte, sowie die Sorption unterschiedlicher Assoziatformationen dar. Die Adsorption von IPU und PR hängt von dem pH-Wert ab. Im Falle der beiden Wirkstoffe ist unter sauren Umständen die spezifisch adsorbierte Quantität größer als unter alkalischen. Im Falle von PR die hydrophobe Wechselwirkung dominiert besser und die solubilisierende Wirkung der auslösenden organischen Materialien ist stärker im Falle von IPU0. Die Sorption des Chlorsulfurons hängt vom Gehalt an organischen Materialien im Boden nicht ab. Seine Sorption ist auch im Falle von Glean® ganz ähnlich.
Wenn der Gehalt an organischen Materialien im Boden größer ist, ist auch das Volumen des Abbaus von IPU größer, dabei war die pH-Abhängigkeit in keinem analysierten Abbausystem vorzufinden. Bei der schwarzen Erde erwiesen sich Metaboliten, deren Anwesenheit die Fachliteratur bis jetzt nur als Nachwirkung von UV- Bestrahlung erwähnte.
Az alkalmazott rövidítések jegyzéke és fogalmak magyarázata
a.i.: aktív hatóanyag
ADI-érték: megengedett napi felvétel (mg/kg/nap) ALS: acetolaktát szintetáz enzim
BE: barna erdőtalaj
BET-egyenlet: Brunauer-Emmett-Teller-féle izotermaegyenlet C.A. név: a Chemical Abstracts által használt elnevezés CAS RN: Chemical Abstracts Szolgálat regisztrációs száma
CS: csernozjom talaj
CE: kapilláris elektroforézis
c.m.c.: kritikus micellaképződési koncentráció DF: vízben diszpergálható/oldható granulátum DOC: oldott szerves szén
DOM: oldott szerves anyag
DT50: felezési idő
EC50: az a méreganyagkoncentráció, ami a kísérleti élőlények 50%-nál élettani hatást vált ki
EDL: elektromos kettősréteg
EPC: a talaj környezetvédelmi kapacitása (environmental protection capacity)
ESR: elektronspin rezonancia spektroszkópia
FA: fulvosav
FW: folyékony szuszpenzió
GC-MS; LC-MS: tömegspektrométerrel kapcsolt gáz-, illetve folyadékkromatográfia GLC-ECD: gáz-folyadék kromatográf(ia) elektron-befogásos detektorral GLC-FID: gáz-folyadék kromatográf(ia) lángionizációs detektorral GPC: gélszűrés
HA: huminsav HO: homoktalaj
HPLC: nagyhatékonyságú folyadékkromatográfia
HS: humuszanyag HU: humin
IHSS: Nemzetközi Humuszanyag Társaság
IPU: izoproturon
IR: infravörös spektroszkópia
IUPAC név: a vegyület nemzetközileg elfogadott tudományos neve
KOC: a szerves széntartalomra vonatkoztatott adszorpciós koefficiens
KV: kvarc
LC50: az a méreganyag koncentráció (mg/dm3), vízben vagy levegőben, mely a kezelt kísérleti állatok 50%-át elpusztítja
LD50: az a testtömegre számított méreganyag koncentráció (mg/kg), mely a kezelt kísérleti állatok 50%-át elpusztítja
log Kow (= logP): oktanol-víz megoszlási hányados logaritmusa
NOEL: az a legnagyobb méreg dózis, amelynél nincs megfigyelhető hatás NOM: természetes szerves anyag
OECD: Organisation for Economic Co-Operation and Development pKa: a savi disszociációs állandó negatív logaritmusa
ppb: part per billion; µg/kg, illetve µg/dm3 mértékegységeknek felel meg ppm: part per million; mg/kg, illetve mg/dm3 mértékegységeknek felel meg ppt: part per trillion; ng/kg, illetve ng/dm3 mértékegységeknek felel meg PR: prometrin
p.z.c.: nulla töltéspont (point of zero charge)
RP-LC/UV: fordított fázisú folyadékkromatográfia UV-detektorral
SC: szuszpenzió koncentrátum
SCMs: felületi komplexálási modellek
S/L: szilárd/folyadék határfelület
SEC: méretkizárásos kromatográfia SP: poralakú permetezőszer SPE: szilárd fázisú extrakció
SU: klórszulfuron
SUs: szulfonil-karbamidok
TC: összes szén
TIC: összes szervetlen szén
TLC: vékonyréteg kromatográfia
TOC: összes szerves szén (total organic carbon) UV-VIS: ultraibolya és látható spektrofotometria Val, Leu, Ile: valin, leucin, izoleucin (elágazó aminosavak) WG: vízben diszpergálható/oldható granulátum WP: vízben oldható/nedvesedő por
1. Bevezetés
A fenntartható fejlődés problémakörének egyik fontos eleme az egyre növekvő népesség élelmezése. A mezőgazdaság igényeknek megfelelő termelő kapacitása speciális kemikáliák alkalmazása nélkül nem lehetséges. A növényvédőszer-hatóanyagok és szerformátumok (peszticidek) környezetvédelmi megítélése fontos és nagyon sokrétű, sürgető feladat, hiszen a szénhidrogének után a gyomirtószerek (herbicidek) a leggyakoribb talajszennyezők.
A peszticidek környezetterhelő hatása abban rejlik, hogy az ökoszféra szennyezése folytán az ökorendszer egyensúlyának felbomlásával fenyeget [1]. A peszticidek előnyös, előre megtervezett hatása mellett a biocönózis valamennyi alkotóját potenciálisan érintő, kevésbé kiszámítható, veszélyeztető hatásával is számolnunk kell, amelyeket időben fel kell tudni ismerni, ha lehet, megelőzni, illetve megszüntetni. Ezért vizsgálni kell sorsukat a bioszféra minden közegében, de főleg a kijuttatással közvetlenül érintkező talajban és a talaj – víz rendszerekben, ami azért is meglehetősen nehéz feladat, mivel a vegyszermaradványok környezeti viselkedését/sorsát számtalan biotikus és abiotikus tényező befolyásolja. Ehhez a munkához szeretnék hozzájárulni dolgozatommal, mely három, mérsékelt vízoldhatóságú herbicid talaj – oldat rendszerekben történő megkötődésével foglalkozik.
Mivel a környezeti szennyezők, így a peszticidek környezeti sorsát is alapvetően befolyásolja a talajon bekövetkező adszorpció mértéke, értekezésem szakirodalmi áttekintését (2. fejezet) a híg oldatokban zajló határfelületi egyensúlyok és a folyamatokban szerepet játszó kölcsönhatások vázolásával kezdem, majd kitérek a talajok adszorpció szempontjából szükséges bemutatására (az adszorbens jellemzése) és a növényvédőszerek (mint adszorptívumok) talajbeli viselkedésére. A Kísérleti részben (4. fejezet) bemutatom a felhasznált szerek és adszorbensek jellemzőit, a kísérletek kivitelezését, az elemzéshez használt analitikai módszereket (nagynyomású folyadékkromatográfia, UV-spektrofotometria, összes szerves szén meghatározása, tömegspektrométerrel kapcsolt gázkromatográfia). Az Eredmények, értékelés című fejezetben (5. fejezet) ismertetem a mérési pontjaimra izotermaegyenlet segítségével illesztett izotermákat, az illesztési paraméterekből és a megkötődés tendenciáiból levont következtetéseimet. A bomlásvizsgálatban bemutatom a tömegspektrometriával kapott eredményeket. A 6. fejezetben összefoglalom és összevetem eredményeimet a szakirodalmi megállapításokkal, végül megfogalmazom téziseimet.
„Das Spiel ist die höchste Form der Forschung.”
Albert Einstein
2. Irodalmi áttekintés
2.1. Az adszorpció jelensége szilárd/folyadék (S/L) határfelületen
A jelenség határfelületen, illetve fázishatáron történő, számos egyidejű határfelületi egyen- súlyi folyamat eredőjeként jelentkező anyagfelhalmozódás. A felületi helyekért az oldószer és az oldott molekula (adszorptívum) közötti, míg az oldott anyagért a felületi és a szolvatációs erők közötti kompetíció zajlik. Az adszorbensen számos folyamat révén felületi töltés alakulhat ki. Mivel a felületi elektromos jelenségeknek is nagy jelentősége van a talajok határfelületi egyensúlyaiban, a későbbiekben kitérek a nemelektrolit oldatokból bekövetkező adszorpció mellett (ld. részletesen a 2.3.2. és 2.3.5. fejezetet) az elektrolit oldatokból történő adszorpcióra is a részben ionos határfelületen (ld. 2.1.1.3. fejezet).
Az adszorbens és az adszorptívum közötti kölcsönhatás erőssége alapján megkülönbözte- tünk fiziszorpciót és kemiszorpciót. Kemiszorpciónál az adszorbens felületével való kölcsönha- táskor az adszorptívum kötésviszonyai megváltoznak, vegyérték-elektronrendszere beleolvad az adszorbensébe, új kémiai kötések alakulnak ki. Jellegéből fakadóan a kemiszorpció mindig csak monomolekulás adszorpciós réteg kialakulásához vezethet. Ez az adszorpciótípus általá- ban aktiválásra szorul, kemiszorpció esetén az adszorbátum deszorpciójához is energia szük- séges (akár 80-400 kJ/mol), míg a fiziszorpció önként lejátszódó és mindig exoterm folyamat.
Fiziszorpció esetében molekuláris kölcsönhatások játszanak szerepet, melyek kötési energiá- ja kb. 1-40 kJ/mol. Az adszorpció és deszorpció között idővel dinamikus egyensúly áll be [2].
Az adszorpciót befolyásoló kvalitatív tényezők:
adszorbens felületének polaritása (felületi csoportok)
adszorbens fajlagos felületének nagysága (kötőhelyek sűrűsége)
oldott anyag (adszorptívum) szerkezete és polaritása
oldott anyag molekulatömege és mérete
oldott anyag adott oldószerben való oldékonysága
oldószer polaritása, szolvatációja, kémhatása, ionerőssége, nedvesítőképessége
állapotjelzők (p, T) stb.
2.1.1. Adszorpció híg, vizes oldatokból
Folyadékból történő adszorpció esetén az adszorbens felülete mindig teljesen borítottnak tekinthető és a felületi erőhatások következtében megváltozik a határfelületi fázisban a
komponensek aránya a vele egyensúlyban lévő folyadék halmazállapotú tömbfázishoz képest.
Híg oldatokra az egységnyi (1 g) adszorbensen adszorbeált hatóanyag mennyisége (q, fajlagos adszorbeált mennyiség) a
[ ] [ ]
( ) [ ]
[ ]
q[
mol g]
g m
l V l mol c l mol
c µ µ µ
⋅ =
0 − (1)
összefüggéssel adható meg, ahol m az adszorbens tömege, amelyre V térfogatú és c0 koncent- rációjú vizsgálandó oldatot juttatunk, c pedig a vizsgálandó anyag méréssel meghatározott egyensúlyi koncentrációja. Ez az összefüggés akkor használható, ha a komponensek parciális móltérfogata egymással megegyező, vagy a preferáltan adszorbeálódó komponens koncentrá- ciója a tömbfázisban elhanyagolhatóan kicsi a másik komponenshez képest [3].
2.1.1.1. Adszorpciós izotermák
Az állandó hőmérsékleten történő adszorpciót a mennyiségi viszonyok szempontjából izotermákkal jellemezhetjük. Az adszorpciós izotermák oldatból történő adszorpció esetén állandó hőmérsékleten és egyensúlyi állapotban az egységnyi adszorbens által adszorbeált mennyiség és a tömbfázis összetétele közötti kapcsolatot jelentik [4].
Giles és munkatársai osztályozták [5], [6], [7], [8] a híg oldatokból történő adszorpciók esetén kapott izotermák kezdeti szakaszának alakját. Megkülönböztetnek S-, L-, H- és C-típusú izotermát (1. ábra). (A bonyolultabb izotermák e négy fő kategóriához alcsoportot rendelve jellemezhetők.) Szerintük ez a besorolás az adszorptívum adszorbenshez való kötődési affinitását mutatja. Az izotermák alakja nem bizonyítja az adszorpció mechanizmusát, csak utalhat rá [8].
1. ábra: A Giles-féle izoterma típusok
Az S-típus esetén a már adszorbeált molekula segíti a továbbiak adszorpcióját (kooperatív adszorpció), az adszorbens és az oldott molekula között kisebb mértékű a kölcsönhatás, mint az adszorbátum molekulák között. Az adszorbátum kis felületen érintkezik az adszorbenssel, így azok a felületen szabályos rendben, a feltételezés szerint többnyire arra merőlegesen helyezkednek el. Erős a versengés a kötőhelyekért az adszorptívum és az oldószer molekulái között. L-típus akkor alakul ki, ha a kezdeti megkötődés után egyre nehezebb az adszorptívumnak üres kötőhelyet találni. A molekulák elhelyezkedésére valószínűsítik, hogy a felület síkjával párhuzamosak és nincs erős versengés az oldószer molekuláival. A H-típus ioncserére képes anyagokra jellemző, gyorsan eléri a telítettséget. A molekula affinitása olyan nagy a felülethez, hogy a híg oldatból minden adszorptívum molekula adszorbeálódik. A kötő- helyek telítődése után az izotermán egy vízszintes plató jelentkezik, azaz ebben a tartományban állandó a megkötődő mennyiség. A C-típusnál az adszorptívumnak az oldószer és a felület közötti megoszlása állandó, minél több molekula adszorbeálódik, annál több kötőhely alakul ki.
Ha az adszorpció körülményeiben bekövetkezik valamilyen változás, az másik rendszert, következésképpen más típusú izotermát eredményez. Például a fenol izotermájának kezdeti szakasza S-típusú, ha poláris oldószerből poláris felületre adszorbeálódik, L-típusú, ha grafiton adszorbeálódik vízből vagy poláris felszínen apoláris oldószerből, C-típusú, ha cellulóz-triacetáton adszorbeálódik vízből [6].
2.1.1.2. Adszorpciós izotermaegyenletek
A kísérletileg meghatározott görbékre közelítéssel tapasztalati izotermaegyenleteket vagy különböző feltételezéseken alapuló összefüggéseket határoznak meg. A felhalmozódott anyag mennyiségét az adszorbens tömegegységére (esetleg felületegységére) vonatkoztatott fajlagos adszorbeált mennyiséggel szokták megadni. Leggyakoribbak a két paraméteres leírások.
Legegyszerűbb esetekben a kapott kísérleti eredmények a Langmuir és a Freundlich izotermákkal írhatók le [2].
2.1.1.2.1. A Langmuir-izoterma
Az első, világos modell alapján levezetett izotermaegyenlet Langmuirtól származik [2].
A Langmuir izoterma a következő meggondolásokon alapszik:
Egymástól független, azonos erősségű vonzási helyeken, az ún. aktív helyeken történik az adszorpció.
Az adszorpciós kötés erőssége minden kötőhelyen ugyanakkora, függetlenül attól, hogy a szomszédos aktív hely foglalt-e vagy sem, azaz a kötőhelyek energetikailag homogének.
Az adszorpció során monomolekulás réteg alakul ki.
A Langmuir izoterma a következő összefüggéssel írható le:
c K
c K q qT
⋅ +
⋅
= ⋅
1 (2)
ahol q : fajlagos adszorbeált mennyiség [mg/g]
K: Langmuir – állandó [l/mg]
qT: monomolekulás adszorpciós kapacitás [mg/g]
c : az oldat egyensúlyi koncentrációja [mg/l].
Az egyenlet a telítési jellegű kísérleti izotermákat nem írja le kellő pontossággal az egész koncentráció-tartományban, hiszen az izoterma levezetésének feltételei nem mindenben helytállóak. Ennek ellenére kellő óvatossággal a fajlagos felület becslésére is használható.
A fajlagos felület meghatározásához a Langmuir izoterma linearizált alakjára van szükségünk [2] (ha az egyenlet érvényes, egyenest kapunk):
c q K q =q1T + ⋅1T⋅
1 (3)
Az 1/q – 1/c diagramban ábrázolt ordinátametszet megadja a monomolekulás adszorpciós kapacitás reciprokát, az iránytangensből pedig a K állandó határozható meg. Ha ismerjük az adszorptívum egy molekulájának, illetve egységnyi tömegének (As) felületigényét, akkor az adszorbens fajlagos felülete (as) megadható az alábbi módon:
⋅
=
mg A m g q mg g
as m T s
2
2 (4)
2.1.1.2.2. A Freundlich-izoterma
Freundlich tapasztalati izotermaegyenlete az alábbi összefüggéssel adható meg [2]:
c n
k
q= ⋅ 1/
n>1
(5)
ahol q: fajlagos adszorbeált mennyiség
k; 1/n: adott adszorbens párra jellemző, hőmérséklettől függő állandók c: egyensúlyi oldatkoncentráció.
Az egyenlet a telítési típusú izotermák középső, nem túl hirtelen áthajló szakaszára ad kielégítő leírást.
2.1.1.2.3. Czinkota és munkatársai által levezetett izotermaegyenlet
A vizes fázisban oldott hidrofil és hidrofób molekularésszel is rendelkező (analógia a felületaktív anyagokkal) adszorptívum molekuláknak energetikailag kedvezőbb, ha a hidrofób molekularész és a víz közötti kölcsönhatások minimálisra csökkennek, azaz az apoláris felületek a vizet kizárva kötődnek egymáshoz. Ez a hidrofób kölcsönhatás lényege, ami úgy valósul meg, hogy az adszorptívum molekulák egymáshoz jobban kötődnek, asszociátumokat hoznak létre. Ha bizonyos kritikus határkoncentráció (c.m.c.) felett asszociátumok képződését tételezzük fel, valamint több eltérő affinitású és adszorpciós kapacitású kötőhelyet különböztetünk meg, akkor konszekutív adszorpciós egyensúlyi egyenletek (amely analóg a komplexképződési egyensúlyokkal) felírásával és az adszorpciós kötőhelyekre vonatkozó mérlegegyenletek segítségével a (6) adszorpciós egyenlet vezethető le. Az egyenlet jól alkalmazható különböző szerkezetű herbicidek többlépcsős izotermáinak (s számú lépcső) környezeti és egyéb kolloid rendszerekben történő leírására is [9].
∑
=
− +
−
⋅ +
− +
−
⋅
= s ⋅
i n
i i
i n
n i i
i i T
i i
i
b c b c K
b c b c K q q
1 2 ( )
)
( (6)
ahol
q: a fajlagos adszorbeált mennyiség [mol/g]
c: egyensúlyi koncentráció [µmol/l]
qTi: a kötőhelyek adszorpciós kapacitása [µmol/g]
Ki: az adott kötőhely adszorpciós aktivitását jellemző egyensúlyi állandók [(l/µmol) ni] bi: az i-edik lépcsőre jellemző kritikus adszorptívum koncentráció [µmol/l]
ni: az i-edik lépcsőszakaszt jellemző átlagos asszociációfok.
Ha a rendszerben nincs kritikus koncentrációhatár, akkor b=0. Ha egy bizonyos koncentrációhatár fölött kialakulnak hidrofób asszociátumok, akkor b>0, és a transzformált változó automatikusan beviszi az asszociátumok koncentrációját az egyenletbe. A modell nem tesz különbséget abban, hogy az asszociátumok előbb keletkeznek és utána adszorbeálódnak, vagy pedig az adszorbeálódott molekulák alakítanak ki asszociátumokat. A b=0 és n>1 teljesülése azonban a felület és az adszorptívum kölcsönhatása következtében kialakuló felületi komplexre (SAn) utal, tehát ekkor csak a felületen alakulnak ki asszociátumok [10].
2.1.1.3. Adszorpció elektrolitoldatokból
A legegyszerűbb esetben sem tekinthetjük az elektrolitból történő adszorpciót csupán az ionok határfelületi felhalmozódásának, hanem a töltött részecskék kémiailag szabályozott meg- oszlásáról van szó, amelyet az ott helyben kialakuló elektromos határfelület irányít [11]. Az elektromos határfelület a töltéssel rendelkező felületi helyek sokaságának képződésével és az ellenionok felhalmozódásával alakul ki [12]. A felület és az oldat között potenciálkülönbség van. A létrejött elektromos kettősréteg töltéseloszlása, továbbá a felülettől az oldat tömbfázisának irányába jelentkező potenciál csökkenés az oldott részecskék minőségétől és mennyiségétől függ. Az állandó töltés és a körülményektől (pH-tól) függő töltések együttesen alakítják ki a felületi töltést [5], [13].
A felületi töltés többféle módon jöhet létre:
a felületi csoportok ionizálódnak (a savas vagy bázikus csoportok disszociációja)
a felület ionjai eltérően oldódnak
izomorf szubsztitúcióval
töltött kristályfelületek a törések mentén
specifikus ionadszorpcióval
vízmolekula disszociatív kemiszorpciójával (oxid felületeken).
A folyamatok egyidejűleg is lejátszódhatnak. A felületi töltéssűrűség csak akkor marad állandó, ha a töltés helyhez kötött a felületen, mint pl. a rácshibák vagy az izomorf helyettesítés okozta töltések. Az adszorpcióval, ionizációval, oldódással, disszociációval, felületi kémiai reakcióval változik a felületi töltéssűrűség. Emiatt fontosak az érintkező fázisok kémiai tulajdonságai [12]. Az S/L határfelületi rétegben az ionok a felülettől közelebb vagy távolabb helyezkednek el a méretüknek, töltésüknek vagy a felülettel kémiai kötést létrehozó képességüknek megfelelően.
Ha az ion egyező a felület felépítésében résztvevő ionnal vagy affinitása nagy a felülethez, akkor azokat felületi ionoknak, kötődésüket pedig specifikus adszorpciónak nevezzük.
Jelenlétüknek közvetlen hatása van a felületi töltésre (potenciálmeghatározó ionok). Belső szférás komplexet képeznek, ha az ionok közvetlenül a felülethez kötnek. Külső szférás komplex esetében az ion a felülethez víz hídon keresztül köt. Az (ellen)ionok diffúz tömege a részecske felületétől távolabb helyezkedik el és elektrosztatikailag szeparált, termikus hatásra megzavarható [2].
A klasszikus leírás szerint az S/L határrétegben a töltések a felületen lévő töltéseket és az ellenionokat jelentik, amelyek az elektromos kettősréteget képezik (EDL). A legegyszerűbb megközelítés (Helmholtz) két egymástól kis távolságra lévő töltött síkot képzel el, amelyek
között lineáris potenciálesés van [5]. A diffúz kettősréteg modell (Gouy-Chapmann) felületi és diffúz részt különböztet meg. A részecskefelülethez tartozó töltést felületi töltésnek nevezi, amelynek felületegységre vonatkoztatott mennyisége a felületi töltéssűrűség (σ0). A kompenzá- ló, ún. ellenionok okozzák a diffúz réteg töltését, amelynek töltéssűrűsége σd. A felületi töltés egyensúlyában σ0+σd =0. Ez a modell akkor alkalmazható a részecske EDL-jének leírására, ha a részecske felületén lévő töltés állandó felületi töltés, mely izomorf szubsztitúcióból ered vagy potenciálmeghatározó ion adszorpciójában képződik és az indifferens elektrolitionok diffúz tömege kompenzálja a felületi töltést. A Gouy-Chapman modell csak elektrosztatikai kölcsönhatásokon alapszik, az ionokat térfogat nélküli töltéspontoknak tekinti. A töltés – potenciál (ψ) összefüggés az EDL diffúz részére a
ψ κ ε ψ
ε
ψ 2
0 2 2 2
2 =
=
∑
nz kTedx d
r i i i
(7) összefüggéssel adható meg, ahol
( )
1/22 / 1
0 2 2
288 ,
3 I
kT e z n
r i i i
⋅
=
=
∑
ε εκ (8)
a Debye-Hückel paraméter (κ, dimenzió: hosszúság-1), ami látható, hogy függ az ionerősségtől (I). A felülettől az oldat belseje felé haladva az ellenionok fokozatosan leárnyékolják a felületi töltést, a potenciál csökken. Meghatározhatjuk a potenciál változását a felülettől való távolság (x) függvényében, ha figyelembe vesszük a felületen uralkodó potenciál (Ψ0) nagyságát, az ellenionok töltésszámát (z), koncentrációját, a közeg permittivitását (ε0·εr) és a hőmérsékletet (T), ugyanis ezek a tényezők befolyásolják az ellenionok eloszlását a kettősrétegben [2].
A kettősréteg kiterjedését 1/κ-val adjuk meg, miután integráljuk a következő egyenletet:
(
κx)
ψ
ψ = 0exp− . (9)
A diffúz rétegben exponenciális potenciálesés van. Mivel κ arányos az oldat ionerősségével, a potenciálesés távolságtól való függése növekszik az elektrolitkoncentráció növekedésével.
Minél nagyobb az ellenionok koncentrációja és értékűsége, a potenciálgörbe annál merede- kebben fut, a kettősréteg vastagsága csökken, azaz a kettősréteg tömörebbé válik [2], [3].
A töltés-potenciál összefüggés a diffúz rétegben:
0 0
0 σ ε ε κψ
σ =− d = r . (10)
Látható, hogy a sókoncentrációban bekövetkező bármilyen változás hatással van állandó töltés esetén a felületi potenciálra vagy – állandó ψ0 esetén – a felületi töltéssűrűségre.
A felületi töltéssűrűség (σ0) kísérletileg meghatározható, bár a töltés – potenciál összefüggés is függ az alkalmazott elméleti modelltől. A Gouy-Chapman modell általában jó közelítést ad
az EDL diffúz részére, de a felszín közelében irreálisak az eredmények. Ezért erre a régióra korrekciókat kell bevezetni (pl. kémiai hozzájárulás az elektrosztatikus kölcsönhatáshoz).
Stern elmélete számol az ionok térfogatával és figyelembe veszi a specifikus adszorpciót is [5]. A specifikus adszorpció (mely elektrosztatikus és kémiai kölcsönhatás következtében jön létre) olyan erős kötődésű réteget hoz létre, amelyet a hőmozgás nem befolyásol. Ezt Stern- rétegnek nevezzük. Vastagsága jellemző, a hozzá tartozó potenciál a Stern-potenciál (ΨSt).
A diffúz kettősréteg csak ezután következik. Tehát a felületi potenciál csökkenése a tömör Stern-rétegen belül meredek, majd a kettős- (illetve hármas-) réteg diffúz részében lassabb.
Az is előfordulhat, hogy a Stern-rétegben az ionok áttöltik a felületet. Az elmélet ezt is figyelmbe tudja venni.
Kémiai és elektrosztatikus megközelítést is tartalmazó modellek például a felületi ionizációs modellek, komplexálási modellek [12]. Közös bennük, hogy a felületi csoportok reakcióit a tömeghatás törvénye és anyagmérleg egyenletek segítségével, a felületi potenciált pedig a felületi töltésre vonatkozó elektrosztatikus modellel írják le. A manapság legelfogadottabbak a felületi komplexálási modellek (SCMs). Ezekben kombinálják a koordinációs kémiai elgondolásokat az elektromos kettősrétegre vonatkozó elméletekkel.
A töltés kialakulását a felületen és az ionok adszorpcióját felületi komplexálási reakcióként kezelik. A legáltalánosabb SCM modellek a konstans kapacitás, diffúz- és hármas réteg modellek. Mindháromban a felület töltését bizonyos távolságon belül ellenionok kompenzálják.
A konstans kapacitás és a diffúz réteg modellben minden specifikusan adszorbeált ion hozzá- járul a felületi töltéshez és az ellenionok kiegyenlítik azt. A töltés – potenciál összefüggés a konstans kapacitás modellben lineáris. A hármas réteg modellben az adszorbeált ionok két felszín közeli síkját különböztetik meg: a specifikusan adszorbeált protonok és hidroxil-ionok helyezkednek el legközelebb a felülethez (σ0), míg a többi ion attól távolabb (σβ). A diffúz rétegben jelenlévő ellenionokkal együtt (σd) a három réteget alkotó töltések egyensúlyára felírható: σ0+ σβ + σd = 0.
A felületi komplexálási modellek az elektrolitoldatokból történő adszorpció számos eseté- ben alkalmazhatóak. A szerves anyagok adszorpciója, különösen azoké, amelyek komplexet képesek képezni a felületi kötőhelyekkel, sikeresen modellezhetők az SCM-ekkel. Például kis molekulájú szerves savak (egyszerűek és aromásak) göthiten való pH-függő adszorpciójában feltételezik [14], hogy itt a kötőhelyspecifikus ligandumcsere dominál. A felületi komplexeket spektroszkópiai módszerrel bizonyították, leginkább egymagvú komplexek képződtek. Némely komponens szokatlan szorpciós viselkedést mutatott, ami azt jelzi, hogy a ligandumcserés
úgy próbálják az SCM-be bevinni, hogy egy kötőhelyhez kettő vagy több szerves molekula is kapcsolódhat, mivel feltételezik, hogy a felületre megkötött molekula és az oldott molekula hidrofób részeinek kölcsönhatása révén asszociátum keletkezik (vö. 2.1.1.2.3. fejezet).
2.2. A talaj
2.2.1. A talaj mint sokoldalú környezeti szféra
A fenntartható fejlődés két fontos alapeleme a természeti erőforrásunkat képező talajkész- leteink ésszerű hasznosítása, védelme, állagának megőrzése, sokoldalú funkcióképességének fenntartása, valamint felszíni és felszínalatti vízkészleteink minőségének megóvása [15].
A kettő szorosan összefügg egymással.
A pedoszféra (talajzóna) környezetünk szennyező anyagoktól legnagyobb mértékben veszélyeztetett tartománya [16]. A talaj szűrő- és megkötőképessége a hidroszféra és az atmoszféra védelme szempontjából döntő jelentőségű. Ennek ellenére, ha a kémiai anyagok ellenőrizetlen és mérték nélküli bevitele a talajba folytatódik, hosszú távon a talaj mint élettér és a vele egyensúlyban lévő szférák súlyos szennyeződésével kell számolnunk.
A talaj – bizonyos határig – képes a talajba jutó szennyező anyagok kedvezőtlen hatását tompítani (stresszhatások pufferközege), megakadályozva azok oldódását (adszorpció), moz- gását, s ezáltal felszíni vagy felszínalatti vizekbe jutását, illetve azok növény általi felvehető- ségét, táplálékláncba kerülését (oldhatóság → mozgékonyság → felvehetőség → toxicitás).
A pont- (pl. ipari tevékenység, hulladéklerakás) és diffúz formában (mezőgazdaság) jelentkező talajszennyezések veszélyeztetik a talaj öntisztulását, öntisztító hatását (fizikai szűrés, adszorpció, kémiai és biológiai lebontó folyamatok) is [17].
2.2.2. A talaj felépítése
A talaj kolloidikai értelemben sokkomponensű, három fázisú, heterogén, polidiszperz rend- szer. 5-20 térfogat %-át levegő, 30-45 %-át víz tölti ki. E kettő térfogata alkotja a pórusteret.
Az 5-7 %-ban előforduló szerves és 43-45%-ban jelen lévő szervetlen (ásványos és amorf) alkotók a talaj szilárd fázisát teszik ki. A szerves anyag a szárazanyag tömegszázalékában kifejezve 85%-ban elbomlott szerves anyagot tartalmaz [5]. A növényvédőszerek zöménél a talajbeli viselkedést befolyásoló tényezők között kiemelkedő szerepű a talajok összetétele.
2.2.2.1. A talajok ásványi alkotórészei
A talaj szilárd fázisának legnagyobb részét az ásványi összetevők adják [18]. Talajtani szem- pontból a kloridok, szulfidok, nitrátok, foszfátok, borátok, karbonátok, oxidok és hidroxidok, valamint a szilikátok jelentősek.
A szilikátokon belül az SiO4 tetraéderek kapcsolódása alapján megkülönböztetünk sziget-, lánc, szalag-, réteg- és vázrácsos (pl. kvarc [5]) szilikátokat. A rétegszilikátok közül az agyagásványok fordulnak elő legnagyobb arányban a talajokban. Az agyagásványok tulajdonságait a tetraéder és oktaéder hálókból felépülő rétegek egymástól való távolsága, az összeköttetést biztosító erők és a rétegek között kialakuló esetleges felületek szabják meg [19].
Ezen bonyolít az izomorf szubsztitúció: az Al3+-iont Mg2+ vagy Fe2+-ion, a Si4+-iont Al3+-ion helyettesítheti. Így negatív töltésfelesleg alakul ki a kristályrácsban, amelyeket kicserélhető kationok kompenzálnak. Az agyagásványok és oxidok zömében a talaj kolloid frakciójában találhatóak és a talaj fizikai és kémiai állapotát nagymértékben befolyásolják. Jelentős a szerepük az ionadszorpcióban, az ioncserében és a talajok szervesanyagának adszorpciójában is, növelik a talajok pufferképességét [20]. Szerepükre bővebben a 2.2.2.3. fejezetben térek ki.
A kvarc a Föld szilárd kérgének egyik legelterjedtebb oxid ásványa. Szinte minden kőzetanyagban előfordul, de mállás során is keletkezik. Az ásványok közül a legjobban ellenáll a mállásnak, ezért található meg elterjedten, tömegesen [20].
2.2.2.2. A talaj szerves alkotói
A talajban található szervesanyag-tartalom – a humusz (szerves maradványok többé-ke- vésbé átalakult része) – nem egységes anyag, hanem különböző kémiai összetételű és fizikai viselkedésű szerves anyagok keveréke. Alkotói alapján két csoportra, a nem valódi humusz- anyagokra (fehérjék, peptidek, aminosavak, szénhidrátok, szerves savak, lignin, zsírok, viaszok, gyanták) és valódi humuszanyagokra (geopolimerek) bontható [18]. Ez utóbbiak a természet élő szénciklusából kikerülő szerves molekulák véletlenszerű halmazából képződő, kémiailag heterogén összetételű, funkciós csoportokban gazdag, természetes makromolekulás anyagok, amelyek a szervesanyag-mineralizáció köztes termékeinek tekinthetők [11], [21], [22].
Növényi és állati eredetű anyagokból jönnek létre fizikai, kémiai, enzimatikus és mikrobiológiai átalakulások során az ún. humifikációs folyamatban. A természet legelterjedtebb nem élő szerves anyagai, megtalálhatók talajokban, üledékekben, tőzegben, felszíni és felszín alatti vizekben, fiatalabb szenekben és a légköri aeroszolban is. Számos
környezeti kémiai folyamatot befolyásolnak, szerepük meghatározó a természetes vizes rend- szerekben történő anyagmozgásban, mely hatással van a szennyező anyagok sorsára [22].
A talaj összes szervesanyag-tartalmát a talaj humusztartalmának nevezik. Ezt összes szerves szén mérésével (TOC) állapítják meg, a kapott TOC értéket egy 1,72-es szorzóval átszámítják a humusz mennyiségére. A humusztartalom (ezen belül pedig a humuszanyag) fontos a növény- védőszer-dózis alkalmazandó vagy alkalmazható határértékeinek megállapításához is [23].
A humusz fontos agrokémiai és környezetvédelmi szereppel rendelkezik [20]. A talajter- mékenységhez lényegesen hozzájárul, fontos a talaj hő- és vízgazdálkodásában, a talajszerkezet kialakulásában. Közvetlen, valamint a kelátképzés révén közvetett tápanyagforrás, befolyásolja a biológiai aktivitást. Környezetvédelmi szerepe az adszorpciós- és pufferképességben, a kelátképzésben (toxikus nehézfémek) nyilvánul meg, emiatt jelentősége van – mennyiségileg és minőségileg egyaránt – a talaj környezetvédelmi kapacitásának (EPC) meghatározásában, amelyet Hargitai L. vezetett be és alkalmazott hazai talajaink jellemzésére [20], [23], [24], [25].
Az általános és specifikus EPC a következőképpen adható meg:
K D H
EPC(G)= 2⋅ ⋅ (11)
R D H
EPC(S) = 2⋅ ⋅ (12)
ahol H: a %-os humusztartalom egy adott rétegre D: a humuszréteg vastagsága cm-ben
K és R: a humusz minőségére vonatkozó értékek.
Hargitai eredményei szerint, ha a talajhumuszt 1 %-os NaF és 0,5%-os NaOH oldószerekkel vonjuk ki, akkor a talajmódszertani szakirodalmakban fellelhető bonyolult frakcionálási eljá- rások helyett a kétféle extraktum optikai módszerrel történő összehasonlításával lehetővé válik a humuszanyagok minőségi vizsgálata. A nátrium-hidroxid oldattal a nyersebb, nem humifikált, kevésbé kedvező tulajdonságú szervesanyagok oldódnak ki főleg, a nátrium-fluorid oldatba pedig a nagy molekulájú, jól humifikált, többnyire még a talaj kalcium-ionjaihoz is kötött nagyobb stabilitású, jó minőségű humuszanyagok kerülnek. Amennyiben a kétféle extraktumot fotometriásan összehasonlítjuk, akkor a fényelnyelés (a mért fényelnyelés átlaga a látható fény tartományában, 6 hullámhosszon) aránya egy jellemző számértéket ad. Ez az ún. stabilitási koefficiens. Ha ezt az értéket osztjuk a humusztartalommal (H), az ún. humuszstabilitási koefficienst (K) kapjuk:
H E
K E
NaOH NaF⋅
= (13)
A K lehetőséget nyújt a kalciumhoz kötött és a szabad humuszanyag arányának kifejezésére.
K értékével nő a humifikáció (nyers humuszra 0,01; csernozjomra 10 körüli érték [25]), és ennek köszönhetően a kelátképzés fokozottabb. Ezért a K érték alapja lehet a humusz környezetvédelmi megítélésének. A jó minőségű humuszanyagban különösen sok a nitrogén, amely fokozza a szennyező ionnal vagy molekulával a kötés kialakításának lehetőségét. Ezt is figyelembe vehetjük a humusz szén és nitrogén elemi összetételéből képzett C/N hányadossal a következő módon:
) / (C N
R= K , (14)
amely a specifikus EPC kifejezésében szereplő R minőségi érték. A humifikáció növekedésével párhuzamosan a C/N hányados csökken [25], [26]. EPC értéke minél nagyobb (pl. EPC(G) kis humusztartalmú homoktalajra 21,77; csernozjomra 2258,42 [25]), annál kisebb a kockázata pl.
a nehézfém-szennyezésnek [24], mivel a talajhoz kötött humuszanyagok megkötik azokat, így mobilitásuk csökken. A komplex humuszértékelő rendszer [25] lehetővé teszi a humuszminőség sokoldalú megközelítését, alkalmas a humuszállapot megbecslésére például a földhasználat, a talajtermékenység valamint a környezetvédelem szempontjából.
A humuszanyagok (HS) kémiai szerkezetének felderítésére számos roncsolásos (pl. pirolízis, hidrolízis, oxidáció) és nem roncsolásos (pl. spektroszkópiai, kromatográfiai, elektronmik- roszkópiai, elektroanalítikai) módszert alkalmaznak [22]. Általánosságban a HS jellemző szerkezeti egysége az aromás váz (izo- és heterociklikus gyűrűk), amelynek egyes részeit pl.
C-C, C-O-C és N hidak kötik össze, a vázhoz pedig eredettől függően közbenső bomláster- mékek, pl. fehérje, peptid, aminosav vagy szénhidrát egységek és apoláris alkil oldalláncok (növényi viaszokból, állati zsírokból, olajokból származó) kapcsolódnak [5], [21], [22].
Az összekapcsolódás (gyűrűzáródás, aromatizáció, polimerizáció, kondenzáció stb.) révén sötét színű, nagy molekulájú, jelentős külső és belső felülettel rendelkező ún. röntgenamorf kolloidok képződnek [19], amelyek nem jellemezhetőek jól definiált szerkezettel [20], [27].
A HS tulajdonságait jelentősen befolyásoló funkciós csoportok, a savas jelleget hordozó –COOH és fenolos –OH csoport (előfordul még alkoholos –OH, –C=O) valamint a bázikus tulajdonságú, kisebb mennyiségben előforduló –NH, –NH2 csoportok mind a vázon, mind az oldalláncokon megtalálhatóak. A humuszanyagok alapvető, domináns jellemzője a savasság, tulajdonságaikat, viselkedésüket elsődlegesen a savas jellegű funkciós csoportok disszociációs állapota határozza meg (kialakuló lokális elektrosztatikus tér). Vizes oldataik egyaránt mutatják az asszociációs kolloidok és a polielektrolitok tulajdonságait, a körülmények viszonylag cse- kély változtatásával pedig a kolloid diszperziók jellegzetességeit [22]. A molekulák nagysága a
váz méretétől, a hidrofilitás pedig elsősorban a funkciós csoportok és az oldalláncok mennyi- ségétől és minőségétől függ. Minél kondenzáltabb a vázszerkezet, annál kevésbé mozgékony a molekula. A molekula-mag általában hidrofób, az oldalláncok alkil csoportjai is ilyen jellegűek.
A HS-t klasszikusan a lúgban és savban való eltérő oldhatóságuk alapján a fulvosavak (FA), huminsavak (HA) és a humin (HU) csoportjára osztják fel [5]. A szénülés előrehalad a csoportokban, azaz bennük a szén aránya egyre nagyobb.
A fulvosavak viszonylag kis molekulatömegű (kb. 2000), savas funkciós csoportokban gazdagabb, jobban oldható frakciót alkotnak (savban és lúgban is oldódnak) [5], [18], [21], [22]. A huminsavak nagy molekulatömegűek (5000-100000), savas oldatban kicsapódnak.
A fulvosavakban a HA-hoz képest a mag aromás gyűrűihez viszonyítva nagyobb az oldalláncok száma. A FA adszorpciós kapacitása is jelentősebb, mivel bennük több aktív csoport található.
A FA és HA savassága, ionmegkötő képessége, oldhatósága az aktív csoportok mennyiségétől függ. A FA és HA széles pH-tartományban negatív töltésűek a disszociáció miatt [28], [29].
A FA a HA-nál lényegesen mozgékonyabb, elektrolitokkal szemben kevésbé érzékeny [23].
A fulvosavak egy- és kétértékű fémionnal alkotott sói (fulvátok) oldódnak vízben, a három- értékűek kicsapódnak. A huminsavak esetén már a kétértékűek is kicsapódnak (a Ca-humát víz hatására duzzad, de nem oldódik). A FA világosabb (fulvus = sárga), a HA sötét színű.
A humin olyan anyagok csoportja, amely a hideg, savas és lúgos oldás folyamán nem oldható ki a talajból. Ez a humuszanyag-frakció kötődik legerősebben a talaj ásványi részéhez.
Molekulatömege és polimerizáció foka az előbbi két csoportnál nagyobb, kevesebb az aktív csoportok száma, így kevésbé savas jellegűek és kisebb oldhatóságúak is.
2.2.2.3. A talajkolloidok és szerepük
A talajkolloidok a talaj legaktívabb, legreaktívabb komponensei (< 1 µm) [5]. A talajban a szerves és az ásványi rész nem független egymástól, közöttük erősebb vagy lazább kapcsolat alakul ki. A kolloidális ásványi részecskék (oxidok, agyagásványok) a felületükhöz adszorbeálódó humuszanyaggal együttesen alkotják az ún. agyag-humusz komplexumot (organo-minerális komplex) [30]. Ezáltal megváltoznak a vizekben szuszpendált ásványi részecskék felületi tulajdonságai – a reaktív felületi helyek borítottakká válnak, elfedettek az agyagásvány és oxid részecskék közötti különbségek –, a részecske-részecske kölcsönhatások, a vizes szuszpenziók kolloid stabilitása növekszik [13], [21], [22]. Védőkolloidként a HS növeli az ásványi részecske koagulációval szembeni ellenállását [13], sztérikusan és elektrosztatikusan stabilizálja az ásványi komponenseket. A részecskék diszpergálhatósága növekszik, a
szuszpenziók elektrolitérzékenysége jelentősen csökken [21], ami hatással van a felszíni vizek lebegőanyagtartalmára, üledékképződésre, a talajok szerkezetére, erodáltságára, az ásványi részek mobilitására [11]. A természetes vizekben oldott HS-nak az ásványi részecskékre kifejtett diszpergáló hatása nagyon fontos a környezeti folyamatok szempontjából [22].
A talajkolloidok nagy fajlagos felülete (800-900 m2/g) a felületi/határfelületi jelenségeknek meghatározó szerepet kölcsönöz [31]. Az agyagásványok és a humuszanyagok töltése túlnyomóan negatív, így rajtuk a kationadszorpció az uralkodó folyamat [19], [20], [32].
Negatív töltésű felület akkor alakul ki, ha
izomorf szubsztitúcióval az agyagásványokba a helyettesítendőnél kisebb vegyértékű fémion épül be,
az agyagásványok, oxidok (Fe-, Al-oxidok) törésfelületein és az éleken lévő SiOH-, AlOH-, FeOH-csoportok disszociálnak,
a huminsavak karboxil- és fenolos OH-csoportjai disszociálnak.
Az izomorf szubsztitúcióval a kristály lapjain állandó töltés, míg disszociációval pH-függő töltés jön létre. Ez a töltésbeli heterogenitás irányítja vizes szuszpenziókban a részecskék közötti kölcsönhatásokat [19], [33]. A vas- és alumínium-oxid hidroxidjai amfoterek, gyengén lúgos közegben protont adnak le, savas közegben protont vesznek fel.
A humuszanyagok polielektrolit jellegű, kémiailag kötött, disszociábilis funkciós csoportokat tartalmazó, töltéssel rendelkező makromolekulák [34], [21]. A FA és HA agyagásványokkal/oxidokkal való kölcsönhatását a pH és az ionerősség lényegesen befolyásolja [21]. A HS töltés- és kolloid állapota (konformáció, aggregáció, határfelületi felhalmozódás) a funkciós csoportok minőségétől, mennyiségétől, a vizes oldat összetételétől, elsősorban annak pH-jától, ionerősségétől, a specifikus ionok (minőség és töltés) és szilárd részecskék jelenlététől függően változik. A HS kolloid tulajdonságait vizes közegben alapvetően a térhálós szénváz savas funkciós csoportjainak disszociációjával kialakuló elektrosztatikus tér határozza meg. A nanorészecskék töltött térrészei közötti taszítás csökken (ezáltal a HS adszorpciója nő), ha csökken a pH és nő a töltéseket árnyékoló elektrolitok koncentrációja. A pH növekedésével, kicsi elektrolitkoncentrációnál fokozódik a HS disszociációja, a töltések kevésbé árnyékoltak, a negatívan töltött helyek erős taszítása (elektrosztatikai gátlás) miatt azok egymástól a lehető legtávolabb helyezkednek el, így a humátegységek kinyílnak [21]. Ám játszódik le adszorpció erősen lúgos pH-n is, ami bizonyítja, hogy az elektrosztatikus kölcsönhatáson kívül más mechanizmusok is működnek [21]. Ilyen a felületi aktív helyek – agyagásványok esetén elsősorban az oktaéderes Al-OH
helyek, oxidoknál a kristályrács adott felületi fémionjaihoz kötött Me-OH helyek – komplexálása, felületi komplexek képződése [11]. Al-oxidon a nulla töltéspont (p.z.c.) körüli és annál nagyobb pH-kon az adszorpció domináns mechanizmusa a humátanionok felületi Al- OH helyekkel való komplexálása [21]. Felületi komplexálás esetén az adszorpció mértéke az adszorbensek felületén hozzáférhető aktív helyek mennyiségétől és kémiai tulajdonságaitól függ. A p.z.c.-nél kisebb pH-kon az Al-OH helyek protonálódnak, csökkenő pH-val növekszik a részecskék pozitív felületi töltéssűrűsége, a pozitív potenciálú lokális elektroszta- tikus tér vonzza az ellentétes töltésű humátionokat, így savas pH-n jelentős az adszorpciójuk.
Az adszorpció mellett a közeg pH-jától és ionerősségétől, valamint a humuszmolekulák méretétől és funkcióscsoport-gazdagságától függő mértékben lejátszódik a HS fázisszeparációja is. Bármely tényező, ami a humuszmolekulák hidrofilitását – elsősorban a funkciós csoportok disszociációjának visszaszorítása révén – csökkenti, fázisszeparációt idézhet elő és a már vízben nem oldódó hidrofób humusz-nanorészecskékből kolloid diszperzió képződik. A töltésárnyéko- lás, valamint töltés semlegesítés hatására létrejött liofób állapot aggregálódást (koaguláció) eredményez. Elősegíti a kolloid vagy durva diszperzió képződését a pH csökkentése és a sókon- centráció növelése. A koagulációhoz szükséges sókoncentráció változik a pH-val. A fázis- szeparáció és az oldódás, valamint az aggregáció és diszpergálódás reverzibilis folyamatok.
A talajból a talajvízbe kioldódó humuszanyagok kolloid oldatot képeznek, az oldott szerves szén (DOC) jelentős részét alkotják [35], [36]. A talajszennyezők környezeti eloszlását ez a frakció is erősen befolyásolja. A HS önrendeződése révén szerkezetében különböző méretű üregek alakulnak ki, amelyek képesek visszatartani szerves molekulákat (pl. peszticideket), szervetlen vegyületeket (pl. fémsókat) [21], [22], [28]. Ez a jelenség a szolubilizáció.
A humusz molekulák expanziójakor a szennyeződések ismét felszabadulhatnak [22]. Azzal, hogy a talajban található szerves anyagok a talaj biológiai aktivitását, valamint kémiai és fizikai tulajdonságait jelentősen befolyásolják, hatást gyakorolnak a növényvédőszerek mozgására, perzisztenciájára, átalakulási folyamataira is.
A talaj szerves anyagai és a szervetlen kolloidok többféle módon is kölcsönhatásba kerülhet- nek a növényvédőszerekkel. Mint kolloidok, felületükön képesek jelentős mennyiségű apoláris, illetve poláris anyagot megkötni. A HS karboxil- és fenolos hidroxil-csoportjai disszociálva kationok, amino-csoportjai protonálódva anionok megkötésére képesek. A különböző tulajdon- ságú csoportok együttesen is kölcsönhatásba léphetnek a többféle tulajdonságú molekularészt tartalmazó növényvédőszer molekulákkal. Még erősebb kötődést eredményező komplexek alakulhatnak ki koordinatív, illetve hidrogénhíd-kötések létrejöttével. Lehetséges a peszticid molekula beépülése a humuszmolekulába kovalens kötésekkel is [37]. A szer mind az oldott,
mind a talajon kötött HS-al képes kölcsönhatásba lépni, e két fázisban jelenlévő különböző humusanyagok versengenek egymással a szerves szennyezőkért [13]. Az első folyamat csökkenti, a második növeli a növényvédőszer talaj-víz közötti megoszlását.
2.2.2.3.1. Asszociációs kolloidok
Az asszociációs kolloidok a kolloidok azon csoportját jelentik, amelyben az amfifil molekulák – megfelelő oldószerben és körülmények között – az oldatban önrendeződéssel szubmikroszkópos méretű egységeket, micellákat alkotnak. Ide tartoznak a felületaktív anyagok [2]. Ha kis koncentrációban vannak jelen, a felületen vagy a határfelületen monomolekulás réteget eredményező, erős, irányított adszorpciójukat nevezzük felületaktivitásnak [38], amelynek következtében felületi feszültség csökkentő hatásúak [11]. A felületaktív anyagokat gyakran technológiai alkalmazásuknak megfelelően nevezik el, például ilyen elnevezés a mosószer (detergens), a nedvesítőszer, az emulgeátor vagy a diszpergálószer [38].
A felületaktív anyagok híg oldatban mutatott számos fizikai tulajdonsága (pl. turbiditás, ozmózisnyomás, elektromos vezetés, felületi feszültség) egy viszonylag jól definiált koncentrá- ciónál hirtelen megváltozik [38]. Ez a viselkedés a felületaktív anyagból rendezett aggregátu- mok (micellák) létrejöttével értelmezhető. Az a koncentráció, ami felett a micellaképződés jelentőssé válik, a kritikus micellaképződési koncentráció (c.m.c.). Az aggregáció spontán folyamat, a szabadenergia csökkenésével jár (Hardy-Harkins elvnek megfelelő elrendeződés), a felületaktív anyag oldatának határfelületi energiáját csökkenti [38]. Az asszociáció fokát a koncentráció és a hőmérséklet mellett a molekulatömeg, kémiai szerkezet, pH, oldószer is befolyásolja. Molekulaszerkezet alapján megkülönböztetünk anionaktív, kationaktív, nemionos és amfoter asszociációs kolloidokat. A nemionos felületaktív anyagok molekulái 1000-nél is nagyobb tagszámú asszociációt képezhetnek, míg az ionos részecskék a fejcsoportok elektrosz- tatikus taszítása miatt csak 10-100-as tagszámú csoportokat hoznak létre [31]. Gyakran a micellák polidiszperz együttest alkotnak, s alakjuk a koncentrációval változik. Ha az apoláris rész mérete nő, az asszociációs hajlam is növekszik poláris oldószerben, ugyanis az apoláris részek inkább egymással kerülnek kölcsönhatásba, mint a poláris molekulákkal [8], [38]. Oldott elektrolit mennyiségének növelése csökkenti a c.m.c.-t.
A HS a felületaktív anyagokkal analóg módon – hiszen a térhálós humuszmolekula hidrofil és hidrofób tulajdonságokkal egyaránt bír – képes asszociátumok, micellák képzésére [21].
A HS c.m.c. értéke 5-10 g/l [12]. A hidrofób és a gyengén poláris szennyezők előnyben részesí- tik a talajbeli szerves anyaggal kialakított kölcsönhatást, legyen az akár a talaj folyadék, akár
![3. ábra: A közeg pH-jának hatása a vegyületek polaritására, vízoldhatóságára [8]](https://thumb-eu.123doks.com/thumbv2/9dokorg/872627.46940/35.892.269.644.633.1037/ábra-közeg-ph-jának-hatása-vegyületek-polaritására-vízoldhatóságára.webp)
![4. táblázat: A használt formázószerek tulajdonságai [116], [117], [118]](https://thumb-eu.123doks.com/thumbv2/9dokorg/872627.46940/54.892.126.784.454.750/táblázat-használt-formázószerek-tulajdonságai.webp)