DIAZOVEGYÜLETEK KATALITIKUS KARBONILEZÉSE.
SZINTÉZIS ÉS KINETIKA.
Ph.D. DOKTORI ÉRTEKEZÉS
Készítette:
Kuikné Ungvári Neszta Okleveles vegyész
Témavezető:
Dr. Ungváry Ferenc
Egyetemi tanár, a kémiai tudományok doktora
Pannon Egyetem Kémiai és Környezettudományok Doktori Iskola
Kémia Intézet
Szerves Kémia Intézeti Tanszék Veszprém
2010
DIAZOVEGYÜLETEK KATALITIKUS KARBONILEZÉSE.
SZINTÉZIS ÉS KINETIKA.
Értekezés doktori (Ph.D.) fokozat elnyerése érdekében Írta:
Kuikné Ungvári Neszta
Készült a Pannon Egyetem Kémiai és Környezettudományok Doktori Iskolájának keretében.
Témavezető: Dr. Ungváry Ferenc, egyetemi tanár
Elfogadásra javaslom (igen / nem) ……….
(aláírás)
A jelölt a doktori szigorlaton …... % -ot ért el.
Veszprém,……… ……….
a Szigorlati Bizottság elnöke
Az értekezést bírálóként elfogadásra javaslom:
Bíráló neve: …... …... igen /nem
……….
(aláírás) Bíráló neve: …... …... igen /nem
……….
(aláírás)
A jelölt az értekezés nyilvános vitáján …...% - ot ért el.
Veszprém,……… ……….
a Bíráló Bizottság elnöke A doktori (Ph.D.) oklevél minősítése…...
………
az EDT elnöke
TARTALOMJEGYZÉK
TARTALOMJEGYZÉK...1
KIVONAT...2
ABSTRACT...3
AUSZUG...4
BEVEZETÉS...5
1. IRODALMI ÖSSZEFOGLALÓ...8
1.1. Diazoalkánok keténekhez vezető átalakítása ...8
1.1.1. Diazoalkánok reakciója szén-monoxiddal hő vagy fény hatására ...9
1.1.2. Diazoalkánok reakciója szén-monoxiddal átmenetifém-komplexek jelenlétében ...12
1.2. Dikobalt-karbonil komplexek és izotóp jelzésű szén-monoxid reakciója ...30
2. KÍSÉRLETI EREDMÉNYEK ÉS ÉRTÉKELÉSÜK...34
2.1. Diazometán karbonilezése Co2(CO)8 jelenlétében...34
2.2. Trimetilszilil-diazometán karbonilezése Co2(CO)8 jelenlétében ...37
2.3. Etil-diazoacetát karbonilezése Co2(CO)8 katalizátor prekurzor alkalmazásával ...47
2.3.1. Új preparatív alkalmazások...47
2.3.2. Dietil-malonát képződés kinetikai vizsgálata Co2(CO)8 katalizátor prekurzor alkalmazásával ...48
2.3.3. Dietil-malonát képződés kinetikai vizsgálata Co2(CO)7(CHCO2Et) (1) katalizátor prekurzor alkalmazásával...51
2.3.4. Dietil-malonát képződés kinetikai vizsgálata Co2(CO)6(CHCO2Et)2(2) katalizátor prekurzor alkalmazásával...52
2.4. A kobalt-katalizált etil-diazoacetát karbonilezés részlépéseinek kinetikai vizsgálata .53 2.4.1. Az oktakarbonil-dikobalt és etil-diazoacetát reakciójának kinetikai vizsgálata ...53
2.4.2. Co2(CO)8 és 13CO reakciójának vizsgálata ...56
2.4.3. A Co2(CO)7(CHCO2Et) (1) komplex és szén-monoxid reakciójának kinetikája etanol jelenlétében ...58
2.4.4. A Co2(CO)7(CHCO2Et) (1) komplex és 13CO reakciójának vizsgálata ...59
2.4.5. A Co2(CO)7(CHCO2Et) (1) komplex és etil-diazoacetát reakciójának kinetikai vizsgálata...61
2.4.6. A Co2(CO)7(CHCO2Et) (1) komplex és PPh3 reakció vizsgálata ...64
2.4.7. A Co2(CO)6(CHCO2Et)2 (2) komplex és szén-monoxid reakciójának kinetikai vizsgálata etanol jelenlétében...67
2.4.8. A Co2(CO)6(CHCO2Et)2 (2) komplex és 13CO reakciójának vizsgálata ...68
2.5. A kobalt katalizált etil-diazoacetát karbonilezés mechanizmusa Co2(CO)8 katalizátor prekurzor esetében...70
2.6. Etil-diazoacetát karbonilezése trifenil-foszfánnal módosított karbonil-kobalt komplexek jelenlétében ...76
2.6.1. Kísérletek Co2(CO)7(PPh3) (M) komplexszel...78
2.6.2. Kísérletek Co2(CO)6(CHCO2Et)(PPh3) (3) komplexszel ...80
2.6.3. Kísérletek Co2(CO)5(CHCO2Et)(PPh3)2 (4) komplexszel ...81
2.6.4. Az etil-diazoacetát katalitikus karbonilezésének feltételezett mechanizmusa a Co2(CO)7(PPh3) (M) és Co2(CO)6(CHCO2Et)(PPh3) (3) komplexek közreműködésével ...83
2.6.5. Kísérletek [Co(CO)3(PPh3)2][Co(CO)4] (5) komplexszel...84
2.6.6. Az etil-diazoacetát katalitikus karbonilezésének feltételezett mechanizmusa a [Co(CO)3(PPh3)2][Co(CO)4] (5) komplex közreműködésével ...92
2.6.7. Kísérletek polisztirol-difenil-foszfánnal módosított karbonil-kobalt komplexszekkel 94 3. KÍSÉRLETEK LEÍRÁSA...99
3.1. Általános technika ...99
3.2. Diazometán (CH2N2) előállítása...100
3.3. Trimetilszilil-diazometán és oktakarbonil-dikobalt reakciójának vizsgálata szén- monoxid atmoszférában...102
3.4. Trimetilszilil-diazometán és oktakarbonil-dikobalt reakciójának kinetikai vizsgálata szén-monoxid atmoszférában...102
3.5. Trimetilszilil-diazometán és oktakarbonil-dikobalt reakciójának vizsgálata argon atmoszférában...103
3.6. Propándisav-etil-5-metil-2-(1-metil-etil)-ciklohexil-észter előállítása...103
3.7. 3-(4-morfolinil)-3-oxo-propánoinsav-etil-észter előállítása ...104
3.8. A Co2(CO)7(CHCO2Et) (1) komplex előállítása ...104
3.9. A Co2(CO)6(CHCO2Et)2 (2) komplex előállítása...106
3.10. A Co2(CO)6(CHCO2Et)(PPh3) (3) komplex előállítása...107
3.11. A Co2(CO)5(CHCO2Et)(PPh3)2 (4) komplex előállítása...108
3.12. Dietil-malonát képződés kinetikai vizsgálata oktakarbonil-dikobalt-katalizátor alkalmazásával ...110
3.13. Dietil-malonát képződés kinetikai vizsgálata Co2(CO)7(CHCO2Et) (1), illetve Co2(CO)6(CHCO2Et)2(2) komplexek alkalmazásával...111
3.14. Az oktakarbonil-dikobalt és etil-diazoacetát reakciójának kinetikai vizsgálata ...111 3.15. A Co2(CO)7(CHCO2Et) (1) komplex és szén-monoxid reakciójának kinetikája etanol
jelenlétében ...112 3.16. A Co2(CO)7(CHCO2Et) (1) komplex és etil-diazoacetát reakciójának kinetikai
vizsgálata...112 3.17. Co2(CO)7(CHCO2Et) (1) és PPh3 reakciójának kinetikai vizsgálata...113 3.18. A Co2(CO)6(CHCO2Et)2 (2) komplex és szén-monoxid reakciójának kinetikai
vizsgálata etanol jelenlétében...113 3.19. 13CO-val végzett kísérletek ...114 3.20. Foszfánokkal módosított karbonil-kobalt katalizátorok vizsgálata etil-diazoacetát
karbonilezésénél ...114 3.21. Polisztirol-difenil-foszfánnal (PSDP) módosított kobalt-komplexek előállítása PSDP
és Co2(CO)8 reakciójával...115 3.22. Polisztirol-difenil-foszfánnal (PSDP) módosított kobalt-komplex előállítása PSDP és
Co2(CO)7(CHCO2Et) (1) reakciójával...116 3.23. Etil-diazoacetát karbonilezése polisztirol-difenil-foszfánnnal módosított kobalt-
komplex katalizátorral ...116 4. ÖSSZEFOGLALÁS...117 5. IRODALOMJEGYZÉK...122
KIVONAT
Karbonil-kobalt-komplexek alkalmas katalizátor prekurzoroknak bizonyultak primer diazoalkánok keténekké való szelektív átalakítására. Oktakarbonil-dikobalt katalizátor prekurzor esetében tisztázták a karbonilezési reakció mechanizmusát etil-diazoacetát modell diazoalkánnal. Aktív intermedierként kétmagvú etoxikarbonil-karbén ligandumo(ka)t tartalmazó komplexeket azonosítottak, és megállapították ezek releváns kémiai tulajdonságait. A karbonilezés meghatározó lépése az etoxikarbonil-karbén és egy szén- monoxid ligandum keténné való összekapcsolódása. Etanol jelenlétében dietil-malonát az etil-diazoacetát katalitikus karbonilezésének kizárólagos terméke. Különböző reakciókörülmények között azonosították a katalitikus reakció sebesség-meghatározó lépését.
ABSTRACT
Carbonyl cobalt complexes were found to serve as catalysts or catalyst precursors for the facile and selective transformation of primary diazoalkanes into the corresponding ketene.
The mechanism of this carbonylation reaction has been elucidated in the case of ethyl diazoacetate as model diazoalkane using octacarbonyl dicobalt as the catalyst precursor.
Dinuclear cobalt complexes having ethoxycarbonylcarbene ligand(s) in bridging position(s) have been identified as active intermediates of the catalytic cycles and their relevant chemical properties have been explored. Key step of the carbonylation is the formation of the highly reactive ethoxycarbonylketene by intramolecular coupling of a carbonyl ligand with the ethoxycarbonylcarbene ligand. In the presence of ethanol diethyl malonate is the only product of the catalytic carbonylation of ethyl diazoacetate. Localization of the rate determining step under various reaction conditions has been made.
AUSZUG
Die selektive Carbonylierung von primeren Diazoalkane zu den entsprechenden Ketene in der Anwesendheit von Carbonyl Kobalt Komplexe wurde untersucht. Der Mechanismus der kobalt-katalysierten Carbonylierung wurde an Hand von Diazoessigsäure-ethylester als Modell-Diazoalkan geklärt. Zweikernige Kobalt-komplexe verbrückt mit Ethoxycarbonylcarben Ligand(en) wurden als aktive Teilnehmer im katalytischen Zyklus identifiziert und ihre relevanten chemischen Eigenschaften erforscht. Wichtigster Teilschritt der Carbonylierung ist die Bildung der reaktiven Ethoxycarbonylketen durch intramolekulare Verknüpfung von einem Carbonyl Liganden mit dem Ethoxycarbonylcarben Ligand. In Gegenwart von Ethanol Malonsäure-diethylester ist das einzige Produkt der katalytischen Carbonylierung von Diazoessigsäure-ethylester. Unter verschiedenen Reaktionsbedingungen wurde der Geschwindigkeitsbestimmender Schritt bestimmt.
BEVEZETÉS
A diazoalkánok diazocsoportjának az izoelektronos szén-monoxiddal elképzelhető kicserélése dinitrogén felszabadulását és ketén képződését eredményezheti.
R2C=N=N + CO R2C=C=O + N2
A kémiai irodalomban nagy számban találhatók a fenti reakcióval kapcsolatban álló közvetett és közvetlen kísérleti bizonyítékok. Ezek valószínűsítik, hogy a ketén képződése több részlépésen keresztül történik. A szakmai közvélemény által elfogadott részlépésnek tekintik a karbén intermedierhez vezető dinitrogén kiszakadást, valamint a karbén intermedier és a szén-monoxid keténné való összekapcsolódását. Az áttekinthetőséget bonyolítja, hogy a reakció végeredményére hatással van az aktiválás módja és az átmenetifém-komplexek jelenléte.
A fenti reakció gyakorlat számára hasznos katalitikus megvalósításának kutatásában öt éve veszek részt. Munkám kiinduló pontja Tuba Róbert PhD értekezésében összefoglalt megállapításai voltak, miszerint etil-diazoacetát és szén-monoxid etanol jelenlétében katalitikus mennyiségű oktakarbonil-dikobalt hatására lejátszódó reakciója 100%-os kitermelést megközelítően dietil-malonáthoz vezet.[1]
EtO2CCH=N=N + CO + EtOH
1 mol% Co2(CO)8
25 °C; 50 bar EtO2CCH2CO2Et + N2
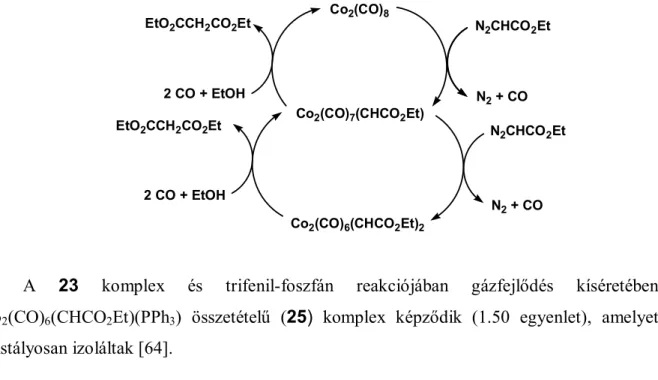
Tuba Róbert etil-diazoacetát és oktakarbonil-dikobalt sztöchiometrikus reakciójából kétmagvú karbén-hidas komplexeket, Co2(CO)7(CHCO2Et) és Co2(CO)6(CHCO2Et)2 izolált, amelyekről kísérletileg bizonyította, hogy a dietil-malonát-képződés intermedierjei.[2] A dietil-malonát keletkezését a kobalthoz kötött etoxikarbonil-karbén és szén-monoxid kapcsolódásával feltételezett etoxikarbonil-ketén intermedier és etanol reakciójával magyarázta.
Co2(CO)8 + EtO2CCHN2
- CO, - N2 Co2(CO)7(CHCO2Et)
- CO, - N2 Co2(CO)6(CHCO2Et)2
+ EtO2CCHN2
+ 2CO + EtOH 25 °C
1 bar + EtO2CCH2CO2Et
Co2(CO)6(CHCO2Et)2 Co2(CO)7(CHCO2Et)
+ 2CO + EtOH 25 °C
1 bar Co2(CO)8 + EtO2CCH2CO2Et Co2(CO)7(CHCO2Et)
Munkám első részében diazoalkánok katalitikus dediazotálását és karbonilezését vizsgáltam diazometán és trimetilszilil-diazometán esetében. Az etil-diazoacetátnál tapasztalt intermedier karbenoidok képződését egyik esetben sem tudtam meggyőzően igazolni. Ezzel szemben diazometán etil-alkohol jelenlétében végrehajtott karbonilezése a várakozásnak megfelelően etil-acetáthoz is vezetett, míg trimetilszilil-diazometán esetében etil-alkohol távollétében a trimetilszilil-ketén mennyiségi képződését sikerült megállapítanom.
A diazoalkán katalitikus dediazotálásának és karbonilezésének mechanizmus vizsgálatához modellként etil-diazoacetátot választottam, mivel ebben az esetben esély kínálkozott az intermedier karbenoidok részvételével lejátszódó részlépések részletekbe menő vizsgálatára. E vizsgálatok eredményeként sikerült a feltételezett katalitikus ciklus valamennyi kimutatható részlépésének kinetikáját megállapítani, és ezzel az etil-diazoacetát katalitikus karbonilezését mennyiségileg és minőségileg leírnom.
Az etil-diazoacetát katalitikus karbonilezésére ugyancsak alkalmas foszfán-módosított kobalt-komplexek esetében a fő összefüggéseket felismertem, amelyekre támaszkodva javaslatot teszek az elképzelhető működési mechanizmusokra.
A fenti témakörben végzett munkám részeredményeiről három Intézményi és egy Országos Tudományos Diákköri Konferencián,[3] diplomamunkámban,[4] az irodalmi összefoglalást és néhány új kísérleti eredményemet tartalmazó könyvfejezetben,[5] valamint szakfolyóiratokban megjelent tudományos közleményekben[6-11] számoltam be.
[1] Tuba Róbert PhD Disszertáció, Veszprém, 2003.
[2] R. Tuba, F. Ungváry, Octacarbonyl dicobalt-catalyzed selective transformation of ethyl diazoacetate into organic products containing the ethoxycarbonyl carbene building block J. Mol. Catal. A: Chem.
203 (2003) 59-67.
[3] a. Ungvári Neszta: Alifás diazovegyületek karbonilezésének vizsgálata, Tudományos Diákköri Dolgozat, Veszprém, 2003. b. Ungvári Neszta: Oktakarbonil-dikobalt által katalizált trimetilszilil- diazometán karbonilezésének vizsgálata, Tudományos Diákköri Dolgozat, Veszprém, 2004. c. Ungvári Neszta: Jelzett szén-monoxid reakciója etoxikarbonil-karbén-hidas karbonil-kobalt komplexekkel, Tudományos Diákköri Dolgozat, Veszprém, 2005. d. Ungvári Neszta: Oktakarbonil-dikobalt által katalizált trimetilszilil-diazometán karbonilezésének vizsgálata, Országos Tudományos Diákköri Dolgozat, Budapest, 2005.
[4] Ungvári Neszta: Alifás diazovegyületek katalitikus karbonilezésének vizsgálata, Diplomamunka, Veszprém, 2006.
[5] N. Ungvári, F. Ungváry, Carbonylation of diazoalkanes, in Modern Carbonylation Methods, Kollár, L.
(Ed.), Wiley-VCH, Weinheim, Chapter 8, pp 199-221, 2008.
[6] N. Ungvári, T. Kégl, F. Ungváry, Octacarbonyl dicobalt-catalyzed selective carbonylation of (trimethylsilyl)-diazomethane to obtain (trimethylsilyl)ketene J. Mol. Catal. A Chem. 219 (2004) 7-11.
[7] E. Fördős, N. Ungvári, T. Kégl, F. Ungváry, Reactions of 13CO with ethoxycarbonylcarbene-bridged dicobalt carbonyl complexes: [2-{ethoxycarbonyl(methylene)}-2-(carbonyl)-bis(tricarbonyl-cobalt) (CoCo)] and [di-2-{ethoxycarbonyl(methylene)}-bis(tricarbonyl-cobalt) (CoCo)]. Eur. J. Inorg.
Chem, (2006) 1875-1880.
[8] E. Fördős, N. Ungvári, L. Párkányi, G. Szalontai, T. Kégl, F. Ungváry: Structure of Co2(CO)6(dppm) and Co2(CO)5(CHCO2Et)(dppm) (dppm = Ph2PCH2PPh2) and exchange reaction with 13CO : An experimental and computational study. Inorg. Chim. Acta, 361 (2008) 1832-1842.
[9] N. Ungvári, E. Fördős, T. Kégl, F. Ungváry: Reactions of triphenylphosphane-substituted ethoxycarbonylcarbene-bridged dicobalt carbonyl complexes with carbon monoxide or 13CO: An experimental and theoretical study Inorg. Chim. Acta 362 (2009) 1333-1342.
[10] N. Ungvári, E. Fördős, T. Kégl, F. Ungváry: Mechanism of the cobalt-catalyzed carbonylation of ethyl diazoacetate. Inorg. Chim. Acta 363 (2010) 2016-2028.
[11] N. Ungvári, E. Fördős, J. Balogh, T. Kégl, L. Párkányi, F. Ungváry: Triphenylphosphane-modified cobalt-catalysts for the selective carbonylation of ethyl diazoacetate. Organometallics, 29 (2010) 3837- 3851.
1. IRODALMI ÖSSZEFOGLALÓ
1.1. Diazoalkánok keténekhez vezető átalakítása
A diazoalkánok diazocsoportjának az izoelektronos szén-monoxiddal történő kicserélése dinitrogén felszabadulását és ketén képződését eredményezheti (1.1 egyenlet). A ketének sokoldalú intermedierek a szerves szintézisekben [1][2][3].
(1.1)
X
C=N=N Y
X
C=C=O Y
(X,Y = H, alkil, aril, alkoxi, alkiltio, acil, alkoxikarbonil, alkilamino, F, Cl, trialkilszilil, ...)
+ CO + N2
A ketén képződését diazoalkánokból két lépésben képzelik el [4]. E szerint az első lépésben a diazoalkánok dediazotálása történik hő, fény vagy átmenetifémek [5] hatására, amely reakció szabad karbént (1.2 egyenlet) vagy átmenetifémhez koordinált karbént u. n.
karbenoidot (1.3 egyenlet) eredményez. A második lépésben a karbén illetve a karbenoid szén-monoxiddal megfelelő reakciókörülmények között ketén termékké alakul (1.4 vagy 1.5 egyenlet).
(1.2)
X C Y
+ N2
vagyh X
C=N=N Y
:
C=N=N +
X Y
N2
MLn C=MLn + (1.3)
X Y
(MLn= egy-, két-, vagy polinukleári s átmene ti-fém komplexek változatos elektro n don or ligandmokka l)
(1.4)
X C Y
+ CO
X
C=C=O Y
:
(1.5)
X
C=MLn Y
+ MLn + CO
X
C=C=O Y
A következő két alfejezetben a ketének fenti utakon feltételezett vagy igazolt képződésével összefüggő irodalmakat mutatok be.
1.1.1. Diazoalkánok reakciója szén-monoxiddal hő vagy fény hatására
Diazometán karbonilezésével nyerhető keténről első ízben Staudinger és Kupfer írtak.
Kísérletükben szén-monoxidot buborékoltattak át diazometán 1%-os éteres oldatán és a távozó szén-monoxidot, diazometánt és éter gőzöket tartalmazó gázelegyet 400-500°C-ra hevített kvarc csövön vezették át (1.6 egyenlet). A kvarc csövön átvezetett gáz anilin éteres oldatával érintkeztetve a diazometánra számított 3%-os kitermeléssel acetanilidet eredményezett, amit a ketén-képződés közvetett bizonyítékának tekintettek [6].
CH2N2 + CO + PhNH2
(1.6)
- N2 CH2=C=O PhNHC(=O)CH3
Staudinger és munkatársa egy későbbi közleményben leírták, hogy szilárd difenil- diazometánt szén-monoxid jelenlétében hevítve nem sikerült difenil-ketén képződését kimutatni [7]. Poliakoff és munkatársai diazociklopentadiénnel alacsony hőfokú mátrixban végzett kísérleteikben nagy szén-monoxid felesleget alkalmazva a megfelelő ketén származék képződését igazolni tudták. Szén-monoxid távollétében ciklopentadienilidén és fulvalén keletkezését figyelték meg a rendszerben (1.7 egyenlet) [8][9].
N2 - N2
ISC
fulvalén 20-35 K
20K h
+ CO
C=C=O
(1.7)
A Chemical Abstract adatbázisban a fenti példákhoz hasonló további néhány irodalmat találtam diazoketonokból (1.8 és 1.9 egyenlet) [10][11][12], diazoészterekből (1.10 egyenlet) [13][14], más változatos szerkezetű diazoalkánokból (1.11 és 1.12 egyenlet) [13][14]
valamint diazirinekből (1.13 és 1.14 egyenlet) [15][16] keletkező ketének leírására.
Mindegyikben közös az alacsony hőmérsékleten alkalmazott fotokémiai aktiválás.
O O O
N2 C
O + CO
10 K, h h
365 nm 625 nm
(1.8)
- N2
N2 O
C - N2 O
O
O R
R
R R
R R
R R
R
R R
R + CO
(R = H, F, Cl)
35 K 10 K, h
(1.9)
RO O
O RO
N2
RO O
O RO
RO O
O RO h C
- N2 O
+ CO
(R = Me, Et)
6,5 K,
(1.10)
N
N2
N N
C O 12 K, h
- N2
(1.11)
+ CO
N2 F3C
Ph - N2
F3C Ph
C F3C
Ph
+ CO O
40 K 12 K, h
(1.12)
F3C
F3C - N2
F3C F3C
C F3C F3C
+ CO O
N
N 12 K, h
40 K (1.13)
N N
h
N2, 6 K
(1.14)
N N + + CO C O
38 K
A fentieken túl ellentmondó eredmények jelentek meg a nagy stabilitású és ezért izolálható nitrogén-heterociklusos karbének és szén-monoxid reakciójának vonatkozásában.
Lyashchuk és Skrypnik arról számoltak be, hogy az 1,3-di-1-adamantil-imidazol-2-ilidén 1015°C-on légköri nyomású szén-monoxiddal THF-os oldatban 20-30%-os kitermeléssel a megfelelő ketén, 1,3-di-1-adamantil-imidazol-2-karbonil keletkezik (1.15 egyenlet) [17].
N
N Ad
Ad (Ad = 1-adamantil)
+ CO
10-15 °C; 1 bar THF
N
N Ad
Ad C O
20-30% kitermelés
(1.15)
Arduengo és munkatársai kísérleti tapasztalataik alapján kétségbe vonták Lyashschuk és Skrypnik idézett eredményeit. Szerintük 1,3-di-1-adamantil-imidazol-2-ilidén nem reagál szén-monoxiddal még nagyobb szén-monoxid nyomás alatt sem [18]. Ezzel a kétellyel összhangba állnak Denk és munkatársainak eredményei, miszerint sem 1,3-di-terc-butil- imidazol-2-ilidénből sem 1,3-di-terc-butil-4,5-dihidroimidazol-2-ilidénből semmilyen ketén termék nem képződik szén-monoxiddal légköri nyomáson 25 °C körül [19]. Nemrég viszont Bertrand és munkatársai arról számoltak be, hogy egy stabilis aciklikus amino-helyettesített karbénből és egy ciklikus karbénből 1 bar nyomás alatt egyszerű szén-monoxid addíciós reakcióban szobahőmérsékleten THF-os oldatban mégis csak képződnek stabilis ketének 80- 82 (1.16 egyenlet) illetve 65 %-os kitermeléssel (1.17 egyenlet) [20].
R tBu R tBu
C O (R =iPr,cHexil)
80-82% kitermelés + CO 25 °C; 1 bar
THF (1.16)
N
iPr
iPr
iPr
N
iPr
iPr
iPr C O
THF (1.17)
65% kitermelés + CO 25 °C; 1 bar
1.1.2. Diazoalkánok reakciója szén-monoxiddal átmenetifém-komplexek jelenlétében
A diazoalkán karbonilezése átmenetifém-komplexek közvetítésével legalább két lépésből áll (1.3 és 1.5 egyenlet), melyek részei lehetnek az 1.1. séma szerint ábrázolt katalitikus ciklusnak is [21].
1.1. séma.
LnM LnM=CR2
LnM-CR2 N2
S
R2C=N2
SCR2
S : = I , C=C , CO , C C
N2
: CR2 ,
A szabad koordinációs hellyel rendelkező átmenetifém az LnM-típusú komplexben, mint elektrofil Lewis-sav centrum koordinálni képes a diazoalkánt, amely dinitrogén vesztésen keresztül a fémhez koordinált karbént, az u. n. karbenoidot eredményez. A karbén ligandomot az átmenetifém centrum képes átadni egy alkalmas elektrondús S: molekulának egy SCR2
típusú termék képződése közben és ezzel regenerálódik a diazoalkán koordinációjára képes LnM és kezdődhet egy új ciklus. Ha az általános sémában szereplő S: reagens molekula helyére szén-monoxidot képzelünk, akkor a szén-monoxid és az LnM=CR2 karbenoid reakciójából levezethető SCR2 típusú termék-molekula egy ketén.
Különböző átmenetifémekhez kötött karbén és szén-monoxid keténhez vezető reakciójára számos példa található az irodalomban, melyeket a következő alfejezetekben átmenetifém csoportonként fogom bemutatni.
Titán és Cirkónium
Ozawa és munkatársai megállapították, hogy -metilén ligandumokkal rendelkező heterobinukleáris komplexek: Cp2Ti(Cl)CH2Pt(CH3)L2 (L=P(CH3)2Ph, PCH3Ph2) (1) reakciója szén-monoxiddal atmoszférikus nyomás alatt gyors átalakulással -(C,O)-ketén komplexet: Cp2Ti(Cl)-OC(=CH2)-Pt(CH3)2L2 (2) eredményez (1.18 egyenlet) [22].
Cp2Ti Cl
Pt Me
L
L O
Cp2Ti Cl
CH2 Pt
Me L L + CO - 50 °C, 1 bar
12 óra
1 (L = PMe2Ph, PMePh2) 2
80-95% kitermelés (1.18)
(Cp =5C5H5)
Barger és munkatársai szobahőmérsékleten végzett kísérleteiben cirkónium-karbén komplexet (3) hoztak össze szén-monoxiddal. Eredményként cirkónium-koordinált ketén komplexet (4) kaptak 30 %-os kitermeléssel (1.19 egyenlet) [23].
Cp2Zr PMe3 C H
OZrCp*2 I
3
+ CO 25 °C, 200 torr
3,5 óra C O
C Cp2Zr
I
H O
ZrCp*2
4
30% izolált kitermelés (1.19)
(Cp =5-C5H5, Cp* =5-C5Me5)
Króm, Molibdén és Volfram
Dorrer és Fischer izolált króm-karbén-komplexből karbonilezéssel 150 bar nyomáson 1-vinil-2-pirrolidon jelenlétében Cr(CO)6–ot és olyan szerves terméket kaptak, amely metoxi- fenil-ketén intermedier feltételezésével keletkezhet [24]. Dötz (CO)5Cr=C(OCH3)Ph és bisz- (trimetilszilil)-acetilén 50oC-on végzett reakciójában tiszta vinil-ketén és vinil-ketén-króm- komplex keletkezését figyelte meg (1.20 egyenlet) [25][26][27].
(CO)5Cr C OMe Ph Me3Si C C SiM e3 +
50 °C O C C
SiMe3 C Me3Si
C OMe
Cr(CO)3
52% izolált kitermelés
O C C SiMe3 C Me3Si
C Ph OMe 20% izolált kitermelés
+ (1.20)
nBu2O
Etanol jelenlétében (CO)5Cr=C(OCH3)Ph és etil-propiolát reakciója malonát származékhoz vezet (1.21 egyenlet)[28].
Ph C MeO
C
CH(CO2Et)2 H
(CO)5Cr C OMe Ph
H C C CO2Et +
60 °C
THF Ph
C MeO
C H
CH(CO2Et)2
6 : 1
83% kitermelés + EtOH
(1.21)
Fischer difenil-ketént izolált 70 %-ban (CO)5Cr=CPh2-ből 1 bar szén-monoxid nyomás alatt 50oC-on. Feltételezi, hogy a difenil-ketén intramolekuláris difenil-karbénszén-monoxid kapcsolódással keletkezik, melyet az a 13-as szénizotóppal dúsított szén-monoxiddal végzett kísérleti megfigyelése támaszt alá, miszerint 25 %-os átalakulásnál az izotópjelzésű szén- monoxid nem épült be a difenil-ketén termékbe [29].
Kron és Schubert a (CO)3M=C(OEt)SiPh3 (M=Cr, Mo, W) összetételű karbén- komplexekből 80-100oC-on és 50 bar szén-monoxid nyomás alatt N-metil-benzaldimin reagens jelenlétében in situ állították elő a Ph3Si(EtO)C=C=O ketént, és így a keténből levezethető -laktám származékhoz jutottak (1.22 egyenlet) [30].
(CO)5M C OEt SiPh3
+ CO + PhCH=NMe
N Ph3Si
EtO
O Me
Ph 50 bar
80-100 °C, 2 nap
90% izolált kitermelés (M = Cr, Mo, W)
(1.22)
Króm-karbén komplexek fotolízise rövid élettartalmú reakcióképes intermedieren keresztül karbonsav származékok, karbonsavamidok, -laktámok és ciklobutanonok szintéziséhez vezet (1.23 egyenlet) [31].
(CO)5Cr C X R
(X = OR, NR2; R = alkil)
h (CO)4Cr X
C R C O
X R
O NR2 X
R O
OR
N R
X
X R
O
O ROH
R2NH
N
(1.23)
Messerle és Curtis Cp2Mo2(CO)4 és difenil-diazometán reakciójából szobahőmérsékleten diklórmetános oldatban Cp2Mo2(CO)4(N2CPh2) összetételű komplexet nyertek >90 %-os kitermeléssel (Cp = 5-ciklopentadienil-). Ebből melegítéssel benzolos oldatban dinitrogén veszítésével egy Cp2Mo2(CO)4(CPh2) összetételű stabilis -difenil- karbén komplexhez jutottak jó kitermeléssel. Enyhe reakciókörülmények között 3 bar szén- monoxid nyomáson és 50oC-on a -difenil-karbén-komplexből valószínűleg egy közbenső difenil-ketén-komplexen keresztül difenil-ketént és Cp2Mo2(CO)6-ot kaptak [32]. A Cp2Mo2(CO)6 termikus dekarbonilezésekor Cp2Mo2(CO)4 keletkezik [33], amelynek rövid 2,448 Ǻ molibdén─molibdén távolsága alapján hármaskötést feltételeznek [33]. Ezen sztöchiometrikus reakciók végeredményét összegzi az 1.2. séma egy elvi katalitikus ciklus formájában, amelynek gyakorlati működését még nem demonstrálták.
1.2. séma.
N Cp(CO)Mo
C
Mo(CO)2Cp N
C Cp(CO)Mo
C
Mo(CO)2Cp Ph
O
O
Ph C Ph
N2 Ph
C=C=O Ph
3 CO
Ph C=N2 Ph
Cp(CO)2Mo Mo(CO)2Cp
Cp(CO)3Mo Mo(CO)3Cp 2 CO
A tiokarbén-komplex: (CO)5W=C(SEt)SiPh3 20oC-on szilárd fázisban és pentános oldatban egyaránt karbonil-wolfram-komplexre és egy (CO)5W fragmentumhoz kötött (etiltio)-(trifenil-szilil)keténre bomlik [34]. Az analóg etoxikarbén-komplex:
(CO)5W=C(OEt)SiPh3 nem olyan reakcióképes, mint a (CO)5W=C(SEt)SiPh3 komplex, de 50 bar szén-monoxid nyomással ebből is nyerhető EtO(Ph3Si)C=C=O összetételű ketén termék [35].
Fischer és munkatársai arról számoltak be, hogy szokatlanul könnyen kapcsolódik össze szén-monoxid semleges karbén-wolfram komplexek: (CO)5W=C(Ar)H (Ar=Ph, p-tolil) karbén ligandumaival. A reakcióban keletkező O=C=CHAr összetételű keténnel magyarázzák azt, hogy metanol jelenlétében diklórmetános oldatban 1 bar CO nyomás alatt 20 °C-on a (CO)5W=C(Ar)H komplexből aril-ecetsav-metil-észter: ArCH2CO2CH3 keletkezik. Az észter kitermelése a CO nyomás növelésével növelhető. Diwolfram-metilén-komplex Cp2(CO)6W2(-CH2) karbonilezésénél 1 bar szén-monoxid nyomást alkalmazva fém-fém kötés nélküli hidas ketén komplex Cp2(CO)6W2(-CH2CO) képződése figyelhető meg [36][37].
Mangán
Herrmann mangán-karbonil-komplexeket: LMn(CO)2(THF) (L = 5-CH3C5H4 vagy 5- C5H5) nagyon hatásosnak találta a diazoalkánok dediazotálásához, melyek szobahőmérsékleten stabilis mangán-karbén-karbonil-komplexeket eredményeznek (1.24 és 1.25 egyenlet) [38][39].
H3C Mn OC
CO THF
Ph N
Ph
O N
+
H3C Mn OC
CO Ph
O Ph
+ N2 THF
25 °C (1.24)
Mn OC CO THF
+
Ph Ph
N N
Mn OC
CO
Ph + N2 Ph
THF (1.25)
25 °C
A CpMn(CO)2(CPh2) összetételű karbén-komplex 650 bar szén-monoxid nyomás hatására 30-50oC-on 45 %-os kitermeléssel izolálható CpMn(CO)2(O=C=CPh2) összetételű difenil-ketén komplexet eredményez [40][41].
Vas, Ruténium és Ozmium
Gáz fázisban (5-C5H5)Fe(CO)2CH2OCH3-ból elektronok hatására vas karbén komplex (5-C5H5)Fe(CO)(CH2+
) keletkezik. Ciklohexénnel vagy n-donor molekulákkal (NH3, CH3CN vagy CD3CDO) ketén szorítható ki a komplexből (1.26 egyenlet). A vas koordinációs övezetében metilénszén-monoxid összekapcsolódást feltételeznek [42].
(5-C5H5)Fe(CO)(CH2)+ + B (5-C5H5)Fe(B)+ + CH2=C=O (B = ciklohexén, NH3, CH3CN, CD3CDO)
(1.26)
A metilén-hidas vas komplex: Fe2(-CH2)(CO)8 sztöchiometrikus reakciójában metanollal 65-75%-os kitermeléssel metil-acetát képződése figyelhető meg (1.27 egyenlet).
Azt feltételezik, hogy ebben a reakcióban átmenetileg egy -metilén és egy szén-monoxid ligandum összekapcsolódásából származó hidas ketén intermedier alakul ki [43].
H2
C
(OC)4Fe Fe(CO)4
H2C
(OC)4Fe Fe(CO)4 O
CH3OH 60 °C, 14 óra
O CH3C
OCH3 65-75% kitermelés
(1.27)
Az (5) vinil-ketén komplex melegítés hatására reverzibilisen szén-monoxidot veszít, aminek következményeként vinil-karbén komplex (6) kialakulása figyelhető meg (1.28 egyenlet) [44].
O C
C C
C C C C O Ph Ph O
Ph Ph
Fe(CO)3
O C
C C
C C C Ph Ph O
Ph Ph
Fe(CO)3 (1.28)
6
60 °C; - CO 20 °C; + CO
5
Cutler és Bodnar leírták, hogy egy [(5-C5H5)(CO)2Fe+(CH2)][PF6] összetételű vas- metilidén-komplex karbonilezése 25 °C-on, 6 bar szén-monoxid nyomáson stabilis [(5- C5H5)(CO)2Fe+(CH2=C=O)][PF6] összetételű (2-C,C) ketén komplex kialakulását eredményezi. A 13-as szénizotóppal jelzett szén-monoxiddal folytatott vizsgálataik alapján állítják, hogy az elektrofil metilidén ligandum által felvett szén-monoxid nem a vas koordinációs övezetből, hanem a gázfázisból származik [45].
A [(5-C5H5)(CO)2(Ru]2(-CH2) komplex karbonilezése 25oC-on, 3 bar szén-monoxid nyomáson készségesen a megfelelő hidas ketén komplex [(5-C5H5)(CO)2Ru]2(-CH2=C=O) kialakulásához vezet 80 %-os kitermeléssel. Ez a karbénszén-monoxid kapcsolódás látszólag nem igényeli a ruténium atomok közötti kötést [46]. Ha toluolban melegítik a hidas- ketén-ruténium komplexet (7) akkor a (8) -metilén komplex gyors kialakulása figyelhető meg az 1.29 egyenletnek megfelelően, amely 88 %-os kitermeléssel kinyerhető. Ez az átalakulás 100oC-on és 150 bar CO nyomás alatt sem fordítható vissza [47].
Ru Ru
CO CO
C CH2
O
CO
Ru Ru
CO CO
H2
C CO
- CO
, PhMe
7 8
(1.29)
Triozmium metilén komplex diklórmetános oldata 22 °C-on könnyen reagál 2 mól szén-monoxiddal és ketén komplexet (9) eredményez (1.30 egyenlet). Ez a reakció csökkentett nyomáson való hevítéssel megfordítható. Izotópjelzéses kísérletek azt mutatják, hogy a ketén-karbonil a kiindulási Os3(CO)11(-CH2) komplex egyik karbonil ligandumából származik és nem a gázfázisból. Ez arra utal, hogy Os3(CO)11(-CH2) és egy koordinatív telítetlen ketén komplex között előegyensúlyi reakció van, és ebből alakul ki 2 mól szén- monoxid felvételével a (9) izolált termék [48][49].
(CO)3Os C
Os(CO)3 C
Os(CO)4
(CO)4Os C C
Os(CO)4 Os(CO)4
H H O H H O
+ 2CO 22 °C, 1 bar CH2Cl2
9
(1.30)
Megállapították, hogy a szén-monoxidmetilén összekapcsolódás 100-szor lassabb olyan komplexben, ahol hidas karbonil helyett hidas halogenid ion van [50][51]. Az egymagú ozmium metilén komplex (10) szén-monoxid atmoszférába gyors reakcióban a (11) ketén komplexet eredményezi (1.31 egyenlet) [52].
(PPh3)2Cl(NO)Os=CH2 + CO (PPh3)2Cl(NO)Os(CH2=C=O)
10 11
(1.31)
Kobalt, Ródium és Irídium
Wulff és munkatársai a (12) kobalt karbén komplexet reagáltatták 3-hexinnel, és 25 °C- on, 48 óra reakcióidő után a (13) 4–vinil-ketén komplex keletkezését figyelték meg (1.32 egyenlet), amely komplexet 35 %-os kitermeléssel izolálták [53].
Ph3Sn Co CO
OC CO C
OMe Ph
O C
C Et
C Et Ph
OMe
(CO)2Co
SnPh3
12 13
EtC CEt
+ 25 °C, 48 óra
benzol (1.32)
Bisz-(trifluorometil)-diazometán transz-(Ph2PCH3)2Ir(CO)Cl-val végrehajtott lassú dediazotálásával a (14) irídium karbén komplexet állították elő 37 %-os kitermeléssel (1.33 egyenlet) [54].
tr ansz-(Ph2PMe)2Ir(CO)Cl + (CF3)2CN2
C OC Ir
Ph2MeP Cl PMePh2
F3C CF3
14
25 °C, 20 nap
benzol + N2 (1.33)
Stone és munkatársai 54 %-os kitermeléssel nyerték a (15) 2-bisz-(trifluorometil)- metilén komplexet bisz-(trifluorometil)-diazometán és oktakarbonil-dikobalt reakciójával (1.34 egyenlet). A reakciót szobahőmérsékleten végezték 28 napon keresztül [54][55].
Co (OC)3Co Co(CO)3
C C
15
F3C CF3
Co2(CO)8 + (CF3)2CN2
n-hexán
+ N2 (1.34)
O 25 °C, 28 nap
Különböző diazoalkánok dediazotálási reakcióját (1.35 egyenlet) sikeresen alkalmazták
5-pentametil-ciklopentadienil ligandumokat tartalmazó dinukleáris kobalt karbén komplexek 16 előállításánál a formálisan Co=Co kettőskötést tartalmazó Cp*2Co2(CO)2 (Cp* = C5Me5) komplex és diazoalkánok reakciójával [56].
Cp*Co=CoCp* + N2 C R1 R2
C Cp*Co CoCp*
R1 R2
+ N2
R1= R2= H; CH3; CO2Et; R1= H, R2= CO2Et; R1= H, R2= CF3) (Cp* =5-C5Me5;
16
C CO
O C C
O O
(1.35)
Co2(CO)6(dppm) (dppm = bisz-difenil-foszfanometán, Ph2PCH2PPh2) reakciója diazometánnal vagy etil-diazoacetáttal a (17-20) stabilis -metilén komplexekhez vezet (1.36-1.39 egyenlet). Különböző hőmérsékleteken készített NMR spektrumok alapján megfigyelték a (18) komplexben lévő híd helyzetű -metilének terminális metilénekké való egyensúlyi átalakulását (1.40 egyenlet) [57].


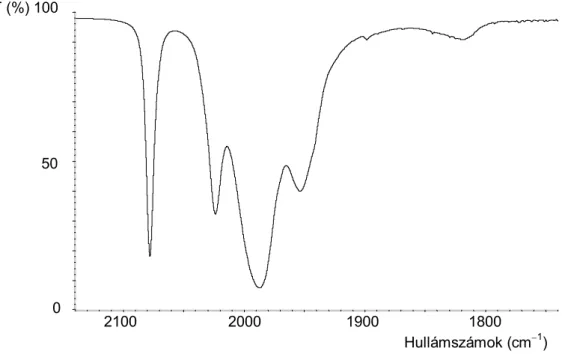
![2.13. táblázat. A Co 2 (CO) 6 (CHCO 2 Et) 2 (2), CO, és etanol kezdeti koncentrációinak hatása a kezdeti dietil-malonát képződés sebességére (r 2 DEM ) és a számított sebességi állandó (k 2 DEM = r 2 DEM /[2] 0 [CO]) a Co 2 (CO) 6 (CHCO 2 Et) 2 +](https://thumb-eu.123doks.com/thumbv2/9dokorg/873396.46989/71.892.108.797.663.1125/táblázat-koncentrációinak-malonát-képződés-sebességére-számított-sebességi-állandó.webp)

![ábra tanúsága szerint az 5 komplex [Co(CO) 3 (PPh 3 ) 2 ] + kation részéhez rendelhető 2010 cm 1 hullámszámú sáv több mint két órán keresztül változatlan az infravörös spektrumban](https://thumb-eu.123doks.com/thumbv2/9dokorg/873396.46989/90.892.100.791.78.583/tanúsága-komplex-részéhez-rendelhető-hullámszámú-változatlan-infravörös-spektrumban.webp)