Kozma Péter
Interferometrikus
optikai hullámvezető bioszenzor jelölésmentes érzékeléshez
- Doktori (PhD) értekezés -
Pannon Egyetem – Molekuláris- és Nanotechnológiák Doktori Iskola
1valamint
Magyar Tudományos Akadémia Mű szaki Fizikai és Anyagtudományi Kutatóintézete
2Témavezető k:
Dr. Horváth Róbert
2és Dr. Petrik Péter
2Budapest, 2011.
Interferometrikus optikai hullámvezetőbioszenzor jelölésmentes érzékeléshez
- Értekezés doktori (PhD) fokozat elnyerése érdekében -
Írta:
Kozma Péter
Készült a Pannon Egyetem – Molekuláris- és Nanotechnológiák Doktori Iskolájában Témavezetők: Dr. Horváth Róbert és Dr. Petrik Péter
Az értekezést témavezetőként elfogadásra javaslom:
Dr. Horváth Róbert: igen / nem ………..
(aláírás)
Dr. Petrik Péter: igen / nem ………..
(aláírás)
A jelölt a doktori szigorlaton ……… %-ot ért el.
Az értekezést bírálóként elfogadásra javaslom:
Bíráló neve: ………. igen / nem ………..
(aláírás)
Bíráló neve: ………. igen / nem ………
(aláírás)
A jelölt az értekezés nyilvános vitáján ……… %-ot ért el.
………
A Bíráló Bizottság elnöke
A doktori (PhD) oklevél minősítése ………
………
Az EDT elnöke Veszprém,………..
Elő szó
Az „Interferometrikus optikai hullámvezetőbioszenzor jelölésmentes érzékeléshez” című doktori értekezés alapjául szolgáló kutatásokat, mint a Pannon Egyetem Molekuláris- és Nanotechnológiák Doktori Iskolájának állami ösztöndíjas diákja a Magyar Tudományos Akadémia Műszaki Fizikai és Anyagtudományi Kutatóintézetének Nanotechnológia, Optika és Fotonika laboratóriumaiban végeztem. Hálásan köszönöm mindkét intézet, s a Magyar Állam támogatását, mely nélkül e munka nem születhetett volna meg.
A fent megnevezett intézményekben fejlesztés alatt áll a flagelláris filamentum felismerő elemeket alkalmazó, kisméretű, jelölésmentes optikai hullámvezetőbioszenzor, az ún.
rácscsatolt interferométer jelátalakító. Ezzel az eszközzel reményeink szerint pár év múlva költséghatékony módon, akár laboratóriumi körülményeken kívül is, kiemelkedő érzékenységgel, specifikusan detektálhatunk majd különféle célmolekulákat. Doktori munkám során ezen interdiszciplináris kutatás módszer- és műszerfejlesztéssel kapcsolatos, eddig felmerült kérdéseire próbáltam egy-egy megoldást találni. Eredményeimet e disszertációban foglalom össze.
Mivel a fenti kutatás több párhuzamos fejlesztési eredmény együtteséből áll majd össze egyetlen egésszé, – melyekkel több intézmény kutatóinak egyidőben kell előrehaladniuk – a világos mondanivaló háttérbe szorítása nélkül e disszertáció sem tárgyalhatja e párhuzamos szálakat egyetlen egységként. Következésképp a dolgozat felépítése is kénytelen kissé eltérni a hagyományos tárgyalásmódtól. Az olvasó tehát joggal érezheti úgy, hogy rendre váltják egymást a bevezetéshez, az anyagok és módszerek, eredmények és az eredmények megvitatása alfejezetekhez illőrészek. Ám, ha úgy fogja kezébe e munkát, hogy az érdemi, 6- os, 7-8-as és 9-es fejezeteket, mint önálló egységeket olvassa, a megszokott didaktikai rend megváltozása miatt szerkezetében kevésbé hagyománytisztelőnek tűnődolgozat talán könnyebben megmutatja a maga sajátos rendszerét.
Tartalomjegyzék
Előszó 4
Tartalomjegyzék 5
1. Bevezetés 7
2. A doktori munkát motiváló tényezők 9
3. A dolgozat rövid kivonata három nyelven 10
3.1. Kivonat 10
3.2. Abstract 10
3.3. Zusammenfassung 11
4. A disszertációban használatos fontosabb jelölések 12
5. Bioérzékelés alapjai 13
5. 1. Jelölésmentes bioérzékelők felismerőelemei 13
5. 1. 1. Receptorok 14
5. 1. 2. Enzimek 14
5. 1. 3. Antitestek 15
5. 1. 4. Nukleinsavak 15
5. 1. 5. Flagelláris filamentumok 16
5. 2. Jelölésmentes érzékelők jelátalakítói 19
5. 2. 1. Tömegérzékeny jelátalakítók 19
5. 2. 2. Hőmennyiségmérőjelátalakítók 21
5. 2. 3. Elektrokémiai jelátalakítók 21
5. 2. 4. Optikai jelátalakítók 22
6. Flagelláris filamentum alapú érzékelőrétegek minősítése 28
6. 1. Ex situ felületanalízis 29
6. 1. 1. Mintakészítés 30
6. 1. 2. Modellalkotás és spektrum kiértékelés 32
6. 2. In situ felületanalízis 38
6. 2. 1. Előkészületek az in situ kísérletekhez 39
6. 2. 2. In situ kísérletek 43
6. 2. 3. A fehérjeréteg szerkezetanalízise – egy lehetséges megoldás 48
6. 3. Összefoglalás és kitekintés 53
7. Rácscsatolt interferométer - refraktometria 55
7. 1. Az elsőmérési összeállítás 57
7. 2. Integrált optikai egység 59
7. 3. Folyadékkristály modulátor 60
7. 4. A szenzorműködés elve 61
7. 5. A mérés menete 62
7. 6. Az első, működést igazoló kísérletek 63
7. 7. Összegzés 66
8. Rácscsatolt interferométer bioszenzorikai kísérletekhez 67
8. 1. A válaszjel kiértékelés új formája 67
8. 2. A valós idejűvezérlőés kiértékelőalgoritmus 72
8. 3. A zaj hatásának csökkentése referencia alkalmazásával 74 8. 4. Nagy felbontású kísérletek rácscsatolt interferométerrel 76 8. 4. 1. Refraktometria és fehérje adszorpció vizsgálat 76 8. 4. 2. Felismerőelem - célmolekula típusú érzékelés 80
8. 5. Összegezés és kitekintés 84
9. Rácscsatolt interferométer - spektroszkópiai ellipszométer kombinált összeállítás 85
9. 1. A mérési összeállítás 86
9. 2. Az elsőmérési eredmény 88
9. 3. Összegzés és kitekintés 90
10. Összefoglalás 92
11. Tézispontok – Conclusions 93
12. Köszönetnyilvánítás 100
13. Függelék - Fényterjedés közegben és közeghatáron 101
13. 1. Síkhullámok homogén közegben 101
13. 2. Interferencia 103
13. 3. Síkhullámok közegek határán 104
13. 4. Az ellipszometria 106
13. 4. 1. Az ellipszometriai modellek alapjai 108
13. 4. 2. Fontosabb ellipszometriai rétegmodellek 112
13. 5. Hullámvezetés izotróp közegben 113
13. 6. Nematikus folyadékkristály modulátor 119
14. Irodalomjegyzék 123
1. Bevezetés
A nanotechnológia területén az évtized egyik főkutatási iránya olyan érzékelők, érzékelő- rendszerek megalkotása és fejlesztése, melyek képesek mind nagyobb és nagyobb érzékenységgel, gyors és költséghatékony módon detektálni akár kisebb molekulák, sőt akár önálló atomok valamilyen felismerőelemhez történőkötődését is. Az ilyen irányú törekvések eredményeit főként a gyógyszerkutatásban hasznosítják, ahol fontos szerepet töltenek be a molekuláris kölcsönhatások kutatásában, mint például a gyógyszer, toxicitás és hatékonyság vizsgálatok [1, 2], új orvos-diagnosztikai és terápiás eljárások fejlesztése [3, 4] területén. Az orvosi, biológiai kutatásokon túl az igazságügy (drog, dopping vizsgálatok, stb.) és az ipar (víz- és ételminőség ellenőrzés, stb.) is széles körben alkalmaz ilyen eszközöket [5, 6]. Ezek a vizsgálatok jellemzően rendkívül parányi, 500 Da-nál kisebb molekulatömeggel rendelkező,
~ pg/ml (esetenként ~ fg/ml) koncentrációban jelen lévőcélmolekulák érzékeny és specifikus kimutatását kívánják olyan oldatokban, ahol egy időben és nagy mennyiségben más molekulák is megtalálhatók [7].
Napjainkban a felismerőelem - célmolekula típusú kísérleteket többnyire úgy végezik, hogy a vizsgálandó molekulákat radioaktív, fluoreszcens vagy mágnesezhetőanyagokkal megjelölik, majd a megfelelőeljárással a jelölők által szolgáltatott jelet keresik a vizsgált térfogatban vagy felületen [2, 8]. Az ilyen eljárásokkal érhetőel ma a legnagyobb érzékenység, hiszen a jelölőt követve akár egyetlen apró molekula bekötődése is megfigyelhető. E kétségtelen előnyük mellett azonban számos hátránnyal rendelkeznek. A detektálandó molekulák megjelölése nem csupán rendkívül idő-, laboratórium- és költségigényes, de maga a jelölés is kihatással lehet a vizsgált folyamat mérési eredményeire [1]. Ennek okán az ilyen irányú kutatások az elmúlt években mind inkább a jelölésmentes alkalmazások felé fordultak.
A legígéretesebb jelölésmentes mérési eljárások, ún. jelátalakítók közé tartoznak az optikai hullámvezetőalapú érzékelők, melyek kihasználva a fény határfelületről való teljes visszaverődés képességét, a terjedőmódus ún. evaneszcens mezejének segítségével vizsgálják a hullámvezetőréteg felültén végbemenőfolyamatokat [9, 10, 11]. Ilyen eszközök alkalmazásával oldatok törésmutatójának (kivitelezéstől függően) ötödik - hatodik - hetedik tizedesjegyében történőváltozása detektálható, illetve az érzékelőfelületre leválasztott fehérjerétegek vastagsága akár nanométer alatti pontossággal meghatározható [7, 12, 13, 14, 15, 16]. Indokolt tehát a felismerőelemeket hullámvezetőstruktúrákra, chipekre rögzíteni.
Ekkor lehetőség nyílik arra, hogy az általuk megkötött célmolekulák nem csupán kvalitatív,
hanem kvantitatív analízise is megvalósítható legyen. A szenzorchipet folyadékcellával felszerelt mérőkészülékbe helyezve in situ(latin, folyamat közben) és valós időben mérhetjük a célmolekulák kötődését [10, 11, 12, 17]. További előnye a látható tartománybeli optikai módszerek alkalmazásának, hogy az ilyen típusú folyamatokat nagy érzékenységgel követhetjük anélkül, hogy a vizsgált rendszer bármiféle károsodást szenvedne, illetve, hogy jelentékeny módon beavatkoznánk a kísérlet menetébe.
2. A doktori munkát motiváló tényező k
Számos, különféle elven alapuló bioérzékelővált mára hatékony és új eredményekre mutató mérési eljárássá, azonban egyedi hibáikon kívül, főés közös hátrányuk a magas piaci áruk. A jövőbioérzékelőinek azonban költséghatékony módon kell biztosítaniuk a lehetőséget arra, hogy akár analitikai laboratóriumokon kívül is, gyors és megbízható méréseket végezhessünk.
A felismerőelemek és jelátalakítók fejlesztői számára a jelen kihívása, hogy e célt megvalósítsák.
A veszprémi Pannon Egyetemen (PE) folyó kutatások közül a legígéretesebbek közé tartoznak a Nanotechnológia tanszék, Prof. Vonderviszt Ferenc csoportjának azon kísérletei, melyek módosított baktérium ostorok, ún. flagelláris filamentumok felismerőelemekként történőalkalmazását célozzák. Bíztató eredményeik alapján várható, hogy hamarosan olyan in vivo (latin, az élőszervezetben) sokszorosítható, mutáns filamentumokat hozzanak létre, melyekkel specifikus, jó hatásfokú és olcsó detektálás valósítható meg.
E kísérletekkel párhuzamosan, az egyetemmel munkakapcsolatban álló Műszaki Fizikai és Anyagtudományi Kutatóintézet (MFA) Fotonika osztályán végezett kutatások – az ún. vad (módosítatlan, detektálásra még képtelen) flagelláris filamentumok felhasználásával – a közeli jövőben megvalósításra kerülőfelismerőelemek megfelelőjelátalakítóba történőintegrálását készítik elő. Az ilyen irányú fejlesztések alapvetően két részre, módszer- és műszerfejlesztési egységekre bonthatók.
Az előbbi esetében nem csupán a felismerőelemek érzékelőfelületére történőrögzítésének technikáját kell megoldani, hanem egy olyan mérési eljárást is ki kell fejleszteni, mellyel a felületre leválasztott fehérjeréteg minősége, opto-geometriai tulajdonságai meghatározhatók, illetve ellenőrizhetők. Egy ilyen eljárás kifejlesztése a minőségi bioérzékelők gyártásának egyik kulcsa.
A sikeresen előállított flagelláris filamentum felismerőelemek kisebb molekulák, vagy akár atomok jelenlétét detektálják majd a kívánt oldatban. Az ilyen apró célmolekulák bekötődése csupán a legérzékenyebb mérési eljárásokkal követhetők nyomon. Az e célra legalkalmasabbnak ígérkezőhullámvezetőalapú módszerek közül, számos előnye miatt, az MFA és a PE közös nanoszenzorikai laboratóriumában fejlesztés alatt álló rácscsatolt interferométerre esett a választás, hogy az érzékelőfelületére immobilizált flagelláris filamentum felismerőelemekkel korszerű, költséghatékony és nagy érzékenységűdetektálást valósítson majd meg.
3. A dolgozat rövid kivonata három nyelven
3.1. Kivonat
Interferometrikus optikai hullámvezetőbioszenzor jelölésmentes érzékeléshez
Doktori munkám elsőrészében javaslatot teszek egy gyors, érzékeny, roncsolásmentes és költséghatékony optikai eljárás, a spektroszkópiai ellipszometria alkalmazására, mellyel az összetett rétegszerkezetű hordozókra leválasztott flagelláris filamentum rétegek opto- geometriai paraméterei meghatározhatók. Folyadékcellás kísérletekkel bemutatom, hogy a mérési módszer jól használható e fehérjék felületre történőleválasztásának in situ és valós idejű nyomon követésére, sőt minősítésére is. Megmutatom, hogy spektroszkópiai ellipszométerrel a fehérjeréteg tömegsűrűségének mélységbeli eloszlása is meghatározható, melynek alapján a filamentumokból felépülőréteg háromdimenziós struktúrája kutatható.
Doktori munkám második részében, egy olyan jelölésmentes, optikai érzékelő, ún. rácscsatolt interferométer (ang. Grating Coupled Interferometer – GCI) jelátalakító prototípus megépítéséről és fejlesztéséről számolok be, mely egyszerűés olcsó optikai elemeket alkalmazva minden tekintetben felveszi a versenyt napjaink csúcskészülékeivel. Egyszerre érvényesíti az interferometria-alapú hullámvezetőmódszerek által biztosított tág mérési tartományokon belüli rendkívüli érzékenységet [18, 19, 20, 21, 22] a rácscsatolók egyszerűségével [9]. Mivel mozgó alkatrészeket nem tartalmaz, potenciális lehetőséget biztosít kézi-műszer gyártásra, továbbá más eljárásokkal való összeházasításra. Amennyiben a készülék érzékelőfelületét felismerőelemekkel látjuk el, kitűnően alkalmazható akár bioszenzorikai kutatásokra is.
3.2. Abstract
Optical Waveguide Interferometer for label-free Biosensing
In the first part of the present thesis, a fast, sensitive, non-destructive and cost-effective optical method, the spectroscopic ellipsometry (SE) is proposed for the characterization of the opto-geometrical parameters of the flagellar filament protein layers deposited on complex multilayer substrates. By introducing a flow-cell, SE can be successfully applied for in situ and real quantitative monitoring of the protein deposition from aqueous solutions. It is also demonstrated that SE is able to reveal the in-depth mass density profile of the protein layers.
Based on the obtained in-depth information, the three-dimensional structure of the filamentous layer can be investigated.
The second part of the thesis deals with the development of the Grating Coupled Interferometer (GCI) label-free optical sensor prototype, built of simple and low-cost components. Combining the wide measurement range and the excellent sensitivity of the interferometry based waveguide methods [18, 19, 20, 21, 22] with the simplicity of grating couplers [9] the device has become a competitor of today's top biosensor devices. Since this instrument does not contain any moving parts, it is a promising candidate for being used in handheld sensing devices. Moreover, it has a great potential in easy combination with other methods. Functionalizing the sensor surface of GCI with appropriate recognition elements the device can be excellently applied in biosensoric research, as well.
3.3. Zusammenfassung
Interferometrischer Biosensor basierend auf optischem Wellenleiter zur Detektion ohne Marker Im ersten Teil der vorliegenden Doktorarbeit wird ein schnelles, sensitives, zerstörungsfreies und kostenwirksames Verfahren, die Spektroskopische Ellipsometrie vorgeschlagen, mit deren Hilfe die optischen und geometrischen Parameter der Flagellin-Faserproteinen, die auf ein Substrat mit komplexer Schichtstruktur abgeschieden werden, bestimmt werden können.
Anhand von Experimenten mit einer Durchflusszelle wird gezeigt, dass diese Methode gut geeignet ist, um in situ und echtzeitig die Proteinablagerung auf der Oberfläche zu verfolgen und zu bewerten. Außerdem wird gezeigt, dass mit dem Spektoskopischen Ellipsometer das Tiefenprofil der Proteinenschichten gemessen werden kann, anhand dessen die dreidimensionale Oberflächenstruktur der Faserschichten erforscht werden kann.
Im zweiten Teil der Arbeit wird zur markierungsfreien optischen Detektion die Entwicklung eines Prototyps eines so genannten Gitterkoppler-Interferometers (eng. Grating Coupled Interferometer - GCI) gezeigt, welcher aus einfachen und günstigen optischen Elementen aufgebaut ist. Dank der Kombination eines grossen Messbereichs und der hervorragenden Empfindlichkeit der Interferometrie-basierten Wellenleitermethoden [18, 19, 20, 21, 22] mit der Einfachheit der Gitterkoppler [9] vermag GCI in jeder Hinsicht im Wettbewerb heutiger Spitzengeräte mitzuhalten. Da er keine beweglichen Teile enthält, ist das Prinzip hervorragend für die Herstellung tragbarer Geräte oder die Integration in andere Messverfahren geeignet. Durch die Funktionalisierung der Oberfläche mit spezifischen Erkennungsmolekülen findet der Sensor eine Anwendung in den biophysikalischen Forschungen.
4. A disszertációban használatos fontosabb jelölések
t időkoordináta
τ időállandó
r(x,y,z) helyvektor
E(r,t) elektromos térerősség
B(r,t) mágneses indukció
D(r,t) elektromos eltolás
H(r,t) mágneses térerősség
n törésmutató
no ordinárius törésmutató
ne extraordinárius törésmutató
N effektív törésmutató
ε permittivitás
μ permeabilitás
k hullámszám
λ hullámhossz
ω körfrekvencia
c fénysebesség
φ,Φ fázis
ΔΦ(t,t0) relatív fázistolás
A amplitúdó
I intenzitás
d vastagság
(r,t) elfordulás szöge
α orientációs szög
∆, Ψ ellipszometriai szögek
κ rugalmassági együttható
γ forgási viszkozitás
m módus száma
Γ tömegsűrűség
l, L hosszúság
σ szórás
S érzékenység
FF flagelláris filamentum
GA glutáraldehid
APTES 3-aminopropil-trietoxi-szilán
PBS foszfát puffer
SE spektroszkópiai ellipszométer
GCI rácscsatolt interferométer
OWLS optikai hullámvezető
fénymódus spektroszkóp
DPI dupla polarizációs interferométer
SPR felületi plazmon
rezonancia spektroszkóp
AFM atomerőmikroszkóp
SEM pásztázó elektronmikroszkóp
5. Bioérzékelés alapjai
1967-ben Updike és Hicks megalkotta az elsőbioérzékelőt [23]. Azóta már számos hasonló eszköz látott napvilágot [4], fejlesztésük azonban mind egyre nagyobb erőkkel zajlik. Méretük és áruk csökkentése, valamint érzékenységük, stabilitásuk és specifikusságuk növelése újabb és újabb kihívásokat jelentenek a kutatók és az ipar számára. Parányi, olcsó és megbízható eszközök piaci érvényesítése a fejlesztők vágyálma, melyeknek az élet legkülönfélébb területein történő alkalmazása megkönnyítik komfortérzetünket. Gondoljunk csak a vércukorszint ellenőrzőkészülékekre, melyek a cukorbetegek biztonságos inzulinadagolását segítik [4].
A bioérzékelőegyik lehetséges meghatározását Turner adta, aki a következőképpen fogalmazott: „A bioérzékelőkompakt analitikai eszköz vagy egység, melyben biológiai vagy biológiai útón előállított érzékeny felismerőelemet integrálnak fizikai-kémiai jelátalakítóba.”
[24] Turner definícióját a 5.-1. ábra szemlélteti, bővebb kifejtése a következőalfejezetekben olvasható.
5.-1. ábra: A bioérzékelők összefoglaló jellegűvázlata: a vizsgálandó célmolekulát a felismerőelem érzékeli, majd e hatást a jelátalakító erősített jellé formálja [4].
5. 1. Jelölésmentes bioérzékelők felismerőelemei
A molekuláris felismerés az egyik lényegi kutatási iránya a biológiai érzékelés fejlődésének.
A felismerőelemeket többnyire még élőszervezetekből nyerik ki, azonban napjainkra már gyakori a laboratóriumi úton előállított ún. szintetikus elemek használata is. Alkalmazva a modern biotechnológia nyújtotta lehetőségeket, ma már tetszőleges DNS szekvenciákat is szintetizálhatunk, megnyitva ezzel a kaput olyan felismerőelemek megalkotása és így olyan célmolekulák detektálása felé, melyekre nincs példa a természetben.
A következőáttekintés csupán a legfontosabb és legígéretesebb természetes és mesterséges felismerőelemek (receptorok, antitestek, enzimek, nukleinsavak és flagelláris filametumok) rövid bemutatására szorítkozik, a pontos részletekre nem tér ki. Ezek részletgazdag kiegészítése a szövegben megjelölt referenciákban található.
5. 1. 1. Receptorok
A receptorok (latin, felfogó szerv) ígéretes felismerőelemek, hiszen a természetben betöltött szerepük is részben a specifikus azonosítás. Különféle méreganyagok és hatóanyagok természetes célpontjai évmilliárdok óta. Mint közvetítő transzmembrán fehérjék a célmolekula megkötését valamilyen biológiai jelátvitel segítségével továbbítják a gazdasejtjüknek a sejt felületéről a sejtmembránon át a sejt megfelelőrészébe. A ligandum bekötődése a receptor konformációváltozását eredményezi, mely további csatolt eseménylánc következményeként kiváltja a megfelelő sejtválaszt (pl.: sejtmembrán csatornák nyitása/zárása, sejtműködés-változás) [25, 26].
A receptor preparátumok nagy lingandum specificitásuk és affinitásuk miatt vonzó felismerő elemek, hátrányuk azonban, hogy kevésbé stabilak, valamint labor- és költségigényes tisztítási folyamatokkal izolálhatók csupán a sejtmembránból. Rekombináns technikák alkalmazásával e hátrány enyhíthető. Mivel az ilyen receptor - ligandum jellegűfelismerés esetén semmilyen jelerősítőhatásról nem beszélhetünk csak a legérzékenyebb jelátalakítók segítségével detektálhatók az ilyen események [27].
5. 1. 2. Enzimek
Az enzimek szintén gyakran használt felismerőelemek a bioszenzorikai kutatásokban.
Esetükben is, hasonlóan a receptorokhoz, a természetbeni szerepüket használják ki a célmolekulák érzékelésére. Az enzimfehérjék ún. aktív centrumain katalizált, az enzimekre jellemzőkémiai folyamatokhoz szükséges vegyületek, ún.szubsztrát-ok specifikus megkötése és ezek reakciótermékekké, ún. produktum-okká alakítása adja az érzékelés alapját. A keletkezőproduktumok számát mérve ugyanis választ kaphatunk a detektálni kívánt célmolekulák (esetünkben a szubsztrátok) jelenlétére és azok mennyiségére.
Az alloszterikus enzimek egy vagy több olyan szabályzó szerkezeti egységgel rendelkeznek, melyekre az ún. effektor-ok bekötődésükkel hatnak. A bekötődés szerkezeti változásokra kényszeríti az enzimfehérjét, mely következtében alkalmassá, illetve alkalmatlanná válik az általa katalizált folyamat elvégzésére. Az ilyen hatásokat rendre alloszterikus aktivitásnak,
illetve alloszterikus gátlásnak nevezzük. Amennyiben a detektálandó célmolekula az effektor, az alloszterikus kötőhely és az aktív centrum együtt jelátalakítóval és jelerősítővel ellátott bioérzékelőt alkotnak. A mérendőjel az előállított produktum mennyisége [28].
Az ilyen enzim felismerőelemek hátránya, hogy bonyolult, több doménes, több alkotóelemes szerkezetük miatt nehezebben előállíthatóak. Továbbá, hogy a szubsztrát folytonos produktummá történőkatalízise csökkenti a szubsztrát koncentrációt, mely hatással van a katalízis sebességére, ez pedig megzavarja a valós idejűméréseket. Még annak ellenére is, hogy a világpiacot uraló glükóz szenzor enzim katalízis elven működik, ideálisnak mégsem az ilyen jellegűdetektálást tekintjük [4].
5. 1. 3. Antitestek
Az enzim alapú glükóz szenzor kivételével a gyors mérőrendszerek napjainkban főként antitesteket használnak felismerőelemekként a célmolekulák azonosítására és mennyiségi analízisére. Az antitestek népszerűsége 1984-től eredeztethető, mikor Kohler és Milstein javasolt egy később Nobel-díjjal jutalmazott eljárást, mely segítségével már monoklonáris antitestek is nagy mennyiségben izolálhatóak. Az antitest felismerőelemeket tartalmazó bioérzékelők a rendkívül érzékeny és specifikus a biomolekuláris antitest - antigén kölcsönhatásra építenek. Mára már könnyebben előállítható, olcsóbb rekombináns antitestek is elérhetőek, melyek genetikailag, a célmolekulának megfelelően módosított antigén kötőhellyel rendelkeznek [29]. Jelerősítés például ELISA (enzyme-linked immunosorbent assay) és IPCR (immuno-polymerase chain reaction) technikákkal valósítható meg [30].
5. 1. 4. Nukleinsavak
Tetszőleges szekvenciájú RNS (ribonukleinsav), illetve egyszálú DNS (dezoxiribonukleinsav) láncokat is használhatunk komplementereik hibridizációval történődetektálására. Ilyen felismerőelemeket alkalmaznak például a világon mára már széles körben elterjedt PCR és IPCR vizsgálatok. Továbbá a jövőben valószínűleg fontos szerepet játszanak majd a gyors, megbízható és költséghatékony DNS szekvenálás, illetve diagnosztika területén is [2, 8, 30, 31]. Kémiailag rendkívül stabilak, a nukleázoknak azonban csak módosított fehérje vázzal rendelkezőnukleinsav (ang.peptid nukleid acid - PNA) változataik állnak ellen [32].
A jövőtalán legígéretesebb felismerőelemei a néhány tíz bázishosszúságú ún. aptamer oligonukleotidok, melyek tipikusan 1015 - 1016 elemszámú RNS, módosított RNS, egyszálú DNS, illetve módosított egyszálú DNS könyvtárakból irányított evolúció elvűSELEX
(systematic evolution of ligands by exponential enrichment) eljárással izolálhatóak és szaporíthatóak in vitro [33]. E mesterségesen előállított RNS vagy egyszálú DNS származékok két végén található állandó szekvencia közötti szakasz módosítható mindaddig, míg a kapott aptamer nagy affinitással és specificitással nem köt a kívánt célmolekulához. A felismerés hatékonyságát a célmolekulák színes palettáján a variációk hatalmas száma biztosítja. Nem komplementer nukleinsav típusú detektálás esetén is képes a ligandumot specifikusan megkötni annak térszerkezeti sajátosságai alapján [4]. Alkalmas jelöltjei analitikai és diagnosztikai alkalmazásoknak [34]. Számos előnyük közül néhány, hogy minimális méretűek, így könnyen reprodukálhatók és költséghatékony módon állíthatók elő, valamint végeik állandó szekvenciáinak révén könnyen immobilizálhatók. A célmolekula kötődés hatására jelentős mértékűkonformáció-változáson mennek keresztül, mely nem csupán megkönnyíti, de új lehetőségeket is nyit a jelátalakításra [35].
5. 1. 5. Flagelláris filamentumok
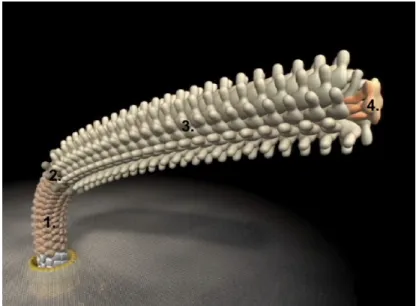
A baktériumok mozgásszervei aflagellumok, melyek sejten kívüli részei az 5 - 20 mikrométer hosszúságú, 20 - 25 nanométer átmérőjű, fehérje alegységekből felépülőflagelláris filamentumok [36]. (5.1.5.-1.a. ábra) Minden egyes filamentumot egy-egy, a sejtmembránban található, 50 nanométer széles olyan forgómotor hajt (5.1.5.-1.b. ábra), mely fordulatszáma egyes fajoknál elérheti a hihetetlenül nagy, akár kilencvenezres percenkénti fordulatot is [37, 38]. A forgatáshoz szükséges energiát a sejtmembrán két oldala közötti protongradiens biztosítja, csak úgy, mint számos más biokémiai folyamat esetén.
A flagelláris filamentumok a 5.1.5.-2. ábrán látható módon több tízezer flagellin fehérjéből
a.) b.)
5.1.5.-1. ábra: a.) A baktérium sejtmembránjából kinyúló helikális propellerré szerveződött filamentumok b.) a filamentumot hajtó forgómotor sematikus rajza [36].
felépülőtubuláris struktúrák. Ezek, a sejtmembránba ágyazott motorokhoz görbült szerkezetű, azonos fehérje alegységekből felépülőún. kampók segítségével kapcsolódnak, melyek lehetővé teszik, hogy a filamentumok ne a motor tengelye által meghatározott, hanem a haladó mozgás szempontjából optimális forgástengely mentén foroghassanak [39]. E kampót a fehérjeszállal ún. HAP1 és HAP3 fehérjék rögzítik egymáshoz.
A motor tengelyét felépítőötféle fehérjét, valamint a kampófehérjét, a flagellint és a HAP fehérjéket együttesen axiális fehérjéknek nevezzük. Ezek a citoplazmában szintetizálódnak, majd a filamentum tubuláris szerkezetéből adódó csatornán keresztül jutnak el beépülési helyükre, a filamentumok végére [39]. Itt az ún. HAP2 sapka szabályozza az érkező alegységek kapcsolódását, valamint ez védi a filamentumot az esetleges depolimerizációtól is.
A Salmonella typhimurium törzsből preparált filamentumok és az ezeket felépítőflagellin alegységek szerkezetét röntgendiffrakciós és elektronmikroszkópos analízissel határozták meg. Kiderült, hogy a flagellinek négy lineárisan kapcsolódó doménből állnak, ezeket D0,
5.1.5.-2. ábra: A flagelláris filamentum felépítése: 1. Kampó 2. HAP1, HAP3 3. Flagellin alegységek 4. HAP2 sapka [36].
D1, D2, D3-mal jelölték. (5.1.5.-3.a. ábra) Továbbá, arra is fény derült, hogy körbejárva az ilyen filamentumokat 11 flagellin alegységet számolhatunk össze, melyek kölcsönhatva egymással koncentrikus szerkezetet alakítanak ki a szál hossztengelye körül [36, 38, 39]
(5.1.5.-3.b. ábra). Az axiális irányban egymás felett elhelyezkedőalegységek N- és C- terminális régiói egymásba fonódó kötegeket képezve felépítik a 5.1.5.-3.c. ábrán piros színnel kihangsúlyozott, ún. protofilamentumot. Egy híján egy tucat ilyen protofilamentum együttese adja a filamentális (tubuláris) szerkezetet [40].
a.) b.) c.)
5.1.5.-3. ábra: a.) A Salmonella typhimuriumból származó flagellinmolekulák atomi szerkezete. b.) Flagelláris filamentumokban e flagellin alegységek koncentrikus c) protofilamentális szerkezetbe rendeződnek, úgy hogy a D0 domének befelé, a D3 domének kifelé néznek [40].
A D3 domének a filamentum felszínén találhatók, így nem vesznek részt a szerkezet kialakításában. Éppen ezért, a D3 domén kiváló célpont génsebészeti beavatkozások számára, hiszen aminosavsorrendje szabadon módosítható anélkül, hogy a flagellin polimerizációs képessége sérülne, illetve a filamentális szerkezet módosulna. Ez a figyelemreméltó tulajdonság teszi különösen alkalmassá a flagellinmolekulákat arra, hogy belőlük – meghatározott célmolekulák hatékony felismerésére és megkötésére képes – mesterséges felismerőelemek legyenek előállíthatók [41]. Ennek tervezett menete a következő: A flagellin D3 doménjének felületén található három hurokrégiót kódoló génszakaszokat fehérjetervezés, célzott mutagenezis és irányított evolúciós eljárásokkal [42] módosítják, majd az így kapott mutáns géneket hordozó baktériumokat tenyésztik. Ezek filamentumait már a módosított felismerőflagellinek alkotják. E mutáns fehérjeszálakat– a sejtekről való leválasztásuk után–
alkalmas mérőchip felületére rögzítik (ld.: 14. 3. fejezet). Mivel már egyetlen filamentumot is több tízezer felismerőflagellin alkot, és ilyen szálakból hatalmas mennyiséget köthetünk ki a jelátalakítók felületére, rendkívüli érzékenységgel bíró szenzorokat gyárthatunk majd.
Megjegyzendő, hogy különbözőfelismerőrégiókkal rendelkezőflagellineket kontrollált módon polimerizáltatva elvileg olyan flagelláris érzékelőszálakat – és így olyan nanochipeket – is létrehozhatunk, amelyek nem csupán egyetlen molekula, hanem akár egy vegyületcsalád felismerésére is képesek.
5. 2. Jelölésmentes érzékelők jelátalakítói
A jelölésmentes bioszenzorokban az érzékelés alapját egy részről a célmolekula és a felismerő elem között létrejövőspecifikus reakció képezi. A felismerés valamilyen fizikai-kémiai változást hoz létre a rendszerben, mely azután egy alkalmas jelátalakító segítségével detektálandó és mérendő. Az előzőfejezetben bemutatott felismerőelemekhez fejlesztett jelátalakítók számos típusa lelhetőfel az irodalomban. Ezeket tömeg-, hőmennyiség-, elektrokémiai- vagy optikai változáson alapuló érzékeléstechnikák csoportjába sorolhatjuk [35, 43]. Terjedelem korlátok miatt, a következőalfejezetekben e csoportokra jellemző alapvető tulajdonságok tárgyalására szorítkozom, csupán a dolgozat szempontjából elengedhetetlenül fontos optikai módszereket részletezem. Az alfejezet végén található 5.2.4.-I. táblázat összegzi napjaink legfejlettebb és legígéretesebb jelátalakítóit megjelölve az egyes eszközökhöz tartozó maximális érzékenységet.
5. 2. 1. Tömegérzékeny jelátalakítók
A tömegérzékeny jelátalakítók definíció szerint olyan fizikai mennyiséget mérnek, mely a felismerőelemek által megkötött célmolekulák össztömegének függvénye. Tipikusan egy rezgésbe hozott rendszer sajátfrekvenciájának elhangolódását követik optikai, piezorezisztív vagy kapacitív módszerekkel [44]. Bár ez a legfiatalabb méréstechnika e fejezetben tárgyaltak között, máris figyelemre méltó mérési érzékenységekről számol be az irodalom [45].
a.) b.)
5.2.1.-1. ábra: a.) A 0,3 mm vastag, 14 mm átmérőjűQCM piezoelektromos jelátalakító egység b.) saját frekvenciája a felületén megkötött célmolekulák össztömegének függvényében megváltozik [46].
A kvarc-kristály mikromérleg (ang.quartz crystal microballance-QCM) eljárás alapvetően a piezoelektromos kvarc kristályoknak arra a tulajdonságára épül, hogy megfelelőfrekvenciájú váltófeszültséget kapcsolva rájuk rezonanciába hozhatók. E rezonanciafrekvencia értéke érzékeny függvénye a kvarckristály tömegének, így a felületére leváló tömeg elhangolja a rendszert [45]. Amennyiben a detektálni kívánt célmolekulának megfelelőfelismerőelemeket az érzékelők felületére csatolják, a felismerőelemek által megkötött célmolekulák száma tömegük ismeretében meghatározható (5.2.1.-1. ábra) [46].
A hasonló elven működőfelületi akusztikus hullámok (ang. surface acoustic waves- SAW) eljárás esetében egy membrán felületén terjedőmódus sebessége változik a felületére levált célmolekulák össztömegének függvényében [47].
Ide sorolhatók még a mikro- és nanomechanikus erőkarok (ang. micro- and nanomechanical cantilevers - MC) is, melyek a megkötött célmolekulák súlyával arányosan néhány nanométert meghajolnak (5.2.1.-2.a. ábra). A meghajlás mértéke optikai, piezorezisztív, kapacitív elven működőeljárásokkal olvasható ki [44]. Dinamikus módban mérve velük, a QCM-hez hasonlóan, a rezonanciafrekvenciájuk hangolódik el. Mivel a mikro- és nanomechanikus erőkarok könnyen tömbbe rendezhetők, nagyszámú párhuzamos mérés végezhetővelük (5.2.1.-2.b. ábra). E nagyszerűtulajdonság a jövőegyik legígéretesebb jelátalakító eljárásává teszi ezeket [2, 44].
a.) b.)
5.2.1.-2. ábra. a.) A tömbbe rendezett rugalmas erőkarok a rájuk rögzített felismerőelemek által megkötött célmolekulák súlya alatt meghajolnak [8]. b.) Pásztázó elektronmikroszkóp felvétel egy kereskedelmi forgalomban már kapható 8 egységes mikromechanikus erőkarról [48].
5. 2. 2. Hőmennyiségmérőjelátalakítók
A jelátalakítók hőmennyiség mérésén alapuló típusa azt az alapvetőtulajdonságát használja ki a kémiai reakcióknak, hogy az ilyen folyamatokat mindig hőváltozás (hőelnyelés vagy hőfejlődés) kíséri. Ennek oka, hogy a reakcióban résztvevőanyagok átalakulása során belső energiájuk megváltozik, majd környezetükkel újra termikus egyensúlyba kerülnek. Egy rendkívül érzékeny hőmennyiségmérővel – általában termisztorral – mérhetjük a felületére immobilizált felismerőelemek célmolekula megkötéskor fejlődőhőt. Egy kísérlet során mért összes hőmennyiség a felismerési reakcióban résztvevőcélmolekulák számával arányos. A jobb érzékenység érdekében érdemes energiaigényes folyamatokat követnünk, ilyenek például az enzim katalizált reakciók [49].
5. 2. 3. Elektrokémiai jelátalakítók
Az elektrokémiai jelátalakítók a megfigyelt rendszer valamely elektromos tulajdonságának időbeli megváltozását követik nyomon. Vizsgálhatják a rendszerben ébredő potenciálkülönbséget (potenciometria), a rajta átfolyó áram mértékét (amperometria) illetve annak vezetőképességét (konduktometria) is [50]. A következőkben mindezekre egy-egy, napjaink kutatásait meghatározó példát olvashatunk.
a.) b.)
5.2.3.-1. ábra: a.) A térvezérlésűtranzisztor alapú nanovezeték vezetőképességét [51] míg b.) a nanopórusok esetén a pórusok átmérőjét, így az átfolyó ionáramot, [52] szabályozzák a felismerőelemek által megkötött célmolekulák.
A töltésérzékeny jelátalakítók vezetőképességét módosíthatja a felismerőelemek által megkötött célmolekulák töltésállapota. Napjaink egyik legígéretesebb, és az irodalomban legtöbbet említett tagja a térvezérlésűtranzisztor (ang. field effect transistor - FET) alapú nanovezeték (ang. nanowire - NW) érzékelők (5.2.3.-1.a. ábra). Nanoméretűkollektorukat és
emitterüket egy néhány nanométer átmérőjűfélvezetőszál köti össze, mely vezetési tulajdonságait töltésük révén, a felületéhez csatolt felismerőelemek által megkötött célmolekulák kapuzzák. A módszer olyan érzékeny, hogy segítségével fehérjéket, DNS szálakat, sőt akár önálló vírusokat is detektálhatunk. Tömbökbe rendezve ezeket nagy teljesítményűanalízist és párhuzamos méréseket is végezhetünk velük [51].
Egy másik nagy erőkkel kutatott és rendkívül ígéretesnek tűnőjelátalakító eljárás a nanopórusokkal (ang. nanopore - NP) való érzékelés. Egy néhány nanométer átmérőjű póruson (csatornán) átfolyó ionáramot a pórus belsejébe kémiai úton csatolt felismerőelem által megkötött célmolekula módosíthatja úgy, hogy térfogatával jelentősen csökkenti a csatorna keresztmetszetét, így az átfolyó áram mértékét is (5.2.3.-1.b. ábra) [52]. Kutatók nagy áttörést remélnek az ún. nanopórus jelátalakítóktól a biológiai érzékelés területén.
Alkalmazásukkal már a legkisebb molekulák detektálhatók, az áhított cél azonban a jelölésmentes szupergyors és olcsó DNS szekvenálás megvalósítása [31].
A korszerű elektrokémiai érzékelés egy harmadik fontos példája az impedancia spektroszkópia (ang. impedance spectroscopy - IS). Működésének alapja, hogy a felismerő elemek redox-aktív csoportjainak egy mérőelektródhoz képesti elhelyezkedése megszabja a rendszer ellenállását [35]. A célmolekulák a váltóárammal hajtott elektródhoz csatolt felismerő elemek konformációját bekötődésükkel megváltoztatják, mely következtében a mért impedancia spektrum (Nyquist-diagram) módosul. Ezen változás nyomon követése a mérés alapja.
5. 2. 4. Optikai jelátalakítók
A jelölésmentes jelátalakítók piaci versenyét tekintve az optikai módszerek lényegesen keresettebbek társaiknál [43]. Ennek oka főként az, hogy ezek a mérési eljárások a fenti módszerek előnyeit költséghatékony módon egyesítik. A célmolekula bekötődési eseményeket kis teljesítményűelektromágneses mezősegítségével roncsolás- és egyéb mellékhatásmentesen azonnal és nagy mintavételezési frekvencia mellett detektálhatjuk. Az ilyen jelátalakítók felületegységre jutó érzékenysége kiemelkedően jó, továbbá könnyebb tömbbe rendezhetőségük révén számos mérés végezhetővelük párhuzamosan [7], valamint érzékelőfelületeik kialakításának technológia igénye relatíve alacsony.
Az optikai jelátalakítók működésének alapja, hogy a magasabb permittivitású célmolekulák bekötődésükkel kiszorítják a jelátalakító felületén elhelyezett felismerőelemeket körülvevő közeg (általában valamilyen puffer oldat) alacsonyabb permittivitású molekuláit, így e fizikai mennyiségek átlagos értékét eltolják a felületközeli rétegben. A permittivitás és a vele arányosságban álló fizikai mennyiségek (a haladó elektromágneses mezőfázissebessége,
polarizációs állapota, a rendszeren áthaladó fény intenzitása, hullámhossza, stb.) a megkötött célmolekulák mennyiségével arányosan változik. (ld.: „13. Függelék – Fényterjedés közegben és közeghatáron”) Az optikai jelátalakítók e különbséget formálják mérhetőjellé [7, 53].
A következőalfejezetek, terjedelmi korlátok miatt, csupán a legismertebb és legsikeresebb, a fény polarizációs állapotának vagy fázissebességének megváltozását mérő optikai jelátalakítók rövid bemutatására összpontosítanak. A megadott hivatkozásokban további részletezőleírást találhat az olvasó.
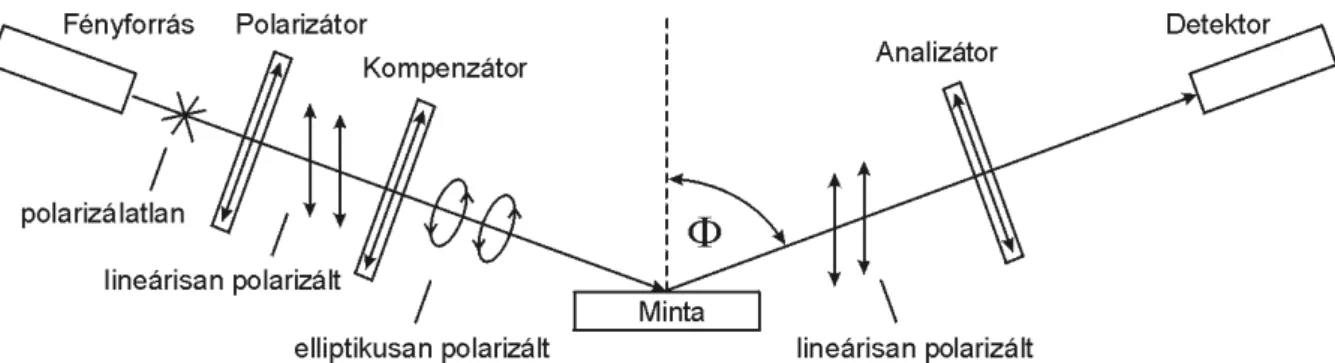
Spektroszkópiai ellipszométer
Az optikai jelátalakítók egyik csoportja a vizsgált, felismerőelemekkel ellátott felületet felülről, lézer, LED, vagy izzólámpa fényével világítja meg, majd a reflektált vagy a transzmittált nyaláb a beesőfénysugárhoz képesti polarizációváltozását méri. (ld.: „13. 4. Az ellipszometria”) E csoport egyik közkedvelt tagja a spektroszkópiai ellipszométer (ang.
spectroscopic ellipsometer - SE). Számos típusa közül a legnépszerűbbek a forgó polarizátoros (RPE), a forgó analizátoros (RAE) és a forgó kompenzátoros (RCE) készülékek [54]. E műszer felépítését tekintve két állítható dőlésszögű, azonos síkban fekvőoptikai karból, egy finoman pozícionálható optikai asztalból, valamint a vezérlőés feldolgozó elektronikai elemekből épül fel. Az optikai karok egyike a fényforrást és a polarizátort, a másik pedig az analizátort és a detektort foglalja magában. A fényforrás prizmával monokromatizált fénye a forgó polarizátoron áthaladva az épp aktuális polarizátor azimutszögnek megfelelősíkban lineárisan polarizálttá válik. Ezt követően a mintára vetődik, ahol is a fény-anyag kölcsönhatás következtében polarizációs állapota megváltozik. (Általában elliptikusan polarizálttá válik.) A mintáról a sugár az analizátorra reflektálódik, ahol az ezen áthaladni képes fényhányad végül bejut a detektorba. (5.2.4.-1.)
5.2.4.-1. ábra: Spektroszkópiai ellipszométer sematikus vázlata a vizsgáló fény megfelelő polarizációs állapotainak megjelölésével.
Mach-Zender interferometéter
Az interferométerek működési elve, hogy a rendszerébe jutó fényt két egymástól független útvonalon juttatja el a detektorig, ahol azokat interferáltatva a két nyaláb– mérőés referencia ágak –fáziskülönbségéről kaphatunk információt. (ld.: „13. 2. Interferencia”) Interferometria alapú, jelölésmentes bioérzékelésre alkalmas eszközök közül mindenképp a legismertebbek közé tartoznak a Mach-Zender interferométer alapú eljárások [55]. Az ilyen műszerek működésének alapja, hogy a mérőágukban haladó fény a kívánt biológiai oldaton, a mintán halad át, miközben a referencia ágban haladóhoz képest fáziseltolódást szenved (5.2.4.-2.a.
ábra). Amennyiben az oldat optikai sűrűsége változik, a detektált interferencia intenzitás is ezzel arányosan módosul.
a.) b.)
5.2.4.-2. ábra: a.) Mach-Zender interferométer b.) Young interferométer működési vázlata [56].
Young interferométer
Számos optikai módszer gyakran kihasználja, hogy szilárd közegben, a teljes visszaverődés következtében csapdában tartott fény az őt fogvatartó közeg környezetével, evaneszcens mezejének segítségével kölcsönhat és az ott végbemenőváltozásokra érzékenyen, fázisának eltolódásával reagál. Mivel az ilyen típusú jelátalakítók érzékelőfelületétől távolodva az evaneszcens mezőintenzitása exponenciálisan csökken (ld.: „13. 5. Hullámvezetés izotróp közegben”), ezért a műszerek tipikusan csupán néhány száz nanométer mélyen képesek
„belelátni” a vizsgált felismerőelem - célmolekula rendszer térfogatába. Ennek okán az ilyen jelátalakítók csakis a közvetlen környezet változását detektálják [7]. Ezen elsőpillantásra hátrányosnak tűnőtulajdonságból szakavatott kezekben előnyt kovácsolnak. Horváth et al.
[57] például megmutatta, hogy a hullámvezető struktúra paramétereinek megfelelő
beállításával az evaneszcens mezőbehatolási mélysége megnövelhető, illetve finoman hangolható sík dielektromos hullámvezetőkben.
A Young interferometerek a következőképpen kombinálják az interferencia és a hullámvezetés nyújtotta lehetőségeket. A hordozó felületén kialakított „Y” alakú hullámvezetőstruktúra a becsatolt fényt két párhuzamosan haladó módusra osztja fel. Az egyik, mint mérőág, az érzékelőfelület alatt elhaladva evaneszcens mezejével „letapogatja”
azt, miközben fázisa a referenciaágban terjedőéhez képest eltolódik. Ezt követően a hullámvezetőstruktúrából, egymás szomszédságában kilépőmódusok interferálnak, majd az általuk létrehozott interferencia mintázatról CCD kamerával készítünk pillanatfelvételeket.
(5.2.4.-2.b. ábra) A szenzorfelületen végbemenőváltozások az alatta terjedőmódus fázisát, így az interferencia mintázat intenzitás minimum és maximum helyeit eltolják, melyből visszakövetkeztethetünk a vizsgált folyamat paramétereire [56].
Dupla polarizációs interferométer
Napjaink vezetőjelölésmentes optikai mérési eljárása, a Young interferometria elvén alapuló dupla polarizációs interferometria (ang. dual polarization interferometry - DPI). Működési elve nagyon hasonló a Young interferométerekéhez, különbséget csupán a hullámvezető struktúra elrendezésében mutat. (5.2.4.-3.a. ábra) A lézer fényforrás síkban polarizált fényét két egymásra rétegzett hordozó - hullámvezetőstruktúra oldalára irányítjuk, és így egyszerre mindkettőbe becsatoljuk. Az alsó hullámvezetőt a felette lévőstruktúra a felületi biológiai rétegben történőváltozásoktól leárnyékolja, így az előbbi referenciaként, utóbbi pedig érzékelőként szolgál. A hullámvezetőszerkezet másik felén kilépőmódusok interferálnak egymással, majd az interferencia mintázatot egy alkalmas CCD detektorral felvesszük. Mivel a felső„érzékelő” hullámvezetőfelszínén végbemenőváltozások a benne terjedőmódus fázisát eltolják, azonban az alsó „referencia” hullámvezetőmódusának fázisa ettől független, az interferencia mintázat minimum és maximum helyei elcsúsznak. E változás mértéke hordozza az információt a vizsgált folyamatról [58].
Optikai hullámvezetőfénymódus spektroszkóp
Az elsőhullámvezetésen alapuló érzékelőt Tiefenthaler és Lukosz mutatta be 1984-ben [59].
Azóta már számos más összeállítás is bizonyította, hogy az integrált optikai sík dielektrikum hullámvezetők kiválóan alkalmasak szenzorikai feladatok ellátására. Ezek közül az egyik legismertebb eljárás, mely hatékonyan használja ki a hullámvezetők kivételes felületérzékenységét, az optikai hullámvezetőfénymódus spektroszkópia (ang. optical
waveguide lightmode spectroscopy - OWLS). Elrendezése a következő: Egy sík hullámvezető struktúrát egy rendkívül finoman forgatható goniométer asztalra helyezünk, majd egy lézerfényforrás fényét polarizáció forgatón keresztül a hullámvezetőn található optikai rácsra irányítjuk. A hullámvezetőkét végére egy-egy fotodiódát illesztünk, s ezek segítségével mérjük a beesési szög függvényében a fényintenzitást. (5.2.4.-3.b. ábra) Annál a beesési szögnél, ahol a fény képes a hullámvezetőbe becsatolni, azaz módust indítani, intenzitáscsúcsot mérünk a detektorokkal. Ez a pozíció azonban a beesőfény hullámhosszán és a rács periódusán túl függ a rétegek opto-geometriai paramétereitől, azaz a rendszer effektív törésmutatójától is. (ld.: „13. 5. Hullámvezetés izotróp közegben”) Amennyiben a fedő, film és hordozó közegek optikai sűrűsége állandónak tekinthető, a felületen fejlődő vékonyrétegben végbemenőváltozás a móduscsúcsok pozíciójának folyamatos mérésével követhető[12].
5.2.4.-3. ábra: a.) A dupla polarizációs interferométer (DPI), b.) az optikai hullámvezető fénymódus spektroszkóp (OWLS) és c.) a Kretschmann-féle felületi plazmon rezonancia spektroszkóp (SPR) berendezések vázlata [1, 58, 60].
Felületi plazmon rezonancia spektroszkóp
A hivatkozásokat és az eladási statisztikákat tekintve minden idők legsikeresebb optikai jelátalakítói a felületi plazmon rezonanciát (ang. surface plasmon resonance - SPR) kihasználó spektroszkópiai berendezések [53]. E műszerek működési elve, hogy egy vékony aranyréteg felületről teljes visszaverődést szenvedőlézerfény evaneszcens mezeje felületi plazmonokat (hideg elektronplazma rezgésének kvázirészecskéi) gerjeszthet a fémréteg felületén. SPR technológia alkalmazása esetén a fémfelületről reflektálódó fény intenzitásának szögfüggését mérik.
A 5.2.4.-3.c. ábrán látható, ún. Kretschmann elrendezésben egy prizmához törésmutató illesztőfolyadékkal egy olyan üveghordozót rögzítenek, mely túlsó felületére előzőleg arany vékonyréteget választottak le. A bioérzékelés folyamata az aranyréteg felületén, folyadékcella alatt megy végbe. A fémrétegre fókuszált és innen visszaverődőfény intenzitása egy adott – a felületi plazmonokat gerjesztő– szögnél leesik, melyből meghatározható a vékonyréteg effektív permittivitása. E fizikai paraméter megváltozása kapcsolatba hozható a bekötődő célmolekulák mennyiségével [1].
5.2.4.-I. táblázat: Legelterjedtebb és legnépszerűbb mérési eljárások érzékenységét összefoglaló táblázat
Eljárás Maximális érzékenység Referencia
Nem optikai jelátalakítók
Kvarc-kristály mikromérleg 5 pg/mm2 [46]
Felületi akusztikus hullámok 3 pg felbontás [61]
Mikromechanikus erőkar* Passzív mód: egyetlen sejt Dinamikus mód: pM DNS
[62]
Nanovezeték* Egyetlen vírus [62]
Nanopórus* Egyetlen DNS [62]
Impedancia spektroszkópia* Oligopeptid konformáció vált. [35]
Optikai jelátalakítók törésmutató tömeg / felület
Spektroszkópiai ellipszométer ~10-4 ~10 pg/mm2 saját mérések
Young interferométer ~10-6 — [56]
Dupla polarizációs interferométer ~10-7 0,1 pg/mm2 [15]
Optikai hullámvezetőfénymódus spektroszkóp ~10-5 10 pg/mm2 [63]
Felületi plazmon rezonancia spektroszkóp ~10-5 ~10 pg/mm2 [64]
* Ezen eljárások egyetlen sejtet, molekulát, vírust, vagy DNS-t képesek detektálni egyetlen jelátalakító szegmensen, azonban ezen szegmensek kicsiny mérete hátrányt jelent bizonyos gyakorlati alkalmazásokban (pl.: komplex oldatok esetén leárnyékolás, nagy diffúziós időa szenzorfelületre).
6. Flagelláris filamentum alapú érzékelő rétegek minő sítése
A spektroszkópiai ellipszometria, mint roncsolásmentes optikai mérési módszer –ahogyan azt a jelen fejezet bemutatja– alkalmas összetett szerkezetűflagelláris filamentum fehérjerétegek nagyérzékenységűminősítésére akár összetett, a hullámvezetőszenzorikában is használatos multiréteg szerkezeteken is. A megfelelőoptikai modell megkonstruálásával folyadékcellában történőleválasztás közben meghatározható a felületen épülőréteg tömegsűrűségének időbeli változása, sőt a modell tökéletesítésével megmérhetőe paraméter mélységbeli eloszlása is.
Kiderül az is, hogy az így kapott információ alapján becslés adható a flagelláris filamentum vékonyrétegek várható háromdimenziós szerkezetére.
Ahogy azt az „5. 1. 5. Flagelláris filamentumok” címűfejezetben már tárgyaltuk, a flagelláris filamentumokat alkotó flagellin alegységek külsőrégiója a filamentáris szerkezet károsítása nélkül módosítható. E régiók fehérjeszerkezetét mesterségesen megváltoztatva a filamentumok alkalmassá tehetők célmolekulák specifikus megkötésére. Mivel ezek mindegyikét több tízezer flagellin alegység alkotja, rendkívüli felületi felismerőelem sűrűséget érhetünk el úgy, ha e fehérjéket a megfelelőimmobilizációs technikával a választott jelátalakító érzékelő-felületéhez rögzítjük. A flagelláris filamentumok alkotta réteg ugyanis nem kétdimenziós jellegű, hanem a vizsgált oldatba több száz nanométer mélyen benyúló, filamentumokkal sűrűn kitöltött statisztikus elrendeződésű, háromdimenziós rendszer (ld.
később). E tulajdonság adja a flagelláris filamentumokkal érzékenyített felületek egyik előnyét a kétdimenziós rétegekkel szemben, hiszen a vizsgált oldat e háromdimenziós szerkezetet térfogatában járhatja át. Hullámvezetőalapú érzékelők ígéretes jelátalakítói az ilyen rendszereknek, tekintve, hogy érzékenységük kiváló, s a felületi réteget vizsgáló evaneszcens mező(ld.: „13. 5. Hullámvezetés izotróp közegben”) karakterisztikus vastagága tág határok között (~ 100 nm-től ~ 1000 nm-ig) hangolható [57, 60], így a filamentáris rétegnek megfelelően optimalizálható. A flagelláris filamentumok előnyös tulajdonsága továbbá, hogy gyorsan és költséghatékony módon termeltethetőek baktériumokkal, melyekről azután a sejtek feltárása nélkül leválaszthatóak. Elkülönítésükhöz nem szükségesek olyan bonyolult tisztítási és szűrési folyamatok, melyek például az antitest felismerőelemek előállítását jellemzik. Fontos előnyös tulajdonságuk – például a mikrotubulus vagy más biopolimer rendszerekkel szemben – a rendkívüli kémiai stabilitásuk. Ennek „évmilliárdos
oka”, hogy a baktériumok olyan ostorokat, azaz flagellumokat fejlesztettek ki, melyek ellenállnak az őket körülvevőkörnyezet szélsőséges viszonyainak is.
Megbízható, gyakorlatban jól használható bioszenzorok előállításának egyik fontos kritériuma, hogy ellenőrzött módon, jó minőségűfelismerőelem vékonyrétegeket hozzunk létre a jelátalakító érzékelőfelületén. Egyedi, ismeretlen minőségűrétegek ugyanis, csak kvalitatív mérésekre alkalmasak, mennyiségi meghatározásra biztosan használhatatlanok.
Kiváltképp így van ez az egyszer használatos érzékelőrétegek esetén. Ott ugyanis még az a lehetőségünk sincsen meg, hogy kalibráljuk ezeket. Rendkívül fontos tehát, egy olyan eljárást kifejlesztenünk, mely minősíteni tudja az előállított rétegeket. Amennyiben e feladat ellátására sikerülne egy alkalmas módszert kidolgoznunk, segítségével nem csupán a fehérjeréteg érzékelőfelületre való leválasztásának (immobilizációjának) eredményéről mondhatnánk objektív véleményt, hanem mint visszacsatolásnak a felület kémia paramétereinek optimális beállításában is pótolhatatlan szerepe lenne.
6. 1. Ex situ felületanalízis
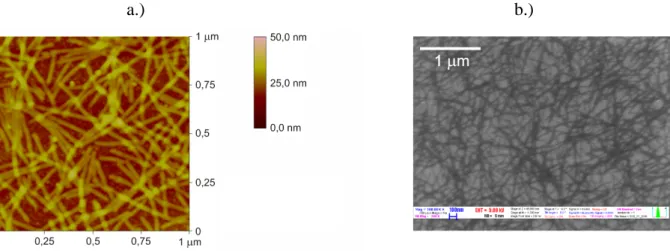
Flagelláris filamentum alapú biológiai érzékelőrétegek fejlesztése során az egyik legfontosabb kérdés az, hogy a fehérjeszálak –az immobilizációt követően– milyen felületi tömegsűrűség mellett helyezkednek el az érzékelőfelületen. Ennek megválaszolására alkalmasak lehetnek olyan lokális méréstechnikák, mint például az atomerőmikroszkópia (ang. atomic force microscopy - AFM) és a pásztázó elektron mikroszkópia (ang. scanning electron microscopy- SEM) is. Járható útnak tűnik az a lehetőség, hogy az 6.1.-1. ábrához hasonló SEM illetve
a.) b.)
6.1.-1. ábra: A flagelláris filamentumokkal beborított felületről készült a.) AFM és b.) SEM felvétel. (Az AFM képeket Dr. Osváth Zoltán, a SEM képeket Dr. Tóth Attila készítette.)
AFM felvételeket képfeldolgozó eljárás alá vessük. Ez esetben a nehézséget nem csupán a képfeldolgozás jelentené, hanem az is, hogy az anyagmennyiség kvantitatív, makroszkopikus felületméretre érvényes meghatározása e mikro-képek alapján problémás. Hátrányuk továbbá, hogy mindkét eljárás rendkívül idő- és költségigényes, illetve, hogy az ex situ vizsgálatokra történőelőkészítés, s maga a mérés is károsítja a mintákat. Önállóan tehát semmiképp sem alkalmasak a fentiekben megfogalmazott feladat rutinszerűellátására.
Optikai módszerek alkalmazásával a flagelláris filamentumok alkotta rétegek minősége gyorsan, egyszerűen, rutinszerűen, nagymennyiségűminta esetén is, akár az érzékelőfelületre való immobilizáció közben is, nagy érzékenységgel mérhetőanélkül, hogy azok bármiféle károsodást szenvednének. A spektroszkópiai ellipszometria olyan nagyérzékenységű polarizációs optikai módszer, amely széles hullámhossztartományban globális információt nyújt a felismerőelem vékonyréteg szerkezeti paramétereiről: vastagságáról, sűrűségéről és akár mélységbeli és laterális homogenitásáról is. Ezen integrális méréstechnika alkalmazásával megfelelőfelületanalízist remélünk megvalósítani, mely kulcsa lehet az érzékelők fejlesztésének és megbízható, reproduktív gyártásának.
6. 1. 1. Mintakészítés
Immobilizáció
A hordozóra porlasztott Ta2O5film réteget kénsavas fürdőben megtisztítjuk, majd a 2,5 %-os 3-aminopropil-trietoxi-szilán (APTES) - ultratiszta víz oldatba mártva szilanizáljuk (6.1.1.- 1.a. ábra). Ezt követően szárítósütőbe helyezve 2 órán keresztül, 120°C-on szárítjuk a mintát.
A szilanizált felszínt keresztkötővel, 2%-os glutáraldehid (GA) és 20 mM-os, 7.4-es pH-jú nátriumfoszfát puffer (PBS) oldatával kezeljük 20°C-on, ugyancsak 2 órán keresztül. Ennek során vízkilépéssel kovalens kötés jön létre az APTES nitrogénje és a GA egyik láncvégi
6.1.1.-1. ábra: A fehérje immobilizáció reakciólépései
szénatomja között (6.1.1.-1.b ábra). Ezek után a flagelláris filamentumokat (FF) PBS pufferben feloldva 0,3 mg/ml koncentrációjú oldatot készítünk. Ebben 17 órán keresztül áztatjuk a chipet. Ezalatt – a fentivel megegyezőreakcióban– a GA másik láncvége szintén kovalens kötést alakít ki a rögzíteni kívánt fehérjével (6.1.1.-1.c ábra). Az oldatból kiemelve ultratiszta vízzel leöblítjük a mintát. E vegyi folyamat után a 6.1.-2. ábrán látható vékonyréteg struktúrát kapjuk [65].
Hordozó választás
A rácscsatolt interferométerben használatos hullámvezetők hordozó rétege átlátszó dielektrikum, amorf SiO2, mely kedvezőoptikai és mechanikai tulajdonságai révén alkalmas eleme ezen egységeknek. Az ellipszometria szempontjából azonban kellemetlen választás, hiszen nem tekinthető félvégtelen közegnek. Az erre épített vékonyréteg-rendszer ellipszometriai spektruma, a hátoldali reflexió következtében, a függelék „13. 4. 1. Az ellipszometriai modellek alapjai” alfejezetében bemutatott matematikai módszert alkalmazó algoritmusokkal (csak úgy, mint az általunk használt WVASE 32 v.3.386 programmal) kiértékelhetetlen. E kellemetlenség orvosolható, ha valamilyen módon megszüntetjük a hátoldalról való fényvisszaverődést. Jelen kísérletsorozatban ezt úgy valósítottuk meg, hogy a hullámvezetőrétegszerkezetét módosítottuk: A minták egyik csoportjában az eredeti SiO2
hordozót szilícium hordozóra növesztett, ≈200 nm vastag, termikus SiO2-dal helyettesítettük, a másikban pedig csupán natív oxidréteggel rendelkezőszilícium hordozóra cseréltük. Az új hordozókra, a közönséges hullámvezetők gyártásával analóg módon, elektronsugaras porlasztással ≈200 nm vastagságú Ta2O5 hullámvezetőréteget gőzölünk. Ezt követően 3- aminopropil-trietoxi-szilán (APTES) és glutáraldehid keresztkötő(GA) segítségével a flagelláris filamentumokat (FF) a Ta2O5 film felületéhez rögzítjük. A szilanizálás
6.1.1.-2. ábra: A flagelláris filamentum felismerőelemekkel borított hullámvezetőszenzor vékonyréteg-struktúrája, és ennek szükséges módosítása a spektroszkópiai ellipszometirával történőszerkezetanalízishez.
idejét optimalizálandó, a két csoport hat-hat mintáját rendre 5, 10, 20, 30, 40, 60 perc szilanizálási időnek vetettük alá. Az eljárás a 6.1.1.-2. ábrán látható rétegszerkezetet eredményezi.
A fenti kísérlet elvégzésével a következőkérdésekre kívántunk választ kapni: Alkotható-e optikai modell e rétegszerkezet ellipszometriai elemzéséhez? Ha igen, a modellel kapott értékek, milyen viszonyban állnak az irodalmi referenciaértékekkel? Milyen érzékenyen mérhetjük e rétegek opto-geometriai paramétereit? A kapott értékekből milyen következtetéseket vonhatunk le? Hatással van-e a termikus SiO2 réteg a mérés érzékenységére? Jellemzően mennyi az a szilanizálási idő, melynél több már nem növeli a megkötött filamentumok számát?
Feladatom egy olyan optikai modell megalkotása volt, mellyel a fentiekben ismertetett vékonyréteg-rendszerről készült ellipszometriai spektrumok egyértelműen kiértékelhetők, illetve, hogy a kapott paraméter értékek megfelelőösszegzésével választ adjak az előbbi kérdésekre. Az eredmények vegyészeti értelmezése nem volt része a feladatkörömnek.
6. 1. 2. Modellalkotás és spektrum kiértékelés
A fentiekben ismertetett vékonyréteg-rendszer Sopra ES4G ellipszométerrel, 75°-os beesési szög mellett, 320 - 720 nm-es hullámhossztartományban mért spektrumainak analízisére nem csupán egyetlen optikai modellt gondolhatunk alkalmasnak. Azt, hogy ezek közül mégis melyik a legmegfelelőbb kiértékelési mód, az illesztőprogram által számított paraméterek hibáinak nagysága és az illesztés minőségét megadó MSE* (mean square error – négyzetes középhiba) értékek összehasonlításával dönthetjük el. Az előbbiből elsősorban arra következtethetünk, hogy a modellben szereplőváltozók mennyire korrelálnak. Az utóbbiak főleg a mért , spektrumokra való modellillesztés jóságát jellemzik. Mivel minden minta esetén, a gyártási folyamat – a Ta2O5réteg felületre való porlasztását követő– minden egyes
___________________________________________________________________________
* MSE (mean square error– négyzetes középhiba)
N
j meas
j calc j meas j measj
calc j meas
j
P MSE N
1 1
1
ahol N az ellipszometriai mérés során az adott hullámhosszon vett független leolvasások száma, P a modell ismeretlen paramétereinek mennyisége, meas, meas a mért, calc, calc a modellből számolt ellipszometriai szögek, meas pedig a független mérések eredmények szórása. Az 10 alatti MSE értékkel jellemezhetőillesztést szokás a szakirodalomban kiválónak nevezni.
fázisa utáni állapotról készült spektroszkópiai felvétel, a kiértékelés során lehetőségem volt lépésről-lépésre haladni. Így tehát először a {Si - termikus/natív SiO2 - Ta2O5} struktúra spektrumait elemeztem, majd a későbbieket már ezek rögzített paraméter értékeinek ismeretében vizsgáltam tovább. A már megkapott részeredményeket előre görgetve segíthető az újabbak biztosabb meghatározása. Ezzel egy sokváltozós rendszer – több független mérés bevonásával –kisebb paraméterbizonytalansággal értékelhetőki.
Érdemes a kiértékelést a {Si - natív SiO2- Ta2O5} mintákról készült spektrumokkal kezdeni.
Itt ugyanis a natív oxid réteg vastagságáról jogosan feltehetjük, hogy lényegesen kisebb, mint a Ta2O5rétegé, ezért a spektrumot a két szélsőanyag fogja meghatározni. A modell alkotás során először az irodalmi törésmutató adatokra, azaz a tömbi anyagokon végzett referenciamérésekre támaszkodtam, azonban az ezekkel történőillesztés hatalmas MSE értékre vezetett. Ez azt az elképzelést erősíti meg, hogy a gőzölés amorf Ta2O5 réteget hoz létre a hordozó felszínén, így nem illeszthetők rá az irodalmi, kristályos Ta2O5-ra vonatkozó referencia értékek. Az irodalmi Ta2O5rétegmodellt egy általános, szilárd, izotróp szigetelőkre vonatkozó Cauchy dielektromos függvénnyel* (ld.: „13. 4. 2. Fontosabb ellipszometriai rétegmodellek”) helyettesítetve az illesztések MSE értékei lezuhantak, míg az illesztett paraméterek érzékenységei nem romlottak (a paraméterillesztés hibája nem növekedett), továbbra is 0,1 - 0,5 % között maradtak. Ezek után következhettek azok a minták, melyek natív helyett termikus oxidréteget tartalmaztak. Az oxidréteg modellezésére az irodalmi SiO2
referencia értékeket használtam fel, mellyel ennek tipikus vastagságára 216,4 ± 5,9 nm-t kaptam. E mintákon mért átlagos Ta2O5 rétegvastagság és a hullámvezetőtechnikákban érdekes, He-Ne lézer fényforrások 632,8 nm-es hullámhosszán mért átlagos Ta2O5 törésmutató érték a natív oxid alapúakéval egybe esett. Ezen értékek rendre 186,2 ± 2,2 nm- nek és 2,136 ± 0,019-nek adódtak. A 6.1.2.-1. ábrán egy-egy tipikus illesztés eredményét láthatjuk.
Az imént kapott paraméterek és azok hibái alapján megállapíthatjuk, hogy az elektronsugaras porlasztással történőTa2O5rétegleválasztás jól kézbentartott, megfelelően precíz eljárás, mely
___________________________________________________________________________
*A függelék 13. 4. 2. alfejezetében részletesen tárgyalt Cauchy függvény elsőhárom tagját tartjuk meg, a többit elhanyagolhatóan kicsinek tekintjük. Ezzel az egyszerűsítéssel a Cauchy dielektromos függvény a következő alakot ölti:
0 21 42
B B B
n
Az illesztendőparaméterek: B0, B1, B2
![[24] Turner definícióját a 5.-1. ábra szemlélteti, bő vebb kifejtése a következő alfejezetekben olvasható.](https://thumb-eu.123doks.com/thumbv2/9dokorg/872165.46908/13.892.157.729.608.812/turner-definícióját-ábra-szemlélteti-kifejtése-következő-alfejezetekben-olvasható.webp)
![5.1.5.-1. ábra: a.) A baktérium sejtmembránjából kinyúló helikális propellerré szervező dött filamentumok b.) a filamentumot hajtó forgómotor sematikus rajza [36].](https://thumb-eu.123doks.com/thumbv2/9dokorg/872165.46908/16.892.145.753.822.1058/baktérium-sejtmembránjából-kinyúló-helikális-propellerré-filamentumok-filamentumot-forgómotor.webp)
![5.2.1.-2. ábra. a.) A tömbbe rendezett rugalmas erő karok a rájuk rögzített felismerő elemek által megkötött célmolekulák súlya alatt meghajolnak [8]](https://thumb-eu.123doks.com/thumbv2/9dokorg/872165.46908/20.892.136.764.700.940/tömbbe-rendezett-rugalmas-rögzített-felismerő-megkötött-célmolekulák-meghajolnak.webp)
![5.2.3.-1. ábra: a.) A térvezérlésű tranzisztor alapú nanovezeték vezető képességét [51] míg b.) a nanopórusok esetén a pórusok átmérő jét, így az átfolyó ionáramot, [52] szabályozzák a felismerő elemek által megkötött célmolekulák.](https://thumb-eu.123doks.com/thumbv2/9dokorg/872165.46908/21.892.159.753.670.912/térvezérlésű-tranzisztor-nanovezeték-képességét-nanopórusok-szabályozzák-megkötött-célmolekulák.webp)
![5.2.4.-2. ábra: a.) Mach-Zender interferométer b.) Young interferométer mű ködési vázlata [56].](https://thumb-eu.123doks.com/thumbv2/9dokorg/872165.46908/24.892.115.778.452.694/ábra-mach-zender-interferométer-young-interferométer-ködési-vázlata.webp)