Pannon Egyetem
Vegyészmérnöki Tudományok és Anyagtudományok Doktori Iskola
EU KONFORM VÍZRENDSZEREK (ALKÁLI ÚJRAHASZNOSÍTÁS)
D
OKTORI(P
H.D.)
ÉRTEKEZÉSKészítette:
Rippelné Peth ő Dóra
okleveles vegyészmérnök
Témavezető:
Dr. Horváth Géza
egyetemi docens
Pannon Egyetem
Vegyipari Műveleti Intézeti Tanszék
2010
EU KONFORM VÍZRENDSZEREK Értekezés doktori (PhD) fokozat elnyerése érdekében
Írta:
Rippelné Pethő Dóra okleveles vegyészmérnök
Készült a Pannon Egyetem, Vegyészmérnöki Tudományok és Anyagtudományok Doktori Iskolája keretében
Témavezető: Dr. Horváth Géza
Elfogadásra javaslom (igen / nem) ………...
(aláírás) A jelölt a doktori szigorlaton …... % -ot ért el,
Az értekezést bírálóként elfogadásra javaslom:
Bíráló neve: …... …... igen /nem
………...
(aláírás) Bíráló neve: …... …... igen /nem
………...
(aláírás) Bíráló neve: …... …... igen /nem
………...
(aláírás) A jelölt az értekezés nyilvános vitáján …...% - ot ért el
Veszprém,
………...
a Bíráló Bizottság elnöke
A doktori (PhD) oklevél minősítése…...
………...
Az EDT elnöke
KIVONAT
A szerző a dolgozatban az ipari szennyvizek kezelésére egy új megoldást mutat be, amelyet elnevezett határréteg szeparációs módszernek (BLSM). Felhasználta azt a jelenséget, hogy elektromosan töltött elektród felületén a határrétegben az ionok feldúsíthatóak a fázishoz képest. A módszer lényege, hogy alkalmasan megválasztott sebességgel a határréteg sérülés nélkül kiemelhető a szennyvízből és az ionokban gazdag határréteg recirkuláltatható. A módszer az elektroszorpció jelenségén alapul, amely felületi jelenség. Akkor használható jó hatásfokkal, ha nagy az elektródok elektrokémiailag hozzáférhető felülete. A szerző munkája során két nagyfelületű nikkel elektródot állított elő. Megbecsülte az elektródok elektrokémiai szempontból hatásos felületének nagyságát. Kísérletileg kimutatta a kettősréteg diffúz részének létezését.
Meghatározta az elektrolitikus kettősréteg kapacitását, valamint a fizikai adszorpció és az elektroszorpció relatív szerepét az iontranszportban. Megvizsgálta a kialakult határréteg kapacitását, a maximálisan alkalmazható áramlási sebességet valamint az elektrokémiai folyamatok sebességét és a szükséges műveleti időket.
A szerző bemutatta a határréteg szeparációs módszerrel történő iontranszportot, melyet ciklikus műveletként valósított meg. A kísérletekhez automata elektroszorpciós berendezést és egy kaszkád rendszerű készüléket épített. Matematikai modell segítségével összehasonlította a mért és számított eredményeket. A modell oldatok mellett ipari szennyvízzel is végzett kísérleteket.
ABSTRACT
In her dissertation, the author presents a novel method for wastewater treatment named Boundary Layer Separation Method (BLSM). The phenomenon that ions can be enriched in the boundary layer as compared to the bulk liquid phase has been exploited.
The essence of the method is that – with appropriately chosen velocity – the boundary layer can be withdrawn from the wastewater without any damage to itself. The boundary layer enriched with ions can be recycled. The method is based on the phenomenon of electrosorption which is a surface phenomenon. It can be used with good efficiency if the electrochemically accessible surface area of the electrodes are high. During her research work, the author produced two high surface area nickel electrodes. The author estimated the extent of the electrochemically effective area of the electrodes. The existence of a diffusion part of the double layer has been experimentally proven. The capacity of the electrolytic double layer and the relative role of the physical adsorption and electrosorption processes in the ion transport have been defined. The capacity of the boundary layer, the maximal flow velocity, the velocity of the electrochemical processes and also the required time spans of the procedures have been examined.
The author presents ion transport with BLSM, which was realized as a cyclic procedure. For the experiments an automatic electrosorption apparatus and a cascade device was built. The calculated and the measured data were compared with the use of a mathematical model. Experiments were carried out not only with model solutions, but also with industrial wastewater samples.
AUSZUG
Der Autor stellt im Aufsatz zur Behandlung der industriellen Schmutzwässer eine neue Lösung dar, welcher sie den Namen „Grenzschicht Separation Methode“ gegeben hat. Sie hat den Effekt verwendet, dass auf der Oberfläche der elektrisch geladenen Elektrode, in der Grenzschicht die Ionen gegenüber der Phase angereicht werden können. Das Wesen der Methode ist es, dass die Grenzschicht aus dem Schmutzwasser mit einer geeignet gewählten Geschwindigkeit ohne Beschädigung ausgehoben werden kann, und die an Ionen reiche Grenzschicht lässt sich rezirkulieren. Die Methode gründet sich auf dem Effekt der Elektrosorption, der eine Oberflächenerscheinung ist.
Die Methode kann im Falle mit gutem Wirkungsgrad benutzt werden, wenn die elektrochemisch zugängliche Oberfläche der Elektroden groß ist. Der Autor hat im Laufe seiner Arbeit zwei Nickelelektroden mit großer Oberfläche hergestellt. Er hat die Größe der elektrochemisch wirksamen Oberfläche der Elektroden geschätzt. Mit Versuchen hat er das Vorhandensein des diffusen Teiles der Doppelschicht nachgewiesen. Sie hat die Kapazität der elektrolytischen Doppelschicht, sowie die relative Rolle der physikalischen Adsorption und der Elektrosorption bestimmt. Sie hat die Kapazität der zustande gekommenen Grenzschicht, die maximal verwendbare Strömungsgeschwindigkeit, sowie die Geschwindigkeit der elektrochemischen Prozesse und die nötigen operativen Zeiten geprüft.
Der Autor hat mit den Grenzschicht Separation Methode erfolgenden Ionentransport der Grenzschicht dargestellt, den sie als zyklische Operation verwirklicht hat. Zu den Versuchen hat sie eine Elektrosorptionseinrichtung und ein Gerät in Kaskadensystem gebaut. Mit Hilfe einer mathematischen Modells hat sie die gemessenen und die gerechneten Ergebnisse verglichen. Neben den Modelllösungen hat sie auch mit industriellen Schmutzwässern Versuche gemacht.
TARTALOMJEGYZÉK
KIVONAT ...II ABSTRACT...III AUSZUG ... IV TARTALOMJEGYZÉK ...V Jelölések jegyzéke...VIII
Bevezetés ...1
1. Irodalmi összefoglaló ...3
1.1. Elektrolitok ...3
1.1.1. A disszociációs egyensúly elektrolitokban ...3
1.1.2. Ionok szolvatációja elektrolitokban...4
1.1.3. Az elektrolitok vezetőképessége ...6
1.1.4. Az ionok mozgása oldatban ...6
1.1.5. Az elektrolit oldat vezetését befolyásoló tényezők ...7
1.1.6. Diffúzió elektrolitokban...9
1.2. Elektródok...10
1.2.1. Elektromos potenciál ...11
1.2.2. Elektródfolyamatok kinetikája ...11
1.2.3. Polarizáció...12
1.2.4. Alkalmazható elektródok...12
1.3. Az elektrokémiai adszorpció ...13
1.3.1. Kettősréteg kialakulása...14
1.3.2. Az elektrokémiai kettős réteg szerkezete...15
1.3.2.1. Helmholtz-féle elektromos kettősréteg modell...16
1.3.2.2. Gouy-Chapman féle diffúz elektromos kettősréteg modell...16
1.3.2.3. A Gouy-Chapman-Stern-féle, kétrétegű modell ...20
1.3.2.4. A Gouy-Chapman-Stern-Grahame-féle, háromrétegű modell...21
1.3.2.5. Elektrolitikus kettősréteg modell porózus anyagoknál ...23
1.3.3. Elektródok áramló rendszerben...24
1.3.3.1. A zéta potenciál...24
1.3.3.2. Határréteg áramló folyadékban...24
1.3.3.3. Sebességprofil csőben áramló folyadékban...27
1.3.4. A határfelületi jelenségek termodinamikai tárgyalása...29
1.4. A feszültségváltó adszorpció ...31
1.4.1. Elektrokémiai paraméteres szivattyúzás...31
2. Vizsgálati módszerek, felhasznált anyagok...36
2.1. Felhasznált anyagok ...36
2.2. Analízis...36
2.2.1. Sav-bázis titrálás...36
2.2.2. Atomabszorpció spektrofotometria ...36
2.2.3. Pásztázó elektronmikroszkóp...38
2.2.4. Higany porozimetria ...39
2.2.5. BET felületmeghatározás...40
3. Kísérleti munka és eredmények bemutatása...41
3.1. Elektródok készítése...41
3.1.1. Porózus nikkel pasztilla elektród előállítása ...41
3.1.2. Nikkelezett nikkel elektród előállítása...44
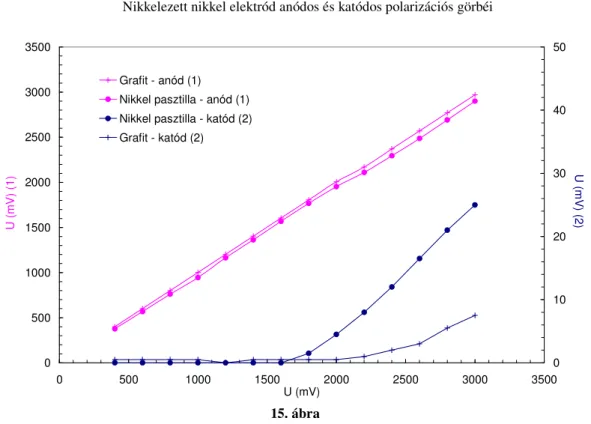
3.2. Elektródok vizsgálata ...46
3.2.1. Elektródok polarizációja ...46
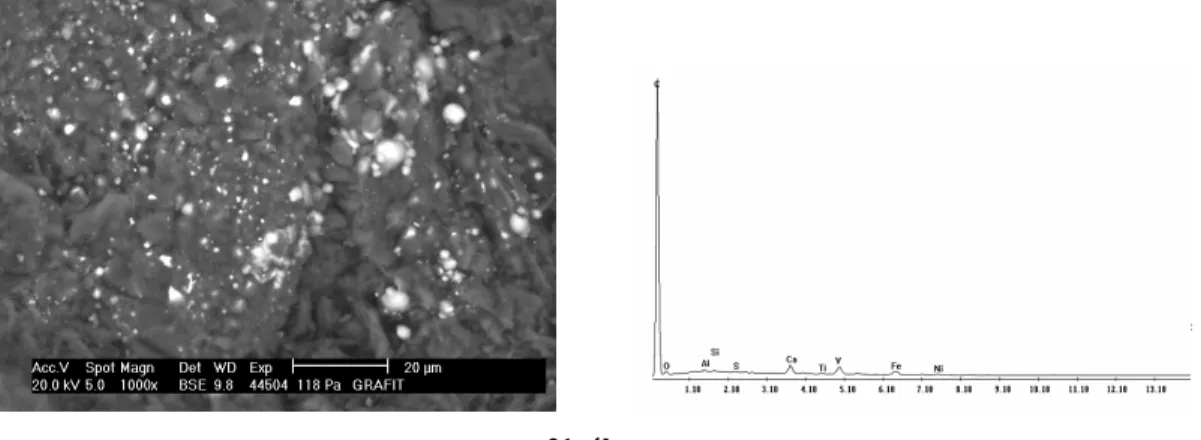
3.2.2. Elektronmikroszkópos vizsgálatok...49
3.2.3. Elektródok felülete és pórusmérete ...51
3.2.4. Az elektrokémiailag hozzáférhető felület meghatározása ...52
3.2.5. Az elektrokémiai kettős réteg vizsgálatai ...53
3.2.5.1. Az elektrokémiai kettős réteg kapacitásának mérése...53
3.2.5.2. A diffúziós réteg stabilitásának vizsgálata ...55
3.2.6. Határréteg kialakulása áramló folyadékban...59
3.2.7. A fizikai adszorpció és hidrodinamikai tapadóréteg ...60
3.3. Határréteg szeparációs módszer...62
3.3.1. A módszer elve...62
3.3.2. Kísérleti berendezés és működése...63
3.3.3. Műveleti paraméterek hatása...66
3.3.3.1. Koncentráció...66
3.3.3.2. Ciklus szám...68
3.3.3.3. Polarizációs potenciál...69
3.3.3.4. Műveleti idők ...70
3.3.3.5. Elektródok távolsága ...72
3.3.4. A töltéshasznosulás mértéke ...74
3.3.5. Matematikai modell...75
3.3.6. Kísérletek ipari szennyvízzel ...79
3.3.7. Mérések áramló rendszerben...80
3.4. Kaszkád rendszerű folyamatos készülék ...82
3.4.1. Az elektroszorpciós oszlop felépítése...82
3.4.2. Elektroszorpciós kaszkád berendezés működése ...83
3.4.3. Kísérletek kaszkád rendszerű készülékkel...86
4. Összefoglalás ...89
Tézisek...91
Theses...94
PUBLIKÁCIÓK ÉS PROCEEDINGSEK...97
IRODALOMJEGYZÉK ...99
KÖSZÖNETNYILVÁNÍTÁS ...107
FÜGGELÉK ...108
Jelölések jegyzéke
a aktivitás
b a gömbnek feltételezett részecske sugara (m) c az oldat koncentrációja (mol/dm3)
cθ 1 mol/dm3 koncentrációt jelent
ca koncentráció az anódtér kádban (mol/dm3) ck koncentráció a katódtér kádban (mol/dm3)
cF a „F” tartályban lévő folyadék koncentrációja (mol/dm3) cB a „B” tartályban lévő folyadék koncentrációja (mol/dm3)
CC
c koncentráció a cellában töltés alatt (mol/dm3)
FC
c koncentráció a cellában áramoltatás után (mol/dm3)
DC
c koncentráció a cellában töltés nélkül (mol/dm3)
BC
c koncentráció a cellában visszaáramoltatás után (mol/dm3)
( )
ncIA n-edik ciklusban az anódtéri (Anod-space) koncentráció az elektroadszorpció előtt a ciklus elején (Initial) (mol/dm3)
( )
ncFA n-edik ciklusban az anódtéri (Anod-space) koncentráció az elektroadszorpció után a ciklus végén (Final) (mol/dm3)
( )
ncIC n-edik ciklusban a katódtéri (Cathode-space) koncentráció a deszorpció előtt a ciklus elején (Initial) (mol/dm3)
( )
ncFC n-edik ciklusban a katódtéri (Cathode-space) koncentráció a deszorpció után a ciklus végén (Final) (mol/dm3)
d ionátmérő (m)
dm határátmérő (m)
dx az elektródok közötti távolság (m)
e elemi töltés (C)
f az a folyadékhányad, amely a folyadékból való kiemelés után az elektród felületén marad
g nehézségi gyorsulás (m/s2)
h veszteségmagasság (m)
j áramsűrűség (A/m2) k Boltzmann – állandó (J/K)
l segédelektródok közötti távolság (m) lI az áram által átjárt szakasz hossza (m)
lk a kondenzátor fegyverzetek közötti távolság (m)
m az elektródok által megkötött anyagmennyiség (mol/m2 vagy g/ m2) m0 ∆ε vs. t görbe kezdeti meredeksége
n ciklusszám (db)
ni(x) ionok sűrűségeloszlása (db/m3) n+(x) kationok lokális sűrűsége (db/m3) n-(x) anion lokális sűrűsége (db/m3)
niB az illető komponens sűrűsége a tömbfázisban (db/m3)
∆p nyomásesés (kg/m s2) qi egy részecske töltése (C)
rp pórus sugár (m)
s anyagszerkezeti tényező
t idő (s)
ta elektroszorpciós idő az anódtér kádban (s) tk deszorpciós idő a katódtér kádban (s) ū az ion átlagos sebessége (m/s)
u az ion egységnyi térerősség hatására kialakuló stacionárius sebessége (m2/(s V))
u* csúszási sebesség (m/s) v áramlási átlagsebesség (m/s)
vk határrétegen kívüli áramlási sebesség (m/s) vx x irányú sebességkomponens (m/s)
vy y irányú sebességkomponens (m/s) vz z irányú sebességkomponens (m/s)
w állandó
x koordinátatengely x iránya y koordinátatengely y iránya xe elektródok távolsága (m) z koordinátatengely z iránya z+ a kation töltésszáma z- az anion töltésszáma
z az ion töltésszáma
A az anion jele
Af kondenzátor felület (m2)
AI az áram által átjárt szakasz keresztmetszete (mm2)
B a kation jele
C kondenzátor kapacitása (F)
Ct a polarizációs kapacitás adott t időpontban (F) Cd a kettősréteg kapacitása (F)
D az elektromos eltolás vektora (As/m) D+ a kation diffúziós tényezője (m2/s) D- az anion diffúziós tényezője (m2/s) Di közös diffúziós együttható (m2/s) E elektródpotenciál (V)
E° standard elektródpotenciál (V)
E
e egyensúlyi elektródpotenciál (V) EQ=0 töltésnullapont-potenciál (V) Etér homogén elektromos tér (V/m) F Faraday-állandó (9,65*104 C/mol)Fe (z e) töltésre ható erő E elektromos térben (N) Ffékező az ionra ható fékezőerő az oldatban (N) G az elektród geometriai felülete (m2)
H műszer állandó
I áramerősség (A)
Irel színképvonal relatív intenzitása
J állandó
K termodinamikai vagy reális disszociáció állandó (mol/dm3) K’ a látszólagos disszociáció állandó (mol/dm3)
L cső hossza (m)
P a Hg behatolásához szükséges nyomás (Pa)
Q töltés (C)
R cső sugara (m)
Re az elektrolit oldat ellenállása (Ω) Rt a töltésátviteli ellenállás (Ω)
Re Reynolds szám
Rex belépőéltől mért távolsággal számított Reynolds szám Rey dimenziómentes távolsággal kifejezett Reynolds szám
T hőmérséklet (K)
U mért potenciálkülönbség (V)
Ua polarizációs potenciál az anódtér kádban (mV) Uk polarizációs potenciál a katódtér kádban (mV) V0 a rögzített elektródpotenciál (V)
V a folyadék mennyisége (m3) Vd diffúziós réteg potenciálja (V) Vt a teljes cellatérfogat (m3)
∆V elmozduló folyadéktérfogat (m3)
γ felületi feszültsége (N/m) γHg higany felületi feszültsége (N/m) γc moláris aktivitási tényező δ Helmoltz-réteg vastagsága (m) δPr határréteg vastagság (m)
ε a közeg dielektromos állandója (As/Vm) ε0 a vákuum permittivítása (As/Vm) εp kondenzátor potenciálja (V) ζ zéta potenciál (V)
η a folyadék viszkozitása (Pas) θ illeszkedési szög (°)
κ fajlagos vezetés (S/m)
κD Debye-féle árnyékolási hossz (1/m) λ csősúrlódási tényező
µ kémiai potenciál (J/mol)
~j
µ elektrokémiai potenciál (J/mol)
0
µj standard kémiai potenciál (J/mol) ν kinematikai viszkozitás (m2/s)
ν+ a kation sztöchiometriai száma a disszociáció egyenletében az anion sztöchiometriai száma a disszociáció egyenletében
ρ sűrűség (kg/m3)
ρt a felületi töltéssűrűség (As/m2) ρe fajlagos ellenállás (Ω mm2/m) σ határfelületi szabad töltéssűrűség (C) τ nyírófeszültség a közegben (kg/s2 m) τ0 nyírófeszültség a falnál (kg/s2 m)
Γi felületi többletkoncentráció (mol/dm3) Λm a moláris fajlagos vezetés (S m2/ mol) dΦ az elektródok közötti potenciálkülönbség (V) Φe az elektrolit oldat belső potenciálja (V) ΦM
az elektródfázis belső potenciálja (V) ψ elektrosztatikus potenciál (V)
ψ0 felületi potenciál (V)
ψD elektromos kettősréteg diffúz-réteg potenciál (V)
Bevezetés
Az ipari hulladék anyagok nagy része közismerten veszélyes és ezekre egyre szigorúbb környezetvédelmi előírások vonatkoznak, szabályozva pl. a vegyi üzemek szennyvizeinek fém- és sótartalmát, valamint egyéb szerves és szervetlen komponenseinek mennyiségét. A törvények betartása érdekében környezetkímélő, ha lehetséges, hulladékszegény gyártási eljárásokra van szükség. Ez teszi indokolttá az esetlegesen keletkező hulladék anyagok kezelésének korszerűsítését. A keletkező hulladék kezelésének egyik legcélravezetőbb technológiai megoldása az újrahasznosítás.
Problémát jelent a Tiszai Vegyi Kombinát (továbbiakban TVK) olefingyártása során keletkező szennyvíz magas Na+-ion tartalma. A pirolízis művelete során keletkező pirolízis gázokat lúgos mosótornyokban nyeletik el. A rendszerbe folyamatosan adagolnak nátronlúgot és közben folyamatos leiszapolás történik. A keletkező szennyvízből a „hagyományos” szennyvízkezelés során a szervesanyag-tartalom eltávolítható, a környezetre veszélyt jelentő lúgtartalom viszont nem. A szennyvíz lúgtartalma semlegesíthető, ekkor azonban só keletkezik és a kibocsátott sótartalomra is szigorú környezetvédelmi előírások vonatkoznak.
A szennyvíz összetételének ismeretében célom olyan technológia megvalósítása, amely a Na+-ion csökkentése mellett lehetővé teszi a szennyező anyag egy más rendszerben való dúsítását és a technológiába való visszavezetését. Ennek következtében a környezetbe való káros anyag kibocsátás is jelentősen csökkenthető.
A szennyvizek Na+-ion koncentrációjának csökkentésére ioncserés műveletet, kalcináláson alapuló módszereket vagy membrántechnikát alkalmaznak. Az ioncsere művelet hátránya, hogy a kimerült ioncserélő anyagot regenerálni kell. A regenerálás során az eredeti sótartalom több mint kétszerese termelődik. Ennek hasznosításáról illetve megfelelő elhelyezéséről a környezetvédelmi előírások miatt gondoskodni kell. A nátriumtartalom csökkentése megoldható kalcinálással is, amikor kémiai reakcióval NaHCO3 kristályokat állítanak elő és hőkezelés következtében kalcinált szóda keletkezik. Ennek a módszernek a hátránya, hogy nagy a hőigénye, valamint a technológiában használt nátronlúg nátrium-tartalma termékként (szóda) jelentkezik, és így nem vezethető vissza a technológiai folyamatba. Membrántechnika alkalmazásakor a TVK ipari szennyvizéhez speciális, drága ioncserélő membránokat kellene alkalmazni a szennyvíz magas kéntartalma és szénhidrogén tartalma miatt.
A lúgos ipari szennyvizek kezelésére egy új megoldást dolgoztam ki, amelyet elneveztem határréteg szeparációs módszernek (Boundary Layer Separation Method = BLSM). A módszer lényege hogy, elektromosan töltött elektród felületén kialakult ionokban gazdag réteg jól megválasztott sebességgel kiemelhető a szennyvízből. Az elektród polaritását ellentétesre változtatva az ionokban gazdag réteg egy másik rendszerben deszorbeáltatható, az oldat dúsítható és a technológiába visszavezethető.
A módszer az elektroszorpció jelenségén alapul. Elektroszorpción elektromosan töltött elektródok felületén végbemenő adszorpciót értünk (Rong, 2005). Katódosan polarizált (negatív) elektródon a kationok elektroszorpciója lép fel. Ez az elektroszorpció szuperponálódik a fizikai (töltés nélküli elektródon lejátszódó) adszorpcióra. Ha ellentétesre változtatjuk az elektromos polarizáció irányát, akkor a kationok deszorbeálódnak (Afkhauni, 2002; Xu, 2000; Farmer, 1996; Ayranci, 2001b).
A jelenséget ciklikus műveletben felhasználva elektroszorpcióval ioneltávolítás valósítható meg. Az elektrokémiai módszerek, közöttük az elektroszorpció alkalmazásának feltétlen előnye, hogy nem használnak veszélyes kemikáliákat, csak inert elektródokat. További előnye, hogy nem termel környezetszennyező anyagokat.
Az elektrokémiai paraméterek egyszerűen mérhetők és könnyen szabályozhatók. Az eljárás hátránya, hogy nem ionszelektív és az elektrolízis során keletkező hidrogén veszélyes lehet.
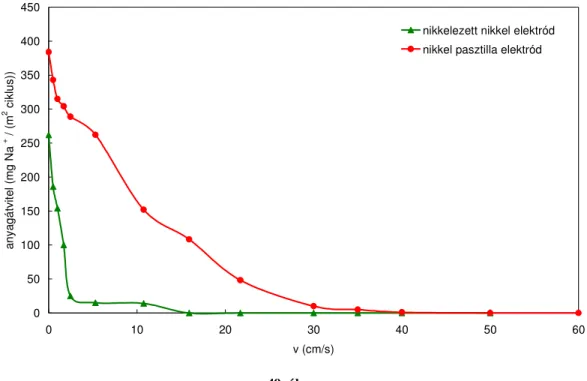
A dolgozatban bemutatom a határréteg szeparációval történő iontranszportot, melyet ciklikus műveletként valósítottam meg. A kísérletekhez automata elektroszorpciós berendezést és egy kaszkád rendszerű készüléket építettem. A kísérletekhez két különböző típusú nikkel elektródot állítottam elő. Elektrolízissel nikkelezett nikkel, porkohászati módszerrel pedig porózus nikkel elektródokat készítettem. Megbecsültem az elektródok elektrokémiai szempontból hatásos felületének nagyságát. Kísérletileg kimutattam a kettősréteg diffúz részének létezését.
Meghatároztam az elektrolitikus kettősréteg kapacitását, valamint a fizikai adszorpció, az elektroszorpció és a hidrodinamikai tapadóréteg relatív szerepét az iontranszportban.
Megvizsgáltam a kialakult határréteg kapacitását, valamint az elektrokémiai folyamatok sebességét. Meghatároztam a műveleti paraméterek szeparációra gyakorolt hatását.
Matematikai modell segítségével összehasonlítottam a mért és számított eredményeket.
A szeparációt modelloldatok mellett ipari szennyvízzel végzett kísérletekkel is bizonyítottam.
1. Irodalmi összefoglaló
1.1. Elektrolitok
Elektrolitnak nevezzük azokat az anyagokat, amelyek oldatban (elektrolit oldat) vagy olvadékban (elektrolitolvadék) részben vagy teljesen ionok alakjában vannak jelen (Koryta, 1993).
1.1.1. A disszociációs egyensúly elektrolitokban
Az elektrolit tiszta állapotában lehet ionos vegyület, vagy állhat semleges molekulákból, amelyek oldószerrel kölcsönhatásban, az oldódás során ionokra esnek szét. Ezt a jelenséget elektrolitikus disszociációnak nevezzük. Az elektrolitok oldataikban gyakran nincsenek teljesen disszociálva, hanem a nemdisszociált molekulák és az ionok között egyensúly van. Az egyensúly egyenlete (Koryta, 1993):
− +
−
+ υ ↔ + z + − z
υ A υ B υ A
B (1)
Az elektrolit töltésszáma a disszociációs egyensúlyban szereplő ionok sztöchiometriai számának és a töltésszámnak a szorzata:
zi = z+ υ+ (2)
zi = z- υ- (3)
Természetesen egy elektrolit egészére mindig érvényes az elektroneutralitás elve:
∑
=i i
iυ 0
z (4)
A koncentrációk helyett definiáljunk egy új mennyiséget az aktivitást (a). Ennek segítségével a termodinamikai vagy reális disszociációállandó (K):
BA υ A υ B
a a
K=a + − (5)
Az aktivitásokat az aktivitási tényezők (γc) segítségével számíthatjuk ki:
cθ c a
γc= (6)
A (6) egyenlet segítségével a termodinamikai vagy reális disszociációállandó:
[ ] [ ]
[ ]
BAυ A υ ' B BA
υ A υ B υ
υ z υ z υ
γ γ K γ γ
γ γ A
B A
K B + − + −
− +
− +
=
=
− +
(7)
[ ] [ ] [
+ −]
−
+ −
+
=
υ υ
z υ z υ '
A B
A
K B (8)
Az elektrolitok osztályozása a (8) egyenlettel definiálható K’ látszólagos disszociáció állandó mol/dm3-ben kifejezett értéke alapján történhet (Erdey-Grúz, 1962):
• Erős elektrolitok: K’> 1
• Középerős elektrolitok: 1 > K’ > 10-2
• Gyenge elektrolitok: 10-2 > K’
A kísérletekben felhasznált 0,05 M-1 M koncentrációjú NaOH oldatok erős elektrolitok közzé sorhatóak, az oldat gyakorlatilag teljesen disszociált formában van. A továbbiakban az elektrolitokra jellemző tulajdonságokat mutatom be különös tekintettel az erős elektrolitokra.
1.1.2. Ionok szolvatációja elektrolitokban
Az elektrolitok ionos vezetők, oldatai még viszonylag kis koncentrációk esetében sem ideális oldatok, melynek oka az ionok, valamint az ionok és oldószer molekulák közötti elektrosztatikus kölcsönhatás.
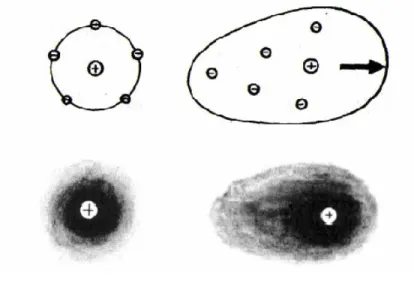
Az elektrolitok oldódása során annyi energia termelődik, amelyhez a viszonylag kicsi termikus energiát hozzáadva elegendően nagy ahhoz, hogy meggátolja az oldott ionok molekulákká való egyesülését. A disszociációs energia zömét az ionok és az oldószer molekulák közötti kölcsönhatás adja, melyet általában szolvatációnak, vagy vizes közegben hidratációnak nevezünk (1. ábra) (Koryta, 1993).
A szolvatáció elsősorban az oldószer-molekulák dipólusai révén jön létre, de kismértékben előfordul nem dipólus természetű közegekben is, mert az ionok elektromos erőtere gömbszimmetrikus töltéseloszlású molekulára is polarizálólag hat, és ezeket is dipólussá alakítja.
1. ábra
A kation és a körülötte elhelyezkedő hidrátburok
Az oldószer ionizáló képessége attól függ, hogy mekkora az oldószer permanens dipólusmomentuma, és mekkora a polarizálhatósága. Minél nagyobb az oldószermolekulák permanens dipólusmomentuma és minél nagyobb a polarizálhatósága, annál nagyobb lesz a szolvatációs hő is, vagyis annál nagyobb mértékben képződnek ionok az oldószerben (Kiss, 1997). Csökkenti az ionok közötti vonzást az oldószer dielektromos hatása is. Mivel a dielektromos állandó (permittivitás) a dipólusmomentum és a polarizálhatóság növekedésével nő, az oldószer ionizálóképessége és permittivitása között kapcsolat van. Ezt az összefüggést írja le a Nernst-Thomson-szabály, mely szerint valamely elektrolit disszociációja különböző oldószerekben annál nagyobb mértékű, minél nagyobb az oldószer dielektromos állandója (Erdey-Grúz, 1962).
Az ion-oldószer kölcsönhatás miatt az ionok környezetében megváltozik az oldószer szerkezete, mely során három hatás is érvényesülhet (Liszi, 1993):
• Az ion mérete nem teszi lehetővé, hogy egy vagy több oldószermolekula helyét feszülésmentesen foglalja el az oldatban.
• Az ionok erőtere polarizálja az oldószermolekulák környezetét, emiatt a molekulák szorosabban illeszkednek egymáshoz, így kisebb lesz a parciális moláris térfogatuk a tiszta oldószerhez képpest, ez az elektrostrikció jelensége.
Az ion környezetében lévő nagy térerősség lecsökkenti az oldószer relatív permittivitását, ezt a jelenséget dielektromos telítésnek nevezzük.
• Az ionok és az oldószermolekulák között kovalens kötések is kialakulhatnak, amelyek során szolvát-komplexek képződnek.
1.1.3. Az elektrolitok vezetőképessége
Az elektrolitok oldatokban való disszociációjának következménye, hogy vezetik az elektromos áramot (Koryta, 1993).
Az általánosságban megismert vezetők mellett az elektrolitokra is érvényes az Ohm-törvény (Atkins, 1994). Az elektrolit-oldatok ellenállása (Re) növekszik az árammal átjárt szakasz hosszával (lI), és csökken annak keresztmetszetével (AI):
I I e
e Α
l
R =ρ (9)
A fajlagos ellenállás reciproka a fajlagos vezetés (κ), amely egy egységnyi élhosszúságú kocka alakú elektrolit oldat vezetésével értelmezhető (Atkins, 1994).
e
1
= ρ
κ (10)
A fajlagos vezetés függ az elektrolit koncentrációjától. Célszerűbb az oldat vezetését a moláris fajlagos vezetéssel (Λm) jellemezni, amely egy mólnyi oldott elektrolit vezetését jelenti:
c
Λm = κ (11)
1.1.4. Az ionok mozgása oldatban
Minél nagyobb egy ion mozgékonysága az oldatban annál nagyobb a része a vezetésben (Atkins, 1994).
Ha egy elektrolit oldatba két elektródot merítünk és potenciálkülönbséget hozunk létre köztük, akkor az ionok az oldatban egy Etér erősségű homogén elektromos tér hatása alatta vannak.
dx
Etér =−dΦ (12)
Ebben a térben a kationok a potenciálcsökkenés irányába, az anionok az ellenkező irányba mozdulnak el. A (zie) töltésű ionokra ható erő (Fe):
dx edΦ z E e z
Fe = tér =− (13)
Ha nem lenne fékező erő az ionok állandóan gyorsulva mozognának, azonban az oldószer molekulákkal való súrlódás miatt egy Ffékező erő is hat rájuk. A fékezőerő nagyságát a Stokes-egyenlet írja le:
u b η 6π
Ffékező = (14)
Stacionárius esetben az ionra ható erő és az ellenerő eredőjeként az ion állandó ū sebességgel mozog (Liszi, 1993):
b η 6π
E e
u= z tér (15)
A részecske sebessége tehát a viszkozitás növekedésével csökken, ugyanakkor a krisztallográfiai ionsugár csökkenésével nem növekszik, mert az ionnal együttmozgó hidrátburok is hatással van a sebességre. A kisebb ionok erősebb elektromos terükkel több vízmolekulát képesek megkötni, mint a nagyobbak, így a hidrodinamikai átmérőjük a hidrátburokkal együtt nagyobb.
Az ū ionmozgékonyságot a következő egyenlettel definiáljuk:
Etér
u
u = (16)
Gyenge elektrolitok híg oldataiban az ionmozgékonyság gyakorlatilag független a koncentrációtól. Ennek oka, hogy a gyenge elektrolitok oldatában a kisfokú disszociáció folytán az ionok koncentrációja oly kicsi, hogy észrevehető elektrosztatikus kölcsönhatást töményebb oldatokban sem fejtenek ki egymásra. Azonban az erős elektrolitok híg oldatban gyakorlatilag teljesen disszociálva vannak. Az ionok mozgékonyságának változása okozza a vezetőképesség változását a koncentrációval. A disszociáció csökkenése és az ionok asszociációja csak töményebb oldatokban válik észrevehetővé (Erdey-Grúz, 1962).
1.1.5. Az elektrolit oldat vezetését befolyásoló tényezők
Az erős elektrolit oldatokban az ionok elektrosztatikus kölcsönhatása miatt az azonos töltésű ionok taszítják és az ellentétes töltésű ionok vonzzák egymást. Ennek következtében oldott anyag ionjainak eloszlása nem teljesen rendezetlen. Az elektrosztatikus kölcsönhatás eredményeként egy adott ion körül a vele ellentétes töltésű ionokból ionatmoszféra (ionfelhő, töltésfelhő) képződik. A külső elektromos térben
mozgó ionoknál a kialakult ionatmoszféra nem gömbszimmetrikus, hanem tojás alakú lesz. Ennek oka, hogy az ionatmoszféra létezése miatt két fékező hatás lép fel, amelyek csökkentik a központi ion mozgékonyságát. A két hatás a relaxációs effektus és az elektroforetikus kölcsönhatás.
A relaxációs effektust (2. ábra) az okozza, hogy a mozgó ion körül az eredetileg szimmetrikus ionatmoszféra deformálódik, és az ellenkező töltésű ionok fékezik a központi ion mozgását (Bockris, 1998).
2. ábra Relaxációs effektus
Az ionok mozgását gátló elektroforetikus hatás létrejöttének oka, hogy a kationok a külső elektromos térerősség hatására a velük ellenkező irányba mozgó, hidratált anionok áramában mozognak. Az ionatmoszféra fékező hatását két egyéb hatás is csökkenti érvényes, amely az oldat vezetésének növekedéséhez vezet. Egyrészt ugyanis kellően nagy frekvenciájú tér esetén (~1 MHz) az ionok olyan gyorsan változtatják a mozgás irányukat, hogy az ionatmoszféra eltorzulása elhanyagolhatóvá válik, így megszűnik a központi ion mozgását fékező relaxációs effektus. Ez a jelenség a Debye- Falkenhagen-effektus. Másrészt pedig nagyon erős elektromos térben (106-107 V/m) olyan gyorsan mozognak az ionok, hogy nem tud kialakulni az ionatmoszféra, ezt Wien- effektusnak nevezzük (Bagotsky, 2006).
Az elektrolit oldat vezetése közvetlen kapcsolatban van az ionmozgékonysággal.
Egy c mol/dm3 koncentrációjú, Bν+Aν- elektrolit vizes oldatában az ionok mozgásából eredő áramsűrűség (Liszi, 1993):
Etér
F c ) z u z (u
j= +ν+ + + −ν− − (17)
A (17) egyenletet összehasonlítva Ohm-törvényével a moláris vezetés a következőképpen alakul:
F ) z u z (u
Λm = +ν+ ++ −ν− − (18)
1.1.6. Diffúzió elektrolitokban
A (13) egyenlet az anyagtranszport hajtóerejét írja le, amely lineáris diffúzió esetén, és a kémiai potenciál explicit alakját behelyettesítve (Liszi, 1993):
x T lnc x k
Fe µ
∂
− ∂
∂ =
−∂
= (19)
A Fick-egyenlet j=-Di ∂c/∂x, és a diffúziós áramsűrűség (j=cū) kombinációjából az ion átlagos sebessége:
x c D ln x c c
u Di i
∂
− ∂
∂ =
− ∂
= (20)
A (19) és (20) egyenletek alapján:
i Fe
T k
u= D (21)
Ha az erőt az Fe=zeE-el adjuk meg, akkor az átlagos sebesség felírható a következőképpen:
e
tér F
e z E u u
u= = (22)
A (21) és a (22) egyenletek összehasonlításából megkapjuk az Einstein–
egyenletet, amely kapcsolatot teremt az ionmozgékonyság, és a diffúziós tényező között:
e z
T k
Di= u (23)
Az Einstein-egyenletet a (18)-as egyenletbe behelyettesítve a Nernst-Einstein- egyenletet kapjuk, amely segítségével vezetési adatokból meghatározható a diffúziós tényező (Atkins, 1994):
) D D RT (
F ) z D D kT (
eF ) z u u ( F
z ++ − = 2 ++ − = 2 2 ++ −
=
Λ (24)
A közös diffúziós együttható az ionok diffúziós együtthatójának harmónikus középértéke (Liszi, 1993):
+
=
−
+ D
1 D
1 2 1 D
1
i
(25) Az elektromos tér kölcsönhatásba lép az ionokkal. A kölcsönhatási energia megváltoztatja az ionok kémiai potenciálját. Ha egy mol (zie) töltésű iont zérus potenciálú helyről Φ potenciálú helyre visszük, zFΦ elektromos munkát kell végeznünk. Ennyivel nagyobb lesz a töltött rendszer potenciálja:
FΦ z lna T R µ µ~
j 0
j
j= + + (26)
1.2. Elektródok
Elektródnak nevezzük az olyan heterogén elektrokémiai rendszert, amelyben legalább két fázis érintkezik, és ezek közül az egyik elektron- vagy félvezető, a másik pedig ionvezető. Az elektródot azonban sokszor a következőképpen definiálják:
elektród az az anyagi rendszer, amelyben egy határfelületen az elektródreakció végbemegy (Atkins, 1994). Ez a definíció egyes esetekben azonban nem állja meg a helyét.
Egyszerű elektródnak nevezzük az olyan elektródot, amelyben csak egyetlen elektródreakció, keverékelektródnak pedig az olyan elektródot, amelyben egynél több elektródreakció megy végbe (Kiss, 1997).
Egy elektrokémiai cellában két típusú elektród van jelen, az anód és a katód.
Anódnak nevezzük azt az elektródot, amelyen az átfolyó eredő áram pozitív. Az anódon az oxidáció a kizárólagosan, vagy túlnyomó részben lezajló folyamat. Ezeket az oxidációs reakciókat nevezzük anódreakcióknak. Katódnak nevezzük azt az elektródot, amelyen az eredő átfolyó áram negatív. A katódon a redukció a kizárólagosan vagy túlnyomó mértékben végbemenő reakció. Az elektródon lezajló redukciós reakciókat katódreakcióknak szokás nevezni. Az elektródon egyensúlykor az anód- és a katódreakció sebessége azonos. Ez a sebesség elektromos árammal kifejezve a csereáram. Általában akkor egyensúlyi az elektród, ha a rajta végbemenő minden egyes reakcióra nézve egyensúly áll be.
1.2.1. Elektromos potenciál
Az elektródot felépítő fázisok közötti potenciál, a Galvani-potenciálkülönbség abszolút értéke nem határozható meg, csak annak változása, mivel a mérőberendezéssel való összekötéskor elektrokémiai cella keletkezik (Koryta, 1993). A cella elektromos potenciálkülönbsége viszont mérhető, ami a két elektród azonos fémes hozzávezetése közötti potencálkülönbség, függetlenül attól, hogy folyik-e áram a cellán keresztül vagy sem. Az elektromos potenciálkülönbséget két elektródpotenciál különbségére választhatjuk szét. Ez megvalósítható, ha az egyik elektród egy jól definiált egyensúlyi állapotban lévő elektród (referenciaelektród), ekkor a mért potenciál értékéből egy relatív skálán következtethetünk az elektród potenciáljára. A skála nullpontját megállapodás alapján a molekuláris hidrogén szolvatált protonná történő oxidációja jelenti (Atkins, 1994).
a F ln 0 RT E
E= − (27)
1.2.2. Elektródfolyamatok kinetikája
Az elektródfolyamat kifejezés valamely adott elektródon vagy annak közelében elektromos áram hatására fellépő változások összességét jelöli. A határfelületi reakciót, amely magába foglalja a töltésátlépést, de ezenkívül a határfelületi tartományban lejátszódó kémiai reakciókat, szerkezeti átrendeződéseket és az adszorpciót is, elektródreakcióknak nevezzük (Kiss, 1999). Az elektródfolyamatban az elektródreakción kívül szerepet játszik a határfelülethez, illetve a határfelülettől történő anyagtranszport is, sőt sok esetben ez a sebesség meghatározó lépés is.
Az elektródfolyamat lejátszódásakor vizsgálhatjuk, hogy milyen összefüggés áll fenn az átfolyó áram és potenciál között. Vizsgálatokat lehet végezni állandó feszültség mellett (potenciosztatikusan), ekkor az átfolyó áramerősség a vizsgált paraméter, vagy állandó áram mellett (galvanosztatikusan), amikor a potenciál változása a mért mennyiség (Atkins, 1994). Az elektródfolyamatok során fellépő lehetséges részfolyamatok a következők (Kiss, 1999):
• anyagtranszport a határfelülethez, illetve a határfelülettől
• ionok illetve molekulák adszorpciója és deszorpciója, illetve kemiszorpciója
• töltésátlépés
• elektródreakciók
• Az elektródfém felületének esetleges szerkezeti átrendeződése, az oldószer- molekulák, illetve a reakcióban résztvevő ionok, molekulák szerkezeti relaxációs folyamatai
• Az oldat belsejében lejátszódhatnak különféle gócképződéses és kristályosodásos folyamatok
A részfolyamatok egy része vagy egésze egymás után megy végbe a sorozatos folyamatok reakciókinetikai törvényei szerint. A bruttó folyamat sebességét mindig az energetikailag leginkább gátolt („leglassúbb") részfolyamat sebessége határozza meg.
A határréteg szeparációs módszer során az elektródfolyamatok közül anyagtranszport illetve az ionok adszorpciója és deszorpciója következik be. A folyamat során nem történik elektródreakció.
1.2.3. Polarizáció
Azokat az elektródokat, amelyek potenciálja csak kis mértékben változik, ha áram halad át rajtuk, nem polarizálható elektródoknak nevezzük. Azokat az elektródokat amelyek potenciálja nagymértékben függ az áthaladó áram erősségétől polarizálható elektródoknak nevezzük (Atkins, 1994).
Ha a nem polarizálható elektródba töltéseket vezetünk, a fázishatáron töltések mennek át és az áram megszűnése után azonnal visszaáll az eredeti egyensúlyi állapot.
Ezzel ellentétben az ideálisan polarizálható elektródokra jellemző hogy a fázishatáron töltésátlépés nem lehetséges vagyis elektródfolyamat nem megy végbe. Az elektródra adott potenciálkülönbség a feszültség forrás kikapcsolása után is megmarad és csak a depolarizációs idő után áll vissza a polarizáció előtti állapotba. Ekkor az ionok és a dipólusmolekulák adszorpciója játszik fontos szerepet. Az ideálisan polarizálható elektród tökéletes veszteségmentes kondenzátorként viselkedik (Kiss, 1997).
A kísérletekben polarizálható elektródokat használtam fel.
1.2.4. Alkalmazható elektródok
A dolgozatban tárgyalt jelenségekhez (elektrokémiai adszorpció) nagy felületű elektródok szükségesek. Többnyire nagy fajlagos felületű, porózus szén–elektródokat használnak (Niu, 2004a, 2004b, 2002a; Rong, 2005; Béguin, 2002; Ying, 2002;
Ayranci, 2001a; Bán, 1998; Cohen, 1987; Koresh, 1977). A modernkor anyagait felhasználva szén nanocső és szénszál kompozitokból készült elektródokat (Pan, 2009,
Wang, 2007) és aktivált szén szálakat (Jung, 2001 ) valamint aktivált szén szövetet (Bayram, 2009; Huang, 2009, Niu, 2006, 2003, 2002c) is alkalmaznak elektródként.
Kísérleteket végeztek szén aerogél alapú elektródok felhasználására is (Gabelich, 2002;
Pekala, 1998; Farmer, 1996)
Fém elektródok közül leggyakrabban a réz (Conway, 1961; Parsons 1981), a platina (Bagotzky, 1970; Horányi, 1997; Zinola, 1999 ), az arany (Vericat, 2004) és az ezüst (Hamad, 2004) elektródokat alkalmazzák felületkezelés nélkül. Felületkezeléssel nagy felületű fémelektródok állíthatók elő. A fémes vezető felületére kémiai reakció vagy adszorpció útján olyan vegyületeket rögzítenek, melyek jelentős mértékben módosítják az elektród sajátságait. A legtöbb esetben egy teljesen új elektródot hoznak létre ahol az alapfém már csak áramvezetésre szolgál (Inzelt, 1999b). NiO, Co3O4 és Fe2O3 hidrogénnel történő redukciójával makropórusos Ni, Co és Fe állítható elő (Yan, 1999). Porózus Ni, Cu, Ag, Pt, és Au állítható elő úgy, hogy kolloid kovasavra fémet választanak le, majd kalcinálás után HF-dal eltávolítják a szilícium–dioxidot (Jiang, 1999).
Az elektrokémiai módszerek közül közismert a platinázott platina előállítása (Feltham, 1972). Ennek mintájára nagy felületű „fekete” vagy „szürke” nikkel elektród is készíthető (Horányi, 1984; Berezina, 1951). Potenciálciklizálás alkalmazásával a polikristályos sima felületből adott kristályorientációnak megfelelő platina, arany, ródium és palládium elektródok állíthatók elő, amely a kialakuló oxidréteg átrendeződésének és redukciójának következménye (Arvia, 1986).
A kísérleti részben a határréteg szeparációs módszert két különböző típusú elektróddal kívántam tesztelni. A kereskedelmi forgalomban kapható nikkel elektródok előállításakor a nikkelt inert hordozóra viszik fel, így nem vezető a teljes felületük.
Ennek értelmében a kísérletekhez a Vegyipari Műveleti Intézeti Tanszéken állítottam elő stabil, teljes felületükön vezető nikkel elektródokat.
1.3. Az elektrokémiai adszorpció
Elektroszorpción elektromosan töltött elektródok felületén végbemenő adszorpciót értünk (Rong, 2005). Az elektromos polarizáció történhet galvanosztatikusan vagy potenciosztatikusan (Niu, 2002a). A gyakorlatban többnyire a galvanosztatikus módszert részesítik előnyben (Niu, 2002a, 2002b; Vaškelis, 2004).
Katódosan polarizált (negatív) elektródon a kationok elektroszorpciója lép fel. Ez az elektroszorpció szuperponálódik a fizikai (töltés nélküli elektródon lejátszódó) adszorpcióra. Ha ellentétesre változtatjuk az elektromos polarizáció irányát, akkor a kationok deszorbeálódnak (Afkhauin, 2002; Xu, 2000; Farmer, 1996; Ayranci, 2001b).
Elektroszorpció segítségével szervetlen (Oren, 1978) és szerves ionok pl. fenolok (Ayranci, 2001a), piridin (Niu, 2002a), anilin és bipiridinek (Niu, 2002b), továbbá tiocianát (Rong, 2005) távolíthatók el vizes oldatokból. Kolloid részecskék eltávolítására is találunk példát (Hall, 1987). A gyakorlati alkalmazások közül figyelemre méltó a szennyvíz-tisztítás (Ganesh, 2004; Niu, 2002a; Niu, 2002b; Ayranci, 2001a, Genders, 2000) a víz-sótalanítás (Oren, 2008, 1992a, 1992b, 1983a, 1983b, 1978; Ginffrida, 1990; Ginffrida, 1986; Johnson, 1971) és izotópokat is tartalmazó szennyvízkezelés (Hobbs, 1999).
1.3.1. Kettősréteg kialakulása
Az elektród és az elektrolit érintkeztetésekor töltésátrendeződés következik be az elektrolitban, és a felület mentén kialakul az elektrokémiai kettősréteg (Bagotsky, 2006), melyet a 3. ábra szemléltet (Scholz, 2005). A réteg kialakulásának feltétele, a két fázis közötti potenciálkülönbség.
3. ábra
Elektrokémiai kettősréteg az oldat és az elektród határfelületen
Ha az elektródtöltés negatív, a kationok lokális sűrűsége (n+(x)) nagyobb az elektród közelében, mint az anionok sűrűsége (n-(x)). A 4. ábra az ionok eloszlását, és a töltéssűrűség változását mutatja, ahol x az elektródtól való távolság. Az elektródtól távolodva az ion sűrűségek a megfelelő tömbfázisbeli értékekhez tartanak (Boda, 2002).
4. ábra
Ionok eloszlása a határfelület környezetében
1.3.2. Az elektrokémiai kettős réteg szerkezete
Egy szilárd-folyadék határfelület idealizált szerkezetét vizsgálva, a szilárd felszínt molekuláris szintig síknak tekintve az x=0 helyen lévő képzeletbeli sík két homogén fázist választ el (egy szilárd és egy vizes). A szilárd fázisban Q töltéstöbblet van, amelyet a felületre vonatkoztatott a felületi töltéssűrűséggel jellemezük:
G
ρt =Q (28)
A felületi töltéstöbbletet a vízben lévő ionok ellenkező előjelű töltéstöbblete (-Q) kompenzálja, hiszen a makroszkópos rendszer elektromosan semleges. Fontos, hogy hol
helyezkednek el a vizes fázisban a felületi töltést kompenzáló ellenionok, azaz milyen lesz a határfelület lokális elektromos szerkezete (Delahay, 1966).
Erre vonatkozóan több, egymást kiegészítő, pontosságukat tekintve egyre jobb modell készült. A következő fejezetekben a kettős réteg modellezésének fejlődését tekintettem át.
1.3.2.1. Helmholtz-féle elektromos kettősréteg modell
A legegyszerűbb elképzelés a síkkondenzátor-modell. Az ionok a fém töltésének következtében feldúsulnak a fém felületén. A felületen rögzített formában (nem mozgékonyak) vannak jelen és a kondenzátor másik fegyverzetét képezik (Vol’fkovich, 2002).
A kettősréteg szerkezetének további vizsgálatánál vegyük figyelembe azt is, hogy az elektrolit kationjai hidratált formában vannak jelen (Atkins, 1994). Az ionok a hidrátburkuk által megszabott távolságra közelítheti meg a fém felületét. Helmholtz síkkondenzátor modellje szerint a hidratált ionok középpontján átfektetett síkot a Helmholtz-síknak nevezik.
A Helmholtz-réteg a fém és a külső Helmholtz-sík közötti, δ vastagságú réteg.
1.3.2.2. Gouy-Chapman féle diffúz elektromos kettősréteg modell
Gouy és Chapman egymástól függetlenül javasoltak egy új modellt, ahol figyelembe vették, hogy a kialakult réteg nem lehet merev, hanem diffúzá válik (Atkins, 1994). Az ionok hőmozgása miatt, a felülettől számított véges tartományban (diffúz rétegben) alakul ki az elektród töltését kompenzáló ionok által létrehozott tértöltés (Inzelt 1999a).
Az elektromos kettősréteg modelljében az elektródot egy végtelen kiterjedésű töltött síkfelületként értelmezték (Boda, 2002). Vagyis a rendszer planáris geometriával rendelkezik, miszerint a rendszer a felülettel párhuzamos két dimenzióra nézve homogén. Ezen megfontolások alapján Maxwell I. törvénye felírható egy dimenzióban:
(x) dx ρ
dD(x)
= t (29)
Abban az esetben, ha a közeg dielektromos állandóját konstansnak tekintjük, a D(x) felírható a potenciál segítségével is:
x d ε dψ (x) ε
E ε
D(x) = ε0 tér = − 0 (30)
A (30) egyenletet felhasználva, és a (29) egyenletbe visszaírva, kifejezhető az úgynevezett Poisson-egyenlet egy dimenziós alakja:
(x) ερ ε
1 dx
ψ(x) d
t 0 2
2
−
= (31)
A kettősréteg esetében a peremfeltételeink a következők:
Ha x → ∞, akkor ψ(x) → 0 Ha x → 0, akkor ψ(x) → ψ0
Ezek alapján Poisson-egyenlet megoldása Boltzmann-eloszlást feltételezve a következő integrális alakban adható meg (Rieger, 1994):
∫
∞
′
− ′
− ′
=
x t 0
x )d x )(x x ( ε ρ ε
ψ(x) 1 (32)
A ρ(x) töltéssűrűség meghatározható Monte Carlo szimulációval, és annak ismeretében numerikus integrálással adható meg a potenciálprofil. Ugyanez a megközelítés használatos ionok szolvatációjánál tömbfázisban, ahol Debye-Hückel elméletnek hívják, illetve kolloidkémiában, ahol Derjaguin-Landau-Verwey-Overbeek egyenletnek nevezik.
Tekintsük az ionok sűrűségeloszlásait (ni(x)), melyekre feltételezzük a Boltzmann- eloszlás érvényességét:
−
= kT
ψ(x) exp q
n (x)
ni Bi i (33)
A (33) egyenlet azt mutatja, hogy az illető ion milyen valószínűséggel tartózkodik az „x” helyen. Ez a valószínűség annak az energiának az exponensével arányos, amit az illető ion az adott helyen felvesz „kT” egységben mérve. Látható, hogy az egyenlet összefüggést állapít meg a potenciál és az ionsűrűség között, akár csak a Poisson- egyenlet, ezért könnyen összehozható a két egyenlet. A Boltzmann-eloszlást a Poisson- egyenletbe behelyettesítve a következő egyenletet kapjuk (Poisson-Boltzmann egyenlet):
∑
−
−
=
i B i i i 0 2
2
T k ψ(x) exp q
n ε q ε
1 dx
ψ(x)
d (34)
A modell a következő egyszerűsítéseket használja: az ionokat ponttöltéseknek feltételezi, emiatt annak érvényessége csupán a híg oldatokra korlátozódik, valamint az egyenlet megoldása során linearizálást alkalmaz.
Az (34) egyenlet megoldásához ki kell kötni a következőket:
Ha x → ∞, akkor ψ(x) → 0,
valamint rögzítenünk kell az elektródpotenciált ψ(0)=Vo.
Amennyiben qiψ(x)<<kT, akkor az egyenlet linearizálható, vagyis az exponenciális Boltzmann-faktor sorba fejthető. Majd ezt szummázva, és bevezetve a Debye-féle árnyékolási hossz fogalmát az egyenlet könnyen megoldható, melynek eredménye:
x κ
0 e D
V
ψ(x)= ⋅ − ⋅ (35)
A Debye-féle árnyékolási hossz az az inverz távolság, amely alatt a potenciál e-ad részére csökken:
∑
= ε εkT n κ q
0 B i 2 2 i
D (36)
A kapott ψ potenciál-függvényt két különböző κD értéknél a szilárd felülettől vett távolság függvényében ábrázolva az 5. ábra feltüntetett görbéket kapjuk.
5. ábra
Az elektrosztatikus potenciál változása az oldat-fázisban
Ha a (33) Boltzmann-eloszlás egyenletébe visszahelyettesítjük a potenciált, akkor megkapjuk a sűrűségprofil egyenletét:
−
=
−
= e−κ x
kT V 1 q kT n
ψ(x) 1 q
n (x)
n B i Bi i D
i
i (37)
Az előzőekben ismertetett levezetésnek egyik fontos pontja az, hogy az elektródpotenciált (V) rögzítettük, azonban ezt megtehetjük az elektródtöltéssel is (σ).
Ugyanis a kettősrétegben lévő töltések száma ellensúlyozza az elektródon levő töltéseket, vagyis számuk megegyezik:
[
q n (x)]
dxσ
0
i
∫ ∑
i∞
= (38)
A (38)-as egyenlet eredményéül kapjuk az alábbi egyszerű összefüggést:
D 0
0ε V κ
ε
σ = ⋅ (39)
Ez alapján megállapítható, hogy bármelyiket használhatjuk független váltózóként, mert a köztük lévő összefüggés lineáris, és egyértelmű.
Az elektród és a diffúz réteg gyakorlatilag felfogható úgy, mint egy kondenzátor egy-egy fegyverzete. Ha a kondenzátor kapacitást úgy definiáljuk, hogy:
V0
C = σ (40)
A kettősréteg kapacitására a következő összefüggés adódik:
D 0
ε κ
C = ε
(41)A Gouy-Chapman modell jól alkalmazható a különböző anyagi rendszereknél pl. nátrium-dodecil-szulfát – NaCl – H2O rendszerben (Persson, 2003) és NaCl – montmorillonit rendszerben (Tournassat, 2009). A pontosabb leírásokhoz azonban a továbbfejlesztett modelleket használják.
1.3.2.3. A Gouy-Chapman-Stern-féle, kétrétegű modell
A Helmholtz- és a Gouy-Chapman modell sem adja vissza jól a kettősréteg sajátságait. A Helmholzt modell túlbecsüli, míg a Gouy-Chapman modell alulbecsüli az oldat helyi strukturáltságát. A Gouy-Chapman modell hiányossága, hogy az ionokat pontszerűnek tekinti. Ez által azt is megengedi, hogy az ionok az elektródot tetszőleges távolságig megközelítsék, akár nulla távolságra is. A valóságban ez természetesen nem lehet így, ezért a modellt Otto Stern javaslatára később módosították (Atkins, 1994).
A Stern-modell a Helmholtz- és a Gouy-Chapman modellt kombinálja. Az elektródhoz legközelebb eső ionokra a Helmholtz-féle merev elrendeződést veszi figyelembe, az elektródtól távolabb pedig a Gouy-Chapman- féle diffúz elrendeződést tekinti érvényesnek. Ezen kívül megengedi a specifikus kölcsönhatást is, mivel a fém felületén gyakran nemcsak az elektrosztatikusan megkötött ionok vannak, hanem van der Waals-féle erőkkel vagy kémiai kölcsönhatással megkötött (adszorbeálódott) ionok és molekulák is. Az ilyen, nem elektrosztatikus kölcsönhatással bekövetkező adszorpciót specifikus adszorpciónak nevezzük. A specifikus adszorpcióval kötődő ionokat Stern mellett mások is vizsgálták pl. réz (Gómez, 1986), platina (Armand, 1989), ezüst (Hupp, 1983) és higany (Lamperski, 1996) elektródokon.
A Gouy-Chapman-Stern modell szerint az ionok csak d/2 távolságra közelítik meg az elektródot (d = a hidratált ionok átmérője), de a számítások során továbbra is pontszerűnek tekinthetők. Vagyis a diffúz rétegre vonatkozó modell változatlan maradt csak d/2 távolsággal el van tolva a felülettől a sűrűség- és potenciálprofil. A x=0 és az x=d/2 távolság közötti réteget nevezzük Stern-rétegnek, vagy Helmholtz-rétegnek, amelyre jellemző, hogy töltéseket nem tartalmaz, azonban potenciálesést létesít a réteg két oldala között. Ez az úgynevezett Gouy-Chapman-Stern elmélet (Boda, 2002).
Az x=d/2 pontban a potenciált jelöljük Vd-vel (diffúz réteg potenciálja), így a potenciálprofil egyenlete a következőképpen módosul:
−
−
⋅
= 2
x d κ d
e D
V
ψ(x) (42)
A Vd potenciál meghatározható a Stern-réteg vastagságának (d/2) és a benne lévő E = σ/ε0ε térerősség ismeretében. Ebből a potenciálesés meghatározható:
ε 2ε
dσ 2 E d V V
0 d
0− = ⋅ = (43)
Ebből pedig adódik a Vd potenciál:
ε 2ε V dσ V
0 0
d = − (44)
A potenciálprofil az x < d/2 távolságra lineárisnak adódik, amely jól látszik, ha felírjuk rá a következő alakot:
ε ε V σx x E V (x) V
0 tér
0
0 = − = − (45)
A kapacitást az előzőekhez hasonlóan, a sűrűségprofilok integrálásával lehet meghatározni:
2 dκ 1
κ ε ε V C σ
D D 0
+
=
= (46)
Vegyük a (46) egyenlet reciprokát, és rendezzük át:
ε 2ε
d ε ε κ
1 C
1
0 0
D
+
= (47)
Jól látható hogy a teljes rendszer kapacitása úgy áll elő, mint két sorba kötött kondenzátor kapacitása, vagyis a kettőnek az összege. Az első tag maga a diffúz-réteg kapacitása, a második tag a Stern-réteg kapacitása.
A Gouy-Chapman-Stern modell a szervetlen kationok mellett szerves kationok adszorpciója során is alkalmazható (Rytwo, 2004). Ezen kívül a modell nem csak fém/
elektrolit rendszerekre ad leírást, hanem felhasználható fém/ionos folyadék határfelületen is (Oldham, 2008).
1.3.2.4. A Gouy-Chapman-Stern-Grahame-féle, háromrétegű modell
Grahame mutatott rá, hogy specifikus adszorpció esetén célszerűbb 3 rétegű modellt alkalmazni. A modellt tovább bővítették amelyben a Stern-réteget további két rétegre osztották fel. Ez a Gouy-Chapman-Stern-Grahame-modell (Bagotsky, 2006).
Ezen modell szerint a legbelső síkot speciális adszorpcióval kötött ionok középvonala adja (6. ábra). Ezek mindenképpen közelebb helyezkednek el az elektród felületéhez, mivel hidrátburokkal nem rendelkeznek. Ezt a síkot belső Helmholtz-síknak (x1) nevezik. A belső és a külső Helmholtz-sík (x2) közötti réteg a külső Helmholtz-
réteg, a belső Helmholtz-sík és a fém közötti réteg pedig a belső Helmholtz-réteg (Koryta, 1993).
A külső Helmholtz-síktól indulva az oldat belseje felé helyezkedik el a diffúz réteg. A diffúziós réteg határa (x3) az a sík, ahol a potenciál nem különbözik számottevően a tömbfázisbelitől.
A két Helmholtz-rétegre jellemző, hogy bennük a potenciálesés lineáris, de eltérő meredekségű lehet. A Helmholtz-rétegen kívül elhelyezkedő diffúziós-rétegben a potenciálesés pedig exponenciális.
Az előzőekben bemutatott modellekre felírt összefüggések itt is érvényesek, azzal a módosítással, hogy a diffúz ionatmoszféra kiépülését a fémfelszín helyett a külső Helmholtz síktól értelmezzük, valamint a felületi potenciál ψ0 helyett ψ2-vel számolunk.
6. ábra
A háromrétegű modell szerkezete és potenciálprofilja, ahol x1:belső Helmholzt-sík határa, x2:külső Helmholzt-sík határa, Ψ0: az elektród felületén a potenciál,
Ψ1, Ψ2: a Helmholtz-rétegek határain a potenciál
A modell széleskörűen alkalmazott, a Gouy-Chapman modellel összehasonlítva pontosabb leírást ad az elektrokémiai rétegről különböző koncentrációjú tartományokat vizsgálva (Usui, 2004). A modellt alkalmazták az egyes ionok aktivitásának meghatározására is pl. KF vizes oldatában (Grassi, 1987).