AMINOKARBONILEZÉS ALKALMAZÁSA ÚJ SZTERÁNVÁZAS VEGYÜLETEK SZINTÉZISÉBEN
Ph.D. DOKTORI ÉRTEKEZÉS
Készítette:
Takács Eszter okleveles vegyészmérnök
Témavezető:
Skodáné Dr. Földes Rita egyetemi docens, az MTA doktora
PANNON EGYETEM
KÉMIAI TUDOMÁNYOK DOKTORI ISKOLA
VESZPRÉM 2008
AMINOKARBONILEZÉS ALKALMAZÁSA ÚJ SZTERÁNVÁZAS VEGYÜLETEK SZINTÉZISÉBEN
Értekezés doktori (Ph.D.) fokozat elnyerése érdekében
Írta:
Takács Eszter
Készült a Pannon Egyetem Kémiai Tudományok Doktori Iskolájának keretében.
Témavezető: Skodáné Dr. Földes Rita Elfogadásra javaslom (igen/nem).
……….
(aláírás)
A jelölt a doktori szigorlaton ……... %-ot ért el.
Veszprém, ………....
……….
a Szigorlati Bizottság elnöke
Az értekezést bírálóként elfogadásra javaslom:
Bíráló neve: ………. igen/nem.
..………
(aláírás) Bíráló neve: ………. igen/nem.
...………
(aláírás)
A jelölt az értekezés nyilvános vitáján …………%-ot ért el.
Veszprém, ……….
.……….
a Bíráló Bizottság elnöke A doktori (Ph.D.) oklevél minősítése:……….
.………..
az EDT elnöke
„A tudomány arra a tapasztalatra épül, hogy a természet értelmes kérdésekre értelmes válaszokat ad, következésképpen amennyiben nincs válasz, minden bizonnyal a kérdéssel van a baj.
A kérdés ugyanis hibás, minthogy „élet”, mint olyan, nem létezik - még soha senki nem látta. Amit látunk, azok anyagi rendszerek, amelyek azzal a csodálatos tulajdonsággal rendelkeznek, hogy élők.
Az „élet”- egyfajta minőség, és a kérdés e minőség mibenlétében áll.”
(Szent-Györgyi Albert, 1893-1986)
Köszönetemet szeretném kifejezni témavezetőmnek, mentoromnak Skodáné Dr.
Földes Ritának, odaadó figyelméért, türelméért, mindig hasznos tanácsaiért, emberi és szakmai segítségéért, hogy bármilyen helyzetben számtíhattam útmutató és mértékadó meglátásaira; továbbá Dr. Kollár Lászlónak szakmai segítségéért.
Köszönöm kedves barátaimnak, kollégáimnak: Horváth Anitának, Kuik Árpádnak, Balogh Jánosnak, Dr. Szarka Zsoltnak a felejthetetlenül élménygazdag együtt töltött éveket.
Köszönet illeti továbbá a Pannon Egyetem Szerves Kémia Intézeti Tanszékének minden dolgozóját, akik munkámat mindvégig segítették. Köszönöm Dr. Bakos Józsefnek, hogy értekezésem befejezésének feltételeit biztosította (NKFP 07 A2 FLOWREAC).
Szeretném megköszönni Édesapámnak és Édesanyámnak végtelen szeretetüket, emberi, szellemi és anyagi támogatásukat, amellyel lehetővé tették, hogy elindulhassak utamon.
Takács Eszter
TARTALOMJEGYZÉK
BEVEZETÉS 1
1. IRODALMI ÁTTEKINTÉS 3
1.1 A szteránvázas vegyületek 3
1.1.1. A szteroidok csoportosítása és bemutatása 3 1.1.2. A nitrogéntartalmú szteroidok biológiai jelentősége 7
1.1.2.1. Az aza-szteroidok 7
1.1.2.2. Aminosav ⎯ szteroid és peptid ⎯ szteroid konjugátumok 9 1.1.2.3. Oldalláncban N-tartalmú heterociklussal rendelkező szteroidok 11
1.2. Palládium-katalizált karbonilezési reakciók 12
1.2.1. Aril-, vagy alkenil-halodenidek palládium-katalizált karbonilezése 13 1.2.2. A karbonilezés során leggyakrabban alkalmazott katalizátorok 15 1.2.2.1. Palládium katalizátor prekurzorok foszfán ligandumokkal 15 1.2.2.2. Foszfán ligandumot nem tartalmazó palládium katalizátorok 18
1.2.3. A homogénkatalitikus aminokarbonilezés 19
1.2.4. A homogénkatalitikus kettős karbonilezés 22
1.3. Primer karbonsavamidok előállítása 26
1.4. Ionfolyadékok, mint alternatív oldószerek 27
1.4.1. Az ionfolyadékok kutatásának története 27
1.4.2. Az ionfolyadékok tulajdonságai 28 1.4.3. Ionfolyadékban lejátszódó homogénkatalitikus reakciók 31 1.4.4. Aril-halogenidek karbonilezése ionfolyadékban 32
2. KÍSÉRLETI EREDMÉNYEK ÉS ÉRTÉKELÉSÜK 36
2.1. 17-Jód-5α-androszt-16-én aminokarbonilezése ionfolyadékban morfolin
reakciópartnerrel 36
2.1.1. A reakciókörülmények kiválasztása 36 2.1.2. Az ionfolyadék ⎯ katalizátor elegy újrafelhasználásának vizsgálata 38 2.1.3. Egyéb szteroidok aminokarbonilezése morfolin reakciópartnerrel 44 2.2. Az ionfolyadék ⎯ katalizátor elegy újrafelhasználásának vizsgálata
aminosav-észterek jelenlétében 45
2.2.1. Aminokarbonilezés glicin-metil-észter reakciópartnerrel 45 2.2.2. Aminokarbonilezés prolin-észter reakciópartnerekkel 49 2.2.3. Aminokarbonilezés egyéb aminosav-észterekkel 54
2.3. Szabad karboxilcsoportot tartalmazó szteroid ⎯ aminosav konjugátumok
előállítása és reakcióik 57
2.3.1. Szteroid ⎯ aminosav konjugátumok előállítása 59 2.3.2. 5(4H)-Oxazolonok előállítása szteránvázas aminosavakból 60 2.4. Primer karbonsavamidok és primer α-keto-karbonsavamidok előállítása 68 2.4.1. Szteránvázas primer karbonsavamidok előállítása 69
2.4.2. Aril-jodidok aminokarbonilezése 71
2.4.3. A terc-butil-csoport hasítása aril-N-tBu-karbonsavamidok és
aril-N-tBu-keto-karbonsavamidok esetében 73 2.4.4. A karbonilezés és hasítás kivitelezése „egy-lombik” reakcióként 74
3. METODIKAI RÉSZ 77
3.1. Felhasznált anyagok 77
3.2. Ionfolyadékok előállítása 77
3.3. Az aminokarbonilezési reakció kivitelezése 77
3.3.1. Aminokarbonilezés szerves oldószerben 77
3.3.2. Aminokarbonilezés ionfolyadék oldószerben 78
3.4. A szteroid ⎯ aminosav konjugátumok előállítása 78
3.5. Szteroid ⎯ aminosav konjugátumok (7a, 10a-12a) reakciója diciklohexil-
karbodiimiddel 79
3.6. Az alkenil- (1, 3, 5, 16) és aril-halogenidek (18-21) karbonilezési reakciója
tBuNH2-al 79
3.7. Primer karbonsavamidok és primer α-keto-karbonsavamidok előállítása 79
3.7.1. A módszer 79
3.7.2. B módszer 79
3.8. Analitikai vizsgálatok 80
3.9. Az előállított vegyületek analitikai adatai 80
ÖSSZEFOGLALÁS 90
IRODALOMJEGYZÉK 92
ÁBRÁK JEGYZÉKE
AZ IRODALMI ÁTTEKINTÉS ÁBRÁI
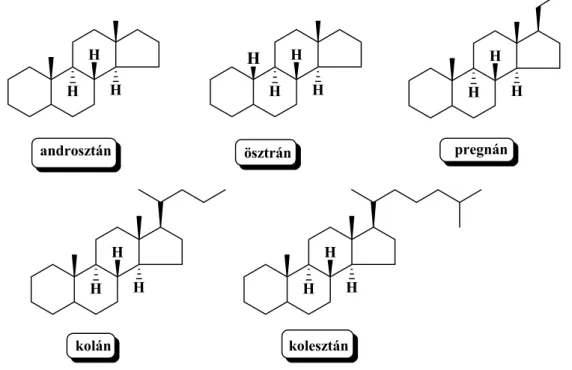
1. ábra A szteránvázas vegyületek csoportosítása 4 2. ábra A szteránváz szénatomjainak számozása 4
3. ábra A koleszterin szerkezete 5
4. ábra A szteroid alapváz leggyakrabban előforduló térszerkezeti lehetőségei 6 5. ábra A legfontosabb szteroidcsaládok 6 6. ábra Az 5α-reduktáz enzim biokémiai szerepe 8
7. ábra A finaszterid szerkezete 8
8. ábra A finaszterid addukt képzése az 5α-reduktáz enzimmel 8
9. ábra 5α-Androsztán-peptid konjugátum 9
10. ábra Ösztronszármazékok és aminosavak konjugátumai 10 11. ábra A (Cys-Gly-Cys)-estra-1,3,5(10),16-tetraeno[17,16-e]-2’-aminopirimidin
védett származéka 10
12. ábra A 17α-hidroxiláz-C17,20-liáz inhibitor hatású heterociklusos vegyületek 11 13. ábra Palládium-katalizált szerves kémiai reakciók 12 14. ábra Aril-halogenidek palládium-katalizált reakciói 13 15. ábra Acil-palládium-komplex reakciója nukleofil vegyületekkel 15 16. ábra A homogénkatalitikus karbonilezés mechanizmusa 15 17. ábra Az aktív katalizátor részecske kialakulása PdII(OAc)2 és PPh3 esetében 16 18. ábra A katalitikusan aktív Pd(0)-vegyület kialakulása [PdIICl2(COD)] esetén 18 19. ábra Az aminok jelenlétében lejátszódó karbonilezés feltételezett
mechanizmusai 19
20. ábra Szteránvázas alkenil-triflátok aminokarbonilezése 21 21. ábra A kettős karbonilezés feltételezett mechanizmusa 23 22. ábra Palládium-komplexek karbonilezése 23 23. ábra Aril-halogenidek kettős karbonilezése 24 24. ábra Leggyakrabban alkalmazott ionfolyadékok kationjai és anionjai 29 25. ábra A jód-benzol aminokarbonilezésének egyenlete 33 26. ábra Az imidazolium-kation kötődése a Pd-kolloid felületéhez 34
A KÍSÉRLETI RÉSZ ÁBRÁI
27. ábra A 17-jód-5α-androszt-16-én aminokarbonilezése morfolin jelenlétében 36
28. ábra A felhasznált ionfolyadékok 37
29. ábra A katalizátor-rendszerekben alkalmazott foszfánok 38 30. ábra Aminokarbonilezés különböző katalizátor-rendszerek felhasználásával
[bmim]+[PF6]- -ban 39
31. ábra Aminokarbonilezés PdII(OAc)2 + 2PPh3 katalizátorral, PPh3 pótlással 39 32. ábra Aminokarbonilezés [bmim]+[PF6]-ionfolyadékban 4/1 P/Pd aránynál 41 33. ábra Aminokarbonilezés [bmim]+[PF6]-ionfolyadékban 6/1 P/Pd aránynál 41 34. ábra Aminokarbonilezés [bmim]+[PF6]-ionfolyadékban 10/1 P/Pd aránynál 41 35. ábra Egyéb szteránvázas 17-jód-16-alkének aminokarbonilezése 44
36. ábra Aminokarbonilezés Gly-OMe-rel 46
37. ábra Aminokarbonilezés Gly-OMe-rel [bmim]+[PF6]-ionfolyadékban 2/1
P/Pd aránynál 46
38. ábra Aminokarbonilezés Gly-OMe-rel [bmim]+[PF6]-ionfolyadékban 4/1
P/Pd aránynál 47
39. ábra Aminokarbonilezés Gly-OMe-rel [bmim]+[PF6]-ionfolyadékban 6/1
P/Pd aránynál 47
40. ábra Aminokarbonilezés Gly-OMe-rel [bmim]+[PF6]-ionfolyadékban 10/1
P/Pd aránynál 47
41. ábra Aminokarbonilezés Gly-OMe-rel [bmim]+[BF4]-ionfolyadékban 4/1
P/Pd aránynál 48
42. ábra Aminokarbonilezés Gly-OMe-rel [bmim]+[BF4]-ionfolyadékban 6/1
P/Pd aránynál 48
43. ábra Aminokarbonilezés Gly-OMe-rel [bmim]+[BF4]-ionfolyadékban 10/1
P/Pd aránynál 48
44. ábra Aminokarbonilezés prolin-észterekkel 49 45. ábra Aminokarbonilezés L-Pro-OBzl-rel [bmim]+[PF6]- ionfolyadékban 2/1
P/Pd aránynál 50
46. ábra Aminokarbonilezés L-Pro-OBzl-rel [bmim]+[PF6]- ionfolyadékban 4/1
P/Pd aránynál 51
47. ábra Aminokarbonilezés L-Pro-OBzl-rel [bmim]+[PF6]- ionfolyadékban 6/1
P/Pd aránynál 51
48. ábra Aminokarbonilezés L-Pro-OBzl-rel [bmim]+[BF4]- ionfolyadékban 2/1
P/Pd aránynál 51
49. ábra Aminokarbonilezés L-Pro-OBzl-rel [bmim]+[BF4]-ionfolyadékban 4/1
P/Pd aránynál 52
50. ábra Aminokarbonilezés L-Pro-OBzl-rel [bmim]+[BF4]-ionfolyadékban 6/1
P/Pd aránynál 52
51. ábra Aminokarbonilezés L-Pro-OBzl-rel [bmim]+[BF4]-ionfolyadékban 10/1
P/Pd aránynál 52
52. ábra Aminokarbonilezés egyéb aminosav-észterekkel 53 53. ábra Különféle aminosav-észterek karbonilezése PdII(OAc)2 + 4PPh3 katalizátor
alkalmazásakor [bmim]+[PF6]- -ban 55
54. ábra Aminosav-észterek karbonilezése PdII(OAc)2 + 6PPh3 katalizátor
alkalmazásakor [bmim]+[PF6]- -ban 56
55. ábra Aminosav-észterek karbonilezése PdII(OAc)2 + 10DPPBA katalizátor
alkalmazásakor [bmim]+[BF4]- -ban 56
56. ábra Az 5(4H)-oxazolonok, béta-laktámok és a penicillin szerkezete 57 57. ábra Oxazolon-származékok előállítása aldehidekből 58 58. ábra Az oxazolon mint kiindulási vegyület 59 59. ábra Szteránvázas aminosav-amidok előállítása 59 60. ábra Szteroid ⎯ aminosav konjugátumok reakciója diciklohexil-karbodiimid
jelenlétében 61
61. ábra Aktiválás diciklohexil-karbodiimiddel 62 62. ábra A McLafferty átrendeződés ferrocén-származékok esetében 63 63. ábra Az oxazolon keténné alakulása Lewis-sav hatására 65 64. ábra Az oxazolon átalakulása fény hatására 67
65. ábra A fumaramidmycin szerkezete 68
66. ábra N-Me-amidok előállítása Weinreb amidokból 68 67. ábra Szteránvázas alkenil-halogenidek aminokarbonilezése tBuNH2
jelenlétében 70
68. ábra A tBu-amidok hasítási reakciója 70 69. ábra A hasítási reakció Boc-csoporttal védett amin esetében 71 70. ábra A vizsgált kiindulási aril-jodidok 72 71. ábra Aril-jodidok aminokarbonilezésének általános reakcióegyenlete 72 72. ábra A 18a-21a és 18b-21b vegyületek hasítási reakciója 73 73. ábra A primer karbonsavamidok és primer α-keto-karbonsavamidok előállítása
kétlépéses és „egy-lombik” szintézissel 75
TÁBLÁZATOK JEGYZÉKE A KÍSÉRLETI RÉSZ TÁBLÁZATAI
1. táblázat Különböző ionfolyadékok összehasonlítása az aminokarbonilezési
reakcióban 42
2. táblázat A katalizátor — ionfolyadék elegy újrafelhasználása szteránvázas
17-jód-16-alkének aminokarbonilezésénél 44
3. táblázat Az aminokarbonilezés összehasonlítása morfolin, glicin-metil-észter és prolin-észterek esetében PdII(OAc)2 + 2PPh3 katalizátor-rendszer
használatakor [bmim]+[PF6]--ban 50
4. táblázat A három nukleofil reagens esetében kapott optimális eredmények
összefoglalása 54
5. táblázat Egyéb aminosav-észterek jelenlétében lejátszódó aminokarbonilezés 55 6. táblázat A termékmegoszlások alakulása a reakciókörülmények függvényében 64 7. táblázat Aril-jodidok aminokarbonilezésének szelektivitás és izolált
hozam értékei 73
8. táblázat Aril-jodidok hasítási reakcióinak izolált hozam értékei 74 9. táblázat Primer karbonsavamidok és primer α-keto-karbonsavamidok előállítása
„egy-lombik” szintézissel 75
RÖVIDÍTÉSEK JEGYZÉKE
Ala alanin
Asp aszparaginsav
17β-HSD 17β-hidroxi-szteroid-dehidrogenáz BINAP 2,2’-bisz(difenilfoszfáno)-1,1’-binaftil
BINAS szulfonált 2,2’-bisz(difenilfoszfáno-metil)-1,1’-binaftilén [bmim]+ 1-butil-3-metil-imidazolium
Bn benzilcsoport
Boc terc-butoxi-karbonil-csoport
BOP [(benzo-triazol-1-iloxi)-trisz(dimetil-amino)-foszfonium]-hexafluoro-foszfát [bumepy]+ 1-butil-3-metil-piridinium
COD ciklooktadién
COSY correlation spectroscopy
dba 1,5-difenil-penta-1,4-dién-3-on DCC diciklohexil-karbodiimid
DPPBA 4-(difenil-foszfáno)-benzoesav DPPB 1,4-bisz(difenil-foszfáno)-bután DPPF 1,1’-bisz(difenil-foszfáno)-ferrocén DMF dimetil-formamid
[emim]+ 1-etil-3-metil-imidazolium Fmoc 9-fluorenil-metoxi-karbonil-csoport
Gly glicin
HATU [O-(7-aza-benzo-triazol-1-il)-N,N,N’,N’-tetrametil-uronium]-hexafluoro- foszfát
HBTU [O-(benzo-triazol-1-il)-N,N,N’,N’-tetrametil-uronium]-hexafluoro-foszfát HMBC heteronuclear multiple-bond correlation spectra
HMDS hexametil-diszilazán HOBt 1-hidroxi-benzo-triazol
HSQC heteronuclear single quantum coherence spectra ICP induktív csatolású plazma
IR infravörös spektroszkópia
Leu leucin
Met metionin
MS tömegspektroszkópia
NADPH nikotinsavamid-adenin-dinukleotid-foszfát NMP N-metil-pirrolidinon
NMR mágneses magrezonancia spektroszkópia OTf trifiloxi-csoport
PADPR foszfoadenozin-difoszforibóz
PNS 3-(difenilfoszfáno-propán)-N-(2-metil)-propánamid szulfonsav Li sója PPA poli-foszforsav
Pro prolin
Phe fenilalanin
PVP polivinil-pirrolidon
PyBOP [(benzo-triazol-1-iloxi)-tripirrolidino-foszfónium]-hexafluoro-foszfát tbab tetrabutil-ammónium-bromid
TBDMSOTf (terc-butil-dimetil-szilil)-trifluor-metánszulfonát TMSCl trimetil-szilil-klorid
THF tetrahidrofurán TOF átalakítási frekvencia TON átalakítási szám
TPPTS triszulfonált trifenil-foszfán trinátrium sója Vcp2 vanadocén
Kivonat
Aminokarbonilezés alkalmazása új szteránvázas vegyületek szintézisében
Készítette: Takács Eszter, okleveles vegyészmérnök
Témavezető: Skodáné Dr. Földes Rita, egyetemi docens, az MTA doktora
Doktori munkám során szteránvázas alkenil-halogenidek aminokarbonilezési reakcióinak vizsgálatával, valamint e reakció egyes termékeinek továbbalakításával foglalkoztam.
Részletesen tanulmányoztam a katalizátor újrafelhasználásának lehetőségét az említett szteroidok aminok vagy aminosavak mint nukleofil reakcióparnerek jelenlétében, ionfolyadék oldószerben lejátszódó aminokarbonilezésénél. Az ionfolyadékok számos egyéb pozitív tulajdonságuk mellett lehetővé teszik, hogy a karbonilezés lejátszódása után a terméket a reakcióelegyből alkalmasan megválasztott oldószerrel extraháljuk, miközben a katalizátor az ionfolyadékban marad és újrafelhasználható.
A folyamatok szelektíven játszódtak le bizonyos ionfolyadékokban mint oldószerekben. Megállapítottam, hogy a katalizátor aktivitáscsökkenésének mértéke az újrafelhasználás során jelentős mértékben függ az alkalmazott ionfolyadéktól, a ligandum megválasztásától és a palládium/ligandum aránytól. Az optimális reakciókörülményeket erősen befolyásolja a nukleofil rekaciópartner minősége is.
Az aminosavak mint nukleofil reakciópartnerek felhasználásával előállított amidok hidrolízisével nyert szabad karboxilcsoporttal rendelkező származékokból kiindulva oxazolon vegyületek előállítását terveztem.
A glicin-származék és diciklohexil-karbodiimid reakciójában jó hozammal és teljesen szelektíven kaptam a megfelelő oxazolon terméket. Az L-alanin-, L-metionin- és L-fenilalanin-származékok hasonló körülmények között két további, rendkívül nehezen elválasztható, ám jelentősen eltérő szerkezetű termékké alakultak. A várt oxazolon csak csekély hozamban keletkezett alanin és metionin esetében, fenilalanin használatakor pedig egyáltalán nem. Az új vegyületek (szteránvázas N-acil-karbamidok és imidek) szerkezetét különböző spektroszkópiai módszerekkel igazoltam és javaslatot tettem képződésük mechanizmusára.
Új, kétlépéses módszert dolgoztam ki primer amidok előállítására. Megállapítottam, hogy a szteránvázas alkenil-halogenidek tBu-amin jelenlétében lejátszódó palládium- katalizált karbonilezése során képződő N-tBu-karbonsavamidokból (terc-butil-dimetil- szilil)-trifluor-metánszulfonát (TBDMSOTf) segítségével a tBu-csoport eredményesen lehasítható. A módszert sikeresen alkalmaztam primer karbonsavamidok és primer α-keto- karbonsavamidok aril-jodidokból történő szintézisére is.
Kihasználva, hogy az aril-halogenidek tBu-aminnal lejátszódó karbonilezése magas hőmérsékleten fő termékként a megfelelő karbonsavamidhoz vezet, a hőmérséklet csökkentése pedig a kettős karbonilezésnek kedvez, a hőmérsékelt megfelelő megválasztásával sikerült jó szelektivitással előállítanom mind az N-tBu- karbonsavamidokat, mind az α-keto-N-tBu-karbonsavamidokat. E vegyületek TBDMSOTf-tal lejátszódó reakciójában jó hozammal izoláltam a kívánt primer termékeket.
Abstract
Application of aminocarbonylation in the synthesis of new steroidal compounds
Written by: Eszter Takács, Chemical Engineer
Supervisor: Dr. Rita Skoda-Földes, Associate Professor
Homogeneous catalysis may serve as an attractive tool in organic synthesis due to the mild reaction conditions and high activity and selectivity of the catalysts.
In this work the results concerning aminocarbonylation of steroidal 17-iodo-16-ene compounds with primary amine (morpholine) or secondary amine (aminoacid esters) nucleophiles are presented. It has been shown that the reactions were completely selective in the ionic liquids and the catalyst ⎯ ionic liquid mixtures can be reused several times.
The loss of catalytic activity of the recirculated mixtures depended greatly on the nature of the ionic liquid, on the phosphine ligand and on the ligand/palladium ratio. Optimal reaction conditions were greatly influenced by the choice of the nucleophile, as well.
The synthesis of new oxazolone derivatives by the reaction of steroidal amino acid derivatives and dicyclohexylcarbodiimide (DCC) was also attempted. Although the reaction of the glycine derivative led to the formation of the desired oxazolone with high selectivity, two other compounds as main products were isolated from the reaction mixtures of the L-alanine, L-methionine and L-phenylalanine derivatives and DCC. The structures of the new products, steroidal N-acylurea and imide derivatives, were determined by various spectroscopic methods.
Various primary amides and ketoamides have been obtained in good yields in a two-step reaction sequence. The first step involves the synthesis of aryl/alkenyl N-tert- butyl amides and aryl N-tert-butyl ketoamides from the corresponding iodides via palladium-catalysed carbonylation in the presence of tBuNH2 as the nucleophile. For the reaction of aryl halides, higher reaction temperature enhances both the reaction rate and the selectivity for α-ketoamide formation. Carbonylation was followed by selective cleavage of the tBu group using tert-butyldimethylsilyl trifluoromethanesulfonate (TBDMSOTf) as the reagent.
Zusammenfassung
Aminocarbonylierung in der Synthese von neuen Steroid-Verbindungen
Von: Eszter Takács, Chemieingenieurin
Mentorin: Dr. Rita Skoda-Földes, Chemieprofessorin
Die homogene Katalyse ist eine attraktive Methode in organischen Synthesen wegen der wenig drastischen Reaktionsbedingungen und die im Vergleich bessere Selektivität und Aktivität.
In dieser Arbeit sind die Ergebnisse die Aminocarbonylierung von Steroiden 17- Iodo-16-en Verbindungen mit primären Aminen (Morpholine) oder sekundären Aminen (Aminosäure-Estern) in der Anwesenheit der Nucleophilen vorgestellt. Es hat sich gezeigt, dass die Reaktionen in ionischen Flüssigkeiten völlig selektiv waren.
Das Ziel dieser Arbeit war die Untersuchung von Steroidaminosäuren mit freier Carboxylgruppe als Ausgangsverbindung in der Synthese von Oxazolonderivaten mit DCC (Dicyclohexylcarbodiimid) zu verwenden. Das Oxazolone-Produkt mit Phenylalanin ist nicht gebildet worden. Wir haben zwei unterschiedliche Produkte mit L-Alanin, L- Methionin und L-Phenylalanin ⎯ ausser Glycin ⎯ erhalten. Das Eine von diesen ist das entsprechende N-Acylkarbamide und das andere ist das entsprechende Imide-Produkt.
Verschiedene primäre Amide und Ketoamide waren in guten Ausbeuten in den zweistufigen Reaktionen gewonnen. Der erste Schritt ist die Synthese von Aryl/Alkenil N- tert-Butyl-Amiden von den entschprechenden Iodiden über Palladium-katalysierte Carbonylierung in der Anwesenheit von tBuNH2 als Nucleophile. Höhere Reaktionstemperature erhöhen die Reaktiongeschwindigkeit und die Selektivität der Bildung vom α-Keto-Amide in der Reaktion von Arylhalogeniden. Selektive Spaltung von der tBu-Gruppe folgt der Carbonylierung mit der Hilfe von Trifluoromethansulfonsäure- tert-butyl-dimethylsilylester (TBDMSOTf).
BEVEZETÉS
A szteroidok a biológiailag aktív vegyületek egyik legfontosabb csoportját alkotják.
A 17-es szénatomhoz kapcsolódó szubsztituens minősége meghatározó jelentőségű az egész molekula biológiai aktivitását tekintve. Nagy érdeklődésre tarthatnak számot bizonyos szteránvázas 17-karboxamidok, mint például az irodalmi összefoglalóban részletesen taglalt finaszterid. Ezért a későbbiek folyamán kutatásaim középpontjában e biológiailag nagy jelentőségű 17-karboxamid származékkal analóg vegyületek előállítása állt.
A palládium katalizátorok jelenlétében lejátszódó karbonilezési reakciók segítségével szelektíven és jó hozammal állíthatóak elő karbonsavszármazékok telítetlen halogenidekből mint kiindulási vegyületekből. A természetben előforduló szteránvázas ketonok könnyen átalakíthatók a megfelelő alkenil-jodidokká. Doktori munkám elsődleges célja e vegyületek aminokarbonilezésének vizsgálata volt.
A szteroid vegyületek palládium-katalizált reakciói során a megfelelő hozam eléréséhez viszonylag magas katalizátor/szteroid arányt kell alkalmazni. A reakció végén, az oldószer eltávolítása után a teljes katalizátor-mennyiség a nyerstermékben marad. Mind a katalizátor újrafelhasználása, mind a termék magas fémtartalma megoldásra váró problémát jelent.
Kísérleteim során célom az volt, hogy megállapítsam, az ionfolyadékok alkalmazhatóak-e szteránvázas vegyületek homogénkatalitikus reakcióinak oldószereként.
Választ kerestem arra is, felhasználható-e újra az ionfolyadék ⎯ katalizátor elegy, illetve megkönnyíti-e ez a módszer a termék tisztítását.
A szteránvázas kiindulási vegyületek aminokarbonilezését többféle nukleofil vegyület: morfolin, illetve aminosav-észterek: glicin-, L-metionin-, L-alanin-, L- fenilalanin-, L-prolin-metil-észter és L-prolin-benzil-észter jelenlétében is vizsgáltam. A glicin-, L-alanin-, L-fenilalanin- és L-metionin-metil-észter esetében a homogén- katalitikus reakcióban nyert észterekből savakat állítottam elő, melyek felhasználásával kísérletet tettem szteránvázas 5(4H)-oxazolon származékok szintézisére. Az összetett biológiai aktivitással rendelkező oxazolon-származékok előállításán túlmenően a savak szteránvázas peptid konjugátumok fontos kiindulási anyagai is lehetnek.
Szteránvázas alkenil-jodidokból két lépésben, terc-butil-amin jelenlétében lejátszódó karbonilezéssel, majd a tBu-csoport (terc-butil-dimetil-szilil)-trifluor- metánszulfonát (TBDMSOTf) segítségével történő lehasításával primer
karbonsavamidokat állítottam elő. A 17-es pozícióban heterociklust tartalmazó vegyületek kedvező biológiai hatással rendelkeznek, ezen vegyületek kiindulási anyagai lehetnek a szteránvázas primer alkenil-karbonsavamidok.
Mivel a kidolgozott eljárás mind a tBu-csoport mint védőcsoport eltávolítása, mind egyszerűbb primer karbonsavamidok szintézise szempontjából is érdekes lehet, megvizsgáltam a módszer alkalmazhatóságát primer aril-karbonsavamidok és primer aril- α-keto-karbonsavamidok szintézisében is.
Vizsgáltam annak lehetőségét is, hogy az aminokarbonilezést és a hasítási reakciót
„egy-lombik” (one-pot) reakcióként is meg lehet-e valósítani.
1. IRODALMI ÁTTEKINTÉS
Ebben a fejezetben szeretném összefoglalni a szteroidokkal kapcsolatos legalapvetőbb általános ismereteket. Részletesebben foglalkozom a tanulmányozott folyamatokban termékként nyerhető szteránvázas karboxamidok biokémiai jelentőségével.
Ismertetem a karbonilezéssel, az aminokarbonilezési reakcióval és a kettős karbonilezéssel kapcsolatos legfontosabb tudnivalókat, valamint bemutatom a kísérletek során oldószerként alkalmazott ionfolyadékok történetét és tulajdonságait.
1.1. A szteránvázas vegyületek
1.1.1. A szteroidok csoportosítása és bemutatása
A szteránvázas vegyületek döntő többsége kiemelkedő biológiai aktivitással rendelkezik. Fejlettebb élő szervezetek működéséhez nélkülözhetetlen a szteroid- származékok jelenléte. Ezen vegyületek felfedezése, biokémiai funkciójának megértése, szerves kémiai szintézise óriási jelentőséggel bír az egyre korszerűbb és hatékonyabb gyógyszerek kifejlesztésének szempontjából. A szteroidokkal kapcsolatos kutatási eredmények olyan széleskörűen használható ismeretanyaghoz vezetnek, amelyet a biokémiában és az orvostudomány területén is alkalmazhatunk.
A szteránvázas vegyületek a természetes szénvegyületek egyik különösen érdekes és jelentős csoportját alkotják. A vegyületcsoport neve a legrégebben ismert és tanulmányozott tagjának, a koleszterinnek a nevére utal.
A khole epét, a szterosz szilárdat jelent. Tiszta kristályos állapotban a koleszterint elsőként 1815-ben epekövekből Chevreul nyerte ki, akitől a vegyület elnevezése is származik.
Ez a vegyület az ember és a gerinces állatok szervezetének minden szövetében megtalálható. A legtöbb szövet 0,05-5% koleszterint tartalmaz, legnagyobb mennyiségben a velőállományban van jelen.
További kutatások azt igazolták, hogy számos, szerves anyagból elkülöníthető termék a koleszterinhez messzemenően hasonló, rokon szerkezettel rendelkezik [1].
Nagy áttörést jelentett Diels 1926-ban végzett dehidrogénezési kísérlete.
Koleszterin és epesavak dehidrogénezési reakcióiban a C18H16 összegképletű γ-metil-1,2- ciklopenteno-fenantrén keletkezését tapasztalta. Ezt a vegyületet utólag a Diels szénhidrogén névvel illették. A kísérletek alapján arra a következtetésre jutottak, hogy a vizsgált vegyületek csakis a hidrogénezett 1,2-ciklopenteno-fenantrén származékai
lehetnek. A későbbiekben a hasonló szerkezetű természetes vegyületeket gyűjtőnéven szteroidoknak nevezték el. A szteránvázas vegyületek biológiai funkciójuk alapján történő csoportosítását az 1. ábra mutatja be.
SZTEROIDOK növényi szteroidok
- fitoszterolok - brasszinoszteroidok - szívre ható glikozidok - szteroid szaponinok
- szteroid alkaloidok gombákban előforduló szteroidok - ergoszterolok
állatokban előforduló szteroidok rovarok szteroidjai
- ekdiszteroidok
gerincesek szteroidjai
nemi hormonok - androgének - ösztrogének - progesztogének
szteroid hormonok
kortikoszteroidok - glükokortikoidok - mineralokortikoidok - anabolikus szteroidok
koleszterin epesavak
1. ábra A szteránvázas vegyületek csoportosítása
A szteroidok közös váza, a perhidro-1,2-ciklopenteno-fenantrén szerkezetű szteránváz (vagy gonán váz), melyben három hattagú és egy öttagú gyűrű kapcsolódik össze. A gyűrűket rendre az A, B, C, D, jelölésekkel látják el, a szénatomokat pedig a második ábrán bemutatott sorrendben számozzák.
A B
C D
1 2 3
5 6
7 9 8 11
12
15 16
4 10
18 24
19 14
17 13
21 242
241
25 23
22 20
28 29
30
26
27
2. ábra A szteránváz szénatomjainak számozása [2]
A szteránvázas vegyületek a molekulát alkotó szénatomok száma és a vázhoz kapcsolódó funkciós csoportok száma, minősége, helyzete és térállása szerint különböző csoportokba sorolhatóak be.
A szteránvázas vegyületek esetén — mivel nem planáris hattagú gyűrűket tartalmaznak — a vázhoz kapcsolódó szubsztituensek ill. hidrogénatomok térbeli állásától függően elvileg számos izomer szerkezet alakulhat ki [1].
A szteroidokkal kapcsolatos kutatások jelentős részét képezte a bonyolult térszerkezeti kérdések felderítése, a gyűrűhöz tartozó aszimmetriacentrumok egymáshoz viszonyított konfigurációjának tisztázása.
A szteroidok szerkezetére vonatkozó kutatások a koleszterin struktúrájának beható vizsgálatával indultak meg (3. ábra).
H3C CH3 CH3 CH3
CH3
HO
* H
*
* *
*
* *
* H H
3. ábra A koleszterin szerkezete
A térszerkezet felderítése során figyelembe kell venni, hogy a váz több nem azonos telítettségű aszimmetriacentrumot tartalmaz. A koleszterin molekulában nyolc aszimmetriacentrum található, ezekből elméletileg 256 sztereoizomer vezethető le.
Megállapodás szerint az aszimmetriacentrumok relatív konfigurációit a C10- aszimmetriacentrumra vonatkoztatják, feltételezve, hogy a 10-es helyzetű metilcsoport a gyűrűrendszer általános síkja fölött helyezkedik el.
A gyűrűvázhoz kapcsolódó összes szubsztituens a 10-es-helyzetű metilcsoporthoz viszonyítva lehet cisz (β), vagy transz (α) szerkezetű. A gyűrűváz szubsztituenseinek, valamint a tercier szénatomokhoz fűződő hidrogénatomoknak a térállása meghatározza a gyűrűk kapcsolódási módját. Ennek megfelelően cisz vagy transz anellációról beszélhetünk.
Számos szteroid térszerkezetének meghatározása ahhoz az érdekes felismeréshez vezetett, hogy a scillaglikozidok, a szívre ható glikozidok és varangymérgek kivételével valamennyi szteroid vagy transz-anti, transz-anti, transz (4. ábra, a-típus); vagy cisz-anti, transz-anti, transz térszerkezeti típushoz (4. ábra, b-típus) tartozik, a kivételként felsorolt szteroidok pedig cisz-anti-, transz-szin-, cisz gyűrűszerkezettel (4. ábra, c-típus) jellemezhetők [1]. (A térszerkezetek típusának elnevezésénél a transz szó a három anelláció (A/B, B/C és C/D) módjára vonatkozik, az anti vagy szin szó pedig két szomszédos aszimmetriacentrum (C és C , illetve C és C ) egymáshoz viszonyított
konfigurációját, vagyis a két szomszédos aszimmetriacentrumhoz kapcsolódó CH3-csoport és H-atom, illetve egy-egy H-atom viszonylagos térhelyzetét jelöli meg.)
Érdekességként megemlíthető, hogy a három transz-anelláció határozza meg azt, hogy a kolesztán négygyűrűs váza feltűnően lapos, úgynevezett „léc” alakú. Ugyancsak a transz-anellációk eredményezik azt a tényt, hogy a három hattagú gyűrű szék alkatú, s ez esetben a D-gyűrű nem lehet planáris. A székkonformáció feltüntetésével beszélhetünk a váz szénatomjaihoz kapcsolódó funkciós csoportok és hidrogénatomok axiális, illetve ekvatoriális irányultságáról. A három leggyakrabban előforduló térszerkezeti lehetőséget mutatja be a 4. ábra.
H
H H H
transz-anti, transz-anti, transz (a-típus)
H H
H H
cisz-anti, transz-anti, transz (b-típus)
cisz-anti, transz-szin, cisz (c-típus) H
H H
H
4. ábra A szteroid alapváz leggyakrabban előforduló térszerkezeti lehetőségei Természetesen, ha valamelyik anellációs C-atom telítetlen, akkor az ehhez tartozó két gyűrű cisz- avagy transz- illeszkedésmódjáról beszélni már nem lehet. A jellemző szerkezeti sajátosságokkal rendelkező szteroidcsaládokat az 5. ábra mutatja be.
H H H
H H
H H
H H H
H H H
androsztán ösztrán pregnán
kolán
H H H
kolesztán
5. ábra A legfontosabb szteroidcsaládok
(A koleszterin esetében az A és B gyűrű anellációja telítetlen szénatomot tartalmaz (C5), ezért nem értelmezhető a fenti cisz illeszkedés.) A természetben előforduló szteroidokat a szénvázban tapasztalható eltérés alapján különböző családokba sorolhatjuk.
Az egyes szteroidok elnevezése a megfelelő szteroidcsalád nevéből származtatható (5.
ábra) [1].
A különböző szteroidcsaládok tagjai térszerkezeti szempontból egyaránt tartozhatnak az a- illetve a b-típusba (ld. 4. ábra). Az a-típusba tartozó vegyületek elnevezésénél a családnév elé 5α-, a b-típusba tartozók elé, pedig 5β-előtagot írnak, mely az 5-ös szénatomon lévő hidrogén térállását mutatja.
1.1.2. A nitrogéntartalmú szteroidok biológiai jelentősége
Azon szteroidmolekulák, amelyek vázában egy vagy több szénatom helyén nitrogénatomok vannak jelen (aza-szteroidok), érdekes biológiai tulajdonságokat mutatnak. Különleges biológiai aktivitást eredményezhetnek a vázhoz kapcsolódó nitrogéntartalmú funkciós csoportok is.
1.1.2.1. Az aza-szteroidok
Az aza-szteroidok közül néhány gyógyászati szempontból is jelentős vegyület.
Például a koleszterin aza-analógjáról azt bizonyították, hogy a koleszterin bioszintézisének inhibitoraként működhet [3].
Néhány aza-szteroidnál (pl. 6-aza-B-, ill. 11-aza-C-homo-ösztronoknál) állatokon végzett kísérletek során fogamzásgátló hatást is tapasztaltak [4]. A fenti származékokkal végzett biológiai kísérleteknél figyelmesek lettek továbbá baktericid, fungicid, koleszterin- hiányt csökkentő, illetve neuromuszkuláris blokkoló hatásra [5].
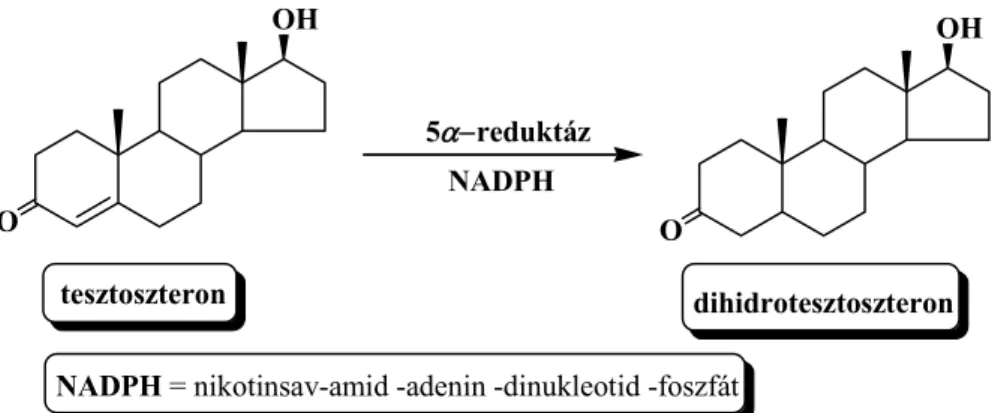
A szteroidmolekula 17-es pozíciója általában igen fontos szerepet játszik a receptorok felismerésében, ezen kívül a bioszintetikus átalakulások is itt játszódnak le. A 17α-alkil- és a 17α-aril-17-aza-D-homo-androsztán-származékok bioregulációs hatását fedezték fel parazita élőlényeken [3]: képesek gátolni a tesztoszteront dihidrotesztoszteronná redukáló 5α-reduktáz enzim működését. Ez a tulajdonság gyógyszerkémiai szempontból is nagyon jelentős, ugyanis a megemelkedett dihidrotesztoszteron szintet számos betegség kialakulásával összefüggésbe hozzák. Az 5α- reduktáz enzim működését a következő ábra mutatja be (6. ábra).
O
OH
O
OH
NADPH
tesztoszteron dihidrotesztoszteron NADPH = nikotinsav-amid -adenin -dinukleotid -foszfát
5α−reduktáz
6. ábra Az 5α-reduktáz enzim biokémiai szerepe
5α-Reduktáz inhibitor tulajdonsággal rendelkező 17β-karbonsavamid-származék a finaszterid (7. ábra), amely Proscar® néven kerül forgalomba [6]. Adagolása a férfiaknál bekövetkező jóindulatú prostata hyperplasia (prosztata megnagyobbodás) gyógyításakor történik.
NH
HN
O
O
7. ábra A finaszterid szerkezete
A vegyület hatása azon alapszik [6], hogy az 5α-reduktáz enzim a tesztoszteron helyett alternatív szubsztrátumként a finaszteridet alakítja át dihidrofinaszteriddé, mely azután az enzimhez kötött NADP-dihidrofinaszterid adduktot képez (8. ábra).
NH
HN
O
O
NH
HN
O
O
NADPH
finaszterid NADP-dihirofinaszterid-enzim-addukt
NH2 N
O PADPR
PADPR= foszfoadenozin-difoszforibóz 5α-reduktáz
8. ábra A finaszterid addukt képzése az 5α-reduktáz enzimmel
A keletkező enzim-NADP-dihidrofinaszterid-komplex rendkívül stabil, felezési ideje 37 °C-on 1 hónap. A tesztoszteron és a finaszterid redukciója hasonló szerkezetű
enolát intermediereken keresztül játszódik le. A két konkurrens reakció az utolsó lépésben különbözik egymástól. Az eltérés abban van, hogy a finaszterid enolát formájában a negatív töltés a 2-es szénatomra kerül. Ebben a pozícióban nem tud lejátszódni a redukcióhoz szükséges protontranszfer. Emiatt a dihidrofinaszterid képződése helyett egy kovalens kötéssel rendelkező NADP-dihidrofinaszterid addukt jön létre. Ez a mechanizmus magyarázza a finaszterid kivételes hatékonyságát és specifitását a jóindulatú prosztata megnagyobbodás kezelésében.
1.1.2.2. Aminosav — szteroid és peptid — szteroid konjugátumok
Mivel a szteránvázas vegyületek sajátja, hogy képesek áthatolni a sejtmembránon és specifikusan megkötődni a megfelelő receptorokon, értékes kiindulási anyagai lehetnek egyéb biomolekulákkal képzett konjugátumoknak. A különféle szteroid konjugátumok számos farmakológiai alkalmazási lehetőséggel is rendelkeznek [7].
Poirier és munkatársai szilárd fázisú szintézissel olyan 5α-androsztánvázas származékokat állítottak elő (9. ábra), amelyek 3-as helyzetben peptidláncokat tartalmaznak [8]. A vegyületek hatékony inhibitorai a 17β-hidroxi-szteroid-dehidrogenáz (17β-HSD) [9-12] enzimnek. 1983-ban Pittaway és munkatársai bizonyították, hogy a 17β- HSD enzimre gyakorolt inhibitor hatás mértéke összefüggésben van a szteroid váz 17-es helyzetében lévő karbonilcsoporttal és az A-gyűrű nem aromás jellegével [13].
A 17β-hidroxi-szteroid-dehidrogenáz enzim szteroidogén enzim, amely a szervezetben az inaktív androgén androszt-4-én-3,17-diont tesztoszteronná alakítja át, amely a második legaktívabb androgén a férfiak szervezetében a dihidrotesztoszteron után [14]. Az enzim blokkolja a tesztoszteron bioszintézisét, ezáltal gátolja androgén érzékeny [15, 16] betegségek, például a prosztata rák kialakulását [17-19]. Tekintettel arra, hogy a 17β-HSD a herékben megtalálható, fontos szerepet kaphat spermium termelés csökkentő, vagyis potencia csökkentő szerepben is [20, 21].
O
H NH
OH R3
HN O NH R1
R2 O O
R= Ph, Bn, iPr, iBu, hexil, Ph-propil
9. ábra 5α-Androsztán-peptid konjugátum [8]
Sok érdekes molekulát találhatunk az ösztronvázas szteroidok körében is. A 17- amino- és a 17-hidrazino-ösztronszármazékok aminosavakkal képzett konjugátumait állították elő enzimkatalitikus úton Yan és munkatársai [22]. Megállapították, hogy a konjugátumok kötődésének mértéke az ösztrogén receptorokhoz függ a beépített aminosav minőségétől (10. ábra).
NHAAP
HO HO
NNHAAP
P = Boc, Fmoc
AA = Ala, Leu, Asp(OBzl), Asp
10. ábra Ösztronszármazékok és aminosavak konjugátumai [22]
Ratcliffe és munkatársai a pregnén 21-es szénatomjához kapcsoltak aminosav tartalmú oldalláncot. A kísérleti megfigyelések azt bizonyították, hogy a 21-es szénatomon szubsztituált pregnénvázas konjugátum progesztogén hatást fejt ki majmokon [23].
Thiemann és munkatársai ösztráno[17,16-e]pirimidinekhez jutottak egy ösztronból kiinduló ötlépéses szintézissor eredményeként (11. ábra).
A heterociklus aminocsoportjához tripeptid egységet kapcsoltak a peptidkémiában szokásos általános módszerekkel [24]. A konjugátum a tripeptid rész révén 186Re-mal és
188Re-mal is képes komplex képzésre, így e származékok radiodiagnosztikumként használhatók [24].
BnO
N N
HN O
S Bn
NH NH O
C(O)CHNH Boc CH2SBn
11. ábra A (Cys-Gly-Cys)-estra-1,3,5(10),16-tetraeno[17,16-e]-2’-aminopirimidin védett származéka
1.1.2.3. Oldalláncban N-tartalmú heterociklussal rendelkező szteroidok
Napjainkra számos olyan szteránvázas vegyületet állítottak elő, amelyek oldalláncukban heterociklust tartalmaznak. E vegyületek közül különösen a nitrogéntartalmúak rendelkeznek valamilyen szempontból érdekes biológiai hatással.
Potter és munkatársai 17-es helyzetben 3’-piridil-csoportot tartalmazó, a 16-os szénatomon kettős kötéssel rendelkező 3β-acetoxi-5α-androsztán-származékok 17α- hidroxiláz-C17,20-liáz inhibitor hatását ismertették [25]. Az enzim szerepe, hogy a progeszteronból és a pregnenolonból származó 17α-hidroxi-származékokat szintetizáljon, amelyeket egy következő lépésben androszt-4-én-3,17-dionná (androszténdion), illetve 3α- hidroxi-androszt-5-én-17-onná (dehidroandroszteron) alakít át. Ez a reakció része az androgén hormonok (pl.: tesztoszteron) szintézisútjának, így blokkolása hatékony módszert jelenthet a prostata hypertrophia (a prosztata nem rákos megnagyobbodása) és az androgénfüggő tumoros betegségek kezelésében [25].
A 17-es pozícióban imidazol, pirazol, izoxazol heterociklusos gyűrűt tartalmazó androszta-5,16-diének szintén blokkolják a 17α-hidroxiláz-C17,20-liáz működését [26]. A heteroatomot tartalmazó gyűrű szerkezete meghatározza az inhibitor hatás mértékét. A 4’- imidazolil-származékok erős blokkoló hatással rendelkeznek, míg a 2’-imidazolil- csoportot tartalmazó szteroidok csak kis mértékben képesek a biokémiai folyamat gátlására (12. ábra).
A szerkezet és aktivitás összefüggésének vizsgálatakor feltárták, hogy az enzimet a nitrogénatom nemkötő elektronpárja blokkolja azáltal, hogy koordinálódik az enzim aktív centrumában elhelyezkedő hem vasatomjához. Minden olyan hatás (pl.: nagy térkitöltésű csoportok jelenléte, delokalizáció), amely rontja a nitrogén koordinációs készségét, a vegyület aktivitását is csökkenti [26, 27].
N N
N O
N
NH N
N N N R
HO
5'-izoxazolil- 3'-pirazolil- 1'H-imidazolil-
1'H-1',2',4'-triazolil- 3'-piridil- 3β-hidroxi-17-R-androszta-5,16-dién
R :
12. ábra A 17α-hidroxiláz-C17,20-liáz inhibitor hatású heterociklusos vegyületek
1.2. Palládium-katalizált karbonilezési reakciók
Az átmenetifém katalizált karbonilezési reakciók különféle karbonilvegyületek és karbonsavszármazékok szintézisét teszik lehetővé laboratóriumi, illetve ipari méretekben egyaránt. Példaként megemlíthető a propén hidroformilezése, mely az egyik legnagyobb méretekben megvalósított homogénkatalitikus vegyipari eljárás [28].
A karbonilezési reakciók alkalmazásával előállított aldehidek, karbonsavak, észterek, vagy amidok fontos intermedierként szerepelnek a gyógyszerkémiában, a növényvédőszer kémiában és a preparatív kémia egyéb területein.
Katalizátorként többféle átmenetifém-komplexet is alkalmaznak, például: Rh [29], Pt [30], Cu [31], Ni [32]; továbbá nemfém Se [33] vegyületeket is. A legáltalánosabban használt átmenetifém azonban a palládium. A továbbiakban a palládium által katalizált reakciókról szeretnék egy rövid, általános áttekintést adni.
Az átmenetifémek között elfoglalt különleges helyüket a palládium-komplexek annak köszönhetik, hogy kitűnően alkalmazhatóak C-C kötés kialakítására [34-42]. Több mint kilencven szerves kémiai reakcióban használják katalizátorként a palládiumot, bár ezen reakciók nagy része nem ipari jelentőségű.
Egyik kivétel a Wacker-eljárás, melynek segítségével sok millió tonna acetaldehidet gyártanak évente. A következő ábra a palládium jelenlétében lejátszódó szintézisek közül mutat be néhány példát.
[Pd]
PhC CPh Ph
Ph Ph Ph Ph Ph
CO2R
CO2R RO2C
+
CO2R RO2C
CuCl2 HCl O2
CH3CHO HNu
Nu ROH, CO
CO2R O PhX
ROH CO O
OR
13. ábra Palládium-katalizált szerves kémiai reakciók [43]
Az elmúlt 15 évben a palládium kémia fontos részévé vált a koordinációs és fémorganikus kémiának, hozzájárult a különféle katalitikus eljárások: a homogén-, heterogenizált-, heterogén- és a napjainkban előretörő nanokatalízis általánosabb megértéséhez.
A palládium vegyületek mint aktív és szelektív katalizátorok jelenlétében számos bonyolult szerkezetű szubsztrátum átalakítása vezetett különféle új, gyakorlati szempontból is fontos termékhez. A kiindulási vegyületek között különösen fontosak az aril-(vagy alkenil-) halogenidek, melyek a reakciókörülményektől függően átalakíthatóak például telítetlen oldalláncot, vagy aromás csoportot tartalmazó származékokká, illetve karbonsavakká, észterekké, amidokká (14. ábra).
R X ArBOH2
Suzuki R Ar
R R R R
R R
H R
Sonogoshira
R
COH2O vagy ROH O
OH(R) Kumada
RMgBr Stille
ArSnBu2
RHeck R
Ar
14. ábra Aril-halogenidek palládium-katalizált reakciói [42]
1.2.1. Aril-, vagy alkenil-halogenidek palládium-katalizált karbonilezése
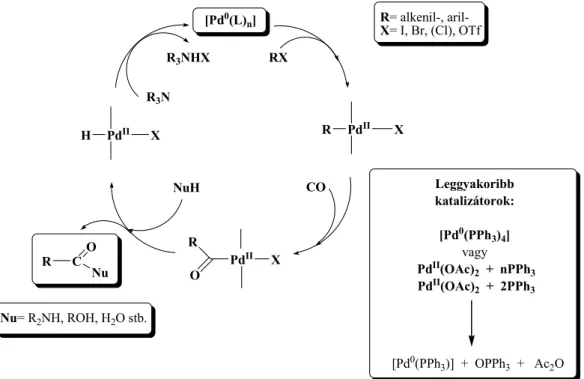
A palládium katalizátor jelenlétében, szén-monoxid atmoszférában a szubsztrátum reagál egy nukleofil molekulával, például alkohollal (alkoxikarbonilezés), primer vagy szekunder aminnal (aminokarbonilezés), vízzel (hidroxikarbonilezés), vagy egy fémorganikus reagenssel (formilezés vagy ún. „cross-coupling” reakció). A ciklokarbonilezés különböző heterociklusos vegyületekhez vezet.
A kettős karbonilezés magas CO nyomáson α-keto-karbonsavamidokat vagy - észtereket eredményez. A palládium-katalizált karbonilezési reakciók számos funkciós csoporttal szemben toleránsak, fontos részét képezik természetes vagy biológiailag aktív intermedierek szelektív szintézisének.
Mint ahogy a legtöbb átmenetifém ionnak, a Pd(0)-nak és a Pd(II)-nek is az a sajátossága, hogy olyan kis molekulákat aktiválnak — mint például a hidrogén vagy a szén-monoxid —, amelyek alapvetően nem reakcióképesek a szerves vegyületekkel szemben. Az aktiválás a koordinációs övezetben következik be. A központi fématomhoz a
reagenseken kívül különféle ligandumok is kapcsolód(hat)nak. Mivel a koordinációs övezet tulajdonságai erős hatást gyakorolnak a reakció folyamatára, a ligandumok megválasztása kulcskérdés a szelektív katalízisben.
Homogén katalizátoron gyakran az izolált katalizátor prekurzort értjük, amely később a tényleges katalizátorrá alakul át. A katalizátor prekurzor átalakulása magában foglalhatja a ligandumok egyikének disszociációját, vagy a kiindulási komplex redukcióját, vagy oxidációját.
A karbonilezési reakció során alkalmazott prekurzor komplexben a palládium lehet már eleve 0 oxidációfokú (pl.: [Pd0(PPh3)4], [Pd0(dba)2]), azonban nagyobb stabilitásuk miatt igen elterjedtek a Pd(II)-vegyületek is (a PdII(OAc)2 + foszfán [44, 45], vagy [PdIICl2(foszfán)2] prekurzorok [46]). A vizsgált reakciókban az aktív katalizátorforma minden esetben [Pd0(L)2] összetételű [47]. A [Pd0(L)4] típusú prekurzorokból a kis ligandumszámú [Pd0(L)2] aktív komplex disszociációs folyamatok eredményeként, a Pd(II)-tartalmúakból pedig in situ redukcióval [48] képződik.
A karbonilezési reakciók kivitelezésére az említetteken kívül sokféle, a koordinációs szférához tartozó foszfán ligandummal rendelkező, valamint ligandummentes palládium-komplexet is alkalmaznak. A foszfán ligandumot a Pd(0)-komplex stabilizálására használják, hogy meggátolják a katalitikusan inaktív fém-palládium keletkezését [49].
Az aril-(vagy alkenil-)halogenidek oxidatív addíciós reakciójának eredményeként a katalitikusan aktív Pd(0)-komplexek Pd(II)-köztitermékekké alakulnak.
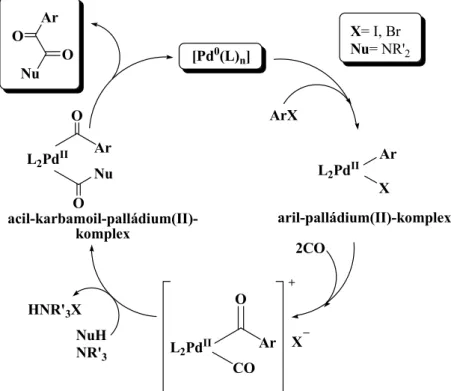
Szén-monoxid atmoszférában a σ-kötéssel kapcsolódó szerves csoportokat tartalmazó palládium(II)-komplexek acil-palládium(II)-komplexekké alakulnak, amelyek képesek reakcióba lépni vízzel, alkoholokkal, aminokkal vagy egyéb nukleofil vegyületekkel (15. ábra). Termékként karbonsavszármazékok vagy karbonilvegyületek nyerhetők [50].
A karbonilezés lejátszódása után kapott [HPd0(L)2X] vegyületek könnyen visszaalakíthatók szerves palládium-komplexekké. Így a folyamat lejátszódásához a legtöbb esetben elegendő katalitikus mennyiségű palládium vegyület jelenléte.
A szerves halogenidek Pd-katalizált karbonilezésének feltételezett mechanizmusában az első, oxidatív addíciós lépést a szén-monoxid beékelődése követi, ezután a nukleofil reagens (pl.: H2O, ROH, R2NH, RCOOH) hatására kialakul a termék (16. ábra). A katalitikus ciklust egy reduktív eliminációs lépés zárja. A Et3N bázikus
tercier aminként savakceptor hatású, megköti a reakcióban felszabadult hidrogén- halogenidet, és ezáltal elősegíti a katalitikus ciklusban a koordinatíve telítetlen Pd(0)- komplex visszanyerését.
[RPdII(L)2X]
R C
O
PdII(L)2X RCC CR'
O
+ [HPd0(L)2X]
RCO2H + [HPd0(L)2X]
RCO2R' + [HPd0(L)2X] RCONHR' + [HPd0(L)2X]
RCO2COR + [HPd0(L)2X]
RCOCN + [Pd0(L)2] + X R'C CH
H2O
R'OH R'NH2
RCO2H CO
RX [Pd0(L)n]
CN
15. ábra Acil-palládium-komplex reakciója nukleofil vegyületekkel
[Pd0(L)n]
H PdII R PdII
R
O PdII RX
CO NuH
CO
R Nu
R3N R3NHX
Nu= R2NH, ROH, H2O stb.
R= alkenil-, aril- X= I, Br, (Cl), OTf
Leggyakoribb katalizátorok:
[Pd0(PPh3)4] vagy PdII(OAc)2 + nPPh3 PdII(OAc)2 + 2PPh3
[Pd0(PPh3)] + OPPh3 + Ac2O
X X
X
16. ábra A homogénkatalitikus karbonilezés mechanizmusa 1.2.2. A karbonilezés során leggyakrabban alkalmazott katalizátorok 1.2.2.1. Palládium katalizátor prekurzorok foszfán ligandumokkal
A [PdIICl2(P)2]-típusú komplexek általánosan használt katalizátor prekurzorok a karbonilezési reakciókban.
A Pd(II)-típusú komplexekből π-akceptor tartalmú foszfán ligandumokkal metanolban Et3N jelenlétében CO atmoszférában különféle Pd(0)-karbonil-foszfán komplexek keletkeznek, melyek infravörös spektroszkópia segítségével azonosíthatók [51]. A [PdIICl2(P)2] típusú vegyületekből (P= PPh2(OEt), PPh2(OnBu), P(OPh)3, P(OCH2CF3)3, P(OMe)3), x + y = 4), különféle [Pd0(CO)x(P)y] karbonil-foszfánok keletkeznek.
A leggyakrabban használt katalizátor prekurzor a PdII(OAc)2, melyet általában valamilyen foszfán ligandum feleslegével együtt alkalmaznak. Ekkor a katalitikusan aktív Pd(0)-komplex a reakcióelegyben alakul ki, pl. a jelenlévő foszfán hatására. Ezt a folyamatot részletesen vizsgálta Amatore [44], aki bizonyította, hogy a PdII(OAc)2 ⎯ PPh3
katalizátor-rendszerben a foszfán nemcsak ligandumként, hanem redukálószerként is működik.
A PdII(OAc)2 és PPh3 katalizátor-rendszerben első lépésként kialakul a [PdII(L)2X2] komplex, amely kvantitatív intramolekuláris redukcióban 0 oxidációfokú Pd-trifenil- foszfán-komplexszé alakul át a trifenil-foszfán hatására [44] (17. ábra).
Kísérletekkel igazolták, hogy a Pd(II)-vegyület redukciója csak abban az esetben játszódik le, ha a központi fémionhoz oxigéntartalmú ligandum vagy anion kapcsolódik.
lassú
[Pd0(PPh3)] + OAc + AcO PPh3 PdII(OAc)2 + 2 PPh3 gyors [PdII(OAc)2(PPh3)2]
[PdII(OAc)2(PPh3)2] _
17. ábra Az aktív katalizátor részecske kialakulása PdII(OAc)2 és PPh3 esetében Két ekvivalens trifenil-foszfán alkalmazása során kis stabilitású Pd(0)-trifenil- foszfán-komplex keletkezik, amely a szubsztrátum jelenlétében a katalitikus ciklus oxidatív addíciós lépésében vesz részt. Trifenil-foszfán felesleg hatására a keletkezett aktív forma elektrokémiai tulajdonságai hasonlítanak a [Pd0(PPh3)4] komplex tulajdonságaihoz.
Ligandumként a legáltalánosabban alkalmazott trifenil-foszfán mellett foszfitokat, vagy különböző módon helyettesített foszfánokat is használnak.
Vizsgálták a benzil-bromid karbonilezési reakcióját különböző [PdIICl2(L)2]-típusú komplexekkel, ahol ligandumként foszfánok (L = PPhx(C6F5)3-x, x = 0-3), foszfitok (L = P(OMe)3, P(OPh)3, P(OEt)3) és foszfinitek (L = PPh2(OC6F5), PPh2(O-3,5-F2C6H3), PPh2(OEt), PPh2(OnBu), PPh2(OtBu) szerepeltek [51]. Valamennyi komplex aktív prekurzornak bizonyult a benzil-bromid karbonilezési reakciójában, 40°C-on,
![13. ábra Palládium-katalizált szerves kémiai reakciók [43]](https://thumb-eu.123doks.com/thumbv2/9dokorg/874324.47046/29.892.170.757.702.1105/ábra-palládium-katalizált-szerves-kémiai-reakciók.webp)
![18. ábra A katalitikusan aktív Pd(0)-vegyület kialakulása [Pd II Cl 2 (COD)] esetén [58]](https://thumb-eu.123doks.com/thumbv2/9dokorg/874324.47046/35.892.270.645.205.506/ábra-katalitikusan-aktív-pd-vegyület-kialakulása-cod-esetén.webp)
![26. ábra Az imidazolium-kation kötődése a Pd-kolloid felületéhez [139, 140]](https://thumb-eu.123doks.com/thumbv2/9dokorg/874324.47046/51.892.223.704.746.997/ábra-imidazolium-kation-kötődése-pd-kolloid-felületéhez.webp)
![30. ábra Aminokarbonilezés különböző katalizátor-rendszerek felhasználásával [bmim] + [PF 6 ] - -ban](https://thumb-eu.123doks.com/thumbv2/9dokorg/874324.47046/56.892.191.725.245.536/ábra-aminokarbonilezés-különböző-katalizátor-rendszerek-felhasználásával-bmim-pf.webp)
![32. ábra Aminokarbonilezés [bmim] + [PF 6 ] - ionfolyadékban 4/1 P/Pd aránynál](https://thumb-eu.123doks.com/thumbv2/9dokorg/874324.47046/58.892.188.726.103.399/ábra-aminokarbonilezés-bmim-pf-ionfolyadékban-p-pd-aránynál.webp)