DOKTORI (Ph.D.) ÉRTEKEZÉS
CSÖNDES IZABELLA
PANNON EGYETEM GEORGIKON KAR
KESZTHELY
2009
PANNON EGYETEM, GEORGIKON KAR KESZTHELY
NÖVÉNYTERMESZTÉSI ÉS KERTÉSZETI TUDOMÁNYOK DOKTORI ISKOLA
ISKOLAVEZETİ:
Dr. GÁBORJÁNYI RICHARD egyetemi tanár, az MTA doktora
A MACROPHOMINA PHASEOLINA KÁROSÍTÁSÁT BEFOLYÁSOLÓ TÉNYEZ İ K VIZSGÁLATA ELTÉR İ GAZDA-PARAZITA
KAPCSOLATOKBAN
DOKTORI ÉRTEKEZÉS
KÉSZÍTETTE:
CSÖNDES IZABELLA okleveles agrármérnök
TÉMAVEZETİ:
Dr. GÁBORJÁNYI RICHARD egyetemi tanár, az MTA doktora
TÁRSTÉMAVEZETİ:
Dr. KADLICSKÓ SÁNDOR
nyugalmazott egyetemi docens, mezıgazdasági tudományok kandidátusa
Keszthely
2009
A MACROPHOMINA PHASEOLINA KÁROSÍTÁSÁT BEFOLYÁSOLÓ TÉNYEZİK VIZSGÁLATA ELTÉRİ GAZDA-PARAZITA KAPCSOLATOKBAN
Írta:
Csöndes Izabella
Készült a Pannon Egyetem Növénytermesztési és Kertészeti Tudományok Dok- tori iskolája keretében.
Témavezetı: Dr. Gáborjányi Richard Elfogadásra javaslom (igen / nem)
………..
(aláírás) A jelölt a doktori szigorlaton …... % -ot ért el,
Keszthely, 2008.
………...
a Szigorlati Bizottság elnöke Az értekezést bírálóként elfogadásra javaslom:
Bíráló neve: …... …... igen /nem
…………..……….
(aláírás) Bíráló neve: …... …... igen /nem
…………...……….
(aláírás) A jelölt az értekezés nyilvános vitáján …...% - ot ért el
Keszthely,
………...……….
a Bíráló Bizottság elnöke A doktori (PhD) oklevél minısítése…...
………
Az EDT elnöke
Tartalomjegyzék
1. Kivonatok 5
1.1. Magyar nyelvő kivonat 5
1.2. Angol nyelvő kivonat - Abstract 6
1.3. Német nyelvő kivonat - Zusammenfassung 7
2. Bevezetés és a téma indoklása 8
2.1.Célkitőzések 9
3. Irodalmi áttekintés 10
3.1. A kórokozó rendszertani besorolása 10
3.2. A kórokozó jelentısége 11
3.3. A kórokozó által okozott betegség tünetei 12
3.4. A kórokozó biológiája 15
3.5. A kórokozó fejlıdését befolyásoló tényezık és a gomba patogenitása 16
3.6. A kórokozó hazai gazdanövényköre 20
3.7. A kórokozó molekuláris jellemzése 20
3.8. A kórokozó elleni védekezés 23
4. Anyag és módszer 26
4.1. A gomba izolálása és tiszta tenyészetek elıállítása 26
4.2. Laboratóriumi vizsgálatok 28
4.2.1.1. Hımérséklet hatásának vizsgálata a micélium növekedésére
és a mikroszkleróciumok képzésére 28
4.2.1.2. Táptalajok hatásának vizsgálata a micélium növekedésére
és a mikroszkleróciumok képzésére 28
4.2.1.3. Morfológiai és tenyészbélyegek 29
4.2.1.4. A pH hatásának vizsgálata a micélium növekedésére
és a mikroszkleróciumok képzésére 29
4.2.1.5. Micélium kompatibilitás vizsgálat 30
4.2.1.6. UV-C sugárzás hatásának vizsgálata a micélium növekedésére
és a mikroszkleróciumok képzésére 30
4.2.2. Molekuláris genetikai vizsgálatok 31
4.2.2.1. DNS izolálás 32
4.2.2.2. RAPD analízis 32
4.2.2.3. Adatelemzés 32
4.2.2.4. ITS felszaporítás és PCR-RFLP 33
4.3. Tenyészedényes vizsgálatok 33
4.3.1. Gazdanövénykör vizsgálata 34
4.3.2. Patogenitási vizsgálatok 36
5. Eredmények 38
5.2.1. Klasszikus mikológiai vizsgálatok eredményei 38 5.2.1.1. Hımérséklet hatásának vizsgálata a micélium növekedésére
és a mikroszkleróciumok képzésére 38
5.2.1.2. Táptalajok hatásának vizsgálata a micélium növekedésére
és a mikroszkleróciumok képzésére 43
5.2.1.3. Morfológiai és tenyészbélyegek vizsgálatának eredményei 48 5.2.1.4. A pH hatásának vizsgálata a micélium növekedésére
és a mikroszkleróciumok képzésére 56
5.2.1.5. Micélium kompatibilitás vizsgálat eredményei 61 5.2.1.6. UV-C sugárzás hatásának vizsgálata a micélium növekedésére
és a mikroszkleróciumok képzésére 63
5.2.2. Molekuláris genetikai vizsgálatok eredményei 69
5.2.2.2. RAPD analízis eredményei 69
5.2.2.3. Adatelemzés eredményei 71
5.2.2.4. ITS felszaporítás és PCR-RFLP eredményei 75
5.3. Tenyészedényes vizsgálatok eredményei 78
5.3.1. Gazdanövénykör vizsgálatának eredményei 78
5.3.2. Patogenitási vizsgálatok eredményei 84
6. Következtetések, javaslatok 92
7. Összefoglalás 98
8. Új tudományos eredmények 101
9. Köszönetnyilvánítás 103
10. Publikációk, elıadások 104
11. Irodalomjegyzék 107
12. Mellékletek i
1. Kivonatok
1. Kivonatok
1. 1. Magyar nyelvő kivonat
A disszertáció ötven magyarországi, két szerbiai és egy spanyolországi Macrophomina phaseolina izolátum (Mp) klasszikus mikológiai és molekuláris genetikai vizsgálatával fog- lalkozik. A vizsgálatok célja a kórokozó fiziológiájának részletes megismerése volt. Munkán- kat laboratóriumi és tenyészedényes körülmények között végeztük.
In vitro kísérleti körülmények között tanulmányoztuk a gomba izolátumok növekedését eltérı hımérséklet, pH és táptalaj függvényében, jellemeztük azokat mikro- és makromorfológiai tulajdonságaik alapján, vizsgáltuk a micélium kompatibilitását. Megállapítottuk, hogy a patogén növekedéséhez a 25-35 °C, a 4-6 pH és a kukorica-liszt agar táptalaj bizonyult opti- málisnak, valamint megfigyeltük, hogy izolátumaink többnyire kompatibilisek voltak egy- mással. A kutatás további tárgyát képezte a rövid hullámú ultraibolya sugárzás (UV-C) kór- okozóra gyakorolt hatásának vizsgálata. Megállapítottuk, hogy a 1,62 J/cm2 dózisú UV-C sugárzás a gomba micélium növekedését és a mikroszkleróciumok képzıdését átlagosan a negyedére csökkentette, továbbá a Mp 1, a Mp 10, a Mp 19, a Mp 22 és a Mp 24 izolátumok mikroszklerócium képzését 48 órára gátolta. Statisztikailag igazoltuk, hogy a besugárzás dó- zisának csökkenésével emelkedett a kórokozó növekedésének mértéke. Klasszikus mikológiai eredményeinket molekuláris szinten RAPD (véletlenszerő amplifikált polimorf DNS) és PCR- RFLP (polimeráz láncreakción alapuló restrikciós fragmentum-hossz polimorfizmus) vizsgá- latokkal egészítettük ki az izolátumok genetikai diverzitásának megállapítására. A PCR-RFLP során az EcoR I és a Taq I restrikciós enzimekkel monomorf, a BstU I, a Hae III, a Hinf I, az Mbo I, az Msp I és az Rsa I enzimekkel polimorf restrikciós mintázatokat kaptunk. A Mp 34, a Mp 38 és a Mp 45 izolátum a RAPD és a PCR-RFLP során is elkülönült a többi izolátumtól.
Az izolátumok nemcsak fenotípusosan, hanem genetikailag is nagy variabilitást mutattak.
Tenyészedényes vizsgálataink között szerepelt egyrészt 39 olyan növényfaj csírakori fogé- konyságának, illetve ellenállóságának elemzése, amelyek a gomba gazdanövényeként ezideig nem ismeretesek. A 39 növényfajból kettı ellenállónak bizonyult, öt pedig kifejezett fogé- kony volt a gombával szemben. Másrészt napraforgó és paprika növényen vizsgáltuk a kór- okozó patogenitását, a növények kelési, szárhossz, szártömeg, gyökérhossz és gyökértömeg eredményei alapján. Az izolátumok patogenitását öt csoportba soroltuk és statisztikailag iga- zoltuk, hogy nincs összefüggés a kórokozó patogenitásában a napraforgón és a paprikán. Nap- raforgón a Mp 35, paprikán a Mp 38 izolátum károsított a legnagyobb mértékben.
1. Kivonatok
1. 2. Angol nyelvő kivonat - Abstract
This work deals with the classical mycology and molecular genetics of fifteen Hungarian, two Serbian and one Spanish isolate of Macrophomina phaseolina (Mp). The aim of the work was to have detailed information on the physiology of this pathogen. Experiments were carried out both in laboratory conditions and in pot experiments.
The growth of mycelia was studied in different temperatures, pH ranges and in different nutri- ents and characterized according to their micro- and macro-morphological behaviours, and on the basis of the mycelium compatibility. It has been established that 25-35 °C, and 4,0-6,0 pH were the optimal conditions for the growth of the pathogen in maize flour agar media. It has been observed that the isolates were mainly compatibles with each other. The effect of ultra- violet irradiation on the pathogen was also studied. It was established, that the 1,62 J/cm2 dose of UV-C irradiation reduced the growth of mycelia, and the microsclerotia formation of Mp 1, Mp 10, Mp 19, Mp 22 and Mp 24 isolates was inhibited by 48 hrs. It was statistically demon- strated, that by the decrease of the irradiation doses the pathogenicity was increased. To com- plete the results of classical morphological experiments, molecular methods has been done by applying RAPD and PCR-RFLP methods to show the genetic diversity of the isolates. After the PCR-RFLP the use of EcoR I és a Taq I restriction enzymes resulted monomorph restric- tion patterns, but by applying BstU I, Hae III, Hinf I, Mbo I, Msp I and Rsa I enzymes poly- morph restriction pattern was formed. In the RAPD and PCR-RFLP study the isolates Mp 34, Mp 38 and Mp 45 basically differed from the others. Generally, the isolates showed large scale of variability not only phenotypically but genetically too.
In the pot experiments seedlings of 39 plant species has been tested, which were not men- tioned in the literature as host plants of Macrophomina phaseolina. Among them two has been found to be resistant and five were susceptible to the pathogen. Pathogenicity of the fun- gus on sunflower and pepper plants was compared on the bases of their germination, stem growth, stem and root fresh weighs. Pathogenicity of the isolates formed five groups, and sta- tistically demonstrated that there was no correlation between the pathogenicity of the two host plants However, on sunflower the Mp 35 isolate and on pepper the Mp 38 isolates caused the biggest injury.
1. Kivonatok
1. 3. Német nyelvő kivonat – Zusammenfassung
Es wurde 50 Isolaten aus Ungarn, 2 aus Serbien und 1 aus Spanien von Macrophomina pha- seolina (Mp) mit klassische sowie molekular pysiologische Methode untersucht.
Es wurde als Ziel festgestellt, die Biologie der Krankheitserreger kennen lernen. Die Untersu- chungen wurden in Laboratorium und also im Topfexperimente durchgeführt.
Es wurde die Wachstum der Pilzisolaten in different Temperaturen, pH und Nährboden nach- gewissen. Es wurde charakterisieren der Isolaten Mikro und Makromorphologie und Myzel- kompatibilität. 25.35 oC, 4,0-6,0 pH und Mais-Mehl Agar Nährboden wurde optimal für die Isolaten. Die Isolaten wurden also kompatible miteinander. Es wurde die Wirksamkeit des kurzwellen Ultraviolastrahl (UV-C) der Krankheitserreger untersucht. 1,62 J/cm2 Dosis UV- C wurde die Myzelwachstum und Mikrosklerociaproduktion stark reduziert, und bei Mp 1 Mp 10, Mp 19, Mp 22 und Mp 24 für 48 Stunden standhalten. Es wurde statistisch festgestellt, je die Verminderung der Strahldosis desto erhöht die Wachstum des Pathogen.
Die klassische mycologische Methode wurde ergänzt mit molekular RAPD und PCR-RFLP Methoden für untersuchen die Genetikvariabilität der Isolaten. In der PCR-RFLP untersucun- gen mit EcoR I und Taq I restriction Enzyms wurde monomorph und BstU I, Hae III, Hinf I, Mbo I, Msp I und Rsa I restriction Enzyms wurde polymorph Mustern bekommen. Die Mp 34, Mp 38 und Mp 45 Isolaten waren different unter RAPD und PCR-RFLP Untersuchungen.
Die Isolaten aufweisen große fenotypische und also genetische Variabilität.
In den Topfexperimenten wurde 39 neue Wirtpflanzenart Pilzempfänglichkeit bei Keimungs- phase untersucht. Es wurde 2 resistent und 5 empfänglich gegen den Pilz. Es wurde die Pa- thogenität der Krankheitserreger mit Sonnenblumen und also Paprika Pflanzen nachgewissen.
Es wurde die Stängellange, Stängelgewicht, Wurzellange und Wurzelgewicht untersucht. Die Pathogenität der Isolaten wurde in 5 Gruppe gesetzt und Statistisch festgestellt. Es wurde kein Zusammenhang in der Pathogenität zwischen Sonnenblumen und Paprika gefunden. Zwi- schen die Isolate Mp35 bei Sonnenblumen und Mp 38 bei Paprika kann die größte Schade erregen.
2. Bevezetés és a téma indoklása
2. Bevezetés és a téma indoklása
A szántóföldi növénytermesztés sorrendjében a világ nagy részén az olajnövények közvetle- nül a gabonafélék után következnek. Olajnövények közül hazánk ökológiai adottságai elsı- sorban a napraforgó és a repce termesztésére alkalmasak. Napjainkban a napraforgót 400.000- 500.000 hektáron termesztik, átlag 1,8 t/ha terméssel. Olajosmag termésünk jelentıs részét nyers vagy finomított olajként, valamint magként exportáljuk, továbbá jelentıs a hazai olaj- és margarin fogyasztás is. A nagy genetikai választék ellenére a hazai termelık egy része rit- kán használ több hibridbıl álló, eltérı tenyészidejő és genetikai hátterő magot, így mind a betegségeknek, mind az idıjárás szélsıségeinek sokkal kitettebb a termelésük. Magyarorszá- gon jelenleg a biztonságos napraforgó termesztést a különbözı gombafajok által elıidézett betegségek határozzák meg. A napraforgót húsznál több kórokozó támadhatja meg, amelyek- bıl több mint öt faj súlyos kár elıidézésére is képes (Békési 2002). Ezek közül az egyik a napraforgó hamuszürke szárkorhadásának a kórokozója, a Macrophomina phaseolina (Tassi) Goidanich (=M. phaseolina). Ez a gomba a soktápnövényő fajok közé tartozik, több mint 500 gazdanövénye ismert. Az utóbbi években egyre nagyobb jelentıségő, kedvezı számára a szá- raz, meleg, aszályos idıjárás. A 2007-es év egyértelmően a M. phaseolina éve volt hazánk- ban, a napraforgónak más betegsége ez évben alig jelentkezett. A kórokozó károsításának mértéke a következı években hazánkban még nagyobb méreteket ölthet, tekintve, hogy a ha- zai éghajlatkutatók elemzése szerint 2000 és 2050 között az évi középhımérséklet 0,5 °C-os emelkedésével, a nyári idıszakban a napfénytartam 10 %-os növekedésével és az évi csapa- dékmennyiség 10-15 %-os csökkenésével számolhatunk (Vörös és Maros 2004). A kórokozó károsításának eredménye teljes növénypusztulás vagy minıségi és mennyiségi termésveszte- ség lesz. Napraforgó esetén a minıségi változás alacsony savszámban nyilvánul meg, a meny- nyiségi veszteség komponensei pedig a hektáronkénti tıszám, a tányérátmérı és az ezerkaszattömeg. Betakarítás után a fertızıdött szárral a gomba mikroszkleróciumainak mil- liói kerülnek a talajba, ahol akár tíz évig is megırzik életképességüket. A sokféle gazdanö- vény és a mikroszkleróciumok hosszú élettartama magyarázza, hogy rendkívül nehéz a véde- kezés a kórokozó ellen. A rezisztencianemesítés eddig nem vezetett eredményre és a vegysze- res védekezés sem adott kielégítı eredményt. Ugyanakkor számolni kell azzal is, hogy a gomba populációiban olyan változások zajlanak le, amelyek a fertızıképesség hirtelen felerı- södését okozzák, ami robbanásszerő járványok kialakulásához vezethet. Bár évtizedek óta ismert a kórokozó hazai elıfordulása, mégis több kérdés tisztázatlan még a M. phaseolinaval
2. Bevezetés és a téma indoklása
kapcsolatban. Tudomásunk szerint az elmúlt években, évtizedekben nem vizsgálták részlete- sen a Magyarország különbözı termıhelyein elıforduló gomba populációit, és csak részben a növényfajok és azok fajtáinak, hibridjeinek gomba iránti magatartását, elsısorban a megfelelı anyagi háttér hiánya miatt.
A kórokozó hazai elterjedésével, fiziológiai, morfológiai és patogenitási tulajdonságaival, genetikai hátterével kapcsolatos ismereteink bıvítése érdekében végeztünk kísérleteket a M.
phaseolinaval.
2. 1. Célkitőzések
Elsıdleges célunk, hogy adatokkal szolgáljunk a hazai M. phaseolina populációk fenotípusos és genotípusos jellemzéséhez. Ennek megfelelıen munkánk során az alábbi célokat tőztük ki:
- magyarországi termıhelyekrıl származó M. phaseolina izolátumok győjtése;
- in vitro körülmények között az izolátumok növekedésének tanulmányozása eltérı hımérsék- let, pH és táptalaj függvényében, hogy ezáltal alkalmunk nyíljon az izolátumok fenotípusos összehasonlítására;
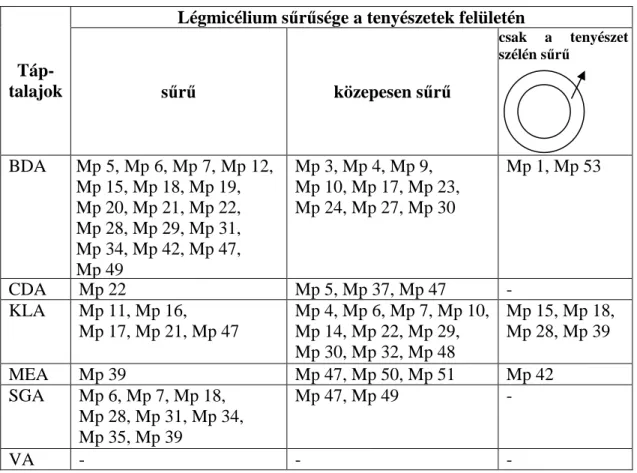
- az izolátumok mikro- és makromorfológiai jellemzése (mikroszkleróciumok színe, alakja, mérete, tenyészet színe és alakja, légmicéliumképzés, stb.);
- kapcsolat teremtése az összes izolátum között Petri-csészében, hogy megtudjuk, mely he- lyekrıl származó izolátumok mutatnak micélium kompatibilitást, ezáltal is jellemzve a kór- okozó változékonyságát;
- az UV-C sugárzás M. phaseolina micélium növekedésére és mikroszklerócium képzésére gyakorolt hatásának vizsgálata;
- RAPD és PCR-RFLP alkalmazása az izolátumok közti genetikai távolságok feltárására, il- letve a genetikai különbségek megállapítására, továbbá annak felderítése, hogy a gomba nö- vekedésében kapott fenotípusosan megnyilvánuló különbségek igazolhatóak-e genetikailag;
- tenyészedényes vizsgálatban hazai M. phaseolina izolátumokkal olyan növényfajok csírako- ri fogékonyságának, illetve ellenállóságának elemzése, amelyek a gomba gazdanövényeként eddigi szakirodalmi adatok alapján nem ismeretesek;
- a M. phaseolina izolátumok patogenitásának vizsgálata üvegházi körülmények között, nap- raforgó és paprika növényen, a növények kelési, szárhossz, szártömeg, gyökérhossz és gyö- kértömeg eredményeit alapul véve.
3. Irodalmi áttekintés
3. Irodalmi áttekintés
3. 1. A kórokozó rendszertani besorolása
Piknídiumos (anamorf) alak: Macrophomina phaseolina (Tassi) Goidanich Fungi ország
Deuteromycota törzs Coelomycetes osztály
Sphaeropsidales rend Sphaeropsidaceae család
Mikroszkleróciumos (synanamorf) alak: Sclerotium bataticola TAUB.
syn: Rhizoctonia bataticola (Taubenhaus) E. J. Butler Fungi ország
Deuteromycota törzs Agonomycetes osztály
Myceliales rend
A fajok leírásánál az anamorf alakokat veszik elsısorban figyelembe, a szakirodalomban ál- talában a Macrophomina phaseolina megnevezést használják, mivel az a kórokozó magasabb fejlettségő formája.
A mikroszkleróciumos formát Taubenhaus (1913) írta le elıször. A piknídiumos formát Haig (1928) azonosította, mint Macrophomina phaseoli Maublanc fajt. Haig (1928) szerint a piknídium mindig hoz létre mikroszkleróciumot, ellenben a mikroszklerócium rendszerint nem hoz létre piknídiumot. Ezt a megállapítását egy sokkal késıbbi tanulmány is alátámasztja (Singh és Kaiser 1995).
A kórokozó legfontosabb morfológiai jellemzıi a következık: a piknídiumok sötétbarnák, vastag falúak, kissé lapítottak, serte nélküliek, leveleken, szárakon képzıdnek, 100-200 µm átmérıjőek. A konídiumtartók hialinok, kúp alakúak, 5-13 x 4-6 µm méretőek. A pikno- konídiumok egysejtőek, tojásdadok, füstszínőek, 14-30 x 5-10 µm nagyságúak (Horváth 1995). A hifa (micélium) derékszögben elágazó (1. ábra). A Sclerotium bataticola fekete szí- nő, valódi mikroszkleróciumokat (2. ábra) fejleszt, amelyek sima felületőek, kemények, a
3. Irodalmi áttekintés
gyökerekben, a szárakban és a levelekben találhatóak. Alakjuk gömb vagy tojásdad (Bánhegyi és mtsai. 1985). A gomba növényen belül csak mikroszkleróciumot fejleszt, piknídiumot pe- dig csak növényen kívül (Chan és Sackston 1973).
1. ábra. M. phaseolina derékszögben 2. ábra. M. phaseolina
elágazó micéliuma mikroszkleróciumai
Haig (1929) a mikroszkleróciumok mérete alapján a kórokozó három típusát különböztette meg. Így az A csoport mikroszkleróciumainak mérete 1 mm-es nagyságrendő, a B csoportban a mikroszkleróciumok átlagos mérete 200 µm, míg ez a C csoportban 120 µm körül van.
Békési (1970) Magyarországon elsıként napraforgón találta meg a kórokozó 80-160 mikron átmérıjő mikroszkleróciumokkal rendelkezı Haig szerinti C csoportba tartozó típusát. Majd Simay (1987) hazánkban pár évvel késıbb már a gomba 46-340 µm átmérıjő mikroszkleróciumairól adott közlést. A Dhingra és Sinclair (1973) izolátumaiból mért mikroszkleróciumok 44-291 µm, míg Ilyas és Sinclair (1974) mikroszkleróciumai 80-360 µm közti értékeket mutattak. Az elızıeknél szőkebb méret intervallumban helyezkednek el Manici és mtsai. (1992) olasz izolátumaiból (72,8-127,8 µm) és Purkayastha és mtsai. (2004) indiai izolátumaiból (44,65-126,2 µm) mért mikroszkleróciumok méretei. Magyarországon a M. phaseolina piknídiumát egy alkalommal észlelték bab száron (Vajna és Békési 2009).
3. 2. A kórokozó jelentısége
A M. phaseolina Földünk mind az öt növényt termesztı kontinensén jelentıs mértékben ká- rosít. E polifág gomba különösen a trópusi és szubtrópusi területeken terjedt el, de Magyaror- szágon is jelentıs veszteségeket okoz. Déli szomszédaink, Szerbia és Horvátország után ke- rült a kórokozó hazánk területére. A kórokozó hazai elıfordulásával, gazdanövénykörével, károsításával és a kártétel súlyosságával több kutató foglalkozott. Magyarországi megjelené- sekor Agárd, Baja, Ikrény, Röjtökmuzsaj, Tordas és Villány-Siklós környékén a gomba 1-20
3. Irodalmi áttekintés
% közötti napraforgón észlelt elıfordulásáról kaptunk hírt (Békési 1970). Két év megfigyelé- se alapján Vörös és Manninger (1973) szerint a gomba kukoricán és napraforgón csak száraz és meleg, aszályos idıjárás esetén idéz elı megbetegedést, míg hővös és csapadékos tenyész- idı folyamán a patogén okozta tünetek nem észlelhetık, és a kórokozó sem izolálható a kuko- rica szártı szöveteibıl. 1974-ben a Bácsalmási Állami Gazdaság területén egy teljesen egész- ségesnek tőnı állományból 500 tı napraforgót megvizsgálva 62 %-os fertızöttséget tapasztal- tak (Békési 2007). Az 1980-as években végzett felmérések szerint Hajdúszoboszlónál 1 % körüli, Szekszárdnál 2-8 % közötti, míg Mélykút környékén 50 %-ot meghaladó fertızöttséget találtak. Ahol 50-60 %-os fertızöttséget okozott a kórokozó, ott két döntı terméselem, a tá- nyérátmérı és az ezerkaszattömeg alakulására vizsgálták a gomba napraforgó termésre gyako- rolt hatását. Az enyhe tünetek alapján sokan nem gondolták, hogy a gomba különösebb vesz- teséget okozna a termésben, mégis a beteg növények tányérátmérıje 15-17 %-kal, az ezerkaszattömeg pedig mintegy 25 %-kal csökkent. Ebbıl következik, hogy a kórokozó a fertızött egyedek termését legalább 30-40 %-kal csökkenti, ami 50 %-os állományfertızött- ségnél 15-20 % termésveszteséget jelent (Békési 1981). Kratancsikné (1992) Fejér megyében a kártétel mértékét jellemezve nagyüzemi kukoricatáblákon 30-80 %-os fertızöttséget állapí- tott meg. A Galgamenti MGTSZ 152 ha-os cukorrépa tábláján pedig 70 %-os tıpusztulás kö- vetkezett be, rendkívül alacsony 4-5 t/ha termésátlaggal (Koppányi és mtsai. 1993). Békési (2002) az elmúlt években arról számolt be, hogy a napraforgó gombafertızöttsége gyakran meghaladta a 90 %-ot, ami 30-35 %-os termésveszteséget jelent. A gomba az utóbbi években Magyarországon a legsúlyosabb fertızéseket napraforgón okozta. A 2007-es év egyértelmően a M. phaseolina éve volt. A napraforgónak más betegsége ez évben alig jelentkezett (Békési 2007). Mindezek alapján kijelenthetjük, hogy a kórokozó jelentısége egyre jobban növekszik hazánkban.
3. 3. A kórokozó által okozott betegség tünetei
A talajból, mikroszkleróciumokkal történı fertızés korán bekövetkezik, de a tipikus tünetek csak termésképzés idıszakától alakulnak ki. A növények lankadnak, majd hervadnak, a kora- érés tüneteit mutatják. A szár alsó egyharmada hamuszürkére színezıdik, majd az epidermisz lehámlik. A szárat félbevágva látható, hogy a szár bélszövete a tömegesen képzıdı rendkívül apró mikroszkleróciumoktól kékes-feketére színezıdik. Súlyos esetben a bélállomány teljesen összezsugorodik (3.A ábra). A mikroszkleróciumok jelen lehetnek a szárban, illetve a szár külsı részén a lehámló epidermisz alatt (3.B és C ábra).
3. Irodalmi áttekintés
3. ábra. M. phaseolina által károsított napraforgó összezsugorodott bélállománya (=A), illetve a gomba mikroszkleróciumai szója szárának külsı felületén (=B) és a szárban (=C)
3. Irodalmi áttekintés
A gombafertızés következményeként kicsi, torzult tányérok is megjelenhetnek. Gyakran foltokban jelentkezik a betegség. A növények hervadása gyors és sokkszerő is lehet, ha az meleg, aszályos periódussal esik egybe. Végsı tünetként a hervadó növények teljesen elpusz- tulnak (4. ábra).
4. ábra. M. phaseolina fertızés következtében hervadó paprikatı teljes pusztulása
Több növény esetében – például szójánál – súlyos betegségforma a csíranövénypusztulás. A kórokozó már a fejlıdı csíranövény pusztulását is eredményezheti, szikleveles kortól bármi- kor fertızheti a növényt (Varga és mtsai.. 1997). Korábbi szakirodalmak a következı csíranövénykori tünetek elıfordulásáról számoltak be: gyökérnyaki lézió (Simay 1987), klorotikus hervadó, majd lehulló alsó levelek (Érsek 1979a, Msikita és mtsai. 1998), szár és gyökér nekrózisa (Pratt és mtsai. 1998), feketés léziók leveleken (Purkayastha és mtsai.
2004), vörösesbarna léziók a csíranövények hipokotilján közel a sziklevelekhez (Meyer és mtsai. 1974), barna léziók szikleveleken és/vagy a hajtáson, fiatal levelek szisztemikus klorózisa (Rusuku és mtsai. 1997), barna-fekete léziók az alacsonyabb szárrészeken (Msikita és mtsai. 1998). Grezes-Besset és mtsai. (1996) viszont a fiatal növények föld feletti tünetek nélküli gyors pusztulásáról számoltak be.
3. Irodalmi áttekintés
A gomba csíranövényeken történı károsításának mértékérıl a szakirodalomban eltérı érté- kekkel találkozhatunk. Meyer és mtsai. (1973) tapasztalatai szerint a szójamagok csírapusztu- lása 35 és 90 % között volt. Suriachandraselvan és Seetharaman (2000) szerint 38,3 és 88,3 % közti a napraforgó magok kelése. Purkayastha és mtsai. (2004) csomósbabnál a gomba erısen patogén izolátuma által okozott 79 %-os csíranövény pusztulást is megállapítottak, míg más izolátumaik „csak” 33 %-os pusztulást okoztak. Gangopadhyay és mtsai. (1970) vizsgálatai- ban 59 %-kal csökkent a tünetmentes szójamagok kelése. Ugyancsak szója esetében Rajeev és Mukhopadhyay (2002) kísérletei esetében a patogén által okozott kelési veszteség 52,5 % volt. Ezzel szemben egy XX. század eleji tanulmányban arról olvashatunk, hogy a gomba a paprikamagok csírázását nem befolyásolta, bár jelentıs számban képzıdtek a magok felületén mikroszkleróciumok (Martin 1917). A M. phaseolina patogenitása feltehetıleg azóta felerı- södött. A fiatalkori károsítás után (csíranövény pusztulás) általában már csak a virágzás után kialakuló tünetek figyelmeztetnek a kórokozó jelenlétére.
3. 4. A kórokozó biológiája
A gomba áttelelése elterjedési területe jelentıs részén – így hazánkban is – mikroszklerócium formájában történik, általában a talajban vagy a talaj felületén a fertızött növényi maradványokban. Akár egyetlen fertızött növényben mikroszkleróciumok százai keletkeznek, amelyek betakarítás után a szármaradványokkal együtt általában a talajba kerül- nek, és ott nyugalmi állapotban akár tíz évig is megırzik életképességüket. A gomba vetı- maggal – akár tünetmentesen – is biztosíthatja életben maradását és továbbterjedést (Gangopadhyay és mtsai. 1970). Számos vizsgálat történt a kórokozó csírakori fertızésének megállapítására, melyek során fény derült arra, hogy számos növény esetében a gomba a ma- gok csírázásképtelenségét vagy a csíranövények gyors pusztulását okozza (Anwar és mtsai.
1995). Hazai vizsgálatokban Simay (1990) a gomba maggal való terjedését bab (Phaseolus vulgaris L.) és repce (Brassica napus L.) növényeknél figyelte meg, melyek közül repce ese- tében a kórokozó magoncrothadást is okozott. Garcia és mtsai. (1983) eredményei azt mutat- ják, hogy a fertızöttség mértéke az öt napos és a fejlıdésük végén lévı szója növényeknél volt a legnagyobb. Sinha és Khare (1978) homoki bab esetében kimutatták, hogy a micélium jelen volt a sziklevelekben, a rügyecskékben és a gyököcskékben. Szójamagvak vizsgálata alapján Kunwar és mtsai. (1986) szerint a hifák és a mikroszkleróciumok ekto- és endofiták, a hifa intra- és intercelluláris a maghéj szöveteiben, az endospermiumban és az embrióban. A patogenézis során a gomba elıször a gyökerekbe hatol be, majd a hifa terjed inter- és
3. Irodalmi áttekintés
intracellulárisan is, és elárasztja a floémet és a xylemet (Chan és Sackston 1973). A M.
phaseolina által fertızött 4-5 éves kajszifáknál a gomba hifái és mikroszkleróciumai kimutat- hatóak voltak a tracheákban is, nemcsak a xylemben (Vajna és Rozsnyai 1995).
Ebben a fejezetben említjük meg a kórokozó törzsek kompatibilitásának kérdését is. A kompatibilitás genetikailag szabályozott. Két törzs akkor kompatibilis, ha a hifák egy micéli- umrendszeren belül nem csak elágazásokat, hanem anasztomózisokat (hifahidakat) is képez- nek. Az anasztomózisokon keresztül megtörténik a sejtmagok cseréje, ami lehetıséget biztosít a genetikai rekombinációra (paraszexuális rekombináció). Ez olyan fajoknál jelentıs, amelyek elsısorban vagy kizárólag ivartalanul szaporodnak vagy homotallikusak, tehát az ivaros úton bekövetkezı rekombináció valószínősége csekély. Idegen hifák között – micélium inkompati- bilitás esetén – nem alakulnak ki anasztomózisok, gyakran gátlási zónák vagy ún. barrierek is létrejönnek, sıt az egymás közelébe kerülı gombafonalak még el is pusztulhatnak. A geneti- kailag különbözı micéliumtelepek térbelileg is elkülönülnek és egymással vetélkedı egyed- ként viselkednek (Zándoki és Turóczi 2002). A micélium kompatibilitás vizsgálata arra is alkalmas, hogy egy-egy kisebb vagy nagyobb területen jellemezzük a kórokozó változékony- ságát. A M. phaseolina esetében a paraszexuális rekombináció során képzıdı heterokarionok- nak szerepe lehet a fajon belüli genetikai változékonyság fenntartásában.
3. 5. A kórokozó fejlıdését befolyásoló tényezık és a gomba patogenitása
A M. phaseolina okozta fertızöttség mértékét több tényezı befolyásolja, ezek közül kiemelt szerepe van a környezeti tényezıknek. A kórokozó morfológiai változékonysága függ a te- nyésztés feltételeitıl, a hımérséklettıl, a tápközeg összetevıitıl, a tápközeg kémhatásától, a fénytıl és a nedvességtıl.
- Hımérséklet
A hımérséklet hatását a patogén növekedésére többen vizsgálták világszerte és megállapí- tották, hogy a gomba 15 és 40 °C között képes növekedni. Optimális fejlıdését 30 °C körül tapasztalták (Rana és Tripathi 1985, Das 1988, Maholay 1992, Manici és mtsai. 1995, Devi és Singh 1998, Viana és Souza 2002, Lokesha és Benagi 2004, Csöndes és Kadlicskó 2007).
3. Irodalmi áttekintés
- Táptalaj
Minden élı szervezetnek szüksége van (elsısorban energianyerés céljából) könnyen hasz- nosítható tápanyagokra. A gombák számára a könnyen hasznosítható tápanyagok szénhidrát- ok formájában állnak rendelkezésre. A legtöbb gombafaj a monoszacharidok közül a glükózt és a fruktózt, diszacharidok közül a maltózt (malátacukor) és a szacharózt jól hasznosítja.
Singh és Chohan (1982) a M. phaseolina micéliumnövekedését és mikroszkleróciumainak kialakulását a szacharóz tartalmú Czapek-Dox agaron (CDA) történı tenyésztés során találta a legintenzívebbnek. Singh és Kaiser (1994) szintén a CDA-t, valamint a glükóz tartalmú bur- gonya-dextróz agar (BDA) táptalajt vélték a legjobbnak a kórokozó nagymértékő növekédéséhez. Ezzel szemben a növekedést Simay (1987) hazánkban CDA-on, illetve a glü- kóz és pepton tartalmú Sabouraud-glükóz agar (SGA) táptalajokon találta a leglassúbbnak.
Suriachandraselvan és Seetharaman (2003) ellentmondásos eredményt kaptak a CDA és a BDA táptalaj alkalmazása során. Eredményeik szerint a micélium növekedése BDA-on volt a legnagyobb, CDA-on a legkisebb, míg a mikroszklerócium képzés a CDA-on volt a legbısé- gesebb és a BDA-on a legkisebb mértékő. El-Wakil és mtsai. (1985) a glükózt (BDA és SGA összetevıje) találták a legjobbnak a gomba növekedésehez. Dhingra és Sinclair (1973) izolátumai közül a legtöbb BDA-n növekedett a legintenzívebben. Több szerzı beszámolt a kórokozó felszaporításához megfelelı kukorica-liszt agar (KLA) alkalmazásáról, mivel az a kórokozó intenzív növekedéséhez a legkedvezıbbnek bizonyult (Thirumalachar és mtsai.
1977, Mukkopadhyay és mtsai. 1991). Suriachandraselvan és Seetharaman (2000) azt tapasz- talta a pepton-szacharóz agar alkalmazásánál, hogy a gomba, illetve az anyagcsereterméke elszínezi a táptalajt. Izolátumaik közül néhány mély vörös pigmenteket termelt. Az izolátumok növekedése és a pigment bioszintézisük között nem volt korreláció. Ghosh és Sen (1973) szerint a peptonban (enzimekkel részlegesen bontott fehérjék, amelyek átmenetek a fehérjék és a peptidek között) a polipeptid lánc stimulálja a pigmentszintézist. Haq és mtsai.
(1999) a pepton tartalmú glükóz-pepton agart tartják a legjobbnak a kórokozó növekedéséhez, a légmicélium és a mikroszklerócium képzéséhez, azonban pigmentszintézist nem észleltek.
Az is bizonyossá vált, hogy a mikroszkleróciumok mérete függ a szubsztrátumban rendelke- zésre álló tápanyagoktól (Short és Wyllie 1978).
- Kémhatás (pH)
A gombák többsége számára az optimális növekedési viszonyokat a savas pH tartomány je- lenti. A pH hatásai részben az egyes tápanyagok felvételének befolyásolása révén valósulnak meg. Számos vizsgálat történt a tápközeg pH-jának a M. phaseolina növekedésére és fejlıdé-
3. Irodalmi áttekintés
sére gyakorolt hatásának megismerésére, viszont hazánkban errıl csak egy publikációban (Békési 1970) találtunk adatokat. A határértékekrıl a kutatók véleménye nem egységes. Bé- kési (1970) közlésében azt olvashatjuk, hogy a gomba számára a 4-6 pH optimális. Singh és Chohan (1982) tapasztalatai szerint a mikroszkleróciumok képzıdése 2 és 7 pH között bısé- gesnek mutatkozott, 9-es pH-nál pedig elmaradt. Eredményeik szerint a gomba 2-9 pH között fejlıdött, a pH emelésével a növekedés fokozódását tapasztalták, majd pH 7,0 felett annak csökkenését. Az in vitro pH optimum 5,0 és 6,0 között volt. Ugyanezt az eredményt kapta Devi és Singh (1998), valamint Ratnoo és Bhatnagar (1991) is. Lokesha and Benagi (2004) 6 és 8 pH között figyelték meg a gomba jó növekedését. Rana és Tripathi (1985) megállapítot- ták, hogy a kórokozó maximális fejlıdése pH 6-nál van, míg Singh és Kaiser (1994) közlése szerint pH 6,5-nél.
- Ultraibolya fény (UV)
A gomba reprodukciójában – a hımérsékleten, a páratartalmon, a kémhatáson és a tápköze- gen kívül – az UV sugárzás intenzitása is fontos faktor lehet (Jakucs és Vajna 2003). A fény- nek a növénypatogén gombákra gyakorolt hatása napjainkig nem olyan ismert, mint akár a növényi, akár az állati szervezetekre gyakorolt. Külföldi szakirodalmakban számos közle- mény található, amely az UV sugárzás konídiumos és tömlısgombákra gyakorolt morfo- genetikai hatását vizsgálja. Ezzel szemben Magyarországon csak az utóbbi években kezdtek el kutatni e témában többek között a Sclerotinia sclerotiorum, a M. phaseolina, az Alternaria alternata és a Fusarium culmorum gombák körében (Fischl és Nagy 2002a, Fischl és Nagy 2002b, Nagy 2003, Nagy és Fischl 2003, Nagy és mtsai. 2005, Varga és Nagy 2008). Fischl és Nagy (2002b) szerint függetlenül az idıjárási feltételektıl az ózonkoncentráció csökkené- sével vagy az ózonpajzs megszőnésével a közeli UV sugárzás intenzitása növekedni fog. Ke- vés adat áll rendelkezésünkre, hogy a M. phaseolina miképpen reagál a különbözı intenzitású UV sugárzásra. Az egyik publikáció szerint (Fischl és Nagy 2002b) az UV-C sugárzás befo- lyásolja a kórokozó mikroszkleróciumainak számát és átmérıjüket, továbbá azok méret sze- rinti eloszlását is. Fischl és Nagy (2002b) munkájuk során azt tapasztalták, hogy az UV-C sugárzás a micélium növekedését 48 órára gátolta az 1,62 J/cm2 dózisú besugárzás alkalmazá- sa során és további 48 órára fenntartható volt a gátlás a 0,81 J/cm2 dózissal. Kimutatták, hogy a kezelt tenyészetekben a mikroszkleróciumok átmérıje kisebb volt, mint a kontrollé.
Ismert a gomba fiatal növényeken történı károsítása, ezért a kifejlettkori értékelésen túl je- lentıs a csíra- és a fiatal növények ellenálló képességének a vizsgálata is. A felnıttkori és a
3. Irodalmi áttekintés
fiatalkori rezisztencia összefüggésének esetén fiatal korban hatékonyabban lehetne szelektál- ni, ami természetesen megkövetel egy fiatalkori rezisztencia elbírálására alkalmas módszert (Varga és mtsai. 1997). A M. phaseolina patogenitásának vizsgálata céljából – történjen az akár csíranövényeken akár kifejlett állapotú növényeken – eddig számos inokulációs módszert dolgoztak ki. Vitatott, hogy melyik inokulációs módszer a legmegfelelıbb a patogenitás érté- keléséhez. Egyes tudósítások szerint a fogvájós mószer adta a legmagasabb fertızöttségi %-ot (Blanco-Lopéz és Jiménez-Diáz 1983, Singh és Kaiser 1989), míg mások a talajinokulációs módszerek valamely formáját találták hatékonyabbnak (Thirumalachar és mtsai. 1977, Grezes-Besset és mtsai. 1996, Rajeev és Mukhopadhyay 2002). Coelho Netto és Dhingra (1996) a rezisztencia értékeléséhez az inokulációs módszerek közül a talajinokuláció alkalma- zását javasolták, hiszen vizsgálataik során ezen módszerrel olyan babgenotípusokat is fogé- konynak találtak, amelyek a fogvájós inokuláció során rezisztensnek bizonyultak. Több szer- zı jó eredménnyel alkalmazta már a maginokulációs módszert az ellenállóság elbírálására különbözı gazda-parazita kapcsolat esetében, köztük a M. phaseolinaval végzett vizsgálatok- nál is (Mesterházy 1974, Fischl 1977, Kadlicskó 1990, Manici és mtsai. 1995). Az itatóspapír módszer nagy elınye, hogy a rezisztencia értékelése akár nagyon rövid idı alatt is végbe me- het (Grezes-Besset és mtsai. 1996).
Eddigi eredmények azt bizonyítják, hogy a M. phaseolina izolátumok patogenitása jelentıs mértékben eltér, a fertızıdött növényfajok a gyengén fogékonytól az erısen fogékony kategó- riáig széles intervallumban helyezkednek el (Meyer és mtsai. 1973, Smith és Carvil 1997, Suriachandraselvan és Seetharaman 2000, Purkayastha és mtsai. 2004). Egyes eredmények szerint az izolátumok patogenitásában azok származási helye (geográfiai elhelyezkedése) sze- rint volt eltérés (Monga és mtsai. 2004, Reyes-Franco és mtsai. 2006). Ezzel szemben Thirumalachar és mtsai. (1977), illetve Manici és mtsai. (1995) munkájuk során azt tapasztal- ták, hogy az izolátumok patogenitása növényfajonként tért el. Éppen ezek ismeretében köve- tendı Mesterházy (2000) – többnyire Fusarium gombák esetében bizonyított - megállapítása, miszerint a patogenitást több fajta átlagában kell vizsgálni.
Számos szerzı talált nagy variabilitást az eltérı gazdanövényekrıl származó izolátumok patogenitása és azok fiziológiai, illetve morfológiai jellegzetességei között (Dhingra és Sinclair 1973, Jiménez-Diáz és mtsai. 1983, Manici és mtsai. 1995). Több szerzı (Ghosh és Sen 1973, Hooda és Grover 1988, Suriachandraselvan és Seetharaman 2003) is beszámolt arról, hogy a patogénebb izolátumok több mikroszkleróciumot produkálnak. Ezzel szemben Manici és mtsai. (1992) e tekintetben pozitív korrelációt nem tapasztaltak.
3. Irodalmi áttekintés
3. 6. A kórokozó hazai gazdanövényköre
A polifág M. phaseolinanak több mint 500 gazdanövénye ismert világszerte, amelyek több- nyire kétszikőek, ugyanakkor egyszikőeket is képes megfertızni (Jones and Canada, 1994, Purkayastha és mtsai. 2006). A gomba esetében nem áll fenn gazdaspecializáció Zazzerini és Tosi (1989) szerint, mely vélemény cirok, szója, napraforgó és pórsáfrány növények patogenitás-vizsgálatán alapszik.
A M. phaseolina hazai gazdanövénykörérıl több szerzı is beszámolt. Elıször Békési (1970) írta le napraforgóról, majd Vörös és Manninger (1973) kukoricáról, Érsek (1979b) szójáról, Simay (1987, 1990, 1991a, 1991b) burgonyáról, csicsókáról, lóbabról, babról, fokhagymáról, máriatövisrıl, néhány gyomnövényrıl és dísznövényekrıl. Majd Koppányi és mtsai. (1993) cukorrépáról, Simay és Kadlicskó (1993) kenderrıl és macskagyökérrıl. Kadlicskó (1993) több éven keresztül vizsgálta a kórokozó hazai gazdanövénykörét és 22 új kultúrnövényfajról bizonyította a kórokozó iránti fogékonyságot. Fischl és mtsai. (1995) paprikáról, míg Békési és mtsai. (1995) dinnyérıl izolálták a gombát. Vajna és Rozsnyai (1995) e polifág gombafaj megjelenését hazai vizsgálatok során elsıként közölte fásszárú növényfajon, kajszifákon.
Fischl és mtsai. (2008) ezüstfenyı gyökerébıl izolálták a gombát. Külföldi publikációkból már ismert a M. phaseolina fenyıfaiskolákban okozott károsítása, mely nyomán a fenyıtők sárgulása, a lombozat hervadása, a fertızıdött gyökerek rothadása, a kéreg lehámlása és a magonc elhalása következett be (Hodges 1962, Reuveni és Madar 1985, Mitchell és mtsai.
1991, Barnard 1994). A kórokozó fásszárú növényeken történı károsítása – a kajszifát kivéve – hazánkban eddig nem volt ismert. Ezért is érdekes és újszerő e polifág gombafaj magyaror- szági ezüstfenyın való elıfordulása.
3. 7. A kórokozó molekuláris jellemzése
A fajon belüli polimorfizmus vizsgálatánál ma már elengedhetetlen a genetikai információt hordozó molekulák (DNS, RNS) vizsgálata. Bármely szervezet genetikai tanulmányozásához kellenek olyan tulajdonságok vagy bélyegek ún. markerek, amelyek jól felismerhetıek, köny- nyen, pontosan megkülönböztethetıek és értékelhetıek. A múltban csak fenotípusos bélye- gekre támaszkodtak. Napjainkban a DNS markerek, úgy mint RAPD (véletlenszerő amplifikált polimorf DNS – random amplified polymorphic DNA), RFLP (restrikciós frag- mentum-hossz polimorfizmus – restriction fragment length polymorphism), AFLP (sokszoro- sított fragmentum-hossz polimorfizmus – amplified fragment length polymorphism) és SSR
3. Irodalmi áttekintés
(egyszerő szekvencia ismétlıdések – simple sequence repeats) számos fitopatogén gomba (köztük a M. phaseolina) genetikai variabilitásának meghatározására alkalmasak. A RAPD során a véletlenszerően megválasztott indítószekvenciájú ún. random primer a DNS molekula különbözı pontjain a komplementer szakaszokhoz kapcsolódik. Ha ezeknek a hibridizáló szekvenciáknak az orientációja és távolsága megfelelı (50-3000 bp), akkor különbözı számú és hosszúságú DNS fragmentumok felszaporodnak. A polimorfizmust a gélelektroforézissel elválasztott DNS fragmentumok eltérı mérete és száma adja. Az RFLP elve, hogy a DNS-t restrikciós enzimekkel emésztik. Ha az emésztett DNS-t gélelektroforézis alá vetjük, megtud- ható hány darabra vágta azt az enzim és milyen méretőekre. A restrikciós fragment hossz po- limorfizmust a plussz hasítóhely okozza. Az RFLP a DNS-fragmentek hosszában, míg az AFLP a specifikus primerekkel és a specifikus restrikciós enzimekkel elıállított specifikus restrikciós fragmentek méretében szolgál markerként.
Egy szervezet tanulmányozásakor mind a fenotípusos, mind a molekuláris markerrendszert figyelembe kell venni. Nem szabad figyelmen kívül hagyni azt sem, hogy a molekuláris mód- szerek sikeresen csak a hagyományos módszerekre ráépülve alkalmazhatóak.
Az elmúlt évtizedben többen vizsgálták a M. phaseolina populációit molekuláris genetikai módszerekkel. A közölt munkákban eltérı eredmények születtek, egyes szerzık találtak ösz- szefüggést a gomba izolátumok győjtési helye, gazdanövénye és a genetikai variabilitása kö- zött, míg más munkák nem tudták igazolni ezeket az összefüggéseket.
Jana és mtsai. (2003) 43 eltérı földrajzi régióból és különbözı gazdanövényekrıl származó M. phaseolina izolátummal végeztek RAPD analízist, amely során 70 OPA primert (indító- szekvenciát) teszteltek. Közülük egy, az OPA 13 alkalmas volt az izolátumok elkülönítésére.
Jana és mtsai. (2003) gazdanövény szerinti ujjlenyomatot kaptak ezen primerrel, ahogy ké- sıbb Aboshosha és mtsai. (2007) is az általuk vizsgált 33 egyiptomi izolátumnál. Almeida és mtsai. (2003) elsıként végeztek genetikai vizsgálatokat brazil M. phaseolina izolátumokkal.
Eredményeik szerint RAPD analízissel az 55 izolátumot három csoportba osztották, de ezek a csoportok függetlenek voltak a gazdanövénytıl. Indiában cirokról származó izolátumok kö- zött Das és mtsai. (2008) hét csoportot tudtak elkülöníteni 14 OPA primerrel végzett RAPD analízis során, amelyek tükrözték az izolátumok győjtés helyét. Jana és mtsai. (2005) nagy genetikai távolságot találtak az indiai és az észak-amerikai gomba izolátumok között URP-2F, URP-6R és URP-30F primerek alkalmazása során. Egy másik módszerrel (AFLP) Reyes-
3. Irodalmi áttekintés
Franco és mtsai. (2006) szintén nagy genetikai eltérést kaptak, munkájuk során ık is el tudták különíteni a Mexikóban győjtött izolátumokat az Olaszországból, Ausztráliából, Japán, Argentinából, USA-ból, Columbiából és Brazíliából származó izolátumoktól. Ezzel szemben Rajkumar és Mahaling (2007) azt tapasztalták, hogy a genetikai variabilitás független a geo- gráfiai elhelyezkedéstıl. Vandemark és mtsai. (2000) sem tudta elkülöníteni gazdanövény és származási hely szerint az általa vizsgált izolátumokat. Purkayastha és mtsai. (2006) Indiában végzett vizsgálataik alapján az izolátumok származási helye (geográfiai elhelyezkedése) és a polimorfizmusok között szintén nem találtak összefüggést, viszont a klorát rezisztencia és a gazdanövény szerint tudták csoportosítani az izolátumokat. Omar és mtsai. (2007) RAPD so- rán négy primert használtak, mindegyikkel kaptak polimorfizmust. A genetikai vizsgálat so- rán kapott RAPD mintázatot és a patogenitás-vizsgálat során kapott eredményeket összeha- sonlítva nem tudtak kimutatni korrelációt. Chase és mtsai. (1994) 40 fenotípusosan különbözı M. phaseolina izolátumot vizsgáltak, hogy megtudják, hogy a molekuláris variabilitás össze- függ-e olyan faktorokkal, mint a gazdanövény, a geogrifiai eloszlás és/vagy a biokémiai vagy morfológiai tulajdonságok. RAPD vizsgálat során 20 OPA primerbıl 18-cal kaptak polimorf mintázatot. Eredményeik a fenotípusosan eltérı izolátumok közti molekuláris variabilitás ma- gas szintjét mutatták. Monga és mtsai. (2004) 18 primert használtak RAPD vizsgálat során, a vizsgált 15 izolátum genetikai távolsága 0,27 és 1,00 között volt.
Akkor használható jól az ITS (köztes régió, nem átíródó szakasz – internal transcribed spacer) felszaporításán alapuló RFLP módszer a polimorfizmus kimutatására, ha feltételezhe- tıen nagy az izolátumok közti genetikai távolság. Erre utalhatnak például az elızetes mikoló- giai vizsgálatok vagy a nagy geográfiai távolság (az izolátumok származását tekintve).
Almeida és mtsai. (2003) kilenc eltérı gazdanövényrıl származó M. phaseolina izolátum ITS1 és ITS4 primerekkel felszaporítható 620 bp nagyságú fragmentumát emésztették tíz rest- rikciós enzimmel RFLP módszert használva. Azt tapasztalták, hogy a fragmentumot csak négy enzim vágta, de ezekkel is ugyanazt a (monomorf) mintázatot kaptak. Su és mtsai.
(2001) szójáról, cirokról, gyapotról és kukoricáról származó izolátumok 25 S fragmentumát Msp I, Hae III., Mbo I, Rsa I és Taqa I restrikciós enzimekkel emésztették, azonban polimor- fizmust ık sem találtak. Szintén monomorf restrikciós mintázatot adott az EcorI és a TaqI enzimmel történı RFLP vizsgálat Purkayastha és mtsai. (2006) munkája során. Chase és mtsai. (1994) sem kaptak polimorfizmust a BstUI és TaqI restrikciós enzimekkel történı emésztést követıen.
3. Irodalmi áttekintés
3. 8. A kórokozó elleni védekezés
Jelenleg a fıleg talajjal, illetve fertızött növényi maradványokkal terjedı M. phaseolina el- len hatásos védekezési mód nincs. Egyetlen a gyakorlatban is kivitelezhetı védekezési eljárás a csávázás, ami jól alkalmazható a betegség vetımaggal történı terjedésének gátlására és a fiatalkori károsítás megakadályozására (Varga és mtsai. 1997). Békési (2007) is a csávázást javasolja a védekezés egyik lehetıségeként, továbbá felhívja a figyelmet egy 2007-es vizsgá- lat eredményei alapján arra, hogy kerüljük a korai vetést és a növényállomány sőrítését. Vé- leménye szerint a genetikai védelem, a rezisztens hibridek jelenthetnék a megoldást, amelyek a termesztık számára környezetkímélıek és egyben a legolcsóbb védekezési módot adnák.
Természetesen a genetikai védelemben rejlı lehetıségeket minden növény és növénybetegség esetében ajánlatos kihasználni. Napjainkban azonban nagyon költséges feladat megismerni a betegség lefolyását, kutatni a rezisztencia-forrásokat, illetve elvégezni a termesztésben lévı és a termesztésbe kerülı szaporító anyagok ellenállóképességének vizsgálatát.
További védekezési mód a vetésváltás, a növényi sorrend adta lehetıség kihasználása. Ne- hezítheti azonban a vetésváltással történı védekezést a kórokozó polifág tulajdonságán túl az is, hogy a gomba mikroszkleróciumai több éven át megtarthatják életképességüket a talajban (Cook és mtsai. 1973, Watanabe 1973, Maholay 1992). Ndiaye és mtsai. (2008) legújabb eredménye szerint csökken a mikroszkleróciumok sőrősége a talajban, ha a vetésforgóba ujjasmuhar vagy köles kerül. Koppányi és mtsai. (1993) elıveteménynek ıszi kalászosokat és a tavaszi árpát javasolják.
Számos szerzı úgy véli, hogy a vízhiányos növények sokkal fogékonyabbak a gombára, mint azok a növények, amelyek megfelelı vízellátásban részesülnek. Különösen, ha ez a vízstresszes állapot a reproduktív fejlıdési szakaszra, tehát a virágzás és/vagy a magkitelítı- dés idejére esik (Edmunds 1964, Ghaffar és Erwin 1969, Dhingra és Sinclair 1975, Blanco- Lopéz és Jiménez-Diáz 1983). Éppen ezért az aszály megelızésére megfelelı agrotechnikai módszerek (talajmővelés, vízigényes és víztakarékos növények sorrendjének kialakítása, ön- tözés stb.) kidolgozására van szükség. Koppányi és mtsai. (1993) az aszályos idıjárás kezde- tén történı legalább egyszeri öntözés alkalmazását ajánlják. Kendig és mtsai. (2000) eredmé- nyei szerint is megfelelı vízellátás esetén a kórokozó károsítása mérsékelt volt, mert az öntö- zés negatív hatással volt a mikroszklerócium-sőrőségre a talajban.
3. Irodalmi áttekintés
Alternatív védekezési mód a M. phaseolina elleni biológiai védekezés, amely lehetıség fel- tárására számos kutató végzett kísérleteket. A következı hasznos szervezeteket, anyagokat találták hatékonynak a kórokozó ellen:
- baktériumok – pl. Actinomycetes sp. (Herbar és mtsai. 1991), Pseudomonas sp. (Kavitha és mtsai. 2005) és Bacillus subtilis (Siddiqui és Mahmood 1993);
- gombák – pl. Aspergillus sp. (Eswaran és Mishra 2004), Trichoderma sp. (Dinakaran és mtsai. 1995, Prashanthi és mtsai. 2000) és Fusarium solani f. sp. psidii (Singh és Kaiser 1996);
- nematódák – pl. Heterodera cajani (Tiwari 1998) és Meloidogyne incognita (Jain és Trivedi 1998);
- növényi kivonatok – pl. Cymbopogon citratus (Bankole és Adebanjo 1995), Ocimum sanctum és Vitex negundo (Ushamalini és mtsai. 1997);
- talajhoz adott növényi anyagok/termékek – pl. Prosopis spp. (Ehteshamul-Haque és mtsai.
1996);
- egyéb anyagok – pl. aktinidin (Saxena és Mathela 1996), cercosporin extraktum (Velicheti és Sinclair 1992).
A munkákban megismert M. phaseolina elleni biológiai védekezési módszereknek a gya- korlatban is hatékonyan kivitelezhetı alkalmazása még a jövı feladata.
Itt hívjuk fel a figyelmet arra, hogy a M. phaseolina, mint a Hydrilla verticillata (piroserő átokhínár) vizi gyomnövényt károsító hasznos szervezet, eredményesen felhasználható a piroserő átokhínár elleni biológiai védekezésben (Joye és Paul 1991).
A M. phaseolina elleni védekezés nemcsak azért nehéz, mert nincs még igazán hatékony védekezési technológia ellene, hanem mert a hibridek kórokozóval szembeni fogékonysága kellı mértékben nem ismert. Az 1990-es évek eleje óta nincs az államilag elismert hibridekre vonatkozó adat a vizsgálat költséges volta és a pénzhiány miatt. Pedig nagy szükség volna rá, hiszen Békési (1970) már évtizedekkel ezelıtt – mikor elıször írt a gomba hazai megjelenésé- rıl – felhívta a figyelmet arra, hogy a napraforgó fajták között jelentıs fogékonyság- különbségek vannak. Az 1980-as évekbıl származó adatok alapján is nagy különbségek vol- tak a hibridek fogékonyságában, a vizsgált hibridek fertızöttsége 1-2 %-tól 90-95 %-ig válto- zott (Békési 2007). Másrészt az is megnehezíti a védekezést, hogy amióta csatlakoztunk az Európai Unióhoz, már nem kötelezı a fajták állami elismerése ahhoz, hogy Magyarországon
3. Irodalmi áttekintés
azokat termeszteni lehessen. Szabadon termeszthetı az EU-listán lévı fajták bármelyike, ami meglehetıs növényvédelmi veszélyt hordoz magában. Hiszen egy külföldön már köztermesz- tésben lévı és bevált fajta rezisztencia tulajdonságai magyarországi körülmények között (adott éghajlat, adott patogenitású gombatörzsek) nem feltétlenül érvényesülnek (Békési 2008).
4. Anyag és módszer
4. Anyag és módszer
4. 1. A gomba izolálása és tiszta tenyészetek elıállítása
A vizsgálatba vont, Magyarországon győjtött M. phaseolina 39 termıhelyrıl származik (5.
ábra) napraforgó, kukorica és szója növényekrıl. Laboratóriumi körülmények között a fertı- zött növényi részekrıl a gombát BDA táptalajon tenyésztettük ki Keszthelyen, a Pannon Egyetem Növényvédelmi Intézet növénykórtani laboratóriumában. Az izolálás során minden esetben azonosítottuk a M. phaseolina gombát. Tiszta tenyészeteket többszöri átoltás után kaptunk. A spanyolországi és az egyik szerbiai izolátumot napraforgó növényekrıl, a másik szerbiai izolátumot cukorrépáról izolálták. Az izolátumok eredetére és gazdanövényére vo- natkozó adatokat az 1. táblázat mutatja. Késıbbi felhasználásra a kórokozókat Eppendorf- csıbe, parafinolajjal lezárva, 5-10 °C-os hőtıben tároltuk.
5. ábra. 39 magyarországi mintagyőjtı termıhely
4. Anyag és módszer
1. táblázat.
A vizsgálatba vont M. phaseolina izolátumok adatai
Izolátumok
kódja Győjtés helye Forrás Győjtés
ideje Gazdanövény
Mp 1 Balatonújlak saját 2005 napraforgó
Mp 2 Bize saját 2005 napraforgó
Mp 3 Boda saját 2005 napraforgó
Mp 4 Bóly saját 2005 napraforgó
Mp 5 Böhönye saját 2005 napraforgó
Mp 6 Cserkeszılı saját 2005 napraforgó
Mp 7 Cserkeszılı saját 2005 napraforgó (gyom)
Mp 8 Debrecen saját 2005 napraforgó
Mp 9 Dunaföldvár saját 2005 napraforgó
Mp 10 Gyulafirátót saját 2005 napraforgó
Mp 11 Hódmezıvásárhely saját 2005 napraforgó
Mp 12 Kadarkút saját 2005 napraforgó
Mp 13 Kaposvár-Toponár saját 2005 napraforgó
Mp 14 Karcag saját 2005 napraforgó
Mp 15 Kecskemét saját 2005 napraforgó
Mp 16 Keszthely saját 2005 napraforgó
Mp 17 Kéthely saját 2005 napraforgó
Mp 18 Kunszentmárton saját 2005 napraforgó
Mp 19 Lakitelek saját 2005 napraforgó
Mp 20 Lepsény saját 2005 napraforgó
Mp 21 Mesztegnyı saját 2005 napraforgó
Mp 22 Nagykanizsa saját 2005 napraforgó
Mp 23 Nyíregyháza saját 2005 napraforgó
Mp 24 Pogányszentpéter saját 2005 napraforgó
Mp 25 Röjtökmuzsaj saját 2005 napraforgó
Mp 26 Sármellék saját 2005 napraforgó
Mp 27 Szederkény saját 2005 napraforgó
Mp 28 Szentes saját 2005 napraforgó
Mp 29 Székkutas saját 2005 napraforgó
Mp 30 Szigetvár saját 2005 napraforgó
Mp 31 Tiszakürt saját 2005 napraforgó
Mp 32 Tordas Dr. Gergely László 2005 napraforgó
Mp 33 Bóly saját 2005 szója
Mp 34 Iregszemcse saját 2005 szója
Mp 35 Keszthely saját 2005 szója
Mp 36 Böhönye saját 2006 napraforgó
Mp 37 Dombóvár saját 2006 napraforgó
Mp 38 Kaposvár-Toponár saját 2006 napraforgó
Mp 39 Kéthely saját 2006 napraforgó
Mp 40 Marcali saját 2006 napraforgó
Mp 41 Nagyrécse saját 2006 napraforgó
Mp 42 Sármellék saját 2006 napraforgó
Mp 43 Zalaapáti saját 2006 napraforgó
Mp 44 Zalaszabar saját 2006 napraforgó
Mp 45 Cordoba (Spanyolország) Dr. Leire Molinero-Ruiz 2006 napraforgó
Mp 46 Sangaj (Szerbia) 2004 napraforgó
Mp 47 Rimski Sancevi (Szerbia)
Dr. Vera Stojsin
és Dr. Bagi Ferenc 2003 cukorrépa Mp 48 Keszthely Dr. Kadlicskó Sándor 2002 szója
Mp 49 Bicsérd Walcz Ilona 1984 napraforgó
Mp 50 Bicsérd Walcz Ilona 1986 szója
Mp 51 Bicsérd Walcz Ilona 1999 kukorica
Mp 52 Bicsérd Walcz Ilona 2004 napraforgó
Mp 53 Szekszárd Walcz Ilona 1982 napraforgó
4. Anyag és módszer
4. 2. Laboratóriumi vizsgálatok
Klasszikus mikológiai vizsgálatainkat az 53 M. phaseolina izolátum fenotípusos jellemzé- séhez Keszthelyen, a Pannon Egyetem Növényvédelmi Intézet növénykórtani laboratóriumá- ban, a molekuláris genetikai vizsgálatainkat a Növénytudományi és Biotechnológia Tanszék laboratóriumában végeztük. Klasszikus mikológiai vizsgálataink során összesen megközelítı- leg 5000 db Petri-csészét használtunk. A dolgozat bármely fejezetében található fotók eredeti, saját felvételek.
4. 2. 1. 1. Hımérséklet hatásának vizsgálata a micélium növekedésére és a mikroszkleró- ciumok képzésére
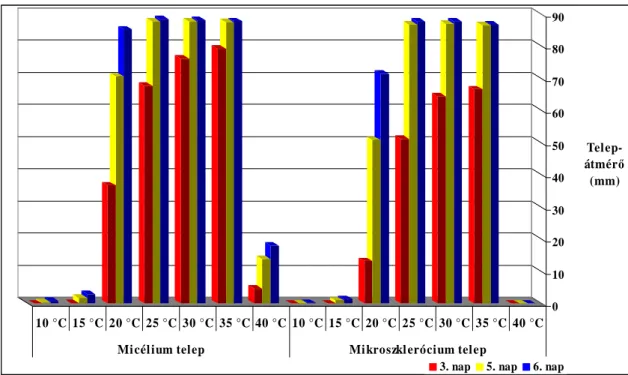
A hımérséklet hatásának vizsgálatakor az oltáshoz az aktívan (25 °C-on) növı 1 hetes tiszta telepek szélébıl kivágott 5 mm átmérıjő agar-korongokat használtunk. Az inokulálás elızete- sen sterilezett, 10-10 ml BDA-t tartalmazó 9 cm átmérıjő Petri-csésze közepére történt. Ez- után a Petri-csészéket sötétben, 10, 15, 20, 25, 30, 35 és 40 °C-os termosztátban tartottuk. A hımérséklet hatását a patogén növekedésére négyszeres ismétlésben vizsgáltuk. A gombate- nyészetek telepátmérıjét az oltástól számított 3., 5. és 6. napon mértük, azonos idıben, a Petri-csésze alján húzott, két, egymásra merıleges átló mentén. Az eredmények statisztikai értékeléséhez Microsoft Excel 2003 programcsomag segítségével egytényezıs varianciaanalí- zist és szignifikáns differenciaszámítást alkalmaztunk (Sváb 1981).
4. 2. 1. 2. Táptalajok hatásának vizsgálata a micélium növekedésére és a mikroszkleró- ciumok képzésére
A gomba micélium növekedését és a mikroszklerócium képzıdés mértékét BDA, CDA, KLA, maláta-extrakt agar (MEA), SGA és vizes-agar (VA) táptalajokon vizsgáltuk. A kór- okozó számára tápanyagforrásként a BDA-ban glükóz, a CDA-ban szacharóz, a KLA-ban dextrin, a MEA-ban maltóz, a SGA-ban glükóz és pepton, a VA-ban csupán bakterológiai agar szolgált. A táptalajokból 10-10 ml-t öntöttünk ki 9 cm-es Petri-csészékbe, 4 ismétlést alkalmazva. A vizsgálathoz BDA táptalajon, 25 °C-on tartott, egyhetes tiszta tenyészeteket használtunk. Az inokulálást ezek szélébıl kivágott 5 mm átmérıjő, mikroszkleróciumokat bıven tartalmazó agarblokkokkal végeztük. A tenyészeteket 25 °C-on, sötétben inkubáltuk.
Az oltástól számított 3., 5. és 6. napon mértük a gombatenyészetek micélium, illetve
4. Anyag és módszer
mikroszkleróciumok alkotta telepátmérıjét. Az eredményeket statisztikailag Microsoft Excel 2003 segítségével egytényezıs varianciaanalízissel és szignifikáns differenciaszámítással ér- tékeltük.
4. 2. 1. 3. Morfológiai és tenyészbélyegek
A kórokozó makro- és mikromorfológiai jellemzıit BDA, CDA, KLA, MEA, SGA és VA táptalajokon vizsgáltuk, a „táptalajok hatásának vizsgálata a micélium növekedésére és a mikroszkleróciumok képzésére” során kapott tenyészetek felhasználásával. A telepmorfológi- ai bélyegeket az oltástól számított 6. napon jegyeztük fel. A mikroszkleróciumok méreteinek vizsgálatához mind a hat táptalajra oltott összes tenyészetbıl az inokulálástól számított 7. na- pon kezelésenként 60-60 db mikroszklerócium átmérıjét mértük Ergawal fénymikroszkóppal, 64-szeres nagyításnál. Ez összesen 19080 darab mikroszklerócium mérését jelentette. A mikroszkleróciumok telepben való sőrőségének megállapításához okkulár mikrométerrel egy általunk egységnyinek (281250 µm2) vett látótérben elıforduló mikroszkleróciumokat számol- tuk meg. Munkánk során a kórokozóról Carl Zeiss binokuláris fénymikroszkóphoz csatlakoz- tatott Flexcam videokamera segítségével felvételeket készítettünk.
4. 2. 1. 4. A pH hatásának vizsgálata a micélium növekedésére és a mikroszkleróciumok képzésére
A M. phaseolina tenyészetekre kifejtett H-ion koncentráció hatását 8 különbözı pH-jú BDA táptalajon (pH=2,0-9,0) végeztük. A táptalaj kémhatását a kívánt mértékre 10 %-os HCl -val, illetve 1N NaOH oldattal állítottuk be 206-pH2 (Testo GmbH, Németország) pH-mérıvel,
±0,02 pontossággal, az autoklávozást követıen. Az oltáshoz az aktívan (25 °C-on) növı 1 hetes tiszta telepek szélébıl kivágott 5 mm átmérıjő agar-korongokat és 9 cm átmérıjő steril Petri-csészéket használtunk. Az inokulumot az egyes kívánt pH-jú 10-10 ml táptalajt tartal- mazó Petri-csésze közepére helyeztünk. Négy ismétlést alkalmaztunk A gombatenyészetek micéliummal és mikroszkleróciumokkal fedett telepátmérıit az oltástól számított 3., 5. és a 6.
napon mértük azonos idıben, a Petri-csésze alján húzott, két, egymásra merıleges átló men- tén. Az eredmények statisztikai értékelését Microsoft Excel 2003 egytényezıs varianciaanalí- zisével és szignifikáns differenciaszámítással végeztük.