IZOINDOLIN VÁZÚ LIGANDUMOK FÉMKOMPLEXEINEK ELŐÁLLÍTÁSA ÉS ENZIMUTÁNZÓ REAKCIÓINAK VIZSGÁLATA
DOKTORI (PhD) ÉRTEKEZÉS
Készítette:
CSAY TAMÁS okleveles vegyész
Témavezetők:
Dr. SPEIER GÁBOR
és
Dr. KAIZER JÓZSEF egyetemi tanár egyetemi docens
Pannon Egyetem - Kémiai és Környezettudományi Doktori Iskola
Kémia Intézet
Szerves Kémia Intézeti Tanszék Veszprém
2011
ÉS ENZIMUTÁNZÓ REAKCIÓINAK VIZSGÁLATA Értekezés doktori (PhD) fokozat elnyerése érdekében
Írta:
Csay Tamás
Készült a Pannon Egyetem Kémiai és Környezettudományi Doktori Iskolájának keretében.
Témavetető: Dr. Speier Gábor
Elfogadásra javaslom (igen/nem) ...
(aláírás)
Témavetető: Dr. Kaizer József
Elfogadásra javaslom (igen/nem) ...
(aláírás)
A jelölt a doktori szigorlaton ... %-ot ért el.
Veszprém, ...
...
Szigorlati Bizottság elnöke
Az értekezést bírálóként elfogadásra javaslom:
Bíráló neve: ... igen/nem
...
(aláírás) Bíráló neve: ... igen/nem
...
(aláírás) A jelölt az értekezés nyilvános vitáján ... %-ot ért el.
Veszprém, ...
...
Bíráló Bizottság elnöke A doktori (PhD) oklevél minősítése: ...
...
EDT elnöke
Köszönetemet szeretném kifejezni témavezetőimnek, Dr. Speier Gábor egyetemi tanár úrnak és Dr. Kaizer József egyetemi docens úrnak a kutatások során nyújtott segítségükért és figyelmükért. Köszönöm kutatócsoportunk minden tagjának és a Pannon Egyetem Szerves Kémia Intézeti Tanszékén dolgozóknak az önzetlen segítségét.
Köszönettel tartozom Dr Rockenbauer Antalnak és Dr. Korecz Lászlónak (MTA Kémiai Kutatóközpont) az ESR spektrumok felvételében és azok értékelésében nyújtott segítségét, Dr.
Párkányi Lászlónak (MTA Kémiai Kutatóközpont) és Dr. Michel Giorginak (Spectropole, Université Aix-Marseille) a röntgendiffrakciós szerkezet-vizsgálatokért.
Köszönöm az MTA – Izotópkutató Intézetében dolgozók lelki és szakmai támogatását, különösen Dr. Takács Erzsébetnek és Dr. Wojnárovits Lászlónak.
Külön köszönöm Szüleimnek és Feleségemnek, hogy mindvégig kitartottak mellettem és támogattak céljaimban.
Csay Tamás
KIVONAT
Izoindolin vázú ligandumok fémkomplexeinek előállítása és enzimutánzó reakcióinak vizsgálata
Készítette: Csay Tamás okleveles vegyész
Témavezetők: Dr. Speier Gábor egyetemi tanár és Dr. Kaizer József egyetemi docens
Az enzimatikus folyamatok behatóbb vizsgálatára csak az utóbbi időkben nyílott lehetőség. Részletesebb elemzések nem csak a biokémiai folyamatok jobb megértése céljából szükségesek, de az új tudást felhasználva jelentősen előre mozdítható az orvostudomány, az ipar és a környezetvédelem fejlődése is.
A kataláz és a katechol oxidáz olyan fémtartalmú oxireduktáz enzimek, melyek aktív centrumukban vasat, mangánt, vagy rezet tartalmaznak. A kataláz az ún. reaktív oxigén intermedierek képződésében jelentős szerepet játszó hidrogén-peroxidot bontja vízzé és oxigéné. A katechol oxidáz o-difenolok metabolizmusát katalizálja o-kinonokká. Az enzimatikus körfolyamataik minden részlete azonban még nem ismert. További kutatásukban a bioszervetlen kémia nyújthat segítséget. Az enzimreakció feltárása és új kémiai ismeretek megszerzése céljából előállítottunk olyan réz- és mangántartalmú vegyületeket, melyekkel különböző szempontokból modellezni kívántuk ezeket a biokatalizátorokat. Szerkezetüket spektroszkópiai módszerekkel (ESR, UV-Vis, IR) és röntgendiffrakcióval határoztuk meg, majd kinetikai vizsgálatokkal elemeztük bioutánzó reakcióikat. Eredményeinket összevetettük az enzimek, illetve más, az irodalomból már ismert modellvegyületek adataival és ezek alapján javaslatot tettünk a lehetséges reakciómechanizmusokra is.
ABSTRACT
Preparation of complexes with isoindoline like ligands and investigation of their enzime mimic reactions
Written by: Tamás Csay, Chemist
Supervisors: Dr. Gábor Speier, Professor and Dr. József Kaizer, Associate Professor
The particular investigation of enzymatic processes is a new opportunity for science.
To understand their function is of great interest for pharmacological, industrial and environmental point of view. Catalase and catechol oxidase are enzymes with metallic cofactor at their active sites. Catalase protects living organisms from the destructive effects of hydrogen-peroxide; catechol oxidase is breaking down o-phenols to o-quinones. The details of their enzymatic reactions are not well known. To get insight into the enzymatic pathway, new manganese and copper containing complexes were synthesized and characterized with numerous spectroscopic (EPR, UV-VIS, IR) and X-ray diffractometric methods. They served as good functional and structural models for the enzymes mentioned above. Detailed kinetic investigations of the catalytic reactions have been performed and reaction mechanisms were proposed.
ZUSAMMENFASSUNG
Herstellung von Komplexen mit Isoindoline artigen Liganden und Untersuchungen ihrer Enzym-ähnlichen Reaktionen
Von: Tamás Csay, Diplomchemiker
Mentoren: Dr. Gábor Speier Chemieprofessor und Dr. József Kaizer Chemieprofessor
Die ausführlichen Untersuchungen der enzymatischen Prozesse sind eine neue Gelegenheit für die Wissenschaft. Ihre Funktionen zu verstehen ist von großem Interesse für die pharmakologische, industrielle und ökologische Sichtweise. Catalase und Catechol oxidase sind Enzyme mit metallischem Cofaktor an ihrer aktiven Seite. Catalase beschützt lebende Organismen vor dem zerstörerischen Effekt von Wasserstoffperoxid; Catechol oxidase reduziert o-phenole zu o-chinone. Die Details der enzymatischen Reaktionen sind nicht komplett bekannt. Um eine Einsicht in den enzymatischen Reaktionsweg zu bekommen, wurden neue Mangan und Kupfer enthaltende Komplexe hergestellt und charakterisiert mit einer bestimmten Anzahl von spektroskopischen (EPR, UV-VIS, IR) und Röntgenstrukturanalysen. Sie funktionieren als gute Funktionsmodelle und Strukturmodelle für die oben genannten Enzyme. Detaillierte kinetischen Untersuchungen der katalytischen Reaktionen wurden durchgeführt und Reaktionsmechanismen wurden vorgeschlagen.
A DOLGOZATBAN ELŐFORDULÓ RÖVIDÍTÉSEK
ROI reaktív oxigén intermedier
SOD szuperoxid dizmutáz
Kat kataláz
FeKat vastartalmú kataláz, ferrikataláz
His hisztidin
Asn aszparagin
NADPH nikotinamid-adenin-dinukleotid-foszfát redukált formája
Arg arginin
Tyr tirozin
MnKat mangántartalmú kataláz
Glu glutaminsav
ESR elektron spin rezonancia spektroszkópia
EXAFS röntgenabszorpciós finomszerkezet spektroszkópia
KO katechol oxidáz
CatH2 katechol, pirokatechin, orto-difenol
BQ orto-benzokinon
Cys cisztein
PTU fenil-tiokarbamid
UV-Vis ultraibolya-látható spektroszkópia
IR infravörös spektroszkópia
IndH 1,3-bisz(2’-piridilimino)-izoindolin
DMF dimetil-formamid
dtBCatH2 3,5-di-terc-butil-katechol
imH imidazol
py piridin
Tempo 2,2,6,6-tetrametil-1-piperidiniloxil
4’MeIndH 1,3-bisz(4’-metil-2’-piridil-imino)-izoindolin
dtBQ 3,5-diterc-butil-orto-benzokinon
dtBCatD2 kétszeresen deuterált 3,5-di-terc-butil-katechol
NMR mágneses magrezonancia spektroszkópia
DMSO-D6 hatszorosan deuterált dimetil-szulfoxid
dtBSQ 3,5-diterc-butil-orto-benzoszemikinon gyök
NBT nitro-tetrazolium-klorid
dtBCatD2 deuterált 3,5-diterc-butil-katechol
KIE kinetikus izotópeffektus
3’MePyOInd 3-(3’-metil-2’-piridilimino)-1-isoindolinon
NEt3 trietil-amin
Cl4CatH2 3,4,5,6-tetra-kloro-katechol
TARTALOMJEGYZÉK
1. BEVEZETÉS ... 1
2. IRODALMI ÁTTEKINTÉS ... 3
2.1.BIOKATALIZÁTOROK ÉS MŰKÖDÉSÜK ... 3
2.1.1. Metalloenzimek és fémionok által katalizált enzimek ... 4
2.2.A KATALÁZ ENZIM ... 5
2.2.1. Reaktív oxigén intermedierek ... 5
2.2.2. A hidrogén-peroxid és a hidroxil-gyök ... 6
2.2.3. A kataláz enzim és működése ... 8
2.2.4. A vascentrumú kataláz ... 9
2.2.5. Mangáncentrumú kataláz ... 11
2.2.6. Katalázmodellek és jelentőségük ... 15
2.3.A KATECHOL OXIDÁZ ENZIM ... 17
2.3.1. A katechol oxidáz enzim és működése ... 17
2.3.2. A katechol oxidáz enzimmodellek ... 21
3. CÉLKITŰZÉSEK ...24
4. EREDMÉNYEK ÉS ÉRTÉKELÉSÜK ...26
4.1.A[MN(INDH)CL2](CH3OH) KOMPLEX [98] ... 26
4.1.1. A [Mn(IndH)Cl2](CH3OH) komplex előállítása és szerkezetének vizsgálata ... 26
4.1.2. A [Mn(IndH)Cl2](CH3OH) katalázaktivitása aprotikus oldószerben, bázis jelenlétében ... 30
4.1.3. A [Mn(IndH)Cl2](CH3OH) katalázaktivitása protikus oldószerben ... 39
4.1.4. A [Mn(IndH)Cl2](CH3OH) katalázaktivitása aprotikus oldószerben, szabad gyök jelenlétében *109] 43 4.2.A[CU2(4’MEIND)2(MEOH)(µ-OH)]CLO4∙MEOH KOMPLEX [110] ... 48
4.2.1. A [Cu2(4’MeInd)2(MeOH)(µ-OH)]ClO4∙MeOH komplex előállítása ... 48
4.2.2. A [Cu2(4’MeInd)2(MeOH)(µ-OH)]ClO4∙MeOH komplex katechol oxidázaktivitása ... 52
4.3.ACU(3’MEPYOIND)2 KOMPLEX [117] ... 62
4.3.1. A 3’MePyOIndH ligandum előállítása ... 62
4.3.2. A Cu(3’MePyOInd)2 komplex előállítása ... 63
4.3.3. A Cu(3’MePyOInd)2 komplex sav-bázis titrálása ... 66
4.3.4. A Cu(3’MePyOInd)2 komplex katechol oxidázaktivitása ... 69
5. ÖSSZEFOGLALÁS ...77
6. KÍSÉRLETI RÉSZ ...79
IRODALOMJEGYZÉK ...83
1. BEVEZETÉS
Az élő szervezetekben végbemenő reakciók kellő sebességgel történő lejátszódása megfelelő katalizátorok nélkül elképzelhetetlen. Az élőlények anyagcseréjük (metabolizmus) során a felvett tápanyagok átalakításával felépítik sejtjeiket (anabolizmus), vagy lebontják őket energiaszerzés céljából (katabolizmus). Mind a szükséges anyagok előállításához, mind pedig a felesleges, esetleg káros anyagok lebontásához kémiai reakciók sokaságára van szükség. A legtöbb ilyen reakció normál körülmények között nem, vagy csak rendkívül lassan megy végbe. A reakciók aktiválási energiájának csökkentéséhez az élőlények biokatalizátorokat, ún. enzimeket használnak. Az enzimek bonyolult felépítésű fehérjék, közvetlen vizsgálatukat csak az utóbbi évtizedek műszertechnikai fejlődése tette lehetővé.
Ilyen vizsgálati módszerek szilárd fázisban a röntgendiffrakció, a folyadékfázisban a röntgenabszorpciós finomszerkezet spektroszkópia (EXAFS) és az NMR.
Az enzimek felépítését és reakcióikat a kémia mai tudásával még megközelítőleg sem vagyunk képesek leutánozni, viszont egyszerűbb szerkezeti és működési modelleken keresztül közvetett módon vizsgálhatjuk őket. Erre az aktív centrumukban fémionokat tartalmazó enzimek esetében a bioszervetlen, vagy más néven biokoordinációs kémia módszerei adnak lehetőséget. Ilyen modellekkel ún. bioutánzó reakciókat dolgozhatunk ki, amelyek az enzimkatalizált reakciók szelektivitásának és sebességének vizsgálatára alkalmasak.
A biokatalizátorok által gyorsított reakciók rendkívül sokfélék lehetnek. Mi a jelen értekezésben olyan enzimek modelljeinek vizsgálatával foglalkozunk, melyek metabolitikus folyamatokban vesznek részt és reakcióikhoz oxigént vagy hidrogén-peroxidot használnak fel.
Ilyen, általunk modellezett enzimek a katechol oxidáz és a kataláz.
A biológia folyamatok megismerése sok szempontból fontos lehet az emberiség számára. Az, hogy egyre „mélyebben” tekinthetünk be a saját és a minket körülvevő élőlények szervezetébe, egyre több lehetőséget adhat számunkra, hogy újfajta gyógyszereket és terápiás módokat dolgozhassunk ki a különböző betegségek ellen. De nem csak a már meglévő problémáink kezelésében, hanem a szervezetünket érő rengeteg káros hatás csökkentésében is fontos eredményeket érhetünk el ily módon. És akkor még nem is
beszéltünk a manapság rendkívül gyorsan fejlődő „zöld kémiában” rejlő lehetőségekről és az ipari felhasználhatóságról. Ez a fiatal tudományág, a bioszervetlen kémia mindegyik említett területen produkált már előrelépéseket és minden bizonnyal tartogat még új és lényeges eredményeket az emberiség javára.
A dolgozat témája olyan új bioutánzó vegyületek előállítása és bemutatása, amelyek valamilyen szempontból előre mozdíthatják a kutatásokat az enzimműködés és a kémia jobb megértése felé, de akár ötletekkel is szolgálhatnak későbbi gyakorlati alkalmazhatóságok megvalósításához.
2. IRODALMI ÁTTEKINTÉS
2.1. Biokatalizátorok és működésük
Eddig több mint 1500 különböző enzimet ismerünk. Mindegyikükre jellemző a katalitikus képesség és a szelektivitás, tehát egy bizonyos kémiai reakciót segítenek elő, azt is legtöbbször csak megfelelő körülmények között. A legtöbb enzim csak szűk pH- és/vagy a hőmérséklettartományon fejti ki hatását megfelelően.
Azt a vegyületet, melynek átalakulását az enzim segíti, szubsztrátumnak (S) nevezzük.
A szubsztrátum az enzim ún. aktív centrumában kötődik meg. A kötés erőssége viszonylag kicsi (12-50 kJ/mol), azaz a másodlagos kötések (hidrogénkötés, dipólus-dipólus kötés) szerepe jelentős. Az enzim aktív részeinek száma kevés, sokszor csak enzimenként egyet találunk. A szerkezet legnagyobb hányada legtöbbször „csak” az aktív centrum(ok) megfelelő elektrosztatikus környezetének kialakításában játszik szerepet. Az enzimek általában nagyszámú (több száz) aminosavmaradékból épülnek fel, molekulatömegük nagyobb, mint 10 kDa, átmérőjük meghaladja a 2,5 m-t. Az enzimkatalizált reakció (1. ábra) során a szubsztrátum (S) kapcsolódik az enzim (E) aktív centrumához és létrejön az enzim- szubsztrátum-komplex (ES). Ezután lejátszódik a kémiai reakció és képződik az enzim- termék-komplex (EP). Az utolsó lépésben a komplexből kilép a megfelelő termék (P) és a katalitikus körfolyamat újrakezdődhet.
S
EP ES
E P
1. ábra Az enzimkatalizált reakció
A katalizált reakciók típusa szerint az enzimeket hat csoportra bonthatjuk:
1. Hidrolázok: a fehérjék, poliszaharidok, zsírok, foszfátok hidrolízisét katalizálják.
Hasítják a szubsztrátumot a peptidkötés, a glikozidkötés, illetve az észterkötés mentén.
2. Oxireduktázok: a sejten belül végbemenő redoxireakciókat segítik. Ezen reakciók során elektron(ok) vagy hidrogénatom(ok) átvitele történik a résztvevő molekulák között.
3. Transzferázok: meghatározott atomcsoportok (pl.: -CH3, -NH2, -CO2H, -PO4) átvitelét katalizálják molekulák között.
4. Izomerázok: izomerizációs reakciók katalizátorai.
5. Liázok: hidrolitikus reakcióval hasítanak le csoportokat a szubsztrátumról (pl.: a dekarboxilázok karboxilcsoportból szén-dioxidot hasítanak le).
6. Ligázok: két molekula összekapcsolását segítik (pl.: C-O, C-N, C-C kötéseket alakítanak ki) [1].
2.1.1. Metalloenzimek és fémionok által katalizált enzimek
Az enzimek kb. harmada tartalmaz fémiont. A fémion molekulában betöltött szerepe alapján az ilyen enzimeknek két típusát ismerjük:
1. Fémionok által katalizált enzimek: a fémion nincs szorosan a fehérjéhez kötve.
Egyensúly áll fenn a fémion, az enzim és a fémion által aktivált enzim között, mivel általában csak gyenge kölcsönhatások révén kapcsolódnak. Ha a fehérjéről eltávolítjuk a fémet, aktivitása nem szűnik meg teljesen, de lényegesen lecsökken.
Legtöbbször ezek az enzimek a fémionra kevéssé, a fehérjékre viszont nagyon
specifikusak. Az aktiválást biztosító fém lehet: nátrium, kálium, magnézium, kalcium, cink vagy mangán.
2. Metalloenzimek: a fém a fehérje meghatározott helyén szorosan beépült alkotórész. A fém és a fehérje sztöchiometriai aránya meghatározott. Fiziológiás körülmények között a fémet a fehérjéből nem lehet eltávolítani. Ha más módon mégis eltávolítjuk, az enzim elveszíti aktivitását. Az enzim fémionra nézve általában specifikus. Gyakran a fehérje és a fém stabilis kelátkomplexet képeznek.
Ilyen fémek lehetnek például a vas(III), a réz(II), a cink(II), vagy a mangán(II).
Meghatározott reakcióhoz specifikus fémek szükségesek. Általában a réz az oxidázok, a cink a dehidrogenázok és a hidrolázok, a vas és a mangán az elektronátvivő enzimek és az oxigenázok fémkomponense. A fémion az aktív centrum sztereokémiáját és az elektronszerkezetét nagyban befolyásolja. A kialakult komplex általában belső feszültség alatt áll, így reakcióképesebb. Ez az állapot a fém oxidációfokának változását és ezzel a fém körüli szerkezet megváltozását is elősegítheti. Például a réz(I) tetraéderes, míg a réz(II) síknégyzetes vagy torzult oktaéderes geometriai elrendeződést alakít ki maga körül. Az eltérő szerkezetek közül az egyik stabilisabb állapotot jelent. A réz esetében a réz(II) a stabilisabb komplexképző, ezért a réz(I) oxidációja általában könnyebbé válik [1].
2.2. A kataláz enzim
2.2.1. Reaktív oxigén intermedierek
Mint tudjuk, „az oxigén ellensége az életnek és a jó bornak”. Az oxigénen át az alkoxilgyökökön, a peroxinitrilen és a szingulett oxigénen keresztül a hidroxilgyökig minden, az oxigénből levezethető részecske (általában szabad gyök) káros az élő szervezetre. Az ilyen részecskéket reaktív oxigén intermediereknek (ROI) nevezzük. Az ROI-k igen sokféle, a sejtekben lejátszódó folyamat során keletkezhetnek, gyakorlatilag saját szervezetünk termeli őket. Például, képződik szingulett oxigén proteinekből ultraibolya fény hatására, de a sejtes
kromoforok (színes vegyületek) látható fény hatására is indukálnak ilyet. Ez különböző bőrelváltozásokat okozhat, mint a hályog, a napégés, a bőrrák és a bőr korai öregedése. Az ROI-k által a szervezetben kiváltott káros hatások összességét oxidatív stressznek nevezzük.
Mivel az ROI-k szinte az összes szerves vegyülettel képesek reakcióba lépni, - köztük a DNS- sel is, - ezért ezeknek az anyagoknak a semlegesítése a sejtek számára szükséges és létfontosságú. Az élőlények rendelkeznek is a lebontáshoz szükséges mechanizmusokkal, de a kutatók még koránt sincsenek a metabolitikus folyamatok megértésének birtokában (2. ábra) [2; 3].
2. ábra A reaktív oxigén intermedierek hatásai
2.2.2. A hidrogén-peroxid és a hidroxil-gyök
Hidrogén-peroxid a szervezetben főleg a szuperoxid dizmutáz (SOD) [4] és egyes oxidáz enzimek [5] működésének melléktermékeként keletkezhet. A hidrogén-peroxid képes az említett enzimek aktív centrumában lévő Fe(II)-t oxidálva hatástalanítani azt, ám ettől még önmagában nem túlságosan toxikus. A Fe(II) jelenlétében azonban további átalakulás során az ROI-k egyik „képviselője” a hidroxil-gyök (•OH) képződik. A reakció elsőre rendkívül
hipoxia, iszkémia-reperfúzió, akut- és krónikus gyulladások, toxinok, égés, UV- és radioaktív sugárzás, tumoros
betegségek
Szabadgyökök fokozott termelése
Csökkent antioxidáns védelem
Oxidatív stressz
Lipidperoxidáció fokozódás, Membrándestrukció SEJTHALÁL
Szöveti keringés csökken
O2·- ; H2O2 ; HO· ; 1O2 egyensúlyi állapot
Szuperoxid dizmutáz Glutation peroxidáz,
endogén tiolok vitaminok, kataláz
egyszerűnek tűnhet, ennek ellenére az elmúlt több mint száz év intenzív kutatásai sem tudták teljes egészében feltárni a reakciómechanizmust. A témával a kémia sok jeles képviselője foglalkozott és publikáltak is eredményeket például az ún. Fenton-kémia [6-8], a Haber- Willstätter- [9] és a Haber-Weiss-folyamatok [10], illetve a George-mechanizmus [11; 12]
kidolgozásával. A rengeteg megjelent publikáció és az elvégzett kísérletek ellenére, még az sem tisztázott, hogy a vas milyen oxidációs állapotain keresztül játszódik le a folyamat, illetve, hogy gyökös, vagy ionos jellegű reakcióról van szó (1-4).
Fe(II)-Fe(IV) átmenet (ionos) [13]:
(1) Fe(II)-Fe(III) átmenet (gyökös) [12]:
(2)
Fe(III)-Fe(V) átmenet (ionos) [14]:
(3)
Fe(II)-Fe(III)-Fe(V) átmenet (ionos) [15]:
(4)
Jelenleg a hidrogén-peroxid lebontására leginkább elfogadott mechanizmus a Fe(IV)- ion kialakulásával és diszproporciójával járó kételektronos Fe(II)/Fe(III) átmenet, mely
szerint az (1-3) egyenletek között egyensúly áll fenn az (5)-ik egyenletben feltüntetett sztöchiometria szerint [13; 16].
(5)
Az említett folyamatok során keletkező hidroxil-gyök rendkívül reakcióképes és a már említett enziminhibíció mellett számos egyéb elváltozás okozója is lehet a szervezetben. Ilyen káros hatás lehet a lipidperoxidáció és a membrándestrukció, de akár közvetlenül a sejthalál kiváltója is lehet [17]. Az elmondottak alapján belátható, hogy a hidrogén-peroxid metabolizmusa az aerób élőlények számára elsődleges fontosságú.
2.2.3. A kataláz enzim és működése
A kataláz (Kat) az egyik leggyakrabban előforduló metalloenzim az élővilágban, mely aktív centrumában vasat vagy mangánt tartalmaz. Feladata a hidrogén-peroxid vízzé és oxigénné történő lebontása (6). Megtalálható gyakorlatilag az összes oxidatív környezetben élő létformában. Felfedezése, szerkezetének kutatása, valamint reakcióinak vizsgálata szorosan összefonódik a hidrogén-peroxid és a (bio)katalizátorok megismerésének történetével [18].
(6)
A H2O2 felfedezője L. J. Thénard már 1811-ben feltételezte, hogy kell léteznie az élőlényekben egy anyagnak, mely ezt a sejthalált okozó vegyületet semlegesíteni képes.
Később (1863) Schönbein vetette fel annak a lehetőségét, hogy ez az anyag egy
„fragmentum”, azaz mai szóhasználattal élve, egy enzim lehet. A kataláz szót Loew használta először (1900) utalva a hidrogén-peroxid katalitikus bontására [19]. Ebben az időszakban elsősorban a Kat vizsgálatának hatására kezdtek a tudósok rádöbbeni, hogy az enzimek valószínűleg olyan speciális fehérjék, melyek magas szintű szubsztrátum specifikus tulajdonságokkal rendelkeznek. Mindez azonban még puszta feltételezés maradt, mígnem az első enzimet, a Canavalia ensiformis nevű növényből kivont ureázt ki nem kristályosították
[20]. A Kat kristályszerkezete azonban ekkor még nem volt ismert. Hamarosan egy Wartburg nevű német tudós fontos felfedezést tett (1927), amikor cianid hozzáadására a Kat inhibícióját tapasztalta és a kísérlete alapján feltételezte, hogy az enzim vasat tartalmaz. Végül 1937-ben Sumner és Dounce a szarvasmarha májából tudta kellően tiszta, kristályos formában elkülöníteni az enzimet. Egy éven belül sikerült annak molekulatömegét is meghatározniuk [21], de a műszertechnika fejlődése csak később tette lehetővé az aminosav szekvenciák [22]
és 3 dimenziós szerkezet [23] pontos meghatározását. Mangántartalmú katalázt először 1985- ben sikerült azonosítani [24]. Ennek a kataláztípusnak napjainkban is csak néhány képviselője ismert.
2.2.4. A vascentrumú kataláz
A hem típusú aktív centrummal rendelkező kataláz (ferrikataláz, FeKat) enzimek az aerób létformák szinte mindegyikében előfordulnak a mikroorganizmusoktól [25] az állatokon keresztül [26] egészen az emberig (3. ábra) [27].
3. ábra Az emberi kataláz enzim [28]
Az állati kataláz homotetramer szerkezete négy különálló, egyenként ~60 kDa tömegű alegységből áll [29] (4. ábra). Mindegyik alegység belsejében egy hem ferriprotoporfirin IX
típusú aktív centrum helyezkedik el, melyhez a hidrofób felületű fehérjeszerkezet csak egy fokozatosan szűkülő, körülbelül 25 Å hosszú átjárót biztosít a kisméretű szubsztrátum molekula számára [30; 31]. Az egyes aktív centrumok működése a többitől térben elkülönülten zajlik, ezért az enzim egy időben akár négy szubsztrátum átalakítására is képes.
4. ábra Hem-szerkezet a FeKat-ban [32]
A szubsztrátum molekula, miután bekerült a hidrofób felületű átjárón keresztül az aktív centrum közelébe, a falat alkotó csoportokhoz lazán kötötten (hidrogénhíd-kötések)
„várakozik” míg az aktív centrum meg nem üresedik. Ezután a hidrogén-peroxid egyik oxigénje koordinatív kötést alakít ki a fématommal, a másik pedig hidrogénhíd-kötést létesít a fehérjelánc egy His75 és egy Asn148 aminosavával. Ekkor a csatorna ismét képes lesz egy újabb szubsztrátum fogadására. A koordinálódott és az aminosavak által polarizált peroxid heterolitikusan felhasad és kialakul egy vas-oxo-komplex, valamint egy vízmolekula (7). A katalitikus ciklus következő fázisában, a második peroxid oxidációja után tér vissza az enzim a nyugalmi állapotába (8). A szükséges redukciós folyamat körülményei jelenleg még tisztázatlanok. Mivel elektrontranszferrel jár, lehetséges, hogy a redukció nem az aktív centrum közelében történik, hanem a csatornán keresztül egymást követő hidridtranszferrel, vagy fokozatos kételektronos, egyprotonos transzferrel játszódik le. Fontos szerepet tulajdonítanak reakció lezárásában a NADPH-nak és az aktív centrum körül elhelyezkedő aminosavaknak, mint redukálószereknek, de a reakció körülményeinek tisztázása még várat magára. Valószínűleg némileg más lesz a reakciómechanizmus alacsony illetve magas hidrogén-peroxid koncentráció esetén is [33].
(7)
(8)
2.2.5. Mangáncentrumú kataláz
A legtöbb élőlényben ugyan a vastartalmú, hem típusú kataláz működik, azonban néhány egyszerűbb organizmusban az enzimnek egy másik típusa, a kétmagvú, mangáncentrumú kataláz (MnKat) fejlődött ki [34; 35]. A MnKat szerkezete és működése ugyan jelentős eltéréseket mutat a FeKat-hoz képest, de mindkét típus ugyanazt a funkciót látja el. Különbséget legegyszerűbben úgy tehetünk a két forma között, hogy cianid ionok hatására a FeKat-al szemben a MnKat-nál nem tapasztalható inhibíció [36; 37]. A
Lactobacillus plantarum [38], a Thermus thermophilus [39], a Thermoleophilum album [40], valamint a Thermus sp. YS 8-133 baktériumok [41] MnKat-ot használnak a H2O2 lebontására. Ezek közül a legtöbb információ (reakciókinetikai és szerkezeti) a Lactobacillus plantarumban és a Thermus thermophilusban található MnKat-ról áll rendelkezésünkre.
5. ábra A Lactobacillus plantarumban található kataláz enzim szerkezete
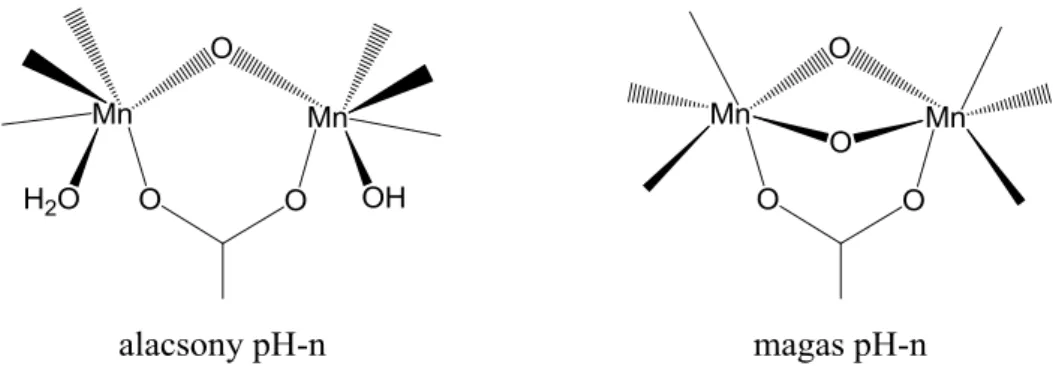
Mindkét baktériumból nyert enzim első koordinációs övezete (1 atom távolságra) nagyon hasonló felépítésű. A Lactobacillus plantarum nevű baktériumból nyert kataláz nyugalmi állapotában két Mn(III) atom egy Glu66 -karboxiláthídján valamint egy -oxo- és egy -hidroxocsoport egy-egy oxigénhídján keresztül kapcsolódik egymáshoz (5. ábra) [42;
43]. Az egyik mangánionhoz egy His181 nitrogénje és egy Glu35 karboxilát-csoportjának mindkét oxigénje kapcsolódik közvetlenül, míg a másik Mn-hoz egy His69 nitrogénje és egy Glu35 karboxilát-csoportjának egyik oxigénje kötődik. A hatodik koordinációs helyet egy labilis vízmolekula foglalja el (6. ábra).
6. ábra A Lactobacillus plantarum aktív centruma
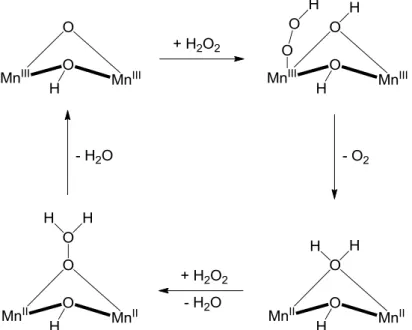
A H2O2 bontásának katalitikus ciklusa egy redukált Mn2(II,II) és egy oxidált Mn2(III,III) állapoton keresztül játszódik le [44; 45]. Bármelyik állapotból indul is a körfolyamat, az enzim aktivitására ez nem lesz hatással [46]. A pH azonban befolyásolja a reakciósebességet, mivel savas környezetben a hidroxohíd felbomlik (7. ábra) és a reakciósebesség nagymértékben lecsökken [47]. H2O2 jelenlétében kis mennyiségű Mn(II,III) és a Mn(III,IV) formák is kialakulnak, melyek azonban inaktívak és nem vesznek részt a szubsztrátum bontásában. Az enzim inhibícióját tapasztaljuk, ha a -oxohidat -Cl--ra cseréljük, vagy a labilisan kötött vízmolekulát, - melynek helyére a H2O2 beépülne a reakció során - aziddal helyettesítjük [48]. Ez utóbbi két megállapításból láthatjuk, hogy a különböző formában koordinálódott oldószer-molekuláknak igen fontos szerepe van az enzim megfelelő működésében és feltehetően a szubsztrátum megkötődésében. Ez a ligandumok labilitásának tulajdonítható, ami nagymértékben függ a központi fématomok oxidációs állapotától, a Mn- Mn távolságtól és a ligandumok protonáltsági fokától is.
7. ábra Egyensúly az MnKat aktív centrumának lehetséges szerkezetei között Mn2(III,III) oxidációs állapotban, eltérő pH-n
Mint említettük, a hidrogén-peroxid kételektronos katalitikus bontása egy redukált Mn2(II,II) és egy oxidált Mn2(III,III) formán keresztül játszódik le. Eközben egy H2O2 molekula O2-é oxidálódik, egy másik pedig H2O-é redukálódik (8. ábra). Az oxidatív és a reduktív félreakcióban a H2O2 eltérő módon koordinálódik. Az oxidatív félreakcióban szubsztrátum a labilis H2O helyére épül be és protonálja a -oxohidat, majd a Mn-dimer redukciójával párhuzamosan kilép egy O2 molekula. Ezután a reduktív félreakcióban a második ekvivalens H2O2 1,1-hidroperoxohídként koordinálódik, melynek során az O-O kötés polarizálódik és felhasad. A körfolyamat a fémcentrumok visszaoxidálódásával és vízvesztéssel zárul.
8. ábra A MnKat katalitikus körfolyamata a feltételezett oxidatív és reduktív állapotok feltüntetésével
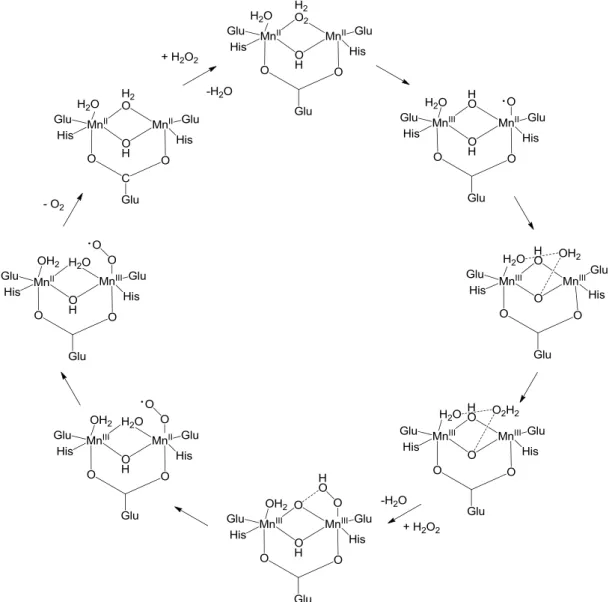
Mivel a körfolyamat egyedi lépéseit nem minden esetben lehetett kísérletileg is igazolni, az elméletek helyességét eddig csak számítógépes szimulációs módszerekkel (B3LYP, DFT) sikerült alátámasztani [49; 50]. A javasolt mechanizmus nyolc elemi lépésből áll (9. ábra). Az enzim redukált állapotában a Mn2(II,II) centrumot összekötő vízmolekula helyére először egy H2O2 szubsztituálódik. A hidrogén-peroxid O-O kötése ezután felhasad egy hidroxil-gyököt és egy hidroxohidat képezve, melynek során az egyik mangánról (Mn2(II,III)) egy elektron átkerül a hidrogén-peroxidra. Spinátrendeződéssel és protontranszfer folyamat során alakul ki a Mn2(III,III) oxidált forma, a hozzá kapcsolódó vízmolekulával. Ezt a vízmolekulát helyettesíti ezután egy H2O2, melynek koordinációja során az egyik O-H kötése heterolitikusan felhasad. A másik O-H kötés felhasadása vezet a
Mn2(III,II) komplexhez és a hozzá terminális helyzetben kötött O2 ligandumhoz. Ebben az átmeneti állapotban egy egyelektronos átmenet is történik a peroxidtól az egyik mangán centrumhoz. A két fématom között az elektronok átrendeződnek (Mn2(II,III)), majd a körfolyamat végén kilép egy triplett oxigénmolekula.
9. ábra Javasolt mechanizmus a MnKat által katalizált H2O2 metabolizmus körfolyamatára (B3LYP szimulációs módszerrel)
2.2.6. Katalázmodellek és jelentőségük
Főleg az utóbbi évtizedben szaporodtak meg az irodalmi leírások kataláz modellvegyületekkel kapcsolatban. Ennek oka nyilvánvalóan az, hogy az enzim szerkezetét és működésének megismerését az előző évszázad vége felé kezdték feltárni, ami a
műszertechnika fejlődésének (ESR, EXAFS, röntgendiffrakció, stb.) egyenes következménye volt. Az eredmények azonban még mindig részben feltételezéseken alapultak. Az enzimmechanizmusok minden lépését még ma sem tudjuk közvetlenül vizsgálni. Ilyen esetekben segíthetnek a modellvegyületek. Ezek nem csak az enzimhez való szerkezetbeli, illetve működésbeli hasonlatosságokból adódóan, hanem éppen ez enzimhez képesti eltéréseik miatt is fontos, új információkkal szolgálhatnak. Az élővilágból vett példákat nem csak lemásolni, de megérteni is szükséges. Az emberiség javára való fordításuk igazán csak ezután lehetséges.
Az 1. táblázatban a mangántartalmú katalázok és többféle fém központi atommal rendelkező modellvegyületek kinetika paramétereinek összehasonlítása látható. A közöttük különbségeket elsősorban a Michaelis-Menten-féle paraméterek arányával (kkat/KM) tehetünk.
Jól látható, hogy az enzimek katalitikus aktivitása messze meghaladja az eddigi legjobb mesterséges vegyület képességeit ([Mn(bpia)(-OAc)]2(ClO4)2). Ebből is látható, hogy enzim közvetlen környezetének lemásolásával még nem kerültünk lényegesen közelebb a problémák megoldásához. A természet összetettsége ebben az esetben is meghaladja az emberi lehetőségek határait. Azonban, már ezek a modellek is szerephez juthatnak az iparban és/vagy akár a gyógyászatban. Például az ún. „zöld-kémia” jegyében, a textilfestés során el nem használt azofestékek bontásakor visszamaradó H2O2-ot, ilyen katalizátorok segítségével semlegesítve lehet akár közvetlenül a környezetbe juttatni [58]. Sok lehetőség rejlik az ilyen vegyületekkel végzett antitumor, tüdő-, szív- vagy idegrendszeri problémák esetén, illetve gyulladásos betegségek során végzett kezelésekben is [59; 60]. Valószínűleg nem az enzimek pontos másolásával érhetünk el sikereket, hanem adott célnak legjobban megfelelő vegyületek megalkotásával. Ilyen célokra nem csak a mangán- és vastartalmú komplexek lehetnek alkalmasak, hanem más fémek is szóba jöhetnek. Ilyen lehet például a réz is. Különböző modellekkel végzett kísérletekből tudjuk, hogy nem feltétele a hatékony peroxid-bontásnak, a négymagvú vas, illetve a kétmagvú mangán sem. Mindemellett fontosak az enzim minél pontosabb leutánzásában rejlő kísérletek is, melyek közelebb vihetnek minket a bonyolult reakciómechanizmusok megértéséhez.
1. táblázat Katalázok és modellvegyületeik kinetikai adatai
Katalizátor kkat
(s-1)
KM
( × 10-3 M)
kkat/KM
(s-1M-1) T. thermophilus [51]
L. plantarum [52]
T. album [40]
[Mn(bpia)(-OAc)]2(ClO4)2a
[53]
[Mn(salpn)(-O)]2b
[54; 55]
[Mn(2-OH(Xsalpn)]2c [55; 56]
[Mn(ind)2] [57]
[Mn(H2O)6](ClO4)2 [55]
2,6×105 2,0×105 2,6×104 1,1×103 2,5×102 4,2-21,9 6,0×10-2 6,3×10-3
83 350
15 31,5
250 10,2-118
19 -
3.1×106 0.6×106 1.7×106 3.4×104 1.0×103 160-990
3,2 -
abpa: bisz(2-pikolil)(N-metilimidazol-2-il)-amin, bH2salpn: N,N’-bisz(szalicilidén)-1,3-diaminopropán; cH3(2- OHsalpn: N,N’-bisz(szalicilidén)-2-hidroxi-1,3-diaminopropán
2.3. A katechol oxidáz enzim
2.3.1. A katechol oxidáz enzim és működése
Az oxidoreduktáz enzimek egyik képviselője az oxidáz alcsoportba tartozó katechol oxidáz (KO), vagy régebbi nevén pirokatechin oxidáz enzim. Ez az enzim felelős a katechol (CatH2, pirokatechin) orto-benzokinonná (BQ) történő oxidatív lebontásáért oxigén jelenlétében (9). A KO enzim és szubsztrátuma is megtalálható számos növényben. Szemmel láthatóan megfigyelhető jelenlétük, mikor a színtelen CatH2 és a KO reakciója során keletkező barna BQ és polimerjei, a melaninok ősszel megszínezik a lehulló leveleket, vagy amikor a saláta sérült levele megbarnul a levegőn [61]. A folyamat a növények védelmi mechanizmusának részét képezi, ugyanis a keletkező kinon antibakteriális hatása révén próbálja meggátolni a keletkezett „seb” fertőződését. Ezenkívül a melaninok UV-elnyelésük révén képesek visszaszorítani a napsugárzás miatt keletkező szabadgyökök mennyiségét [62].
A kiváltott barnulás üteme lassítható, vagy akár teljesen meg is gátolható antioxidánsok (pl.
citromsav) hozzáadásával vagy a levegő (oxigén) megvonásával.
(9)
A katecholt H. Reinsch fedezte fel és izolálta az Acacia catechu nevű fa gyantájából 1839-ben. A catechu necű gyantából desztillált katechint hevítve jutott hozzá a fehér kristályos anyaghoz, a pirokatechinhez. Az enzimet első alkalommal 1937-ben Mayer és Harel tudta elkülöníteni [63], majd jóval később, az édesburgonyából kivonva, Krebs és munkatársai tudták meghatározni a röntgenszerkezetét 1998-ban (10. ábra) [64].
10. ábra Az édesburgonyából kivont katechol oxidáz enzim natív, Cu(II)-Cu(II) állapotban
Szerkezetét tekintve a KO kétmagvú, hármas típusú rézcentrummal rendelkező metalloenzim, melyben a két rézatom antiferromágnesessen csatolt és ezért ESR-ben nem ad jelet [65]. Ismeretes, hogy ilyen típusú fémcentrummal rendelkeznek a tirozináz [66] és hemocianin [67] enzimek is. Ezek a biokatalizátorok nem csak szerkezetükben, hanem az általuk gyorsított reakciók kémiájában is némileg hasonlóak egymáshoz. A hemocianin reverzibilisen képes megkötni a molekuláris oxigént és a legtöbb puhatestűben, illetve ízeltlábúban mint oxigénhordozó fehérjéje működik. A tirozináz fenolokat hidroxilál o- difenolokká (monofenoláz aktivitás), majd ezeket kételektronos folyamatban o-kinonokká (katechol oxidáz, vagy katecholáz aktivitás) oxidálja tovább. Összes képviselőjük UV- spektrumában intenzív sáv látható 330 nm körül. Oxidált állapotban mindkét központi Cu(II)- atomjuk 3-3 hisztidinhez koordinálódik és trigonális piramis szerkezetet alakít ki. A fémek
között gyakran -hidroxo- (11. ábra), vagy aktív állapotban -peroxohíd (O22-) alakul ki -
2:2 formában.
11. ábra A katechol oxidáz enzim aktív centruma és környezete az enzim nyugalmi (met) állapotában
A 11. ábra az édesburgonyából (Ipomoea batatas) kivont enzimet a nyugalmi, ún. met állapotában mutatja. Ez tipikus szerkezet a hármas típusú centrummal rendelkező enzimek esetén. A fématomok egymástól mért távolsága 2,87 Å. Érdekesség, hogy a His109 egyik szénatomja és a Cys92 kénatomja között kovalens kötés alakult ki. A met formából kiinduló enzimatikus körfolyamat (12. ábra) első lépésében egy katecholmolekula koordinálódik a központi fématom(ok)hoz. Mai ismereteink alapján nem világos, hogy egy, vagy két foggal koordinálódik a szubsztrátum. Fenil-tiokarbamiddal (PTU), egy természetes inhibitorral végzett kísérletek (CuII-CuII távolság 4.2 Å) alapján az egyfogú kapcsolatot valószínűsítik [64], de más kutatások a kétfogú koordinációt sem zárják ki [68; 69]. Ez utóbbi eset bizonyítása rendkívül nehéz - és eddig nem is járt sikerrel -, mivel a rendkívül feszített állapot legfeljebb csak igen rövid ideig létezhet. A következő lépésben egy ekvivalens o-kinon termék lép ki abban az esetben is, ha a reakció oxigéntől elzárva zajlik, ami kizárja, hogy a körfolyamat az oxi alakból indulhasson. Ezt a feltételezett alakot a szerkezetileg már felderített deoxi formából vezethetjük le oxigén jelenlétében. A redukált deoxi alak nem tartalmaz hídligandumot (CuI-CuI távolság 4,4 Å). Helyette az egyik rézzel egy vízmolekula alakít ki koordinatív kötést, míg a másik fém egy szabad koordinációs hellyel rendelkezik.
Mindkét központi fématom környezete legjobban torzult trigonális piramis szerkezettel írható
le. Az oxigén molekula koordinációja után kialakuló oxi forma meglétét in vitro kísérletekkel igazolták, melyeknek során H2O2-ot adtak a met alakhoz [65; 70]. Az oxi forma jelenlétére utalnak az UV-Vis spektrumban 343 és 585 nm-nél jelentkező sávok (peroxo-réz töltésátvitel), illetve a ~750 cm-1-nél látható Raman-rezgések (intra-peroxid νO-O feszítettség).
Ezekhez igen hasonló adatokat kaptak hemocianin esetében is [71]. A második szubsztrátum egy, vagy két foggal kapcsolódik az oxi forma aktív centrumához. Az enzim nyugalmi állapotához egy kételektronos transzfer során keletkező BQ kilépése után jut vissza.
12. ábra A katechol oxidáz lehetséges enzimatikus körfolyamata és a fenil-tiokarbamid inhibíciója [72; 73]
2.3.2. A katechol oxidáz enzimmodellek
A számos hemocianinnal [74-78], az alig néhány tirozinázzal [79] és a katechol oxidázokkal végzett vizsgálatok rengeteg szerkezeti hasonlóságra derítettek fényt az enzimek között. Eddig viszont még nem sok támasszal szolgáltak a működésükben rejlő különbségek mibenlétére. Fontos kérdések maradtak megválaszolatlanul a katalitikus körfolyamat részleteit tekintve is. Nem tudjuk például teljes bizonyossággal megmondani, hogy a katechol milyen módon koordinálódik a fémcentrumhoz, egy foggal, vagy esetleg hídligandumként és eközben hogyan deprotonálódik. Abban sem lehetünk biztosak, hogy a reaktív intermediereknek (oxi forma) milyen a pontos szerkezeti felépítése. Ilyen esetekben segíthetnek a szerkezeti és működési modellvegyületekkel végzet kísérletek. Mivel a modellek katalizálta reakciók lényegesen lassabban mennek végbe, szerencsés esetben lehetőség nyílhat akár a körfolyamat egyedi lépéseinek vizsgálatára is, ami közvetlenül az enzimmel végezve nem, vagy csak nagyon nehezen lenne megvalósítható.
A leírtak alapján nem lehet véletlen, hogy a KO enzim esetében viszonylag rövid idő alatt rendkívül sok modellvegyülettel végzett kísérletről jelent már meg tudományos közlemény. A katalitikus körfolyamatban „tátongó” rések betömködése nagyon jó indokot szolgáltat a kémikusoknak új vegyületek előállítására és reakcióiknak vizsgálatára. Ez pedig lehetőséget teremt a különböző kémiai szerkezetek és a bonyolult reakciómechanizusok közötti kapcsolatok részletesebb feltárására, illetve új nézőpontokból történő szemügyre vételére.
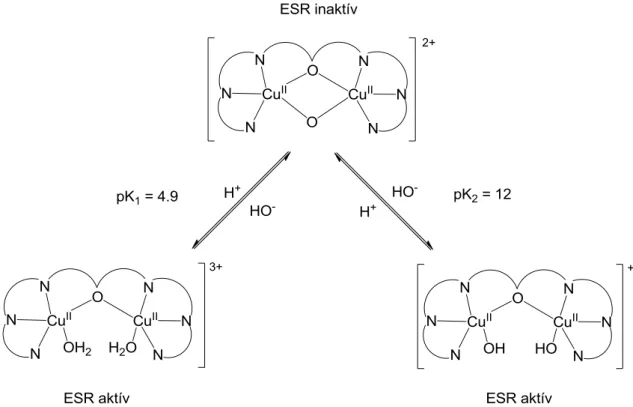
Merev szerkezetű modellvegyületekkel vizsgálták például a pH katalízisre gyakorolt hatásait [80] és azt tapasztalták, hogy alacsony pH-n az natív állapotban OH-hidas kétmagvú rézkomplex ESR-aktívvá válik és katalitikus képességei nagymértékben csökkennek. Ennek oka az OH-híd helyett kialakuló két különálló Cu(II)-OH2 fémcentrum egymástól 4,14 Å távolságban. Hasonló aktivitáscsökkenés lép fel magas pH-n is. Ekkor két Cu(II)-OH centrumot valószínűsítettek, feltehetően, az előbbi esetben tapasztalthoz hasonló távolságban egymástól. Ez az állapot szintén ESR-aktív volt. Ebből látható, hogy a közepes pH-n stabil µ–
OH-szerkezetben lévő viszonylag kicsi 2,96 Å Cu-Cu távolság nagyon fontos a reakció kellően gyors lefolyásában. Természetesen a hídligandum reverzibilis felbomlása során a
koordinációs övezet geometriája is torzul, illetve meg is változik. A kapott eredmények nagyon hasonlóak voltak az enzimműködésnél tapasztalt pH-függéshez (13. ábra).
13. ábra A pH hatása egyes merev vázú katechol oxidáz modellvegyületek szerkezetére
Előállíthatóak szubsztrátum-komplex adduktok is, reprezentálva a katechol kötődését a katalizátorhoz. Az első ilyen jellegű próbálkozások már 1985-ben megszülettek Karlin és munkatársainak munkája nyomán [81]. Különböző modellszubsztrátumok hozzáadására is érdekes felfedezések tehetőek. Az oxigén kiküszöbölésével és egy kevéssé reakcióképes modellszubsztrátummal, a 3,4,5,6-tetra-kloro-katechollal végzett vizsgálatok szerint a szubsztrátum koordinációja során a µ–OH-híd felhasad [82]. Hasonló jellegű mérésekből tudjuk, hogy a 4-es helyen szubsztituált katecholszármazékok esetén az elektronküldő csoportok növelik, míg az elektronszívó csoportok csökkentik a katecholázaktivitást. Az elvégzett kísérletek ellenére még mindig több féle lehetőség van arra, hogy működés közben hogyan koordinálódik az enzimhez a szubsztrátum [83; 84].
Sok kísérlet foglalkozik az oxi forma szerkezetének feltárásával is (14. ábra). A különböző elméletek alátámasztására számos szerkezeti modellvegyületet állítottak elő és vizsgálták katalitikus képességeiket [85-89]. Összességében elmondható, hogy a µ-OH-hidat tartalamzó komplexek általában jobb hatásfokkal katalizálják a CatH2 bontását, de a
legfontosabb tényezőnek ismét csak a Cu-Cu távolság tűnik. A legjobb katecholázaktivitással - az enzimhez hasonlóan - a 3 Å körüli értékkel rendelkező komplexek rendelkeznek és megközelítőleg 4 Å feletti távolság esetén az aktivitás lényegesen lecsökken (2. táblázat).
14. ábra Az oxi forma lehetséges szerkezetei
Az eddig elmondottak alapján lényeges szempontnak tűnhet, hogy a modellvegyületek két rézmaggal rendelkezzenek. Ennek ellenére számos, viszonylag jó hatásfokkal működő egymagvú réz [90], mangán [91], vagy vastartalmú [92] enzimmodell is létezik.
2. táblázat Katechol oxidáz modellvegyületek kinetikai adatai*
Katalizátor Cu-Cu
(Å)
kkat
(× 10-2 s-1)
KM
(× 10-3 M)
kkat/KM
(s-1M-1) [Cu2(LO)(OAc)(H2O)](ClO4)2 [93]
[Cu2(LO)(OTf)](OTf)2 [85]
[Cu2(LO)(OH)](ClO4)2 [80]
[Cu2(LO)(OH)2](ClO4)2·H2O [84]
[Cu2(LO)(OH)(H2O)(EtOH)](ClO4)2 [94]
[Cu2(LO)(OMe)(MeOH)(ClO4)]ClO4 [94]
[Cu2(LH2)(MeCN)4](ClO4)6·2H2O [87]
[Cu2L(OMe)(MeOH)](ClO4)2 [84]
[Cu2L(OH)(BF4)2](BF4)2 [84]
3,40 3,70 2,96
- 2,90 2,94
- 4,53 3,45
0,28 3,3 2,4 2,8 5,9 0,13
5,0 0,006
78
8,6 29 15 49 2,4 3,1
22 0,79 0,89
3,30 11,4 16,4 5,67 248 43 22,7
8,0 8741
*L = különféle ligandumok
3. CÉLKITŰZÉSEK
Az enzimek közvetlen vizsgálata drága, körülményes és időigényes feladat és az elért eredmények gyakran nem egyértelműek. A műszertechnika fejlődése ugyan egyre több lehetőséget ad közvetlen vizsgálatokra, de ezek még mindig nem elégségesek a teljes kép feltárásához. Az egyik legfőbb problémát ilyen esetekben az enzimreakciók nagy sebessége jelenti. A készülékeink felbontása sokszor még nem elégséges a folyamatok egyedi lépéseinek vizsgálatára. Valószínűleg a biokatalizátorok pontos lemásolása egyébként sem járna túl sok sikerrel. A nagyméretű molekulák terápiás céllal való bejuttatása a szervezetbe óriási probléma lenne, mivel ezek sokszor nem képesek átjutni a sejtfalon sem. Nem is beszélve a gyógyszerek kifejlesztésével és az előállításukkal járó költségek várhatóan rendkívül nagy mértékéről. Az ipari felhasználhatóságot is minden bizonnyal a magas ár szabná meg. Ma még nem lehetünk teljesen biztosak abban, hogy az enzimek hatalmas fehérjeszerkezetének minden egységére szükség van a kívánt hatás elérésére. Sokkal egyszerűbb feladatnak tűnik jelenleg, ha nem az enzimek teljes egészét vizsgáljuk egyszerre, hanem annak csak egy kiragadott, kisebb részletét. Kézenfekvő, hogy ez a rész az aktív centrum legyen. Az ilyen irányú kísérleteket többféle módon is megközelíthetjük. Megpróbálhatjuk teljes pontossággal, vagy legalább nagyjából lemásolni a központot szerkezeti modelleket előállítva, vagy modellezhetjük csak az enzimreakciót, az enzimétől akár teljesen eltérő felépítésű molekulákkal (működési modellek). Nyilvánvaló, hogy előbbi esetben főleg az enzimműködés feltárása lehet a cél, míg utóbbiban inkább az attól való eltérések mibenlétének keresése lehet érdekes. A kétféle kutatási lehetőséget azonban nem érdemes egymástól elkülöníteni és összefüggéseiben kell nézni a feltárandó problémákat.
A kataláz enzimmodellek:
A katalázoknak és főleg modelljeiknek rendkívül széles a gyakorlati felhasználhatóságuk. Az iparban gyakran használnak hidrogén-peroxidot oxidálószerként (például azofestékek bontásakor). Ezt a „zöld kémia” jegyében teszik, ugyanis a peroxid viszonylag gyorsan lebomlik a természetben, azonban a kibocsátás környékének élővilágát ettől még károsíthatja. Ezért minél olcsóbb és hatékonyabb lebontásuk így is szükséges. A
szervezetünkre egyre gyakrabban és egyre pusztítóbb hatással van az ún. oxidatív stressz. Ide tartoznak többek között a hidrogén-peroxidból levezethető hidroxil-gyök okozta panaszok (például az acatalasemia). Az ellenük való védekezés egyik lehetősége megfelelő antioxidáns hatással bíró vegyületek kifejlesztése, melyek nem mérgezőek, valamint könnyen és olcsón előállíthatóak.
Mindemellett fontos szempont az enzimműködés részletesebb vizsgálata, mely ebben az esetben különösen nehéz, ugyanis a vastartalmú katalázok a leghatékonyabb ma ismert biokatalizátorok. Egyetlen másodperc alatt akár 6 millió szubsztrátum átalakítására is képesek, így a reakció nyomon követése nem teljesen megoldott és sok részlet vár még feltárásra.
Mi olyan mangántartalmú modellvegyületet szerettünk volna előállítani, mellyel hatékonyan szemléltethetjük az enzim aktív centrumában jelenlévő bázisok esetleges hatásait.
Meg kívántuk vizsgálni, milyen hatással lehet a reakcióra a pH, illetve hogyan befolyásolja a fémcentrum redox állapotának megváltozása a mechanizmust. Reményeink szerint ezekkel a kutatásokkal hozzájárulhatunk a kataláz enzimatikus körfolyamatának jobb megértéséhez és ötletet adhatunk új gyógyszerek kifejlesztésére.
Katechol oxidáz enzimodellek:
Az aromás szerves vegyületek oxidatív lebontása enyhe körülmények között nagy érdeklődésre tart számot az iparban [95] és a környezetvédelemben [96] is. A széles körű felhasználhatóságot ebben az esetben nem az enzimreakciókra jellemző specifikusság, hanem éppen ellenkezőleg, az azonos katalizátorral elvégezhető minél többféle vegyület lebontása jelenti. A katecholáz reakciónak jelentős szerepe van az orvosi diagnosztikában is, mivel ennek segítségével határozzák meg a catecholamint, az adrenalint, a noradrenalint, a dopamint is [97]. Különböző mesterséges vegyületekkel lényegesen olcsóbbá lehetne tenni ezeket a vizsgálatokat. A KO enzimmodelljeink legfontosabb célja azonban az enzimműködés egyes aspektusainak feltárása. Meg szeretnénk tudni, hogy a szubsztrátum egy, vagy két foggal koordinálódik fémcentrumhoz és eközben hogyan képes deprotonálódni. Fontos szerepe lehet például ebben a folyamatban többféle bázisnak is, például a centrumhoz közel elhelyezkedő, egy oldószer molekulával hidrogénhíd kötésben lévő glutamátnak. Érdekes lehet olyan modellek vizsgálata is, melyek a fémek közötti hídkapcsolatokat szemléltetik a reakció során.
4. EREDMÉNYEK ÉS ÉRTÉKELÉSÜK 4.1. A [Mn(IndH)Cl
2](CH
3OH) komplex [98]
4.1.1. A [Mn(IndH)Cl
2](CH
3OH) komplex előállítása és szerkezetének vizsgálata
A kataláz modellvegyületünkhöz ligandumként 1,3-bisz(2’-piridilimino)-izoindolint (IndH) használtunk. Ennek a bázikus sajátságú molekulának a felépítése tautomer szerkezetekkel írható le (15. ábra). A vegyület a fehérjék egyes aminosav alegységeihez hasonlóan (pl.: szerin, hisztidin) a nitrogénatomok nemkötő elektonpárjainak révén képes a központi fémmel koordinatív kötés kialakítására, akár kelátkomplexet is képezve, így merevítve a szerkezetet. Egyes réz- [99], ruténium- [100], kobalt- [101] és vastartalmú [102]
vegyületeiről pedig már korábban leírták, hogy képesek különböző oxidációs folyamatok katalízisére is.
15. ábra Az IndH ligandum
MnCl2·4H2O-ot és IndH-t acetonitril-metanol elegyében, inert atmoszférában refluxáltattunk egy napig, majd a kivált csapadékot szűrtük, éterrel mostuk és vákuumban szárítottuk (10). A nyersterméket metanolból, éter rádiffundáltatásával kristályosítottuk át.
Ekkor sárgásbarna kristályokat kaptunk.
(10)
A komplexet infravörös, UV-Vis és ESR spektroszkópiai módszerekkel, valamint elemanalízissel és röntgendiffrakcióval vizsgáltuk.
Az IndH ligandum pirrol nitrogénje koordináció során deprotonálódhat, ami nagyban befolyásolhatja a komplex szerkezetét és elektroneloszlását. A protonált illetve deprotonált formák azonban spektroszkópiai módszerekkel megkülönböztethetőek. A [Mn(IndH)Cl2](CH3OH)-ról felvett infravörös spektrumokon (KBr) az 1659 cm-1-nél és az 1628 cm-1-nél látható intenzív sávok, valamint a 3288 cm-1-nél jelentkező gyengébb sáv a protonált formára jellemzőek. Az Ind- esetében csak egy gyenge sáv lenne észlelhető 1600 cm-1 körül [57; 103]. Ezeket a sávokat nem lehet pontosan egy adott rezgéshez rendelni, feltehetően az imin- és a 2-piridil-csoportokhoz tartoznak. A 3470 cm-1-nél (O-H) és a 2966 cm-1-nél (C-H alifás) lévő sávok az átkristályosítás során a kristályrácsba beépült metanol oldószer jelenlétére utalnak (3. táblázat).
Az UV-Vis spektrumban (DMF) 330 és 370 nm között jellegzetes csúcsok figyelhetőek meg, melyek az IndH ligandum -* átmeneteivel társíthatóak. Deprotonált esetben a betöltött és betöltetlen -MO-k közötti energiakülönbség csökken, 50-100 nm-es batokróm eltolódást eredményezve [104]. 700 nm környékén a láthatóak a Cu(II)-re jellemző, alacsony intenzitású d-d átmenetek csúcsai (3. táblázat).
3. táblázat A [Mn(IndH)Cl2](CH3OH) komplex fontosabb spektroszkópiai adatai IR (KBr, cm-1) 1628, 1659, 3288, 3470 (OH), 2966 (CH alifás) UV-Vis (DMF), max(
)271(15488), 284(19953), 296(19953), 330(17378), 346(17782), 367(19055), 386(21878),
690(13)
ESR (DMF) g = 2,0011, A = 94,14 G
Az ESR spektrumon (DMF oldószerben) lévő hatos sáv a monomer mangán(II) központi fématomra jellemző (3. táblázat; 16. ábra).
3000 3200 3400 3600 3800 4000 Gauss
16. ábra A [Mn(IndH)Cl2](CH3OH) komplexről szobahőmérsékleten, levegőn,
DMF oldószerben készült ESR felvétel
A metanolból történő átkristályosítás után kivált kristályok röntgendiffrakciós mérésre alkalmasnak bizonyultak (17. ábra). Az eredmények ismeretében meghatároztuk a fontosabb kötéstávolságokat, kötésszögeket és cellaparamétereket (4. táblázat; 5. táblázat).
17. ábra A [Mn(IndH)Cl2](CH3OH) komplex szerkezete (a MeOH feltüntetése nélkül)
A szerkezet alapján, az előbbiek figyelembevételével megállapítható, hogy az egymagvú komplexet egy IndH és két klorid ligandum veszi körül enyhén torzult trigonális bipiramis elrendeződésben ( = 0,69). Az IndH középső nitrogénatomja és a két klorid ligandum egy síkban helyezkednek el, míg a két szemben lévő csúcson a piridingyűrűk nitrogénjei találhatóak. Látható, hogy az IndH protonált formában van jelen. A kristályrácsba rendezetlenül oldószer-molekulák is épültek.
4. táblázat A [Mn(IndH)Cl2](CH3OH) komplex jelentősebb kötéshosszai és kötésszögei
Kötés Kötéshossz (Å) Kötés Kötésszög (°)
Mn(1) – N(1) Mn(1) – N(5) Mn(1) – N(4) Mn(1) – Cl(2) Mn(1) – Cl(1) N(3) – C(4) C(1) – N(2)
2,152(4) 2,236(5) 2,261(5) 2,373(2) 2,406(2) 1,284(7) 1,323(7)
N(5) – Mn(1) – N(4) N(1) – Mn(1) – Cl(1) N(1) – Mn(1) – Cl(2) Cl(1) – Mn(1) – Cl(2)
C(4) – N(3) – C(14) C(1) – N(2) – C(9)
165,72(18) 123,63(13) 124,53(13) 111,68(7)
128,2(5) 112,5(5)
5. táblázat A [Mn(IndH)Cl2](CH3OH) komplex kristályadatai és adatgyűjtési paraméterei Összegképlet C19H17ON5MnCl2 Az elemi cella
3813(4) Molekulatömeg [g/mol] 425,17 térfogata [Å3]
Kristály színe sárgásbarna Abszorpciós
0,984
Hőmérséklet [°C] 20 koefficiens [mm-1]
Kristályrendszer Monoklin F(0000) 1720
Tércsoport C 2/c Index tartományok -17≤h≤17
Molekulák száma/elemi cella 8 -18≤k≤18
Sűrűség (számított) [g/cm3] 1,481 -18≤l≤18
Elemi cella méretei: Mért adatok 3299
a [Å] 15,052(10) Reflexiók I > 2σ(I) 1936
b [Å] 15,964(8) Paraméterek 380
c [Å] 115,870(11) R 0,0632
α [°] 90,00 wR 0,1469
β [°] 90,66(2) GOF 1,295
γ [°] 90,00
4.1.2. A [Mn(IndH)Cl
2](CH
3OH) katalázaktivitása aprotikus oldószerben, bázis jelenlétében
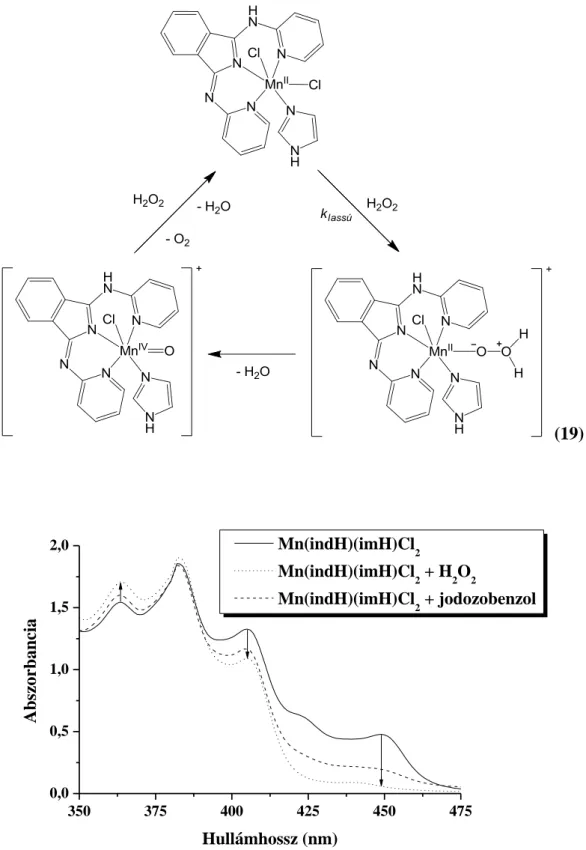
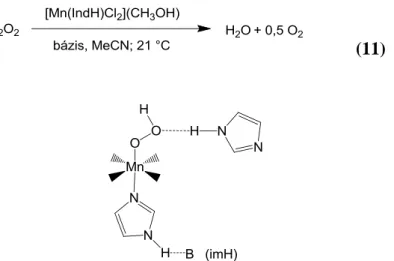
A [Mn(IndH)Cl2](CH3OH) komplex katalázaktivitásának vizsgálatát levegőn, acetonitril oldószerben, 21°C-on végeztük. A hidrogén-peroxid oxigénné és vízzé történő katalitikus diszproporcióját gázvolumetriás módszerrel követtük nyomon, melynek során gázbürettával mértük a keletkezett O2 térfogatát, melyből a hidrogén-peroxid fogyása számolható. A [Mn(IndH)Cl2](CH3OH) mint katalizátor, önmagában nem bizonyult aktívnak.
Egyes kataláz enzimek esetében azonban ismert az a tény, hogy nitrogéntartalmú, nem az enzimhez tartozó szerves bázisok is jelen vannak az aktív centrum közelében. Jelentőségük még nem teljesen tisztázott, de feltételezhetően bázikus sajátságaik, esetleg az aktív centrumhoz történő koordinációjuk során az enzim elektronszerkezetében fellépő változások miatt számottevően befolyásolhatják a hidrogén-peroxid metabolizmusát. Ezért vizsgáltuk a modellvegyületet, hogy különböző szerves bázisok tudják e aktiválni, és ha igen, akkor milyen módon képesek erre (11).
(11)
18. ábra A koordináció és a bázikusság lehetséges hatásai imidazol esetében
Az általunk választott bázisok különböző imidazol- (imH) és piridinszármazékok (py) voltak (19. ábra). Ezek a bázisok egymástól többé-kevésbé eltérő szerkezetük miatt mind elektronküldő sajátságaikban, mind pedig -donor és-donor tulajdonságaikban is némileg különböznek egymástól (20. ábra). Fém centrumhoz való koordinációjuk nitrogén atomjaik nem-kötő elektronpárjai révén lehetséges, ez alól azonban kivételt jelent a sztérikus gátlás
miatt koordinatív kötés kialakítására nem képes 2,6-ditercbutil-piridin. Így ez utóbbi vegyületet csak Brønsted-bázisként működő referenciaként használtuk.
19. ábra A H2O2 katalitikus bontása során használt bázisok
20. ábra A bázisok elektronküldő sajátságai
Az eltérő bázisok azonos körülmények között eltérő mértékben befolyásolták a H2O2
diszproporcióját (21. ábra). A 2,6-dtBu-py esetében számottevő oxigén gázfejlődés nem volt tapasztalható, ami bizonyítja, hogy ilyen körülmények között önmagában a bázikus jelleg nincs hatással a reakció lejátszódására. Azonban a koordinatív kötés kialakítására képes bázisok kisebb-nagyobb mértékben elősegítették a hidrogén-peroxid bontását.
![12. ábra A katechol oxidáz lehetséges enzimatikus körfolyamata és a fenil-tiokarbamid inhibíciója [72; 73]](https://thumb-eu.123doks.com/thumbv2/9dokorg/872621.46934/30.892.127.805.351.948/ábra-katechol-oxidáz-lehetséges-enzimatikus-körfolyamata-tiokarbamid-inhibíciója.webp)
![22. ábra A kezdeti reakciósebesség változása az imH koncentrációjának függvényében [{Mn(IndH)Cl 2 }(CH 3 OH)] 0 = 2,11 × 10 -3 M; [H 2 O 2 ] 0 = 4,47 × 10 -1 M;](https://thumb-eu.123doks.com/thumbv2/9dokorg/872621.46934/42.892.232.655.643.975/ábra-kezdeti-reakciósebesség-változása-imh-koncentrációjának-függvényében-indh.webp)
 komplex színképében imidazol hozzáadásának hatására](https://thumb-eu.123doks.com/thumbv2/9dokorg/872621.46934/43.892.227.716.371.685/ábra-spektrális-változások-komplex-színképében-imidazol-hozzáadásának-hatására.webp)
 komplex koncentrációjának függvényében](https://thumb-eu.123doks.com/thumbv2/9dokorg/872621.46934/46.892.224.647.292.615/ábra-kezdeti-reakciósebesség-változása-indh-komplex-koncentrációjának-függvényében.webp)