A nesfatin-1/NUCB2 szerepének vizsgálata a központi idegrendszerben
Doktori értekezés
Könczöl Katalin
Semmelweis Egyetem
Szentágothai János Idegtudományi Doktori Iskola
Témavezető : Dr. Tóth Zsuzsanna, Ph.D.
Hivatalos bírálók: Dr. Hrabovszky Erik, D.Sc.
Dr. Kocsis Katalin, Ph.D
Szigorlati bizottság elnöke: Dr. Köves Katalin, D.Sc.
Szigorlati bizottság tagjai: Dr. Papp Edit, Ph.D.
Dr. Oláh Márk, Ph.D.
Budapest
2014
2
Tartalom
1. Rövidítések jegyzéke ... 5
2. Bevezetés ... 7
2.1. Az energiaháztartás egyensúlya és a testsúly ... 7
2.2. Az energiafelvétel (táplálkozás) központi idegrendszeri szabályozása ... 8
2.3. Az energia leadás módjai és azok szabályzása ... 10
2.3.1. Az alapanyagcsere és szabályozása ... 10
2.3.2. A hőszabályozás idegi mechanizmusai ... 11
2.4. Az energiaegyensúlyt módosító hatások ... 14
2.5. A táplálékfelvétel szabályzás egy újabban megismert faktora; a nesfatin-1 ... 15
2.5.1. A nesfatin-1 felépítése, előfordulása a szervezetben ... 15
2.5.2. A nesfatin-1 hatása a táplálékfelvételre ... 17
2.5.3. A nesfatin-1 egyéb, eddig megismert funkciói ... 18
2.5.4. A nesfatin-1 hatásmechanizmusa ... 20
2.5.5. A hipotézis kifejtése ... 20
3. Célkitűzések ... 24
4. Anyagok és módszerek ... 25
4.1. A kísérletek felépítése és időbeosztása ... 25
4.2. Kísérleti állatok ... 29
4.3. Intracerebroventricularis kanül beültetése ... 29
4.4. Biotelemetria ... 30
4.5. Hideg stressz ... 31
4.6. Kolhicin kezelés ... 31
4.7. Juguláris kanül beültetése és vérvétel ... 32
4.8. Hypophysis sejttenyészet ... 32
4.9. Restraint stressz ... 33
4.10.Adrenalektómia ... 33
4.11.ACTH és kortikoszteron radioimmunoassay ... 34
4.12.Immunhisztokémiai festések ... 34
4.12.1. Általános immunhisztokémiai protokoll ... 34
3
4.12.2. Fos és nesfatin-1/NUCB2 kettős és Fos, nesfatin-1/NUCB2 és
prepro-TRH tripla fluorescens immunfestés ... 35
4.12.3. Nesfatin-1/NUCB2 és prepro-TRH kettős fluorescens immunfestés ... 36
4.12.4. Fos és nesfatin-1/NUCB2 kettős immunfestés ... 36
4.12.5. PrRP és nesfatin-1/NUCB2 kettős és PrRP, nesfatin-1/NUCB2 és TH tripla fluorescens immunfestés ... 37
4.13.Kolokalizációs arányok számolása ... 37
4.13.1. A restraint hatására aktiválódott nesfatin-1/NUCB2 sejtek aránya a PVN-ben ... 37
4.13.2. PrRP és nesfatin-1/NUCB2 kolokalizáció a nyúltvelőben ... 37
4.14.Nesfatin-1/NUCB2 in situ hibridizáció ... 38
4.14.1. A nesfatin-1/NUCB2 próba előállítása ... 38
4.14.2. A nesfatin-1/NUCB2 in situ hibridizációs hisztokémia ... 39
4.15.Az in situ hibridizációs jel kvantálása ... 40
4.16.Statisztikai analízis ... 40
5. Eredmények ... 42
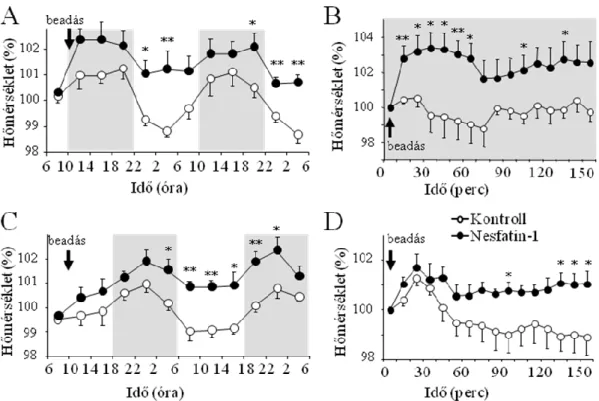
5.1. A nesfatin-1 energialeadásra gyakorolt hatásának vizsgálata ... 42
5.2. A hideg környezet hatása a nesfatin-1/NUCB2 immunpozitív sejtek aktiváltsági állapotára ... 50
5.3. Az exogen nesfatin-1 HPA tengely aktiváló hatása in vivo ... 54
5.4. A nesfatin-1 közvetlen hatásának vizsgálata a hypophysis sejtekre in vitro ... 55
5.5. Az endogen nesfatin-1 szerepe a stressz válasz kialakításában ... 55
5.6. A negatív glükokortikoid feedback hiánya a nesfatin-1/NUCB2 mRNS expresszióra a PVN-ben ... 60
6. Megbeszélés ... 63
6.1. Az alkalmazott dózis ... 63
6.2. A nesfatin-1 élettani hatásainak jellemzése a cirkadian ritmus függvényében .. 63
6.2.1. A táplálék- és vízfelvételre gyakorolt hatások jellemzése ... 64
6.3. A nesfatin-1 részvétele a termoregulációban... 65
6.3.1. A telemetriával mért paraméterek elemzése ... 66
4
6.3.2. A hideg stressz hatására aktiválódott nesfatin-1/NUCB2 termelő
neuronok a központi idegrendszer területén ... 67
6.4. A nesfatin-1 szerepe a stresszreakcióban ... 69
6.4.1. Az exogen nesfatin-1 hatása a HPA tengely aktivációjára ... 70
6.4.2. A restraint hatása a nesfatin-1/NUCB2 termelő neuronok aktivációjára és mRNS expressziójára ... 71
6.4.3. A NTS és a VLM területén elhelyezkedő nesfatin-1/NUCB2 sejtek kémiai karakterizálása ... 71
6.4.4. A glükokortikoidok szerepe a nesfatin-1/NUCB2 expresszió szabályzásában ... 72
7. Következtetések ... 74
8. Összefoglalás ... 75
9. Summary ... 76
10. Irodalomjegyzék ... 77
11. Saját publikációk jegyzéke ... 92
12. Köszönetnyilvánítás ... 93
5
1. Rövidítések jegyzéke
3V – harmadik agykamra Acc – accumbens mag
ACTH – adrenokortikotrop hormon, kortikotropin ADX – adrenalektómia
AgRP – agouti-related fehérje AP – area postrema
ARC – arcuatus mag BAT – barna zsírszövet bpm – szívverés/perc
BSA – borjú szérum (bovine serum albumin)
CART – kokain- és amfetamin-regulált transzkript fehérje CCK – kolecisztokinin (cholecystokinin)
CRH – kortikotropin-rilízing hormon DAB – 3,3’-diaminobenzidin
DAPI – 4’,6-diamino-2-fenilindol
DLHA – dorsolateralis hypothalamicus area DMH – dorsomedialis mag
DMX – a nervus vagus általános visceromotoros (dorsalis motoros) magja
dp – a hypothalamicus paraventricularis mag dorsalis parvocellularis szubdivíziója
GLP-1 – glukagon-szerű peptid-1
HPA – hypothalamo-hypophysis-mellékvese tengely icv – intracerebroventricularis
IHC – immunhisztokémia
IML – intermediolateralis sejtoszlop ISH – in situ hibridizáció
LB – Luria-Bertani tápleves LPB – lateralis parabrachialis mag MCH – melanin-koncentráló hormon
mpdd – a hypothalamicus paraventricularis mag medialis parvocellularis szubdivíziójának dorsalis része
6
mpdv – a hypothalamicus paraventricularis mag medialis parvocellularis szubdivíziójának ventralis része
mpv – a hypothalamicus paraventricularis mag medialis parvocellularis szubdivíziójának pre-autonóm régiója
NPY – neuropeptid Y
NTS – nucleus tractus solitarii NUCB2 – nucleobindin-2 fehérje
PBS – foszfát pufferelt fiziológiás sóoldat, 0,1M, pH: 7,4 PFA – paraformaldehid, 4%, pH: 7,4
pm – a hypothalamicus paraventricularis mag posterior magnocellularis szubdivíziója
POA – praeopticus area POMC – proopiomelanocortin PrPR – prolactin-rilízing peptid
pv – a hypothalamicus paraventricularis mag parvocellularis periventricularis szubdivíziója
PVN – hypothalamicus paraventricularis mag rRPa – rostralis raphe pallidus mag
SON – supraopticus mag
SSC – nátrium-citrát puffer, pH: 7,0 T3 – trijód-tironin
T4 – tiroxin
TH – tirozin-hidroxiláz
TRH – tireotropin-rilízing hormon
Tris – trisz (hidroxi-metil)-amino-metán puffer, 0,1M, pH: 8,0 TSH – tireoidea-stimuláló hormon, tireotropin
UCP1 – uncoupling protein-1 enzim VLM – ventrolateralis nyúltvelő VMH – ventromedialis mag
7
2. Bevezetés
2.1. Az energiaháztartás egyensúlya és a testsúly
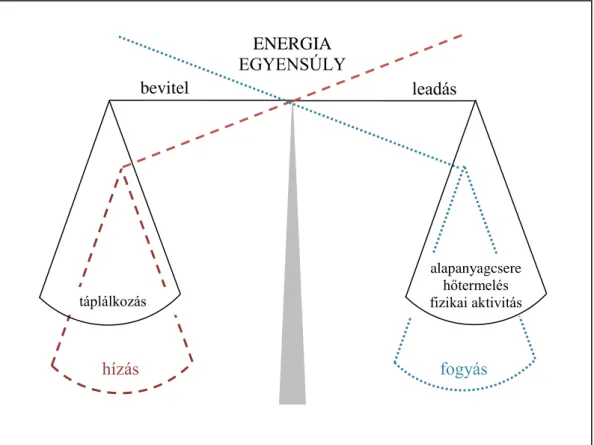
Az élőlények túlélése szempontjából az energiaháztartás egyensúlya, mely meghatározza a testtömeg alakulását is, alapvető jelentőségű. Ismert, hogy mind az elhízás, mind a kóros soványság veszélyezteti az egészséget, és napjainkban világszerte súlyos problémát okoz (Smink és mtsai 2013). Az állatok az életfunkciók fenntartásához az energiát az elfogyasztott táplálékból nyerik, aminek egy részét hő és mozgási energia formájában leadják. Amennyiben az energiabevitel nagyobb, mint az elhasznált mennyiség, az hízáshoz vezet, fordított esetben testsúlycsökkenés jön létre (1. ábra). Az energiaháztartás, és ezáltal az állat testsúlya is egy meghatározott intervallumon belül mozog, így dinamikus egyensúly alakul ki.
1. ábra: Az energia egyensúly kialakulása. Ha a bevitt energia mennyisége (táplálék) megegyezik, a felhasználttal (alapanyagcsere, hőtermelés, fizikai aktivitás), akkor az egyed testsúlya nem változik. Amennyiben a bevitel kerül túlsúlyba, akkor hízás, fordított esetben a testsúly csökkenés figyelhető meg.
bevitel leadás
ENERGIA EGYENSÚLY
alapanyagcsere hőtermelés fizikai aktivitás
hízás fogyás
táplálkozás
8
2.2. Az energiafelvétel (táplálkozás) központi idegrendszeri szabályozása
A táplálékfelvétel komplex mechanizmus, melyhez hozzátartozik az éhségérzet kialakulása, a táplálékkeresési viselkedés, valamint a táplálkozás elkezdése és befejezése. Mindezeket össze kell hangolni a napi, illetve a szezonális ritmussal, és – különösen embereknél – szociális, és tanult elemekkel (Guyenet és Schwartz 2012).
Mindezen feladatokat a központi idegrendszer látja el, melyen belül a hypothalamus szerepe kulcsfontosságú. A külső (pl. látás, szaglás, ítérzés) és a belső környezeti információk (pl. energiaraktárak feltöltöttségi szintje, gyomor telítettségi állapota, pszichés állapot) idegi és humorális útvonalakon is eljutnak a hypothalamusba (Palkovits 2003), ahol megtörténik az integráció és ez alapján adekvát válasz szerveződik (Guyenet és Schwartz 2012, Rui 2013). A hypothalamus közvetlen kimenetei az endokrin és az autonóm idegrendszer, de efferensei révén a felsőbbrendű agyi központokkal (pl. limbikus rendszer) is reciprok kapcsolatban áll (Palkovits 2003).
Fontos komponens, hogy a táplálék, mint örömforrás, jutalom is szerepet játszik, ami a táplálékfelvétel mennyiségét és minőségét is befolyásolhatja. A kortiko-limbikus jutalom rendszer szoros kapcsolatban áll a lateralis hypothalamusszal, de a nyúltvelőben található nucleus tractus solitarii-val (NTS) is (Palkovits 2003, Rui 2013). A jutalom pályában a korábban ismert közvetítőkön (pl. dopamin, opioidok, serotonin) kívül az endocannabinoid rendszer szerepe is bebizonyosodott (Simpson és mtsai 2009).
Az éhségi-jóllakottsági szint rövid távon, a szervezet energiaraktárainak állapota pedig hosszú távon határozza meg a táplálékfelvételt. A hypothalamicus idegi afferensek elsősorban a táplálékfelvétel rövid távú szabályozásában, a jóllakottság közvetítésében fontosak (Guyenet és Schwartz 2012, Renner és mtsai 2012). Az emésztőrendszer felől, főleg a gyomor mechanoreceptoraiból, a bolygóidegen át érkező ingerület az NTS-en keresztül éri el a hypothalamust (Rinaman 2010). A pályában többek közt a kolecisztokinin (CCK) és a glukagon-szerű peptid-1 (GLP-1) közvetíti az információt (Guyenet és Schwartz 2012, Palkovits 2003, Renner és mtsai 2012) (2. A ábra).
A humorális bemenet „kapui” a circumventricularis szervek, melyek kívül esnek a vér-agy gáton (Fry és mtsai 2007, Meister és Hakansson 2001, Palkovits 1984). A hypothalamus „kapuját” az arcuatus mag (ARC) jelenti, de humorális szignálok hatnak
9
a nyúltvelőben az area postremán (AP) keresztül az NTS sejtjeire is, (Palkovits 2003, Schwartz 2010). A humorális szignálok mind a rövid távú, mind a hosszú távú szabályzásban részt vesznek. Kiemelkedő jelentőségű ezek közül a zsírszövet által termelt leptin, a gyomorban felszabaduló ghrelin, mely az egyetlen ismert táplálékfelvételt serkentő, periférián termelődő hormon, valamint a glükóz és az inzulin, (Arora és Anubhuti 2006, Guyenet és Schwartz 2012, Maffei és mtsai 1995) (2. A ábra).
A hypothalamuson belül az információközvetítés fontos eszközei az idegsejtek által termelt orexigén (táplálékfelvételt serkentő) és anorexigén (táplálékfelvételt gátló) neuropeptidek (Palkovits 2003). Az ARC magban két sejtcsoport található, egy
2. ábra: A táplálékfelvétel központi szabályzása. A: A hypothalamus afferens és efferens szignál útvonalai. Rózsaszín: humorális útvonalak, melyek elérik az arcuatus magot, illetve a nucleus tractus solitarii-t (az area postremán keresztül). Fekete: a gyomorból a nucleus tractus solitarii-ba felszálló idegi pályák (főleg nervus vagus), melyek tovább a hypothalamusba, és a kortikolimbikus rendszerhez futnak.
Sárga: a hypothalamus autonóm efferens pályája, mely a szimpatikus preganglionaris neuronokhoz projiciál. Zöld: a gyomorba és a hasnyálmirigybe futó n. vagus rostok. Kék: a gyomor-gerincvelő szimpatikus reflex ív. Narancs: a gastrointestinalis rendszerhez futó, az intermediolateralis sejtoszlop szimpatikus preganglionaris sejtjeiből kiinduló rostok. B: A táplálékfelvételt szabályzó hypothalamicus magok elhelyezkedése, arcuatus maggal való kapcsolata és a legfontosabb általuk termelt orexigén (piros) és anorexigén (kék) peptidek.
Rövidítések: Acc: accumbens mag, AgPR: agouti-related peptid, ARC: arcuatus mag, AP: area postrema, CART: kokain- és amfetamin regulált transzkript fehérje, CCK: kolecisztokinin, CRH:
kortikotropin-releasing hormon, DLHA: dorsolateralis hypothalamicus area, DMH: dorsomedialis mag, DMX: a nervus vagus általános visceromotoros magja GLP-1: glukagon-szerű peptid-1, IML:
intermediolateralis sejtoszlop, MCH: melanin-koncentráló hormon, NPY: neuropeptid Y, NTS: nucleus tractus solitarii, POMC: proopiomelanocortin, PrRP: prolaktin-rilízing peptid, PVN: hypothalamicus paraventricularis mag, TRH: tireotropin-releasing hormon, VMH: ventromedialis mag. A: (Palkovits 2003), B: (Arora és Anubhuti 2006).
A B
10
neuropeptid Y-t (NPY) és agouti-related fehérjét (AgRP) koexpresszáló orexigén sejtcsoport, és egy proopiomelanocortint (POMC) és kokain- és amfetamin-regulált transzkript fehérjét (CART) koexpresszáló anorexigén sejtcsoport (Arora és Anubhuti 2006) (2. B ábra). Az ARC több, a táplálékfelvétel szabályzásban résztvevő hypothalamicus maggal áll összeköttetésben, így informálja a paraventricularis (PVN), a dorso- (DMH) és ventromedialis (VMH) magokat, valamint a dorsolateralis hypothalamicus areat (DLHA) (Simpson és mtsai 2009). Ezekben a magokban számos egyéb anorexigén (kortikotropin-releasing hormon (CRH) és tireotropin-releasing hormon (TRH) a PVN-ben, CART a DLHA-ban, prolaktin-rilízing peptid (PrRP) a DMH magban) és orexigén (orexin A és B, valamint melanin-koncentráló hormon (MCH) a DLHA-ban) peptid termelődik (Arora és Anubhuti 2006, Gotoh és mtsai 2013, Lawrence és mtsai 2002). Az intrahypothalamicus összeköttetések száma igen magas, az orexigén és anorexigén sejtcsoportok egymás aktivitását is befolyásolhatják (Palkovits 2003, Simpson és mtsai 2009) (2. B ábra). A PVN központi helyet foglal el az integrációban, mivel összeköttetései révén kapcsolatot teremt a rövid- és hosszú távú szabályozó körök között (2. A,B ábra), (Arora és Anubhuti 2006, Rui 2013), és kiinduló pontja a hypothalamus-hypophysis-mellékvese (HPA, 7. A ábra) és hypothalamus-hypophysis-pajzsmirigy tengelynek (Arora és Anubhuti 2006), valamint autonóm efferensei is jelentősek (Tóth és mtsai 1999).
2.3. Az energia leadás módjai és azok szabályzása
A hosszú távú energiaegyensúlyt nemcsak a kalória bevitel, hanem az energia leadás is befolyásolja. A szervezet energiát használ önmaga fenntartásához (alapanyagcsere, metabolikus ráta), a mozgáshoz, valamint madarakban és emlősökben a testhőmérséklet fenntartásához.
2.3.1. Az alapanyagcsere és szabályozása
Az életfunkciók (légzés, szívverés, izzadás, emésztés, stb.) fenntartásához a szervezet energiát használ, ezt az energia mennyiséget jelöli az alapanyagcsere. Mivel az alapanyagcsere teszi ki a napi energiafelhasználás legnagyobb részét, nagyban befolyásolja az energiaháztartás egyensúlyát (Sabounchi és mtsai 2013). Értékét a testsúly, a nem és az életkor is befolyásolja (Patil és Bharadwaj 2013).
11
Az alapanyagcsere szintje egyenes arányban áll a pajzsmirigy hormonok vérben keringő mennyiségével. Ezek a hormonok neuroendokrin szabályzás alatt állnak, mely szabályozókör a már említett hypothalamo-hypophysis-pajzsmirigy tengely. A kör kiindulási pontja a hypothalamuson belül a PVN TRH termelő sejtjei. Ezen sejtek axonjaiból felszabaduló TRH a portális keringésen keresztül fokozza az agyalapi mirigy elülső lebenyének tireoidea-stimuláló hormon (TSH) termelését. A szisztémás keringésen keresztül a TSH serkenti a pajzsmirigy tiroxin (T4) és trijód-tironin (T3) expresszióját és leadását (Nillni 2010). A TSH negatív visszacsatolás révén csökkenti a TRH, a pajzsmirigyhormonok pedig a TRH és a TSH termelődést. A pajzsmirigy hormonok megemelik a sejtek oxigén felvételét, gyorsítják a metabolizmusukat, és ezáltal fokozzák a szervezet hőtermelést is. Hideg hatására a pajzsmirigy a PVN-t elérő nyúltvelői katekolaminerg rendszeren (A1, A2 sejtcsoport) keresztül (2. A ábra) aktiválódik, ami segíti a hideghez való alkalmazkodást (Nillni 2010, Pacak és Palkovits 2001, Silva 2006). Ugyanakkor éhezés alatt a pajzsmirigy hormonok szintje csökken, az alapanyagcsere is redukálódik, ezzel rábírva a szervezetet az energiaraktárak takarékos kihasználására (Nillni 2010). A hízással ellentétes folyamat - a pajzsmirigy serkentése - indul be. A szignálok ilyenkor nagymértékben a humorális útvonalon, az ARC magon keresztül jutnak a PVN-be (2. A,B ábra) (Nillni 2010). Így nem meglepő, hogy a pajzsmirigy működésének zavaraival általában együtt jár az energiaháztartás és a testsúly változása is.
2.3.2. A hőszabályozás idegi mechanizmusai
Ha az állat hideg környezetbe kerül, hogy megtartsa a testhőmérsékletét, hőt termel, melegben pedig növeli a hőleadást. A hőszabályozás fő központjának a hypothalamus preopticus areáját (POA) tekintjük (Nagashima és mtsai 2000). Ezen az agyterületen találhatunk meleg, illetve hideg szignálokra érzékeny termoszenzitív neuronokat. Az előbbiek hatására a POA-ból kiinduló efferens pályáknak köszönhetően kitágulnak a bőr erei, megindul a nyál- és verejtéktermelés, melyek a párolgásnak köszönhetően elősegítik a szervezet hűtését (Morrison és Nakamura 2011), (Nagashima és mtsai 2000). Az utóbbiak hatására a szervezet megpróbál hőt termelni, illetve a hőleadását csökkenteni. Mivel kísérleteink során a testhőmérséklet emelésében résztvevő mechanizmusokat vizsgáltuk, így csak ezeket fogom részletezni dolgozatomban.
12
Hőtermelés történhet izom munkával, az állat helyváltoztató aktivitásával, vagy didergés (shivering) útján.
A másik lehetőség az úgynevezett „reszketésmentes” (non-shivering) hőtermelés (Nagashima és mtsai 2000). Ennek központja a barna zsírszövet (BAT), ami morfológiailag abban különbözik a fehértől zsírszövettől, hogy kis méretű lipid cseppekkel van kitöltve, és sok mitokondriumot tartalmaz (Morrison 2004), melyek a színét is adják. A mitokondriumok a sejt energiatermelő egységei. A tápanyaglebontásból keletkező szerves anyagok a sejtekben a biológiai oxidáció, másnéven sejtlégzés során szén-dioxidra és vízre bomlanak, a közben felszabaduló energia pedig ATP formájában raktározódik. Az ATP a sejtlégzés utolsó fázisában a terminális oxidációnak nevezett folyamat során a mitokondriumokban keletkezik. A BAT különlegessége, hogy itt a mitokondriumok egy speciális fehérjét tartalmaznak, az uncoupling protein-1 enzimet (UCP1), mely szét tudja kapcsolni az energiatermelést az ATP szintézistől, így az energia hő formájában felszabadul (Gianotti és mtsai 1998, Virtue és Vidal-Puig 2013). A BAT ereiben aktivált állapotában fellépő fokozott véráramlásnak köszönhetően az itt keletkező hő eloszlik a szervezetben (Cannon és Nedergaard 2004). Sokáig úgy gondolták, hogy a BAT-nek csak kisebb testű emlősökben (patkány, egér), illetve csecsemőkben van jelentősége (Cannon és Nedergaard 2004), de újabban kiderült, hogy jelentős aktív BAT mennyiség található felnőttben is a nyaki és a kulcscsont körüli régióban (Cannon és Nedergaard 2012, Richard és mtsai 2012).
A hőmérsékleti viszonyokon kívül más faktorok is befolyásolhatják a BAT hőtermelő aktivitását, ezáltal is befolyásolva az energia egyensúlyt. Ilyen például az öregedés, a szoptatás, az éhezés, vagy az elhízás (Rodriguez-Cuenca és mtsai 2007).
Mint már láttuk, a hypothalamus-hypophysis-pajzsmirigy útvonal fontos láncszeme az alapanyagcsere szabályzásának, és ismert, hogy a pajzsmirigyhormonok modulálni képesek a BAT hőtermelését is (Nillni 2010, Silva 2006). Ezenkívül több orexigén és anorexigén peptid is módosító tényezőként hat a hőtermelésre (Szekely és mtsai 2004).
Nagy általánosságban elmondható, hogy az anorexigén peptidek (pl.: CRH, TRH, oxitocin) fokozzák, míg az orexigének (pl.: NPY, orexin A) gátolják a termogenezist (Balasko és mtsai 1999, Chaves és mtsai 2013, Lechan és Fekete 2006, Solinas és mtsai 2006, Szekely és mtsai 2004). A fenti szabály alól kivételt képez az MCH, mely annak
13
ellenére, hogy orexigén hatású, emeli a testhőmérsékletet (Pereira-Da-Silva és mtsai 2003).
3. ábra: A hideg környezetben aktiválódó autonóm termoregulációs pályák. A bőrben lévő hidegérzékeny receptorok által közvetített információ a gerincvelő hátsó szarvában, majd a lateralis parabrachialis magban átkapcsolódva jut a preopticus area neuronjaihoz. Alapesetben ezek tónusos gátlás alatt tartják a dorsomedialis magban és a rostralis raphe pallidusban lévő célsejtjeiket. A hideg hatására a preopticus area sejtjei gátlódnak, a diszinhibíció révén pedig aktiválódnak a dorsomedialis mag és a rostralis raphe pallidus sejtjei. A rostralis raphe pallidus szimpatikus premotoros neuronokat tartalmaz, melyek az intermediolateralis sejtoszlopon keresztül a bőrfelszínhez közel futó erek összehúzódását váltják ki. A rostralis raphe pallidus egy másik neuronpopulációja hat a barna zsírszövetre, ezen sejtek axonjai szintén az intermediolateralis sejtoszlopon kapcsolnak át, de ezek az információt a dorsomedialis magon keresztül kapják, nem pedig közvetlenül a preopticus areából. Ugyanezen az útvonalon jut el az ingerület azokhoz a sejtekhez, melyek a medulla medialis premotoros neuronjaihoz projiciálnak, majd az elülső szarv alfa és gamma motoneuronjait hozzák ingerületbe, kiváltva ezzel a didergést.
LPB: lateralis parabrachialis mag, POA: preopticus area, DMH: dorsomedialis mag, IML:
intermediolateralis sejtoszlop, rRPa: rostralis raphe pallidus, BAT: barna zsírszövet. Az ábra (Morrison és Nakamura 2011) alapján.
14
A testhőmérséklet megtartásának másik módja a hőveszteség csökkentése. Ezt egyfelől a bunda borzolása révén (embernél a „libabőr”), annak megnövekedett hőszigetelő képességének köszönhetően történhet, vagy a bőrfelülethez közel futó erek összehúzódása által, ami főleg a végtagok és a vékony bőrrel fedett, szőrtelen testrészek esetében érvényesül (Nagashima és mtsai 2000). Mind a BAT, mind pedig az erek szimpatikus beidegzés alatt állnak (Morrison és Nakamura 2011).
A bőrben lévő hidegérzékeny receptorok által közvetített információ a gerincvelő hátsó szarvában, majd a lateralis parabrachialis magban átkapcsolódva jut a POA GABAerg interneuronjaihoz (3. ábra). Alapesetben ezek tónusos gátlás alatt tartják a DMH-ban és a rostralis raphe pallidusban (rRPa) lévő célsejtjeiket. A hideg hatására a POA GABAerg sejtjei gátlódnak, így a diszinhibíció révén aktiválódnak a DMH és a rRPa sejtjei. A rRPa szimpatikus premotoros neuronokat tartalmaz, melyek az intermediolateralis sejtoszlopon (IML) keresztül a bőrfelszínhez közel futó erek összehúzódását váltják ki, csökkentve a bőr keringését és ezáltal a hőleadást (Baffi és Palkovits 2000, Bratincsák és Palkovits 2004, Morrison és Nakamura 2011) (3. ábra). A rRPa egy másik neuronpopulációja hat a BAT-re, ezen sejtek axonjai is az IML-on kapcsolnak át, de ezek az információt a DMH-on át kapják, nem pedig közvetlenül a POA-ból, mint az erek összehúzódását stimuláló sejtcsoport esetében (Nagashima és mtsai 2000). Ugyanezen az útvonalon jut el az ingerület azokhoz a sejtekhez, melyek a medulla medialis premotoros neuronjaihoz projiciálnak, majd az elülső szarv alfa és gamma motoneuronjait hozzák ingerületbe, kiváltva ezzel az izmok ritmikus összehúzódását, vagyis a didergést (Morrison és Nakamura 2011), (3. ábra).
2.4. Az energiaegyensúlyt módosító hatások
Az optimális testtömeg egyénenként változik, vagyis genetikai tényezők is meghatározzák, de, például a pubertás időszaka, a terhesség, a méhen belüli környezet, az öregedés, vagy a stressz mind-mind megváltoztathatják az egyensúlyi állapotot, mely ezután egy újabb értékre állhat be.
A reprodukció energiaigényes folyamat, így a nemi funkciók függnek a szervezet energia raktárainak állapotától. Túlsúlyos egyedeknél a pubertás időszaka korábban következik be (Sanchez-Garrido és Tena-Sempere 2013). A leptin módosító szerepét is leírták a reproduktív neuroendokrin szabályzó körben (Elias és Purohit 2013). Ennél
15
talán még nagyobb hatással van a szervezetre a terhesség időszaka. Ekkor még a vérben keringő magas leptin szint ellenére is a pozitív energia mérleg a jellemző, ami részben magyarázható az ilyenkor kialakuló leptin rezisztenciával (Page-Wilson és mtsai 2013).
Ismert, hogy a magzat fejlődését befolyásolják az anya szervezetét érő hatások. Az utóbbi időben egyre több bizonyíték van arra, hogy az anyaméhben elszenvedett alul- vagy túltápláltság a magzat egész életére kihat, és hajlamossá teheti az elhízás, a kardiovaszkuláris betegségek és a 2-es típusú diabétesz kialakulására (Begum és mtsai 2013, Kruse és mtsai 2013, Yarde és mtsai 2013). Az idősebb embereknél is megfigyelhető súlygyarapodás, az alapanyagcsere lelassulása mellett, újabban feltételezik, hogy ebben közrejátszhat a jutalom pálya csökkent aktivitása (Green és mtsai 2011). Stressz helyzetekben is megváltozhat az energiaegyensúly, akár a hízás akár a fogyás irányába (Nieuwenhuizen és Rutters 2008). Szociális stressznek kitett egerekben fokozott ghrelin termelődést, ennek megfelelően megnövekedett táplálékbevitelt mutattak ki, ezzel együtt a hypothalamusban emelkedett az orexigén hatású NPY és AgRP szintje (Patterson és mtsai 2013). Ugyanakkor a hiperaktív stressz válasz állhat az anorexia nervosa hátterében is (Oskis és mtsai 2012).
2.5. A táplálékfelvétel szabályzás egy újabban megismert faktora; a nesfatin-1
Amint láttuk, az energiaháztartás szabályzásának nagyon sok aspektusa van, bonyolult rendszer felügyeli, és sok külső és belső tényező befolyásolja. Az utóbbi időben egyre nagyobb problémákat okoznak a táplálkozási zavarok okozta kórképek (Smink és mtsai 2013). Társadalmi szempontból is fontos tehát, hogy minél pontosabban megismerjük az energiaegyensúly szabályzásának hátterében álló mechanizmusokat. E kifinomult rendszer csupán néhány éve felfedezett tagja állt vizsgálataink középpontjában. Ez a fehérje az anorexigén hatású nesfatin-1.
2.5.1. A nesfatin-1 felépítése, előfordulása a szervezetben
A nesfatin-1 molekulát először a hypothalamusban írták le 2006-ban, mint egy nagyobb prekurzor fehérje, a nucleobindin-2 (NUCB2), N terminális végén található, 82 aminosavból felépülő, szekretálódó peptidjét (Oh és mtsai 2006). A preprofehérjéből további két másik is hasítódik, a nesfatin-2 és a nesfatin-3, melyeknek DNS kötő
16
szekvenciáik vannak, de pontos funkciójuk még nem ismert (4. ábra). Konzervatív fehérje, a patkány és az emberi protein között mindössze 11 aminosav eltérés van, ez 87,4%-os homológiát jelent (Oh és mtsai 2006).
A nesfatin-1/NUCB21 a központi idegrendszerben szélesen elterjedt.
Immunhisztokémiával (IHC) kimutatták többek között az accumbens magban (Acc), a piriform- és az insularis kéregben, a lateralis septumban és az amygdala magban, a hypothalamus területén a medialis preopticus areaban, az ARC magban, a PVN parvo- és magnocellularis részében is, a supraopticus magban (SON) és a DLHA-ban.
Megtalálható a középagyi és medullaris raphe magokban, a NTS területén, az A1/C1 katekolamin sejtcsoportban, ugyanakkor kimutatták a kisagyi Purkinje sejtekben, és a gerincvelő intermediolateralis sejtoszlopában is (Goebel és mtsai 2009a). A nesfatin-1/NUCB2-t expresszáló sejtek térképezését elvégezték in situ hibridizációs (ISH) módszerrel is, mely nagymértékben egyezett az IHC eredményekkel (Foo és mtsai 2008).
1 Az immunhisztokémiai festések esetében az antitestek, illetve az in situ hibridizációs próbák jelölik a teljes prekurzorfehérjét, illetve NUCB2 mRNS-t, ezen belül a nesfatin-1-et is, így ezen technikák alkalmazásakor a nesfatin-1/NUCB2 jelölést használom.
4. ábra: A nucleobindin-2 fehérje aminosav sorrendje és fragmentjei. Sárga a szignál fehérje, kék a nesfatin-1, piros a nesfatin-2, zöld a nesfatin-3 szekvenciája.
l MRWRTILLQY CFLLITCLLT ALEAVPIDID KTKVQNIHPV 41 ESAKIEPPDT GLYYDEYLKQ VIDVLETDKH FREKLQKADI 81 EEIKSGRLSK ELDLVSHHVR TKLDELKRQE VGRLRMLIKA 121 KLDSLQDIGM DHQALLKQFD HLNHLNPDKF ESTDLDMLIK 161 AATSDLEHYD KTRHEEFKKY EMMKEHERRE YLKTLNEEKR 201 KEEESKFEEM KKKHENHPKV NHPGSKDQLK EVWEETDGLD 241 PNDFDPKTFF KLHDVNSDGF LDEQELEALF TKELEKVYDP 281 KNEEDDMVEM EEERLRMREH VMNEVDTNKD RLVTLEEFLK 321 ATEKKEFLEP DSWETLDQQQ FFTEEELKEY ENIIALQENE 361 LKKKADELQK QKEELQRQHD QLEAQKLEYH QVIQQMEQKK 401 LQQGIPPSGP AGELKFEPHI
17
A központi idegrendszeren kívül nesfatin-1/NUCB2 expresszáló sejtek a periférián szintén előfordulnak. Termelődik a herékben, az emésztőrendszer egyes szakaszaiban és a hasnyálmirigy inzulintermelő sejtjeiben, a szívben, illetve a zsírszövetben (Angelone és mtsai 2013, Garcia-Galiano és mtsai 2012, Gonkowski és mtsai 2012, Gonzalez és mtsai 2009, Osaki és mtsai 2012, Zhang és mtsai 2010).
2.5.2. A nesfatin-1 hatása a táplálékfelvételre
Az első vizsgálatok a nesfatin-1 táplálékfelvételt csökkentő hatását mutatták ki.
Egyszeri, az aktív periódus elején történő intracerebroventricularis (icv) beadását követően a vizsgált patkányok 6 órán át kevesebbet ettek, mint a kontroll állatok.
Testsúlycsökkenést csak hosszú távú adagolása okoz, a nevét adó mozaikszó is eme tulajdonságára utal (NEFA/nucleobindin2-encoded satiety- and fat-influencing protein) (Oh és mtsai 2006). Igen érdekes, hogy egyedülálló módon, a nesfatin-1 anorexigén hatását leptin független úton fejti ki (Oh és mtsai 2006). A legtöbb hypothalamicus, a táplálékfelvételt szabályzó fehérje expresszióját ugyanis a vérben keringő leptin mennyisége befolyásolja, mely a raktározott zsír mennyiségével egyenesen arányos (Hamann és Matthaei 1996, Maffei és mtsai 1995), és az anorexigén fehérjék termelését aktiválja, míg az orexigén faktorokét gátolja (Jequier 2002). Kóros elhízás esetében viszont leptin rezisztencia alakulhat ki, ekkor a szervezet már nem képes megfelelően szabályozni az energiaháztartást, ami még súlyosabb elhízáshoz vezet (De Lartigue és mtsai 2012, Guerre-Millo 1997).
Mivel a nesfatin-1 leptin receptor mutáns Zucker patkányok táplélékfelvételét is csökkentette (Oh és mtsai 2006), ez a peptid az elhízás elleni küzdelem kiemelt farmakológiai célpontjává vált. Farmakológiai szempontból ugyancsak előnyös, hogy a nesfatin-1 képes átjutni a vér-agy gáton, kimutatható a cerebrospinális folyadékban, illetve a vérplazmában is (Chaolu és mtsai 2011, Ogiso és mtsai 2011, Pan és mtsai 2007, Price és mtsai 2007, Tan és mtsai 2011). Ebből kifolyólag, intraperitonealisan vagy intranasalisan adagolva is alkalmazható és így is csökkenti a táplálékfelvételt (Shimizu és mtsai 2009a, Shimizu és mtsai 2009b). Megemlítendő, hogy a NUCB2 molekula másik két fragmentje a táplálékfelvételt nem befolyásolja (Oh és mtsai 2006).
18
2.5.3. A nesfatin-1 egyéb, eddig megismert funkciói
Azokon a területeken, ahol a nesfatin-1/NUCB2 expresszálódik, számos más neuropeptid is kimutatható, amelyekkel kolokalizál is (Brailoiu és mtsai 2007, Foo és mtsai 2008, Kohno és mtsai 2008). A hypothalamuson belül a PVN területén TRH-val, CRH-val, oxitocinnal és vazopresszinnel, az ARC magban CART-tal és POMC-nal (Foo és mtsai 2008) a DLHA-ban MCH-val mutatták ki kolokalizációját (Fort és mtsai 2008). Az agytörzsben az Edingher-Westfal magban urocortin 3-mal, a raphe pallidusban szerotoninnal, az NTS és a locus coeruleus területén lévő katekolamin sejtcsoportokban tirozin-hidroxilázzal (TH, a katekolamin szintézis sebességének a meghatározó enzimje) kolokalizál (Xu és mtsai 2009, Yoshida és mtsai) (5. és 6. ábra).
5 ábra: A nesfatin-1/NUCB2 kolokalizációja egyéb neurotranszmitterekkel a munka szempontjából kiemelten fontos hypothalamicus területeken. Kettős fluoreszcens immunfestések. Zöld: nesfatin-1/NUCB2 (A,D,G), piros: a kolokalizálandó neurotranszmitterek (C,F,J), sárga: a megfelelő egymásra vetített képek a kettős jelölt sejtekről (B,E,H). A nesfatin-1/NUCB2 koexpresszálódik: A,B,C: tireotropin-releasing hormonnal (TRH), és D,E,F:
kortikotropin-releasing hormonnal (CRH) a hypothalamicus paraventricularis magban, G,H,I: melanin-koncentráló hormonnal (MCH) a dorsolateralis hypothalamus területén. Mérték: A-I: 100µm. (Foo és mtsai 2008)
19
Széleskörű elterjedése és kolokalizációs mintázata alapján arra következtethetünk, hogy ez a peptid többféle élettani folyamatban vehet részt. Valóban, a táplálékfelvételt csökkentő hatáson kívül leírták, hogy befolyásolja a vízfogyasztást, bár az irodalmi adatok e tekintetben ellentmondásosak (Moreau és Ciriello 2013, Yosten és mtsai 2012, Yosten és Samson 2010). García-Galiano és munkatársai azt találták, hogy nesfatin-1 kezelést követően megnövekedett a gonadotropinok mennyisége a pubertáló nőstény patkányok vérében (Garcia-Galiano és mtsai 2010). Ezt a hatást sertéseknél is megfigyelték (Lents és mtsai 2013). Sőt, a prepubertás időszakában lévő nőstény patkányoknál antiszensz-nesfatin-1/NUCB2 oligonukleotid kezelést követően kitolódott a nemi érés időpontja (Garcia-Galiano és mtsai 2010). Két napos éheztetést követően a nesfatin-1 kezelés jelentősen megemelte a luteinizáló hormon szintjét a fiatal nőstényeknél az ad libitum etetettekhez képest (Garcia-Galiano és mtsai 2010), ami bizonyítéka lehet a reprodukció és a szervezet energiaraktárai közötti szabályzó kapocsnak (Garcia-Galiano és Tena-Sempere 2013).
6 ábra: A nesfatin-1/NUCB2 kolokalizációja egyéb neurotranszmitterekkel a munka szempontjából kiemelten fontos agytörzsi területeken. Kettős fluoreszcens immunfestések. Zöld: nesfatin-1/NUCB2 (A,D), piros: a kolokalizálandó neurotranszmitterek (C,F), sárga: a megfelelő egymásra vetített képek a kettős jelölt sejtekről (B,E). A nesfatin-1/NUCB2 koexpresszálódik: A,B,C: szerotoninnal a raphe pallidusban, D,E,F tirozin-hidroxilázzal (TH) a nucleus tractus solitarii területén. Mérték:
A-C: 10µm, D-F: 30µm. A-C: (Brailoiu és mtsai 2007), D-F: (Yoshida és mtsai 2010).
20
Ezenkívül, a nesfatin-1 szorongással és félelemmel összefüggő viselkedésformák megjelenését fokozza. A kezelt állatok kevesebb időt töltöttek az emelt keresztpalló tesztnél a nyitott karban, ezen felül szignifikánsan kevesebb csemegét ettek új környezetben a kezeletlen állatokhoz képest (Merali és mtsai 2008). Humán vizsgálatok kimutatták, hogy megváltozott a vérben keringő nesfatin-1 szintje az epilepsziás betegeknél (Aydin és mtsai 2011, Aydin és mtsai 2009), akárcsak egyes depressziós és szorongásos kórképek esetében is (Ari és mtsai 2011, Gunay és mtsai 2012).
2.5.4. A nesfatin-1 hatásmechanizmusa
Mind kutatási, mind gyógyszertani szempontból égető kérdés, mi lehet a nesfatin-1 hatásmechanizmusa. Táplálékfelvételt csökkentő hatását a POMC (Maejima és mtsai 2009, Oh és mtsai 2006), a CRH (Stengel és mtsai 2009) és az oxitocin (Yosten és Samson 2010) közvetítésével is kifejtheti, vagyis többféle rendszerrel is kölcsönhatásba lép. Ezen felül az ARC mag orexigén NPY tartalmú sejtjeinek aktivitását is blokkolja (Price és mtsai 2008b). Különlegessége, hogy az idegsejtekre feltételezhetően parakrin, illetve autokrin módon hat, nem pedig szinaptikus jelátvitel segítségével, mivel nem transzportálódik az axonokba, viszont megtalálható a dendritekben (Maejima és mtsai 2009).
Sajnálatos módon receptorát még nem sikerült azonosítani. Hypothalamicus sejtkultúrákon végzett kísérletek során kiderült, hogy a nesfatin-1 megemeli az intracellularis Ca2+ mennyiségét. Ez a válaszreakció blokkolható volt pertusszisz toxin előkezeléssel, ami arra utal, hogy a nesfatin-1 egy Gi/o proteinhez kapcsolt, hét transzmembrán doménnel rendelkező receptorral rendelkezik (Brailoiu és mtsai 2007).
Egy másik kutatócsoport a fenti megfigyeléstől némileg eltérő eredményt kapott, de ez adódhat abból, hogy ők neuroblastoma sejteken kísérleteztek (Ishida és mtsai 2012).
2.5.5. A hipotézis kifejtése
Mint a fentiekből kitűnik, a nesfatin-1 egy nagyon izgalmas, és gyógyszertani szempontból is érdekes neuropeptid, működésével kapcsolatban azonban még számos tisztázatlan kérdés fogalmazódik meg. Elsőként két felmerülő hipotézist vizsgáltunk.
I.) Amint már említettem, a táplálkozást befolyásoló neuropeptidek gyakran az energia leadásra is hatnak. Ezek közül a nesfatin-1/NUCB2 többel is kolokalizál (Brailoiu és mtsai 2007, Foo és mtsai 2008, Fort és mtsai 2008, Kohno és mtsai 2008),
21
továbbá nesfatin-1/NUCB2 immunreaktív sejtek találhatók a rRPa és a POA területén (Brailoiu és mtsai 2007, Goebel és mtsai 2009a), a termoregulációs pálya átkapcsoló állomásain. Mindezek alapján feltételeztük, hogy a nesfatin-1 az energia leadást is befolyásolhatja.
II.) Az energiaháztartás egyensúlyi pontjának értékét, vagyis a testsúlyt a korábbiak szerint különböző hatások tudják módosítani, például a stressz (Nieuwenhuizen és Rutters 2008). Stressz hatására kétféle válaszreakció indul meg a szervezetben: egyrészt a HPA tengely, másrészt a szimpatikus idegrendszer aktiválódik (7. A ábra). Az előbbi aktiválódása egy lassabb (néhány óra), míg az utóbbi egy gyorsabb (néhány másodperc) választ eredményez.
A két útvonal integráló központja a hypothalamusban a PVN, amely egy igen összetett mag (Pacak és Palkovits 2001). A magnocellularis szubdivízió sejtjei a
7. ábra: A: A stressz által kiváltott válaszreakciók. B: A paraventrikularis mag neuroendokrin szubdivízióinak feltérképezése a vérbe juttatott jelölőanyag segítségével. C: A paraventrikularis mag szimpatikus efferensekkel rendelkező szubdivízióinak feltérképezése a gerincvelőbe beadott jelölőanyag segítségével.
ACTH: adrenokortikotrop hormon, CRH: kortikotropin-releasing hormon, PVN: hypothalamicus paraventricularis mag. A PVN B,C képeken a koronális síkban megjelenő szubdivíziói: dp: dorsalis parvocellularis, mpdd: medialis parvocellularis szubdivízió dorsalis része mpdv: medialis parvocellularis szubdivízió ventralis része, mpv: pre-automonóm régió, pm: posterior magnocellularis, pv:
periventricularis parvocellularis szubdivízió, 3V: harmadik agykamra. Mérték: B-C: 100µm. B és C (Viau és Sawchenko 2002) nyomán.
22
hypothalamo-neurohypophysealis rendszerhez tartoznak, ezek a sejtek termelik az oxitocint, illetve a vazopresszint. A parvocellularis szubdivízió almagjai képezik részben a hypophyseotrop areat, az itt található sejtek a portalis keringésen keresztül az adenohypophysis hormontermelésére hatnak (7. A,B ábra). A parvocellularis rész két kisebb almagja autonóm projiciáló neuronokat tartalmaz, melyek efferensei a szimpatikus idegrendszert aktiválják (Viau és Sawchenko 2002) (7. C ábra).
A stressz információk nagy többsége a nyúltvelő A1 (sejtjei a ventrolateralis medulla-VLM-területén) és A2-es (a sejtek elszórva találhatóak a NTS és a nervus vagus általános visceromotoros motoros magjának - DMX - területén) katekolamin sejtcsoportjain keresztül jut a PVN-be (Pacak és Palkovits 2001). A HPA tengely stimulációja során a parvocellularis eredetű CRH az agyalapi mirigy elülső lebenyében az adenokortikotop hormon (ACTH) termelését serkenti, mely a szisztémás vérbe jutva a mellékvese kéregben a glükokortikoidok (emberben főleg kortizol, patkányban elsősorban kortikoszteron) felszabadulását fokozza. A kortizol legfőbb feladata a szervezet fiziológiás adaptációja a stresszhelyzethez. Mobilizálja a szervezet energiaraktárait és csökkenti az immunrendszer aktivitását. A kortizol és az ACTH negatív visszacsatolással hat a PVN CRH neuronjaira, illetve a kortizol az agyalapi mirigy ACTH termelő sejtjeire is, így bezárva a szabályzó kört biztosítja a válaszreakció lecsengését (Pacak és Palkovits 2001). A neurális válasz esetében a szimpatikus idegrendszer mozgósítása révén a mellékvese velő állományában adrenalin és noradrenalin képződik. A bekövetkező gyors válaszok révén a szervezet felkészül a stresszt okozó vészhelyzet elhárítására (fight or flight reakció, (Patterson és Abizaid 2013), 7. A ábra).
Tudjuk, hogy a nesfatin-1/NUCB2 koexpresszálódik CRH-val a parvocellularis PVN neuronokban, továbbá TH-zal a nyúltvelői A2 sejtcsoportban (Brailoiu és mtsai 2007, Foo és mtsai 2008, Kohno és mtsai 2008). Ezen felül az irodalomban leírták, hogy 30 perces restraint stressz (fájdalommentes mozgáskorlátozás) hatására a nesfatin-1/NUCB2 tartalmú neuronok aktiválódtak (Fos megjelenése a sejtmagban) a SON, a PVN anterior parvocellularis és a lateralis magnocellularis részében, a locus coeruleus, az NTS és a VLM területén (Goebel és mtsai 2009b). Akut restraint stressz hatására megemelkedett a nesfatin-1/NUCB2 mRNS mennyisége az Edinger-Westphal magban (Okere és mtsai 2010). Ugyancsak aktiválódtak nesfatin-1/NUCB2 termelő
23
sejtek egyéb stressz helyzetekben, mint például hasi műtétek során (Stengel és mtsai 2010), vagy perifériás gyulladásoknál (Bonnet és mtsai 2009), továbbá a nesfatin-1 kezelt állatoknál stresszhez köthető viselkedésformákat (félelem, szorongás fokozódása) mutattak ki (Merali és mtsai 2008). Mindezen adatok alapján kíváncsiak voltunk arra, vajon a nesfatin-1/NUCB2 fehérje szerepet játszik-e a HPA tengely aktiválásában, és ezzel a stressz válasz kialakításában?
24
3. Célkitűzések
Eddigi ismereteink és „A hipotézis kifejtése” című alfejezet alapján munkám során vizsgálataimat több irányban folytattam. Részletesebben jellemezni kívántam, a nesfatin-1 táplálék- és vízfelvételre való hatását, vizsgálni annak lehetőségét, hogy a táplálékfelvétel szabályozása mellett, részt vesz-e a nesfatin-1 az energiaegyensúly másik oldalának, az energia leadásnak a szabályozásában, illetve az energiaegyensúlyt módosítani képes tényezők közül a stresszt kiválasztva azt tanulmányoztam, van-e szerepe a nesfatin-1-nek a HPA tengely szabályozásában.
A kísérletek során a következő tényleges kérdésekre kerestünk választ:
I.)
1. A nesfatin-1 képes-e az energia leadást a testhőmérséklet emelésén keresztül befolyásolni?
2. Ha igen, milyen a dinamikával, és milyen mechanizmuson keresztül éri el ezt?
a. Növeli-e az állatok fizikai aktivitását?
b. Hat-e a szívfrekvenciára?
c. A hideg aktiválja-e a nesfatin-1/NUCB2 termelő sejteket? Ha igen, milyen ezen sejtek kémiai karaktere?
3. Milyen a nesfatin-1 táplálék- és vízfogyasztásra gyakorolt hatásának időbeli lefutása? Hatását befolyásolja-e a cirkadian ritmus?
II.)
4. Befolyásolja-e az exogen nesfatin-1 a HPA tengely aktivitását? Ha igen, akkor ez a hatás közvetett, vagy közvetlen?
5. A stressz válasz kialakításában részt vesz-e az endogen nesfatin-1/NUCB2?
Stressz hatást követően aktiválódnak-e a PVN nesfatin-1/NUCB2-t termelő sejtei, illetve változik-e itt a nesfatin-1/NUCB2 gén expresszió?
6. A PVN nesfatin-1/NUCB2-t expresszáló sejtek érzékenyek-e a negatív glükokortikoid feedbackre?
25
4. Anyagok és módszerek
Kutatásaink során több kísérletsorozatot végeztünk, számos műtéti technikát és vizsgálati, analitikai módszert alkalmaztunk. A következőkben megadom a kísérletek vázlatos időrendi menetét, majd a fejezet második felében részletesen ismertetem az alkalmazott metódusokat.
4.1. A kísérletek felépítése és időbeosztása
1. kísérlet: Biotelemetriás mérések. A kísérlet során az állatok tápfogyasztásának gyakoriságát, testhőmérsékletét, szívfrekvenciáját és mozgását detektáltuk, valamint e paraméterek változását vizsgáltuk icv beadott nesfatin-1 hatására. Ehhez először icv kanült és radiotelemetriás transzmittereket ültettünk be az állatokba. Felgyógyulás után icv nesfatin-1-et, illetve kontroll állatoknak fiziológiás sóoldatot adtunk be, a nappali vagy az éjszakai ciklus kezdetén. Ez utóbbi esetben a patkányok ritmusát a munka megkönnyítése érdekében megfordítottuk. A telemetriás megfigyeléseket két napig folytattuk. Az állatok testtömegét, táplálék- és vízfogyasztását naponta mértük. Az icv kanül helyzetét a kísérlet után ellenőriztük (8. és 9. ábra, részletek lásd: 4.2, 4.3, 4.4 és 4.16 alfejezetek).
icv kanül és telemetriás transzmitter beültetés
telemetriás mérés, táp-, és vízfogyasztás, illetve testsúly napi mérése napok
8 6
5 4 2 3
1 7
0
icv nesfatin-1 vagy fiziológiás sóoldat beadás a nappali ciklus
elején
icv kanül helyzetének ellenőrzése 8. ábra: Az első kísérlet időbeosztása, nappali beadás esetében.
26
2. kísérlet: Hideg stressz hatása a nesfatin-1/NUCB2 pozitív neuronok aktivációjára. A kísérletben az állatokat egyesével helyeztük el a ketrecekben, majd 3 nap habituáció után az állatok egy részét hideg stressznek (4°C) vetettük alá, míg a kontrollokat standard környezetben (21°C) tartottuk. Két óra múlva a patkányokat perfundáltuk, agyukat kivettük, és Fos-nesfatin-1/NUCB2 kettős, illetve Fos-nesfatin-1/NUCB2-prepro-TRH tripla fluorescens immunhisztokémiára továbbvittük (10. ábra, 4.2, 4.5, 4.12.1 és 4.12.2 alfejezetek). A prepro-TRH nesfatin-1/NUCB2-vel való agytörzsi kolokalizációs vizsgálatához kolhicin kezelt, szobahőmérsékleten tartott kontroll állatokat is használtunk, mivel a sűrű prepro-TRH rosthálózat megnehezítette a vizsgálatokat, mivel eltakarták a detektálandó sejteket, a kolhicin kezelés eredményeképpen pedig a rostfestés csökkent (4.2, 4.6 és 4.12.3 alfejezetek).
icv kanül és telemetriás transzmitter beültetés
a fordított megvilágításhoz való szoktatás időszaka (3 hét)
telemetriás mérés, napi testsúly, táp- és
vízfogyasztás mérése
az állatok fordított megvilágítási ciklusú szobában (megvilágított órák: 22h-10h-ig)
icv kanül helyzetének ellenőrzése napok
-13 -1 1 6 7 8
-14 0 9
icv nesfatin-1 vagy fiziológiás sóoldat beadás az éjszakai ciklus elején
10. ábra: A második kísérlet időbeosztása.
9. ábra: Az első kísérlet időbeosztása, esti beadás esetében.
4ºC vagy 21ºC
perfúziós fixálás
agyFos + nesfatin-1/NUCB2 dupla fluoreszcens immunhisztokémia
Fos + nesfatin-1/NUCB2 + prepro-TRH tripla fluoreszcens immunhisztokémia
az állatok ketrecenként egyesével elhelyezve napok
1 2
0 3
2 0 1
órák
27
3. kísérlet: Az exogen nesfatin-1 hatása a vér stressz hormon szintjeire. Ebben a kísérletben az állatokat a szokásosnál hosszabban, két héten át kézhez szoktattuk és többször imitáláltuk rajtuk az icv beadási procedúrát, hogy a kísérlet során ez ne lépjen fel, mint stresszt okozó tényező. A második héten 3 nap eltéréssel icv és juguláris kanült ültettünk be a patkányokba. A két időpont közt az icv kanül helyét angiotenzin II beadással ellenőriztük. Újabb 3 nap gyógyulási idő után a patkányok icv nesfatin-1-et, a kontrollok fiziológiás sóoldatot kaptak. A kísérlet megkezdése előtt és időtartama alatt különböző időpontokban vért vettünk az állatoktól a juguláris kanülön keresztül. A vérplazmából ACTH és kortikoszteron szint mérés történt (11. ábra, 4.2, 4.3, 4.7, 4.11 és 4.16 alfejezetek).
4. kísérlet: A nesfatin-1 hatásának vizsgálata a hypophysis sejttenyészet ACTH termelésére. Elsőként a patkányok hypophysiséből sejtkultúrákat készítettünk. Másnap, a sejtek letapadása után a tenyésztőmédiumot friss, illetve különböző koncentrációban nesfatin-1-et tartalmazó médiumra cseréltük le. A sejteket egy órán át inkubáltuk 37°C-on, standard CO2 inkubátorban, majd a médiumot leszívtuk, és ebből végeztettük az ACTH hormon szint meghatározást (12. ábra, 4.2, 4.8 és 4.11 alfejezetek).
11. ábra: A harmadik kísérlet időbeosztása.
icv kanül beültetés
icv kanül ellenőrzése angiotenzin II-vel
jugularis kanül beültetés
icv nesfatin-1 vagy fiziológiás sóoldat beadás vérvétel a juguláris kanülön átACTH és kortikoszteron szint meghatározás plazmából
radioimmunoassey-vel napok
0 1 8 9 10 11 12 13 14
kézhez szoktatás (2 hét)
28
5. kísérlet: Restraint stressz hatása a nyúltvelői és hypothalamicus nesfatin-1/NUCB2 pozitív neuronok aktivációjára és nesfatin-1/NUCB2 mRNS expressziójára. A kísérletben az állatok egy részét restraint stressznek vetettük alá, a kontrollokat saját ketrecükben hagytuk. Négy óra elteltével a patkányokat fixálóval transzkardiálisan perfundáltuk, az agyakat nesfatin-1/NUCB2 ISH-ra, vagy Fos és nesfatin-1/NUCB2 kettős ICH-ra továbbvittük (13. ábra, 4.2, 4.9, 4.12.1, 4.12.4, 4.13.1, 4.14, 4.15 és 4.16 alfejezetek). A nyúltvelő NTS és VLM területén található nesfatin-1/NUCB2 neuronok további karakterizálása céljából kontroll metszeteken nesfatin-1/NUCB2-TH és nesfatin-1/NUCB2-TH-PrRP dupla, illetve tripla fluorescens IHC-t is végeztünk, és meghatároztuk a kolokalicáció mértékét (4.2, 4.12.1, 4.12.5, 4.13.2 és 4.16 alfejezetek).
6. kísérlet: A glükokortikoid negatív feedback hiányának hatása a nesfatin-1/NUCB2 mRNS expresszió szintjére a PVN-ben. A kísérlet első lépéseként az állatok mellékveséit eltávolítottuk (adrenalektómia - ADX). Áloperált állatok esetében a
13. ábra: Az ötödik kísérlet időbeosztása.
12. ábra: A negyedik kísérlet időbeosztása.
médium csere friss, illetve különböző koncentrációjú nesfatin-1-et tartalmazó tenyésztőoldatra
1h inkubáció standard CO2
inkubátorban 37°C-on dekapitálás,
sejtek kiültetése
médium leszívása ACTH szint meghatározás radioimmunoassay-vel
órák
25
0 1 24
perfúziós fixálás
agynesfatin-1/NUCB2 in situ hibridizáció
Fos + nesfatin-1/NUCB2 immunhisztokémia
0 1 2 3 4
órák
restraint, illetve saját ketrec
29
műtét minden lépését elvégeztük, de a mellékveséket érintetlenül hagytuk. Ezek az állatok kontrollként szolgáltak. Az állatok ezután fiziológiás sóoldatot kaptak inni csapvíz helyett. Egy hét múlva az állatokat dekapitáltuk, agyukat nesfatin-1/NUCB2 in situ hibridizációra továbbvittük, törzsvérükből kortikoszteron szint meghatározás történt (14. ábra, 4.2, 4.10, 4.11, 4.14, 4.15 és 4.16 alfejezetek).
4.2. Kísérleti állatok
A kísérletekben 250-300g súlyú hím, Wistar patkányokat használtunk. Az állatokat standard rágcsálótápon (VRF-1; Bioplan Kft, Isaszeg, Magyarország), 12h világos:12h sötét megvilágítási ciklus mellett, állandó hőmérsékleten (21 ± 2°C) tartottuk. A kísérleteket a Semmelweis Egyetem Egyetemi Állatvédelmi Szabályzatának figyelembe vételével, valamint a Fővárosi Állategészségügyi és Élelmiszer Ellenőrző Állomás 1894/003/2004 számú engedélyével végeztük. A műtétekhez és a transzkardiális perfúziókhoz minden esetben mély altatást alkalmaztunk intraperitonealisan beadott ketamin (50mg/kg; Richter Gedeon Nyrt, Budapest, Magyarország) és xylazine (15mg/kg; CP-Pharma, Bönsensell, Németország) keverékével. A kísérletek előtt az állatokat legalább egy hétig kézhez szoktattuk, hogy a kísérleti procedúra által kiváltott stresszt minimálisra csökkentsük.
4.3. Intracerebroventricularis kanül beültetése
Egy héttel az adott kísérletek előtt az állatokat elaltattuk, és sztereotaxikus készülék segítségével polyetilén kanült (belső átmérő: 0,4mm, külső átmérő: 0,8mm, Replant Cardo Kft., Budapest, Magyarország) ültettünk be a jobb oldal kamra elülső szarvába (koordináták: 0,8mm-re a bregma mögött, 2mm-re a középvonaltól, 4mm-re ventralisan a koponya felszínétől) (Zelena és mtsai 1999). Ezt követően az állatokat
14. ábra: A hatodik kísérlet időbeosztása.
műtét (adrenalektómia/
áloperált)
dekapitálás
agynesfatin-1/NUCB2 in situ hibridizáció vérplazma kortikoszteron szint meghatározás
radioimmunoassay-vel napok
0 1 2 3 4 5 6
30
egyesével tartottuk. A kanülök helyzetét vagy a kísérletek után a kanül szintjén történő koronális rámetszéssel, vagy a műtét utáni napon 10nM/3µl angiotenzin II (Sigma, Budapest, Magyarország) icv beadásával ellenőriztük. A kísérletekbe csak azokat az állatokat vontuk be, melyek kanülje megfelelő helyen volt, illetve melyek intenzív ivással (5 ml víz megivása a beadást követő 30 percen belül) reagáltak a hormonra (Stoppa és mtsai 2008).
4.4. Biotelemetria
A biotelemetriai méréseket 12 csatornás VitalView (Minimitters.Co., Bend, OR, USA) automata rendszeren keresztül végeztük (Mikics és mtsai 2008). Ennek segítségével mérni tudtuk az állatok vízszintes irányú mozgását (detektor elmozdulása), szívfrekvenciáját, testhőmérsékletét és a táplálékfelvétel gyakoriságát. A gép percenkénti mérést tett lehetővé. A kísérletek egy részét a nappali megvilágítási ciklus, másik részét a sötét megvilágítási ciklus kezdetén végeztük. Ez utóbbi esetben az állatokat a kísérlet előtt 3 hétig fordított megvilágítású szobában tartottuk (megvilágított órák: 22:00h-10:00h-ig).
Altatást követően a patkányok jobb oldalkamrájába icv kanült ültettünk be.
Ezzel egy időben az állatok hasüregébe VitalView biotelemetriás transzmittereket helyeztünk el. Az állatokat egy hétig hagytuk felépülni a műtét után. A kísérlet napján az állatokat csoportokra osztottuk. A kezelt csoportok 5µl nesfatin-1-et (Phoenix Pharmaceuticals, Inc., Burlingame, CA, USA, 25pmol, n=10-12 a nappali beadások során, és n=5-6 az esti beadások esetében, illetve 100pmol, n=7 nappali beadásnál), a kontroll csoportok minden esetben 5 µl fiziológiás sóoldatot kaptak icv. A kezeléseket minden esetben 10:00h és 10:30h között végeztük. A lokomócióra, a táplálék felvétel gyakoriságára, a szívfrekvenciára és a testhőmérsékletre vonatkozó adatokat két napig rögzítettük. A percenkénti adatokból rövid- és hosszú távú megfigyeléseket végeztünk.
Rövid távon a kísérlet kezdetétől eltelt 2,5 órát értékeltük 10 perces intervallumokban, hosszú távon a két nap adatait értékeltük 4 órás intervallumokban. Így az egyes időpontokban a statisztikához és az ábrázoláshoz az értékeket a táplálékfelvétel gyakoriságára és a lokomócióra vonatkozóan összeg ± standard hiba, a testhőmérsékletre és a szívfrekvenciára vonatkozóan pedig átlag ± standard hibaként kaptuk meg. A szívfrekvencia és a testhőmérséklet adatait százalékban adtuk meg; a
31
rövid távú megfigyelések esetében viszonyítási alapként a kísérlet előtti 10 perc, míg a hosszú távú megfigyeléseknél a beadás napján 6:00 és 7:00 óra között mért adatok átlagát vettük.
Az állatok testtömegét, az elfogyasztott táp és víz mennyiségét naponta ugyan abban az időpontban (10:00) mértük. A statisztikai analízishez a napi adatok állatonkénti különbségét használtuk, az eredményeket csoportonkénti átlag ± standard hibaként fejeztük ki.
4.5. Hideg stressz
A kísérlet előtt három nappal a patkányokat egyesével tettük ketrecekbe. A kísérlet napján a stresszelt csoport állatait (n=3) alom nélküli ketrecekben 4°C-os helyiségben helyeztük el. A kontroll csoportot (n=3) standard körülmények között tartottuk. Két óra múlva a patkányokat elaltattuk, először fiziológiás sóoldattal, majd 4%-os foszfát pufferes fiziológiás sóoldattal (PBS, 0,1M, pH: 7,4) oldott paraformaldehid (Sigma) oldattal (PFA, pH:7,4) transzkardiálisan perfundáltuk. Az agyakat kivettük, egy órás szobahőmérsékleten történő utófixálás után krioprotekció céljából egy éjszakára 20%-os cukor oldatba tettük, majd a vizsgálandó területekről 50µm-es koronális sorozatmetszeteket készítettünk fagyasztó mikrotómmal (Frigomobil, Reichter-Jung, Bécs, Austria). A kész metszeteket az immunhisztokémiai feldolgozásig azidos PBS-ben (0,1% Na-azid, konzerváció céljából, Sigma) 4°C-on tároltuk.
4.6. Kolhicin kezelés
Altatást követően a jobb oldalkamrába, (a koordináták megegyeznek az icv kanül beültetésnél megadottakkal) sztereotaxikus készülék segítségével, Hamilton fecskendőn keresztül 200µg/20µl fiziológiás sóoldatban oldott kolhicint (Sigma) juttattunk. Két nap elteltével az állatokat újból elaltattuk, először fiziológiás sóoldattal, majd 4%-os PFA-del perfundáltuk. Az agyakat ebben az esetben is kivettük, és az agytörzsből az előzőekben leírt módon 50µm-es koronális sorozatmetszeteket készítettünk, melyeket az immunhisztokémiai feldolgozásig azidos PBS-ben 4°C-on tároltuk.
32
4.7. Juguláris kanül beültetése és vérvétel
Altatást követően a patkányok jobb juguláris vénájába egy krónikus szilikon kanült ültettünk be (belső átmérő: 0,5mm, külső átmérő: 0,9mm; Dow Corning Corp., Midland, MI, and Becton Dickinson Parsipparny, New York USA), mely a későbbiekben lehetővé tette a többszöri vérvételt mozgáskorlátozás nélkül (Bodnar és mtsai 2009). Az állatokat hagytuk gyógyulni három napig, majd csoportokra osztottuk őket (n=5), és reggel 8:00h és 9:00h között 25pmol/5µl fiziólógiás sóoldatban oldott nesfatin-1-et (Phoenix), illetve a kontroll csoport esetében 5µl fiziológiás sóoldatot adtunk be nekik icv. Közvetlenül a kezelés előtt (0. perc), illetve az azt követő 15., 30., 60. és 90. percben időpontonként 400µl vért vettünk az állatoktól. A keringő vér térfogatának változatlansága érdekében, a levett vért fiziológiás sóoldattal pótoltuk. A mintákat a kísérlet végéig jégen tároltuk, ezt követően a vérplazmát centrifugálással (3000g, 10 perc, 4°C) elválasztottuk és leszívtuk, majd felhasználásig -20°C-on tároltuk (Bodnar és mtsai 2009).
4.8. Hypophysis sejttenyészet
A sejtkultúrák három felnőtt hím patkány hypophysiséből készültek. A szövetmintákat kisebb darabokra vágtuk, majd 37°C-os vízfürdőben 90 percig inkubáltuk trypsint (0,8mg/ml, Invitrogen, Budapest, Magyarország), és 0,1% borjú szérumot (BSA, Sigma) tartalmazó DMEM (Dulbecco modified Eagle’s medium, Invitrogen) oldatban a sejtek szeparációja érdekében. A mintákat centrifugáltuk (2000g, 10 perc, 24°C), a felülúszót leszívtuk. A sejteket reszuszpendáltuk 10mM aszkorbinsavat tartalmazó DMEM (Invitrogen) oldatban. Ezután a sejteket 106 sejt/petricsésze sűrűségben kiültettük. A sejtkultúrákat 24h-n át 0,1% BSA-t és 2,5%
magzati borjú szérumot (Invitrogen) tartalmazó DMEM médiumban, 37°C-on, standard CO2 inkubátorban tenyésztettük (Raptis és mtsai 2004). Másnap a sejttenyészeteket csoportokra osztottuk, és a médiumot lecseréltük: kontroll (n=4); 5nM (n=4); 10nM (n=4); és 50nM (n=3) nesfatin-1-et (Phoneix) tartalmazó friss tenyésztő médiumra. Egy óra standard CO2 termosztátban való inkubáció után a médiumot leszívtuk és felhasználásig -20°C-on tároltuk.
33
4.9. Restraint stressz
A hím állatokat (n=6) reggel 8:00h-kor egy átlátszó, kúposan végződő, légzőnyílással rendelkező műanyag hengerbe helyeztük (belső átmérő 5-6 cm), melynek hátsó végét papírtörölközőkkel lazán lezártuk (Zelena és mtsai 2003). Ez a módszer lehetőséget adott a fájdalom nélküli mozgáskorlátozásra, és minimalizáltuk a hőmérsékleti hatásokat is. A 4 órás restraintet követően az állatokat először fiziológiás sóoldattal, majd 4%-os PFA-del transzkardiálisan perfundáltuk. A kontroll állatok (n=6) stressz hatásnak nem voltak kitéve. Az agyakat kivettük, krioprotekció céljából 20%-os steril cukoroldatba helyeztük lesüllyedésig, majd a caudalis medulla és a hypothalamus területéről 20µm vastag koronális sorozatmetszeteket készítettünk fagyasztó mikrotómmal (Reichter-Jung). A metszeteket steril PBS-sel átmostuk, majd felhasználásig RNáz mentes fagyálló oldatban (20% glicerin, 30% etilénglicol tartalmú PBS oldat) tároltuk -20°C-on.
4.10. Adrenalektómia
A hím állatokon (n=7) bilateralis ADX-t végeztünk. Az elaltatott állatok hátán a vesék magasságában felvágtuk a bőrt, majd egy kis vágást ejtettünk az izomzaton.
Megkerestük a vesék felső pólusán a mellékveséket, melyeket óvatosan eltávolítottunk.
Kontrollként áloperált patkányokat (n=7) használtunk, melyeken minden műtéti lépést elvégeztünk, de a mellékveséket a helyükön hagytuk. A műtét után az állatok 0,9%-os sóoldatot kaptak inni csapvíz helyett, hogy a mellékvese kéregben termelődő mineralokortikoidok hiányának következtében felboruló só-vízháztartás zavarait csökkentsük. Egy hét elteltével az állatokat dekapitáltuk, a törzsvért jégen összegyűjtöttük a vérplazmát centrifugálással (3000g, 10 perc, 4°C) elválasztottuk és leszívtuk, majd felhasználásig -20°C-on tároltuk. Az agyakat kivettük, szárazjégen lefagyasztottuk további felhasználásig -80°C-on tároltuk. Az analízisbe csak azokat az állatokat vontuk be, melyek vérplazmájának kortikoszteron szintje nullára csökkent az ADX-át követően.