PANNON EGYETEM
VEGYÉSZMÉRNÖKI- ÉS ANYAGTUDOMÁNYOK DOKTORI ISKOLA
A biohidrogén Escherichia coli-val megvalósított előállításának és membrános szeparálásának vizsgálata
DOKTORI (Ph.D.) ÉRTEKEZÉS KÉSZÍTETTE:
Bakonyi Péter
OKLEVELES KÖRNYEZETMÉRNÖK
TÉMAVEZETŐ:
Dr. Nemestóthy Nándor TUDOMÁNYOS MUNKATÁRS
PANNON EGYETEM
BIOMÉRNÖKI, MEMBRÁNTECHNOLÓGIAI ÉS ENERGETIKAI KUTATÓ INTÉZET
2012
2
A biohidrogén Escherichia coli-val megvalósított előállításának és membrános szeparálásának vizsgálata
Értekezés doktori (PhD) fokozat elnyerése érdekében
*a Pannon Egyetem …...
Doktori Iskolájához tartozóan*.
Írta:
Bakonyi Péter
**Készült a Pannon Egyetem Vegyészmérnöki- és Anyagtudományok Doktori iskolája/
programja/alprogramja keretében Témavezető: Dr. Nemestóthy Nándor
Elfogadásra javaslom (igen / nem)
(aláírás)**
A jelölt a doktori szigorlaton ...%-ot ért el, Az értekezést bírálóként elfogadásra javaslom:
Bíráló neve: …... …... igen /nem
……….
(aláírás) Bíráló neve: …... …...) igen /nem
……….
(aláírás) ***Bíráló neve: …... …...) igen /nem
……….
(aláírás) A jelölt az értekezés nyilvános vitáján …...%-ot ért el.
Veszprém/Keszthely, ……….
a Bíráló Bizottság elnöke
A doktori (PhD) oklevél minősítése…...
………
Az EDHT elnöke
Megjegyzés: a * közötti részt az egyéni felkészülők, a ** közötti részt a képzésben résztvevők használják, *** esetleges
3
Tartalomjegyzék
Absztrakt ... 5
Summary ... 6
Auszug. ... 7
1. Bevezetés ... 8
1.1. A hidrogén biológiai előállításának koncepciója, megoldandó problémái ... 10
2. Célkitűzések ... 13
3. Irodalmi áttekintés ... 14
3.1. A H2 előállítás biológiai módszerei ... 14
3.1.1. Direkt biofotolízis ... 15
3.1.2. Indirekt biofotolízis ... 16
3.1.3. Fotofermentáció ... 17
3.1.4. Sötét fermentáció ... 19
3.2. Lehetőségek a hidrogéntermelés hatékonyságának növelésére ... 23
3.3. Fermentációs hidrogéntermelés Escherichia coli-val ... 24
3.4. Az Escherichia coli hidrogenázainak, hidrogén metabolizmusának részletes bemutatása ... 26
3.5. Hatékony biohidrogén termelő rendszerek kialakítása ... 30
3.6. A kísérlettervezés ... 30
3.7. A biohidrogén fermentáció kísérlettervezéssel történő optimalizálásának lépései ... 31
3.8. A baktériumok növekedésének kinetikája ... 33
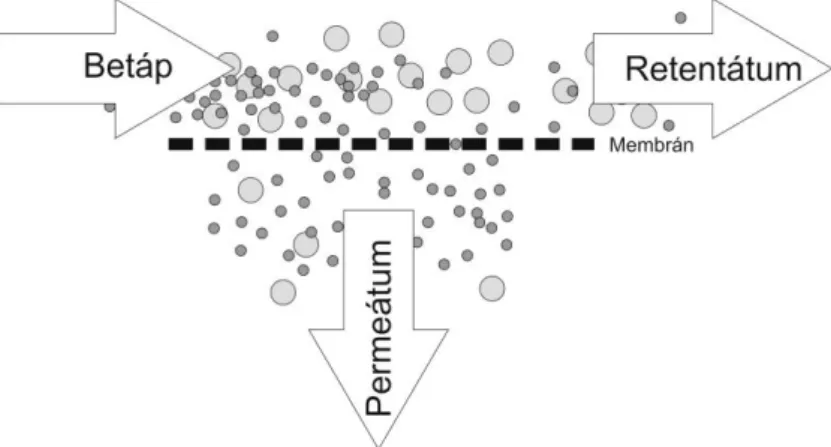
3.9. A hidrogén szeparációja ... 36
3.10. A membrános gáz szeparáció ... 38
3.11. A hidrogén szeparációja pórusmentes, polimer membránokkal ... 41
4. Kísérleti rész ... 44
4.1. A fermentációs kísérletek során alkalmazott anyagok, eszközök, módszerek ... 44
4.2. A membrános gáz szeparációhoz használt anyagok, eszközök, módszerek ... 52
5. Eredmények és értékelésük ... 58
5.1. Kísérletek a formiát szubsztrát hatásának vizsgálatára ... 58
5.2. A biohidrogén fermentáció optimalizálása kísérlettervezéssel ... 59
5.2.1. A fermentációs paraméterek hatásának, a kulcsfaktorok körének meghatározása .... 60
5.2.2. Az optimális formiát koncentráció meghatározása... 64
5.3. Az Escherichia coli (XL1-BLUE) szaporodási kinetikájának vizsgálata ... 66
5.4. Biohidrogén fermentáció folyamatos rendszerben ... 70
4
5.5. Az Escherichia coli (XL1-BLUE) és (DJT 135) baktériumtörzsek
hidrogéntermelésének összehasonlítása ... 75
5.6. Gáz szeparációs kísérletek az ME1 membrán modul használatával ... 81
5.7. Gáz szeparációs kísérletek az UBE „NM-B01A” membrán modullal a GSMS-100 membrántesztelő készülékben ... 83
6. Összefoglalás ... 88
7. Új tudományos eredmények ... 90
8. Novel scientific results ... 92
9. Irodalomjegyzék ... 94
10. Publikációs jegyzék ... 103
11. Köszönetnyilvánítás ... 106
5
Absztrakt
Munkám első részében fermentációs kísérleteket végeztem biohidrogén előállítása céljából különböző Escherichia coli baktériumtörzsekkel.
A kísérletek első részében szakaszos rendszerben, E. coli (XL1-BLUE)-ot alkalmazva, kísérlettervezéses alapon változtattam a fermentációs körülményeket (formiát-, élesztőkivonat-, tripton-, NaCl- és sejtkoncentráció, keverési sebesség) a minél hatékonyabb biohidrogén előállítás érdekében, s meghatároztam a hidrogénképződés szempontjából optimális paraméterkombinációkat.
Következő lépésként formiát szubsztrát alkalmazásával vizsgáltam az E. coli (XL1- BLUE)-ra jellemző szaporodási kinetikáját, melynek során megállapítottam a növekedés exponenciális szakaszának, s ezzel együtt a legintenzívebb gáztermelésnek az időszakát. Ezen túlmenően számítottam a folyamatos rendszer tervezéséhez fontos kinetikai konstansok, a maximális szaporodási sebesség és a szubsztrát féltelítési állandó értékeit is, majd folyamatos üzemű, tökéletesen kevert bioreaktort alakítottam ki és meghatároztam az optimális hidraulikus tartózkodási idő értékét.
A biohidrogén termelés fokozására bemutattam a metabolikusan módosított törzsek alkalmazása és a folyamatoptimálás adta lehetőségeket, melynek során összehasonlító vizsgálatot végeztem az E. coli (XL1-BLUE) és az expressziós mutáns E. coli (DJT 135) között, a formiát koncentráció és pH hatását vizsgálva. Az eredmények tükrében elmondható, hogy utóbbi törzs optimális körülmények között 50%-kal nagyobb hidrogén hozam elérését teszi lehetővé az előző organizmushoz képest.
A kísérletek második felében célom az volt, hogy a keletkezett gázból – amely összetételében egy több komponensű gázelegynek tekinthető – a biohidrogént valamilyen módon elválasszam, ami a hidrogén végfelhasználása érdekében fontos. Az elválasztáshoz két pórusmentes, kapilláris csöves, poliimid anyagú membránt (ME1 és UBE „NM-B01A”
modulok) teszteltem. A kísérleteket a gázelegyre jellemző egykomponensű gázokkal, valamint biner – hidrogén és szén-dioxid tartalmú – gázeleggyel folytattam, s meghatároztam az adott gázokra jellemző, a vizsgált membránokra vonatkozó permeabilitás és szelektivitás értékeket különböző szeparációs körülmények (hőmérséklet, retentátum elvételi arány) mellett. Az eredmények alapján elmondható, hogy ezen típusú membránok potenciálisan alkalmasak a biohidrogén szeparációjára.
6
Summary
In this dissertation biohydrogen fermentation by using various E. coli strains and the purification of biohydrogen from multicomponent gaseous mixture by membranes were aimed to study.
Firstly, the optimal conditions (formate-, yeast extract-, tryptone-, NaCl concentration, inoculum size, stirring speed) for batch biohydrogen fermentation using E. coli (XL1-BLUE) were investigated by experimental design. It was found that among the several variables only formate compound plays a key role in hydrogen formation and the optimal conditions for biohydrogen production were determined.
Secondly, a kinetic investigation was performed on formate supplemented broth by employing the same bacteria and the exponential growth phase – when the most intense gas formation takes place – was determined. Furthermore, important process design parameters such as saturation constant and maximal growth rate were calculated. Afterwards, based on the kinetic study, continuous hydrogen fermentations using the cultures of E. coli (XL1- BLUE) were carried out in a CSTR reactor at various hydraulic retention times (HRT) and its optimum value for biohydrogen formation was determined.
Thirdly, the benefit of simultaneous application of metabolic engineered strains and process optimization through a comparative study of wild-type E. coli (XL1-BLUE) and expression mutant E. coli (DJT 135) was demonstrated. The effect of two major operational factors (formate concentration and pH) on bioH2 production was investigated and the results revealed that using E. coli (DJT 135) strain under optimized conditions 1.5 times higher yield could be obtained compared to the wild-type E. coli (XL1-BLUE).
In addition to production purposes, biohydrogen recovery was also investigated by testing different non-porous, hollow-fiber, polyimide membranes (ME1 and UBE „NM- B01A”) at various operational conditions (temperature, retentate and feed flow ratio). Based on the obtained permeability and selectivity data – determined in single and binary gas experiments, as well – it was concluded that such membranes possess real potential for efficient hydrogen enrichment.
7
Auszug.
Im ersten Teil der Arbeit wurden Fermentationsversuche durchgeführt, um Biowasserstoff aus verschiedenen Escherichia coli Bakterien-Stämmen herzustellen.
Zuerst wurden die Bedingungen der Fermentation (Formiat-, Inokulum, Trypton-, NaCl- und Zellkonzentration, Geschwindigkeit der Mischung) unter Verwendung von E. coli (XL1-BLUE) in einem diskontinuerlichem System durch experimentelle Versuchsplanung untersucht, um die Biowasserstobbausbeute zu erhöhen.
Als näschster Schritt wurde die charakteristische Wachstumkinetik der E. coli (XL1- BLUE) unter Verwendung von Formiatsubstrat untersucht wodurch der Zeitinterwall der Phase des exponentiellen Wachstums und gleichzeitig der der intensivsten Gasproduktion festgestellt. Es wurden weiterhin die zur Planung des kontinuierlichen Systems wichtigen kinetischen Kostanten, die maximale Wachstumrate und die Sättigungskonzentration berechnet. Dann wurde ein kontinuierlich durchströmter Rührkesselreaktor ausgestattet und die optimalen hydraulischen Verweilzeiten wurden ermittelt.
Um die Biowasserstoffproduktion zu erhöhen, wurden die Möglichkeiten, die durch die Anwendung von metabolisch modifizierten Stämmen und Prozessoptimierung gegeben werden demonstriert. Vergleichuntersuchungen wurden zwischen E. coli (XL1-BLUE) und Expressionsmutant E. coli (DJT 135) gemacht, wobei die Wirkung der Formiatkonzentration und des pH-Wertes untersucht wurden. Im Spiegel der Ergebnisse kann gesagt werden, dass der letztere Stamm im Vergleich zum vorherigen Organismus bei optimalen Bedingungen die Erreichung von um 50 % höhere Wasserstoffausbeute ermöglicht.
In dem zweiten Teil der Versuche mein Ziel war es, aus dem produziertem Gas – das als ein mehrkomponentes Gasgemisch betrachtet werden kann – das Biowasserstoff irgendwie abzutrennen, was für die Endverwendung des Wasserstoffes wichtig ist. Zur Trennung wurden zwei porenlose, kapillare Membrane bestehend aus Polyimid (ME1 and UBE „NM- B01A”) getestet. Die Versuche wurden mit einkoponenten Gasen sowie mit bineren, Wasserstoff und Kohlendioxid enthaltenden Gasgemischen durchgeführt und es wurden die auf die gegeben Gase charakterische Permeabilität- und Selektivität-Werte bei verschiedenen Separationsbedingungen bestimmt. Aufgrund der Ergebnisse kann man sagen, dass die Membranen von solcher Typ potenziell für die Trennung von Biowasserstoff geeignet sind.
8
1. Bevezetés
Mára a fosszilis energiahordozók (kőolaj, kőszén, földgáz) féktelen „habzsolása”
következtében a Föld nem megújuló energiatartalékai mind inkább a kimerülés szélére kerülnek, mellyel párhuzamosan környezetünk is egyre növekvő károkat szenved el.
Napjainkban a kőolaj-finomítók minden 1 millió tonna feldolgozott kőolajra vonatkoztatva (az európai üzemek feldolgozó kapacitása 0.5-20 millió tonna/év) 20000-820000 tonna szén- dioxidot, 60-700 tonna nitrogén-oxidot, 10-3000 tonna port, 30-6000 tonna kén-dioxidot és 50-6000 tonna illékony szerves vegyületet (VOC) bocsátanak ki [Kovács, 2010]. Nyilvánvaló, hogy bolygónk további kizsákmányolásának és a környezet elszennyeződésének visszaszorítása érdekében szükség van a fosszilis készletek felhasználásának csökkentésére az azokat helyettesíteni képes megújuló energiaforrások használatának segítségével. A fosszilis energiahordozók (kőszén, kőolaj, földgáz) uralma 1960-1970-es évekig az energiaellátás minden területén töretlen volt. Az élhető környezet iránti egyre növekvő igény felerősödésével párhuzamosan 1967-1972 között jelentek meg az első olyan kezdeményezések, melyek a környezetbarát energiaforrások kutatását célozták meg, majd az 1973-as energiaválság ébresztette rá az emberiséget arra, hogy itt az ideje cselekedni, itt az ideje az alternatív energiahordozók irányába fordulni, s minél inkább függetleníteni magunkat a nem megújuló forrásoktól. Ennek szellemében még abban az évben megalakult a Miami Egyetemen (USA) a Clean Energy Research Institute (CERI), s ez volt az első olyan kutató intézet, amelynek célja a megújuló, „zöld” energiahordozók kutatása volt.
A megújuló energiaforrás olyan közeg, természeti jelenség, melyekből energia nyerhető ki, és amely akár naponta többször ismétlődően rendelkezésre áll, vagy jelentősebb emberi beavatkozás nélkül legfeljebb néhány éven belül újratermelődik. A „zöld”
energiaforrások használata lehetővé teszi a fenntartható fejlődés alapelveinek való megfelelést, vagyis ezek alkalmazása nem károsítja, szennyezi a környezetet, ugyanakkor nem gátolja a folyamatos emberi fejlődés lehetőségét sem. A CERI-ben dolgozó kutatók voltak az elsők, akik felvetették egy hidrogén alapú gazdaság, energiaellátó rendszer gondolatát. 1974-ben megalakult az International Association for Hydrogen Energy (IAHE), melynek vezetősége úgy döntött, hogy a hidrogénnel kapcsolatos kutatások eredményeinek, vívmányainak közkinccsé tétele érdekében létrehoznak egy hivatalos folyóiratot International Journal of Hydrogen Energy (IJHE) néven, melynek első kiadása 1976 januárjában jelent
9
meg. Az első hidrogénnel kapcsolatos világméretű konferenciát szintén ebben az évben tartották Miamiban.
Az évek múlásával a hidrogénnel kapcsolatos tudományterület egyre nagyobb ismertségre és népszerűségre tett szert, egyre több fontos felfedezés, eredmény látott napvilágot, melyet mi sem bizonyít jobban, minthogy az IJHE kezdetben negyedévi megjelenéssel indult, míg 2008-tól ez a szám már évi 24 kiadványra emelkedett. Az ipar és a hidrogénenergia közötti kapcsolatot illetően elmondható, hogy az 1974-től napjainkig terjedő időszakban a hidrogént az ipar számos területéről egyre fokozódó érdeklődés követi - kivéve a petrolkémiai ipart. Az IAHE vezetői az évek során többször próbálták érdemben felvenni a kapcsolatot az olajipari vállalatokkal, azonban ezek a próbálkozások rendre sikertelennek bizonyultak, ugyanis az olajipar képviselői szerint a hidrogéngazdaság nem volt más, mint egy „romantikus” elképzelés. Mindezek mellett a küzdelem nem bizonyult hiábavalónak, mivel 1998 augusztusában a Shell Oil Co. szakított az addigi általános gondolkodásmóddal, s létrehozta saját „Hidrogén Divízióját” elhagyva ezzel az „anti-hidrogén” konzorciumot. A Shell törekvéseit nem sokra rá követte a BP olajtársaság is, s ezzel az olajipar is elkezdett a hidrogénnel, mint ígéretes energiaforrással foglalkozni. Azt, hogy a hidrogén alapú energiaellátás már nem csak egy „romantikus” gondolat, több tény támasztja alá, melyre példaként szolgálhatnak a világszerte jelenleg is folyó kezdeményezések. Németországban például egy 7 ipari partnerből, 3 olajipari vállalatból, 1 ipari gáz gyártóból és 1 autó gyártóból álló konzorcium támogatásával megvalósuló „H2 mobility” projekt, míg Japánban a petróleum ipar számos tagját (Nippon Oil, Tokyo Gas, Showa Shell, Osaka Gas, Toko Gas, Air Liquid Japan, Idemitsu Kosan) tömörítő szervezet, a „H2 Supply Technology Association” jött létre azért, hogy lépéseket tegyenek egy a hidrogén-t (is) felhasználó energia ellátó rendszer létrehozására. Másik fontos példaként említhető, hogy több autógyártó cég (General Motors, Toyota, Ford, Honda, Daimler, Hyundai, Kia, Renault, Nissan) tervei között szerepel az is, hogy a jövőben üzemanyagcellás, hidrogén-meghajtású autók tömegét gyártsák le és állítsák forgalomba, s ennek elérésére évente dollár milliárdos nagyságrendű összegeket költenek kutatásra, fejlesztésre [Veziroglu, 2010].
A mai várakozások, előrejelzések szerint kb. 2040-2050-re jöhet el azaz időszak, amikor is az előállítási költségek, a szükséges infrastruktúra kiépítettsége, a technikai feltételek és a politika elhivatottsága olyan szintre kerülnek, hogy a hidrogénenergia nagymértékben képes lehet felváltani a hagyományos, jelenleg még szinte kizárólagosan fosszilis energiára épülő energiaellátó rendszereket [Lee, 2008].
10
1.1. A hidrogén biológiai előállításának koncepciója, megoldandó problémái
A hidrogén ideális energiahordozó környezetvédelmi, egészségügyi és energetikai szempontokból egyaránt, mivel tömegegységre vonatkoztatott energiatartalma nagyobb (120 MJ/kg), mint a metáné (földgáz), továbbá használatával nincs szennyezőanyag kibocsátás, ha alacsony hőmérsékleten, üzemanyag cellákban hasznosítjuk, hiszen oxidációjának terméke kizárólag víz, melynek eredményeképpen elkerülhető a regionális- és globális légszennyezettségért főként felelős NOx és CO2 gázok kibocsátása. A hidrogén üzemanyagcellákban való hasznosításával jelentősen nagyobb energia átalakítási hatásfok (ηüc~50-60 %) érhető el a hagyományos belsőégésű robbanómotorokhoz képest, melyek további előnye, hogy működésük csendes (mivel nincs bennük mozgó alkatrész), így a hidrogénnel működtetett üzemanyagcellás járműveknek, szállító eszközöknek nincs zajkibocsátása.
Ahhoz, hogy a hidrogén a jövő energiaforrása lehessen, mindenképpen környezetbarát eljárásokkal kell azt előállítanunk, napjainkban azonban az ipar különféle területein felhasznált hidrogén kb. 96%-át fosszilis alapon, főként metán vízgőzös reformálásával állítják elő, éves mennyisége mintegy 65-70 millió t (IEA, 2007). A hagyományos eljárásokon túlmenően a hidrogén megújuló forrásból, biológiai úton történő előállítása ígéretes, alternatív lehetőségnek tekinthető, azonban ehhez kapcsolódóan számos probléma vár még megoldásra, melyek döntően az előkezelés, előállítás, szeparálás, tárolás, felhasználás tárgykörét érintik (1.1. ábra).
1.1. ábra – A biológiai módszerrel történő hidrogén előállítási technológia
11
A növényi biomassza, a mezőgazdasági és ipari (gyümölcsfeldogozó ipar, papíripar, élelmiszeripar, stb.) eredetű cellulóz/hemicellulóz/lignin tartalmú (hulladék)anyagok szinte kimeríthetetlen – szénhidrátban gazdag - forrást jelentenek, s potenciálisan felhasználhatók biohidrogén előállításra. A komplex összetételű anyagok biohidrogénné fermentálhatóságának kulcslépése a hidrolízis, mert a szubsztrátoknak elsőként a baktériumok számára hozzáférhető, felvehető, hasznosítható formába kell alakulniuk. Ahhoz azonban, hogy a hidrolízis jó hatásfokkal működhessen, a legtöbb esetben szükség van valamilyen fizikai (pl.
aprítás, darálás, gőz- v. gázrobbantás, ultrahangos előkezelés, stb.), kémiai (savas vagy lúgos előkezelés) vagy enzimatikus előkezelésre. A legjobb természetesen az lenne, ha sikerülne olyan „mindenevő” mikroorganizmusokat azonosítani és alkalmazni, melyek a fizikai/kémiai eljárások elhagyásával is képesek az összetett alapanyagok hatékony lebontására és hasznosítására pusztán a saját maguk által megtermelt specifikus enzimek segítségével közvetlenül a bioreaktorban. Erre potenciálisan olyan mikrobák, mikrobakonzorciumok lehetnek alkalmasak, melyek nagy mennyiségben képesek a különféle enzimek pl. endo- és exoglükonáz, β-glükozidáz, hemicelluláz, xilanáz, stb. enzimek termelésére [Nath, 2004; Lo, 2008; Lee, 2010].
Az előkezelt biomasszából ezt követően hidrogént állítunk elő, melynek helyszíne a bioreaktor. Az előállítás történhet egy- ill. többlépcsős eljárással is. Az első lépcső általában sötét fermentációt jelent, s ehhez opcionálisan valamilyen kiegészítő eljárás kapcsolható (pl.
fotofermentáció, mikrobiális üzemanyag cella, mikrobiális elektolízis cella, metán fermentáció), amellyel jelentősen növelhető a folyamat hatékonysága [Liu, 2005; Cooney, 2007; Laurinavichene, 2010; Pant, 2010]. Emellett a biohidrogén technológia versenyképessége növelhető a fermentációs paraméterek megfelelő beállításával is, hiszen ezeken keresztül befolyásolhatjuk a bioreaktorban lévő mikroba, mikrobakonzorcium anyagcsere folyamatait, vagyis a megfelelő kombinációkkal nagyobb hozamok és gázképződési sebességek érhetők el.
Továbbá, a biológiai módszerekkel előállított hidrogént – a későbbi felhasználási céltól függően – tisztítani is kell, hiszen az a fermentorban nem önmagában, hanem egyéb komponensekkel együtt (főként CO2, emellett vízgőz, kén-hidrogén) keletkezik [Shao, 2009].
A hidrogén tárolása szintén kulcskérdés, melynek kapcsán még nincsenek kiforrott megoldások. A hidrogén palackokban, komprimált állapotban történő tárolása, szállítása nagyléptékben nem nyújt megfelelő megoldást.
12
A kívánatos megoldás az lenne, hogy olyan anyagokat fejlesszünk ki, melyek nagy kapacitással, biztonságosan teszik lehetővé a hidrogén tárolását. A legújabb eredmények alapján a különböző fémhidridek (pl. LiBH4, NaAlH4, stb.) illetve szénnanocsövek, grafitnanoszálak lehetnek azok az anyagok, melyek fejlesztésével megfelelő üzemanyagtároló egységeket hozhatunk létre, azonban ezek még nem versenyképes alternatívák [Schlapbach, 2001; Cheng, 2001].
Végezetül pedig még jobb hatásfokú, még hosszabb élettartamú, még alacsonyabb előállítási költségű üzemanyagcellákat kellene kifejleszteni annak érdekében, hogy megfizethető áru, megbízható, a vásárlók széles körének elérhető hidrogénüzemű járművek álljanak rendelkezésre [Levin, 2004].
Az eddigiek alapján látható, hogy számos olyan terület van, ahol a hidrogéntechnológia fejlesztésébe be lehet kapcsolódni, s doktori munkám során én az 1.1.
ábrán feltüntetett két fontos részre, a biohidrogén sötét fermentációs előállítására és annak (membrános) tisztítására, szeparációjára fókuszáltam.
13
2. Célkitűzések
Doktori munkám során az alábbiakat tűztem ki célul:
1. E. coli (XL1-BLUE) baktériumtörzset és formiát szubsztrátot alkalmazva a sötét fetmentációs biohidrogén előállítás vizsgálata és optimalizálása szakaszos rendszerben a hidrogéntermelés hatékonyságának maximalizálása érdekében.
2. A baktérium szaporodási kinetikájának tanulmányozása, az exponenciális növekedési szakasz, valamint a kinetikai konstansok (maximális szaporodási sebesség, szubsztrát féltelítési állandó) meghatározása.
3. A szakaszos rendszerben végzett vizsgálatok, valamint az E. coli (XL1-BLUE) szaporodási jellemzőinek meghatározása során nyert eredményekre alapozva a hidrogén fermentáció megvalósítása folyamatos üzemű bioreaktorban, optimális hidraulikus tartózkodási idő meghatározása.
4. A biohidrogén fermentáció hatékonyságának növelésére vonatkozó – a metabolikus mérnökség és a folyamatoptimálás együttes alkalmazásában rejlő – lehetőségek bemutatása, alkalmazása. Ennek keretében az E. coli (XL1-BLUE) és a metabolikusan módosított E. coli (DJT 135) hidrogéntermelő képességének összehasonlító vizsgálata.
5. A fermentáció során keletkező gázelegy szétválaszthatóságának vizsgálata membrános gáz szeparációval a hidrogén kinyerése, koncentrálása céljából. Ehhez kapcsolódóan a potenciális membránok tesztelése, jellemzése egykomponensű, valamint kevert gázokkal, az elválasztás műveleti paramétereinek a szeparációs hatékonyságra gyakorolt hatásának tanulmányozása.
14
3. Irodalmi áttekintés
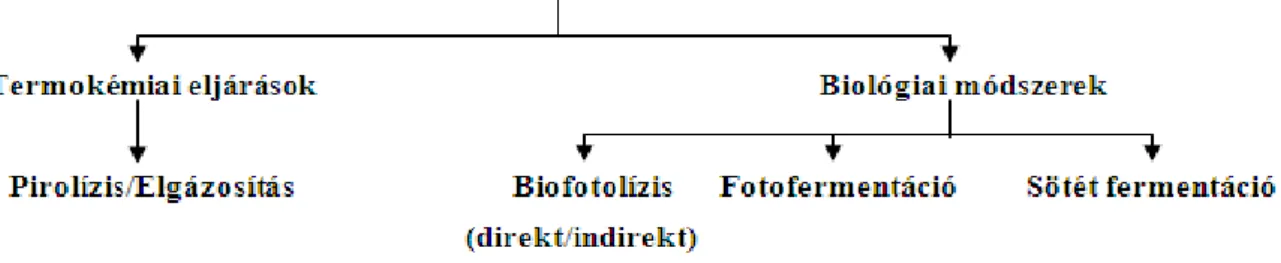
Figyelembe véve azt a tényt, hogy a hidrogén előállítása nagy mennyiségben rendelkezésre álló, megújuló forrásból kívánatos, célszerű a biomasszából kiinduló lehetőségek felé fordulnunk. A hidrogén biomassza, vagyis megújuló alapon történő előállításának több módja is ismeretes, közöttük megkülönböztetünk termokémiai és a biológiai eljárásokat, melyeket a 3.1. ábra szemléltet.
3.1. ábra – A hidrogén biomasszából történő előállításának lehetőségei
3.1. A H
2előállítás biológiai módszerei
A mikrobák – élettani tulajdonságaik és metabolizmusuk sokféleségének köszönhetően – különböző folyamatok révén képesek hidrogént termelni, melyek mindegyikének megvannak a maguk jellemző tulajdonságai, előnyei és hátrányai [Manish, 2008]. Mérnöki szempontból nézve a hagyományos hidrogén előállító eljárásokhoz (pl. metán vízgőzös reformálása) képest mindenképpen előnyösek, hiszen a mikrobiális sejtek olcsó biokatalizátorok, valamint alkalmazásuk nagyságrendekkel kisebb energia befektetést igényel a reaktorok üzemeltetése során, mivel ezek a környezetihez közeli hőmérsékleti és nyomás tartományban játszódnak le. A hidrogén biológiai módszerekkel való előállítási lehetőségeinek felismerése kb. egy évszázados múltra tekint vissza, s az 1970-es évektől kezdődően ezek a lehetőségek fokozatosan, egyre inkább a figyelem fókuszába kerültek.
Közös jellemzőjük, hogy hidrogéntermelő (hidrogenáz és nitrogenáz) enzimek vesznek részt benne, anaerob körülmények között [Manish, 2008; Das, 2001]. A nitrogenáz enzimek fő építőelemei a Mo-, Fe- és V-tartalmú fehérjék. Ezen enzimeknek megvan a képességük arra, hogy ATP-t és elektronokat felhasználva protonokat hidrogénné redukáljanak [Eroglu, 2011].
15 h
A hidrogenázok a legtöbb hidrogéntermelésre képes mikroorganizmusban megtalálhatók és 2 fő osztályba, hidrogénfelvevő (uptake) és a reverzibilis hidrogenázok közé sorolhatók be. Elnevezésüknek megfelelően az első csoport képviselői a hidrogén oxidációját katalizálják (H2 2H+ + 2e-), míg a másik osztályba tartozók a hidrogén előállítására (fölös redukáló erő H2 formájában való eltávolítása) és oxidációjára (H2 2H+ + 2e-) is képesek a környezeti (pl. redox) feltételek függvényében.
A hidrogenázok számos baktériumban, valamint néhány eukariótában (pl. algákban) fordulnak elő. Az aktív centrumban helyet foglaló fémtartalmuk szerint három fő csoportjuk különíthető el: [NiFe]-hidrogenázok, [FeFe]-hidrogenázok és [Fe]-hidrogenázok [Kim, 2011], melyek a nitrogenázokkal való összehasonlításban nagyságrendileg gyorsabb működésre képesek és a katalitikus átalakítás nem igényel energia (ATP) befektetést [Mathews, 2009].
A hidrogenázok működése érzékeny az oxigénre, s oxigéntoleranciájuk tekintetében jelentős különbség mutatkozik közöttük: míg a [FeFe]-hidrogenázok extrém érzékenységgel rendelkeznek, a [NiFe]-hidrogenázok jelentősen nagyobb mértékben képesek ellenállni az oxigén okozta inhibíciónak [Mathews, 2009]. A biológiai hidrogén előállító módszereket 3 fő csoportba különíthetjük el: biofotolízis, fotofermentáció és sötét fermentáció [Das, 2001].
3.1.1. Direkt biofotolízis
A hidrogéntermelés eme módja a zöld algákra (pl. Clamydomonas reinhardtii, Chlorella fusca, Scendesmus obliquus, Chlorococcum littorale, Platymonas subcordiformis) és cianobaktériumokra (pl. Synechocystis, Synechococcus, Gloebacter nemzettség tagjai) jellemző. Az organizmusokban jelenlévő PSI és PSII fotokémiai rendszerek fényt nyelnek el, s a PSII rendszer oxidálja a vizet, melyből protonok, elektronok és O2 keletkezik. Ezt követően a keletkezett elektronok a PSI rendszer által felvett fényenergia segítségével egy ferrodoxin molekulára vándorolnak s redukálják azt (Fdred), majd végül a redukált állapotú ferrodoxinról származó elektronok (Fdred→Fdox) és a vízbontásból származó protonok hidrogénné rekombinálódnak [Levin, 2004; Das, 2001; Hallenbeck, 2009a]:
2 H2O 2 H2 + O2
h : foton (fény) energiája (h: Planck-állandó; : frekvencia)
16
3.1.1.1. ábra – A direkt biofotolízis folyamata [Hallenbeck, 2009a]
Mivel a hidrogenázok rendkívül érzékenyek az oxigénre, mindenképpen szükséges az O2 tartalmat 0.1 %(V/V) alatt tartani [Levin, 2004; Das, 2001; Hallenbeck, 2009a]. A folyamat oxigén toleranciáját, s ezen keresztül a hidrogén termelés hatékonyságát fehérjemérnöki módszerek alkalmazásával, oxigén toleráns hidrogenázok és mutáns törzsek létrehozásával is igyekeznek megnövelni [Ni, 2006; Hallenbeck, 2009a]. Mindemellett, direkt biofotolízissel ma még az extrém magas előállítási ár miatt nem lehet ipari méretekben, gazdaságosan hidrogént előállítani.
Előnyök:
- megújuló szubsztrát: víz és napfény - zéró CO2 kibocsátás
Hátrányok:
- nincs fenntartható technológia
3.1.2. Indirekt biofotolízis
Indirekt biofotolízis alkalmazásával a direkt biofotolízis során fellépő oxigén gátlás elkerülése a cél, amikor is a biomassza képződés és a hidrogén előállítás időben/térben elkülönül. Ez a folyamat szintén zöld algák és cianobaktériumok segítségével valósítható meg. Az 1. lépésben fotoszintézis történik, amikor is az egyes élőlények vízből és szén- dioxidból, a fotoszintetikus rendszer és napfény segítségével oxigént és szerves anyagot (glükóz) előállítanak elő, melyet különböző formákban (pl. keményítő, glikogén) tárolnak. Ez a növekedés v. biomassza képződés szakasza. A 2. lépésben összegyűjtik, koncentrálják a
17 h
keletkezett biomasszát, s anaerobizálják a rendszert. Ekkor a felhalmozott poliszacharid fermentatív átalakulása történik meg, melynek során a keletkező elektronok és protonok – az anaerob körülmények hatására aktivizálódó – hidrogéntermelő enzimek által hidrogénné alakulnak. A folyamat koncepciója, lépései tehát a következők [Levin, 2004; Das, 2001;
Hallenbeck, 2009a]:
(1) fotoszintézis, biomassza termelés;
(2) a keletkezett biomassza koncentrálása;
(3) anaerob, sötét fermentáció (a sejttömegben felhalmozott poliszacharid átalakítása hidrogénné és acetáttá);
(4) a keletkezett acetát hasznosítása
A folyamat egyszerűsítve az alábbi reakcióegyenlettel írható le:
12 H2O + 6 CO2 C6H12O6 + 6 O2 (biomassza képződés fény jelenlétében) C6H12O6 + 6 H2O 12 H2 + 6 CO2 (hidrogén képződés sötét fermentáció során)
Előnyök:
- megújuló szubsztrát: víz és napfény
- O2/H2 termelés külön választása – O2 inhibíció elkerülése Hátrányok:
- alacsony hidrogéntermelési ráta - alacsony fénykonverziós hatékonyság
- a megvalósítás (fotobioreaktorok tervezése, üzemeltetése) költséges
3.1.3. Fotofermentáció
A biohidrogén termelés eme módja bíbor (nem-kén) baktériumok (pl. Rhodospirillum rubrum, Rhodopseudomonas palustris, Rhodobacter sphaeroides, Rhodobacter capsulatus) alkalmazásával valósítható meg, melyek a biofotolízissel ellentétben nem hidrogenáz, hanem nitrogenáz enzim(ek) által katalizálják a hidrogéntermelést. A nitrogenáz enzimek elsődleges feladata a molekuláris nitrogén fixálása, ammóniává alakítása. Anaerob körülmények között, N2 jelenlétében vagy annak hiányában azonban a nitrogenázok hidrogén előállításra képesek
18 h
rövid szénláncú szerves savak, fermentációs termékek (pl. acetát, butirát, malát, laktát, szukcinát, propionát) és a napenergia felhasználásával [Levin, 2004; Das, 2001; Hallenbeck, 2009a; Eroglu, 2011]:
CH3COOH + 2 H2O 4 H2 + 2 CO2
3.1.3.1. ábra – A fotofermentáció folyamata [Hallenbeck, 2002]
A bíborbaktériumok fotoszintetikus pigmentjei jellemzően a látható (400-700 nm) és a közeli infravörös (700-950 nm) sugárzás tartományában képesek fényelnyelésre. A fotofermentációs rendszerekre vonatkozó vizsgálatok döntő többségét egyszerű szubsztrátokkal végezték, azonban ipari szennyvizet hasznosítva is sikerült ígéretes eredményeket elérni [Eroglu, 2011]. Meg kell azonban említeni, hogy az ipari környezetből származó (hulladék)áramok reaktorba történő betáplálását ajánlatos valamilyen előkezelő eljárásnak megelőznie, mivel az ilyen alapanyagok különböző, az adott anyag eredete függvényében mikroorganizmusokra nézve toxikus anyagot tartalmazhatnak, így ezek eltávolítása vagy kívánt szintre, koncentrációra csökkentése szükségszerű lehet. Ez természetesen nem csak a fotofermentáció, hanem a többi eljárás esetében is igaz.
Emellett előkezelés abban az esetben is kívánatos, ha a szubsztrát optikai tulajdonságai nem megfelelőek (szín, opálosság, turbiditás), mert ez csökkenti a folyamathoz esszenciálisan szükséges fény reaktortérbe való bejutásának hatékonyságát. Ebből adódóan az ilyen típusú reaktorokban egyrészt nem célszerű túl magas biomassza koncentrációval dolgozni, másrészt a reaktorok konstrukciójakor nem elhanyagolhatóak a geometriai megfontolások, vagyis törekedni kell a minél kisebb keresztmetszet elérésére, annak érdekében, hogy a megvilágító fény útja, s ez által a fény intenzitás csökkenése minél kisebb mértékű legyen a bioreaktor belseje felé haladva. Az ezen a területen elért sikerek ellenére még sok munka, számos
19
kihívás vár a kutatókra és mérnökökre annak érdekében, hogy ipari méretekben, a gazdasági szempontoknak is megfelelő eljárást dolgozzanak ki. Erre az eljárásra jelenleg úgy tekinthetünk, amely kiegészítő megoldásként szolgálhat valamilyen más eljáráshoz (pl. sötét fermentáció) csatoltan, növelve így a teljes folyamat hatékonyságát [Eroglu, 2011; Reith, 2003].
Előnyök:
- felhasználható szubsztrátok köre széles - napenergia hasznosítása
- magas hozamok érhetők el - nem keletkezik oxigén
- amennyiben a szubsztrát megújuló forrásból származik, úgy nincs nettó CO2 kibocsátás Hátrányok:
- alacsony hidrogéntermelési ráta - alacsony fénykonverziós hatékonyság
- költséges bioreaktor tervezés és üzemeltetés, nagy területszükséglet - nitrogenáz enzim jelentős ATP szükséglete
3.1.4. Sötét fermentáció
Ebben a folyamatban különféle heterotróf, fakultatív (pl. Enterobacteriaceae) ill.
obligát (pl. Clostridiaceae) anaerob baktériumok játszanak szerepet, melynek során napenergia közvetlen felhasználása nélkül, a különféle szerves anyagokból (pl. glükóz, keményítő, cellulóz, stb.) oxigénmentes körülmények között H2, CO2 és különféle szerves komponensek, melléktermékek keletkeznek [Levin, 2004; Das, 2001, 2008; Hallenbeck, 2009a].
szerves anyag H2 + CO2 + szerves melléktermékek
A hidrogénképződés alapvetően 2 fajta mechanizmus szerint játszódhat le. Obligát anaerob szervezetek esetén a beadagolt szubsztrát (pl. glükóz) lebontása során elsőként piruvát és NADH keletkezik. A képződött piruvát ezt követően a piruvát-ferrodoxin- oxidoreduktáz (PFOR) enzim által katalizált reakcióban acetil-KoA-vá és CO2-vé alakul, majd az acetil-KoA acetil-foszfáttá konvertálódik, miközben acetát és ATP képződik.
20
A piruvát acetil-KoA-vá oxidációja a ferrodoxin (Fd) redukciójával valósul meg. A redukált állapotú Fd a hidrogenáz által katalizált hidrogénképződés során oxidálódik újra. További hidrogéntermelés érhető el NADH-ból kiindulva, ez az útvonal azonban csak extrém alacsony hidrogén parciális nyomás (<60 Pa) mellett aktivizálódik [Mathews, 2009].
3.1.4.1. ábra –Hidrogéntermelő metabolizmus Clostridium baktériumokban [Mathews, 2009]
A 3.1.4.1. ábrán megfigyelhető, hogy attól függően, milyen mellékterméket eredményez a fermentáció, a hidrogén más-más hozammal (mol H2/mol glükóz) keletkezik.
Amennyiben acetát a végtermék, úgy a maximális hozam 4 mol H2/mol glükóz [Hawkes, 2002]:
C6H12O6 + 2 H2O 2 CH3COO- + 2 H+ + 2 CO2 + 4 H2
Ha acetát helyett butirátban végződik a folyamat, akkor a hozam maximális értéke 2 mol H2/mol glükóz [Hawkes, 2002]:
C6H12O6 CH3CH2CH2COO- + H+ + 2 CO2 + 2 H2
Fontos megjegyezni, hogy laktát és propionát képződése nem vezet hidrogénképződéshez, vagyis ezek keletkezése minél inkább megelőzendő. A propionát képződés során hidrogén felhasználás történik az alábbi reakcióegyenletnek megfelelően [Hawkes, 2002]:
C6H12O6 + 2 H2 2 CH3CH2COO- + H+ + 2 H2O
21
A fakultatív anaerob mikroorganizmusok hidrogéntermeléssel összefüggő anyagcsere folyamatait a későbbiekben, az E. coli hidrogéntermelése kapcsán mutatom be.
Előnyök:
- fény jelenléte nem szükséges
- a felhasználható szubsztrátok, szerves anyagok köre széles (pl. mezőgazdasági hulladékok is). Hulladék anyagok használatával egy lépésben valósíthatjuk meg mind a hulladékok környezetbarát kezelését, mind pedig a megújuló energia előállítását.
- egyszerűbb reaktortechnika, olcsóbb üzemeltetés, mint a fotobioreaktorok esetében, nincs nagy területhasználati igény
- nagy gázképződési sebesség. A szakirodalomban fellelhető legnagyobb volumetrikus képződési gázáram értéke 15 L H2 L-1h-1, melyet 2006-ban publikálták [Wu, 2006]. Ezt mezofil körülmények között, Clostridiaceae által dominált, granulált iszappal sikerült elérni.
- nem keletkezik oxigén
- amennyiben a szubsztrát megújuló forrásból származik, úgy nincs nettó CO2 kibocsátás Hátrányok:
- Relatíve alacsony H2 hozam (fotofermentációs eljárásokhoz képest). Az előnyök között említett 360 L H2 L-1d-1 eddig elért legnagyobb fajlagos képződési gázáram is csupán 3.5 mol H2/mol szacharóz hozammal párosult, mely az elméleti maximum 44%-a.
- Energiadús melléktermékek képződése (pl. acetát, etanol, butirát, butanol, aceton, propionát, laktát, szukcinát)
A 3.1.4.1. táblázatban feltüntetett adatok alapján az látható, hogy a biológiai módszerek között a sötét fermentációs eljárások igen vonzó alternatívát kínálnak [Krupp, 2009].
3.1.4.1. táblázat – Adott teljesítményű üzemanyagcella működtetéséhez szükséges bioreaktor mérete a különböző biohidrogén előállító módszerek alkalmazásával [Krupp, 2009]
22
A sötét fermetációs hidrogéntermeléshez kapcsolódó eddigi kutatások meghatározó részében főként az obligát anaerob Clostridiaceae (pl. C. paraputrificum, C. lentocellum, C.
bifermentans, C. saccharoperbutylacetonium, C. acetobutilicum, C. pasteurianum) és a fakultatív anaerob Enterobacteriaceae (pl. E. coli, E. aerogenes, E. cloacae) baktériumcsaládok képviselőit vizsgálták, alkalmazták biohidrogén termelésre.
Előbbi csoportba tartozó mikroorganizmusok előnye, hogy hidrogéntermelő képességük általában meghaladja az Enterobacteriaceae-ét, s spórákat képezve hatékonyan tudják átvészelni a kedvezőtlen környezeti körülmények (pH, hőmérséklet, stb.) fennállását, majd azok normalizálódása esetén ismét szaporodásnak indulnak. Emellett azonban extrém módon érzékenyek az oxigénnyomokra is, így alkalmazásuk során tökéletesen anaerob környezetet kell biztosítani, ami azonban pl. ipari méretekben nehezen megoldható, valamint hidrogéntermelő aktivitásukat a fermentorban akkumulálódó hidrogén parciális nyomása jelentősen képes befolyásolni [Hallenbeck, 2009b].
Utóbbiak, vagyis az Enterobacteriaceae baktériumok viszonylag gyorsan szaporodnak, jellemzően alacsony-közepes, 1-2 mol H2/mol glükóz hozam értékek elérésére képesek [Wang, 2009a]. Előnyük, hogy ezek a fakultatív anaerob mikroorganizmusok kevésbé érzékenyek az oxigén okozta inhibícióra, hiszen képesek annak gyors és hatékony kivonására a rendszerből, s ezt követően visszatérni a hidrogéntermelő életmódra [Yokoi, 2001; Ogino, 2005].
Az eddigiekből következően célszerű lehet ezen mikrobákat kevert tenyészetekben alkalmazni, ahol a Clostridiumok hatékony hidrogéntermelését kiegészítheti az Enterobaktériumok oxigénelimináló (és hidrogéntermelő) képessége.
A szóbanforgó baktériumokkal a legtöbb vizsgálatot monokultúrás tenyészetekkel, szakaszos kísérletekben, egyszerű szubsztrátokkal, főként glükóz, xilóz, keményítő végeztek.
Bár számos figyelemre méltó eredmény született, a mikrobák további tesztelése szükséges folyamatos üzemmódban működő fermentorokban, összetettebb szubsztrátok alkalmazásával, mivel az ilyen körülmények között végzett vizsgálatok sokkal jobban közelítik az ipari körülményeket, s így a kapott eredmények is jobban felhasználhatók egy technológia tervezése során [Hawkes, 2002; Hallenbeck, 2009b].
23
3.2. Lehetőségek a hidrogéntermelés hatékonyságának növelésére
Fejlett, mutáns törzsek létrehozása
A mikroorganizmusok egyedi jellemzőinek megfelelően a reaktorba betáplált szubsztrátok a kívánatostól eltérően többféleképpen is metabolizálódhatnak, vagyis felhasználásuk nem kizárólag hidrogénképződésre fordítódik, tehát ezek a mellékreakciók csökkenthetik az elérhető hozamok értékét. A kompetitív útvonalaknak a gátlásával, metabolikus mérnökséggel olyan fejlett, mutáns egyedek hozhatók létre, melyek pl. jóval nagyobb hozamok és gázképződési sebességek biztosítására képesek. A metabolikus mérnökség a fejlett molekuláris biológia és genetika eszköztárát alkalmazza a sejtben lejátszódó reakcióutak módosítására, bizonyos anyagok (pl. H2) termelésének fokozására vagy csökkentésére. A biomérnöki módszerek segítségével csökkenthető pl. a hidrogenázok oxigénérzékenysége, növelhető a hasznosítható szubsztrátok köre (pl. lignocellulóz, pentózok, stb.). [Mathews, 2009; Nath, 2004; Hallenbeck, 2009b; Lee, 2010].
Fermentációs paraméterek optimalizálása
A fermentációs paraméterek változtatásával befolyásolhatjuk az adott mikroba, mikrobakonzorcium anyagcseréjét, vagyis a megfelelő kombinációk beállításával a folyamat hatékonysága növelhető. A hidrogéntermelést meghatározó kulcsparaméterek optimalizálásán keresztül a fajlagos képződési gázáram és hozam értékek növelhetők. Ilyen paraméterek lehetnek az alkalmazott mikroba/mikrobák típusa(i), pH, hőmérséklet, szubsztrát anyagi minősége, tápoldat összetétele, térfogati szerves anyag terhelés (OLR: Organic Loading Rate), a reaktor típusa (CSTR, UASB, stb.) és üzemmódja (szakaszos, rátáplálásos, folyamatos, stb.), a tartózkodási idő, a keverés sebessége és módja, stb. A megfelelő keverés fontos a folyadékfázis homogenitásának biztosítására, emellett az is megfontolandó, hogy mechanikus vagy gázbuborékoltatásos keverést célszerű-e alkalmazni. Ipari méretekben az utóbbi gazdaságosabb megoldás lehet, másrészt használatával elkerülhető a túlságosan nagy nyíróerők kialakulása, melyek károsíthatják a sejteket.
24
A hidrogéntermelés általában csökkenésnek indul, ha a sejtek szakaszos üzemmódban elérik a stacioner szaporodás fázisát. Folyamatos rendszerek kialakításával elérhető, hogy a reaktorban lévő biomassza tömegben az exponenciális szaporodás szakaszában lévő sejtek legyenek dominánsak [Eroglu, 2011; Wang, 2009a].
3.3. Fermentációs hidrogéntermelés Escherichia coli-val
Biohidrogén termelésre minden olyan mikroorganizmus képes, amely megfelelő enzimekkel rendelkezik, s ezek közé tartozik többek között az Enterobacteriaceae baktérium család képviselője, az Escherichia coli (a továbbiakban E. coli) (3.3.1. ábra) is, amely egy mezofil, fakultatív anaerob, pálcika alakú mikroba. Megtalálható pl. az emberi emésztőrendszerben is, ahol a vastagbél falára tapadva képezi a normál bélflóra fontos részét.
3.3.1. ábra – Az E.coli elektronmikroszkópos képe
Az E. coli széleskörűen alkalmazott a biokémiai, molekuláris biológiai kutatásokban, s ebből következően kiterjedt szakirodalom áll róla rendelkezésre, amelyből ismert az is, hogy különböző szerves alapanyagokon pl. glükóz, hangyasav (avagy sói a formiátok), stb.
szaporodva sötét fermentációs útvonalon, ún. kevert savas erjedéssel hidrogéntermelésre képes. Több kutatás rámutatott arra, hogy a lehetséges szubsztrátok körében a hangyasav (vagy sója a formiát) olyan alapanyag, amely alkalmas lehet arra, hogy felhasználásával hatékony biohidrogén termelő rendszereket lehessen kialakítani [Yoshida, 2005, 2007].
Természetesen ezek a rendszerek csak akkor lehetnek igazán hatékonyak és válhatnak egyszer széles körben elterjedtté, ha a felhasznált alapanyagokat képesek vagyunk megújuló forrásokból biztosítani.
25
Szerencsére az elmúlt néhány évben sikeresen dolgoztak ki olyan eljárásokat, amelyek lehetővé teszik már pl. nemcsak a glükóz, hanem a hangyasav közvetlenül biomasszából (vagyis akár mezőgazdasági hulladékokból), mint olcsó alapanyagból történő előállítását is [Yun, 2010].
Az E. coli-ban lejátszódó hidrogéntermelés úgynevezett kevert savas fermentációval (mixed-acid fermentation) formiáton, mint kulcs-szubsztráton keresztül játszódik le, mely mechanizmus a fakultatív anaerob szervezetekre általában jellemző.
Ha a sejt anaerob körülmények közé kerül, a cukor lebontásból keletkező piruvát legnagyobb részéből a piruvát-formiát-liáz (PFL) segítségével formiát és acetil-KoA keletkezik. Az acetil-KoA további lebomlása acetátot és etanolt eredményez, míg a piruvát egy másik része pedig laktáttá alakul. Oxigén és nitrát, mint elektron akceptorok hiányában a NADHNAD+ átalakulás alternatív úton kell, hogy végbemenjen, így anaerob körülmények között a glikolízishez esszenciálisan szükséges folyamatos NAD+ áram fenntartásában a laktát, etanol és szukcinát képződése játszik szerepet, mivel ezek képződése NAD+-t eredményez, míg az acetát termelés során ATP keletkezik [Mathews, 2009].
A piruvátból keletkező formiát további lehetséges átalakulási útvonala a hidrogén és szén-dioxid gáz képződése enyhén savas (6<pH<7) körülmények között:
HCOO- + H2O = H2 + HCO3-
Az E. coli ugyanakkor nemcsak H2 előállításra, hanem a (megtermelt) hidrogén felvételére (oxidációjára) is képes. Ebben a baktériumban négy különböző [NiFe]-tartalmú hidrogenáz enzimet azonosítottak, melyek közül az 1-es (Hyd-1) és 2-es (Hyd-2) hidrogenázok elsősorban a H2 felvételért felelősek, míg a 3-as (Hyd-3) és 4-es (Hyd-4) hidrogenázok a sejtmembrán belső oldala felé orientálódó enzim komplexek részeiként a H2
képződést katalizálják. A Hyd-3 a formiát-dehidrogenáz (FDH-H) enzimmel együtt alkotja az enyhén savas pH-n aktív formiát-hidrogén-liáz (FHL-1) enzim komplexet. A Hyd-4 az FHL-2 komplex része, amely enyhén lúgos pH-n szintén képes hidrogén előállításra, mindazonáltal a Hyd-4 aktivitása vad-típusú sejtekben elhanyagolható [Mathews, 2009; Sawers, 2005;
Skibinski, 2002; Self, 2004].
Az E. coli hidrogéntermeléssel összefüggő anyagcsere útjait a 3.3.2. ábra mutatja.
26
3.3.2. ábra – Az E. coli hidrogéntermelő metabolizmusa [Mathews, 2009]
3.4. Az Escherichia coli hidrogenázainak, hidrogén metabolizmusának részletes bemutatása
Az E. coli a hidrogenáz bioszintézis kutatásainak egyik modellorganizmusa. Négy membránkötött hidrogenáza van, ami szinte egyedülálló a mikrobák között. A Hyd-1 és Hyd- 2 respirációs folyamatokhoz kapcsolódó hidrogenáz, míg a Hyd-3 és az utoljára, nagy erőfeszítésekkel kutatott Hyd-4 a formát metabolizmushoz kapcsolt s mindkettő egy ún.
formiát-hidrogén-liáz komplex része [Sawers, 1994; Andrews, 1997]. A hidrogenázok poszttranszlációs érési folyamatának jelentős részét a Hyd-3 fehérjén keresztül ismerték meg.
Ahhoz, hogy az E. coli hidrogéntermelő képességét maximalizáljuk, szükséges megismerni az egyes hidrogenázokat, azok bioszintézisének körülményeit, valamint az enzimek fiziológiás szerepét.
Hyd-1 és Hyd-2
A Hyd-1 egy klasszikus hidrogén felvevő enzim, melyet a hyaABCDEF policisztronos operon kódol [Sawers, 1994; Redwood, 2008]. Két struktúrális alegységből, a kis és nagy alegységből áll (HyaAB), amihez egy harmadik transzmembrán citokróm b típusú fehérje kapcsolódik (HyaC). A többi alegység a bioszintézisben játszik szerepet. A felépítésből már valószínűsíthető, hogy a Hyd-1 egy hidrogénoxidáló enzim, amely a H2 oxidációjából származó elektronokat a CytB segítségével a kinon raktár redukciójára fordítja és végső soron
27
valamilyen terminális elektron akceptorra kerül. Az enzim expresszióját az oxigén és a nitrát is gátolja annak ellenére, hogy az enzim hidrogén oxidációja kapcsolható a nitrát illetve oxigén redukciójához [Laurinavichene, 2001a].
Ez utóbbi széles oxigénkoncentrációs tartományban is működik. Az enzim fiziológiás szerepéről számos javaslat látott napvilágot, egyes kutatások szerint feladata a Hyd-3 hidrogenáz által termelt hidrogén visszaforgatása [Redwood, 2008], mások szerint inkább hidrogén szenzorként funkcionál [Laurinavichene, 2001b]. Ezek alapján úgy tűnik, hogy a Hyd-1 mindenképpen egy hidrogénoxidáló enzim, a biohidrogén termelésben való szerepe inkább negatív, azonban ezt a képet kicsit megváltoztatta az utóbbi évek azon felfedezése, hogy az E. coli a glicerin fermentálás során képes hidrogént termelni és semleges pH-n ebben a Hyd-1 is szerepet játszhat [Trchounian, 2009].
A Hyd-2 egy bonyolult, egyedi struktúrával rendelkező enzim, melyet a hybOABCDEFG operon kódol [Sawers 1994, Redwood, 2008]. Nemcsak az enzim szerkezete, hanem a gének szerveződése is különleges, ugyanis a kis (HybO) és a nagy (HybC) alegység génje közé két fehérjét kódoló gén ékelődik, melyek valószínűsíthetően egy membránkötött redox-dimer részei. Az enzim, a Hyd-1-hez hasonlóan szintén a hidrogénfelvétel iránya mutat nagyobb aktivitást, a hidrogén oxidációja ebben az esetben is kapcsolható az oxigén és a nitrát redukciójához, igaz az előbbi csak alacsony oxigén parciális nyomás esetén működik. Korábbi elképzelések szerint az enzim fiziológiás szerepe az anaerob respirációs folyamatokhoz kapcsolható, melyek közül is a fumarát, mint terminális elektron akceptor kapott kiemelt szerepet.
Az eddigiek alapján következtetésként elmondható, hogy a Hyd-1 és Hyd-2 hidrogénfelvevő hidrogenázok, a biohidrogén termelésben – cukor fermentálás során – nem tudnak részt venni, jellemzően inkább a formiát-hidrogén-liáz (FHL) által termelt hidrogén visszaalakításában van szerepük. A legújabb kutatások azonban kimutatták, hogy a Hyd-1 illetve Hyd-2 képes semleges pH-n, glicerin fermentáció során hidrogént termelni, a pH csökkentése (pH=5.5), azonban az aktivitásuk megfordulásával jár (3.4.1-3.4.2. ábra) [Trchounian, 2009, 2011, 2012a, 2012b].
Hyd-3 és Hyd-4
A Hyd-3-at a hycABCDEFGHI operon kódolja [Sawers 1994, Redwood, 2008]. A HycG és HycE az enzim kis és nagy alegysége, a HycB és HycF elektrontranszfer alegységek, a HycC és HycD membránfehérjék, a HycH egy hidrofil fehérje, a HycI pedig a
28
poszttranszlációs érésben játszik szerepet. A HycA egy transzkripciós faktor, melynek deléciója megnövekedett hidrogéntermelést eredményez.
A Hyd-3 hidrogenáz működése a formiát-dehidrogenázhoz (FDH-H) kapcsolt és együtt képezik az ún. formiát-hidrogén-liáz (FHL-1) komplexet, mely a formiát oxidációját hidrogéntermeléssel egybekötve katalizálja. A folyamat nem kapcsolódik energiatermeléshez (ATP), sőt mivel hidrogén távozik a rendszerből jelentős energiaveszteséget jelent a sejteknek [Bagramyan, 2002]. A komplex fiziológiás szerepe a sejtek számára toxikus hangyasav (v.
formiát) eltávolítása. Az enzim elsősorban enyhén savas illetve semleges körülmények között mutat aktivitást, de külsőleg hozzáadott formát hatására még alkalikus körülmények között is domináns FHL komplexszé válik.
1997-ben jelent meg a hír, hogy az E. coli rendelkezik egy negyedik hidrogenáz enzimmel (Hyd-4) is [Andrews, 1997], melynek ekkor még csak a génjeit azonosították (hyfABCDEFGHIJR). Az operonnak három új komponense van, ezek a hyfDEF gének, melyek olyan membránkötött fehérjéket kódolnak, melyek hasonlóak a respirációs komplex (NAD-ubikinon-oxidoreduktáz) alegységeihez. Később sikerült olyan aktivitást kimutatni, mely ehhez az enzimhez kapcsolható, és kiderült, hogy ez is egy FDH-H-hoz kapcsolódik, így alkotva egy másik formiát-hidrogén-liáz (FHL-2) enzim komplexet, mely alkalikus körülmények között rendelkezik aktivitással [Bagramyan, 2002]. Ezen felül megállapították azt is, hogy ez az aktivitás ATP szintézishez kapcsolt, tehát egy olyan formiát-hidrogén- liázról van szó, mely képes a sejtek számára energiát (ATP-t) generálni. Az FHL-2 speciális esetben (glicerin fermentáció, savas pH) képes a hidrogén oxidációjára is.
Mindazonáltal világossá vált, hogy még lúgos közegben is az FHL-1 a domináns enzim, amennyiben külső forrásból formiátot adunk a rendszerhez, s így elmondható, hogy az E. coli elsődleges, formiátból hidrogént termelő enzime az FHL-1. Ha glükózt használunk szubsztrátként pepton háttéren, akkor pH=7.5-n a Hyd-3 és a Hyd-2 aktivitása meghatározó: a Hyd-3 hidrogénfejlesztő, míg a Hyd-2 hidrogénoxidáló irányban működik [Trchounian, 2012].
Összefoglalva, kevert savas fermentáció során érdemes olyan törzsekkel dolgozni, melyek a két, respirációhoz kapcsolt, membránkötött hidrogenázt (Hyd-1, Hyd-2) nem, de a formiát-hidrogén-liázokat (FHL-1, FHL-2) tartalmazzák.
29
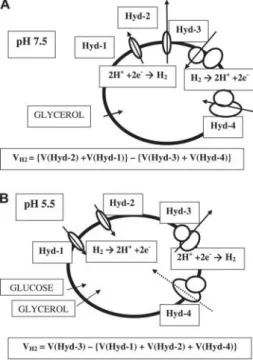
3.4.1. ábra – Az E. coli H2 termelő és fogyasztó enzimjeinek működése cukor vagy formiát (A) ill. glicerin (B) fermentáció során. A(H2): a sejtek hidrogéntermelő sebessége; A(Hyd):
az egyes hidrogenázok hidrogéntermelő vagy hidrogénoxidáló sebessége [Trchounian, 2009].
3.4.2. ábra – Az E. coli H2 termelő és fogyasztó enzimjeinek működése glicerin fermentáció során pH=7.5 (A) és pH=5.5 (B) mellett. VH2: a sejtek hidrogéntermelő sebessége; V(Hyd):
az egyes hidrogenázok hidrogéntermelő vagy hidrogénoxidáló sebessége [Trchounian, 2011].
30
3.5. Hatékony biohidrogén termelő rendszerek kialakítása
Ahhoz, hogy a hidrogén a jövő energiaforrása lehessen, azt környezetbarát módon, megújuló forrásokból kell előállítanunk, például nagyhatékonyságú biológiai rendszerek segítségével. A kérdés tehát az: hogyan, milyen lépéseken keresztül lehet ilyen bioreaktorokat kialakítani. Az ilyen rendszerek létrehozásának 3 fő lépése van:
1, Hidrogéntermelő mikroorganizmusok (vad-típusok) azonosítása.
2, A mikrobák biokémiai, fiziológiai sajátságainak megismerése, jellemzése, amely magában foglalhatja az egyes vad-típusú mikroorganizmusok genetikai, metabolikus módosításának lehetőségét is a nagyobb hidrogéntermelő képességű, hatékonyabb mutáns törzsek létrehozása érdekében.
3, Bioreaktorok tervezése és optimalizálása a – metabolikusan is akár módosított – mikrobák alkalmazásával.
Az utolsó lépést, vagyis a bioreaktorok optimalizálását illetően felmerül azonban az a probléma, hogy a vizsgálandó, optimalizálandó paraméterek száma általában nagy, így az optimális működési beállítások megtalálása sokszor nagyszámú és költséges kísérletek elvégzését igényli. A probléma megoldására – vagyis annak a célnak az elérésére, hogy lehetőleg az elvégzendő kísérletek számát csökkentve növeljük a reaktor teljesítőképességét is – alkalmazhatók a kísérlettervezésen alapuló optimalizálási módszerek.
3.6. A kísérlettervezés
Minden biotechnológiai eljárás esetében – s nincs ez másképp a biohidrogén fermentáció esetében sem – kiemelten fontos azoknak a paramétereknek a megtalálása, melyeket szabályozva, s optimális értékre beállítva az adott folyamat, rendszer (pl. bioreaktor) minél nagyobb hatékonysággal üzemeltethető. Ilyen tényezők lehetnek pl. a pH, a hőmérséklet, a fermentációs közeg (fermentlé) összetétele, anyagátadási viszonyok stb. A legtöbb esetben elmondható, hogy a vizsgálandó paraméterek száma az optimális rendszer beállítások meghatározásához nagy, az adott rendszerre vonatkozó tényleges kulcs
31
faktoroknak a kiválasztása és optimálása sokszor nagyszámú kísérlet elvégzését igényli, vagyis komoly idő- és költség faktorként jelentkezhet a biotechnológia kutatásokban, fejlesztésekben [Weuster-Botz, 2000]. Mivel a gazdasági- és időtényezők általában korlátozottak, törekedni kell arra, hogy adott problémát minél gazdaságosabban, minél rövidebb idő alatt képesek legyünk megoldani. Az eddigiekből következik, hogy az optimális működés feltételeit nem kereshetjük az összes lehetséges bemeneti (input) beállítás
„kipróbálásával”, hanem célszerű csak bizonyos, lehetőleg minél kisebb számú kísérleti beállítás mellett vizsgálódni, s így keresni az egyes input-output kapcsolatokat és az ezekből nyert információk alapján következtethetünk az általunk elérni kívánt optimális beállításokra.
Ezeket az elvégzendő kísérleteket, kísérleti beállításokat kell megtervezni úgy, hogy minimális költség- és időráfordítással maximalizáljuk a kinyerhető információk mennyiségét [Márkus, 2012]. Az említett problémák megoldásában nyújthatnak hatékony segítséget a különböző kísérlettervezésen alapuló optimalizálási módszerek. Ezek tulajdonképpen olyan (a matematikai statisztikához szorosan kötődő) eljárások, amelyek célja a valóság „kihámozása”
valamilyen mért vagy megfigyelt adatok alapján. Ezekkel a módszerekkel egy adott kísérletben szándékosan változtatunk egy vagy több faktort, s figyeljük annak hatását az elérni kívánt célt jellemző válasz változón. A kísérlettervezés során a vizsgált rendszert ún. „fekete doboznak” tekintjük, amikor is nem keresünk ok-okozati összefüggéseket, vagyis hogy mi miért történik, hanem egyszerűen kvantitatív összefüggést akarunk feltárni az egyes függő és független változók között [Kemény, 2000; Márkus, 2012].
3.7. A biohidrogén fermentáció kísérlettervezéssel történő optimalizálásának lépései
Ahhoz, hogy kísérlettervezéses alapon optimalizáljunk egy biohidrogén fermentációs eljárást, a következő 4 lépéses folyamaton célszerű végigmennünk [Kemény, 2000; Wang, 2009b]:
1, A lehetséges faktorok körének meghatározása, melyek befolyással lehetnek a kívánt cél elérésére pl. a fajlagos képződési gázáramra, a hozamra, stb. („Brainstorming”)
2, A tényleges hatótényező(k) meghatározása („Screening”) 3, A kulcsfaktor(ok) optimumának közelítése („Narrowing”) 4, Optimum érték(ek) meghatározása („Optimum search”)
32 A (szignifikáns) hatótényezők meghatározása
A vizsgálandó paraméterek nagy száma a valóságban nem feltétlenül jelenti azt, hogy az összes faktornak jelentős hatása lenne egy adott (optimalizálandó) válasz változóra. Az optimalizáláshoz kizárólag a szignifikáns változók a fontosak, mert ezek határozzák meg a rendszer, a folyamat valamilyen szempontú viselkedését, s ebből a megfontolásból az optimalizálás első lépése a legfontosabb változók körének meghatározása. A szakirodalom szerint a hidrogén fermentáció statisztikai alapon történő optimalizálása során a Plackett- Burman-féle, 2-szintes, faktoriális terv a leggyakrabban alkalmazott a kulcsváltozók kiválasztására. Ezzel a típusú tervvel max. n=N-1 db faktor hatását vizsgálhatjuk egy időben, ahol „n” a vizsgálandó faktorok száma; „N” a kísérletek száma (N≤100), vagyis az elvégzendő mérések száma mindig legalább eggyel több kell, hogy legyen, mint a faktorok száma, s az alap kísérleti beállítások számához hozzájöhet még néhány (általában 3) középpontbeli mérés is annak érdekében, hogy becsülhető legyen a szórás. Ezen fajta kísérleti terv alkalmazásakor úgy tekintjük, hogy abban az értéktartományban, ahol az egyes faktorokat vizsgáljuk, nem lépnek fel jelentős kölcsönhatások, így azok hatásainak vizsgálatától eltekintünk [Plackett, 1946; Weuster-Botz, 2000]. A mérési eredmények varianciaanalízissel (ANOVA) történő kiértékelésével a szignifikáns hatótényezők és azok hatásának irányai azonosíthatók [Wang, 2009b; Kuehl, 2000; Montgomery, 2005].
Optimum közelítés
A kulcsfaktorok kiválasztását követő fontos lépés azok tovább tanulmányozása, azok optimum környezetének megtalálása. Azokat a változókat, amelyek a “szűrés” szerint nem voltak szingifikáns hatással az adott válasz változóra, nem vizsgáljuk tovább, és legtöbbször azon az értéken rögzítjük, ahol számunkra kedvezőbb hatást váltottak ki. Az optimum közelítés során az előzetesen meghatározott kulcsváltozók faktorszint értékeit addig változtatjuk, ameddig a válasz változón számunkra kedvező (növekvő v. csökkenő) változás tapasztalható, vagyis amíg el nem érjük az egyes faktorok értékeinek olyan kombinációját, együttállását, ahonnan bármely irányba tovább lépve nem tapasztalunk további kedvező hatást, vagyis amíg elérjük az optimum környezetet [Wang, 2009b; Kuehl, 2000;
Montgomery, 2005].
33 Optimum keresés
Miután megtaláltuk az optimum intervallumot, fontos, hogy azon belül tovább vizsgálódjunk és megkeressük a válasz változó optimumához tartozó tényleges beállításokat, amihez (több kulcsváltozó esetén) a centrális kompozíciós és a Box-Behnken-féle tervek a leggyakrabban használatosak, míg csupán egy szignifikáns faktor optimalizálása a klasszikus módszer szerint történhet.
3.8. A baktériumok növekedésének kinetikája
Ha egy baktériumsejtet megfelelő környezetbe helyezünk, akkor egy adott ún.
lappangási időszakot követően az osztódásnak indul, miközben a kultúra egy adott maximális növekedési sebességet ér el, ez azonban csak bizonyos ideig tartható fenn, s egy időt követően lassulni kezd, végül pedig megáll. A mikroorganizmusok növekedését ezen növekedési sebességek változásai szerint több jellemző periódusra lehet felosztani [Nyeste, 1997;
Atkinson, 1992; Bailey, 1986]. Ha az élő egyedszámot (N) ill. az összes baktériumszámot az idő függvényeként ábrázoljuk, akkor az ún. növekedési v. szaporodási görbét kapjuk (3.8.1.
ábra).
3.8.1. ábra – A baktériumok növekedési görbéje [Búcsú, 2008]
![3.1.1.1. ábra – A direkt biofotolízis folyamata [Hallenbeck, 2009a]](https://thumb-eu.123doks.com/thumbv2/9dokorg/874557.47070/16.892.327.567.99.365/ábra-direkt-biofotolízis-folyamata-hallenbeck-a.webp)
![3.1.3.1. ábra – A fotofermentáció folyamata [Hallenbeck, 2002]](https://thumb-eu.123doks.com/thumbv2/9dokorg/874557.47070/18.892.370.576.285.509/ábra-a-fotofermentáció-folyamata-hallenbeck.webp)
![3.1.4.1. ábra –Hidrogéntermelő metabolizmus Clostridium baktériumokban [Mathews, 2009]](https://thumb-eu.123doks.com/thumbv2/9dokorg/874557.47070/20.892.280.620.234.462/ábra-hidrogéntermelő-metabolizmus-clostridium-baktériumokban-mathews.webp)
![3.1.4.1. táblázat – Adott teljesítményű üzemanyagcella működtetéséhez szükséges bioreaktor mérete a különböző biohidrogén előállító módszerek alkalmazásával [Krupp, 2009]](https://thumb-eu.123doks.com/thumbv2/9dokorg/874557.47070/21.892.259.633.1016.1137/teljesítményű-üzemanyagcella-működtetéséhez-szükséges-különböző-biohidrogén-előállító-alkalmazásával.webp)
![3.3.2. ábra – Az E. coli hidrogéntermelő metabolizmusa [Mathews, 2009]](https://thumb-eu.123doks.com/thumbv2/9dokorg/874557.47070/26.892.224.667.104.407/ábra-coli-hidrogéntermelő-metabolizmusa-mathews.webp)