DOKTORI (Ph.D.) ÉRTEKEZÉS
CSEH ANDRÁS ATTILA
PANNON EGYETEM GEORGIKON KAR
KESZTHELY
2010
A PARLAGFŰ GYOMBIOLÓGIAI VALAMINT EGÉSZSÉGÜGYI SZEMPONTBÓL LEGLÉNYEGESEBB TULAJDONSÁGAINAK
MOLEKULÁRIS GENETIKAI VIZSGÁLATA
NÖVÉNYTERMESZTÉSI ÉS KERTÉSZETI TUDOMÁNYOK DOKTORI ISKOLA
iskolavezető: Dr. Gáborjányi Richárd egyetemi tanár, az MTA doktora
témavezető: Dr. Taller János tudományos főmunkatárs
DOKTORI ÉRTEKEZÉS
Cseh András Attila Ph.D. hallgató
Keszthely 2010
A PARLAGFŰ GYOMBIOLÓGIAI VALAMINT EGÉSZSÉGÜGYI SZEMPONTBÓL LEGLÉNYEGESEBB TULAJDONSÁGAINAK
MOLEKULÁRIS GENETIKAI VIZSGÁLATA Írta:
Cseh András Attila
Készült a Pannon Egyetem Növénytermesztési és Kertészeti Tudományok Doktori Iskolája keretében
Témavezető: Dr. Taller János Elfogadásra javaslom (igen / nem)
………..
(aláírás) A jelölt a doktori szigorlaton …... % -ot ért el,
Keszthely, 2010.
………...
a Szigorlati Bizottság elnöke Az értekezést bírálóként elfogadásra javaslom:
Bíráló neve: …... …... igen /nem
…………..……….
(aláírás) Bíráló neve: …... …... igen /nem
…………...……….
(aláírás) A jelölt az értekezés nyilvános vitáján …...% - ot ért el
Keszthely,
………...……….
a Bíráló Bizottság elnöke A doktori (PhD) oklevél minősítése…...
………
Az EDT elnöke
Kivonat
A parlagfű (Ambrosia artemisiifolia L.) invazív gyom Európában és hatalmas egészségügyi és gazdasági károkat okoz. Magyarországon az elsőszámú gyomnövény és a pollene a legveszélyesebb allergének közé tartozik. A fentiek miatt célul tűztük ki, hogy a parlagfű származásának és terjedésének nyomonkövetésére anyai öröklésű markereket fejlesszünk, valamint a triazinokkal és az ALS-gátló herbicidekkel szembeni rezisztencia gyors DNS szintű kimutatását és az amb a I géncsalád pontosabb megismerését.
A különböző parlagfű populációk genetikai összehasonlításához a kloroplasztisz és mitokondrium nem kódoló régióit PCR-RFLP módszerrel vizsgáltuk. Az anyai öröklésű markerek alapján, az általunk vizsgált magyarországi parlagfüvek genetikai értelemben a kanadaiakhoz álltak közelebb, az USA-ból származók pedig távolabbi csoportot alkottak.
Az atrazin rezisztens és szenzitív parlagfüvek psbA génjét szekvenáltuk.
Bizonyítottuk, hogy a gén egyetlen pontmutációja felelős a rezisztencia kialakulásáért, hasonlóan más gyomnövényekhez. Restrikciós enzimeket és bi-PASA primereket használva kimutattuk, hogy a rezisztens parlagfüvekben a psbA gén szenzitív változata is megtalálható.
Magyarországi parlagfüvekből és a ’Nova’ napraforgó fajtából az ALS-gátló herbicidek célgénjének A és B régióját szekvenáltuk és elemeztük. Ha Magyarországon is megjelenne a rezisztens biotípus, akkor eredményeink felhasználásával a rezisztencia DNS szinten is igazolható.
A parlagfű pollen allergén fehérjéjét kódoló amb a I gén első felét amplifikáltuk szekvencia specifikus primerekkel magyarországi parlagfüvekből. Szekvencia specifikus primerekkel nem sikerült felszaporítanunk a teljes gént, így közvetve bizonyítottuk a gén változékonyságát és azt, hogy a parlagfű genomban több helyen kódolt az Amb a I fehérje.
ABSTRACT
Common ragweed (Ambrosia artemisiifolia L.) is an invasive weed in Europe, causing important economic and public health damage. Ragweed is the most widespread weed in Hungary and is recognized as the most dangerous pollen allergen.
For these reasons, the aims of the present study were to reveal the origin and sperad of ragweed by developping maternally inherited markers and to detect the resistance against triazine and ALS–inhibitor herbicides at the DNA level and to expand knowledge involving the amb a I gene family.
In order to compare different ragweed populations non coding regions of the chloroplast (cp) and mitochondrial (mt) DNA of common ragweed were analysed by PCR-RFLP. It was demonstrated that the analysed ragweed plants, collected from Hungarian populations, may have originated from Canada, rather than the United States.
The psbA chloroplast gene of atrazine-resistant and susceptible A. artemisiifolia plants were sequenced. It was demonstrated that the atrazine resistance of ragweed is caused by a single point mutation in the gene, similarly to other weeds. Restriction enzyme analysis and bi-PASA primers detected both the atrazine-resistant and susceptible types of the psbA gene in atrazine-resistant plants.
Regions A and B of the ALS gene (the target gene of ALS-inhibitor herbicides) of Hungarian ragweed plants and that of the sunflower cultivar ‘Nova’ were also sequenced in the present study. Our results make it possible to confirm the ALS resistance in the case that the resistant biotype appears in Hungary.
Sequence-specific primers were used to amplify the Amb a I gene, which encodes the major allergen of the ragweed pollen with the objective to define polymorphic gene variants in the Hungarian populations. Sequence specific primers did not amplified the complete gene, so the polymorphism of the gene was prouved indirectly and also that the Amb I protein is encoded by multiple loci.
ABSTRACT
L ADN chloroplastique et mitochondrial de l’ambroisie á feuilles d'armoise (Ambro- sia artemisiifolia L.), faisant partie des especes envahissantes et posant d'importants problemes a la santé humain, avait etait analysé par PCR-RFLP. La detection des variable regions de l’ADN chloroplastique et mitochondrial aide a charactériser les relations genetiques entre differents populations. Ces analyses ont confirmé que les plantes d’ ambroisie de la population hongroise sont plus proches de la poplulation de Canada plutot que des Etats Units.
Un gene chloroplastique (psbA ) a été amplifié et sequencé ce qui a révélé que l’
atrazine tolérance de l’ambroisie est la conséquence d’ une point-mutation dans ce gene.
Restriction enzymes et PASA primaires paires ont demonstré que les plants resistants a l’atrazine contient les deux formes (resitant et sensitives) de la psbA gene.
L’ ALS gene (le target gene des ALS-inhibitor herbicides) de l’ambroisie hongroise et de tournesol NOVA ont été analyses dans le présent travail. La region A et B de l’ALS gene étaient sequencés pour les comparer avec les populations americains.
Sequence-specifiques primaires etaient utilisés pour analyser l’Amb a I gene, qui est responsable pour le majeur allergen de l’ambroisie pour obtenir les gene-variétés dans la population hongroise.
Rövidítések Jegyzéke
ALS: Acetolaktát-szintetáz
bp: bázispár
cDNS: complementary DNS
cpDNS: kloroplasztisz DNS
EDTA: Ethylen-diamine tetra-acetic acid IPTG: isopropyl-beta-D-thiogalactopyranoside
knt: kilonukleotid
mtDNS: mitokondrium DNS
nt: nukleotid
PASA: PCR Amplification of Specific Alleles PCR: Polymerase Chain Reaction
RAPD: Random Amplified Polymorphic DNA RFLP: Restriction Fragment Length Polymorphism
SSR: Simple Sequence Repeat
SNP: Single Nucleotide Polymorphism
X-Gal: 5-bromo-4-chloro-3-indolyl-b-D-galactopyranoside
Tartalomjegyzék
1.
BEVEZETÉS ÉS CÉLKITŰZÉSEK
...111.1. Célkitűzések...14
2. IRODALMI ÁTTEKINTÉS
...152.1. A gyom fogalma...15
2.2. A parlagfű (Ambrosia altemisiifolia L.) általános jellemzése...15
2.2.1.Morfológia és taxonómia...15
2.2.2. Származása és elterjedése...17
2.2.3. Szaporodásbiológiája...19
2.2.4. A parlagfű kórokozói...21
2.5.5. A parlagfű ellen alkalmazott védekezési eljárások...22
2.3. A kloroplasztisz és mitokondrium genom sajátosságai...23
2.3.1. A kloroplasztisz-genom...24
2.3.2. A mitokondriális genom...25
2.4. Molekuláris genetikai vizsgálati módszerek és molekuláris markerek...25
2.4.1. Restrikciós fragmentumhossz polimorfizmus (RFLP)...25
2.4.2. Polimeráz láncreakció (PCR)...26
2.4.3. Szekvencia specifikus primerek (SCAR)...26
2.4.4. PCR-RFLP...26
2.4.5. PASA (PCR amplification of specific alleles)...26
2.4.6. Bi-PASA (bidirectional-PASA)...27
2.5. A Genetikai távolság értékelése...27
2.6. A triazin-rezisztencia...28
2.6.1. Az 1,3,5-triazinok rövid jellemzése...28
2.6.2. A triazin-rezisztencia mechanizmusa és öröklődése...29
2.6.3. A parlagfű atrazin-rezisztens biotípusának elterjedése Magyarországon...31
2.7. Az acetolaktát–szintetáz (ALS) működést gátló herbicidekkel szembeni rezisztencia...32
2.7.1. Az ALS-gátló herbicidek rövid jellemzése...32
2.7.2. Az ALS-gátlókkal szembeni rezisztencia mechanizmusa és öröklődése a gyomnövényekben...32
2.8. A parlagfű pollenallergia és az Amb a I géncsalád...34
3. ANYAGOK ÉS MÓDSZEREK
...353.1. Növényanyag...35
3.1.1. A filogenetikai összehasonlításra használt egyedek...35
3.1.2. A triazin rezisztencia molekuláris genetikai vizsgálatához felhasznált növények ...35
3.1.3. Acetolaktát–szintetáz (ALS) működést gátló herbicidek célgénjének szekvenálásánál vizsgált növények...36
3.1.4. Az Amb a I géncsalád vizsgálatánál tesztelt növények...36
3.2. Molekuláris vizsgálatok...36
3.2.1. DNS izolálás...36
3.2.2. DNS amplifikálása polimeráz láncreakcióval (PCR)...37
3.2.2.1. A kloroplasztisz és mitokondrium genom vizsgálata...38
3.2.2.2. A psbA gén felszaporítása restrikciós emésztéshez és szekvenáláshoz...40
3.2.2.3. A psbA gén allél specifikus felszaporítása Bi-PASA (bidirectional-PCR amplification of specific alleles) primerekkel...41
3.2.2.4. Az ALS-A és ALS-B fragmentum amplifikálása...41
3.2.2.5. Az Amb a I géncsalád vizsgálata specifikus primerekkel...41
3.2.3. Restikciós enzimek használata...43
3.2.3.1. A kloroplasztisz és mitokondrium DNS-ének PCR-RFLP vizsgálata...43
3.2.3.2. A psbA gén rezisztenciát okozó pontmutációjánál vágó enzimek...43
3.2.4. DNS elválasztás gélelektoforézissel és értékelés...43
3.2.5. DNS fragmentumok tisztítása gélből...44
3.2.6. Klónozás és szekvenálás...44
3.2.7. A filogenetikai és a szekvencia adatok értékelése...45
4.
EREDMÉNYEK
...474.1. A parlagfű populációgenetikai viszgálata PCR-RFLP módszerrel fejlesztett anyai öröklésű markerek segítségével ...47
4.2. Herbicid célgének és rezisztenciát okozó mutációk jellemzése a parlagfűben...52
4.2.1. Az atrazin-rezisztencia molekuláris genetikai vizsgálata...52
4.2.1.1. A psbA gén rezisztens és fogékony alléljának kimutatása...55
4.2.2. Az ALS-gátlókkal szembeni rezisztencia molekuláris genetikai vizsgálata...60
4.3. A parlagfű pollen fő allergénjét kódoló Amb a I géncsalád vizsgálata szekvencia specifikus primerekkel...65
5.
KÖVETKEZTETÉSEK ÉS JAVASLATOK
...685.1. Parlagfű populációk genetikai összehasonlítása...68
5.2. A parlagfű triazin-rezisztenciájának molekuláris genetikai háttere...70
5.3. A parlagfű ALS-gátló herbicidekkel szembeni rezisztenciája...71
5.4. Az Amb a I géncsalád molekuláris genetikai vizsgálata szekvencia specifikus primerekkel...73
6.
ÖSSZEFOGLALÁS
...757.
Irodalomjegyzék
...778.
Új tudományos eredmények
...879.
KÖSZÖNETNYILVÁNÍTÁS
...9010.
Az értekezés témakörében megjelent publikációk, előadások
...9111.
Mellékletek
...951. Bevezetés és célkitűzések
Az ürömlevelű parlagfű (Ambrosia artemisiifolia L.) hatalmas humán egészségügyi és gazdasági károkat okoz Magyarországon. Ennek a problémának a nagyságát jelzi, hogy 2004 óta kormányzati szintre emelkedett a parlagfű elleni küzdelem. Megalakult a
"Parlagfűmentes Magyarországért" Tárcaközi Bizottság, melynek célja a parlagfű elleni harc irányítása, koordinációja. A bizottság állásfoglalása szerint a parlagfű borítottság és ezzel együtt a parlagfű pollenkoncentrációjának a csökkentését csak az egész társadalom szervezett erőfeszítéseivel, anyagi, szellemi erőforrásainak, egyéni kezdeményezéseinek mozgósításával és hatékony felhasználásával lehet elérni.
Az utóbbi néhány évtizedben a parlagfű szó szerint meghódította a Kárpát-medencét, és úgy tűnik inváziójának egyik égtáj irányában sem sikerül gátat vetni. E gyors terjedés legkellemetlenebb mellékhatása a pollen által kiváltott allergia, amitől már minden negyedik-ötödik honfitársunk szenved (Makra és mtsai 2004). Emellett, a parlagfű irtására vonatkozó szigorú rendelkezések ellenére, az A. artemisiifolia az utóbbi években a legelterjedtebb gyomnövényünkké vált.
Növényvédelmi szempontból meghatározó kérdés a mezőgazdasági termelésben a gyomirtás. Az éves növényvédőszer felhasználás nagy részét a herbicidek teszik ki. A gyomszabályozást többek között a gyomflóra dinamikus változása és herbicidrezisztens változatok megjelenése nehezíti.
Jól ismert jelenség az új fajok megjelenése, egyes gyomfajok előretörése, ökológiai illetve termesztéstechnológiai változás vagy emberi beavatkozás hatására egy adott ökoszisztémában. Ezt figyelhettük meg a parlagfű Európába, és közelebbről a Kárpát-medencébe való behurcolása esetében is, amit jól alátámasztanak az országos gyomfelvételezések adatai. Az A. artemisiifolia 1947–53 között a borítottságot tekintve 0,39 százalékkal még csak a 21. volt, de az 1996–1997. évi felvételezésen 4,7 százalékkal a fontossági sorrendben már az első helyen végzett. A legújabb 2007-2008.
évi Országos Szántóföldi Gyomfelvételezés szerint 5,3 %-ra nőtt a borítása.
A parlagfű európai megtelepedése, hogy egy vagy több centrumból indult ki, illetve terjedésének pontos útvonala sem ismert. Az invázió nyomonkövetése érdekes lehetne gyombiológiai és növényvédelmi szempontból egyaránt. Ezeknek a nehéz kérdéseknek a megválaszolásához nyújthatnak segítséget az egyes régiókra, biotípusokra jellemző molekuláris markerek. A parlagfű kizárólag magokkal szaporodik, ezért célravezető az
anyai öröklésű kloroplasztisz és mitokondrium specifikus markereket használni a terjedés nyomonkövetésére, a megbízhatóság és a nukleáris genomnál egyszerűbb vizsgálhatóság miatt.
Az energia-központként funkcionáló mitokondrium és a fotoszintézis helye, a kloroplasztisz kulcsfontosságú sejtszervecskéi a növénynek. Fontosságukat nyomatékosítja, és sejten belüli részleges „autonómiájukat” mutatja, hogy mindkét organellum rendelkezik önálló DNS-sel, és a génjeikben bekövetkező változás a teljes növényre kihat, amire jó példa a citoplazmás hímsterilitás, vagy a triazin-rezisztencia.
1992-ben Somogy megyében találták az első triazin-rezisztens parlagfüvet, és alig kilenc év elteltével, 2001-ben már Békés megyében is megtalálható volt a rezisztens biotípus. A felvételezést végző szakemberek szerint ma már Magyarországon mindenhol előfordul a triazin-rezisztens változat. Elgondolkodtató, hogy noha a triazin- rezisztencia a kloroplasztisz genomban kódolt mutáció következménye, és így anyai öröklésű - tehát pollennel nem terjed - mégis a parlagfű esetében néhány év elég volt, hogy százkilométeres távolságokra megjelenjen a triazinszármazékoknak ellenálló biotípus. Vajon mezőgazdasági munkagépekkel, járművekkel, ha akaratlanul is, de terjesztjük a rezisztens magokat, vagy pedig az ugyanazzal a szerrel történő kezelés kiváltotta szelekciós nyomással, folyamatosan indukáljuk a rezisztenciát? Valószínűleg mindkét lehetőség igaz, és annyi a közös bennük, hogy bizonyos fokú gondatlanság eredményei.
A közeljövő nagy feladata, az ALS-gátló herbicidekre rezisztens parlagfű biotípus magyarországi megjelenésének a megakadályozása, ill. felkészülés a rezisztens parlagfű terjedésére, gyors monitoring rendszer kidolgozása és erre alapozott pontos gyomirtási tanácsadások készítése. Az Amerikai Egyesült Államokban 1998-ban jelent meg a rezisztens biotípus. A kutatások során feltárták a rezisztencia genetikai okát, ami az ALS génben meghatározott helyeken bekövetkező öt pontmutáció bármelyike lehet. Mivel egy sejtmagi gén mutációja felelős a rezisztenciáért, ezért a mutáns genotípus a pollennel is terjedhet, így sokkal gyorsabb és nagyobb területeket érintő invázióra kell számítani, mint a triazin rezisztencia esetében.
A jelenlegi helyzetet tekintve félő, hogy az ország nagy részét kitevő mezőgazdasági művelés alatt álló területeken - mezőgazdaságunk általános állapota miatt - a parlagfű továbbra is megfelelő feltételeket fog találni magának. Ugyanakkor meg kell jegyeznünk, hogy a parlagfű terjedésének okai nemcsak mezőgazdaságunk kedvezőtlen viszonyaiban keresendők, hanem kedvező biológiai tulajdonságai és a természetes
ellenségeinek hiánya is segítette. Noha jelenleg Európa legfertőzöttebb területének mondható Magyarország, további terjedése várható az egész kontinensen.
Lengyelországban, pl. már Varsó magasságában is megtalálták, és fertőzött Bulgária ill.
Románia nagy része is. Franciaország középső és a földközi-tengeri részén, és Olaszországban is elterjedt. Az utóbbi években regisztrálták nagyarányú terjedését Ausztriában és Svájcban is. Géncentrumában, Észak Amerikában is a fertőzés erősödését tapasztalják.
Környezetvédelmi szempontból nemcsak a gyomirtó szerek jelentenek problémát a parlagfű elleni védekezésben. A nem szakszerűen végzett kaszálás következtében a talajhoz közel eső rügyekből erős oldalhajtás képződés indul meg, melyek hatalmas mennyiségű pollent és magot produkálnak. Ugyanakkor a rendszeres kaszálásnak országos szinten hatalmas az üzemanyagigénye, ami jelentős légszennyező. Megoldás lehetne a fiatal növények gyökerestül történő kézi kitépése, de erre a fertőzött terület méretei miatt egyszerűen nincs, és nem is lesz kapacitás. A védekezés hatékonyságának növeléséhez és az új eljárások kidolgozásához szükség van új, más szemléletű kutatásokra.
Az elmúlt pár évtizedben szemtanúi lehettünk a molekuláris genetikai vizsgálati módszerek látványos fejlődésének. Ugyanakkor jelentősége ellenére, nemcsak hazai szinten, de világviszonylatban is kevés szakirodalom található a parlagfű molekuláris genetikai vizsgálatáról. Genton és munkatársai (2005) mikroszatellit markerekkel hasonlítottak össze észak-amerikai és franciaországi parlagfű populációkat. A franciaországi populációkban nagyobb genetikai változatosságot találtak mint az amerikaiakban, mely eredményből arra következtetnek, hogy több forrásból történthetett a parlagfű inváziója. Amerikában Patzoldt és mtsai (2001) és Tranel és mtsai (2004) vizsgálták az ALS-gátló herbicidekkel szembeni rezisztencia molekuláris genetikai okait az A. artemisiifolia, Xanthium strumarium, Amaranthus hybridus és az Amaranthus tuberculatus gyomfajokban.
Ez a kevés eredmény meglehetősen érthetetlen, hiszen orvos-biológiai vonatkozású kutatások tömege jelzi a pollenallergia okozta probléma súlyosságát, de az allergiát kiváltó növény molekuláris genetikai természetének megismerésével mégsem foglalkoznak mélyebben.
A parlagfűpollen allergén fehérjéjét, már immunológusok azonosították, ezt az összetett fehérjét az amb a I géncsalád kódolja. A génnek több cDNS szekvencia váláltozata ismert. Alapkutatás szintű vizsgálatok szükségesek a gén szerkezetének jobb
megismeréséhez és hasznos információt jelenthetne a magyarországi génváltozatok meghatározása is.
1.1 Célkitűzések
A fentiek miatt, a jelen kutatási program célja a parlagfűről molekuláris genetikai információk gyűjtése, melyek felhasználhatóak további kutatásokhoz ill. közvetlenül alkalmazhatóak gyombiológiai vizsgálatokhoz, így populáció-genetikai összehasonlításokhoz, a triazinokkal és az ALS-gátló herbicidekkel szembeni rezisztencia gyors DNS szintű meghatározásához és az amb a I géncsalád pontosabb megismeréséhez.
2.
Irodalmi áttekintés
2.1 A gyom fogalmaA világ mezőgazdaságilag művelt területén átlagban 0-25%-nyi termésveszteséget okoznak a kártevő rovarok, 10-15%-nyit a gyomok és mintegy 10-15%-ra tehető az élősködő gombák, vírusok stb. okozta kár.
A gyom fogalmát, már többen is meghatározták:
Ujvárosi (1957) szerint gyomnak tekinthető minden olyan növény, amelyet nem vetettünk, hasznot nem hoz, és jelenléte káros leginkább azzal, hogy a vetett növény elől elfoglalja a helyet, vagy felhasználja a talaj tápanyag- és vízkészletét.
Hunyadi (1988) megfogalmazása szerint gyomnak nevezzük bármelyik fejlődési stádiumban lévő olyan növényt vagy növényi részt (rizóma, tarack, hagyma, hagymagumó, stb.), amely ott fordul elő, ahol nem kívánatos.
A parlagfű ezeknek a meghatározásoknak a kereteit is feszegeti, mert nem csak jelenlétével káros és nem csak a kultúrnövényektől vesz el helyet és tápanyagot, ahol előfordul ott biztosan nem kívánatos, hanem közvetlenül az emberre veszélyes allergén pollent is termel.
2.2 A parlagfű (Ambrosia altemisiifolia L.) általános jellemzése 2.2.1 Morfológia és taxonómia
Az A. artemisiifolia ürömlevelű parlagfű a fészkesek (Asteraceae) családjába, a csöves virágúak (Asteroideae) alcsaládjába a parlagfű (Ambrosia)
nemzetségbe tartozó egyéves T4-es életformájú gyom. A fajon belül három változatot különítettek el, ezek
közül Magyarországon szinte csak az A.
artemisiifolia var. elatior (L.) Descourtils változat fordul elő (Szigetvári és Benkő 2004). A csíranövény
kelésekor a sziklevelek széles tojásdadok, lekerekített csúcsúak, rövid nyelűek (1. ábra).
Az első lomblevelek keresztben átellenesek és szárnyasan hasogatottak, a későbbi lomblevelek pedig szórt állásúak, rövid nyelűek, kontúrjuk tojásdad, szárnyaltak, szeldeltek. A legfelső szárlevelek esetenként tagolatlanok. A levelek színe sötétzöld, vastagon, tompán szőrözött, fonákuk sötétszürke, sűrűn szőrözött (Béres és mtsai 2005).
A kifejlett növény közepes vagy nagy termetű, felálló, dúsan, terpedten elágazó, tompán négyélű szárú növény, rányomott és elálló szőrökkel borítva. Levelei rövid nyelűek egy-kétszeresen, szárnyasan szeldeltek. A szeletek tojásdadok, pelyhesek. Az ágak végén füzérekben helyezkednek el a sárga porzós virágok, míg a termős virágok lentebb, a füzérek alján, illetve a felső lomblevelek hónaljában ülnek. A termős fészek egyvirágú, a termőt szőrös hatfogú burok zárja körül, amely a terméssel együtt hullik le (Béres és mtsai. 2005).
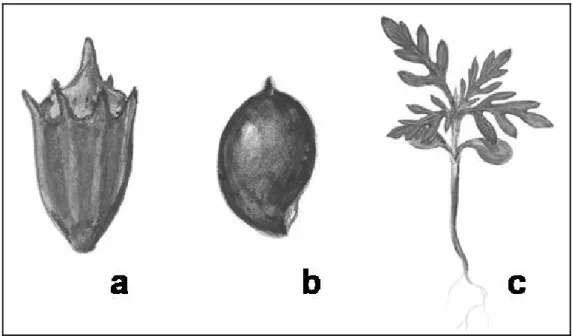
Termését jellemezve elmondható, hogy az egymagú fészek külső héja a fészek vackából és a murva pikkelyekből fejlődött ki, kehely alakú, a peremén 5-7 bütyökkel a pikkelyek csúcsaival (1. ábra). A kehelyre csúcsos fedő borul. Az egymagvú fészek sárgásbarna vagy szürkésbarna, érdes, fénytelen, törékeny. Ha ez a héj széttörik, szabaddá válik a kaszat, amely citrom alakú csúcsa szélesen gömbölyű, rajta rövid bibecsonk található. Ez fedi a tojás alakú faggyúszerű magot (Németh 2000).
1. ábra: Az ürömlevelű parlagfű szaporítóképletei: a – egymagvú fészek, b – kaszat. Ambrisia artemisiifolia csíranövény (c). (Abonyi Zsuzsanna rajzai)
2.2.2 Származása és elterjedése
Az A. artemisiifolia Észak-Amerika déli területeiről származó egyéves növény. Az Egyesült Államokból, ahol 1838-ban fedezték fel, mint gyomnövényt (Wagner és Beals 1958), többször is behurcolták Európába heremag, gabona és burgonya szállítmányokkal. Németországban már az 1800-as évek közepe táján regisztrálták, azonban klimatikus okokból, a termése nem tudott beérni, és így nem honosodott meg (Hegi 1960). A tényleges megtelepedés és a felszaporodása az első világháború környékén indult meg Fiume és Trieszt kikötői felől fertőzött gabonaszállítmányokkal.
A gyors terjedés a második világháború után kezdődött el. Az európai inváziójának két központja volt: a kisebbik Délnyugat-Franciaországban, Lyon körzetében, a nagyobbik Délnyugat-Magyarország és Horvátország határos részein (Szigetvári és Benkő 2004).
A parlagfű 1923-ban már megtalálható volt Somogy megyében (Lengyel 1923), majd 1924-ben Zala és Veszprém megyékben is (Moesz 1926). Később a Duna-Tisza közén Szegedtől kiindulva terjedt északra (Tímár 1955). Ma már az ország teljes területén megtalálható (2. ábra).
2. ábra: A parlagfű hazai elterjedése megjelenésétől a hetvenes évek végéig (Béres 1981). A sötétebb színek a nagyobb borítottságot szemléltetik.
Az országos gyomfelvételezések adatai szerint az A artemisiifolia 1947 – 53 között a borítottságot tekintve 0,39 %-kal még csak a 21. volt, de az 1996–1997. évi
felvételezésen 4,7 %-kal a fontossági sorrendben már az első helyen végzett (Novák és mtsai 2009). A parlagfű mezőgazdasági művelés alatt álló területeken, szántóföldeken, szőlőkben, gyümölcsösökben gyakori, de előfordul legelőkön, árokparton, útszéleken, erdők szélén és különösen parlagon hagyott területeken terjed gyorsan. Gyakorlatilag mindenhol megtalálható, még a városokban is (3. ábra).
3. ábra: A parlagfű fertőzöttség mértéke és a borítási %-a Magyarországon (Parlagfű kézikönyv, 2007).
Kiss és Béres (2006) szerint az ürömlevelű parlagfű tömeges felszaporodásának okai a következők lehetnek: közrejátszanak biológiai jellemzői, mint a nagyfokú alkalmazkodó képessége, a hidegtűrő képességének növekedése, jó kompetíciós képessége, talajjal szembeni igénytelensége, jó szárazságtűrése, gyors regenerálódó képessége, rezisztens biotípusának kialakulása, allelopatikus hatású anyagok képzése.
Meghatározó szerepe azonban a helytelen emberi tevékenységeknek van, melyek a múltban is elősegítették elszaporodását (Kiss és Béres 2006). Ezek a hibák a következők lehettek: gyomos táblaszegélyek növekedése, gondozatlanul hagyott területek gyarapodása, kezdeti védekezések elmulasztása, gyommaggal fertőzött vetőmag használata, a bérmunkák során a művelő-, betakarító- és szállítóeszközökkel széthurcolás, a szakismeret hiánya, a gyomirtási technológiák helytelen megválasztása és jelentős költsége, a gabonatarlók ápolási munkáinak elhagyása, késői elvégzése és
rossz minőségű talajmunkák végzése (Tóth és mtsai 2001, Tóth és mtsai 2004, Szentey és mtsai 2004).
2.2.3 Szaporodásbiológiája
A parlagfű hímnős növény, a porzós virágzatok a hajtások csúcsain, míg a termős fészkek a felső lomblevelek hónaljában a porzós virágzatok alatt helyezkednek el. A porzós virágzatban 10-100 halványsárga virág van (Basset és Crompton 1975). A pollen viszonylag nagy 10-25 mikron átmérőjű. A termős fészkek rendszerint egyvirágúak, ülők, és murvapikkellyel borítottak. A szaporítóképlet háromféle módon fordulhat elő:
egymagvú fészek, kaszat és mint csupasz mag (Schermann 1966), de a leggyakoribb a fészek. A dús olajtartalmú mag faggyúszerű, tojásalakú. Ezer kaszat súlya 2,0-2,3 gramm (Béres 1981).
Az A. artemisiifolia csak magvakkal szaporodik. A növények kb. 95%-a monoikus, egylaki növény. Előfordulnak azonban olyan egyedek is, amelyek kizárólag termős virágokat hoznak, illetve olyanok, amelyeken vagy a termős vagy a porzós virágok vannak túlsúlyban (Gebben 1965). Hegi (1960) szerint sűrű állomány esetén csaknem kizárólag porzós, míg ritkább térállásban, jó talajon inkább termős virágokat hoz. A termős virágok nyílását a porzósak mintegy 7-10 nappal megelőzik.
Elsősorban szélporozta növény, a pollenje akár több száz kilométerre is eljut (Bíró 2003). Egy gramm parlagfű pollenben 30-35 millió virágporszem van, és egyetlen növény képes akár nyolcmilliárd virágporszemet is termelni (Juhász és Juhász 2002). A virágzás legintenzívebb szakasza augusztusra esik, azonban július második felétől szeptember végéig virágzik (4. ábra).
4. ábra: A parlagfű életciklusa (Béres 1981).
Az idegenmegporzás mellett önmegporzással is életképes magokat hoz létre. A kisebb növények átlagos magszáma néhány száz, míg a közepeseké 3000 (Béres és Hunyadi 1980), de a nagyobb növények magprodukciója a 62000-t is eléri (Dickerson és Sweet 1971). A növény zöldtömege és magprodukciója között arányosan növekvő, szoros összefüggés figyelhető meg (Dickerson 1968). A csírázási idő szintén befolyásolja a maghozamot. Külföldi adatok szerint a május közepéig kikelt növények átlagosan 32000 magot hoztak, míg a július elején kikeltek csak 3.100 darabot (Basset és Crompton 1975). A frissen érett magvak ősszel nyugalomban vannak. A nyugalmi állapot 8 hetes 4°C-on történő stratifikációval megszüntethető (Willemsen és Rice 1972). A magvak csírázását a változó hőmérséklet és a primer dormancia megszűnése után a fény is segíti (Maguire és Overland 1959, Béres és Hunyadi 1980). A magvak csírázását a gibberellines kezelés jelentősen nem fokozza (Kosikova, 1960). Toole és Brown (1946) szerint a talajban tárolt magvak 39 évig megőrizték csírázóképességüket.
Béres és mtsai (2005) arra az eredményre jutottak, hogy a magnyugalmat a termésekben lévő vízzel ki nem mosható endogén gátló anyagok felhalmozódása okozza, melyek 6-12 hetes sztratifikáció után válnak inaktívvá. Az A. artemisiifolia termések nyugalma tehát Crocker (1916) klasszikus felosztása alapján „endogén anyagcsere akadályok” típusba sorolható.
2.2.4 A parlagfű kórokozói
Magyarországon eddig tíz növénykórokozó gomba jelenlétét mutatták ki az ürömlevelű parlagfüvön (Entyloma polysporum, Albugo tragopogonis, Plasmopara halstedii, Verticillium dahliae, Botrytis cinerea, Rhizoctonia solani, Macrophomina phaseolina, Septoria epambrosiae, Sclerotinia sclerotiorum, Phyllachora ambrosiae) (Kiss és mtsai 2003). Ezek közül csupán a Ph. ambrosiae és a P. halstedii okozott egy- egy évben komolyabb károkat a hazai parlagfű állományban.
Az 1999-es évben az ország egész területén a Ph. ambrosiae okozott járványt (Bohár és mtsai 2000, Vajna és mtsai 2000). Ebben az évben egy hónappal megrövidült a parlagfű pollenszórási időszaka (Kiss és mtsai 2001). A járvány nem ismétlődött meg, de sikerült meghatározni a Ph. ambrosiae rDNS ITS-régió nukleotid sorrendjét és fajspecifikus primereket tervezni, így lehetővé vált a kórokozó kimutatása (Varga és Kiss 2003).
A Plasmopara halstedii 2001 őszén okozott járványos megbetegedést az ürömlevelű parlagfüvön (Vajna 2002). Ebben az időszakban a sokéves átlag egytizedére csökkent a levegő parlagfűpollen koncentrációja (Kiss és mtsai 2003).
Kiss és mtsai (2003) szerint 6 amerikai gombafaj tűnik perspektivikusnak a biológiai védekezésre: a Puccinia xanthii, P. canaliculata, P. conoclinii, Entyloma polysporum, E. compositarum és Protomyces gravidus fajok. Ezeket a gombafajokat eddig még csak Észak-Amerikában írták le a parlagfüvön, tehát ezek a parlagfűre specializálódott rozsdagombák nem követték gazdanövényüket Európába (Kiss és mtsai 2003).
P. xanthii gombafajt csak amerikai herbáriumi gyűjteményekben sikerült kimutatni a parlagfüvön, gyűjtőutakon nem találták meg, így csak az elméleti lehetősége adott a gombafaj biológiai védekezésben való használatának (Kiss 2007). A parlagfű fertőzés mérsékléséhez a biológiai védekezés is hozzájárulhatna, bár önmagában valószínűleg nem jelentene teljes megoldást (Béres és mtsai 2005).
Biológiai gyomirtásra a vírusok nem használthatók, mert polifág kórokozók, de a gyomnövények vírusrezervoár szerepe nagy jelentőségű. A parlagfű növényvirológiai szempontból történő alaposabb megismerése azért is fontos, mivel igen nagy számban megtalálható az egész ország területén. Schmelzer és Wolf (1977) szerint az ürömlevelű parlagfűn előforduló vírusok a következők: dohány mozaik vírus (Tobacco mosaic), dohány gyűrűsfoltosság vírus (Tobacco ringspot), dohány csíkosság vírus (Tobacco streak) és uborka mozaik vírus (Cucumber mosaic). Ilyen irányú kutatásokat végeztek a Pannon Egyetem Georgikon Karán, Keszthelyen Takács és mtsai (2001). A parlagfű
vírus-ellenállóságát vizsgálták a burgonya Y-vírus (Potato Y virus) N törzsével (PVYN) és NTN (PVYNTN) törzsével, a Chenopodium mozaik vírussal (Sowbane mosaic virus), a dohány mozaik vírus OB törzsével (Tobacco mosaic virus), az uborka mozaik vírus U/246 törzsével (Cucumber mosaic virus) és legutóbb a cukkíni sárga mozaikvírussal (Zucchini yellow mosaic virus) szemben. A kísérlet során a mesterségesen inokulált növényekben a vírusok jelenlétét a fertőzést követő ötödik héten DAS-ELISA szerológiai módszerrel és visszaizolálással ellenőrizték. Megállapították, hogy az általuk vizsgált vírustörzsekkel szemben a parlagfű rezisztens, azaz a fertőzést követően a vírusokra jellemző lokális és szisztemikus tünetek nem mutatkoztak (Takács és mtsai 2001, Takács és mtsai 2002).
Kazinczi (2004) vizsgálatában a szabadföldről gyűjtött tünetmentes minták 8 %-ából az uborka mozaik vírust (Cucumber mosaic virus) sikerült szerológiai úton és bioteszttel is kimutatni.
2.2.5 A parlagfű ellen alkalmazott védekezési eljárások
Béres és mtsai (2005) szerint a védekezés integrált és célirányos kell, hogy legyen. A kémiai védekezés során a szükségtelen herbiciddel történő kezelés gazdaságtalan és káros. A herbicides kezelésnek komoly gyakorlati korlátai vannak, ugyanis használatuk elsősorban mezőgazdasági művelés alatt álló területekre - és a szer hatóanyagától, típusától függően - ott is csak bizonyos kultúrákra korlátozódik. A herbicidek rendszeres egyoldalú használata következtében rezisztens gyompopulációk alakulhatnak ki, mint ahogy Magyarországon is megjelent a triazin-rezisztens parlagfű biotípus.
Az ürömlevelű parlagfű a legnagyobb gyomirtási problémát a kapás kultúrákban okozza, de szinte minden kultúrában eredményesen irtható a megfelelő herbicid alkalmazásával (Béres és mtsai 2005).
Béres és mtsai (2005) szerint a mechanikai védekezés leghatékonyabb módját a növény gyökerestül történő eltávolítása jelentené, de ez csak kis területen, esetleg városokban lehet hatékony. A kapálás is jól alkalmazható kisebb bolygatott területeken.
A kaszálással történő védekezés legnagyobb problémája, hogy a kaszálásra a parlagfű nem pusztul ki, hanem rövid idő alatt a talajjal párhuzamosan futó új hajtásokat fejleszt.
A kaszálás időpontjának helyes megválasztásával nagyban nő a hatékonysága. Egyszeri kaszálás esetén a leghatásosabb közvetlenül a virágzás előtt kaszálni, de a porzós virágok újrafejlődésének a megakadályozásához további 1-2 kaszálásra lehet még szükség (Béres és mtsai 2005). Az ürömlevelű parlagfű a bolygatott talajú, növényekkel
nem leárnyékolt területeken érzi jól magát, ezért fűfélék telepítése vagy mulcs réteggel történő talajtakarás is jó lehetőséget jelent a parlagfű elleni védekezésre (Béres és mtsai 2005).
A mezőgazdasági művelés során a gabonatarlók és tarlóhántásban részesített területek kiváló lehetőséget kínálnak a mechanikai védekezésre. A tarlóhántás időbeni elvégzésével megakadályozzuk, hogy magot érleljen, majd a terület többszöri művelésével sok gyommag csírázását serkentjük és ezzel jelentősen csökken a talajok magkészlete (Béres és mtsai 2005).
Biológiai védekezés: A behurcolt gyomokkal szemben a biológiai védekezés leghatékonyabb módja az őshazájukból származó természetes ellenségeik körültekintő alkalmazása (Kiss és mtsai 2003).
Goeden és mtsai (1974) szerint az ürömlevelű parlagfüvön táplálkozó rovarok közül a Tarachidia candefacta és a Zygogramma suturalis (parlagfű levélbogár) fajok a legígéretesebbek. A parlagfű levélbogarat több országba betelepítették (Horvátország, Kína, volt Szovjetunió), ahol károsítást nem okozott a kultúrnövényekben, viszont a parlagfűben sem tett komoly kárt (Reznik és mtsai 1994, Igrc és mtsai 1995). Japán szabadföldi kísérletekben az Ophraella communa faj a parlagfüvet jelentősen károsította (Yamazaki és mtsai 2000).
A biológiai védekezésben kulcsszerepet játszhatnának a parlagfűre specializálódott gombák, azonban még nem adtak hírt egyik gombafaj kitűnő agrotechnikai alkalmazhatóságáról sem.
2.3 A kloroplasztisz és mitokondrium genom sajátosságai
A növényi genom különlegessége, hogy a mitokondriumok mellett a színtestekben is található DNS-állomány (Mátyás 2002). A három genom mérete és öröklődése is eltér egymástól.
Az organellum-DNS felhasználása széles körű a rokon fajok közötti és fajon belüli genetikai távolságok elemzésére, a megbízhatóság, a nukleáris DNS-hez képest egyszerűbb vizsgálhatóság és a génáramlásban betöltött különleges szerepe miatt (Clegg és mtsai 1984, Pillay és Hilu 1990, Hultquist és mtsai 1997, Perez de la Rosa és mtsai 1995, Cipriani és mtsai 1998, Parducci és Szmidt 1999). A kloroplasztisz és mitokondrium DNS vizsgálata jobban rávilágíthat az evolúciós kapcsolatokra, mivel ezek mutációs rátája jóval kisebb, mint a nukleáris DNS-nek (Wolfe és mtsai 1987). Az organellum-DNS vizsgálatok hatékonyságát növeli, ha a vizsgálni kívánt növényfaj
maggal szaporodik és szélbeporzású. A pollen migrációs távolsága igen nagy lehet, ugyanakkor a mag terjedőképessége korlátozott. A sejtmag DNS-ében kódolt allélok hatékony génáramlásával szemben tehát az anyai öröklésmenet helyi genotípusok fennmaradását teszi lehetővé. Ezért különböző területek populációinak genotípizálására az organellum-DNS markerek is jól alkalmazhatóak (Mátyás 2002). Markerként való alkalmazásukhoz ki kell emelni, hogy az organellumgenom haploid, ritkán rekombinálódik, azaz a változások zöme csak mutációk révén alakulhat ki és csak az egyik szülő által örökíthető át (Mátyás 2002).
A DNS-t tartalmazó sejtorganellumok, a kloroplasztisz és a mitokondrium az endoszimbionta elmélet szerint az eukarióta szervezetek „fogságába” került baktériumszerű sejtekből alakultak ki, amelyek a mai fotoszintetizáló lila baktériumokkal és Cyanobacteriumokkal, állnak rokonságban (Gray 1989). A kloroplasztisz-DNS (cpDNS) és a mitokondriális DNS (mtDNS) kétszikűekben, kizárólagosan anyai öröklődést mutat, a pollenből hiányzik, így csak a petesejt citoplazmájával kerül át az utódba (Heifetz 2000, Bock és Hagemann 2000).
2.3.1 A kloroplasztisz-genom
A kloroplasztiszok genomja kettősszálú, gyűrű alakú DNS-molekula. A legfontosabb termesztett növények így a búza: Yasunari és mtsai 2000, rizs: Hiratsuka és mtsai 1989, kukorica: Maier és mtsai 1995 és sok más faj (lúdfű: Shusei és mtsai 1999) teljes kloroplasztisz DNS szekvenciáját meghatározták, ezért pontos ismeretekkel rendelkezünk a gének számáról és sorrendjéről, amelyek távoli fajokban is megegyeznek. A teljes színtestgenom 130-160 ezer nukleotid, amely mindig tartalmazza a riboszomális géneket, amelyek a kloroplasztisz felépítéséhez szükségesek, de ezek a színtestecske működéséhez a fotoszintézishez nem elegendőek, ebben a nukleáris gének is közreműködnek (Velich 2001). A kloroplasztisz genomra jellemző a tömör szerveződés, intronok csak rövid szakaszokban fordulnak elő és az ismétlődő szekvenciák előfordulása sem jellemző, egyetlen ilyen szekvencia ismert, amely a legtöbb növényben 20-25 knt (kilonukleotid) (Velich 2001). A színtestekben 10-100 DNS molekula lehet és minden növényi sejt tartalmazhat 10-100 kloroplasztiszt, tehát ezerszeres kópiaszámú is lehet a színtestgenom (Velich 2001).
2.3.2 A mitokondriális genom
A mitokondriumok DNS-állománya a kloroplasztiszokénál lényegesen nagyobb, 300-2500 knt közé esik (Mátyás 2002). A magasabb rendű növények mitokondriális genomjára az a jellemző, hogy a gének intronokkal lehetnek megszakítva, a kódoló szekvenciák között nagyobb nem átíródó szakaszok találhatók és nagy az ismétlődő szekvenciák aránya is. A genom több algenomikus gyűrűből áll, melyek az ismétlődő szekvenciáknál fűződnek le és a gyűrűk dinamikus egyensúlyban vannak (Velich 2001).
A növényi mitokondrium általában mindössze 40-50 gént tartalmaz, amelyek jórészt a glikolízis és az elektrontranszport fehérjéit kódolják (Mátyás 2002). Nagyon kevés szervezetben ismert a mitokondrium-DNS-ének teljes nukleotidsorrendje, a genom mérete és a gyűrűfajták állandó változása miatt.
2.4 Molekuláris genetikai vizsgálati módszerek és molekuláris markerek A molekuláris genetika robbanásszerű fejlődése számtalan új DNS vizsgálati módszer és új molekuláris marker típus kifejlesztését eredményezte. A DNS markerek alkalmazását a „Southern blot” hibridizáció és az ezen alapuló RFLP (Restriction Fragment Length Polymorphism) módszer, majd a polimeráz láncreakció (Polymerase Chain Reaction) kifejlesztése tette lehetővé.
2.4.1 Restrikciós fragmentumhossz polimorfizmus (RFLP)
Az első DNS marker, melyet Botstein és mtsai 1980-ban írtak le az RFLP (Restriction Fragment Length Polymorphism) volt. Ennek a felfedezésnek az alapját a restrikciós enzimek működésének megismerése teremtette meg. A leggyakoribb restrikciós endonukleázok 4 illetve 6 bp nagyságú DNS szekvenciákat „ismernek fel”, majd elvágják a kétszálú DNS molekulát. A különböző genomok eltérő pozíciókban tartalmaznak restrikciós emésztési helyeket, ezért különböző méretű fragmentumokra darabolódnak fel az emésztés során. A növényi genom nagy mérete miatt, a restrikciós enzimek olyan sok darabra vágják a DNS-t, hogy pontos elválasztásuk nem lehetséges, ezért a gélelektroforézis után jelölt próbákkal Southern-hibridizációt (Southern 1975) végeznek a genomok megkülönböztetéséhez. Az így kapott fragmentumok kodomináns markerként viselkednek, tehát a heterozigóták is kimutathatók a segítségükkel. A módszer hátránya, hogy nagy mennyiségű DNS-t igényel és a jelölt próbák alkalmazása miatt hosszadalmas és költséges eljárás (Heszky és mtsai 2005).
2.4.2 Polimeráz láncreakció (PCR)
A polimeráz láncreakciót (Polymerase Chain Reaction) először 1985-ben Saiki és mtsai írták le a β-globin gén amplifikálására. A reakcióval a sejtekben végbemenő DNS replikációt utánozzuk. A PCR ciklusokból áll, amelyekben a primerek kapcsolódási helyétől kiinduló DNS szintézis történik. A ciklusok ismétlésével a primerek közötti DNS szakasz exponenciálisan amplifikálódik, mert a polimeráz enzim az újonnan készített DNS szálakat is templátként használja. Az így kapott DNS mennyiség már egyszerű agaróz gélelektroforézissel kimutatható, míg a templátként használt DNS kis mennyisége miatt nem látszik (Kiss 1999). A napjainkban is használt hőstabil Taq polimeráz enzimet Saiki és mtsai 1988-ban izolálták a Thermus aquaticus baktériumból, ezzel lehetővé vált a specifikus PCR egyetlen reakcióelegyben, a hőmérséklet gyors és pontos változtatásával.
2.4.3 Szekvencia specifikus primerek (SCAR)
Marker fragmentumok, gének manapság akár teljes genomok szekvenálásával pontos szekvencia adatokhoz juthatunk. Ezután ezekre a szekvenciákra specifikus, 18-26 bp nagyságú primereket tervezhetünk, ezek az ún. Sequence Characterized Amplified Regions (SCAR) primerek. Ezekkel a primerekkel jól reprodukálható termékeket várhatunk, melyek egyúttal kodomináns markerek is lehetnek (Heszky és mtsai 2005).
2.4.4 PCR-RFLP
Specifikus primerek alkalmazása során gyakran azonos méretű, de eltérő szekvenciájú termékeket kapunk. Ezeknek a termékeknek a markerként való alkalmazásához és SNP-k detektálásához az egyik lehetséges módszer a PCR termékek restrikciós enzimekkel történő emésztése. Ha a termékekben voltak nukleotid eltérések és a megfelelő restrikciós endonukleázzal dolgoztunk, akkor különböző méretű restrikciós fragmentumokat fogunk látni a gélelektroforézis után. Ezzel a módszerrel kodomináns CAPS (Cleaved Amplified Polymorphic Sequences) markereket kaphatunk (Heszky és mtsai 2005).
2.4.5 PASA (PCR amplification of specific alleles)
Az SNP-k (Single Nucleotide Polymorphism), a csupán egyetlen nukleotidban eltérő allélok kimutatásának gyors PCR alapú módszere a PASA (allél-specifikus PCR). A módszer elve az, hogy a szekvencia ismeretében a mutáció helyére két primert
tervezünk, melyek végein találhatóak a polimorf nukleotidokkal komplementer bázisok.
A harmadik primert az SNP-től megfelelő távolságba (100-500 bp) az ellentétes szálra tervezzük. A PCR reakció allél specifikusságát növeli, ha az SNP-hez készített primerek 3’ végétől 5 nukleotid távolságra egy nukleotid cserét (mismatch) is beiktatunk (Gaudet és mtsai 2007). A primerek tervezésekor fontos figyelembe venni, hogy mind a három primer kapcsolódási hőmérsékletének azonosnak kell lennie. Ezzel a módszerrel két PCR reakció szükséges a heterozigóták és a homozigóták elkülönítéséhez.
2.4.6 Bi-PASA (bidirectional-PASA)
A bi-PASA (kétirányú allél-specifikus amplifikáció) a PASA módszer továbbfejlesztett változata, amellyel egyetlen PCR reakcióban alkalmazott két primerpárral, allél specifikus termékeket kapunk. Tehát a hetero és homozigóták jól elkülöníthetőek az alapján, hogy egy vagy két allél specifikus (különböző méretű) termék szaporodik fel a PCR reakcióban (Liu és mtsai 1997). A primerek tervezésénél nagy hangsúlyt kell fektetni az azonos kapcsolódási hőmérsékletekre, a megfelelő méretkülönbségre a két allél-specifikus termék között és a primer-dimerek kialakulásának lehetőségével is számolni kell.
2.5 A Genetikai távolság értékelése
Ha két vagy több populáció genetikai elkülönülését szeretnénk értékelni, akkor a genetikai azonosság mértékét kell kiszámolnunk. Egy vagy több génhelyre vonatkoztatva, a genetikai azonosság (I = identitás) az X és Y jelű populációk között:
∑
∑
∑
⋅
= ⋅
2 2
) (
i i
i i
xy x y
y
I x , ahol
xi és yi az allélok gyakoriságai a két populációban.
I értéke 0 és 1 között változhat. Ha értéke 1, a két populáció azonos. A genetikai azonosság tulajdonképpen annak az átlagos valószínűségét fejezi ki, hogy a két populációban véletlenszerűen kiválasztott allél azonos lesz-e (Mátyás 2002).
Nei (1975) a genetikai azonosságot felhasználva a két populáció genetikai távolságát (genetic distance ) az allélgyakoriságban mutatkozó eltéréssel jellemzi:
D = - lnI ( I = identitás)
A genetikai távolság a két populációban mért allélgyakoriságok különbségéből is számítható:
∑
−= ( )
2 1
i
i y
x d
A két populáció azonossága esetén D ill. d értéke 0.
Nei és Li (1979) a genetikai távolság (GD) meghatározására, ha RFLP vizsgálat eredményeiből szeretnénk meghatározni, a következő összefüggést javasolja:
, ahol
Nxy a két egyed azonos fragmentumainak a száma, Nx az első minta fragmentumainak a száma, Ny a második minta fragmentumainak az összege. Két vagy több populáció egyedei között, ezzel az összefüggéssel kiszámíthatóak a genetikai távolságok. Az eredményeket egy genetikai távolság mátrixba rendezhetjük.
Populáció genetikai elemző programok segítségével a genetikai távolság mátrix egyszerűbben meghatározható, és az eredmények jobb és érthetőbb szemléltetése érdekében dendogrammot is szerkeszthetünk klaszteranalízissel.
A klaszteranalízis jól ismert módszer a genetikai eredmények kiértékelésének gyakorlatában. Ilyen módszer az UPGMA (Unweighted Pair Group Method with Arithmetic mean), vagy a WPGMA (weighted pair group method with averaging) is.
Ezek a módszerek a klaszterek közötti különbségek számítási módjában térnek el egymástól. A leggyakrabban alkalmazott UPGMA csoportátlag módszer, egy hierarchikus osztályozó algoritmus, melyben két csoport távolságát a tagjaik közötti összes távolságérték mértani átlaga fejezi ki (Sokal és Michener 1958). A mértani közép alapján súlyozás nélkül számoló UPGMA módszerrel lehet az egyes csoportok közötti különbségeket a leginkább kimutatni (Sneath és Sokal 1973).
2.6 A triazin-rezisztencia
2.6.1 Az 1,3,5-triazinok rövid jellemzése
Az 1,3,5-triazinok a fotoszintézist gátló herbicidek csoportjába tartoznak. A xylémben transzlokálódnak. Pre- és posztemergensen is alkalmazzuk egyéves kétszikű és néhány egyszikű gyom ellen, talajherbicidként. A triazinokat környezetvédelmi
megfontolásokból 2007 végéig lehetett használni Magyarországon kivéve a terbutilazin hatóanyagot. A hatáskifejtésükhöz bemosó csapadékra van szükség. A klóramino- trazinok rendkívül perzisztensek, és vízoldékonyságuk a legrosszabb. Felhasználási területük széles: leggyakrabban a kukoricában, de szántóföldi kultúrákban (gabona, burgonya, cukorrépa), négy évesnél idősebb szőlőben, almástermésűeknél, kertészeti kultúrákban és erdészetekben használjuk. Az 1,3,5-triazinok csoportjába tartozik a terbutilazin, a terbumetoncianazin, a terbutrin, az aziprotrin, a prometrin, a dipropetrin és a legismertebb, a II-klór-4-etil-amino-6-izopropilamino-1,3,5-triazin, azaz az atrazin (Kádár 2001).
2.6.2 A triazin-rezisztencia mechanizmusa és öröklődése
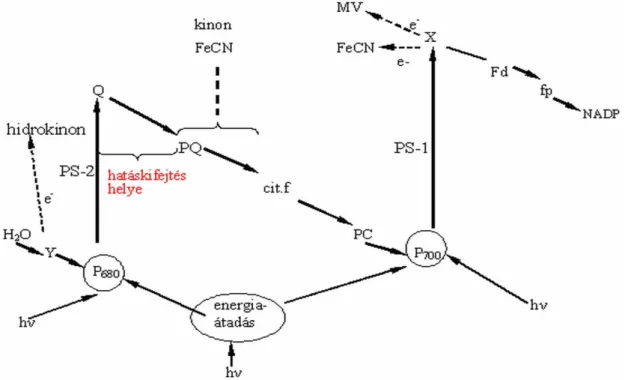
A triazinok hatásukat a fotoszintézis gátlásával fejtik ki. Ezt úgy érik el, hogy a II.
fotószisztéma területén az elektrontranszportot szétkapcsolják a primer (Q) és a szekunder (plasztokinon) elektron akceptor között. Pontosabban a kloroplasztiszban hozzákötődnek a D1 thylakoid membrán fehérjéhez, ezzel helyéről elmozdítják a plasztokinont, így gátolják a fotoszintetikus elektrontranszportot (Berzsenyi 2000) (5.
ábra).
5. ábra: A triazinok fotoszintézis gátlása (Kádár 2001).
A triazin herbicidekkel szembeni rezisztenciának három fő formája ismert. Az első a gyökérzet elhelyezkedésén alapuló szelektivitás, amely számos kultúrnövény ellenálló képességének alapja. Ebben az esetben a növények gyökérzete mélyebben helyezkedik el, mint a herbicid bemosódási zónája (Warwick 1976). A második a triazin herbicidek biokémiai alapokon nyugvó hatástalanítása. A detoxifikálás három formáját ismerjük:
I. hidroxi atrazin képzés
II. oldallánchasítás (dealkiláció)
III. glutation-konjugáció (Jensen és Bandeen 1979).
A harmadik rezisztenciát okozó változás a D1 thylakoid membrán fehérje szerkezetében következhet be. Mivel e 32 kDa méretű fehérjéhez ezután már nem tud kötődni az atrazin, és így tovább működhet a fotoszintézis.
A D1 fehérjét a psbA gén kódolja a kloropasztisz genomban (Steinback és mtsai 1981), tehát extra kromoszomális öröklődésű. A psbA gént először Spinacea oleraceaból illetve Nicotiana debneyből izolálták és szekvenálták (Zurawsky és mtsai 1982). Azóta különböző fotoszintetikus szervezetekből klónozták, és a szekvenálás eredményei a gén nagyfokú konzerváltságát mutatják (Holt és mtsai 1993). Egyetlen primerpárral a psbA konzervált régiója kimutatható volt a kultúrnövények közül búzában, kukoricában, repcében, lucernában. A növények egy részénél a triazin rezisztencia a psbA gén 264-es kódonján bekövetkezett egyetlen pontmutáció eredménye (Botterman és Leemans 1988, Rios és mtsai 2003). Ez a nukleotid csere adenin helyett guanint eredményez, ami a fentiek szerint változtatja meg a D1 fehérje tulajdonságait. Mivel hasonló molekuláris változásokat figyeltek meg a repcében (Reith és Strauss 1987), az árpában (Rios és mtsai, 2003) és a gyomnövények közül az Amaranthus fajokban (Hirschberg és McIntosh 1983), a Solanum nigrum-ban (Goloubinoff és Edelman 1984) és a Poa annua-ban (Barros és Dyer 1988), ebből e tulajdonság konzervált változékonyságára lehet következtetni. Erre Botterman és Leemans (1988), majd Holt (1993) is felhívta a figyelmet. Cheung (1993) egy primerpárt fejlesztett ki, amellyel repcében, a Chenopodium spp.-ben és az Amaranthus spp.-ben egyetlen PCR reakcióval ki tudták mutatni a psbA gén régióját, ahol a mutáció bekövetkezett. Ugyanezzel a primerpárral több növény fajban, még egyszikűekben is, mint az árpa (Rios és mtsai 2003) ugyanazt a fragmentumot kapták. Ez a primerpár egy 277 bp méretű PCR terméket ad mind a triazin rezisztens, mind a triazin fogékony növényekben. E fragmentumon belül a pontmutáció szekvenálás nélkül is kimutatható.
A psbA gén atrazin rezisztens biotípusa elkülöníthető a fogékonytól, mivel a BstXI-es
restrikciós endonukleáz a mutáció helyén vágja ezt a szekvenciát (Thomzik és Hain 1988). A MaeI restrikciós enzim felismerési szekvenciája szintén itt található, de csak a fogékony biotípust vágja (Cheung és mtsai 1993).
A teljes psbA gén amplifikálása egy másik primerpárral (trnH+trnK) lehetséges, melyet Demesure és mtsai (1995) fejlesztettek ki. Ezt a primerpárt szintén univerzálisnak tartják, mivel különféle növényeken végzett vizsgálatok során egyetlen 1.800 bp méretű, a psbA gént tartalmazó fragmentumot szaporított fel. Ez a fragmentum tartalmazza az egész gént és a gén promóter és 5’UTR (5’ untranslated region) régióját is. A psbA gén fényre indukálódik, és a legintenzívebben átíródó növényi gén (Kim és mtsai 1993, Mayfield és mtsai 1995). A promóter a génkifejeződés szabályozásában a transzkripció szintjén vesz részt, az 5’UTR pedig a transzláció folyamatában játszik szerepet. A psbA gén promótere egy jól ismert promóter, amely tartalmazza a ”-10”
(TATAAT) és a “-35” (TTGACA) konzervált elemeket (Igloi és Kössel 1992, Hayashi és mtsai 2003). Az 5’UTR a promóter és a gén kódoló régiója között helyezkedik el, és szabályozza, hogy fény hatására a psbA gén mRNS-éről a D1 fehérje transzlációja induljon el (Staub és Maliga 1993). Így meghatározó szerepe van a poszttranszkripcionális génszabályozásban (Shen és mtsai 2001).
Frey és mtsai (1999) a psbA gént vizsgálták a közönséges aggófűben (Senecio vulgaris). Eredményeik arra utaltak, hogy e növény kloroplasztisz genomja polimorf, de ez a polimorfizmus nem csak egyedszintű, hanem az egyes növények levelei között is találhatók eltérések. Ezt a jelenséget, amikor egy növényben illetve egy sejtben több kloroplasztisz vagy mitokondrium genotípus található meg, heteroplazmásságnak nevezzük.
2.6.3 A parlagfű atrazin-rezisztens biotípusának elterjedése Magyarországon A rezisztens gyombiotípusok megjelenését és elterjedését az ország egész területére kiterjedő monitoring vizsgálatokkal a Komárom-Esztergom Megyei és a Somogy Megyei Növény- és Talajvédelmi Szolgálat követi nyomon. A rezisztens biotípust először az 1992-ben gyűjtött Somogy megyei magmintákból mutatták ki. Az 1999-2001 között Somogy megyei minták 50 százaléka atrazin rezisztensnek bizonyult. 2000-re a rezisztens változat már megjelent Vas és Tolna, valamint az Alföldön is Békés megyében. Baranya és Zala megyéket 2001-ben érte el, és az országosan vizsgált összes csíraképes magminta 36 százaléka bizonyult rezisztensnek. Ezeknek az adatoknak az ismeretében megállapítható, hogy a parlagfű atrazin-rezisztens biotípusa hasonlóan –
bár sokkal rövidebb idő alatt – terjedt el, mint korábban a hazánk délnyugati részéből kiinduló szenzitív típus (Hartmann és mtsai 2003).
2.7 Az acetolaktát–szintetáz (ALS) működést gátló herbicidekkel szembeni rezisztencia
2.7.1 Az ALS-gátló herbicidek rövid jellemzése
Az ALS (acetolaktát-szintetáz) enzim, amely azonos az AHAS-sal (hidroxi-ecetsav- szintetáz) az elágazó szénláncú aminosavak (leucin, izoleucin, valin) szintézisében játszik szerepet, öt herbicidcsoport hatáshelye (Scarabela és mtsai 2004). Ez az öt herbicidcsoport, melyekhez számtalan hatóanyag tartozik a szulfonil-ureák, imidazolinonok, triazolpirimidin szulfonanilidek, pirimidiniltio-benzoátok és szulfonilaminokarbonil-triazolinonok. Ezekbe a csoportokba tartozó hatóanyagok megjelenésével, kezdve a legelsővel a klórszulfuronnal forradalmi változás kezdődött a herbicidek felhasználásában az addig alkalmazott kg/ha-os dózisokat a g/ha váltotta fel.
Mára az ALS-gátlók a legszélesebb körben használt herbicidek lettek a világon (Tranel és Wright 2002).
A kultúrnövények toleranciája az ALS-gátló herbicidekkel szemben a gyors metabolikus lebontásából ered. A termesztett növények, mint a búza, kukorica, árpa, rizs és a szója más-más helyen hatástalanítják, bontják meg a hatóanyag szerkezetét (Kádár 2001).
Az ALS-gátlók a xylémben és a floémben egyaránt transzlokálódó szisztemikus mikroherbicidek, melyek a gyökéren és a levélen keresztül is képesek elpusztítani az érzékeny növényeket. Felhasználási területük széles, pre- és posztemergensen is alkalmazhatóak egy- és kétszikű gyomok ellen. A herbicid felvétele gyors, a pusztulás azonban hosszú, általában 7-17 nap (Kádár 2001).
2.7.2 Az ALS-gátlókkal szembeni rezisztencia mechanizmusa és öröklődése a gyomnövényekben
Jelenleg a világon az ALS gátló herbicidekkel szemben 95 rezisztens gyomfaj ismert.
Az ALS gátló herbicidekkel szemben rezisztens parlagfüveket először 1998-ban, az USA-ban találtak, Magyarországon még nem ismert ez a biotípus (www.weedscience.org). Az ALS gén két reprezentatív szakasza az A és a B régió. Ez a két szakasz kódolja az ALS fehérjének azon részét, ahol a herbicidek kapcsolódnak az
enzimhez, így megakadályozák annak működését (Tranel és Wright 2002). Az ALS fehérje funkcióját a kloroplasztiszban fejti ki, az első enzim az elágazó szénláncú aminosav bioszintézisben (Tranel és Wright 2002). Az ALS gén a nukleáris genomban kódolt és a Mendeli öröklésmenetet követi, így az ALS gén alléljai a pollennel és a maggal is terjednek (Tranel és Wright 2002). Az ALS-A és ALS-B régiókban, ha bekövetkezik a Sathasivan és mtsai (1990) által Arabidopsis thaliana-ban meghatározott öt pontmutáció valamelyike, akkor kialakul a rezisztencia (Gutteri és mtsai 1996, Wright és mtsai 1998). A rezisztenciát okozó aminosav cserék a különböző gyomnövényekben az ALS-A régióban a következők voltak: Ala122/Thr122, Pro197/Ser197, Ala205/Val205 az ALS-B régióban: Trp574/Leu574, Ser653/Thr653 (McNaughtona és mtsai 2005).
Patzoldt és mtsai (2001) négy fogékony és két rezisztens parlagfüvet hasonlítottak össze az ALS-A és ALS-B szekvencia alapján. Arra a következtetésre jutottak, hogy a rezisztenciát ebben a populációban a Trp574-es aminosav (triptofán) leucinra cserélődése okozza. Azt is bizonyították, hogy az általuk vizsgált mintákban a 653-as aminosav, - amely a legtöbb növényben szerin - a parlagfűben alaninra változott, de ez az aminosav csere nem váltott ki rezisztenciát. Zheng és mtsai (2005) szerint a parlagfű ALS rezisztenciájának meghatározó oka a Trp574/Leu574 aminosav csere, valamint a rezisztencia mértékét befolyásolja, hogy a mutáció heterozigóta vagy homozigóta formában van-e jelen az adott növényben. Keresztrezisztenciát is kimutattak, szulfonilureákkal, imidazolinokkal és a triazol-pirimidinekkel szemben (Taylor és mtsai 2002, Tranel és mtsai 2004, Zheng és mtsai 2005).
Tranel és mtsai (2004) az USA három államában - Illinois, Minnesota és Ohio - vizsgálták az ALS-A szekvencia változatosságát 24 db parlagfűben (Ambrosia artemisiifolia), 24 db bojtorján szerbtövisben (Xanthium strumarium) és 10-10 db disznóparéjban (Amaranthus hybridus, Amaranthus tuberculatus). A legtöbb polimorfizmust a parlagfűben találták, a 24 egyedben 48 db SNP-t (Single Nucleotide Polymorphism) detektáltak. A két Amaranthus faj húsz egyedében összesen 7 polimorf nukleotid volt, a szerbtövisben nem fedeztek fel eltérést az egyedek között.
2.8 A parlagfű pollenallergia és az Amb a I géncsalád
Az allergia fogalmát a 20. század első évtizedében Clement von Pirquet vezette be a tuberkulózissal kapcsolatban. A fogalmat ma szélesebb körben használják: betegségek és állapotok sorát jelöli, amelyeknél egy adott szervezet másképpen reagál a külső
antigénekkel (legtöbbször fehérjékkel) szemben egy ismételt találkozásnál, mint ahogyan azt más emberi szervezetek teszik és ezen reakció során kóros és ártó tünetek jelentkeznek (Cserháti 2006). A XX. század második felében rohamosan növekedett világszerte az allergiás és asztmás betegek száma elsősorban a technikai civilizáció közepes vagy magasabb szintjén álló országokban, és e betegségek kezelése egyre növekvő költségeket jelent (Cserháti 2006). Magyarországon 2005-ben a légúti allergiák kezelésére 17 milliárd forintot fordítottak (Nékám és Páldy 2008).
Világszerte az allergiás megbetegedések egyik leggyakoribb kiváltói a pollenek. Az általánosan elfogadott szakmai vélemény szerint a pollinózisok legalább 50%-ában a parlagfű oki vagy társtényező (Kazinczi és mtsai 2009). Ennek az a magyarázata, hogy a parlagfűpollen erős allergén és egy átlagos növény nyolcmilliárd virágporszem termelésére képes 2-3 hónap alatt (Béres és mtsai 2005). Juhász és Juhász (2002) megállapítása szerint Magyarországon az ürömlevelű parlagfű virágpora a szezonális pollenkoncentráció 60-71 %-át teszi ki. Pollenje erős allergén, mert nagyon aktív, és hatékony antigént tartalmaz, amely a pollenből az orrnyálkahártyán keresztül másodpercek alatt diffundál, így a tünetek szinte azonnal jelentkeznek (Béres és mtsai 2005). Ez az antigén egy fehérje, amit az Amb a I géncsalád kódol (Rafnar és mtsai 1991). Az Amb a I fehérje a pollen fehérjetartalmának a 6%-át teszi ki, de az allergiás reakciók kb. 90 %-áért az Amb a I specifikus antitestek a felelősek (Lockey és Ledford 2008). Amb a 2-től egészen Amb a 9-ig izoláltak már kisebb molekulasúlyú allergén fehérjéket, de ezek jelentősége is jóval kisebb az allergia kialakulásában (Lockey és Ledford 2008).
Az Amb a I fehérje 38 kDa nagyságú, lánc formájú és savas jellegű (Rafnar és mtsai 1991). Az Amb a I génnek eddig négy változatát azonosították cDNS szinten. Rafnar és mtsai (1991) parlagfű pollenből izolált mRNS-eket írták át cDNS-é és elemezték az Amb a I.1, Amb a I.2 és Amb a I.3 génváltozatokat nukleinsav és aminosav szinten.
Griffitha és mtsai (1991) az Amb a I gén kódoló régiójának negyedik változatát (Amb a I.4) is leírták. A parlagfű genetikai változékonyságából arra lehet következtetni, hogy a génnek még több változata létezhet.