N
EHEZEN BONTHATÓ,
VAGY TOXIKUS KOMPONENSEKET TARTALMAZÓ IPARI SZENNYVIZEK BIOLÓGIAI KEZELÉSE(Ph.D. disszertáció)
Készítette: Farkas Ferenc okl. vegyészmérnök Témavezetõ Dr. Németh Károly
egyetemi tanár az MTA doktora
Nyugat-Magyarországi Egyetem Erdõmérnöki Kar
Kémiai Intézet
2003.
Nehezen bontható, vagy toxikus komponenseket tartalmazó ipari szennyvizek biol ógiai kezelése
Értekezés doktori (PhD) fokozat elnyerése érdekében, a Nyugat-Magyarországi Egyetem Kitaibel Pál Doktori Iskolája,
Környezettudományi programjához tartozóan.
Írta:
Farkas Ferenc
Témavezetõ: Dr. Németh Károly Elfogadásra javaslom (igen / nem)
(aláírás)
A jelölt a doktori szigorlaton …... % -ot ért el,
Sopron, …...
a Szigorlati Bizottság elnöke
Az értekezést bírálóként elfogadásra javaslom (igen /nem) Elsõ bíráló (Dr. …... …...) igen /nem
(aláírás)
Második bíráló (Dr. …... …...) igen /nem (aláírás)
(Esetleg harmadik bíráló (Dr. …... …...) igen /nem (aláírás)
A jelölt az értekezés nyilvános vitáján…...% - ot ért el
Sopron,
………..
a Bírálóbizottság elnöke
A doktori (PhD) oklevél minõsítése…...
………..
Az EDT elnöke
K
ÖSZÖNETKöszönöm a Kémiai Intézet munkatársainak segítségé t, mindenek elõtt Dr. Németh Károly egyetemi tanárnak a munka szakmai irányításáért, nélkülözhetetlen tanácsaiért.
Megkülönböztetett köszönettel tartozom Dr. C. P. L. Grady professzornak, hogy a kí- sérleti munka egy részét az általa vezetett Clemson University Environmental Engineering and Science tanszék (USA), világhírû laboratóriumában vége zhettem.
Köszönöm a Nitrokémia Rt. vezetõségének, hogy helyszíni kísérleteimhez biztosították a szakmai és a tárgyi feltételeket.
Köszönöm családomnak az irányomb an tanúsított türelmet és megértést, különösen lá-
nyaimnak, Gabinak, Dórának, és Annának, valamint feleségemnek, Mariannának.
T
ARTALOMJEGYZÉK1. Bevezetés, célkitûzések...3
2. Irodalmi áttekintés ...5
1.1. A szennyvíztisztítás folyamatai...5
2.1.1. A szennyezõanyagok jellegének és koncentrációjának hatása biológiai eltávolíthatóságukra ...5
2.1.2. A bioreaktor elrendezés hatása a szervesanyag lebontás sebességére ...5
2.1.2.1. A tökéletesen kevert bioreaktor...6
2.1.2.2. Ideális csõreaktor ...6
2.1.2.3. Párhuzamosan és sorosan kapcsolt tökéletesen kevert bioreaktorok tartózkodási idejének összevetése adott tisztítási hatásfok mellett ...7
2.1.3. Az eleveniszap szerkezete...9
2.1.4. Toxikus anyagok hatása az eleveniszap szerkezetére...10
2.2. Biológiai tápanyag-eltávolítás ...11
2.2.1. Mikrobiális nitrogén-eltávolítás...11
2.2.1.1. Nitrifikáció ...12
2.2.1.2. Toxikus anyagok hatása a nitrifikációra...13
2.2.1.3. Denitrifikáció ...14
2.2.2. Mikrobiális foszfor-eltávolítás ...16
2.2.3. Mikrobiológiai tápanyag-eltávolítást biztosító eleveniszapos rendszerek...17
2.2.4. Az eleveniszapos rendszerek mûködésének kinetikai leírása...18
2.3. A kinetikai vizsgálatok fontossága és módszerei...18
2.3.1. Extant kinetika mérési elve...20
3. Kísérleti rész...23
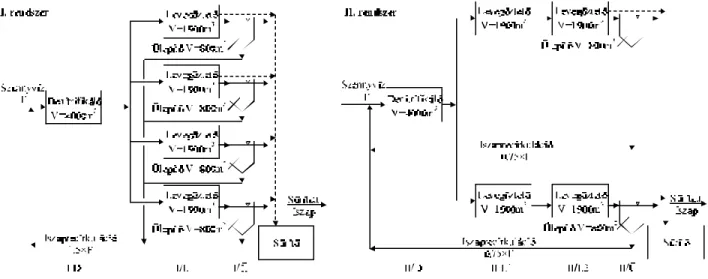
3.1. Folytonos üzemû kísérletek...23
3.1.1. A kísérletek célja...23
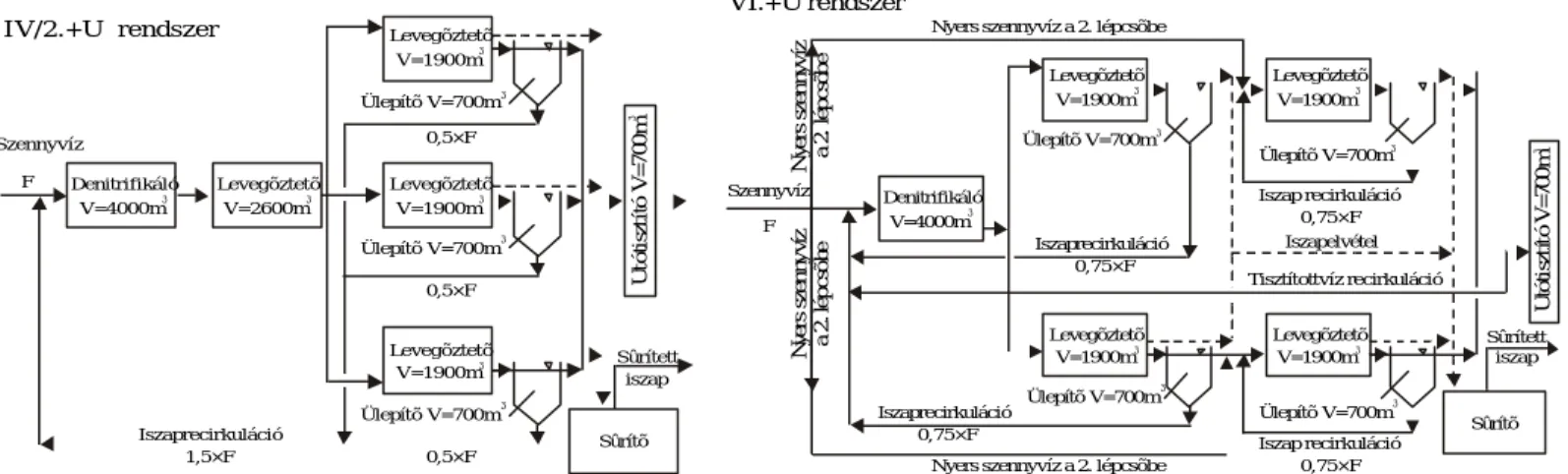
3.1.2. A hatékonyságnövelésre szoruló rendszer ismertetése...23
3.1.3. Párhuzamosan és sorosan kapcsolt elrendezések összehasonlítása...24
3.1.3.1. Kísérleti berendezések és a vizsgált szennyvíz...24
3.1.3.2. Kísérleti módszerek...26
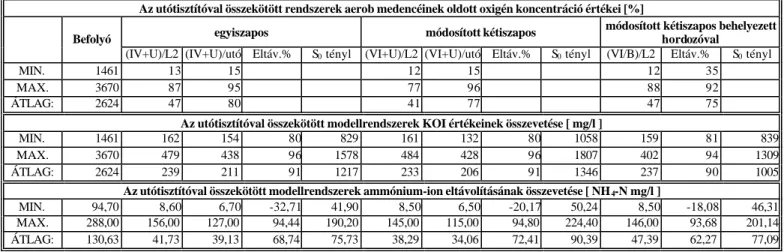
3.1.3.3. Az alapelrendezések kísérleti eredményei...26
3.1.3.4. Az alapelrendezések összehasonlító értékelése...35
3.1.4. Egy és kétiszapkörös soros rendszerek összevetése...37
3.1.4.1. A modellrendszerek leírása...37
3.1.4.2. A vizsgált paraméterek és az alkalmazott analitikai módszerek...37
3.1.4.3. Az eredmények értékelése...38
3.1.5. Az új, módosított kétiszapos bioreaktor elrendezés kidolgozása...40
3.1.5.1. A kísérleti modellek...40
3.1.5.2. A kísérlet menete, a vizsgált paraméterek...41
3.1.5.3. Kísérleti eredmények...42
3.1.5.4. Az eredmények értékelése...42
3.1.6. Új kötöttágyas biológiai utótisztítási technológia kidolgozása...42
3.1.6.1. A tanulmányozott kísérleti elrendezések ...43
3.1.6.2. A kísérletek kivitelezése...44
3.1.6.3. Kísérleti eredmények...44
3.1.7. Az összekapcsolt új eleveniszapos és kötöttágyas technológiák tanulmányozása...47
3.1.7.1. Az összekapcsolt rendszerek elrendezése...47
3.1.7.2. A kísérlet menete ...47
3.1.7.3. Kísérleti eredmények...48
3.1.7.4. Kiegészítõ vizsgálatok ...49
3.1.7.5. Az összekapcsolt technológiák eredményeinek értékelése...51
3.2. Folytonos üzemû rendszerek modellezése szakaszos kísérletben...53
3.2.1. A kísérlettervezéshez használt számítások...53
3.2.1.1. A CMAS rendszerek jellemzõi...53
3.2.1.2. Az SBR jellemzése, elméleti megfontolások...53
3.2.2. Kísérleti eszközök és anyagok ...55
3.2.2.1. Kísérleti eszközök...55
3.2.2.2. Vizsgálati módszerek...57
3.2.3. A kísérlet menete...58
3.2.3.1. Kinetikai paraméterek F/M= 4,5 nap-1 aránynál (1. terhelési állapot)...58
3.2.3.2. Kinetikai paraméterek F/M= 9,0 nap-1 aránynál (2. terhelési állapot)...60
3.2.3.3. Kinetikai paraméterek F/M= 18,0 nap-1 terhelési aránynál (3. terhelési állapot)...61
3.2.3.4. Kinetikai paraméterek F/M= 2,25 nap-1 terhelési aránynál (4. terhelési állapot)...62
3.2.4. A kinetikai vizsgálatok eredményeinek összefoglalása...63
3.2.5. A soros bioreaktor elrendezés elõnyének kinetikai alapjai...68
4. Összefoglaló értékelés...69
5. Tudományos eredmények (Tézisek)...73
6. Irodalomi hivatkozások...75
Saját publikációk jegyzéke ...80
1. B
EVEZETÉS,
CÉLKITÛZÉSEKSzámos olyan technológia létezik világunkban, melyeket a természetben végbemenõ fizikai, kémiai vagy biológiai folyamatokról mintáztunk. Jó példa erre a biológiai szennyvíztisztítás, ahol nemcsak lemásoltuk a természetes vizekben lezajló folyamatokat, hanem aktívan felhasználjuk ezek talán legfontosabb résztvevõit, a mikroorganizmusokat.
A természetes élõvizek biológiai egyensúlyát már régóta vizsgálják a tudósok. A különbözõ elemek, szer- ves és szervetlen anyagok körforgását a tavakban, folyókban és tengerekben – illetve ezek kapcsolatát a bi- oszféra egészével – ma már elég jól ismerjük, bár számtalan nyitott kérdés van még a témával kapcsolatban.
Ha a természetes élõvizek biológiai egyensúlyát akarjuk megérteni, akkor a különbözõ létfontosságú ele- mek (C, O, N, P stb.) körforgását külön-külön kell megvizsgálni, illetve fel kell fedni az élõ szervezetek sze- repét ebben a rendkívül bonyolult és érzékeny folyamatban.
A természetes vizekben élõ egysejtûekre, mikroorganizmusokra óriási feladat hárul a körfolyamat fenn- tartásában. Egyrészt azért, mert a tápláléklánc legalsó szintjét alkotják, másrészt pedig ezek végzik a külön- bözõ természetes forrásokból érkezõ szerves és szervetlen anyagok lebontását, átalakítását. A lebontási fo- lyamatban természetesen más szervezetek is részt vesznek, azonban a biológiai szennyvíztisztítás szempont- jából a mikroorganizmusok által végzett munkára érdemes leginkább koncentrálni.
Az elsõsorban biológiai eredetû szerves és kisebb részben szervetlen anyagok mikroorganizmusokkal végzett lebontásának, vizes fázisból történõ eltávolításának üzemesített, intenzifikált változata az elevenisza- pos szennyvíztisztítás (Activated Sludge Treatment). Az ilyen rendszer a mikroorganizmusokat szuszpendált állapotban, úgynevezett eleveniszap formában folyamatosan vagy ciklikusan visszaforgatva hasznosítja. A ciklusok végén az utóülepítés során az iszap leülepszik, és a tisztított víz távozik a rendszerbõl. A mikroorga- nizmusok a számukra táplálékot jelentõ szennyezõ anyagokat folyamatos szaporodás közben részben szén- dioxiddá oxidálják, részben beépítik szervezetükbe, s az élõ, illetõleg elhalt sejtek fölöslegét iszap formájá- ban távolítják el a vízbõl, illetõleg a szennyvíztisztítóból. Ez a napi iszaphozam, a fölösiszap folyamatosan elvételre kerül, egy elhanyagolható része pedig rendszerint az elfolyó vízzel távozik.
Az eleveniszap visszaforgatott, recirkulált része a reaktorban keveredik a nyers szennyvízzel. A szennyvíz összetétele, a keverés intenzitása, illetve az aerob zónában az oxigénellátás mértéke meghatározója a mikro- organizmusok szaporodásának, melyek együttélése kifejezetten dinamikus jellegû. A folyamatosan változó intenzitással és összetétellel érkezõ szennyvíz fizikai és kémiai jellemzõi, valamint a mindenkori környezeti feltételek együttesen alakítják ki az adott szennyvízre jellemzõ mikrobiológiai populációt. A biológiai tisztí- tás ilyen formáját fizikai (durvarács, finom rács, elõülepítés) és szükség esetén kémiai (többletfoszfor eltávo- lítás) módszerekkel kombinálva használják kommunális szennyvizek tisztítására.
A környezetvédelem fokozott elõtérbe kerülése, a befogadókba jutó különbözõ – szerves és szervetlen – anyagok által kiváltott folyamatok feltárása és ezzel összefüggésben a szennyvíztisztítás nyomán elõálló tis z- tított szennyvízzel szemben támasztott követelmények szigorodása, világszerte új eljárások alkalmazását tette szükségessé. Így került elõtérbe az ún. biológiai tápanyag-eltávolítás, amelynek feladata a szervetlen nitro- gén- és foszforvegyületek eltávolítása, melyek mindenekelõtt az állóvizek – és ezen belül is elsõsorban a s e- kély vízmélységû tavak – természetes állapotát alapvetõen veszélyeztetik, azok ún. eutrofizációjához (növé- nyi túlburjánzáshoz) vezetnek.
A megoldás érdekében, a tisztítandó szennyvíz összetételének és az elérendõ tisztítási célnak megfelelõ- en, a különbözõ kutatómûhelyekben nagyszámú eljárás került kidolgozásra. A biotechnológia robbanásszerû fejlõdése nyomán – fentiek mellett, ill. azokon túlmenõen – bizonyítást nyert az, hogy a szennyvíztisztító bioreaktorok elrendezése, azok tagolása ill. térkiosztása, alapvetõen befolyásolhatja a tisztítási folyamat haté- konyságát.
A hazai gyakorlat a tisztított szennyvízzel szemben támasztott követelmények tekintetében – többek kö- zött a Balaton védelme érdekében – a legszigorúbb külföldi szabványokhoz igazodik [1]. Ennek megfelelõen szükségesnek bizonyul az, hogy ebben a térségben is a legkorszerûbb technológiákat alkalmazzák. Feltétlenül szem elõtt kell tartani azonban azt, hogy – a szennyvíz minõségi eltéréseibõl fakadóan – más országokban vagy azok egyes vidékein jól bevált eljárások csupán körültekintõ adaptáció nyomán alkalmazhatók a kívánt sikerrel. A hatékony és gazdaságos tisztítási technológia kialakításánál fontos tényezõ a biológiai tisztítást végzõ reaktorterek – a tisztítandó szennyvíz jellegzetességeihez igazodó – optimálása.
Különösen nagy körültekintéssel kell eljárni abban az esetben, amikor a szennyvíz toxikus jellegû anya- gokat tartalmaz.
A kutatás során célunk volt:
− Olyan szennyvíztisztítási technológia kidolgozása, amellyel folyamatosan tartható az elfolyó tisztított szennyvíz határérték alatti szervesanyag- és összes nitrogén tartalma, vagyis, hogy a bejövõ ~3000 mg/l-
es kémiai oxigén igény, és az ~50 mg/l NH4-N koncentráció a szennyvízbírság-rendeletben [1] megadott határérték alá csökkenjen,
− A technológiai berendezések eltérõ kapcsolásával kialakított rendszerek hatékonyságának vizsgálata, a legfontosabb paraméterek összevetése, a különbözõ elrendezések egymással szembeni elõnyeinek és hát- rányainak megállapítása, ezek alapján javaslat tétel az intenzifikált technológiára,
− Olyan új tisztítórendszer kidolgozása, amely elég rugalmas ahhoz, hogy sokkal alacsonyabb vagy maga- sabb terhelésû idõszakokban is megfelelõen és gazdaságosan mûködjön,
− A kialakított technológia mûködésének analitikai vizsgálatai során kapott eredmények alkalmasak legye- nek – egy megfelelõen megalkotott kinetikai modell segítségével – a változtatások hatásának számítógé- pes tervezhetõségére, továbbá a megalkotott modell segítségével az egyedi (kritikus) komponensek eltá- volítása félüzemi kísérletek nélkül szá mítható legyen.
2. I
RODALMI ÁTTEKINTÉS2.1. A szennyvíztisztítás folyamatai
A szennyvíztisztítás folyamata több lépésbõl áll, egy lehetséges felosztási rendszert tartalmaz az 1. táblá - zat. [2]
1. táblázat. Szennyvíztisztítási eljárások
Mód Cél Eszköz/Folyamat
I. rendû tisztítás
(mechanikai) durva, mechanikai szennyezõdések eltávolítása
horizontális-, vertikális ülepítõk, hidrociklonok, ívszi- ták, szeparátorok, elõszûrõk, stb. flokkuláció, majd üle- pítés
II. rendû tisztítás (biológiai)
a) finom, kolloid-diszperz anyagok elt ávolítása b) oldott (fõ tömegben) szerves és szervetlen anyagok
eltávolítása
biológiai oxidáció (helyenként anaerob lebontás)
a) maradék szerves és szervetlen anyagok eltávolítása fizikai-kémiai módszerek: ioncsere, molekulaszita, ad- szorpció, reverz-ozmózis, elektrolitikus oxidáció stb.
b) eutrofizáció gátlása: P, N megkötése Foszfor: Ca-, Al-, Fe-sók
Nitrogén: nitrifikáló- és denitrifikáló baktériumok
c) csírátlanítás Cl2, O3
III. rendû tisztítás (kémiai utókezelés)
d) lebegõanyag mentesítés homokszûrõ, mikroszûrõ
A biológiai tisztítási eljárások – mivel egyre növekszik a biológiailag nem, vagy csak nehezen bontható szennyezõ komponensek mennyisége – egyedül nem mindig tudják biztosítani a kívánt vízminõséget, mégis bizonyos esetekben egyedül alkalmazható módszernek tekinthetjük, különösen szerves anyagok, valamint nitrogén és foszfor részleges vagy teljes eltávolítására [3]. A biológiai szennyvíztisztítás gyakorlatában a szennyvíz tisztítására különbözõ mûtárgyakat alkalmaznak. A legelterjedtebb módszerek: csepegtetõtestes-, tavas- eleveniszapos-, árkos szennyvíztisztítás.
2.1.1. A szennyezõanyagok jellegének és koncentrációjának hatása biológiai eltávolít- hatóságukra
A szennyvíztisztításra kerülõ anyagokat abból a szempontból, hogy a mikroorganizmusok tevékenységét hogyan befolyásolják, alapvetõen a következõképpen csoportosíthatjuk (1. ábra):
−
I: biológiailag bontható, nem mérgezõ−
II: biológiailag bontható, mérgezõ−
III: biológiailag nem bontható, nem mérgezõ−
IV: biológiailag nem bontható, mérgezõ1 rs
Relatív szubsztrátlebontási sebesség
Biológiailag bontható, nem mérgezõ
Biológiailag nem bontható, nem mérgezõ
Biológiailag bontható, mérgezõ Biológiailag
nem bontható, mérgezõ
Szervesanyag koncentráció S
1. ábra. A különbözõ típusú szennyvízkomponensek hatása a mikroorganizmusok anyagcsere sebességére
Ahhoz, hogy a tisztítandó szennyvíz biológiailag bontható, mérgezõ jellegûnek minõsüljön, nem szüksé- ges, hogy a toxikus anyagok benne túlsúlyban forduljanak elõ, elég, ha a szubsztrát-eltávolítási sebesség ma - ximumos görbét ír le a szennyezõanyag koncentráció (pl. KOI) függvényében [4]. Ezt a fajta viselkedést egy igen kis koncentrációban jelenlevõ, a bontást végzõ mikroflóra elég nagy hányadára mérgezõ hatást kifejtõ komponens is elõidézheti. A különbözõ vegyületek egymás toxicitását befolyásolhatják – erõsíthetik, vagy
gyengíthetik – így tehát nem elegendõ az egyes komponensek hatásának pontos ismerete. Az ipari eredetû szennyvizek többségének pontos összetétele azonban a legtöbb esetben nem is ismert, így bonthatóságuk meghatározásához, illetve a lehetõ legnagyobb fokú tisztítás eléréséhez szükséges reaktor elrendezés kivá- lasztásához egyedi kísérletekre van szükség.
Az eleveniszapos rendszer bioreaktorainak kialakítása (kevert- vagy csõreaktor) és az egyes egységek el- rendezése (soros vagy párhuzamos kapcsolása ill. ezek variációja) jelentõsen befolyásolja a bontást végzõ mikroflóra környezetében kialakuló szubsztrát koncentrációt (S – biodegradálható szervesanyag koncentráci- ót). Mivel a biodegradáció sebessége (rS) és a kialakuló iszap szerkezete egyaránt függ az S biodegradálható szervesanyag koncentrációtól, az eleveniszapos tisztító reaktorainak optimális kapcsolása a folyamat intenzifikálásának hatékony és egyben költségkímélõ lehetõsége.
2.1.2. A bioreaktor elrendezés hatása a szervesanyag lebontás sebességére
2.1.2.1. A tökéletesen kevert bioreaktor
A 2. ábrán egy tökéletesen kevert bioreaktor vázlata látható, amelyben a reaktorbeli és az onnan elfolyó szubsztrát-koncentráció – Se – definíciószerûen azonos.
2. ábra. Tökéletesen kevert bioreaktor vázlata
ahol: S0 – befolyó szervesanyag koncentráció Se – elfolyó szervesanyag koncentráció F – térfogatáram
V – reaktor térfogat
rs – a biodegradáció sebessége Az eleveniszapos bioreaktor differenciális anyagmérleg egyenlete:
V r S F S dt F
V⋅dS = ⋅ 0− ⋅ e + s⋅ (1)
Állandósult állapotban a reaktorbeli és az onnan elfolyó szubsztrát koncentráció idõben állandó, azaz:
dt 0
dS = így: s S
(
S0 Se)
V ) F r
(− e = − (2)
A biodegradáció sebessége nem független a szubsztrát koncentrációjától [5], alacsonyabb elfolyó szubsztrát koncentráció eléréséhez jelentõsen megnövelt tartózkodási idõre van szükség (3. ábra). Adott le- bontási hatásfok eléréséhez szükséges tartózkodási idõ (τ):
(
0 e)
S s
S ) S
r (
1 F ô V
e
− −
=
= (3)
A kívánt tisztítási hatásfok eléréséhez szükséges tartózkodási idõt a vonalkázott terület nagysága adja meg.
1 1
-rS -rS
a, Biológiailag bontható, nem mérgezõ szubsztrát
b, Biológiailag bontható, mérgezõ szubsztrát
S0 S0
Se Se
τ
egységes, tökéletesenτ
kevert tankreaktor
pillanatnyi lebontási sebesség
3. ábra. Adott tisztítási hatásfok eléréséhez szükséges tartózkodási idõ tökéletesen kevert tartályreaktorban
2.1.2.2. Ideális csõreaktor
Egy ideális csõreaktor vázlatos rajzát a 4. ábrán tüntettük fel.
4. ábra. Ideális csõreaktor vázlatos rajza
A visszakeveredés nélküli, ideális csõreaktor minden pontján más szubsztrát-koncentráció uralkodik, ún.
longitudinális gradiens alakul ki, s ennek megfelelõen a biodegradáció sebessége, s így az oxigénigény is, pontról pontra változó. Állandósult állapotban a reaktor egy-egy adott pontján mért szubsztrát-koncentráció idõben állandó. Adott tisztítási hatásfok eléréséhez szükséges tartózkodási idõ a (4) egyenlettel fejezhetõ ki [6].
∫
= =∫
−=V
0
S
S s
0
e
dS r 1 F V F
τ dV (4)
A (4) egyenlet grafikus megoldását, azaz egy ideális csõreaktorban S0 szennyezõanyag-koncentráció Se értékre való csökkentéséhez szükséges tartózkodási idõt az 5. ábra görbe alatti területe szolgáltatja.
1 1
-rS -rS
a, Biológiailag bontható, nem mérgezõ szubsztrát
b, Biológiailag bontható, mérgezõ szubsztrát
S0 S0
Se Se
τ
Ideális csõreaktorτ
5. ábra. Adott tisztítási hatásfok eléréséhez szükséges tartózkodási idõ ideális csõreaktorban
2.1.2.3. Párhuzamosan és sorosan kapcsolt tökéletesen kevert bioreaktorok tartózkodási idejének össze- vetése adott tisztítási hatásfok mellett
2.1.2.3.1 Tökéletesen kevert bioreaktor párhuzamos kapcsolású tagolása
A 6. ábrán egy osztatlan, tökéletesen kevert bioreaktor párhuzamosan kötött egységre tagolását szemlé ltettük.
6. ábra. Párhuzamosan kötött, tökéletesen kevert bioreaktorok vázlatos rajza
A párhuzamosan kapcsolt tökéletesen kevert reaktorokban elõálló tartózkodási idõket a (3) egyenlet segít- ségével az alábbiak szerint írhatjuk fel:
(
1)
e1
e 0 S s 1
1 S S
) r (
1 F
V −
= −
1=
τ (5)
(
2)
e2
e 0 S s 2 2
2 S S
) r (
1 F
V −
= −
=
τ (6)
(
n)
en
e 0 S s n
n S S
) r (
1 F
V −
= −
n =
τ (7)
A hipotézis szerint az elfolyó, tisztított vizek koncentrációja azonos, azaz:
n 2
1 e e
e S .... S
S = = = (8)
Ezt az Se értéket egy osztatlan, tökéletesen kevert reaktorban – S és F adott értéke mellett – V térfogatban érjük el, τ tartózkodási idõvel (3 egyenlet).
Amennyiben (7) egyenlet teljesül, úgy valamennyi reaktorban egységesen Se koncentráció uralkodik, így azokban a biodegradáció sebessége is azonos, azaz
(-rS)Se
1 = (-rS)Se2 = ... = (-rS)Sen (9)
A (3) és (8) egyenlõségek egyidejû teljesülésébõl következik, hogy az adott tisztítás i hatásfok eléréséhez szükséges tartózkodási idõ valamennyi reaktorban azonos, azaz:
τ1 = τ2 = ... = τn (10)
Mivel a kiindulási feltételek szerint egy reaktort osztottunk párhuzamosan kötött medencékre:
F1 + F2 + ... + Fn = F (11)
A (11) egyenletet a térfogatokkal kifejezve, és a 10 egyenletet figyelembe véve kapjuk, hogy τ
τ τ
τ
V V V
V
n
n =
+ + + ...
2 2 1 1
(12) A (12) egyenletet τ értékkel egyszerûsítve jutunk a (13) összefüggéshez, ami kimondja, hogy egy osztat- lan tökéletesen kevert reaktor mûködésében pontosan megfelel n db párhuzamosan kötött medencének.
V1 + V2 + ...+Vn = V (13)
Azaz F térfogatáramú szennyvíz megtisztítása S0 koncentrációról Se koncentrációra ugyanakkora párhuzamosan kötött, tökéletesen kevert medence térfogatot igényel, mint amekkora az egy osztatlan, tökéletesen kevert reaktor esetében lenne.
2.1.2.3.2. Tökéletesen kevert bioreaktor soros kapcsolású tagolása
Az 7. ábrán a sorba kapcsolt tökéletesen kevert bioreaktorok vázlatos rajza látható.
S, F0 S , Fe
Bioreaktor 1
V, r1 s
S , Fe
Bioreaktor 2
V, r2 s
S , Fen
Bioreaktor V , rn s
7. ábra. Sorosan kapcsolt tökéletesen kevert bioreaktorok vázlatos rajza Az egyes reaktorokban a tartózkodási idõket a (14) – (16) egyenletekkel fejezhetjük ki.
(
1)
e1
e 0 S s 1
1 S S
) r (
1 F
V −
= −
1=
τ (14)
(
2)
e2
e 0 S s 2
2
2 S S
) r (
1 F
V −
= −
=
τ (15)
(
n)
en
e 0 S s n
n S S
) r (
1 F
V −
= −
n =
τ (16)
A (14) – (16) egyenletek és az osztatlan tökéletesen kevert bioreaktorra felírható (3) egyenlet grafikus megoldásával az adott tisztítási hatásfok eléréséhez szükséges tartózkodási idõket a 8. ábrán vetettük össze. A 8. és 9. ábrák tanúsága szerint a sorba kapcsolt bioreaktorokban adott tisztítási hatásfok eléréséhez szükséges tartózkodási idõk összege mindkét esetben – toxikus, ill. nem toxikus szennyvíz – kisebb, mint az egységes reaktoré. Végtelen sok sorosan kapcsolt egységre tagoláskor jutunk el az ideális csõreaktorhoz, ahol a tartóz- kodási idõ a görbe alatti terület:
∫
∫
= = −= 0
e
S
S s
V
0
)dS r (
1 F V F
τ dV (17)
1 -rS
S0
Se
τ τ 1
τ
negységes, tökéletesen kevert tankreaktor sorba kötött tökéletesen kevert tankreaktorok ideális csõreaktor
8. ábra. Biológiailag bontható, nem mérgezõ szennyvíz adott hatásfokú megtisztításához szükséges tartózkodási idõk
1 -rS
S0
Se
τ 1
τ
nτ
9. ábra. Biológiailag bontható, mérgezõ (általában ipari) szennyvíz esetén a tartózkodási idõk összevetése A 9. ábrából kitûnik, hogy toxikus szennyvíz esetén célszerû a biológiai tisztítási folyamat elejére egy nagy KOI terheléssel, nagy lebontási sebességgel mûködõ reaktort helyezni (10. ábra), melynek feladata a beérkezõ szennyvíz koncentrációját az inhibíciós határ alá, vagy legalább annak közelébe vinni, a folyamat második részét pedig sorba kötött medencék segítségével véghezvinni.
S, F0 S , Fe
1 Bioreaktor
V , re2 s
S , Fe 2
10. ábra. A legkedvezõbb reaktor elrendezés
2.1.3. Az eleveniszap szerkezete
A biológiai szennyvíztisztítás mikrobiális folyamataira jellemzõ az abban résztvevõ mikroorganizmusok sokfélesége, a szennyezõanyag lebontást végzõ mikroflóra nagyfokú heterogenitása.
Az eljárás során kialakuló eleveniszap fizikai és mikrobiológiai állapota alapvetõen a beérkezõ szennyvíz összetételétõl, koncentrációjától és a reaktorelrendezéstõl függ. A fajok szelektálódásának vezérlõ mecha- nizmusa az egyes mikroorganizmusok adott körülmények közötti fajlagos növekedési sebessége. Az eleven- iszapos szennyvíztisztító rendszerek mûködésének egyik alapvetõ kérdése a lebegõanyag – ezen belül a bon- tást végzõ mikroflóra – és a tisztított víz elválaszthatósága. Ebbõl a szempontból az iszap szerkezetének há- rom alapvetõ formáját különböztethetjük meg a 11. ábra szerint. Az iszap szerkezetét a flokkulens és fonalas baktériumok aránya határozza meg.
I.
Puffadó iszap, fonalasok tú lsúlya
II.
Fonalasok és flokkulensek megfelelõ aránya
III.
Fonalasok hiánya, zavaros felü lúszó 11. ábra. Az iszap pehelyszerkezetének típusai
Az elsõ esetben (I. típus) az iszap nehezen tömörödik, hosszú az ülepedési idõ, igaz, a felülúszó szinte le- begõanyag mentes. Viszont a hosszú ülepedési idõ alatt az iszap alacsony (~0) oldott oxigénszint mellett tar- tózkodik az ülepítõben, tovább növelve a fonalasok túlsúlyba kerülésének esélyét (12. ábra). A III. típusú iszap kialakulásában a fonalasok teljes, vagy viszonylagos hiánya játszik szerepet. Ilyenkor az ülepedés gyors, a leülepedett iszap igen kedvezõ iszapindexet (az ülepített iszap térfogatának és tömegének hányadosa, vagyis az egységnyi tömegû iszap által elfoglalt térfogatot jellemzõ szám) mutat, de a felülúszó zavaros, ami az elfolyó víz KOI értékét nagymértékben növeli.
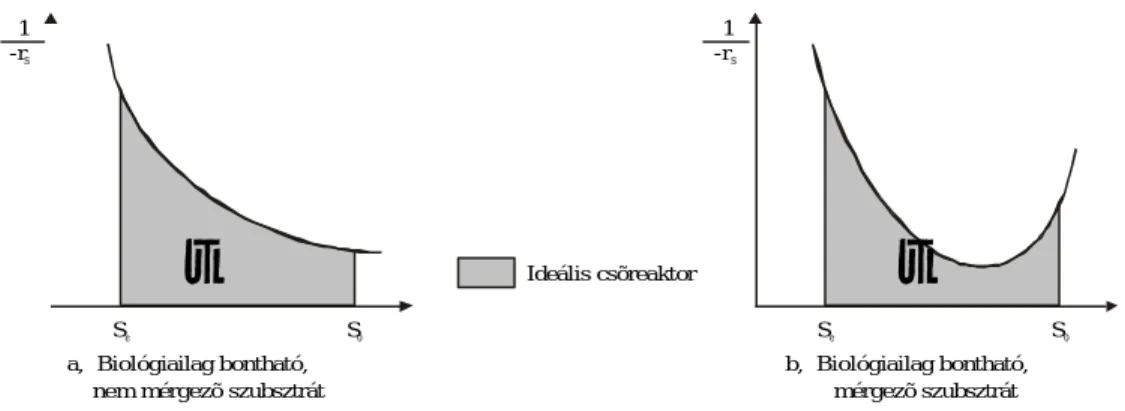
Nyilvánvaló tehát, hogy a szennyvíztisztító rendszereket úgy kell üzemeltetni, hogy a II. jelû – legkedve- zõbb – iszapszerkezet alakulhasson ki, ami a gyakorlatban annyit jelent, hogy a különbözõ reaktor elrendezé- sek segítségével a fonalas és a flokkulens mikroorganizmusok arányát a megfelelõ értékre állítjuk be. Általá- nosan elfogadott, hogy alacsony oldott oxigén koncentráció érték mellett a fonalas szervezetek gyorsabban növekednek, mint a flokkulens mikroorganizmusok. (12. ábra) [7, 8].
A fonalas mikroorganizmusok affinitása nemcsak az oldott oxigénhez, hanem a tápanyagokhoz is na- gyobb, mint a flokkuláló zoogloeás szervezeteké, a 13. ábra tanúsága szerint.
Oldott O konc.2
µ Fajlagos
szaporodási sebesség
Flokkulens
Fonalas
12. ábra. A fonalas és flokkulens mikroorganizmusok szaporodásának oldott oxigén koncentráció függése
13. ábra. A fonalas és flokkulens mikroorganizmusok szaporodásának szervesanyag koncentráció függése
A fonalas mikroorganizmusok szubsztrát-eltávolítását általában viszonylag alacsony maximális növeke- dési sebesség (µmax) és kis szubsztrát telítési állandó (KS érték) jellemzi, így alacsony szubsztrát-koncentráció értékek mellett gyorsabban növekednek, (13. ábra) mint a flokkuláló, zoogloeás szervezetek.
Amennyiben a szennyvíz tisztítására egy egységes, tökéletesen kevert tartályreaktort alkalmazunk, és vi- szonylag nagy szubsztrát-eltávolítási hatásfokot kívánunk elérni, akkor a reaktor minden pontján az elfolyó Se koncentráció uralkodik, ami kedvez a fonalas szervezetek növekedésének. Ennek megfelelõen a koncent- ráció-gradienst alkalmazó csõreaktor típusú, ill. a sorba kapcsolt reaktorokat képviselõ kaszkád rendszerek feltétlenül kedvezõbb iszapszerkezet kialakulásával kecsegtetnek, mint az egységes tökéletesen kevert reaktor [8, 9].
2.1.4. Toxikus anyagok hatása az eleveniszap szerkezetére
A biológiai szennyvíztisztítás sikere sok esetben azon múlik, hogy a tisztítást végzõ eleveniszap az utó- ülepítõben megfelelõen elválasztható-e a tisztított szennyvíztõl. Ezért a szennyvíztisztítás folyamán az egyik legfontosabb biotechnológiai mûvelet a baktériumok egymáshoz kapcsolása, és az aggregátum formálás. Az eleveniszap egy olyan összetett rendszer, amely baktériumok, protozoák, vírusok és egyéb más szervezetek összességébõl épül fel [10]. A bioreaktor konfiguráció, következésképpen a tisztítandó szennyvíz betáplálási módja alapvetõen befolyásolja a kialakuló eleveniszap szerkezetét, mivel különbözõ koncentrációprofilok ki- alakulását eredményezi [11, 12, 13]. Az esetek döntõ többségében az elválasztási problémák a fonalas szer- vezetek túlzott elszaporodásából fakadnak, ezért a tanulmányok túlnyomó része azok növekedésének vissza- szorításával foglalkozik. Mindemellett a szakirodalomban ismertek olyan esetek is, amikor az elválasztás ne- hézségét az okozza, hogy a mikroorganizmusok nem képeznek elég nagy, és jól ülepedõ flokkulumokat, cs u- pán apró aggregátumok formájában fordulnak elõ a szennyvízben, amelyek a kis sûrûségkülönbség miatt ne- hezen ülepíthetõk. A kialakult iszapszerkezet eredményeképpen az utóülepítõrõl elfolyó szennyvíz zavaros, sok lebegõanyagot tartalmaz [14]. Ilyen esetekben alkalmazni lehet segédanyagokat a flokkuláció javítására, ill. a kialakult flokkulumok méretének növelésére. Nagyobb iszappelyhek esetén az ülepedési tulajdonságok javulnak, az elfolyó víz kevesebb lebegõanyagot tartalmaz, és kevésbé zavaros [15].
Néha az inhibíciós vegyületeknek tulajdonított viselkedést (szétesett pelyhek, rossz ülepedés, zavaros fe- lülúszó stb.) valamely nyomelem hiánya okozza, amely tévútra vezetheti a szennyvíztisztító telepet üzeme l- tetõ szakembereket, sõt, a rendszer kifejlesztését, vagy intenzifikálását végzõ kutatókat is [16]
Toxikus anyagok lökésszerû terhelésekor a tisztítást végzõ eleveniszap jelentõs mennyiségû K+ iont juttat a környezetbe [17]. Feltételezhetõ, hogy ezt a baktériumok toxikus, elektrofil (tiol reaktív) vegyületek sokk- szerû terhelésére adott védekezõ válaszának rendkívül bonyolult mechanizmusa okozza. A legtöbb esetben a toxikus vegyületek szignifikáns deflokkulációt okoznak egy olyan alacsony koncentrációnál, amely sokkal kisebb, mint amely a maximális specifikus növekedési sebesség 50%-os csökkentéséhez (IC50) szükséges, ezért a deflokkulációt megelõzõ inhibíció aerob respirometriásan nem detektálható. Ez szintén arra utal, hogy a toxin indukált eleveniszap deflokkulációt a baktériumok védekezõ mechanizmusa okozza. Sokkal fonto- sabb azonban, hogy a kibocsátott K+ mennyisége jól korrelál a deflokkuláció mértékével. Más kationok transzportja (beleértve a nátrium, kalcium, magnézium, vas, és alumínium ionokat is) a flokkulumba, vagy flokkulumból, elhanyagolható a K+ kibocsátáshoz képest. Az is érdekes, hogy a K+ kibocsátás azonnal meg- indul (néhány percen belül) a toxin adagolás után, és ezt azonnal követi az elfolyó turbiditásának növekedése.
Egyes szerzõk [18] az iszapkor alapján felépített modell bevezetését javasolják, a flokkulum struktúra meghatározásához. Ezek szerint alacsony iszapkornál – valószínûleg a viszonylag kicsi polimer termelés mi- att – olyan iszapszerkezet képzõdik, amely gyenge kölcsönhatásokat eredményez az egyes flokkulumok kö - zött. Ugyanis a mikroorganizmusok poliszacharid jellegû vegyületek termelésével segítik elõ egymáshoz, ill.
valamely szilárd felülethez való tapadásukat. A polimerek hidakat képeznek a sejt és az adott felület, vagy a másik sejt között. Ekkor rendkívül fontos a többvegyértékû kationok jelenléte, a polimerek és sejtek össze-
kapcsolása szempontjából. Magasabb iszapkornál a sejtek körül nagyobb az exopolimerek mennyisége, ekkor a kialakuló flokkulumok markánsabbak, elsõsorban az aggregátumok centrumjában erõs a kötõdés. Azonban elõfordulnak az iszappehely külsõ részéhez viszonylag gyengén kapcsolódó sejtek is [18]. Az adhéziós fo- lyamat két részre bontható, ahol az elsõ lépés reverzibilis, amelyet az irreverzibilis kapcsolódás követhet.
A reverzibilis adhéziót a DLVO elmélet [19, 20] írja le, amely szerint a két felület közötti kölcsönhatás a Gibbs energia segítségével a felületek távolságának függvényében számítható. A nettó Gibbs energia a Van der Waals erõk és az elektrosztatikus kölcsönhatások különbségeként értelmezhetõ, amely utóbbiak általában taszító jellegûek, a két egymáshoz közelítõ felület azonos (negatív) töltése következtében.
Az irreverzibilis adhézió termodinamikai megközelítéssel [21, 22] írható le, amely szerint a baktériumok felszíne, vagy az azokon levõ extracelluláris polimerek szabályozzák a tapadást [23, 24, 25]. A polimer- képzõdés az iszapkor növekedésével gyakran nõ, és ez egyenesen arányos a flokkulációval [25]. A két- vegyértékû kationok fontos szerepet játszanak a negatív felszíni töltésû exopolimerek és a baktériumok ösz- szekapcsolódásában. A legfontosabb ilyen kation a Ca2+, [26, 27] amely könnyen adszorbeálódik az iszap fe l- színén, és kölcsönhatásba lép az iszap kötött víz tartalmával. Egyéb fém ionok is megkötõdhetnek az extracelluláris polimereket termelõ mikroorganizmusok felszínén, azonban azok hatása kevésbé jellemzõ.
Más szerzõk [10] a különbözõ ionerõsségben alkalmazott CaSO4, K2SO4 és Fe2(SO4)3 sók hatásának vizsgálatakor azt találták, hogy magasabb ionerõsség alkalmazásakor az ülepedési tulajdonságok javulnak, a felülúszó zavarossága jelentõsen csökken. A mérések szerint alacsony ionerõsség esetén a már kialakult flokkulumok szétesésének valószínûsége megnõ, míg ha a deflokkulálódott iszaphoz megfelelõ ionerõsségû sóoldatot adtak, az iszappelyhek újra kialakultak.
Elõfordul, hogy inhibitor jellegû szubsztrát esetén az ülepítés utáni szupernatans rendkívül sok lebegõ anyagot tartalmaz [28]. Ennek oka lehet a fent leírt jelenség, amikor megfelelõ kationok, vagy exopolimerek hiányában a flokkulum szétesik, ill. a másik ok az, ha a fonalas szerkezetek aránya a toxikus jellegû szubsztrát következtében túl kicsi a populációban.
A szakirodalomban megjelentek olyan publikációk is, amely szerint valamely nyomelem hiánya okozott a szubsztrát inhibícióhoz rendkívül hasonló viselkedést, amelyet a hiányzó nyomelem (pl. réz!) adagolásával sikerült megszüntetni [16].
Az ülepedési problémák kezelése során vizsgálták az egyes fajok elõfordulási gyakoriságát, ill. az ezek által termelt oligonukleotidek koncentrációját az elegyben. A habot okozó fonalas szervezetek vizsgálata so- rán fény derült arra, hogy az erõs habzást néhány faj okozza (Gordonia, és Actinomyceta fajok) [29].
Általánosságban elmondható, hogy az inhibitor jellegû vegyületekre a fonalas szervezetek érzékenyebbek, mivel fajlagos felületük sokkal nagyobb a flokkulens szervezetekénél, – így a Ks érték jóval kisebb – vala- mint ha egy inhibitor csúcs jelenik meg a beérkezõ szennyvízben, akkor az elpusztult fonalas szervezetek las- sabban szaporodnak el újból, mint a flokkulens mikroorganizmusok (mivel kisebb a µmax értékük). Ilyen ese- tekben a 2.1.2 és 2.1.3. fejezetekben leírt elveket alkalmazva a bioreaktor kapcsolás megváltoztatásával jó eredményeket lehet elérni. Soros reaktor elrendezés esetén célszerû megosztani a befolyó szennyvizet az elsõ 2 reaktor között, azaz a kisebb terhelés megvalósításával, antiszelektor hatást elérni, amellyel a fonalas szer- vezetek szaporodásának kedvezünk [11, 30]. Ekkor kialakulhat a flokkulensek és fonalasok megfelelõ ará- nya, amelynek eredményeképpen az ülepíthetõség és a felülúszó szempontjából az iszap struktúrája optimális lesz.
2.2. Biológiai tápanyag-eltávolítás
Biológiai tápanyag-eltávolítás (biological nutrient removal) alatt a nyers, vagy tisztított szennyvíz nitro- gén és foszfor-tartalmú vegyületeinek biológiai mechanizmusok általi oldatból való kivonását, eltávolítását értjük. Ezek hatására az adott komponensek részben a biomasszába, részben a levegõbe kerülnek. A szenny- víztisztításon belül a figyelem azért fordult intenzíven a nitrogén és foszfor elimináció felé, mert az ammónia, nitrit, nitrát és foszfát káros hatásai (elsõsorban az eutrofizáció révén) nyilvánvalóvá vált.
2.2.1. Mikrobiális nitrogén-eltávolítás
A nyers szennyvíz nitrogén vegyületeinek leggyakoribb formája az ammónia, amely a szennyvízre je l- lemzõ semleges körüli pH-viszonyok között NH4+ ionok formájában található a vízben. Vagy közvetlenül, vagy mikrobiológiai ammonifikáció során, nitrogén tartalmú szerves vegyületek bomlástermékeként kerül a vízbe.
Az ammóniát a különbözõ mikroorganizmusok kétféleképpen tudják hasznosítani:
−
mint az eleveniszap építõanyagát (sejtalkotó),−
mint energiahordozó szubsztrátot, amelyet aerob körülmények között nitritté, ill. nitráttá oxidálnak (nit- rifikáció).A keletkezõ nitrátot a denitrifikáló mikroorganizmusok – elemi O2 hiányában – a terminális oxidációban elektron-akceptorként képesek hasznosítani, végtermékként N2 -t elõállítva (denitrifikáció).
A sejtanyagba beépült nitrogént a fölösiszappal távolítjuk el, a nitrogén gázzá konvertálódott része pedig az oldhatósági határ elérése után eltávozik a rendszerbõl.
A nitrogén természetes körforgását a 14. ábra szemlélteti.
14. ábra. A nitrogén természetes körforgása
2.2.1.1. Nitrifikáció
A szennyvizek nitrogéntartalma (TKN, azaz Total Kjeldahl Nitrogen) gyakran jó néhány g/l-es értéket is elérhet. Az aerob tisztítás során – elsõsorban a fehérjék, peptidek, aminosavak biodegradációjának eredmé- nyeképpen – ennek a nitrogén mennyiségnek a döntõ része ammóniává ill. ammónium vegyületekké alakul (ammonifikáció). A szabad ammónia a halakra erõsen toxikus, a letális érték a legtöbb esetben ~1 mg/l NH3– N [32] (ahol NH3–N alatt a szabad ammónia formájában jelenlevõ nitrogén mennyiségét értjük). A különösen intenzív mérgezõ hatás oka, hogy a gerinces élõlények többségétõl eltérõen, a halak a fehérje anyagcsere végtermékeként döntõen szabad ammóniát ürítenek ki. Ez a toxikus anyag a kopoltyú légzõhámján keresztül, passzív transzport útján kerül a környezõ vízbe, így a kiürítés lehetõsége és sebessége az ammóniakoncentrá- ció egyértelmû függvénye. Semleges pH mellett a teljes ammónia ammónium-ion formájában van jelen, míg pH = 9 esetén a szabad ammónia aránya meghaladhatja a 20% -ot is.
Mivel az ammónium-ion a kopoltyú hámsejtjén sokkal nehezebben jut át, mint a szabad ammónia, a toxi- citás szempontjából a reakció erõsen pH függõ. Az algák bikarbonátokat elimináló tevékenysége miatt a fe l- színi vizekben elég gyakori a magas pH, így lehetõség van az erõsen toxikus szabad ammónia arányának nö- vekedésére. Az ammónia-nitrogén eltávolítása tehát rendkívül lényeges.
A nitrifikációt, ami tulajdonképpen az ammónium nitrogén konvertálása nitrát nitrogénné [6], alapvetõen két autotróf mikroorganizmus csoport végzi: a Nitrosomonas és a Nitrobacter [32]. A reakció két lépcsõben játszódik le:
kJ +275 O
H + 2H + NO O
1,5 +
NH +4 2 Nitrosomonas→ -2 + 2
kJ +75 NO
O 0,5 +
NO -2 2 Nitrobacter→ -3
kJ +350 O
H + 2H + NO 2O
+
NH +4 2 Nitrosomonas,Nitrobacter→ -3 + 2
A felszabaduló energia sejtszintézisre fordítódik. Mivel azonban mennyisége a szaporodás szükségletéhez képest csekély, ezért a sejttömeg hozam alacsony. Így a nitrifikáció általában elhanyagolható iszapszaporu- latot eredményez [33].
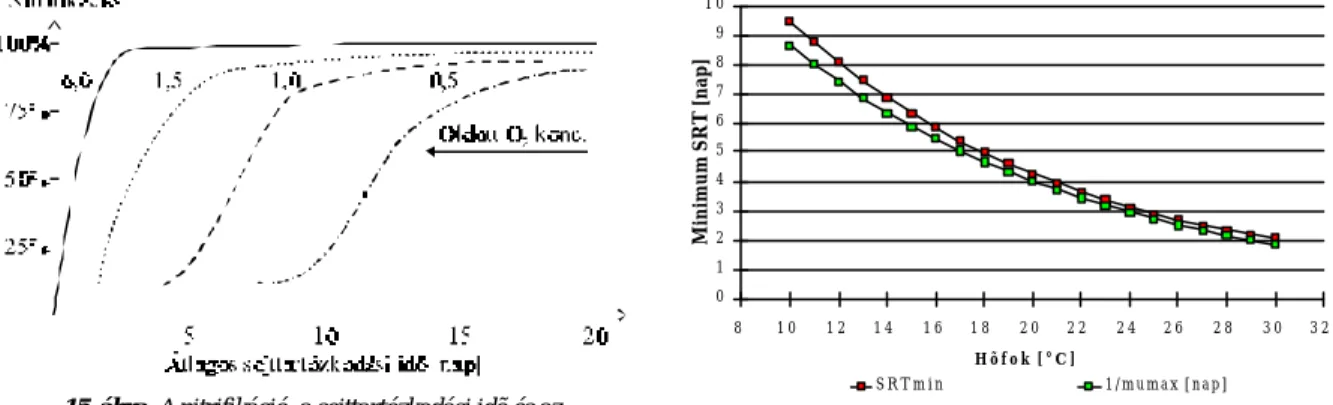
Nitrifikáció esetén a szén eliminációhoz képest hosszabb a rendszer sejttartózkodási-idõ (Solid Retention Time, azaz SRT) szükséglete, mivel a Monod féle µmax – maximális fajlagos növekedési sebesség – a nitrifi- káló mikroorganizmusok esetén egy nagyságrenddel kisebb, mint a kevert mikroflórára megadott érték. Így a kimosódás elkerülése érdekében a sejttartózkodási idõt növelni kell (15. ábra). Ezért a biológiai szennyvíz- tisztítóban jóval nagyobb SRT-t kell biztosítani, mint amit a szervesanyag-lebontás általában igényelne [34, 35].
A nitrifikáló mikroorganizmusok a széneliminációban résztvevõ heterotróf szervezetekhez képest na- gyobb KSO2 értékûek [36]. Mivel a szaporodási sebesség és az oldott oxigén szint között egyértelmû össze- függés van [6]:
[
1 0,833 (7,2 pH)]
S ) K
S S )(
K ( S ì ì
2 2 O
2
N S O
O N
S N
max − ⋅ −
+
⋅ +
= (18)
ezért nagy oldott oxigén koncentráció biztosításával a szaporodásgátló hatás csökkenthetõ (15. ábra).
A nitrifikáció, mint ahogy az a nitrátkonverzió egyenletébõl (18 egyenlet) is kitûnik, pH csökkenéssel járó folyamat lehet egy nem elegendõen nagy pufferkapacitású rendszerben.
15. ábra. A nitrifikáció, a sejttartózkodási idõ és az oldott O2 koncentráció összefüggése
0 1 2 3 4 5 6 7 8 9 1 0
8 1 0 1 2 1 4 1 6 1 8 2 0 2 2 2 4 2 6 2 8 3 0 3 2
H õ f o k [ ° C ]
Minimum SRT [nap]
S R T m i n 1 / m u m a x [ n a p ]
16. ábra. A nitrifikáció hõfokfüggése
A nitrifikációt befolyásoló tényezõk között igen fontos a hõmérséklet szerepe. A nitrifikálók mezofil szervezetek, a hõmérsékleti optimum 28 – 35°C között van [37]. Hõmérsékleti koefficiensük az eleveniszap mikroflóráját alkotó baktériumok között a legnagyobb. A hõmérsékletfüggést mutatja a 16. ábra, amelyet az Arrhenius egyenlet alapján, kísérleti úton meghatározott kinetikai paraméterek segítségével számítható ki [38]. Az ábrán látható, hogy a reakció hõmérsékletfüggése exponenciális jellegû bizonyos határok között, azonban bizonyos hõmérséklet fölött a sejtpusztulás olyan mértékûvé válik, hogy az SRT növelése válik szükségessé. (Az ábrán ez már nem látható.)
2.2.1.2. Toxikus anyagok hatása a nitrifikációra
A biológiai nitrogéneltávolítás egyetlen lehetséges megoldása az, ha a szennyvíz ammóniatartalmát elõbb nitritté, majd nitráttá oxidáljuk (nitrifikáció) a nitrifikáló mikroorganizmusok segítségével. Az így keletkezett nitrátot aztán a denitrifikáló szervezetek oxigénmentes környezetben tudják hasznosítani terminális elektron- akceptorként a jelenlevõ szerves szubsztrát metabolizációja során. A szennyvíztisztítás mikrobiális folyama- tai közül a nitrifikáció a legérzékenyebb a hõmérsékletre, az oldott oxigén és az inhibitorok koncentrációjára.
A szennyvízkezelésben résztvevõ populációk közül nitrifikáló szervezetek hõmérsékleti koefficiense a legna- gyobb, ezért a nitrifikáció hõmérsékletfüggése is jelentõs.
A folyamatot gátló tényezõk közül az elsõ helyen a szabad ammónia és salétromossav hatása említendõ [39]. Ezek a hatások erõsen pH függõek. Szerves anyag jelenléte általában a nitrifikációt kevéssé befolyásol- ja, – kivéve az inhibíciót okozó vegyületeket – ami a nitrifikáló baktériumok autotróf természetének követ- kezménye. A szén és a nitrogén asszimilációban résztvevõ szervezetek azonban egyaránt fogyasztanak oxi- gént, így nem kielégítõ levegõztetés esetén a nitrifikáció a szerves anyag növekedése következtében leállhat.
Fordított eset kevéssé valószínû, mert a heterotróf mikroorganizmusok KS értéke jóval kisebb, mint az autotrófoké.
Nem elégséges oxigénmennyiség, vagy alacsony hõmérséklet annyira lelassítja ezeknek a szervezeteknek a növekedési sebességét, hogy a nitrifikáció gyakorlatilag leáll. Hasonló a helyzet az inhibitor jellegû vegyü- letek jelenlétében is. Néhány – a szennyvízben gyakran elõforduló – vegyület 75%-os inhibíciót okozó ko n- centrációját tünteti fel a 3. táblázat.
Azokat a szerves vegyületeket, melyek jellegzetesen gátolják a nitrogén oxidációt, – ugyanakkor azonban nem sorolhatók a bakteriális tevékenységet általában gátoló vegyületek közé, – a 3. táblázatban láthatjuk [40]. Ezek a vegyületek gyakran tartalmaznak ként, így fémkelátok képzésére alkalmasak. A nitrifikáló mik- roorganizmusok azért érzékenyek specifikusan ezekre a vegyületekre, mert enzimkészletük egy részének ak- tiválásához fémet igényelnek. A 4. táblázatban felsorolt vegyületek elsõsorban a nitrifikáció elsõ lépését, az ammónia oxidációt gátolják, s csak kevéssé befolyásolják a nitrit oxidáció sebességét [41].
3. Táblázat. Az eleveniszapos nitrifikációt gátló szerves vegyületek
Inhibeáló vegyület 75%-os inhibíciót eredményezõ koncentráció [mg/l]
aceton 2000
allil-alkohol 19,5
allil-klorid 180
allil-izotiocianát 1,9
benztiazol-diszulfid 38
szén-diszulfid 35
kloroform 18
o-krezol 12.8
diallil-éter 100
diciánamid 250
diguanid 50
2,4-dinitro-fenol 460
ditio-oxamid 1,1
etanol 2400
guanidin-karbonát 16,5
hidrazin 58
8-hidroxi-kinolin 72,5
merkapto-benztiazol 3,0
metilamin-hidroklorid 150
metil-izotiocianát 0,8
metil-tiurónium-szulfát 6,5
fenol 5,6
kálium-tiocianát 300
szkatol 7
Na-dimetil-ditio-karbamát 13,6 Na-metil-ditio-karbamát 0,9 tetrametil-tiurám-
diszulfid
30
tio-acetamid 0,53
tio-szemikarbazid 0,076 (!)
trimetil-amin 118
4. Táblázat. Az ammónia oxidációt a nitrifikáló baktériumok dúsított kultúrájában gátló vegyületek
Inhibeáló vegyület 50%-os inhibíciót eredményezõ koncentráció [mg/l]
dodecil-amin <1
anilin <1
n-metil-anilin <1
1-naftil-amin 15
etilén-diamin 17
naftil-etilén-diamin-di-HCl 23
2,2 -bipiridin 23
p-nitro-anilin 31
p-amino-propio-fenon 43
benzidin-di-HCl 45
p-fenil-azo-anilin 72
hexametilén-diamin 85
p-nitro-benzaldehid 87
trietil-amin 127
ninhidrin >100
benzocián >100
dimetil-glioxim 140
benzilamin >100
csersav >100
mono-etanolamin >200
2.2.1.3. Denitrifikáció
A nitrát eltávolítása több szempontból is fontos. Egyrészt az eutrofizáció elkerülése végett, másrészt az ivóvízzel a szervezetbe kerülõ nitrát – amely a hemoglobinhoz kapcsolódva akadályozza az oxigénfelvételt – csökkentése miatt.
Oxigén hiányában, az eleveniszapban elõforduló szervezetek többsége képes a nitrátot nitrogénné redu- kálni, a folyamat során a nitrát, ill. nitrit molekuláris nitrogénné redukálódik, és kijut az atmoszférába:
NO3- → NO2- → NO → N2O → N2
A nitrát fenti összefüggéssel vázolt mikrobiális redukciója a valóságban bonyolult enzimreakciók soro- zatában megy végbe, alapvetõen asszimilációs vagy disszimilációs úton.
Az asszimilációs denitrifikáció során a nitrát – mint hidrogén akceptor –ammóniává redukálódik, majd sejtszintézisre fordítódik.
A disszimilációs denitrifikálásban – molekuláris oxigén távollétében, – a szénforrás oxidációja során a nitrátion elektron akceptorként szolgál, s ezúton vesz részt a sejtszintézishez szükséges energia termelésében [42]. Disszimilációs denitrifikáláshoz elektrondonor szénvegyület szükséges. Molekuláris oxigén hiányában a nitrát szolgál a szénvegyületrõl lekerülõ elektron akceptoraként. Erre a fakultatívan aerob mikroorganizmu s- ok képesek [33]:
5C6H12O6 + 24NO3- + 24H+ → 12N2 + 30CO2 + 42H2O + 13,5 MJ 5C6H12O6 + 30O2 → 30CO2 + 30H2O + 14,4 MJ
A két különbözõ folyamat során felszabaduló energia közel azonos, így amennyiben nincs oxigén a rend- szerben, kedvelt elektron akceptor a nitrát, mivel a fenti egyenletek tanúsága szerint a felhasznált nitrát egy- értelmûen oxigént vált ki a szervesanyag elimináció által. A reakció H+ -ion fogyasztó, vagyis pH növelõ ha- tású egy nem eléggé nagy pufferkapacitású rendszerben.
A nitrát és nitrit elektronakceptorként való felhasználására nagyszámú baktérium képes, melyek közül a legfontosabbak a Pseudomonas, Alcaligenes, Acinetobacter, Hyphomicrobium és Thiobacillus nemzetségbe tartoznak [32]. Ezek a mikroorganizmusok fakultatív aerobok, ami annyit jelent, hogy oxigén távollétében citokróm rendszerüket nitrát hasznosításra módosítják. (Mivel szerves vegyületeket terminális elektron ak- ceptorként felhasználni, azaz anaerob fermentációval energiát nyerni nem képesek, fakultatívan anaerobok- nak nem minõsülnek.)
A denitrifikáció számára biztosítandó környezeti tényezõk közül a legfontosabb az oldott oxigén minél tökéletesebb kizárása. A molekuláris oxigén nitrát disszimilációt gátló hatása abban rejlik, hogy elektron ak- ceptorként való felhasználása preferált, így jelenlétében nitrát redukció nem történik [43]. A nitrát és oxigén respirációban alapvetõen ugyanazok az enzimek vesznek részt, egy – a nitrát reduktáz – kivételével, amely az elektronakceptorként való felhasználáshoz szükséges, s csupán oxigén távollétében képzõdik [44].
A denitrifikáció számára biztosítandó környezeti feltételek:
−
oldott oxigénmentes közeg,−
pH = 6 – 8 és a−
nitrátredukcióhoz szükséges szénmennyiség megléte.Mérhetõ oxigénszint mellet is elõfordulhat denitrifikáció, ha a biomassza aggregátumokat képez, s a flokkulumok belsejében az O2 koncentráció már elenyészõ a metabolizmus következtében.
A denitrifikáció pH optimuma közel semleges, (pH = 6 – 8 érték [44]), amit – ha nitrifikációt is folyta- tunk a rendszerben – viszonylag könnyû megvalósítani.
A redukciós reakciólánc megszakadhat pH = 6 alatt, nem kívánatos nitrit akkumulációt eredményezve.
Mivel a nitrát disszimiláció hidrogén-ion fogyasztással, ill. más interpretáció szerint hidroxil-ion képzõdéssel jár (ld. fenti reakcióegyenlet), a denitrifikáció az elegy lúgosságának növekedését eredményezi. (A sztöchio- metrikus arányok alapján 1 mg NO3-
-N oxidációja során 3,6 mg CaCO3-ban kifejezett alkalinitás-növekedés tapasztalható.) A pH csökkenéssel járó nitrifikációt és a pH növekedést eredményezõ denitrifikációt adott szennyvíztisztító rendszerben együttesen alkalmazva, függetlenül ezen folyamatok esetleges térbeli elkülö- nítettségétõl, jó közelítéssel semleges pH-jú tisztított víz jut ki a környezetbe [45].
A denitrifikáció a gyakorlat számára elfogadható sebességgel 5 – 60°C hõfoktartományban játszódik le, optimuma 40°C [44].
A célzott denitrifikációt biztosító technológiai megoldásoknál az anoxikus (nitrátot igen, oxigént nem tartalmazó) medence a levegõztetõ medence elõtt vagy után helyezkedik el a szennyvíz áramlási irányát te- kintve (17. ábra). Az ún. elõdenitrifikáció során nitráteliminációra a szennyvíz könnyen biodegradálható komponenseit alkalmazzák szénforrásként, kiegészítõ, adalék szerves anyagot ez a megoldás általában nem igényel. Az utódenitrifikációban a mikroorganizmusok számára csupán kismennyiségû és nehezen hasznosít- ható szénforrás marad. Ilyen esetben a nitrát redukcióhoz szükséges szén szükségletet a sejtek saját anyaguk- ból, ún. endogén metabolizmus útján fedezik, vagy ezt elkerülendõ a rendszerbe külsõ, pótszénforrást (pl.
metanolt) kell adagolni.
a. Elkülönített utódenitrifikáció
b. Egyiszapos utódenitrifikáció
c. Egyiszapos elõdenitrifikáció
C-N: szénelimináció és nitrifikálás, C: szénforrás adagolás DN: denitrifikálás
L: levegõztetés Ü1: elõülepítés Ü2-Ü3: utóülepítés
17. ábra. Nitrogén eltávolítására alkalmas reaktor elrendezések [28]


![18. táblázat. A tanulmányozott modellrendszerek tisztítási paramétereinek összevetése A kémiai oxigén igény értékei az alaprendszerekben [mg/l]](https://thumb-eu.123doks.com/thumbv2/9dokorg/526917.1428/45.894.100.815.306.1012/táblázat-tanulmányozott-modellrendszerek-tisztítási-paramétereinek-összevetése-értékei-alaprendszerekben.webp)