VIZSGÁLATA A NAGY MOCSÁRI CSIGA (LYMNAEA STAGNALIS L.) KÖZPONTI IDEGRENDSZERÉBEN
Értekezés doktori (PhD) fokozat elnyerése érdekében
Írta:
Molnár Gábor
Készült a Veszprémi Egyetem Környezettudományi Doktori Iskolája keretében az MTA Balatoni Limnológiai Kutatóintézetében
Témavezetõ: Dr. Salánki János
A jelölt a doktori szigorlaton …... % -ot ért el,
Veszprém, Keszthely …...
a Szigorlati Bizottság elnöke
Az értekezést bírálóként elfogadásra javaslom:
Bíráló neve: …... …... igen /nem
……….
(aláírás) Bíráló neve: …... …...) igen /nem
……….
(aláírás)
A doktori (PhD) oklevél minõsítése…...
………
Az EDT elnöke
Tartalomjegyzék
TARTALOMJEGYZÉK 2
1. BEVEZETÉS ÉS IRODALMI ÁTTEKINTÉS 4
1.1TOXIKUS ANYAGOK KÖLCSÖNHATÁSA 4
1.2NEHÉZFÉMEK A KÖRNYEZETBEN, HATÁSUK BIOLÓGIAI RENDSZEREKRE 4
1.3KADMIUM 4
1.4ÓN 4
1.5GAMMA-AMINOVAJSAV 4
&e/.,7 =e6 4
3. ANYAGOK ÉS MÓDSZEREK 4
3.1.PREPARÁLÁS 4
3.2.OLDATOK, FELHASZNÁLT ANYAGOK 4
3.3.MIKROPERFUZIÓ ALKALMAZÁSA 4
3.4.ELVEZETÉS 4
3.5.INTRACELLULÁRIS INJEKTÁLÁS 4
3.6.KRÓNIKUS NEHÉZFÉM- KEZELÉS 4
3.7.ADATFELDOLGOZÁS 4
3.8.STATISZTIKAI VIZSGÁLATOK: 4
4. EREDMÉNYEK 4
4.1GABA AKTIVÁLTA IONÁRAMOK FARMAKOLÓGIAI ÉS KINETIKAI JELLEMZÉSE 4 4.2S ZSGÁLATOK – A NEHÉZFÉMEK HATÁSA A GABA-AKTIVÁLTA
MEMBRÁNÁRAMOKRA 4
4.2.1. Az ón hatása GABA-aktiválta ionáramokra 4
4.2.2. Cd2+ hatása a GABA-aktiválta ionáramokra 4
4.2.3. Cd2+ hatása a GABA-aktiválta ionáramokra krónikusan kezelt állatokon 4
4.2.4. Cd2+ gátló hatásának lehetséges mechanizmusa 4
4.3H ! LATOK 4
4.3.1. Ónklorid hatása a tüzelési mintázatokra 4
4.3.2. Trimetil ón hatása a tüzelési mintázatokra 4
+iOy]DWV]LQW YL]VJiODWRk – tüzelési mintázat vizsgálata 4
5. MEGBESZÉLÉS ÉS ÖSSZEFOGLALÁS 4
5.1. A Lymnaea sejtek GABA-indukálta áramai 4
5.2. Szerves ón hatása GABA-aktiválta ionáramokra 4
5.3. Cd2+ ionáramot indukál 4
5.4. Cd2+ blokkoló hatása és lehetséges hatásmechanizmusa GABA-aktiválta
ionáramokon 4
5.5. Cd2+ krónikus hatása 4
5.6. Kisülési mintázatok modifikációja ón hatására 4
5.7. Cd2+ hatása GABA-válaszra idegsejtek kisülési mintázatán 4
6. ÖSSZEFOGLALÁS 4
A DOLGOZATBAN ANYAGÁUL SZOLGÁLÓ SAJÁT PUBLIKÁCIÓK LISTÁJA 4
TOVÁBBI PUBLIKÁCIÓK LISTÁJA 4
78'20È1<26(/ $'È62. LISTÁJA 4
KÖSZÖNETNYILVÁNÍTÁS 4
IRODALMI HIVATKOZÁSOK 4
Ón és kadmium hatásának sejt-pVQHXURQKiOy]DWLV]LQW YL]VJiODWDDQDJ\PRFViULFVLJD (Lymnaea stagnalis L.) központi idegrendszerében
A nehézfémek, a földkéreg eredeti komponensei, természeti katasztrófák, vagy az emberi
WHYpNHQ\VpJ HUHGPpQ\HNpQW D N|UQ\H]HWEH MXWYD PHJKDWiUR]y N|UQ\H]HWL VWUHVV]WpQ\H] Yp YiOWDN
Kutatásaink célja a környezetben általánosan és nagy mennyiségben elforduló két nehézfém, ón és kadmium neurotoxikológiai vizsgálata volt a nagy mocsári csiga, Lymnaea stagnalis L. központi
LGHJUHQGV]HUpQ9L]VJiOWXNDQHKp]IpPMHOHQOpWpEHQOpWUHM|Y DNFLyVSRWHQFLiONLVOpVLPLQWázatokat, a gamma-aminovajsavra (GABA) adott neurális választ, és GABA-ra adott membránon keresztülfolyó ionáramok megváltozását.
Kimutattuk, hogy a Cd2+ önmagában 1-2 nA-es ionáramot indukál. Igazoltuk, hogy 5 µmol/l-nál
PDJDVDEE NRQFHQWUiFLyN Gy]LV IJJ en gátolták a GABA-indukálta ionáramot, továbbá megváltoztatták a GABA-indukálta ionáram kinetikai paramétereit. Ennél alacsonyabb koncentrációnál enyhe serkentést mutattunk ki 20 perces Cd2+ kezelés után.
Eredményeink a neuronok intracelluláris folyamatainak, illetve kommunikációjának megváltozását mutatták. Kadmium krónikus kezelés hatására a GABA-aktiválta ionáramok paraméterei nem változtak szignifikánsak, viszont Cd2+ akut kezeléssel szembeni érzékenységük tizedére csökkent. Adataink szerint a Cd2+ bORNNROy KDWiVD D N|YHWNH] V]LJQDOL]iFLyV ~WYRQDORQ
történik: a Cd2+ D] H[WUDFHOOXOiULV WpUEHQ D VHMWPHPEUiQ NOV IHOOHWpQ PHJWDOiOKDWy IHOWpWHOH]HWW *-
SURWHLQ NDSFVROW UHFHSWRUKR] NDSFVROyGLN DPHO\ KDWiViUD D VHMW EHOV UDNWiUDLEyO &D2+
lép ki, és intracelluláris szintje megemelkedik, amely végül blokkolja a GABA-aktiválta klorid ionáramot.
.L]iUWXN DQQDN D OHKHW VpJpW KRJ\ D] H[WUDFHOOXOiULV WpUE O EHOpS &D2+
okozza a gátló hatást,
XJ\DQDNNRU NOV UHFHSWRU PHJOpWpUH XWDO D] LQWUDFHOOXOiULVDQ EHMXWWDtott Cd2+ hatástalansága is a GABA-aktiválta ionáramra. Kisülési mintázatok matematikai analízisével kimutattuk, hogy az ónklorid (SnCl2) és trimetilón ((CH3)3SnCl) a neuronális aktivitást mérsékelten megváltoztatta.
Idegsejtek szinaptikus bementeinek gyakorisága és amplitúdója csökkent. Ugyanakkor a trimetilón a GABA-szenzitív idegsejteken a GABA aktiválta ionáramra szignifikáns hatással nem volt. A kadmiumklorid (CdCl2)LG OHJHVHQEORNNROWDDQHXUiOLVDNWLYLWiVW&G2+
jelenlétében a GABA-ra adott
LGHJVHMWHNYiODV]UHDNFLyLQDNJiWOyIi]LVDHOW QW
.tVpUOHWLHUHPpQ\HLQNLJD]ROWiNDN|UQ\H]HWV]HQQ\H] QHKp]IpPHNVHMW-pVKiOy]DWV]LQW KDWiViW
nagy mocsári csiga, Lymnaea stagnalis központi idegrendszerében. Lymnaea központi idegrendszerének GABA-érzékeny neuronjain megfigyelt intracelluláris változások párhuzamba állíthatók gerincesek analóg rendszereivel is. Tekintve a GABA-DNWLYiOWDIRO\DPDWRNMHOHQW VV]HUHSpW
a gerincesek – így az emberi – idegrendszerben, azok akut és krónikus kölcsönhatásai fontos szerepet játszanak a toxikológiában.
Effect of tin and cadmium on the central nervous system of the pond snail Lymnaea stagnalis L. on cellular and network level
Due to environmental disaster or the human activity, emission of heavy metals, the original components of Earth crust, can be a significant stress factor to the environment. In this study, our aim was to determine the neurotoxicological impact of two frequent heavy metal, cadmium and tin, on the central nervous system of the pond snail Lymnaea stagnalis L.
We monitored the effect heavy metals had on the modulation of firing patterns, gamma aminobutyric acid (GABA) mediated neural response, and GABA-activated ion currents has been shown due to heavy metal exposition. Based on our results, we suggest the following pathway for the Cd2+-induced blocking mechanism on GABA-induced current in Lymnaea neurones: cadmium ions interact at the cell surface with a putative Cd2+-binding protein coupled to a G-protein, which elevates intracellular Ca2+ concentration and subsequently which blocks the GABA-mediated ion currents. The hazardous heavy metals, tin and cadmium, had a toxic effect on the central nervous system of the pond snail Lymnaea stagnalis L. The effect of cadmium on intracellular processes of Lymnaea neurons can provides an analogous toxic mechanism for other GABA systems, which is one of the most important inhibitory mechanisms in the central nervous system of vertebrates.
Zellnetz- und Neuronennetzuntersuchung aufgrund der Auswirkung von Blei und Kadmium auf das Zentralnervensystem der Großen Sumpfschnecke (Lymnaea stagnalis L.)
Der Einfluss der Schwermetalle auf die ursprünglichen Komponenten der Erdkruste, die Naturkatastrophen oder die Auswirkung menschlicher Tätigkeiten auf die Umwelt entwickelte sich zu bedeutenden Stressfaktoren der Umwelt. Ziel unserer Forschung war die Untersuchung der neurotoxikologischen Wirkung der zwei Schwermetalle, wie Blei und Kadmium auf das zentrale Nervensystem der Großen Sumpfschnecke Lymnaea stagnalis L.
Wir haben den Einfluss von Schwermetallen beim Zustandekommen potentieller Entladungsformen, die Neuronenreaktion auf Gamma-Aminobuttersäure (GABA), die Veränderung des Ionendurchflusses durch die auf GABA gegebene Membran untersucht.
Laut unseren Angaben erfolgt die blockierende Wirkung von Cd2+ auf dem nachfolgend Signalisationswege: Cd2+ verbindet sich im extrazellularen Raum mit dem an der Außenfläche der Zellmembran vermutlich befindlichen G-Protein verbundenen Rezeptor, wodurch aus den Innenräumen der Zelle Ca2+ austritt und sich somit die interzellulare Konzentration erhöht, die den GABA-aktivierten Chlorid-Ionenstrom blockiert. Unsere Untersuchungsergebnisse bestätigten die Zell- und Zellnetzauswirkungen von umweltverschmutzenden Schwermetallen auf das Zentralnervensystem der Großen Sumpfschnecke (Lymnaea stagnalis L.). Zu den beobachteten intrazellularen Veränderungen auf GABA-empfindlichen Neuronen im Zentralnervensystem der Lymnaea kann auch eine Parallele zum analogen System der Wirbeltiere gezogen werden. In Betracht darauf, dass die GABA-aktivierten Prozesse eine bedeutende Rolle bei den Wirbeltieren spielen - und somit auch auf das menschliche Nervensystem haben – spielen die akuten und chronischen Wechselwirkungen eine wichtige Rolle in der Toxikologie.
1. Bevezetés és irodalmi áttekintés 1.1 Toxikus anyagok kölcsönhatása
$] pOHWPLQ VpJHW D] HPEHUL HJpV]VpJHW NiURVDQ EHIRO\iVROy WpQ\H] N N|]|WW PHJKDWiUR]y V]HUHSHW MiWV]DQDN D N|UQ\H]HWV]HQQ\H] DQ\DJRN $] XWyEEL pYWL]HGHNEHQ MHOHQW VHQ PHJQ WW D YL]HNEH D WiSOiOpNED pV D OHYHJ EH NHUO V]HUYHV pV V]HUYHWOHQ V]HQQ\H] DQ\DJRN V]iPD pV PHQQ\LVpJH 0LQG D PRELOL]iOW PLQG D V]LQWHWL]iOW HUHGHW
környezetre ártalmas anyagok egy bizonyos mennyiség és koncentráció fölött válnak az
|NROyJLDL UHQGV]HUHNHW PHJ]DYDUy NiURV V]HQQ\H] DQ\DJJi $ PpUJH] DQ\DJRN YHV]pO\W
jelentenHN D] HPEHU pV D] HJpV] pO YLOiJ V]iPiUD iOODWRNDW Q|YpQ\HNHW NiURVtWDQDN YDJ\
szétrombolják a természeti környezetet és annak kölcsönhatásait. Ezek a káros anyagok
ELROyJLDL KR]]iIpUKHW VpJN HVHWpQ EHNHUOQHN D] pO UHQGV]HUHNEH DKRO D V]HQQ\H] DQ\Dg
NRQFHQWUiFLyMDDN|UQ\H]HWNK|]NpSHVWQDJ\ViJUHQGHNNHOPHJQ KHWELRDNNXPXOiFLypVH]
a hatás a tápláléklánc mentén tovább haladva a koncentráció további megsokszorozódásához
YH]HWKHW ELRPDJQLILNiFLy $] pO V]HUYH]HWHNEHQ D WR[LNXV DQ\DJRN KDWiVD Uendkívül változatos lehet. Zavarhatják, vagy megakadályozhatják az anyagcsere-folyamatokat enzimek blokkolása vagy a biológiai membránok károsítása révén, befolyásolhatják az embrionális
IHMO GpVW WHUDWRJpQ DQ\DJRN LUUHYHU]LELOLV PyGRQ PHJYiOWR]WDWKDWMik a genetikai információkat (mutagén anyagok), illetve rákos elváltozásokat okozhatnak (karcinogén anyagok).
A neurotoxikus anyagok hatásvizsgálata a modern fiziológiai kutatásokkal együtt
NH]G G|WW pV IRO\WDWyGLN QDSMDLQNEDQ LV $] LO\HQ LUiQ\~ NXWDWiVRN QDJ\ MHOHQW VpJ HN WHNLQWYH D IRO\DPDWRV LSDUL PH] JD]GDViJL pV NRPPXQiOLV KXOODGpN XWiQSyWOiVW YDJ\ D QHPULWNiQHO IRUGXOyN|UQ\H]HWLNDWDV]WUyIiNDWPHO\HNN|]YHWYHYDJ\N|]YHWOHQOD]HPEHUW
is fenyegetik.
1.2 Nehézfémek a környezetben, hatásuk biológiai rendszerekre
A nehézfémek, a földkéreg eredeti komponensei, természeti katasztrófák, vagy az emberi
WHYpNHQ\VpJ HUHGPpQ\HNpQW D N|UQ\H]HWEH MXWYD PHJKDWiUR]y N|UQ\H]HWL VWUHVV]WpQ\H] Yp YiOWDN ,SDUL WHYpNHQ\VpJ PH] JD]GDViJL WHFKQROyJLiEyO V]iUPD]y pV NRPPXQiOLV HUHGHW
források hatására nagy mennyiségben és lokálisan nagy koncentrációban kerülnek a
WHUPpV]HWL N|UQ\H]HWEH $ YL]HNEHQ D WDODMEDQ D OHYHJ EHQ PHJWDOiOKDWy QHKp]IpPHN
geográfiai eloszlása és koncentrációja nagyban befolyásolja az ökoszisztéma, illetve az ember
QHKp]IpP H[SR]tFLyMiW $ IpPHN ELROyJLDLODJ QHP ERQWKDWyN OH D] pO V]HUYH]HWEHQ
felhalmozódhatnak, továbbá biokémiai reakciók során toxicitásuk is változhat (csökkenhet,
YDJ\ Q KHW %L]RQ\RV QHKp]IpPHN D WiSOiOpNOiQF PHQWpn felhalmozódnak, bekerülnek az élelmiszerekbe, és valós veszélyt jelentenek az emberi egészségre. A toxikus
N|UQ\H]HWV]HQQ\H] NpPLDL DQ\DJRN PLQGHJ\LNH D] pO V]HUYH]HWHN YDODPLO\HQ P N|GpVpW EHIRO\iVROMDpVH]DEHOV V]DEiO\R]yPHFKDQL]PXVRNRQ iWYDOósul meg. Káros hatás akkor
MHOHQWNH]LN KD D NpPLDL iJHQV NDSFVRODWED NHUO D] DGRWW pO OpQ\ IHOV]tQL YDJ\ EHOV UHFHSWRUDLYDOPyGRVtWMDD]RNP N|GpVpWYDJ\D]RNDWDPHPEUiQpVELRNpPLDLIRO\DPDWRNDW
melyek a szervezet életfunkcióinak szabályozásában részt vesznek. Ez a "testidegen"
beavatkozás sokféle lehet, de mindegyike patológiás folyamatot indít el. A pontos hatásmechanizmus tisztázása éppen ezért csak egyedi lehet, és laboratóriumi kutatással valósítható meg.
A természeti környezetbe került nehézfpPHN RNR]WD PpUJH] WQHWHN YpOHWOHQ
megfigyelés eredményeként váltak ismertté, mint pl. a Minamata-kór, vagy Itai-Itai
WQHWFVRSRUW .LGHUOW KRJ\ D QHKp]IpPHN NiURVtWy YROWXN I NpQW D] LGHJUHQGV]HUUH NLIHMWHWW
akut vagy krónikus hatás következménye. A nehézfémek az idegrendszerre károsító hatással
YDQQDN D]D] QHXURWR[LNXV DQ\DJRN $ QHKp]IpPHN HJ\LN I WiPDGiVL SRQWMD D]
idegrendszerben az idegsejt membránja. A fémekkel való kölcsönhatás eredményeként a membrán permeabilitási tulajdonságai megváltozhatnak, ami befolyással lehet az idegsejtek információ feldolgozására, továbbítására és tárolására. A nehézfém mérgezések idegrendszerre gyakorolt funkcionális és struktúrális hatásával a neurotoxikológia foglalkozik. Ezen belül megkülönböztethetünk viselkedési, morfológiai, biokémiai/molekuláris, és élettani vizsgálatokat. Egy-HJ\ KDWiV PLQpO V]pOHVHEE N|U
tanulmányozása adhat teljesebb képet a fémek toxikológiai hatásosságáról, illetve azok mechanizmusáról.
0LYHODQHKp]IpPHN NiURVtWyKDWiVVDOYDQD] D]HO szervezetekre, azok szerveire fontos
D]RNNLPXWDWiVD$NRUV]HU DQDOLWLNDLPyGV]HUHNQHNN|V]|QKHW HQSRQWRVDQPHJKDWiUR]KDWy
az egyes anyagok biológiai szövetekben megtalálható koncentrációja. Azok hatása viszont az
pO V]HUYH]HWUH VRN WpQ\H] W O IJJ $ folyamat függ a nehézfémek biológiai
KR]]iIpUKHW VpJpW O D] H[SR]tFLy PyGMiWyO LGHMpW O D V]HUYH]HWEHQ OHIRO\y NRPSDUWPHQWDOL]iOyGiV PLO\HQVpJpW O D UHVSLUiFLyV WUDNWXV WLV]WXOiViWyO D IpP ELROyJLDL IHOH]pVLLGHMpW OpVDV]HUYH]HWIpPPHOV]HPEHQLUezisztenciájától (Nieboer, 1993). A toxikus anyagok szervezetekben található koncentrációinak ismételt mérések során való
|VV]HKDVRQOtWiVDV]iPRWDGDN|UQ\H]HWV]HQQ\H]pVLG EHOLYiOWR]isáról, akár szezonális, akár
W|EEpYHVYDJ\YDODPLO\HQHVHPpQ\KH]P V]DNLEHDYDWNR]iVKR]N|W|WWYiOWR]iVUyOOHJ\HQLV V]y $] LG EHOL YiOWR]iVRN PRQLWRUR]iViUD HPHOOHWW RO\DQ GLQDPLNXV IXQNFLRQiOLV WHV]WHN LV DONDOPD]KDWyDN PHO\HN FVDN LG WiYODWEDQ pUWpNHOKHW HN ,O\HQ SO D] pO OpQ\HN
alkalmazkodóképessége, a populáció nagysága, fajok közötti arányok alakulása továbbá
HJ\HGIHMO GpVH Q|YHNHGpVH V]DSRURGiVD PR]JiVD WiSOiONR]iVD OpJ]pVH UHDNFLyNpV]VpJH
az anyagcsere-IRO\DPDWDLN NO|QE|] PXWDWyL Eiokémiai paraméterek, illetve egyéb sejtbiológiai módszerekkel (Salánki és mtsai, 2003).
$ SXKDWHVW HN W|U]VpKH] WDUWR]y FVLJiN HJ\HV FVRSRUWMDLQiO SOAplysia, Helisoma, Helix, Lymnaea, Pleurobranhaea fajok) idegrendszere a gerincesekéhez viszonyítva igen nagy idegsejteket tartalmaz, amelyeket morfológiai tulajdonságaik, lokalizációjuk, kisülési mintázatuk és kémiai érzékenységük alapján azonosíthatunk (Benjamin és Winlow, 1981). A
JDQJOLRQRNEDV]HUYH] G QHXURQRNPpUHWHJ\DNUDQDP-t is felülmúlja (óriásneuronok), így a mikroelektródás mérési technikák igen alkalmas kísérleti objektumai. Ezek alapján
OHKHW VpJQN YDQ D VHMWHN P N|GpVpW EHIRO\iVROy WR[LNXV DQ\DJRN KDWiVDLQDN kimutatását és elemzését azonos, identifikált sejttípusokon, jól reprodukálható módon elvégezni.
$ SXKDWHVW HN pV D JHULQFHVHN LGHJUHQGV]HUL V]HUYH] GpVpEHQ MHOHQW V NO|QEVpJHN YDQQDN YLV]RQW LRQFVDWRUQiLN D] LGHJUHQGV]HUNEHQ WDOiOKDWy KtUYLY DQ\DJRN tulajdonságai között sok közös sajátságot találunk (Kandel, 1976; S.-Rózsa, 1984). Az idegsejtek membránjában az ingerület keletkezését és terjedését feszültségérzékeny ioncsatornák
P N|GpVH WHV]L OHKHW Yp 0LQGHQ QHXURWUDQV]PLWWHU DPHO\ HO IRUGXO PiV IDMRNEDQ NLPXWDWKDWy D SXKDWHVW HN LGHJUHQGV]HUpEHQ pV QpPHO\HNHW SO V]HURWRQLQ )05)-amid)
HO V]|U JHULQFWHOHQ IDMRNRQ tUWDN OH PDMG D PDJDVDEEUHQG V]HUYH]HWHNEHQ LV D]RQRVtWRWWiN
azokat (Erspamer, 1948; Price és Greenberg, 1977).
*\DNRUODWL MHOHQW VpJJHO EtU KRJ\ D JHULQFWHOHQHNE O tJ\ D FVLJiNEyO NpV]tWHWW SUHSDUiWXPRN LV NHYpVEp pU]pNHQ\HN D SUHSDUiOiV VRUiQ IHOOpS iUWDOPDNUD K PpUVpNOHW- és
R[LJpQWHQ]Ly YiOWR]iVRNUD PLQW D JHULQFHVHNE O Q\HUW NpV]tWPpQ\HN $] HOHNWURIL]LROyJLDL SDUDPpWHUHN VWDELOLWiVD IRQWRV V]HPSRQW D KRVV]DEE LG W LJpQ\O NtVpUOHWHNEHQ- a csigák óriásneuronjai általában teljesítik ezt a feltételt is.
MinGH]HN DODSMiQ D FVLJiN LGHJVHMWMHL DONDOPDVQDN WHNLQWKHW N WR[LNXV DQ\DJRN PHPEUiQKDWiViQDN YL]VJiODWiUD $ YH]HW NpSHVVpJ LOOHWYH LQJHUHOKHW VpJ HOHP]pVH KDWiVRV
megközelítés a celluláris mechanizmusok feltárásában. Fiziológiai kutatásokban, a laboratóriumunkban évtizedek óta eredményesen alkalmazott nagy mocsári csiga, Lymnaea stagnalis idegrendszeren, mely a neurobiológia egyik klasszikus modell rendszere, a
viselkedés és tanulás celluláris mechanizmusai részletesen tanulmányozhatók (Benjamin és mtsai, 2000) YDODPLQW D NO|QIpOH V]LJQiO PROHNXOiN KDWiVD pV V]HUHSH LV pUWHOPH]KHW (S.- Rózsa, 1984). A sejtmembrán biofizikai tulajdonságai jól ismertek, az elemi folyamatok jól reprodukálhatók. Ezeken felül a hálózati analízis, azaz a csiga azonosított neuronhálózatának
P N|GpVEHOL YiOWR]iVDLQDN HOHP]pVH KDV]QRV HV]N|] D QHKp]IpPHN LGHJL IRO\DPDWRNUD
gyakorolt hatásainak megértésében (S.-Rózsa és Salánki, 1994).
E kutatások arra adhatnDN YiODV]W KRJ\ D] pO OpQ\HN N|UQ\H]HWpEH WiSOiOpNiED NHUOW WR[LNXVDQ\DJRND]iOODWRNV]HUYH]HWpEHEHMXWYDPLO\HQPyGRQKDWQDND]LGHJLP N|GpVUHD]
egyes sejtek membránjának befolyásolásával, a sejtek közötti kapcsolat károsításával, illetve a központL LGHJUHQGV]HUE O D YpJUHKDMWy V]HUYHN D SHULIpULD IHOp W|UWpQ NLPHQHWHN
módosításával.
1.3 Kadmium
$ NDGPLXP D KHWHGLN OHJPpUJH] EE DQ\DJ D] $JHQF\ IRU 7R[LF 6XEVWDQFHV DQG
Disease Registry (ATSDR, 1999) veszélyes anyag listáján, veszélyességét fokozza hosszú biológiai felezési ideje, mely emberben 25-30 év (IPCS, 1992). A kadmium által kiváltott toxikus hatások véletlen megfigyelés eredményeként váltak ismertté. 1955-ben írták le Japánban az Itai-,WDLNyUWPHO\I NpQWD-LQ]XIRO\ySDUWMiQpO LG V|G Q NHWWiPDGWDPHJ$
NyUWDN|]HOEHQOpY Up]EiQ\iEyODIRO\yEDHQJHGHWW]DJ\NDGPLXP-tartalma okozta. A folyó
YL]pW D N|UQ\H] UL]VI|OGHNHQ KDV]QiOWiN tJ\ QDJ\ PHQQ\LVpJEHQ MXWRWW D] RWW WHUPHV]WHWW UL]]VHODN|UQ\H] ODNRVViJV]HUYH]HWpEH1RJDZDpVPWVDL$NyUDV]HUYH]HWEHQD'- vitamin és a parathyroid hormon metabolizmus és ezzel a kalcium transzport zavarát okozta, mely súlyos csontdegenerációhoz vezetett, mely az esetek többségében folyamatos
IiMGDORPPDO MiUW D] LWDL V]y D MDSiQ MDMJDWiV V]DYD $ NDGPLXP H[SR]tFLyMD HOWpU OHKHW NO|QE|] pO OpQ\HNHQ6]iUD]I|OGL iOODWRNV]HUYH]HWpEHHOV Vorban a táplálékkal juthat, vízi
V]HUYH]HWHN HVHWpEHQ SHGLJ N|]YHWOHQO D Yt]E O SO GLII~]Ly NRSROW\~OpJ]pV pV WiSOiONR]iV
útján (Sunda és mtsai, 1978; Part és Wikmark, 1984; Borgmann és mtsai, 1989; IPCS, 1992).
A kadmium humán neurotoxikológLDL KDWiVDL I NpQW ILDWDODEE LOOHWYH ~MV]O|WW NRUEDQ ILJ\HOKHW N PHJ )HOQ WW NRUEDQ D SHULIpULiV LGHJUHQGV]HUEHQ RNR] MHOHQW VHEE
elváltozásokat, mivel a vér-agy gáton nehezen hatol át, de az expozíció a szaglóhámon keresztül lehetséges (Sunderman, 2001). A kadmium átjutása a vér-agy gáton keresztül megnövekedhet etanol jelenlétében (Pal és mtsai, 1993), vagy krónikus expozíció hatására (Shukla és mtsai, 1996) $ NDGPLXP NpWpUWpN NDWLRQ OpYpQ NRPSOH[ NpS]pVUH KDMODPRV
csökken (O'Callaghan és Miller, 1986) 7RYiEEL WpQ\H] N LV Q|YHOKHWLN D NDGPLXP
szervezetbe való bejutását, melyek a vér-agy gát permeabilitásának növekedését okozzák pl.:
magas vérnyomás, stressz, kábítószerek stb.
$NDGPLXPPHJOHKHW VHQVRNHJ\pEWiPDGiVLSRQWRWWDOiOD]pO VHMWHNEHQNLPXWDWWiN
mutagén, karcinogén, és teratogén hatásait is (Degraeve, 1981; Jennette, 1981). Celluláris hatása igen összetett, nagy reakcióképessége révén, számos munka rávilágít a kadmium hatásmechanizmus komplexitására (Stohs és mtsai, 2000; LaRochelle és mtsai, 2001; Misra és mtsai, 2002)0pUJH] KDWiVDHJ\UpV]WDV]XOIKLGULOFVRSRUWRNKR]YDOyN|W GpVpE ODGyGLN PHJJiWROYD D QDWtY iOODSRWEDQ OpWUHM|Y GLV]XOILGKLGDN NLDODNXOiViW 0LYHO D GLV]XOILG KtG D IHKpUMpN KDUPDGODJRV V]HUNH]HWpQHN NLDODNtWiViEDQ UpV]WYHY NRYDOHQV N|WpV H]HNQHN D
kötéstípusoknak a megszüntetésekor a fehérje részleges vagy teljes felbomlása (denaturációja) jöhet létre, melynek következtében a fehérje harmadlagos szerkezete megváltozik, és elveszti funkcióját. A kadmium további celluláris hatásai: apoptózis, lipid peroxidáció, DNS
NiURVRGiV K VRNN SURWHLQHN pV PHWDOORWKLRQHLQHN H[SUHVV]LyMD &D2+
homeosztázis zavara, transzmembrán ioncsatornák konduktanciáinak csökkentése stb. (Salánki, 1988; Ma és Narahashi, 1993; Kiss és Osipenko, 1994; Waalkes és Misra, 1996; Nordberg és Nordberg, 2000; Stohs és mtsai, 2000; Wätjen és mtsai, 2002).
A neurotoxikológiában a Ca2+/Cd2+ kompetíció meghatározó jelenség, mely a kadmium
pV NDOFLXP LRQRN N|]HO D]RQRV PpUHWpE O IDNDG .DOFLXP FVDWRUQiN NDGPLXPPDO YDOy
blokkolhatóságát már 1977-ben leírták (Kostyuk és mtsai, 1977), ezen hatása miatt neurobiológiai laboratóriumok egyik elengedhetetlen kísérleti „eszköze”. Az utóbbi évek
NO|QE|] JHULQFHV QHP LGHJVHMWHNHQ YpJ]HWW NXWDWiVRN HUHGPpQ\HL DUUD HQJHGQHN
következtetni, hogy a kadmium okozta citotoxikológiai hatások, illetve azok mellékhatásai,
HOV VRUEDQ D NDGPLXP-indukálta intracelluláris kalciumszint emelkedésének következménye lehet (Kanthasamy és mtsai, 1995; Misra és mtsai, 2002). A Cd2+, azzal, hogy Ca2+
N|W KHO\HNUH NDSFVROyGLN RO\DQ IHKpUMpNNHO OpSKHW LQWHUDNFLyED PHO\HN D VHMWHQ EHOOL
szignál transzdukcióban létfontosságúak. Így például Cd2+ NpSHV D NDOPRGXOLQKR] N|W GQL
(Suzuki és mtsai, 1985), mely számos Ca2+ IJJ IRO\DPDW KtUYLY WDJMD(Beguin és mtsai, 2001).
1.4 Ón
$] yQ PpUJH] KDWiViQDN YL]VJiODWD HO WW KDQJV~O\R]QL NHOO KRJ\ H QHKp]IpP NO|QE|] V]HUYHV pV V]HUYHWOHQ YHJ\OHWHLW WR[LNROyJLDL V]HPSRQWEyO QHP OHKHW D]RQRVQDN WHNLQWHQL 0DJD D] yQ PLQW IpP J\DNRUODWLODJ QHP PpUJH] 6]HUYHWOHQ vegyületeit az
HQ\KpQPpUJH] NDWHJyULiEDOHKHWEHVRUROQLV]HUYHVYHJ\OHWHLD]RQEDQPiUHU VHQPpUJH]
hatással bírnak.
Szervetlen ónvegyületek számos neurotoxikológiai hatása ismert. Orális expozíciója nagy dózisban idegrendszeri rendellenességet okozott patkányokon, mint ataxia, depresszió, izomgyengeség (IPCS, 1992). SnCl2 Gy]LVIJJ KDWiVW PXWDWRWW DFHWLONROLQpV]WHUi] DNWLYLWiV
megnövelésében, ideg és izomszövetben (Savolainen és Valkonen, 1986), illetve szinaptikus
iUDP Q|YHNHGpVpW RNR]WD EpND LGHJYpJ] GpVHNHQ PRGLILNiOYD D SUHV]LQDSWLNXV &D2+
áramot (Hattori és mtsai, 2001). Acetilkolin aktiválta ionáramokon SnCl2-DOW|UWpQ NH]HOpV-os csökkenést okozott a kontrollhoz képest Lymnaea stagnalis L. neuronokon (Gy UL pV PWVDL
2000) $ V]HU] N KDVRQOy HUHGPpQ\HNHW NDSWDN D WULPHWLOyQQDO YpJ]HWW NtVpUOHWHNEHQ LV pV NLPXWDWWiN D] yQNORULG NRQFHQWUiFLyIJJ PRGXOiOy KDWiViW D IHV]OWVpJDNWLYiOWD 1D-ion csatornákon: 10 µmol/l növelte, 50 µmol/l csökkentette azt.
SzeUYHVYHJ\OHWHLQHNPpUJH] KDWiVDD]yQKR]NDSFVROyGyV]HUYHVFVRSRUWRNV]iPiYDO Q LO\ PyGRQ D] 536Q; WtSXV~ YHJ\OHWHL D OHJPpUJH] EEHN(Bulten és Meinema, 1991).
Vízi szervezetek pedig már 10-6 - 10-9 mol/l ón koncentráció jelenlétére is érzékenyek (Hall és Pinkney, 1985). Az ón szerves vegyületei a szervezetbe jutva, viszonylag gyorsan kiválasztódik, nincs adat teratogén vagy karcinogén hatásairól (IPCS, 1980; Bulten és Meinema, 1991) $ NO|QE|] yQYHJ\OHWHN ELROyJLDL IHOH]pVL LGHMH PD[LPXP KyQDS OHJODVVDEEDQ D] DJ\V]|YHWE O WiYR]QDN (IPCS, 1980), a vér-agy gáton nehezen jutnak keresztül. Trimetilón ((CH3)3SnCl) orális expozíciója az idegrendszerre káros befolyással van, patkányokon mentális rendellenességeket, remegést, aggressziót, hiperaktivitást írtak le, és
PHJILJ\HOWpN D NO|QE|] DJ\WHUOHWHN NiURVRGiViW(Foucin és Gruner, 1979; Chang, 1984).
Patkány idegsejteken végzett biokémiai vizsgálatok a glutamát és GABA rendszer modifikációját mutatták ki: hippokampális sejtek trimetilón expozíciója esetén a glutamát felvétele és szintézise, illetve a GABA szintézise csökken, a glutamát szinaptikus felszabadulása megQ DPHO\ YpJV VRURQ D] LGHJVHMWEHQ D WULPHWLOyQ KDWiViUD OH]DMOy JiWOy UHQGV]HUHN *$%$ JiWOiVD pV VHUNHQW UHQGV]HUHN JOXWDPiW IRNR]yGiVD D VHMW W~OP N|GpVpKH]KLSHUIXQNFLyMiKR]pVSXV]WXOiViKR]YH]HW(Costa, 1985; Chang, 1995).
Az irodalmi adatok rámutatnak, hogy az ón és kadmium neurotoxikológiai hatásossága jelent V H]pUW WRYiEEL QHXURWR[LNROyJLDL KDWiVXN WRYiEEL YL]VJiODWRNDW LJpQ\HOQHN $
idegrendszerben a GABA-mediált ingerület továbbitó rendszert módosíthatja a kadmium, vagy ón jelenléte a sejtközti térben, ezért indokoltnak találtuk ezen fémek hatásvizsgálatait a mocsári csiga idegrendszerében megtalálható GABA-aktiválta ionáramokon.
1.5 Gamma-aminovajsav
A gamma-aminovajsav (GABA) mind a gerinces mind a gerinctelen idegrendszerben
PHJWDOiOKDWy QHXURWUDQV]PLWWHU D JHULQFHV LGHJUHQGV]HUQHN I JiWOy QHXURWUDQVzmittere.
Számos GABA hatásban az idegrendszerben a klorid ion kapuzó GABAA receptor altípus vesz részt, melynek blokkolószerei a bicucullin és a picrotoxin (Olsen, 1981; Sieghart, 1992).
$ J\DNUDEEDQPHJILJ\HOKHW KLSHUSRODUL]iOyKDWiVPHOOHWWHVHWHQNpQWGHSRODUL]iFLyWLVNLYiOW
mind gerinces (Alger és Nicoll, 1982; Segal és Barker, 1984), mind gerinctelen állatok neuronjaiban (Walker és mtsai, 1975; Alger és Nicoll, 1982; Segal és Barker, 1984; King és Carpenter, 1989; Vehovszky és mtsai, 1989). Farmakológiai – biokémiai jellemzés alapján kétféle GABA receptort különböztetünk meg. A GABAA receptor struktúra, mely kinyitása
NORULGLRQRNiUDPOiViWWHV]LOHKHW YpDVHMWPHPEUiQRQiW*-SURWHLQW OIJJHWOHQO(]WD&O-
áramot gátolja ezeken a receptor strukturákon pl. a bicucullin, és picrotoxin, serkenti a GABA, izoguvacin, muscimol, és a gerinces preparátumokon ismert moduláló szerek, a benzodiazepinek (Sieghart, 1992; Sieghart, 1995; Barnard és mtsai, 1998). Ez a receptor
DOWtSXV DOHJ\VpJE O iOO PHO\HN DOHJ\VpJE O α1-α6, β1-β4, γ1-γ3, ρ1-ρ3, δ, ε, π) kombinálódhatnak össze. Így a GABAA receptornak elméletileg 800 lehetséges altípusa létezhet (Barnard és mtsai, 1998). A másik típusú receptor a GABAB, mely G-protein kapcsolt receptor, vagyis hatását nem közvetlenül, hanem egy, a sejtben található ún. G-fehérje
NDSFVROW NDV]NiGPHFKDQL]PXVRQ NHUHV]WO PiVRGLN KtUYLY UHQGV]HU IHMWL NL pV
aktiválásakor K+-LRQFVDWRUQD DNWLYLWiV Q &D2+
ioncsatorna permeabilitás pedig csökken (Bowery és mtsai, 2002).
A Lymnaea központi idegrendszer DNS-E ONOyQR]RWW*$%$A receptor alegységek és a Xenopus petesejtekben expresszált receptorok, farmakológiai és kinetikai tulajdonságait tekintve 35-50 %-os hasonlóságot mutattak a gerincesek GABAA-receptoraival. A GABA- válasz muscimollal kiváltható, pikrotoxinnal és bicucullinnal blokkolható, és az ionáram megfordulási potenciálja -25 mV (Harvey és mtsai, 1991; Darlison és mtsai, 1993; Bhandal és mtsai, 1995). Rubakhin és mtsai (1996) elektrofiziológiai módszerekkel kimutatták GABAA
receptor jelenlétét Lymnaea azonosított idegsejteiben (RPeD1, RPaD1, LPaV2).
GABA aktiválta klorid áram modulációját több nehézfém hatásaként leírták. A GABA aktiválta ionáram higany és lantán hatására fokozódott, míg réz, kadmium, ólom és más polivalens kation gátolta azt patkány hátsó szarvi neuronokon (Ma és Narahashi, 1993).
Alacsony koncentrációjú higany (0,01-0,1 µmol/l) a GABA aktiválta klorid áram
SRWHQFtUR]iViW PtJ PDJDVDEE NRQFHQWUiFLy D EORNNROiViW LGp]WH HO Lymnaea neuronokon
(Rubakhin és mtsai, 1995). A GABA-aktiválta ionáram megváltozásának, illetve kadmium esetében blokkolásának hatásmechanizmusa ezidáig nem ismert.
2. CélkiW ]pV
Kutatásaink célja a környezetben általánosan és nagy mennyiségben elforduló két nehézfém (ón és kadmium) valamint származékainak neurotoxikológiai vizsgálata volt a nagy mocsári csiga, Lymnaea stagnalis L. központi idegrendszerén.
1. 6HMW V]LQW YL]VJiOataink identifikált GABA-érzékeny neuronokon annak vizsgálatára irányultak, hogy mi módon befolyásolják a nehézfémek a GABA-indukálta ionáramokat, illetve képesek-e maguk a fémek ionáramokat generálni.
2. &pOXO W ]WN NL WRYiEEi D] yQ pV NDGPLXP iOWDO D *$%$-indukálta ionáramok modulálását biztosító membrán- és lehetséges intracelluláris mechanizmusok feltárását.
3. Az ón és kadmium sejtkapcsolatokat befolyásoló hatásának feltárása volt a célunk, ami
OHKHW YpWHV]LDQHKp]IpPHNKDWiViQDND]LGHJLV]HUYH] GpV|VV]HWHWWHEEIRNiQW|UWpQ
értelmezését.
4. &pOXQN YROW FVLJD LGHJVHMWHN NLVOpVL PLQWi]DWDLQDN yQ pV NDGPLXP KDWiViUD W|UWpQ
esetleges megváltozásainak kimutatása és vizsgálata.
3. Anyagok és módszerek
A kísérleteinket a nagy mocsári csiga (Lymnaea stagnalis L., Mollusca Basommatophora) azonosított idegsejtjein végeztük (1. ábra) (Benjamin és Winlow, 1981;
Moroz, 1991) $] iOODWRNDW WHUPpV]HWHV pO KHO\NU O J\ MW|WWN .LV-Balaton), illetve
DNYiULXPRNEDQWHQ\pV]WHWWNDKROIRO\DPDWRVEDODWRQYt]]HOW|UWpQ iWiUDPOiVWEL]WRVtWRWWXQN
Az állatokat salátával tápláltuk ad libitum.
3.1. Preparálás
$ JDUDWN|UOL JDQJOLRQJ\ U W NLPHWV]HWWN pV QRUPiO IL]iológiás oldatba helyeztük egy 2 ml
WpUIRJDW~ SUHSDUiWXPWDUWy NDPUiEDQ $] LGHJHNHW J\HQJpQ PHJIHV]tWYH D JDQJOLRQJ\ U W YpNRQ\ URYDUW NNHO D NDPUD 6\OJDUGGDO 6\OJDUG 'RZ &RUQLQJ EHYRQW IHOV]tQpKH]
U|J]tWHWWN PDMG D YDVWDJ N|W V]|YHWL EXUNRW KHJ\HV csipeszekkel eltávolítottuk. Ezután 5
SHUFLJ D JDQJOLRQJ\ U W -0,8 mg/ml koncentrációjú Protease XIV (Sigma) enzimmel
NH]HOWN DPHO\ D OHJEHOV YpNRQ\ N|W V]|YHWL KiUW\iW HOYpNRQ\tWRWWD pV IHOOD]tWRWWD
megkönnyítve annak teljes eltávolítását. A sejteNE ODPpUpVW-2 órás pihentetés után kezdtük
PHJH]LG DODWWDSUHSDUiWXPRW°&K PpUVpNOHWHQWDUWRWWXN
Fél-izolált preparátumok készítését úgy végeztük, hogy tartalmazza a központi idegrendszert, valamint a környezet kemo- és ozmotikus változásait pU]pNHO RVSKUDGLXPRW pV D NHWW W
|VV]HNDSFVROy LGHJHW EHOV SDULHWiOLV LGHJ - IPN). Az idegrendszer és az osphradium
HJ\PiVWyO HOYiODV]WYD NO|Q WiUROyHGpQ\EH KHO\H]WN $] |VV]HN|W LGHJ YD]HOLQQHO YROW
szigetelve, megakadályozva az idegrendszert és az RVSKUDGLXPRW N|UOYHY IL]LROyJLiV
sóoldatok keveredését. Nehézfém, és GABA applikálás csak az idegrendszerre történt.
A kísérletekben ismert funkciójú identifikált óriásneuronokat használtunk a ganglionok
GRU]iOLV IHOV]tQpU O PHO\HNHW ORNDOL]iFLyMXN Ppretük, színük és tüzelési mintázatuk alapján azonosítottuk (1. ábra). A neuronok kiválasztásában ugyanakkor az ionáramok stabilitása és jó reprodukálhatósága is szempontunk volt.
1. ábra: Lymnaea stagnalis L. garatkörüli ganlioncsoportjának dorsalis ( a cerebralisnak viszont ventralis) oldali térképe. A Lymnaea N|]SRQWL LGHJUHQGV]HUH W|EE MyO HONO|QtWKHW JDQJOLRQEyOWHY GLN|VV]HEXNNiOLV%XFHUHEUiOLV&SHGiOLV3HSOHXUiOLV3OSDULHWiOLV
(Pa), viscerális (V). További jelölések: D: dorsalis, V: ventralis, R: jobb, L: bal, A: anterior és P: posterior. Az identifikált sejteket rövidített nevük jelöli: RPeD1 – right pedal dorsal 1 (jobb oldali pedalis dorsalis sejt 1), RPaD1 – right parietal dorsal 1 (jobb oldali parietalis dorsalis sejt 1), VD4 – visceral dorsal 4, RBu1 – right buccal 1 stb. A gangliRQRNEDQ HO IRUGXOQDN RO\DQ VHMWFVRSRUWRN PHO\HN WDJMDL HJ\PiVVDO LGHQWLNXVQDN WHNLQWKHW N PRUIROyJLDL pV
elektrofiziológiai tulajdonságaik alapján, így ezeket is az identifikált sejtekhez soroljuk (pl. A csoport, H,I,J,K csoport). Extracelluláris aktivitáV UHJLV]WUiOiVW D] ,31 EHOV SDULHWiOLV LGHJ MHO|OpV LGHJU O YpJH]WQN $ WpUNpS %HQMDPLQ pV :LQORZ D *$%$ V]HQ]LWtY VHMWHN HO IRUGXOiVD5XEDNKLQpVPWVDLDODSMiQ
3.2. Oldatok, felhasznált anyagok
$QRUPiOIL]LROyJLiVIUG IRO\DGpN|VV]HWpWHOHDN|YHWNH] YROWPPROO1D&O.&O
1,7, CaCl2 4, MgCl2 1,5, glükóz 10, Tris-HCl 10, Tris Cl 10 (pH 7,4). A kálciumhiányos fiziológiás oldat CaCl2 helyett BaCl2 oldatot tartalmazott 4 mmol/l koncentrációban.
A kísérletekben felhasznált anyagok: gamma-aminovajsav (GABA), etilén-glikol-bisz-[2- aminoetil]-tetraecetsav (EGTA), tris-hidroxi-metil-amino-metán (Tris), tris-hidroxi-metil- amino-metán-hidroklorid (Tris-HCl), suramin, pikrotoxin, pertussis toxin, koffein, ruténium vörös, metilénkék a Sigmától, 5(6)-carboxyfluoresceint a Eastman Kodaktól más anyagokat illetve szervetlen sókat Reanal Finomvegyszer Rt.-W OYiViUROWXN
,QMHNWiOiV VRUiQ D N|YHWNH] DQ\DJRNDW MXWWDWWXN D VHMWEH NO|Q-külön: 0,1 mol/l CaCl2, 0,1 mol/l K-EGTA (0,1 mol/l EGTA, 0,3 mol/l KOH, pH=7,2 beállítva HCl-el), 5mmol/l CdCl2, 5(6)-carboxyfluorescein.
3.3. Mikroperfuzió alkalmazása
A GABA neurotranszmitter applikálása az idegsejt membrán felszínére, hidrosztatikus
PLNURSHUI~]LyYDOW|UWpQW$PLNURSHUI~]LyVPyGV]HUOHKHW VpJHWDGRWWJ\RUVPHPEUiQKDWiVRN
nyomonkövetésére, mivel itt a neurotranszmitter koncentrációja azonnal elérte a kívánt értéket. Az idegrendszert stacionárius folyadékáramban tartottuk úgy, hogy a vizsgálni kívánt
VHMW D SHUI~]LyV FV Q\tOiVD HO WW NE -1 mm-rel helyezkedjen el. A neurotranszmitter egy
P DQ\DJ NDSLOOiULVRQ NHUHV]WO MXWRWW D JDQJOLRQUD D PHJIHOHO NRQcentrációban (1-100
PROO -2 s ideig, feltételezve, hogy az adáskor a megcélzott sejt felszínén a hígulás elhanyagolható. Az így adott folyadék odajutását és kimosódását vitális festékkel is
HOOHQ UL]WN PHWLOpQNpN $ PLNURSHUI~]LyQ NHUHV]WO DONDOPDzott oldat adása mechanikai
]DYDUW QHP RNR]RWW ,VPpWHOpV HVHWpQ D] *$%$ KR]]iDGiVD HO WW PLQGHQ HVHWEHQ OHJDOiEE
percet, illetve meghatározott esetekben 2 percet vártunk a receptor-deszenzitizáció elkerülése végett.
A nehézfémek applikációját a feszültség-zár kísérleteknél 1- PROO
végkoncentrációban közvetlenül a perfúziós oldatba juttava végeztük. A current-clamp kísérleteknél az anyag-applikációkat pipettával végeztük. A használt nehézfém végkoncentráció 1 mmol/l volt, a GABA 1 mmol/l-os koncentrációit juttattuk közvetlenül a sejtekre.
3.4. Elvezetés
(i) Áram zár (current-clamp) mérések: A Lymnaea LGHJUHQGV]HUE O D FXUUHQW-clamp
HOYH]HWpVHNQpO HOV VRUEDQ D MREE SHGiOLV JDQJOLRQ 53H' MHO QDJ\ GRSDPLQHUJ QHXURQMiW
valamint az RPaD1, RPaV2, VD1 sejteket illetve a H, I, J, K-motoneuron csoportot
YL]VJiOWXNiEUD$VHMWHNMHO|OpVpEHQD]XWROVy'LOOHWYH9EHW DGRU]iOLVLOOHWYHYHQWUiOLV
felszínre utal, R és L a jobb és bal oldali ganglionokat jelöli. További rövidítések: Pa – parietalis, V – visceralis, Pe - pedalis)
(J\LGHM OHJ PD[LPXP LGHJVHMW PHPEUiQMiQDN IHV]OWVpJYiOWR]iVDLW N|YHWWN
VWDQGDUG LQWUDFHOOXOiULV HOYH]HWpVW DONDOPD]YD YHJ PLNURHOHNWUyGiN VHJtWVpJpYHO D] HU VtW
current-clamp üzemmódjában. A transzmembrán potenciálokat 2,5 mol/l-os KCl oldattal töltött mikroelektródával vezettük el azok ellenállása 2-5 MΩ volt. Az elvezetett feszültségjeleket magas bemeneti impedanciájú (109 Ohm) Axoclamp 2A (Axon, USA), és
'XR :RUOG 3UHFLVLRQ ,QVWUXPHQW WtSXV~ ELROyJLDL HU VtW NNHl végzett amplifikálás után oszcilloszkópon megjelenítettük, és egy PCL-818HD (Advantech, USA) A/D konverterrel ellátott IBM kompatibilis komputerbe (Pentium 166) vezettük.
(ii) Feszültség zár (voltage-clamp) mérések: Lymnaea CNS azonosított neuronok ligand-aktiválta ionáramainak mérésére a két-mikroelektródás voltage-clamp (feszültség-zár) módszert alkalmaztuk, azonosított GABA szenzitív óriásneuronokon: RPeD1, RPaD1, LPaV1. Az ionáramokat DAGAN 8500 (Dagan Corp., USA) típusú többfunkciós intracelluláris voltage-FODPSHU VtW YHOUHJLV]WUiOWXNpV7HNWURQL['7HNWURQL[,QF86$
oszcilloszkópon jelenítettük meg. Az üveg mikroelektródákat 2,5 mol/l koncentrációjú KCl oldattal töltöttük meg. Az áram és feszültségelektróda ellenálása 3-4 MΩ volt. Az elektródák közötti résbe egy földelt fémlemezt vittünk, csökkentve a rendszer kereszt-kapacitását. Az
$J$J&O UHIHUHQFLD HOHNWUyGiW D SUHSDUiWXPWDUWy NDPUD PHOOHWWL WDUWiO\EDQ OpY PPROO
KCl-oldatba merítettük, és egy U alakú agarhíddal teremtettük meg az elektromos kontaktust
D IUG IRO\DGpNNDO $ PHPEUiQIHV]OWVpJHW YH]pUO FRPPDQG MHOHNHW HJ\ ,%0 NRPSDWLELOLV 3HQWLXP WtSXV~ V]iPtWyJpSHQ IXWWDWRWW 2UELWDO &ODPS 6] FV $WWLOD QHY PpU SURJUDPPDOiOOtWRWWXNHO $V]iPtWyJpSHJ\8$0-1500 (Détári László) típusú AD/DA konverter interface-HQ NHUHV]WO FVDWODNR]RWW D] HU VtW K|] DPL OHKHW Yp WHWWH D VHMWUH MXWy IHV]OWVpJ YH]pUOpVpW pV D] HJ\LGHM OHJ Q\HUW LRQiUDPRN PHPyULiED W|OWpVpW $
regisztrátumokat file-okba mentettük és a mérés végeztével off-line módon kiértékeltük. A sejtek membránfeszültségét adott feszültség értékeken (holding potenciál) rögzítettük (-75 mV).
(iii) Az idegaktivitás regisztrálása fél-intakt preparátumon extracelluláris elvezetés alkalmazásával történt. Platinaelektródákat helyezve az idegre, aktivitás esetén egy
YiOWyiUDP~ Ki]LODJ NpV]tWHWW HU VtW YHO UHJLV]WUiOWXN D SHULIpULiV LGHJHQ D] H[WUDFHOOXOiULV DNWLYLWiVW (] D PyGV]HU W|EE QHXURQEyO HUHG LQIRUPiFLy iUDPOiViW PXWDWMD HJ\V]HUUH D
központi idegrendszert egy perifériával összHN|W LGHJHQ$IHOKDV]QiOWLGHJDMREESDULHWiOLV LGHJ YROW ,31 PHO\ D OpJ] Q\tOiVW LGHJ]L EH $] LGHJ pV LGHJVHMW HJ\LGHM DNWLYLWiViQDN
regisztrálások Gould RS3400 oszcillografikus rekorder segítségével végeztük.
3.5. Intracelluláris injektálás
Intracelluláris injektálást végeztünk anyagok sejtbe juttatásához. A sejtbe bejuttatni
NtYiQW ROGDWRW HJ\ NE P FV~FViWPpU M YHJ NDSLOOiULVED W|OW|WWQN $] LQMHNWiOiV U|YLG LGHM PDJDVQ\RPiV~ EDU QLWURJpQJi]]DO W|UWpQW PiJQHV V]HOHS VHJtWVpJpYHO PHlyet
LG ]tW HOHNWURQLND NDSFVROW EH (]]HO D PyGV]HUUHO – PV LG WDUWDP~ LQMHNWiOiV YROW YpJH]KHW D NtVpUOHWHLQNEHQ iOWDOiEDQ PV LG WDUWDPRW KDV]QiOWXQN $] LQMHNWiOW PHQQ\LVpJHW N|YHWNH] PyGRQ V]iPtWRWWXN NL RODMIUG EH LQMHNWiOW IRO\DGpN Jömb alakot
IRUPiOW PHO\QHN iWPpU MpW RV]WiVRV RNXOiUUDO PpUWN OH D J|PE WpUIRJDWiW HEE O V]iPROWXN
(McCaman és mtsai, 1977; Hara és mtsai, 1985). Az így bejuttatott anyag mennyisége 3-25
QDQROLWHU PHQQ\LVpJ YROW $] LQMHNWiOW PHQQ\LVpJ OLQHiULVDQ IJJ|WW D] LQMHNWálás
LG WDUWDPiWyO $] tJ\ RODMED MXWWDWRWW DQ\DJ PHQQ\LVpJH - QDQROLWHU PHQQ\LVpJ YROW pV
feltételeztük, hogy a sejtplazma ellenállása elhanyagolható, így a sejtbe injektált anyag mennyiségét is hasonlóképpen megbecsülhetjük. A sejtbe injektált anyagok hígulását a sejten belül az injektált anyagmennyiség és a sejt számított térfogatának arányából számítottuk ki. A
VHMWHN DODNMD PHJN|]HOtW OHJ HJ\ HOOLSV]RLGUD KDVRQOtWRWWDN WpUIRJDWXNDW HQQHN DODSMiQ V]iPtWRWWXN D N|YHWNH] NpSOHWWHOVcell=π/6⋅d1⋅d2⋅d3 ahol d1 a sejt hosszúsága, d2 a sejt
V]pOHVVpJH LOOHWYH D KDUPDGLN iWPpU QHN D VHMW V]pOHVVpJpW YHWWN G3=d1 $ N|YHWNH]
átlagos sejttérfogatokat kaptuk a vizsgált sejtekre: RPeD1: 1149,47 ± 175,2 pl, (n=10) és RPaD1: 1254,43 ± 210,89 pl. (n=6) Az LQMHNWiOiV HOOHQ U]pVpUH YLWiOLV IHVWpNHNHW
metilénkéket és 5(6)-karboxifluoresceint használtunk, mely a sejtet egyetlen injektálás után jól láthatóan megjelölte. A GABA-DNWLYiOWDLRQiUDPRNUDDMHO|O IHVWpNHNQHPYROWDNKDWiVVDO
(n=4).
EGTA injektálásániO D VHMWEHQ HO IRUGXOy V]DEDG &D2+
szintjék becslésére a MaxChelator számítógépes programot (Bers és mtsai, 1994) használtuk, mely szukcesszív
approximációs módszerrel számította ki a szabad ionkoncentrációkat. A becsléshez a
N|YHWNH] NRQFHQWUiFLyNDW KDV]QiOWXN (*7$ [-4
mol/l, Ca2+: 10-4 mol/l, pH=7,2,
K PpUVpNOHW & $ V]iPtWiV FVDN LQIRUPDWtY MHOOHJ D IHOKDV]QiOW NRQFHQWUiFLy DGDWRN KR]]iYHW OHJHVHN
3.6. Krónikus nehézfém- kezelés
Az állatok krónikus nehézfém-kezelését akváriumokban végeztük, mely során CdCl2-t oldottunk föl balatonvízben 1 mg/l koncentrációban. A kezelések 14 napja alatt, 10-10 csiga kezelését végeztük egy-egy 10 literes akváriumban. Kontroll vizsgálatként hasonló körülmények között CdCl2 hozzáadása nélkül tartottunk csigákat, és azt tapasztaltuk, hogy a kontroll és kezelt állatok közötti halálozási ráta nem volt szLJQLILNiQVDQNO|QE|]
3.7. Adatfeldolgozás
L$FXUUHQWFODPS]HPPyGEHQQ\HUWIHV]OWVpJpUWpNHNW]HOpVLJ\DNRULViJDODSMiQW|UWpQ
kiértékelése:
$] LGHJVHMWHN DNWLYLWiVL PLQWi]DWiQDN KRVV]~ LGHM UHJLV]WUiOiVD VRUiQ D GLQDPLNXV
változások jellemzésére off-OLQH V]iPtWyJpSHV SURJUDPRW KDV]QiOWXQN 2UELWDO 6SLNH 6] FV
Attila). Feszültség-GLV]NULPLQiFLyV PyGV]HUHQ DODSXOy DGDWJ\ MW pV DGDWHOHP] V]iPtWyJpS V]RIWYHUHNNHO 2UELWDO 6SLNH 6] FV $WWLOD 'DV\/DE 'DV\WHFK 86$ D] HJ\PiV XWiQ N|YHWNH] DNFLyV SRWHQFLiORN LG SRQWMDLW PHJKDWiUR]WXN pV FVDWRUQiQNpQW V]pWYiORJDWYD
soros formában mentettük el disk-file-okba.A mérés alatt elmentett akciós potenciál (spike)
NLVOpV LG SRQW DGDWRN IHOKDV]QiOiViYDO LQWHUVSLNH LQWHUYDOOXP ,6, GLDJUDPRNDW YDODPLQW
azokból gyakorisági eloszlásokat (hisztogramokat) számítottunk ki.
$ NLVOpVL V U VpJ IJJYpQ\W VSLNH GHQVLW\ IXQFWLRQ 6') D GLV]NUpW DNFLyV SRWHQFLiO
sorozat és Gauss függvény konvolúciójaként kapjuk meg 6] FV:
6') W = K X −W S X GX
−∞
+∞
∫
ahol p(t) a spike sor, h(t) pedig a folytonos Gauss függvény volt. Ez a kísérlet alatt
IRO\WRQRVDQ YDOyV LG EHQ PXWDWWD D] DNWXiOLV VSLNH V U VpJ IJJYpQ\W 6') PHO\ D
neuronális aktivitás dinamikai jellemzésének szemléletes eszköze és állapothatározója volt (2.
iEUDËJ\DW]HOpVLJ\DNRULViJEDQEHN|YHWNH] QpKiQ\V]i]DOékos ingadozások kimutatására
LVOHKHW VpJQ\tOW
Input 3 RPeD1
VD4
A
B C
J sejt
H sejt
40 mV
2 s
0 50 100 150
0 1 2
,G >V@
SDF G [s-1 ]
2. ábra: Lymnaea stagnalis L. légzésszabályzó neuronjainak akcióspotenciál mintázatai. A.
7LSLNXVNLVOpVLPLQWi]DWHJ\LGHM OHJUHJLV]WUiOWQpJ\D]RQRVtWRWWQHXURQEyO9t]V]LQWHs vonal a preszinaptikus Input 3 interneuron aktivitását jelöli, mely az RPeD1 hiperpolarizációját és a VD4, a H és I sejtek depolarizációját okozzák. B. 6SLNH V U VpJ IJJYpQ\ OpWUHKR]iViQDN
szemléltetése a diszkrét spike sorozat, melyet a háttérben láthaWy IJJ OHJHV YRQDODN
szemléltetnek, és Gauss függvény konvolúciójaként kapjuk meg. C. Lymnaea motoneuron
DNFLyV SRWHQFLiO VRUR]DWiQDN VSLNH V U VpJ IJJYpQ\H PHO\ D NLVOpVL PLQWi]DWRNEDQ
található frekvenciaváltozásokra gyors és pontos követést ad. Felette a forrás diszkrét spike sorozat. A periódikus beszakadások a függvényben rövid spike-PHQWHVLG V]DNRNDWMHO|OQHN
(ii) A ligand-aktiválta ionáramok kiértékelése:
A GABA applikálással kiváltott ligand-DNWLYiOWD iUDPRN DODNMiW YDJ\LV LG IJJpVpW
több kísérleti körülmény befolyásolhatja. Az ioncsatornák nyitási-]iUiVL P N|GpVH D
transzmitter-UHFHSWRUN|OFV|QKDWiVQ\RPiQM|QOpWUHDPHO\HWYLV]RQWHU WHOMHVHQEHIRO\iVROD
neurotranszmitter applikálásának módja, a koncentráció beállásának sebessége is. Az ionáram aktivációs szakaszát az extracelluláris oldat rövid ideig tartó mozgásából származó zavar kisebb-nagyobb mértékben torzíthatja, de az alkalmazott mikroperfúzióból áramló neurotranszmittert tartalmazó oldat mechanikai zavart nem okozott. Esetenként a
UHJLV]WUiWXPRNRQ D] DQ\DJ DONDOPD]iVD HVHWpEHQ D PpUW LRQiUDPRNWyO MyO HONO|QtWKHW
WVNHV]HU iOWDOiEDQ HOOHQNH] LUiQ\~ U|YLG ]DM NHOHWNH]HWW PHO\ D PpUpVHNHW pV
kiértékeléseket nem zavarta.
A keletkezett GABA-aktiválta ionáramok nagyságát amplitúdójukkal jellemeztük állandó, -75 mV holding potenciálon mérve. Az áram a maximális értékét az applikáció
NH]GHWpW O V]iPtWRWW - PiVRGSHUFEHQ pUL HO DPLNRU PiU QHP V]iPRWWHY HN D] DJRQLVWD
esetleges koncentrációjának egyenetlenségei.
Rögzített feszültség esetén az anyag applikálás ideje alatt, majd a kimosáskor vettük fel az áram-LG GLDJUDPPRNDW $] LRQFVDWRUQiN DNWLYiFLyMiW tJ\ D IHOIXWiVL LG WLPH-to-peak)
PpUpVpYHO PHJIHOHO HQMHOOHPH]KHWWN $] LQDNWLYiFLyV V]DNDV] NYDQWLWDWtY MHOOHP]pVpW D IpO-
LQDNWLYiFLyV LG YHO MHOOHPH]WN DPHO\ D] LQDNWLYiFLy LGHMH D] iUDP PD[LPXPiWyO PpUYH D PD[LPXPIHOpQHNHOpUpVLLG SLOODQDWiLJWDUW
$ PpUpVL DGDWRN HOHP]pVpUH iEUiN HONpV]tWpVpUH 0LFURVRIW ([FHO WiEOi]DWNH]HO W pV 0LFURFDO2ULJLQDGDWHOHP] pVUDM]ROy programot használtam.
3.8. Statisztikai vizsgálatok:
Méréseink során az GABA applikálással kiváltott ionáramok amplitudójában és
LG MHOOHJ NLQHWLNDL SDUDPpWHUHLEHQ OpWUHM|WW YiOWR]iVRNDW D NRQWUROO pUWpNHNKH] YDOy YLV]RQ\tWiVVDOV]iPV]HU HQNLIHMH]WN A vizsgálni kívánt anyag jelenlétében mért áramgörbék
KDVRQOy SDUDPpWHUHLW iWODJRV DPSOLWXGy DNWLYiFLyV LG IpO-LQDNWLYiFLyV LG D NRQWUROO
értékekre normalizálva megkaptuk a paraméterek relatív értékeit, illetve azok relatív, százalékos változását. Minden nehézfémkezelést külön-külön preparátumon végeztünk el, ugyanazokon az azonosított GABA-szenzitív idegsejteken, azonos körülmények között
NRQFHQWUiFLyIUG IRO\DGpN
A statisztikai minták szórásvizsgálatához F-próbát, szignifikancia vizsgálathoz kétmintás t-próbát alkalmaztunk P=0,05 szint mellett. A populációk elemszámát a mérési pontok mennyiségén túl az összevonható és átlagolható értékek maximális száma határozta meg.
4. Eredmények
4.1 GABA aktiválta ionáramok farmakológiai és kinetikai jellemzése
A gamma-aminovajsav (GABA) hatását és a GABA-receptorok farmakológiai tulajdonságait izolált, extracelluláris perfúzió alatt tartott Lymnaea azonosított GABA- szenzitív óriásneuronokon (RPaD1, RPeD1, LPaV1) vizsgáltuk és jellemeztük. A vizsgálatok két mikroelektródás feszültség zár módszerrel történtek, mellyel a sejtmembránon
NHUHV]WOIRO\y iUDPRNDW LOOHWYH D]RN DQ\DJKDWiVUD W|UWpQ PHJYiOWR]iVDLW PpUWN $ KROGLQJ
potenciál -75 mV, míg a mikroperfuzióval applikált GABA koncentrációja 25, 50 µmol/l volt.
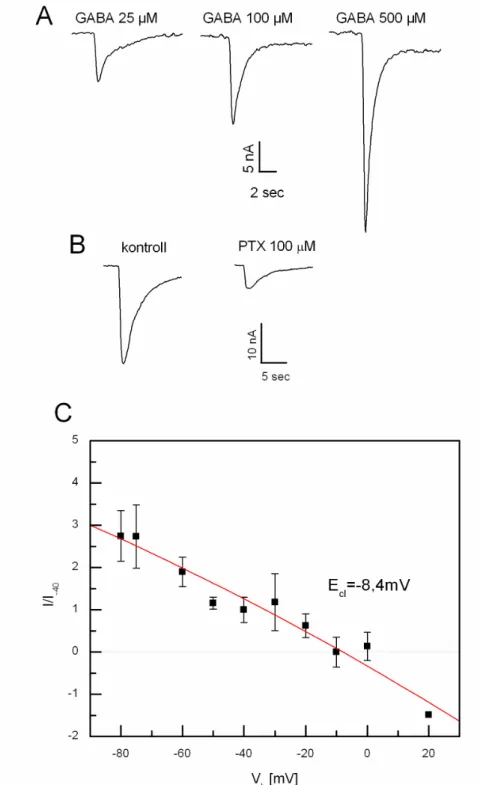
A GABA applikálás által kiváltott a ionáram 4 - Q$ DPSOLW~GyM~ EHPHQ LQZDUG LRQiUDP PHO\QHN LG EHQL OHIRO\iVD - V YROW *$%$ KDWiVD NRQFHQWUiFLyIJJ PHO\HW – 500 µmol/l tartományban vizsgáltunk (3A ábra). A GABAA receptor antagonista pikrotoxin 100 µmol/l-os koncentrációban 28 ± 15 %-ra csökkentette a GABA-aktiválta ionáramot (n=8, 3B ábra).
Az áramok csúcsértékét az alkalmazott holding potenciál változtatásával és azonos
NRQFHQWUiFLyM~ *$%$ HJ\LGHM DGiViYDO ,-V karakterisztikát nyertünk. Az I-V karakterisztikán megállapított megfordulási potenciál, vagyis azt a feszültséghatár, ahonnan a sejtbe befelé irányuló áram kifelé irányulóvá változik, -8,4 ± 12,9 mV-nak adódott (n = 7, 3C ábra).
A GABA-indukálta ionáramok kinetikai jellemzését a fHOIXWiVL LG WLPH-to-peak) és a
IpOLQDNWLYiFLyV LG N PHJKDWiUR]iViYDO YpJH]WN PROO *$%$ NRQFHQWUiFLy HVWHWpQ D IHOIXWiVL LG pUWpNH ± V Q YROW $ IHOIXWiVL LG XJ\DQDNNRU QHP YiOWR]RWW
szignifikánsan a membránpotenciállal. Az ionáramokat a csúcs elérése utáni szakaszból fél
LQDNWLYiFLyV LG YHO MHOOHPH]WN $ PROO NRQFHQWUiFLyM~ *$%$ iOWDO LQGXNiOW iUDPRN
gyors- pV ODVV~ LQDNWLYiFLyV LG iOODQGyMD ± V Q pUWpN QHN EL]RQ\XOW QRUPiO
fiziológiás oldatban.
3. ábra: GABA kiváltotta ionáramok karakterisztikája. A. Inward klorid áramok 25, 100, 500 µmol/l GABA hatására -75 mV holding potenciálon az RPeD1 neuronon. Kiváltott áramok amplitúdói: 8,6 nA, 15,8 nA, és 40,4 nA. B. 100 µmol/l pikrotoxin (PTX) hatása GABA aktiválta ionáramra RPeD1 neuronon. C. áram-feszültség összefüggés GABA (25 µmol/l) válaszokra az RPeD1, RPaD1, és LPaV2 sejteken. Az értékeket -40 mV holding potenciálon mért átlagos amplitúdókhoz normalizáltuk (n=7-11).
6HMWPHPEUiQV]LQW YL]VJiODWRN– a nehézfémek hatása a GABA-aktiválta membránáramokra
4.2.1. Az ón hatása GABA-aktiválta ionáramokra
Vizsgáltuk a GABA-aktiválta ionáram módosulását trimetilón jelenlétében, melynek toxicitása magasabb, mint a szervetlen származékoké (IPCS 1980)10 µmol/l trimetilón hatására mérsékelten csökkent a GABA-aktiválta ionáram amplitúdója, mely a kezelés 30.
percében volt a legnagyobb (4A ábra), míg 50 µmol/l trimetilón adásakor a gátló hatás kisebb volt (4B ábra). Eredményeink azt mutatták, hogy 10 µmol/l koncentrációnál 74 ± 20 %-ra (n=9), 50 µmol/l koncentrációnál 87 ± 17 %-ra (n=8) csökkentették a mért GABA aktiválta ionáramot a kontrollhoz képest. A statisztikai vizsgálatból kiderült, hogy az anyaghatásra
IHOOpS YiOWR]iVQHPWHNLQWKHW V]LJQLILNiQVQDN3&iEUD
Trimetilón hatását vizsgáltuk továbbá a GABA-mediált ionáramok kinetikai
SDUDPpWHUHLUH LV $]W WDOiOWXN KRJ\ PLQG D] DNWLYiFLyV LG N PLQG D IpO-LQDNWLYiFLyV LG N
megnövekedtek, trimetilón kezelés hatására mindkét alkalmazott koncentráció esetében. Az
DNWLYiFLyVLG NPHJQ|YHNHGpVpWV]LJQLILNiQVQDNWDláltuk mind 10 µmol/l (n=9, P<0,05), mind 50 µmol/l esetében (n=8, P<0,05) (4D ábra).
4. ábra: Trimetilón hatása GABA-indukálta ionáramokra. A. 10 µmol/l trimetilón hatása GABA-aktiválta (GABA 25 µmol/l, Vh=-75mV) ionáramokon az RPeD1 neuronon. B. 50 µmol/l trimetilón GABA-aktiválta (GABA 25 µmol/l, Vh=-75mV) ionáramokon az RPeD1 neuronon. Trimetilón jelenlétét vízszintes vonal jelöli. C. Normalizált amplitúdó értékek nem mutatnak szignifikáns különbséget. D. AktiviFLyV pV LQDNWLYiFLyV LG N PHJYiOWR]iVD
trimetilón jelenlétében.Az oszlopok az átlag ± szórás értékeket jelölik.
4.2.2. Cd2+ hatása a GABA-aktiválta ionáramokra
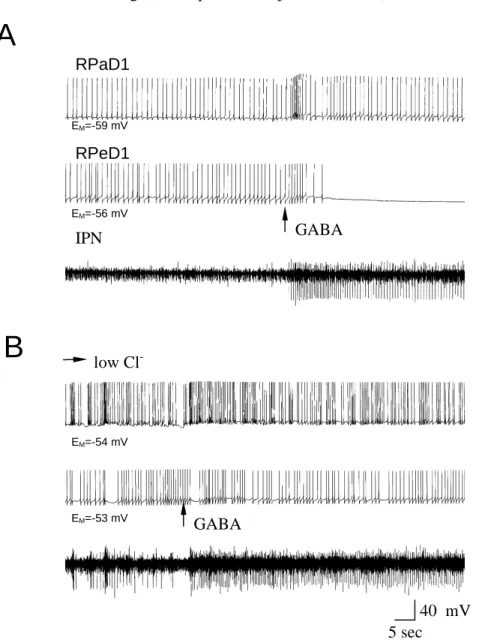
50 µmol/l koncentrációjú kadmium mikroperfúzióval közvetlenül a sejtmembránra (RPeD1, RPaD1) való juttatása feszültség zár módban -75 mV holding potenciálon 1-2 nA amplitúdójú áramot váltott ki. A mért inward áram aktivációs ideje azonos volt az oldott kadmium adásának idejével és a nehézfém adásának befejezésével kezdett inaktiválódni (5.
ábra). Ez az ionáram kinetika lassabb és jyO PHJNO|QE|]WHWKHW YROW D *$%$-indukálta ionáramokéhoz képest.
5. ábra: Cd2+ hatása a RPeD1 neuron membránján egész ganglion preparátumon -75 mV holdingpotenciálon. Cd2+ applikációja (vízszintes vonal) 1-2 nA inward áramot indukál.
Akut CdCl2 kezelések 1- PROO N|]|WW PpUYH NRQFHQWUiFLyIJJ PyGRQ
befolyásolták a GABA-indukálta ionáramokat. A 1 µmol/l Cd2+ jelenlétében 5 perces kezelés
XWiQ PpUKHW *$%$-indukált inward áram enyhe gátlását figyeltük meg, a GABA-aktiválta ionáram amplitudó értéke 79 ± 11 %-ra csökkent (n=7), mely nem szignifikáns változás a
NRQWUROOKR] NpSHVW $ NH]HOpVW IRO\WDWYD NE D SHUFEHQ PHJV] QW D JiWOy KDWiV PDMG
serkentésbe ment át. 30 perces kezelés után már 117 ± 8 % (n=6) volt a változás a kontrollhoz képest, mely szintén nem szignifikáns eltérés. A hatás részben reverzibilis volt, a kezelés befejezésével majd 5 perces kimosással 109 ± 41 %-os (n=6) lett a GABA-aktiválta áram a kontrollhoz képest (6B ábra, - -). 1 µmol/l-nál nagyobb koncentrációjú kadmiumkezelés gátló hatású volt a GABA-aktiválta ionáramokon. 5 µmol/l CdCl2 kezelésnél 58 ± 25 % (n=9) (6B ábra, - -), 10 µmol/l-nál 45 ± 17 %-os (n=12) volt a 25. percben a GABA által kiváltott ionáram amplitúdója kontrollhoz képest (6B ábra, - -). A 10 µmol/l-os adatsor
H[SRQHQFLiOLV IJJYpQQ\HO LOOHV]WKHW YROW LG iOODQGy W1/2= 0,82 ± 0,22 sec. 50 µmol/l-os koncentráció teljesen blokkolta az ionáramot (n=8) (5 ± 5%), mely 3 percen belül kialakult (10. ábra). A gátló hatás fiziológiás oldattal való kimosás után részben reverzibilis volt, 5
perces mosás után rendre 59 ± 25 %, 67 ± 12 %, 34 ± 9 %-nak adódtak a kontrollhoz képest a
N|YHWNH] NRQFHQWUiFLy-sorban: 5, 10, 50 µmol/l (6B ábra).
6. ábra: 1, 5, 10 µmol/l CdCl2 hatása GABA (25 µmol/l) aktiválta ionáramokra D] LG
függvényében. A. Az alacsonyabb Cd2+ (1 µmol/l) koncentráció a GABA aktiválta klorid ionáramot enyhe gátlás után potencírozza, nagyobb koncentrációkban (5 µmol/l, 10 µmol/l) a gátlás hatásosabb, és részben kimosható. B. A grafikon a kontrollhoz normalizált összesített adatokat tünteti fel (átlag ± szórás). 29 kísérlet RPaD1, RPeD1, LPaV2 sejteken, Vh=-75 mV.
A
B
A dózis hatásgörbe felvételével megállapíthatjuk, hogy a Lymnaea stagnalis L. GABA érzékeny sejtjeinek klorid áramain a CdCl2 blokkolás féltelítési állandója IC50=9,2 µmol/l, Hill koefficiense pedig h=2,65 ± 0,48 (7. ábra).
A GABA-szenzitív sejtek ionáramainak modulációját 10 µmol/l kadmium kezelést
N|YHW HQ NLQHWLNDLODJ LV HOHPH]WN iEUD $ QRUPDOL]iOW PLQWDJ|UEpN D IHOIXWiVL LG pV D]
LQDNWLYiFLyVLG iOODQGyFV|NNHQpVpWPXWDWWiN%iEUD$VWDWLV]WLNDLHOHP]pVDODSMiQD&G2+
hatására a GABA aktiválta áram aktivációs ideje (time-to-SHDN V]LJQLILNiQVDQ PHJQ WW
(P<0,05): 0,33 ± 0,08 s-ról 0,61 ± 0,2 s-ra. Fél-LQDNWLYiFLyV LGHMHL LV Q WWHN H] D YiOWR]iV
azonban statisztikailag nem szignifikáns (P<0,05): 0,99 ± 0,58 s-ról 1,2 ± 0,22 s-ra (8C ábra).
7. ábra: 1|YHNY NRQFHQWUiFLyM~ &G&O2 15 perces akut alkalmazásának hatása GABA aktiválta ionáramra – dózis hatásgörbe. A normalizált GABA-aktiválta ionáramok amplitúdó értékei az RPeD1, RPaD1 és LPaV2 neuronokon (Vh=-75 mV). Féltelítési állandó: IC50=9,2 µmol/l, Hill koefficiens h=2,65 ± 0,48 (n=7-12).
8. ábra: Aktivációs és fpO LQDNWLYiFLyV LG N YiOWR]iVD &G2+
hatására. A. GABA-aktiválta ionáram modulációja µmol/l 10 Cd2+ hatására -75 mV holding potenciálon (GABA 25 µmol/l, RPeD1) B. Ugyanaz a regisztrátum amplitúdóban a kontroll méréshez normalizálva. C. Cd2+
hatására az aktiYiFLyV LG N pV LQDNWLYiFLyV LG N PHJQ WWHN D]D] D OLJDQGDNWLYiOWD iUDPRN
dinamikája lecsökkent. * jelöli a szignifikán eltérést a kontrollhoz képest (P<0,05).
4.2.3. Cd2+ hatása a GABA-aktiválta ionáramokra krónikusan kezelt állatokon
A csigák 2 hetes 1 mg/l CdCl2-DO YDOy NUyQLNXV NH]HOpVpW N|YHW HQ D *$%$ PROO
aktiválta ionáramok tulajdonságaiban (aktiváció, inaktiváció, megfordulási potenciál) nem találtunk szignifikáns eltérést. Megismételve azonban az akut kezelési kísérleteket a
nagyobb koncentrációjú akut kezelés hatására mutattak ugyanakkora blokkolást a GABA aktiválta ionáramokon. A krónikusan kezelt csigák esetében mintegy tízszer nagyobb koncentrációjú Cd2+ fejtette ki ugyanazt a hatást. Az akut CdCl2 gátló hatásának küszöbértéke a kezeletlen állatoknál 1 µmol/l körül a kezelteknél 10 µmol/l körül volt. 10 µmol/l Cd2+ akut kezelés esetén 43 ± PtJ NUyQLNXV NH]HOpVW N|YHW PROO &G2+
akut kezelés esetén 119 ± 17 % volt a GABA-aktiválta ionáramok amplitúdójának változása a kontrollhoz viszonyítva. A krónikusan kezelt állatokon mért akut hatás dózis hatásgörbéjének féltelítési állandója IC50=97,73 µmol/l (h=1,41 ± 0,18) volt (9. ábra).
9. ábra: Cd2+ (10 µmol/l) akut és krónikus kezelésének hatása GABA (25 µmol/l) által kiváltott áramokra RPeD1, RPaD1 és LPaV2 sejteken (Vh=-75 mV). A krónikusan kezelt állatokon mért akut Cd2+ adás dózis hatásgörbét kék színnel jelöltem (n=5-8). Féltelítési állandója: IC50=97,73 µmol/l (h=1,41 ± 0,18). A diagramon a kontroll Cd2+ akut blokkolásának dózishatás görbe is látható (piros színnel, ld. 7. ábra). A dózishatás görbék mellett a 10 µmol/l-os Cd2+ koncentráció hatása láthatók GABA aktiválta ionáramokra, krónikus kezeléssel (jobb oldalon) és nélküle (bal oldalon).
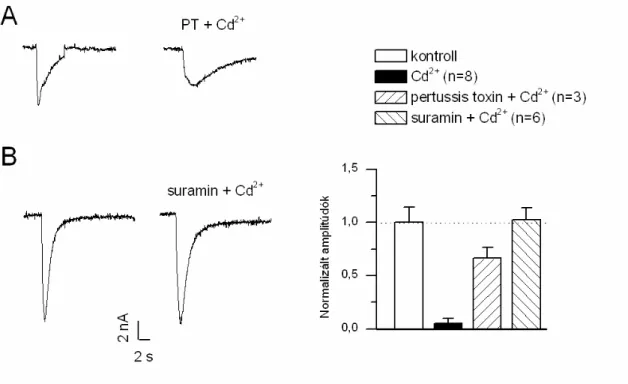
4.2.4. Cd2+ gátló hatásának lehetséges mechanizmusa
A Cd2+ GABA-aktiválta ionáramokra gyakorolt gátló hatásának mechanizmusa a szakirodalomban nem ismert pontosan. Vannak adatok azonban arra, hogy a Cd2+
intracelluláris Ca2+ felszabadulást okozott (Smith és mtsai, 1989; Yamagami és mtsai, 1998;
Hague és mtsai, 2000; Misra és mtsai, 2002). Hasonló mechanizmus a GABA-hatásra
YRQDWNR]yDQ LV IHOWpWHOH]KHW H]pUW PHJYL]VJiOWXN D] H[WUDFHOOXOiULV LOOHWYH LQWUDFHOOXOiULV
Ca2+ ion szerepét a Cd2+ gátló hatásának kialakításában.
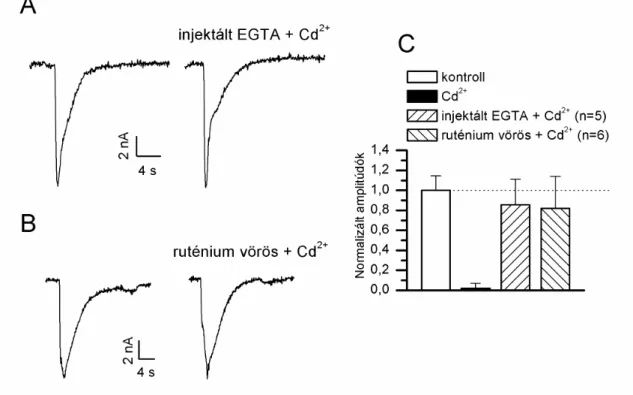
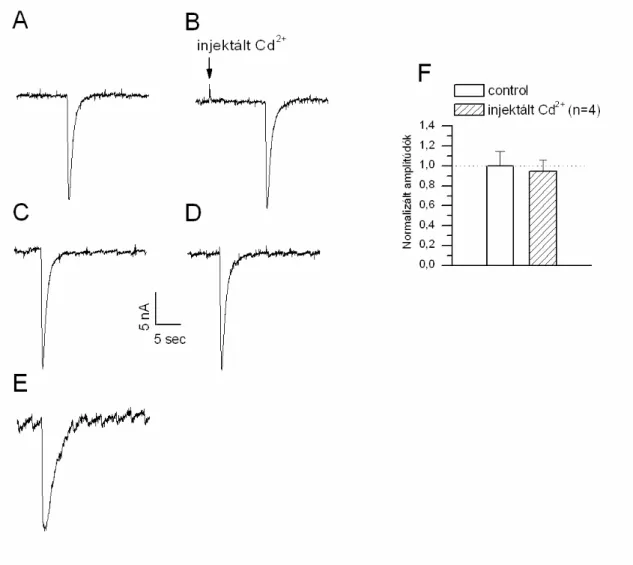
A 50 µmol/l extracellulárisan alkalmazott kadmium blokkoló hatása GABA-aktiválta ioncsatornán nem változott, mikor az extracelluláris CaCl2 helyett BaCl2-t (4 mmol/l) tartalmazó sóoldatban végeztük el a kísérletet. A GABA válasz 12 ± 6 % a kontrollhoz képest (n=5, 10. ábra). A normál és báriumos oldatban kapott gátló hatások különbségét statisztikailag nem találtuk szignifikánsnak (10 C ábra).
10. ábra: Cd2+ (50 µmol/l) hatása GABA-indukálta ionáramokra. A. GABA-indukálta ionáram (50 µmol/l) kontroll RPaD1 neuronon (Vh=-75mV). B. 50 µmol/l Cd2+ teljesen eltörölte GABA-aktiválta ionáramot (Vh=-75mV). C. Ca2+ KLiQ\RV IUG ROGDWEDQ %D2+
-al helyettesítve) extracelluláris oldatban a Cd2+ blokkoló hatása megmaradt. Az oszlopdiagramokon a Cd2+ normál extracelluláris sóoldatban illetve a Ca2+ hiányos Ba2+-t tartalmazó (4 mmol/l) oldatban mért Cd2+ hatások normalizált átlag ± szórás értékei a kontrollhoz képest szignifikánsan csökkentek, illetve a Cd2+ hatások közötti különbség nem szignifikáns. (P<0,05)
Az intracellulárisan jelenléY V]DEDG &D2+ hatását vizsgáltunk GABA-indukálta ionáramra a sejtbe bejuttatott Ca2+-injektálássegítségével. Ca2+ (1 mmol/l) intracellulárisan
W|UWpQ LQMHNWiOiVD YDJ\ NRIIHLQ KR]]iDGiVD PPROO PHO\ D] LQWUDFHOOXOiULV UDNWiUDNEDQ OpY &D2+
-ot szabadítja fel, hasonló gátló hatást mutatott a GABA-aktiválta ionáramokon
$%iEUD$NRQWUROO*$%$YiODV]KR]'iEUDHOV RV]ORSQRUPDOL]iOWDPSOLW~GyN
-injektálás és koffein alkalmazása esetében: 13 ± 3 % (n=3) és 41 ± 27 % (n=7).