B
12vitamin tartalmú, bukkális gyógyszerhordozó rendszer formulálása, mikro- és makroszerkezetének
vizsgálata
Doktori értekezés
Szabó Barnabás
Semmelweis Egyetem Gyógyszertudományok Doktori Iskola
Témavezető: Dr. Zelkó Romána, egyetemi tanár, D.Sc.
Hivatalos bírálók: Dr. Révész Piroska, egyetemi tanár, D.Sc.
Dr. Stampf György, egyetemi docens, Ph.D.
Szigorlati bizottság elnöke: Dr. Klebovich Imre, egyetemi tanár, D.Sc.
Szigorlati bizottság tagjai: Dr. Ludányi Krisztina, egyetemi docens, Ph.D.
Dr. Homonnay Zoltán, egyetemi tanár, D.Sc.
Budapest 2012
1 Tartalomjegyzék
Rövidítések jegyzéke ... 4
1. Irodalmi háttér ... 7
1.1. B12 vitamin élettana, indikációi és alkalmazásának lehetőségei ... 7
1.1.1. A B12 felfedezése ... 7
1.1.2. A B12 szerkezete és tulajdonságai ... 7
1.1.3. A B12 bioszintézise ... 8
1.1.4. A B12 élettani szerepe... 9
1.1.5. A B12 hiánybetegsége, a ”vészes” vérszegénység ... 10
1.1.6. Terápiás lehetőségek ... 12
1.2. Bukkális hordozórendszerek ... 13
1.3. Mikroszerkezeti vizsgálatok ... 24
1.3.1. Fourier-transzformációs infravörös spektroszkópia (FTIR) ... 25
1.3.2. Raman spektroszkópia ... 25
1.3.3. Pozitron annihilációs módszerek ... 27
1.3.3.1. Pozitron annihilációs élettartam spektroszkópia (PALS) ... 27
1.3.3.2. Doppler-szélesedés mérése (DB) ... 37
1.3.3.3. Gyakorlati, gyógyszerészeti alkalmazások ... 39
1.4. Makroszerkezeti vizsgálatok ... 40
2. Célkitűzések ... 41
3. Módszerek ... 42
3.1. Felhasznált hatóanyag ... 42
3.2. Felhasznált segédanyagok ... 42
3.3. Mintakészítés ... 44
3.3.1. Hidrogélek előállítása ... 44
2
3.3.2. Szabadfilm előállítás öntéses technikával ... 44
3.3.3. Liofilizált filmek előállítása fagyasztva szárítás technikával ... 45
3.3.4. Minták tárolása ... 45
3.4. Vizsgálati módszerek ... 45
3.4.1. Fourier-transzformációs infravörös spektroszkópia (FTIR) ... 45
3.4.2. Viszkozitás meghatározása ... 46
3.4.3. Hidrogélek pH-jának meghatározása ... 46
3.4.4. Pozitron annihilációs élettartam spektroszkópia ... 47
3.4.4.1. Kompatibilitás vizsgálat PALS módszerrel ... 47
3.4.4.2. Gél-film átmenet vizsgálata PALS módszerrel ... 47
3.4.4.3. Szabadfilmek és ostyák mérése PALS módszerrel ... 48
3.4.4.4. Doppler-szélesedés (DB) mérése ... 48
3.4.5. Mikrohullámú kezelés ... 49
3.4.6. Raman térképezés (Raman Mapping) ... 49
3.4.7. Mikroszkópos képek készítése ... 49
3.4.7.1. Pásztázó elektronmikroszkópia (SEM) ... 49
3.4.7.2. Kisteljesítményű, digitális mikroszkópos képek készítése ... 49
3.4.8. Mechanikai tulajdonságok vizsgálata ... 50
3.4.9. In vitro kioldódás vizsgálat ... 51
3.4.9.1. Kioldódás vizsgálat és mintavétel ... 51
3.4.9.2. Kioldódott hatóanyag mennyiségének meghatározása ... 51
3.4.9.3. A kioldódási görbék hatóanyagleadási modellekkel való jellemzése ... 51
3.4.10. Ex vivo kioldódás vizsgálat ... 52
4. Eredmények ... 54
4.1. Preformulációs vizsgálatok eredményei ... 54
4.2. A heterogenitás vizsgálatának eredményei ... 66
3
4.3. Az előállított gyógyszerformák vizsgálatának eredményei ... 75
5. Következtetések ... 94
6. Összefoglalás ... 96
7. Summary ... 97
8. Irodalomjegyzék ... 98
9. Saját publikációk jegyzéke ... 108
9.1. Az értekezés témaköréhez kapcsolódó közlemények ... 108
9.2. Az értekezés témaköréhez kapcsolódó, teljes terjedelemben megjelent kongresszusi előadások... 108
9.3. Az értekezés témaköréhez nem kapcsolódó közlemények ... 109
10. Köszönetnyilvánítás ... 110
4 Rövidítések jegyzéke
3D – 3 dimenziós, térbeli A – terület (area)
AAS – atomabszorbciós spektroszkópia (atom absorbtion spectrometry) AES – atomemissziós spektroszkópia (atom emission spectrometry) AFM – atomi erő mikroszkópia (atomic force microscopy)
API – aktív komponens, hatóanyag (active pharmaceutical ingredient) ATR – Gyengített teljes reflexió (attenuated total reflectance)
B12 – B12 vitamin, ciano-kobalamin (cyanocobalamine)
BCS – Biofarmáciai Osztályozási Rendszer (biopharmaceutics classification system) CP – Carbopol 71G polimer
DB – Doppler-szélesedés (Doppler-broadening)
DSC – differenciál pásztázó kalorimetria (differential scanning calorimetry) ESR – elektronspin rezonancia (electron spin resonance)
e+ – pozitron e- – elektron F – erő (force)
FTIR – Fourier-transzformációs infravörös spektroszkópia (Fourier transform infrared spectroscopy)
G-L-guluronsav
HIV emberi immun-alulműködést kiváltó vírus human immunodeficiency virus) HPGe nagy tisztaságú germánium (high purity germanium)
IBD – gyulladásos bélbetegség (inflammatory bowel disease) i.m. – izomba adott (intramuszkuláris)
IR – „vörösön inneni”, infravörös (infrared) i.v. – vénába adott (intravénás)
k – kioldódási sebességi konstans
K&P – Korsmeyer és Peppas (kinetikai modell)
logP – a megoszlási hányados (partition coefficient) logaritmusa M -D-mannuronsav
5
MCC mikrokristályos cellulóz (microcrystalline cellulose) MCM – metil-malonil-koenzim-A mutáz enzim
MET – metionin aminosav (S-metil-homocisztein) MPa – megapascal
MRI – képalkotó magmágneses rezonancia spektroszkópia (magnetic resonance imaging)
MRM – (multiple reaction monitoring)
MS – tömegspektrometria, tömegspektrométer (mass spectrometry, mass spectrometer) Mt – t időpontig felszabadult hatóanyag-mennyiség
MTR – 5-metil-tetrahidrofolát-homocisztein-metiltranszferáz enzim M∞ – az elméleti végtelen időpontig felszabadult hatóanyag-mennyiség n – a diffúzió transzport-mechanizmusát jellemző állandó
n0 – neutron
NIR – közeli infravörös spektroszkópia (near infrared spectroscopy)
NMR – magmágneses rezonancia spektroszkópia (nuclear magnetic resonance) ODT – szájban széteső tabletta (orally disintegrating tablet)
o-Ps – orto-pozitrónium (azonos spinű elektronból és pozitronból álló kvázi-atom) PALS – Pozitron annihilációs élettartam spektroszkópia (positron annihilation lifetime spectrometry)
PET – pozitron-emissziós tomográf (positron emission tomography)
p-Ps – para-pozitrónium (ellentétes spinű elektronból és pozitronból álló atom) PS – törési szilárdság (puncture strenght)
p+ – proton
R – az üregek átlagos sugara (radius) RBC – vörösvértest (red blood cell)
RH – relatív páratartalom (relative humidity)
RPM – percenkénti fordulat (revolutions per minute)
RP-LC – fordított fázisú folyadákkromatográfia (reverse-phase liquid chromatography) R0 – a látszólagos falvastagság
S – eredő spin
SA – nátrium-alginát, az alginsav nátriumsója (sodium alginate)
SEM – Pásztázó elektron mikroszkópia (scanning electron microscopy)
6 SucCoA – szukcinil-koenzim-A
t1/2 – felezési idő τ3 – o-Ps életidő ún. – úgy nevezett
USA – Amerikai Egyesült Államok (United States of America) UV – ibolyántúli, ultraibolya (ultraviolet)
7 1. Irodalmi háttér
1.1. B12 vitamin élettana, indikációi és alkalmazásának lehetőségei 1.1.1. A B12 felfedezése
A B12 vitamin felfedezéséhez a vérszegénység gyógymódjának keresése vezetett. Az 1920-as években George Hoyt Whipple kutyán végzett kísérletekben bizonyította a nyers máj jótékony hatását a kóros vérszegénységben, később George Richards Minot és William Parry Murphy a nyers májból izoláltak vasat, amellyel Whipple kísérleteit reprodukálni tudták. Emberben a vas hatástalannak bizonyult, azonban 1926-ban a máj egy másik összetevőjének hatásosságát írták le, munkájukért 1934-ben megosztott orvosi Nobel-díjat kaptak. A B12-vitamint csak 1948-ban izolálta Mary Shaw Shorb, Karl August Folkers és Alexander Robertus Todd, 3 dimenziós szerkezetét (1. ábra) Dorothy Hodgkin (született: Dorothy Crowfoot) igazolta kristály-röntgendiffrakciós módszerrel 1956-ban, amelyért 1964-ben (Marie Curie és Irène Joliot-Curie után harmadik nőként) kémiai Nobel-díjat kapott.
1.1.2. A B12 szerkezete és tulajdonságai
A kobalaminok (így a B12-vitamin is) porfirin, tehát tetrapirrol-származékok, korrin- vázas vegyületek, amelyek központi szerkezeti eleme a hemhez és a klorofillhez hasonló. A porfirinek központi atomja általában (kivétel például a klorofill Mg-magja) valamilyen vegyértékváltó átmeneti- (tehát d-mezőbeli) fémion, pl. vanádium (hemovanádium), nikkel (F430 metil-koenzim M reduktáz), vas (hem) vagy éppen mangán (pinnaglobin), a kobalaminok esetében pedig (ahogy nevük is mutatja) kobalt.
A porfirinhez képest a korrin-gyűrű eggyel kevesebb szénatomot (-CH2-, metilén- csoportot) tartalmaz (1. ábra 2D-s ábrázoláson a központi atomtól balra hiányzik a metiléncsoport) ezzel megbontja a szimmetriát és a konjugált kötésű központi gyűrűt [www.chm.bris.ac.uk] lánccá degradálja.
8
1. ábra A ciano-kobalamin szerkezete a hagyományos 2 dimenziós és 3 dimenziós ábrázolásban
(A jobb oldali (3D) képen a központi Co-atom a szokásostól eltérő világoszöld, míg a koordinációs-szférájában található cianid-ion aranysárga színnel szerepel a könnyebb áttekinthetőség miatt, a többi atom színezése a hagyományos: Hidrogén-fehér, Oxigén-
piros, Nitrogén-kék, Foszfor-lila.)
A B12 vitamin kiváló vízoldékonyságú (10,2-10,7 mg/ml [Wang és mtsai 2007]), nagy lipofilitása (logP = 3,57 [Mylan és Howard 1995]) ellenére nagy molekulatömege (M = 1355,37 g/mol) miatt rosszul felszívódó, a Biofarmáciai Osztályozási Rendszer (BCS) III. osztályába tartozó hatóanyag. A kobalt korrin- komplexének, így a B12-nek is mélyvörös a színe.
1.1.3. A B12 bioszintézise
Kobalaminokat már az első fotoszintetizáló élőlények csoportjába tartozó spirulina nemzetség (ciano-baktériumok, sokáig hibásan kékmoszatok) is termeltek, amelyek a ciano-kobalaminnal azonos biológiai aktivitást mutattak. A baktériumok számára a levegő N2-jének megkötéséhez szükséges a kobalt-központú vegyület, a folyamat közben az aerob (oxidációs folyamatukhoz O2 szükséges) élővilág kialakulásához és fennmaradásához szükséges O2-t bocsátanak ki. Anaerob baktériumokban a kobalaminok és így a B12 vitamin a Cl2 felvételben és anyagcserében
9
vesznek részt [Brennan és Sanford 2002]. A B12 az emberi szervezet és a legtöbb állati szervezet számára esszenciális, a szükséges mennyiséghez a táplálékfelvétellel kell hozzájutnunk, de ez nem jelenti azt, hogy az emberi szervezet nem képes előállítására.
A vastagbélben élő egyes baktérium-törzsek (és más baktériumok pl. a hastífuszt okozó Salmonella typhimurium is [Jeter és mtsai 1984]) képesek a B12 bioszintézisére, azonban mivel a vitamin főként a vékonybélben, a csípőbél (ileum) alsó felében szívódik fel, így az előállított mennyiséget nem tudjuk hasznosítani, a széklettel kiürül szervezetünkből.
A ciano-kobalamin az emberi szervezetben metabolizálódik és a kiindulási vegyülettel azonos biológiai szerepű metil-, adenozil-, illetve hidroxi-származékká alakul. A hidroxi-származék rendkívül nagy cianid-ion affinitással rendelkezik, ezért cianid-mérgezés esetén is alkalmazzák.
1.1.4. A B12 élettani szerepe
A B12 élettani feladata a metil-malonil-koenzim-A mutáz enzim (MCM) koenzimeként a propionil-, illetve metil-malonil-koenzim-A-ból szukcinil-koenzim-A-t (SucCoA) előállítani. A MCM vesz részt az elágazó láncú aminosavak, így az izoleucin, valin, treonin, metionin, a DNS-t felépítésében részt vevő timin, a koleszterin és a páros szénatomszámú zsírsavak lebontásában és a SucCoA-n keresztül a Szent-Györgyi–
Krebs-ciklusba (más néven citromsav-ciklus, német nyelvterületen csak Krebs-ciklus) való kapcsolásában.
Az 5-metil-tetrahidrofolát-homocisztein-metiltranszferáz enzim (MTR) koenzimeként az 5-metil-tetrahidro-folát demetilezésével, a metionin (MET) homociszteinből kiinduló bioszintézisében is részt vesz [Berg és mtsai 2002]. A MET az emberi szervezet számára esszenciális, de létfontosságú, fehérje-alkotó aminosav (amelyet alkohol- és opiát-elvonási terápiában is alkalmaznak táplálék-kiegészítőként), amelyet hal, hús és egyes növényi magvak (pl. szezámmag [El Tinay és mtsai 1976]) tartalmaznak nagyobb mennyiségben. A bioszintézis megléte és a MET esszenciális volta látszólag ellentmondás, amely feloldható a homocisztein eredetének vizsgálatával.
A MET-bioszintézis alapját képező homociszteint a szervezet MET-ből állítja elő, így a
10
visszaalakítás tulajdonképpen a homocisztein egyik eliminációs módja (a másik út a transzszulfuráció, amelynek B6-vitamin a kofaktora)[www.medlist.com].
1.1.5. A B12 hiánybetegsége, a ”vészes” vérszegénység
Az emberi szervezet B12-vitamin igénye 0,4 (csecsemők) - 2,8 (szoptatós anyák)
g/nap [Meltzer 2003] között változik, mivel vízben jól oldódó vitamin, biológiai felezési ideje plazmában (amelyben normál koncentrációja 200-900 pg/ml) kb. 5 nap [Adams 1963], azonban az egészséges emberi máj 2 évre elegendő mennyiséget képes tárolni. A B12 hiánybetegsége a ”vészes” vérszegénység (anaemia perniciosa), amelyet a XIX. században lefolyása során drámaian, akár a normál érték tizedére csökkenő vörösvértest-számra utalva neveztek ”vészes”-nek. A vérszegénység (anaemia) leggyakoribb oka a vöröscsontvelő-sejtek osztódásának, a vörösvértestek (erythrocyták vagy magyarosan eritrociták, RBC) termelésének (erythropoesis) nem megfelelő működését okozó vas-, ritkább esetekben a B12-, a folsav- (B9-vitamin) vagy a B12
felszívódását segítő, a gyomor-nyálkahártya fedő- (ún. parietalis-) sejtjeiben termelődő, apoeritein nevű fehérje (intrinsic faktor) hiánya. Szintén vérszegénységet okoz, a vörösvértestek fokozott lebontása (valamilyen gyógyszer, anyagcserezavar, szerzett vagy örökletes betegség hatására).
A B12 hiányát (vérszint 100 pg/ml alatt vagy 100-400 pg/ml között magas homocisztein vagy metil-malonilsav szinttel [Snow 1999]), amelyben főként 60 éven felüliek és nők szenvednek, több tényező is okozhatja, azonban az esetek jelentős részében nem azonosítható a kiváltó ok [Carmel 2008]. A B12 nem áll rendelkezésre a szükséges mennyiségben, ha az állati eredetű ételt kizáró étrend nem párosul, a szükséges vitaminok pótlásával (pl. dúsított élesztő, gabonafélék, húshelyettesítők [American Dietetic Association and Dietitians of Canada 2003] vagy táplálék kiegészítők fogyasztásával). Szintén hiánytünetet okoz, ha a vitamin nem képes felszívódni, pl. a csípőbél egy részének eltávolítása miatt [Commonwealth of Massachusetts, 2007], illetve ha az intrinsic faktor-hiány alakul ki a gyomor eltávolítása vagy idült (krónikus) gyulladása esetén [Doscherholmen és Swaim 1973].
A B12-hiány következtében az említett RBC-szám csökkenésen túl, magas metilmalonilsav-, illetve homocisztein-szint alakul ki, ezek következménye kimerültség,
11
légszomj, szédülés, sápadtság, gyors szívverés (tachycardia), lépnagyobbodás, sárgaság (citromsárga bőr), gyomor-, bél-, szájnyálkahártya- és nyelvgyulladás (glossitis), hajhullás, ritkább esetben enyhe hőemelkedés. A B12-hiány kiválthat más betegségeket, amelyek közül fontos megemlíteni a hiperkróm- vagy megaloblasztos vérszegénységet (hyperchrom anaemia), illetve a gerincvelő szubakut kombinált degenerációját (funicularis myelosis). Előbbi esetében a RBC-ek nagyobbak és ”túlfestődnek”, bennük a hemoglobin mennyisége több a normálisnál. Utóbbi esetében neurológiai tünetek, mozgásszervi panaszok, alsó végtagi-gyengeség, -érzéketlenség, -zsibbadás, súlyos esetben bénulás, erektilis diszfunkció, vizelet- és széklettartási problémák is jelentkezhetnek.
A ”vészes” vérszegénység kezelhető nagy dózisú B12-vel, adagolása az ekkora mennyiség felszívódásához szükséges intrinsic faktor hiányában, jellemzően intravénás (i.v.) vagy intramuszkuláris (i.m.) injekcióval történik. Kiegészítő kezelésként folsav (a homocisztein-szint csökkentésére), vas (a RBC termelés megnövekedett vas-igényére), réz (vas felszívódásának és a vérképzés fokozására), C-vitamin bevitelét és fehérje-, illetve energiadús táplálkozást (a felszívódás és a RBC-szintézis energia igényének biztosítására) javasolnak.
A B12 vitamin-hiány sok betegségnek mellékhatása, mondhatni biomarkere. Ezek közül a legismertebb talán a bélférgesség, amely a fejlődő (gazdaságilag elmaradott, nem megfelelő higiénés körülményekkel rendelkező) államokban igen gyakori. A kutatások alapján, bár alapvetően élősködők jelenlétéről van szó (amely sok esetben olyan súlyos tünetekkel párosul, mint a végbélviszketés, a végbéltájéki ekcéma, a kialvatlanság okozta neurózis, vérszegénység, súlyos szövődményként vakbélgyulladás (appendicitis) vagy a húgyutak gyulladása), azonban jótékony hatásai is ismertek. Ezek közül a legfontosabbak: az asztma, az 1. típusú diabétesz, a sclerosis multiplex, az IBD (gyulladásos bélbetegségek), a Crohn-betegség [Summers és mtsai 2005], szénanátha és sok más, főként autoimmun jellegű betegséggel kapcsolatban kimutatható gyógyító hatásuk. Tünetei, a tápanyag-elvonás következtében történő súlycsökkentés, étvágytalanság, a nyomelemek (főként vas), illetve a vitaminok (elsősorban a B12) alacsony szérumszintje, amelyeket ezért a bélféreggel kezelés során pótolni kell.
12 1.1.6. Terápiás lehetőségek
A B12 vitamin terápiás alkalmazásában komoly változások történtek az utóbbi években. Korábban azt mondhattuk, a ”vészes” vérszegénység gyógyításában, a B12
vitamin súlyos hiányában az izomba adott (i.m.) injekciós formát alkalmazzák széles körben [Andrès és mtsai 2007]. Mára azonban az injekciós készítmények száma drasztikusan lecsökkent, Magyarországon csak a Richter Gedeon 1000 μg/ml-es oldatos injekciója van forgalomban, de az Amerikai Egyesült Államokban (USA) is csak 1, receptre kapható, kizárólag B12 hatóanyagú, formula maradt a gyógyszerpiacon (1 mg/ml Vibisone™ (App Pharm). Korábban olyan nagy gyógyszergyárak rendelkeztek FDA engedéllyel B12-injekció gyártáshoz és forgalmazáshoz, mint a Lilly (0,1 és 1 mg/ml, Betalin™), a Roche (Berocca PN™), a Watson Labs (0,1 és 1 mg/ml, Cobavite™), a Bayer (1 mg/ml, VI-TWEL™) vagy épp a Merck (1 mg/ml, Redisol™).
Ezek a készítmények mind kikerültek a forgalomból, a Vibisone-on kívül csak olyan több hatóanyagú vitamininjekciók kaphatók B12-tartalommal, mint a Sandoz Infuvite™
termékcsaládja vagy a Hospira M.V.I.™ termékei. A nem-parenterális gyógyszerek sincsenek nagy számban a piacon, Magyarországon a Feroglobin-B12™ (Vitabiotics) kemény kapszula, amely vérképzés elősegítéséhez alkalmazott komplex készítmény vérképzéshez B6-, B9-vitaminnal, vassal, cinkkel és rézzel, a Milgamma drazsé (Wörwag Pharma) B1-származékkal, az USA-ban pedig Nascobal® nazális spray. A jelenség oka néhány klinikai tanulmány, amelyek tanulsága szerint az orális (per os) forma lehet (nagyobb hatóanyag-tartalommal) ugyanolyan hatékony, mint i.m.
adagolással [Butler és mtsai 2006], valamint a szublingvális formulák is felveszik a versenyt a per os adagolással [Sharabi és mtsai 2003, Yazaki és mtsai 2006].
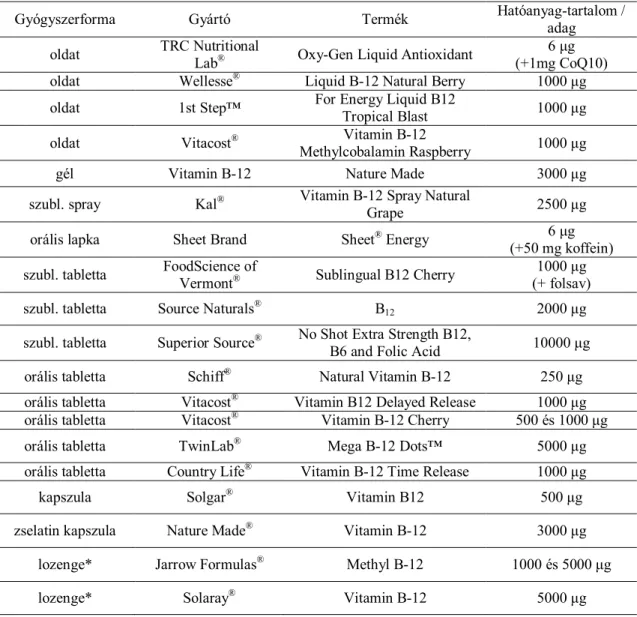
Ezek a vizsgálatok elősegítették a kisebb költséggel előállítható intraorális formákat, amelyek recept nélkül kapható étrend-kiegészítőként kerültek forgalomba. A termékpaletta bemutatására néhány (50-nél több gyártó, több mint 150 készítménye közül), az Egyesült Államokban kapható termék és hatóanyagtartalma látható a 1.
táblázatban. Ahogy a felsorolásból látható, a sokféle forma változatos hatóanyag- tartalommal rendelkezik, 5 (amely a napi szükséglet kétszerese) és 10000 μg / adag között. A 2500-10000 μg-os B12-mennyiségű formulák komoly vetélytársaivá váltak az 1000 μg-os injekcióknak, ráadásul szedésük nem invazív, fájdalommentes, valamint a
13
receptköteles szereknél olcsóbbak is. Bár a hatóanyagnak nincs rossz íze, a fogyasztók megszerzésére a termékek általában valamelyik, B12-höz hasonlóan piros színű gyümölcs aromájával készülnek, amelyet sokuk neve is tükröz.
1. táblázat Néhány kereskedelmi forgalomban lévő, B12-tartalmú étrend kiegészítő
Gyógyszerforma Gyártó Termék Hatóanyag-tartalom /
adag oldat TRC Nutritional
Lab® Oxy-Gen Liquid Antioxidant 6 μg (+1mg CoQ10)
oldat Wellesse® Liquid B-12 Natural Berry 1000 μg
oldat 1st Step™ For Energy Liquid B12
Tropical Blast 1000 μg
oldat Vitacost® Vitamin B-12
Methylcobalamin Raspberry 1000 μg
gél Vitamin B-12 Nature Made 3000 μg
szubl. spray Kal® Vitamin B-12 Spray Natural
Grape 2500 μg
orális lapka Sheet Brand Sheet® Energy 6 μg
(+50 mg koffein) szubl. tabletta FoodScience of
Vermont® Sublingual B12 Cherry 1000 μg (+ folsav)
szubl. tabletta Source Naturals® B12 2000 μg
szubl. tabletta Superior Source® No Shot Extra Strength B12,
B6 and Folic Acid 10000 μg
orális tabletta Schiff® Natural Vitamin B-12 250 μg
orális tabletta Vitacost® Vitamin B12 Delayed Release 1000 μg orális tabletta Vitacost® Vitamin B-12 Cherry 500 és 1000 μg
orális tabletta TwinLab® Mega B-12 Dots™ 5000 μg
orális tabletta Country Life® Vitamin B-12 Time Release 1000 μg
kapszula Solgar® Vitamin B12 500 μg
zselatin kapszula Nature Made® Vitamin B-12 3000 μg
lozenge* Jarrow Formulas® Methyl B-12 1000 és 5000 μg
lozenge* Solaray® Vitamin B-12 5000 μg
* A lozenge formák eredetileg olvasztásos, öntéses eljárással készült lassan oldódó, lokális hatású torokcukorkák voltak, melyek formájukról (lozenge= rombusz) kapták a nevüket. A modern formák már más alakúak is lehetnek, előállítási módjuk is változhat, a közös tulajdonságuk a szájban történő nyújtott hatóanyagleadás.
1.2. Bukkális hordozórendszerek
14
A szájüreg (cavum oris) a táplálkozás kezdeti lépésében játszik meghatározó szerepet. A táplálékot a fogak aprítják, majd a nyálmirigyek által termelt, enyhén lúgos folyadékkal falatot alkotva lenyelhetővé válik és folytatja útját a gasztrointesztinális rendszerben (GIT). A nyál (saliva) nem csak a falat-alkotásban, a nyálkahártyák nedvesen tartásában vesz részt, hanem baktericid hatása révén védi a szervezetet a kórokozóktól, a táplálékból feloldódott fluorid-tartalma pedig (a természetes kalcium- és foszfát-tartalommal) a fogak épségének megőrzésében is fontos szerepet játszik. A nyál emésztő- (főként szénhidrátbontó-) enzimeket tartalmaz, amelyek már a szájüregben megkezdik a táplálék egyes komponenseinek lebontását [Dévay és Antal 2009]. A szájüreg tápanyag-felvevő funkcióval is rendelkezik, nyálkahártyái erekkel sűrűn beszőttek, membránjai aktív transzport-mechanizmusokkal eresztik át pl. a glükóz molekuláit, a jellemző felszívódási mechanizmus mégis a passzív diffúzió. Az 2. ábra mutatja a főbb nyálkahártyák, köztük a kétoldali bukkális nyálkahártya elhelyezkedését a szájüregben.
2. ábra A szájüreg főbb nyálkahártyái
A bukkális nyálkahártya a szájüreg két oldalán, szimmetrikusan helyezkedik el, felszíne kb. 100-200 cm2 [Smart 1993]. E felszívódási terület kihasználhatóságát a nyálkahártya állapota döntően befolyásolja. Sérülés esetén a membránon való átjutás, amennyiben még beszélhetünk membránról, felgyorsul, azonban ez, a gyógyszerelés szempontjából kedvező, hatása jelentősen csökkenti a szervezet védekezőképességét,
15
hiszen a nyílt seben keresztül a különböző mikroorganizmusok is a keringési rendszerbe juthatnak. Elegendő nedvesség hiányában, a felszívódás akár teljesen meg is szűnhet. Ez különösen nagy problémát jelent a termelődés akut alulműködése (szájszárazság - xerostómia) esetében, amelyet különböző gyógyszerek (mintegy 400-féle, köztük vérnyomáscsökkentők, antidepresszánsok) vagy betegségek (HIV; cukorbetegség;
Sjörgen-szindróma, amely egy viszonylag gyakori, könny- és nyálmirigyeket érintő autoimmun betegség) idézhetnek elő. A nyál túltermelődése (nyálfolyás - ptyalismus) szintén csökkenti a bevitel hatékonyságát, mivel leöblíti a terápiás rendszert és vele a hatóanyagot a gyomorba és a GIT további szakaszaiba, ahonnan sok hatóanyag nem megfelelően szívódik fel vagy a gyomorsav, illetve más enzimek bontják. A megnövekedett szekréciót gyógyszerek (pl. a zöldhályog kezelésében alkalmazott pilokarpin), betegségek (pl. a mandula-gyulladás, a tetanusz-fertőzés vagy a Tourette- szindróma), illetve különböző mérgezések (pl. gomba- vagy higanymérgezés) okozhatják.
Az anatómiai bevezetés után, bukkális beviteli forma általános jellemzőit, a bukkális hatóanyag-leadó rendszerek szerkezeti csoportosítását, az ezeket felépítő segédanyagokat, hatóanyagokat, valamint a jelenleg kutatási fázisban, illetve már forgalomban lévő formulációkat mutatom be.
A bukkális gyógyszerbevitel előnye (a per os adagoláshoz képest) a gyorsabb hatást eredményező gyorsabb felszívódás és az ún. first pass metabolizmus elkerülése.
A máj lebontó enzimein kívül a bukkális nyálkahártyán keresztül felszívódó hatóanyag a GIT rendszer metabolizáló tereit (a gyomorsavat, a gyomor enzimeit, az epét, a bélben található enzimeket) is elkerüli, így nagyobb arányban kerül aktív formában a hatáskifejtés helyére. A szájüregből felszívódó hatóanyag dózisa a fenti oko miatt kisebb lehet, mint per os adagolásnál (pl. a dopaminreceptor-blokkoló proklórperazin bukkális tablettája (BuccastemTM) 3 mg, míg a normál per os tabletta 5 mg hatóanyagot tartalmaz [Bond 1998]), illetve azonos dózisban hatékonyabb, mint a hagyományos beviteli formában (lidokain és az artikain bukkális formában [Aggarwal és mtsai 2009]).
Ez a beviteli forma kísérletek alapján mind az alkalmazott hatóanyagok dózisában, mind felszívódási sebességében, a bukkális rendszerek több előnyével szintén rendelkező intranazális úton történő bevitellel rokon [Schols-Hendriks és mtsai 1995].
16
A bukkális hordozórendszerek hátránya ugyanakkor a bevihető kis anyagmennyiség, a rövid és kis felületű felszívódási ablak, illetve, hogy csak olyan hatóanyag alkalmazható esetükben, amely passzív diffúzióval képes átjutni a membránon. További hátrány lehet, hogy a szájüregben viszonylag kicsi a folyadék térfogata (0,6-0,96 ml; 0,82-1,19 ml nők, illetve férfiak esetében [Lagerlof és Dawes 1984]), amelyben nagy koncentráció érhető el, így lokális mellékhatások léphetnek fel (pl. a hidrokortizon helyi fertőzést, a tesztoszteron íny-érzékenységet, -irritációt, keserű szájízt, a proklórperazin pedig szájszárazságot okozhat).
A gyógyszerformáknak számos követelménynek kell eleget tenniük, a hatékony bevitel érdekében a nyálkahártyához kell tapadniuk (mukoadhezivitás), a felszívódáshoz szükséges időt a szájüregben kell tölteniük és ez idő alatt minimalizálniuk kell a hatóanyag-veszteséget (pl. lassan oldódó vagy inert fedőréteg alkalmazásával).
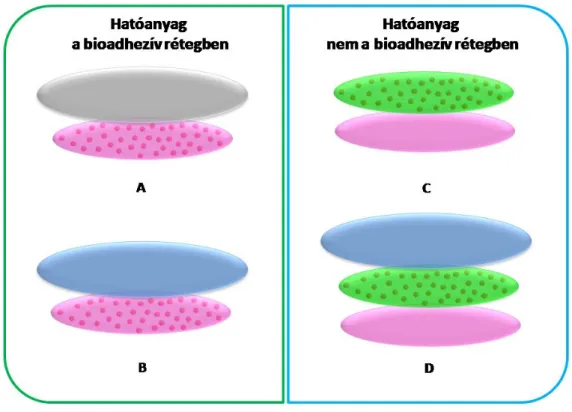
A bukkális gyógyszerformák alapvető szerkezetük alapján 3 osztályba sorolhatók [Verma és mtsai 2011], lehetnek 1 rétegűek (1. osztály), fedőréteggel rendelkezőek (2. osztály), illetve egyirányú hatóanyag-leadást biztosító formák (3.
osztály). A 3 osztály szerkezetét mutatja be a 3. ábra. Fontos szempont, hogy ez az osztályozás nem különbözteti meg a különböző gyógyszerformákat (tabletta, film, gél, oldat).
17
3. ábra A bukkális gyógyszerformák szerkezeti osztályai
További osztályozási lehetőséget biztosít a szilárd gyógyszerformák mátrix-, illetve rezervoár-típusra bontása. A mátrix-típusú gyógyszerformák esetében a hatóanyag szabályozott leadásáról a réteg gondoskodik, amely az aktív komponenst (API) tartalmazza, míg a rezervoár-típusba sorolandó formulák egy (vagy több) szabályozó membránt tartalmaznak a hatóanyag-tartalmú rétegen kívül (4. ábra).
18
4. ábra A mátrix- és a rezervoár-típusú gyógyszerformák általános szerkezete
Mindkét típust további, kisebb csoportokba oszthatjuk a hatóanyag-leadó rendszerek az aktív komponenst tartalmazó réteg, a fedőréteg és a nyálkahártyához való tapadást biztosító réteg elhelyezkedése szerint. E csoportosítás csak a 2. és a 3. osztályra értelmezhető, az 5. ábrán a fedőréteggel rendelkező, mátrix-gyógyszerformák csoportjait mutatom be. A rezervoár-típusú és a 3. osztályba tartozó formák hasonló módon bonthatók csoportokra.
19
5. ábra A fedőréteggel ellátott, mátrix-gyógyszerformák további szerkezeti csoportosítása
(A - inert segédanyaggal, B - vízzáró réteggel védett mukoadhezív mátrixú, C - fedőréteg nélküli, D - fedőréteggel rendelkező, nem mukoadhezív mátrixú tabletta)
A leggyakrabban alkalmazott bukkális gyógyszerformák a filmek, tapaszok, tabletták (minitabletták), pelletek, mikroszemcsék és kapszulák, valamint a gélek és az oldatok (cseppentővel vagy szórófejjel). Fontos a bukkális gyógyszerformákat fogalmilag elkülönítenünk az intraorális gyógyszerformáktól, utóbbiaknak természetesen a bukkális formák részhalmazát képezik, de sok olyan formuláció intraorális, amelynek a felszívódási helye nem a bukkális szájnyálkahártya, csak a formula szétesésének/oldódásának helye a szájüreg (szájban széteső tabletták ún. ODT- k, vagy gyorsan oldódó filmek/lapkák [Kállai és mtsai 2012]).
A gyógyszerformák közös tulajdonsága, a fenti osztályozásból, csoportosításból következő anyagi összetétel, tehát minden formának tartalmaznia kell egy mátrixot, amelyben diszpergáljuk (az esetenként bevont, membránnal ellátott) hatóanyagot, legalább egy szabályozó réteget és egy mukoadhezív réteget. Sok esetben, pl. a nem-
20
szilárd bukkális formuláknál ezt a 3 funkciót egy fázis látja el. A szabályozó réteg általában valamilyen porózus, esetenként nedvesség hatására duzzadó, de mindenképpen erodálódó réteg, amely általában összetett polimer-rendszer (valamilyen segédanyaggal, pl. lágyítókkal formulálva). A mukoadhezivitás biztosítása és ezzel a gyógyszerforma lokalizálása a szájüregben, a tartózkodási idő növelésére is egy megoldandó technológiai probléma. A nyálkahártyához tapadás kémiai feltételeit a következőképpen foglalhatjuk össze: szükséges megfelelő felületi feszültség, sok hidrofil (-OH, -COOH) funkciós csoport, anionos töltés, flexibilitás illetve lehetőség szerint nagy molekulatömeg [Peppas és Buri 1985; Roy és Prabhakar 2010]. A legfontosabb mukoadhezív polimereket és a pektinhez viszonyított, közepes kötődési erősségüket a 6. ábra mutatja.
6. ábra Mukoadhezív polimerek és kötődési erősségük [Hunt és mtsai 1987]
(rövidítések: PAA- poliakrilsav, PEO- poli-etilénoxid, SA- nátrium alginát, HPMC- hidroxipropil-metilcellulóz, MEC- metil-etilcellulóz, PVP- poli-vinilpirrolidon,
PEG- poli-etilénglikol, PVA- poli-vinilalkohol, pHEMA- poli-hidroximetil-akrilsav, HPC- hidroxipropil-cellulóz)
PAA PEO Metil-c
ellulóz SA HPM
C ME
C Kem
ényítõ Zselatin
Pektin
PVP PEG PVA pH EM
A HPC
70 80 90 100 110 120 130 140 150 160 170 180 190 200
Közepes relatív tapadási erõsség / %
21
A mukoadhezivitás és amennyiben nem valamilyen nyálkahártyához tapad a formuláció, a bioadhezivitás (pl. transzdermális tapaszok esetében) mérésére sok módszer található az irodalomban [Mathiowitz és mtsai 1999, Latheeshjlal és mtsai 2011], de az általánosan alkalmazott módszer valamilyen ex vivo membránhoz, nyálkahártyákhoz, szövethez való tapadási erő mérése. A mérés alapvető lépései szinte minden ilyen módszernél azonosak, az ex vivo szövetet és a gyógyszerformát is rögzítjük (pl. egy állomány-elemző (texture analyser) készülék mintatartójához, illetve mozgó részéhez), majd a mintát meghatározott folyadék pontos mennyiségével nedvesítjük adott ideig, létrehozzuk a kapcsolatot a minta és a membrán között (fontos a
”ragasztás” ereje és időtartama is), majd mérjük a szétválasztáshoz szükséges erőt [Verma és mtsai 2011]. A mukoadhezivitás meghatározásával jellemezhető a bukkális formuláció jósága, persze a hatékonyság nem csak a tapadási tulajdonságok javításával, hanem különböző segédanyagok hozzáadásával, lágyítókkal és penetráció-fokozókkal [Senel és Hincal 2001] is növelhető.
A bukkális formulációk hatóanyagának a következő elvárások elvárásoknak kell megfelelniük: kis moláris tömeg (M < 500 g/mol), jó a lipidoldékonyság, stabil a szájüreg fiziológiás pH-ján, szagtalan és íztelen. A bukkális nyálkahártyán keresztül az aktív komponens főként passzív diffúzióval juthat át, ezért fontos az első két paraméter.
A rossz íz a bukkális beviteli formáknál különösen fontos, hiszen ezek a gyógyszerformák tartózkodnak a leghosszabb ideig a szájüregben, így ezek hatnak a legtovább a nyelv ízlelőbimbóira. Ha a szájüregben rossz szagú (például a cukorbetegség kezelésében használt metformin [Shuster 2010]) komponens szabadul fel azt a szaglószervünk közelsége miatt fokozottan észleljük pl. egy gyomorban vagy főként egy bélbe oldódó formulációhoz képest. Ha a hatóanyagnak rossz íze vagy szaga van, az a gyógyszerforma hatását ugyan nem csökkenti, de a termék értékét, a beteg- együttműködést, valamint ezzel együtt a terápia hatékonyságát igen. Természetesen nem vethető el minden olyan gyógyszer-jelölt molekula, amelynek rossz íze van, vannak ízfedési technikák, amelyek sok esetben sikerrel alkalmazhatók [Szakonyi és Zelkó 2012]. Az ízfedés, mint kutatási-fejlesztési irány, fontosságát mutatja, hogy olyan fejlett és költséges technológiák jelentek meg a kereskedelmi forgalomban, mint például
22
az elektromos nyelv [Zheng és Keeney 2006, Lorenz és mtsai 2009, www.alpha- mos.com].
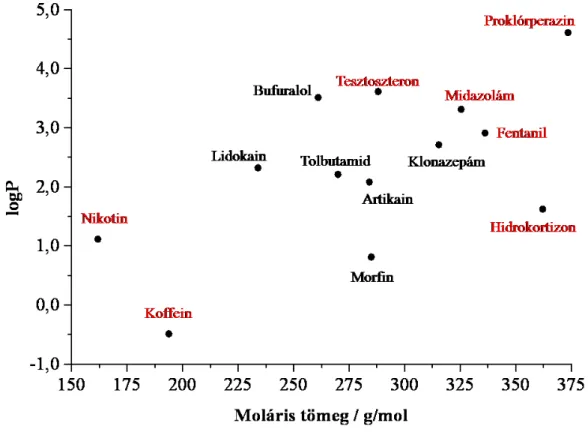
Néhány, jelenleg kísérleti szakaszban vagy már forgalomban lévő hatóanyag [Obradovic és Hidalgo 2008] molekulatömegét és logP (a anyagok oktanol-víz megoszlási állandójának logaritmusa, amely a passzív membránpenetráció egy jó definiált paramétere) értékét mutatja be az 7. ábra.
7. ábra Néhány bukkális formulációjú hatóanyag M, valamint logP értékei (a piros színnel kiemelt hatóanyagok forgalomban vannak bukkális gyógyszerformában)
A bukkális formulációjú hatóanyagok többsége ideális tulajdonságokkal rendelkezik, az ábrán látható összes anyag teljesíti a Lipinski-szabályok [Lipinski és mtsai 1997, Lipinski 2000, Owens 2003] ábrázolt részét (M < 500 g/mol; logP < 5).
Vannak azonban kivételek, olyan vizsgált vegyületek, amelyek (általában) egy tulajdonsága nem megfelelő (ilyen például az aciklovir (M=225,2 g/mol), amely nem eléggé lipofil (logP= -1,6 - -2,2), a kutya-modellen folytatott kísérletek tanulsága szerint mégis felszívódik a szájüregből [Değim és mtsai 2006]), mégis hatékonyak lehetnek.
Egy másik intenzíven kutatott hatóanyag az inzulin, amely túl nagy méretű, nem elég
23
lipofil, mégis a cukorbetegség (diabetes mellitus) egyre nagyobb betegpopulációjának nyomására, ezzel a felvevőpiac rohamos bővülésével, kísérletek szinte minden beviteli formával sikeresen, vagy részben sikeresen folynak. Bukkális úton történő beviteli formája jelenleg klinikai vizsgálatok alatt áll (Fázis 3., Ora-Lyn®, Generex Biotech.), de megfelelő intraorális forma sincs még, elméleti megvalósíthatósága ellenére, elérhető áron történő előállítása még komoly fejlesztéseket igényel [Heinemann és Jacques 2009].
A forgalmazott bukkális gyógyszerformák többsége tabletta (pl. a FentoraTM - fentanil-citrát [www.fentora.com]; Hydrocortisone Muco-Adhesive Buccal Tablets - hidrokortizon; BuccastemTM - proklórperazin; StriantTM - tesztoszteron [www.striant.com, Bologna és mtsai 1999]; SuscardTM – nitroglicerin), lozenge (ActiqTM - fentanil-citrát [www.actiq.com]; CommitTM - nikotin), folyadék (Epistatus®
és Buccolam® - midazolám-maleát, illetve midazolám-HCl) vagy valamilyen film (OnsolisTM - fentanil-citrát [www.onsolis.com]; SheetsTM Energy Strip – koffein, E-, B6- , B12- vitamin) [Batchelor 2004, Szabó, Hetényi és mtsaik 2011]. A tablettákat általában közvetlen préseléssel, míg a filmeket liofilizálással, öntéses technikával, porlasztással vagy extrúzióval állítják elő.
A filmek előállítására leggyakrabban használt, módszer az öntéses (solvent casting) vagy más néven oldószer-elpárologtatásos (solvent evaporation) eljárás, amelynek ipari megvalósítási sémáját a 8. ábra mutatja be.
8. ábra A film-képzés öntéses eljárása [Kállai és mtsai 2012]
24 1.3. Mikroszerkezeti vizsgálatok
A hagyományos értelemben vett mikroszerkezet az anyag azon szerkezete, amely mikroszkóp alatt, 25x-nél nagyobb nagyítás alkalmazásával látható [American Society for Metals 1985]. Tágabb értelemben vett mikroszerkezeti vizsgálatnak tekinthetünk minden olyan módszert, beleértve az olyan modern mikroszkópiás technikákat, mint a pásztázó elektron-mikroszkópia (SEM) vagy az atomi-erő mikroszkópia (AFM), amely a vizsgált anyagot atomjainak, ionjainak, molekuláinak (így pl. a polimer láncok), tehát a kémiai kötéseinek szintjén, több nagyságrenddel a mikrométer-tartomány alatt vizsgálja. Ezt figyelembe véve a kötések gerjesztésén alapuló módszerek, a látható (pl. az atomabszorbciós spektroszkópia - AAS; az atomemissziós spektroszkópia - AES), az infravörös (Fourier-transzformációs infravörös spektroszkópia - FTIR; közeli infravörös spektroszkópia - NIR) és az ultraibolya (UV- (ibolyántúli-) spektrofotometria) tartományba eső ”színmérés” mind- mind mikroszerkezeti módszerek. Ugyancsak a minta mikroszerkezetét jellemezhetjük a más hullámhosszúságú elektromágneses hullámokkal (pl. röntgen-sugárzással vagy épp rádióhullámokkal (elektronspin rezonancia - ESR, magmágneses rezonancia spektroszkópia - NMR, illetve orvosi alkalmazása a képalkotó magmágneses rezonancia spektroszkópia - MRI)) történő gerjeszthetőség mérésével. Mikroszerkezeti módszerek a rugalmas (röntgen-, elektron-, neutron-diffrakciós) és a rugalmatlan szóráson (Raman, floureszcencia) alapuló a technikák is. Az említett módszerek csoportjába ritkán sorolják be a differenciál pásztázó kalorimetriát (DSC [Watson és Watson 1962]), azonban elvét tekintve, e hőelnyelésen alapuló módszer is az anyag elektromágneses sugárzással történő kölcsönhatását méri és fő felhasználási területe is az anyagok elemi celláinak vizsgálata, azok különböző kristályos vagy amorf formáinak azonosítására. A jelen disszertáció alapját képezi, az anyagok ún. szabadtérfogatát mérő, pozitron annihilációs élettartam spektroszkópia (PALS) névre hallgató módszer, amely az általánosan alkalmazott porozitásmérésekhez (a higanyos porozitásmérés, illetve a BET módszer [McMillan és Teller 1951, Jiang és mtsai 2008]) hasonló, de azoknál pontosabb eredményt ad [Sebe és mtsai 2012].
A fejezet további részében az alkalmazott, mikroszerkezet-meghatározó technikák elvét ismertetem, előbb a rutinszerűen használt, gazdag irodalommal
25
rendelkező módszereket röviden, majd a kevésbé ismert, korlátozottabb számú irodalmi forrásból megismerhető, a disszertáció gerincét adó, PALS-módszert elméleti hátterével, részletesen.
1.3.1. Fourier-transzformációs infravörös spektroszkópia (FTIR)
Az infravörös spektroszkópia infravörös tartományba eső (102-104 cm-1 hullámszám, 3·1012 - 3·1014 Hz frekvencia) elektromágneses hullámok molekulákban való elnyelődését vizsgálja. Ebben a tartományban a vegyületben található kötések rezgési és nyújtási frekvenciáit találjuk, így az ezeket gerjeszteni képes (azonos frekvenciájú) sugárzás a vizsgált anyagban elnyelődik, míg a más frekvenciájú sugárzások intenzitása (a szóródási veszteségtől eltekintve) nem változik. A szerves vegyületek esetében karakterisztikus frekvencia- (és így hullámszám-) tartományok jelölhetők ki, amelyek egy kötés-típusra vagy funkciós-csoportra jellemzőek, így az ismeretlen anyagok funkciós csoportjai azonosíthatók. A spektrum kialakulása, felépítése meglehetősen egyszerű, a különböző hullámhosszúságú monokromatikus fénynyalábok áthatolóképességét (általában százalékos transzmittancia) mérjük és ábrázoljuk a sugárzás hullámszámának függvényében.
1.3.2. Raman spektroszkópia
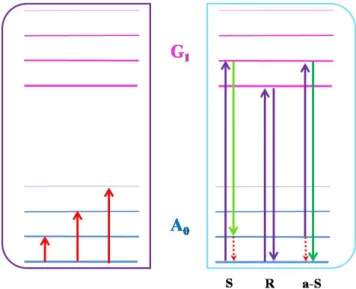
A Raman-spektroszkópia elvét tekintve jelentősen eltér az FTIR-től. Ez a módszer a rugalmatlan fényszórás jelenségét használja ki, monokromatikus fénnyel besugározva a mérendő mintát, a forrásból érkező nyaláb irányára merőlegesen detektáljuk a szórt sugárzást. A Raman-spektrum, az FTIR-énél kicsivel bonyolultabb, a besugárzás hullámhosszánál megjelenő, rugalmas szórásból adódó (ún. Rayleigh-) csúcs két oldalán, attól egyenlő távolságra található (Stokes és Anti-Stokes) csúcspárokból áll (9. ábra).
26
9. ábra A Raman-spektrum szerkezete
Az alkalmazott forrás itt jóval nagyobb energiájú (pl. esetünkben 785 nm hosszúságú fény, ami kb. 12740 cm-1 hullámszámot jelent), de az anyagokra jellemző eltolódások (ún. Raman-shift) általában mégis az IR-nél alkalmazott 500–4000 cm−1 tartományba esnek, a csúcsok mérésének elvét a 10. ábra mutatja. Az ábrán csak a legkisebb IR csúcsnak megfelelő Raman-csúcs megjelenése látható, természetesen amennyiben a többi rezgési átmenet is Raman-aktív, azok is megjelennek a spektrumban.
27
10. ábra Az IR csúcsok (bal oldalon, piros nyilak) és a Raman-eltolódás (jobb oldalon, piros szaggatott nyilak) elvi háttere
(az A0 az alapállapotot, a G1 a gerjesztett állapotot, az S a Stokes-csúcsot, az R a Rayleigh-csúcsot, az a-S pedig az Anti-Stokes-csúcsot jelöli)
A Raman-spektrometria a gyógyszer- és anyagtudomány kedvelt módszere, kiválóan alkalmas a minta egy kiválasztott pontjának elemzésére, illetve anyageloszlás feltérképezésére egy vizsgálandó felszínen (ún. Raman-térképezés technika [Stuart és mtsai 2012, Zoubir 2012]).
1.3.3. Pozitron annihilációs módszerek
1.3.3.1. Pozitron annihilációs élettartam spektroszkópia (PALS)
A PALS egy 70 éves [Behringer és Montgomery 1942], modern vizsgálati módszerek között fiatalnak számító módszer (tömegspektrometria - 1899, röntgen- krisztllográfia - 1914, Raman-spektroszkópia - 1928, NMR - [Rabi és mtsai 1938], cirkuláris dikroizmus- [Greenfield és Fasman 1969], MRI - 1974). Elméleti alapja megegyezik korunk egyik ismert orvosi képalkotó eljárásával, a metabolizmus vizsgálatok során használt PET-tel (positron emission tomography), amelyet bár 31 évvel az első PALS-mérések után alkalmaztak először (Michael Phelps 1973-ben
28
[Raiche és mtsai 1975]), mégis a működő berendezések számában 100-szorosan túltesz a PALS módszeren.
A pozitron annihilációs élettartam spektroszkópia a módszer nevéből adódóan pozitronok, annihilációjukat megelőző, élettartamát méri. A pozitron (e+) az elektron (e-) antirészecskéje [Anderson 1933], így minden mérhető tulajdonságában (töltés nagysága, tömege, perdülete stb.) megegyezik az elektronnal, kivéve a töltését. Pozitív töltése nem befolyásolja nagyban a tulajdonságait, ahogy világunkban a hidrogén- atomban a pozitív töltésű proton kerül ”kering” a negatív töltésű elektron, úgy, a mi világunktól semmilyen lényeges tulajdonságában nem különböző (hiszen a világunk is csak azért nevezhető anyaginak, mert 106 db antirészecskére (106 +1) db anyagi részecske jut), antivilágban az antihidrogénben a negatív töltéssel rendelkező antiproton körül egy pozitív töltésű antielektron, azaz pozitron mozog. Különlegessége inkább az antianyag voltából fakad, mint töltéséből. Míg az elektron a többi elektronnal Coulomb- kölcsönhatásba lépve taszítja őket, addig a pozitron nemcsak vonzza őket, hanem sikeres találkozásuk esetén egyesül az elektronnal, amely a két részecske megszűnését eredményezi két vagy három -foton (nagyenergiájú, perdülettel (ún. spin), nyugalmi tömeggel sem rendelkező, semleges töltésű elemi részecske) keletkezése közben. A pozitron anyagi világunkban meglehetősen rövid életű, 3 alapvetően különböző formában van jelen (11. ábra): szabad pozitronként, para-pozitróniumként (p-Ps), illetve orto-pozitróniumként (o-Ps).
29
11. ábra A pozitron állapotai az anyagban
A pozitrónium (Ps) egy könnyű hidrogénatomként képzelhető el, amelyben az elektron nem egy proton körül [Born és Oppenheimer 1927], hanem egy a protonnál 1840-szer könnyebb, de ugyancsak pozitív töltésű részecskével közös tömegközéppont körül kering. A kétféle Ps-atom a két részecske két lehetséges kötött állapotára utal, spinjük szerint az elektron-pozitron pár vagy azonos, (+1/2) és (+1/2) vagy (-1/2) és (-1/2), vagy ellentétes spinnel kapcsolódik, ebből adódóan a két forma tulajdonságai eltérőek. A 0 eredő spinnel (S) rendelkező részecskepár (p-Ps) vákuumban 125 ps alatt annihilálódik, míg a S = ±1 állapot (o-Ps) ennél 1000-szer tovább, 142 ns-ig észlelhető, szintén nagyvákuumban. Itt érdemes megjegyezni, hogy a szabad pozitron tökéletes vákuumban (ahol rajta kívül semmi sincs), ugyanolyan stabil, mint a proton vagy az elektron. A két (mivel a spinállapotok száma 2S+1, o:p = 3:1 arányban képződő [Suzuki és mtsai 2003]) pozitrónium forma nem csak különböző élettartammal jellemezhető, de az annihilációjuk eredménye is más, a p-Ps esetében 2, míg az orto-forma esetén 3 foton keletkezik (a természet ezzel a 3. fotonnal ellensúlyozza az annihiláció spin-tiltott voltát).
30
Anyagi rendszerekben az annihilációig eltelő időtartam hossza a pozitron (imént tárgyalt háromféle) állapotától és a minta lokális elektronsűrűségétől függ. A p-Ps önannihilációja a vákuumban megfigyelt 100-150 ps körüli életidővel jellemezhető, míg a szabad pozitronnál ennél valamivel hosszabb, 200-500 ps-os élettartamot figyelhetünk meg. A két forma pusztán életidők alapján nem mindig megkülönböztethető. Nagy elektron-sűrűségű, mint amilyenek a fémek, vagy más könnyen elmozdítható elektronokat tartalmazó (elektromos vezetők) és sok kristályos rendszerben az o-Ps forma életideje sem haladja meg az 500-600 ps-ot, így általában csak 1-2 diszkrét élettartamot mérünk (1, 2). Nem vezető anyagokban, amilyenek a gyógyszerészeti segéd- és hatóanyagok is, az élettartam-spektrumban megjelenik egy (vagy több) hosszabb (3) komponens, amely az o-Ps életideje. Aerogélekben és zeolitokban, amelyek extrém rendezett és (elektronsűrűség szempontjából) ”üres” struktúrák az o-Ps élettartam akár a 100 ns-ot is megközelítheti, de a jellemző érték 800 (kristályos anyagok pl. szacharóz) és 2500 ps (amorf porózus anyagok, pl. Mg-sztearát) közötti. Ez a ”hosszú” idő már elegendő arra, hogy az 0,116 nm átmérőjű [McCullagh és mtsai 1995] o-Ps felderítse környezetét, bejárja az anyag olyan szubnano-tartományú üregeit is, amelyek a porozitásvizsgálatok szondái (H2, He, N2) számára méretükből adódóan láthatatlanok [Duke és mtsai 2008]. Az üreg ”falát” elérve, ahol nagyobb az elektronsűrűség, egy környezeti elektronnal ún. pick-off, tehát „felkapásos”
annihilációban megsemmisül [Sato és mtsai 2008].
A leírt jelenség alapján kapcsolatot teremthetünk a mért o-Ps élettartam és az üregméret (free holes) vagy, ahogy gyakran nevezzük, a szabadtérfogat (free volume) között. A más módszerek (elsősorban a BET) alapján történő kalibráció [Lowell 1979, Dutta és mtsai 2005] során az alábbi (E1) összefüggést találták az életidő és a szabadtérfogat között:
= ∙ 1 − + ∙ (E1)
[Paranhos és mtsai 2007], ahol a τ3 az o-Ps élettartam, a =2 ns-1 az Ps átlagos annihilációs sebessége az elektronok rétegében [Mills 1981], az R az üregek átlagos sugara, az R0 pedig a látszólagos falvastagságot leíró, anyagcsoportra jellemző állandó,
31
ami a porózus anyagok esetén 1,66 Å (ami SI egységben 1,66·10-10 m, azaz 0,166 nm) [Nakanishi és mtsai 1988].
A gyógyszerészeti alkalmazásokban vizsgált tartományban az üregméretek alakulása az 12. ábrán látható. Az üregméretek meghatározásával az anyagi rendszerek összehasonlíthatóakká válnak, a módszer segítségével, a mikroszerkezetet befolyásoló, hatások követhetőek, így a nedvesedés, duzzadás, oldódás, illetve többkomponensű rendszereknél az összetevők közötti kölcsönhatások tanulmányozhatóak.
12. ábra: Az üregméret és az o-Ps élettartam közötti összefüggés
A nyers adatokból az üregméretekhez nem minden esetben egyszerű eljutni. A spektrométerhez kapcsolódó számítógépről a 13. és a 14. ábrán ábrázolthoz hasonló adatsorokhoz juthatunk. A kiértékeléshez a görbe csúcstól jobbra eső oldalát használjuk.
A két ábrázolt (13-14. ábra) adatsor-hármas teljesen azonos, csak a grafikonok y- tengelyének skálázása más, a 13. ábrán a közel lineáris intenzitás-arányok követhetők, míg az logaritmikus y-tengellyel (14. ábra) az alapvonal és így a mérés pontosságának alakulása látható, illetve így magyarázható, a gyakorlati megvalósításban alkalmazott 3 órás mérésidő.
32
13. ábra A mért intenzitás alakulása különböző mérési idők esetén
14. ábra A mért háttér különböző mérési idők esetén
33
15. ábra A nyers adatgörbe felbontása 3 diszkrét élettartamra [Sebe és mtsai 2012]
Az adatsorokat egy egyszerű szoftver segítségével értékelhetjük, amely a görbe exponenciális függvényekre való bontását jelenti. Az illesztett függvények száma általában 2-3, de hosszabb mérési idő alkalmazásával akár 4-5 exponenciálisra bontható adatsorokat kaphatunk, így a radioaktív bomlásoknál megismert módon (az E2 egyenlet alapján) élettartam értékekhez juthatunk. A felbontás logaritmikus skálán jól vizualizálható, ezt mutatja be a 15. ábra.
(E2),
ahol Nτ és N0 a bomló atomok száma egy kiválasztott 0 és τ időpillanatban, a a bomlási állandó.
34
Az elméleti megfontolások után lássuk a gyakorlati megvalósítást. Az említett rövid életük miatt a pozitronok felhalmozása és szállítása nem megoldható, így olyan forrást kell keresnünk, amelyben folyamatosan (vagy szakaszosan) keletkeznek pozitronok. Ilyen források az ún. β+-bomló atommagok (a β+ a pozitront jelöli, ahogy radioaktivitással foglalkozók körében az elektron is inkább β--részecske). A pozitron- források általában (más radioaktív magokhoz képest mindenképpen) ártalmatlanok, a PALS mérésekhez alkalmazott forrás-aktivitás 105 Bq nagyságrendű, ami nagyon kicsi (Az emberi test 35-98 Bq/ttkg aktivitású sugárzást bocsát ki a természetes 40K izotópnak köszönhetően [Gomaa és mtsai 2008], így egy átlagos 15-41 fős tantermi előadás már ugyanolyan radioaktív, mint az esetünkben alkalmazott forrás), ráadásul a e+ közepes behatolási mélysége 100 μm körüli érték, így a bőrrel közvetlenül érintkező forrás is csak a felső, elszarusodó hámrétegben (amelynek vastagsága kb. 0,2 mm) okozhat károsodást. Többféle β+-sugárzó magot (11C, 13N, 15O,124I [Bailey és mtsai 2005], illetve 44Ti [Antus és mtsai 2002], 58Co [Kögel és mtsai 1997], 68Ge [Calloo és Jaeger 2010]) is alkalmaznak a PET (amelyhez szintén pozitron-forrásra van szükség) és a PALS mérésekhez, ezek közül a legfontosabbak a PALS esetében a 22Na [Jean és mtsai 2003], míg a PET-nél a 18F. A 18F drága, rövid felezési idejű (t1/2 = 109,5 perc), de nagy aktivitású forrás, amely in vivo alkalmazásnál, a szervezetből való gyors kiürülése és a rövid mérési idő miatt, előnyös, azonban a PALS mérésnél mindkét paramétere hátrányt jelent. A 22Na ezzel szemben (22NaCl vagy 22Na2CO3 formában [Nagasaka és mtsai 2000]) olcsó, hosszú felezési idejű (2,6 év) és kis aktivitású. A hosszú felezési idő gazdaságossági okokból is előnyös, hiszen egy forrás akár 2-5 évig is használható nagyságrendi aktivitáscsökkenés nélkül. A kis aktivitás a későbbiekben ismertetett mérés menete szempontjából fontos. A 16. ábrán látható a PALS mérés általános mérési elve 22Na pozitronforrás esetében.
35
16. ábra A PALS mérés általános mérési elve [Szabó és Zelkó 2012]
Az ábrán látható módon a 22Na gerjesztett állapotú 22Ne-ra (22Ne*), pozitronra és egy neutrínóra bomlik, majd a 22Ne* alapállapotba relaxál (t1/2 = 3,6 ps), miközben egy 1274 keV energiájú foton szabadul fel, amelyet az egyik (általában BaF2-) detektor érzékel, ez a Start jel. Az emittált pozitron a fentebb részletezett állapotok egyikében annihilálódik, miközben tömegének (ami egyenlő az elektron tömegével) megfelelő, az Einstein-i, E=mc2 alapján [Einstein 1905], két, egyenként 511 keV energiájú foton keletkezik, amelyek egyikét érzékeli a másik detektor, ez a Stop jel.
36
17. ábra A PALS mérés ismétlődő lépései
A PALS méréssel, amely kb. 1012 /óra, a 17. ábrán ábrázolt, ciklusból áll, a Start és Stop jelek között időtartamot mérjük. Mivel a forrás aktivitása 105 Bq nagyságrendű (1 Bq = 1/s = 1 részecske/másodperc), így belátható annak a valószínűsége, hogy egy pozitron Start jelével nyitott ciklust egy másik e+ annihilációja zárja le, ezzel hamis adatot szolgáltatva, igen kicsi. A jellemző hasznos ciklusok száma 107 /óra, tehát a mérési idő alatt keletkező, mintegy 108-109 db pozitronnak alig az 1%-át érzékeljük. Ez nem a készülék hiányossága, hanem annak a jelenségnek a következménye, miszerint a (mérendő anyagnak megfelelő) várakozási idő alatt, esetünkben kb. 4000 ps, a Start jel után Stop jelet vár a mérő-rendszer, ha nem érkezik Stop jel, akkor csak ennyi idő után törli az és kezd újabb Start jelet várni. Emiatt, ha a Start és a Stop jel között újabb Start jel jelenik meg, azt nem érzékeljük. Az ilyen, nem teljes térszögű detektálásból következő, ”hatástalan” mérési idők és az egy cikluson belül létrejövő pozitronok miatt kicsi az érzékelt események száma.
37 1.3.3.2. Doppler-szélesedés mérése (DB)
A Doppler-eltolódás a hétköznapi életben jól ismert, tudományosan 170 éve (kerek 100 évvel az első PALS alkalmazás előtt, 1842-ben Christian Doppler által [Eden 1988]) leírt hatás. A jelenség későbbi névadójává váló osztrák tudós először a csillagok színének változását magyarázta, majd 1845-ben hanghullámok segítségével igazolta elméletét [Schuster 2005], amely szerint az elektromágneses hullámok frekvenciáját (a fény színét, a hang magasságát) a forrásuk elmozdulása a megfigyelőhöz képest megváltoztatja, amennyiben a mozgás a terjedő hulláméval összemérhető sebességű. A csillagok színének változása alapján tehát megállapítható, hogy az égitestek milyen sebességgel távolodnak vagy épp közelednek hozzánk, megfigyelőkhöz. Az asztrofizikában ma is alkalmazzák a csillagok vörös- (távolodás), illetve kék-eltolódásának (közeledés) mérését a Világegyetem tágulásának leírására.
Hanghullámok esetén, amelyeknek Doppler-eltolódását a mindennapi életben is tapasztaljuk, a mozgó forrásnak 343,2 m/s-mal (a hang terjedési sebessége száraz, 20
°C-os levegőben, amelyet természetesen sok körülmény változtat kis mértékben [Cramer 1993], pl. 0°C-os levegőben ez az érték már csak 331,3 m/s [Wong 1986]) kell összemérhető sebességűnek lennie, ami pl. a hétköznapi közlekedési eszközök esetében teljesül is.
A Doppler-szélesedés (DB) a Doppler-eltolódás jelenségének következménye, mivel az annihilációban részt vevő elektronok kinetikus energiája összemérhető a tömegük energia-ekvivalensével (E = mc2 alapján: me-= 510,99906 ± 0,00015 keV/c2), így az elektron, amely az annihilációs sugárzás forrása, kezdeti energiája az annihilációs fotonok energiáját is kis mértékben megváltoztatja.
38
18. ábra A DB spektrum
19. ábra A DB paraméterei
Az energiaspektrum ebből következő kiszélesedését, azaz a DB adatsorát láthatjuk a 18. ábrán. A spektrum a Compton-szóródás következtében aszimmetrikus, a görbe csúcsánál kisebb energiákat előidézhet a fotonok, elektronokkal való, ütközése, de annál nagyobb energiát nem. A jelenség a DB-re nincs hatással, így a kiértékelés során kétoldali háttér-levonással korrekcióba vehető. A korrigált Doppler-csúcsot 5
39
részre bontjuk a 19. ábra szerint, a középső (ábrán feketével), csúcsra szimmetrikus rész a kis energiájú elektronok annihilációinak következménye, míg a csúcstól távolabb eső pontok a nagyenergiájú elektronok kinetikus energiáit hordozzák magukban, megváltoztatva ezzel az 511 keV-os (kb. 8·10-14 J) átlagos energiát.
A görbe parametrizálás után értékelhető ki, az ábrán látható módon számítható S- és W-paraméterek utalnak a minta ”kémiai” szerkezetére az annihiláció helyén. Ha a mintában sok a kis kinetikus energiájú e- (ezek a gyengén kötött vagy nem-kötő elektronpárok, mivel a viriál-tétel [Clausius 1870] értelmében a kinetikus energia a potenciális energia fele), akkor az S-paraméter nagy, a W pedig kicsi, míg kötésben lévő (pl. H-híd) elektronok esetén az S-paraméter kicsi és a W nagy. Ezzel a kémiaibb információt adó (elektron-szerkezettel összefüggő) módszerrel a fizikai jellegű üregméret-érték meghatározás kiegészíthető, stabilitás-vizsgálatoknál az FTIR módszerhez hasonlóan megállapítható, hogy létrejött-e másodlagos kötés a komponensek között.
1.3.3.3. Gyakorlati, gyógyszerészeti alkalmazások
A PALS és a DB módszert a gyakorlatban főként fémek [Kawaguchi és Shirai 2002], félvezető anyagok [Abdul-Jabbar és mtsai 2012] rács-hibáinak keresésére, illetve műanyagok [Suzuki és mtsai 2000] vizsgálatára használják, esetenként a mérés külső körülményeinek, például hőmérséklet vagy fényhatás [Suzuki és mtsai 2003]
változtatása során. Csak néhány kutatócsoport van, akik gyógyszerészeti polimerek, hordozó-rendszerek mikroszerkezeti leírására alkalmazták a módszert.
A közlemények többsége valamely, a gyógyszerforma kialakítása szempontjából fontos paraméter, így például a különböző összetevők alkalmazása [Szente és mtsai 2009, Papp és mtsai 2010] és aránya [Li és mtsai 2011], az alkalmazott oldószer [Bajdik és mtsai 2005] vagy segédanyag anyagi minősége [Minfeng és mtsai 2008, Bajdik és mtsai 2009] és mennyiségének [Zelkó és Süvegh 2002] függvényében tanulmányozta az o-Ps élettartamok, átlagos élettartamok, eloszlás-görbék, illetve a DB [Djourelov és mtsai 2007] jelenségét. Sok esetben hasznos vizsgálati módszernek bizonyultak ezek a módszerek a gyógyszerformák stabilitásának vizsgálatában is, eredményeiket összevetve a tárolás időtartamával [Kiss és mtsai 2006], a közeg páratartalmával [Zelkó és mtsai 2004] vagy termosztátot alkalmazva a mérés hőmérsékletével [Hamdy és mtsai 2001].


![26. ábra SA segédanyag FTIR spektrumai: tárolás nélkül, 1 hét, 2 hét, 3 hét, 4 hét tárolás után [Szabó és Zelkó 2011]](https://thumb-eu.123doks.com/thumbv2/9dokorg/1359100.110579/56.892.191.702.161.493/ábra-segédanyag-ftir-spektrumai-tárolás-tárolás-szabó-zelkó.webp)
![27. ábra CP segédanyag FTIR spektrumai: tárolás nélkül, 1 hét, 2 hét, 3 hét, 4 hét tárolás után [Szabó, Süvegh és Zelkó 2011]](https://thumb-eu.123doks.com/thumbv2/9dokorg/1359100.110579/57.892.194.617.150.481/ábra-segédanyag-spektrumai-tárolás-tárolás-szabó-süvegh-zelkó.webp)
![35. ábra Mikrohullámú kezelések hatása a különböző polimerek o-Ps élettartam értékeire [Szabó, Molnár és mtsaik 2011]](https://thumb-eu.123doks.com/thumbv2/9dokorg/1359100.110579/63.892.195.704.144.460/mikrohullámú-kezelések-hatása-különböző-polimerek-élettartam-értékeire-molnár.webp)