Keringő biomarkerek vizsgálata asztmával szövődött terhességben
Doktori értekezés
Dr. Ivancsó István
Semmelweis Egyetem
Klinikai Orvostudományok Doktori Iskola
Témavezető:
Dr. Tamási Lilla PhD, habilitált egyetemi docens
Hivatalos bírálók:
Dr. Joó József Gábor PhD, egyetemi adjunktus Dr. Brugós László PhD, osztályvezető főorvos
Szigorlati bizottság elnöke:
Dr. Farkas Henriette DSc, egyetemi tanár
Szigorlati bizottság tagjai:
Dr. Holub Marianna Csilla PhD, egyetemi adjunktus Dr. Böcskei Csaba PhD, osztályvezető főorvos
Budapest
2015
1
TARTALOMJEGYZÉK
I. RÖVIDÍTÉSEK JEGYZÉKE ... 3
II. BEVEZETÉS ÉS IRODALMI HÁTTÉR ... 5
II. 1. AZ ASZTMA KLINIKAI JELLEMZŐI ... 5
II. 2. ASZTMA TERHESSÉGBEN ... 11
II. 2. 1. Klinikai összefüggések az asztma és várandósság között ... 11
II. 2. 2. Az asztma diagnosztikai és gondozási nehézségei terhességben ... 13
II. 2. 3. Az asztma kezelése várandósságban ... 16
II. 2. 4. Biomarker-keresés asztmával szövődött terhességben ... 17
II. 2. 5. Hsp70 asztmával szövődött terhességben... 19
II. 3. LEHETSÉGES ÚJ BIOMARKEREK ASZTMÁVAL SZÖVŐDÖTT TERHESSÉGBEN ... 23
II. 3. 1. Vaszkuláris endoteliális növekedési faktor (VEGF) ... 23
II. 3. 2. Szolubilis urokináz plazminogén aktivátor receptor (suPAR) ... 26
II. 3. 3. Hialuronsav ... 29
III. CÉLKITŰZÉSEK ... 32
IV. MÓDSZEREK ... 34
IV. 1. Vizsgálati elrendezés ... 34
IV. 2. A vizsgálatokban résztvevő alanyok ... 34
IV. 3. Etikai engedély ... 36
IV. 4. Mintagyűjtés és laboratóriumi mérések ... 36
IV. 5. A légzésfunkció és a kilégzett nitrogén-monoxid szint mérése, illetve az asztma kontroll meghatározása ... 37
IV. 6. A szülészeti adatok rögzítése ... 37
IV. 7. Statisztikai elemzés ... 37
V. EREDMÉNYEK ... 39
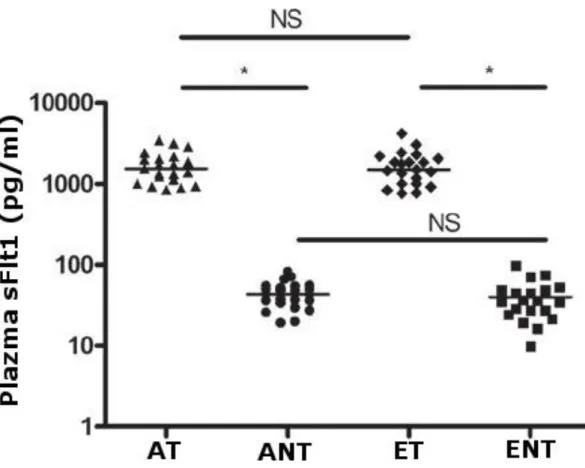
V. 1. VEGF és sFlt1 ... 39
V. 1. 1. Klinikai adatok ... 39
V. 1. 2. Az sFlt1 befolyása a VEGF mérésre ... 41
V. 1. 3. A VEGF perifériás szintje ... 41
V. 1. 4. A keringő szabad VEGF és az asztma klinikai jellemzői közti összefüggések ... 44
2
V. 1. 5. Az sFlt1 perifériás szintje ... 44
V. 1. 6. A keringő sFlt1 és az asztma klinikai jellemzői közti összefüggések ... 45
V. 1. 7. A plazma szabad VEGF és sFlt1 szintek és a születési súly közötti összefüggés... 45
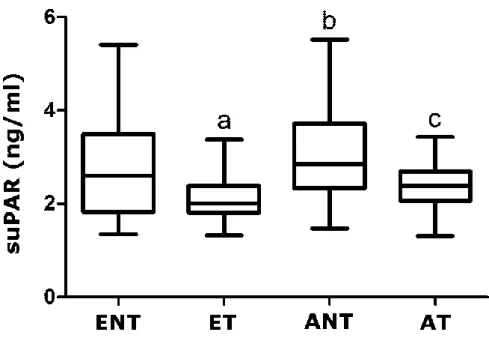
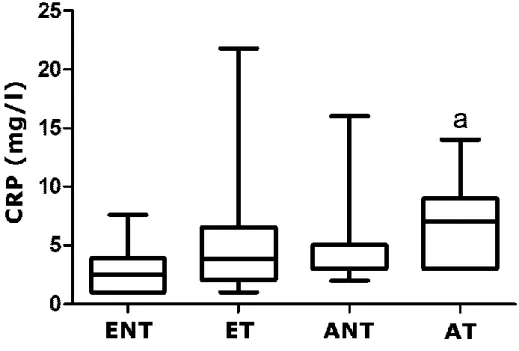
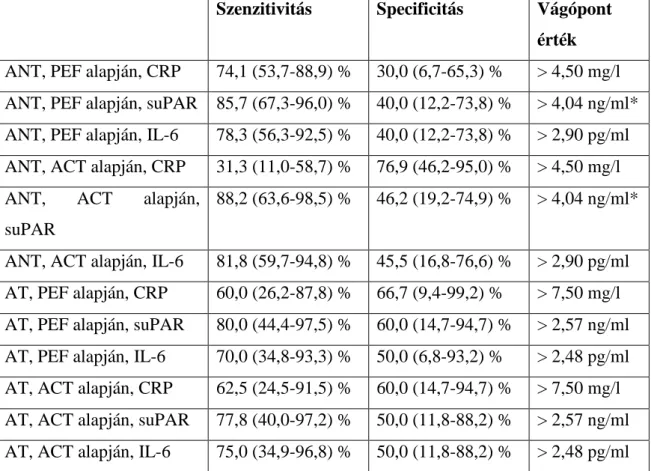
V. 2. suPAR ... 46
V. 2. 1. Klinikai adatok ... 46
V. 2. 2. A vizsgált gyulladásos markerek (suPAR, CRP, IL-6) perifériás szintje .. 47
V. 2. 3. A vizsgált gyulladásos markerek (suPAR, CRP, IL-6) és az asztma klinikai jellemzői közti összefüggések ... 49
V. 2. 4. A vizsgált gyulladásos markerek (suPAR, CRP, IL-6) és a születési súly közötti összefüggés ... 53
V. 3. Hialuronsav ... 54
V. 3. 1. Klinikai adatok ... 54
V. 3. 2. A hialuronsav perifériás szintje ... 55
V. 3. 3. A hialuronsav és az asztma klinikai jellemzői közti összefüggések ... 56
V. 3. 4. A keringő hialuronsav szintek és a születési súly közötti összefüggés ... 61
VI. MEGBESZÉLÉS ... 62
VI. 1. VEGF és sFlt1 ... 62
VI. 2. suPAR, IL-6 és CRP ... 65
VI. 3. Hialuronsav ... 70
VII. KÖVETKEZTETÉSEK ... 74
VIII. ÖSSZEFOGLALÁS ... 76
IX. SUMMARY ... 77
X. IRODALOMJEGYZÉK ... 78
XI. SAJÁT PUBLIKÁCIÓK JEGYZÉKE ... 92
XI. 1. Az értekezés alapjául szolgáló közlemények ... 92
XI. 2. Az értekezéshez nem kapcsolódó közlemények ... 93
XII. KÖSZÖNETNYILVÁNÍTÁS ... 94
3
I. RÖVIDÍTÉSEK JEGYZÉKE
ACQ ………..Asztma Kontroll Kérdőív ACT ………Asztma Kontroll Teszt AUC ……….. görbe alatti terület BAL ………bronchoalveoláris lavázs BMI ………...testtömegindex CRP ………..C-reaktív protein ECM ……….………...extracelluláris mátrix FENO ………....kilégzett levegő nitrogén-monoxid szint FEV1 ……….…….kilégzési másodperctérfogat FVC ……….erőltetett vitálkapacitás GERD ……….gastro-oesophagealis reflux betegség HSP ……….hősokkfehérje ICS ……….inhalációs kortikoszteroid Ig ………....immunglobulin IL ………...interleukin IUGR ………..intrauterin növekedési retardáció OCS ……….………orális kortikoszteroid PEF ………..kilégzési csúcsáramlás Raw ………...légúti áramlási ellenállás ROC ………...Receiver Operating Characteristics
SABA ………rövidhatású β2-agonista
SGA ………small for gestational age SPT ………...bőr prick teszt suPAR ………szolubilis urokináz plazminogén aktivátor receptor TGF ………. transzformáló növekedési faktor Th ………..T helper TLR ………..toll-like receptor TNF ………..tumor nekrózis faktor uPA ……….urokináz plazminogén aktivátor uPAR ………urokináz plazminogén aktivátor receptor
4
VEGF ……….vaszkuláris endoteliális növekedési faktor
5
II. BEVEZETÉS ÉS IRODALMI HÁTTÉR
II. 1. AZ ASZTMA KLINIKAI JELLEMZŐI
Az asztma krónikus légúti gyulladással jellemzett heterogén betegség. Visszatérő és változó súlyosságú légzőszervi tünetek határozzák meg, zihálás, légszomj, mellkasi feszülés és köhögés, melyeket variablilis kilégzési nehezítettség, áramláskorlátozottság okoz (Global Initiative for Asthma 2015, Tamási és mtsai 2012). A légúti szűkület hátterében a légutak direkt vagy indirekt stimulusokra kialakuló hiperreaktív reakciója és a krónikus gyulladás állnak. Ezek a kóros eltérések tünetmentes állapotban és aktuálisan normális légzésfunkció mellett is tartósan fennállnak, de a kezelés hatására megszűnhetnek. A tünetek változékonyságát külső tényezők is befolyásolják, mint például allergéneknek vagy irritánsoknak való kitettség, sportolás, nevetés, időjárás- változás, vagy légúti vírusinfekciók. A betegek gyakran tapasztalnak állapotromlást éjszaka vagy hajnalban. A tünetek spontán vagy gyógyszer hatására megszűnnek (akár hetekig-hónapokig tartó folyamatos tünetmentesség is lehetséges), ugyanakkor súlyos, akár életveszélyes állapotromlás (akut exacerbáció) is előfordulhat.
Az asztma az utóbbi évtizedekben a „nyugati életmód” terjedésével az egyik leggyakoribb krónikus betegséggé vált, a különböző országokban 1-18% közötti a prevalenciája, és évről évre növekszik. Jelenleg legalább 300 millió beteg él a világon, de valószínűleg kevésbé konzervatív diagnosztikus kritériumok alkalmazásával ez a szám jelentősen nagyobb lenne. Hazánkban 2014-ben a tüdőgondozókban regisztrált felnőtt asztmások száma 290201, ami 2,9 %-os prevalenciának felel meg; közülük 177761 nőbeteg, legnagyobb gyakorisággal a fogamzóképes korosztályban (Korányi Bulletin 2015). Az asztma gazdasági jelentősége is nagy, mind a közvetlen költségeket illetően (gyógyszerek, kórházi ellátás), mind a közvetett tényezők miatt (munkából kieső napok száma, korai halálozás). Az asztmás betegek kis hányadát kitevő, ugyanakkor a legjelentősebb társadalmi összköltséget jelentő súlyos asztma előfordulási gyakorisága 5-10% (Korányi Bulletin 2015).
Az asztma heterogén betegség, szerteágazó kóros gyulladásos folyamatokkal a háttérben. A különböző sajátosságok alapján különböző fenotípusok különíthetők el, melyek közül a leggyakoribbak az allergiás, a nem allergiás, a késői fellépésű, a fixált
6
légúti obstrukcióval járó, és az obezitáshoz társuló asztma (Global Initiative for Asthma 2015). Mégis, egyelőre még nem sikerült egyértelműen feltárni a kapcsolatokat egyes patológiás történések és a klinikai megjelenés, illetve a kezelési módokra adott válasz között, de ez ma intenzív kutatások tárgya.
A diagnózis az időben és súlyosságban változékony tünetek alapján légzésfunkciós vizsgálattal állítható fel (Global Initiative for Asthma 2015, Tamási és mtsai 2012). A légzésfunkciós paraméterek közül szükséges igazolni, hogy a kilégzési másodperctérfogat(FEV1)/erőltetett vitálkapacitás(FVC) < 0,75-0,8 és a FEV1 értékében legalább 12% és 200 ml javulás alakul ki bronchodilatátor szer hatására, vagy igazolni kell a 10%-ot elérő napi változékonyságot a kilégzési csúcsáramlás (PEF) értékében.
Kétséges esetben a gyulladásgátló szerrel 4 hétig tartó kezelés hatására javuló légzésfunkció (FEV1 és PEF) is alátámasztja a diagnózist. Továbbá aktuálisan normális légzésfunkció esetén a diagnózis felállításához provokációs tesztekkel is kiváltható a légúti hiperreaktivitást jelző légzésfunkció-rosszabbodás. Leggyakrabban metakolint alkalmaznak, de hisztamin, terheléses teszt, eukapnikus akaratlagos hiperventilláció és mannitol is használható. A bőr prick teszttel (SPT) vagy specifikus immunglobuli(Ig)E mérésével megállapított atópia az allergiás asztma valószínűségét növeli.
Az asztmás betegek gondozása magába foglalja az asztma kontroll felmérését, a megfelelő kezelést (különös tekintettel a helyes eszközhasználatra és az adherencia ellenőrzésére), valamint az asztmát befolyásoló és az életminőséget rontó társbetegségek (pl. rhinitis, rhinosinusitis, gastro-oesophagealis reflux betegség /GERD/, obezitás, obstruktív alvási apnoe, depresszió) felderítését és kezelését is.
Az „asztma kontroll” kifejezés két tényezőt takar, benne foglaltatik egyrészt a tünetek kontrolláltságának mértéke, másrészt a kedvezőtlen kimenetel jövőbeni rizikója.
A tünetek kontrollját az elmúlt 4 hetes időszakra szükséges meghatározni.
Számszerűsíteni validált kérdőívek segítségével lehet, amilyen az Asztma Kontroll Kérdőív (ACQ) és az Asztma Kontroll Teszt (ACT). Az ACQ hét kérdést tartalmaz, melyek közül öt a tünetekre vonatkozik az elmúlt héten, egy a rohamoldó használatra, és egy maga a FEV1 érték. Minden kérdésre 0-6 közötti pontszám adható (a nagyobb érték rosszabb), és az ACQ pontszám ezek átlagát jelenti. Jól kontrollált asztma a 0-0,75 közötti ACQ pontszám, határzóna a 0,75-1,5 közötti, és rosszul kontrollált az 1,5 fölötti érték. Magyarországon inkább az ACT terjedt el. Ez a következő öt dologra kérdez rá:
7
1. korlátozottság a feladatok elvégzésében; 2. nehézlégzés; 3. asztma miatti felébredés;
4. rohamoldó használat; 5. összességében az asztma állapotának szubjektív megítélése.
A kérdésekre adott 1-5 pont alapján 5-25 pont érhető el: 20-25 között beszélünk jól kontrollált asztmáról, 16-20 között nem jól kontrolláltról és 5-15 között nagyon rosszul kontrollált asztmáról. A rosszul kontrolált asztma a légzésfunkció nagyobb változékonyságával is jár a jól kontrollált asztmához képest, és jelentősen emeli az akut exacerbáció kialakulásának valószínűségét (Global Initiative for Asthma 2015).
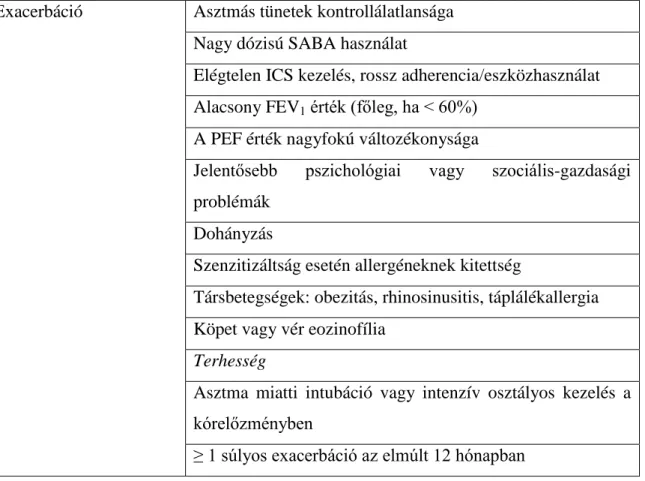
Kedvezőtlen kimenetel alatt elsősorban az akut exacerbáció fellépését, a fixált légúti obstrukció kialakulását és a kezelés mellékhatásait értjük. Ezek ismert rizikófaktorai az 1. táblázatban láthatók.
1. táblázat. A kedvezőtlen asztmás kimenetel ismert rizikófaktorai.
SABA, rövidhatású β2-agonista; ICS, inhalációs kortikoszteroid; FEV1, kilégzési másodperctérfogat; PEF, kilégzési csúcsáramlás, OCS, orális kortikoszteroid.
Exacerbáció Asztmás tünetek kontrollálatlansága Nagy dózisú SABA használat
Elégtelen ICS kezelés, rossz adherencia/eszközhasználat Alacsony FEV1 érték (főleg, ha < 60%)
A PEF érték nagyfokú változékonysága
Jelentősebb pszichológiai vagy szociális-gazdasági problémák
Dohányzás
Szenzitizáltság esetén allergéneknek kitettség
Társbetegségek: obezitás, rhinosinusitis, táplálékallergia Köpet vagy vér eozinofília
Terhesség
Asztma miatti intubáció vagy intenzív osztályos kezelés a kórelőzményben
≥ 1 súlyos exacerbáció az elmúlt 12 hónapban
8 Fixált légúti obstrukció ICS kezelés hiánya
Dohányzás, ártalmas kemikáliák, foglalkoztatási ártalmak Alacsony kiindulási FEV1
Krónikus nyáktúltermelés Köpet vagy vér eozinofília
Kezelés mellékhatások Szisztémás: gyakori OCS használat; hosszú távú, nagy dózisú és/vagy potens ICS használat; citokróm P450 gátlószer együttes alkalmazása
Lokális: nagy dózisú és/vagy potens ICS használat; rossz inhalációs technika
Asztma miatti halál Intubációt és lélegeztetést igénylő közel-fatális asztma a kórelőzményben
Asztma miatti hospitalizáció vagy sürgősségi ellátás az elmúlt 12 hónapban
Aktuálisan használt, vagy nemrég abbahagyott OCS szedés ICS kezelés hiánya
SABA túlhasználat, főleg ha > 200 adag / hónap Pszichiátriai betegség
Rossz adherencia Táplálékallergia
A tünetek kontrollálatlansága – bár erős prediktora az exacerbáció rizikónak –, önmagában mégsem elég a rizikóbecslésre, mivel egyrészt a hörgőtágító szerek elfedhetik a tüneteket, de a háttérben zajló krónikus gyulladást nem gyógyítják, másrészt a tünetesség nem mindig függ össze a légzésfunkcióval. Asztmás betegekben idővel kialakulhat nem teljesen reverzibilis, azaz fixált légúti áramláskorlátozottság, ami gyakran perzisztáló nehézlégzéssel jár. A normálisnak tartott 15-20 ml-nél asztmásokban gyorsabb ütemű a FEV1 éves csökkenése is. A kezelés mellékhatásainak esélye nő a nagyobb dózisok alkalmazásával. A hosszú távú, nagy dózisú inhalációs kortikoszteroid (ICS) kezelés fokozza a véraláfutások, csontritkulás, szürkehályog, glaucoma és mellékvese szuppresszió rizikóját, míg a lokális mellékhatások közé
9
tartozik a szájpenész és a diszfónia (Global Initiative for Asthma 2015, Tamási és mtsai 2012).
Exacerbáció alatt a tüneteknek és a légzésfunkciónak olyan fokú progresszív romlását értjük, ami szükségessé teszi a beteg szokásos gyógyszerelésének a megváltoztatását (Global Initiative for Asthma 2015). Az exacerbáció fellépésének érzékenyebb jelzője a tünetek gyakoriságának fokozódása, viszont a súlyosságát az akut ellátásban a légzésfunkciós paraméterek eltérései a tüneteknél jobban jelzik. A betegek egy kis része a tüneteket alig érzékeli, még jelentős légzésfunkció romlás ellenére is; az ilyen betegek kórelőzményében gyakran szerepel közel-fatális asztma. Súlyos exacerbáció enyhe, illetve jól kontrollált asztmásokban is felléphet, vagy akár az asztma első manifesztálódása is lehet. Általában valamilyen külső ágens (pl. vírusos felső légúti fertőzés, pollen, légszennyezettség) vagy a rossz ICS adherencia a kiváltó oka, de a betegek egy részénél nem deríthető fel semmilyen külső hatás. A súlyos exacerbáció potenciálisan életet veszélyeztető állapot, szoros monitorozást és megfelelő kórházi kezelést igényel.
Az exacerbációk elkerülése miatt elengedhetetlen az ismert rizikók csökkentése.
Ugyanakkor nem minden esetben mutatható ki a kiváltó ok, tehát egyelőre ismeretlen tényezők is közrejátszanak az exacerbációk kialakulásában. Emiatt hasznosak lennének olyan validált, nem invazív módon nyerhető biomarkerek az asztmás betegek gondozásában, amik képesek lennének előre jelezni a jövőbeni nagyobb rizikót, a várható állapotrosszabbodást. Így az asztma kontroll megítélése és a kezelés irányítása nem csak a szubjektív tünetekre és légzésfunkcióra támaszkodna. Az asztma biomarkerek keresése jelenleg is nagy erőkkel zajlik a nemzetközi kutatásban (Muñoz és mtsai 2015). A perifériás vérben számos gyulladásos marker mérhető, melyek közül néhánynak a jövőben a klinikumban is szerepe lehet, például az eozinofil gyulladást jelző periostin már jelenleg is használatos a Th2 citokinek, mint az interleukin(IL)-13 és IL-5 gátló, vagy az IgE gátló kezelés várható hasznának megítélésére (Arron és mtsai 2013). Az indukált köpet, abban is elsősorban az eozinofil sejtek arányának vizsgálata hasznos lehet, bár a klinikai alkalmazása egyelőre nehézségekbe ütközik, és félig invazív módszernek számít, a betegek egy részében bronchospazmust okozhat, emiatt például terhességben ellenjavallt alkalmazása. A légúti eozinofil gyulladásra utaló kilégzett levegő nitrogén-monoxid szint (FENO) az egyik legígéretesebb módszer,
10
összefüggést mutathat a tünetekkel, légzésfunkcióval, köpet eozinofíliával és a légúti hiperreaktivitással, de még az exacerbáció éves előfordulásával is; egyes vizsgálatok szerint az ez alapján vezérelt kezelés fenntarthatja vagy javíthatja az asztma kontrollt az ICS dózisának csökkentése mellett (Jones és mtsai 2001, Smith és mtsai 2005), sőt az exacerbációk előfordulását is csökkentheti (Malerba és mtsai 2008). A kilégzett levegő kondenzátum gyűjtése szintén nem invazív metodika, ebben is számos citokin, kemokin, prosztanoid és oxidatív stressz marker mérhető, vagy akár a pH és hőmérséklet is információt nyújthat a légutakról. Még újabb és szintén ígéretes módszer az illékony szerves összetevők vizsgálata. Mindezek a vizsgálatok még kutatási fázisban vannak, de remélhetőleg a jövőben lesznek olyan biomarkerek, melyek a klinikumban is jól használhatónak bizonyulnak.
11
II. 2. ASZTMA TERHESSÉGBEN
II. 2. 1. Klinikai összefüggések az asztma és várandósság között
Az asztma az egyik leggyakoribb terhességgel szövődő krónikus betegség, bizonyos fejlett országokban a legfrissebb adatok szerint már a kismamák 8,3-13,9%-a asztmás (Charlton és mtsai 2013). A két állapot között kétirányú kölcsönhatás áll fenn: egyrészt az asztma befolyásolhatja a terhesség kimenetelét, másrészt a terhesség során végbemenő számos élettani és mechanikai változás miatt maga a várandósság is hatással lehet az asztma tünetességére, súlyosságára (Murphy és mtsai 2006). Tizennégy 1990 előtt megjelent vizsgálat metaanalízise szerint nagyjából az asztmás kismamák egyharmadánál történik javulás az asztmás tünetekben a terhesség során, másik egyharmadnál ellenben rosszabbodás lép fel, a maradék egyharmadnál pedig nem változik a súlyosság. Az esetleges exacerbációk leginkább a második és harmadik trimeszterben fordulnak elő, a gyakoriság csúcsa a 6. hónapban van (Schatz 1999), és nagyjából a terhességek 6%-ában következik be exacerbáció (Charlton és mtsai 2013, Ali és Ulrik 2013). Ugyanakkor a terhesség utolsó négy hetében általában javulás lép fel, és a vajúdás és szülés közben csak a betegek 10-20%-ában jelentkeznek asztmás tünetek (Gluck és Gluck 2006). A terhesség során bekövetkező változás gyakran visszaalakul a terhesség előtti szintre a szülés után három hónapon belül. Egy adott beteg egymást követő terhességei során az asztma hasonló lefolyása várható (Gluck és Gluck 2006).
Ugyanakkor a nem jól kontrollált anyai asztma hatására emelkedhet számos súlyos anyai és magzati szövődmények rizikója, amely ismeret gyakran okoz félelmet és jelent gátlást az asztmás asszonyok gyermekvállalásában. Asztmás várandósságban nagyobb az esélye az asztma exacerbáció kialakulásának, az orális kortikoszteroid-kezelés szükségességének, az asztma miatti hospitalizációnak, a preeclampsiának, terhességi hipertóniának, gesztációs diabétesznek, chorioamnionitisnek, placenta praeviának, koraszülésnek, császármetszésnek, alacsony születési súlynak, intrauterin növekedési retardációnak (IUGR), vetélésnek, perinatális mortalitásnak és hosszabb kórházi tartózkodásnak (Demissie és mtsai 1998, Källén és mtsai 2000, Liu és mtsai 2001,
12
Hendler és mtsai 2006, Schatz és mtsai 2006, Breton és mtsai 2009, Schatz 2009, Murphy és mtsai 2011). Újabb adatok szerint hasonló arányban várható exacerbáció terhesség alatt, mint nem terhes állapotban (Charlton és mtsai 2013). A perinatális mortalitás szempontjából az asztma 35%-kos rizikóemelkedést jelent, aminek hátterében részben a gyakoribb koraszülés és alacsony születési súly áll (Breton és mtsai 2009). Az anyai asztma az ideg-, a légző- és az emésztőrendszer kongenitális malformációjának rizikóját is fokozhatja (Blais és mtsai 2010).
Azonban az asztma és a terhesség közötti klinikai kölcsönhatások hátterében álló pontos immunológiai mechanizmusok még nincsenek feltérképezve, és nem ismert, mi vezet az esetleges állapotrosszabbodáshoz terhesség alatt. Így jelenleg még nem határozható meg előre nagy biztonsággal, mely asztmás kismamák veszélyeztetettek a terhesség során a szülészeti szövődmények szempontjából, így ez a betegcsoport különleges kihívást jelent a tüdőgyógyászok számára. Az asztma terhesség alatti menedzselése mindig gondos mérlegelést igényel, amihez szükséges az orvosok kellő felkészültsége, valamint a beteg és kezelőorvosa közti gyakori és megfelelő, a beteg számára jól érthető konzultáció is. Az asztma terhesség alatt történő rendszeres állapotkövetése, az adekvát kezelés, és ezáltal az optimális asztma kontroll, a tünetmentes állapot fenntartása terhesség során azért kulcsfontosságú, mivel ez csökkenti az anyai és magzati szövődményrizikót egyaránt (Murphy és mtsai 2011, Bakhireva és mtsai 2008a, Firoozi és mtsai 2010, Tamási és mtsai 2011, Namazy és mtsai 2013). Egy 719 asztmás nő terhességét követő vizsgálatban például gyakoribb volt a koraszülés azoknál a kismamáknál, akik terhességének első felében nem volt megfelelő az asztma kontroll azokhoz képest, akiknél megfelelő volt, illetve azoknál, akiknek asztma miatti hospitalizációra volt szükség azokhoz képest, akiknek nem volt szüksége hospitalizációra (Bakhireva és mtsai 2008a). Egy másik, 13007 asztmás terhességet elemző kohorsz vizsgálat szerint mind a súlyos, mind a mérsékelten súlyos asztma növeli a méhen belüli növekedési elmaradás (small for gestational age – SGA) esélyét az enyhe asztmával szövődött terhességhez képest (Firoozi és mtsai 2010).
Ugyanezt egy még újabb metaanalízis is megerősítette, melynek eredményei szerint az anyai mérsékelten súlyos-súlyos asztma fokozta a méhen belüli növekedési elmaradás és az alacsony születési súly rizikóját, ezenkívül az exacerbáció és az orális kortikoszteroid-használat emelkedettebb koraszülés- és alacsony születési súly-rizikóval
13
járt (Namazy és mtsai 2013). Egy friss tanulmány szerint a kongenitális malformációk rizikója magasabb az első trimeszterben súlyos exacerbációt elszenvedő asztmás kismamák körében, azokhoz képest, akiknél mérsékelten súlyos exacerbáció lépett fel, vagy nem történt exacerbáció (Blais és mtsai 2015).
Az anyai asztmának hosszú távú következményei is lehetnek a gyermek egészségére nézve. Gyakoribbak lehetnek a gyermekkor során a fertőző betegségek, az idegrendszer, a fül, a légzőrendszer és a bőr megbetegedései, ezenkívül valószínűleg az endokrin és metabolikus eltérések, emésztőrendszeri betegségek és a malformációk is (Tegethoff és mtsai 2013).
II. 2. 2. Az asztma diagnosztikai és gondozási nehézségei terhességben
A kontrollált állapot fenntartásához és a kezelés megfelelő szintű beállításához alapvető követelmény az asztmás kismama körültekintő állapotfelmérése, és rendszeres monitorizálása a gondozás során. Igen fontos lenne időben felismerni a fenyegető állapotrosszabbodást, kontrollvesztést – a veszélyeztetett kismamák korai kiszűrésével – , azonban ez nehézségekbe ütközik. Ugyanis a légzésfunkciós vizsgálat eredményeit maga a terhesség is befolyásolja (Grindheim és mtsai 2012), emiatt óvatosan szabad csak megítélni ennek eredményei alapján a kismama aktuális légzésfunkcióját. Egy követéses vizsgálat szerint mind az FVC és FVC%, mind a PEF és PEF% nőtt a 14-16.
terhességi hét után, így ez a fiziológiás emelkedés asztmások esetében akár elfedhet egy rosszabbodó légzésfunkciót, és így a rutin légzésfunkciós vizsgálat egyedüli alkalmazása a terhesség során az állapotromlás korai jeleinek fel nem ismeréséhez vezethet. A megváltozott légzésfunkció szülés után is emelkedett marad, így a már szült nők FVC% értékei szignifikánsan magasabbak, mint a még sosem szült nőké (Grindheim és mtsai 2012). Emellett a légzésfunkciós vizsgálat során szükséges erőltetett kilégzési manővert a terhesség előrehaladtával egyre nehezebben végzik el a betegek. A terhességi fiziológiás hiperventilláció miatt az artériás parciális oxigénnyomás valamivel magasabb (pO2 100–105 Hgmm), míg a széndioxid-nyomás valamivel alacsonyabb (pCO2 32–34 Hgmm) várandósokban, mint nem terhesekben;
emiatt akár már az enyhe anyai hipoxémia hátterében is sérült gázcsere-funkció állhat asztmás kismamákban. Legalább 95%-os artériás oxigénszaturáció fenntartása ajánlott a
14
megfelelő anyai és magzati oxigenizáció eléréséhez (Tamási és mtsai 2011). Az indukált köpet vizsgálata terhességben nem végezhető, hasonlóan a bronchiális hiperreaktivitás teszteléséhez, mivel ezek biztonságosságára nincs adat terhességben;
ezen kívül az allergiás bőrpróba is kontraindikált a szisztémás reakció veszélye miatt.
Mindezek a tényezők nagyban csökkentik a diagnosztikai és betegség-monitorozási lehetőségeket asztmás terhességben (Tamási és mtsai 2011). A légúti gyulladásra utaló kilégzett nitrogén-monoxid koncentráció (FENO) mérése viszont – munkacsoportunk adatai alapján - asztmás várandósságban is alkalmazható, nem-invazív módszer (Tamási és mtsai 2009). A FENO terhesség alatti monitorozása alapján titrált kezelés képes volt csökkenteni az exacerbációk előfordulását a hagyományos módon gondozott várandós betegekhez képest, emellett az életminőség is javult, és a neonatális hospitalizáció csökkent (Powell és mtsai 2011). Ugyanakkor egy újabb követéses vizsgálat szerint nagy az egyénen belüli variabilitás asztmás várandósokban, az asztma kontroll fokától függetlenül (Nittner-Marszalska és mtsai 2013).
Asztmával szövődött terhesség esetén a fentiek miatt különösen hasznosak lennének a klinikumban használható olyan nem invazív biomarkerek, amik előre jeleznék az asztma terhesség alatti várható lefolyását, illetve a terhesség valószínű kimenetelét.
Azonban a nemzetközi szakirodalom mai állása szerint – a FENO-n kívül – egyelőre nem ismert az asztma terhesség alatti súlyosbodásával, tünetessé válásával korrelációt mutató biomarker, amely a fokozott rizikóval rendelkező asztmás terhes asszonyok korai kiemelését segítené elő a mindennapi klinikai betegellátás gyakorlatában. Ismert viszont néhány olyan klinikai „gyanújel”, ami felhívhatja a kezelőorvos figyelmét a várható állapotrosszabbodásra. Ezek részben magával az asztmával, részben társbetegségekkel kapcsolatosak. Egyes vizsgálatok szerint a súlyosabb asztmás betegek, illetve a magasabb terápiás lépcsőt igénylők nagyobb eséllyel exacerbálnak terhesség során, mint az enyhe asztmások, amellett, hogy a tüneteik is súlyosabbak (Gluck és Gluck 2006, Charlton és mtsai 2013, Ali és Ulrik 2013). Azoknál a várandósoknál is nagyobb eséllyel alakul ki állapotromlás, akiknél az előző év azonos évszakában, nem terhes állapotban exacerbáció lépett fel (Charlton és mtsai 2013). A terhesség elejét jellemző asztma-specifikus életminőség is kapcsolatban áll a későbbi terhesség alatti asztma morbiditással, mint tünetesség vagy exacerbáció (Schatz és mtsai 2010), valamint a megelőző terhességek során fellépő asztma romlás is fokozott rizikót jelenthet (Global
15
Initiative for Asthma 2015). Az asztmás tünetek terhesség alatti rosszabbodására hajlamosítanak bizonyos társbetegségek, mint a fertőzések, gastro-oesophagealis reflux betegség (GERD), dohányzás és obezitás (Gluck és Gluck 2006, Hendler és mtsai 2006, Ali és Ulrik 2013). Egy újabb követéses vizsgálat is megerősítette, hogy az asztmás kismamák gyakrabban betegszenek meg közönséges náthában, mint az egészséges kismamák, és a tüneteik is súlyosabbak. Ez azért is fontos, mert a laboratóriumban igazolt vírusinfekció fokozta az exacerbáció előfordulását: az infekciók nem kevesebb, mint 60%-a járt kontrollálatlan asztmával (Murphy és mtsai 2013). Emiatt a legújabb GINA irányelvbe bekerült egy új ajánlás, miszerint az asztmás kismamákat légúti infekciók irányában is vizsgálni kell (Global Initiative for Asthma 2015). Az asztmás kismamák harmada dohányzik, és a dohányzás nem csak az exacerbációk előfordulását, de a súlyosságát is fokozza asztmás várandósokban (Murphy és mtsai 2010), ezenkívül a neonatális asztma rizikóját is növeli (Newman és mtsai 2010). Továbbá a koraszülés és a húgyúti fertőzések előfordulása nagyobb mértékben nő a dohányzás és az asztma együttes fennállásakor, mint a két betegség hatására külön-külön (Hodyl és mtsai 2014).
A terhességi fiziológiás immuntolerancia elhízott kismamákban kevésbé működik (Bohács és mtsai 2010), és az anyai obezitás mind a pulmonológiai (mint például asztma exacerbáció), mind a nem pulmonológiai szövődmények (preeclampsia, gesztációs diabétesz, terhességi hipertónia) rizikóját fokozza asztmás várandósokban (Hendler és mtsai 2006, Ali és Ulrik 2013). Egyes vizsgálatok szerint a magzat neme is befolyásolhatja az asztma súlyosságát, amennyiben a lány magzattal várandós nők esetében gyakoribb volt az állapotrosszabbodás (Bakhireva és mtsai 2008b, Bohács és mtsai 2010), illetve a lány magzatok nagyobb eséllyel maradtak el a növekedésben (Murphy és mtsai 2003, Bohács és mtsai 2010). Ugyanakkor más vizsgálatok nem igazoltak nemek közti különbségeket (Ali és Ulrik 2013). Mindezek mellett a megfelelő gyógyszerelés csökkentése is – akár a kezelőorvos, akár önkényesen a beteg által – fokozza a rizikót; az alulkezelés, illetve a rossz adherencia továbbra is általános probléma terhesség során (Gluck és Gluck 2006, Ali és Ulrik 2013).
16 II. 2. 3. Az asztma kezelése várandósságban
Az asztmás kismamák kezelésének célja – a fentiek fényében érthető módon – az optimális asztma kontroll elérése és fenntartása. A kismamákban általában bármilyen gyógyszerelés ellenérzést vált ki, azonban az asztma kezelésének előnyei határozottan felülmúlják a használt szerekkel járó rizikót. Az ICS, β2-agonista, motelukast és theophyllin nem okoz magzati abnormalitást, viszont az ICS használat szüneteltetése fokozza az exacerbáció rizikóját terhesség során (Global Initiative for Asthma 2015). A fent bemutatott diagnosztikai nehézségek miatt a terhesség során újonnan fellépő, a klinikai kép alapján valószínűsíthető, de légzésfunkciós vizsgálattal nem bizonyítható betegséget szintén asztmaként kell kezelni terhesség alatt (Tamási és mtsai 2011). Az asztmás nők egy része, amikor megtudja, hogy terhes, önkényesen abbahagyja a gyógyszerek használatát, míg más kismamák adherenciája javul (Charlton és mtsai 2013). Fontos ezért a kismamák kellő tájékoztatása a kontroll fenntartásának, és így az adekvát kezelésnek a szükségességéről. Szoros, havi rendszerességű követés szükséges a betegség terhesség alatti változékonysága miatt. A jól kontrollált kismamáknak a kezelés folytatása javasolt, és bár nem terhes állapotban 3 hónap után megfontolandó egy lépcsővel lejjebb lépés a terápiában, terhesség alatt ez nem javasolt a kontrollvesztés veszélye miatt (Tamási és mtsai 2011). A nem jól kontrollált kismamáknál egy terápiás lépcsővel feljebb lépés szükséges, míg a nagyon rosszul kontrolláltak számára két lépcsővel feljebb lépés és/vagy orális kortikoszteroid adása ajánlott (Tamási és mtsai 2011). A rendelkezésre álló biztonságossági adatok alapján az albuterol/salbutamol az elsőként választandó rohamoldó szer, míg a budesonid a preferált inhalációs kortikoszteroid hatóanyag. A hosszú hatású inhalációs béta- agonisták, a formoterol és salmeterol is adhatók terhességben, amennyiben a fenntartó ICS terápia ellenére tünetek állnak fenn. A leukotrién-receptor antagonista montelukast és zafirlukast is biztonságosnak tűnik terhességben, bár még elég kevés a humán adat (Tamási és mtsai 2011). Fontos a légúti infekciók adekvát kezelése is terhesség alatt. Az exacerbációk elkerülése azért is fontos, mert a szisztémás kortikoszteroidok kedvezőtlenül befolyásolhatják a terhesség kimenetelét, használatuk a terhességei hipertónia, praeeclampsia, koraszülés, alacsonyabb születési súly és kongenitális malformációk gyakoribb előfordulásával jár (Park-Wyllie és mtsai 2000). A magzati
17
hipoxia elkerülése miatt elengedhetetlen az akut exacerbációk agresszív kezelése SABA, oxigén és szisztémás kortikoszteroid korai adásával (Global Initiative for Asthma 2015).
A nem jól kontrollált betegek szülészeti ellátásában kívánatos a gyakoribb ultrahang- vizsgálat a méhen belüli növekedési elmaradásának lehetősége miatt, és a 32. terhességi héttől a non-stressz teszt vizsgálat. Vajúdás és szülés közben folytatni kell a beteg szokásos asztma medikációját. Bár szülés közben ritkán lép fel exacerbáció, de a hiperventilláció miatt bizonyos fokú hörgőszűkület előállhat, amit SABA adagolásával kell kezelni. Szisztémás kortikoszteroidot szedő, vagy a terhesség során többször szisztémás kortikoszteroid kezelésben részesülő kismamáknak intravénás kortikoszteroid adása javasolt szülés közben és 24 óráig szülés után (Tamási és mtsai 2011). A legújabb GINA ajánlásban újdonság, hogy – főleg koraszülött babákban – a neonatális hipoglikémia lehetősége miatt az újszülött vércukorszintjét az első 24 órában monitorozni kell, amennyiben a kismama a szülést megelőző 48 órában nagy dózisban használt SABA rohamoldó szert (Global Initiative for Asthma 2015).
II. 2. 4. Biomarker-keresés asztmával szövődött terhességben
A nem jól kontrollált asztma, illetve az asztma akut romlásának korai felismerése tehát kulcsfontosságú asztmával szövődött terhességben. A diagnosztika és monitorozás terhesség alatti nehézségei miatt ebben nagy segítséget jelenthetnének nem invazív módon detektálható biomarkerek. Az immunrendszer fokozott aktiváltságát asztmában – és így talán asztmás terhességben is – a periférián keringő gyulladásos fehérjék és egyéb gyulladásos markerek szintjének emelkedése is jelezheti. Asztmában több proinflammatorikus citokin, gyulladásos marker szisztémás emelkedését kimutatták, mint például az IL-6 (Yokoyama és mtsai 1995), tumor nekrózis faktor(TNF)-α (Silvestri és mtsai 2006), C-reaktív protein (CRP) (Takemura és mtsai 2006), fibrinogén és szérum amiloid-A (Jousilahti és mtsai 2002), amelyek azonban nem elég érzékenyek és specifikusak az asztmás kontrollvesztés előrejelzése, az exacerbáció rizikóbecslése szempontjából.
A CRP-t számos alkalommal vizsgálták asztmában, de még nem eldöntött kérdés, mennyire függ össze a súlyossággal és a kontrolláltsággal, illetve mely asztma
18
fenotípusokkal mutat kapcsolatot. Több vizsgálat megerősítette, hogy korrelálhat rosszabb légzésfunkcióval, súlyosabb betegséggel, rosszabb kontrollal, köpet eozinofíliával és légúti hiperreaktivitás előfordulásával (Kony és mtsai 2004, Fujita és mtsai 2007, Allam és mtsai 2009, Kilic és mtsai 2012). Ugyanakkor más vizsgálatok szerint csak szteroid-naiv betegekben emelkedett a szintje, és csak ebben a betegcsoportban korrelált rosszabb légzésfunkcióval és a köpet eozinofíl számmal (Takemura és mtsai 2006), szteroid-kezelt betegekben nem; más vizsgálatok szerint pedig vagy csak nem allergiás asztmával függött össze, allergiás asztmával nem (Olafsdottir és mtsai 2005), vagy egyáltalán nem korrelált az asztma kontrollal és a légzésfunkcióval asztmásokban (Sigari és Ghasri 2013).
Az IL-6 is gyulladásos citokin, akut fázis fehérje, ami tovább fokozza más akut fázis fehérjék, így a CRP termelését is. Valószínűleg – a korábbi nézettel szemben – nem csak a gyulladásos folyamatok „mellékterméke” asztmában, hanem hasonlóan más citokinekhez, ez is aktív résztvevő a betegség patogenezisében, méghozzá már a korai fázisban, a légúti epitélsejtekből felszabadulva (Rincon és Irvin 2012). Enyhe- mérsékelten súlyos allergiás asztmások indukált köpetében magasabb szintet mértek egészséges kontrollokhoz képest (Neveu és mtsai 2010), míg bronchoalveoláris lavázs (BAL) mosófolyadékban mérve „intrinsic” asztmásokban magasabb szintet írtak le allergiás asztmásokhoz képest (Virchow és mtsai 1996). Érdekes, hogy mivel a zsírsejtek is termelik egyéb gyulladásos molekulákkal együtt, az obezitáshoz társuló asztma fenotípusban különösen fontos lehet (Canöz és mtsai 2008). Perifériás vérben az IL-6 szintjét még kevés alkalommal vizsgálták asztmában. Egészséges kontrollokhoz képest két vizsgálatban is emelkedett szintet mértek stabil állapotú asztmásokban (Yokoyama és mtsai 1995, Higashimoto és mtsai 2008), ami tovább emelkedett asztmás roham során, illetve allergén inhaláció hatására (Yokoyama és mtsai 1995). Egy másik vizsgálatban csak enyhe és súlyos asztmás betegek IL-6 szintjét hasonlították össze (egészséges kontrollcsoport nélkül), és köztük nem találtak különbséget (Ghaffari és mtsai 2011).
Különböző gyulladásos markerek perifériás vér-, illetve légúti szintjeinek, és a tünetekkel, illetve egyéb klinikai és gyulladásos jellemzőkkel való összefüggéseinek vizsgálata tehát jelenleg is zajlik az asztma kutatásban, de a mindennapi klinikai gyakorlatban még nem áll rendelkezésre jól használható, megbízható, perifériás vérben
19
mérhető biomarker. Másrészt, egyáltalán nem biztos, hogy egy nem terhes állapotban validált biomarker várandós állapotban is használható lehet, illetve ugyanazok a normálértékek érvényesek, hiszen a fiziológiás terhességre jellemző immunológiai, hormonális és fizikai változások a gyulladásos markerek szintjét is befolyásolhatják, mint ahogy kimutatták korábban a D-dimer, fibrinogén (Réger és mtsai 2013), vörösvértest süllyedés (van den Broe és Letsky 2001), fehérvérsejt szám (Valdimarsson és mtsai 1983), és CRP (Watts és mtsai 1991) esetében is. Emiatt egy esetleg asztmában már jól bevált biomarkert mindenképpen meg kell vizsgálni asztmával szövődött terhességben is, mielőtt a nem terhes állapotban validált szerepének megfelelően terhes állapotban is biomarkerként alkalmaznánk.
II. 2. 5. Hsp70 asztmával szövődött terhességben
Munkacsoportunk korábban már megvizsgált egy potenciális biomarkert, a hősokkfehérje (HSP)-70-et asztmával szövődött terhességben (Tamási és mtsai 2010).
A hősokkfehérjék a sejtekben molekuláris chaperon funkcióval bíró filogenetikailag konzervált, sejtvédő molekulák, azonban a sejtek stressz esetén exocitózissal kiválasztják, illetve az elpusztult sejtekből felszabadul, így a vérkeringésben is detektálhatók, és stresszmarkerként szolgálnak. A Hsp70 perifériás szintje egészséges terhességben alacsonyabb, mint nem terhes állapotban, valószínűleg a terhességi immutolerancia következtében (Molvarec és mtsai 2007). Ugyanakkor a terhesség előrehaladtával nőhet a koncentrációja a vérben (Molvarec és mtsai 2007), bár az erre vonatkozó adatok nem egyértelműek (Fukushima és mtsai 2005). Mindenesetre az emelkedett szint szülészeti szövődményekkel járhat, mint preeclampsia vagy koraszülés (Fukushima és mtsai 2005). A Hsp70-nek asztmában is szerepe lehet, hiszen mindinkább ismert, hogy az asztmára jellemző gyulladásos folyamatokat nem specifikus veszélyszignál is beindíthatja, melyben az antigénprezentáló dendritikus sejtek kóros működése a döntő (Willart és Lambrecht 2009). A Hsp70 közreműködik az antigén feldolgozásban és bemutatásban, illetve az antigénprezentáló sejtek aktivitását növelve, és a tolerogén dendritikus sejtek immunogénekké való konverzióját okozva az asztmás immunválasz beindításában, majd Th2 környezetben ennek fenntartásában is.
Stimulálja gyulladásos citokinek (TNF-α, IL-1β és IL-6) és kemokinek termelését,
20
valamint az NK sejtek és γ/δ T sejtek citolitikus aktivitását. Később – már munkacsoportunk vizsgálatát követően – kimutatták, hogy mind az eozinofil, mind a nem eozinofil fenotípusú asztmások köpetében és plazmájában magasabb a szintje, és a súlyossággal korrelál, így a szerzők szerint biomarkerként is használható lehetne (Hou és mtsai 2011).
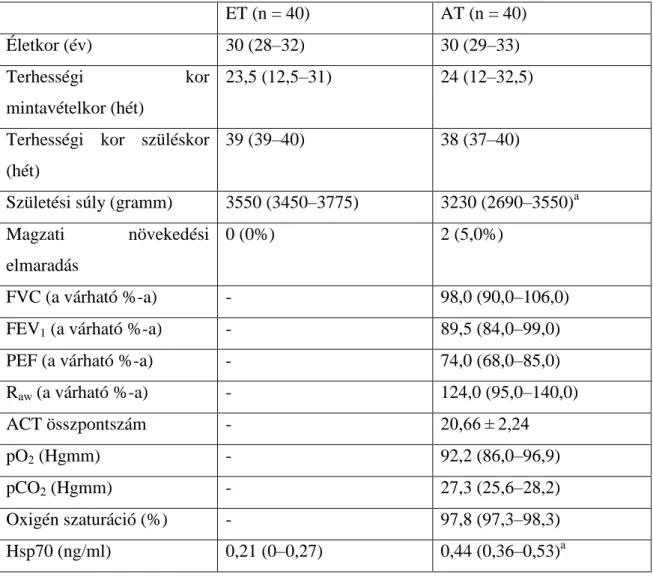
Célszerűnek tűnt megvizsgálni lehetséges alkalmazhatóságát asztmás várandósságban is. A vizsgálatban 40 egészséges és 40 asztmás várandós vett részt, az életkor (medián: 30 év) és a gesztációs kor (medián: 23,5 vs. 24 hét) is egyezett a két csoportban (2. táblázat). Azonban a betegek egy részében nem megfelelően kontrollált asztma eredményeképpen az újszülöttek születési súlya alacsonyabb volt az asztmás csoportban, mint az egészséges terhes csoportban (medián: 3230 gramm /2690–3550/
vs. 3550 gramm /3450–3775/, p < 0,05), azonos terhességi kor mellett. A parciális artériás oxigéntenzió mediánja 92,2 Hgmm volt az asztmás kismamák körében, ami elmarad a fiziológiás terhességben várhatóhoz képest. Az asztma kontroll foka nagyrészt kielégítő volt, 20,66 ± 2,24 átlagos ACT összpontszámmal. A medián FEV1 89,5%, a medián PEF 74% volt (Tamási és mtsai 2010).
21
2. táblázat. Klinikai jellemzők és szérum Hsp70 szintek a két vizsgált csoportban.
Medián [interkvartilis tartomány], átlag ± SD. ET, egészséges terhes; AT, asztmás terhes; FVC, erőltetett vitálkapacitás; FEV1, erőltetett kilégzési másodperctérfogat;
PEF, kilégzési csúcsáramlás; Raw, légúti áramlási ellenállás; ACT, Asztma Kontroll Teszt; pO2, parciális artériás oxigénnyomás; pCO2, parciális artériás széndioxid- nyomás; a p < 0,05.
ET (n = 40) AT (n = 40)
Életkor (év) 30 (28–32) 30 (29–33)
Terhességi kor
mintavételkor (hét)
23,5 (12,5–31) 24 (12–32,5)
Terhességi kor szüléskor (hét)
39 (39–40) 38 (37–40)
Születési súly (gramm) 3550 (3450–3775) 3230 (2690–3550)a Magzati növekedési
elmaradás
0 (0%) 2 (5,0%)
FVC (a várható %-a) - 98,0 (90,0–106,0)
FEV1 (a várható %-a) - 89,5 (84,0–99,0)
PEF (a várható %-a) - 74,0 (68,0–85,0)
Raw (a várható %-a) - 124,0 (95,0–140,0)
ACT összpontszám - 20,66 ± 2,24
pO2 (Hgmm) - 92,2 (86,0–96,9)
pCO2 (Hgmm) - 27,3 (25,6–28,2)
Oxigén szaturáció (%) - 97,8 (97,3–98,3)
Hsp70 (ng/ml) 0,21 (0–0,27) 0,44 (0,36–0,53)a
A szérum Hsp70 koncentráció szignifikánsan magasabb volt az asztmás terhes csoportban, olyannyira, hogy meghaladta az egészséges terhesekben mért medián érték kétszeresét (0,44 /0,36–0,53/ vs. 0,21 /0–0,27/ ng/ml, p < 0,001). Továbbá ROC analízissel meghatározható volt a Hsp70 koncentráció olyan értéke (0,30 ng/ml), amely az asztmás és egészséges terheseket 90%-os szenzitivitással és 85%-os specificitással képes volt elkülöníteni. Az efölötti Hsp70 értékek többszörös logisztikus regresszió analízissel a terhességi korra és anyai életkorra való korrekció után is szignifikánsan összefüggtek az anyai asztmával; a korrekcióra azért volt szükség, mert a Hsp70 szint az
22
egészséges terhes csoportban – a korábbiakban már ismert adatokhoz hasonlóan – korrelált a gesztációs korral és fordítottan korrelált az anyai életkorral. A fokozott gyulladásos állapot és a tünetesség összefüggését jelezte asztmás terhességben az ACT összpontszám és a Hsp70 szint közötti fordított korreláció trendje (r2 = 0,9669; p=0,07;
1. ábra) (Tamási és mtsai 2010).
1. ábra. A Hsp70 szint és az ACT összpontszám kapcsolata asztmás terhesekben ACT – Asztma Kontroll Teszt.
A Hsp70 mérése tehát a jövőben segítheti a terhesség alatt újonnan fellépő asztma diagnosztikáját, illetve a már ismert asztmás kismamák esetében hozzájárulhatna a kontrolláltság fokának objektív értékeléséhez, azonban ehhez nagyobb esetszámú vizsgálatban történő validálás szükséges. Az eddigi adatok alapján a Hsp70-nek összekötő szerepe lehet az asztmás gyulladás és a szülészeti/perinatális szövődmények kialakulása között: az asztma miatt nagyobb mennyiségben a keringésbe kerülő extracelluláris Hsp70 által kiváltott proinflammatorikus immunreakciók terhességi szövődményekhez és a magzat elmaradott fejlődéséhez vezethetnek (Tamási és mtsai 2010).
23
A fent ismertetett, már megkezdett biomarker-kutatásnak a folytatásaként munkacsoportunk további olyan potenciális molekulákat keresett, amelyek használhatók lehetnének a klinikumban az asztmás kismamák állapotának objektív megítélésére és a terhesség alatti várható kockázat felmérésére. Három szóba jövő molekula elemzésére került sor: a vaszkuláris endoteliális növekedési faktor (VEGF), a szolubilis urokináz plazminogén aktivátor receptor (suPAR) és a hialuronsav.
II. 3. LEHETSÉGES ÚJ BIOMARKEREK ASZTMÁVAL SZÖVŐDÖTT TERHESSÉGBEN
II. 3. 1. Vaszkuláris endoteliális növekedési faktor (VEGF)
A vaszkuláris endoteliális növekedési faktor az angiogenezis egyik fő mediátora, a makrofágok, T sejtek, epitél-, simaizom- és fibroblasztsejtek, citotrofoblaszt és tumorsejtek által termelt citokin. Az érújdonképződést több fronton hatva váltja ki: igen jelentősen megnöveli a vaszkuláris permeabilitást, elősegíti az endotélsejtek és prekurzoraik migrációját és proliferációját, míg apoptózisukat gátolja; emellett a nitrogén-monoxid szintézis szabályozásában is fontos szerepe van. De az eozinofilekre, hízósejtekre és makrofágokra is hat, stimulálja ezen gyulladásos sejtek kemotaktikus migrációját. A vaszkuláris simaizomsejtek migrációját pedig a mátrix metalloproteináz termelésüket fokozva serkenti. A T sejtek elsődleges aktiválódásában („priming”) is szerepe lehet (Meyer és Akdis 2013).
A hatos kromoszómán elhelyezkedő génje nyolc exont tartalmaz, melyek egy több altípusból álló proteincsaládot kódolnak: PlGF (placenta growth factor – placenta növekedési faktor), VEGF-A, VEGF-B, VEGF-C és VEGF-D, melyek közül a VEGF-A a predomináns forma (Yamazaki és Morita 2006, Jardim és mtsai 2015, Pałgan és Bartuzi 2015). A VEGF-nek a sejtekben tirozin-kináz aktivitással bíró receptorai vannak. A VEGF-A, VEGF-B és PlGF a VEGFR-1 (vagy más néven fms-like tyrosine kinase 1; Flt1) receptorhoz kötődnek, míg a VEGFR-2 (vagy KDR-growth factor receptor, vagy Flk1) receptorhoz csak a VEGF-A kötődik. Bár az Flt1-hez nagyobb az
24
affinitása a VEGF-nek, mégis a KDR receptor az angiogenezis és az éráteresztés fő mediátora (Jardim és mtsai 2015). Az Flt1-nek szolubilis formája is van, az sFlt1, amit monociták és endotélsejtek termelnek alternatív splicing útján, és a VEGF fiziológiás szabályozására szolgál. A jól szabályozott, állandó VEGF szint ugyanis igen fontos, hiszen ez elengedhetetlen az endotélsejtek túléléséhez és proliferációjához. Az sFlt1 a VEGF és PlGF antagonistájaként hat, mivel a plazmában hozzájuk kötődve megakadályozza a biológiai hatással bíró receptorukhoz való kötődésüket, és így a sejten belüli biológiai hatásuk kiváltását. Ez a szolubilis receptor ugyanis nem fejt ki tirozin-kináz aktivitást. Így végső soron endotélsejt diszfunkciót és vazokonstrikciót okozhat (Levine és mtsai 2004, Maynard és mtsai 2003). Emellett a kereskedelmi forgalomban lévő ELISA kitek VEGF mérését is befolyásolja, blokkolva a VEGF- antitest kötőhelyet (Jelkmann 2001). Így tehát a mért szintek valójában „szabad” VEGF szinteket jelentenek, nem pedig „összes” VEGF szinteket.
A VEGF terhesség során a normális embrionális és placentális angiogenezisben kritikus szerepet játszik (Espinoza és mtsai 2010). A terhesség 21. napjától egészen a 26. hétig tartó folyamat során a trofoblasztsejtek, deciduasejtek és makrofágok termelik lokálisan az ezt elősegítő angiogén faktorokat, többek között a VEGF-et. Ugyanakkor a szinciciotrofoblaszt terhességben több sFlt1-et is termel, jellemző időbeli szérumszint változásokkal. A fogantatás után eleinte megnő a szintje, majd a 30. hétig állandó marad. Végül az utolsó két hónapban gyorsan tovább emelkedik, és terminuskor tetőzik (Levine és mtsai 2004, Palm és mtsai 2011). Azonban a nem megfelelő placentációval és placentális erezettséggel járó preeclampsiában már a 30. hétnél korábban és jelentősebb mértékben megemelkedik az sFlt1 keringő szintje, a szabad VEGF (és PlGF) pedig csökken, így az angiogén-angiosztatikus faktorok aránya romlik (Levine és mtsai 2004, Maynard és mtsai 2003, Park és mtsai 2005, Espinoza és mtsai 2010, Molvarec és mtsai 2010). Az sFlt1 és más keringő angiosztatikus faktorok megemelkedő szintje okozhatja az anyában az endoteliális diszfunkciót, hipertenziót és proteinuriát. Mivel már a betegség manifesztálódása előtt 5 héttel megemelkedett az sFlt1 szint, így ennek mérése a korai diagnózist is segítheti. Egyébként hasonló tünetek, hipertenzió és proteinuria daganatos betegek VEGF-gátlóval való kezelése során is megfigyelhető volt (Jardim és mtsai 2015).
25
Asztmában a krónikus gyulladás következtében kialakuló, minden szövettani réteget érintő légúti átépülés egyik legkorábbi eleme a légutak erezettségének jelentős megnövekedése (Pałgan és Bartuzi 2015). Ez csökkenti a légúti átmérőt, a légúti hiperreaktivitást viszont fokozhatja (Hoshino és mtsai 2001). A neovaszkularizáció a bronchiális endotélium destrukciójával és VEGF felszabadulással kezdődik (Pałgan és Bartuzi 2015). A légúti VEGF fő forrása az alveoláris és bronchiális epitélsejtek, a simaizomsejtek, a fibroblasztok és az alveoláris makrofágok, de az IgE-aktivált bazofilek, hízósejtek és eozinofilek is szecernálják (Meyer és Akdis 2013). Asztmás betegekből származó bronchiális epitélsejtekről és simaizomsejtekről is kimutatták, hogy nagyobb mennyiségben képesek termelni VEGF-et, mint egészségesekből származó sejtek, melynek hátterében epigenetikai módosulásokat írtak le (Pałgan és Bartuzi 2015, Meyer és Akdis 2013). A bronchiális epitélsejtek VEGF termelését a Th2 jellegzete citokinjei (IL-4, IL-5, IL-13) és a Th17 sejtek növelik, a Th1 sejtek ellenben elnyomják (Meyer és Akdis2013). A VEGF fokozott termelése korrelált az erek számával, a bazális membrán vastagságával és a hízósejtek számával a bronchiális mucosában, enyhe vagy középsúlyos asztmásokban (Meyer és Akdis 2013).
A fentieknek megfelelően asztmás betegekben magasabb légúti VEGF koncentrációkat mértek mind indukált köpet, mind bronchiális biopszia mintákban, mind BAL folyadékban detektálva (Hoshino és mtsai 2001, Asai és mtsai 2003).
Ráadásul szignifikáns korrelációt írtak le a légúti VEGF szintek és a bronchiális obstrukció, valamint a vaszkuláris permeabilitás súlyossága között, emellett a VEGF az eozinofil gyulladás mértékével is korrelált; az ICS kezelés viszont csökkentette a légúti VEGF szinteket (Hoshino és mtsai 2001, Asai és mtsai 2003). Rhinovírus infekció gyakran áll asztma exacerbáció hátterében, és ismert, hogy a rhinovírus fertőzés serkenti a bronchiális epitélsejtek VEGF termelését, így az sem meglepő, hogy rhinovírus okozta asztma exacerbációban magasabb a VEGF szintje (Meyer és Akdis2013).
A VEGF tehát mind egészséges terhességben, mind asztmában jelentőséggel bír, azonban ezen ismeretek ellenére perifériásan keringő mennyiségéről sem asztmában, sem asztmás terhességben nem volt még adat.
26
II. 3. 2. Szolubilis urokináz plazminogén aktivátor receptor (suPAR)
Az utóbbi évek kutatási eredményei alapján a szolubilis urokináz plazminogén aktivátor receptor (suPAR) az immunrendszer általános aktiváltsági állapotának értékes indikátorává lépett elő. Az urokináz-típusú plazminogén aktivátor receptor (uPAR) egy membrán glikoprotein; számos sejt expresszálja felszínén, így különféle immun-, simaizom-, endotél- és daganatsejteken is megjelenik (Thunø és mtsai 2009). Az expresszióját egyes növekedési faktorok és citokinek (pl. IL-1β és TNF-α) fokozzák. A fő ligandja, az uPA kötődésének hatására a plazminogént plazminná konvertálja, ami az extracelluláris mátrix degradálódásához vezet, ami pedig elősegíti akár a gyulladásos sejtek migrációját, akár például a daganatsejtek invázióját. De az uPAR-hoz nem csak az uPA, hanem más ligandok is kötődhetnek, mint például vitronectin és integrinek.
Ennek megfelelően az uPAR nem csak a proteolízist szabályozza, hanem számos intracelluláris jelátviteli utat is aktiválhat, amik tovább serkentik a sejtek motilitását, invázióját, de proliferációját és túlélését is, más transzmembrán receptorokkal is kölcsönhatásba lépve (Peng és mtsai2015). Ezenkívül, az uPAR az immunsejtek adhéziójára, és főleg a neutrofilek besorozására is jelentős hatással van, és a fagocitózist is serkenti (Wrotek és Jackowska 2015). Így az uPAR/uPA rendszer a gyulladásban kétségkívül fontos szerepet játszik. Gyulladásos stimulus közben az uPAR proteázok hatására leválik a sejtfelszínről, így jön létre a szolubilis formája, a suPAR, melyet 1991-ben fedeztek fel (Stephens és mtsai 1997). Egészséges felnőttek medián suPAR szintjét 1,5 ng/ml-nek vagy 2,6 ng/ml-nek határozták meg a különböző vizsgálatok (Donadello és mtsai 2012).
A suPAR alacsony, de konstans koncentrációban kimutatható egészséges személyek plazmájában és egyéb testfolyadékaiban (Stephens és mtsai 1997). A CRP-vel ellentétben a suPAR szintjét nem befolyásolja napszaki változás vagy a prandiális állapot (Sier és mtsai 1999). A suPAR a plazmaminták ismételt fagyasztására – felolvasztására sem érzékeny (Riisbro és mtsai 2001), így a nagyfokú stabilitásnak köszönhetően ideális klinikai biomarker lehet. A gyulladásos válasz magasabb suPAR szinthez vezet számos gyulladásos betegségben, ráadásul rosszabb prognózist is előre jelezhet (Sier és mtsai 1999, Ostrowski és mtsai 2005, Ostergaard és mtsai 2004, Sier és mtsai 1998, Eugen-Olsen és mtsai 2002). A suPAR szintje más gyulladásos
27
markerekkel – például CRP, fibrinogén – is korrelál (Gumus és mtsai 2015). Mivel etiológiától független a koncentrációjának emelkedése, a gyulladás, az immunrendszer általános aktiváltsági állapotának és nem utolsó sorban a betegek állapotának univerzális markere lehet. Az átlagnépességben a CRP-hez hasonlóan a krónikus gyulladás jelzője; a dohányzás, morbid elhízás, alkoholfogyasztás, egészségtelen táplálkozás, alacsony HDL szint és korábban elszenvedett szívizom infarktus magasabb szinttel jár. A népességben az emelkedett szintje összefügg a szív-érrendszeri betegségek, 2-es típusú diabétesz, rák és korai halálozás rizikójával, a CRP-től függetlenül is (Haupt és mtsai 2014).
Az ideálisnak tűnő tulajdonságai miatt számos állapotban vizsgálták már biomarkerként, de asztmában korábban még nem. A normálisnál magasabb suPAR szintet mértek különféle fertőző (Ostrowski és mtsai 2005, Ostergaard és mtsai 2004), autoimmun (Balabanov és mtsai 2001, Toldi és mtsai 2013) és daganatos betegségekben (Sier és mtsai 1998). COPD-ben stabil állapotban (leginkább GINA III és IV stádiumban) (Can és mtsai 2014) és akut exacerbációban (Gumus és mtsai 2015) is emelkedett a szintje; utóbbi betegekben egy hét kezelés után csökkent. A suPAR – a fibrinogénhez hasonlóan – erős prediktora volt a COPD exacerbációnak, és a FEV1-gyel fordítottan korrelált (Gumus és mtsai 2015). A COPD-n kívül más betegségekben is leírták, hogy a megemelkedő suPAR koncentráció a kezelés illetve a klinikai javulás során körülbelül egy hét után mutat újra csökkenést (Wrotek és Jackowska 2015, Donadello és mtsai 2012). A sikeres kezelés hatására fertőző és daganatos betegségekben is csökkent, és teljes gyógyulás után normalizálódott a szintje (Eugen- Olsen és mtsai 2002, Ostrowski és mtsai 2005). A koronária betegséget, a mikrovaszkuláris funkciót, a koronária kalcifikációt és ezek súlyosságát is jelezte, sőt képes volt előrejelezni a szívizom infarktus és a szíveredetű halálozás rizikóját (Eapen és mtsai 2014, Sørensen és mtsai 2014, Mekonnen és mtsai 2015). Az érelmeszesedés folyamatában a makrofágok közvetítette gyulladásban, az endotélsejtek diszfunkciójában és az immunrendszer kóros szabályozásában vesz részt (Mekonnen és mtsai 2015). Vesebetegségekben a podocita funkcióval és proteinuriával mutatott összefüggést (Peng és mtsai 2015). Kritikus állapotú betegekben fontos prognosztikus marker. Elsősorban szepszisben vízsgálták, ahol a bacteriaemiát legérzékenyebben a procalcitoninnal (PCT) és IL-6-tal együtt detektálta, de a többi gyulladásos markernél
28
jobban jelezte előre a mortalitást (Donadello és mtsai 2012, Wrotek és Jackowska 2015). Súlyos betegekben a suPAR vérszintje a szervkárosodás mértékét jelző markerekkel is összefüggést mutatott, mint pl. kreatinin, urea, cystatin C, bilirubin és albumin. Traumás agysérülésben a súlyossági fokkal együtt emelkedett és prediktálta a mortalitást (Yu és mtsai 2014). Krónikus májbetegekben a progresszív májfibrózis súlyosságát jelezte a rosszabb prognózissal együtt, szisztémás lupusz erythematosusban pedig a szervkárosodás mértékét és a betegség súlyosságát tükrözte (Sjöwall és mtsai 2015).
A suPAR-t terhességben korábban már vizsgálták. A trofoblaszt sejtek is expresszálják az uPAR-t, amely mátrixdegradáló képessége ezen sejtek invázióját segítheti. A placenta a terhesség elején relatíve hipoxiás területnek számít, és a hipoxia is aktiválja az uPA/uPAR rendszert; elképzelhető, hogy ez is közrejátszik abban, hogy a trofoblaszt sejtek ekkor, a terhesség elején a leginvazívabbak. Terhesség hatására a suPAR perifériás szintje magasabb lehet, ami tehát a trofoblaszt sejtek aktivitására, emellett az immunrendszer fiziológiásan aktivált állapotára utalhat (Odden és mtsai 2012). A suPAR perifériás szintje korábbi adatok alapján nem függött össze a kismama testtömegindexével (BMI), életkorával, a minták tárolási idejével, sem a szülészeti adatokkal, mint születési súly, születési hossz, placenta súlya, a szülés módja vagy az újszülött neme (Odden és mtsai 2012). Aktív maláriás beteg anyák suPAR szinjte – a gesztációs hét mellett – független prediktora volt az alacsonyabb születési súlynak (Ostrowski és mtsai 2007). Praeeclampsiában az élettani terhességben mértnél magasabb koncentrációt írtak le (Toldi és mtsai 2011), azonban úgy tűnik, a betegség klinikai manifesztálódása előtt, első vagy második trimeszterben mérve a suPAR nem használható korai biomarkerként, nem jelezte előre a később diagnosztizált praeeclampsiát (Odden és mtsai 2012, Haedersdal és mtsai 2013).
A gyulladásos állapotokban és patológiás terhességben eddig feltárt szerepei ellenére a suPAR-t korábban asztmában még nem vizsgálták, így perifériásan mérhető koncentrációjáról, tünetfüggéséről sem asztmában, sem pedig asztmás terhességben nem volt adat.
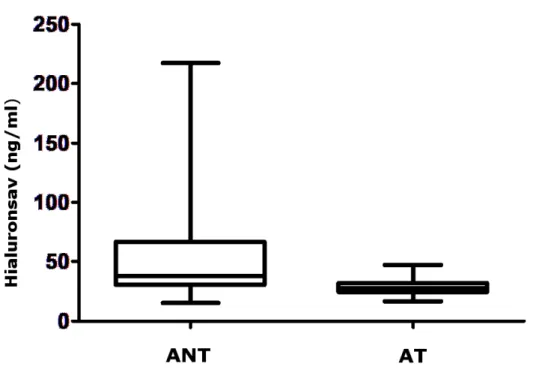
29 II. 3. 3. Hialuronsav
A hialuronsav egy glukozaminoglikán, az extracelluláris mátrix (ECM) egyik fő alkotója, számos egészséges szövet strukturális molekulája. Fiziológiás körülmények között nagy molekulasúlyú polimer, viszkózus és elasztikus tulajdonságai miatt térkitöltő, vízmennyiség- és fehérjemegoszlás-szabályozó, szűrő funkciókkal bír.
Újabban már felismerték, hogy az ECM-ot felépítő molekuláknak, így a hialuronsavnak egyéb, szabályozó szerepei is vannak. Az ECM folyamatos dinamikus átalakulásban van, például az emberi tüdőben a becsült napi turnover 10-15% (Cheng és mtsai 2011).
A hialuronsav szövetsérüléssel (Jiang és mtsai 2007) és gyulladással (Grootveld és mtsai 1991) járó állapotokban hialuronidáz enzimek és reaktív oxigéngyökök hatására kisebb molekulasúlyú fragmentumokká degradálódhat, melyeknek szabályozó szerepük van. Ugyanis ezek a fragmentumok tovább stimulálják különféle kemokinek, citokinek, adhéziós molekulák termelését, transzkripciós és növekedési faktorok expresszióját, aktiválják a fibroblasztokat, epitél- és gyulladásos sejteket, így szerteágazó gyulladásserkentő és érújdonképző hatásokat fejtenek ki (Stern és mtsai 2006). Ezeknek a töredékeknek az eltakarítása tehát elengedhetetlen a gyulladás oldódásához és a szöveti integritás helyreállításához. Ehhez a fő hialuronsavkötő molekula, a CD44 expressziójára van szükség a hemopoetikus sejtek felszínén (Liang és mtsai 2011, Lennon és Singleton 2011).
A hialuronsav szérumkoncentrációja egészséges személyekben 10-100 µg/l között van, a keringésbe kerülve a máj gyorsan eliminálja, a féléletideje 2-5 perc (Laurent 1987). Azonban perifériás szintje szisztémás gyulladással járó betegségekben megemelkedhet, mint például szepszisben, rheumatoid arthritisben, máj- és tüdőfibrózisban, ateroszklerózisban, diabéteszben, különféle daganatokban, vagy COPD-ben (Jiang és mtsai 2011).
Az asztma patogenezisében is fontos szerepet játszik, hozzájárulva a két fő patológiai történéshez, a légúti gyulladáshoz és a légúti átépüléshez. A tüdőben a hialuronsav fontos forrásai a fibroblaszt sejtek, melyek hialuronsav termelését különböző citokinek serkentik, mint pl. IL-1β, TNFα és transzformáló növekedési faktor (TGF)β (Lennon és Singleton 2011). Asztmások fibroblasztjai az egészségesekéhez képest szignifikánsan több hialuronsavat termelnek, ráadásul a leginkább hiperreaktív légutakkal bíró betegek
30
sejtjei a kevésbé hiperreaktív betegekből származó sejteknél is jelentősen többet termeltek (Liang és mtsai 2011, Westergren-Thorsson és mtsai 2002). Az asztmás légutak submucosájában és a simaizomsejtek körül több hialuronsav rakódik le, ami a tüdő biomechanikai tulajdonságait is befolyásolja (Cheng és mtsai 2011). A T sejteken hatva a CD44-hialuronsav kötésnek fontos szerepe lehet a légutak Th2 sejtes infiltrációjában (Katoh és mtsai 2007). Asztmában a bronchiális simaizomzat fokozottan expresszálja a CD44-et, míg ennek antitesttel való kísérletes blokkolása csökkentette a hízósejtek és simaizomsejtek közti adhéziót (Girodet és mtsai 2010). Az alacsony molekulasúlyú hialuronsav fragmentumok a CD44-en kívül toll-like receptorokon (TLR) is hatnak, ezeknek pedig egyre inkább ismert a szerepük asztmában, mind a veleszületett immunitás terén, mind a Th2 válaszban (Liang és mtsai 2011, Lennon és Singleton 2011). In vitro vizsgálatban kimutatták, hogy asztmásokból származó makrofágok CD44 expressziója csökkent mértékű, míg a TLR2 és TLR4 expressziója megnövekedett. Ennek megfelelően ezek a makrofágok érzékenyebben reagáltak az alacsony molekulasúlyú hialuronsavra, azaz több IL-8-at termeltek hialuronsav-stimuláció hatására, ugyanakkor az alacsonyabb CD44 expresszió csökkent hialuronsav eltakarítást okozhat asztmában, ami perzisztáló gyulladáshoz vezet (Liang és mtsai 2011). A hialuronsav az eozinofil sejtek aktivációját és túlélését is serkenti dózisfüggő módon (Ohkawara és mtsai 2000). Glukokortikoid és hosszú hatású β2- agonista hatóanyagok légúti simaizomzatra kifejtett hatását in vitro vizsgálva azt találták, hogy ezek a szerek befolyásolták a simaizomsejtek hialuronsav- metabolizmusát: bár a teljes glikozaminoglikán szekréciójukat csökkentették, mégis ezen belül a nagy molekulasúlyú hialuronsav szekrécióját és depozícióját növelték, de a hialuronsavat kis molekulasúlyú fragmentumokká hasító hialuronidáz enzim termelődését gátolták, míg a CD44 expressziójukat fokozták; így a kezelés csökkentette a légúti simaizomzat proinflammatorikus potenciálját (Papakonstantinou és mtsai 2012).
A fluticason pedig maga a tüdő fibroblasztok hialuronsav termelését is gátolta (Jiang és mtsai 2011).
A hialuronsav szerepét asztmában a klinikumhoz közelebb álló kutatásokban kevés alkalommal vizsgálták. Asztmások BAL mosófolyadékában magasabb szintet mértek, amely korrelált a súlyossággal (Bousquet és mtsai 1991). A köpetben is emelkedett a szintje, amit mepolizumab (anti-IL-5 monoklonális antitest) kezelés csökkenteni tudott,