Síkképlet:
H C C C H
H
H H
H H
H Ábrázolásmódok:
Fűrészbak-projekció: perspektivikus ábrázolásmód:
H
F H
H Br Cl
Newman-projekció: háromdimenziós szerkezetet úgy ábrázol, hogy két egymáshoz kapcsolódó atomot egymás mögé helyez:
H
Cl Br
H
H F
A fűrészbak- és Newman-projekciók kölcsönösen megfelelnek egymásnak:
H
F H
H Br Cl
H
Cl Br
H H F
Fischer-projekció: a háromdimenziós szerkezetből vonalképletet hoz létre. Egy vagy több atom körüli kötéselrendeződéseket lehet szemléltetni vele.
X C
Z
Y
W
C Y X W
Z
11.1.3. A szerves vegyületek felépítése
A szerves vegyületek általában egy szénláncból (vagy szénláncokból) és funkciós csoportokból épülnek fel.
Funkciós csoport: a szerves vegyület molekulájának az a része (atom vagy atomcsoport), amely jelentősen befolyásolja a vegyület fizikai és kémiai tulajdonságait. Például alkoholoknál a hidroxilcsoport (−OH), a karbonsavaknál a karboxilcsoport (−COOH).
A szerves vegyületek építőkockákból, különféle csoportokból épülnek fel. Gyakran a molekulát többféleképpen is feloszthatjuk funkciós csoportokra. Erre néhány példát szeretnénk bemutatni:
Etán:
Metil-acetát:
Paracetamol: N-(p-hidroxifenil)acetamid
Néhány fontos alapfogalom
Konstitúció: a molekulában az atomok kapcsolódási sorrendje.
Konfiguráció: egy szénatom körül az egymással közvetlenül nem kapcsolódó atomok, atomcsoportok viszonylagos térbeli elrendeződését.
Konformációk: a molekula azon lehetséges térszerkezetei, amelyek egy-egy kötéstengely körüli átfordulással átmehetnek egymásba.
Szubsztituens vagy helyettesítő: az adott szénatomhoz kapcsolódó (hidrogéntől eltérő) atom vagy csoport.
Például:
D C Cl F Br
A központi szénatomhoz kapcsolódik egy fluor-, egy klór-, egy bróm- és egy deutérium- szubsztituens. Ezért ezt a szénatomot négyszeresen szubsztituáltnak nevezzük.
A szénatomok rendűsége: megadja, hogy az adott szénatomhoz hány szénatom kapcsolódik a szénláncban.
Ez alapján megkülönböztetünk:
primer: elsőrendű,
szekunder: másodrendű,
tercier: harmadrendű,
kvaterner: negyedrendű szénatomokat.
A telítetlenségek elhelyezkedése a láncban:
Kumulált: a két kettős kötés ugyanahhoz a szénatomhoz kapcsolódik:
−C=C=C−
Konjugált: a két kettős kötés között pontosan egy egyszeres kötés van:
−C=C−C=C−
Izolált: a két kettős kötés között legalább két egyszeres kötés van:
−C=C−C−C=C−, −C=C−C−C−C=C−, stb.
A lánchoz kapcsolódó csoportok elhelyezkedése alapján:
Geminális: a két csoport ugyanahhoz a szénatomhoz kapcsolódik:
C C C X
X
Vicinális: a két csoport egymás melletti szénatomokon található:
C C C C X X
Diszjunkt: a két csoport olyan szénatomokhoz kapcsolódnak, melyek között legalább még egy szénatom található:
C C C C C X X
Aromás gyűrűhöz kapcsolódó csoportok elhelyezkedése alapján:
Orto: a két csoport egymás melletti szénatomokhoz kapcsolódik:
X X
Meta: a két csoport olyan szénatomokhoz kapcsolódik, melyek között a gyűrűben egy szénatom található:
X
X
Para: a két csoport a gyűrű átellenes szénatomjain található:
X
X 11.1.4. A szerves vegyületek nagy számának okai
Felmerül a kérdés, hogy miért ismerünk nagyságrendekkel több szerves vegyületet, mint szervetlent (mintegy 10 millióra tehető az ismert szerves vegyületek száma, míg a szervetlen vegyületeké nagyjából százezres nagyságrendű). A válasz egyrészt a szénatom speciális tulajdonságaiban keresendő, mivel szénatomok egymással gyakorlatilag végtelen számban össze tudnak kapcsolódni igen változatos szerkezeteket és kötésformákat létrehozva. Másrészt igen gyakori, hogy egy adott összegképlethez többféle különböző szerkezetű molekulát is fel tudunk rajzolni. Most ismerkedjünk meg ezekkel részletesebben is!
A szénatom jellemzői:
kisméretű,
viszonylag nagy az elektronegativitása (EN=2,5),
négy kovalens kötés kialakítására képes számos kémiai elemmel (H, O, N, S, P, halogének),
igen erős C−C kötés kialakítására képes,
számos oxidációs fokkal rendelkezhet vegyületeiben (−4-től +4-ig),
változatos kötésszerkezeteket tud kialakítani (például többszörös kötések, aromás gyűrűk stb.),
gyűrűk, láncok létrehozására alkalmas.
11.1.5. Az izoméria
Izomerek: olyan vegyületek, amelyeknek azonos az összegképletük (tapasztalati képletük), de az alkotó atomoknak eltérő a kapcsolódási sorrendje vagy a térbeli helyzete, és emiatt fizikai, illetve kémiai tulajdonságaik eltérőek.
Az izoméria fajtái:
– konstitúciós (szerkezeti) izoméria, – sztereoizoméria (térizoméria).
Konstitúciós (szerkezeti) izoméria: az izomer molekulákban az atomok kapcsolódási sorrendje (konstitúciója) tér el.
Például az etil-alkohol (H3C−CH2−OH) és a dimetil-éter (H3C−O−CH3) konstitúciós izomerek.
Sztereoizoméria (térizoméria): az izomer molekulákban a ligandumok (atomok, atomcsoportok) viszonylagos helyzete tér el, tehát más a konfigurációjuk.
Sztereoizomerek: azonos konstitúciójú, de eltérő szerkezetű, egymásba nem forgatható molekulák. Csak a csoportok térbeli elrendeződésében különböznek egymástól.
A sztereoizomeria fajtái:
– geometriai vagy cisz-transz izoméria, – optikai izoméria.
Geometriai vagy cisz-transz izoméria: a geometriai izoméria a kötés gátolt rotációja miatt alakul ki.
Feltétele, hogy a kettős kötéssel kapcsolódó szénatom pár mindegyikén két különböző csoport legyen. Például a but-2-én esetén a két izomer:
A gátolt rotációt nemcsak kettős kötés okozhatja, hanem például kötött geometriájú gyűrű is. Itt csak a legegyszerűbb háromtagú gyűrűt mutatjuk be, ám nagyobb tagszámú gyűrűk esetén is felléphet cisz-transz izoméria.
Optikai izoméria
Királis molekula: a molekula a tükörképével nem hozható fedésbe. A királis molekulákra jellemző az optikai aktivitás. Az optikai aktivitás azt jelenti, hogy a síkban polarizált fény síkját az egyik molekula jobbra, a másik molekula balra forgatja el azonos szöggel.
Megjegyzés: nem csak molekulák lehetnek királisak. Például a kezünk és a lábunk is királis, mivel nem hozható fedésbe a tükörképével.
A nem királis molekulákat (objektumokat) akirálisnak nevezzük. Az akirális molekulák fedésbe hozhatók tükörképükkel.
Királis szénatom: négy különböző csoport (ideértendő az atom is) kapcsolódik hozzá. A királis szénatomot tartalmazó vegyületeket két csoportra oszthatjuk: az egy királis szénatomot tartalmazó molekulák mindig királisak, ám abban az esetben, ha több királis szénatom (aszimmetriacentrum) is található a molekulában, nem szükségszerű, hogy a molekula királis legyen (lásd később).
Az optikai izoméria nem csak királis szénatomot tartalmazó molekulák esetén léphet fel, ám ezen vegyületekre is jellemző az optikai aktivitás.
Például a bután-2-olnak két sztereoizomerje létezik, amelyek egymásnak tükörképi párjai:
11.1.5.1. animáció: Tükörképi párok
A két molekula enantiomerpárt, vagyis egymással nem azonos tükörképi párt alkot. A királis molekula tükörképe nem azonos önmagával és mindkét molekula optikailag aktív. A négy különböző helyettesítővel rendelkező királis szénatomnak az enentiomerpároknál más a térbeli elrendeződése, más a két molekulában a konfiguráció.
Az optikai sztereoizomerek száma 2n képlettel számolható, ahol n a királis szénatomok száma, amennyiben nincs belső szimmetriasíkja a molekulának (lásd később).
Ha a szerves vegyületben több királis szénatom is található, diasztereomernek nevezzük azt a sztereoizomert, amely nem tükörképi párja a vizsgált molekulának.
Például a 3-bróm-butan-2-ol négy optikai izomerje:
Az a) és b) enantiomerpárok (tükörképi párok), a)-val c), illetve d) nem enantiomer-, hanem diasztereomerviszonyban áll.
Az élő szervezetben a legtöbb molekula királis, de a természetben sokszor csak az egyik enantiomer fordul elő. A két izomer azonos fizikai tulajdonságokkal rendelkezik (ám a forgatásuk ellentétes irányú), de a biológiai tulajdonságuk eltér. Akirális molekulákkal reagálva a két enantiomer hasonló reakciót eredményez, ám a termék térszerkezetét csak a reakció alapos megismerésével lehet előre jelezni. (Ha a termék konfigurációja azonos a kiindulási anyagéval, retenció történik, ha ellentétes, akkor inverzióról beszélünk.)
Fontos hangsúlyozni, hogy a diasztereomer kifejezés nem csak a kiralitással áll összefüggésben:
például a cisz-transz izomerek is diasztereomerviszonyban vannak egymással, mivel nem azonosak és
nem is tükörképei egymásnak. (A diasztereomerek olyan sztereoizomerek, melyek nem tükörképei egymásnak.)
Racemát: a két enantiomer 1 : 1 arányú elegye vagy keveréke. A racém elegy optikailag inaktív, mert a két enantiomer forgatása kiegyenlíti egymást.
Reszolválás: a racém elegy szétválasztása. Ennek gyakori módja, hogy a két enantiomert királis molekulával reagáltatják, melynek során diasztereomerek keletkeznek, melyeknek már eltérőek a fizikai tulajdonságai. Például racém tejsavat (H3C−CH(OH)−COOH) királis bázis egyik tiszta enantiomerjével reagáltatva két só keletkezik, melyek már diasztereomer viszonyban állnak egymással, így például eltér az oldhatóságuk. Kedvező esetben frakcionált kristályosítással elválaszthatóak a diasztereomer sópárok, és ezekből kinyerhetők a tiszta enantiomerek. Napjainkban igen gyakori a királis vegyületek – gyakran biológiai úton történő – enantiomertiszta előállítása.
Mezo-vegyület: ha molekulának van belső tükörsíkja, akirális (optikailag inaktív) vegyületet kapunk. Például a mezo-borkősav.
Jól megfigyelhető, hogy a belső szimmetriasík csökkenti az izomerek számát, mivel a belső szimmetriasíkkal rendelkező molekula azonos a tükörképi párjával, így akirális.
Érdekességként megemlíthető, hogy az 1,2-dimetil-ciklopropán transz izomerje (a és b) is királis, míg a belső szimmetriasíkkal rendelkező cisz izomer (c) akirális:
H3C H
H CH3
CH3 H H3C
H CH3 H H
H3C
mezo c)
a) b)
Ezen vegyületek konstitúciós izomerjei például: metil-ciklobután (d), ciklopentán (e), pent-1-én (f), cisz- (g) és transz-pent-2-én (h), 2-metil-but-2-én (i).
CH3
d) e)
C C C C
H3C
CH2 H3C CH2
H H
H H CH3
CH3 C C
H
CH2 H
H
C C H3C
CH3 H3C
H CH2
CH3
f) g) h) i)
Így az a) és c), b) és c), illetve g) és h) szerkezetek diasztereomer viszonyban állnak.
Mint korábban említettük, a kiralitásnak nem szükséges feltétele, hogy a molekula rendelkezzen királis szénatommal. (Az aszimmetriás szénatom következtében létrejött kiralitást szokás centrális kiralitásnak nevezni.) Az alábbiakban erre is szeretnénk bemutatni néhány példát az érdekesség kedvéért.
Axiális (tengelyes) kiralitás: például allénvegyületek (C=C=C egységet tartalmazó vegyületek) esetén lép fel, ha a szénatomokhoz különböző szubsztituensek kapcsolódnak.
C C C Cl
H Cl
H C C C
Cl
Cl H H
Atropizoméria: gátolt rotáció esetén jön létre. Az atropizoméria az axiális kiralitás egyik fajtája.
Például bifenilek esetén különböző és megfelelően nagy szubsztituenseket alkalmazva atropizomereket kapunk:
NO2
COOH O2N HOOC
O2N
HOOC NO2 COOH
Helikális kiralitás: spirálszerűen „tekeredő” molekulák esetén a jobbra és balra csavarodó spirál egymás tükörképe:
11.1.6. A szerves vegyületek csoportosítása
A szénváz alapján:
alifás:
o nyílt láncú (aciklusos):
el nem ágazó (normális),
elágazó láncú, o gyűrűs (ciklusos, alicklusos),
aromás.
Megjegyzés: az alifás kifejezés bizonyos irodalmakban nyílt láncú szénhidrogént jelent. Az IUPAC jelenlegi ajánlása alapján az alifás olyan szénhidrogént jelent, mely nem aromás.
Az alifás vegyületekben a szénatomok közötti kötés fajtája szerint tovább csoportosíthatunk:
telített (csak szén-szén egyszeres kötést tartalmaz),
telítetlen:
o szén-szén kettős kötést (kötéseket) tartalmazó, o szén-szén hármas kötést (kötéseket) tartalmazó,
o esetleg szén-szén kettős és hármas kötést is tartalmazó vegyületek.
A funkciós (jellemző) csoportok alapján:
A legfontosabb funkciós csoportok és vegyületcsoportok:
Funkciós csoport Vegyületcsoport Képlet Példa
Alkil Alkánok −(CH2)nCH3
bután
Alkenil Alkének
C C C CH
H H
H etén
Alkinil Alkinek C C HC CH
etin
Aril Aromás vegyületek aromás gyűrű,
például fenil: OH
fenil-metanol
Halogén Halogénszármazékok −X
fluoro: −F kloro: −Cl bromo: −Br jodo: −I
Cl
2-klór-propán
Hidroxi Alkoholok (nem
aromás csoporthoz kapcsolódik)
Fenolok (aromás csoporthoz
kapcsolódik)
O H OH
butanol (butil-alkohol) OH
fenol
Éter Éterek O O
dietil-éter
Aldehid Aldehidek
C O H
H3C C O H acetaldehid Keton (karbonil) Ketonok
C O
H3C C CH3 O
aceton
Karboxil Karbonsavak
C O O H
HCOOH hnagyasav
Észter Észterek
C O O
H3C C O O C2H5 etil-acetát
Amino Aminok primer:
N H H
NH2 etil-amin szekunder:
N H
NH dipropil-amin tercier:
N H3C N
CH3 CH3 trimetil-amin kvaterner:
N+
CH3 N+ H3C CHCH3 3
tetrametil-ammónium ion
Amid Amidok
C O N
H3C C O NH2 acetamid
Nitro Nitrovegyületek
N O O
NO2
nitro-benzol
Szulfhidril Tiolok S
H SH
etántiol
Szulfid Szulfidok (tiéterek) S
H3C S CH3 dimetil-szulfid A szerves vegyületek elemi összetétele alapján:
– Szénhidrogének: csak szénből és hidrogénből épülnek fel.
Alifás szénhidrogének:
o Telített szénhidrogének:
Alkánok: nyílt láncú szénhidrogének, melyekben csak egyszeres (ζ) kötés van a szénatomok között.
Cikloalkánok: gyűrűs telített szénhidrogének, csak ζ-kötés van a szénatomok között.
o Telítetlen szénhidrogének:
Alkének: legalább egy szénatompár között kettős kötés (C=C) található a szénhidrogén-molekulában.
Alkinek: legalább egy szénatompár közt hármas kötés (C≡C) található a szénhidrogénben.
Aromás vegyületek: aromás delokalizációval rendelkező gyűrűs vegyületek.
– Heteroatomot tartalmazó szerves vegyületek:
A szén- és hidrogénatomokon kívül a molekula tartalmaz heteroatomot, azaz halogén-, oxigén-, nitrogén-, kén- stb. atomot.
A teljesség igénye nélkül lehetnek például:
– Halogéntartalmú vegyületek
Halogénatomot (fluort, klórt, brómot, jódot) tartalmaznak.
– Oxigénatomot tartalmazó vegyületek
Alkoholok, fenolok, enolok: −OH, hidroxilcsoportot tartalmaznak.
Éterek: R−O−R’, étercsoport van bennük.
Oxovegyületek: =O, oxocsoportot tartalmaznak.
o Aldehidek: −CHO, aldehidcsoportot tartalmaznak.
o Ketonok: C=O, karbonilcsoportot tartalmaznak, helyhez egy-egy szénatom kapcsolódik.
o Karbonsavak: −COOH, karboxilcsoportot tartalmaznak.
o Észterek: −COO− észtercsoport található bennük.
o Amidok: −CO−NH−, amidcsoportot tartalmaznak.
Egyéb vegyületek.
– Nitrogénatomot tartalmazó vegyületek
Aminok: −NH2 aminocsoportot tartalmaznak.
Amidok: −CO−NH− amidcsoport található bennük.
Nitrovegyületek: −NO2, nitrocsoport van bennük.
Nitrogéntartalmú heterociklusos vegyületek.
– Kénatomot tartalmazó vegyületek:
Tiolok: −SH, tiolcsoportot (szulfhidrilcsoportot) tartalmaznak.
Tioéterek (szulfidok): −S−, szulfidcsoport található bennük.
Diszulfidok: −S−S−, diszulfidcsoportot tartalmaznak.
Szulfonsavak: −SO3H, szulfonsavcsoport található bennük.
11.1.7. A homológ sor fogalma:
A különböző szerves vegyületek olyan sora, ahol az egymást követő tagok egy metiléncsoportban (CH2) különböznek.
Például: alkánok homológ sora, karbonsavak homológ sora, alkoholok homológ sora.
11.1.8. A szerves kémiai reakciók alapvető fajtái:
Szubsztitúció (kicserélődés): egy molekula atomja vagy atomcsoportja másik atomra vagy atomcsoportra cserélődik ki, melléktermék keletkezése mellett.
Jele: S
H3C CH2
CH2 OH H3C
CH2 CH2
Cl + NaOH + NaCl
Addíció (egyesülés): két vagy több molekulából egy molekula keletkezik melléktermék keletkezése nélkül.
Jele: A
H2C CH2 C
H2 H2 C Br Br Br2
+
Elimináció: egy molekulából kettő vagy több molekula keletkezik. Gyakran egy kis molekula (például hidrogén-halogenid, víz stb.) szakad ki a nagyobb molekulából.
Jele: E
H2C CH2 + HOH H C C OH
H H
H H
Izomerizáció: egy molekulából annak izomerje keletkezik, így tulajdonképpen egy átrendeződés.
H2C CH OH H3C C O H
Kondenzáció: két vagy több molekulából egy molekula képződik kis molekulájú melléktermék keletkezése közben.
R' CH2
OH + H2O
R C
OH O
+
R C
O O
CH2 R'
Polimerizáció: kis molekulák (monomerek) óriásmolekulává alakulnak, melléktermék keletkezése nélkül.
Jele: P
CH2CH2 CH2
H2C n
n
Polikondenzáció: kis molekulájú monomerekből óriásmolekula képződik kis molekulájú melléktermék (például víz, ammónia, hidrogén-halogenid stb.) keletkezése közben.
n + n H2O
N (CH2)6 H
H
+ n N
H
H
C (CH2)4 HO
O
C O
OH
N (CH2)6 H
N H
C O
(CH2)4 C O n
Oxidáció és redukció
Oxidáció: a hidrogénatomok száma csökken vagy az oxigénatomok száma nő a molekulában. (A szénatom oxidációfoka nő.)
: a hidrogénatomok száma nő vagy az oxigénatomok száma csökken a molekulában. (A szénatom oxidációfoka csökken.)
11.1.9. A nevezéktan szabályai
A szerves vegyületek elnevezése szempontjából meg kell különböztetnünk a szénláncot és a funkciós csoportot. Először a funkciós csoportot nem tartalmazó telített szénhidrogének elnevezésével foglalkozunk.
Telített szénhidrogének elnevezése
1. Megkeressük a leghosszabb szénláncot (alaplánc).
2. Amennyiben több azonos hosszúságú is van, akkor azt választjuk, amelyiknél több az elágazás.
3. Elnevezzük az alapláncot a szénatomszámnak megfelelően:
1 metán 6 hexán
2 etán 7 heptán
3 propán 8 oktán
4 bután 9 nonán
5 propán 10 dekán
4. Attól a láncvégről kezdjük számozni a szénatomokat, amelyhez legközelebb esik az elágazás.
Ha a láncvégtől két elágazás azonos helyzetben van, akkor az ábécérendben előbb álló kapja a kisebb számot.
5. A helyettesítőket, oldalláncokat az alaplánc neve előtt, ábécérendben felsoroljuk a helyzetüket megadó számmal együtt.
6. Ha az azonos csoport többször szerepel di-, tri-, tetra- stb. szócskával jelezzük. Ezek a sokszorozótagok nem számítanak az 5. pont szerinti ábécérendbe.
1 mono- 6 hexa-
2 di- 7 hepta-
3 tri- 8 okta-
4 tetra- 9 nona-
5 penta- 10 deka-
Az alábbi ábrákon az alapláncot zölddel jelöljük.
2-metil-bután 2,3-dimetil-bután 3,4-dimetil-hexán 2,2,4-trimetil- pentán
3,3-dimetil-hexán 2,4,4-trimetil-hexán 3-etil-5-metil-heptán 5-etil-3,3-dimetil- heptán
Telítetlen szénhidrogének elnevezése
1. Megkeressük azt a szénláncot, amely a legtöbb telítetlenséget tartalmazza. Ha több ilyen is van, akkor a több szénatomot tartalmazót válasszuk! Amennyiben ebből is több van, azt választjuk, melyben több a kettős kötés.
2. Úgy számozzuk a láncot, hogy minél kisebb számot kapjanak a kettős és hármas kötések. Ha több ilyen is van, akkor a kettős kötések száma legyen a legkisebb.
3. A helyettesítőket, oldalláncokat az alaplánc neve előtt, ábécérendben felsoroljuk a helyzetüket megadó számmal együtt.
4. Ha az azonos csoport többször szerepel, di-, tri-, tetra- stb. szócskával jelezzük.
5. Az alapláncot elnevezzük a szénatomszám alapján: a megfelelő alkán nevéből eltávolítjuk az -án végződést, mely helyett kettős kötések esetén -én, hármas kötések esetén -in végződést alkalmazunk. A végződés előtt jelöljük a telítetlenségek helyét (a kisebbik számú szénatomot).
A kettős kötés végződése megelőzi a hármas kötését.
hex-2-in 3-metil-
but-1-én buta-1,3-dién 3,3-dimetil-hex-1-in
but-1-én-3-in 3-pentil-penta-1,4-diin 2-etil-3-metil- pent-1-én
4,4-dimetil- hex-1-én-5-in
Funkciós csoportot tartalmazó vegyületek elnevezése
1. Megkeressük azt a szénláncot, mely a legtöbb utótagként megnevezhető funkciós csoportot tartalmazza. (Például a halogén- és nitrocsoport csak előtagként nevezhető meg.) Ha több ilyen is van, akkor a legtöbb többszörös kötést tartalmazót válasszuk! Amennyiben ebből is több van, azt választjuk, melyben a több szénatomot (illetve ezután a legtöbb a kettős kötést) tartalmazza.
2. Megállapítjuk a fő funkciós csoportot (amennyiben több is van). Ezt az alábbi prioritási sorrend alapján határozzuk meg (a legalacsonyabb prioritású csoport a fő funkciós csoport).
Prioritás Név Csoport Előtag Utótag
1 karbonsav −COOH karboxi- -karbonsav
2 észter −COOR R-oxikarbonil- -oát
3 amid −CONH2 karbamoil- -amid
4 aldehid −CHO formil- -al
5 keton −CO− oxo- -on
6 alkohol −OH hidroxi- -ol
7 fenol −OH hidroxi- -ol
8 amin −NH2 amino- -amin
9 éter −O− alkoxi-
10 halogén −X halogén-
3. Az alapláncot elnevezzük a fő funkciós csoport alapján: a megfelelő alkán, alkén stb. nevéhez a fenti utótagot illesztjük.
4. Úgy számozzuk a láncot, hogy minél kisebb számot kapjanak a funkciós csoportok. Ha több ilyen is van, akkor a többszörös kötések száma legyen a legkisebb.
5. A helyettesítőket, oldalláncokat az alaplánc neve előtt, ábécérendben felsoroljuk a helyzetüket megadó számmal együtt.
6. Ha az azonos csoport többször szerepel di-, tri-, tetra- stb. szócskával jelezzük.
OH O
O O
NH2 O
H O
hexánkarbonsav etil-hexanoát hexánamid hexanal
O OH NH2 Cl
hexan-3-on hexan-3-ol hexán-3-amin 3-klór-hexán
O OH
O
O O
OH
O OH
OH
4-oxo-hexánkarbonsav 4-oxo-hexanal 6-hidroxi-hexan-3-on hexán-1,4-diol
O O OH
O OH O
HO
H O
1-etoxi-propán 3-etoxi-propan-1-ol but-2-indikarbonsav hex-4-énal Egyszerűbb gyűrűs vegyületek elnevezése
A gyűrű számozásánál a legkisebb számot a legalacsonyabb prioritású helyettesítő kapja.
OH
OH
COOH OH
CH3
CH3
NH2
COOH OH
ciklohexán-1,3-diol 2-hidroxi-benzoesav 1,2-dimetil-ciklobután 5-amino-2-hidroxi- benzoesav NH2
OH
CHO
O
Cl Cl
4-amino-fenol ciklopent-2-
énkarbaldehid ciklohex-2-énon 1,2-diklór- cikloprop-1-én
11.2. Alkánok
11.2.1. Alkánok: telített, nyílt láncú szénhidrogének (így maximális a hidrogéntartalmuk a többi szénhidrogénnel összehasonlítva).
Az alkánok nevei -án végződésűek.
Az alkánok régies elnevezése: paraffinok.
11.2.2. Homológ sor, egyszerűbb képviselők és elnevezésük Az alkánok általános összegképlete: CnH2n+2
CH4 metán
C2H6 etán H3C−CH3
C3H8 propán H3C−CH2−CH3
C4H10 bután két konstitúciós (szerkezeti) izomerje van:
H3C CH2
CH2 CH3
CH3 H3C CH
CH3
H3C−CH2−CH3 HC(CH3)3
normál bután (n-bután)
izobután (i-bután) Alkilcsoport: az alkánból egy hidrogénatom eltávolításával keletkező csoport.
Az alkilcsoportok nevei -il végződésűek.
Jele: R.
H3C− metilcsoport
H3C−CH2− etilcsoport
H3C−CH2−CH2− propilcsoport (egyenes) (H3C)2CH− izopropilcsoport (elágazó) H3C−CH2−CH2−CH2− butilcsoport (egyenes) (H3C)2CH−CH2−CH2− izobutilcsoport (elágazó)
H3C−CH2−CH(CH3)− szek-butilcsoport (elágazó, szekunder szénatommal kapcsolódik)
(H3C)3C− terc-butilcsoport (elágazó, tercier szénatommal kapcsolódik) 11.2.3. Előállítás
A földgáz főleg metánt és C2–C4-es gáz-halmazállapotú alkánokat tartalmaz.
A kőolaj folyékony szénhidrogének elegye, amely oldva tartalmaz gáz- és szilárd halmazállapotú alkánokat is.
a) Desztillációs elválasztás
A kőolaj frakcionált desztillációjával különböző szénatomszámú szénhidrogének elegyét lehet előállítani (a desztilláció párlatait nyers párlatoknak nevezik).
– Nyersbenzin: forráspontja 50–150 °C (C5–C10 szénatomszámú frakció),
– Petróleum vagy petrolátum: a kerozin alapanyaga, forráspontja 150–250 °C (C11–C12), – Nyersgázolaj: a dízelolaj alapanyaga, forráspont 250–350 oC (C13-C15),
– Pakura, fenéktermék: a forráspontja 350 °C feletti, fűtőanyagként használják, vagy további vákuumdesztillációnak vetik alá.
A pakura vákuumdesztillációjával: finom-, közép- és nehézkenőolaj-párlatokat, illetve gudront, a bitumen-, illetve aszfaltgyártás alapanyagát állítják elő.
b) Kémiai előállítás
– a kőolajlepárlás nyerspárlataiból krakkolással (lásd később), majd a telítetlen komponensek hidrogénezésével.
– szén-monoxid és hidrogéngáz reakciójával, melyet átmenetifém (Fe, Co, Ni, Ru) katalizátorral végeznek (Fischer–Tropsch-eljárás).
11.2.4. Szerkezet – Metán, CH4.
Szabályos tetraéder alakú molekula, a H−C−H kötésszög 109,5 o. H
C H HH – Etán, H3C−CH3.
A C−C kötéstengely elfordulásával létrejövő két szélső konformációs állás a nyitott állás és a fedő állás. Ennek oka, hogy a C−C kötés tengelye körül a két metilcsoport elfordulhat (szabad rotáció). A nyitott állás energetikailag kedvezőbb.
H
H H
H
H H H
H H H
H H
fedő állás nyitott állás
11.2.4.1. animáció: Az etán térszerkezete Nagyobb szénatom számú alkánok szerkezete
A szén körüli elrendeződés továbbra is tetraéderes, bár a kötésszögek az eltérő térkitöltésű csoportok miatt már nem azonos a metánban találhatóval. A nem elágazó szénláncú alkánok lánca cikkcakkos, és energetikailag kedvezőbb a nyitott állású. Megjegyzendő, hogy a hosszabb szénláncú szénhidrogének egy adott izomerjének számos konformációja lehetséges, melyek között rendszerint igen csekély az energiakülönbség. A normál hexán cikkcakkos láncelrendeződése:
Izomerek: a butánnak már van két konstitúciós izomerje, majd a szénatomszám növekedésével az izomerek száma egyre nő (például a nonánnak 35, míg a dekánnak 75 konstitúciós izomerje van). A heptántól kezdve a konstitúciós izomerek mellett már optikai izomerek is lehetségesek.
Képlet Név Konstitúciós izomer Összes izomer
C4H10 bután 2 2
C5H12 pentán 3 3
C6H14 hexán 5 5
C7H16 heptán 9 11
C8H18 oktán 18 24
11.2.5. Fizikai tulajdonságok
– Mint minden szénhidrogén, az alkánok is apolárisak. Az apoláris molekulák között csak a leggyengébb másodrendű kötés, a diszperziós kötés hat.
– Olvadás- és forráspontjuk, továbbá a sűrűségük is a moláris tömeggel nő. Az egyes izomerek eltérő tulajdonsággal rendelkeznek. Azonos moláris tömegnél többnyire az elágazó izomerek olvadáspontja nagyobb, a normális (el nem ágazó) láncúnak a forráspontja a magasabb.
– A C1–C4 szénatomszámúak gáz-halmazállapotúak, az el nem ágazó láncú C5–C16
szénatomszámúak folyadékok, C17-től pedig szilárdak 25 C hőmérsékleten és normál légköri nyomáson.
– Mivel apolárisak, vízben rosszul oldódnak.
– A sűrűségük kisebb a víz sűrűségénél, ezért a víz felszínén helyezkednek el. (Megjegyzés:
vízzel nem lehet oltani a benzint, mely bizonyos alkánok elegye!) 11.2.6. Kémiai tulajdonságok és reaktivitás
A paraffin elnevezés kicsi reakciókészséget jelent [parum (= kevéssé) + affinis (= képesség) latin szavak összetételéből származik].
A kis reakciókészség oka a molekulában lévő kötések nagy kötési energiája. (A C−C egyszeres kötés kötésfelszakítási energiája 344 kJ/mol, a C−H kötésé pedig 315 kJ/mol).
Szobahőmérsékleten gyakorlatilag nem vihetők spontán reakcióba. Melegítve vagy ultraibolya fénnyel (UV-fénnyel) megvilágítva reakcióba vihetők, és ilyenkor a jellemző reakciótípusúk a szubsztitúció.
a) Halogénezés
Halogénezés: olyan kémiai folyamat, amikor a szerves vegyületbe halogénatomot (F, Cl, Br, I) viszünk be.
Kis reakciókészségük miatt az alkánok csak erélyes körülmények között halogénezhetőek (ezért a brómos vizet közönséges körülmények közt nem színtelenítik el).
Például a metán klórozása magas hőmérsékleten vagy UV-fény hatására:
CH4 + Cl2 H3C Cl + HCl
A termék szabályos neve: klórmetán (köznapi vagy triviális név: metil-klorid).
A reakció a szubsztitúciós reakciók csoportjába tartozik: egy hidrogénatomot „cserélünk ki”
klóratomra.
Ez más részről egy láncreakció, melyben a láncvivő részecskék a gyökök. (A gyök párosítatlan elektronnal rendelkező, nagy reakcióképességű részecske.)
A láncreakció első lépése (láncindítás) a gyökök keletkezése:
Cl2 2 Cl
(A kötés felszakításához szükséges a hő vagy a nagy energiájú fény.)
A klórgyök egy metánmolekuláról leszakít egy hidrogénatomot, így egy metilgyök keletkezik:
Cl CH3
CH4 + + HCl
A metilgyök egy klórmolekulával ütközve – a klór-metán keletkezése mellett – klórgyököt generál:
Cl2
+ H3C Cl + Cl CH3
A klórgyök és a metilgyök láncvivő szerepet tölt be.
A lánczáró lépések a gyökök összekapcsolódása:
CH3 + Cl H3C Cl Cl2 2 Cl
A reakcióban többféle termék is keletkezhet: a klór-metán tovább reagálhat a klórral, és így diklór-metán, triklór-metán (kloroform) és tetraklór-metán (szén-tetraklorid) keletkezhet. Ezen vegyületek keletkezésének reakcióegyenletei:
CH4 + 2 Cl2 CH2Cl2 + HCl CH4 + 3 Cl2 CHCl3 + HCl CH4 + 4 Cl2 CCl4 + HCl
2 3 4
Megjegyzés: a klórozás és brómozás jól irányítható, ám a fluorozás igen heves reakció. A paraffinok elemi jóddal nem reagálnak.
b) Hőbontás (levegőtől elzárt térben hevítés)
– 650 °C-ig a hőbontás primer folyamata a krakkolás, azaz C−C kötés felbontása (láncszakadás), amelynek során a kiindulási alkánnál rövidebb szénláncú alkánok és alkének keletkeznek.
H3C CH2
H2
C CH3 H3C CH3 + H2C CH2
– 650 °C felett pirolízisről beszélünk, mert a C−C kötés felbomlásával párhuzamosan a C−H kötések felbontása is lejátszódik (dehidrogénezés) és a telített és telítetlen szénhidrogének mellett hidrogéngáz és korom is keletkezik.
H3C CH2
H2 C C
H2 H2 C C
H2 H2
C CH3 4 H2C CH2 + H2
c) Égés
Az égés tulajdonképpen az alkánok oxidációja, melynek során rendszerint igen jelentős energia szabadul fel.
Tökéletes égés esetén szén-dioxid és víz keletkezik:
CH4 + 4 O2 CO2 + 2 H2O
Egy CnH2n+2 általános összegképlettel leírható alkán tökéletes égése:
A részleges (parciális) oxidáció úgynevezett szintézis gázelegyet eredményez:
CH4 + 0,5 O2 CO + 2 H2
Egy alkán tökéletes égésének általános reakcióegyenlete:
CnH2n+2 + 3n+1 O2 n CO2 + (n+1) H2O 2
11.2.7. Felhasználás
a) Energiahordozók (tüzelőanyagok és üzemanyagok)
Oktánszám (a benzin kompressziótűrésének mértéke): megmutatja, hogy a benzin kompressziótűrése hány %-os izooktántartalmú izooktán–heptán modellelegy kompressziótűrésével egyezik meg.
Az izooktán (2,2,4-trimetil-pentán) kompressziótűrése igen jó (oktánszáma 100), a heptáné rossz (oktánszáma 0).
Az oktánszám nem csak 0 és 100 közötti értéket vehet fel (például a benzol oktánszáma 137).
Cetánszám (a gázolaj vagy dízelolaj öngyulladási tulajdonságait méri): megmutatja, hogy a gázolaj öngyulladási tulajdonsága hány %-os cetántartalmú cetán–1-metil-naftalin modellelegy tulajdonságaival egyezik meg.
A cetán (egyenes láncú hexadekán: C16H34) öngyulladóképessége kiváló, míg az 1-metil-naftaliné igen csekély.
b) Ipari méretű szintézisek segítségével különféle alapanyagokat lehet előállítani, amellyel a petrolkémia foglalkozik.
Például a szintézisgázból metil-alkoholt lehet előállítani katalitikus úton:
CO + 2 H2 H3C OH
11.2.8. Legfontosabb képviselők Metán (CH4):
– színtelen, szagtalan, normál légköri nyomáson −182 °C olvadáspontú és −161 °C forráspontú, a levegőnél kisebb sűrűségű gáz 25 C hőmérsékleten és normál légköri nyomáson,
– éghető, a levegővel robbanóelegyet képez (a bányákban a sújtólégrobbanás okozója), – apoláris, vízben rosszul oldódik, de apoláris oldószerben, például benzinben jól oldódik, – tüzelőanyag,
– szintézisgáz, etilén, acetilén, kloroform stb. előállítására használják.
11.3. Cikloalkánok
11.3.1. Cikloalkánok: telített, gyűrűs szénhidrogének.
A cikloalkánok nevei a ciklo- előtaggal kezdődnek és -án utótagra végződnek.
Általános összegképlet: CnH2n
11.3.2. Homológ sor, egyszerűbb képviselők és elnevezésük
Név Összegképlet Szerkezeti képlet
Ciklopropán C3H6
Ciklobután C4H8
Ciklopentán C5H10
Ciklohexán C6H12
Cikloheptán C7H14
11.3.3. Szerkezet
Legstabilabb az öt-, a hat- és héttagú gyűrű. A ciklopropán kivételével a cikloalkánok gyűrűje nem planáris szerkezetű. Itt részletesen csak a ciklohexán szerkezetével foglalkozunk.
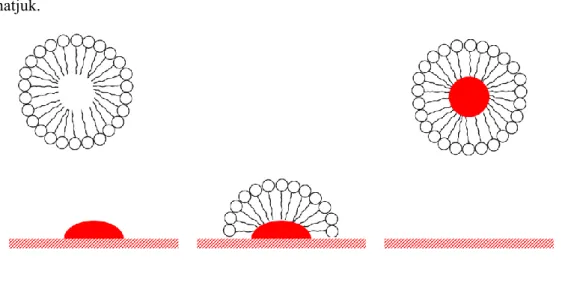
A ciklohexán két szélső konformációja: a szék és a kád, ám emellett más – kevésbé fontos – konformációk is lehetségesek. A Fischer-projekción jól megfigyelhető, hogy a székkonformáció esetén a csoportok nyitott állásban vannak, míg a kádkonformáció esetén fedő állás jön létre, mely energetikailag kedvezőtlenebb. Ezért a székkonformáció a stabilabb. A két konformáció között egyensúly áll fenn, a konformációk könnyen egymásba tudnak alakulni.
szék kád
A molekulában kétféle helyzetű hidrogénatom van, az egyik helyzete: a székkonformáció közepén áthaladó képzeletbeli tengellyel párhuzamos (lefelé-, felfelé mutató) axiális (a) helyzet, a másik, a kifelé mutató ekvatoriális (e) helyzetű.
a e
a
e a
a a e e
e a
e
11.4. Alkének
11.4.1. Alkének: szén-szén kettős kötést tartalmazó telítetlen szénhidrogének.
Az alkének nevei -én végződésűek.
Az alkének régies elnevezése: olefinek.
Az alkének csoportosítása – A szénlánc jellege szerint:
– nyílt láncú, – gyűrűs.
– A kettős kötés száma alapján:
– monoolefinek: alkének, egy kettős kötés, – diolefin: alkadién, két kettős kötés, – poliolefin: alkapolién, sok kettős kötés.
– A kettős kötés helyzete alapján:
−C=C=C− kumulált,
−C=C−C=C− konjugált (legstabilabb), ha sok ilyen van színes a vegyület, −C=C−C−C=C− izolált.
11.4.2. Homológ sor, egyszerűbb képviselők és elnevezésük Általános összegképlet: CnH2n
Képlet Név Triviális név
H2C=CH2 etén etilén
H2C=CH−CH3 propén propilén
Alkenilcsoport: egy alkénből egy hidrogén eltávolításával keletkező csoport.
Képlet Név Triviális név
H2C=CH− etenil vinil
H3C−CH=CH− 1-propenil
H2C=CH−CH2− 2-propenil allil
H2C=C(CH3)− 1-metil-etenil izopropenil
A konstitúciós izomerek száma nagyobb az alkánokénál, mert a kettős kötés helye szerint is különbözhetnek a molekulák.
Például a buténnek (C4H8) a kettős kötés helyzete alapján két (helyzeti) konstitúciós izomerje van:
H2C=CH−CH2−CH3 H3C−CH=CH−CH3
but-1-én but-2-én
A but-2-énnél és minden olyan alkén esetében, ahol a kettős kötés mindkét szénatomjához különböző atomok, atomcsoportok kapcsolódnak, fellép a geometriai izoméria is.
C C C C
H3C
CH3
H3C CH3 H
H
H H
transz-but-2-én cisz-but-2-én
(Ne feledjük, az izoméria oka ebben az esetben a szén-szén kettős kötés gátolt rotációja! A π- kötés a molekula síkja alatt és felett helyezkedik el, ezért a két sztereoizomer nem tud átalakulni egymásba.)
A cisz-transz izomerek fizikai és kémiai tulajdonságai eltérnek: például a cisz-but-2-én forráspontja normál légköri nyomáson 4 °C, míg a transz-but-2-éné 1 °C.
11.4.3. Előállítás
a) Alkánok dehidrogénezésével
A dehidrogénezés olyan szerves kémiai folyamat, ahol hidrogén eltávolítása valósul meg.
Alkánok levegőtől elzárt hevítésével alkének állíthatóak elő. Az alábbi reakció egy dehidrogénezésnek tekinthető:
R CH2 CH2 R
R CH CH
R + 2 H2
Például etán 700–900 °C hőmérsékleten etánból etilént lehet előállítani.
b) Kőolajpárlatok hőbontásával
Krakkolás során alkánok és alkének keletkeznek. Magas hőmérsékleten dehidrogéneződés is végbemegy, ilyenkor alkinek is keletkezhetnek. Az egyes szénhidrogéneket desztillációval lehet szétválasztani.
C8H18 3 H2C CH2 + HC CH + 2 H2 c) Eliminációval
– Halogénszármazékból eliminációval
Például klór-etánból tömény nátrium-hidroxid-oldat hatására etiléngáz képződik:
H2C CH2 + HCl H C C Cl
H H
H H
A reakcióban természetesen nem hidrogén-klorid keletkezik, hanem a lúgos közeg (NaOH) következtében nátrium-klorid és víz. A fenti formában felírva az egyenletet azonban az elimináció ténye sokkal szemléletesebben bemutatható.
Hidrogén-halogenid eliminációjakor a Zajcev-szabály érvényesül: a proton mindig a magasabb rendű szénatomtól lép ki. (Azaz a proton mindig onnan lép ki, ahol eleve kevesebb van.)
Így a 2-klór-butánból elsősorban but-2-én keletkezik (but-1-én sokkal kisebb mennyiségben keletkezik):
H3C CH
HC CH3 H3C
C C
CH3 + HCl
H H H Cl
– Alkoholokból vízeliminációval
Például etil-alkoholból vízelvonó szer (például tömény kénsav) hatására magas (160 °C fölött) etilén keletkezik:
H2C CH2 + HOH H C C OH
H H
H H 11.4.4. Szerkezet
Az etén szerkezete:
A molekulában mind a hat atom egy síkban van. A H−C−H kötésszög kisebb, mint 120 o, ennek oka a π-kötés nagyobb térigénye.
C C H H H
H
A szén-szén kettős kötés „erősebb” kötés, mint a szén-szén egyszeres kötés, ez megmutatkozik a kötéshosszakban is (erősebb kötés esetén a kötéshossz kisebb).
Kötés C−C CC
Kötéshossz (pm) 154 133
Kötési energia (kJ/mol) 344 615
A kettős kötésnek nem kétszer akkora a kötési energiája, mint egy egyes kötésnek: a „második”
azaz a π-kötés kötési energiája: 615 kJ/ mol − 344 kJ/mol = 271 kJ/mol.
Ennek következménye, hogy a kettős kötésű vegyületek reakcióképesebbek, mint az alkánok, ugyanis a π-kötés energiája kisebb, mint a ζ-kötésé, ezért könnyebben felszakad.
A buta-1,3-dién szerkezete:
C C
H H C
C H
H H
H
C C
H H C
C H
H H
H
A molekulában a két π-kötés delokalizálódik a teljes szénláncra, és a kötések hossza közel azonos lesz (137 pm, illetve 147 pm). Mint korábban láttuk, a szén-szén egyszeres kötés körül a rotáció (forgás) könnyen végbemehet, ám a buta-1,3-dién esetén a delokalizáció következtében a két
−CH=CH2 csoport viszonylag nagy aktiválási gáton keresztül tud csak elfordulni. A molekula a delokalizáció következtében sík szerkezetű.
11.4.5. Fizikai tulajdonságok
– Hasonlóan az alkánokhoz, mint minden szénhidrogén, az alkének is apolárisak. Az apoláris molekulák között csak a leggyengébb másodrendű kötés, a diszperziós kötés hat.
– Az olvadáspont, forráspont, és a sűrűség a molekula „méretével”, a moláris tömeggel nő (C2–C4
gáz, C5-től folyadék, C17-től szilárdak 25 C hőmérsékleten és normál légköri nyomáson).
– Mivel apolárisak, vízben rosszul oldódnak.
11.4.6. Kémiai tulajdonságok és reaktivitás
Az alkánokhoz képest jelentősen nagyobb a reakciókészségük, bizonyos reagensekkel már szobahőmérsékleten reakcióba lépnek (a szén-szén π-kötés könnyebben felbontható, mint a szén-szén ζ-kötés).
Jellemző reakciótípusok:
– addíció, – polimerizáció, – égés.
a) Hidrogénaddíció
Az alkének katalizátor (például platina, palládium vagy finom eloszlású nikkel) jelenlétében hidrogénezhetők, melynek során alkánok keletkeznek:
H2C CH2 + H2 katalizátor H3C CH3
Azért szükséges katalizátor a hidrogénezéshez, mivel a hidrogén-hidrogén kötés igen erős (igen jelentős a disszociációs energiája). A katalizátor felületén megkötődik az alkén és a hidrogén is, majd részben vagy teljesen felbomlik a H−H kötés. Így a katalizátor felületén jóval kisebb aktiválási energiával megy végbe a hidrogénaddíció. Az alkének hidrogénezése egyébként energetikailag igen kedvező folyamat (exoterm). Ennek oka, hogy a keletkező két erős C−H kötés energetikailag kedvezőbb, mint az erős H−H és a gyengébb szén-szén π-kötés. Tulajdonképpen ez az alapja általánosságban az addíciós reakcióknak.
b) Halogénaddíció
Az alkének szobahőmérsékleten reagálnak az elemi halogénekkel (a telítetlenségek kimutathatóak brómos vízzel: a brómos víz elszíntelenedik).
H2C CH2 C
H2 H2 C Br Br Br2
+
A bróm-bróm kötés disszociációs energiája kisebb a hidrogén-hidrogén kötésénél, ezért a brómaddíció esetén nincs szükség katalizátorra.
A buta-1,3-dién brómaddíciójánál mintegy 80%-ban 1-4 addíció történik és csak 20%-ban van 1-2 addíció:
H2 C C
H HC
CH2
Br Br
H2 CCH
HC CH2 Br Br2
+
Br H2C
CH HC
CH2
80%
20%
Ez a delokalizált π-kötésekkel van összefüggésben, mivel lokalizált kettős kötések esetén elsősorban 1-2 addíció történne.
c) Hidrogén-halogenidek addíciója
Az alkének hidrogén-halogenideket is addícionálnak:
H2C CH2 + HCl H C C Cl H H
H H
A hidrogén-halogenidek addíciója a Markovnyikov-szabály szerint megy végbe: ha a π-kötéssel kapcsolt szénatomok rendűsége eltérő, akkor az alacsonyabb rendű szénatomhoz kapcsolódik a proton.
(A hidrogén mindig odamegy, ahol eleve több van.)
Így a propén HCl-addíciójával 2-klór-propán keletkezik:
CH2 HC
H3C CHCH2
H3C Cl HCl
+
H
CH3 H3C CH
Cl
=
d) Vízaddíció
Kénsav (H2SO4) katalizátor jelenlétében vízaddíció történik:
H3C CH2 OH H2C CH2 + H2O
H2SO4 Hasonló módon előállítható propénből propan-2-ol is.
e) Polimerizáció
Az etilén katalitikus polimerizációjával hőre lágyuló (termoplasztikus) polietilén (PE), propilén polimerizációjával hőre lágyuló polipropilén (PP) keletkezik. (Ezen egyedi rövidítések [például PE, PP] segítik a szelektív hulladékgyűjtést is.)
A polietilén képződése:
CH2CH2 CH2
H2C n
n
A polipropilén képződése:
CH2 CH CH3 CH3
CH H2C n
n
A polimerizációs reakciókban mutatott nagy reaktivitás oka, hogy ilyenkor a „gyengébb” π-kötés helyett két „erősebb” ζ-kötés keletkezik. A katalizátornak (általában átmenetifém-vegyületek, például titánsók) a szerepe, hogy a π-kötést „felszakítsa”, illetve bizonyos esetekben a katalizátor befolyásolja a termék térszerkezetét. Például polipropilén esetén a hidrogénatomok és a metilcsoportok a láncon belül kétféleképpen is állhatnak, és ezek sorozatos elrendeződése hatással van a keletkező polimer mechanikai stabilitására. Például az alábbi szerkezetű polimereknek eltérőek a mechanikai tulajdonságai és megmunkálhatóságuk (a vonalképletben nem jelöltük a hidrogénatomokat, csak a metilcsoportok irányultságát):
izotaktikus polimer szindiotaktikus polimer ataktikus polimer A gumigyártás
Izoprén (2-metil-buta-1,3-dién) polimerizációjával poliizoprén keletkezik, mely tulajdonképpen a természetes kaucsukkal azonos szerkezetű:
H2C C CH
CH2 CH3
CH2 C C
H H2 C CH3 n
n
Vulkanizálás: a nem túl jó mechanikai tulajdonságokkal rendelkező poliizoprénből (nyersgumiból) keményebb, ellenállóbb gumi előállításához a poliizoprént kénnel főzik, így a polimerláncok között szulfid- (−S−) és diszulfid- (−S−S−) hidak alakulnak ki. Így a szerkezet térhálóssá válik (hőre keményedő polimer), mely jelentős hatással van a gumi mechanikai tulajdonságaira. (Megjegyzés: a vulkanizált gumi például a gumiabroncs alapanyaga.)
CH2 C CH
H2 C CH3 S
S n
CH2 C C
H H2 C CH3
n
S
Ebonit vagy keménygumi: legalább 30%-os kéntartalom (szigetelőanyagnak használják).
A műgumi gyártása hasonló a természetes gumi gyártásához, csak itt buta-1,3-diénből indulnak ki izoprén helyett.
CH2
CH CHCH2 S
S
n
S H2C
HC CH
CH2
CH2 HC
CH H2 n C
n
f) Égés
Egy alkén tökéletes égésének általános reakcióegyenlete:
CnH2n + 3n O2 n CO2 + n H2O 2
11.4.7. Felhasználás
Szerves vegyipari alapanyagok előállítása:
– polimerek gyártása, – alkoholok előállítása,
– halogéntartalmú vegyületek előállítása.
11.4.8. Legfontosabb képviselők Etén:
– színtelen, édeskés szagú gáz,
– olvadáspontja és forráspontja igen alacsony,
– éghető; meggyújtva enyhén kormozó lánggal ég, mert magasabb a széntartalma, mint az etáné, – a levegővel robbanóelegyet képez,
– apoláris, vízben rosszul, de apoláris oldószerben jól oldódik.
Előállítása a laborban etil-alkohol dehidratálásával (160 °C fölött tömény kénsav jelenlétében):
H3C CH2 OH H2C CH2 + H2O Előállítás az iparban: benzin pirolízisével.
Felhasználása: polietilén, PVC, glikol (HO−CH2−CH2−OH) előállítása.
Propén:
Előállítása iparban: kőolajpárlatok hőbontásával.
Felhasználása: polipropilén, aceton (H3C−CO−CH3) előállítása.
Buta-1,3-dién:
Előállítása butánból dehidrogénezéssel:
H2C CH
HC CH2 H3C
CH2 H2
C CH3 + 2 H2
Felhasználása: műgumigyártás.
2-metilbuta-1,3-dién (köznapi neve izoprén) egységekből áll a kaucsukfa nedve, de az -karotin, a -karotin, és az A-vitamin is ilyen egységekből áll (konjugált kettős kötésűek).
11.5. Alkinek
11.5.1. Alkinek: szén-szén hármas kötést tartalmazó telítetlen szénhidrogének.
Az alkinek nevei -in végződésűek.
11.5.2. Homológ sor, egyszerűbb képviselők és elnevezésük Általános összegképlet: CnH2n−2
Képlet Név Triviális név
HC≡CH etin acetilén
HC≡C−CH3 propin metil-acetilén
HC≡C−CH2−CH3 but-1-in
H3C−C≡C−CH3 but-2-in
Alkenilcsoport: egy alkénből egy hidrogén eltávolításával keletkező csoport.
Képlet Név
HC≡C− etinil
CH3−C≡C− 1-propinil
HC≡C−CH2− 2-propinil
11.5.3. Előállítás Az acetilén előállítása:
a) Laboratóriumban kalcium-karbidból:
CaC2 + 2 H2O HC CH + Ca(OH)2 A kalcium-karbidot kalcium-oxid és szén reakciójából lehet előállítani:
CaO + 3 C CaC2 + CO
A karbidlámpában is hasonló módon acetiléngázt fejlesztenek, amelyet meggyújtva a kormozó lánggal világítanak.
b) Iparban metán termikus bontásával:
2 CH4 HC CH + 3 H2
A magasabb szénatomszámú homológokat rendszerint acetilénből állítják elő szubsztitúciós reakciókkal.
11.5.4. Szerkezet
Itt részletesen az acetilén szerkezetével foglalkozunk:
H−C≡C−H – a szénatomok között egy ζ-kötésés két π-kötés található, – a két π-kötés egymásra merőleges,
– a H, C, C és H atomok egy vonalba esnek, a molekula lineáris, – a H−C−C kötésszög 180°.
Az egyszeres, a kettős és a hármas kötést összehasonlítva a hármas kötés a legrövidebb, ennek a legnagyobb a kötési energiája:
Kötés C−C CC C≡C
Kötéshossz (pm) 154 133 121
Kötési energia (kJ/mol) 344 615 812
Ezek alapján a három kötés közül a hármas kötés a legerősebb kötés (ám nem háromszor olyan erős, mint egy egyszeres kötés).
11.5.5. Fizikai tulajdonságok
– Hasonló az alkánokhoz és alkénekhez, az apoláris molekulák között csak diszperziós kötés hat.
– Olvadáspont, forráspont, a sűrűség a moláris tömeggel nő (C2-C4 gáz, C5- folyadék a magasabb szénatomszámúak szilárdak (C17-től) 25 C hőmérsékleten és normál légköri nyomáson).
– Mivel apolárisak, vízben rosszul oldódnak.
11.5.6. Kémiai tulajdonságok és reaktivitás
Már szobahőmérsékleten jelentős reakciókészséggel rendelkeznek.
Jellemző reakciójuk:
– addíció, – oxidáció,
– gyenge savként viselkednek.
a) Hidrogénaddíció
Két lépésben, katalitikus úton (Pd, Pt vagy Ni) az alkinek alkánokká redukálhatóak:
HC CH + 2 H2 katalizátor H3C CH3 Az első lépés a hármas kötés telítése kettős kötéssé:
HC CH + H2 katalizátor H2C CH2
Amennyiben csak alkénig szeretnénk redukálni az alkint, rendszerint csökkentett aktivitású (mérgezett) katalizátort kell alkalmazni, mivel a reakció könnyen eredményezhet teljes telítődést.
b) Halogén- és hidrogénhalogenid-addíció
Az alkinek elemi halogénnel és hidrogén-halogenidekkel addíciós reakcióba vihetők. Például a brómos vizet elszíntelenítik, a reakció első lépésében 1,2-dibróm-etén keletkezik, melyből brómfeleslegben 1,1,2,2-tetrabróm-etán keletkezik.
Br2
+ Br C
H C H Br HC CH
Br2
+ Br C C Br
Br C H C
H Br
Br
H Br
H
Az alkinek reakciója hidrogén-halogenidekkel szintén kétlépéses folyamat: először vinil- halogenid (HCl esetén vinil-klorid) keletkezik:
HC CH + HCl H C
H C H Cl A második lépésben 1,1-diklór-etán keletkezik:
+ HCl H C C Cl
H C H C
H Cl
H
H Cl H c) Vízaddíció
Hg2+-sók és kénsav jelenlétében vinil-alkohol keletkezik első lépésben, ám ez átalakul a stabilabb acetaldehiddé:
H2C CH OH
HC CH + H2O H3C C
O H
A reakciót Kucserov-reakciónak is nevezik. Régen ezzel a reakcióval állítottak elő acetaldehidet.