Gyó g ys ze rg yár i old ala k
BEVEZETÉS
A szolid malignus daganatok metasztatikus prog- ressziójának alapja a „seed-and-soil” elmélet (4), ami a folyamat szervspecifi citását fogalmazza meg.
Ugyanakkor számos daganat esetében ez a folyamat érellátási illetve perfúziós sajátosságokkal (is) ma- gyarázható. A korábbi vizsgálatok viszonylag kis- számú esetet elemeztek, így következtetéseik eset- leg megkérdőjelezhetőek voltak. Most egy 6 millió beteget érintő Medicare-adatbázis alapján a kérdést
imformatikailag újraelemezték (2) 43 primer tumor- fajta vonatkozásában, ahol 27 metasztázis-szervet elemeztek (a nyomonkövetés minimálisan 48 hónap volt). A legtöbb adat a prosztata-, tüdő-, emlő-, vastag- bél- és húgyhólyagrákokról illetve melanómáról állt rendelkezésre. Az egyik fontos megfi gyelés az volt, hogy a szervi átt étek gyakorlatilag 2 hullámban kelet- keznek: ún. korai és késői formában, ami alól kivétel a melanóma (késői) és a tüdőrák (korai). Az egyes daga- natok szervspecifi citását tekintve csodák nincsenek:
a prosztatarák csontmetasztázis-specifi kus daganat
MOLEKULÁRIS ALAPJAI ÉS CÉLZOTT TERÁPIÁJA
Tímár József
Semmelweis Egyetem, II. sz. Patológiai Intézet, Budapest
Közlésre érkezett : 2010. január 28.
Elfogadva:
2010. február 10.
Levelezési cím:
Dr. Tímár József Semmelweis Egyetem II. sz. Patológiai Intézet 1091 Budapest Üllői út 93.
Telefon: (06-20) 825-9685 Fax: (06-1) 215-6921 E-mail:
jtimar@korb2.sote.hu A munkát az Amgen Kft . támogatt a.
A csontátt étképzés számos szolid daganat progressziójának jellegzetessége, mely kiváló példát szolgál- tat az átt éti folyamat szervspecifi citására. Megvalósulása mind a vénás, mind az artériás rendszeren keresztüli szóródás révén történhet. Az oszteolitikus vagy oszteoplasztikus átt étek keletkezése eltérő mo- lekuláris útvonalakat feltételez, de a gyakorlatban a két folyamat keveredése révén zajlik. Mai tudásunk szempontjából alapvető jelentőségű az oszteoklasztok daganatsejtek általi aktiválódása és az ennek révén létrejövő csontreszorpció, mely a csontbomlás ördögi körének kialakulásához vezet. A csontátt étek keze- lésében forradalmat jelentett az oszteoklaszt–csontmatrix kölcsönhatást gátló biszfoszfonátok felfedezése és klinikai sikere. A folyamat molekuláris alapjainak tisztázása azonban újabb terápiás célpontokat jelölt meg az oszteoklaszt-diff erenciálódásban, melyet a a TNF-receptorcsalád egyik tagja, a RANK–RANK- ligand rendszer szabályoz. Ennek az új terápiás megközelítésnek életképességét már sikeres klinikai vizs- gálatok támasztják alá, melyekben RANKL-ellenes antitestet alkalmaztak. Ennek klinikai sikeressége tovább erősíti azt a nézetet, hogy a daganatokban zajló molekuláris történések pontos megismerése ké- pezi az alapját az egyre hatékonyabb terápiás eljárások kifejlesztésének. Magyar Onkológia 54:59–64, 2010
Kulcsszavak: csontátt étképzés, molekuláris mechanizmus, célzott terápia
Formation of bone metastasis is a hallmark of the progression of several solid cancers, providing example for the organ specifi city of the process. Bone metastasis may result in both venous and arterial dissemina- tion. Though the molecular basis of the lytic and plastic bone metastasis formation is diff erent, in reality these organ metastases represent a mixture of the two processes. The basis of bone metastasis formation is the activation of osteoclasts and the resulting bone resorption, initiating a vicious circle by activating the initiator cancer cell. The discovery of osteoclast–bone matrix interaction inhibitor bisphosphonates revolutionized the therapy of bone metastasis. Clarifying the molecular pathways involved in bone me- tastasis formation identifi ed osteoclast diff erentiation as another feasible target. This process is under control of the TNF receptor family member RANK and its ligand RANKL. The feasibility of using this system to control bone resorption or cancer-induced skeletal events was proven clinically in trials using an anti-RANKL antibody. The clinical success of anti-RANKL antibody therapy provide further evi- dence that only precise identifi cation of molecular pathways operational in cancers can lead to discovery of more eff ective (targeted) therapies. Tímár J. Molecular basis of bone metastasis formation and its targeted therapy. Hungarian Oncology 54:59–64, 2010
Keywords: bone metastasis, molecular mechanism, targeted therapy
Gyó g ys ze rg yár i old ala k
(folyamatos), az emlőrák a csont mellett (folyamatos) késői máj- és tüdőátt étképzéssel jellemezhető. A tü- dőrák a csont mellett máj- és tüdőátt étképzéssel, míg a vastagbélrák folyamatos májátt étképzéssel és késői tüdőátt étekkel jellemezhető. Érdekes módon a húgy- hólyagrák szintén folyamatos csontátt étképzésű és kéthullámú tüdő- és májátt étképző.
A szervi átt étképzés új elmélete, amit kísérleti rendszerben igazoltak, az ún. metasztatikus bölcső kialakulása (7). Ismert az, hogy a malignus daganat által termelt citokinek stimulálják a csontvelőt, amely- ből őssejtek (hematopoetikus, hemangiopoetikus, stb.) áramlanak ki és jutnak el az egyes szervek- be. A citokinek közül értelemszerűen az angiogén faktorok (pl. VEGF) vagy TNFα, IL-6, EGF, HGF, stb.
játszhatnak fontos szerepet. Ezek a faktorok pl.
a metasztázis helyén megemelik a fi broblasztok fi bronektin termelését lokálisan az átt ét kialakulása előtt , a tüdő endotélsejtjeiben pl. kemoatt raktánsok termelődnek (S100A8/9 vagy szérum amyloid, SAA).
Előfordulhat az is (emlőrák), hogy a tumor enzime, a LOX a metasztázis kollagénjét keresztköti. Mind- ezen mikromilieu-változások kedvezőek a csontve- lői prekurzorok nem véletlenszerű kitapadásához a keringésből (Mac1+, CD11b+, endotél-progenitorok).
Ezek a megváltozott matrixú csontvelői segítőket tartalmazó gócok azok a helyek, ahol a keringésből a daganatsejtek is előszeretett el tapadnak ki. A szer- vek felismerésének egy másik útja a kemokinek és re- ceptoraik révén történő felismerés: emlőrák esetében a daganatsejtek CXCR4-pozitivitása elősegíti a tüdő-, de főleg az agyi átt étek kialakulását a lokális CXCL12 ligandot használva segítségül (1, 8). Egy másik lehet- séges út, hogy a csontátt étképző daganatok sejtjei csontspecifi kus matrixot termelnek (OPN, ON, BSP), ami segít az új szervben való megtelepedésben.
Ett ől azonban nem lesz a daganatsejtekből átt ét.
A szervekbe (pl. csont) kikerülő daganatsejtek álta- lában nyugvó állapotba kerülnek, aminek oka az ún.
metasztázis-szuppresszor gének működése: a KISS1 (G0-stop), a KAI1 proliferáció-gátló hatású, az NM23H1 és az MKK4/7 a kezdetben meginduló proliferációt ál- lítják le a mitogén jelpályák blokkolásával. A dagana- tok bizonyos genetikai sajátosságai szintén fontosak lehetnek a szervi átt étek kialakulásában: emlőrákban az ER+/PgR- fenotípus ilyen specifi kus prognosztikus tényező (18).
A CSONTÁTTÉTKÉPZÉS PATOMECHANIZMUSA
A csontátt étképzés alaplépései megegyeznek a hema- togén átt étképzés folyamatának lépéseivel, kisebb eltérések vannak csak, amelyek csakis és kizáró- lag a csontra jellemzők. A primer daganat ereződé- se alapfeltétele a hematogén átt étképzésnek és így a csontátt étképzésnek is, mert a primer daganatban
lévő tumorsejtek a daganatot ellátó, ill. daganatközeli erek falán átlépve ahhoz kitapadva, lebontva, majd azon keresztülvándorolva jutnak be a keringésbe.
Ez az intravazációs folyamat elsősorban a venózus posztkapilláris vénákat érinti. A tüdő esetében a vena pulmonalis rendszere gyakorlatilag az artériás szisz- témás keringésbe jutt atja a daganatsejteket. Az egyik leggyakoribb csontátt étet képző daganat, a proszta- tarák esetében az ún. periprosztatikus vénás plexus elvezetése jutt atja el a lumbális, lumboszakrális csi- golyák közvetlen közelébe a daganatsejteket, amelyek ott az ún. Batson-vénák révén kerülnek kapcsolatba a csontokkal, ill. a csontállománnyal.
A csontátt étek kialakulása azonban döntően az artériás rendszeren keresztül történik. Az artériás rendszer végén lévő kapillárishálózat a csontok- ba vezeti a daganatsejteket, amelyek a csontvelő sinusoidjáig jutnak. A csont szinuszoidrendszere igen egyszerű, nagymértékű hasonlóságot mutat a máj és a nyirokerek szinuszoidjaihoz. Mindhármójuk közös vonása, hogy igen vékony, majdnem virtuális bazális membrán határolja az endotélsejteket, ma- guk az endotélsejtek nem fenesztráltak, a keringés- ben lévő, ill. a lokális szervben lévő kémiai faktorok gyakorlatilag szabadon jutnak át, így a daganatsejtek számára fontos információk anélkül elérhetők, hogy a daganatsejtek átléptek volna a szinuszoidok falán.
Természetesen az is nagy előny, hogy szemben más szervek érstruktúrájával, a csont szinuszoidjaiból történő extravazációs folyamat csak migrációs, ill.
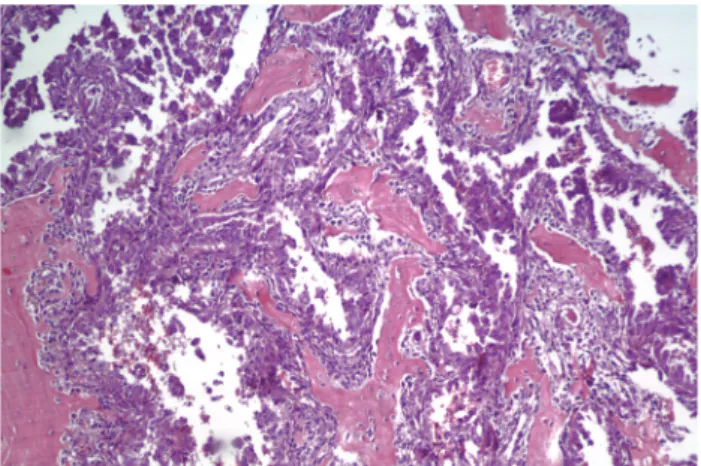
kemotaktikus képességet tételez fel. Természetesen a csontvelőbe történő kilépés után jellegzetes és kü- lönleges extracelluláris, ill. sejtes kölcsönhatások lépnek fel. A folyamat a klasszikus mag és talaj ta- lálkozása eseményeinek elemzését igényli. A csont szinuszoidjaiba történő extravazáció után előbb-utóbb a daganatsejtek a csontvelő/csontgerendák határához vándorolnak. A csontgerendák egyrészt különleges matrixstruktúrát jelentenek, talán a legkeményebb mechanokémiai ellenállást jelentik, amivel egy daga- natsejt szembesülhet, hiszen jelentősen mineralizált alapállományról van szó (1. ábra).
1. ábra. Nem-kissejtes tüdőrák csontátt étének szövett ani képe.
H&E festés
Gyó g ys ze rg yár i old ala k
Ugyanakkor a daganatsejtek számára könnyebb- séget jelenthet az, hogy a csont állandó átépülésben van fi ziológiásan is, ezt az átépülést tulajdonkép- pen a folyamatos lebomlás és felépülés ciklusai je- lentik, amelynek két fő gazdasejti tényezője van, az oszteoklasztok és az oszteoblasztok. A daganatsejtek mind az oszteoklasztokat, mind az oszteoblasztokat felhasználják arra, hogy a csontgerendákat átépítsék, és gyakorlatilag a csontátt étképzés folyamatának moleku- láris mechanizmusai e sejtekkel kialakuló molekuláris kölcsönhatások sajátosságaiból épülnek fel.
A CSONTÁTTÉTEK FORMÁI:
AZ OSZTEOLITIKUS
ÉS AZ OSZTEOPLASZTIKUS ÁTTÉTEK
Régóta ismert, hogy a rosszindulatú daganatok átt étei két formában nyilvánulnak meg. Az egyik esetében a csontban növekedő átt ét folyamatosan lebontja a kör- nyező csontgerendákat; ez a folyamat az érintett csont anatómiai struktúrájának súlyos destrukcióját idézi elő és utóbb patológiás csontt öréshez vezet. Általában igen jelentős fájdalommal jár, hiszen a mechanikus terhelést ezek a csontok nem viselik el. Oszteolitikus átt étet tipi- kusan az emlőrák képez. Korábban azt gondolták, hogy az oszteolitikus átt étképzéskor a daganatsejtek maguk képesek olyan bontóenzimeket előállítani, amelyek a csont lebontására alkalmasak, de ez a teória régen meg- dőlt. Az oszteolitikus átt étek kialakításához a daganat- sejtek az oszteoklasztokat használják fel (13, 15, 20), tehát ezt az átt étképzést oszteoklasztos átt étképzésnek is lehet nevezni (2. ábra). Ez esetben a fi ziológiás csontlebontá- si folyamat mechanizmusát erősítik fel a daganatsejtek megfelelő kémiai mediátorok révén. A másik lehetőség az, hogy az átt étek oszteoplasztikusak, tehát a kialakuló tumorsejtfészkek körül csont-újdonképződés indul meg (13, 15, 20). Miután a csont felépítését az oszteoblasztok vezénylik és hajtják végre, az oszteoplasztikus átt ét- képzés gyakorlatilag oszteoblasztikus átt étképzést jelent. A daganatsejtek az oszteoblasztok aktiválása révén képeznek maguk körül új, de autentikus lokális
csontmatrixot. Az oszteoblasztikus átt étképzés során a csont bár átépül, de anatómiai stabilitása jelentősen nem károsodik, tehát a klinikai szövődmények kevésbé súlyosak egy ideig, szemben az oszteolitikus átt étekkel.
Természetesen több daganatféleség esetében a kétféle folyamat nem kizárólagosan zajlik, és akár egy átt éti góc esetében is van litikus és plasztikus terület, azaz a mechanizmusok átfedhetnek att ól függően, hogy a klasztokat és blasztokat stimuláló faktorok vannak-e többségben az adott daganatban.
Érdemes elemeznünk a két átt étképzési mechanizmus molekuláris részleteit azért, mert ezek során világossá válik az, hogy milyen lehetséges beavatkozási pontok tárulhatnak elénk, hogy a folyamatokat befolyásolni tudjuk. Fiziológiásan a csont felépülésének folyamatát az oszteoblasztok irányítják a csont-morfogenikus fe- hérjék (BMP-k) valamint alapvető növekedési faktorok, mint a TGFβ, IGF és az FGF segítségével. Ezt a folyama- tot elsősorban a PTH (parathormon) befolyásolja pozi- tívan, de prosztaglandinok illetve citokinek is képesek erre, míg a kortikoszteroidok negatív szabályozók. Az oszteolitikus folyamat az oszteoklasztok aktiválásán ill.
gátlásán keresztül valósul meg, ahol a PTH, D3 vitamin, valamint az IL-1, IL-6, IL-17, a RANK-ligand, bizonyos prosztaglandinok aktiválók, míg kortikoszteroidok, a prosztaglandin E2, az IL-4, IL-18, és az IFNγ, a TGFβ, az OPG gátló hatású (13, 15, 20).
A litikus folyamat szempontjából a legnagyobb jelen- tősége a RANK-ligandnak van, melynek sejtfelszíni re- ceptora a RANK. Fontos tudni azonban, hogy létezik egy ún. szolúbilis formája is a RANKL receptorának, ez az oszteoprotegerin (OPG). A RANK a tumornekrózis-fak- tor (TNF) receptorcsalád tagja. Az oszteolitikus átt éteket azok a tumorsejtek képesek kezdeményezni, amelyek PTHrP parathormon-szerű peptidet képesek szekretálni (az emlőrákok 50%-a). Ez a peptid a stromális sejteket és oszteoklaszt-prekurzorokat aktiválja és diff erenciálódás- ra serkenti, amihez ezek a sejtek elkezdik expresszálni a RANKL-ot. Az aktiválódó oszteoklasztok elkezdik lebontani a csontmatrixot és felszabadítják az abban inaktív állapotban lévő növekedési faktorokat (TGFβ-t, IGF-et és az FGF-et). A felszabaduló TGFβ és Ca++ ak- tiválja a tumorsejteket, amelyek újabb citokineket és PTHrP-t termelnek, így circulus vitiosus alakul ki, az egyre inkább aktiválódó oszteoklasztok egyre nagyobb csontlebontást idéznek elő és tovább aktiválják a daga- natsejteket, és így előbb-utóbb oszteolitikus folyamat in- dul be (13, 15). A PTHrP mellett a tumorsejtek több olyan faktort is szekretálnak, amelyek a fi ziológiás csontlebon- tás pozitív stimulálói, így az IL-6-ot, a prosztaglandin- E2-t, az IL-1-et, vagy TNFα-t. Az oszteoklasztok fel- színén az αvβ3 integrin expresszálódik, amely a csont sajátos matrixfehérjéi közül az oszteonektint (ON), az oszteopontint (OPN) és a többi matrixligandot is fel képes ismerni, és ezzel biztosítja, hogy az oszteoklaszt megfelelő alapállományba ágyazódjon be.
Az oszteoplasztikus átt étképzés folyamata kevés- bé jól karakterizált molekuláris szempontból (13, 15).
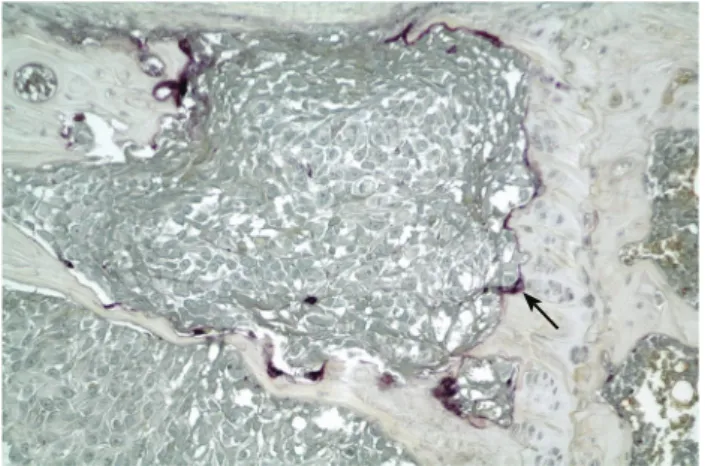
2. ábra. Emlőrák csontátt étében oszteoklaszt jelölése (nyíl). Savas foszfatáz-reakció (lila)
Gyó g ys ze rg yár i old ala k
Újabb vizsgálatok arra utalnak, hogy egyik kulcsfak- tora a daganatsejtek által termelt endotelin-1. Emel- lett a trombocita növekedési faktor, a PDGF is fontos szerepet tölthet be, és egyértelműen igazolódott , hogy a daganatsejtek által nagyon gyakran fokozott an ter- melt plazminogénaktivátor, az urokináz forma (uPA) fontos szerepet játszik. Ebből a szempontból fontos proteáz még a PSA, amely kallikrein-szerű proteáz.
A PSA képes bontani a PTHrP-t és így akadályoz- hatja a csont lebontását. Ugyanakkor a PSA képes az oszteoblasztok aktiválására, annak révén, hogy ez a proteáz (és a többi segítő proteáz) felszabadítja a csontban lévő növekedési faktorokat, mint az IGF- 1,2, vagy TGFβ, és ezek indítják el az oszteoblasztok proliferációját.
A CSONTÁTTÉTKÉPZÉS MOLEKULÁRIS GENETIKÁJA
A csontátt étképzés olyan különleges képességet felté- telez a daganatsejtek részéről, amely ebben a különle- ges matrixkörnyezetben való túlélést eredményezheti, hogy ehhez különleges genetikai képesség is szüksé- ges, és ezt esetleg oszteogenetikus mimikrinek nevez- hetjük. Ez alatt azt értjük, hogy a daganatsejtek olyan matrixfehérjéket expresszálnak, amelyek máskülönben csak a csontban vannak jelen. Régóta ismert az a tény, hogy elsősorban a csontokba gyakran átt étet képző da- ganatok, mint emlőrák, prosztatarák, tüdőrák esetében fi gyelték meg, hogy csont-morfogenetikus fehérjéket (BMP), oszteopontint (OPN), oszteonektint (ON) képe- sek expresszálni, valamint ezek azok a daganatok (el- sősorban az emlő- és prosztatarák), amelyek a PTHrP-t is expresszálják (13, 15, 20). Ez a jellegzetes genetikai karakter biztosítja a daganatsejteknek azt a képességét, hogy abban a különleges matrixkörnyezetben, amit a csont jelent, túléljenek.
Korszerű molekuláris genetikai genomikai vizsgá- latok a közelmúltban fényt derített ek arra, hogy mi- lyen genetikai képességekkel rendelkezhetnek azok a daganatok, amelyek szelektíven a csontokba képesek átt étet képezni. Az ilyen képességű emlőráksejtek fo- kozott an expresszálják az oszteoklasztokat aktiváló IL- 11 citokint, az oszteoklasztok aktiválása során szerepet játszó matrixfehérjét, az oszteopontint, a csontátt étek sajátos vaszkularizáltságát elindító angiogenetikus faktort, az FGF5-öt és a CTGF-et (kötőszöveti növe- kedési faktor), a matrixlebontásban iniciáló szere- pet játszó MMP-1 kollagenázt és a daganatsejteket a csontban termelődő kemokinek felismerésére képes- sé tevő receptort, a CXCL4-et (9). A további klinikai vizsgálatok megerősített ék ezeket a megfi gyeléseket, de a mintázatot néhány más matrixfehérje, mint a PRG1, az I. típusú kondroitinszulfát-proteoglikán, a trombospondin-1 angiogenezis-szabályozó fehérje, az amiloid-A2, a follisztatin és az MHCII-DR/DP egészí- tett e ki (12).
A CSONTÁTTÉTEK CÉLZOTT KEZELÉSE
A jelen
A biszfoszfonátok (BP) voltak az első ún. célzott csont- átt ét-ellenes gyógyszerek, melyek példát mutatt ak a szervi átt étképzés folyamatának befolyásolására. A klasszikus nem-amino-BP-k metilálódnak a szervezet- ben (csontban) és ezzel stabil ATP-analóggá válnak, és miután ez az oszteoklasztokban történik, elsődleges celluláris célpontjuk ez a sejt, aminek biológiai követ- kezménye csontstabilizáció. Az amino-BP-k, bár ké- miailag hasonlóak és szintén elsősorban a csontokban akkumulálódnak, kevésbé hatékonyan metilálódnak, azonban egy másik kémiai tulajdonsággal is rendel- keznek: hatékony inhibitorai a farnezilpirofoszfát- szintáznak (5, 14). A jelátvitelben szereplő fehérjék (pl.
RAS, RHO, RAC, RAB) egy részének aktív működésé- hez a plazmamembránhoz kell kikötődniük, ami lipid- módosuláson (preniláción) keresztül történik (19). A prenilációs folyamat farneziláció és/vagy geraniláció formájában történhet, mely az egyes fehérjék eseté- ben specifi kusan (nem véletlenszerűen) történik és transzferázok végzik (19). A RAS fehérjék mindkét módon aktiválódhatnak, a RHO-B csak farnezilációval, a többi RHO fehérje csak geranilációval. Fontos megje- gyezni, hogy a cdc42 is geraniláció révén aktiválódik.
Ugyanakkor a farneziláció fontos a magi lamin fehér- je működése szempontjából, és a mitotikus orsófehér- jék egy része is farnezilálódik (CENP-k). Mindezek alapján egyértelmű, hogy amennyiben e prenilálódó fehérjék aktivitását preniláció révén kívánnánk be- folyásolni, azt a transzferázok révén csak bizonyos fehérjék esetében lehet elérni, melyek egyoldalúan használják ezt a mechanizmust, a jelátviteli fehérjék többsége mindkét transzferázrendszert képes használ- ni, így nem elegendő az egyik gátlása. A prenilációs folyamat leghatékonyabb általános gátlószerei ma- napság az aminobiszfoszfonátok, melyek a specifi - kus transzferázok belépése előtt már felfüggesztik a prenilációhoz szükséges szubsztrátok termelését (16).
Az első generációs biszfoszfonátcsaládba tartozó clodronát a malignus tumorok litikus csontátt éteinek és a hiperkalcémiának kezelésére kerül alkalmazásra.
Az aminobiszfoszfonát ibandronát és zoledronsav a da- ganat-indukált hiperkalcémia kezelése mellett a csont- átt étes betegek csontszövődményeinek megelőzésére használatos. Újabban előrehaladott klinikai vizsgálatok zajlanak annak igazolására, hogy a zoledronsav képes megelőzni emlőrák és prosztatarák esetében a csontát- tétek kialakulását is (10).
A jövő
Mint azt korábban említett em, a parathormon-szerű fe- hérje (PTHrP) a daganatsejtekben az egyik fő tényező bizonyos típusú rákok csontátt étképző képességében.
Gyó g ys ze rg yár i old ala k
Kísérleti rendszerekben az ez ellen termelt antitest (CAL) meggátolta a daganatsejtek oszteolitikus átt ét- képzését. Ilyen antitestet klinikai fázis I vizsgálatban is teszteltek már (11).
A csontlebontó circulus vitiosus fontos faktora a TGFβ, illetve a PDGF, amely a csontmatrixból kerül fel- szabadulásra az oszteoklasztok aktivitása révén. Állatkí- sérleti modellekben mind a TGFβ-t gátló kismolekulájú inhibitorok, mind a PDGF-receptort blokkoló sunitinib képes volt gátolni az oszteolitikus folyamatokat (11).
Új típusú megközelítés az oszteoklaszt-diff erenciáció gátlása. Mint ahogy a korábbi fejezetekben bemutat- tam, az oszteoklasztok diff erenciálódásában alapvető szerepet játszik a RANK, annak ligandja (RANKL), valamint az oszteoprotegerin. A denosumab (ANG 662) humanizált monoklonális antitest, amelyet a RANK-ligand ellen fejlesztett ek ki. Fázis III vizsgála- tokban metasztatikus csontátt étekkel rendelkező da- ganatos betegek esetében illetve posztmenopauzális oszteoporózisban tesztelték hatását. A denosumab hosz- szú felezési idővel rendelkezik a keringésben. Biológiai hatása kiterjedt csontreszorpció-gátló hatásban nyilvá- nul meg, ezt posztmenopauzális nőbetegek esetében és csontátt étes betegek esetében is kimutatt ák (3, 17). A csontátt étes betegek egy része a biszfoszfonát-terápia ellenére progrediál, aminek érzékeny biomarkere a kollagén-eredetű N-telopeptid vizeletürítése. Egy fázis II vizsgálatban az ilyen betegek aminobiszfoszfonát- kezelését denosumabra váltott ák. A denosumab- adagolás az esetek többségében csökkenteni volt képes a csontreszorpció markerét (N-telopeptid vizeletszint- jét), míg a biszfoszfonát ezt csak a betegek harmadában érte el. Ami azonban még érdekesebb, hogy a követési pe riódusban felére csökkent a csontrendszert érintő események aránya a denosumab karon a biszfoszfonát karhoz képest (6), ami arra utal, hogy a RANKL elleni terápia esetleg hatékony lehet a biszfoszfonát-rezisztens
csontátt étek esetében. Érdekes, hogy a denosumab adago- lása szubkután történik és ezzel új utat mutat az antitest- terápiák számára, hiszen eddig ezeket csak iv. adagolták.
Egy másik megközelítési lehetőség az oszteoklasz- tok jelátviteli folyamatainak befolyásolása. Lehetséges terápiás target a katepszin-K-t bontó enzim, amely az oszteoklasztokban magas szinten fejeződik ki, és az I–
II-es típusú kollagén lebontásában játszik fontos szere- pet. Az oszteoklasztok által indukált csontlebontásnak két célpontja van, a kalciumhidroxiapatit kristályok és a proteinmatrix bontása. A katepszin-K ellen számos kismolekulájú inhibitort fejlesztett ek ki, amelyek állat- kísérleti modellekben képesek voltak a csontreszorp- ciót blokkolni (11) (1. táblázat).
Az oszteoklasztok jelátviteli pályáinak közös jellem- zője, hogy ezek az SRC onkogénen keresztül aktiválód- nak. Érdekes módon, ha egészséges kísérleti állatokban az SRC onkogént kikapcsolják, ezekben az állatokban oszteopetrózis alakul ki, mert a csont reszorpciós fo- lyamatai gátoltak. Kis molekulájú SRC-inhibitorok rendelkezésre állnak már, és ezeket különböző kísérle- ti modellekben is tesztelték, sőt fázis I–II vizsgálatok- ban is vizsgálták már. Célszerű volna ezek specifi kus csontátt étképzést befolyásoló szerepét is tesztelni. Az oszteoklasztok gyulladásos citokin-termelésének egyik kulcs jelátviteli pontja a MAP-kináz aktiválódása, amely eredménye az interleukin-1 és TNFα termelése, amely tovább fokozza a csontreszorpciós folyamatot.
MAP-kinázgátló szereket elég széles körben alkalmaz- nak kísérleti rendszerekben, és ezek egyik fontos bioló- giai hatása, hogy gátolják az oszteoklasztok aktivitását és a csontreszorpció folyamatát.
A citoplazmai proteinek eliminálásának egyik útja a proteaszomális lebomlás. Érdekes biológiai jelenség, hogy a proteaszóma funkciójának gátlása stimulálja az oszteoblasztok funkcióit, míg gátolja az oszteoklasztok diff erenciálódását. Bár kísérleti rendszerekben a pro- 1. táblázat. A csontátt étképzés célzott terápiájának lehetőségei
Szer Molekuláris célpont Sejtes célpont Oszteoporózis Csontátt ét Csontátt ét-
megelőzés
Biszfoszfonátok ATP oszteoklaszt gátló gátló ?
Amino-biszfoszfonátok preniláció ATP oszteoklaszt daganatsejt
gátló gátló igen
Denosumab antitest RANKL oszteoklaszt gátló gátló ?
Kismolekulájú inhibitor katepszin-K oszteoklaszt gátló (preklinikai) gátló (preklinikai) ? AZD0530
SKI-606
SRC oszteoklaszt
daganatsejt
gátló (preklinikai) gátló (preklinikai) ?
Bortezomib proteaszóma oszteoklaszt
daganatsejt
gátló (preklinikai) gátló (preklinikai) ?
Zibotentan endotelin-A- receptor daganatsejt gátló (preklinikai) ?
Cilengitid αvβ3 integrin oszteoklaszt
daganatsejt
gátló (preklinikai) gátló (preklinikai) ?
RANKL= RANK-ligand, SRC= sarc-onkogén
Gyó g ys ze rg yár i old ala k
teaszóma-gátló szerek, mint pl a bortezomib, képesek voltak az oszteoklasztok funkcióját gátolni, az ilyen proteaszóma-inhibitorokat csontátt étek, vagy osz teo- porózis kezelésére még nem tesztelték klinikai rend- szerekben (11).
Egy további lehetséges támadáspont az oszteo klasztok matrixkapcsolatának felfüggesztése. Az osz teoklasztok a csontmatrix fehérjéit a vitronektin re ceptoron keresz- tül ismerik fel (αvβ3 integrin). Az integrin aktiválódása oszteoklaszt-aktiválódáshoz vezet, amelynek eredmé- nye a katepszinek, többek között a katepszin-K felszaba- dulása. A vitronektin receptor funkciójának blokkolásá- ra specifi kus αvβ3 integrin elleni antitesteket, kis mole- kulájú inhibitorokat, illetve RGDS peptideket állított ak elő, amelyek állatkísérleti modellekben képesek voltak az oszteoklasztok aktivitását blokkolni (11).
Prosztatarákok gyakran képeznek oszteoblasztikus átt éteket. Ennek molekuláris mechanizmusát vizsgálva kiderült, hogy a prosztataráksejtek nagy mennyiség- ben termelnek egy endotelin-1 nevű citokint, amelynek receptora az endotelin-A-receptor. Ennek vaszkuláris hatásai mellett oszteoblaszt-aktiváló hatása van. Kí- sérleti rendszerekben egyértelműen bebizonyoso- dott , hogy az endotelin-A-receptor blokkolása humán prosztatarákok esetében gátolja az oszteoblasztikus metasztázisképződést. Több endotelin-A-receptort gát- ló szer is kifejlesztésre került, részben antitest, részben kis molekulasúlyú inhibitor, amelyek klinikai hasz- nosítására fázis II–III vizsgálatok zajlanak (11).
ÖSSZEFOGLALÁS
Az elmúlt évtizedet a csontátt étek kezelésében a bi- szfoszfonátok évtizedének is lehet nevezni, hiszen a malignus daganatok által okozott csontelváltozások ke- zelésében egyeduralkodóak voltak. Ez az évtized azon- ban jelentősen kiszélesített e ismereteinket a csontátt étek keletkezésének molekuláris mechanizmusáról, aminek eredményeként számos új terápiás célpont körvonala- zódott . A RANKL elleni antitest első sikeres klinikai alkalmazásai, esetleg első lépésben a biszfoszfonát- rezisztens esetekben, azzal kecsegtetnek, hogy újabb terápiás eszközzel gazdagodhat az onkológia fegyver- tára, ami tovább erősítheti a célzott terápiák alkalmazá- sa iránti bizalmat.
IRODALOM
1. Ben-Baruch A. Organ selectivity in metastasis: regulation by chemokines and their receptors. Clin Exp Metastasis 25:345–356, 2008
2. Chen LL, Blumm N, Christakis NA, et al. Cancer metastasis net- works and the prediction of progression patt erns. Br J Cancer 101:749–758, 2009
3. Cummings SR, San Martin J, McClung MR, et al. Denosumab for prevention of fractures in postmenopausal women with oste- oporosis. N Engl J Med 361:756–765, 2009
4. Fidler IJ , Poste G. The “seed and soil” hypothesis revisited. Lancet Oncol 9:808, 2008
5. Finley RS. Bisphosphonates in the treatment of bone metastases.
Semin Oncol 29(1 Suppl 4):132–138, 2002
6. Fizazi K, Lipton A, Mariett e X, et al. Randomized phase II trial of denosumab in patients with bone metastases from prostate can- cer, breast cancer, or other neoplasms aft er intravenous bisphos- phonates. J Clin Oncol 27:1564–1571, 2009
7. Gao D, Mitt al V. The role of bone-marrow-derived cells in tumor growth, metastasis initiation and progression. Trends Mol Med 15:333–343, 2009
8. Hinton CV, Avraham S, Avraham HK. Role of the CXCR4/CXCL12 signaling axis in breast cancer metastasis to the brain. Clin Exp Metastasis 27:97–105, 2010
9. Kang Y, Siegel PM, Shu W, et al. A multigenic program mediating breast cancer metastasis to bone. Cancer Cell 3:537–549, 2003 10. Kopper L, Tímár J, Becságh P, Nagy Zs. Célzott diagnosztika és
célzott terápia az onkológiában. ISBN 978 963 9879 59 1. Semmel- weis Kiadó, Budapest, 2009
11. Lipton A. Future treatment of bone metastases. Clin Cancer Res 12:6305s–6308s, 2006
12. Minn AJ, Kang Y, Serganova I, et al. Distinct organ-specifi c meta- static potential of individual breast cancer cells and primary tu- mors. J Clin Invest 115:44–55, 2005
13. Mundy GR. Metastasis to bone: causes, consequences and thera- peutic opportunities. Nat Rev Cancer 2:584–593, 2002
14. Paterson AH. Adjuvant bisphosphonate therapy: the future. Sem- in Oncol 28( 4 Suppl 11):81–85, 2001
15. Roodman GD. Mechanisms of bone metastasis. N Engl J Med 350:1655–1664, 2004
16. Santini D, Caraglia M, Vincenzi B, et al. Mechanisms of disease:
preclinical reports of antineoplastic synergistic action of bisphos- phonates. Nat Clin Pract Oncol 3:1–14, 2006
17. Smith MR, Egerdie B, Hernandez Toriz N, et al. Denosumab in men receiving androgen-deprivation therapy for prostate cancer.
N Engl J Med 361:745–755, 2009
18. Wei B, Wang J, Bourne P, et al. Bone metastasis is strongly associ- ated with estrogen receptor-positive/progesterone receptor-nega- tive breast carcinomas. Hum Pathol 39:1809–1815, 2008
19. Winter-Vann AM, Casey PJ. Post-prenylation-processing en- zymes as new targets in oncogenesis. Nat Rev Cancer 5:405–412, 2005
20. Yoneda T, Hiraga T. Crosstalk between cancer cells and bone mi- croenvironment in bone metastasis. BBRC 327:679–687, 2005