Akadémiai Doktori Értekezés
A magyarországi gubacsatka kutatás (Acari: Eriophyoidea) elmúlt negyedszázadának eredményei
Dr. Ripka Géza
Budapest
2017
TARTALOMJEGYZÉK
1. BEVEZETÉS ... 3
1.1. Atkák testfelépítése és életmódja ... 6
2. ATKÁK GYŰJTÉSE, TÁROLÁSA ÉS PREPARÁLÁSA ... 11
2.1. Atkagyűjtési módszerek ... 11
2.2. Atkát tartalmazó növényminták feldolgozása és tárolása ... 12
2.3. Preparálási eljárások ... 13
2.3.1. Atkák testének kitisztítása ... 13
2.3.2. Tartós atkapreparátum készítésének módjai... 14
3. ATKÁK RENDSZERTANI BESOROLÁSA (TAXONÓMIA) ... 22
4. GUBACSATKA-FÉLÉK CSALÁDJAI – PHYTOPTIDAE, ERIOPHYIDAE, DIPTILOMIOPIDAE... 28
4.1. Rendszertan, alaktani és biológiai sajátosságok, életmód és elterjedés ... 28
4.1.2. Testfelépítés és életmód ... 28
4.1.3. Elterjedés és jelentőség ... 34
4.1.4. A gubacsatkák életmódjának néhány érdekessége ... 44
5. ÚJ TUDOMÁNYOS EREDMÉNYEK ... 50
6. IRODALOMJEGYZÉK ... 54
7. KÖSZÖNETNYILVÁNÍTÁS ... 76
8. ÖSSZEFOGLALÓ ... 78
9. SUMMARY ... 83
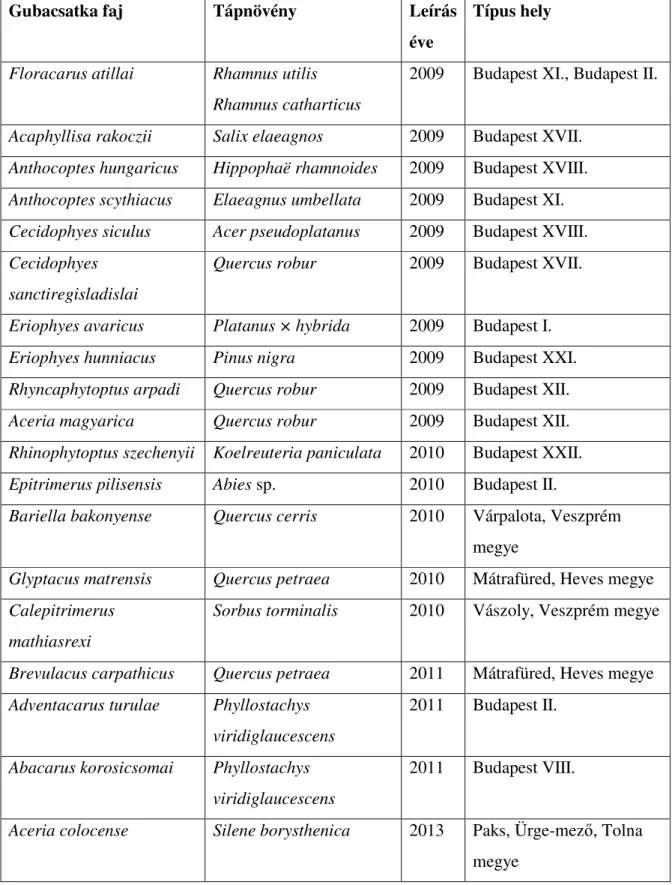
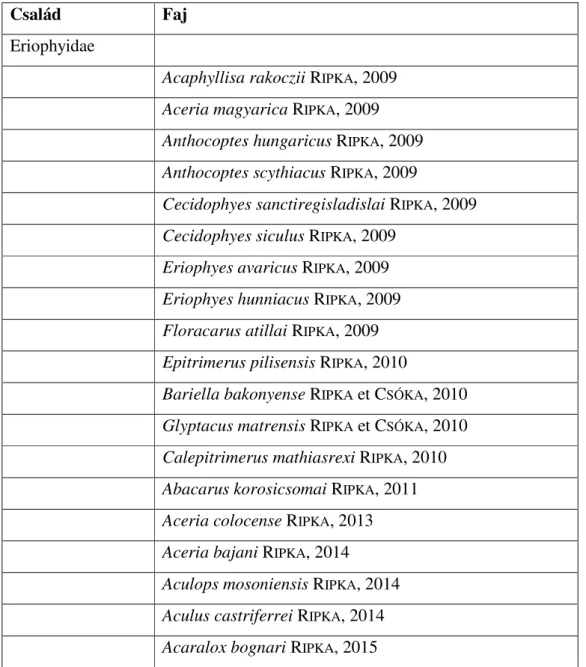
10. FÜGGELÉK ... 87
„Ha a kutatásaim másoknak fele annyi örömet szereznek, mint nekem, akkor én nagy jutalmat kaptam a munkámért.” A. D. Michael* (cit. G. O. Evans 1992)
1. BEVEZETÉS
Doktori (PhD) értekezésemet (Ripka 1997) a díszfákon és díszcserjéken élő levéltetű- és atkafauna vizsgálatából készítettem. A nyolcvanas években elkezdett kutatásaim során meggyőződhettem arról, hogy e fásszárú növényeken élő ízeltlábú fajokra – közöttük elsősorban az atkákra, levélbolhákra és levéltetvekre – vonatkozó hazai ismeretek meglehetősen hiányosak.
Az ezen csoportokra vonatkozó faunisztikai kutatásaimat tovább folytattam. 2010 a Biológiai Sokféleség Nemzetközi Éve volt. A közelmúltban megjelent összesítés szerint az állatvilág 40 törzsének 1.552.319 faja ismert (Zhang 2011a). Munkám céljaként a növényeken élő gubacsatkákra vonatkozó ismeretek magyar nyelven történő összefoglalását tűztem ki.
Értekezésem megírásakor két fontos célkitűzést fogalmaztam meg, egyrészt áttekintést adni a szakterület legújabb nemzetközi tudományos eredményeiről, másodsorban pedig összefoglalni a téma hazai – köztük saját – kutatási eredményeit. Kifejezett szándékom, hogy segítséget nyújtsak a téma iránt érdeklődő szakembereknek, egyetemi hallgatóknak az utóbbi két évtizedben a szakterületen felgyorsult morfológiai, élettani, rendszertani, faunisztikai és növényvédelmi kutatások legújabb eredményeinek a megismeréséhez. Jelen értekezés természetesen elsősorban a hazánkban termesztett, illetve a Kárpát-medencében őshonos növényeken található négylábú atkákkal kapcsolatos ismereteket tárgyalja, de kitekintést ad az Európában valamint a többi földrészen folyó szakterületi kutatások eredményeire is. A felhasznált irodalomban felsorolt közlemények – terjedelemtakarékossági okokból – nem ölelhetik fel valamennyi részterület összes fontos munkáját, ennek ellenére remélem, hogy olyanok is haszonnal tudják majd tanulmányozni, akik csak egy bizonyos téma iránt érdeklődnek. Ezen kívül érdemesnek tartottam összefoglalni az eddigi kutatási eredményeimet, melyek számos hazai és nemzetközi folyóiratban cikkek formájában megjelentek.
A növény- és állatrendszertant megalapozó Carl von Linné (1758) Systema Naturae (’A természet rendszere’) című művében 29 Acarus-fajt sorolt fel. Az első leírt atkafajok között található pl. a raktári kártevő Acarus siro L. (magyar neve lisztatka), valamint a ragadozó Acarus (= Anystis) baccarum (L.) és Acarus (= Anystis) salicinus (L.). Linnét megelőzően kevesebb, mint
100 atka- és kullancsvonatkozású irodalmi adatról tudunk. A legkorábbi ilyen témájú fennmaradt feljegyzés Kr. e. 1550 évvel Egyiptomban készült (Krantz 1971). Homérosz Kr. e. 850-ben kullancsról, mintegy 500 évvel később Arisztotelész sáskán élősködő atkáról írt. Jelenleg a mintegy 540 családból több mint 55.000 atka- és kullancsfaj ismert (Zhang 2011a), s a létező fajok becsült száma 1 millió lehet (Walter és Proctor 1999). (A másik nagy ízeltlábú csoportban, a rovarvilágban eddig mintegy 1.020.000 fajt írtak le (Zhang 2011a), s a reális becslések számukat 4 és 6 millió közé teszik (Gullan és Cranston 2005)).
Az atkák vizsgálatával önálló tudományágként az akarológia foglalkozik. Intenzív kutatásukat közvetlen növényvédelmi, köz- és állategészségügyi, valamint gazdasági hatásuk is indokolttá teszi.
Az akarológia mint modern tudomány alapjait a XIX. század végén és a XX. század elején Európában és Észak-Amerikában C. L. Koch, P. A. Latreille, W. E. Leach, G. Canestrini, A. D. Michael, A. Nalepa, A. Berlese, P. Kramer, A. C. Oudemans, N. Banks, E. Reuter, S. Thor, I. Trägårdh, H. G. Vitzthum és F. Grandjean rakták le. Az ő munkásságuk meghatározó volt e rendkívül népes és változatos ízeltlábú csoport megismerésében és az ismeretek rendszerezésében. Magyarországon elsőként Karpelles Lajos (1893) majd Jablonowski József (1900) közölt listát az ismert atkafajokról. A hazánkban növényeken és talajban előforduló atkafajok vizsgálatával számos nemzetközileg elismert magyar kutató foglalkozott a közel múltban, illetve foglalkozik napjainkban is, pl. Balogh János, Mahunka Sándor, Farkas Henrik, Bognár Sándor, Bozai József, Jenser Gábor, Kerényiné Nemestóthy Klára, Szabóné Komlovszky Ildikó, Kontschán Jenő és Ujvári Zsolt.
Ausztrál, kínai, egyesült államokbeli, kanadai, lengyel, orosz, olasz, német, brazil, dél-afrikai, iráni, indiai és török akarológusok folytatnak intenzív kutatásokat.
A környezet élő- és holt szervesanyagkészletének legváltozatosabb hasznosítói. A többségük csupán tizedmilliméteres nagyságot ér el. A legkisebb képviselőik egyes gubacsatkák (0,08 mm), míg a legnagyobbak a kullancsok között ismertek (30 mm).
Az atkák sikeresen népesítik be földünk különböző élőhelyeit, szinte minden szárazföldi és vízi életközösségben jelen vannak. Megtalálhatók az édes vizekben, a tengerekben, valamennyi szárazföldi élőhelyen a kietlen sivatagtól a tundráig, a trópusi síkságoktól a hegységek több ezer
méteres magasságáig, a talaj felszínén, és a talaj mélyebb rétegeiben, a növényeken, az állatokon, az állatokban és még az ember ruházatában is. Hogy milyen hihetetlenül sikeres képviselői az ízeltlábúaknak, azt jól mutatja az a tény, hogy talajban 10 méteres mélységben, tengeri árok 5000 méteres mélységében, illetve föld alatti meleg vizű források 50 °C-os vizében is élnek atkák. Kis méretük következtében olyan egészen különleges élőhelyeken is megtalálják életfeltételeiket, mint pl. a szobai légkondicionáló szűrőbetétje vagy a házi méh tracheája. Földünk valamennyi nagy ökoszisztémájában jelen vannak. Talajban a legnagyobb egyedsűrűségű ízeltlábú csoportot alkotják.
A legkorábbi fosszilis Acariformes atka lelet (Endeostigmata és Oribatida) a devonból, a földtörténeti ókor középső szakaszából ismert (USA, Norton és mtsai 1988). Kora 376–379 millió évre tehető. Míg a legkorábbi fosszilis Parasitiformes atka lelet a kréta időszakból (földtörténeti középkorból) származik (Walter és Proctor 2013).
Mint növényt károsító szervezetek viszonylag későn váltak ismertté. Napjainkban számos kultúrnövény valamint tárolt termény gazdaságilag jelentős kártevője tartozik ebbe az ízeltlábú csoportba. Mintegy 7000 növényfogyasztó fajt tartanak számon (Kane 2003). Vannak köztük betegséget terjesztő fajok, de ismeretesek biológiai védekezésben eredményesen felhasználható képviselőik is. Több csoportjuk fontos szerepet tölt be a tápanyagforgalomban a szerves anyagok lebontásával, átalakításával. Kisméretű ízeltlábúakkal táplálkozó állatok (pl. rovarok, atkák, hüllők, madarak) számára táplálékforrásul szolgálnak. Ezen kívül bioindikátorként alkalmasak a biológiai sokféleség valamint az élőhelyeken bekövetkezett változások (pl. emberi tevékenység, különböző szennyeződés, zavaró hatások) vizsgálatára.
Jelem értekezésembe beépítettem a doktori (PhD) értekezésem (Budapest, 1997) valamint a Növényvédelmi akarológia – kártevő és hasznos atkák című könyvem (Agroinform Kiadó, Budapest, 2009) vonatkozó részeit. A növényfajok tudományos nevének a szerepeltetésénél terjedelmi okok miatt eltekintettem a leíró nevének és a leírás évszámának a szerepeltetésétől. Az atkafajok tudományos nevének első említésénél a leíró nevét kiskapitális betűvel szedve tüntettem fel. Növényfajok esetében a leíró(k) neve, atkák esetében a leíró(k) neve és a leírás évszáma a Függelék vonatkozó táblázataiban normál betűkkel szedve található meg.
Remélem, hogy a növényeken élő végtelenül sokszínű atka együttesek megismeréséhez az eddigi tanulmányaimmal – mintegy kiegészítve az eddig meglévő képet néhány mozaikkal, – hozzá tudtam járulni.
1.1. Atkák testfelépítése és életmódja
Az atkák alaktani, valamint életmódbeli változatossága lényegesen meghaladja a többi csáprágós ízeltlábúét. Jelentős részük mikroszkopikus méretű. Testük szelvényezetlen, fejtoruk a potrohukkal összeolvadt. A többi ízeltlábúra jellemző valódi fej, a csápok, az alsó és felső állkapcsok valamint a szárnyak hiányzanak (Zhang 2003). A szelvényezettség csupán egy kis fajszámú csoportjukra (Opilioacarida) jellemző. Ezek megjelenésükben egyes ősinek tekintett kaszáspókokkal (Stylocellus) mutatnak hasonlóságot. Testtagolódásuk eltér a többi pókszabásúétól, ezért testtájaik megnevezésére önálló fogalmakat használunk. A test (idiosoma) a lábakat viselő előtestre (podosoma) és az utótestre osztható (Zhang 2003). A test elején, a hasi oldalon elhelyezkedő páros tapogatóláb (pedipalpus, röviden palpus) és az efölött a háti oldalon lévő szintén páros csáprágó (chelicera) − a hypostomával és az ajakkal (labrum) − alkotják a szájszervtájat (gnatosoma) (Fain és mtsai 1990). Az opistosoma előtti – a gnatosomát és a lábakat viselő – testrész neve prosoma (Walter és Proctor 1999). A test elején, a gnatosomán elsősorban a táplálkozást, illetve az érzékelést szolgáló szervek helyezkednek el, de egyes fajoknál (pl.
Tetranychidae, Anystidae, Cunaxidae, Eriophyidae, Tydeidae, Cheyletidae stb. családokban) a szövés képességét biztosító szerv is itt található. A kifejlett atkák testén (idiosoma) a többi életfunkciót – pl. mozgás, érzékelés, kapcsolatlétesítés, emésztés, kiválasztás, légzés és szaporodás – ellátó szervek találhatók. Az atkák többségénél a második és harmadik lábpár között húzódó barázda tagolja a testet két, többé-kevésbé elkülönülő testtájra, a proterosomára, valamint hysterosomára. A proterosoma elülső, általában jól elkülönülő része a szájszervtáj, a gnatosoma (capitulum), melyet a fej csúcsszelvénye, valamint háti oldalon a két csáprágó (chelicera), a hasi oldalon a két tapogatóláb (pedipalpus) alkotnak. A proterosomán 1–3 pár szem lehet. Túlnyomó részüknek redukálódott a szeme, de a fényt ezek is érzékelik. Az eltérő táplálkozásmódú atkák esetében a csáprágó felépítése jelentősen különbözik. A szúró-szívó szájszervű atkáknál a chelicera tű-, szigony- vagy szuronyszerű szúrósertévé, az ősibb rágó szájszervű atkák esetében, pedig ollóhoz hasonló fogókészülékké alakult. Más fajok esetében horogszerű, görbe karomban végződik. A hím Mesostigmata atkáknál a szaporodásban is szerepet játszik. A csáprágók 1–3 ízűek és alkotásuk életmódtól, táplákozásmódtól függően ollós, karmos vagy szigonyszerű. A csipeszhez, más esetben járólábhoz vagy csáphoz hasonló tapogatólábak legfeljebb hat ízből
állnak. A szájnyílás előtti tér a különböző rendek és családok esetében változatos. Az általában csőszerű, előre irányuló gnatosoma alsó és oldalsó részét a tapogatólábak összeforrt alapízei és azok függelékei alkotják. Ez az úgynevezett hypostoma. A hypostomán mint tálcán előrenyúló csáprágókat felülről a homlok kettőzete mint felsőajak, epistoma fedi. A gnatosoma általában mozgathatóan kapcsolódik a proterosoma első és második járólábat viselő részéhez, melyet propodosomának neveznek. A hátulsó főtesttáj, a hysterosoma további tagolása a harmadik és negyedik lábpárat viselő metapodosomára, valamint az opistosomára történik. Ez utóbbi a többi pókszabású utótestével azonos. Az utótest alakja legtöbbször kerekded és erőteljes háthasi lapítottságú, de féregszerű, görbült és másodlagosan gyűrűzött is lehet. Gyakran pajzsokkal fedett. A járólábak (4 vagy 2 pár, néhány kivétel esetében 3 pár) karmokat, tapadólebenyeket és érzékelő szőröket, valamint a víziatkáknál nagyméretű felületnövelő szőrzetet viselhetnek. A lábak erőteljesen megrövidülhetnek, részben redukálódhatnak. Lárváiknak általában három, egyes családok (Eriophyidae, Phytoptidae, Diptilomiopidae) kifejlett alakjainak csak két pár, vagy mindössze egy pár csökevényes lába van (néhány Podapolipidae családba tartozó faj nősténye).
Légzésük gyengén fejlett tracheákkal történik, melyek hiányozhatnak is. 1–4 pár jól látható légzőnyílásuk lehet, melyek elhelyezkedése rokonsági körökre jellemző. Jelenlegi rendszerezésükben ez komoly szerepet kap. A légcsőrendszer teljesen redukálódhat is. Szívük a kaszáspókokéhoz hasonló, legfeljebb két kamrából áll. Kiválasztószerveik csípőmirigyek, de Malpighi-edényeik is lehetnek (Opilioacarida, Ixodida, Mesostigmata). A parazita fajok tápcsatornájának tároló kapacitása a középbélhez kapcsolódó vakbelek (maximum hét pár) révén jelentős lehet. Végbélnyílásuk az opistosoma végén jellegzetes hosszanti rés, gyakran lemezekkel fedett. Váltivarúak, az ivari kétalakúság erőteljes lehet.
A legkülönbözőbb szárazföldi élőhelyek mellett az édesvizeket és a tengereket is benépesítik. Ez utóbbiak között vannak fajok, melyek a 4000 méternél mélyebb tengerek lakói. Táplálkozási módjuk szerint ragadozók, növényevők, korhadék- és egyéb szerves törmelékfogyasztók, azaz lebontók, valamint élősködők lehetnek. A kullancsfajok által közvetített kórokozók okozta súlyos betegségek (pl. vírusos agyvelőgyulladás, Lyme-kór) mellett egyre gyakoribbá válnak az atkák okozta allergiás eredetű, asztmás megbetegedések is. Ez utóbbiak elsődlegesen a városlakó embereket veszélyeztetik. A számos parazita, valamint növény- és készletkártevő atka köz- és
állategészségügyi, valamint gazdasági jelentősége mellett, egyre jobban felértékelődik néhány ragadozó atka gyakorlati jelentősége a biológiai védekezésre is alapozó növényvédelemben.
A fajok jelentős része folyékony halmazállapotú (pl. növényi nedv, nektár, mézharmat, állati testfolyadék, vér, váladék), a másik része szilárd (apró, darabos) táplálékot fogyaszt, ami a csáprágósok (Chelicerata) altörzsében egyedül itt fordul elő. A táplálékforrás lehet élő gazdaszervezet (mikroszkopikus élőlény, pl. baktérium, gomba; virágos és virágtalan növény;
állat; ember) vagy élettelen szerves anyag (elpusztult növény és állat, ürülék). Ez alapján ismeretes közöttük élősködő, ragadozó, parazitoid, növényevő, szerves törmelékfogyasztó, ürülékfogyasztó és dögevő faj. A táplálék emésztése, a fölösleges anyagok kiválasztása az opistosomában zajlik. A végbélnyílás az utótest végén található hosszanti rés, mely a szilárd táplálékot fogyasztó atkák esetében nagyobb, mint a nedveket fogyasztó fajoknál.
A lábak nem kizárólag a helyváltoztatás eszközei, hanem számos atka csoport esetében a táplálék felismerésében és megragadásában, valamint a szexuális partner érzékelésében, illetve az azzal való kapcsolatlétesítésben is szerepet játszik. Különösen a – tapogatólábhoz hasonlóan – nem kevés érzéksertével rendelkező első pár lábak ilyen elsődleges funkciója jelentős (Walter és Proctor 1999). A másik három pár láb alapvető feladata a test mozgatása. Az atkák lába a csípő (coxa), a tompor (trochanter), a comb (femur), a térd (genu), a lábszár (tibia), a lábtő/lábfej (tarsus) és az ambulacrum más elnevezéssel apotele ízekből áll. Bizonyos lábízek (leggyakrabban a tibia és a tarsus) egyes atkacsoportoknál összeolvadnak. A prelárva és a lárva hatlábú. A kifejlett gubacsatkáknak (Eriophyoidea) mindössze két pár, míg bizonyos áltakácsatkáknak (Tenuipalpidae) csak három pár lábuk van.
Elsődleges légzőszerveik a tracheák, a légcsövek (peritrema), amelyek bizonyos csoportoknál a testet behálózó légcsőrendszert alkotnak. A tracheák (peritrema) elhelyezkedése, alakja, tagoltsága több család esetében fontos diagnosztikai bélyeg. Az 1–4 pár légzőnyílás (stigmata) párosával a test különböző részein, általában annak szélén nyílnak: a Prostigmata atkáknál rendszerint a háti, a Mesostigmata atkák esetében a hasi oldalon. Az atkák számottevő részének nincs légzőszerve. Ezeknél a gázcsere a kültakarón keresztül történik (pl. Astigmata, Eriophyoidea). A fényt érzékelő egyszerű szemek (egy- vagy kétpár) – amennyiben vannak – a podosoma hátoldalán helyezkednek el. Az ivarnyílás a hasi oldalon található.
Az atkák szaporodásbiológiája változatos: a kétivaros, tehát megtermékenyítéssel (heteroszexuális) és a szűznemzéssel (partenogenezis) való szaporodás egyaránt megtalálható. Váltivarú atkák
esetében a hímivarsejtek átadása történhet közvetlenül párzással, azon fajoknál ahol a hím pénisszel (aedeagus) rendelkezik, illetve az átvitel történhet a gnatosomával, tapogatólábbal is, vagy közvetve, amikor pl. a hím kis csomagokban (spermatophore) helyezi el a növény felszínén azokat, amit a nőstény később felvesz és kis nyíláson keresztül behelyez a testébe. A szűznemzésnek több változata ismert. Ennek két leggyakrabban előforduló módja az arrhenotókia és a telitókia, mely előfordul több csoportjuknál (pl. Mesostigmata, Prostigmata, Oribatida). Az arrhenotók partenogenezis esetében a megtermékenyítetlen tojásokból hímek, a telitókia esetében pedig nőstények fejlődnek (Helle és Wysoki 1996). Ismertek olyan atkafajok (pl. az Anoetidae családban), amelyek esetében arrhenotók és telitók vonal egyaránt előfordul (Heinemann és Hughes 1969). Többségük tojásrakó, az álelevenszülés (ovoviviparia) és a lárvarakás (lárvaszülés) nem gyakori. Részleges átalakulással (anamorfózis) fejlődnek (Papp 1997). E tekintetben csak a sapkás pókokkal (Ricinulei) mutatnak hasonlóságot. A tojás és a kifejlett alak (adult) fejlődési fokozatok között egy lárva és 0–3 nimfastádium található. Kevés taxonnál a prelárva stádium is előfordul (amely pl. szájszerv és végtagok nélkül differenciálódott test; vagy test, ízekre még nem tagolt végtagokkal; vagy serték nélküli test serték nélküli végtagokkal). A nimfastádiumok neve proto-, deuto-/deutero- és tritonimfa. A szaporodásbiológiájuk változatosságát jól jellemzi, hogy ismeretes lárvanemzés is. A Pyemotidae és Siteroptidae családok fajaira jellemző, hogy a nőstény ivarérett utódokat szül. Családonként, illetve fajonként is különböző a nemzedékszámuk. Zárt termesztőberendezésben megfelelő körülmények között a közönséges takácsatka folyamatosan szaporodik, és egymást átfedő nemzedékek vegyes összetételű népessége található meg egy adott időpontban a növényen. Vannak közöttük magányosan, illetve lazább vagy szorosabb közösségben élő fajok. Az élőhely más élőlényéhez való viszonyukat tekintve ismeretes közöttük szimbionta, kommenzalista, mutualista és foréta faj.
Az atkák többrétegű kültakarója a sejtes szerkezetű epidermiszből és az általa kiválasztott belső és külső kutikulából áll. Ennek összetétele hasonló a többi ízeltlábú kültakarójához, mert kitin (poliszaharid fehérje mátrixban), lipidek, tannin és viasz alkotják. A vedlések után ez általában világos színű, ami a megszilárdulást (szklerotizáció) követően felveszi a fajra jellemző mintázatot és rendszerint sötétebb árnyalatú lesz. A köztakaró lehet egészen lágy, puha, de meglehetősen kemény is. A test felszínén található képletek és struktúrák (pl. lemezek, pajzsok, különböző rendeltetésű serték, nyúlványok, pórusok= lyrifissura, nyílások, rések, redők) fontos szerepet töltenek be a fajok azonosításában. A mechanikus és kémiai ingereket, a hőmérsékletet, a
páratartalmat valamint a fényhatást rendkívül változatos alakulású – a szájszervtájon, a testen (háti és hasoldali) valamint a lábakon található – serték segítségével érzékelik az atkák.
Optikai és kémiai tulajdonságok valamint a szerkezeti felépítés szerint négy fő típusa van a sertéknek. Ezek közül három típus az ún. „valódi” vagy normál serték közös tulajdonsága az anizotrópia: 1. közönséges serték, 2. eupathidia (a végtagok pórussal rendelkező, kémiai ingereket érzékelő sertéi) 3. famuli (végtagok nagyobb sertéi közelében lévő elágazó serték).
Ezzel szemben a negyedik csoport az érző- vagy szaglórudacska, más kifejezéssel különleges érzőcsövecske (solenidion, többes száma: solenidia) izotróp tulajdonságú. Tejsavban és sósavban nem oldódó, a tisztító ágensekkel végzett macerálást kibíró anyag található a belső magjában, ami polarizált fényben kettős törést mutat. Ezek a szaglórudacskák a láb három ízületén jelenhetnek meg: a térden, a lábszáron és a lábfejen, amiket a görög abc betűivel jelölnek az egyes ízületeknek megfelelően: genu – sigma, σ; tibia – fi, φ; tarsus – omega, ω. Ezek falán nyílások, pórusok találhatók.
A serték alakja rendkívül változatos lehet: tűalakú, pillás, fűrészes, fonalszerű, tövisszerű, botszerű, pálcikaszerű, fésűszerű, lapátalakú, lándzsaalakú, levélalakú, ékalakú, sarlóalakú, bunkóalakú, buzogányalakú, hegyes, tompa végű, elágazó és ezek kombinációi.
2. ATKÁK GYŰJTÉSE, TÁROLÁSA ÉS PREPARÁLÁSA
2.1. Atkagyűjtési módszerek
Az atkák az ízeltlábúak egyik olyan népes csoportját alkotják, amelyek – szemben több más csoporttal (pl. sáskák, bogarak, lepkék stb.) – apró testméretük (rendszerint 1 mm-nél kisebb) miatt, szabad szemmel nem vagy csak alig észlelhetők. Jelenlétük tehát nehezen állapítható meg.
A helyszínen történő vizsgálatot egy kézi nagyító (legalább 12× nagyítású) nagymértékben megkönnyíti. A növényfogyasztó atkák esetében rendszerint az okozott kártétel árulja el a jelenlétüket, különösen, ha nagy tömegben táplálkoznak. A gubacsot képező Eriophyoidea atkák esetében ezért észlelésük viszonylag egyszerű. Az atkák nagy része tulajdonképpen egész éven át gyűjthető. A fásszárú növényeken élő fitofág és ragadozó atkák jelentős része a téli időszakban is a gazdanövényen található. Sok faj egyedsűrűsége ingadozó. Van, amelyik fajnak tavasszal nagyobb az egyedszáma, míg egy másiknak ősszel. A kicsi egyedszámban jelenlevő atkák a növény kopogtatásával (ütögetésével) gyűjthetők. A növényről a papír vagy műanyag lapra lehullott atkát ebben az esetben a terepen gyűjtőfolyadékba kell helyezni. Helyszíni, egyeléssel végzett gyűjtés során az atka a növény felszínéről megnedvesített végű vékony ecsettel vehető le és kismennyiségű gyűjtőfolyadékot tartalmazó üvegcsébe vagy Eppendorf-csőbe helyezhető. Ha az atkát tartalmazó növényi rész eltávolítható, akkor azt papír- vagy polietilén-zacskóba kell tenni. A gyűjtő üvegen vagy a zacskón alkoholos filctollal fel kell tüntetni a gazdanövény nevét, a gyűjtés helyét, idejét és a gyűjtő nevét. A lezárt zacskót árnyékos helyen kell tárolni, s ha az anyag feldolgozására a gyűjtés napján nem kerül sor, hűtőszekrénybe kell tenni, ahol az állatok életben maradnak. Az előbbi módszereken kívül Bozai (1969a) részletesen ismertette a szippantóval végzett atka-begyűjtés módszerét, továbbá az egyedeknek a vizsgálati mintából való kinyerésének tölcséres, atkafuttatós és atkakefélő gépes megoldását. Hordozható motoros rovarszívó berendezéssel (pl. D-Vac) – több más ízeltlábú csoporthoz hasonlóan – atkák is gyűjthetők. Talajcsapdák szintén alkalmasak bizonyos fajok gyűjtésére. Az atkák a vizsgálati mintából (különösen talajt, vagy avart is tartalmazó mintából, tárolt terményből) tölcséres módszerrel (Berlese-tölcsér, Tullgren-féle tölcsérsor), továbbá levél felszínéről atkakefélő gép alkalmazásával is viszonylag rövid idő alatt, jó hatékonysággal kinyerhetők (Bozai 1969a, Upton 1991, Gerson és mtsai 2003).
2.2. Atkát tartalmazó növényminták feldolgozása és tárolása
Ha az atkákból nem készítünk azonnal mikroszkópi preparátumot, akkor a gyűjtött növényminta feldolgozása során gyűjtő (konzerváló) folyadékba kell az egyedeket tenni vagy más módon tartósítani. A gubacsatkákat tartalmazó növényi részeket - hajtás, levél, rügy, virágzat, termés - itatóspapír közé helyezve szobahőmérsékleten kell hagyni, megszáradni, majd borítékba téve, mint herbárium tárolható. A borítékra fel kell vezetni a gyűjtés idejét, helyét, a tápnövény nevét stb. A száraz növényi részről leszedett Eriophyoidea atkákból jó minőségű tartóspreparátum készíthető (Briones és McDaniel 1976). A herbáriumokat múzeumi kártevő rovarok számára nem hozzáférhető helyen kell tárolni. A növényi részek terepi vizsgálatához kézi nagyító, az atkák laboratóriumi legyűjtéséhez, preparálásához sztereo mikroszkóp, az atkákból készített mikroszkópi preparátum alapján való azonosításhoz fázis-kontraszt mikroszkóp szükséges.
A legtöbb atkacsoport konzerválására a számos kutató által ajánlott és használatos 70–80 %-os töménységű etilalkohol nem megfelelő. A hosszabb ideig ebben tárolt atkák kutikulája és végtagjai zsugorodnak, merevvé válnak, megnehezítve azok későbbi preparálását (Bozai 1969a, Keifer 1975, Szabóné Komlovszky 1980). Ehelyett Baker és mtsai (1996) 70%-os izopropil- alkoholt, vagy a Keifer-féle gyűjtőfolyadékot (szorbit, izopropil-alkohol és desztillált víz 1:1:1 arányú keverékét kis mennyiségű jódkristály hozzáadásával) javasolják. A jódkristály a penészgombák megjelenését akadályozza meg.
Atkák tárolására még az alábbi folyadékok alkalmazhatók: az Oudemans-féle folyadék (összetétele: 87 rész 70%-os etilalkohol, 8 rész ecetsav, 5 rész glicerin), az AGA oldat (összetétele: 8 rész 70%-os izopropil- vagy etilalkohol (240 cm3), 1 rész ecetsav (30 cm3), 1 rész glicerin (30 cm3), 1 rész szorbit (23,8 g)), vagy a Koenicke-féle folyadék (összetétele: 1 rész ecetsav, 3–4 rész desztillált víz, 5 rész glicerin) (Hughes 1961, Gutierrez 1985, Upton 1991, Amrine és Manson 1996). Kreiter és Bourdonnaye (1993) a 70%-os etilalkoholhoz 2–3% glicerin töltését ajánlja. Gubacsatkákat még 25%-os izopropil-alkoholban feloldott szorbitot tartalmazó híg szirupban lehet megfelelően tartósítani (Keifer 1975).
A binokuláris mikroszkóp segítségével a minta teljes felületét (levél színe, fonáka, érzugok, levélnyél és rügy illetve rügy és hajtás vagy vessző közti rész, virág, gyökér, hagyma, gumó, termés, kéregrepedések stb.) célszerű átvizsgálni. Az atkákat egy műanyagból vagy fából készített
szárba erősített rovartű (00 jelzésű minuciatű) vagy vékony ecset segítségével vagy azonnal tejsavba, vagy AGA oldatba kell helyezni. Zhang (2003) az élő atkák forró vízben való elölését ajánlja, hogy a végtagok kinyújtott helyzetben maradjanak, ami a jó minőségű preparátumkészítés egyik feltétele. A mintának adott számot a gyűjtőüvegen illetve később a mikroszkópi preparátumon is fel kell tüntetni a gazdanövény tudományos nevével, a gyűjtés helyével, idejével, a gyűjtő nevével együtt. A növényen szabad szemmel vagy mikroszkóppal látható elváltozásokat, s amennyiben volt, a kártétel jellegét szintén szükséges lejegyezni. Egy gyorsabb módszer az atkák legyűjtésére azok növényi mintáról történő lemosása. Először néhány csepp mosogatószert kell a szükséges mennyiségű vízbe cseppenteni, majd a növényi részt bele kell tenni a folyadékot tartalmazó edénybe. Alapos keverés és rázás után a folyadékból megfelelő sűrűségű szűrővel lehet az atkákat kigyűjteni.
2.3. Preparálási eljárások
2.3.1. Atkák testének kitisztítása
Bizonyos atkákból előzetes tisztítás nélkül is megfelelő minőségű mikroszkópi preparátum készíthető. A többségét viszont, különösen a pigmentált, sötét színű vagy viaszt kiválasztó egyedeket – jó minőségű tartóspreparátum készítéséhez – előzetesen átlátszóvá kell tenni. Ez azt jelenti, hogy az atkák testéből el kell távolítani a lényeges morfológiai jellemzők vizsgálatát zavaró testtartalmat és festékanyagot (pigmentet). A legtöbb atka tisztítására alkalmas tejsav mellett a laktofenol (összetétele: 50 rész tejsav, 25 rész fenol kristály, 25 rész desztillált víz), az André-féle folyadék (összetétele: 1/3 rész ecetsav, 1/3 rész klorálhidrát, 1/3 rész víz /súly/), a Nesbitt-féle folyadék (összetétele: 40 g klorálhidrát, 25 cm3 desztillált víz, 2,5 cm3 koncentrált sósav) (Krantz 1978), és a Keifer-féle Booster (összetétele: 3 g szorbit, 7,5 g klorálhidrát, 1 g jódkristály, 15 cm3 desztillált víz, 1 cm3 koncentrált sósav) használható (Amrine és Manson 1996). Ezek közül a Nesbitt-féle folyadék a legerősebb ágens, s használata egyben a leggyorsabb műveletet biztosítja a tisztításra. Fontos megemlíteni, hogy mind a fenol, mind a klorálhidrát mérgező vegyület, használatuk során nagyon gondosan kell eljárni. Gubacsatkák átlátszóvá tételére Baker és mtsai (1996) az 50 ml desztillált víz, 200 g klorálhidrát, 20 g glicerin, 1 g káliumjodid és 2 g jód összetételű folyadékot ajánlják, ami tulajdonképpen a gumiarábikumot
nem tartalmazó, jód hozzáadásával módosított Hoyer-féle közeg. A folyamat gyorsítható, ha 95
°C-os meleg lapra tesszük a tisztító folyadékba helyezett atkákat tartalmazó mélyített tárgylemezt.
Hughes (1961) a színtelen atkák tisztítására és egyben festésére a rózsaligninnel színezett tejsav (összetétele: 60 rész tejsav, 40 rész glicerin, kevés rózsalignin) használatát javasolja. Gutierrez (1985b) a rózsaligninnel pirosra festett tejsavval végzett tisztítást tartja a legjobbnak. 40-60 °C-os meleg lapon tartva 1-2 óra alatt elérhető a szükséges tisztaság. Abo-Korah (1985) a tetűatkák tisztítására 15%-os kálium-hidroxidot használt. Kreiter és Bourdonnaye (1993) a Phytoseiidae atkák tisztítására a tejsavat ajánlja. Az egyedeket óraüvegbe öntött tejsavban 40–60 °C-on több napig tartva érhető el a kívánt tisztaság. Ennek az időigénye atkacsoportonként (színüktől és a szklerotizáció vagy kitinizáció fokától függően) jelentősen eltér, pl. gubacsatkák esetében hosszabb, Phytoseiidae és Tydeidae atkák esetében rövidebb. A tisztaság fokát mikroszkópos vizsgálattal lehet ellenőrizni.
Gyors vizsgálatra a kitisztított atkából, azt tejsavba ágyazva készíthető nem tartós mikroszkópi preparátum. Az atkák és a tárgylemez tisztítását követően tárgylemezre cseppentett tejsavba egy műanyag- vagy fa szárba erősített vékony rovartűvel kell az atkát áttenni. A műveletet megkönnyíti, ha a rovartű végét kissé begörbítjük. Az atka testét és végtagjait óvatos mozdulatokkal kell a megfelelő helyzetbe igazítani (kinyújtani, kitárni). Utána a fedőlemezt lassú mozdulattal kell a cseppre helyezni. Mélyített tárgylemez is használható ideiglenes preparátum készítéséhez, különösen viszonylag nagyméretű, domború és erősen szklerotizált atkák esetében, pl. Oribatida.
2.3.2. Tartós atkapreparátum készítésének módjai
Ízeltlábúakból tartós mikroszkópi preparátum készítéséhez háromféle hagyományos preparáló közeg használata terjedt el:
1. gumiarábikum (porított akáciamézga)–klorálhidrát közeg 2. polivinil-alkohol–tejsav közeg
3. kanadabalzsam
Az első kettő oldószere desztillált víz, a kanadabalzsamé viszont xilol.
Upton (1993) részletes történeti áttekintést adott a vizes gumiarábikum–klorálhidrát tartalmú, sok szerző által tévesen Berlesenek illetve más kutatóknak tulajdonított preparáló
folyadéknak a kisméretű ízeltlábúak preparálásában betöltött szerepéről. A XIX. században Hoyer készítette az első gumiarábikum–klorálhidrát–glicerin–desztillált víz összetételű preparáló folyadékot, amelyet a XX. században számos kutató módosított. A Hoyer-féle médium összetétele a következő: 30 g gumiarábikum, 200 g klorálhidrát, 50 ml desztillált víz, 20 ml glicerin (Upton 1993). A gubacsatkák gyors preparálására használt módosított Hoyer-féle oldat az előbbi összetevők mellett még 1 g káliumjodidot és 2 g jódot tartalmaz (Schuster és Pritchard 1963). A Hoyer-féle preparáló közeg és annak több mint tízféle változata általánosan elterjedt a levéltetű- illetve atkapreparálással, határozással foglalkozó szakemberek körében. A változtatások döntően az alaprecept két fő összetevőjét: a glicerint és a klorálhidrátot érintették. A glicerint tartalmazó preparáló közegek közül a Hoyer-, a Singer-, a Jeppson és mtsai-, a Puri- valamint a Rusek-féle a magas 47,6–72 súly % klorálhidrát-tartalmúak közé tartoznak. A Faure-, a Ewing-, a Doetschman- valamint az Eastop és van Emden-féle közegek klorálhidrát tartalma alacsony:
22,4–32,2 súly %. A glicerint nem tartalmazó közegekben glicerin helyett ecetsav és glükóz szirup szerepel. Ez utóbbiban a magas klorálhidrát-tartalmú Davidson és Swan-féle közegekben 54,5–76,2 súly % a klorálhidrát-tartalom, míg a Womersley és Stroyan nevéhez fűződő alacsony klorálhidrát-tartalmú folyadékban 23,7–25,7%.
A legtöbb gondot az ismertetett közegek esetében a viszonylag rövid idő elteltével a preparátumban megjelenő klorálhidrát kristályok okozzák (Upton 1993). A gumiarábikum biztosítja a közeg viszkózus állapotát, megakadályozva a klorálhidrát kristályok képződését. A klorálhidrát túlzott csökkentése a preparált állatok rövid időn belül bekövetkező gyűrődéséhez vezetnek. Ewing (1939) glükóz szirup, Jeppson és mtsai (1975) szorbit hozzáadásával igyekeztek a kloráhidrátot oldatban tartani, míg Doetschman a glicerin mennyiségét növelte meg. Keifer (1979) cit. Amrine és Manson (1996) a Hoyer-féle preparáló folyadékban a gumiarábikumot benzofenon-tetrakaboxil-dianhidriddel (BTDA) helyettesítette.
Általában egylépéses preparáló közegként használják a Hoyer-féle médiumot, tehát az atkát közvetlenül helyezik a tárgylemezre cseppentett folyadékba, majd azonnal ráteszik a fedőlemezt. Így az atka a közegben kell, hogy a kívánt mértékben kitisztuljon (Fain és mtsai 1990). Ez a folyamat elektromos melegítő lapon vagy termosztátban történő melegítéssel gyorsítható. Kono viszont egy előzetes tisztító közeg használatát ajánlja a Hoyer-féle közegben történő preparálás előtt (= kétlépéses preparálás) (Jeppson és mtsai 1975). Ennek az összetétele:
100 g klorálhidrát, 10 g glicerin, 50 cm3 desztillált víz, 1 cm3 tömény sósav. Ebben a Kono-féle
keverékben kell az atkákat óvatosan melegíteni, majd a megfelelő tisztaság elérése után Hoyer- féle közegben átmosni. Végül a tárgylemezre tett Hoyer-féle médiumba ágyazzuk az atkát. A kész preparátumot nem kell melegíteni.
A kutatók egy része szükségesnek tartja a preparátumok bekeretezését, pl. kanadabalzsammal, körömlakkal, festékkel, mások szerint ez szükségtelen a mérsékelt égövben. Hasonlóan megoszlanak a vélemények a kész preparátumok melegítésével (45–50 °C), és annak idejével kapcsolatban. Zhang (2003) a Hoyer-féle közeg használatával készült preparátumok 60 °C-ra történő melegítését javasolja az atka teljes kitisztulásáig (egylépéses preparálás esetén, a szerző megjegyzése). Gerson és mtsai (2003) szerint 40 °C-on egy–két hetes szárítás szükséges az egyedek teljes kitisztulásához és az előbbi közeg megszilárdulásához. A vizet tartalmazó közegek preparátumait 45–60 °C-on 7–10 napig kell szárítani (Fain és mtsai 1990), majd ecset segítségével gondosan be kell keretezni, tulajdonképpen szigetelni, a fedőlemez mentén Glyceel, Euparal nevű anyaggal vagy színtelen körömlakkal (akár több rétegben) (Zhang 2003).
Upton (1993) annak ellenére, hogy a romló minőségű preparátumokat víz felhasználásával viszonylag egyszerűen restaurálni lehet, kritikai munkájában nem ajánlja e közegek használatát.
A kanadabalzsamot és a szintetikus gyantabázisú Euparalt javasolta felhasználni azoknak, akik tartós preparátumokat akarnak készíteni, különösképpen típuspéldányok esetében. Amrine és Manson (1996) gubacsatkák tartós preparálására szintén nem tartja megfelelőnek a Hoyer-féle közeget, mert abban idővel elszíntelenedik az atka, vagy homályos lesz, illetve összezsugorodik.
A polivinil-alkohol–tejsav keveréket tartalmazó közeg (rövidítve PVA) az előzőekben felsorolt hátrányok kiküszöbölésére készült. Schmutterer (1959) a Heinze receptje által összeállított polivinil-alkohol–laktofenol közeget pajzstetvek preparálásához javasolta felhasználni. A Heinze-féle PVA médium összetétele a következő: 10 g polivinil-alkohol, 40–60 ml desztillált víz, 35 ml tejsav (85–92%), 25 ml 1%-os fenol oldat, 10 ml glicerin, 100 g klorálhidrát (Zhang 2003). Danielsson (1985) jó eredményeket ért el a PVA használatával levéltetvek, levélbolha lárvák, liszteskék, pajzstetvek, tripszek, hártyásszárnyúak preparálása esetén is. Kristályosodást nem tapasztalt tíz év elteltével sem a preparátumokban.
Heikinheimo (1988) két napig 55–60 °C-on, Danielsson (1985) egy hétig 70 °C-on javasolja szárítani a PVA preparátumokat. A kanadabalzsamos vagy lakkos bekeretezést nem ajánlják.
A kanadabalzsam a leginkább időtálló preparáló közeg. Hibája, hogy a fénytörési mutatója rosszabb az előző közegeknél és az oldószere a mérgező és illékony xilol, továbbá a preparálás
folyamata nagyon munka- és időigényes. A beágyazás előtt az egyedeket többlépéses eljárással (alkohol – xilol – eugenol, vagy szegfűszeg-, vagy citromolaj, többszöri áztatással) teljesen vízteleníteni kell (Ilharco és Lemos 1981).
Az állatokon kívül a tárgylemezt is alaposan meg kell tisztítani 96%-os etilalkohollal. Ezután a kellően kitisztított, desztillált vízben leöblített és víztelenített állatokból 1–4 egyedet a tárgylemez közepére cseppentett megfelelő mennyiségű médiumba teszünk. Mikroszkóp és tű segítségével az állatok lábait elrendezzük. Takácsatkák esetében a hímeket nem hát-hasi, hanem oldalnézetben kell elhelyezni az aedeagus (penis) vizsgálhatósága miatt. A fedőlemezt óvatosan a közegre helyezzük. Vízzel le nem mosható tintával az azonosításhoz szükséges adatokat a preparátumra kell írni.
A legtöbb atkacsalád beágyazására a Hoyer-féle preparáló médium illetve ennek változatai terjedtek el (Hughes 1961, Bozai 1969a, Karg 1971, Krantz 1978, Livshitz és Mitrofanov 1975, Jeppson és mtsai 1975, Fain és mtsai 1990, Smiley 1992). Bozai (1969a) ismertette a rózsalignin–
tejsav–glicerin keverék felhasználásával történő takácsatka festést valamint megemlítette a Reck által módosított Hoyer-féle folyadék és a Ribeiro-féle polivinil-alkoholos beágyazó közeg használatát ennél az atkacsaládnál. Karg (1971) a polivinil-laktofenolos médiumot a Phytoseiidae atkákkal kapcsolatban közölte. Beer (1954) a tetűatkák preparálására a polivinil-alkohol–
laktofenol közeget találta a legmegfelelőbbnek. Az élő atkát vagy az alkoholból kivett atkát közvetlenül a tárgylemezre cseppentett közegbe kell helyezni. A fedőlemezzel történt lefedés után rövid ideig tartó óvatos melegítés szükséges. A C-M médium illetve a Hyrax is használható atkák (pl. tetűatkák) preparálására (Beer 1954, Hughes 1961). Takácsatkák és Acaridae atkák preparálására Keifer (1953) kétlépéses módszert ajánlott. Az atkákat először a 4 cm3 fenol, 12 cm3 tejsav, 0,5 g rezorcin, 0,5 g káliumjodid, 16 csepp sósav összetételű tisztító oldatban kell a kívánt tisztaság eléréséig melegíteni. A kihűlt oldathoz kereskedelmi töménységű formaldehid oldatot kell cseppenteni s legalább fél óráig állni hagyni. A formaldehid az atkák testét és lábát megvédi a későbbi zsugorodástól, begörbüléstől. A beágyazás 1 g gumiarábikum, 1 g cukor, 10 g klorálhidrát, 0,25 g jódkristály, 0,5 g káliumjodid, 2 cm3 glicerin, 1–3 cm3 fél töménységre higított formaldehid összetételű végleges közegbe történik. Keifer a közegkészítés pontos menetét is közölte, ami tulajdonképpen minden preparáló anyag készítéséhez elengedhetetlen. A preparáló közeg minősége jórészt az összeállítás sorrendjén, az oldódási időn és az esetleges melegítés kivitelezésén múlik (mindig a részletekben bújik meg...).
Saito és Osakabe (1992) új atkafixáló anyagot és tartósító módszert fejlesztettek ki Phytoseiidae és takácsatkák preparálására. A 99,5%-os metilalkohol és 99,3% ecetsav illetve desztillált víz keverékéből álló MA folyadékban 1 nap–1 hét időtartamig tárolt atkákból jó minőségű mikroszkópi preparátum készíthető a Hoyer-féle közeg felhasználásával. Az atkák teste, lába nem rövidült, nem görbült meg szemben a kizárólag 70%-os etilalkoholban fixált egyedekével. Ez az anyag a pásztázó (scanning) elektronmikroszkópos vizsgálatokhoz is jól használható. Az MA folyadékban történt fixálás után az atkák 70%-os etilalkoholban tárolhatók.
Több akarológus szerint a kanadabalzsam nem megfelelő médium az atkák tartós preparálására. Saito és mtsai (1993) a takácsatkák kanadabalzsamba történő beágyazásának módszerét dolgozták ki. Az atkákat 1–2 napig 2:2:1 arányú metilalkohol : ecetsav : desztillált víz összetételű MA 80 folyadékban fixálták. A tisztítást a fixáló folyadékhoz töltött hasonló mennyiségű tejsavban végezték 55–60 °C-on néhány (2–7) napig. Ha nem tisztultak ki kellően az atkák, akkor 55 °C-on egy napig 10%-os kálium-hidroxidban folytatták a macerálást. Az atkákat etilalkoholban mosták át, majd savanyú fuxinban 25 °C-on 1–2 órán keresztül festették. Ezután 70 %-tól 99,5%-ig fokozatosan töményedő etilalkoholos víztelenítés következett 10–30 perces időközönként. A legalább 1 napig 99,5%-os etilalkoholban történt víztelenítés után kémcsőben α- terpineolba kell ügyes művelettel az atkákat átcsúsztatni. Az atkákat az α-terpineolból pipetta segítségével kell a tárgylemezre helyezni, majd ott a megfelelő testhelyzetbe állítani. Az atka mellé a tárgylemezre vékony selyemszálat kell tenni, majd a fedőlemezt óvatosan ráhelyezni az α-terpineolban preparált atkákra. Ezután híg kanadabalzsamot kell a fedőlemez széléhez cseppentve a fedőlemez alá a szűrőpapírral eltávolított α-terpineol helyére bejuttatni. A preparálás a tárgylemez alsó oldaláról vékony csúcsú elektromos melegítő vassal végzett, legfeljebb 5 percig tartó melegítéssel fejeződik be. A japán kutatók ezzel a meglehetősen bonyolult és jó kézügyességet, gyakorlottságot igénylő módszerrel kiváló minőségű (kinyújtott lábú, tiszta, éles kontúrú) preparátumokat készítettek. Véleményük szerint taxonómiai vizsgálatokhoz, típuspéldányok preparálásához ez a legjobb módszer.
A gubacsatkák preparálására Keifer dolgozott ki több módszert (Keifer 1940a, 1951, 1952, 1954, 1975). Három lépésből álló módszerében először az 1 g gumiarábikum, 3 g rezorcin, 0,2 g káliumjodid, 0,35 g jódkristály, 10 cm3 tejsav, 8 csepp sósav összetételű tisztító közegbe ('Keifer 1') kell az atkákat helyezni, s melegíteni (Keifer 1952). Az 1 g cukor, 8 g klorálhidrát, 0,2 g káliumjodid, 0,35 g jódkristály, 30 csepp fél-töménységre higított formaldehid közbülső
közegbe ('Keifer 2') az atkákat áttéve 1–2 napig ebben tarthatók. A kristályos jód a rendkívül kisméretű atkák határozása szempontjából legfontosabb morfológiai bélyegek kiemelésére használt kontrasztnövelő színezőanyag. A 0,5 g gumiarábikumot, 0,5 g cukrot, 7 g klorálhidrátot, 0,2 g káliumjodidot, 0,2–0,35 g jódkristályt és 18 csepp negyedtöménységű formaldehidet tartalmazó tartós közegbe ('Keifer 3') történik a beágyazás. Keifer (1954) módosította az előbbi anyagok összetételét. Az első, tisztító közeg 50 g rezorcint, 20 g diglikolsavat, 25 cm3 glicerint, kevés jódot és 10 cm3 vizet tartalmaz. A kívánt tisztaság eléréséig ebben a folyadékban kell az atkákat melegíteni. A második közeg további tisztításra valamint végleges beágyazásra is alkalmas. Összetétele 25 cm3 fehér karo szirup (keményítőmentes), 125 g klorálhidrát, 5 cm3 glicerin, kis mennyiségű jódkristály és 15 cm3 víz. Az atkákat ebben a közegben melegítve a tisztítási folyamat tökéletesíthető.
A végső közeg receptje: 12 cm3 keményítőmentes karo szirup, 60 g klorálhidrát, kis mennyiségű káliumjodid kristály, 2 g jódkristály, s a kívánt hígítás eléréséhez szükséges mennyiségű formaldehid oldat. A gubacsatkákat tűvel ebbe a közegbe helyezve, majd fedőlemezzel lefedve készíthető jó minőségű tartóspreparátum. Keifer enyhe melegítést javasolt utolsó mozzanatként.
Az említett szerző ebben az esetben is közölte a közegek elkészítésének pontos menetét.
Keifer (1975) később egy újabb közeget fejlesztett ki az Eriophyoidea atkák preparálására. A formaldehid közegnek (F-médium) nevezett anyag az előzőtől abban tér el leginkább, hogy gumiarábikumot tartalmaz. Összetétele a következő: 3 g szorbit, 1 g gumiarábikum, 0,02 g jódkristály, 5 cm3 4%-os formaldehid oldat, 14 g klorálhidrát, 1 cm3 glicerin, 0,1–0,2 g káliumjodid, 0,1–0,2 g jód. Ebben a közegben történik a tisztítás is – mélyített tárgylemezen melegítve az atkákat – 1 csepp sósav és 1 csepp fenol hozzáadásával. Amint az atkák átlátszóvá váltak egy csepp F-médiumban óvatosan át kell azokat öblíteni, majd tiszta tárgylemezre cseppentett F-médiumba kerülnek beágyazásra. Egy tárgylemezre 5–10 egyedet érdemes preparálni. A fedőlemez ráhelyezése előtt Keifer kapok1 rostszál (kapok fiber) behelyezését ajánlotta az atkák köré, megelőzendő az egyedek túlzott szétnyomását. A fedőlemez óvatos mozgatásával a preparált atkák tulajdonképpen forgathatókká, gördíthetőkké váltak. A tökéletes testhelyzet beállítása egyszerűvé vált. Vattaszállal helyettesíthető a jelenleg nem forgalmazott
1kapokfa vagy pamutfa (Ceiba pentandra, Bombacaceae) hosszúkás termése belül fehér, a gyapot terméséhez hasonló rostszálak tömegét tartalmazza. Párnák töltőanyagául, mentőövek készítésére használják.
kapok szál. Melegíteni nem kell a preparátumokat, bekeretezni viszont célszerű. Gyors, intenzív tisztításra az 1 g szorbitot, 2,5 g klorálhidrátot, kis mennyiségű jódkristályt, legalább 5 cm3 vizet, 7–8 csepp sósavat tartalmazó ún. Booster keveréket ajánlotta. Briones és McDaniel (1976) Keiferre hivatkozva négy, az előzőekhez alapjában véve hasonló tisztító-, Booster-, öblítő- (mosó) és beágyazó (végső) médiumot ismertettek szintén gubacsatkák tartós preparálására. A súlyarányokon kívül a nagyobb eltérés az előző közegektől az, hogy a Booster keverék ebben az esetben glicerint tartalmaz, valamint az öblítő médium kivételével mindegyikben szerepel karo szirup vagy méz. Mikroszkópi fényképezés esetén nem javasolták a kapok rost- vagy vattaszál behelyezését a tárgylemez és a fedőlemez közé, érthető okokból.
Összefoglalóan, az élő illetve AGA oldatban esetleg 70 %-os etilalkoholban tárolt atkákat görbe végű preparáló tűvel óraüvegbe töltött tejsavba kell helyezni s szobahőmérsékleten tartani több hétig. Amennyiben nem világosodtak ki a szükséges mértékig, akkor az André- vagy a Nesbitt-féle folyadékban folytatható az állatok, pl. Tenuipalpidae, Cheyletidae fajok tisztítása. Ha a tejsavas illetve az André- vagy Nesbitt-féle folyadékos tisztítással kellő tisztaságot sikerült elérni, akkor az egyedeket 'Keifer 2' közegbe kell helyezni festés céljából, mélyített tárgylemezre.
A 'Keifer 1' közeg használatát több okból célszerű elhagyni. Ugyanis a 'Keifer 1' közeg, annak rezorcin tartalma miatt, a 'Keifer 2' közeggel érintkezve kocsonyássá válik. A gélszerű anyag akadályozza az atkák kiemelését és áttételét. A 'Keifer 2' közegben való tisztítás és festés után a 'Keifer 3' közegbe kell beágyazni az atkákat. A takácsatkákat, a Phytoseiidae, a Stigmaeidae, a Tydeidae, a Iolinidae, a Triophtydeidae és az Acaridae atkákat nem szükséges festeni a 'Keifer 2' közegben. Ezekből az atkákból megfelelő minőségű preparátum készíthető úgy is, ha a tejsavból közvetlenül 'Keifer 3' vagy F-közegbe helyezzük azokat. A gubacsatkákat fél-másfél óráig kell a 'Keifer 2' médiumban tartani. A preparátumokat a megjelölés, feliratozás után 33 °C-on termosztátba szükséges tenni szárítás céljából, több hétre. Takácsatkák, laposatkák, gubacsatkák, Phytoseiidae, Stigmaeidae, Tydeidae, Iolinidae, Triophtydeidae, Acaridae és Winterschmidtiidae atkák preparálására használható az F-médium (Keifer 1975), a Keifer által javasolt végső médium (Keifer 1953) valamint a Singer-, a Hoyer-, a Jeppson és szerzőtársai-féle vizes gumiarábikum–
klorálhidrát közegek, illetve a Heinze-féle PVA. A tetűatkákat Hoyer-féle preparáló közegbe célszerű preparálni. Napjainkban a készen kapható Euparalt széles körben használják az atkák tartós preparálására.
Kellő kézügyesség, megfelelő gyakorlat és a türelem nélkülözhetetlen kellékek a jó preparátum készítéséhez.
Az atkák azonosításában is alkalmazzák már az elektroforetikus, az immunológiai és a molekuláris genetikai módszereket (pl. PCR). Ennek során olyan izoenzim, genetikai és biokémiai markereket vizsgálnak, amelyek segítségével esetleg tisztázhatók a hagyományos vizsgálati módszerekkel nem megoldható taxonómiai problémák is. Nagy lendületet kapott a mitokondriális és a sejtmag DNS vizsgálata ebben az ízeltlábú csoportban is. Jelenleg a három család 74 genuszának 1737 bázissorrendjére vonatkozóan van adat a nemzetközi adatbázisban (GenBank, www.ncbi.nlm.nih.gov, 2016. október 20).
A pásztázó elektronmikroszkópos képalkotás (SEM) nagy segítséget tud nyújtani a taxonómusoknak olyan morfológiai részletek vizsgálatához, amely a kutató (fény) mikroszkóppal nem biztosítható. Ha az atkák fixálása, víztelenítése és vákuumgőzöléssel történő egyenletes vezetőréteggel (arany, arany-palládium, platina) való bevonása nélkül készítünk ilyen felvételeket, akkor ez egy kifejezetten gyors módszer, mely alkalmas olyan alaktani részletek vizsgálatára, amelyek fáziskontraszt mikroszkóppal nem végezhetők.
A konfokális pásztázó mikroszkópi (confocal laser scanning microscope, CLSM) képalkotás egy új egyre inkább terjedő korszerű lehetőség illetve eszköz az atkák nagyon aprólékos vizsgálatához. Ebben az esetben az atkákból Hoyer-közeg felhasználásával mikroszkópi preparátumot szükséges készíteni.
Az atkákat Zeiss Stemi 2000-C sztereo binokuláris mikroszkóp segítségével fa szárba erősített rovartűvel egyenként szedtem le a növénymintákról. Az atkák legyűjtéséhez atkafuttatót, atkakefélő-gépet valamint azok folyadékba történő lemosását nem alkalmaztam. Az óraüvegben végzett tejsavas tisztítást követően Keifer-féle preparáló közegekbe (’Keifer 3’- illetve F- médium) vagy Hoyer-féle preparáló folyadékba ágyazva készítettem a tartós mikroszkópi preparátumokat. A preparált atkák morfológiai, morfometriai vizsgálatait Nikon Eclipse E 600 fáziskontraszt kutatómikroszkóppal végeztem. A tudományra új fajokról Nikon Y-IDT rajzoló feltét segítségével készítettem rajzokat. Néhány faj esetében a morfológiai bélyegek vizsgálatához gyors módszerrel pásztázó elektronmikroszkópos felvételeket (PEM/SEM/) is készítettem a Magyar Tudományos Akadémia Természettudományi Kutató Központjában. A preparáló mikroszkópos vizsgálat során az élő egyedeket a levélről leemeltem és közvetlenül a Zeiss EVO 40 XVP készülék mintatartó asztalát (tárgytartóját) borító kétoldalán ragasztós bevonatú korongra
helyeztem. A pásztázó elektronmikroszkópos felvételek az atkák víztelenítése és vákuumgőzöléssel történő egyenletes vezetőréteggel (arany, arany-palládium, platina) való bevonása nélkül készültek.
3. ATKÁK RENDSZERTANI BESOROLÁSA (TAXONÓMIA)
Az atkák (Acari) az ízeltlábúak (Arthropoda) törzsén belül a csáprágósok (Chelicerata) altörzsébe tartozó kisméretű szárazföldi és vízi állatok. Lábaik ízekre tagoltak, kültakarójuk kitinizált. Több mint 55000 ismert fajukat mintegy 540 családba és közel 5500 genuszba sorolják, de jelentős hányaduk még ismeretlen a tudomány számára. Az atkák monofiletikus származása továbbra is nyitott kérdés. Emellett hosszú ideje nincs általánosan elfogadott rendszer ebben az ízeltlábú csoportban (Krantz 1978, Evans 1992, Smiley 1992, Walter és mtsai 1996, Walter és Proctor 1999, Zhang 2003). Már rendsorozat és rend szinten eltérések vannak. Alrend szinten a rendszerezés változó, cseppfolyós állapotban van. Rend szinten a légző rendszer jellemzői alapján történik az osztályozás (Evans 1992). Van der Hammen (1973) és Lindquist (1984) cit. Evans (1992) két fő csoportra osztotta az Acari akkor alosztályt: Anactinotrichida és Actinotrichida.
Ennek az alapja egy actinochitin (amely elnevezés később actinopilinre változott) nevű optikailag aktív vegyületnek az előfordulása az atkák érző szervecskéiben, testfüggelékeiben, pl. a sertékben. A serte, érzékserte (trichobothrium) és érzőrudacska belső magját, vagy azokban egy réteget képező actinopilin ellenáll a tejsavban és sósavban végzett macerálásnak, és polarizált fényben kettős törésű (Grandjean 1935, 1970 cit. Evans 1992). Az említett anyag az Actinotrichida főcsoport atkáiban előfordul, az Anactinotrichida atkákban nem. Van der Hammen és Lindquist előbbi munkái alapján Evans (1992) a két említett főcsoportot rendsorozatnak vagy öregrendeknek nevezte, és számos alrendet rend szintre emelt. Így az Anactinotrichida rendsorozatba sorolta a Notostigmata, Holothyrida, Ixodida és Mesostigmata rendeket, az Actinotrichida rendsorozatba pedig az Astigmata, Oribatida és Prostigmata rendeket. A két rendsorozat között további különbségek még: az Anactinotrichida atkák esetében a járólábak csípői szabadon állnak, a test hátoldalán érzékserték nincsenek. Az Actinotrichida atkáknál a járólábak csípői a hasi oldalhoz forrtak, emiatt nem mozgathatók szabadon, valamint lehetnek érzéksertéik.
Az atkák alosztályán belül jelenleg hat rendet különítenek el, melyeket két rendsorozatba (más elnevezéssel öregrend) sorolnak. A rokonsági körök elkülönítésében korábban kiemelt szempontként értékelték a légzőnyílások számát és elhelyezkedését. Az alábbiakban ismertetett felosztásuk Lindquist, Krantz és Walter által kidolgozott rendszert követi (Lindquist és mtsai 2009).
Lindquist és mtsai (2009) rendszere szerint az Acari (atkák) alosztályon belül Parasitiformes (nyűgatkák) és Acariformes (atkaalakúak) rendsorozatokat különböztetnek meg. A további felosztásban az Opilioacarida, a Holothyrida, az Ixodida, a Mesostigmata, a Trombidiformes (bársonyatka-formájúak) és a Sarcoptiformes (rühatka-szabásúak) rendként, a Monogynaspida, a Prostigmata, az Oribatida alrendként, a Gamasina és az Astigmatina pedig alrendágként (angol cohort = latin cohors) szerepelnek.
A Fauna Europaea (Magowski 2011) által használt rendszertani besorolás szerint az atkák az állatok (Animalia) országába (Regnum), ezen belül a valódi szövetes állatok (Eumetazoa) alországába (Subregnum), az ízeltlábúak (Arthropoda) törzsébe (Phylum), a csáprágósok /más helyen csáprágós ízeltlábúak/ (Chelicerata) altörzsébe (Subphylum), a pókszabásúak /más helyen pókidomúak/ (Arachnida) osztályába (Classis), a Micrura alosztályba (Subclassis), az atkák (Acari) alosztályágába (Infraclass), ezen belül egy részük az Actinotrichida, a másik részük pedig az Anactinotrichida rendsorozatba vagy öregrendbe (Superordo) tartoznak. Az alosztályág további felosztása a következő. Jelenleg az Anactinotrichida rendsorozat az Ixodida, Mesostigmata és Notostigmata rendekre, az Actinotrichida rendsorozat, pedig az Astigmata, Oribatida és Prostigmata rendekre tagolódik (Magowski 2011). A Prostigmata rendet az Anystina, Eleutherengona, Endeostigmata és Eupodina alrendekre osztották fel. Az Astigmata és az Oribatida rend tovább nagyszámú családsorozatokra bomlik.
Zhang (2011b) legutóbbi Acari osztályozása eltér a fentiektől. Az atkák eszerint két rendsorozat:
a Parasitiformes (4 rend) vagy az Acariformes (2 rend) egyikébe a tartoznak. A Parasitiformes kategória alatt a Mesostigmata rend (3 alrend), a Monogynaspida alrend (2 alrendág), a Gamasina alrendág (4 hyporder = főcsaládsorozat, javasolt elnevezés) találhatók. Az Acariformes alatti rendszertani egységek a Trombidiformes rend (3 alrend), a Prostigmata alrend (4 alrendág, pl. az Eupodina, az Anystina, az Eleutherengona alrendágak), valamint a Sarcoptiformes rend, az Oribatida alrend (öt alrendággal), valamint az Astigmata hyporder (= főcsaládsorozat) találhatók (Beaulieu és mtsai 2009).
Az Ohio State University Acarology Collection (OSU Acarology 2015) által használt besorolás kis mértékben különbözik Lindquist és mtsai (2009) hierarchiájától. Eszerint a Parasitiformes és az Acariformes nem rendsorozat, hanem rend. Emiatt a Mesostigmata és a Trombidiformes alrendek és nem rendek, a Gamasina pedig alrendág (cohort).
Egyéb rendszerezések a következők: Walter és mtsai (1996) az Acariformes és a Parasitiformes mellett az Opilioacariformest is rendsorozatként (öregrendként) kezelik. Ez utóbbiba az Opilioacarida rend, a Parasitiformesbe a Holothyrida, Ixodida és Mesostigmata rendek, az Acariformesbe a Sarcoptiformes (Oribatida és Astigmata) valamint a Trombidiformes (Prostigmata) rend tartozik. A Mesostigmata renden belül korábban a Gamasina, a Prostigmata renden belül az Actinedida + Tarsonemida, az Astigmata renden belül az Acaridida alrend elnevezés volt használatos (Fain és mtsai 1990, Zhang 2003, Krantz 1978 részben, Krantz és Lindquist 1979). Szintén széles körben használt rendszertani kategóriák voltak, − illetve részben még ma is azok − az Acariformes (Prostigmata, Astigmata, Oribatida rendek), a Parasitiformes (Holothyrida, Mesostigmata, Ixodida rendek) és az Opilioacariformes (Opilioacarida rend) rendsorozatok (vagy rendek) (Zhang 2003, Smith és mtsai 2002), valamint a Sarcoptiformes és Trombidiformes (Hughes 1961, Lindquist 1996, Walter és Proctor 1999) vagy Trombidiiformes (Farkas 1966, Dudich és Loksa 1987) alrendek. Napjainkban Halliday (2007) két rendsorozatot, Parasitiformes és Acariformes, különböztet meg. Az előbbi rendsorozaton belül az Opilioacarida, Holothyrida, Ixodida és Mesostigmata rendeket, az utóbbiban a Prostigmata (= Trombidiformes) és a Sarcoptiformes rendeket sorolja fel. Smith és mtsai (2002) alrendként szerepeltetik az Acaridiae taxont az Acariformes renden belül. OConnor (2004) alrendágként említi az Astigmata taxont.
Linné rendszerében az idők folyamán számos változás történt. Újabb kategóriákat hoztak létre.
Egyes osztályozások (pl. Systema Naturae, The Taxonomicon, Encyclopedia of Life) az állatok országa (Animalia Linnaeus, 1958) fölött az eukarióták doménjét (Domain) (Eukaryota Chatton, 1925), az Eumetazoa Bütschli, 1910 alország alatt, pedig a kétoldali részarányosak (Bilateria Hatschek, 1888) törzscsoportot vagy alországot (Subregnum, illetve Subkingdom), a Protostomia Grobben, 1908 Branch-et (alországág), az Ecdysozoa A. M. A. Aguinaldo és mtsai 1997 főtörzset (Infrakingdom), és a Panarthropoda C. Nielsen, 1995 törzssorozatot (Superphylum) is mint történeti kategóriákat szerepeltetik.
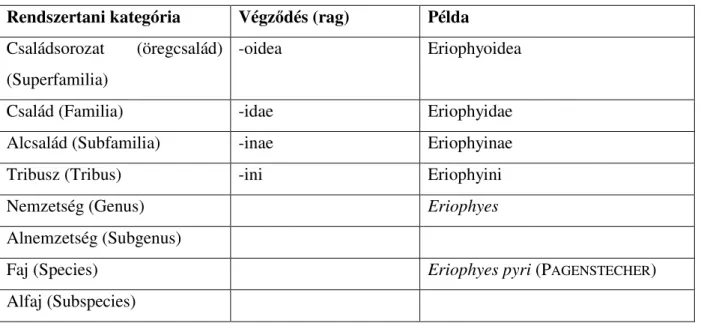
A rendszertani kategóriákban bizonyos taxon nevek képzésére kialakult egy szabályszerűség. Így a végződés alapján a taxon helye megállapítható (1. táblázat).
1. táblázat. Alrend alatti rendszertani egységek Rendszertani kategória Végződés (rag) Példa
Családsorozat (öregcsalád) (Superfamilia)
-oidea Eriophyoidea
Család (Familia) -idae Eriophyidae
Alcsalád (Subfamilia) -inae Eriophyinae
Tribusz (Tribus) -ini Eriophyini
Nemzetség (Genus) Eriophyes
Alnemzetség (Subgenus)
Faj (Species) Eriophyes pyri (PAGENSTECHER)
Alfaj (Subspecies)
ACARI alosztály (Lindquist, Krantz és Walter, 2009 szerint) ARTHROPODA von Siebold, 1848 törzs CHELICERATA Heymons, 1901 altörzs ARACHNIDA Cuvier, 1812 osztály ACARI Leach, 1817 alosztály
PARASITIFORMES Reuter, 1909 rendsorozat (=Anactinotrichida) OPILIOACARIDA Zakhvatkin, 1952 rend (=Notostigmata) HOLOTHYRIDA Thon, 1905 rend (=Holothyrina, Tetrastigmata) IXODIDA Leach, 1815 rend (=Metastigmata)
MESOSTIGMATA G. Canestrini, 1891 rend (=Gamasida) MONOGYNASPIDA Camin et Gorirossi, 1955 alrend
UROPODINA Kramer, 1881 alrendág (cohort) GAMASINA Kramer, 1881 alrendág (cohort) ACARIFORMES Reuter, 1909 rendsorozat (=Actinotrichida)
TROMBIDIFORMES Reuter, 1909 rend
SPHAEROLICHIDA OConnor, 1984 alrend PROSTIGMATA Kramer, 1877 alrend SARCOPTIFORMES Reuter, 1909 rend
ENDEOSTIGMATA Reuter, 1909 alrend
ORIBATIDA van der Hammen, 1968 alrend (=Cryptostigmata, Oribatei Charpentier, 1840, Dugès, 1833)
ASTIGMATINA Krantz et Walter, 2009 alrendág (=Astigmata G. Canestrini, 1891)
Néhány magasabb rendszertani egység rövid jellemzése
PARASITIFORMES rendsorozat (=öregrend)
Az ide sorolt rendekre jellemző, hogy a járólábak csípői szabadon mozgathatók, nem forrtak az idiosomához. Az utótestükön (hysterosoma), a 2. lábpár csípőinek vonala mögött 1–4 pár jól látható légzőnyílás van. Ezek általában a 3. és 4. lábpár közelében találhatók. Speciális érzékszőreik (trichobothrium) nincsenek. Az ide tartozó atkák viszonylag nagytermetű külső élősködők, valamint ragadozók. Egyes csoportjaik a hypostomájukon jellegzetes fogazatot viselnek.
MESOSTIGMATA rend (nyűgatkák)
Többségében szabadon élő ragadozó, részben parazita, általában közepes méretű (< 1 mm) atkák.
Bizonyos fajok gombafonalakkal és spórákkal, virágporral valamint nektárral is táplálkoznak.
Légzőnyílásaik a 2. és 3. pár láb (pl. korongatkák = Uropodina) vagy a 3. és 4. pár láb csípői között (pl. Phytoseiidae) nyílnak. Szemük és Haller-féle szervük nincsen, lábaik csípőízülete jól mozgatható. Hypostomájukon nincsenek fogszerű képletek. A végükön egy-egy fog- vagy tőrszerű nyúlvány a corniculus helyezkedik el. A hasi oldalon a gnatosoma mögött a páratlan áll alatti érzőnyúlvány, a tritosternum ered. A gnatosomát felülről az epistoma fedi. Úszni tudó képviselőjük nem ismert. Három alrend, 70 család és 12000 faj tartozik a rendbe.
ACARIFORMES rendsorozat (atkaalakúak) (=öregrend)
A legváltozatosabb életmódú, legfajgazdagabb és rendkívül formagazdag csoport. Az ide tartozó rendek esetében a lábak csípői a podosoma hasi oldalához hozzáforrtak (coxisterna), ezért ezek
szabadon nem mozgathatók. Légzőnyílásaik vagy hiányoznak, amennyiben vannak akkor a gnatosománál nyílnak. A 2. lábpár csípői mögött nem láthatók légzőnyílások. Speciális érzékelő szőreik (trichobothrium) lehetnek. Ezek valamint más érzékelő rudacska és serte belső magját az actinopilin (korábbi nevén actinochitin) nevű optikailag aktív vegyület alkotja, mely a polarizált fényben kettős törésű, és a Parasitiformes (=Anactinotrichida) rendsorozat képviselőiben nem fordul elő. Egyes lábaik redukálódhatnak. Szívük és Malpighi-edényük nincs.
PROSTIGMATA alrend
A 36 családsorozat az atkák legváltozatosabb alrendjét alkotja. Egy pár légzőnyílásuk a csáprágók alapi ízének a közelében található, de hiányozhat is. Középbelük vakon végződik. Rendszerint több nimfa stádiummal rendelkeznek. Talajban, édes- és tenger vízben, növényeken, bomló szerves anyagban élő ragadozó, fitofág és élősködő fajok találhatók közöttük. Számos növényvédelmi valamint köz- és állategészségügyi szempontból fontos faj van közöttük.
ORIBATIDA alrend (páncélosatkák)
Erősen kitinizált, legtöbbször szabadon élő atkák. Elsősorban talaj- és mohalakók. Méretük rendszerint 0,2–1,6 mm. Morfológiájuk hihetetlenül változatos, gyakran szarvszerű nyúlványokat, vállebenyeket, különleges alakú szőröket hordoznak. Lábaikon is különböző módosult lemezeket és szőröket találunk. Az előháton egy-egy csésze-szerű mélyedésből (bothridium) kiemelkedő speciális érzőszőr található (pszeudosztigmatikus szerv). A hímeknek nincs kitinizált aedeagusa és a testvég hasi részén szívókorongja. Növényi korhadékot, ürüléket, moszatokat, gombafonalakat, spórákat és pollent fogyasztanak. A szervesanyag körforgásában betöltött szerepük kiemelkedő. A korongatkákkal (Mesostigmata: Uropodina) a talaj mezofauna meghatározó csoportját alkotják.
Egyedsűrűségük talaj köbméterenként több százezres lehet. Egyes fajaiknál rovarpete illetve fonálféreg fogyasztást is megfigyeltek. A Galumna- és a Scheloribates-fajok galandférgek köztes gazdái, így állat-egészségügyi szempontból is jelentősek lehetnek. Állati parazita és foréta életmódú képviselőjük nem ismert. Egy nemzedék kifejlődéséhez meglehetősen hosszú idő, 3–50 hét szükséges. Anyagcseréjük lassú, szaporodási rátájuk kicsi, k-stratégisták. A kifejlett egyedek viszonylag hosszú ideig élnek. A mérsékelt övben általában 1–2 év az élettartamuk, de egyes fajok 4–5 évig élnek. Szilárd kültakaróval, álcázással, viasz kiválasztásával és vegyi anyagokat termelő mirigyeik váladékával védekeznek az ellenségeikkel szemben.