OXIDOREDUKTÁZ ENZIMEK MODELLREAKCIÓINAK VIZSGÁLATA
DOKTORI (Ph.D.) ÉRTEKEZÉS
Készítette:
Baráth Gábor okleveles vegyész
Témavezető:
Dr. Kaizer József
egyetemi docens, az MTA doktora
PANNON EGYETEM
KÉMIAI ÉS KÖRNYEZETTUDOMÁNYI DOKTORI ISKOLA
VESZPRÉM 2010
OXIDOREDUKTÁZ ENZIMEK MODELLREAKCIÓINAK VIZSGÁLATA
Értekezés doktori (Ph.D.) fokozat elnyerése érdekében Írta:
Baráth Gábor
Készült a Pannon Egyetem Kémiai és Környezettudományi Doktori Iskolájának keretében.
Témavezető: Dr. Kaizer József Elfogadásra javaslom (igen/nem).
……….
(aláírás) A jelölt a doktori szigorlaton ……... %-ot ért el.
Veszprém, ………....
……….
a Szigorlati Bizottság elnöke Az értekezést bírálóként elfogadásra javaslom:
Bíráló neve: Dr. Joó Ferenc igen/nem.
..………
(aláírás) Bíráló neve: Dr. Besenyei Gábor igen/nem.
...………
(aláírás) A jelölt az értekezés nyilvános vitáján …………%-ot ért el.
Veszprém, ……….
.……….
a Bíráló Bizottság elnöke A doktori (Ph.D.) oklevél minősítése:……….
.………..
az EDT elnöke
Köszönetemet szeretném kifejezni témavezetőmnek, Dr. Kaizer József egyetemi docensnek figyelméért, mindig hasznos gyakorlati és szellemi tanácsaiért. Köszönöm Dr.
Speier Gábor egyetemi tanárnak munkám során nyújtott támogatását, valamint Dr. Pap József Sándor tudományos munkatársnak tanácsait és észrevételeit.
Köszönettel tartozom Dr. Rockenbauer Antalnak és Dr. Korecz Lászlónak (MTA Kémiai Kutatóközpont) az ESR spektrumok felvételében és azok értékelésében nyújtott segítségét, Dr. Párkányi Lászlónak (MTA Kémiai Kutatóközpont) és Dr. Michel Giorginak (Spectropole, Université Aix-Marseille) a röntgendiffrakciós szerkezet-vizsgálatokért, valamint Dr. Larry Que Jr-nak (University of Minnesota) a rezonancia Raman vizsgálatokért.
Köszönöm a Pannon Egyetem Szerves Kémia Intézeti Tanszéke minden dolgozójának önzetlen segítségét.
Külön köszönet illeti Családomat, akik törekvéseimet mindvégig támogatták.
Baráth Gábor
Kivonat
Oxidoreduktáz enzimek modellreakcióinak vizsgálata
Készítette: Baráth Gábor, okleveles vegyész
Témavezető: Dr. Kaizer József, egyetemi docens, az MTA doktora
Az értekezésben bemutatott eredmények olyan enzimek modellezésére irányulnak, amelyek reakcióik során oxidálószerként dioxigént használnak fel. Ide sorolható a dioxigenázok közé tartozó flavonol 2,4-dioxigenáz, valamint az oxidázok közé sorolható pirokatechin oxidáz és 1-amino-ciklopropán-1-karbonsav oxidáz. A szervezetben az enzimek működése során melléktermékként reaktív oxigén származékok (ROS: Reactive Oxygen Species) és hidrogén-peroxid keletkezik, amelyek számos káros folyamat inicializálásában vesznek részt, így végül betegségekhez vezethetnek. A szuperoxid dizmutáz és kataláz – mint oxidatív stresszt csökkentő – enzimek és enzimmodell rendszerek iránti tudományos érdeklődés ennek köszönhetően az utóbbi években jelentősen megnőtt.
A disszertációban bemutatásra kerülő kutatómunka ezekhez az enzimekhez kapcsolódik. Az enzimek aktív helyeinek tulajdonságaihoz igazodva célul tűztük ki új vas- és mangántartalmú komplexek előállítását és az enzimatikus reakcióknak megfelelő ún.
bioutánzó reakciók, továbbá különböző szubsztrátumok oxidációs reakcióinak vizsgálatát. Az előállított modellvegyületek szerkezetét különböző spektroszkópiai módszerek (UV-VIS, IR, ESR, Mössbauer) és röntgendiffrakció segítségével jellemeztük.
Az elvégzett részletes reakciókinetikai mérések alapján és a reakciók során keletkező intermedierek valamint termékek azonosítását követően (UV-VIS, ESR, rezonancia Raman, GC-MS), minden enzimmodell rendszer esetében javaslatot tettünk az oxigénezési és oxidációs reakciók lehetséges mechanizmusára vonatkozólag.
Abstract
Investigation of oxidoreductase mimics
Written by: Gábor Baráth, Chemist
Supervisor: Dr. József Kaizer, Associate Professor
The presented work was carried out in order to get insight into the mechanism of the flavonol 2,4-dioxygenase, 1-aminocyclopropane-1-carboxylic acid oxidase, catechol oxidase, superoxide dismutase and catalase enzymes which play key role in the biosynthesis of various molecules in metabolic pathways and protect cells against such hazards. New manganese and iron complexes have been synthesized which were characterized with numerous spectroscopic (UV-VIS, IR, EPR, Mössbauer) and X-ray diffractometric methods. They served as good functional and structural models for the enzymes mentioned above. Various structural methods (UV-VIS, EPR, resonance Raman, GC-MS) were used to characterize the intermediates and products of the enzyme-like reactions. Detailed kinetic investigation of the catalytic reactions have been performed and reaction mechanisms were proposed.
Zusammenfassung
Studien über funkzionelle Modellsysteme Enzymes Oxidoreductase
Von: Gábor Baráth, Diplomchemiker
Mentor: Dr. József Kaizer, Professor für Chemie
Das Ziel der Doktorarbeit war die Untersuchung der Wirkungnsmechanismen von verschiedenen Metalloenzymen mit Hilfe von Modellverbindungen die zur Familie der Oxidoreduktasen gehören. Die Studien umfassten Untersuchungen von Flavonol 2,4- dioxygenase, 1-Aminociklopropane-1-karbonsäure Oxidase, Pyrokatechin Dioxygenase, Superoxide Dismutase und Katalase. Diese Enzyme spielen eine Schlüsselrolle in der Biosynthese von verschiedenen Molekülen uns schützen die Zellen gegen aussere, schadliche Stoffen. Neue Mangan- und Eisen-Komplexe wurden synthetiziert, deren Struktur mit verschiedenen Methoden, wie UV-vis, IR, EPR und Mössbauer Spektroskopie sowie Röntgendiffraktion versichert wurde. Sie dienten als gute funkzionelle und strukturelle Modelle der genannten Enzyme. Diese analytische Methoden halfen auch die auftretende Intermediäre und Endprodukte zu identifizieren. Kinetische Untersuchungen von den Modellreaktionen wurden auch ausgeführt und Reaktionsmechanismen für die katalytische Reaktionen vorgeschlagen.
RÖVIDÍTÉSEK JEGYZÉKE
TON átalakítási arány (egységnyi katalizátorra vonatkoztatva) ROS reaktív oxigén származékok
FDO flavonol 2,4-dioxigenáz 2,3-QDO kvercetin 2,3-dioxigenáz
ES enzim-szubsztrát (komplex)
Glu glutaminsav
His hisztidin
O(fla) flavonolát
salenH2 bisz(szalicilidén-etilén-diamin) O-bsH O-benzoil-szalicilsav
dmf N,N-dimetil-formamid
dmso dimetil-szulfoxid
thf tetrahidrofurán
ESR elektron spin rezonancia
α-KGDO α-ketosav-függő oxidázok/oxigenázok
TH timin hidroxiláz
tauD taurin dioxigenáz
P4H prolil 4-hidroxiláz
4HPPD 4-hidroxi-fenil-piruvát dioxigenáz
ACCO 1-amino-ciklopropán-1-karbonsav oxidáz accH 1-amino-ciklopropán-1-karbonsav
Asp aszparaginsav
MCD mágneses cirkuláris dikroizmus
N-MeaccH N-metil-1-amino-ciklopropán-1-karbonsav acc-NH2 1-amino-ciklopropán-1-karbonsav-amid acc-OMe 1-amino-ciklopropán-1-karbonsav-metilészter BDE kötésfelhasadási energia
aibH 2-amino-izovajsav
Asc aszkorbát
DHAsc dehidro-aszkorbát
pa 2-pikolil-amin
bpy 2,2’-bipiridil
phen 1,10-fenantrolin
tacn 1,4,7-triaza-ciklononán
PO pirokatechin oxidáz
Cis cisztein
SOD szuperoxid dizmutáz
EXAFS finomszerkezetű élközeli röntgenabszorpciós spektroszkópia
flaH 3-hidroxi-flavon
4’MeOflaH 3-hidroxi-4’-metoxi-flavon 4’ClflaH 3-hidroxi-4’-klór-flavon
4’NMe2flaH 3-hidroxi-4’-dimetilamino-flavon O-MeObsH metoxi-O-benzoil-szalicilsav
NEt3 trietil-amin
IR infravörös spektroszkópia
UV-VIS ultraibolya-látható spektroszkópia
py piridin
GC gázkromatográfia
MS tömegspektrometria
NBT nitroblue-tetrazolium
TOF átalakítási frekvencia (egységnyi katalizátorra vonatkoztatva)
alaH alanin
N4Py N,N-bisz(2-piridilmetil)-N-di(2-piridil)metil-amin m-CPBA meta-klór-perbenzoesav
SIE kinetikus oldószerizotóp effektus PCET protoncsatolt elektron transzfer
sz szubsztrátum
indH 1,3-bisz(2’-piridil-imino)-izoindolin
4’MeindH 1,3-bisz(4’-metil-2’-piridil-imino)-izoindolin 6’MeindH 1,3-bisz(6’-metil-2’-piridil-imino)-izoindolin bim2indh 1,3-bisz (2’-benzimidazoil-imino)-izoindolin
1’Me2bim2indh 1,3-bisz (1’metil-2’-benzimidazoil-imino)-izoindolin dbcatH2 3,5-di-terc- butil-pirokatechin
catH2 pirokatechin
4Bu-catH2 4-butil-pirokatechin 4Me-catH2 4-metil-pirokatechin
Cl4catH2 tetrakloro-pirokatechin
dbsq.-
3,5-di-terc- butil-szemikinon gyökanion
bpmpH 2,6-bisz[bisz(piridin-2-metilamino)metil]-4-metil-fenol hbhpmipo N,N,N’,N’-bisz[(2-hidroxibenzil)(N-metilimidazoil)]2-ol-1,3-
propéndiamin
bbppnolH2 N,N’-bisz(2-hidroxibenzil)-N,N’-bisz(pridilmetil)-2-hidroxi-1,3- propiléndiamin
bisp 3,7-diazabiciklo[3,3,1]nonán tpa trisz-2-piridilmetil-amin
bpia bisz-((pikolil)(N-metilimidazol-2-il)-amin) salpnH2 N,N’-bisz(szalicilidén)-1,3-diamino-propán
2-OHsalpnH2 N,N’-bisz(2-hidroxi-szalicilidén)-1,3-diamino-propán salpentOH 1,5-bisz(szalicilidénamino)pentán-3-ol
Mebimap 1,4-di-(2’-N-metilbenzimidazolilamino)-ftalazin
pa pikolinát
paH pikolin
tpaa trisz{2-[N-(2-piridilmetil)amino]etil}amin ntb trisz(2-benzimidazoil-metil)amin
big N,N-bisz[1-metil-2-imidazoil)metil]glicinát tpen N,N,N’,N’-(2-piridilmetil)etiléndiamin
(4MeO)4tpen N,N,N’,N’-(4-metoxi-2-piridilmetil)etiléndiamin bqpa bisz(2-kinolilmetil)(2-metilpiridil)amin
6Me-bqpa bisz(2-kinolilmetil)-6-metilpiridil-2-metilamin 6Me3-tpa trisz-2-(6 metil)-piridilmetil-amin
ET elektrontranszfer
PT protontranszfer
HAT hidrogénatom-transzfer; hidrogén absztrakció
Tartalomjegyzék
1. BEVEZETÉS ... 1
2. IRODALMI ÁTTEKINTÉS ... 3
2.1. Enzimek, mint biokatalizátorok ... 3
2.2. Enzimmodellek ... 5
2.3. Oxigenáz és oxidáz enzimek ... 6
2.4. A dioxigén reakciói ... 7
2.5. Flavonoidok az élővilágban ... 9
2.6. Flavonol 2,4-dioxigenáz enzimek (FDO) ... 10
2.6.1. Réztartalmú flavonol 2,4-dioxigenáz enzim és modellreakciói ... 10
2.6.2. Különböző átmenetifém-tartalmú flavonol 2,4-dioxigenáz enzimek ... 15
2.7. -Ketoglutarát-függő oxidáz és oxigenáz enzimek( KGDO) ... 17
2.7.1. 1-Amino-ciklopropán-1-karbonsav oxidáz (ACCO) enzim és modellreakciói ... 19
2.8. Pirokatechin oxidáz (PO) enzim és modellreakciói ... 22
2.9. Szuperoxid dizmutáz (SOD) enzimek és modellreakcióik ... 26
2.10. Vas- és mangántartalmú kataláz enzimek és modellreakcióik ... 27
3. EREDMÉNYEK ÉS ÉRTÉKELÉSÜK ... 33
3.1.Vas- és mangántartalmú flavonol 2,4-dioxigenáz modellek ... 33
3.1.1. Szintetikus Fe(III)-tartalmú modellvegyületek előállítása és jellemzése ... 33
3.1.2. Szintetikus Mn(II)-tartalmú modellvegyületek előállítása és jellemzése ... 42
3.1.3. A [FeIII(4’MeOfla)3] komplex dioxigénezési reakciójának vizsgálata ... 45
3.1.4. A [FeIII(fla)(salen)] komplex dioxigénezési reakciójának vizsgálata ... 50
3.1.5. A [MnII(fla)2(py)2] komplex dioxigénezési reakciójának vizsgálata ... 65
3.2.ACC oxidáz modellek ... 75
3.2.1. ACC oxidáz enzim modellreakcióinak vizsgálata ... 75
3.3. Izoindolin-típusú ligandumok mangán- és vastartalmú komplexeinek előállítása ... 84
3.3.1. Pirokatechin oxidáz modellek: 3,5-di-terc-butil-pirokatechin [Mn(6’R2indH)(H2O)2(MeCN)](ClO4)2-katalizált oxidációja ... 96
3.3.2. Kataláz és szuperoxid dizmutáz modellek... 103
3.3.2.1. A [MnII(ind)2]és a [MnII(4’Me2ind)2] komplexek kataláz-aktivitásának vizsgálata ... 104
3.3.2.2. A [MnII(ind)2]és a [MnII(4’Me2ind)2] és [FeII(1’Me2bim2ind)2] komplexek
szuperoxid dizmutáz aktivitásának vizsgálata ... 108
3.4.[FeII(indH)(H2O)2(MeCN)](ClO4)2 komplex katalitikus aktivitásának vizsgálata alkoholok oxidációs reakcióiban ... 110
4. ÖSSZEFOGLALÁS ... 116
5. KÍSÉRLETI RÉSZ………..………... 118
6. IRODALOMJEGYZÉK.………..……... 126
1
1. BEVEZETÉS
Az enzimek, mint a biológiai, biokémiai reakciók katalizátorai, szinte mindenütt megtalálhatók az élővilágban, működésükről azonban, csak az elmúlt évtizedek során szereztünk közelebbi ismereteket a mérés- és műszertechnika rohamos fejlődésének köszönhetően. A különböző vizsgálati módszerek (röntgendiffrakció, NMR, EXAFS) azonban az enzimek nagy molekulatömegének, nehézkes tisztíthatóságának és nehéz kristályosíthatóságának következtében gyakorlatilag csak a metalloenzimek tanulmányozása során alkalmazhatóak, de ott is csak korlátozottan.
Egy viszonylag fiatal tudományág, a bioszervetlen kémia (biokoordinációs kémia), amely egyszerűen előállítható szerkezeti és működési modellek vizsgálatán keresztül próbálja felderíteni az aktív centrumban, vagyis a fémion koordinációs övezetében lejátszódó folyamatokat és az aktív hely spektroszkópiai viselkedését, az utóbbi években nagyarányú fejlődésen ment át. A modellreakciók vizsgálata arra is lehetőséget ad, hogy úgynevezett bioutánzó reakciókat dolgozzunk ki, egyrészt a preparatív hasznosítás, másrészt a homogén katalízis jobb megértése céljából.
Az értekezésben bemutatott eredmények olyan enzimek modellezésére irányulnak, amelyek reakcióik során oxidálószerként dioxigént használnak fel. Ide sorolható a dioxigenázok közé tartozó flavonol 2,4-dioxigenáz, valamint az oxidázok közé tartozó pirokatechin oxidáz és 1-amino-ciklopropán-1-karbonsav oxidáz. A témakörök kiegészülnek, egyrészt preparatív alkalmazások, másrészt a dioxigénaktiválás mechanizmusának megismerése céljából, ennek megfelelően kerülnek tárgyalásra a megfelelő szubsztrátumok vagy azokhoz szerkezetileg hasonló vegyületek átmenetifém komplexek által katalizált oxidációs és oxigénezési reakciói.
Az élő szervezetben végbemenő oxidációs reakciók melléktermékeként reaktív oxigén származékok (ROS: szuperoxid gyök-anion, hidroxil gyök stb.) és hidrogén-peroxid keletkezik. A szuperoxid dizmutáz és kataláz enzimek – mint oxidatív stresszt csökkentő enzimek – és enzimmodell rendszerek iránti tudományos érdeklődés ennek köszönhetően az elmúlt években nagymértékben megnőtt.
A dolgozat felépítése a következő: az irodalmi részben a témakör nagysága és szerteágazó jellege miatt csak az áttekintést segítő, összefoglaló közlemények kerültek feldolgozásra. Különös hangsúlyt kaptak a biológiai oxidációs, oxigénezési reakciók alapproblémái és azok eddigi ismeretei. Ezt követi egy rövid összefoglaló a tudományos eredményekről és azok értékeléséről, melynek alapját képező kísérletek részletes leírása a
2
kísérleti részben található. Az egyes rendszerekkel kapcsolatban megfogalmazott célokat, az elvégzett vizsgálatok eredményeinek összefoglalását, a levonható következtetésekkel együtt az adott témakörben ismertetjük.
3
2. IRODALMI ÁTTEKINTÉS
2.1. Enzimek, mint biokatalizátorok
A biológiai katalizátorokat enzimeknek nevezzük. Működésük teszi lehetővé a kiválasztott kovalens kötések testhőmérsékleten történő felbontását és más, megfelelő kovalens kötések kialakítását. Nagyon specifikusan működnek, csak egy kiválasztott molekulatípusban egy adott kötést bontanak fel, a többit érintetlenül hagyják.
Az élő szervezetekben minden anyag enzimreakciók sorozatán keresztül jön létre (anabolizmus), vagy bomlik le (katabolizmus). Érdekes, hogy még maguk az enzimek keletkezése is enzimek által katalizált. Az átalakulási folyamatok összességét metabolizmusnak, vagy anyagcserének nevezzük (1. ábra).
Energia
TERMÉK TÁPANYAG
SZUBSZTRÁTUM Metabolizmus
Enzimatikus reakciók sorozata Katabolizmus
(lebontás) Anabolizmus
(elõállítás) (átalakítás)
1. ábra Enzimreakciók szerepe az élő szervezetekben
Az élőlények anyagcseréjében résztvevő szénvegyületek viszonylag egyszerűek, csak kevés tartalmaz 100-nál több atomot. Ha ezekre pontosan illeszkedő enzimfelületet akarunk elképzelni, akkor ennél lényegesen nagyobb méretre van szükség. Az enzimeknek szükségszerűen nagyságrendekkel nagyobb méretűeknek kell lenniük, mint amekkoráknak az anyagcserén átmenő anyagoknak. Ezek a molekulák lényegesen különböznek az átalakítandó vegyületektől, ezek a fehérjék. Amennyiben csak aminosavak alkotják őket, egyszerű fehérjékről beszélünk (proteinek, apoenzimek), ha nem fehérje természetű részt is tartalmaznak (prosztetikus csoport, koenzim), akkor összetett fehérjékről (proteidek, holoenzimek) van szó. Az enzimek aminosavakból épülnek fel, tehát a fehérjék családjába tartoznak. Molekulatömegük 1,2 × 104 – 5 × 105 Daltonig változhat [1]. Az enzimek alakfelismerő volta oly mértékben specifikus, hogy a reakcióban szereplő molekula teljes
4
térszerkezetét figyelembe véve fejtik ki hatásukat. Mindezen tapasztalatok alapján a 19.
század végén alakult ki az enzimek "kulcs-zár" elmélete, amelyhez 1958-ban, Daniel Koshland javasolt módosítást [2, 3]. Az enzim molekula csak a kiválasztott molekulához illeszkedhet alak és töltéstérkép szerint. Az enzimek geometriai szerkezete biztosítja, hogy csak egyetlen egy kiválasztott kötést torzítsanak el, éppen annak az aktiválási energiáját csökkentsék le (2. ábra). Ezért van az, hogy a nagyon sokféle, az összegképlet alapján lehetséges izomer közül az élő természetben csak meghatározott típusok fordulnak elő.
2. ábra Enzimműködés folyamata
Egy enzim elsődleges szerkezete n darab aminosavból épül fel, tehát 20n féle variáció képzelhető el az aminosav-szekvencia kialakulásánál. Ha egy viszonylag kis fehérjét vizsgálunk, amelyet 100 aminosav alkot, a variációk száma 20100 vagy 10130, ami hatalmas szám, nagyobb, mint az összes molekula száma az univerzumban. Nem túlzás tehát azt állítani, hogy minden eddig ismert kémiai reakcióhoz létezik egy enzim, amely képes katalizálni azt. Természetesen megtalálni minden kémiai, biokémiai folyamathoz a megfelelő enzimet nem egyszerű feladat, valószínűleg nem is lehetséges.
Az eddig ismert enzimek közel egyharmada fémiont (vagy fémionokat) tartalmaz, amelyek többféle módon kötődhetnek a fehérjéhez és többféle funkciót is elláthatnak. Ezeket két csoportra osztjuk: metalloenzimekre és fémionok által aktivált enzimekre. A metalloenzimekben a fémion az enzimmolekulába beépült alkotórész, a fémion és a fehérje sztöchiometrikus aránya meghatározott érték. Amennyiben a fémiont kiszakítjuk a metalloenzimből, az enzim elveszíti aktivitását. A fémionok által aktivált enzimek esetében egyensúly áll fenn a fémion és az enzim, továbbá a fémion aktiválta enzim között. Ennél az enzimcsoportnál a fémet egyszerű kémiai módszerekkel el lehet választani a fehérjétől anélkül, hogy az aktivitását teljesen elveszítené. A katalizált reakciók típusa szerint az enzimek az alábbi hat fő csoportba sorolhatók (1. táblázat) [4]:
5
1. táblázat Az enzimek csoportosítása a katalizált reakciók típusa szerint enzimcsoport katalizált reakció(k)
hidrolázok
fehérjék peptid kötésének, poliszacharidok glikozidkötésének, zsírok, foszfátok
észterkötésének hasítása oxidoreduktázok
redoxireakciók, melyek során elektronok vagy hidrogénatom kerül át egyik molekuláról a
másikra
transzferázok egy meghatározott atomcsoport átvitele egyik molekuláról a másikra
izomerázok különböző átrendeződéses reakciók
liázok a szubsztrátum egy adott csoportjának hidrolitikus eltávolítása
ligázok két molekula összekapcsolása
Az enzimek – ipari folyamatokban – biokatalizátorként történő felhasználása, napjainkban igen intenzíven kutatott terület. A legfőbb problémát az jelenti, hogy az iparban alkalmazott reakciókörülmények oly mértékben eltérnek a fiziológiás körülményektől, hogy legtöbb esetben az enzimek nem képesek kifejteni hatásukat. Az enzimek biokatalizátorként való felhasználásának előnyeit és hátrányait az 2. táblázatban foglaltuk össze [5-11].
2. táblázat Enzimek biokatalizátorként való felhasználásának előnyei és hátrányai
Előnyök Hátrányok
nagy szelektivitás
nagy aktivitás enyhe körülmények között nagy átalakítási arány (TON)
biodegradábilis
általában természetes anyagok
nagyon komplex molekulák magas előállítási költség
belső fragmentálódás
2.2. Enzimmodellek
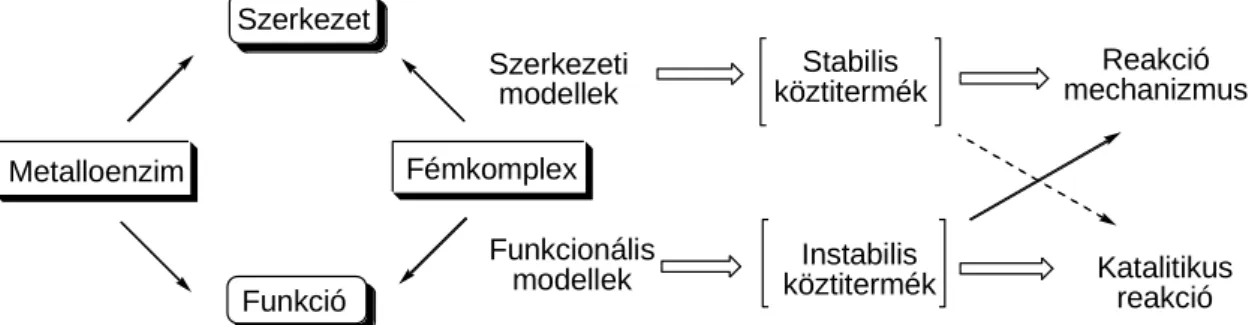
Az enzimmodelleknek alapvetően két csoportját különböztetjük meg: vannak ún.
szerkezeti és működési (funkcionális) modellek (3. ábra). Az enzimek szerkezeti modelljei az aktív centrum térbeli szerkezetének megismerését segítik elő, a modellek és az enzimek spektroszkópiai adatainak összehasonlításával. Mivel az alkalmazható ligandumok tárháza igen gazdag, azok felhasználásával egyre jobban megközelíthetővé válhat az enzim aktív
6
centrumának felépítése. Azt azonban szem előtt kell tartani, hogy a szintetikus vegyületek gyakran túl stabilisak ahhoz, hogy katalitikus funkciókat lássanak el.
A funkcionális (működési) modellek esetében nem a szerkezeti hasonlóság a meghatározó. A cél, az oxigénezési, oxidációs folyamat mechanizmusának megértése és ennek révén hasonló, mesterséges katalitikus reakciók kidolgozása. Az enzimek szelektivitását és aktivitását azonban nagyon nehéz reprodukálni, mivel a bioutánzó rendszerek gyakran a természetestől eltérő körülmények között működnek. Nem elképzelhetetlen azonban, hogy a gyors ütemben fejlődő modellek megközelítsék, illetve túllépjék a proteinek bizonyos tulajdonságait.
Szerkezet
Metalloenzim Fémkomplex
Funkció
Szerkezeti modellek
Funkcionális modellek
Stabilis köztitermék
Instabilis köztitermék
Reakció mechanizmus
Katalitikus reakció
3. ábra A metalloenzimek szerkezeti és működési modelljei 2.3. Oxigenáz és oxidáz enzimek
Az enzimek egy rendkívül fontos csoportját képezik az oxidáz és oxigenáz enzimek, amelyek többsége a metalloenzimek csoportjába sorolható. Széles körben megtalálhatók különböző élő szervezetekben, állatokban, növényekben és mikroorganizmusokban.
Funkciójukat tekintve kulcsfontosságú szerepet töltenek be, a növényi és állati szervezetek számára mérgező anyagok, valamint esszenciális vegyületek – mint a különböző aminosavak, cukrok, zsírsavak, vitaminok, lipidek, szteroidok – aerob körülmények között lejátszódó lebontási folyamataiban, illetve bioszintézisében. A degradációs folyamatok „reakcióhőjét” a sejtek energiaforrásként, a keletkező termékeket pedig szénforrásként hasznosítják.
Az oxidáz és oxigenáz enzimek közös jellemzője, hogy az általuk katalizált folyamatokban a dioxigén nélkülözhetetlen.
Az oxigenáz enzimek aktív centrumukban többnyire rezet, vasat vagy mangánt tartalmazó metalloenzimek, amelyek a dioxigén molekula egy vagy két oxigénatomjának beépülését katalizálják a megfelelő szerves szubsztrátumba. Első esetben monooxigenázokról (1), utóbbi esetben dioxigenázokról (2,3) beszélünk.
7
Dioxigenázok esetében további két alcsoportot is megkülönböztethetünk, az intra- illetve az intermolekuláris dioxigenázokat. Az intramolekuláris enzimek közös jellemzője, hogy a dioxigén mindkét atomja ugyanazon szubsztrátumba épül be (2), az intermolekuláris dioxigenázok esetében pedig a dioxigén atomjai két szubsztrátum között oszlanak meg (3).
Az utóbbi években karakterizált vastartalmú dioxigenáz enzimek két csoportra oszthatók, a Fe(III)-iont tartalmazó intradiol dioxigenázokra, amelyek aktiválják a szubsztrátumot mielőtt a molekuláris oxigén reakcióba lépne velük és a Fe(II)-iont tartalmazó extradiol dioxigenázokra, melyek esetében a molekuláris oxigén aktiválása a kulcs lépés. [12- 14]. Készültek közlemények mangán- [15], magnézium- [16] és réztartalmú [17] dioxigenáz enzimekről is.
Az oxidáz enzimek is aerob körülmények között fejtik ki hatásukat, de az oxigenázokkal ellentétben, itt az oxigén szubsztrátumba való beépülése nem játszódik le, az enzim a szubsztrátum oxidatív dehidrogéneződéséért felelős. A fenti reakciókban másodlagos termékként víz vagy hidrogén-peroxid keletkezik (4,5).
S + O2 + 2e− + 2H+ = SO + H2O (1)
S + O2 = SO2 (2)
S + S’ + O2 = SO + S’O (3)
O2 + 4e− + 4H+ = 2H2O (4)
SH2 + O2 = S + H2O2 (5)
2.4. A dioxigén reakciói
Az aerob élőlényekben a dioxigén felhasználása egy négyelektronos redukción keresztül megy végbe, melynek során egy mol oxigén molekulából 2 mol víz keletkezik (6) [18]. Elektrongazdag, szerves tápanyagok (pl. glükóz) oxidációjával összekapcsolva, ez a folyamat biztosítja az aerob előlények energiaellátását. A biológiai oxidációk ezen típusát légzésnek nevezzük.
O2+ 4H++ 4e- 2H2O E0= +0,815V
(6)
A triplett állapotú dioxigén két pártalan elektronnal rendelkezik, stabilis és ezért szingulett állapotú szerves szubsztrátumokkal szemben inert. A lényegesen nagyobb
8
energiatartalmú, instabilabb szingulett állapotú dioxigén reaktivitása nagyobb és redoxirakciókban, valamint elektrociklikus reakciókban (pl. olefinekkel, Diels-Alder-típusú reakciókban) jól reagál (3. táblázat).
3. táblázat A dioxigén elektronállapotai és tulajdonságai [19-21]
Elektronállapot HOMO orbitálok
Relatív energia (kJ)
Élettartam (s) Gáz - folyadék
Szerkezet
1Σg 1 g
3Σg
↑ ↓
↑↓ −
↑ ↑
x *y
154,8 92,0
0,0
7,12 10-9 3000 10-3
∞ ∞
↑O − O↓
O = O
↑O − O↑
A dioxigénnek a redoxireakciókban mutatott viszonylagos inertsége az első elektron termodinamikailag kedvezőtlen felvételével is magyarázható (E° = -0,32 V) [22]. A szuperoxid aktivitása ennek megfelelően lényegesen nagyobb [23].
A dioxigént felhasználó metalloenzimek és modellvegyületeik vizsgálata kapcsán felmerül a kérdés, hogy a dioxigén aktiválása milyen módon, milyen lépéseken keresztül valósul meg. Ennek megértésében sokat segíthet az intermedier-kutatás, amelynek feladata, hogy az enzimfolyamatokban és az azokat modellező bioutánzó rendszerekben a reaktív intermedierek elkülönítésén, spektroszkópiai jellemzésén keresztül információt nyújtson a dioxigén- és rajta keresztül a szubsztrátumaktiválás mechanizmusáról. A dioxigén-molekula termodinamikai inertsége feloldható olyan átmenetifémek segítségével, amelyek dioxigénnel komplexet képeznek.
Az oxidáz és oxigenáz enzimek esetében a dioxigén aktiválását reaktív peroxo- és oxo-intermedierek képződésén keresztül képzelik el, amelyek reakciója (C–H aktiválás, oxigéntranszfer, stb.) a megfelelő szubsztrátum molekulával már könnyen értelmezhető (4.
ábra) [24-28]. Az aerob élőlények a dioxigént több más reakcióban is felhasználják, többek között különböző molekulák bioszintézisében, továbbá molekulák vízoldhatóvá tételében a kiválasztást elősegítendő.
A fenti reakciók legnagyobb része mono- és dioxigenáz enzimek által katalizált. A sejtek belsejében uralkodó reduktív környezetnek köszönhetően, az ott jelenlévő vegyületek az enzimek szabályozó hatását megkerülve, termodinamikailag képesek reakcióba lépni dioxigénnel, melynek során reaktív oxigén származékok (ROS: szuperoxid gyök-anion, hidroxil gyök, stb.) és hidrogén-peroxid keletkezik [29].
9
CuI CuI
CuII CuII
O O
CuIII CuIII
O O
O2
FeII FeII
O2
O O
FeIII FeIII
O O
O O
FeIV FeIV
O O
O O
FeII
FeIII
FeIV
FeIII FeII
FeIV O
OOR
O(H)
O O(H) O O2 (H+, e-)
O2
Hemocianin, Tirozináz Katekoláz
Metán monooxigenáz Ribonukleotid reduktáz
Naftalin dioxigenáz TauD dioxigenáz Bleomicin Peroxo
Oxo
kofaktor (ketosav)
4. ábra Dioxigénaktiválás mechanizmusa átmenetifémek (Cu, Fe) jelenlétében
2.5. Flavonoidok az élővilágban
A növényi flavonoidok szerepéről, kémiai szerkezetéről, élettani hatásáról az elmúlt negyven évben rendszeresen jelentek meg összefoglaló tanulmányok [30-32], de az emberi szervezetre gyakorolt hatásuk és jelentőségük még ma sem teljesen tisztázott. Szent-Györgyi és munkatársai már 1936-ban kimutatták, hogy a citrusfélékből származó két flavonoid (rutin, naringenin) csökkenti a kapillárisok törékenységét és permeabilitását [33]. A flavonoidokat P- vitaminnak nevezte el (P ~ permeabilitás), illetve C2-vitaminnak, mivel számos flavonoid képes a C-vitamint stabilizálni.
Az 1950-es években a flavonoidok vitamin elmélete megdőlt. A hetvenes években felfedezték, hogy a növényekben az egyik leggyakrabban előforduló flavonoid, a kvercetin bizonyos körülmények között mutagén hatású, ezért nagy figyelem irányult a flavonoidok karcinogenitására, amelyet később nem sikerült egyértelműen bizonyítani. Napjainkban e korai eredményeket kissé elfeledve a legtöbb kutatócsoport a flavonoidok egészségvédő és betegségmegelőző hatását helyezi előtérbe.
Jelenlegi ismereteink szerint több ezer különböző szerkezetű flavonoid létezik, amelyek egymástól az alapszerkezethez kapcsolódó hidroxilcsoportok számában, helyzetében,
10
valamint a C2 - C3 szénatomok közötti kettős kötés meglétében, vagy hiányában térnek el egymástól. Ezeken belül az alábbi főbb csoportok különíthetők el [31]:
-Kalkonok -Flavononok (bioflavonoidok)
-Auronok -Antocianidinek
-Flavonok -Izoflavononoidok -Flavonolok
A kalkonok és auronok jelenlegi ismeretek szerint kisebb jelentőséggel bírnak. A flavonok részt vesznek a növények színének és ízének kialakításában, a flavonolokat a növényvilág csaknem valamennyi tagja előállítja, legnagyobb koncentrációban a gyümölcsök héjában fordulnak elő.
2.6. Flavonol 2,4-dioxigenáz enzimek (FDO)
2.6.1. Réztartalmú flavonol 2,4-dioxigenáz enzim és modellreakciói
A dioxigenáz enzimek egy kisebb csoportját képezik a flavonol 2,4-dioxigenázok (FDO = kvercetin 2,3-dioxigenáz (2,3-QDO), vagy kvercetináz), amelyek a flavonolok gyűrűbontási reakcióját katalizálják, a megfelelő O-benzoil-szalicilsavat és szén-monoxidot eredményezve (7) [34-38].
Az első enzimet, amely ezen átalakulásokat katalizálja, több mint négy évtizeddel ezelőtt ismerték fel az Aspergillus fajaiban [39]. Az Aspergillus-ból izolált, kvercetinázok [40-43] spektroszkópiai vizsgálatai alapján igazolták, hogy a fenti enzim aktív centrumában rezet tartalmaz [17,41,44]. Bár az Aspergillus flavus-ból és Aspergillus niger-ből nyert enzimek spektroszkópiai és biokémiai vizsgálata során számos hasznos információhoz jutottak, az igazi áttörést az Aspergillus japonicus-ból izolált enzim (FDO) 1.6 Å felbontású röntgendiffrakciós szerkezet-meghatározása jelentette (5. ábra). A szerkezet alapján az enzim
O
O OH R
R
R
R O
C CO2H O R
R
R R
O2 -CO
FDO enzim (7)
R= H; OH
11
~100 kDa molekulatömegű, két egyenként egy rezet tartalmazó alegységből álló homodimer.
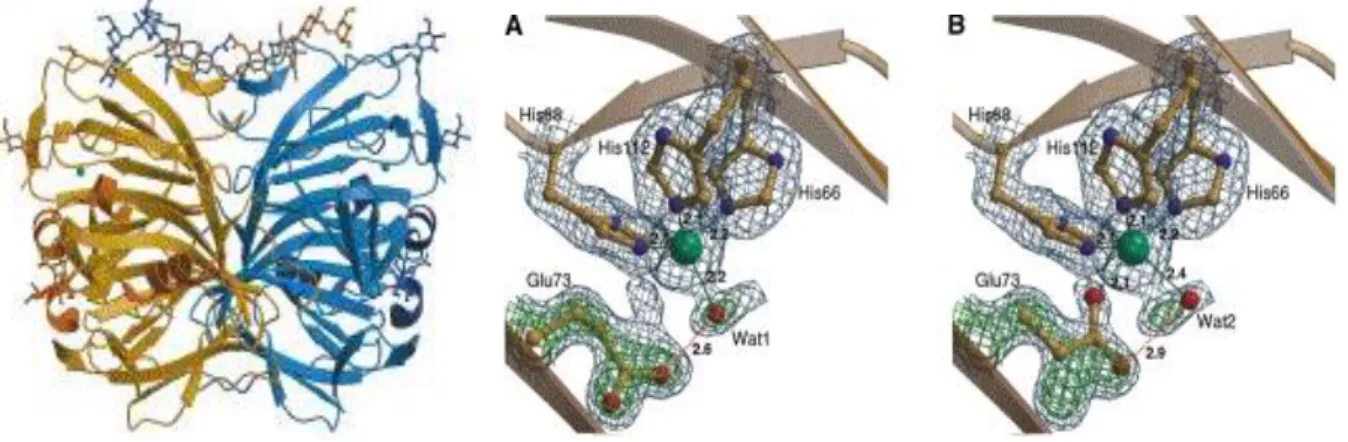
Az egymagvú centrumokat tekintve két egymástól eltérő geometria figyelhető meg [44].
5. ábra Az Aspergillus japonicus-ból izolált FDO enzim szerkezete és a réz(II)ion koordinációs övezete: A) Torzult tetraéderes koordináció B) Torzult trigonális bipiramisos
koordináció [44]
Az irodalomban több réztartalmú enzim-szubsztrát (ES) röntgenszerkezet is a rendelkezésünkre áll, amely alapján az ES komplex kialakulásával kapcsolatosan számos információhoz juthatunk [45,46]. Torzult síknégyzetes piramisos szerkezet kialakulása figyelhető meg kvercetin és kamferol koordinációja esetében ( = 0,38 és 0,41), a síkban két hisztidin [N(His66) és N(His112)] és a glutamát [O(Glu73)] ligandumok mellett a szubsztrát [O(fla)] egyfogú koordinációja figyelhető meg, a harmadik hisztidin [N(His68)] mindkét esetben apikális pozícióban van. Az ilyen módon kötött szubsztrátum jóval reaktívabb dioxigénnel szemben, mint a kelátban stabilizált forma (6. ábra).
6. ábra Az FDO enzim kvercetinnel képzett komplexének szimulációs röntgendiffrakciós szerkezete [44]
A szubsztrátum egy- vagy kétfogú koordinációját a 7- és 4’-hidroxi-csoportok megléte vagy hiánya határozza meg. A szubsztrátum O3 és a glutamát nem koordinálódó O2 atomja
12
közötti kölcsönhatások [2,43 Å (kamferol) és 2,66 Å (kvercetin)] azt sejtetik, hogy a glutamát protonált formában van jelen. A glutamát egyik lehetséges szerepe tehát a szubsztrátum- molekula deprotonálása.
A réz szerepét a kvercetin 2,3-dioxigenáz által katalizált enzimfolyamatokban, Simpson a következő általa feltételezett mechanizmusban vázolta fel (8) [42,45]:
[ ENZIM-Cu ] +
O
O OH
O
O O Cu-ENZIM
+ O2 O
O O Cu-ENZIM O
O
O
O O Cu-ENZIM O
O O
O O Cu-ENZIM O
O
CO2H O O C +
CO
(8)
Az első fémtartalmú modellek előállítása Nishinaga és munkatársai nevéhez fűződik, akik [CoII(salen)], illetve [CuII(acetát)2] katalizátort alkalmaztak a flavonol-származékok dioxigénezési reakciójában [47,48]. Mivel a kobalttartalmú rendszer hatásosabbnak bizonyult a réztartalmú rendszernél (konverzió: ~37%), ezért a kiterjedtebb vizsgálatok ezen rendszerre irányultak.
A reakcióban feltételezett [CoIII(salen)(fla)] komplexet diklór-metánban [CoIII(salen)(OH)] és flavonol reakciójában állították elő, melynek szerkezetét röntgendiffrakciós méréssel meghatározták [49], majd vizsgálták oxigénezési reakcióját [50].
Megállapították, hogy a reakció oldószerfüggő, valamint hogy termékként az enzimatikus útnak megfelelő depszidet tartalmazó [CoIII(salen)(O-bs)] komplex keletkezik. Az oxigénezés dmf-ban és dmso-ban gyors, MeOH-ban lassú, míg thf-ban és CH2Cl2-ban nem megy végbe.
A szubsztituensek hatását vizsgálva azt találták, hogy a 7-es és 4’-es szénen lévő hidroxi- vagy metoxicsoportok megnövelik a szubsztrátum reaktivitását, ami összhangban van az enzimatikus reakcióknál tapasztaltakkal.
A reakcióelegy (dmf) ciklikus-voltametriás vizsgálata alapján azt találták, hogy a komplex az oldószer hatására disszociál és a dioxigén az így képződő flavonolát-anionnal lép reakcióba [51,52]. Ennek bizonyítására elvégezték a flavonol terc-BuOK jelenlétében történő
13
oxigénezését is. A fentiek ismeretében javasolt mechanizmus (7. ábra) kritikus lépése a flavonolátion és a dioxigén reakciója. Nishinaga szerint ez egy közvetlen egylépéses, ún.
koncertikus reakció, amely cikloaddíciós mechanizmussal, gyökintermedierek képződése nélkül játszódik le [53].
Mivel ezen reakció spintiltott (a szingulett állapotú szerves molekula nem képes reakcióba lépni az alapállapotú triplett dioxigénnel szingulett állapotú terméket eredményezve) [54], ezért Nishinaga a látszólagos ellentétet triplett és szingulett állapotú töltésátviteli komplexek és a köztük fennálló ún. spinváltó átmenetek feltételezésével oldotta fel [55].
O
O OH
Ph O
O O [CoIII(salen)(OH)] Ph
-H2O
O2 /dmf/
CoIII(salen)
O
O Ph OO O
O O Ph
[CoIII(salen)(dmf)x] dmf
+
O
O Ph
CoIII(salen) O
O
[CoIII(salen)(dmf)x] dmf +
O
O
Ph O
O O Ph O
1 O
O Ph
O 3
3O2
O O
O
O Ph O
1 O O
MO O M+
1[CT]
3[CT] spinváltó átmenet
7. ábra Flavonol báziskatalizált oxigénezésének javasolt mechanizmusa
Összefoglalva tehát elmondható, hogy a Nishinaga által vizsgált terc-BuOK és kobalttartalmú rendszerekben a fém szerepe a szubsztrátum aktiválásában van, amely deprotonálódáson keresztül valósul meg. Mivel a fém oxidációs foka a reakció során nem
14
változik, valamint a fémnek csak a bázikus karaktere dominál, ezért ezen rendszereket ún.
báziskatalizált, „nem redoxaktív” fémtartalmú rendszereknek nevezzük.
Speier és munkatársai a 8. ábrán feltüntetett ligandumokkal alkotott Cu(I)- és Cu(II)- tartalmú komplexeket állítottak elő és alkalmaztak az enzimreakció vizsgálatára.
Ezek során kiderült, hogy a fenti komplexek reakciói funkcionálisan jól modellezik az enzimet, tehát a megfelelő depszidet eredményezik, viszont csak kis sebességgel és erélyes körülmények között játszódnak le.
Szerkezeti modellként ezek a rendszerek pedig még nem megfelelők, bár ennek a kísérletek elvégzésekor még gyakorlati akadályai voltak. Az enzim szerkezetéről ugyanis csak ezen komplexek vizsgálatát követően, krisztallográfiai mérések alapján kaptak pontos információt.
Az enzimatikus tulajdonságoknak leginkább megfelelő komplexeket rézzel állították elő. Takeda és munkatársai flavonol származékok reaktív részéhez formailag hasonló 1,2- ciklohexándion (illetve annak enolos formája), mint modellvegyület oxigénezési reakcióját vizsgálták metanolban CuCl2.5H2O katalizátor jelenlétében [56].
N N
N N
CH3
CH3 H3C
H3C NH
N N P
CH3 CH3 H3C
H3C
N N HN
HN
NH NH N
N
N HN
N N
N
NH N
N N
N 1,10-fenantrolin [57]
2,2'-bipiridin [57]
N,N,N',N'-tetrametil- etilén-diamin [57]
3,3'-imino-bisz(N,N-dimetil-propil-amin) [59]
trifenil-foszfán [58]
1,4-(di-2'-piridil)amino-ftalazin [60] 1,3-bisz(2'-piridil-imino)-izoindolin [61]
N N
N N
N N
8. ábra Flavonol 2,4-dioxigenáz modellek előállításánál használt ligandumok
15
2.6.2. Különböző átmenetifém-tartalmú flavonol 2,4-dioxigenáz enzimek
A réztartalmú FDO enzim mellett az első vastartalmú kvercetináz enzimet 2003-ban izolálták. Az enzimológiai vizsgálatok azt mutatták, hogy az enzim aktív centruma nagy hasonlóságot mutat a korábban vizsgált réztartalmú enziméhez. A vizsgálatok során azt tapasztalták, hogy az enzim katalizálja a flavonolok oxigénezési reakcióit, tehát flavonol 2,4- dioxigenáz aktivitást mutat. A spektroszkópiai vizsgálatok (ESR) alapján az aktív centrumban vas(II)- és vas(III)ion jelenléte is kimutatható volt [62]. Az inhibíciós vizsgálatok azonban arra utalnak, hogy a kvercetin átalakulásáért a vas(II)ion felelős. A kísérletek során a Fe(II) specifikus inhibitorok – 1,10-fenantrolin és 2,2‘-bipiridin – 50 százalékos inhibíciót okoztak mindössze 200 μM koncentrációban. Érdemes megjegyezni, hogy a Fe(III) specifikus inhibítor (Tiron) a kísérletek során növekedést eredményezett az aktivitásban, alátámasztva a vas(II) szerepét [63].
A Bacillus subtilis-ből izolált enzim (FDO) szerkezetét a 9. ábra szemlélteti. A vas- tartalmú FDO enzimek a réztartalmúakhoz hasonlóan két, egyenként egy vasat tartalmazó alegységből álló homodimer. Mindkét alegységben – melyek között csekély geometriai eltérés figyelhető meg – a Fe(II)-ion pentakoordinált formában helyezkedik el. A szerkezetek között megfigyelhető eltérések a fémet megkötő glutamát nyílt és zárt geometriai formái közti különbségnek tulajdoníthatók (10. ábra) [64].
9. ábra A Bacillus subtilis-ből izolált enzim (FDO) szerkezete [64]
Shaab és munkatársai Escherichia coli baktérium segítségével különböző kétvegyértékű fémet tartalmazó kvercetináz enzimeket állítottak elő. Mn(II), Co(II) és Cu(II) hozzáadása esetén aktív enzim keletkezett, míg Zn(II), Fe(II) és Cd(II) alkalmazása során nem
16
volt szignifikáns aktivitás-növekedés. Az ily módon előállított Mn(II)- és Co(II)-tartalmú kvercetinázokat tisztították és jellemezték. Az ESR spektrumok alapján megállapították, hogy a Mn(II)-tartalmú enzimben a két mangánion oktaéderes koordinációjú. A kinetikai vizsgálatok során kimutatták, hogy a mangántartalmú enzim mintegy negyvenszer nagyobb aktivitást mutat, mint a Fe(II)-tartalmú kvercetináz és közel azonos aktivitású, mint a Cu(II)- tartalmú (4. táblázat), az eredmények alapján tehát a kvercetináz enzim aktív centruma feltételezhetően Mn(II)-tartalmú [65].
10. ábra A Bacillus subtilis-ből izolált enzim (FDO) szerkezete [64]
4. táblázat A kvercetináz enzimek kinetikai adatai: a) A kvercetináz enzim aktív centrumában lévő fém; b) [63]
Féma Atomok/alegység kkat (s-1) KM (µM) KM(O2)( µM)
Mn 1,8 25±1 4,0±0,9 90±10
Co 0,65 6,7±0,2 7,5±0,5 79±5
Fe 0,80b 0,65±0,02 5,2±0,6 150±9
17
2008-ban Merkens és csoportja egy új organizmusból, a Streptomyces baktériumból különítettek el FDO enzimet Escherichia coli baktérium segítségével. A baktériumból kinyert természetes enzimhez különböző átmenteti fémeket adva vizsgálták az aktivitásokat, hasonlóan, mint a B. subtilis esetében. A Ni(II)és Co(II)fémiont tartalmazó enzim a kinetikai mérések során nagy aktivitást mutatott a Mn(II), Fe(II), Cu(II), Zn(II) központi fémiont tartalmazó enzimekhez képest (5. táblázat) [66].
5. táblázat A kvercetináz enzimek kinetikai adatai: a) A kvercetináz enzim aktív centrumában lévő fém; b) [67]
Féma Atomok/alegység kkat (s-1) KM (µM) KM(O2)( µM)
Fe 0,44 b 1,5±0,1 b 14,1±0,7 b -
Co 0,33 7,6±0,5 0,96±0,05 1230±310
Ni 0,55 40,1±3,4 5,75±0,12 256±45
Berreau és munkatársai vas-, mangán-, kobalt- nikkel- réz- és cinkartalmú flavonolát komplexeket állítottak elő, és vizsgálták, hogyan befolyásolja a központi fémion tulajdonsága a szerkezeti, spektroszkópiai és redoxi tulajdonságokat, valamint tanulmányozták a ligandumkicserélődési reakcióikat. A komplexek dioxigénnel való reakcióját csak a vas(II)komplex esetében végezték el, amelynek során az enzimatikus úttól eltérően egy µ-O- vas(III)komplex keletkezett [68].
Funkcionálisan működő vas-, mangán-, és nikkeltartalmú flavonol 2,4-dioxigenáz enzimmodell-rendszerek az irodalomban eddig még nem ismertek, tehát ezen modellreakciókról szerzett tapasztalataink segíthetnek tisztázni a fém(ek) enzimben betöltött szerepét.
2.7. -Ketoglutarát-függő oxidáz és oxigenáz enzimek ( KGDO)
Az oxidoreduktáz enzimek fontos csoportját képezik az -ketoglutarát-függő oxidázok és oxigenázok [69], amelyek különböző, biológiailag fontos vegyületek, pl. aminosav- oldalláncok hidroxilezési reakcióinak katalízisét végzik. Az -ketosav ebben az esetben kofaktorként, vagyis az enzim működését elősegítő csoportként funkcionál.
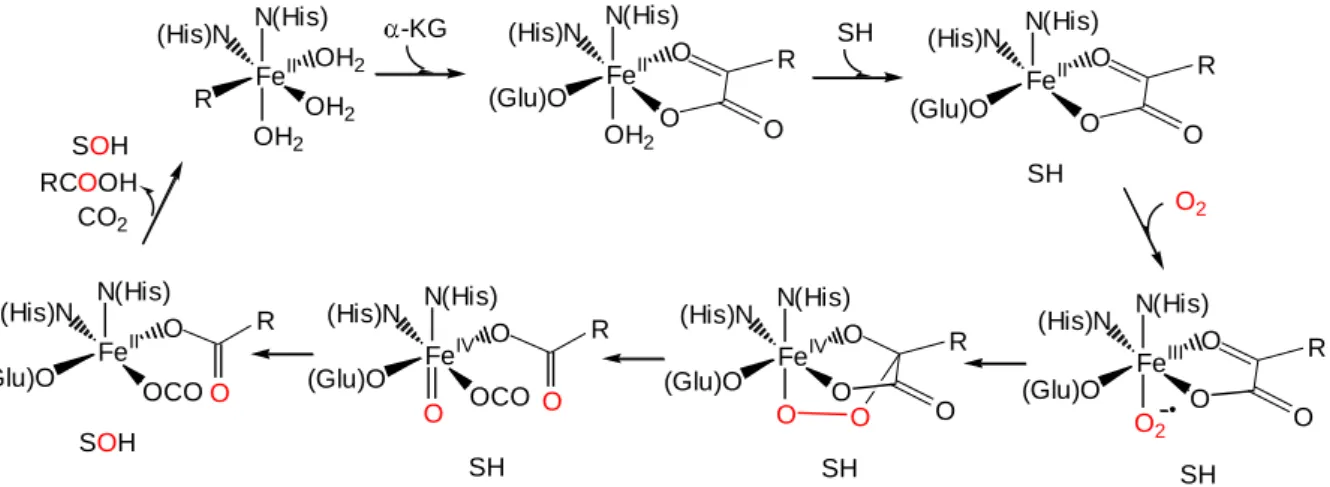
Általánosságban elmondható róluk, hogy -ketosav jelenléte nélkül az enzimatikus reakció (kevés kivétellel) nem játszódik le. Másik fontos sajátságuk, hogy bár aminosav-
18
szekvenciájuk jelentős változatosságot mutat, az aktív helyük szinte kivétel nélkül két hisztidines nitrogénnel és egy glutaminsavból, vagy aszparaginsavból származó karboxilát- funkcióval kötött vas(II)iont tartalmaz. A 2N,O donoratom-csoport mellett még három vízmolekula kapcsolódik a vas(II)centrumhoz (11. ábra) [70], így alakul ki a hatos koordináció.
FeII (His)N
R
N(His)
OH2 OH2
OH2
FeII (His)N (Glu)O
N(His)
OH2O
O R
O
-KG SH
FeII (His)N (Glu)O
N(His)
SH O
O R
O O2
FeIII (His)N (Glu)O
N(His)
SH O
O R
O2 O FeIV
(His)N (Glu)O
N(His)
SH O
O R
O O O FeIV
(His)N (Glu)O
N(His)
SH OCO
O R
O O
FeII (His)N (Glu)O
N(His)
SOH OCO
O R
O SOH RCOOH
CO2
11. ábra A vastartalmú KG-függő dioxigenázok reakcióira javasolt általános mechanizmus
A 11. ábrán látható javasolt mechanizmus [71] épp ezért szinte az összes KGDO enzimre érvényes. Első lépésben az -ketosav kétfogú ligandumként való koordinációja történik öttagú kelátgyűrű képződése közben. Ezzel párhuzamosan két vízmolekula kiszorul a koordinációs övezetből. A szubsztrátum ezután megkötődik a vas(II)ion közelében, kiszorítva a maradék vízmolekulát a vas(II)ion mellől, utat nyitva egy dioxigén molekula koordinációjának. A vas(III)hoz kapcsolódó szuperoxo-ligandum ezután már képes a ketosav ketonos szénatomját támadni, peroxo-vas(IV) intermedier kialakulását eredményezve. Az O O kötés felhasadásával végül létrejön az oxovas(IV) egység, amely a közelben rögzített szubsztrátum C H kötését támadja. A termékek (hidroxilezett szubsztrátum, szén-dioxid és karbonsav) a ciklus zárásaként elhagyják az aktív helyet. Az előbbi átmeneti állapotok közül többnek a röntgenszerkezete is ismert.
A fenti mechanizmussal írható le többek között az alábbi enzimek működése, a nukleinsavak metabolizmusát katalizáló timin hidroxiláz (TH) (9) [72]; a taurin dioxigenáz (tauD) (10), amelynek a szulfit metabolizmusban van szerepe [73]; a prolil 4-hidroxiláz (P4H) (11), amely a kollagént stabilizáló 4-hidroxi-prolint állítja elő [74]; a 4-hidroxi-fenil-piruvát dioxigenáz (4HPPD) (12), ahol maga a kofaktor a szubsztrátum is egyben [75]. A fenti kiragadott példákból látható, hogy ezen enzimek igen fontos szerepet játszanak az élő
19
szervezetek anyagcsere folyamatainak szabályozásában. Nem csoda, hogy számos réz- és vastartalmú modell született működésük jobb megértésére, illetve hasonló, gyakorlati szempontból fontos reakciók katalizálására [76-80].
HN NH O
O
TH HN N H O
O
OH TH HN N H O
O
CHOTH HN NH O
O
CO2H
(9)
(10)
H2N SO3H tauD
H2N SO3H OH
H2N O
+ H2SO3
N (11)
R
O R'
R N
O R' OH P4H
4HPPD (12)
HO
OH O O
HO
OH O OH
2.7.1. 1-Amino-ciklopropán-1-karbonsav oxidáz (ACCO) enzim és modellreakciói
Az etilén növényi hormon, a gyümölcsök érését gyorsítja, és a növények virágzására hat, a magvak csírázását és a hagymák, gumók kihajtását befolyásolja. Az etilént a kertészetben és a gyümölcstermesztésben is felhasználják hormonhatása miatt, mivel a zölden szedett gyümölcsöknek (például a banánnak) segíti az utóérését, és időzíthető vele egyes dísznövények virágzása (bizonyos határok között). A növényekben az etilén bioszintézisének utolsó lépése az 1-amino-ciklopropán-1-karbonsav (accH) átalakítása, melyet az ACC oxidáz enzim katalizál (13) [81-84].
CO2-
NH3+ ACCO + HCN + CO2+ 2H2O
2 H++ 2 e- (13)
A Petunia hybrida-ból izolált enzim (ACCO) szerkezetét a 12. ábra szemlélteti.
Röntgendiffrakciós mérések alapján megállapították, hogy a központi fémionhoz 2 hisztidin
20
(His177, His234) és egy aszparaginsav (Asp179), (2N, O) koordinálódik egyfogú ligandumként [85].
12. ábra ACC oxidáz enzim szerkezete [85]
Az ACC oxidáz enzim eltérően a többi KGDO proteintől, működéséhez nem 2- oxoglutarát, hanem aszkorbát koszubsztrát szükséges, emellett a szén-dioxid (vagy bikarbonát), mint aktivátor játszik szerepet az etilén szintézise során. Mágneses cirkuláris dikroizmus (MCD) vizsgálatokkal alátámasztották, hogy az enzim aktív centrumában jelenlévő vas(II)ion alapállapotban hatos koordinációjú, hasonlóan a többi, ebbe a csoportba tartozó enzimhez. A szubsztrátum koordinációját tekintve szintén eltérés tapasztalható a többi KGDO enzimtől. Míg utóbbi esetben az α-ketosav jobban kötődik a központi fémionhoz, mint az átalakítandó szubsztrátum, addig az ACCO enzim esetében az szubsztrátum (accH) mind az amino-, mind pedig a karboxilát-csoportján keresztül közvetlenül koordinálódik a központi vas(II)ionhoz. A szubsztrátum és a koszubsztrát hozzáadását követően az aktív helyen ötös koordináció alakul ki, amely elősegíti a dioxigén megkötődését és aktiválását.
Ezen eredmények összhangban vannak a korábban elvégzett ún. „steady-state” kinetikai mérésekkel, ahol bebizonyították, hogy a szubsztrátum a dioxigén előtt koordinálódik a központi fémionhoz. Az azonban még nem tisztázott, hogy a koszubsztrát az accH előtt vagy a dioxigén után kordinálódik a vas(II)ionhoz [82, 86-94].
2006-ban Klinman és munkatársai 3 nyíltláncú, valamint 4 gyűrűs aminosavval végeztek mechanizmus vizsgálatokat. Megállapították, hogy a gyűrűs származékok esetében etilén keletkezett, az alifás aminosavak esetében pedig dekarboxileződés játszódott le. A kinetikai vizsgálatok eredményeit a 6. táblázatban foglaltuk össze. Az adatokból jól látható,
Fe
21
hogy nincs egyértelmű összefüggés a szubsztrátumok szerkezete, kötésfelhasadási energiái és a reakció sebessége között (kkat). Ebből arra lehet következtetni, hogy a sebességmeghatározó lépés a szubsztrátum aktiválását megelőzően történik, melynek során egy oxovas(IV) részecske alakul ki. A reakciók feltételezett mechanizmusát a 13. ábra szemlélteti [95].
6. táblázat ACC oxidáz enzim kinetikai vizsgálatának eredményei (BDE: kötésfelhasadási energia)
Szubsztrátum kkat
(s-1)
KM
(µM)
BDE (kcal/kmol)
accH 36,4±1,4 0,099±0,018 97,4
N-MeaccH 12,2±0,5 0,107±0,021 91,4
acc-NH2 acc-OMe
aibH D-alanin
glicin
11,3±0,6 27,3±1,7 22,1±1,6 29,8±0,9 9,5±0,6
0,214±0,047 2,76±0,55 0,92±0,29 4,42±0,49 1,0±0,4
87,1 97,3 100,0
98,8 99,0
C
-O2C
H2N R2 R1 E - Fe(II)
CC OH
OH
O2
C
-O2C
H2N R2 R1 E - Fe(III)
CC OH
OH
O
C
-O2C
H2N R2 R1 E - Fe(III)
CC O
OH
O2H H2O
C
-O2C
H2N R2 R1
E - Fe(IV) CC O
O
O
C
-O2C
HN R2 R1 E - Fe(III)
CC O
O
OH
C
-O2C HN E - Fe(III) C
C O
O
OH
E - Fe(III) HN CC O
O
OH
R1 R2
Asc DHAsc
C
-O2C
H2N R2 R1 E - Fe(II)
OH2 C
C O
O R1,R2=
R1,R2= CH3 CO2
1
2 3
4
5
13. ábra ACCO enzim feltételezett működési mechanizmusa (Asc: aszkorbát; DHAsc: dehidro-aszkorbát)
22
Első lépésként a szubsztrátum kétfogú ligandumként való koordinációja történik meg öttagú kelátgyűrű képződése közben. Ezt követően aszkorbát jelenlétében a dioxigén koordinálódik a központi fémionhoz (1). A vas(III)hoz kapcsolódó szuperoxo-ligandum ezután már képes az aszkorbát szomszédos szénatomját támadni (2), a sebességmeghatározó lépésben oxovas(IV) intermedier kialakulását eredményezve (3), amely közvetlenül felelős a szubsztrátum aktiválásáért, melynek során egyelektronos oxidáción keresztül iminoil-gyök keletkezik (4). Aszkorbát felesleg esetén az oxovas(IV) intermedier reakciója a szubsztátummal és az aszkorbáttal kompetitív (egymással versengő) reakciót eredményez, amelynek során a kiindulási Fe(II)-komplex és víz keletkezik (5) [95].
Az irodalomban csupán néhány példa található réz-, vas-, mangán- és kobalttartalmú enzim-szubsztrát komplexekre, amelyek oxidációja etilént eredményez, katalitikusan működő rendszer azonban ezidáig nem ismert [96-98].
Simaan és munkatársai a 14. ábrán látható ligandumokkal és szubsztrátumokkal réz(I)-, réz(II)- és vas(III)tartalmú (ES) komplexeket állítottak elő, és vizsgálták reakciójukat hidrogén-peroxid oxidálószerrel. Azt tapasztalták, hogy minden esetben az enzimatikus útnak megfelelő termékek keletkeznek, tehát ezen komplexek funkcionálisan jól modellezik az ACC oxidáz enzimet. A vizsgálatok során megállapították, hogy bázis (NaOH) hozzáadásával lényegesen növelhető a képződő etilén mennyisége. Ezt azzal magyarázták, hogy bázis hatására a hidrogén-peroxid deprotonálódik, melynek következtében reaktív fém-peroxo komplex alakul ki [99-102].
N N
N N
bpy phen
H2N N pa
HN
NH HN
tacn
Ligandumok:
Szubsztrátumok:
O OH NH2
aibH
O OH NH2 accH
14. ábra ACC oxidáz modellek előállításánál használt ligandumok és szubsztrátumok (pa: 2-pikolil-amin; tacn: 1,4,7-triaza-ciklononán; aibH: 2-amino-izovajsav) 2.8. Pirokatechin oxidáz (PO) enzim és modellreakciói
A pirokatechin oxidáz az oxidoreduktázok csoportjába tartozó kétmagvú rézcentrummal rendelkező metalloenzim, amely a pirokatechinek (o-difenolok) oxidatív
![30. ábra A [Fe III (4’MeOfla) 3 ] komplex aktuális koncentrációjának logaritmusa az idő függvényében](https://thumb-eu.123doks.com/thumbv2/9dokorg/872484.46927/57.892.194.698.464.740/ábra-iii-meofla-komplex-aktuális-koncentrációjának-logaritmusa-függvényében.webp)
![43. ábra 4’R szubsztituensek elektronikus és karboxilát koligandumok sztérikus hatása a [Fe III (fla)(salen)] komplex dioxigénezési reakciójára](https://thumb-eu.123doks.com/thumbv2/9dokorg/872484.46927/68.892.235.677.131.451/szubsztituensek-elektronikus-karboxilát-koligandumok-sztérikus-hatása-dioxigénezési-reakciójára.webp)
![45. ábra A [Fe III (fla)(salen)] komplex aktuális koncentrációjának logaritmusa az idő függvényében](https://thumb-eu.123doks.com/thumbv2/9dokorg/872484.46927/69.892.189.700.113.386/ábra-iii-salen-komplex-aktuális-koncentrációjának-logaritmusa-függvényében.webp)