DOKTORI (PhD) ÉRTEKEZÉS
TAVASZI JUDIT
KESZTHELY
2012
2
PANNON EGYETEM GEORGIKON KAR ÁLLAT- ÉS AGRÁRKÖRNYEZET-TUDOMÁNYI
DOKTORI ISKOLA
Iskolavezet ő :
Dr. habil. Anda Angéla az MTA doktora
Témavezet ő : Dr. Budai Péter
MEZ Ő GAZDASÁGI VEGYI ANYAGOK IRRITATÍV HATÁSAINAK IN VITRO
TOXIKOLÓGIAI VIZSGÁLATA
DOKTORI (PhD) ÉRTEKEZÉS
Készítette:
Tavaszi Judit
KESZTHELY
2012
MEZŐGAZDASÁGI VEGYI ANYAGOK IRRITATÍV HATÁSAINAK IN VITRO TOXIKOLÓGIAI VIZSGÁLATA
Értekezés doktori (PhD) fokozat elnyerése érdekében Írta:
Tavaszi Judit
Készült a Pannon Egyetem Állat- és Agrárkörnyezet-tudományi Doktori Iskolája keretében
Témavezető: Dr. Budai Péter Elfogadásra javaslom (igen / nem)
…...
aláírás A jelölt a doktori szigorlaton…... %-ot ért el
Az értekezést bírálóként elfogadásra javaslom:
Bíráló neve: …... …... igen / nem
……….
aláírás Bíráló neve: …... …... igen / nem
……….
aláírás
A jelölt az értekezés nyilvános vitáján…...%-ot ért el Veszprém/Keszthely, ……….
……….
a Bíráló Bizottság elnöke A doktori (PhD) oklevél minősítése…...
………
az EDT elnöke
4
TARTALOMJEGYZÉK
1. KIVONATOK... 6
1.1.MAGYAR NYELVŰ KIVONAT...6
1.2.ANGOL NYELVŰ KIVONAT...8
1.3.NÉMET NYELVŰ KIVONAT...8
2. BEVEZETÉS ... 9
3. IRODALMI ÁTTEKINTÉS ... 12
3.1.ALTERNATÍV MÓDSZEREK...12
3.1.1. In vitro módszerek... 13
3.1.2. Alacsonyabb rendű szervezetek felhasználása ... 13
3.1.3. Immunológiai technikák... 13
3.1.4. Mennyiségi szerkezet-aktivitás összefüggés analízis... 14
3.1.5. Élettani folyamatok matematikai modellezése ... 14
3.1.6. Emberi modellek ... 14
3.1.7. Más alternatív módszerek ... 14
3.2.A SZEMIRRITÁCIÓ VIZSGÁLATA ALTERNATÍV MÓDSZEREKKEL...15
3.2.1. Embrionált tojás felhasználása ... 15
3.2.1.1. A madarak embrionális fejlődése ... 15
3.2.1.1.1. A chorioallantois membrán ... 18
3.2.1.2. A tojások előkészítése ... 23
3.2.1.2.1. A légkamrán keresztüli behatolás... 23
3.2.1.2.2. Behatolás a tojás egyenlítőjén át ... 25
3.2.1.3. A chorioallantois membrán felhasználása ... 27
3.2.2. A chorioallantois membránt felhasználó tesztek ... 28
3.2.2.1. Chorioallantoic Membrane Vascular Assay (CAMVA) ... 28
3.2.2.2. Chorioallantoic Membrane – Trypan blue festés (CAM-TB)... 29
3.2.2.3. Hen’s Egg Test - Chorioallantoic Membrane (HET-CAM) ... 29
3.2.3. A citotoxicitási vizsgálatok alkalmazása... 29
3.3. A SZEM FELÉPÍTÉSE...30
4. ANYAG ÉS MÓDSZER... 34
4.1.VIZSGÁLATI MÓDSZEREK...34
4.1.1. HET-CAM teszt ... 34
4.1.2. MTT-Assay ... 37
4.1.3. A Draize-féle primer szemirritációs teszt... 39
4.2.VIZSGÁLATI ANYAGOK...46
4.2.1. A vizsgálatban felhasznált növényvédő szerek ... 46
4.2.1.1. Inszekticidek... 46
4.2.1.2. Herbicidek... 47
4.2.1.3. Fungicidek... 48
4.2.1.4. Tápanyag-visszapótlásra alkalmazható készítmények... 48
5.1.AHET-CAM TESZTBŐL SZÁRMAZÓ EREDMÉNYEK...49
5.1.1. Inszekticidek... 49
5.1.2. Herbicidek... 51
5.1.3. Fungicidek ... 53
5.1.4. Tápanyag-visszapótlásra alkalmazható készítmények ... 54
5.2.A CITOTOXICITÁSI VIZSGÁLAT EREDMÉNYEI...56
5.2.1. Inszekticidek... 56
5.2.2. Herbicidek... 56
5.2.3. Fungicidek ... 57
5.2.4. Tápanyag-visszapótlásra alkalmazható készítmények ... 58
5.3.ADRAIZE-TESZTBŐL SZÁRMAZÓ EREDMÉNYEK...58
5.3.1. Inszekticidek... 58
6. MEGBESZÉLÉS... 68
6.1.AZ INSZEKTICIDEK EREDMÉNYEINEK ÖSSZEHASONLÍTÁSA...68
6.2.A HERBICIDEK EREDMÉNYEINEK ÖSSZEHASONLÍTÁSA...69
6.3.A FUNGICIDEK EREDMÉNYEINEK ÖSSZEHASONLÍTÁSA...70
6.4.A TÁPANYAG-VISSZAPÓTLÁSRA ALKALMAZHATÓ KÉSZÍTMÉNYEK EREDMÉNYEINEK ÖSSZEHASONLÍTÁSA...71
6.5.A CITOTOXICITÁSI VIZSGÁLATOK EREDMÉNYEI...72
6.6.AHET-CAM TESZT ÉS A DRAIZE-FÉLE TESZT EREDMÉNYEINEK STATISZTIKAI VIZSGÁLATA....73
6.7.KÖVETKEZTETÉSEK ÉS JAVASLATOK...74
7. ÖSSZEFOGLALÁS... 77
8. KÖSZÖNETNYILVÁNÍTÁS... 82
9. IRODALOMJEGYZÉK... 83
10. ÚJ TUDOMÁNYOS EREDMÉNYEK ... 92
6
1. KIVONATOK
1.1. Magyar nyelv ű kivonat
A szerző a kísérletei során a mezőgazdaságban használt vegyi anyagok irritációs potenciálját vizsgálta az in vitro HET-CAM (Hen’s Egg Test – Chorioallantoic Membrane) teszttel, valamint a Draize-féle in vivo módszerrel. A vegyi anyagokat a vizsgálatok eredményei alapján irritációs kategóriákba sorolta, és a különböző vizsgálattípusokkal kapott eredményeket összevetette.
A kísérletek során a HET-CAM teszt mellett az anyagok irritációs potenciálját in vitro citotoxicitási teszttel is mérte (MTT Assay), melynek eredményeit szintén összehasonlította a HET-CAM és a Draize tesztből származó adatokkal.
Az in vitro HET-CAM teszt a nemzetközi szakirodalmak alapján eddig korlátozott mértékben került alkalmazásra; elfogadása, engedélyezése jelenleg folyamatban van.
Az in vitro és in vivo eredmények összevetése alapján próbált további adatokat szolgáltatni arra, hogy a HET-CAM teszt mennyiben tükrözi a jelenleg elfogadott in vivo Draize-féle módszer eredményeit, ezáltal alkalmas lehet-e az élő állaton végzett kísérletek kiváltására.
Az in vitro HET-CAM tesztet az Invittox Protocol 47. száma alapján végezte el.
A tyúktojások 10 napi keltetése után a mészhéj és héjmembrán óvatos eltávolítása után a kísérleti anyagokat a megfelelő fejlettségi állapotú chorioallantois membránra cseppentette, és meghatározott ideig figyelemmel követte a membránon bekövetkező elváltozásokat. A megfigyelt változások feljegyzése után a kiértékelést egy számítógépes program alapján végezte el, majd az így kapott irritációs indexeket irritációs kategóriákba sorolta, ami az összehasonlítás alapjául szolgált.
A Draize-féle primer szemirritációs tesztet az OECD 405 guideline irányelvei alapján végezte.
A tesztelendő anyagot az állat egyik szemének kötőhártya zsákjába helyezte, a szemeket pár másodpercig óvatosan zárva tartotta, ezután 1, 24, 48, 72 órával, majd 1, ill. 2 héttel a kezelés után a tünetek erősségét feljegyezte. A kiértékelés a módszer által előírt pontozási és klasszifikációs rendszer alapján történt.
A vizsgálatokban alkalmazott agrokemikáliák in vitro HET-CAM tesztből származó eredményei jó korrelációt mutattak az in vivo adatokkal.
A citotoxicitási vizsgálatokból származó eredményeket az Draize féle primer módszer eredményeivel összevetve szintén jó korrelációt mutattak az in vivo adatokkal.
A kísérletben alkalmazott mezőgazdasági vegyi anyagok in vivo és in vitro eredményeinek összehasonlításából és a szakirodalomban fellelhető eredményekből a szerző megállapította, hogy a HET-CAM teszt az in vivo Draize-féle primer szemirritációs vizsgálat elővizsgálataként (pre-screen) alkalmazható, teljes egészében történő kiváltására azonban jelenlegi formában nem alkalmas.
Az in vitro HET-CAM teszt fontos eleme lehet azon in vitro tesztrendszernek, amely a jövőben képes lesz az in vivo Draize-féle szemirritációs vizsgálat kiváltására.
8
1.2. Angol nyelv ű kivonat
The author examined the irritation potential of 45 different agrochemicals following the worldwide accepted in vivo Draize method (described in OECD 405) and two in vitro methods, the HET-CAM test (Hen’s Egg Test – Chorioallantois Membrane) and the MTT- Assay.
A comparative screening was performed with the 45 agrochemicals to establish parallel data on the in vitro (HET-CAM test, MTT-Assay) and in vivo (Draize) results.
The thesis provides new data from the in vitro methods used during the experiments, in comparison to the in vivo data. Based on the results, the HET-CAM test or the MTT-Assay as single methods can not replace the Draize rabbit eye test but can be useful components of an in vitro system.
1.3. Német nyelv ű kivonat
Die Verfasserin hat im Laufe ihrer Versuche die Irritation von 45 verschiedenen Pflanzenschutz-Mitteln mit 2 in vitro Methoden untersucht. Eine von den meist studiertesten alternativ Methode, der Hühner Ei Test – Chorioallanoic Membrane (HET-CAM), und ein Zell-Giftwirkungs Test, das MTT-Assay waren dabei verwendet worden. Wegen der parallel Ergebnisse von in vitro (HET-CAM, MTT-Assay) und in vivo Untersuchungen. Der Draize Hasen Augen Irritation Test ist auch verrichtet geworden.
Die Experimente lieferten neue Daten von den verwendeten alternativ Methoden verglichen mit den in vivo Ergebnissen. Auf Grund dieser Daten, des HET-CAM Test und dem des MTT-Assay sind wertvolle voruntersuchungs- Methoden in verzeichnen von Augen Irritation. Die toxikologischen Tests für Registration von Agrochemikalien, der in vitro HET- CAM Test oder MTT-Assay können den in vivo Draize Test nicht ersetzen aber beide können praktische Teile von einem in vitro System sein.
2. BEVEZETÉS
A Föld növekvő lakossága és a növekvő élelmiszer igények egyre magasabb szintű követelményeket támasztanak a mezőgazdasággal szemben. Az ipar, a települések és a közlekedés térhódítása, valamint a természetvédelem erősödése a rendelkezésre álló területen elérhető hozam növelését követeli meg a mezőgazdaságtól. A fenntartható fejlődés azonban csak az integrált növényvédelem céltudatos alkalmazásával valósítható meg. Ezt az elvet követve a kémiai növényvédelem mellett a fizikai és biológiai védekezés is megjelenik, amely bizonyos mértékben visszaszorítja ugyan, de teljes mértékben nem pótolhatja a vegyszeres beavatkozásokat; a kémiai növényvédelem továbbra is az egyik legfontosabb védekezési eljárás a mezőgazdasági termelésben.
Felmérések szerint a kultúrnövényeket károsító élő szervezetek (gombák, baktériumok, rovarok stb.) napjainkban világszerte átlagosan mintegy 35%-kal csökkentik a mezőgazdasági terméshozamokat. Ebből az állati kártevők, elsősorban a rovarok 14%, a mikroorganizmusok, főleg a gombák 12%, a gyomnövények 9% termésveszteséget okoznak. A növényvédelem feladata, hogy kiküszöbölje ezeket a káros hatásokat és biztonságossá tegye a termelést (Gáborjányi és mtsai, 1995).
A növényvédő szerek azonban a gyakorlati alkalmazás során a nem-célszervezetekre is hatást gyakorolnak, közvetlenül vagy közvetve károsíthatják az élővilágot. A talajba kerülve az ott élő ökoszisztémát, a talajvízbe, felszíni vizekbe jutva a vízi szervezeteket károsíthatják; a táplálékláncban való feldúsulás esetén a végső fogyasztó, az ember is érintetté válhat.
A növényvédő szerekkel foglalkozó ember a munkája során (napi gyakorisággal) kerülhet érintkezésbe a vegyi anyagokkal. A kijuttatás alkalmával a helyi elváltozás (károsodás), az érintett területről való felszívódás után a szisztémás mérgezés esélye is számottevő. A testfelszín vonatkozásában helyi mérgezés során különböző mértékű szem- és bőrkárosodással kell számolnunk. A szembe jutott mérgező anyagok az enyhe, reverzibilis kötőhártya gyulladástól kezdve súlyos és maradandó szemkárosodást, szaruhártyahomályt, sőt vakságot
10
A mezőgazdasági vegyi anyagok forgalomba hozatalát napjainkban számos toxikológiai vizsgálat előzi meg. Ezek, a készítmények olyan tulajdonságait tárják fel, amelyek a humán egészségkockázat és a természetkárosodás kockázatának jellemzéséhez szükségesek. A szemirritáció mértékének meghatározására jelenleg a Draize-féle, nyúlon végzett tesztből származó eredményeket fogadják el, ezen teszt alapján becsülik az esetleges emberi expozíció során várható szemkárosodást. Mivel a kísérlet az állatra nézve jelentős fájdalommal járhat, több olyan alternatív módszer áll fejlesztés alatt, ami később az in vivo tesztet felválthatja. A primer szemirritáció területén az OECD (Organisation for Economic Co-operation and Development) 1987-ben beleegyezett abba, hogy a jól érvényesített in vitro tesztekből származó adatokat elfogadják az in vivo adatok helyett. A perspektivikus alternatív módszerek közé tartoznak a tyúktojás chorioallantois membránját (CAM) használó in vitro vizsgálati módszerek is (Walum és mtsai, 1992). Mivel a vizsgálat a tesztszervezetre nézve fájdalommal jár, így az erősödő állatvédelmi mozgalmak hatására több olyan alternatív eljárást fejlesztettek ki, amelyek alkalmazásával az in vivo tesztekben használt állatok száma csökkenthető. Az experimentális toxikológia valamennyi szakterületén megjelentek a különböző in vitro, ill.
alternatív módszerek, de általánosan elmondható, hogy jelenleg még az in vitro módszerek nem válthatják ki teljes egészében az in vivo kísérleteket.
A HET-CAM (Hen’s Egg Test – Chorioallantois Membrane) teszttel az embrionálódott tyúktojás chorioallantois membránjának (CAM) reakciója alapján jelezhetjük előre a vegyi anyag irritációs potenciálját (Walum és mtsai., 1992). Az aktív vérkeringéssel rendelkező CAM a szemhez hasonlóan reagál a különböző anyagok kémiai károsító hatásaira (Leighton és mtsai., 1985). A HET-CAM tesztet ez idáig elsősorban kozmetikumok, ipari és háztartási vegyi anyagok irritatív potenciáljának meghatározására használták, mezőgazdasági vegyi anyagok tesztelésére kevésbé, így az általam elvégzett vizsgálatok a vegyi anyag típusát illetően hiánypótló jellegűek.
Vizsgálataim során célul tűztem ki a különböző mezőgazdasági vegyi anyagok, növényvédő szerek és tápanyag-visszapótlásra használható készítmények in vitro vizsgálattal történő irritációs potenciáljának meghatározását. A vizsgálati anyagként alkalmazott készítmények kiválasztásánál figyelembe vettem az irodalmi irritációs adatokat, és a nem irritatív vegyületektől az erősen irritatív vegyületekig az irritációs skálának megfelelően vontam be a mezőgazdasági vegyi anyagokat a kísérletekbe.
Vizsgálataim során összesen 50, a nem irritatív és irritatív kategóriákba eső mezőgazdasági vegyi anyag irritációs potenciálját vizsgáltam in vitro HET-CAM teszttel és in vivo Draize-féle primer szemirritációs vizsgálattal. 12 vizsgálati anyag esetében in vitro citotoxikológiai vizsgálatot is végeztem, az eredményeket pedig az in vivo módszerrel és a HET-CAM teszttel kapott eredményekhez hasonlítottam. A kiértékelés során arra a kérdésre próbáltam választ adni, hogy az in vitro technikák (HET-CAM teszt és az MTT-Assay) önmagukban vagy tesztrendszer formájában alkalmasak lehetnek-e az in vivo Draize-teszt jövőbeni kiváltására.
12
3. IRODALMI ÁTTEKINTÉS
3.1. Alternatív módszerek
A mezőgazdasági vegyi anyagok forgalomba hozatalát megelőző toxikológiai vizsgálatokban a szemirritáció meghatározására jelenleg az élő nyulakon elvégzett vizsgálatok eredményeit fogadják el. Az erősödő állatvédő mozgalmak hatására több olyan alternatív módszert is kidolgoztak, amely nem csak csökkentheti az emlős kísérleti állatok számát, hanem esetleg teljes mértékben ki is válthatja ezek felhasználását.
Az állatkísérletek kiváltására, ill. a kísérletben felhasznált állatok számának, szenvedéseinek csökkentésére irányuló törekvések Russel és Burch 1959-es ún 3R szabályánál gyökereznek. A 3R a szabály alapjául szolgáló helyettesítés (Replacement), finomítás (Refinement) és létszámcsökkentés (Reduction) szavak kezdőbetűiből áll. A 3R szabály megjelenése után egyre több olyan módszert próbáltak bevezetni, mely állatvédelmi szempontból pozitívabb megítélésben tüntette fel az engedélyezés folyamán megkövetelt vizsgálatokat.
Alternatív módszernek tekintünk minden olyan kísérleti módszert és eljárást, amely képes az állatkísérleteket helyettesíteni vagy a kísérletben felhasznált állatok számát csökkenteni, illetve a kísérleti körülményeket finomítva a kísérleti állatok szenvedéseit mérsékelni (Nab és mtsai, 1993). Bár az alternatív módszerek alkalmazása főként állatvédelmi okokra vezethető vissza, ezen módszerek számos előnnyel bírnak a hagyományos in vivo tesztekkel szemben.
Elterjedésükben az etikai szempontokon felül szerepet játszott a gazdaságos és időtakarékos kivitelezhetőség, de a jó standardizálhatóság is nagy előnyként említhető. Alkalmazásuk általában gyorsabb eredményt ad, a költségeik alacsonyabbak, a kivitelezés egyszerűbb, a körülmények jobban befolyásolhatóak, mint élő állat esetén, ami bizonyos fokú szabványosítást tesz lehetővé. Nem alkalmas azonban hosszabb távú hatás kimutatására; a modellrendszer reakciója nem azonos egy élő szervezet reakciójával (Nab és mtsai, 1993), az élő szervezet komplexitását nem tükrözi.
A FRAME (Fund for the Replacement of Animal in Medical Experiments) brit szervezet osztályozása alapján az alternatív módszerek 7 kategóriába sorolhatók:
3.1.1. In vitro módszerek
A kísérleti állatok helyettesítésére, számának csökkentésére irányulnak az in vitro technikák, ahol a kísérleti anyag toxikológiai jellemzőinek meghatározása nem élő állaton, hanem szerven, szervrendszeren, szöveten stb. történik. Leggyakrabban a sejt- és szövetkultúrákat alkalmazzák. Az élő sejteket, szöveteket laboratóriumi körülmények között, de az élő szervezeten kívüli tenyészközegben tartják életben. A szervek esetén a sejtek és a szerven belüli szövetek közötti kapcsolat megmarad, míg a sejtkultúrákban (sejtszuszpenzió) nincs kapcsolat az egyes sejtek között.
Egyszerűsége és gyorsasága miatt az in vitro tesztekben nem követhető nyomon az élő állat szervezetének immunválasza és regenerációja sem, ami egy valós expozíció esetén bekövetkezhetne.
3.1.2. Alacsonyabb rendű szervezetek felhasználása
Az alacsonyabb rendű szervezeteket felhasználó tesztekben gyakran alkalmaznak baktériumokat, gombákat vagy rovarokat. Mutagén hatás megítélésére jelenleg az Escherichia coli triptofán negatív és a Salmonella typhimurinum hisztidin negatív törzseit (Maron és Ames, 1983) használó AMES teszt a legelterjedtebb. Ezen törzsek szervetlen sókat és glükózt tartalmazó táptalajon képtelenek a növekedésre, és így telepek képzésére. Amennyiben a tesztanyag hatására a genetikai állományukban mutáció történik, a táptalajon telepek kifejlődése figyelhető meg (Ames és mtsai., 1975). Egyszerű és gyors kivitelezhetősége miatt széles körben alkalmazzák vegyi anyagok mutagén hatásainak becslésére.
3.1.3. Immunológiai technikák
Immunológiai technikák képezik az alapját több in vitro módszernek. Alkalmazásuk főleg diagnosztikumok tesztelésében, vakcinák kipróbálásában terjedt el. E terület olyan jól ismert technikákat foglal magába, mint a Enzyme-Linked Immunosorbent Assay (ELISA), a
14
3.1.4. Mennyiségi szerkezet-aktivitás összefüggés analízis
Bizonyított, hogy a vegyi anyagok molekuláris szerkezete és biológiai aktivitásuk között összefüggés áll fent. Számítógépes program segítségével a biológiai hatás megbecsülhető, de bizonyos paraméterek ismeretében akár új molekulák is tervezhetők. Ezen eljárás alapján csökkenthető az állatokon tesztelt kísérleti anyagok száma (Nab és mtsai, 1993) és felgyorsítható a fejlesztés fázisa.
3.1.5. Élettani folyamatok matematikai modellezése
A matematikai egyenletek képesek leírni számos élettani, toxikológiai és biokémiai folyamatot. A számítógépes szimuláció tapasztalati adatokon alapul, így képes lehet az ismert hatások összegzésére, összehasonlításra, és bár a módszer reális kísérleti eredményt adhat, ezek a vizsgálatok csak közelítik a valóságot, így eredményeik csak egyéb (általában in vivo) tesztekből származó adatokkal alátámasztva fogadhatók el (Carson, 1986).
3.1.6. Emberi modellek
Bár a toxikológiai vizsgálatok nagyrészt a humán expozíció esetén bekövetkező hatást hivatottak előjelezni – így a legalkalmasabb modell ezen tesztekben az ember lenne –, azonban a humán alanyok kísérletben való alkalmazása jogi és etikai kérdéseket vet fel. A gyógyszerkutatás területén azonban jogszabályok írják elő a humán tesztek elvégzését. A humán tesztek szigorúan ellenőrzött körülmények között, meghatározott kritériumoknak megfelelő önkénteseken zajlanak és az állatkísérletekből nyert adatok értékelése után kezdhetők meg, a minimális kockázat elérése érdekében. Mivel a tesztek eredményeit eleve a célszervezetből nyerik, az extrapoláció kikerülhető (Nab és mtsai, 1993).
3.1.7. Más alternatív módszerek
A laboratóriumi állatokon végzett teszteket bizonyos esetekben vágóhídról származó szervek felhasználásával is pótolhatjuk; pl. a Draize-féle primer szemirritációban előírt nyúl helyett használható az izolált marha- (Bovine Corneal Opacity and Permeability Test Method for Identifying Ocular Corrosives and Severe Irritants; OECD no. 437) vagy csirkeszem (Isolated
Chicken Eye Test Method for Identifying Ocular Corrosives and Severe Irritants; OECD no.
438).
Biokinetikai folyamatok modellezésében alkalmazzák az NMR (Nuclear Magnetic Resonance) eljárást.
3.2. A szemirritáció vizsgálata alternatív módszerekkel
A csirkeembrió gyakran szerepel tesztobjektumként a különböző vegyi anyagok toxikus és/vagy teratogén hatásainak in vitro vizsgálataiban. A chorioallantois membrán (CAM) felhasználása a szemirritáció becslésében az 1980-as évekig nyúlik vissza (Leighton és mtsai., 1983, 1985; Luepke, 1985; Parish, 1985). Mivel a membrán egy vérerekkel gazdagon átszőtt szövet, jó modellként szolgálhat az irritáció becslésére: a szemhez hasonlóan reagál a különböző vegyi anyagok károsító hatásaira. Felhasználását könnyíti, hogy a membrán egyszerűen és gyorsan hozzáférhető.
A szemirritáció becslésére két módszer használatos:
• A tesztanyag érintkezési ideje a CAM-mal meghosszabbított, és ennek megfelelően a megfigyelés is hosszabb idejű (Leighton és mtsai., 1983; 1985).
• A tesztanyag nagyon rövid ideig érintkezik a CAM-mal, és a véredényrendszerben bekövetkező változásokat közvetlenül a kezelés után értékelik (Luepke, 1985).
A kezelés minden esetben a CAM és a tesztanyag érintkezésével zajlik. Az előkészítés, tehát a CAM feltárása a tojáshéjon át történik, általában a légkamrán keresztül, de történhet a tojás egyenlítőjén keresztül is.
3.2.1. Embrionált tojás felhasználása
3.2.1.1. A madarak embrionális fejlődése
16
mennek végbe, azaz kialakulnak a szervkezdemények, végtagok. A magzati fejlődés második felét a mennyiségi fejlődés jellemzi, ekkor alakul ki az embrió végleges formája (Bogenfürst, 2004).
A keltetés első három napjában az intenzív növekedés figyelhető meg. Az első napon kialakulnak a csíralemezek, a mesoderma és a gerinchúr. A második napon megindul a véredények, a hajszálerek, a szem, az ősvese és a szaglószervek kezdeményeinek fejlődése. A szívkezdemény két része kezd összenőni (Hamilton, 1952). A szívverés a keltetés 30. órájában kezdődik. A harmadik napon az allantois belenő az extraembrionális testüregbe (Zboray, 1991). Fejlődésnek indul az emésztőkészülék és az érzékszervek. Megjelennek a végtagbimbók (a hátsó végtagok és a szárnyak kezdeményei) és a csőr (1. ábra).
A negyedik napon alakulnak ki az ivarmirigyek és a vese kezdeményei, a testrészek elkülönülnek. Az amnion körbeveszi az embriót. Az embrió feje az agyvelő gyors fejlődése következtében jelentősen megnő. Az ötödik napon az amnion megtelik folyadékkal, ami az embrió mechanikai védelmét szolgálja. Differenciálódik az első és a hátsó végtag, az ujjak és az agyvelő. A máj fejlődése megindul. A hatodik és a tizedik nap között kialakul az embrió végleges formája. A hetedik naptól megindul az allantoislégzés. A nyolcadik naptól láthatóak a tollkezdemények, és a kilencedik naptól az embrió csibeformát vesz fel. A szív a testüregbe záródik, az embrió a továbbiakban a szik állományával a köldökön keresztül, a vérkeringés útján tart kapcsolatot (Kovács és Fehér, 1966).
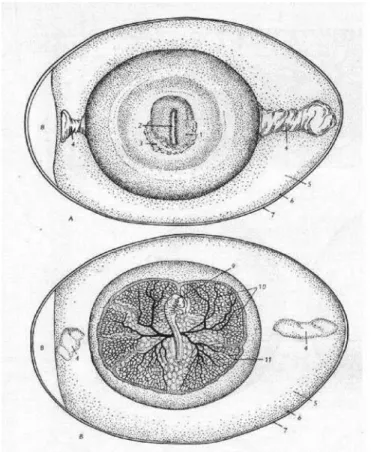
1. ábra A házityúk embrionális fejlődése A) a keltetés 1. napja, B) a keltetés 3. napja
(1. csírapajzs, 2. őscsík, 3. érudvar, 4. jégzsinórok, 5. tojásfehérje, 6. héjhártya, 7. mészhéj, 8.
légkamra, 9. embrió, 10. szikvérkeringés, 11. sinus terminalis) (Kovács és Fehér, 1966)
A tizenegyedik és tizenkettedik napon az izmok és a törzs erőteljes növekedése jellemző. A chorioallantois membrán (CAM) képessé válik a kalcium szállítására a tojáshéj és az embrió között és így biztosítja a megfelelő növekedést (Dieckert és mtsai, 1992). A tizenharmadik napra az embrióban kifejlődnek a szervek.
A tizennegyedik napon a szemhéjak fejlődése befejeződik. A tizenötödik napon a szájszöglet elszarusodott pereme jelenik meg (2. ábra). A tizenhatodik naptól már a szarukezdemények is felismerhetőek. A tizenhetedik-tizennyolcadik napig az embrionális növekedés dominál, a tizenkilencedik napon a sziktömlő megkezdi a behúzódást a hasüregbe, ami a 20 napon
18
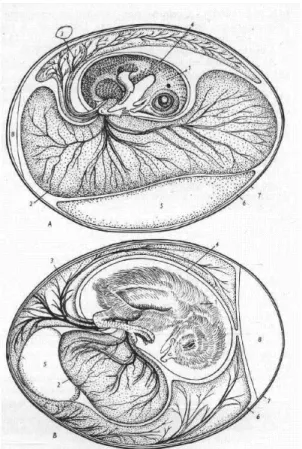
2. ábra A tyúk embrionális fejlődése
A) a keltetés 9. napján B) a keltetés 15. napján
(1. magzat, 2. sziktömlő, szikvérkeringés, 3. allantois, magzati vérkeringés, 4. amnion, 5. tojásfehérje, 6. héjhártya, 7. mészhéj, 8. légkamra) (Kovács és Fehér, 1966)
3.2.1.1.1. A chorioallantois membrán
A szemirritáció mértékének meghatározására jelenleg a Draize-féle primer szemirritációs tesztből származó adatokat fogadják el. Az 1980-as évektől azonban az állatvédő szervezetek egyre inkább megerősödtek és szót emeltek a Draize-féle tesztben alkalmazott kísérleti nyulak szenvedései ellen. Az erősödő állatvédelmi mozgalmak hatására egyre szélesebb körökben támogatták a Draize-féle szemirritációs vizsgálat új, alternatív módszereinek kifejlesztését (Christian és Diener, 1996).
Talsma és mtsai (1988) írták le, hogy a Draize-féle teszt által megkövetelt 6 nyúl állatlétszámának 3-ra csökkentése nem eredményezi az in vivo teszt megbízhatóságának csökkenését. Seabaugh és mtsai (1993) a szemen helyi anesztetikumok felhasználását javasolták a kísérleti nyulak fájdalmainak csökkentésére.
1993-ban Lambert és mtsai a Draize-féle teszt által előírt kezelési koncentrációk tized részét alkalmazták a vegyi anyagok szemirritációs potenciáljának meghatározására; ez volt a Low Volume Eye Test, LVET. A kapott eredmények nagyon jó korrelációt mutattak a primer teszt eredményeivel.
A kutatások főirányát azonban olyan in vitro tesztek kifejlesztése jelentette, amelyek alkalmasak lehetnek az in vivo Draize-féle teszt kiváltására. A perspektivikus alternatív módszerek a következő csoportokba sorolhatók:
• nyúl és szarvasmarha szemmel vagy szemrészekkel végzett vizsgálatok,
• citotoxicitási vizsgálatok,
• chorioallantois membránt felhasználó vizsgálatok,
• biokémiai vizsgálatok (Walum és mtsai, 1992).
A chorioallantois membránt már hosszabb ideje alkalmazzák a biológiai kutatások különböző területein, a virológiai-, bakteriológiai- és tumorkutatásban (Beveridge és Burnet, 1946) is. A csirkeembriót, mint tesztobjektumot gyakran alkalmazzák a különböző vegyi anyagok toxikus és teratogén hatásának becslésére (Verrett és mtsai, 1980; Fisher és Schoenwolf, 1983).
A vegyi anyagok által okozott elváltozások kimutatására Leighton és mtsai (1985) a tyúktojás chorioallantois membránját használták. A CAM-ot a keltetés 14. napján kezelték különböző háztartási vegyi anyagokkal (Zwilling-technika), amit egy 10 mm átmérőjű teflon gyűrűbe helyeztek. A makroszkopikus reakciókat a keltetés 17. napján értékelték, majd szövettani vizsgálathoz mintát vettek a CAM kezelt területéről. A szövettani vizsgálat eredményei jó korrelációt mutattak a makroszkópos elváltozásokkal. Az in vitro vizsgálatból és a Draize-féle primer szemirritációs tesztből származó eredményeiket összehasonlították; a chorioallantois membránt használó in vitro teszt eredményei jó korrelációt mutattak az in vivo adatokkal.
Luepke és Kemper 1986-ban fejlesztették ki a HET-CAM (Hen’s Egg Test – Chorioallantoic Membrane) tesztet. A módszerrel 190 különböző vegyi anyagot és készítményt vizsgáltak. Az
20
felhasznált állatok számát csökkentsék, azonban említik, hogy a módszer teljes egészében nem képes az emlős tesztek felváltására, alkalmas lehet viszont ismert irritációs potenciálú referencia anyagok használatát, és a válaszreakciók értékelését segítő leíró jellegű standard reakciókat bemutató fotóatlaszok alkalmazását.
Lawrence és mtsai (1990) 34, ipari és kozmetikai vegyi anyag irritációs potenciálját vizsgálták a Luepke által kifejlesztett HET-CAM teszttel. A tesztekhez 10 napos embrionálódott tyúktojás chorioallantois membránját használták fel, és 20 másodperces expozíciót követően kiöblítették a vizsgálati anyagokat. A kezelést követően a membránt 5 percig figyelték meg és értékelték a lízis és a vérzések kialakulását. Az in vitro és in vivo eredmények összehasonlításakor a különböző kémiai karakterű anyagokat együttesen értékelve korlátozott mértékű korrelációt állapítottak meg.
Van Erp és Weterings (1990) elővizsgálati módszerként egy in vitro tesztrendszert dolgoztak ki, mely a szaruhártya károsodásainak vizsgálatára az izolált szarvasmarha szemet (BE) használja a szaruhártyahomály mértékének megállapítására. A kötőhártya károsodások vizsgálata a tyúktojás chorioallantois membránján (CAM) történik. A két in vitro tesztből álló tesztrendszer a BECAM módszer. Közel 150 vizsgált vegyi anyag eredményeit figyelembe véve, az in vitro és in vivo eredmények 95%-ban egyeztek. A szerzők megállapították, hogy a BECAM vizsgálati módszerrel nem vagy enyhén irritatívnak minősített anyagokat nem kell veszélyt jelző címkékkel ellátni, míg irritatívabb anyagoknál csökkentett állatlétszámú emlős tesztek elvégzésével nyerhetőek további irritációs adatok az EGK (Európai Gazdasági Közösség) által megkövetelt címkézéshez.
Blein és mtsai (1991) 40, különböző természtű vegyi anyag vizsgálatát végezték el a HET- CAM teszttel. Megállapították, hogy bizonyos, általában színes és zavaros vizsgálati anyagok esetében az in vitro HET-CAM teszttel az irritáció nem határozható meg.
Bruner és mtsai (1991) 17 háztartási vegyi anyag irritációs vizsgálatát végezték el az in vitro BECAM tesztrendszerrel. Az in vitro és az in vivo eredmények összehasonlítása során gyenge korrelációt figyeltek meg.
Rougier és mtsai (1992) nedvesítő szerek és kozmetikai termékek irritációs potenciálját határozták meg HET-CAM teszttel. Az eredmények összehasonlítása alapján az in vitro
eredmények nagyon jó korrelációt (r = 0,96) mutattak a Draize-féle tesztből származó in vivo irritációs adatokkal.
Bagley és mtsai (1992, 1994) öt különböző in vitro tesztet alkalmazva - köztük a HET-CAM tesztet - háztartási vegyi anyagok irritációs potenciálját határozták meg. Öt különböző laboratórium között végzett összehasonlító vizsgálat eredményeként a CAM-ot használó kísérleti módszerek kitűnő reprodukálhatóságát figyelték meg. A vizsgálati eredmények összehasonlítását követően a HET-CAM teszt esetében megállapították, hogy in vitro eredmények jó korrelációt (HET-CAM teszt r = 0,77) mutatnak in vivo adatokkal.
Spielmann és mtsai (1993) a HET-CAM teszttel nagyon jó eredményeket kaptak a szemirritáció vizsgálatára javasolt in vitro módszerekkel végzett laborvizsgálatokban. A szerzők megállapították, hogy az általuk elvégzett vizsgálatok az in vitro HET-CAM teszt jövőbeni felhasználhatóságát jelzik a primer szemirritáció vizsgálatára, alternatív módszerként.
Ohno és mtsai (1995) beszámoltak a japán egészségügyi hatóságok által a Draize-féle in vivo teszt alternatíváiként szóba jöhető módszerekkel elvégzett összehasonlító vizsgálatok eredményeiről. A vizsgálatokban résztvevő laboratóriumok közötti eredményekből meghatározott variabilitás szempontjából a HET-CAM teszttel kapták a legjobb eredményeket. Budai és mtsai 2000-ben a HET-CAM tesztet hisztológiai vizsgálattal egészítették ki. Az in vitro és in vivo eredmények összehasonlítása során a HET-CAM tesztből származó adatok jó korrelációt mutattak az in vivo adatokkal.
Sina és mtsai 1995-ben 37 szintetikus gyógyszer intermedier irritációs potenciálját határozták meg 7 féle különböző in vitro vizsgálattal. Ezen in vitro tesztek között szerepelt egy chorioallantois membránt felhasználó in vitro vizsgálati módszer, a CAMVA (Chorioallantoic Membrane Vascular Assay). Az in vitro és in vivo tesztek eredményeinek összehasonlításakor a chorioallantois membránt használó CAMVA módszerből származó adatok jó korrelációt mutattak az in vivo adatokkal.
22
vizsgálati módszerek (pl. HET-CAM teszt), amelyek 10 napos korú tojást használnak az in vivo tesztek alternatív metodikáinak minősülnek. A német hatóságok elfogadják a chorioallantois membránt felhasználó in vitro módszerek felhasználását az erősen irritatív anyagok (R41: Súlyos szemkárosodást okozhat) meghatározására. A nem irritatív (R36:
Szemizgató hatású) anyagok esetén az in vitro eredményeket, in vivo tesztekből származó eredményekkel is meg kell erősíteni.
Christian és Diener (1996) a perspektivikus in vitro módszerek és az in vivo tesztek közötti összehasonlító vizsgálatok eredményeit mutatták be.
Debbasch és mtsai (2005) 12 kozmetikai tisztítót (make-up lemosót) teszteltek HET-CAM, Bovine Corneal Opacity and Permeability (BCOP) és Corneal Epithelial Cell Line tesztekkel.
A HET-CAM tesztről megállapították, hogy a szemen jelentkező klinikai tüneteket nem képes kimutatni. A kereskedelmi forgalomban elérhető, nem irritatív kozmetikumokat irritatívnak mutatja, ami azonban a kozmetikum összetételével összefüggésben lehet.
A CAM-ot használták irritáció meghatározására Lagarto és mtsai 2005-ben. Huszonegy tesztanyagot, köztük vegyszereket és kozmetikumokat teszteltek, a membránkárosodást trypan blue alkalmazásával mérték fel. A kapott eredmények jó korrelációt mutattak az in vivo tesztből származó eredményekkel.
Vinardell és Mitjans 2005-ben ipari és laboratóriumi vegyszereket vizsgált a CAM-on. A módszert elővizsgálati módszerként javasolják.
Kishore és mtsai (2008) mikrobiocidet, mezőgazdasági fungicideket és növekedésszabályzót teszteltek a CAM-on. A kapott eredményeket in vivo tesztből származó irodalmi adatokkal vetették össze és jó korrelációt állapítottak meg.
Ying és mtsai (2010) öt tesztből álló tesztrendszert dolgoztak ki, melynek a HET-CAM teszt is eleme lett a szintén chorioallantois membránt használó Chorioallantoic Membrane – Trypan Blue Staining (CAM-TBS) mellett. A tesztrendszerben citotoxicitási vizsgálat is szerepel. Az öt módszert használva 16 vegyi anyagot vizsgáltak, néhányat több koncentrációban is. A szerzők a tesztrendszer megbízhatóságáról és reprodukálhatóságáról számoltak be.
A chorioallantois membránt felhasználó tesztek (HET-CAM, CAMVA) is azon in vitro módszerek közé tartoznak, amelyek önmagukban nem, de más in vitro módszerekkel kombinálva, in vitro tesztrendszerként felhasználhatók a szemirritációs potenciál meghatározására (Budai és Várnagy, 2000; Budai és mtsai, 2004). A vérerekkel és kapillárisokkal átszőtt CAM vérérrendszerében bekövetkező változások jól modellezik azokat a károsodásokat, amelyek a kémiai irritáció hatására alakulnak ki a szem kötőhártyáján. Fő hátrányainak egyike a kiértékelés szubjektív természete.
3.2.1.2. A tojások előkészítése
3.2.1.2.1. A légkamrán keresztüli behatolás
A chorioallantois membrán (CAM) a keltetés 10. napjára fejlődik ki. Amikor a CAM kifejlődött, a tojás héját a légkamra fölött ollóval vagy csipesszel eltávolítják, a héjhártyát óvatosan elmozdítják, és ekkor feltárul a CAM. Az így előkészített tojás (3-4. ábra) már alkalmas a kezelésre (Luepke, 1985).
A módszer előnye, hogy egyszerűen kivitelezhető, az elváltozások könnyen követhetők; ezért kísérleteimben a légkamrán keresztüli behatolást alkalmaztam.
3. ábra A légkamrán keresztüli behatolás
24
4. ábra A kezelésre előkészített CAM
3.2.1.2.2. Behatolás a tojás egyenlítőjén át
Kilyukasztott membrán módszer
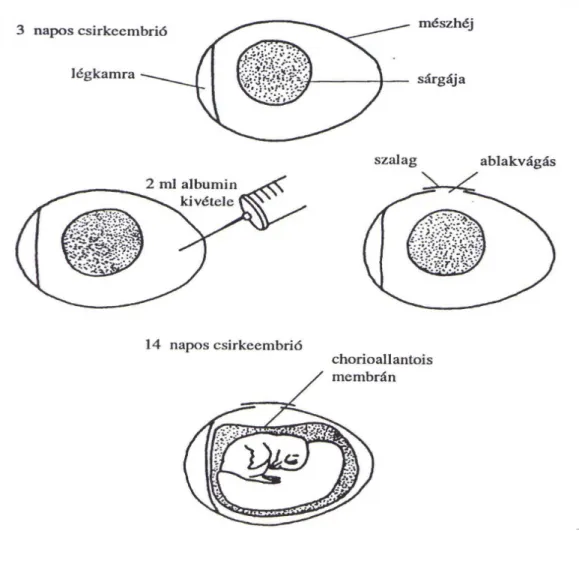
A keltetés 14. napján egy-egy lyukat fúrnak a tojás egyenlítői síkjában és a légkamra felett. A légkamrából a levegőt vákuum segítségével távolítják el. Az egyenlítői síkon ablakot vágnak, hogy a chorioallantois membrán kezelése elvégezhető legyen (5. ábra). Az ablakot öntapadó szalaggal, a lyukat pedig valamilyen kocsonyás anyaggal fedik le (Lawrence, 1987).
5. ábra Kilyukasztott membrán módszer
26 Zwilling-technika
Az inkubáció 3. napján kis lyukat fúrnak a mészhéjon, a tojás hegyes végén. Az albuminból 2 ml-t eltávolítanak fecskendő és egy tű segítségével, majd a nyílást fedik. Az egyenlítői síkban ablakot vágnak a mészhéjon a kilyukasztott membrán módszerben ismertetett módon, majd öntapadó szalaggal fedik. A tojást ezek után visszahelyezik az inkubátorba (6. ábra). A CAM az albumin redukált szintjén fejlődik, a kezelést és az értékelést az ablakon keresztül végzik (Zwilling, 1959).
6. ábra A Zwilling-technika
3.2.1.3. A chorioallantois membrán felhasználása
A chorioallantois membrán felépítése a 7. ábrán látható.
7. ábra A CAM szerkezete
Az inkubáció 11. napja után a chorioallantois három rétegű. A külső réteg a héjhártyával érintkező ectodermalis eredetű hámréteg. A középső réteg embrionális kötőszövet, a mesenchyma, amely a somato- és a splanchnopleurából fejlődik. A belső réteg az entodermából származó allantois-hám (7. ábra) (Fáncsi és Fehér, 1978).
28 Chorion (membrana serosa)
A chorion alkotja az ectodermalis eredetű külső, héjhártyával érintkező réteget. Két rétegű hámja kötőhámsejtekből áll. A külső hámsejtréteg, lap vagy alacsony köbhámsejtekből épül fel. A belső - mesenchyma felőli - a réteg magas köbhámsejtekből áll. A kapillárisok mind a két hámréteg, mind a külső hámréteg és a héjhártya között megtalálhatók. Ez utóbbiak tág öblöket, sinusokat képeznek (Fáncsi és Fehér, 1978).
Mesenchyma
A chorioallantois kialakulásakor a somato- és a splanchnopleura összeolvadásából fejlődik a mesenchyma-réteg, amely csillag alakú, hosszú, nyúlványos sejtekből áll. A mesenchyma héjhártya felöli rétegében szűk és vékonyfalú, az allantois közelében tágabb erek haladnak.
(Fáncsi és Fehér, 1978).
Allantois
Az allantois egyrétegű laphámsejtekből áll. Az allantois hámsejteknek a tömlő ürege felé eső felületén rövid, vaskos nyúlványok, bolyhok és invaginatiók találhatók (Fáncsi és Fehér, 1978).
3.2.2. A chorioallantois membránt felhasználó tesztek
3.2.2.1. Chorioallantoic Membrane Vascular Assay (CAMVA)
A CAMVA tesztet Leighton és mtsai alkalmazták először 1985-ben, majd Bagley és mtsai 1989-ben és 1991-ben fejlesztették tovább. Elsősorban a kozmetikaiparban használják irritáció becslésére. Alkalmazása főleg az Amerikai Egyesült Államokban terjedt el.
A módszer a lehetséges irritációt jelzi előre a csirke embrió chorioallantois membránjának érrendszeri károsodásai alapján.
A keltetés 4. napján kis ablakot vágnak az embrionálódott tojás héján, és egy kis mennyiségű albumint eltávolítanak, azért hogy a CAM megfelelő fejlődése biztosítva legyen. A nyílást ezután lezárják, és a tojást további 6 napig keltetik. A chorioallantois membrán a 10. napra éri
el a megfelelő fejlettségi állapotot (Bagley és mtsai, 1992, 1994). A 10. napon a vizsgálni kívánt anyagot közvetlenül a CAM-ra juttatják. 30 perccel később az érrendszeri elváltozások (vérzés, hyperaemia, vér nélküli erek) vizsgálhatók. A kísérlet végpontjának a tesztanyag azon koncentrációja tekinthető, ami a kezelt tojások 50%-án okoz érrendszeri elváltozást.
3.2.2.2. Chorioallantoic Membrane – Trypan blue festés (CAM-TB)
A CAM-TB (Itagaki és mtsai, 1995) a Japán Egészségügyi Minisztérium “Studies on the test methods to evaluate the safety of new ingredients of cosmetics” (Ohno és mtsai., 1999) című programjának részeként vált ismertté, bár a módszert 1991-ben Hagino és mtsai már alkalmazták (Hagino és mtsai 1991, 1993).
A trypan blue festés célja eredetileg egy olyan eljárás kifejlesztése volt, ami csökkenti a HET- CAM teszt szubjektivitásából eredő esetleges hibalehetőséget, és egy objektívebb eredményt ad. A technika lényege, hogy a CAM által megkötött trypan blue festék mennyiségéből a CAM tényleges károsodására lehet következtetni. A módszert széles körben alkalmazzák a membránkárosodás és az élő sejtek mennyiségének meghatározására (Hagino és mtsai, 1999).
Hátránya, hogy a színes anyagok a festést, mint a kísérlet végpontját zavarhatják (Ohno és mtsai, 1999).
3.2.2.3. Hen’s Egg Test - Chorioallantoic Membrane (HET-CAM)
Jelen kísérletekben a HET-CAM tesztet alkalmaztam. Részletes leírása az Anyag és módszer c. fejezetben megtalálható.
3.2.3. A citotoxicitási vizsgálatok alkalmazása
A citotoxicitási vizsgálatokat széles körben alkalmazzák a vegyi anyagok élő szervezetre gyakorolt toxikus hatásainak vizsgálatára. Károsító hatásra a sejtek reagálhatnak:
• nekrózissal, amelynek során a membrán-integritásukat elveszítve, lysis következtében gyors pusztulás figyelhető meg. A sejt tartalma az intercelluláris térbe ürül.
30
Citotoxicitási vizsgálatokat általában a gyógyszeriparban végezhetnek egy adott anyag tesztelésére, pl. rákellenes gyógyszerek kifejlesztésénél, ahol cél a gyors, specifikus sejtpusztító hatás vizsgálata. A teszt másik felhasználási irányvonala a nem-kívánt (magas) citotoxicitással rendelkező anyagok kiszűrése.
Az MTT Assay során a mitokondrium-függő reakcióban keletkező színes formazán mennyiségét mérik, amire nézve a sejtmembrán impermeabilis. A kimutatható formazán mennyisége alapján az élő sejtek aránya kiszámolható (Invittox Protocol No. 17.).
A tetrazolium sót (3-(4,5 dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide (MTT)) a sejtek felveszik és egy mitokondrium-függő reakcióban formazánná alakítják. Mivel ez a végtermék a sejtmembránon képtelen átjutni, ezért a sejtben felhalmozódik. A sejtek feloldásával a formazán szabaddá válik, mennyisége az élő sejtek számával arányos, és kolorimetriás módszerrel meghatározható.
A vizsgálat a kezelés után életben maradt sejtek mennyiségének meghatározásán alapul. A 24 órás inkubáció alatt a sejtek egyszer osztódnak és a mikroteszt lemez vájatainak falához tapadnak. Ezután a sejtek tápoldatát vizsgálati anyagot is tartalmazó friss oldatra cserélik. Újabb 24 óra múlva 2 óra inkubáció történik MTT-oldattal, melynek során az élő sejtek a vízoldható tetrazólium sóból vízoldhatatlan formazán kristályokat metabolizálnak. A formazán kristályok feloldása után az oldat adszorbancia spektruma megváltozik, a fényelnyelés spectrophotometerrel mérhető, kontrollhoz viszonyított eltérése pedig az élő sejtek számának változásával arányos.
3.3. A szem felépítése
A szem a gerinces állatoknál a csontos szemüregben helyezkedik el, amely a külső fizikai behatásokkal szemben védi a szemet. A szem védelmét látja el a szemhéj, a szempilla és a kötőhártya is.
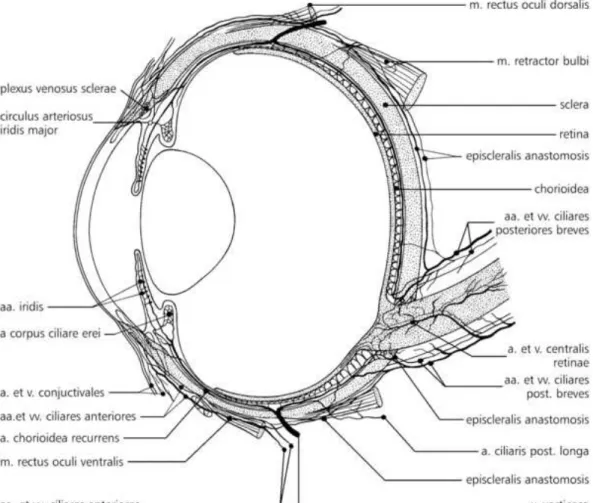
A szemgolyó falát három hártya adja, melyen belül a szemgolyó magja, a szemcsarnokok, a szemlencse és az üvegtest foglalnak helyet (Szentágothai és Réthelyi, 1985). A külső hártya hátulsó része a tülökhártya (sclera), elülső 1/5-öd része pedig a szaruhártya (cornea), mely elvékonyodó részét limbus corneae-nek nevezik. Bár a szaruhártyában nincsenek erek, ennek közelében a felső felületen koszorúszerű vénafonat a plexus venosus sclerae található. A szem felépítése a 8. ábrán látható.
8. ábra A szem felépítése
A szaruhártya a szemgolyó külső felülete, amely a külső környezetből érkező hatásoknak leginkább ki van téve. Ezáltal egy külső, mechanikai és kémiai barrierként szolgál: védelmet biztosít a szem mélyebben fekvő szöveteinek. A nagyjából fél milliméter vastagságú, gazdag beidegzésű szaruhártya 5 részből tevődik össze: a felületi epitheliumból, a Bowman membránból, a stroma-ból, a Descemet membránból és az endotheliumból. A stroma a teljes corneavastagság 85-90%-át adja. Rendezett kollagén rostokból épül fel, amelyek a szaruhártya
32
A középső hártya festékes kötőszöveti sejteket, idegi és simaizom elemeket, sűrű érhálózatot is tartalmaz, a tülökhártyától a corneosclerális határon - tehát a külső hártya elülső és hátulsó részének találkozásánál – válik külön és a szemgolyó belseje felé fordulva a szivárványhártyát vagy iris-t alkotja. Ennek közepén a fényre szűkülő nyílás, a pupilla helyezkedik el. A legbelső hártyát ideghártyának vagy retina-nak nevezzük.
A szemgolyó vérellátását három érrendszer adja, az ideghártyához térő retinális, az érhártyát ellátó ciliaris és az episcleralis - conjuctivalis érrendszer (9. ábra). Külső (mechanikai, kémiai) inger hatására vagy pedig gyulladásos állapotban az erek kitágulnak (Fehér, 1989).
A szemen megfigyelhető irritáció a szem felépítéséből adódóan több régiót érinthet. Általában először a legkülső réteg, a cornea sérül, de erősebb irritáció, vagy korrozív természetű anyag hatására a szem mélyebben fekvő rétegei is károsodhatnak (Kiss, 1997); az érintett terület sérülésének reverzibilitása függ a sérülés mélységétől (Eskes és mtsai, 2005). Maurer és mtsai 2002-ben leírták, hogy a kezelés utáni első órákban megfigyelhető cornea-károsodásból a szemirritáció mértéke és tartóssága becsülhető.
Hámszöveti jellege miatt a corneát és conjunctivát károsító vegyületek hatásmechanizmusa hasonló, mint bőrirritáció esetén, viszont a következmények súlyosabbak: a cornea fénytörésének minimális változása is gátolja a normális szemműködést, és mivel a corneában nem találhatók kapilláris erek, így a gyulladás az alatta található iris és érhártya gazdag érhálózatát érinti.
9. ábra A szem érrendszere
34
4. ANYAG ÉS MÓDSZER
4.1. Vizsgálati módszerek
4.1.1. HET-CAM teszt
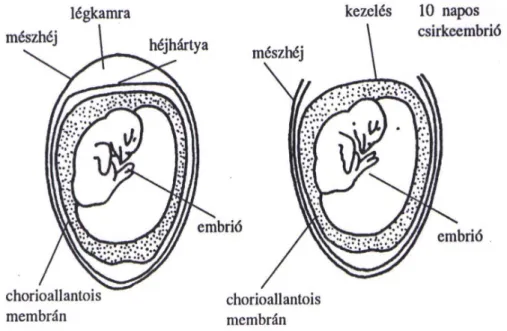
A vizsgálatokhoz Shaver Rusticbro tenyésztojásokat alkalmaztam, amelyeket a sármelléki Goldavis Kft. keltető üzeme biztosított. A Shaver Rusticbro jó termékenységi mutatókkal rendelkezik, a tojások kelési aránya magas. A tojásokat Ragus inkubátorban, 37 oC hőmérsékleten, 60-70%-os relatív páratartalom mellett 10 napig keltettem, mivel a chorioallantois membrán ekkorra éri el a megfelelő fejlettségi állapotot. Nyolc napig naponta forgattam, hogy az embrió letapadását elkerüljem. A 9. napon, lámpázást követően a hibásakat eltávolítottam, és a tojást a tompa végével felfelé helyeztem vissza a keltetőbe, ami a CAM 10.
napi hozzáférhetőségét segítette elő. (10. ábra).
10. ábra Kezelésre előkészített CAM
11. ábra Lízis és vérzés a CAM-on
A módszert az Invittox Protocol 47. száma (1990) írja le. A CAM-on bekövetkező változások (érlízis, vérzés, koaguláció) alapján az irritáció mértéke becsülhető, számítógépes program segítségével számszerűsíthető, és a kapott számszerű érték alapján irritációs kategóriába sorolható.
A kísérletekhez a következő eszközöket és vegyszereket használtam fel:
Eszközszükséglet:
- Ragus keltetőgép: optimális hőmérséklet 37,5 0C (± 0,5) relatív páratartalom 62,5% (± 7,5%),
- átvilágító lámpa, - csipesz, olló,
36 Vegyszerszükséglet:
- 0,9%-os NaCl,
- 1%-os SDS (Na-lauril szulfát), - 0,1 M NaOH.
A tojásokat a keltetés 10. napján dolgoztam fel. Ekkorra az embrionálódott tyúktojás chorioallantois membránja már kifejlődött, kezelésre alkalmas. A CAM-on vérzés, véredény lízis vagy koaguláció figyelhető meg. Az elváltozásokat és azok időpontját (másodpercben) jegyzőkönyvben rögzítettem.
Az értékelés számítógépes program segítségével történt, a következő algoritmus alapján (Invittox Protocol 47, 1990):
301-secH 301-secL 301-secC RI = ────── x 5 + ────── x 7 + ────── x 9 300 300 300
ahol:
H: vérzés, L: érlízis, C: koaguláció, RI: irritációs index, sec: indulási idő másodpercben Az egyes vegyi anyagok vizsgálatából származó eredmények átlagát a képletbe helyettesíve, az irritációs indexeket meghatároztam.
A számítógépes program algoritmusa alapján kapott irritációs indexeket az 1. táblázat alapján irritációs kategóriákba soroltam.
1. táblázat A HET-CAM teszt irritációs indexekhez tartozó irritációs kategóriái
Irritációs index Irritációs kategória
0-0,9 Nem irritatív
1-4,9 Gyengén irritatív 5-8,9 Közepesen irritatív
9-21 Erősen irritatív
4.1.2. MTT-Assay
A módszerrel 12 mezőgazdasági vegyi anyagot vizsgáltam. A felhasznált anyagok: Actellic 50 EC, Confidor 200 SL, Match 050 EC, Alirox 80 EC, Clinic 480 SL, Glialka 480 Plus, Targa Super 5 EC, TrendTM, Previcur 607 SL, Systhane 12 E, Silwet L-77 és Substral.
A vizsgálatot „Vero”, afrikai zöldmajom vese epithelsejteken (ECACC No: 84113001) végeztem, amelyeket 24 órával a vizsgálat megkezdése előtt az előzőleg elkészített szuszpenzióban (Hank-oldat), megfelelő hígításban mikroteszt lemez vájataiba vittem. A sejtek tenyésztő médiuma 10% szérumot és antibiotikumot (penicillin 5 ug/ml és sztreptomocin 25 µ g/ml) tartalmazott. A sejtek 24 óra alatt egyszer osztódnak és a vájatok falához tapadnak.
Másnap a tápoldatot kiöntöttem, és friss tápoldatra cseréltem (10. ábra), amely 10%-ban (v/v%) a vizsgálati anyag különböző mértékben hígított oldatát tartalmazta. A 24 órás expozíció után 2 órán át 1 mg/ml MTT oldattal inkubáltam a sejteket, majd a keletkezett formazán kristályokat metanollal oldottam. Az oldat fényelnyelését 570 és 630 nm hullámhosszon mértem. Az élő sejtek száma az (OD570 – OD630) értékkel arányos. Az azonos hígítások fényelnyelési adataiból (3 mérés) átlagot számoltam, majd ezt a kezeletlen sejtek (24 mérés) átlagához viszonyítva kiszámítottam a %-os sejtpusztulást.
A vizsgálati minták minden hígításával három párhuzamos mérést végeztem. Kontrollként kezeletlen sejteket használtam.
Citotoxikus hatásnak értékeltem, ha a kezelt sejtek fényelnyelési átlaga alacsonyabb volt, mint a kezeletlen sejtek fényelnyelési átlaga.
38
12. ábra A sejtek kezelése
Eszközszükséglet:
- 96 vájattal rendelkező mikroteszt lemez - Easy Reader 400 spektrofotométer - automata lemezrázó
Vegyszerszükséglet:
- 3-(4,5 dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide (MTT-oldat) - KCl
- KH2PO4 - NaCl - NaHCO3 - Na2PO4*7H2O - Etanol
A kezelt oldat fényelnyelését a kezeletlenhez viszonyítva, az élő sejtek %-os aránya meghatározható:
a kezelt sejtek abszorbanciája
___________________________ x100 a kontroll sejtek abszorbanciája
4.1.3. A Draize-féle primer szemirritációs teszt
A Draize-féle primer bőr- és szemirritációs teszteket egyaránt nyúlon végzik. Az új-zélandi fehér nyúl középnagy testű fajta, szőre fehér, szemei pirosak. Kifejlettkori testtömege 4,5-5,5 kg. Fejlődése gyors, a takarmányhasznosítása kiváló, így 8 hetes korára elérheti az 1,8-2,0 kg- ot (Holdas, 1976).
A klasszikus Draize-féle szemirritációs vizsgálatot a 405-ös számú OECD Guideline (2002) alapján végeztem el. A kísérletben minden vegyi anyag esetén 2 vagy 3 új-zélandi fehér nyulat használtam fel. A nyulak egyik oldali szemét kezeltem, a kezeletlen szem kontrollként szolgált, ezért kontroll csoport beállítása nem szükséges (önkontrollos teszt).
Az egyedileg elhelyezett állatok számára 22-25 ºC-ot, 50-70%-os relatív páratartalmat és napi 12 óra mesterséges megvilágítást biztosítottam. Takarmányként egységes nyúltápot és csapvizet kaptak ad libitum.
A kísérleti anyagot főzőpohárban készítettem elő, és szemcseppentővel az egyik szem kötőhártyazsákjába 0,1 ml vizsgálati anyagot helyeztem, majd a kezelést követő 1 óra, 1, 2, 3 és 7 nap után értékeltem a szem hártyáin jelentkező elváltozásokat (Draize és mtsai, 1944) (13.
ábra). A szem különböző hártyáin jelentkező elváltozások külön kerültek értékelésre (2.
táblázat).
40
13. ábra A kezelt szem
2. táblázat Draize-féle értékelő pontozás
I. Kötőhártya (Conjunctiva) Pont
A. Vérbőség
Az erek a normálist meghaladóan, határozottabban láthatók 1 Kifejezettebb, sötétebb, karmazsinvörös szín 2
Diffúz, sötétvörös szín 3
B. Duzzadás
Enyhe duzzadás, beleértve a pislogóhártyát is 1
Szemhéjak részleges kifordulásával 2
Félig zárt, duzzadt szemhéjak 3
Teljesen zárt, duzzadt szemhéjak 4
C. Váladékképződés
Normálist meghaladó mennyiség 1
A szemhéjak széle nedves 2
A szemhéjak környéke is nedves 3
Értékelés: ( A + B + C ) x 2 Max.: 20 pont
42 II. Szaruhártya (Cornea)
A. Homály mértéke
Elszórt, diffúz homály, a szivárványhártya világosan látható 1 A homályban átlátszó területek, a szivárványhártya részletei
csak homályosan láthatók
2
Opálos homály, a szivárványhártya részletei nem láthatók 3 Intenzív opálos, a szivárványhártya láthatatlan 4
B. Homály területe
1/4 rész vagy kisebb 1
2/4 résznél kisebb, de 1/4 résznél nagyobb 2 3/4 résznél kisebb, de 1/2 résznél nagyobb 3
Teljes felszín, 3/4 résznél nagyobb 4
Értékelés: A x B x 5 Max.: 80 pont
III. Szivárványhártya (Iris)
A. Elváltozások
Vérbő, redőzöttebb írisz, szaruhártya belövellt, az írisz fényre
még enyhén reagál 1
Vérzés, fényre nem reagál 2
Értékelés: A x 5 Max.: 10 pont
Végső pontszám: I + II + III = 20 + 80 + 10 = 110 pont
Az elváltozásokhoz értékelő pontokat rendeltem, majd ezeket összesítve, Kay és Calandra módszere alapján (Maximum Mean Total Score – MMTS,Kay J. H. and Calandra J. C., 1962) (3. táblázat) határoztam meg az irritációs indexet.
44
3. táblázat Maximum Mean Total Score – MMTS
MAXIMUM ÁTLAG PONTSZÁM
TÜNETEK
FENNÁLLÁSA OSZTÁLYOZÁS
0.0-0.5
Csop. átl. pont 24 óránál = 0
Csop. átl. pont 24 óránál > 0
Nem irritatív (1)
Gyakorlatilag nem irritatív (2)
0.5-2.5
Csop. átl. pont 24 óránál = 0
Csop. átl. pont 24 óránál > 0
Gyakorlatilag nem irritatív (2) Minimálisan irritatív (3)
2.5-15
Csop. átl. pont 48 óránál = 0
Csop. átl. pont 48 óránál > 0
Minimálisan irritatív (3) Enyhén irritatív (4)
15-25
Csop. átl. pont 72 óránál = 0
Csop. átl. pont 72 óránál > 0
Enyhén irritatív (4) Közepesen irritatív (5)
Az egyedi pontszámok több, mint fele a 7. napon 10 vagy kevesebb
Közepesen irritatív (5)
25-50
Csop. átl. pont a 7 napon 20 vagy kevesebb
Az egyedi pontszámok több, mint fele a 7. napon 10 < de egy esetben sem 30 <
Közepesen irritatív (5)
Az egyedi pontszámok több, mint fele a 7. napon 10 < és 30 pont felett is lehet
Erősen irritatív (6)
Csop. átl. pont a 7
napon 20 < Erősen irritatív (6)
3. táblázat folytatása
MAXIMUM ÁTLAG PONTSZÁM
TÜNETEK FENNÁLLÁSA OSZTÁLYOZÁS
Az egyedi pontszámok több, mint fele a 7. napon 30 vagy kevesebb
Erősen irritatív (6)
50-80
Csop. átl. pont a 7 napon 40 vagy kevesebb
Az egyedi pontszámok több, mint fele a 7. napon 30 < de egy esetben sem 60 <
Erősen irritatív (6)
Az egyedi pontszámok több, mint fele a 7. napon 30 <, és 60 pont felett is lehet
Nagyon erősen irritatív (7)
Csop. átl. pont a 7 napon 40 <
Nagyon erősen irritatív (7)
Az egyedi pontszámok több, mint fele a 7. napon 60 vagy kevesebb
Nagyon erősen irritatív (7)
80-100
Csop. átl. pont a 7 napon 80 vagy kevesebb
Az egyedi pontszámok több, mint fele a 7. napon 60 < de egy esetben sem 100 <
Nagyon erősen irritatív (7)
Az egyedi pontszámok több, mint fele a 7. napon 60 <, és 100 pont felett is lehet
Extrém irritatív (8)
Csop. átl. pont a 7 napon 80 <
Extrém irritatív (8)
100-110
Csop. átl. pont a 7. napon 80 vagy kevesebb
Csop. átl. pont a 7. napon 80 <
Nagyon erősen irritatív (7)
Extrém irritatív (8)
46
4.2. Vizsgálati anyagok
A kísérletben gyomirtó (herbicid), rovarirtó (inszekticid), gombairtó (fungicid) készítmények, valamint adalékanyagok, tapadásfokozók, levéltrágyák kerültek felhasználásra. A kísérleti anyagokat mind a HET-CAM tesztben, mind a Draize-féle primer szemirritáció során 100%- os töménységben alkalmaztam. Amennyiben az in vivo tesztben egy órával a kezelés után erős irritációt figyeltem meg, a kezelést a második és harmadik állaton nem végeztem el.
4.2.1. A vizsgálatban felhasznált növényvédő szerek
4.2.1.1. Inszekticidek (4. táblázat)
4. táblázat A vizsgált inszekticidek
Tesztanyag Hatóanyag LD50(mg/ttkg) Irritáció
Actellic 50 EC pirimifosz-metil 1522-1732 irritatív
Agrol Plus fehér olaj 5000< irritatív
Chinmetrin 25 EC béta-cipermetrin 2060 enyhén irritatív
Confidor 200 SL
imidakloprid, N-metil-2-
pirrolidon
2000< irritatív
Fendona 2 EC alfa-cipermetrin 600 enyhén irritatív
Kohinor 200 SL imidakloprid ~ 2500 irritatív
Match 050 EC lufenuron 3100< irritatív
Mospilan 3 EC acetamprid 2000-2146 irritatív
Omite 57 E propargit 2788 erős irritatív,
irreverzibilis
Pyrinex 48 EC chlorpyrifos 508 enyhén irritatív
Sherpa cipermetrin 2000 enyhén irritatív
Sumi-Alpha 5 EC észfenvalerát 399 irritatív
Talstar 10 EC bifentrin 520 nem irritatív
Thionex 35 EC endoszulfán 0,07 ml/ttkg nem irritatív
Unifosz 50 EC diklórfosz 56-80 enyhe irritatív
Zolone 350 EC phosalone 2000< közepesen irritatív