MTA Doktora Pályázat Doktori Értekezés
A pikkelysömör pathomechanizmusáról
Dr. Bata Zsuzsanna
SZEGED
2005
Tartalomjegyzék
1. A dolgozatban előforduló rövidítések jegyzéke... 3
2. Bevezetés... 4
3. Célkitűzések ... 11
4. Anyagok és Módszerek ... 13
4.1. Szövetminták ... 13
4.2. Szövetfestés ... 13
4.3. Immuncitokémia... 14
4.4. Epidermális sejtszuszpenzió készítése ... 14
4.5. Dermális sejtszuszpenzió készítése ... 15
4.6. Sejttenyésztés T sejtek analíziséhez ... 15
4.7. Felnőtt humán bőrből származó epidermális sejtek tenyésztése ... 15
4.8. HaCaT sejtek tenyésztése... 16
4.9. HaCaT sejtek szinkronizálása ... 17
4.10. Áramlásos citometriás vizsgálatok... 18
4.11. Perifériás vér sejtjeinek immunfestése ... 19
4.12. RT-PCR ... 19
4.13. Quantitatív (real-time) RT-PCR (Q-RT-PCR) ... 21
4.14. Immunoblot ... 21
5. Eredmények... 22
6. Megbeszélés ... 60
7. Összefoglalás... 79
8. A munka gyakorlati hasznosításának lehetősége ... 81
9. Az értekezés témájához kapcsolódó saját közlemények: ... 83
10. A doktori értekezésben felhasznált eredményeket tartalmazó munkák: ... 83
11. Irodalom ... 86
12. Köszönetnyilvánítás ... 99
1. A dolgozatban előforduló rövidítések jegyzéke
PCNA: proliferálódó sejt nukleáris antigén K1/K10: keratin 1/ keratin 10
γIFN: interferon gamma IL-3: interleukin 3
GM-CSF: granulocita makrofág kolónia stimuláló faktor KGFR: keratinocita növekedési faktor
FBS: fötális borjúszérum PBS: foszfát puffer
PMA: forbol mirisztát acetát DNS: dezoxiribonukleinsav RNS: ribonukleinsav
KBM: keratinocita bazális médium EGF: epidermális növekedési faktor EDTA: etiléndiamintetraacetátsav BrDU: 5-bromo-2’-deoxi-uridin IL-1α: interleukin 1 alfa
IL-1β: interleukin 1 béta
IL-1 RA: interleukin1 receptor antagonista PCR: polimeráz láncreakció
FN: fibronektin
DEJ: dermo-epidermális junkció MMP: mátrix metalloproteináz TIMP: tissue inhibitor of MMP
STAT: signal transducer and activator of transcription TGF-β: transzformáló növekedési faktor béta
JAK: Janus tirozin kináz Cdk: ciklin dependens kináz IL-8: interleukin 8
GRO-α: growth related oncogene alfa TNF-α: tumor nekrózis faktor alfa
LFA: leukocita funkció asszociált antigén
2. Bevezetés
A disszertációban a pikkelysömör betegség pathomechanizmusában résztvevő különböző folyamatokat vizsgáló munkákat foglalom össze. Bár részletesebben azokról az eredményekről számolok be, melyek a Ph.D.
értekezésem megvédése (1997. február) után születtek, a munka folyamatos jellegéből következően, az érthetőség kedvéért a korábbi munkák eredményeire is hivatkozom.
A pikkelysömör (Psoriasis) egy poligénesen öröklődő bőrbetegség, melynek prevalenciája 2-3 % körül van különböző populációkban, a bőrbetegségek közül ez a leggyakoribb. Más poligénes betegségekhez hasonlóan a betegség klinikai spektruma széles, az életminőséget alig befolyásoló néhány lokalizált bőrtünet jelentkezésétől, a súlyos, egész bőrfelületet érintő, ízületi panaszokkal kísért, az életet veszélyeztető formáig terjed. A klinikai megjelenés prototípusa a plakkos forma (Psoriasis vulgaris). Az elsősorban nagy ízületeket érintő gyulladás (Arthropathia psoriatica) kivételével a betegség kizárólag a bőrt és annak függelékszerveit érinti.
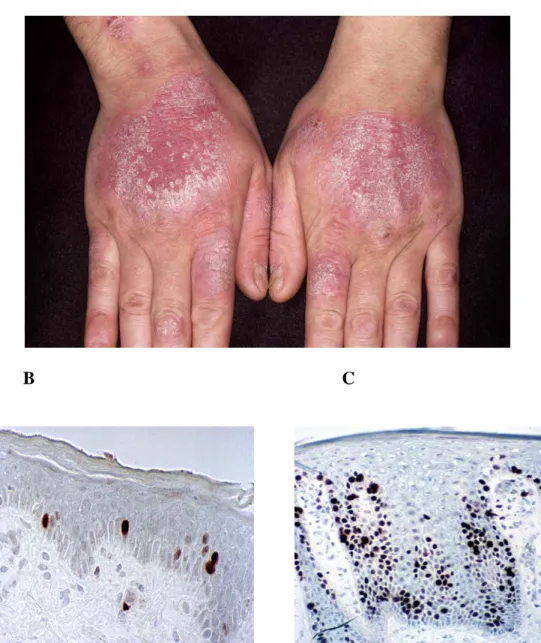
A pikkelysömörös bőrlézió klasszikus elváltozása a dominálóan T sejtes infiltrátum jelenléte a hám alatti kötőszövetben és a hámban, valamint a hámsejtek (keratinociták) fokozott osztódása és kóros differenciálódása (1. ábra).
Polimorfonukleáris granulociták infiltrátumai úgynevezett Munro-féle microabszcessusokat képeznek a hám (epidermisz) felső rétegében, melyek dominanciája a psoriasis pustulosa klinikai megjelenését eredményezi.
A pikkelysömörös betegek bőrén a legkülönbözőbb hatásokra (fizikai-, kémiai trauma, infekció, kontakt allergének, stressz, fokozott alkoholfogyasztás, bizonyos gyógyszerek) kialakul a jellegzetes pikkelysömörös lézió (Köbner jelenség), jelezve, hogy a pikkelysömörös beteg bőre tünetmentes állapotában is kóros reakciókészséget hordoz.
A klinikai variánsok között megkülönböztethetjük a fiatal korban jelentkező (I. típus) és a felnőtt korban jelentkező (II. típus) formáját a betegségnek. A fiatal korban jelentkező forma általában 40 éves kor előtt alakul ki,
plakkok, inkább a kisebb, papulosus bőrelváltozás a jellemző. A fiatalkori csoportban gyakrabban előforduló eruptív, kiterjedt guttált psoriasis kialakulásában valószínűleg szerepet játszanak bakteriális infekciók, a bakteriális szuperantigének nem specifikus módon aktiválják azokat az immunfolyamatokat, melyek a betegség pathomechanizmusában lényeges szerepet játszanak (Prinz, 1999).
A
B C
1. ábra A fölső képen (A) a pikkelysömör jellegzetes vörös, felszínén ezüstösen hámló, jól körülhatárolt elváltozása látható. A két alsó képen a normál bőr (B) és a pikkelysömörös lézió (C) szövettani képe látható. Fagyasztott metszeten immunhisztokémiai eljárással Ki67 ellenanyaggal vannak jelölve a hám osztódó sejtjei (barna pontok). Az egészséges hámszövethez képest jelentősen megnövekedett a proliferatív sejtek száma a pikkelysömörös lézióban. Az epidermisz kiszélesedett, a hám papillái megnyúltak a hámsejtek fokozott osztódása és kóros differenciálódása következtében.
A fiatalkori formában a betegek majdnem 90%-ában találtak HLA Cw6 asszociációt, ez az arány a felnőtt korban, általában 50-60 éves kor körül, jelentkező formában csak 50% kaukázusi beteganyagon (Henseler and Christophers, 1995). A HLA asszociáció etnikai variabilitást mutat, japán pikkelysömörös betegek 26%-a Cw6 pozitív csak, viszont 17%-uk hordozza a Cw7 antigént (Asahina és mtsai., 1996). Különböző populációkban kapcsoltsági analízis vizsgálatokkal eddig 8 különböző kromoszómán azonosítottak psoriasisra hajlamosító géneket, ebből 3-at más, független populációkban is sikerült azonosítani (Elder és mtsai., 2001).
A HLA asszociáció pathomechanizmusban játszott szerepe nem ismert, elképzelhető, hogy a HLA Cw6 csak marker gén és a 6-os kromoszómán a HLA régióban elhelyezkedő más kapcsolt gének, mint például a corneodesmosin, mely a hámsejtek differenciálódása során jelenik meg a sejtekben, játszanak szerepet a betegségre való hajlam kialakításában (Allen és mtsai., 1999; Zhou and Chaplin, 1993).
A bőrt infiltráló T sejtek pathomechanizmusban játszott szerepének vizsgálata az 1980-as években kezdődött, Bos és munkatársai 1983-ban írták le az infiltrátum sejtjeinek immunfenotípusát (2. ábra) (Bos és mtsai., 1983).
Valdimarsson munkatársaival 1986-ban közölte azt a feltételezést, hogy a hámsejtek fokozott osztódásáért a T sejtek lehetnek felelősek a betegségben (Valdimarsson és mtsai., 1986).
Már 1990-ben megjelent közleményekben beszámoltak arról, hogy allogenikus csontvelőtranszplantációval a betegség átvihető, illetve gyógyítható (Eedy és mtsai., 1990; Gardembas-Pain és mtsai., 1990). Hasonló megfigyelésekről az utóbbi években is beszámoltak csontvelőtranszplantált egyéneken (Kanamori és mtsai., 2002 ; Snowden and Heaton, 1997).
1991-ben jelent meg az a dolgozat, melyben nagy beteganyagon végzett, dupla-vak vizsgálattal bizonyították a cyclosporin jó terápiás hatását a betegségben (Ellis és mtsai., 1986). A cyclosporin a calcineurin foszfatáz gátlása révén a T sejtek aktivációját gátolja. Az aktivált calcineurin felelős az aktivált T sejtek citoplazmikus nukleáris faktorának (NFAT) defoszforilálásáért, mely defoszforilált
2. ábra A pikkelysömörös léziót infiltráló CD3+ sejtek immunhisztokémiai preparátumon
Calcium-dependens reguláció számos citokin (IL-2, γIFN, IL-4, TGF), valamint az IL-2 receptor szabályozásában érvényesül (Rao és mtsai., 1997). Ezek az adatok indirekt módon támogatták a T sejtek pathomechanizmusban játszott szerepének fontosságát.
A 70-es évek elejéig az epidermisz osztódni képes bazális sejtrétegét (stratum germinativum) homogén sejtpopulációnak tekintették, melyben a sejtek azonos eséllyel osztódnak, majd differenciálódnak (Leblond és mtsai., 1964). A későbbi vizsgálatok során kiderült, hogy a hámsejtek jellegzetes oszlopos elrendeződést mutatnak, ezen oszlopok alján ritkán osztódó sejtek (keratinocita őssejtek, stem), felette közvetlenül gyors egymásutánban osztódó sejtek (átmeneti osztódó sejtek, transiently amplifying, TAC), majd efelett nem osztódó sejtek helyezkednek el. A hám proliferatív kapacitással bíró sejtjeinek populációja tehát nem homogén.
A pikkelysömörben észlelhető fokozott hámsejt proliferáció jelenségének pontosabb megismerése érdekében a 90-es évek elején multiparaméteres áramlásos citometriás vizsgálatokkal karakterizáltuk a hámszövet proliferatív populációit
normál bőrben, ami lehetővé tette annak felismerését, hogy a pikkelysömörös lézió kórosan osztódó sejtjei az egyébként normál bőrben alig-alig osztódó keratinocita őssejtek (Bata-Csörgő és mtsai., 1993). A normál epidermiszből frissen szeparált osztódó hámsejteken a β1 integrin és a keratin 1/10 kifejeződést vizsgálva megállapítottuk, hogy minden proliferálódó hámsejtre jellemző a β1 integrin kifejeződése, ezen belül a keratin 1/10 (K1/K10) kifejeződés alapján a sejteket két csoportra lehet osztani. A hámban bazálisan elhelyezkedő, K1/K10-et nem kifejező sejtek jellemzően kisméretűek, egyszerű a citoplazmájuk és alacsony az osztódási rátájuk, vagyis a sejtek többsége normál bőrben sejtnyugalmi (quiescent) állapotban van, nem fejezik ki a proliferálódó sejt nukleáris antigént (PCNA) sem.
Mindezek az őssejtpopulációk jellemző tulajdonságai. A K1/K10 pozitív sejtek citoplazmája granuláltabb, nagyobb a sejtek mérete és igen magas az osztódási rátájuk, ami az átmeneti osztódó sejtpopulációra jellemző. A β1 integrint már nem kifejező, K1/K10+ hámsejtek nem osztódó, terminálisan differenciálódott sejtek (3.
ábra).
A pikkelysömörös léziós bőrben a β1 integrin és K1/K10 kifejeződés alapján ugyanazt a három sejtpopulációt lehet elkülöníteni, mint a normál bőrben.
A különbség a β1 integrin+ K1/K10- sejtek populációjában található, ezek a sejtek a normál bőrtől eltérően a pikkelysömörös lézióban igen magas rátával osztódnak és PCNA pozitívak.
Azt a feltételezést, hogy a pikkelysömörös lézióban található T sejtek befolyásolják a hámsejtek proliferációját igazolták azok a kísérletek, melyekben a léziós bőrből klónozott, in vitro aktivált T sejt klónok felülúszójának hatását vizsgáltuk in vitro tenyésztett normál és tünetmentes pikkelysömörös bőrből származó hámsejtek növekedésére (Bata-Csörgő és mtsai., 1995).
3. ábra Az interfollikuláris hámszövet sejtjeinek karakterizálása a sejtek β1 integrin és a keratin 1/10 kifejeződése és proliferációja alapján
Voltak olyan T sejt klónok, melyek felülúszói jelentősen serkentették, voltak olyanok, melyek nem befolyásolták és voltak olyanok, melyek gátolták a hámsejt kolóniák növekedését. A növekedést gátló felülúszók CD8+(αβ+) T sejtekből, míg a többi CD4+ T sejtekből származott. A hámsejtek in vitro növekedését fokozó T sejt felülúszók limfokin profiljára jellemző volt a magas γIFN és GM-CSF és közepes mértékű IL-3 tartalom. Mivel a hosszabb in vitro tenyésztés a tenyésztett sejtek tulajdonságait megváltoztatja és mivel tudtuk, hogy a pikkelysömörben mutatkozó hiperproliferáció lényege az, hogy az egyébként sejtnyugalmi állapotban lévő őssejttípusú hámsejtek proliferálódnak, a T sejt hatások vizsgálatára egy olyan modellt kerestünk, melyben a β1 integrin+ K1/K10- hámsejtek sejtciklusba való indukcióját vizsgálhatjuk. Áramlásos citometriás analízis során kiderült, hogy bizonyos tenyésztési körülmények között a tenyészetbe frissen lerakott hámsejtek közül a β1 integrin+ K1/K10- sejt kezd osztódni, ez az a sejttípus, ami hosszabb távon az in vitro kolóniákat megalapozza, a többi sejt viszonylag rövid idő alatt kihal a tenyészetből, anélkül, hogy in vitro
növekedne. Tehát a primér in vitro hámsejttenyészet első pár napjában a keratinocita őssejtek sejtciklus indukciója következik be. A sejtciklus indukció mértékét a tenyészetben megjelenő a β1 integrint erősen kifejező, PCNA pozitív sejtpopuláció nagyságával, illetve e sejtpopuláció sejtciklus analízisével (DNS festést alkalmazva) mérni lehet. Ezt követően teszteltük az egyik hámsejt kolónia növekedést okozó, in vitro aktivált CD4+ T sejt klón felülúszójának hatását normál és pikkelysömörös tünetmentes bőrből származó hámsejteken. A felülúszó szignifikánsan megnövelte a tünetmentes pikkelysömörös keratinocita őssejtek sejtciklusba való indukcióját, ezzel ellentétben a normál bőrből származó sejteken nem láttunk hatást. Neutralizáló hatású monoklonális ellenanyagokat adva a T sejt felülúszóhoz azt is láttuk, hogy a γINF gátlásával meg lehet akadályozni ezt a sejtnövekedést indukáló hatást, ugyanakkor a γIFN egyedül nem volt képes a sejtek sejtciklus indukcióját növelni, ez a hatása csak a másik két limfokin jelenlétében érvényesült. Ezek a vizsgálatok nemcsak azt bizonyították, hogy az aktivált T sejtek szolubilis faktoraikkal valóban képesek a pikkelysömörös hámsejt hiperproliferációt előidézni, hanem azt is, hogy a pikkelysömörös tünetmentes bőrből származó hámsejtek különböznek a normál bőrből származó sejtektől az aktivált CD4+ T sejt felülúszókra való reakció készségükben.
3. Célkitűzések
3.1. Az extracelluláris mátrix szerepének vizsgálata a pikkelysömörös tünetmentes hámsejt T sejt limfokinekre adott hiperproliferatív válaszában
3.1.1. A normál és a pikkelysömörös tünetmentes epidermisz fibronektin kifejeződésének vizsgálata.
3.1.2. Az α5 integrin kifejeződés összehasonlítása pikkelysömörös tünetmentes és normál bőrben.
3.1.3. A pikkelysömörös tünetmentes keratinocita hiperproliferatív válaszát kiváltó limfokin környezet rekombináns limfokinekkel való pontos meghatározása.
3.1.4. A fibronektin és a T sejt limfokinek együttes hatásának vizsgálata a pikkelysömörös őssejt típusú keratinocita sejtciklus indukciójára.
3.1.5. Megvizsgálni, hogy a fibronektin a sejtek fokozottabb sejtciklus indukcióját a sejtek adhéziójának fokozásával fejti-e ki?
3.1.6. Megvizsgálni, hogy van-e az adhéziótól független direkt sejtciklust szabályozó hatása az α5 integrinnek a humán keratinocitákon?
3.1.7. A hámsejtek onkofötális, EDA+ fibronektin termelésének vizsgálata.
3.1.8. A normál és pikkelysömörös tünetmentes keratinociták EDA+ fibronektin termelésének összehasonlítása.
3.2. A sejtproliferáció és differenciálódás vizsgálata HaCaT keratinocitákon
3.2.1. A proliferáció/differenciálódás és az α5 integrin, keratin 1 és 10 kifejeződés kapcsolatának vizsgálata HaCaT keratinocitákon.
3.2.2. Az α5 integrin, keratin 1 és keratin 10 mRNS szintű szérum általi szabályozásának vizsgálata.
3.2.3. Az α5 integrin sejtciklust szabályozó szerepének vizsgálata HaCaT sejteken.
3.3. A T sejtek viszgálata pikkelysömörben
3.3.1. A pikkelysömörös léziós bőrt in vivo infiltráló T sejtek limfokin profiljának vizsgálata.
3.3.2. A CD3+ CD56+ NK T sejtek vizsgálata pikkelysömörös betegek és egészséges egyének perifériás vérében.
3.4. Az IL-1 sejtszintű kifejeződésének vizsgálata pikkelysömörös léziós és normál hámsejtekben, a proliferatív sejtek populációiban, valamint a sejtciklus különböző fázisaiban levő sejteken.
3.5. 3.5.1.-3.5.2. Az etanol és aceton hatásának vizsgálata a hámsejtek növekedésére, valamint a sejtek α5 integrin, ciklin D1 és keratinocita növekedési faktor receptor (KGFR) mRNS szintű kifejeződésére.
3.6. 3.6.1-3.6.3. Az immunszuppresszív hatású rapamycin (sirolimus) hatásának vizsgálata a keratinociták proliferációjára.
4. Anyagok és Módszerek
4.1. Szövetminták
A kísérletekben felhasznált pikkelysömörös és normál bőrminták betegek, illetve egészséges egyének által önként adományozott, általában a farpofa területéről vett vékony félvastag bőrből (keratóma biopsziák) származtak. Néhány esetben punch biopsziás minták vétele is történt. A betegek megfelelő felvilágosítás után beleegyeztek a bőr önkéntes adományozásába kísérletes célból.
Az önkéntes bőrminták vételének körülményei megfelelően szabályozottak voltak és az aktuális Intézetek Etikai Bizottságainak engedélyével történtek. A vizsgálatokban felhasznált normál keratinociták egy része plasztikai sebészeti műtétek során eldobásra kerülő szövetekből származott.
A perifériás vér vizsgálatához az Intézmények Etikai Bizottsága által engedélyezett módon betegek és egészséges egyének önkéntesen adtak vért.
4.2. Szövetfestés
A punch biopsziás mintákat OCT-ben (Tissue Tec II; Miles Laboratories, Inc, Elkhart, IN, USA) fagyasztottuk, majd kriosztat segítségével metszettük. A fagyasztott metszeteket acetonban fixáltuk és a szövetet anti-humán plazma fibronektin ellenes ellenanyaggal (Sigma Chemical Co, St Louis, MO, USA) festettük. Kontrollként nyúl IgG-t alkalmaztunk az ellenanyaggal azonos koncentrációban (Endogen Inc., Boston, MA, USA). A metszeteket szobahőn 1 óráig inkubáltuk nedves kamrában az elsődleges ellenanyaggal, majd PBS mosást követően a második ellenanyaggal, mely FITC-tal jelölt nyúl IgG ellenes antitest volt (Caltag Laboratories, Inc., San Francisco, CA, USA). Ezt követően a szövetet immunfluoreszcens mikroszkóppal vizsgáltuk.
A normál és pikkelysömörös tünetes szövetminta D1 ciklinnel való festéséhez a fagyasztott metszeteket 2 % paraformaldehidben fixáltuk, majd a sejteket egy éjszakán keresztül 4°C-on inkubáltuk a monoklonális anti-humán D1 ciklin ellenanyaggal (Pharmingen, San Diego, CA, USA) 1:100 hígítás, 50 mM Tris-HCL (pH 7,4) 150 mM NaCl és 0,1% triton-x 100, valamint 0,5 % bovin
szérum albumint tartalmazó festőoldatban (Sigma). Az ellenanyag jelöléséhez avidin-biotin-immunperoxidáz rendszert használtunk (Vectastain Elite kit, Vector Laboratories, Burligame, CA, USA), 3-amino-9-etilkarbazol (AEC, Sigma) szolgált kromogén szubsztrátként.
4.3. Immuncitokémia
Tenyésztett fibroblasztokat és keratinocitákat (mindkettő 3. passzázsban), valamint HaCaT sejteket tárgylemezt tartalmazó tenyésztőflaskákba tettünk (4x104 sejt/cm2), majd pár napig a a sejteknek megfelelő médiumokban tenyésztettük őket (37°C, 5% CO2), amíg majdnem konfluensekké váltak. Ezt követően a flaskából kiemeltük a tárgylemezt és a sejteket 20 percig 4°C-on 2% paraformaldehidben (Sigma) fixáltuk. 1 µg/ml koncentrációjú egérben készült, az EDA+ fibronektinre specifikus monoklonális ellenanyaggal (ICN Biochemicals Inc., Aurora, OH, USA) 4°C-on egy éjszakán át nedves kamrában inkubáltuk a sejteket. Izotipikus kontrollként egér IgG1 (Sigma, Budapest, Magyarország) hasonló koncentrációjú oldata szolgált. Az ellenanyag jelöléséhez avidin-biotin-immunperoxidáz rendszert használtunk (Vectastain Elite kit, Vector Laboratories, Burligame, CA, USA), 3- amino-9-etilkarbazol (AEC, Sigma) szolgált kromogén szubsztrátként.
4.4. Epidermális sejtszuszpenzió készítése
A keratóma biopsziákat diszpázban (Collaborative Biomedical Products, Bedford, USA, Roshe Molecular Biochemicals, Mannheim, Németország) egy éjszakán keresztül 4°C-on tartottuk, mely lehetővé tette az epidermiszről a vékony dermisz leválasztását egy csipesszel. Az epidermiszt ezt követően 0,25 %-os tripszinben (USB Biologicals, Cleveland, OH, USA, Sigma, Budapest) inkubáltuk 37 °C-on 30 percig, majd 0,01%DNáz (Sigma) jelenlétében a sejteket disszociáltuk. A tripszin hatását melegítéssel inaktivált fötális borjúszérum (FBS;
Hyclone, Logan, UT, USA) hozzáadásával semlegesítettük. A kísérletekhez használt borjúszérum minden esetben melegítéssel inaktivált volt. A sejteket
sejtek számát a sejtszuszpenzióban tripán kék festéssel hemocitométerben történő számolással határoztuk meg.
4.5. Dermális sejtszuszpenzió készítése
A diszpáz emésztést követően a bőrmintáról leválasztott dermiszt 2-3 órán keresztül 15 ml RPMI 1640 (Gibco) médiumban 40,5 mg kollagenáz, 18,75 mg hialuronidáz 0,01% DNáz, 0,01% szódium-piruvát és 0,01% Hepes puffer (Sigma) jelenlétében 37 °C-on inkubáltuk. Ezt követően a sejteket sejtszűrő membránon átszűrtük, Hank féle 1% FBS-t tartalmazó izotóniás sóoldatba.
4.6. Sejttenyésztés T sejtek analíziséhez
Az epidermisz és a dermisz sejtjeit 12-14 órán keresztül 37°C-on, 106 sejt/ml L-glutaminnal, penicillin/streptomycin/fungizonnal kiegészített RPMI 1640 (Gibco) mediumban 10% humán AB szérum (NORMLCERA-Plus, NABI, Miami, FL, USA) jelenlétében tenyésztettük. A tenyésztés utolsó 4 órájában a sejtekhez 2,5 ng/ml PMA-t és 1mMol ionomycint adtunk, valamint 10 µg/ml Brefeldint, hogy a citokinek Golgin keresztüli transzportját blokkoljuk (Picker és mtsai., 1995).
4.7. Felnőtt humán bőrből származó epidermális sejtek tenyésztése
A felnőtt humán bőrből készített epidermális sejteket keratinocita bazális médiumban (KBM, illetve keratinocita SFM médium epidermális növekedési faktor (EGF) és borjú agyalapi mirigy kivonat (BPE) kiegészítés nélkül) (Gibco Brl, Gaitersburg, MD, USA, Eggstein, Németország) 1 % FBS jelenlétében tenyésztettük különböző ideig. A médiumot L-glutaminnal, penicillin, streptomycin és fungizon oldatokkal (Sigma) egészítettük ki.
A sejtek tenyésztése 6 lyukú tenyésztőedényben történt, 1x106 sejt/ml sejtszuszpenzióból 2 ml került minden lyukba. A sejtek felvétele a tenyészetből pár perces 0,025% tripszin+0,01% EDTA (Sigma) expozició után történt.
Az extracelluláris fibronektin hatás vizsgálatához a tenyésztőedényekre 20 µg/ml végkoncentrációjú borjú fibronektint (Sigma) tettünk, majd 4°C-on tartottuk az edényeket egy éjszakán át. Foszfát puffer (PBS) mosást követően tettük a bevont edényekre a sejteket.
A limfokin hatások vizsgálatához a sejtek tenyésztőedénybe helyezését követően 2 órával adtuk a különböző rekombináns limfokineket a tenyészetekhez, IL-3 (0,3 ng/ml), GM-CSF (1 ng/ml) és γIFN (100 U/ml) (Collaborative Biomedical Products, Bedford, MA,USA).
Az α5 integrin sejttapadástól független sejtciklusra való hatását vizsgálandó a 20 µg/ml fibronektinnel bevont sejttenyésztő edényre lerakott sejtekhez 24 órával a tenyésztés kezdetét követően 25 µg/ml végkoncentrációjú neutralizáló hatású, Na-azid mentes anti-α5 integrin monoklonális ellenanyagot (IIA1 klón, Pharmingen) és ugyanilyen koncentrációban Na-azid mentes egér IgG1-et (Pharmingen) adtunk.
A tenyésztett sejteket különböző idejű tenyésztési periódust követően, általában 3-4 nap, vizsgáltuk áramlásos citometriás analízissel. A korai tenyészetekben a médiumot nem cseréltük a sejteken, így a tenyészetek zárt rendszert képeztek.
A hámsejt kolóniák nagyságát hosszabb idejű, általában 10-14 napos tenyésztés utáni tenyészetekben, 15 perces 1% formalinos fixálást követően alkalmazott 50% Nílus kék és 50% rhodamin B (Sigma) festéssel határoztuk meg.
A rövid idejű kultúrákhoz a sejttenyésztés elindítását követő 2 óra múlva tettük a 20 nM rapamycint (Wyeth-Ayerst, Philadelphia, PA, USA), a rapamycin abszolút etanolban volt feloldva, ezért a kontroll kultúrákba a megfelelő mennyiségű abszolút etanol került. Ezt követően a sejteket rapamycin jelenlétében tenyésztettük 3 napig. A rapamycin citotoxikus hatását tripán kék festéssel hemocitométerben vizsgáltuk a sejtek tenyészetből való felvételét követően.
4.8. HaCaT sejtek tenyésztése
A HaCaT sejtek Fusening Professzor laboratóriumából (Heidelberg,
ép bőréből (Boukamp és mtsai., 1988). A laboratórium szerte a világban ingyen rendelkezésére bocsájtja minden kutatónak a sejtvonalat. A HaCaT sejteket magas cukortartalmú Dulbecco által modifikált Eagle médiumban 10% FBS jelenlétében tenyésztettük (high glucose DMEM; Gibco, Eggstein, Németország).
4.9. HaCaT sejtek szinkronizálása
Miután a sejtek 100%-ban benőtték a tenyésztőedényt, teljesen konfluens állapotban tartottuk őket 5 napig, majd a 10% FBS-t tartalmazó tenyésztőfolyadékot FBS mentes médiumra cseréltük. A szérummentes környezetben egy hétig tenyésztettük a sejteket, ezt követően ismét 10% FBS-t tartalmazó tenyésztő közegbe passzáltuk őket. A HaCaT sejteket a passzáláshoz 0,025 tripszin+0,01% EDTA kezelés segítségével vettük fel a tenyészetekből. A sejtek passzálása 75 cm2-es tenyésztő flaskákba 5x103 sejt/cm2 sejtdenzitással történt a szinkronizálást követően.
A HaCaT sejtek BrdU inkorporációjának méréséhez szemi-konfluens tenyészetből felvett sejteket 1x104 sejt/lyuk mennyiségben 96 lyukú tenyésztőedényekben növesztettünk. Amikor a sejtek félig benőtték a 96 lyukú edényeket, 30 percig különböző koncentrációjú etanol (2,14 mM-1,71 M) és aceton (1,7 mM-1,36 M) DMEM+0.5% FBS kezelésnek tettük ki őket. Az etanol kezelést követően 48, az aceton kezelést követően 24 órával a sejtekhez 10 µM végkoncentrációban BrdU-t adtunk. A sejteket további 4 órán át inkubáltuk, majd az inkorporált BrdU mennyiségét enzimatikus immunoszorbens esszével határoztuk meg a gyártó előírásának megfelelően (Roche, Mannheim, Németország) spektrofotométer segítségével.
A HaCaT sejtek α5 integrinjének gátlásához a sejtek letapadását követően, 6 órával a passzálás után, a sejtkörnyezethez 25 µg/ml végkoncentrációjú neutralizáló hatású, Na-azid mentes anti-α5 monoklonális ellenanyagot (IIA1 klón, Pharmingen) adtunk. Az izotipikus kontroll tenyészetekhez ugyanilyen koncentrációban Na-azid mentes egér IgG1-et (Pharmingen) adtunk.
A HaCaT keratinocita α5 integrin és keratin1/10 kifejeződésének szérum általi szabályozásának vizsgálatához félig konfluens sejteket szérumot tartalmazó médiumba passzáltunk, majd 12 óra múlva a médiumot szérummentes médiummal
cseréltük ki. Ezt követően különböző időpontokban néztük a sejtek mRNS szintű α5 integrin és K1K10 kifejeződését.
4.10. Áramlásos citometriás vizsgálatok
A frissen szeparált vagy tenyészetből felvett epidermális sejteket az α5 integrinnel való jelöléshez 1% formalinban 15 percig jégen fixáltuk, a β1 integrin, K1/K10, PCNA, ciklin D1, IL-1α, IL-1β, IL-1RA, PI és EDA+ fibronektin jelölésekhez pedig –20°C-os 70%-os etanolban egy éjszakán át –20°C-on. Az EDA+ fibronektinnel való sejtjelölés legeffektívebb akkor volt, ha a fent leírt etanol fixálást a sejtek 0,4% paraformaldehid fixálása előzte meg. Az etanol kezelés megnyitja a sejtmebránt, ezért a sejtek intracelluláris anyagait is jelölhetjük ilyen fixálást követően.
A bőrt infiltráló limfociták sejtfelszíni markereit a rövid ideig tenyésztett natív sejteken megfestettük, majd a sejteket 4% paraformaldehiddel fixáltuk, a citokinek intracelluláris jelöléséhez a sejtmebránt 0,1%-os saponint (Sigma) tartalmazó PBS+1% borjú szérum albumin oldattal nyitottuk meg.
A sejtek jelöléséhez a következő monoklonális ellenanyagokat használtuk:
anti-β1 integrin (4B4, Coulter Immunology, Hialeah, FL, USA) 1:20 hígítás , anti- PCNA (PC10, Boehringer Mannheim Biochemicals, Indianapolis, IN, USA) 1:100 hígítás, anti-ciklin D1 (Pharmingen, San Diego, CA, USA) 1:100 hígítás, anti- keratin 1/keratin 10 (ICN Pharmaceuticals Inc., Costa Mesa, CA, USA) 1:50 hígítás, anti-α2 integrin (CD49b, Pharmingen) 1:100 hígítás, anti-α3 integrin (CD49c, Pharmingen) 1:20 hígítás, anti-α5 integrin (CD49e, Pharmingen) 1:50 hígítás, anti-EDA+ fibronektin (ICN Biochemicals Inc., Aurora, OH, USA) 1:100 hígítás, anti-CD3 (Pharmingen), anti-CD3-PE (DAKO, Koppenhága, Dánia), anti- CD56-FITC (NKH1 klón, Serotec, Oxford, Anglia), anti-IFNγ-FITC (Pharmingen) és anti-IL-4-PE (Pharmingen), anti-IL-1α (A8 klón, Upjohn, Kalamazoo, MI, USA), anti-IL-1RA (I4 klón, Upjohn), anti-IL-1β (8516.3 klón, R&D Systems, Minneapolis, MT, USA), az IL-1 ellenes ellenanyagok mindegyikének 33 µg/ml
A fenti monoklonális ellenanyagok egérben készültek, ezért izotipikus kontrollként a megfelelő izotípusú egér IgG-t használtuk, a monoklonális ellenanyag koncentrációkkal azonos koncentrációban (egér IgG1, egér IgG2a, Sigma). Második ellenanyagként FITC vagy PE jelölt anti-egér izospecifikus immunglobulinok szolgáltak (anti-egér IgG1FITC, anti-egér IgG2aPE vagy IgG2aFITC, Boehringer Mannheim Biochemicals). A direkt konjugált citokin jelölésekhez direkt konjugált izotípus kontrollokat alkalmaztunk. A sejteket 30 percig szobahőn, 1 óráig jégen vagy a ciklin D1 esetében 4°C-on egy éjszakán át inkubáltuk a primér ellenanyagokkal, a második ellenanyaggal való inkubálás 30 percig szobahőn vagy jégen történt.
A sejtek összfehérje tartalmát fluoreszcein izotiocianáttal (FITC, Sigma) határoztuk meg. Az etanolban fixált sejtek DNS festése 50 µg/ml propidium iodid és 100 U RNAze A (Sigma) oldattal történt szobahőn 30 percig.
Az immunjelöléseket, valamint a DNS festést követő sejtanalízis Epics Elite (Coulter Corp., Hialeah, FL), Facscalibur és Facscan (Becton Dickinson, Heidelberg, Németország) áramlásos citométerekkel történt. Az adatokat Elite programmal (Coulter Corporation), CellQuest programmal (Becton Dickinson) és Modfit programmal (Verity Software House, Topsham, ME, USA) analizáltuk.
4.11. Perifériás vér sejtjeinek immunfestése
Vért EDTA tartalmú csövekbe vettünk, majd a vvt-ket FACS Lysing (Becton Dickinson, San Jose, CA, USA) oldattal lizáltuk. A sejteket szobahőn, 20 percig inkubáltuk sötétben a direkt konjugált monoklonális ellenanyagokkal, majd a jelölt sejteket 2% paraformaldehiddel fixáltuk az áramlásos citometriás analízis elvégzése előtt.
4.12. RT-PCR
A sejtekből az RNS kivonása TRIzollal (Gibco) a gyári protokoll szerint történt. A cDNA szintézise 0,5 µg teljes RNS-ből 20 µl végtérfogatban történt First Strand cDNA Synthesis Kit (MBI Fermentas, Vilnius, Litvánia) alkalmazásával. A reverz transzkripció utáni PCR amplifikáció az MBI Fermentas
Taq DNS polimeráz és dNTP kit segítségével történt. Az RT oldatok a következő mennyiségben szolgáltak templátként az egyes specifikus PCR reakciókban: az α5 integrinhez 10 µl vagy 2 µl, a K/K10-hez 0,5 µl, a ciklin D1-hez 2 µl, a KGFR-hez 2 µl, a β-aktinhoz 1 µl vagy 2 µl. A β-aktin szolgált belső kontrollként. A MgCl2 koncentrációja minden reakcióban 1,5 mM volt.
A következő primereket használtuk, a primerek koncentrációja 0,66 pmol/ µl volt minden reakcióban:
β-aktin: 5’-AGA GAT GGC CAC GGC TGC TT-3’ és 5’-ATT TGC GGT GGA CGA TGG AG-3’
KGFR: 5’-AGT TTA AGC AGG AGC ATC GCA TT-3’ és 5’-CTG TTA CCA CCA TAC AGG CGA TTA A-3’
Ciklin D1: 5’-AGG AGA ACA AAC AGA TCA-3’ és 5’-TAG GAC AGG AAG TTG TTG-3’
α5 integrin: 5’-ATT ATC AGA GCA AGA GCC GGA TAG-3’ és 5’-GGA GAT GAG GGA CTG TAA ACC GA-3’
keratin 1: 5’-GGA CAT GGT GGA GGA TTA CCG-3’ és 5’-TGC TCT TTC TGG GCT ATA TCC TCG-3’
keratin 10: 5’-GCA AAA TCA AGG AGC GGT ATG A-3’ és 5’-GAG CTG CAC ACA GTA GCG ACC-3’.
Az egyes PCR reakciók körülményei megegyeztek, 94°C 60 sec, 60°C 60 sec, 72°C 60 sec a ciklusszámok a következők voltak:
β-aktin: 25 ciklus, KGFR: 30 ciklus, ciklin D1: 25 vagy 35 ciklus, α5 integrin: 25 vagy 30 ciklus, keratin 1 és keratin 10: 27 ciklus.
A PCR reakció anyagait 2%-os agaróz gélen megfuttattuk, etidium bromiddal festettük, lefényképeztük és az eredményt denzitométerrel analizáltuk a Kodak Edas 290 denzitométer és a Kodak 1D Digital Science program segítségével (Scientific Imaging Systems, New Haven, CT, USA).
4.13. Quantitatív (real-time) RT-PCR (Q-RT-PCR)
Az α5 integrin hatás neutralizáló monoklonális ellenanyaggal történt blokkolása után a sejtekben a ciklin D1 mRNS menyiségét Q-RT-PCR reakcióval határoztuk meg. A reakcióban SYBR-green (Molecular Probes, Eugene, OR, USA) szolgált a DNS jelölésére, a reakcióban használt D1 specifikus primer-pár a következő volt: ciklin D1: 5’ GAG CCC CAA CAA CTT CTT 3’ és 5’ CCT CCT CCT CCT CTT CCT 3’. 18S rRNS: 5’-CGG CTA CCA CAT CCA AGG AA-3’
és 5’-GCT GGA ATT ACC ACC GCG GCT-3’. A 18S rRNS szolgált belső kontrollként. A Q-RT-PCR reakciót iQ Supermix (BioRad, Hercules, CA, USA) használatával iCyclerrel (BioRad) végeztük.
4.14. Immunoblot
A sejtekből 1,5%-os nátrium-dodecil-szulfát (SDS)+ 62,5 mM Tris-HCl, pH: 6,8, 5 mM EDTA + 5% 2 merkaptoetanol + 1 µg/ml antipain+ 1 µg/ml kimosztatin és 1 µg/ml leupeptin lizáló oldattal kivontuk a fehérjét. A lizátumot lecentrifugáltuk, majd –20°C-on tároltuk. A fehérjét denaturáló körülmények között gélelektroforézissel szeparáltuk (SDS/PAGE 9%-os gél), majd nitrocellulóz membránra vittük (Bio-Rad Laboratories, Hercules, CA, USA). A felvitt fehérjemennyiségek azonosságát a gél és a membrán coomassie kék festésével (Sigma) ellenőríztük. A membránt 2 órán keresztül szobahőn 0,05% Tween 20 (Sigma) és 3% zsírtalanított tejport (Fluka Chemie, Neu Buchs, Svájc) tartalmazó Tris oldatban (150 mM NaCL, 25 mM Tris, pH: 7,4) tartottuk, hogy a nem specifikus kötéseket blokkoljuk. Ezt követően a membránt a megfelelő monoklonális ellenanyagokkal egy éjszakán keresztül 4°C-on inkubáltuk.
A következő ellenanyagokat használtuk: egér monoklonális α5 integrin ellenes ellenanyag (Transduction Laboratories, klón 1) 1:250-es hígításban, egér monoklonális keratin1/keratin10 ellenes ellenanyag (ICN, Biomedicals, AE2 klón) 1:500-as hígításban. Alkalikus foszfatázzal konjugált egér ellenes IgG-t használtunk második ellenanyagként (Sigma) 1:2500-as hígításban. A blottok előhívása 5-bromo-4-kloro-3-indolil foszfatáz/nitroblue tetrazólium szubsztráttal történt (BCIP/NBT, Sigma).
5. Eredmények
5.1.1. A normál bőrtől eltérően a tünetmentes pikkelysömörös bőrben fibronektin található a bazális keratinociták környezetében
A normál valamint a pikkelysömörös tünetmentes keratinocita őssejtek limfokinekre adott eltérő sejtproliferációs válaszának a korai in vitro tenyészetben állhat a sejtek genetikusan determinált tulajdonsága, de az is elképzelhető, hogy a sejtek olyan környezeti hatásoknak vannak folyamatosan kitéve in vivo, mely ezt a kóros reakciókészséget eredményezi. Ismert, hogy a szolubilis mitogének mellett (növekedési faktorok, limfokinek) az adhézió-függő sejtek növekedését az extracelluláris mátrix is befolyásolja.
Normál bőrben a bazális sejtek környezetében nem található fibronektin, sebzés során azonban a sejtek környezete fibronektinben gazdaggá válik, ilyenkor a keratinociták aktiválódásának egyik első jele a fibronektin fő receptorának kifejezése (α5β1 integrin). Transzgenikus egerekben a szuprabazális α2, α5 és β1 integrin forszírozott kifejezése az egérbőr pikkelysömörre emlékeztető fenotípusát idézi elő (Carroll és mtsai., 1995).
A pikkelysömörös léziós bőrben régen leírták, hogy a bazális membrán strukturálisan sérült, herniációk észlelhetők a léziós területen (Pinkus és Mehregan, 1966). 1992-ben egy olasz munkacsoport közölte, hogy nem csak a léziós pikkelysömörös bőrben, hanem a tünetmentes bőrben is eltér bizonyos, köztük az α5 integrin molekulák kifejeződési mintázata a normál bőrhöz viszonyítva (Pellegrini és mtsai., 1992). Míg normál bőrben az α5 integrin gyengén fejeződik ki és diffúzan oszlik el a sejtmembránon, addig a pikkelysömörös bőrben erősebb a kifejeződés és az elrendeződés fokális tömörülést mutat.
Ezek alapján feltételeztük, hogy egy lehetséges sejtkörnyezeti faktor, mely a tünetmentes pikkelysömörös keratinociták limfokin válaszát befolyásolja a sejtek környezetében jelenlevő fibronektin lehet, mely a nem teljesen intakt bazális membránon keresztül juthat be az epidermisz bazális rétegébe. Tünetmentes
észleltük, hogy míg a normál bőrben csak a dermisz és a bazális membrán területe festődött, addig a tünetmentes pikkelysömörös bőrben a fluoreszcens jelölés a bazális hámsejtek környékén az epidermiszben is észlelhető volt (4. ábra).
4. ábra
A bal oldalon a pikkelysömörös tünetmentes, a jobb oldalon a normál bőr plazma fibronektin ellenes ellenanyaggal jelölt képe látható. A normál bőrben csak az epidermiszben látszik jelölés, a pikkelysömörös tünetmentes bőrben a jelölés a dermo- epidermális junkció (pöttyökkel jelölve) felé is terjed, jelezve, hogy a plazma fibronektin a bazális keratinociták közvetlen környezetében is megtalálható. A vonal 20 µm-es.
5.1.2. A pikkelysömörös tünetmentes bőr sejtjei a normál bőr sejtjeihez képest jóval erősebben kifejezik az α5 integrint
Mivel az extracelluláris fibronektinről ismert, hogy fő receptorának az α5β1 integrinnek a kifejeződését fokozhatja a sejtekben, áramlásos citometriás analízissel megvizsgáltuk a frissen szeparált pikkelysömörös tünetmentes, tünetes és a normál bőrsejtek α5 integrin expresszióját. Az α5 integrin mellett összehasonlítottuk a hámsejtek által ismerten kifejezett α2 és α3 integrin kifejeződést is a tünetmentes pikkelysömörös és normál bőrben. Ez utóbbi két integrin nagyjából azonos arányú kifejeződését találtuk, viszont az α5 integrin kifejeződése jóval kifejezettebb volt a tünetmentes pikkelysömörös bőrben, mint a normál bőrben. A sejtek 27±7%-a bizonyult pozitívnak a tünetmentes szeparátumban (10 betegen vizsgálva), míg a normál mintákban (5 egyén) 11±4%
volt ez az arány (5. ábra A).
Két tünetes pikkelysömörös minta analízise a tünetmenteshez hasonló eredményt mutatott: 27±1% volt az α5 integrin pozitív sejtek aránya. A pozitív sejtek arányában mutatkozó különbség mellett figyelemre méltó különbség mutatkozott az α5 integrin pozitivitás intenzitásának mértékében is a pikkelysömörös tünetmentes epidermális sejteken. A normál sejtek relatív maximális fluoreszcenciája 0,151±0.08 volt, ehhez képest a tünetmentes pikkelysömörös sejteken ez az érték 0,649±0,1, tehát nem csak jóval több sejt fejezi ki az α5 integrint a pikkelysömörös epidermiszben, mint a normál bőrben, hanem az egyes sejtek általi α5 integrin kifejeződés mértéke is jóval nagyobb (5.
ábra B).
5. ábra
Pikkelysömörös tünetmentes (fekete oszlopok) és normál (fehér oszlopok) bőr α5 integrint kifejező epidermális sejtjeinek %-os arányát mutatja az A rész, a pozitív sejtek relatív maximális fluoreszcenciáját mutatja a B rész. A pikkelysömörös tünetmentes bőrben nemcsak az α5 integrint kifejező sejtek száma, hanem a pozitív sejtek fluoreszcenciája is jóval erősebb. Az oszlopok az átlagokat±SE mutatják, a független minták száma 10 a betegeken, 5 az egészségeseken.
5.1.3. A rekombináns γIFN csak a GM-CSF és IL-3 jelenlétében indukál sejtproliferációt a nem léziós bőrből származó pikkelysömörös keratinocitákban
A korábbi vizsgálatainkban észlelt tünetes pikkelysömörös bőrből származó T sejt klónok által in vitro aktiváció hatására termelt és a pikkelysömörös tünetmentes keratinocita őssejtekre sejtciklust indukáló hatású felülúszót rekombináns limfokinekkel helyettesítve, próbáltuk modellezni azt a limfokin-környezetet, melyben a tünetmentes keratinocita őssejtek fokozott sejtciklus indukciója bekövetkezik. A frissen szeparált tünetmentes bőrből származó epidermális sejteket rövid idejű tenyésztésnek vetettük alá GM-CSF (1 ng/ml), IL-3 (0,3 ng/ml), γINF (100 U/ml) és e három limfokin keverékét tartalmazó sejtkörnyezetben. A limfokin koncentrációkat a felülúszókban észlelt koncentrációk és a gyártó cég által megadott aktivitási görbék alapján határoztuk
meg. A sejteket 72 óráig tenyésztettük, majd áramlásos citometriával mértük a β1 integrint erősen kifejező sejtpopuláció arányát a tenyészetekben. Korábbi vizsgálataink igazolták, hogy ezekben a tenyésztési modellekben a β1 integrint erősen kifejező sejtek populációjának nagysága arányos a korai tenyészetben sejtciklusba kerülő (az S/G2M fázisú sejtek százalékos arányával meghatározható, illetve a tenyészetben PCNA pozitivitást de novo kifejező sejtek mérésével meghatározható), proliferálódó sejtek számával (Bata-Csörgő és mtsai., 1995).
Önmagában egyik limfokin sem befolyásolta a sejtnövekedést, viszont a három limfokin keveréke szignifikánsan megnövelte a sejtek növekedését a kontroll médiumban növő sejtekhez képest, p=0,005, Student’s t-teszt (6. ábra).
6. ábra
Pikkelysömörös tünetmentes bőrből származó epidermális sejteket 3 napig tenyésztettünk a rekombináns limfokinek jelenlétében. Ezt követően áramlásos citometriás analízissel meghatároztuk a tenyésztett sejtek között a β1 integrint erősen kifejező sejtek és az S/G2M fázisban levő sejtek arányát. Az ábrán a β1 integrint erősen kifejező sejtpopuláció
%-os eltérését tüntettük fel a kontroll, limfokint nem tartalmazó tenyészetekhez képest. 5 független minta átlagát±SE mutatják az oszlopok.
5.1.4. A fibronektin potenciálja a T sejt limfokinek sejtproliferációt fokozó hatását a pikkelysömörös keratinocita őssejtre
Figyelembe véve, hogy a pikkelysömörös tünetmentes bőrben bazálisan elhelyezkedő keratinocita őssejt sejtkörnyezetében a normálistól eltérően fibronektin található, a következőkben megvizsgáltuk, milyen hatással van e sejtek korai in vitro növekedésére a fibronektin jelenléte, ez a hatás eltér-e a fibronektin normál hámsejtekre gyakorolt hatásától és a fibronektin befolyásolja-e a limfokinek hatását.
Vizsgálatainkban először arról győződtünk meg, hogy a fibronektin mátrixon való tenyésztése a sejteknek nem befolyásolta az általunk korábban leírt erős β1 integrin kifejeződés és a sejtciklus indukció szoros kapcsolatát. Normál bőrből származó keratinociták 72 órás tenyésztését követően multiparaméteres flow citometriás analízissel vizsgáltuk a sejtek β1 integrin, PCNA kifejeződését és sejtciklusát. A fibronektin jelenléte e három paraméter párhuzamos alakulását nem befolyásolta a sejtekben. A tenyésztőedényen nőtt sejtek és a fibronektinnel bevont felületen növő sejtek kultúráiban a β1 integrin erős kifejeződése azokra a sejtekre volt jellemző, melyek a tenyészetben de novo PCNA pozitívakká váltak (7. ábra), jelezve, hogy a sejtek sejtciklus indukciója bekövetkezett.
Ezt követően tünetmentes pikkelysömörös és normál bőrből származó epidermális sejteket előzőleg fibronektinnel bevont tenyésztőedényekben tenyésztettünk, a tenyésztőkörnyezet az alapmédium, illetve rekombináns GM- CSF+IL-3+γIFN tartalmú médium volt. Kontrollként a bevonatlan műanyag tenyésztőedényben tenyésztett sejtek szolgáltak. A fibronektin jelenléte valamelyest, de nem szignifikánsan elősegítette a sejtek korai növekedését a tünetmentes pikkelysömörös epidermális sejtek esetében, hasonló jelenség nem látszott a normál sejtek tenyészetében (8. ábra). Viszont a T sejt limfokinek sejtnövekedést indukáló hatását a fibronektin legalábbis additíven, de néhány kultúrában szinergista módon (7 független minta) fokozta tünetmentes pikkelysömörös keratinociták esetében. Normál sejteken semmiféle befolyása nem volt a fibronektin + T sejt limfokin környezetnek a sejtek növekedésére (9. ábra).
A 10. ábra egy pikkelysömörös tünetmentes minta reprezentatív eredményét mutatja, a fibronektin és T sejt limfokinek hámsejt proliferációt indukáló hatásáról.
7. ábra
A keratinociták rövid idejű ex vivo tenyészetében a sejtek a fibronektinnel bevont edényen és a tenyésztő műanyagon hasonlóan nőnek. A 72 órás tenyésztést követően a sejteket β1 integrin és PCNA elleni monoklonális ellenanyagokkal jelölve, majd áramlásos citometriás analízissel vizsgálva a kétparaméteres diagramon látható, hogy a proliferálódó, PCNA-t kifejező sejtek azok, melyek a β1 integrint is erősen kifejezik.
8.ábra
A tünetmentes bőrből származó keratinociták esetében a fibronektinnel bevont tenyésztőedényben konzekvensen, de nem szignifikánsan, magasabb volt a β1 integrint erősen kifejező, proliferálódó sejtek aránya a műanyag tenyésztőedényben tenyésztett sejtetekhez képest (jobb oldali ábra, 7 független tenyészet). Hasonló különbséget a normál bőrből származó rövid idejű ex vivo keratinocita tenyészetekben nem észleltünk (bal oldali ábra, 6 független tenyészet).
9. ábra
Normál (6 független minta) és tünetmentes pikkelysömörös (7 független minta) bőrből származó epidermális sejteket 72 óráig tenyésztettünk műanyag tenyésztőedényben és fibronektinnel bevont tenyésztőedényben limfokinek keverékének (IL-3+GM-CSF+γIFN, T ly) jelenlétében, vagy nélkülük (kontroll, c). Ezt követően a sejteket β1 integrin ellenes ellenanyaggal és propidium jodiddal festettük, majd áramlásos citometrás analízissel meghatároztuk a β1 integrint erősen kifejező sejtek és az S/G2M fázisú sejtek arányát a mintákban. Az ábrán a β1 integrint erősen kifejező sejtek %-os eltérése van feltüntetve a limfokineket tartalmazó tenyészetekben a limfokin-mentes kontroll tenyészetekhez képest a műanyag és a fibronektinnel bevont tenyésztőedényekben.
10. ábra
Ezen az áramlásos citometriás vizsgálattal nyert diagramon egy reprezentatív minta eredménye látható. Ebben a mintában egy pikkelysömörben szenvedő beteg tünetmentes bőréből származó hámsejtek 72 órás tenyészetének áramlásos citometriás analízisét látjuk.
A körrel határolt területek a tenyészet proliferálódó sejtpopulációját (β1 integrint erősen és PCNA-t kifejező sejtek) jelölik. Az alapmédiumban, fibronektin bevonat nélküli edényben tenyésztett sejtekben a proliferatív sejtpopuláció az összes sejtek 13%-a, mind a T sejt limfokinek, mind a fibronektin jelenléte esetén a proliferatív sejtpopuláció megnő, 16,4% a T sejt limfokinek hatására és 22% a fibronektin hatására, a fibronektin és a T sejt limfokinek együttes hatása eredményezi a legnagyobb növekedést a proliferatív sejtek relatív arányában, 32,7%.
5.1.5. A fibronektin sejtnövekedést fokozó hatása nem a sejttapadás függvénye
Az általunk alkalmazott alacsony (20 µg/ml) fibronektin koncentráció mellett a tenyésztőedényben a sejtek letapadása valószínűleg nem elsősorban a fibronektinen keresztül zajlott. Azonban nem lehetett kizárni, hogy a fibronektin által okozott tünetmentes pikkelysömörös keratinocitákon észlelt fokozott sejtnövekedés nem annak volt az eredménye, hogy az őssejt típusú keratinociták (K1/K10- sejtek), melyek a tünetmentes bőrben in vivo eleve fokozottabban kifejezik az α5 integrint, gyorsabban tapadtak le a tenyésztés kezdetén, mint a normál sejtek. Ezáltal a sejtek korábban kerültek olyan helyzetbe, mely alkalmassá tette őket a sejtciklus megkezdésére, a citoplazmikus elemek reorganizációját követően.
A kérdés eldöntésére műanyag edényre és fibronektinnel bevont edényre tünetmentes pikkelysömörös és normál epidermális sejteket helyeztünk, majd 24 óra múlva meghatároztuk a K1/K10- sejtek relatív arányát a letapadt sejtpopulációban.
A fibronektinnel bevont edényre letapadt K1/K10- sejtek aránya 62±5%, a bevonatlan edényre letapadt K1/K10- sejtek aránya 59±5% volt a tünetmentes pikkelysömörös sejtek esetében, a normál sejteknél ez az arány 34±11% volt fibronektines edényen és 36±6% a bevonatlan edényen.
Ez az eredmény azt bizonyította, hogy a sejtnövekedésben észlelt változást nem a keratinocita őssejtek letapadásában jelentkező különbség okozta.
5.1.6. A fibronektin a keratinociták növekedését a sejt tapadásától függetlenül is képes befolyásolni
Miután bizonyítottuk, hogy a 20 µg/ml fibronektinnel való bevonása a tenyésztőedénynek nem befolyásolta az őssejt típusú keratinociták letapadását tenyészeteinkben, bizonyítani kívántuk, vajon ez az alacsony koncentrációjú fibronektin valóban képes a sejtadhéziótól függetlenül befolyásolni a keratinociták in vitro növekedését. Ennek érdekében fibronektinnel bevont edénybe helyeztünk frissen szeparált normál keratinocitákat, majd 24 óra múlva, amikor a sejtek letapadása már megtörtént, a tenyészethez neutralizáló hatású α5 integrin monoklonális ellenanyagot adtunk. Kontrollként az ellenanyaggal azonos koncentrációjú egér IgG1-et tartalmazó tenyészet szolgált. (Bár a normál in vivo bőrben a hámsejtek alig fejezik ki az α5 integrint, tenyészetben rövid idő alatt megjelenik a sejteken az α5 integrin kifejeződése). 24 óra múlva mértük a tenyészetekben megjelenő PCNA és β1 integrin erősen pozitív sejtek arányát.
A kontroll tenyészetben 17,3%, ehhez képest a monoklonális α5 integrin ellenanyagot tartalmazó tenyészetben csak 5,5% volta a PCNA+ β1 integrin erősen+
sejt, jelezve, hogy az α5 integrin fibronektin kötés megakadályozása a sejtek proliferációját a letapadástól függetlenül is képes befolyásolni (11. ábra). Ugyanezt a kísérletet Arg-Gly-Asp peptiddel megismételve, hasonló sejtnövekedés gátlást észleltünk a kontroll peptidhez képest.
11. ábra
Az ábra két napig tenyésztett normál epidermális sejtek áramlásos citometriás analízisét mutatja. A sejteket PCNA és β1 integrin ellenes monoklonális ellenanyaggal jelöltük. A tenyészetekhez a tenyésztés utolsó 24 órájában egér IgG1-t (A, B), illetve egér anti- humán, blokkoló hatású, α5 integrin ellenes ellenanyagot (C, D) adtunk. Az izotipikus kontroll jelölésekhez képest a mindkét ellenanyaggal pozitív jelölést mutató (PCNA+β1 integrin erősen+) sejtpopulációk körül vannak rajzolva.
5.1.7. A hámsejtek EDA+ onkofötális fibronektint termelnek
Láttuk, hogy a pikkelysömörös tünetmentes bőrben a normál bőrtől eltérően a bazális keratinociták sejtkörnyezetében plazma eredetű fibronektin található. A fibronektin molekulának több izoformája ismert, melyek ugyanazon gén 3 exonjának (extra domén-A (EDA), extra domén-B (EDB) és a III-CS domén) alternatív hasítása következtében képződnek. A hepatocyták által termelt plazma fibronektin nem tartalmazza sem az A sem a B extra doméneket. A többi sejt által termelt úgynevezett celluláris fibronektin (cFN) azonban különböző variációkban és összetételben tartalmaz EDA és EDB fragmenteket. A cFN inszolubilis és a sejt közvetlen környezetében található pericelluláris mátrix inkorporálja.
Az EDA domén jelenléte jellemző az embrionális szövetekre, de felnőtt szövetekben normális körülmények között nem található, kivéve bizonyos patológiás eseteket, mint például sebzés, rheumatoid arthritis, epitheliális fibrosis és vasculáris intima proliferáció. Ting és munkatársai 2000-ben kimutatták, hogy a pikkelysömörös tünetmentes bőrben a dermo-epidermális junkció (DEJ) mentén EDA motívumot tartalmazó fibronektin van jelen, valamint azt is, hogy ennek termeléséért nem a dermális fibroblaszt felelős (Ting és mtsai., 2000). Bár Rothaupt munkatársaival kimutatta, hogy a dermisz CD11c+ sejtjei és az EDA+ fibronektin kolokalizálódik a pikkelysömörös léziós bőrben, mivel a tünetmentes bőrben csak elvétve található ilyen sejt, nem valószínű, hogy az észlelt EDA+ kifejeződés ezen sejtek működéséhez kapcsolható volna (Rothaupt és mtsai., 2000).
A keratinociták EDA+ fibronektin termeléséről nem volt irodalmi adat, ezért megvizsgáltuk, vajon a hámsejtek képesek-e ilyen típusú fibronektin izoforma termelésére. Immuncitokémiai festéssel egy az EDA+ fibronektinre specifikus monoklonális ellenanyaggal kimutattuk, hogy mind a tenyésztett normál, mind pedig a HaCaT keratinociták kifejezik az EDA+ fibronektint (12.
ábra). Ez alapján feltehetjük, hogy a tünetmentes pikkelysömörös bőrben a DEJ mentén található EDA+ fibronektin a keratinociták által termelődik.
12. ábra
Fibroblasztok (A, B), tenyésztett normál felnőtt humán keratinociták (C, D), és HaCaT keratinociták (E, F) immunfestését látjuk az EDA+ fibronektinre specifikus monoklonális ellenanyaggal (A, C, E), illetve izotipikus kontroll immunglobulinnal (B, D, F). A fibroblasztokban látszik a legerősebb citoplazmikus jelölés (A), a keratinocitákban kevésbé kifejezett az EDA+ fibronektin kifejeződés (C, E), ezekben főleg a mitotikus
A B
C D
E F
5.1.8. Egy kis szubpopulációja a pikkelysömörös tünetmentes keratinocitáknak rövid idejű tenyésztés során EDA+ onkofötális fibronektint fejez ki, hasonló jelenség normál keratinocita rövid tenyésztése során nem észlelhető
Ezt követően összehasonlítottuk a frissen szeparált tünetes, tünetmentes pikkelysömörös és normál bőrből származó epidermális sejtek EDA+ fibronektin tartalmát immunfestést és áramlásos citometriás analízist alkalmazva, de nem találtunk különbséget a mintákban, egyik mintában sem festődtek a sejtek. (A festési metodika működéséről tenyésztett fibroblasztok alkalmazásával győződtünk meg, ebben az esetben a sejtek erősen kifejezték az EDA+ fibronektint.)
Feltételezve, hogy keratinociták valamilyen aktivációs ingert igényelnek az EDA+ fibronektin szintetizálásához, megnéztük, hogyan alakul az EDA+ fibronektin kifejeződése a hámsejtekben egy rövid idejű tenyésztést követően.
Normál bőrből és tünetmentes bőrből származó sejteket 72 óráig tenyésztettünk, majd immunfestést követően áramlásos citometriával meghatároztuk a pozitív sejtek arányát.
Ellentétben a normál bőrből származó sejtekkel, ahol továbbra sem észleltünk egyetlen sejtben sem EDA+ fibronektint, a pikkelysömörös tünetmentes epidermális sejtek analízise során a sejtek egy kis populációjában (3,06%) megjelent az EDA+ fibronektin (13. ábra).
Ez az eredmény alátámasztja azt az elképzelésünket, hogy a pikkelysömörös tünetmentes bőrben a DEJ mentén található EDA+ fibronektin forrása valóban lehet a keratinocita, ezen túlmenően ismét látunk egy olyan tulajdonságot, melyben a pikkelysömörös tünetmentes bőr hámsejtje a normál bőr hámsejtjétől eltér.
A B
C D
13. ábra
Az ábra 72 óráig tenyésztett pikkelysömörös tünetmentes (A, C) és normál (B, D) epidermális sejtek EDA+ fibronektinre specifikus monoklonális ellenanyaggal való jelölését követő áramlásos citometriás analízis eredményét mutatja. A normál mintában az izotipikus kontrollnál (B) erősebb jelet egyetlen sejt sem ad az ellenanyaggal jelölt mintában (D). A pikkelysömörös tünetmentes epidermális sejtek között az ellenanyaggal jelölt mintában (C) a sejtek egy kis populációja (3,06%) az izotipikus kontrollhoz (A) képest kifejezetten erős fluoreszcens intenzitást mutat.
3,06%
5.2.1. A proliferálódó HaCaT keratinocitákban az α5 integrin kifejeződés felerősödik, ezzel párhuzamosan a sejtek keratin1/10 expressziója csökken.
Normál epidermiszben immunfluoreszcens mikroszkópos vizsgálattal azt látjuk, hogy a β1 integrin pozitív sejtek főleg a bazális sejtsorban helyezkednek el, a keratin 1/10 (K1/K10) kifejeződés ezzel ellentétben a szuprabazálisan elhelyezkedő sejtsorokra jellemző, a bazális sejtek K1/K10 negatívak (Bata- Csörgő és mtsai., 1993). Ha a pikkelysömör betegség jellegzetes bőrelváltozását immunfluoreszcens mikroszkóppal vizsgáljuk, azt látjuk, hogy a normál bőr epidermiszétől eltérően nemcsak a bazális sejtsor, hanem afölött még 2-3 sejtsor β1 integrint kifejező sejtekből áll, ugyanakkor a K1/K10 kifejeződés is 2-3 sejtsorral fentebb észlelhető (Bata-Csörgő és mtsai., 1993). A hiperproliferálódó pikkelysömörös epidermiszben a normál bőrtől eltérő α5 integrin kifejeződés szintén észlelhető a szuprabazális sejteken is (Pellegrini és mtsai., 1992).
A következőkben arra voltunk kíváncsiak, milyen módon kapcsolódik a jellegzetesen hiperproliferálódó sejtekre jellemző α5 integrin és a terminális hámsejt differenciáció első lépésének tekinthető K1/K10 kifejeződés a hámsejtekben a sejtek különböző proliferációs/differenciációs állapotában.
Vizsgálatainkat egy immortalizált keratinocita sejtvonalon (HaCaT) végeztük.
A HaCaT sejtek bár immortalizáltak és genetikusan különböznek a normál sejtektől, sok tekintetben jól modellezik a normál hámsejteket (Ryle és mtsai., 1989). A normál keratinocitákhoz hasonlóan ezek a sejtek in vitro organotipikus kultúrában vagy csupasz egérre transzplantálva többrétegű hámot képeznek, bazális membránt szintetizálnak és keratinizálódnak (Breitkreutz és mtsai., 1998;
Schoop és mtsai., 1999). Végtelennek ítélhető proliferatív kapacitásuk mellett igen gyorsan osztódnak in vitro, ugyanakkor megtartották tapadásfüggőségüket.
Vizsgálatainkat egy olyan HaCaT sejtkultúra-modellen végeztük, melyben a sejteket kontakt gátlás és éheztetés által sejtnyugalmi (quiescent) állapotba kényszerítettük, majd a kontakt gátlás és éhezés feloldásával (a sejtek átpasszálása szérumot tartalmazó médiumba) a sejteket proliferációra késztettük. Ilyen körülmények között a sejtek jelentős hányada sejtciklusba kerül, osztódik, majdnem szinkronizáltan a passzálást követő pár napban. A sejtek ciklusát propidium jodid festéssel és sejtciklus analízissel követtük a kultúrában.
Párhuzamosan néztük a sejtek ciklin D1, α5 integrin és K1/K10 mRNS, valamint az α5 integrin és K1/K10 fehérjeszintű kifejeződését.
A korai ex vivo keratinocita tenyészetben a normál bőrben sejtnyugalmi (G0) állapotban levő keratinociták PCNA negatívak. A PCNA a sejtekben a G1 fázis közepén jelenik meg, majd ezt követően kifejeződése gyengül, de az S/G2M fázisban levő sejtekben is kifejeződik. A PCNA szerepet játszik a DNS replikációban, repairben és a sejtciklus szabályozásában (Bravo és Macdonald- Bravo, 1987; Celis és mtsai., 1987; Celis és Celis, 1985; Celis és Madsen, 1986).
A sejtciklust szabályozó ciklinek közül a D típusúak szintén a ciklus G1 fázisához kötött funkcióval rendelkeznek, blokkolásuk a sejtek osztódását ebben a fázisban állítja le (Dowdy és mtsai., 1993; Pines, 1995; Sherr, 1993). A D típusú ciklineknek a többi ciklintől eltérően 3 izoformája ismert (D1, D2 és D3), a különböző D ciklin izoformák kifejeződése különbözik az egyes sejttípusokban.
Saját vizsgálatainkból tudjuk, hogy mind a felnőtt humán bőrből származó, mind a HaCaTa keratinociták mindhárom izoformát kifejezik. A D1 típusú forma megjelenése a G0-G1 tranziton áthaladó keratinocitákra jellemző, míg a folyamatosan osztódó, tehát a G0 quiescent fázist kihagyó, keratinocitákban a másik két izoforma megjelenése dominál (Bata-Csörgő és mtsai., 1996).
A konfluens sejtkultúrában 1 hetes szérummentesség elegendő volt ahhoz, hogy a sejtek sejtciklusa leálljon, ekkor mind a D1 ciklin mRNS, mind a S/G2M fázisú sejtek száma nagyon alacsony a kultúrában (14. ábra B és A). A passzálást és a szérum visszaadását követően a sejtek α5 integrin mRNS kifejeződése emelkedik először, 24 óránál elérve a legmagasabb kifejeződést, ugyanekkor a K1/K10 mRNS kifejeződés dramatikus csökkenése észlelhető a sejtekben (14. ábra B). A D1 ciklin mRNS kifejeződés 24-48 óra között emelkedik a sejtekben, majd a 48 óránál elért csúcsot követően csökkenni kezd (14. ábra B). Az S/G2M fázisú sejtek számának növekedése ezzel részben párhuzamosan emelkedik, de csak 96 óránál kezd csökkenést mutatni (14. ábra A). Az α5 integrin fehérje szintű kifejeződése az mRNS kifejeződés 24 órás csúcsát követően a 96 órás tenyészetben éri el maximumát, majd csökkenni kezd, a K1/K10 fehérje szintű kifejeződése az üzenetben észlelt dramatikus csökkenést lassan követi, a K1 fehérje 96 óránál tűnik el, a K10 jelentősen csökkent mennyiségben, de még a 168 órás mintákban is detektálható (14. ábra C).
Normál hámsejtek esetében nincs arra vonatkozóan adat, hogy a sejtek képesek elveszíteni a már kifejeződött keratin 1/10-et. A HaCaT kultúrákban a tenyésztés során nem tapasztaltunk fokozott sejtelhalást, ami arra utalna, hogy egy kezdetben K1/K10 negatív sejtpopuláció aránytalan felnövekedése eredményezné a kultúrában a K1/K10 kifejeződés elvesztését, csökkenését. Feltételezhető tehát, hogy a HaCaT sejtekben a K1/K10 mRNS szuppressziója, illetve a fehérje degradációja a normál hámsejtektől eltérő, feltehetően a HaCaT sejt immortalizált voltával kapcsolódó tulajdonság.
14. ábra
Az ábra a kontakt gátolt és szérum éheztetett HaCaT sejtek DNS analízisét (A), K1/K10, α5 integrin és D1 ciklin mRNS kifejeződését (B), valamint a K1/K10 és α5 integrin fehérje szintű (C) kifejeződését mutatja a sejtek kontakt gátlásának és szérumelvonásának megszűnte utáni napokban.
5.2.2. A keratin 1 és az α5 integrin kifejeződést HaCaT keratinocitákban szérum faktorok regulálják, a keratin 10 kifejeződést nem
Annak meghatározására, hogy a sejtekben észlelt α5 integrin és K1/K10 mRNS kifejeződést szérum hatások vagy a kontakt gátlás szabályozza-e, frissen passzált, nem konfluens sejtkultúrában növekvő HaCaT sejtektől elvettük a szérumot (a passzálást követően 12 órával), majd a szérum elvételt követő 24, 48 és 72 óra múlva vizsgáltuk az α5 integrin és a K1/K10 mRNS kifejeződést a sejtekben.
A sejtekben alacsony K1/K10 mRNS kifejeződést észleltünk a szérum elvételekor (12 óra), 24 órával a szérum elvételt követően (36 óra) a K1 mRNS nagyon kifejezetten megemelkedett a sejtekben (15. ábra). Ugyanekkor a kezdeti relatív erős α5 integrin kifejeződés szinte teljesen eltűnt a sejtekből 24 órával a szérumelvonást követően, viszont a szérum hiányától függetlenül 72 óra múlva ismét detektálható volt α5 integrin mRNS a sejtekben, jelezve, hogy a szabályozás nem csak a szérumhatásoktól függ (15. ábra). A szérum elvétele nem befolyásolta a K10 mRNS kifejeződést a sejtekben (15. ábra).
15. ábra
A HaCaT sejtekből a szérum elvonásakor (12 h), majd ezt követően 24 óránként izoláltuk az RNS-t. A PCR reakció Az α5-integrin (358 bp), keratin1 (316 bp), keratin10 (685 bp) és a belső kontroll β-aktin (406 bp) amplifikátumait agaróz gélen futtattuk és etidium bromiddal festettük.