ASZTROCITÓMÁK INVAZIVITÁSÁNAK SZEREPE A SZEMÉLYRE SZABOTT ONKOTERÁPIÁBAN
MTA DOKTORI ÉRTEKEZÉS
Dr. Klekner Álmos
DEBRECENI EGYETEM KLINIKAI KÖZPONT IDEGSEBÉSZETI KLINIKA
Debrecen, 2016
TARTALOMJEGYZÉK
RÖVIDÍTÉSEK JEGYZÉKE ...5
1. BEVEZETÉS ...6
1.1. Általános klinikai háttér ...6
1.2. A temozolomid szerepe a glioblasztóma kezelésében ...7
1.3. Az epidermális növekedési faktor receptor (EGFR) szerepe az asztrocitómákban ...9
1.3.1. Az EGFR és az integrinek kölcsönhatásának szerepe az asztrocitómákban ...9
1.3.2. Az EGFR mutáció szerepe glioblasztómákban ... 10
1.4. A gliómák és az extracelluláris mátrix ... 11
1.4.1. Az extracelluláris mátrix szerepe az invázióban ... 12
1.4.2. A gliómák peritumorális inváziójának molekuláris megközelítése ... 13
1.4.3. A tumorsejtek inváziójának folyamata ... 14
1.4.4. A gliómák inváziójában szerepet játszó extracelluláris mátrix komponensek vizsgálatának klinikai jelentősége ... 16
1.5. Az anti-invazív terápia létjogosultsága ... 16
2. CÉLKITŰZÉSEK ... 18
3. BETEGEK ÉS MÓDSZEREK... 20
3.1. A Debreceni Neuro-onkológiai Labor kialakítása ... 20
3.1.1. Szervezeti háttér ... 20
3.1.2. Az Idegsebészeti Agydaganat- és Szövetbank jelentősége ... 21
3.1.3. Az Agydaganatbank gyakorlati működése során kifejlesztett saját technikák ... 22
3.2. A jelenlegi onkoterápia effektivitásának meghatározása glioblasztóma esetében saját beteganyagon ... 23
3.3. Prediktív markerek meghatározása saját beteganyagon: az 1 p19q kodeléció klinikai relevanciája oligodendrogliómákban és oligoasztrocitómákban ... 24
3.4. A temozolomid vizsgálata glioblasztómában ... 26
3.4.1. A temozolomid szérumbeli koncentrációjának meghatározása glioblasztómás betegben ... 26
3.4.2. A temozolomid intratumorális koncentrációjának direkt meghatározása humán glioblasztómában ... 27
3.5. Az EGFR és az integrinek kölcsönhatásának szerepe asztrocitómákban ... 28
3.5.1. Az ErbB1 (EGFR) és az integrin-β1 közti molekuláris interakció vizsgálata asztrocitómákban ... 28
3.5.2. Az EGFR mutáció szerepének vizsgálata rekurrens glioblasztómában ... 30
3.6. Agyi áttéti daganat és gliómák invazivitásának összehasonlítása ... 31
3.7. A jelenlegi onkoterápia hatása az inváziós panel molekuláinak expressziójára ... 38
3.8. A peritumorális agyállomány szerepe a tumorinvázióban ... 40
3.9. Az inváziós spektrum prognosztikai szerepének vizsgálata glioblasztómában ... 42
4. EREDMÉNYEK ... 44
4.1. A jelenlegi onkoterápia effektivitásának meghatározása glioblasztóma esetében saját beteganyagon ... 44
4.2. Prediktív markerek meghatározása saját beteganyagon: az 1 p19q kodeléció klinikai relevanciája oligodendrogliómákban ... 49
4.3. A temozolomid vizsgálata glioblasztómában ... 53
4.3.1. A temozolomid szérumbeli koncentrációjának meghatározása glioblasztómás betegekben ... 53
4.3.2. A temozolomid intratumorális koncentrációjának közvetlen meghatározása humán glioblasztómában ... 55
4.4. Az EGFR és az integrinek kölcsönhatásának szerepe asztrocitómákban ... 56
4.4.1. Az ErbB1 (EGFR) és az integrin-β1 közti molekuláris interakció vizsgálata asztrocitómákban ... 56
4.4.2. Az EGFR mutáció szerepének vizsgálata rekurrens glioblasztómában ... 58
4.5. Agyi áttéti daganat és gliómák invazivitásának összehasonlítása ... 59
4.5.1. mRNS expressziós eredmények ... 59
4.5.2. Immunhisztokémiai eredmények ... 64
4.6. A jelenlegi onkoterápia hatása az inváziós panel molekuláinak expressziójára ... 66
4.6.1. RNS expressziós eredmények ... 66
4.6.2. Proteomikai eredmények ... 66
4.7. A peritumorális agyállomány szerepe a tumorinvázióban ... 69
4.7.1. RNS expressziós eredmények ... 69
4.7.2. Proteomikai eredmények ... 70
4.8. Az inváziós spektrum prognosztikai szerepének vizsgálata glioblasztómában ... 72
4.8.1. A betegek klinikai adatainak eredményei... 72
4.8.2. Az inváziós molekulák RNS expressziós mintázata ... 72
4.8.3. Protein expressziós eredmények ... 74
5. MEGBESZÉLÉS ... 76
5.2. A jelenlegi onkoterápia effektivitásának meghatározása glioblasztóma esetében saját
beteganyagon ... 77
5.3. Prediktív markerek meghatározása saját beteganyagon: az 1 p19q kodeléció klinikai relevanciája oligodendrogliómákban és oligoasztrocitómákban ... 80
5.4. A temozolomid vizsgálata glioblasztómában ... 82
5.4.1. A temozolomid szérumbeli koncentrációjának meghatározása glioblasztómás betegben ... 82
5.4.2. A temozolomid intratumorális koncentrációjának direkt meghatározása humán glioblasztómában ... 83
5.5. Az EGFR és az integrinek kölcsönhatásának szerepe asztrocitómákban ... 84
5.5.1. Az ErbB1 (EGFR) és az integrin-β1 közti molekuláris interakció vizsgálata asztrocitómákban ... 84
5.5.2. Az EGFR mutáció szerepének vizsgálata rekurrens glioblasztómában ... 85
5.6. Agyi áttéti daganat és gliómák invazivitásának összehasonlítása ... 86
5.6.1. Az inváziós panel vizsgálata tüdőrák agyi metasztázisában és glioblasztómában . 86 5.6.2. Az inváziós panel vizsgálata tüdőrák agyi metasztázisában, alacsony grádusú asztrocitómában és schwannomában ... 88
5.7. A jelenlegi onkoterápia hatása az inváziós panel molekuláinak expressziójára ... 90
5.8. A peritumorális agyállomány szerepe a tumorinvázióban ... 91
5.9. Az inváziós spektrum prognosztikai szerepének vizsgálata glioblasztómában ... 93
6. ÖSSZEFOGLALÁS ... 95
6.1. Általános összefoglalás ... 95
6.2. A disszertációban megerősített vagy módosított korábbi tudományos eredmények ... 96
6.3. A disszertációban megállapított új tudományos eredmények ... 97
7. IRODALOMJEGYZÉK ... 99
8. KÖSZÖNETNYILVÁNÍTÁS ... 114
KUTATÁSI TÁMOGATÁSOK ... 114
9. PUBLIKÁCIÓK ... 115
Az értekezés alapjául szolgáló közlemények ... 115
További közlemények ... 117
RÖVIDÍTÉSEK JEGYZÉKE
AIC – 5-amino-imidazol-4-carboxamid BC – bevacizumab
BSC – best supportive care CE – kapilláris elektroforézis
DE KK – Debreceni Egyetem Klinikai Központ ECM – extracelluláris mátrix
EGFR – epidermal growth hormone receptor EOF – elektroozmotikus áramlás
FBRT – focal brain radiotherapy
FISH – fluoreszcens in situ hibridizáció FRET – fluoreszcencia energia transzfer GAG – glükózaminogliokán
GBM – glioblasztóma HA – hialuronsav
HAS – hialuronsav szintetáz KIR – központi idegrendszer
KPS – Karnofsky Performance Score KT - kemoterápia
MEKC – micelláris elektrokinetikai kapilláris kromatográfia MMP – mátrix metalloproteináz
MTIC – 3-metil-triazén-imidazole-4-carboxamid NSCLC – non-small cell lung cancer
OA – oligoasztrocitóma OD – oligodendroglióma OS – overall survival
PFS – progression free survival PG – proteoglikán
pRT – palliatív radioterápia
QRT-PCR – quantitative real time polymerase chain reaction RHAMM – receptor for hyaluronate-mediated motility RT – radiotherapy
TK – tirozin kináz
TKI – tirozin kináz inhibitor TMZ – temozolomide
VEGF – vascular endothel growth hormone WBRT – whole brain radiotherapy
1. BEVEZETÉS
1.1. Általános klinikai háttér
A primer agydaganatok az összes daganatos megbetegedésnek ugyan csak 2 %-át alkotják, de mortalitásuk szempontjából jelentőségük kiemelkedő. Legnagyobb csoportjuk, a gliómák az összes intrakraniális tumor 30-40%-át teszi ki. Leggyakoribb típusa az asztrocitóma, melynek a WHO szerinti legmagasabb, IV-es grádusú és egyben leggyakoribb képviselője a glioblastoma multiforme (GBM) [1–3]. A GBM incidenciája az Egyesült Államokban 3/100.000/év, férfiakban mintegy másfélszer gyakoribb, mint nőkben. Tipikusan az aktív keresőképes középkorúak betegsége, 40 és 65 év között fordul elő a leggyakrabban, a betegek átlagéletkora 54 év. [4, 5]. A felnőttekben a gliómák nagyjából fele (46%) GBM. A hosszú távú túlélés nagyon ritka, és a legújabb terápiás eszközök bevezetésével is csak 9.8%-os 5 éves túlélés érhető el, míg onkoterápia nélkül a várható átlagos túlélés nem több mint 3-6 hónap [6].
Irodalmi adatok szerint a fiatalabb kor előnyösebb prognózist jelent, ill. a férfiak túlélési adatai kedvezőbbek a női betegekénél [7].
A GBM kezelésének első lépése az esetek többségében a műtéti reszekció. A tumor egy része elhelyezkedésétől függő mértékben sebészileg eltávolítható, de az igen kiterjedt peritumorális infiltráció miatt a radikális reszekció szinte soha nem valósítható meg. Az idegsebész lehetőségeit a daganat elhelyezkedése, kiterjedtsége jelentősen befolyásolja, és a többlebenyi valmint kétoldali érintettség a megfigyelések szerint igen rossz prognózissal jár. A jelenlegi irodalmi adatok szerint a rossz preoperatív Karnofsky Performance Score (KPS), a domináns féltekei érintettség és a nagy tumorméret is csökkenti a túlélési esélyeket [8].
Korábban a glioblasztómás betegek kezelésére általánosan elfogadott és alkalmazott posztoperatív terápiaként évtizedeken keresztül egyedül az egész agy besugárzás (whole brain radiotherapy, WBRT) szolgált, ami az átlagos túlélést a kezelés nélkül várható 3-6 hónapról 9- 12 hónapra emelte [9–13]. A WBRT-t a későbbiekben felváltotta a focal brain radiotherapy (FBRT) amit kemoterápiával (KT) - temozolomid (TMZ) - egészítettek ki, ami a túlélési paraméterek jelentős javulását hozta. A 2005-ben készült Stupp-tanulmányt követően a 70 év alatti, jó KPS ponttal rendelkező betegek számára a standard terápia részévé vált a sugárterápiával (RT) egy időben adott adjuváns kemoterápia (75mg/m2/nap), amelyet további kemoterápiás kezelés követ (havi ciklusban 150-200 mg/m2/nap dózisban általában 6-12
hónapon át, havonta 5 napig).[14] A jelenleg is standard protokollnak számító konkuráló kemo- irradiációs kezelés növelte mind a progressziómentes túlélést (PFS) (4,5 hónapról 6,9 hónapra), mind a teljes túlélést (OS) (8,6 hónapról 14,6 hónapra) [6, 14–19].
A konkuráló kemo-irradiáció ellenére kialakuló tumorprogresszió esetén a kezelés folytatható bevacizumab monoterápiával, mely a biológiai válaszmódosító kezelés eszköze. A bevacizumab monoklonális humanizált antitest, amelyet a vascular endothel growth factor-A (VEGF-A) ellen termeltek. A GBM jelentősen vaszkularizált tumortípus, és fokozottan igényel VEGF-et és egyéb proangiogenetikus faktorokat az érújdonképződéshez [16]. Világszerte számos tanulmány vizsgálta a bevacizumab antitumor hatását, melyekből az a következtetés vonható le, hogy bár a bevacizumab nem befolyásolja szignifikánsan az OS-t, ugyanakkor a PFS időtartamát meghosszabbítja [16, 17, 20–23]. A gyakorlatilag mindig bekövetkező tumorprogresszió után a másodvonalbeli terápia indikációjának klinikai állapothoz kötött feltételei azonban az esetek nagy részében nem engednek meg további kemoterápiát. Továbbá, a bevacizumab monoterápia alatt bekövetkező progresszió esetén a további kezelések megválasztása általánosan elfogadott protokol híján erősen intézetfüggőnek és experimentális jellegűnek mondható. Nem véletlen, hogy napjainkban egyre több kutatás irányul mind a jelenlegi onkoterápia ineffektivitása okának felderítésére, mind pedig további kemotera- peutikumok bevezetésére. A hazai betegállomány terápiafüggő túlélési paramétereiről kevés adat áll rendelkezésre, ezért ahhoz, hogy klinikai konzekvenciákat eredményező kutatást végezhessünk, a saját betegadataink feldolgozása adja meg a kiindulási és viszonyítási alapot.
1.2. A temozolomid szerepe a glioblasztóma kezelésében
A glioblasztómás betegek jelenlegi standard terápiájának gerincét képező kemoterapeutikum, a TMZ alkalmazása mellett előbb-utóbb mindig bekövetkező tumor- progresszió okainak megértése fontos lépés a kezelés effektivitásának javítására irányuló törekvésekhez.
A TMZ egy olyan orális alkiláló ágens, melyet a vér-agy gáton történő permeabilitási tulajdonságai alkalmassá tesznek a high grade gliómák kezelésére. A TMZ fiziológiás pH értéken spontán hidrolizál (3-metil-triazén-imidazole-4-carboxamiddá, MTIC). A MTIC tovább hidrolizál 5-amino-imidazol-4-carboxamiddá (AIC), amely a tulajdonképpeni aktív alkiláló ágenssé, metilhidrazinná alakul. Ez az erősen reaktív kation a DNS-ben az O6
pozícióban lévő guaninokat metilálja és így bázispár mismatch-et okoz. A sikertelen mismatch javítások vezetnek a DNS leány szálának töréséhez, ami a sejt apoptózisát okozza [24].
A TMZ dozírozásánál a szövődmények előfordulási valószínűsége (mieloszupresszív hatás) az elsődleges korlátozó szempont. Az intratumorális lokális koncentráció emelése anélkül fokozná az antiproliferatív hatást, hogy a mellékhatások előfordulási gyakorisága növekedne. A glioblasztómás betegek kezelése során alkalmazott Stupp-protokollban az irradiáció fizikai hatásának tulajdonított átmeneti vér-agy-gát permeabilitás fokozódástól a magasabb intratumorális gyógyszerkoncentráció elérése várható. A kérdés az, hogy a TMZ orális bevitele és az irradiáció kivitelezése időben hogyan viszonyuljon egymáshoz a maximális hatékonyság elérése érdekében? Ehhez első lépésben egy megbízható gyógyszeranalítikai metódus kidolgozására van szükség, mely az igen alacsony koncentrációjú TMZ-t olyan, erősen komplex biológiai mintából, mint a humán szérum nagy biztonsággal detektálni képes.
A TMZ koncentráció meghatározása több nehézségbe ütközik, szérumbeli koncentrációja igen gyorsan változik, melynek időbeni lefolyását több paraméter is erősen befolyásolja. A TMZ lebontása elsősorban a pH-függő MTIC-é történő hidrolízisen keresztül megy végbe és a hepatikus metabolizmus csak kisebb szerepet tölt be. A TMZ savas pH-n stabil, viszont gyorsan lebomlik neutrális vagy bázikus környezetben [25]. Mivel a TMZ az antitumorális hatását a MTIC, mint degradációs termékén keresztül fejti ki, a MTIC plazma koncentrációjának monitorozása a TMZ adagolása során fontos lenne, annak érdekében, hogy effektivitását és farmakokinetikáját kiértékeljük [24].
Állandóan felmerülő kérdés a szakirodalomban, hogy a különböző gyógyszerek milyen lokális koncentrációt érhetnek el az agyállományban, ill. az agydaganatban, jelen esetben a glioblasztómában? Mivel a kezelés effektivitása leginkább a tumorban megjelenő gyógyszerszinttől, a mellékhatások mértéke pedig a szisztémásan keringő hatóanyag- koncentrációtól, és végső soron e kettő érték egymáshoz viszonyított arányától függ, ezekre az adatokra égető szükség lenne. A kemoterápiás készítmények összehasonlításához, a legmegfelelőbb kiválasztásához az elérhető maximális intratumorális gyógyszerkoncentráció ismerete jelentős segítséget nyújtana, de erre vonatkozó irodalmi adatok eddig még nem születtek.
A klinikumban egyre nagyobb jelentőségre szert tevő kapilláris elektroforézis (CE) potenciálisan mindkét célra megfelel, így tanulmányainkat ezirányban is kiterjesztettük.
1.3. Az epidermális növekedési faktor receptor (EGFR) szerepe az asztrocitómákban
1.3.1. Az EGFR és az integrinek kölcsönhatásának szerepe az asztrocitómákban
A GBM gyakorlatilag mindig bekövetkező kiújulásáért nem csak a TMZ-vel szemben kialakuló rezisztencia, hanem a sugárterápia hatékonyságának mérsékelt jellege is felelőssé tehető. Korábban már a GBM radiorezisztenciájának hátterében számos mechanizmus felderítésre került, azonban a pontos molekuláris interakciók egy része még mindig ismeretlen.
Ráadásul, a DNS károsodásra adott elégtelen válasz, a sejtfelszíni molekulák, köztük a növekedési faktor receptorok kóros együttműködése miatt kialakult szabályozatlan jelátvitel szintén fontos szerephez jut. Ebből kifolyólag a transzmembrán receptor tirozin kinázok ErbB családjának tagjait már részletesen tanulmányozták [26]. Az ErbB1 (EGFR-ként vagy HER1- ként is ismert) gyakori funkciószerző mutációja a malignus gliomákban már régóta ismert. Az ErbB receptor tirozin kinázok az ionizáló sugárzásokra adott válaszreakciókban és rezisztencia kialakításában vesznek részt [27], és az emelkedett ErbB1-szint csökkent radioszenzitivitással jár a magas grádusú asztrocitóma sejtekben [28]. Azt is kimutatták, hogy a tumorsejtek több, az ErbB családba tartozó olyan molekulát termelnek, amelyek homo- és heteroasszoci- álódhatnak a jelátviteli folyamatok során [29]. Az egyszeri és ismételt radiáció által kiváltott ErbB1 aktivációra fellépő citoprotektív és citotoxikus válaszok közötti egyensúly nagyban függ a különböző sejtfelszíni receptorok relatív expressziójától és aktivitásától [30].
Előzőek mellett, a tumoros sejtek túlélése és proliferációja nagyban függ a sejt és annak környezete közötti kölcsönhatástól, ezek között is elsősorban az extracelluláris mátrix-szal (ECM) való kapcsolattól [31, 32]. Újabb tanulmányok szerint ezek a funkcionális kapcsolatok bizonyos sejt adhéziós molekulák és a receptor tirozin kinázok (TK) között hozzájárulhatnak a kemo- és radiorezisztencia kialakításához [33, 34]. Az egymással asszociálódott receptor TK- k és sejtadhéziós molekulák koaktivációja redundáns szignálokat küld a citoplazmába és ezzel befolyásolja a sejtek válaszát a célzott terápiákra [35–38]. Az integrinek (pl. α5β1 heterodimer) fokális adhéziós komplexekben különböző fehérjékkel alkotnak multimer clustereket és olyan szignálokat küldenek, amelyek megakadályozzák az apoptosist [39, 40].Az ErbB1 integrin-β1- el történő kölcsönhatása révén a tumorsejtek leválását, migrációját és metasztatikus képességét is elősegíti azáltal, hogy az integrin-β1 citoplazmatikus részéről leválasztja a tenzin-3-at, így a citoszkeletális aktin rendszer destrukturálódását okozza [41, 42].
Továbbá, a legfrisebb tanulmányok azt bizonyítják, hogy az integrin-β1 inhibitorok,
képpen az ErbB1 és integrin-β1 kölcsönhatása fontos szerepet játszhat a fokozott radiorezisztencia kialakulásában, új terápiás targetként szolgálhat. Így ezen interakciók mind inkább a figyelem középpontjába kerülnek az in vitro és a xenograft modellekben megszerzett eredményekre támaszkodva. Fontos azonban az is, hogy az ErbB és integrin molekulák interakciója és expressziós szintje különbözik egyedi in situ glioblasztómák esetében, tehát így megjósolhatják a terápia hatékonyságát, a betegség kimenetelét is.
1.3.2. Az EGFR mutáció szerepe glioblasztómákban
A leggyakoribb genetikai eltérés a GBM-ban az EGFR gén amplifikációja, amely az EGFR, egy transzmembrán TK receptor fokozott expresszióját okozza [43]. Az EGFR gyakran mutált illetve gyakorta felülexpresszált más humán malignitások esetében is, ami általában agresszív viselkedéssel társul [44].
Korábban az EGFR kináz extracelluláris doménjének delécióját tekintették a leggyakoribb EGFR mutációnak a különböző tumor típusokban, egészen a nem kissejtes tüdőrákban (non-small cell lung cancer, NSCLC) az EGFR kinázt érintő szomatikus mutáció felfedezéséig [45, 46]. A legismertebb mutáció az EGFR III-as variánsának deléciója (EGFRvIII, delta 801EGFR, del2-7 EGFR), amely az extracelluláris domén 2-7 exonjainak (801bp) in frame delécióját jelenti - ezt a GBM genomjának szintjén is azonosították. A 2-7 exonok in frame deléciója aktiváló hatást fejt ki a receptorra a sejtek számára proliferatív előnyt biztosítva [47, 48].
A gefitinib és az erlotinib olyan szelektív EGFR tirozin-kináz inhibitorok (TKI), melyek az eddigi klinikai tanulmányok szerint a tüdőrákos betegek egy kis csoportjában megfelelő terápiás választ eredményeznek. A betegek reakciója a célzott EGFR antitumorális kezelésre összefüggésben lehet egy szomatikus-aktiváló mutációval, amely az EGFR gént érinti. A leggyakoribb EGFR mutációk a négy konzervatív aminosav reziduumot tartalmazó rész deléciója a 19-es exonban illetve a 21-es exonban lévő L858R pontmutációja [49, 50].
A legjobb bizonyítéknak az EGFR szerepére glioblasztómákban, azok a klinikai eredmények számítanak, melyek szerint a rekurrens glioblasztómával küzdő betegek 15-20 %- ában a kis molekulasúlyú EGFR TKI-k szignifikáns tumor regressziót értek el. Részletesebb vizsgálatok azonban sajnos azt igazolják, hogy az EGFR kináz doménban lévő mutációk nem jósolják meg a glioblasztómák érzékenységét az EGFR kináz inhibítor terápiára [51, 52].
Mivel a standar terápia részét képező TMZ mellett új készítmény alkalmazása csak progrediáló tumorokban engedélyezett, ezért a TKI-ok hatékonyságát prognosztizáló EGFR
mutáció analízis elsősorban a kiújult tumorok esetében bír klinikai jelentőséggel. Ebben a betegpopulációban azonban még kevés ezirányú vizsgálat született, mert a recidív GBM-ra az esetek többségében újabb műtéti kezelés nem javasolható, így az analizálható tumorszövet gyűjtése is nehézségekbe ütközik.
1.4. A gliómák és az extracelluláris mátrix
Mivel a sejtosztódást gátló antiproliferatív hatásmechanizmusú kemoterapeutikumok effektivitása kitartó próbálkozások ellenére sem érte el a kívánt szintet, határozott igény jelentkezett egyéb támadáspontú készítmények kifejlesztésére. Tekintve, hogy mind a sugárterápia, mind pedig a műtéti kezelés hatékonyságának leginkább az agydaganatok invazivitása szab korlátokat, az intracerebrális tumorok környezeti infiltrációs képességének megismerése és befolyásolása az utóbbi időkben egyre gyakrabban vált a neuro-onkológiai kutatások célpontjává. A tumoros invázió folyamatának megértéséhez a tumorsejtek és környezetük kapcsolatának közelebbi feltárása vált szükségessé.
A központi idegrendszer (KIR) sejtjeit a szervezet többi sejtjeihez hasonlóan a fehérjében és rostban gazdag ECM veszi körül. Összetételét illetően a mátrix rendkívül heterogén, döntően kollagéneket, elasztint, laminineket, fibronektint, proteoglikánokat (PG), glükozaminoglikánokat (GAG) illetve enzimeket tartalmaz. Felépítésére jellemző, hogy a különböző molekulák, enzimek és szolubilis faktorok kötőszöveti rostok hálózatába ágyazódnak [53–55]. Az ECM szövet-specifikus és dinamikus, aktív környezetet biztosít a sejteknek. Ez a szoros sejt-ECM kapcsolat különböző jelátviteli útvonalon keresztül meghatározó szereppel bír számos fiziológiás és pathológiai folyamatban, mint például a sejtmozgás, differenciálódás, génexpresszió, hisztogenezis valamint a rosszindulatú daganatok terjedése [56–58].
A tumorsejtek inváziója során szoros kapcsolat alakul ki a sejtek és az ECM között. Ez a sejt-ECM konnexió a sejt-sejt interakcióval és a szolubilis faktorok rendszerével együtt egy komplex kommunikációs hálózatot hoz létre [59]. Az intrakraniális daganatokat igen jól lehet jellemezni eltérő invazív potenciáljaikkal, ami nagyban ECM függő [60–62]. A kifejezetten invazív malignus gliómák nagyban különböznek a csaknem gömb alakú agyi áttétektől és sokszor nehéz intraoperatíve megkülönböztetni őket a peritumorális agyszövettől, melyet a
lehetetlenné teszi [63, 64]. Másfelől pedig egy átlagos szoliter agyi áttét sebészi eltávolítása rutin idegsebészeti feladatnak számít. Úgy tűnik, az ECM-nek kiemelkedő szerepe van ebben az igen eltérő intenzitású invazív viselkedésben [65].
1.4.1. Az extracelluláris mátrix szerepe az invázióban
Ahhoz, hogy a gliómák invazív természetét megérthessük, át kell tekintenünk a peritumorális infiltráció celluláris és molekuláris történéseit. A tumoros invázió legfontosabb szereplője az ECM, mely a normál agyi térfogat meglehetősen nagy részét jelenti, hiszen az egészséges agyszövet térfogatának nagyjából 20%-a az extracelluláris tér. Az extracelluláris térfogat aránya azonban a primer agytumorok jelentős részében szignifikánsan megemelkedik, a teljes tumorszövet térfogatának mintegy 48%-át képviseli. Az agyszöveti ECM szerkezete és komponensei sokban eltérnek az egyéb szervekben megtalálható ECM felépítésétől. Az agyi ECM főként makromolekulákat tartalmaz, (GAG-okat és PG-ket) és csak kisebb részben vannak jelen a fibrilláris glikoproteinek (pl. kollagének, fibronektin, elasztin vagy retikulin).
Az ECM-ban található glikoproteinek összetevői kulcsfontosságúak a peritumorális infiltrációan, hiszen a celluláris kitapadás és a migráció szerkezeti elemeit adják. Az invázió molekuláris mechanizmusainak feltárása végett kiterjedt kutatások irányultak a hialuronsav (hialuronán, HA), a PG-ok és különböző típusú GAG-ok jelenlétének és funkciójának vizsgálatára és több esetben állapítottak meg pozitív összefüggést egyes ECM alkotók és a malignus gliómák invazivitása között. A sejtek adhéziójához és migrációjához a sejtek felszínén lévő specifikus receptoroknak az ECM komponenseivel kell kapcsolatba lépniük. A sejtfelszíni receptorok közül kiemelendőek az integrinek, a CD44 és a CD168. Bizonyos proteázok valamint szintetázok szintén erősen befolyásolják az invazivitást, ugyanis az ECM alkotóinak mikrolokuláris koncentrációját módosítani és/vagy a pericelluláris hálózatot emészteni képesek [61, 63, 66–75].
A gliómasejtek aktív mozgásukhoz az ECM makromolekuláinak segítségével beszűrik környezetüket és azt a tumoros szövethez hasonlóvá alakítják. A peritumorális invázió folyamata a tumoros sejtek és a nem-neoplasztikus sejtek, illetve az ECM konfrontációs zónájától függ. Míg a gliómasejtek főként adhéziós receptorokat és proteázokat expresszálnak, addig a szöveti sejtek olyan makromolekulák szintézisét segítik elő, amelyek az eredeti szerkezet fenntartásáért felelősek, illetve gátolják az inváziós sejtmozgást. Mivel az agyparenchymában az ECM-ben nincs fibrilláris jellegű, erős kötőszövetes szerkezetű,
kollagénben gazdag hálózat, az agyállomány lágy szöveti tulajdonságokkal bír, és ezért nem képes a tumorsejtek migrációjával szemben valódi ellenállást kifejteni. Ráadásul a gliasejtes tumorok esetében további két tényező segíti még elő a peritumorális beszűrődést. Az egyik ilyen tényező az, hogy az agy parenchymájának normál szerkezete nagyrészt a fehérállomány pályáiból és a bazális membránból áll, melyek alkalmasak arra, hogy a sejtek migrációját vezetni tudják. A másik infiltrációt segítő tényező a gliális sejtek specifikusan fokozott migrációra való képessége. Mindkét tényező az agyszövetre jellemző és a fejlődéstani, szerkezet és a funkció közötti kapcsolat ismeretével könnyen megérthető [76, 77].
Neuro-onkológiai szempontból a gliómasejtek fokozott motilitása, valamint a kifejezett peritumorális infiltráció az alábbi problémákhoz vezet:
A. Mivel a gliómasejtek inváziója az alacsony grádusú tumorokban is megfigyelhető, még ezekben, az egyébként benignus jellegű tumorok esetében sem tekinthető a teljes eltávolítás egyszerűen kivitelezhető és kézenfekvő megoldásnak. Ez az oka annak, hogy az alacsony grádusú (II-es grádusú) tumorokat „semi-benignus” tumoroknak tartjuk. A tumor makroszkóposan teljesnek tűnő sebészi eltávolítása ellenére a recidívák aránya nagyon magas, a betegek teljes gyógyulása messze nem törvényszerű.
B. Magas grádusú tumorok esetében sem nyitott műtéttel, sem pedig konformális radioterápiával, vagy sztereotaktikus pontbesugárzással („gammakés”) sem lehet teljes tumoreltávolítást elérni. Érthető tehát, hogy miért találkozunk majdnem minden esetben a tumor lokális kiújulásával.
C. A lokális kemoterápiás kezelésnek (intraparenchymális vagy műtét után alkalmazott intracavitális gyógyszerek) hatásfoka alacsony, hiszen a reszekciós üreg szélétől akár több cm-es távolságban is megtalálható infiltráló tumorsejtekre a helyi kezelés már érdemben hatást nem gyakorol.
1.4.2. A gliómák peritumorális inváziójának molekuláris megközelítése
Mivel laborvizsgálataink tárgyát az ECM tumorinvázióval összefüggésbe hozható molekulái képezik, részletes megismerésük kutatásunk alapját jelenti. A tumoros infiltráció sejtszintű eseményei igen összetett molekuláris folyamatok eredményeképpen valósulnak meg.
A tumorsejtek migrációjában szerepet játszó molekulákat három fő csoportra lehet osztani:
1. Sejtmembrán-asszociált molekulák (receptorok és adhéziós molekulák).
Főbb képviselőik: - integrinek - CD44
- RHAMM (receptor for hyaluronate-mediated motility) - szindekánok
- kadherinek
2. ECM komponensek (a receptorok célmolekulái).
Főbb képviselőik: - glükózaminoglikánok (GAG-ok) - proteoglikánok (PG-k)
- hialuronsav (HA) - fibronektin - lamininek, - agrin - tenaszcin
- lektikánok (brevikán, neurokán, verzikán, stb.) 3. Az ECM komponenseit szintetizáló vagy lizáló enzimek.
Főbb képviselőik: - mátrix-metalloproteinázok (MMP-k) - katepszinek
- hialuronsav szintetázok (HAS)
1.4.3. A tumorsejtek inváziójának folyamata
A primer agydaganatok inváziós hajlama régóta ismert tény, így a peritumorális beszűrődés molekuláris mechanizmusai már sok éve a neuro-onkológiai kutatások tárgyát képezik és néhány inváziós folyamatot már részletesen ismerünk. Általában a tumoros inváziót egy négylépéses modellel lehet leírni, mely az agytumorok esetében is alkalmazható. Ez a modell az alábbi lépésekből áll:
1) az invazivitás helyén a tumorsejtek leválnak az egyre növekvő primer tumoros sejthalmazról,
2) a levált sejtek specifikus receptoraik révén kapcsolódnak az ECM meghatározott komponenseihez,
3) a gliómasejtek által szekretált proteázok lokálisan bontják az ECM-et, a környező szövetben migrációs útvonalat alakítanak ki,
4) a tumorsejtek citoszkeletális folyamatok segítségével aktív mozgásba kezdenek.
A peritumorális invázió minden egyes fenti lépése számos molekula összehangolt működését kívánja meg, melynek eredményeképpen a tumorsejt az alább részletezett aktív sejtszintű mozgás révén a normális agyparenchymába vándorol [78, 79].
1) A szöveti invázióban szereplő tumorsejtek primer tumorsejthalmazról történő leválása meglehetősen bonyolult folyamat és további lépésekre osztható:
a) a primer tumor-sejthalmazt összetartó kadherin mediált sejtkapcsolatok destabilizálódása és szerkezeti felbomlása,
b) a primer tumormasszához kapcsolódást biztosító további sejtadhéziós molekulák csökkent kifejeződése, mely a gap junction típusú sejt-sejt közötti kapcsolatok erős redukciójához vezet,
c) végül a sejtet az ECM-hez kihorgonyzó CD44 enzimatikus bontása történik meg egy ADAM nevű metalloproteináz által [78–82].
2) A tumoros sejtek ECM-hez történő kapcsolódása specifikus sejtfelszíni és transzmembrán receptorok révén történik meg, melynek egyik jellemző formája az integrinek kapcsolódása a lamininekhez, fibronektinhez és kollagénhez vagy a CD44 kötődése a HA-hoz.
3) Az ECM komponensek degradációja a proteázok, pl. MMP, hialuronidáz, katepszin és kondroitin-szulfatáz megemelkedett szintje és fokozott aktivitása révén jön létre.
4) A migráció során a glióma sejtek a környező ECM-mel állandó kapcsolatban állnak, ahol az ECM a sejtek számára egyrészt mechanikai barriert jelent, de a mozgó sejtek számára húzó kötődési struktúrát is képvisel. A sejtek morfológiája megváltozik a sejtmozgás alatt: a sejt polarizálttá válik, membrán kitüremkedések jelennek meg, a mozgás irányában állábak (pseudopodium-ok), továbbá lamellipodium-ok, filopodium-ok és invadopodium-ok alakulnak ki. A membrán-kitüremkedésekért felelős aktin filamentumok mellett egyéb szerkezeti és jelátviteli molekulák is aktiválódnak és citoszkeletális kontrakciók révén a membrán kihorgonyzódik, összességében a sejt előrehalad. Az ECM alkotók citoszkeletonhoz történő csatlakozását disztroglikánok biztosítják. A glialis sejtek mozgásában és összehúzódásában a miozin-II két izoformája (A és B) vesz részt. A miozin-II révén a glióma sejtek a magjuknál szűkebb pórusokon is képesek átjutni, ami azért fontos, mert az agyállományra kifejezetten szűk extracelluláris terek jellemzők [83, 84].
1.4.4. A gliómák inváziójában szerepet játszó extracelluláris mátrix komponensek vizsgálatának klinikai jelentősége
Közismert idegsebészeti tapasztalat és dilemma, hogy míg a gliómák radikális sebészi megoldása az infiltratív növekedés miatt az esetek döntő többségében kivitelezhetetlen, addig a szoliter áttéti daganatok teljes eltávolítása általában rutin idegsebészeti beavatkozásnak minősül. Ez a megfigyelés a leggyakoribb, primer tüdőkarcinóma eredetű metasztázisok esetében is rendszeresen tapasztalható. A tüdőrák hematogén áttétképzésének leggyakoribb helye a KIR [85]. A betegség lefolyása során az esetek 40-65%-ában létrejön az agyi metasztázis [86], sőt, az esetek 9%-ában ez az egyetlen távoli szervi áttét. Valamennyi egyéb szervi daganat együttesen az esetek 8-10%-ában jár agyi áttéttel [87]. Az intracerebrális áttéti tumor radikális reszekábilitása nem utolsósorban annak a ténynek köszönhető, hogy az agyi áttétek növekedése nem, vagy csak minimális invazivitást mutat. A glióblasztóma és a tüdőrák áttét között tapasztalható jelentősen különböző reszekabilitást eredményező intracerebrális invázió oka döntően a két tumortípus extracellularis mátrixának eltérő szerkezetében, az ott található makromolekulák mikrolokuláris expressziójában és tulajdonságaiban keresendő. Ha megismerjük az egyébként hasonlóan anaplasztikus, de jelentősen eltérő intracerebrális inváziót mutató daganatok peritumorális infiltrációjában látható különbségek okait, akkor a gliómák invazivitásának gátlására szolgáló eszközökhöz juthatunk. Ennek segítségével a műtéti reszekábilitás és a sugárterápia effektivitása is jelentősen növelhető lenne.
1.5. Az anti-invazív terápia létjogosultsága
Jelenleg a primer agytumorok kuratív onkoterápiája még nem ismert. Az intenzív sejtosztódás, a szignifikáns peritumorális beszűrődés és a fokozott angiogenezis együttesen felelős a gliómák kiemelkedően magas recidíva-arányáért. A nemrégiben bevezetett kemoterápiás szerek effektivitásának átmeneti jellege miatt valószínűleg kombinációs terápia hozhatna javuló eredményeket. Ezért amellett, hogy nagy specificitású tumormarkereket keresünk, a gliómák invázójának molekuláris spektrumát is érdemes felderíteni. Emellett szól, hogy az invázióval összefüggésbe hozható molekulák mRNS expressziós szintje jellemző a különböző szövettani típusú tumorcsoportokra. Ezért az individuális kemoterápiához szükséges egyedi anti-tumor célpontok kiválasztásához a gliómák inváziós spektrumának meghatározása komoly segítséget nyújthat [88]. A tumorprogresszió összetettségéből fakadóan a gyógyszerkombináció már kiterjedhet az anti-proliferatív, anti-invazív valamint anti-angiogén
készítményekre is, melyek együttes hatásától az agytumorok onkoterápiájában új eredmények várhatók. A jelen disszertációban részletezett kutatások tárgyát képező peritumorális invázió gyógyszeres redukálása révén a reziduális vagy recidív daganat radikális műtéti eltávolításának esélyei egyértelműen javulnának, illetve a sugárkezelés (akár az FBRT, akár a stereotaxiás sugársebészet) kuratív jellege is felmerülhetne. Kutatásainkat ezek alapján egyrészt a jelenlegi onkoterápia ineffektivitása okainak feltárása, másrészt a peritumorális invázió molekuláris hátterének megismerése vezette.
2. CÉLKITŰZÉSEK
A jelenlegi szerény neuro-onkológiai kezelési eredmények hátterének megismeréséhez és az onkoterápia hatékonyságának fokozása céljából kutatásainkhoz a következő célkitűzéseket fogalmaztuk meg.
1. Mivel minden vizsgálat saját beteganyagon történik, ezért első lépésben a Debreceni Idegsebészeti Klinikán kezelt betegek mintagyűjtését szükséges megszervezni. A szabályozott formában, etikai engedéllyel és kutatási célokra alkalmas szövetminták gyűjtése, tárolása és kezelése céljából Tumor- és Szövetbankot kell létrehozni. A glioblasztómás betegek klinikai paramétereinek feldolgozásával párhuzamosan adatbankot is érdemes kialakítani. Ennek segítségével meg lehet majd határozni a jelenlegi onkoterápia effektivitását és újra lehet értékelni a klinikai betegadatok prognosztikai szerepét valamint az idegsebészeti műtéti ellátás kiterjesztésének jelentőségét.
2. A betegadatok feltérképezése után a genetikai prognosztikai faktorok saját betegpopuláción megvalósuló klinikai relevanciájának meghatározását és az 1p19q kodeléció vizsgálati eredményeinek és onkoterápiát befolyásoló prediktív szerepének elemzését tűztük ki célul.
3. A klinikai adatok elemzését követően a primer malignus agydaganatok kezelésében bázisterápiának számító TMZ mérsékelt hatékonyságának okait célszerű meghatározni. Ehhez elengedhetetlenül szükséges a TMZ szérumbeli aktuális koncentrációja rutinszerű kimutatásának és intratumorális koncentrációja objektív meghatározásának technikáját kidolgozni. Ennek során a GBM kezelésének konkuráló fázisában per os adott TMZ sugárterápiához viszonyított optimális időbeni alkalmazására tudnánk javaslatot tenni, és célkitűzés az irodalomban még nem szereplő, humán glioblasztómában kemoterápiás készítmény intratumorális koncentrációjára vonatkozó objektív adatot szolgáltatni.
4. Miután megállapítottuk a jelenlegi onkoterápia korlátainak egyes fő tényezőit, a glioblasztómás betegek sugár- és kemoszenzitivitására utaló prognosztikai faktorok meghatározása a cél. A korábbi eredmények alapján e szempontból ígéretesnek tűnő EGFR és integrin expresszió szerepének vizsgálatát tekintettük feladatunknak. Egyrészt a két célmolekula sejtfelszíni asszociációjának asztrocitómákra vonatkozó prognosztikai
jelentőségének megítélése, másrészt a TKI-ok GBM kezelésében várható potenciális effektivitását előrevetítő EGFR amplifikáció és mutáció meghatározása a kutatásunk célja.
5. Megértve a kemo- és sugárterápia effektivitásának korlátait, a gliómák műtéti reszekábilitása molekuláris hátterének vizsgálatát tűztük ki célul. Ehhez elsősorban az invázióban szerepet játszó ECM komponenseket kell azonosítani, majd a környező agyállományt különböző mértékben infiltráló tumorok (intracerebrális metasztázis versus glióma) inváziójának elemzését fogalmaztuk meg teendőként. Kérdésünk, hogy milyen molekuláris mechanizmusok állnak a különböző szövettani besorolású, de egyaránt anaplasztikus intracerebrális daganatok igen eltérő mértékű inváziója mögött?
6. Felismerve a GBM kezelési kudarcának egyik fő okaként szerepeltethető kiterjedt peritumorális inváziót, ezen a vonalon tovább kutatva elemeznünk kell a konkuráló kemo- irradiáció gliómák invazivitására gyakorolt hatásának molekuláris szintű manifesztációit kezelés előtti és kezelés utáni GBM mintákon. Kérdésünk, hogy a jelenlegi onkoterápia elősegíti-e a kiújuló GBM műtéti reszekábilitását, azaz van-e kimutatható inváziót gátló hatása?
7. A gliómák peritumorális inváziójának közelebbi megismeréséhez a tumort befogadó környező agyállomány szerepével kapcsolatban merülnek fel kérdések. Így folytatva a különböző eredetű anaplasztikus daganatok (pulmonális adenokarcinóma agyi áttéte versus GBM) eltérő mértékű inváziója magyarázatának kutatását, a peritumorális agyállomány tumoros infiltrációval kapcsolatban fellépő védekező reakcióinak feltárását is célkitűzéseink közé soroltuk. Ezáltal az irreszekábilitást eredményező tumorinvázió mindkét oldalának résztvevőjét vizsgálva lehet a folyamatról egységes képet alkotni és tumor-specifikus személyre szabott onkoterápiához új adatokat szolgáltatni.
8. Mivel GBM esetében a hosszútávú túléléshez szükséges teljes műtéti eltávolítás a peritumorális invázió miatt nem kivitelezhető és a mindig bekövetkező lokális recidiváért is ez tehető felelőssé, az inváziós molekuláknak a várható túlélésre gyakorolt hatása nem kérdéses.
Ennek a megfigyelésnek az objektív meghatározásához azt szükséges megvizsgálnunk, hogy az invázióban szerepet játszó ECM alkotók expressziója milyen összefüggést mutat a glioblasztómás betegek túlélésével, és ez GBM esetében új prognosztikai faktornak minősíthető-e?
3. BETEGEK ÉS MÓDSZEREK
3.1. A Debreceni Neuro-onkológiai Labor kialakítása
3.1.1. Szervezeti háttér
A jelen MTA doktori disszertációban szereplő tudományos eredmények mindegyike a Debreceni Egyetem Klinikai Központ (DE KK) Idegsebészeti Klinikán kezelt betegek klinikai paramétereinek, tumor- és szövetmintáinak feldolgozásából származó közleményekre épült.
Ezeket a kutatásokat az DE KK Idegsebészeti Klinikán működő Idegsebészeti Agydaganat- és Szövetbank által nyújtott lehetőségek alapozták meg.
Az Idegsebészeti Agydaganat- és Szövetbank (a továbbiakban Agydaganatbank) Dr.
Klekner Álmos korábbi neuro-onkológiai kutatási eredményeire benyújtott OTKA pályázat anyagi támogatásának köszönhetően 2005-ben jött létre. Az Agydaganatbank működéséhez a mintát a Kölni Idegsebészeti Klinikán működő Neuro-onkológiai Laborban található hasonló tumorbank adta, ahol a pályázó 1 éves német akadémiai ösztöndíjjal (Deutsche Akademische Austauschdienst, DAAD) eltöltött kutatómunka során ennek működési feltételeiről részletes ismereteket szerzett. Az OTKA keretből beszerzett nagy kapacitású ultramélyhűtő, a mintafeldolgozáshoz szükséges folyékony nitrogén kezelésére alkalmas tartályok, az intraoperatív mintagyűjtés kidolgozása, a szövetminta archiválás meghatározása, a klinikai adatgyűjtés megszervezése, ennek tárolása és a minta- valamint betegadatbank szintézise eredményezte azt a nélkülözhetetlen tudományos hátteret, melyre azóta is kutatások sora épül.
Az Agydaganatbank az első perctől kezdve TUKEB engedéllyel rendelkezik, melyet kétévente beszámoló alapján hosszabbít meg az illetékes Bizottság.
Az Agydaganatbank működésének szervezeti keretét az e célból szintén 2005-ben megalakított Neuro-onkológiai Labor alkotja, melynek fő feladata a Bank nyújtotta lehetőségek tudományos kutatások céljaira történő felhasználásának elősegítése és kivitelezése. A Neuro- onkológiai Labort megalakulása óta Dr. Klekner Álmos vezeti, és működéséhez több kutatási pályázat biztosította és biztosítja ma is az anyagi hátteret. Az Agydaganatbanknak köszönhetően ma már a jelen disszertációban összefoglalt saját kutatások mellett igen jelentős hazai és nemzetközi kollaborációban megvalósuló tudományos eredmények is születtek.
3.1.2. Az Idegsebészeti Agydaganat- és Szövetbank jelentősége
Az Agydaganatbank egyrészt intraoperatív gyorsfagyasztott szövetminta-gyűjtést végez, de emellett egyéb humán szövetminták (likvor, nyál, bronchusváladék, vér) gyűjtését és mélyfagyasztott állapotban történő tárolását is megvalósítja. Az intraoperatív mintagyűjtésnek kiemelkedő előnye, hogy a lefagyasztott szövetminták később nem csak morfológiai vizsgálatokra, molekulák mennyiségi analízisére, hanem funkcionális vizsgálatok céljára (elsősorban enzimaktivitás meghatározására) is alkalmasak maradnak (szemben pl. a formalin fixált mintákkal). További előny, hogy a rutinszerű mintagyűjtés (a DE KK Idegsebészeti Klinikán majdnem minden nap történik mintagyűjtés) egyrészt a ritka tumorokból évek során nagyszámú mintakollekció létrejöttét eredményezi, másrészt a kiújult daganatokból származó szövetminták vizsgálatával a különböző onkológiai kezelések hatásainak molekuláris szintű meghatározása is megvalósítható. Az Agydaganatbank mintagyűjtési stratégiája ezáltal horizontális és vertikális mintagyűjtési célokat valósít meg. A minél többféle szövettani típusú daganatból származó mintagyűjtés a teljes tumorpaletta lefedésének igényével horizontális síkban eredményez nagyszámú mintagyűjtést, míg az egyes betegek időbeni követésével megvalósuló mintagyűjtés vertikális adatkapcsolási lehetőséget valósít meg.
Külön kiemelendő jelentőségű, hogy az Agydaganatbankban az idegsebészeti műtétek során elkerülhetetlenül eltávolításra kerülő, egyébként nem tumoros agyszövetek is tárolásra kerülnek. Ezekben az esetekben elsősorban a funkcionális idegsebészeti műtétekből (pl.
epilepszia-sebészet) származó mintákat gyűjtjük, de a beékelődés elhárítását célzó uncus gyri hippocampi vagy tonsilla cerebelli eltávolítása, illetve alkalmanként a frontális vagy temporális polus reszekció is felbecsülhetetlen értékű mintágyűjtésre ad alkalmat. Ennek köszönhetően alakult ki ugyanis egy nem-tumoros, számos szempontból normálisnak tekinthető agyszövet- gyűjtemény, mely nemzetközi szinten is egyedülálló és minden tumorszövetet célzó tudományos kutatáshoz referenciaszövetként funkcionáló mintákat szolgáltat.
Az Agydaganatbank emellett számos, a későbbi szövettani feldolgozás során un.
peritumorális agyszövetnek bizonyult szövetmintát is tartalmaz, mely műtét során ugyan tumornak tűnik, és az anatómiai szituációból adódóan a tumorral együtt eltávolításra kerül (frontális, temporális pólus, hippocampus), de nem tumorszövet alkotja. Ezek a szövetminták a peritumorális reakciók és invazív folyamatok vizsgálatához jelentenek pótolhatatlan vizsgálati anyagot.
Az Agydaganat- és Szövetbankban tárolt, célzottan gyűjtött bronchusváladék és
szekréciójának és lokális koncentrációjának, azaz az intraorális és pulmonális effektivitást meghatározó minimális inhibitorikus koncentráció meghatározásához szükségesek.
További fő szövetmintagyűjtemény a tumoros betegektől származó teljes vér- és szérumgyűjtemény, mely egyrészt a tumoros betegek genomikai vizsgálatát, másrészt a tumorból származó és a vérkeringésbe került derivátumok (pl. mikro-RNS, mikroszómák) izolálását és analízisét teszi lehetővé. A horizontális és vertikális mintagyűjtési metódus ezekben az esetekben is megvalósulhat és igen jelentős kutatási potenciált hordoz magában.
3.1.3. Az Agydaganatbank gyakorlati működése során kifejlesztett saját technikák
1. A tumorminták mélyfagyasztott tárolása után történő mintafeldolgozás a minták felolvasztásával jár, így a több különböző, időben is elkülönülő vizsgálatokhoz való mintafeldolgozás során az eredeti minta minőségi romlása következhet be. A Debreceni Agydaganatbank esetében a mintatárolási procedúrába beépítettünk egy előzetes mintadarabolási lépést, amikor a folyékony nitrogénben lefagyasztott mintát a nitrogénben tördelve darabokra, az így keletkezett darabokat egyenként külön eppendorf tubusokban fagyasztjuk le. Ezáltal minden vizsgálathoz egy kis mintadarabot tartalmazó külön tubust veszünk elő az ultramélyhűtőből, és elkerüljük az eredeti minta darabolásával járó felolvadási és mintavesztési kockázatot.
2. A folyékony nitrogénben történő szövetminta-fagyasztás már régen bevált mintatárolási módszer, melynek azonban nem csak előnyei, hanem hátrányai is vannak. A folyékony nitrogénbe helyezett szövetminta körül ugyanis a nagy hőmérsékletkülönbség miatt a nitrogén forrni kezd, és számos mikrobuborék képződik, melyek mechanikai hatása a szövetmintát károsítani képes. Ennek elkerülésére különböző médiumokban történő fokozatos lefagyasztás technikái már kidolgozottnak tekinthetők (pl. izopentán), de ezeknek sem rutinszerű technikai kivitelezése (nehezen várható el a műtőszemélyzettől az ehhez hasonló összetett mintapreparálási technikák alkalmazása), sem pedig gazdasági vonatkozása nem tette vonzóvá az egyébként valóban ajánlatos módszert. A Debreceni Agydaganatbank gyakorlatában sikerült kidolgozni egy olyan módszert, mely kihasználja ugyan a folyékony nitrogén adta fagyasztási lehetőségeket, mégsem jár szövetroncsoló jellegű buborékképződéssel. A mi gyakorlatunkban alufóliával bevont parafaszigeteket használunk, melyek szabadon úsznak a folyékony nitrogén felületén. A fémtartalmú bevonatnak köszönhetően a szigetek felszínének hőmérséklete
gyakorlatilag megegyezik a nitrogénével, így a ráhelyezett friss szövetminta azonnal átfagy – anélkül azonban, hogy forrásból származó mechanikai hatásssal számolni kellene. A módszer további előnye, hogy a fémtermoszban lévő nitrogén felszínén úszó alufóliázott szigeteket filctollal több mezőre lehet osztani, mely így az előzetes mintaszelekciót is lehetővé teszi, és az egy műtét során vett többféle szövetminta (pl.
tumor, ép, centrális régió, tumorperiféria) biztonsággal elkülöníthető és nem áll fenn annak a veszélye, hogy a termoszba ejtett minták később összekeveredhetnek.
3.2. A jelenlegi onkoterápia effektivitásának meghatározása glioblasztóma esetében saját beteganyagon
A glioblasztómás betegek nemzetközi szinten 2006-ban bevezetett kezelési protokollja a kemoterápiás készítmények rutinszerű alkalmazásával jelentősen javított a túlélési adatokon.
Felmerült tehát az igény a betegek kezeléstől függő túlélési esélyeinek összehasonlítására, valamint az idegsebészeti, klinikai szempontból meghatározható prognosztikai paraméterek újrabecsülésére. Továbbá felmerül a kérdés, hogy a szisztémás hatású kemoterápiás készítményekkel elért eredmények megváltoztatják-e a műtéti radikalitás kedvező hatását feltételező teljes tumorexstirpatióra való törekvést? Az onkoterápia hatékonyságának ismeretében átértékelődik-e bizonyos klinikai paraméterek prognosztikai jelentősége?
A Debreceni Idegsebészeti Klinikán szintén 2006-ban került bevezetésre glioblasztómás betegek kezelésére a TMZ rutinszerű alkalmazása. A konkuráló kemo-irradiáció és a TMZ monoterápia ellenére kiújult tumor esetében pedig 2009 óta alkalmazzuk a bevacizumab monoterápiát. Jelen vizsgálatban a különböző kezelési metódusok (hagyományos irradiáció, konkuráló kemo-irradiáció, kiegészítő bevacizumab kezelés) hatékonyságát elemeztük a klinikai paraméterek túlélést befolyásoló szerepének tükrében saját beteganyagon.
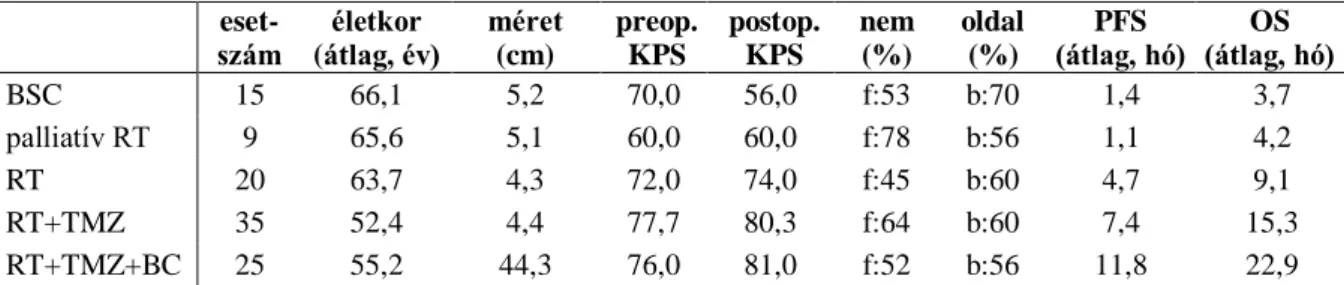
Vizsgálatunkban 104 olyan agydaganatos beteg adatait dolgoztuk fel, akiknél 2002 és 2012 között GBM miatt a Debreceni Egyetem Klinikai Központ (DE KK) Idegsebészeti Klinikáján műtét történt. A posztoperatív terápia alapján a 104 pácienst öt csoportba osztottuk.
1. Az első csoportba tartozó 15 betegnél az igen rossz Karnofsky pontszám (KPS érték) alapján műtét után sem sugár-, sem kemoterápia nem történt (best supportive care, BSC).
2. Kilenc esetben a betegek a műtét utáni állapot alapján csak palliatív radioterápiában (pRT) (10x3 Gy) részesültek.
3. A harmadik csoportba 20 beteg tartozott, akik 2002-2005 között estek át műtéten és utána teljes dózisú sugárkezelésben részesültek, de kemoterápiát nem kaptak (30x2 Gy WBRT).
4. A negyedik csoportba azok a 2006-2008 között operált betegek tartoztak, akik műtéti eltávolítást követően konkuráló kemo-irradiációs kezelésben (Stupp protokol szerint) részesültek (30x2 Gy FBRT + per os TMZ, + 6-12 ciklus (állapottól és radiológiai progressziótól függően) TMZ monoterápia, RT+TMZ). Ebbe a csoportba 35 beteg tartozott.
5. Az ötödik csoportba azokat a betegeket soroltuk (25 beteg), akiknél a Stupp protokol után a daganat progrediált és ezt követően bevacizumab kezelésben részesültek (RT+TMZ+BC).
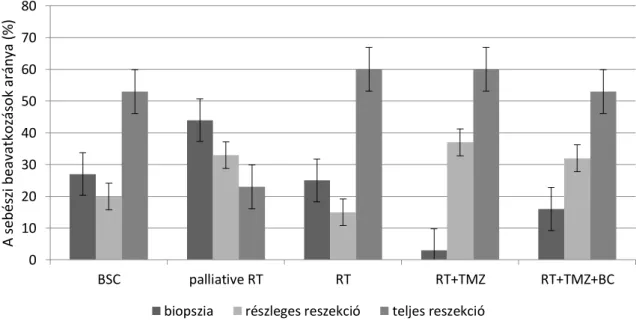
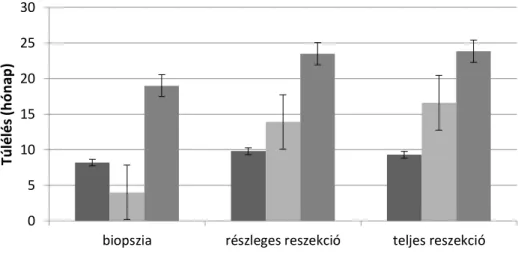
A feldolgozás során figyelembe vettük a betegek korát, nemét, a tumor oldaliságát, lokalizációját, legnagyobb átmérőjét, a műtét előtti és utáni KPS-t és a műtéti beavatkozás kiterjesztettségét. Ez utóbbit 3 típusba soroltuk: 1. biopszia, 2. részleges reszekció, 3.
makroszkóposan teljes reszekció.
Munkánk során az egyes klinikai paraméterek és különböző kezelési metódusok túlélésben játszott szerepét vizsgáltuk.
A tumor oldaliságának szerepét aránybecsléssel vizsgáltuk, a pre- és postoperatív KPS- t, a progresszió előtti, utáni illetve OS szignifikáns voltát kétmintás t-próbával illetve Mann- Whitney próbával ellenőriztük. A két túlélési csoportban a betegek nemének, a különböző műtéttípusok illetve a tumorok lokalizációjának arányait aránybecsléssel vizsgáltuk.
Statisztikai számításaink során minden alkalommal 5%-os szignifikancia szintet alkalmaztunk.
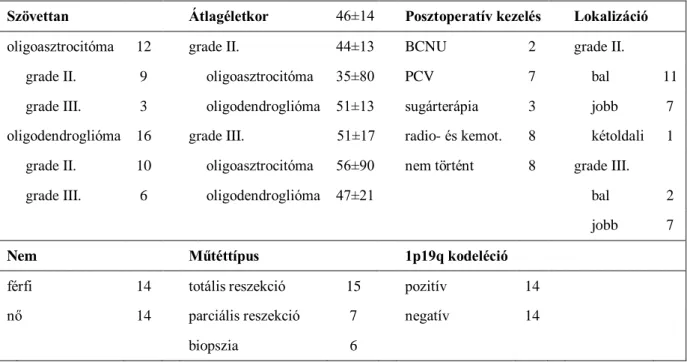
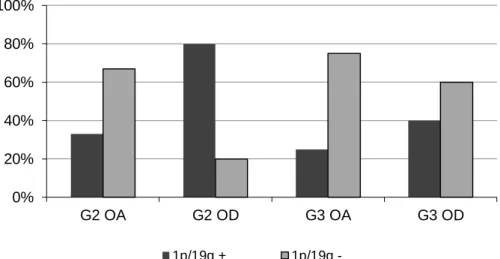
3.3. Prediktív markerek meghatározása saját beteganyagon: az 1 p19q kodeléció klinikai relevanciája oligodendrogliómákban és oligoasztrocitómákban
A Debreceni Egyetemen 2006-tól érhető el az 1p19q kodeléció rutinszerű vizsgálata, mely klinikai jelentőségének megítéléséhez minimálisan szükséges 2,5 év átlagos követési idő adatait elemeztük 2006 és 2008 között összesen 28, klinikánkon kezelt oligodendroglia komponensű tumoros beteg esetében. Vizsgáltuk a kodeléció és a PFS összefüggését a terápia függvényében, majd eredményeinket összehasonlítottuk a nemzetközi irodalomban található adatokkal. Ezek mellett számos további klinikai paraméter és az 1p19q státusz összefüggéseit elemezve kerestünk klinikai relevanciájú következtetéseket.
A betegek klinikai adatait az 1. táblázat tartalmazza. 2006 és 2008 között összesen 28, a DE KK Idegsebészeti Klinikán operált beteg esetében történt a műtét után rutinszerű 1p/19q- kodeléció meghatározás. 9 II-es grádusú oligoasztrocitómás, 10 II-es grádusú oligodendrogliómás, 3 III-as grádusú oligoasztrocitómás és 6 III-as grádusú oligodendrogliómás beteg klinikai adatait vetettük össze a genetikai vizsgálat eredményével.
Szövettan Átlagéletkor 46±14 Posztoperatív kezelés Lokalizáció
oligoasztrocitóma 12 grade II. 44±13 BCNU 2 grade II.
grade II. 9 oligoasztrocitóma 35±80 PCV 7 bal 11
grade III. 3 oligodendroglióma 51±13 sugárterápia 3 jobb 7 oligodendroglióma 16 grade III. 51±17 radio- és kemot. 8 kétoldali 1
grade II. 10 oligoasztrocitóma 56±90 nem történt 8 grade III.
grade III. 6 oligodendroglióma 47±21 bal 2
jobb 7
Nem Műtéttípus 1p19q kodeléció
férfi 14 totális reszekció 15 pozitív 14
nő 14 parciális reszekció 7 negatív 14
biopszia 6
1. táblázat. 28 oligodendroglia komponensű tumoros beteg klinikai adata
Vizsgáltuk a daganat grádusa, a betegek neme, életkora, a műtét típusa, a tumor lokalizációja (féltekék, illetve lebenyek szerinti elhelyezkedés), valamint a szövettani típus és a tumor 1p/19q-kodeléció közötti összefüggéseket. Emellett tanulmányoztuk az 1p/19q- kodeléció recidívamentes túlélésre vonatkozó prognosztikai szerepét a különböző grádusú tumorok, illetve a különböző posztoperatív onkoterápiában részesült betegek vonatkozásában.
Az összehasonlítandó számcsoportok eloszlását a Shapiro-Wilk-teszttel vizsgáltuk.
Normál eloszlás esetén a szignifikáns különbségek meghatározásához a páros, illetve páratlan T-próbát, ellenkező esetben a Mann-Whitney-tesztet, illetve a Wilcoxon-tesztet használtuk.
Szignifikánsnak a p<0.05 értéket tekintettük.
3.4. A temozolomid vizsgálata glioblasztómában
3.4.1. A temozolomid szérumbeli koncentrációjának meghatározása glioblasztómás betegben
A CE méréseinkhez két glioblasztómás beteg szérum mintáját (a vérmintákat az egyszeri 400 mg dózisú TMZ orális alkalmazása után 60 perccel vettük le) és nem tumoros betegek szérum mintáját alkalmaztuk (a minták a Debreceni Idegsebészeti Agydaganat- és Szövetbankból származtak, a mintagyűjtés a betegek beleegyezésével, aláírásával és etikai engedély alapján történt). Mindkét beteg részleges tumoreltávolítás, konkuráló kemo-irradiáció után állt és a TMZ monoterápiás fázisban napi 1x400mg per os gyógyszerbevitelben részesült, mely után 60 perccel történt a mintavétel perifériás vénából. A szérum mintákat centrifugálással nyertük (3000 rpm). Minden minta oldatot -80 °C-on tároltunk az analízisig, majd 0,45 µm-es fecskendőszűrőn szűrtük, és további mintaelőkészítés nélkül injektáltuk a kapillárisba.
Méréseinkhez választott CE készülék egy HP3D CE modell volt (Agilent, Waldbronn, Germany). A minták injektálására minden mérés esetében hidrodinamikus mintabevitelt (50mbar, 2s) alkalmaztunk. A mintaoldatokat a kapilláris anódos végénél juttatuk be. A szeparációt 68cm x 50µm belső átmérőjű polyimidréteggel ellátott kvarckapillárisban végeztük (Polymicro Technology, Phoenix, AZ, USA). A kapilláris effektív hosszúsága a szokásos módszerű injektálásnál 60 cm, az ún. "short end" injektálásnál pedig 8 cm volt). Az alkalmazott feszültség 25 kV volt. A vizsgálatot diódasoros fotometriás detektálással végeztük 200 nm, 214 nm, 260 nm és 325 nm hullámhoszakon. Az elektroferogramokat a ChemStation számítógépes program 7.01-es verziójával (Agilent) rögzítettük és dolgoztuk fel. A stabilitási vizsgálatok elvégzésére a CE készülék automatikus mintainjektáló/elemző rendszere volt segítségünkre.
Az analitikai elválasztáshoz használt pufferelektrolitok összetevői közül a nátrium- dihidrogén-foszfát, a dinátrium-hidrogén-foszfát, a HCl, a NaOH és a nátrium-dodecil-szulfát (SDS) a Reanaltól (Magyarország) származtak. A 180 µg/mL törzsoldatot TMZ (Temodal 20 mg, Schering-Plough, Magyarország) vízben történő feloldásával készítettük.
A kapillárisokat puffer elektrolittal 5 percen keresztül előkondícionáltuk: 1 M NaOH-al (10 perc), 0,1 M NaOH-al (10 perc), vízzel (5 perc) és pufferrel (20 perc) mostuk. A szérum minták analízise esetén utókondícionálásként 0,5 M NaOH-ot (3 perc), 0,3 M SDS-t (3 perc) és puffert (3 perc) alkalmaztunk, hogy eltávolítsuk az összes lehetséges adszorbeált anyagot a kapillárisról. A CE analízis előtt az összes puffert 0,45 µm-es szűrőn filtráltuk és hűtőben + 4
°C-on tároltuk.
Mivel a TMZ és bomlástermékei minimális töltéssel rendelkeznek, a micelláris elektrokinetikus kromatográfiát (MEKC) használtuk arra, hogy elválasszuk őket egymástól és a neutrális komponensektől. 20 mM alatti SDS tartalmú elektrolit esetében a neutrális komponensek közötti elválasztás nem volt elérhető, viszont 100 mM SDS tartalmú puffer elektrolit alkalmazásával nagyon jelentős hőtermelődést tapasztaltunk. Az optimális SDS tartalom a puffer elektrolit számára 40 mM-nak bizonyult. Az elektrolitok pH-ja illetve ionerőssége szinte egyáltalán nincs hatással a vizsgált komponensek effektív mobilitására, csak az elektroozmotikus áramlást (EOF) befolyásolta. Az analízis ideje pH 9-es értéken volt a legrövidebb, viszont a felbontás rosszabb volt, mint az alacsonyabb pH értékeken. Savas puffert alkalmazva az elektroforetikus futtatás során a TMZ degradációja nagyobb fokú volt. Az optimális pH érték a szeparáció számára 7-nek bizonyult, és ezen a pH-n elfogadható felbontást lehetett elérni és az analízis ideje is rövid maradt. A felbontás és a puffer ionerősségének összefüggését (5-100 mM foszfát) is vizsgáltuk, de utóbbinak számottevő hatása a szeparációra nem igazolódott.
A puffer koncentrációjának növelésekor a migrációs idő enyhén megemelkedett. 75 mM fölötti foszfát puffert használva (40 mM SDS a pufferben), az áramerősség 75 µA lett, ami a csúcsok kiszélesedését okozta. A MEKC technika optimalizálása után a puffer elektrolit 25 mM foszfátot, 40 mM SDS-t tartalmazott pH 6,8-as értéken. Minden egyes komponenst a migrációs idejük és jellegzetes UV spektrumuk alapján azonosítottunk.
3.4.2. A temozolomid intratumorális koncentrációjának direkt meghatározása humán glioblasztómában
Az agydaganatmintákat jobb frontális rekurrens glioblasztómás beteg idegsebészeti műtéte során szereztük be. A hullámzó panaszok miatt hospitalizált beteg TMZ monoterápiás kezelés alatt állt, de rapid állapotrosszabbodás követően sürgős műtétre került sor. Az utolsó TMZ adagját (400mg) a műtét előtt 1 órával vette be. A műtét során 3 daganatmintát (0,9915 g, 0,7803 g és 0,7647 g) és egy nem daganatos, normál agyi szövetmintát (peritumorális agyállomány a daganatot fedő frontális póluson, 0,3782 g) gyűjtöttünk 15 perces időintervallumokkal, majd a mintákat egyből folyékony nitrogén felszínén lefagyasztottuk és - 80 °C-on tároltuk az analízisig.
Az intratumorális gyógyszerszint vizsgálatához a szérumszint meghatározására is szükség volt. A glioblasztómás beteg szérum mintáit az egyszeri 400 mg dózisú TMZ orális
szérum mintákat is alkalmaztunk kontrollként illetve a mátrix hatások tanulmányozásához. A mintákat tömény sósavval savanyítottuk 2 körüli pH-értékre (1 mL szérumhoz 10 µL tömény HCl-ot adtunk és összekevertük), hogy elkerüljük a TMZ hidrolízisét. Minden mintát -20 °C- on tároltunk az analízis előtt. A CE analízist megelőzően a szérum mintákat 15 percen keresztül 4 °C-on 9000 rpm-en centrifugáltuk.
A nem tumoros agyszövet- illetve tumormintákat liofilizáltuk, majd homogenizáltuk.
Ezután a homogenizátumokat (0,0075-0,12 g) kis térfogatú (300-600 µL) 1M-os HCl-ban gondosan feloldottuk. A vizes oldat pH-ját az előkészítési folyamatok során erősen savas tartományban, 2 alatt tartottuk, hogy elkerüljük a TMZ hidrolízisét. Az így nyert sűrű, viszkózus oldatot lehűtöttük és 15 percen keresztül 4 °C-on 9000 rpm-en centrifugáltuk. A szupernatánst közvetlenül a CE eszközbe injektáluk. Az elődúsításhoz a felülúszóból 50 µL térfogatot extraktáltunk 3x 300 µL etil-acetáttal (10 perc vortex-keveréssel). A mintákat -20
°C-on tároltuk az analízis előtt.
3.5. Az EGFR és az integrinek kölcsönhatásának szerepe asztrocitómákban
3.5.1. Az ErbB1 (EGFR) és az integrin-β1 közti molekuláris interakció vizsgálata asztrocitómákban
Intraoperatív friss fagyasztott II-es és IV-es grádusú asztrocitómák szöveti metszeteiről készültek fluoreszcencia energia transzfer (FRET) mérések konfokális mikroszkóp használatával. 10 db II-es grádusú asztrocitóma (életkor: 18-59 év, átlagos életkor 37,8 év, 5 férfi és 5 nő) és 10 db IV-es grádusú asztrocitóma (életkor: 42-73 év, átlagos életkor 61,4 év, 3 férfi és 7 nő) mintával dolgoztunk.
A szövetmintákat folyékony nitrogénben hűtött iso-pentánban (Sigma Aldrich, St.
Louis, MO) gyorsfagyasztottuk. A Tissue-Tek O.C.T.-be ágyazás után 15 µm széles metszeteket készítettünk a Shandon Cryotom rendszer segítségével (AS-0620E, ThermoFisher Scientific Inc., Waltham, MA) -20 °C-on. A szilánnal burkolt tárgylemezekre helyezett metszeteket szárítottuk és 4%-os PFA-PBS-ben 30 percig fixáltuk, majd 1%-os BSA-PBS-ben 30 percen át blokkoltuk. Ezután 20 µg/mL Cy3 konjugált anti-ErbB1 antitesttel (Mab528) és 20 µg/mL Cy5 konjugált anti-integrin-β1 antitesttel (TS2 klón) jelöltük egy éjszakán át 4 °C-
on inkubálva, majd 3x mostuk és glicerolban montíroztuk. A hisztológiai meghatározás rutin patológiai vizsgálat során történt.
Antitestek
Az ErbB1 és integrin-β1, elleni antitesteket hibridóma sejtvonalak szupernatánsaiból nyertük: 528 (IgG2a, #HB-8509), TS2/16.2.1 (IgG1, #HB-243, ATCC, Manassas, VA) Sepharose 4B Fast Flow Protein G gyöngyök segítségével az IgG2a esetében és Protein A gyöngyökkel az IgG1esetében (Sigma-Aldrich, St. Louis, MO). Az antitestek jelölése Cy3, és Cy5 (Amersham Biosciences Europe, Freiburg, Németország), festékekkel történt.
A sejtek antitesttel való jelölése
A mikroszkópos mérésekhez, a LabTek II fedőlemezeihez tapadt sejteket (Nalga Nunc International, Rochester, NY) 3x mostuk PBS-ben majd az X-FITC, Cy3 vagy a Cy5-tel konjugált antitestek telítő koncentrációval jelöltük jégen, 30 percen át. Ezután 3x PBS-ben mostuk és 500 µL 4 %-os formaldehid-PBS-ben fixáltuk 20 percen keresztül.
Konfokális mikroszkópiához egy Zeiss LSM510 CLSM (Carl Zeiss, Jena, Németország) készüléket alkalmaztunk Plan-Apochromat 63x/1.40NA olaj immerziós objektívvel és egy UV/488/543/633 sugárelosztóval. Az X-FITC, Cy3 és Cy5 fluroforokat 488, 543, és 633 nm-en excitáltuk és 505–535 nm, 560–605 nm band pass, és 650 nm long pass szűrőkkel detektáltuk. 1-3 µm vastag, 4x átlagolt optikai szekciókat (512 x 512 pixel 12 biten) képeztünk le multitrack módban, hogy a csatornák közötti interakciókat kiküszöböljük. A szöveti minták expressziós értékeinek meghatározására a képeket tile módban készítettük el.
Statisztikai analízis
Az analíziseket a SigmaStat 3.5.0.54 segítségével végeztük (Systat Software, Inc.). A II-es és IV-es grádusú asztrocitóma csoportokat kétmintás t-próbával vagy a normalitás hiányában Mann-Whitney teszttel vizsgáltuk, miután a normál eloszlást Kolmogorov-Smirnov szerint, Lilliefors’ korrekcióval ellenőriztük. Kettőnél több, normál eloszlást mutató csoport esetén ANOVA analízist és post-hoc Tukey's tesztet alkalmaztunk. Az ErbB1 és integrin-β1 expresszió és az ErbB1-integrin-β1 heteroasszociáció relapszus-mentes időre kifejtett hatását lépésenkénti többszörös lineáris regresszióval határoztuk meg. A fent említett paraméterek tumor grádusra vonatkozó prediktív erejét pedig lépésenkénti többszörös bináris logisztikus