MTA Doktori értekezés
Teljes szövegt
Ábra

KAPCSOLÓDÓ DOKUMENTUMOK
Time of the entire, completed check-in process tc is calculated as a sum 1 of the following time values: • Queuing time tq • Service time ts tc = tq+ ts 1 At the airport, that
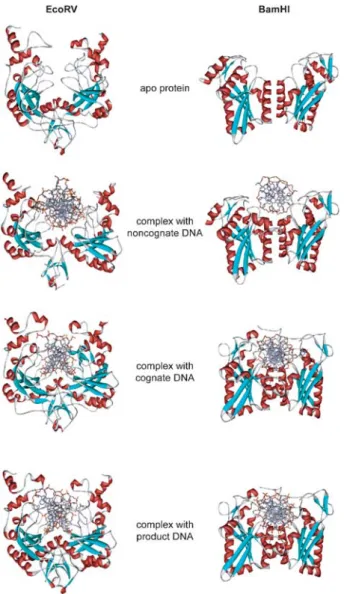
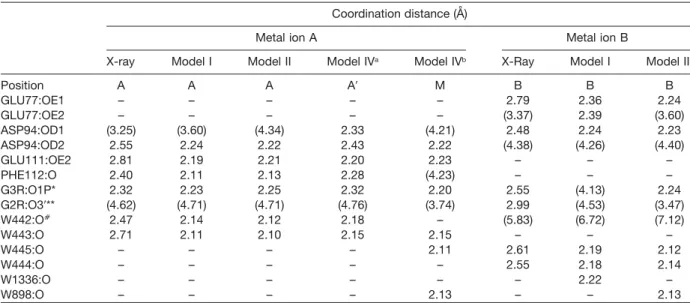
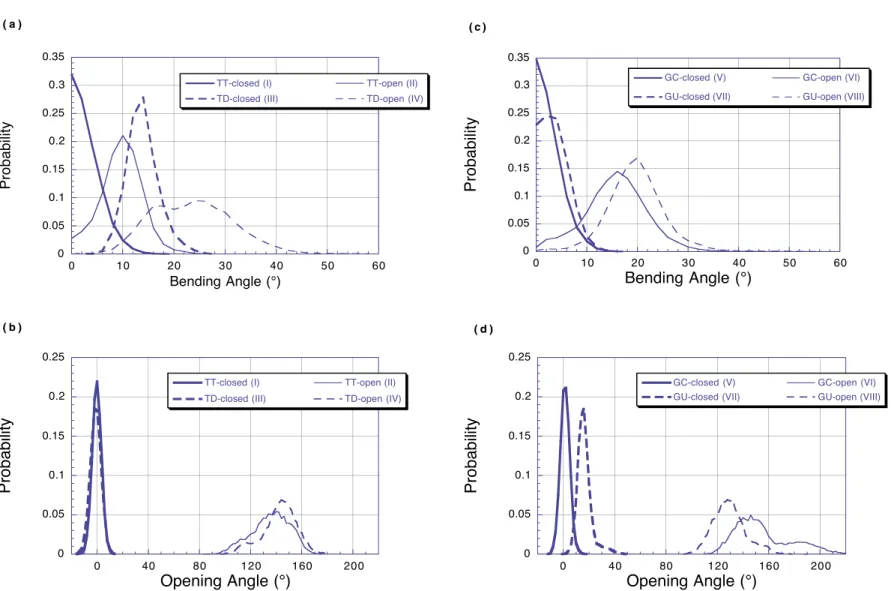
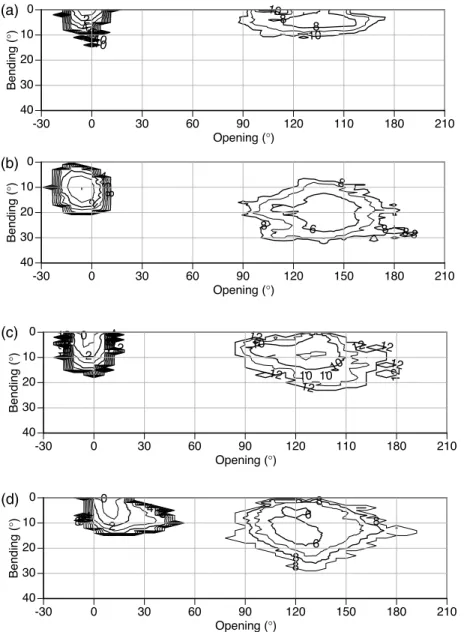
Analysis of protein interaction networks has been of use as a means to grapple with the complexity of the interactome of biological organisms. So far, network based approaches have
Considering the importance of frugivory interactions, it is necessary to identify which species are relevant in the structure of the interaction network and evaluate whether
Among the serotonergic candidate genes of depression in the the case of TPH2 a significant genetic effect was found and in addition we received a significant interaction
The adult primary tumour, newborn primary tumour and lung colony of HT199, the human melanoma cell line with low base CD44 VE expression level, all expressed the variable exons in
To distinguish between specific interaction (dimerization) and non-specific interaction, in qBRET experiments constant amount of donor labeled receptor is coexpressed with
Additional objectives included estimating the prevalence of non-KRAS exon 2 mutations (KRAS exons 3, 4 and NRAS exons 2, 3, 4) in patients with a confirmed wild-type KRAS exon 2
Moreover, given the findings from our previous studies on association of SLITRK1 and HDC haplotypes with TS (Karagiannidis et al., 2012, 2013), we wanted to explore whether