EREDETI KÖZLEMÉNY
Monocyták és neutrophil granulocyták fagocitafunkciója ovariumcarcinomában
Kovács Anna Rebeka dr.
1■
Pál László dr.
2■
Szűcs Sándor dr.
2Lukács Luca oh.
1■
Póka Róbert dr.
1■
Lampé Rudolf dr.
1Debreceni Egyetem, 1Általános Orvostudományi Kar, Szülészeti és Nőgyógyászati Intézet,
2Népegészségügyi Kar, Megelőző Orvostani Intézet, Debrecen
Bevezetés: A közelmúltban számos különböző daganatos megbetegedésben vizsgálták a tumorokat beszűrő immun- sejtek funkcióit. A perifériás immunsejtek tumorpatogenezisben betöltött szerepének vizsgálatára azonban kevesebb kutatás irányult.
Célkitűzés: Célunk annak vizsgálata volt, hogy előrehaladott stádiumú ovariumcarcinomás betegek esetén a tumor jelenléte, illetve annak eltávolítása befolyásolja-e a perifériás monocyták és neutrophil granulocyták fagocitafunkcióját.
Módszer: Előrehaladott stádiumú serosus epithelialis ovariumcarcinomás betegek (n = 12) perifériás vérmintáit vizs- gáltuk, amelyeket a tumorredukciós műtét előtt, valamint a 7. posztoperatív napon gyűjtöttük. A kontrollcsoportot 8 egészséges nő képezte. A monocyták és a neutrophil granulocyták vérmintákból való szeparálását követően a sejtek- kel opszonizált, fluoreszcein–izotiocianáttal jelölt zimozán-A-partikulumokat fagocitáltattunk. A monocytákat indi- rekt immunfluoreszcenciás módszerrel azonosítottuk. A sejtek által bekebelezett részecskéket fluoreszcens mikro- szkóp segítségével megszámoltuk, és kiszámítottuk a fagocitózisindexet. Statisztikai próbaként varianciaanalízist használtunk; a p<0,05 értéket tekintettük szignifikánsnak.
Eredmények: A petefészekrákos betegek vérmintáiból izolált perifériás monocyták és granulocyták preoperatív fagoci- tózisindexei szignifikánsan alacsonyabbak voltak a kontrollcsoportból származó megfelelő sejtek értékeinél. A műtét utáni mintákból izolált monocyták és granulocyták fagocitafunkciója szignifikánsan emelkedett a preoperatív értékek- hez képest, és mindkét sejttípusnál elérte az egészséges kontrolloktól származó sejtek fagocitózisindex-értékét.
Következtetés: Eredményeink alapján arra következtethetünk, hogy ovariumcarcinoma esetén a daganat és/vagy mik- rokörnyezete olyan faktorokat termel, melyek a neutrophil granulocyták és monocyták fagocitafunkcióját deprimál- ják. A citoreduktív műtétet követő fagocitózisindex-növekedés alapján feltételezhető, hogy a tumor eltávolítását kö- vetően e faktorok termelése csökken vagy megszűnik.
Orv Hetil. 2018; 159(33): 1353–1359.
Kulcsszavak: petefészekrák, monocyta, neutrophil granulocyta, fagocitózis
Phagocytic function of monocytes and neutrophil granulocytes in ovarian cancer
Introduction: Recently, tumor-infiltrating immune cells have been studied in various cancers. However, fewer studies address the role of peripheral immune cells in the pathogenesis of cancer.
Aim: Our aim was to investigate whether the phagocytic activity of peripheral monocytes and neutrophil granulo- cytes is affected by the removal of tumor in advanced ovarian cancer.
Method: We investigated peripheral blood samples from 12 patients with advanced stage of serous epithelial ovarian cancer – which were collected before the optimal tumor reduction surgery and on the 7th postoperative day – and from 8 healthy women. After separation of monocytes and neutrophils, the cells were incubated with opsonized fluorescein isothiocyanate-labeled zymosan A particles as the target of phagocytosis. By using fluorescence micro- scope we counted the number of particles phagocytized by the cells and calculated the phagocytic index. Statistical analysis of the data was performed using analysis of variances method.
Results: Preoperative phagocytic indexes of monocytes and neutrophils from patients were significantly lower than phagocytic indexes of the corresponding cells from healthy women. The phagocytic function of monocytes and granulocytes isolated from postoperative samples of patients significantly increased compared to preoperative values and reached the phagocytic indexes of monocytes and neutrophils from healthy controls.
Conclusion: Based on our results we assume that the tumor and/or its microenvironment in ovarian cancer may pro- duce factors that can depress the phagocytic function of monocytes and granulocytes. Since the phagocytic indexes
increased following the cytoreductive surgery, it can be assumed that after the removal of the tumor, the production of these factors is reduced or eliminated.
Keywords: ovarian cancer, monocyte, neutrophil granulocyte, phagocytosis
Kovács AR, Pál L, Szűcs S, Lukács L, Póka R, Lampé R. [Phagocytic function of monocytes and neutrophil granu- locytes in ovarian cancer]. Orv Hetil. 2018; 159(33): 1353–1359.
(Beérkezett: 2018. március 28.; elfogadva: 2018. május 9.)
Rövidítések
CA = (cancer antigen) rákantigén; CRP = C-reaktív protein;
DAPI = (4',6-diamidino-2-phenylindole) 4',6-diamino-2- fenil indol; EDTA = (ethylenediamine tetraacetic acid) etilén- diamin-tetraecetsav; FI = fagocitózisindex; FIGO = (Fédérati- on Internationale de Gynécologie et d’Obstétrique) Nemzetközi Szülészeti és Nőgyógyászati Szövetség; FITC = fluoreszcein-izotiocianát; FITC-OZ = opszonizált, fluoreszce- in-izotiocianáttal jelölt zimozán-A; Ig = immunglobulin; IL = interleukin; SD = (standard deviation) szórás; TGF-β = (trans- forming growth factor beta) transzformáló növekedési faktor- béta; TME = (tumor microenvironment) tumormikrokörnye- zet
Az ovariumcarcinoma a petefészek rosszindulatú daga- natos elváltozása. Alattomosan kialakuló, még ma is ma- gas halálozással járó betegség, mely a rosszindulatú nő- gyógyászati daganatok közül vezető haláloknak számít [1]. A nők körében bekövetkező, leggyakoribb dagana- tos megbetegedésekből származó halálokok sorrendjé- ben az 5. helyen áll, és világszerte évi 140 ezer beteg haláláért felelős [2]. A megbetegedés az életkor előreha- ladtával egyre gyakrabban fordul elő, a diagnózis idején a betegek életkora átlagosan 63 év. A magas halálozás oka részben abban keresendő, hogy a betegség korai stá- diumban sokáig tünetmentes, csak előrehaladott stádi- umban okoz tüneteket, és a leggyakrabban ekkor kerül felismerésre. A daganat kiterjedtsége alapján létrehoz- ták a Fédération Internationale de Gynécologie et d’Obstétrique (FIGO) szerinti stádiumbeosztást, mely- nek alapján a betegek I–IV. főstádiumba sorolhatók [3].
A petefészekrák elsődleges ellátását a citoreduktív műtét („debulking”) jelenti, mely beavatkozás után – amennyi- ben elvégezhető – <1 cm tumoros szövet marad vissza [4]. A műtéti ellátást követően a jelenlegi irányelvek sze- rint platinabázisú kemoterápia javasolt, taxánvegyületek- kel kombinálva [5]. A petefészek hámeredetű daganatai- nak kóreredete az esetek többségében ismeretlen. A serosus epithelialis ovariumcarcinoma etiológiájának kér- désében számos elmélet született [6–8]. Az utóbbi évek- ben kimutatták, hogy az immunrendszer komoly befo- lyással bír a betegség klinikai lefolyására [6].
A monocyták és a neutrophil granulocyták a veleszüle- tett immunrendszer fagocitózisra képes sejtjeiként egy-
aránt fontos szerepet játszanak a tumorosan transzfor- málódott sejtek eltakarításában, ezáltal a daganatok kialakulása elleni védelemben. A fagocitózis célja a beke- belezett mikrobák, apoptotikus vagy tumorossá vált sej- tek elpusztítása, valamint az antigének bemutatása révén az adaptív immunitás sejtjeinek aktiválása [9, 10]. Habár a monocyták és a neutrophil granulocyták fagocitafunk- ciójának csökkenését számos állapotban/betegségben megfigyelték, daganatos megbetegedések esetén jelenleg kevés irodalmi adat áll rendelkezésre e sejtek fagocita- funkciójának változásáról. Kimutatták, hogy nagyobb valószínűséggel alakulhatnak ki egyes daganatok im- munhiányos állapotokban [11], ami az immunrendszer fontos szerepére utal a daganatos betegségek patogene- zisében. Immunológiai szempontból egy daganat mak- roszkópos megjelenése azt jelzi, hogy az azt kialakító sejteknek sikerült kijátszaniuk az immunrendszert („tu- mor escape”), mivel daganatos átalakulásuk ellenére nem pusztították el őket a citotoxikus sejtek, és felszaporodva létrehozták a daganatszövetet [1]. Számos daganattípus esetén megfigyelték, hogy az azokat beszűrő inflamma- toricus sejtek száma korrelált a betegség kimenetelével [12].
Napjainkra számos kutatás ismeretes, melyek szerint az ovariumcarcinoma jelentős befolyással lehet a külön- böző immunsejtek működésére [13, 14]. Kutatások so- rán kimutatták, hogy petefészekrákos betegek perifériás vérmintáiból izolált neutrophil granulocyták proinflam- matoricus fenotípust mutatnak. E sejtekben növekedett a reaktívoxigén-gyökök termelése és az adhéziós mole- kulák expressziója az egészséges kontrollok vérmintái- hoz képest [2]. Megfigyelték továbbá, hogy ovariumcar- cinomás betegek esetén a terápia előtt vett perifériás vérmintában mért emelkedett neutrophil/lymphocyta arány (mely korrelált a „cancer antigen” [CA]-125 emel- kedésével) agresszívabb betegséglefolyást jelzett [15] – csakúgy, mint számos más daganatos betegség esetén [16], míg az emelkedett perifériás lymphocyta/monocy- ta arány a hosszabb túlélési idővel mutatott szoros össze- függést [17].
Az utóbbi években számos, a tumorokat infiltráló im- munsejtek funkcióit vizsgáló kutatás született [18], azonban a keringésben lévő, perifériás immunsejteknek a különböző daganatok patogenezisében betöltött szere-
pét jóval kevesebb kutatás vizsgálta. Jelenleg nincs ismert irodalmi adatunk arra vonatkozóan, hogy az ovariumcar- cinoma műtéti eltávolítása hogyan befolyásolja a neut- rophil granulocyták és monocyták fagocitafunkcióját.
Ezért célunk ezen immunsejtek fagocitafunkciójának vizsgálata volt előrehaladott stádiumú petefészekrákos betegek esetén a tumor eltávolítása előtt és 7 nappal azt követően gyűjtött, valamint egészséges (kontroll-) sze- mélyektől vett perifériás vérmintákból. Célunk mindezek által az ovariumcarcinoma patogenezisének és az im- munrendszerrel való kapcsolatának jobb megismerése volt.
Módszer
Vizsgált személyek
A Debreceni Egyetem Regionális Kutatásetikai Bizottsá- ga engedélyének birtokában, a vizsgált nők tájékozott beleegyezését követően, 10 ml perifériás vérmintát vet- tünk. A perifériás vérmintavételhez Vacutainer típusú EDTA-t tartalmazó (Becton Dickinson, Le Pont-de- Claix, France) zárt rendszerű vérvételi csöveket alkal- maztunk. Kutatásunk során 12 magas gradusú, serosus epithelialis ovariumcarcinomás beteg perifériás vérmintá- it vizsgáltuk: a preoperatív vérmintavétel a tumorreduk- ciós műtét reggelén, a posztoperatív mintavétel a műté- tet követő 7. nap reggelén történt. A kontrollcsoportot 8 egészséges személy képezte, akik nem szenvedtek da- ganatos megbetegedésben. A vizsgálatban részt vevő személyek egyike sem szenvedett cukorbetegségben, im- munszuppresszív betegségben, nem szedett gyógyszert, valamint nem volt súlyos belgyógyászati betegsége.
A monocyták és granulocyták szeparálása
A vizsgálatban részt vevő személyektől származó mono- cyták és granulocyták szeparálását a szakirodalomban ko- rábban meghatározott módszer szerint végeztük [19].
Mind a preoperatív, mind a posztoperatív, valamint az egészséges személyektől származó vérmintákat azonos módon vizsgáltuk. A vérmintákat Hanks-oldattal (pH:
7,2–7,3) térfogatuk duplájára hígítottuk, majd ezt köve- tően Ficoll-sűrűséggradiensre (1,077 g/cm3 és 1,119 g/
cm3) rétegeztük. A rétegezést követően a minták centri- fugálása következett: ezt 400 g-n, 24 °C-on, 30 percig végeztünk, melynek során az eltérő sűrűségű Ficoll-réte- gek fázishatárára szeparálódtak a mononukleáris sejtek (monocyták és lymphocyták) és a polimorfonukleáris sejtek (granulocyták). A szeparálódott sejteket külön kémcsövekbe gyűjtöttük, majd kétszer mostuk Hanks- oldattal. Tripánkékfestéssel ellenőriztük a sejtek életké- pességét, mely minden esetben 96–98%-osnak adódott.
A granulocyták aránya a sejtszuszpenzióban 95–98%-os- nak adódott morfológiai meghatározás alapján.
Zimozánrészecskék opszonizálása és fluoreszcens jelölése
A zimozánrészecskék opszonizálását és fluoreszcens jel- zését a szakirodalomban korábban meghatározott mód- szer szerint végeztük [20]. A zimozán-A-partikulumo- kat (1 × 108/ml) 60 percig 37 °C-on inkubáltuk karbonátpufferben (pH: 9,6), mely 0,01 mg/ml fluo- reszcein-izotiocianátot (FITC) tartalmazott, majd a ré- szecskéket háromszor mostuk Hanks-oldattal. A zimo- zánrészecskék opszonizálását 50% humán AB-szérumot tartalmazó Hanks-oldatban 30 percig, 37 °C-on végez- tük, majd a fluoreszcensen jelölt és opszonizált zimozán- A (FITC-OZ)-partikulumokat háromszor mostuk Hanks-oldattal. Utána milliliterenként 3 × 107 FITC- OZ-partikulumot tartalmazó Hanks-oldatban lefagyasz- tottuk, és felhasználásig –20 °C-on tároltuk.
Monocyták és neutrophil granulocyták fagocitafunkciójának meghatározása
A fagocitafunkció vizsgálatát a szakirodalomban koráb- ban leírt módszerek szerint végeztük [21]. Szeparálást követően a monocyták és granulocyták sejttenyésztő kamrára történő kitapasztása következett, amit 5%-os, hővel inaktivált humán AB-savót tartalmazó Hanks-ol- dat hozzáadásával végeztünk (30 perc, szobahőmérsék- let). Minden kamrára 300 µl 106 db sejtet tartalmazó szuszpenzió került. Végül Hanks-oldattal háromszor mostuk a kamrákat, hogy eltávolítsuk azokat a sejteket, amelyek nem tapadtak ki. A fagocitózis célpontjaként a sejtekhez opszonizált, fluoreszcein-izotiocianáttal jelölt zimozán-A (FITC-OZ)-partikulumokat adtunk. A fel- használásig lefagyasztva tárolt, FITC-OZ-t tartalmazó Hanks-oldatot, kiolvasztás után Hanks-oldattal tovább hígítottuk (1,5 : 1 – Hanks-oldat : FITC-OZ-t tartalma- zó Hanks-oldat-arányban). Az oldatból minden kamrára 300 µl-t mértünk a kitapadt sejtekre, majd 37 °C-on, 5%
CO2-t tartalmazó, 100%-os páratartalmú levegőn 60 percig inkubáltuk. A nem fagocitált zimozánrészecskék fluoreszcenciáját tripánkékfestéssel oltottuk ki [22]. A kamrák leválasztása után a monocytákat és granulocytá- kat 30 percig, 4%-os paraformaldehid-oldattal fixáltuk a lemezekre. A monocyták azonosítására indirekt immun- fluoreszcens jelölést használtunk. Első lépésként antihu- mán CD14+ antitesteket, majd fluoreszcensen jelölt (Dylight 594), IgG-ellenes másodlagos antitesteket ad- tunk a sejtekhez. Végül mind a monocyták, mind a gra- nulocyták sejtmagjait 4',6-diamino-2-fenilindolt (DAPI) tartalmazó fedőmédiummal festettük. A minták kiérté- kelését Axioplan fluoreszcens mikroszkóp (Zeiss, Ober- kochen, Németország) segítségével végeztük. A kiérté- kelés során random módon kiválasztott látóterekben számoltuk a sejtek által fagocitált zimozánpartikulumok számát, majd fagocitózisindexet (FI) számoltunk: FI = 100 sejt által fagocitált részecskék száma ⁄ 100.
1. táblázat A vizsgálatban részt vevő ovariumcarcinomás betegek és egészséges kontrollszemélyek klinikai adatai
Klinikai adatok Ovariumcarcinomás betegek (n = 12) Egészséges kontrollszemélyek (n = 8) p-érték
Kor [év] 65,25 ± 11,64 53,88 ± 11,57 NS
Graviditása 2 ± (0–5) 3 ± (1–9) NS
Paritása 2 ± (0–3) 2 ± (1–3) NS
Testtömegindex [kg/m2] 26,52 ± 4,12 27,65 ± 3,62 NS
Differenciáltság HGb NA NA
Tumorstádium (FIGO) IIICc NA NA
Optimális tumorredukciód 100% NA NA
Az értékek átlagot ± szórást (SD) jelölnek. NA = nem értelmezhető; NS = nincs szignifikáns különbség.
aAz értékek átlagot (szélsőértékeket) jelölnek.
bHG = magas gradus („high-grade”).
c FIGO (Fédération Internationale de Gynécologie et d’Obstétrique) szerinti stádiumbeosztás a daganat kiterjedtsége alapján: III/C: A daganat egyik vagy mindkét petefészket érinti, peritonealis áttétek vannak a kismedencén kívül (>2 cm), és/vagy áttét mutatható ki a retroperitonealis vagy inguinalis nyirokcsomókban.
dOptimális tumorredukció: a daganat eltávolítását célzó műtét során <1 cm tumoros szövet marad vissza.
Statisztikai analízis
Az eredmények statisztikai értékelése során a preoperatív és posztoperatív FI-értékeket ismételt méréses variancia- analízissel („repeated measures ANOVA”) hasonlítottuk össze. A különböző csoportok FI-értékeinek, valamint a kutatásban részt vevő személyek klinikai adatainak össze- hasonlításához egytényezős varianciaanalízist („one-way ANOVA”) használtunk. A p<0,05 értéket tekintettük statisztikailag szignifikánsnak.
Eredmények
A vizsgálatban részt vevő személyek klinikai adatait az 1.
táblázat tartalmazza. Amint a táblázatban látható, az ovariumcarcinomás betegek és az egészséges személyek életkora (p = 0,090), graviditás- (p = 0,682), paritás- (p = 0,481) és testtömegindex-értékei (p = 0,824) kö- zött nem volt szignifikáns különbség. A vizsgálatunkban részt vevő minden beteg magas gradusú, serosus epithe- lialis ovariumcarcinomában szenvedett, és a FIGO-stádi- umbeosztás alapján előrehaladott, III/C stádiumba volt sorolható. Minden beteg esetében optimális tumorre- dukciós műtét történt, a beavatkozás során <1 cm tumo- ros szövet maradt vissza [4].
Monocyták fagocitafunkciója
Az 1. ábrán az ovariumcarcinomás betegektől műtét előtt (n = 12), a 7. posztoperatív napon gyűjtött (n = 9) és egészséges kontrollszemélyektől (n = 8) származó pe- rifériás vérmintákból szeparált monocyták fagocitózisin- dex-értékeinek átlagait, valamint a szórásokat (±SD) tüntettük fel. Amint az 1. ábrán látható, a petefészekrá- kos betegektől műtét előtt gyűjtött perifériás vérminták- ból származó monocyták FI-értéke (FI = 1,95 ± 0,69) szignifikánsan (p<0,001) alacsonyabb volt az egészséges
kontrollszemélyek monocytáinak FI-értékéhez (FI = 4,42 ± 1,59) képest. A petefészekrákos betegek poszt- operatív (FI = 3,76 ± 0,70) és preoperatív (FI = 1,95 ± 0,69) vérmintáiból izolált monocyták fagocitafunkciójá- nak összehasonlítása esetén a posztoperatív vérminták- ból szeparált monocyták FI-értéke szignifikánsan (p<0,001) emelkedett a preoperatív FI-értékhez viszo- nyítva. Az egészséges kontrollszemélyek (FI = 4,42 ± 1,59) és a posztoperatív (FI = 3,76 ± 0,70) statusú bete- gekből izolált monocyták fagocitafunkciójának összeha- sonlítása esetén nem volt szignifikáns különbség (p = 0,585) a két csoport FI-értékei között.
1. ábra A vizsgálatban részt vevő ovariumcarcinomás betegektől műtét előtt (preoperatív [n = 12]) és 7 nappal műtét után (posztope- ratív [n = 9]), valamint egészséges kontrollszemélyektől (n = 8) gyűjtött perifériás vérmintákból izolált monocyták fagocitó- zisindexe. Az ábrán fagocitózisindex-átlagértékek ± szórások (SD) vannak feltüntetve
*p<0,001 Ovariumcarcinomás betegek preoperatív monocytái- nak és egészséges kontrollok monocytáinak FI-értékeit összeha- sonlítva
#p<0,001 Ovariumcarcinomás betegek pre- és posztoperatívan izolált monocytáinak FI-értékeit összehasonlítva
Neutrophil granulocyták fagocitafunkciója
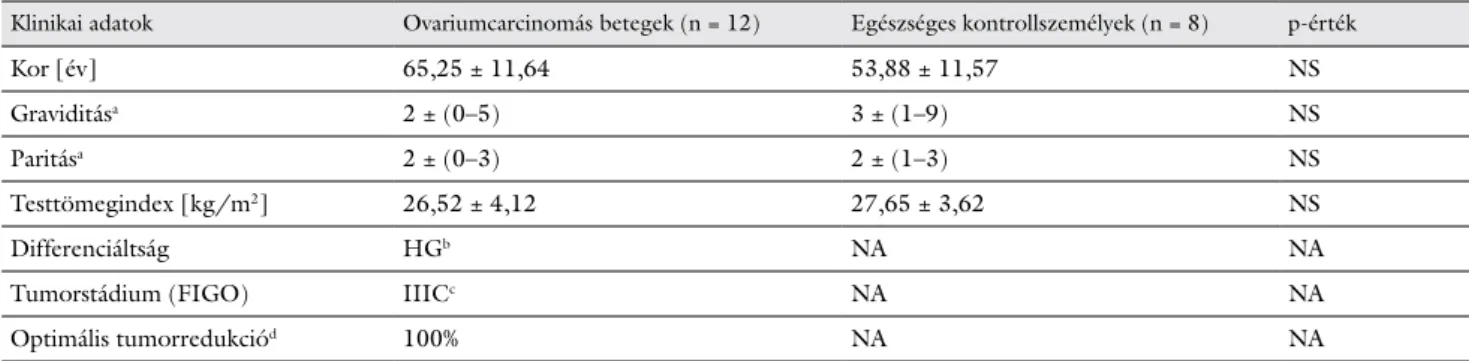
A 2. ábrán az ovariumcarcinomás betegektől műtét előtt (n = 11), illetve a 7. posztoperatív napon gyűjtött (n = 8), valamint egészséges kontrollszemélyektől (n = 5) származó perifériás vérmintákból szeparált neutrophil granulocyták fagocitózisindex-értékeinek átlagait, vala- mint a szórásokat (±SD) tüntettük fel. Amint a 2. ábrán látható, a petefészekrákos betegektől műtét előtt gyűj- tött perifériás vérmintákból származó neutrophil granu- locyták FI-értéke (FI = 2,40 ± 0,96) szignifikánsan (p<0,01) alacsonyabb volt az egészséges kontrollszemé- lyek granulocytáinak FI-értékéhez (FI = 4,19 ± 1,58) képest. A petefészekrákos betegek posztoperatív vérmin- táiból izolált neutrophilek fagocitafunkciója (FI = 4,11 ± 0,74) szignifikánsan (p<0,01) emelkedett a preoperatív FI-értékekhez (FI = 2,40 ± 0,96) viszonyítva. Az egész- séges kontrollszemélyekből (FI = 4,19 ± 1,58) és a poszt operatív (FI = 4,11 ± 0,74) statusú betegekből izo- lált neutrophil granulocyták fagocitafunkciójának össze- hasonlítása esetén nem volt szignifikáns különbség (p = 1,000) a két csoport FI-értékei között.
Megbeszélés
Az ovariumcarcinoma a második leggyakoribb nőgyó- gyászati daganatos megbetegedés, melyből világszerte 225 500 új esetet diagnosztizálnak évente. Általában előrehaladott (FIGO III–IV.) stádiumban kerül felfede- zésre, amikor az 5 éves túlélés esélye már csak 25%-ra tehető [3]. Habár a petefészekrák rengeteg nőt érinthet, etiológiája még ma sem teljesen tisztázott; patogenezi-
sében az immunrendszer szerepét is feltételezik [6–8].
Kutatásunk során célunk az ovariumcarcinoma patoge- nezisének és az immunrendszerrel való kapcsolatának jobb megismerése volt.
Eredményeink szerint a petefészekrákos betegek pre- operatív vérmintáiból izolált perifériás monocyták és gra- nulocyták fagocitafunkciója szignifikánsan csökkent az egészséges kontrollszemélyek sejtjeinek fagocitafunkció- jához képest. Eredményünk egybevág a szakirodalom- ban található, emlőrákos betegek perifériás vérmintáiból izolált monocyták fagocitafunkcióját vizsgáló kutatással, melynek során a betegség súlyosságával összefüggően szignifikánsan csökkent funkciót tapasztaltak egészséges kontrollszemélyek monocytáinak fagocitózisaktivitásá- hoz képest [23]. Az előbbi adatok alapján elképzelhető, hogy ovariumcarcinoma esetében is összefüggés lehet a monocyták és/vagy a neutrophil granulocyták fagocita- funkciójának csökkenése és a betegség súlyossága között, azonban kutatásunk nem tette lehetővé a petefészekrák fagocitózisra gyakorolt hatásának stádium, differenciált- sági fok, illetve szövettani csoportok szerinti összehason- lítását, ezért ennek megállapítása további vizsgálatokat igényel.
Kutatásunk során a műtét utáni mintákból izolált mo- nocyták és granulocyták fagocitózisindexe szignifikánsan emelkedett a preoperatív értékekhez képest, ami ellen- tétben áll a szakirodalomban fellelhető, emlőrákos bete- gek perifériás monocytáinak fagocitafunkcióját vizsgáló kutatás eredményeivel: e szerint a monocyták fagocita- funkciója a műtéti terápiát követően tovább csökkent a diagnózis idején mért értékekhez képest [23]. A szakiro- dalomban számos, a különböző műtéti beavatkozások- nak az immunsejtek funkciójára gyakorolt hatását vizsgá- ló kutatás érhető el, melyek közül néhány a neutrophil granulocyták és/vagy monocyták fagocitafunkciójának vizsgálatára irányult. E kutatások legtöbbje szerint a sej- tek fagocitafunkciója csökkent vagy nem változott a mű- tét alatt, illetve az azt követő napokban vett vérminták- ból izolált sejtek esetén a műtétet megelőző időszakhoz képest [23–26]. Abdominalis hysterectomián [27], illet- ve egyéb nőgyógyászati műtéten átesett betegek periféri- ás neutrophil granulocytáinak fagocitafunkciója nem vál- tozott a műtétet követő 24 órában a műtétet megelőző- en mért adatokhoz képest [28]. Annak pontos megálla- pítása, hogy maga a műtéti beavatkozás hatással van-e a sejtek fagocitózisára, bár a szakirodalmi adatok alapján nem valószínű, további vizsgálatokat igényel jóindulatú nőgyógyászati daganatos betegség miatti hasi műtéten átesett betegek pre- és posztoperatív mintáiból történő fagocitafunkció-meghatározással. Az előbbi adatok alap- ján feltételezhető, hogy serosus epithelialis petefészekrá- kos betegek perifériás monocytáinak és neutrophil gra- nulocytáinak fagocitafunkciójának a posztoperatív idő- szakra történő szignifikáns növekedése az ovariumcarci- noma sajátossága lehet, mely a daganat immunrendszert befolyásoló képességére utalhat.
2. ábra A vizsgálatban részt vevő ovariumcarcinomás betegektől műtét előtt (preoperatív [n = 11]) és 7 nappal műtét után (posztope- ratív [n = 8]), valamint egészséges kontrollszemélyektől (n = 5) gyűjtött perifériás vérmintákból izolált neutrophil granulocyták fagocitózisindexe. Az ábrán fagocitózisindex-átlagértékek ± szórások (SD) vannak feltüntetve
*p<0,01 Ovariumcarcinomás betegek preoperatív granulocytái- nak és egészséges kontrollok granulocytáinak FI-értékeit össze- hasonlítva
#p<0,01 Ovariumcarcinomás betegek pre- és posztoperatívan izolált granulocytáinak FI-értékeit összehasonlítva
Mára már világossá vált, hogy a daganatokat mint szervhez hasonló struktúrákat kell értelmezni, melyek- ben tumorosan átalakult és a sztrómát alkotó, nem transzformálódott, tumorasszociált sejteknek a komplex kétirányú interakciói zajlanak [29]. A neoplasztikus sej- tek számos változást képesek indukálni a tumorstromá- ban, s ezáltal azt patológiás entitássá, „tumormikrokör- nyezetté” (tumor microenvironment – TME) konvertálják. A TME a tumorsejtek és a normális sejtek közötti interakciók hatására alakul ki, feladata pedig a tu- mor növekedésének és progressziójának segítése [30].
Egyéb daganatokhoz hasonlóan ovariumcarcinoma ese- tén is megfigyelték, hogy a TME a benne megjelenő im- munszuppresszív sejtek citokin- és kemokintermelése révén direkt elősegíti a tumorpatogenezist, és elnyomja a tumor ellen irányuló immunválaszt. A termelt faktorok (interleukin [IL]-4, IL-10, IL-13, vascularis endothelia- lis növekedési faktor, transzformáló növekedési faktor [TGF]-β, prosztaglandin E-2, metalloproteáz enzimek) által optimális környezetet teremt a tumor számára, ezál- tal a tumorsejtek az immunrendszert kikerülve prolife- rálhatnak, és a daganat idővel klinikailag is megjelenhet [1, 31]. A fentiek ismerete, valamint az ovariumcarcino- más betegek esetén a tumor eltávolítását követően mért fagocitózisindex-növekedés alapján feltételezhető, hogy a tumor vagy a TME olyan faktorokat termel, melyek a neutrophil granulocyták és monocyták fagocitafunkció- ját deprimálják, és a tumor eltávolítását követően e fakto- rok termelése csökken vagy megszűnik. A fagocitafunk- ciót csökkentő faktorok pontos azonosítása további kutatások célja lehet.
Petefészek-daganatos betegektől vett vérmintákból különböző citokineket vizsgálva megállapították, hogy epithelialis ovariumcarcinomás betegek CA-125-, IL-6-, IL-7-, IL-8-, IL-10- és TGF-β-szérumszintjei szignifi- kánsan magasabbak, mint az egészségesek, illetve a jóin- dulatú petefészek-daganatos betegek szérumában mért értékek [1, 32]. Kimutatták, hogy a szérumban mért emelkedett IL-6-, IL-8- és C-reaktívprotein (CRP)-szint epithelialis petefészekrák esetén rosszabb prognózissal korrelál [33]. Az előbbi adatok alapján feltételezhető, hogy ovariumcarcinoma esetén a betegek szérumában emelkedett szintű faktorok – köztük az IL-10, melynek szérumszintje petefészekrákos betegek debulking műté- tét követően szignifikánsan csökkent [1] – befolyásolhat- ják a monocyták, illetve a neutrophil granulocyták fago- citafunkcióját, ami magyarázhatja az általunk mért preoperatív csökkent fagocitózisindexeket, valamint azok szignifikáns növekedését a műtét utáni 7. napra.
Az ovariumcarcinoma konvencionális terápiájának ki- egészítéseként, a fentiek alapján számos lehetőség elkép- zelhető az immunrendszer befolyásolása által, mely tör- ténhet az ’immunosurveillance’ mechanizmus erősítésé- vel, illetve a protumorhatások antagonizálásával. A TME-ben lévő immunszuppresszív sejtek „átprogramo- zása” tumorellenes hatásúvá, segítheti a tumoros sejtek elpusztítását [31]. Napjainkban számos kutatás foglalko-
zik különböző célzott terápiás lehetőségek kidolgozásá- val [34]. Ennek kivitelezésére a jövőben optimális meg- oldásnak tűnik antitestek alkalmazása, melyek hathatnak közvetlenül a tumorsejteken, a tumor mikrokörnye- zetében vagy az immunválasz módosításán [35] – akár a monocyták és neutrophil granulocyták fagocitózisaktivi- tásának növelésén – keresztül. A petefészekrákos betegek szérumában emelkedettnek mért citokinek (CA125, IL-6, IL-7, IL-8, és IL-10 és TGF-β) antitestterápia cél- pontjai lehetnek.
Anyagi támogatás: A közlemény megírása, illetve a kap- csolódó kutatómunka során a szerzők anyagi támogatás- ban nem részesültek.
Szerzői munkamegosztás: K. A. R.: A kísérletek tervezése, kivitelezése, a közlemény megírása, statisztikai számítá- sok. P. L., L. L.: A kísérletek elvégzése. Sz. S.: A kísér- letek felügyelete, a kísérletek technikai kivitelezésének kidolgozása. P. R.: A vizsgálat felügyelete, a betegbevá- logatás felügyelete. L. R.: A vizsgálat és a kísérletek fel- ügyelete, a közlemény megírása. A cikk végleges változa- tát valamennyi szerző elolvasta és jóváhagyta.
Érdekeltségek: A szerzőknek nincsenek érdekeltségeik.
Köszönetnyilvánítás
A szerzők hálásan köszönik Kovács Mariann asszisztensnőnek a tech- nikai segítséget.
Irodalom
[1] Coosemans A, Decoene J, Baert T, et al. Immunosuppressive parameters in serum of ovarian cancer patients change during the disease course. Oncoimmunology 2016; 5: e1111505.
[2] Mayer C, Darb-Esfahani S, Meyer AS, et al. Neutrophil granulo- cytes in ovarian cancer – induction of epithelial-to-mesenchymal- transition and tumor cell migration. J Cancer 2016; 7: 546–554.
[3] Matulonis UA, Sood AK, Fallowfield L, et al. Ovarian cancer.
Nat Rev Dis Primers 2016; 2: 16061.
[4] Schorge JO, McCann C, Del Carmen MG. Surgical debulking of ovarian cancer: what difference does it make? Rev Obstet Gy- necol. 2010; 3: 111–117.
[5] Webber K, Friedlander M. Chemotherapy for epithelial ovarian, fallopian tube and primary peritoneal cancer. Best Pract Res Clin Obstet Gynaecol. 2017; 41: 126–138.
[6] Charbonneau B, Goode EL, Kalli KR, et al. The immune system in the pathogenesis of ovarian cancer. Crit Rev Immunol. 2013;
33: 137–164.
[7] Long Roche KC, Abu-Rustum NR, Nourmoussavi M, et al.
Risk-reducing salpingectomy: let us be opportunistic. Cancer 2017; 123: 1714–1720.
[8] Macciò A, Madeddu C. Inflammation and ovarian cancer. Cy- tokine 2012; 58: 133–147.
[9] Lim JJ, Grinstein S, Roth Z. Diversity and versatility of phagocy- tosis: roles in innate immunity, tissue remodeling, and homeosta- sis. Front Cell Infect Microbiol. 2017; 7: 191.
[10] Nicolás-Ávila JÁ, Adrover JM, Hidalgo A. Neutrophils in ho- meostasis, immunity, and cancer. Immunity 2017; 46: 15–28.
[11] Salavoura K, Kolialexi A, Tsangaris G, et al. Development of can- cer in patients with primary immunodeficiencies. Anticancer Res.
2008; 28: 1263–1269.
[12] Lança T, Silva-Santos B. The split nature of tumor-infiltrating leukocytes. Implications for cancer surveillance and immuno- therapy. Oncoimmunology 2012; 1: 717–725.
[13] Chen F, Hou M, Ye F, et al. Ovarian cancer cells induce periph- eral mature dendritic cells to differentiate into macrophagelike cells in vitro. Int J Gynecol Cancer 2009; 19: 1487–1493.
[14] Orfanelli T, Doulaveris G, Holcomb K, et al. Inhibition of au- tophagy in peripheral blood mononuclear cells by vaginal fluid from women with a malignant adnexal mass. Int J Cancer 2015;
137: 2879–2884.
[15] Ethier JL, Desautels DN, Templeton AJ, et al. Is the neutrophil- to-lymphocyte ratio prognostic of survival outcomes in gyneco- logic cancers? A systematic review and meta-analysis. Gynecol Oncol. 2017; 145: 584–594.
[16] Templeton AJ, McNamara MG, Šeruga B, et al. Prognostic role of neutrophil-to-lymphocyte ratio in solid tumors: a systematic review and meta-analysis. J Natl Cancer Inst. 2014; 106: dju124.
[17] Zhu JY, Liu CC, Wang L, et al. Peripheral blood lymphocyte-to- monocyte ratio as a prognostic factor in advanced epithelial ovar- ian cancer: a multicenter retrospective study. J Cancer 2017; 8:
737–743.
[18] Uribe-Querol E, Rosales C. Neutrophils in cancer: two sides of the same coin. J Immunol Res. 2015; 2015: 983698.
[19] Bøyum A. Isolation of lymphocytes, granulocytes and mac- rophages. Scand J Immunol. 1976; 5(Suppl 5): 9–15.
[20] Hed J, Hallden G, Johansson SG, et al. The use of fluorescence quenching in flow cytofluorometry to measure the attachment and ingestion phases in phagocytosis in peripheral blood without prior cell separation. J Immunol Methods 1987; 101: 119–125.
[21] Vrsalovic M, Vrsalovic MM, Presecki AV, et al. Modulating role of alcohol and acetaldehyde on neutrophil and monocyte func- tions in vitro. J Cardiovasc Pharmacol 2007; 50: 462–465.
[22] Busetto S, Trevisan E, Patriarca P, et al. A single-step, sensitive flow cytofluorometric assay for the simultaneous assessment of membrane-bound and ingested Candida albicans in phagocy- tosing neutrophils. Cytometry A 2004; 58: 201–206.
[23] Arsenijević N, Baskić D, Popović S, et al. Preliminary study of mononuclear phagocytosis during breast cancer therapy. J BUON 2005; 10: 105–109.
[24] Bowers TK, O’Flaherty J, Simmons RL, et al. Postsurgical granu- locyte dysfunction: studies in healthy kidney donors. J Lab Clin Med. 1977; 90: 720–727.
[25] Cullen BF, Hume RB, Chretien PB. Phagocytosis during general anesthesia in man. Anesth Analg. 1975; 54: 501–504.
[26] van Dijk WC, Verbrugh HA, van Rijswijk RE, et al. Neutrophil function, serum opsonic activity, and delayed hypersensitivity in surgical patients. Surgery 1982; 92: 21–29.
[27] El-Maallem H, Fletcher J. Effects of surgery on neutrophil gran- ulocyte function. Infect Immun. 1981; 32: 38–41.
[28] Khan FA, Kamal RS, Mithani CH, et al. Effect of general anaes- thesia and surgery on neutrophil function. Anaesthesia 1995; 50:
769–775.
[29] Laoui D, Van Overmeire E, Movahedi K, et al. Mononuclear phagocyte heterogeneity in cancer: different subsets and activa- tion states reaching out at the tumor site. Immunbiology 2011;
216: 1192–1202.
[30] Chen F, Zhuang X, Lin L, et al. New horizons in tumor micro- environment biology: challenges and opportunities. BMC Med.
2015; 13: 45.
[31] Chimal-Ramírez GK, Espinoza-Sánchez NA, Fuentes-Pananá EM. Protumor activities of the immune response: insights in the mechanisms of immunological shift, oncotraining, and oncopro- motion. J Oncol. 2013; 2013: 835956.
[32] Lambeck AJ, Crijns AP, Leffers N, et al. Serum cytokine profiling as a diagnostic and prognostic tool in ovarian cancer: a potential role for interleukin 7. Clin Cancer Res. 2007; 13: 2385–2391.
[33] Deme D, Telekes A. Prognostic importance of plasma C-reactive protein (CRP) in oncology. [A C-reaktív protein (CRP) plaz- maszintjének prognosztikai jelentősége az onkológiában.] Orv Hetil. 2017; 158: 243–256. [Hungarian]
[34] Grunewald T, Ledermann JA. Targeted therapies for ovarian cancer. Best Pract Res Clin Obstet Gynaecol. 2017; 41: 139–
152.
[35] Sütő G. The role of immune system in the control of cancer de- velopment and growth. [Hogyan ellenőrzi az immunrendszer a daganatok kialakulásának és növekedésének folyamatát?] Orv Hetil. 2016; 157(Suppl 2): 3–8. [Hungarian]
(Kovács Anna Rebeka dr., Debrecen, Nagyerdei krt. 98., 4032 e-mail: kovacsanna931@gmail.com)
Otthonról végezhető munka nyugdíjas háziorvosok részére!
Otthonról végezhető – kizárólag telefonhívást fogadó – ügyeleti munkára keresünk nyugdíjas háziorvost, ősztől.
Hosszútávú együttműködés, tisztességes mellékjövedelem.
Ha ismer valakit, akit érdekelhet, kérjük jelezze számára a lehetőséget!
Érdeklődés telefonon a +36 30 240 2424-es számon vagy írásban a rolltimeinventltd@gmail.com e-mail címen.
![2. ábra A vizsgálatban részt vevő ovariumcarcinomás betegektől műtét előtt (preoperatív [n = 11]) és 7 nappal műtét után (posztope-ratív [n = 8]), valamint egészséges kontrollszemélyektől (n = 5) gyűjtött perifériás vérmintákból izolált neutrophil granu](https://thumb-eu.123doks.com/thumbv2/9dokorg/1405055.118084/5.892.85.430.537.774/vizsgálatban-ovariumcarcinomás-betegektől-preoperatív-egészséges-kontrollszemélyektől-perifériás-vérmintákból.webp)