Adenoid cysticus emlő- és nyálmirigy carcinomák miRNS-expressziós és immunhisztokémiai vizsgálata
Doktori értekezés
dr. Virágh-Kiss Orsolya
Semmelweis Egyetem
Patológiai Orvostudományok Doktori Iskola
Témavezető: Dr. Kulka Janina, Ph.D., egyetemi tanár
Hivatalos bírálók: Dr. Méhes Gábor, Ph.D., intézetvezető egyetemi docens Dr. Sebestyén Anna, Ph.D., tudományos főmunkatárs Szigorlati bizottság elnöke:
Dr. Fehér Erzsébet, D.Sc., professor emerita Szigorlati bizottság tagjai:
Dr. Nagy Péter, D.Sc., egyetemi tanár
Dr. Kovács Ilona, Ph.D., osztályvezető főorvos
Budapest 2015
TARTALOMJEGYZÉK
RÖVIDÍTÉSEK JEGYZÉKE 3
1. BEVEZETÉS 6
1.1. Adenoid cysticus carcinoma (ACC) 6
1.1.1. Az ACC szövettana, patológiai diagnosztikája 6
1.1.2. Az emlőből kiinduló ACC és a tripla negatív emlőtumorok 9
1.1.3. Az ACC prognózisa és klinikopatológiája 10
1.1.4. Az ACC molekuláris és genetikai jellegzetességei 11
1.1.5. Az ACC terápiás lehetőségei az eddig ismert hisztopatológiai, molekuláris és
genetikai jellegzetességek tükrében 16
1.2. A mikroRNS-ek 18
1.2.1. A mikroRNS-ekről általában 18
1.2.2. A miRNS-ek nevezéktana, miRNS családok 20
1.2.3. A miRNS-ek szerepe élettani és kórélettani folyamatokban 21
1.2.4. miRNS-ek és ACC 22
2. CÉLKITŰZÉSEK 24
3. ANYAGOK ÉS MÓDSZEREK 25
3.1. Kiindulási vizsgálat: miRNS expressziós mintázat feltérképezése 25 3.2. Szűkített számú miRNS-ek expressziójának vizsgálata és az általuk potenciálisan
regulált fehérjék mennyiségi meghatározása 29
3.2.1. Célgének keresése 35
3.2.2. Fehérje szintű vizsgálatok 35
3.2.3. Túlélési adatok 39
4. EREDMÉNYEK 40
4.1. Bevezető vizsgálatunk eredményei 40
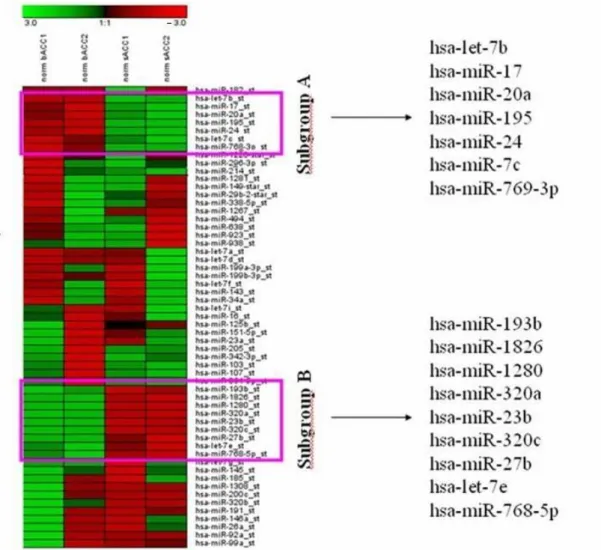
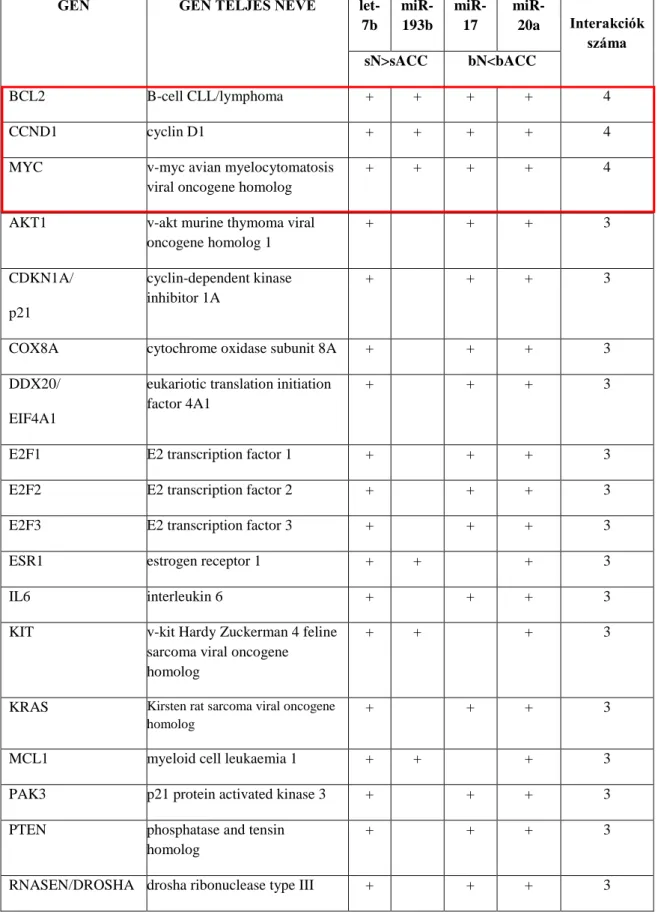
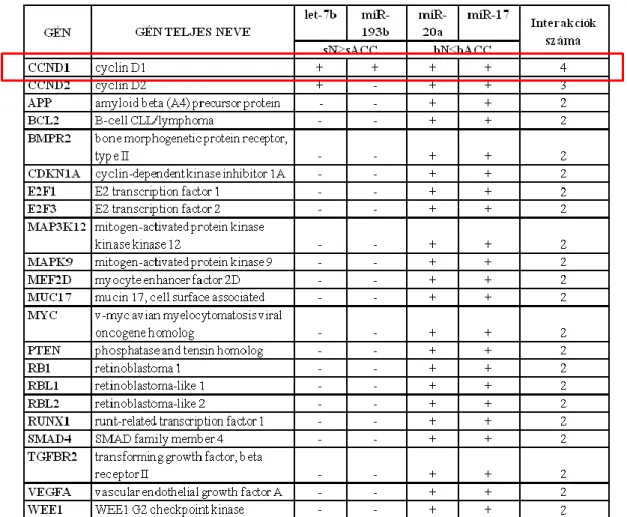
4.1.1. miRNS szelekció Affymetrix® Gene Chip® alkalmazásával 40 4.1.2. Célgén – miRNS interakciós vizsgálat IPA® analízissel 41 4.1.3. Hierarchizált cluster analízis alcsoportok meghatározására 44 4.1.4. Potenciális célgének azonosítása miRecords adatbázis segítségével 46 4.2. Magasabb esetszámon végzett vizsgálataink eredményei 51 4.2.1. Az egyes vizsgálati csoportok miRNS expressziójának összehasonlítása 52 4.2.1.1. bACC esetek és normál emlőszövetek miRNS mintázatának összehasonlítása 52
2
4.2.1.2. A sACC esetek és kontrolljaik miRNS expressziójának összehasonlítása 54 4.2.1.3. bACC és sACC miRNS expressziós mintázatának összehasonlítása 55 4.2.1.4. Normál emlő és nyálmirigy szövetek miRNS mintázatának összehasonlítása 55 4.2.2. A miRNS-célgén kapcsolat további vizsgálata, a célgének szűkítése 58
4.2.3. Immunhisztokémiai vizsgálatok eredményei 64
4.2.3.1. cyclin D1 és Bcl-2 kimutatása 64
4.2.3.2. ER, PgR, HER2 és Ki67 immunhisztokémiai reakciók eredményei 68
4.3. Túlélési adatok 71
5. MEGBESZÉLÉS 72
6. KÖVETKEZTETÉSEK 80
7. ÖSSZEFOGLALÁS 82
8. SUMMARY 83
9. IRODALOMJEGYZÉK 84
10. SAJÁT PUBLIKÁCIÓK JEGYZÉKE (A DISSZERTÁCIÓHOZ KAPCSOLÓDÓ
ABSZTRAKTOK) 115
11. SAJÁT PUBLIKÁCIÓK JEGYZÉKE (A DISSZERTÁCIÓTÓL FÜGGETLEN
KÖZLEMÉNYEK) 116
12. KÖSZÖNETNYILVÁNÍTÁS 117
FÜGGELÉK 119
RÖVIDÍTÉSEK JEGYZÉKE
3’-UTR/5’-UTR: át nem íródó régió (untranslated region)
5-FU: 5-fluorouracil
ACC: adenoid cysticus carcinoma (adenoid cystic carcinoma) AJCC: a ráktípusok stádiumainak meghatározásával foglalkozó
amerikai bizottság (American Joint Committee on Cancer)
AKT: v-akt rágcsáló thymoma virális onkogén homológ 1 ANOVA: variancia analízis (Analysis of variance)
bACC: emlőből kiinduló adenoid cysticus carcinoma (breast- derived adenoid cystic carcinoma/)
BCL2: B-sejtes CLL/lymphoma 2 (apoptózist gátló molekula)
BCL9: B-sejtes CLL/lymphoma 9
BCR/ABL: fúziós fehérje a Philadelphia kromoszómán a 22-es és 9- es kromoszómák transzlokációjának következtében (breakpoint cluster region/ ABL proto-oncogene 1) BIM/BCL2L11: BCL2-szerű 11 (szerin-treonin kináz)
BMPR2: csontvelő morfogenetikus protein receptor,2-es típus bN: kontroll emlőszövet (breast – normal)
CCND1: cyclin D1
CDC25A: sejtosztódás ciklus 25A (foszfatáz) CDH1/ECAD cadherin 1/ E-kadherin (E-cadherin)
CDK6: cyclin-dependens kináz 6 (cyclin-dependent kinase) cDNS: komplementer DNS (mRNS-ről szintetizált DNS) CGH: komparatív genomiális hibridizáció (comparative
genomic hybridization)
CK: citokeratin (cytokeratin)
c-KIT/KIT: v-kit macska sarcoma vírus onkogén homológ
c-Myb: v-myb madár myeloblastosis vírális onkogén homológ
CNN2: calponin 2
Ct: küszöb ciklusszám, vagy áttörési pont a fluoreszcens jel detektálása szempontjából kvantitatív PCR esetén DGCR8: DiGeorge syndroma kritikus régió gén 8
mikroprocesszor komplex alegység (diGeorge syndrome critical region 8)
DNS: dezoxiribonukleinsav
ER/ESR1: ösztrogén receptor-1
ERBB1/EGFR: epidermális növekedési faktor receptor (epidermal growth factor receptor)
FFPE: formalin-fixált, paraffinba ágyazott (formalin-fixed, paraffin-embedded)
FGFR2: fibroblaszt növekedési faktor receptor 2
FOXO1: a forkhead domént tartalmazó transzkripciós faktorok családjának tagja (forkhead box O1)
HE hematoxylin-eosin
HER-
2/neu/HER2/ERBB2:
humán epidermalis növekedési faktor receptor 2 (erb-b2 receptor tyrosine kinase 2)
magas mobilitású csoport AT-hurok 2 (high mobility
4
IGFR1: inzulin-szerű növekedési faktor receptor 1 (insulin-like growth factor type 1 receptor)
IL-8: interleukin 8
IPA®: Ingenuity útvonal analízis (Ingenuity Pathway Analysis®)
JAK1 Janus kináz 1 (Janus kinase 1)
Ki-67: sejtosztódással társított magi fehérje
KISS1R: (a KiSS-1 metasztázis-szupresszor gén termékének, a metastatinnak a receptora)
KRAS: Kirsten patkány sarcoma virális onkogén homológ LAMTOR3: késői endosomális/lysosomális adaptor, MAPK és
MTOR aktivátor 3
MAP3K12: mitogén-aktivált protein kináz kináz kináz 12 MAPK1/ERK: mitogén-aktivált protein kináz 1
MEF2D: myocytafokozó faktor 2D (sejtek differenciációjában részt vevő transzkripciós faktor)
miRNS/miR: mikro-RNS
MTOR rapamycin mechanikus targetje (szerin/treonin kináz)
MTX: metothrexát
MYB: v-myb madár myeloblastosis virális onkogén homológ, transzkripciós faktor
MYC: v-myc madár myelocytomatosis virális onkogén homológ, transzkripciós faktor
NFIB: magi faktor I/B
NOTCH1: notch 1 (transzmembrán fehérje) NOTCH2: notch 2 (transzmembrán fehérje)
p53: protein 53
PACT/PRKRA: az interferon által indukált protein kináz protein aktivátora
PgR: progeszteron receptor
PIK3CA/PI3K: foszfatidylinozitol-4,5-biszfoszfát 3- kinázkatalítikusalegység alpha
PLAU: plazminogén aktivátor, urokináz (szerin proteáz) PRIM1: primáz, DNS, polypeptid 1 (primerekként funkcionáló
RNS-eket szintetizál DNS megkettőződés során) PTEN: foszfatázés tenzin homológ (tumor szupresszor) RET: ret protoonkogén (receptor tirozin kináz)
RNS ribonukleinsav
rRNS: riboszomális RNS
qPCR: kvantitatív/valós idejű polimeráz láncreakció (quantitative/real time polimerase chain reaction) RUNX1: a CBF transzkripciós faktor alfa alegysége (runt-related
transcription factor 1)
sACC: nyálmirigyből kiinduló adenoid cysticus carcinoma (salivary gland-derived adenoid cystic carcinoma)
sN: normál/kontroll nyálmirigy szövet
SNAIL2: snail cink-ujj fehérjék családjába tartozó transzkripciós faktor
snoRNA kis nukleoláris RNS (small nucleolar ribonucleic acid/RNA)
STK11: szerin/treonin kináz 11
TNBC: tripla-negatív emlőrák (triple-negative breast cancer)
TNFα: tumor nekrózis faktor alfa
TP53: tumor protein p53
TRBP: transz-aktivációs válasz serkentő (TAR) RNS-hez kötődő fehérje
tRNS: transzfer RNS
VEGFA: vaszkuláris endothelialis növekedési faktor A (vascular endothelial growth factor A)
6 1. BEVEZETÉS
1.1. Adenoid cysticus carcinoma (ACC)
Az ACC a fej-nyak régió malignomáinak csupán kevesebb mint 5%-ában előforduló daganattípusDodd,2006;Gomez,2008
, azonban a nyálmirigyeket érintő rosszindulatú daganatok között viszonylag gyakori elváltozásnak számít. Átlagosan minden negyedik nagy nyálmirigyből kiindulóRenehan,1996
és szinte minden második kis nyálmirigyet érintő rosszindulatú daganat ACCAnderson,1995, mely leggyakrabban a fültőmirigyet, az állkapocs alatti mirigyeket, valamint a szájpad területén található mirigyeket érintiMarchio,2010. Az ACC egyéb szervek szeromucinózus mirigyeiből is kiindulhat: megjelenhet a bőrbenGray,1963, az emlőbenWeitzner,1970, előfordulhat a könnymirigyekbenPaulino,1999, a prosztatábanNkanza,1988
, vaginalisStefani,1970, valamint cervikális mirigyekbenTchertkoff,1962, valamint érintheti a hallójáratokatMashkevich,2006, a légcsövetHajdu,1970, a tüdőtReid,1952, illetve akár a nyelőcsövetKitada,1997;Tonini,1995
is. Ritka esetekben petefészek, pajzsmirigy, illetve lágyrész kiindulású ACC is előfordulLi,2012.
1.1.1. Az ACC szövettana, patológiai diagnosztikája
Az ACC hisztomorfológiailag igen változatos képet mutat amellett, hogy a sejtek viszonylag egységes megjelenésűek. Szövettani képére kettős sejtpopuláció jellemző:
myoepithelialis (basalis) és ductalis (luminalis) sejtek egyaránt megtalálhatóak benne, melyek szorosan egymás mellé rendeződve viszonylag egységes megjelenésű csoportokat alkotnak.
Az egyes sejtcsoportok között hyalinnal kitöltött terek láthatóak, melyek környezetében az alacsony mitotikus aktivitást mutató, szegényes citoplazmával rendelkező tumorsejtek gyakran paliszád-szerű elrendeződést mutatnak. A sejtcsoportok leggyakrabban cribriform megjelenést öltenek, azonban tubularis és szolid mintázatot is mutathatnak. A cribriform mintázatot sokszor „svájci sajt” („Swiss cheese”) jelzővel is illetikTauxe,1962. Az 1. és 2.
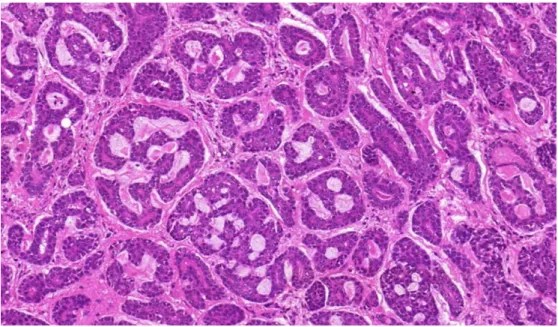
ábrákon egy emlő és egy nyálmirigy eredetű ACC mikroszkópos képe látható.
1. ábra: Emlőből kiinduló Grade II ACC szövettani képe (HE, 10x)
2. ábra: Nyálmirigy eredetű Grade II ACC szövettani képe (HE, 10x)
A daganat cribriform megjelenésű formáját korábban – cilinderekre emlékeztető daganatos stromája miatt – cylindromának nevezték, mely az összetéveszthetőségig hasonlít a bőrből kiinduló cylindroma szöveti képéhez. A megnevezés Theodor Billroth, XIX. századi sebészorvos nevéhez fűződikBillroth,1859., azonban a daganat első leírói az 1850-es években Robin, Lorain és Laboulbene voltakMehta,2013. Billroth nevéhez az elváltozás kiújulásra való fokozott hajlamának felismerése fűzhető, ennek ellenére azonban az ACC-t sokáig benignus tumornak tartották. Ezt a tévhitet az 1940-es években Quattlebaum, Dockerty és Mayo cáfolták megQuattlebaum,1946
.
8
A nyálmirigy eredetű ACC (salivary gland-derived adenoid cystic carcinoma/sACC) szövettani grádusát egy három pontos skálán határozzuk meg, melynek alapját a daganaton belül előforduló, eltérő morfológiát mutató területek százalékos megoszlása adja. A jól differenciált (grade I) ACC-k közé a javarészt tubularis és cribriform megjelenésű területeket tartalmazó daganatok sorolhatóak, melyekben a szolid területek aránya nem haladja meg a 30%-ot. Közepesen differenciált (grade II) ACC-k közé tartoznak a 30 és 70% közötti szolid komponenst tartalmazó tumorok, míg rosszul differenciált (grade III) daganatok esetében 70% feletti szolid komponenst láthatunkBatsakis,1990;Szanto,1984. Rosszul differenciált ACC esetén szövettanilag szembetűnően nagyobb, hyperchromatikus, kifejezett pleomorfiát mutató sejtek, valamint magas osztódási arány figyelhető meg. Ezek az esetek rendszerint kedvezőtlen prognózissal társulnakMitani,2011;Shin,2002
.
Az emlő eredetű ACC (breast-derived adenoid cystic carcinoma/bACC) esetében szintén a nyálmirigy kiindulású forma gradálási rendszerét, a morfológiai megjelenést alapul vevő osztályozást alkalmazzuk.
1.1.2. Az emlőből kiinduló ACC és a tripla negatív emlőtumorok
Az bACC egy igen ritkán, a rosszindulatú emlődaganatok kevesebb mint 0,1%-ában előforduló daganatGlazebrook,2010, mely az ún. „basal-like”(bazális típusú) molekuláris alcsoportba tartozik. Az emlő malignómáinak molekuláris felosztása Prat, Perou és Sorlie nevéhez köthető, akik génexpressziós mintázat alapján új csoportosítást alkottakPerou,2000;Sorlie,2001
. Ennek alapján a mindennapi diagnosztikában immunhisztokémiai reakciókkal meghatározható fehérje expressziós mintázaton alapuló csoportosítást használunk. Ennek a „surrogate” osztályozásnak az alapját a daganatok hormonreceptor- expressziós (ösztrogén, és progeszteron receptor /ER, PgR/), valamint HER2- génamplifikációs és/vagy Her2-fehérje expressziós státusza adja. A hormonreceptor pozitív emlőcarcinomák luminalis típusúnak nevezendők, melyek proliferációs aktivitásuktól függően további kétcsoportra oszthatóak. A luminalis A csoport tagjai alacsony (14% alatti), a luminalis B csoportba tartozók magas (14% feletti) Ki67-expressziót mutatnakPrat,2013. A hormonreceptor expressziót nem mutató emlőrákok tartozhatnak a HER2-pozitív (HER2+), vagy a „basal-like” csoportba. Előbbi tagjai HER2-génamplifikációt mutatnak és fokozott mértékben expresszálják a Her2 fehérjét. Utóbbiak génexpressziós mintázatuk alapján sem ER, PgR kifejeződést, sem HER2 génamplifikációt nem mutatnak, azonban legalább egy basalis típusú citokeratint expresszálnak (CK5/6, CK14, vagy CK17)Perou,2000;Sorlie,2001;Sorlie,2003
. Fehérje mintázatuk alapján ezek az emlődaganatok atripla-negatív (triple-negative breast cancer/TNBC) csoportba tartoznak. A „basal-like” csoporton belül génexpressziós mintázatuk alapján elkülöníthetők továbbá a „claudin-low” típusú emlőcarcinomák, melyeket epithelialis-mesenchymalis átalakulással (epithelial-mesenchymal transition/EMT) összefüggésbe hozható gének expressziója és daganatos őssejtekre jellemző genotípus jellemezCreighton,2009
.
Az egyes alcsoportok ugyan klinikopatológiailag igen heterogén csoportokat alkotnak, általánosságban elmondható, hogy a legrosszabb klinikai kimenetellel leggyakrabban a tripla- negatív emlőcarcinomák rendelkeznek, melyek tagjait terápiára fokozottan rezisztens sejtek jellemzik és egyelőre célzott kezelési lehetőség sem áll rendelkezésreDent,2007;Prat,2014
.
10
1.1.3. Az ACC prognózisa és klinikopatológiája
Az egyes szervekből kiinduló ACC mikroszkópos képe az összetéveszthetőségig megegyezik (1. és 2. ábra), ezzel ellentétben kiindulási szervtől függően igen változatos klinikai viselkedést mutathat. A nem nyálmirigyekből kiinduló ACC-k prognosztikai jellegzetességeiről ritka előfordulásuk miatt igen kevés adattal rendelkezünk, azt azonban tudjuk, hogy a legrosszabb lefolyás általában a cervixből, a könnymirigyekből, illetve a tüdőből kiinduló ACC-k esetében tapasztalhatóElhassani,2009;Font,1998;Li,2012;Ro,1987
.
Az bACC az emlő rosszindulatú daganatainak körében speciális helyet foglal el:
génexpressziós mintázata alapján ugyan a „basal-like” csoportba tartozik, prognózisa – ellentétben az erre a csoportra egyébként jellemző kedvezőtlen biológiai viselkedéssel – igen jó: sok éves követési időszak elteltével is 90% feletti teljes túlélés jellemziGhabach,2010
. Ezzel szemben a sACC kedvezőtlen klinikai viselkedést mutat: a korai túlélési adatok kedvező volta ellenére (90% feletti túlélési arány), 5 év elteltével már 65-68% közöttiCiccolallo,2009;Lin,2012
, ennél is hosszabb távú követési idő elteltével a pedig már csupán 50-60% közötti túlélési arányszámmal találkozhatunkAmpil,1987;Lin,2012. A sACC esetek lefolyása a primer tumor pontos lokalizációjától is függ: a kis nyálmirigyekből kiinduló formák általában kedvezőtlenebbül viselkednek, mint nagy nyálmirigyekből kiinduló társaikLin,2012.
Az bACCkiváló prognózisához feltehetően hozzájárul, hogy igen ritkán képez távoli áttétet (az esetek 91-96%-ában a tumor a kiindulási helyre lokalizálódikGhabach,2010;Li,2012
), valamint hogy igen magas arányban (mintegy 80%-ban) képvisel alacsony szövettani grádustLi,2012. Mindezek ellenére egyes magas grádusú, távoli áttétet képző bACC-k esetében is megfigyelhető kedvező klinikai kimenetelMillar,2004;Vranic,2007
.
Ugyanakkor a sACC sokszor sokszor sokáig tünetmentesen, rejtett lokalizációban progrediál, így az esetek többségében csupán előrehaladott stádiumban kerül felismerésre, mely miatt operálhatósága is sokszor kérdéses. A sACC esetek nagy részére jellemző perineurális invázió, valamint távoli áttétek képzésére és recidívára való fokozott hajlam szintén kedvezőtlenül befolyásolja a prognózistMarchio,2010
.
A betegek korát illetően bACC és sACC esetek között számottevő eltérés nem azonosítható: szinte bármely életkorban manifesztálódhatnak (sACC: 21-89 év közöttiekben, bACC: 33-97 év közöttiekben), leggyakrabban azonban a bACC és sACC is 50-60 éves kor körül jelenik meg. Nyálmirigy eredetű ACC-k nők és férfiak körében közel azonos arányban
fordulnak elő, míg a bACC főleg nőkben fordul elő – hasonlóan a többi típusú rosszindulatúemlődaganathozGhabach,2010;Sur,1997;Triantafillidou,2006. Regionális nyirokcsomó áttétek képzése sem bACC, sem sACC daganatokra nem jellemzőArpino,2002;van der Wal,2002
, ezek leggyakrabban a tüdő, valamint bronchus eredetű tumoroknál figyelhetők megLi,2012.
1.1.4. Az ACC molekuláris és genetikai jellegzetességei
Mivel a bACC esetek többsége a bazális/tripla-negatív emlőtumorok közé sorolható, több kutatócsoport vizsgálta a nyálmirigyekből kiinduló ACC-k ER, PgR és HER2 státuszát.
Ezzel kapcsolatban ellentmondásos eredményekkel találkozhatunk: míg egyes vizsgálatok alátámasztották, hogy a sACC esetek az emlő eredetű formákhoz hasonlóan mindkét hormonreceptor (ER, PgR) tekintetében negatívakMarcinow,2014
, más eredmények szerint azonban előfordulhatnak közöttük ER, vagy PgR receptort expresszáló formákOzono,1992;Shick,1995
. A sACC esetek HER2/Her2-státuszára vonatkozóan hasonló ellentmondásokba ütközhetünk: fehérjeexpressziós és in situ hibridizációs vizsgálatok
egyaránt változó eredményeket
hoztakCho,1999;Clauditz,2011;Dori,2002;Gibbons,2001;Glisson,2004;Karja,1994;Kernohan,1991;Seethala,2011
. Az irodalmi adatok szerint főleg a tubularis és cribriform megjelenésű sACC daganatok expresszálnak Her2-tKusafuka,1991;Shintani,1995
.
ACC-k egy részében kimutatták az ErbB1 (EGFR/epidermal growth factor receptor/növekedési faktor receptor) expresszióját is, mely a sejtek proliferációjának, motilitásának, adhéziójának és inváziójának szabályozásában, valamint angiogenetikus folyamatokban és a sejtek túlélésében szerepet játszó molekula. Az EGFR kifejeződése sACC esetekben – hasonlóan a Her2 fehérje expressziójához – az egyes tanulmányok szerint igen változó arányú (2 és 85% közöttiChen,2001;Gibbons,2001;Kusafuka,1991;Shintani,1995;Vered,2002
), melynek oka feltehetően az egyes vizsgálati módszerek eltérő specificitásában és szenzitivitásában rejlikVered,2002.
Az ACC-k proliferációs aktivitása és prognózisa között – számos más daganatfajtához hasonlóan – egyenes arányú összefüggés figyelhető meg. sACC esetek Ki-67 expressziója egyes tanulmányok alapján igen változó (12-100%-os)Alves,2004;Carlinfante,2005;Lazzaro,2000
. Az
12
gyakran rosszul differenciált (szolid) megjelenésselAlves,2004;Cho,1999;Nordgard,1997
és rosszabb klinikai kimenetellel társulnakNorberg-Spaak,2000;Triantafillidou,2006;Wegner,2007
. Mindezek alapján a Ki- 67 expresszió meghatározása segítségünkre lehet az agresszívebb kórlefolyást mutató sACC esetek elkülönítésébenLazzaro,2000;Norberg-Spaak,2000
. Az igen agresszív megjelenést mutató daganatokon kívül mind az emlőből, mind a nyálmirigyekből kiinduló ACC esetekre egyaránt alacsony Ki67 expresszió jellemzőMarcinow,2014;Trendell-Smith,1999
.
Az ACC fontos differenciáldiagnosztikai markerének számít a c-KIT proto-onkogén, melynek fokozott expressziója fej-nyak régió területén található nyálmirigyekből kiinduló ACC-k mintegy 80-100%-ábanEdwards,2003;Vila,2009;Weigelt,2008
, az emlőből kiinduló formák pedig közel 100%-ában kimutatott.Crisi,2005;Mastropasqua,2005
. A normál szövetekben sejtnövekedést, differenciálódási folyamatokat és sejtmigrációt szabályozó c-KITWoodburn,1999
–ellentétben a Her2 fehérjével – leggyakrabban a szolid megjelenésű formával asszociálódikHolst,1999;Jeng,2000
. KIT mutációt ugyan sACC esetekben leírtak márVila,2009, azonban bACC esetekben jelen tudásunk szerint még nem sikerült igazolniWetterskog,2013
. Eszerint a c-KIT fehérje fokozott expressziójánakoka a KIT gén mutációján felül más is lehetHolst,1999.
ACC esetek egy részében detektálható a MYB transzkripciós faktor fokozott expressziója is, mely gyakran társul rossz prognózissal sACC-ban szenvedő betegek körébenMitani,2011
. A MYB fokozott expressziójának egyik oka mind bACC, mind sACC esetekben egy nemrégiben leírt mutációPersson,2009
, melyről Marta Persson munkacsoportja számolt be elsőként. A mutáció következtében a 6-os kromoszóma hosszú karjának 22-23-as régiója, valamint 9-es kromoszóma rövid karjának 14-es régiója között transzlokáció alakul ki (t(6;9)(q22-23;p23-24), mely az érintett régiókban lokalizált MYB és NFIB-t (nuclear transcription factor I/B) gének közötti fúzióhoz vezet. Az onkogén elváltozás az ACC-k patogenezisében kulcsfontosságú szerepet játszik és jelen tudásunk szerint az ACC-k eddig ismert egyetlen visszatérő mutációjának számítBrill,2011;Persson,2009;Wetterskog,2012. Gao és munkacsoportja által végzett tanulmányokban a forszírozott MYB/NFIB expresszió sACC esetekben a sejtek morfológiájának és a sejtek adhéziós tulajdonságainak megváltozásához vezetGao,2014. Ugyan az ACC-kben gyakran megfigyelhető fokozott MYB expresszió bizonyos esetekben a MYB/NFIB gének közötti fúzió miatt jön létre, számos esetben annak hiányában is kimutathatóPersson,2009;Wetterskog,2012. Ezáltal feltehetően egyéb mechanizmusok is közrejátszanak a magas MYB expresszió kialakulásában.
A különböző szervekből kiinduló ACC esetekben egyaránt megfigyelhető, MYB/NFIB fúziós gént kialakító transzlokáción kívül egyes kutatócsoportok sACC esetekben jelen lévő, további transzlokációk jelenlétét is igazolták (1. táblázat). Ugyan ezen felfedezések lényegesek lehetnek sACC esetek molekuláris jellegzetességeinek megismerésében, az egyes munkacsoportok által közölt eltérések csupán egy-egy különálló ACC esetben igazolódtak, melyeket más tanulmányok mind ez idáig nem támasztottak alá.
14
1. táblázat: sACC-ban, csupán egyedi esetekben igazolt kromoszómális transzlokációk és leíróik listája.
Transzlokáció megnevezése Irodalmi hivatkozás
t(6;12)(p21;q13) MartinsMartins,2001
t(6;14)(q22;q11) BellBell,2007
t(6;9)(q23eq25;p22ep24) NordkvistNordkvist,1994
, StenmanStenman,1986
t(6;15)(q25;q15) el-Naggarel-Naggar,1999
t(1;9)(q21;p21e22)
NordkvistNordkvist,1994
der(9)i(9)(q10)inv(9)(q12q13) der(X)t(X;9)(p21;p22e23)
Rabban munkacsoportja által végzett tanulmányban a fent említett transzlokációkon felül további, egyéb mutációs mechanizmusokat is leírtak. Ezek között említhetjük a 22q, 19p13.3, a 11q13, a 12p13 és a 16q24 lókuszok funkciónyeréses, valamint a 9p13, 10p11, 14q11, 1p12, 2p11, 5q13, 1p36, 2q21, 4p11, 7p11, 8p23, 10q11, 15p11 és 21p11 kromoszómák funkcióvesztéses mutációitVranic,2013
. A funkciónyerő mutációk területein a CNN2, STK11, KISS1R, valamint CCND1 géneket kódoló szakaszok találhatóak, a funkcióvesztéssel járó mutációk helyén a BCL9, NOTCH2, valamint RET gének kódoló szakaszai detektálhatók. A 16q régió funkciónyerését és a 2q, valamint az 5p régiók funkcióvesztését bACC esetekben Fulford, Reis-Filho és Lakhani megfigyelései támogatjákMarchio,2010
. Ugyanez a munkacsoport nyálmirigy eredetű ACC esetekben abACC daganatokban megfigyeltekkel elentétben a 8p és 14q régiók funkciónyeréséről számolt beMarchio,2010
. Reis-Filho és munkatársai – bACC esetekkel megegyező módon – sACC esetekben is kimutatták a 16q kromoszomális régiók funkciónyerését. Az 1p32-36 és a 9p régiókat érintő funkcióvesztést nyálmirigy eredetű ACC esetekben is alátámasztottákMark,1996;Rao,2008
, az 1p32-36 funkciónyeréses mutációját pedig összefüggésbe hozták a sACC esetek rossz klinikai kimenetelévelRao,2008.
ACC esetekben a tumor szupresszorként ismert p53 gén mutációjával és az általa kódolt, megváltozott fehérje expressziójával kapcsolatban kevés adattal rendelkezünk. A sACC esetek egy részében kimutatható p53 mutáció nagyobb gyakorisággal fordul elő rosszul differenciált esetekben, mint jól differenciált sACC tumorokban és ezek a mutációk gyakran figyelhetők meg rekurráló ACC esetekben. Mindezek alapján a p53 expressziójának, valamint
a TP53 mutációjának vizsgálata hasznos prognosztikus marker sACC tumorokbanKiyoshima,2001;Papadaki,1996;Preisegger,2001;Yamamoto,1998
.
A szájüreg területéről kiinduló ACC-k esetében szintén rossz prognosztikai jelnek számít az alacsony E-cadherin expresszió, mely összefüggésbe hozható a fokozott metastasis képzésselFranchi,1999
. Az E-cadherin csökkent expressziójának oka Ge és munkatársai szerint a CDH1 gén metiláltsága következtében alakul kiGe,2012, amely sACC esetekben perineurális invázióhoz, valamint regionális és távoli áttétképzéshez is hozzájárul.
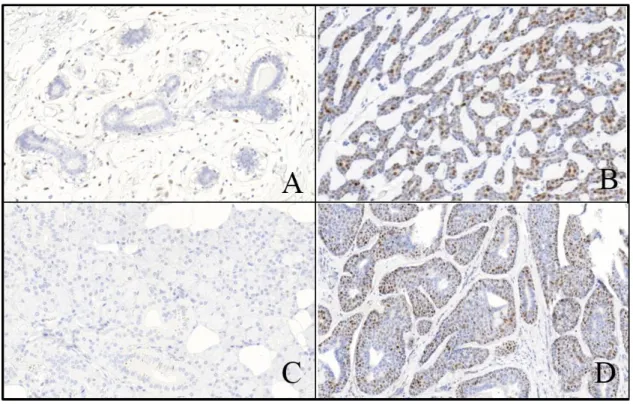
Nyálmirigy eredetű ACC-k fokozott cyclin D1 expressziójáról mind a fej-nyak, mind a tüdő régióból kiinduló daganatok esetében beszámoltak márBernheim,2008;Greer,2007;Sequeiros Santiago,2004;Wegner,2007
. A sACC esetekben kimutatható elváltozás összefüggést mutat ezen daganatok magas proliferácós aktivitásávalShintani,2000. Ellentétben a nagy arányban kimutatható fokozott fehérjeexpresszióval, a cyclin D1 -et kódoló gén, a CCND1 amplifikációja sACC esetek csupán igen kis százalékában (5-33%) mutatható kiGreer,2007;Sequeiros Santiago,2004, így a fehérje fokozott kifejeződésének oka más mechanizmusokban keresendőGreer,2007. Emlő eredetű ACC turmorokban cyclin D1 expresszióra vonatkozó irodalmi adat jelen tudásunk szerint nincsen.
Az apoptózist szabályozó Bcl-2 (B-cell CLL/lymphoma) protoonkogén nyálmirigy eredetű ACC esetekben fokozott expressziót mutat, mely a rosszul differenciált sACC esetekben kifejezetten magas százalékban detektálhatóAl-Rawi,2010
. A sACC tumorok hisztopatológiai jellegzetességeiktől függetlenül igen magas százalékban expresszálják a Bcl- 2 fehérjétBell,2011;Norberg-Spaak,2000. Emlőből származó ACC esetek Bcl-2 expressziójával kapcsolatban tudomásunk szerint még nem közöltek eredményeket.
Egy bACC-vel kacsolatos esettanulmányban a PIK3CA (PIK3K) és PTEN gének mutációjáról számolnak beVranic,2007
. Egy munkacsoport nyálmirigy eredetű ACC-k esetében is kimutatta a PIK3CA gén mutációjátStephens,2013, PTEN mutációról azonban sACC esetekben nem számol be az irodalom. Ezzel szemben a PTEN génexpressziót több kutatócsoport is kiterjedten vizsgálta, főként annak progresszióra, valamint klinikopatológiai jellemzőkre való hatásaitChen,2013;Kou,2013. Egy munkacsoport a PTEN epigenetikai módosulásairól is beszámolt, melynek jelentőségét az ACC korai felismerésében láttákFan,2010.
A fent ismertetett jellegzetességek ugyan hozzájárulhatnak az ACC egyes szervekből
16
sikerült összefüggést igazolni a molekuláris, vagy genetikai eltérés és a daganat prognózisa között. Feltehetően további mechanizmusok kulcsfontosságú szerepét is vizsgálnunk kell:
akár összetett jelátviteli útvonalak (migráció, proliferáció, valamint immunválasz) szabályozási folyamataitWeigelt,2008, akár epigenetikai mechanizmusokat figyelembe véve.
1.1.5. Az ACC terápiás lehetőségei az eddig ismert hisztopatológiai, molekuláris és genetikai jellegzetességek tükrében
Eltérő klinikopatológiai jellegzetességeik miatt abACC és sACC esetek terápiája különbözik: míg az emlőből kiinduló tumor esetébensokszor a sebészi rezekció önmagában kuratívMiyai,2014, addig a nyálmirigy eredetű forma kezelése során radikális sebészi beavatkozás és sugárterápia alkalmazása mellettGomez,2008;Triantafillidou,2006
is magas recidívahajlam tapasztalható. A sACC esetek aspecifikus kemoterápiás kezelése során ezidáig platina-származékok, anthracyclinek, 5-FU (5-fluorouracil), alkiláló szerek, valamint metotrexát (MTX) alkalmazását tanulmányozták, melyek klinikai eredményessége változóAgulnik,2007;Ghosal,2011;Hitre,2013. Az aspecifikus kezelésen túl a fentiekben ismertetett molekuláris és genetikai jellegzetességek lehetőséget nyújtanak célzott kezelési eljárások kifejlesztésére is.
Az elmúlt években feltárt molekuláris és genetikai eltérések sACC esetek célzott kezelésének alapjaként szolgálhatnak. Az ATP kötőhelyekkel rendelkező tirozin-kináz receptorok kompetitív és szelektív gátlója az imatinib, mely az ABL, BCR-ABL fehérjék és a PDGF receptorok gátlásán kívül a c-KIT fehérjének is ismert inhibitoraHotte,2005. Ezáltalaz imatinib fokozott c-KIT expressziót mutató sACC esetek kezelésének ígéretes célpontjaként szolgálhat.Ezzel szemben klinikai vizsgálatok alapján igen ellentmondásos eredmények születtek: míg egyes munkacsoportok szerint sACC-ban szenvedő betegek imatinib kezelése során szembetűnő klinikai választ tapasztalhatóFaivre,2005, ezt az eredményt más tanulmányok nem támasztották aláHotte,2005;Pfeffer,2007. Sőt, bizonyos esetekben az imatinib kezelést a sACC progressziója követteLin,2005. Kedvező klinikai hatás érhető el azonban sACC esetek kezelése során, amennyiben az imatinib kezelést hagyományoskemoterápiás szerek (pl.: cisplatin) alkalmazásával egészítjük kiBruce,2005;Ghosal,2011
.
A Her2-t fokozottan expresszáló sACC esetek célzott kezelésére nyílik lehetőség a trastuzumab (Herceptin) alkalmazásával, mely rekombináns monoklonális antitesként a Her- 2 extracelluláris doménjének direkt antagonistájaként viselkedik. Mindezek ellenére a trastuzumab sACC esetekben mutatott klinikai hatásainak vizsgálatáról mindezidáig még nem számolt be az irodalom, melynek elsődleges oka feltehetően a Her2-t fokozottan expresszáló sACC esetek igen alacsony száma lehet.
Ahogy láthattuk, a sACC esetek célzott kezelése annak ellenére nehézkes, hogy számos molekuláris és genetikai jellegzetességüket ismerjük már. A célzott kezelések kifejlesztését és alkalmazhatóságát nem csak az alkalmazott szerek előre ki nem számítható hatástalansága korlátozza. Az ACC-k nagy hányadában azonosítható eltérések (MYB fehérje fokozott expressziója, a MYB/NFIB fúziós gén jelenléte és a c-KIT overexpresszió) terápiás célpontként való alkalmazása ugyan kézenfekvőnek tűnik, ACC-k patogenezisében betöltött kulcsfontosságú szerepük azonban megkérdőjelezhető. Ezek az eltérések ugyanis egyaránt detektálhatóak a kiváló prognózisú bACC, valamint a kedvezőtlen klinikai kimenetelt mutató sACC esetekben. További molekuláris és genetikai eltérések terápiás célpontként való alkalmazhatóságát pedig az a tény nehezíti, hogy ezek jelentős hányada csupán egy-egy egyedülálló sACC esetben igazolható.
A hatékony célzott kezelés kifejlesztéséhez elsősorban a bACC és a sACC esetek szélsőségesen eltérő biológiai viselkedésére kell magyarázatot találnunk, mely az eddig leírt molekuláris és genetikai szintű jellegzetességeken túl feltehetően epigenetikai szintű szabályozás által is befolyásolt.
18 1.2. A mikroRNS-ek
1.2.1. A mikroRNS-ekről általában
A mikroRNS-ek (miRNS) rövid, 20-24 nukleotidból álló, egyláncú, fehérjét nem kódoló RNS molekulák, melyek funkciója pár évtizeddel ezelőtt még teljesen ismeretlen volt. Az elmúlt években fény derült arra, hogy ezek az apró molekulák a sejtélettani folyamatok szabályozásában központi szerepet töltenek beMoss,2002;Scherr,2004. Máig már több ezer miRNS-t azonosítottak, melyek között közel 2000 az emberi fajra specifikus. A miRNS-ek nagy részétfehérjét nem kódoló, és ezért korábban „hulladék DNS”-ként (junk DNA) számon tartott DNS régiók kódolják. Jelen ismeretünk szerint a miRNS gének az ismert humán gének mintegy 3%-át teszik ki. A miRNS-ek szövetspecifikusak: minden szövettípusnak egy kizárólag rá jellemző miRNS-expressziós mintázata van, mely egyedi és általa a szövet felismerhető, a többi szövettípustól elkülöníthetőGuo,2014;Lagos-Quintana,2002
.
A miRNS-ek többlépcsős folyamat eredményeképpen szintetizálódnak klasszikus, vagy alternatív útvonalon keresztül. A klasszikus útvonal esetében a miRNS saját DNS kódoló régióval rendelkezik, melyről a sejtmagban RNS-polimeráz II/III közreműködésével primer- miRNS készülLee,2003. Ez a hajtű alakú előalak a Drosha endoribonukleáz és a DGCR8 kofaktor közreműködésével a hurok régiót megőrző, de rövidebb pre-miRNS-sé alakul, majd az Exportin-5 fehérje segítségével a citoplazmába kerül. A citoplazmában a Dicer nevű ribonukleáz kofaktorok (TRBP és a PACT) közreműködésével eltávolítja az előalak hurok részét, így létrehozza a kb. 22 nukleotid hosszú szabad végekkel rendelkező miRNS duplexetBohnsack,2004;Chendrimada,2005;Lee,2006;Lee,2002;Morlando,2008;Murchison,2004. A Dicer és kofaktorai közreműködnek továbbá a miRISC (miRNA induced silencing complex), vagy más néven a miRNP (miRNA ribonucleoprotein particle) kialakításában is. A szintézis végső lépése során a kettős szálú miRNS egyik szála degradálódik (kísérő szál), a másik szál (vezető szál) megmarad, az effektor komplexbe épülve (Argonaute fehérje/Ago 1-4) érett, funkcionális miRNS-sé válik, mely az mRNS-ek megfelelő szekvenciáihoz kötődve regulálja azok működését (3. ábra). Az alternatív biogenezis során a miRNS egy gén kódoló szekvenciájában az exonok között elhelyezkedő intronról íródik át. Ennek a mechanizmusnak a lényege, hogy a Drosha enzim közreműködése nélkül, egy úgynevezett debranching enzim segítségével alakul ki a pre-miRNS. A szintézis alternatív útvonala ezek után kapcsolódik a klasszikus útvonal többi lépéséhezNaqvi,2009;Ying,2005
.
3. ábra. AmiRNS bioszintézis klasszikus útvonalának sematikus ábrája. (A bioszintézis lépéseinek részletes leírását ld. a szövegben)
A miRNS-ek, döntően a komplementaritás elve alapján, az általuk szabályozott hírvivő RNS-ek (messenger RNS/mRNS) fehérjévé át nem íródó, 3’ végéhez (3’- UTR/untranslating region/) kötődnek, majd többféle hatásmechanizmus révén előidézik a célgén poszt-transzlációs gátlását. A negatív reguláció egyik formája a transzláció iniciációjának gátlása, mely többféle úton keresztül vezethet az mRNS fehérjére történő átírásának megakadályozásáhozChendrimada,2007;Mathonnet,2007;Wakiyama,2007. Másik lehetséges hatásmechanizmus a poszt-iniciációs gátlás, mely során a transzláció elongációs fázisa blokkolódikPetersen,2006
. A gén expressziójának további lehetséges gátlása az mRNS destabilizációja, mely az mRNS degradálódásával jár, és ennek köszönhetően a miRNS-ek nem csupán a fehérjék expresszióját képesek csökkenteni, hanem az mRNS-ek mennyiségét is befolyásolni tudjákBagga,2005;Giraldez,2006. Végül pedig a gátlás az ún. P-testek (P-body, processing body) segítségével is megvalósulhat, melynek során miRNS-ek hatására a transzlációsan inaktív mRNS-ek citoplazmatikus granulumokban akkumulálódnakBrengues,2005;Eulalio,2007
.
A miRNS-ek hatása egyben pleiotróp és redundáns is: egy miRNS sokféle célgénen kifejtheti a hatását, valamint egyazon célgén több miRNS szabályozása alatt állhatNaqvi,2009. A
20
szabályozottak: egyrészt egymás működését is szabályozni képesek, másrészt gének által is reguláltakKrol,2010. Célgénjeiket ugyan a miRNS-ek javarészt negatívan regulálják, egyes esetekben beszámoltak már aktiváló miRNS-ekről isVasudevan,2008;Zhu,2008
. A fenti hatásmechanizmusok láttán nyilvánvaló, hogy ezek az apró molekulák minden egyes sejtben egy differenciált és igen finoman hangolt szabályozást visznek végbe és bonyolult szabályozási mechanizmusok révén egy szinte átláthatatlan hálózatot képezve biztosítják a gének megfelelő működését.
1.2.2. A miRNS-ek nevezéktana, miRNS családok
A miRNS-ek érett formáját nemzetközileg a „miR-” előtag után feltüntetett arab számmal jelölik (pl. miR-155). Az eltérő fajokból származó miRNS-ek azonosítására a „miR” előtag elé az adott fajt beazonosító, hárombetűs rövidítés kerül (humán/Homo sapiens: hsa;
Caenorhabditis elegans: cel). Bizonyos esetekben ugyanazon fajon belül, a genom különböző lókuszairól azonos szekvenciájú, érett miRNS-ek íródnak át, mely esetekben a miRNS száma után kötőjellel újabb arab számot helyezünk (pl. api-mir-210-2). Amennyiben a bioszintézis során az adott miRNS a prekurzora 5’ karjáról kerül kihasításra, a név után -5p utótag kerül, amennyiben a lehasítás a 3’ karról történik, a név után -3p utótagot applikálunk (pl.: hsa-miR- 126-5p és hsa-miR-126-3p).
Egyes miRNS-ek között az átlagosnál több hasonlóság mutatkozik érett alakjaik szekvenciája, valamint éretlen alakjuk (pre-miRNS) nukleotidsorrendje, vagy szerkezeti felépítése közöttDing,2011;Kozomara,2011
. Az egymásra ily módon fokozottan hasonlító miRNS-eket ún. miRNS-családokba sorolják, melyek tagjaira – az átlagosnál nagyobb fokú szerkezeti hasonlóságon túl – hasonló funkciók jellemzőekKaczkowski,2009. Az egy családba sorolható miRNS-eket kódoló gének non-random módon helyezkednek el olyan gének körül, melyek a fertőzésekben, az immunválaszban, neurodegeneratív betegségekben, vagy daganatos megbetegedésekben játszanak kiemelt szerepetMathelier,2013. A legismertebb és leginkább kutatott humán miRNS családok között említhetjük a let-7, a miR-17-92, valamint a miR- 23b/27b/24-1 családokat.
A „legősibb” miRNS csoportnak a let-7 család tekinthető, hiszen az elsőként felfedezett miRNS-ek (cel-lin-4 és cel-let-7) ebbe a csoportba tartoznak. A nagyfokú konzerváltságot (fajok közötti homológiát) mutató let-7család tagjai között számos humán miRNS is
azonosítható (let-7a, let-7b, let-7c, let-7d, let-7e, let-7f, let7g, let-7i), melyek különböző szervek malignus folyamataiban játszanak szerepetChen,2014;Liang,2011;Ma,2014
. Egyik legfontosabb célpontjuk a KRAS gén, melynek szabályozása révén kiemelt jelentőségük van a colorectalis, valamint tüdő eredetű daganatokban, személyre szabott terápiák kifejlesztésére is lehetőséget nyújtvaKasinski,2014;Langevin,2014. A KRAS génre kifejtett hatásaik révén TNBC-k KRAS variánsai kapcsán is felmerült már potenciális terápiás célpontként való alkalmazásukParanjape,2011
.
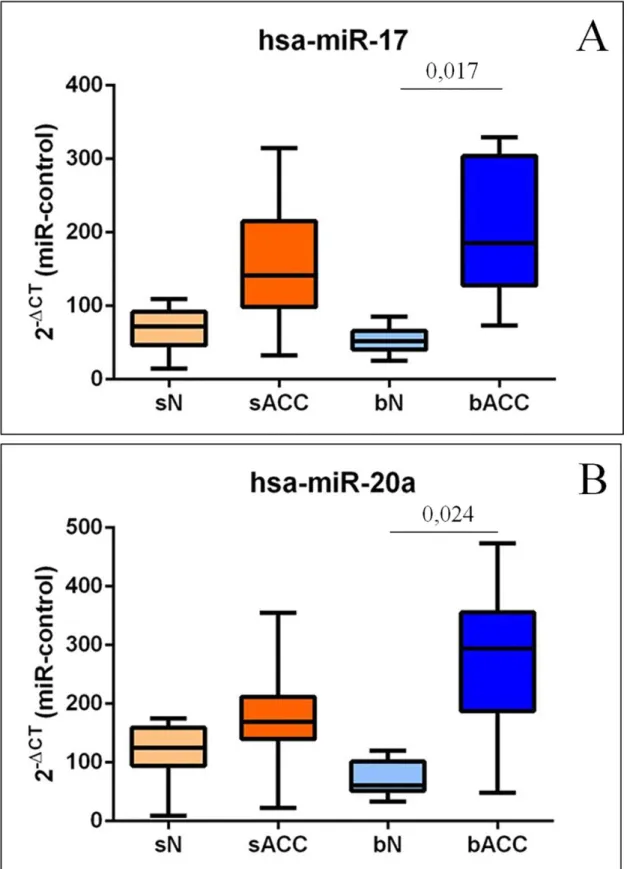
A miR-17 (miR-17-92) család legismertebb tagjai a miR-17, miR-18a, miR-19a, miR-19b, miR-20a, miR-92, melyek szerepe daganatfajtától eltérően változhat. Egyes esetekben ezek a miRNS-ek onkogén, máskor tumor szuppresszor szerepet töltenek beChang,2013;Goto,2014;Li,2014;Wu,2014. Fontos célmolekulák szabályozása révén (CCND1, MYC, BCL2, ERBB2, FGFR2, stb.) ez a miRNS család hozzájárulhat számos daganatféleség proliferációjához, metasztázis képzéséhez, angiogenetikus folyamatok kialakulásáhozJackstadt,2014;Park,2014;Yin,2012
, és befolyásolhatja bizonyos daganatok kemoterápiára való érzékenységét isChatterjee,2014
. A miR-17-92 család tagjai az emlődaganatok különböző molekuláris alcsoportjainak elkülönítésében is szerepet játszhatnak (lásd később)Calvano
Filho,2014
.
1.2.3. A miRNS-ek szerepe élettani és kórélettani folyamatokban
A felsorolt mechanizmusokkal, számos gén kifejeződését regulálva a miRNS-ek rendkívül sokféle élettani folyamatban szerepet játszanak, így befolyásolják a sejten belüli jelátviteli folyamatokat, a sejtek differenciálódását és proliferációját, valamint apoptotikus folyamatokat is regulálnak. A miRNS-ek ismert szabályozói immunológiai folyamatoknak, valamint az inzulinszekréciónak is. Összetett mechanizmusuk révén a miRNS-ek a szervezet homeosztázisának kialakításában elengedhetetlen résztvevők. A normáltól eltérő miRNS- expresszió szinte bármely szerv egyensúlyát felboríthatja, ezáltal számtalan kórélettani folyamat előidézéséhez hozzájárul: fontos szerepet töltenek be többek között iszkémiás szívbetegségekbenCao,2014;Song,2014, krónikus vesebetegségekbenChung,2013, tüdőfibrosisbanPandit,2015;Pandit,2011;Wang,2013
, valamint diabetes mellitusban
isChen,2014;Figueira,2014;Li,2014
. A miRNS-ek jelentősége napjainkban vitathatatlanul az egyre nagyobb számban megjelenő daganatos betegségekben a legnagyobbCalin,2006. A normál szövethez képest a daganatok miRNS mintázata (sok esetben az adott elváltozásra specifikus
22
szövetektől elkülöníthetőkké válnak, lehetőség nyílik a daganatok miRNS-specifikus, célzott terápiájára isGarg,2015;Gong,2005, valamint sok esetben a daganatok klinikai viselkedése is megjósolhatóCalin,2005. Ezen felül az egyes daganatokban speciális megoszlást mutató miRNS- ek által regulált célgének felderíthetők. A daganatra jellegzetes gének ismerete további terápiás célpontok azonosítását teszi lehetővé.
A daganatokban betöltött szerepük alapján a miRNS-ek rendelkezhetnek tumor keletkezést gátló (tumor szuppresszor), valamint a tumoros proliferációt elősegítő (onkogén) funkcióval. Ez utóbbiakat onkomir-eknek is nevezzükFolini,2010;Wang,2015
.
1.2.4. miRNS-ek és ACC
Az adenoid cysticus carcinomákban szerepet játszó miRNS-ekről kevés irodalmi adattal rendelkezünk, melyek között saját közleményeinken kívül csupán sACC esetek epigenetikai vizsgálatai szerepelnek, míg bACC esetekben miRNS expressziós vizsgálatokat korábban (a nyilvánosan elérhető adatbázisok alapján) csak munkacsoportunk végzettKiss,2013;Kiss,2014;Kiss,2015
.
Az elmúlt évek során igazolódott, hogy az ACC-kre jellemző MYB/NFIB fúziós gén egyik tagját, a MYB gént több humán miRNS is negatívan regulálja: miR-15a/16miRNS-eket fokozottan expresszáló daganatokban alacsony MYB expressziót találtak, míg a miR-150-ről igazolódott, hogy a c-MYB-en keresztül a B-sejtek differenciálódási folyamatait szabályozzaXiao,2007;Zhao,2009. Marta Persson munkacsoportjában ezen miRNS-ek terápiás célpontként való alkalmazhatósága is felmerültPersson,2009
, mely az ACC-kben magas arányban előforduló MYB/NFIBfúziós gén jelenléte miatt különösen kiemelt jelentőséggel bírhat.
2013-ban Mitani és kutatócsoportja a miR-17/92 család fokozott expressziójának hatását vizsgálta sACC esetekben (lásd később)Mitani,2013. Ugyanebben az évben He és munkatársai a miR-181a a MAPK-Snail2 útvonalon keresztüli metasztázis képzést csökkentő funkcióját igazolta nyálmirigy eredetű ACC esetekbenHe,2013. Chen és munkatársai szintén ebben az évben nagyfokú metasztázist képző potenciállal rendelkező sACC sejtvonalakban három fokozottan expresszálódó (miR-4487, -4430 és -486-3p), valamint három csökkent expressziót mutató (miR-5191,-3131 and -211-3p) miRNS-t azonosítottChen,2014.
Ugyan az elmúlt években nagy előrelépések történtek az ACC esetekben szerepet játszó miRNS-ek felderítésében, az imént ismertetett eredmények kezdetlegesek, önmagukban nem
magyarázzák a sACC esetek bACC-tól eltérő agresszív klinikai viselkedését. Ahhoz, hogy a miRNS-ek ACC-ban betöltött esetleges szerepét jobban feltárjuk, a két szervből kiinduló daganatok egyidejű miRNS-profil vizsgálatára van szükség.
24 2. CÉLKITŰZÉSEK
Vizsgálatunk két részből állt: egy kiindulási, előzetes miRNS expressziós vizsgálatból, illetve a kapott eredmények alapján kiválasztott miRNS-ek expressziójának vizsgálatából, valamint azok lehetséges célgénjei által kódolt fehérjék mennyiségi meghatározásából. Ennek alapján a következő célokat tűztük ki:
2.1 A bevezető vizsgálat/”screening”:
o Emlőből és nyálmirigyekből kiinduló ACC (bACC és sACC) és normál emlő, valamint nyálmirigy kontroll szövetek (bN és sN) miRNS expressziós profiljának vizsgálata, különös tekintettel a vizsgált minták mindegyikében expresszálódó miRNS-ek, valamint az egyes vizsgálati csoportok között speciális eloszlást mutató miRNS-ek azonosítására.
o A kiválasztott miRNS-ek lehetséges célgénjeinek, potenciálisan érintett fehérjék, valamint érintett jelátviteli folyamatok feltérképezése nyilvános adatbázisok segítségével.
2.2 Szűkített számú miRNS-ek és az általuk szabályozott gének által kódolt fehérjék vizsgálata:
o A kiindulási vizsgálat során kiválasztott miRNS-ek expressziójának meghatározása magasabb esetszámú mintákon és annak összehasonlítása az egyes vizsgálati csoportok között.
o A miRNS-célgén vizsgálat szűkítése a speciális megoszlást mutató miRNS-ekre és a legtöbb miRNS-célgén interakciót mutató gének kiválasztása.
o A kiválasztott célgének által kódolt fehérjék expressziójának meghatározása és összehasonlítása a vizsgálati csoportok között.
o Tumoros minták (bACC és sACC) ER, PgR és Her2 expressziójának vizsgálata.
3. ANYAGOK ÉS MÓDSZEREK
3.1. Kiindulási vizsgálat: miRNS expressziós mintázat feltérképezése
Szövetminták
Bevezető vizsgálataink során 6 esetet vizsgáltunk, melyeket a Semmelweis Egyetem II.
sz. Patológiai Intézetének archívumából választottunk ki. Ezek között két bACC, valamint két sACC eset szerepelt. Kontrolljaikként egy-egy normál submandibularis nyálmirigyből (sN), valamint emlőszövetből származó (bN) mintát vizsgáltunk. Az egyik bACC esetet a szolnoki Hetényi Géza Kórház, a másikat a székesfehérvári Szent György Kórház Patológiai Osztálya konzíliumi vizsgálat céljából küldte intézetünkbe.
RNS izolálás, minőségellenőrzés
Az esetekhez tartozó reprezentatív szövettani metszetek megfelelő FFPE (formalin- fixált, paraffinba ágyazott/ formalin-fixed, paraffin embedded/) blokkjainak kiválasztását követően az RNS izoláláshoz mintánként 10 db 5 μm vastag metszetet készítettünk. A tumoros esetekből származó metszetekből izolálás előtt makrodisszekciót végeztünk, mely során a környező normál szövetet eltávolítottuk. Makrodisszekáláshoz az 5 μm vastag metszeteket kétszer 5 percen át xilolban áztattuk, majd szobahőn száradni hagytuk. A xilol elpárolgása után a vizsgálni kívánt területeket metszeteinkről a HE festett metszet alapján pengével távolítottuk el és Eppendorf csőbe helyeztük. Az RNS izolálás a Qiagen RNeasy Mini Kit (Qiagen, Hilden, Germany) segítségével történt a gyártó útmutatása szerint. Az izolátum minőségellenőrzését az ajánlott protokollnak megfelelően 6000 Pico Chip Kit (Agilent, Palo Alto, CA, USA; Agilent 2100 Bioanalyzer készüléken futtatva) segítségével végeztük
26 miRNS expressziós mintázat meghatározása
Az RNS izolátum mennyiségét fluorometriás méréssel Qubit RNA Assay (Life Technologies, Gand Island, NY, USA) segítségével határoztuk meg. Minden mintából 1 µg mennyiséget a Genisphere HSP Labeling Kit (Genisphere, Hatfield, PA, USA) segítségével biotinnal jelöltünk, a gyártó által megadott instrukcióknak megfelelően. A jelölt RNS- izolátumokat az Affymetrix® GeneChip® miRNA Array-en (Affymetrix, Santa Clara, CA, USA, AF-901325) található komplementer láncokkal hibridizáltattuk (4. ábra). Ez a vizsgálati felület 847 humán miRNS, valamint számos további faj miRNS-ének detektálására alkalmas egyszerre. A vizsgált mintában található miRNS-ek és a felületen lévő komplementer láncok hibridizációja streptavidin-phicoerythrin komplex segítségével váltak detektálhatóvá, mely láthatóvá tette a biotinnal jelölt miRNS-eket. A minták miRNS expresszióját a reakciók fényintenzitása alapján határoztuk meg, mely korrelált az egyes vizsgálati mintákban található miRNS-ek mennyiségével. A kvantifikációhoz miRNA QC Tool software-t (Affymetrix, Santa Clara, CA, USA) használtunk.
4.ábra. Az Affymetrix® GeneChip® miRNA array a fényintenzitás alapján következtet a minták miRNS tartalmára (http://www.stemcore.ca/services/microarrays)
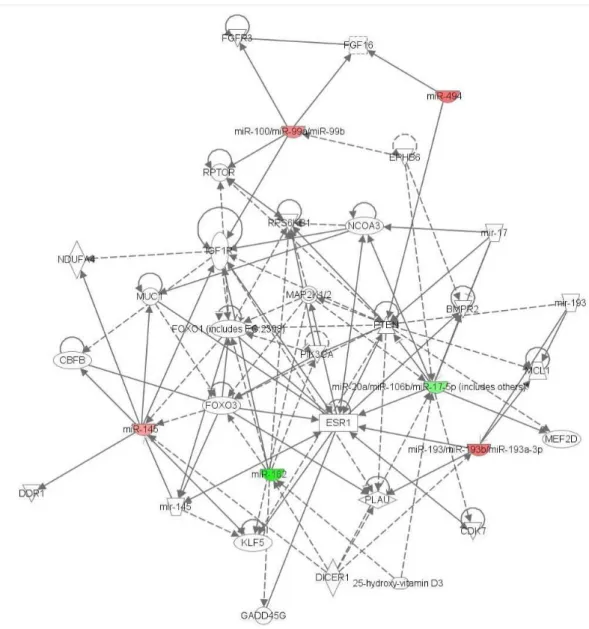
A jelátviteli folyamatok érintettsége az ACC tumor mintákban
Az azonosított miRNS-ek és sejten belüli jelátviteli útvonalak potenciális kapcsolatait az IPA® (Ingenuity Pathway Analysis) adatbázis segítségével tártuk fel. Az IPA® útvonal analízise segítségével lehetőségünk nyílt az irodalomban korábban publikált molekuláris útvonalak azonosítására, melyek ezen publikációk alapján kapcsolatba hozhatóak egyes, általunk detektált miRNS-ekkel. Ebben az elemzésben olyan miRNS-ek interakcióit vizsgáltuk, melyek az Affymetrix® GeneChip® miRNA Array eredményei szerint mind a 6 vizsgált mintánkban expresszálódtak. Az analízis során az emlőből és nyálmirigyből kiinduló ACC esetek miRNS expresszióját normál szöveteikben kapott miRNS expressziós értékekhez normalizáltuk. Az adatbázisba az így kapott értékeket vittük be, mely alapján a program potenciálisan szabályozott gének érintettségét, miRNS-mRNS interakciók lehetőségét listázta számunkra, melyet hálózatos formában is megjelenített.
Az egyes miRNS-ek és az általuk szabályozott célgének interakcióinak meghatározására nyilvános célgén predikciós adatbázisokat használtunk. A feltételezhető miRNS-célgén interakciók azonosítására miRecords felületet alkalmaztuk, mely átfogó adatbázisát képezi több miRNS-célgén interakciót tartalmazó rendszernekXiao,2009. Ezen adatbázisok között megtalálhatóak a DIANA-microT, a MicroInspector, a miRanda, a MirTarget, az NBmiRTar, a PicTar, a PITA, az RNA22, az RNAhybrid, valamint a TargetScan/TargetScanS, melyek a potenciális miRNS-célgén interakciókat eltérő paraméterek alapján azonosítják (2. táblázat). Az egy helyen integrált adatok széles körű célgén elemzésre adtak lehetőséget. Ugyanakkor a találatokat nagy mértékben megerősítette, ha a vizsgált miRNS és célgénjei közötti interakciókat publikált validációs vizsgálatok alá is támasztották.
28
2. táblázat. A miRecords adatbázis által integrált miRNS-célgén interakciós adatbázisok, predikcióik alapja, valamint a rájuk vonatkozó hivatkozások
Adatbázis neve Célgén predikció módja Hivatkozás
TargetScan komplementaritás1 LewisLewis,2005 GrimsonGrimson,2007
FriedmanFriedman,2009
Diana microT v.4 más miRNS adatbázisok becslése
Maragkakis et al.Maragkakis,2009
PicTar komplementaritás1 Krek et al.Krek,2005 MicroInspector komplementaritás
speciális kötődési tulajdonságok figyelembe vétele
RusinovRusinov,2005
Targetminer 10 különböző célgén elemző algoritmus alapján
BandyopadhyayBandyopadhyay,2009
miRanda/microrna.org komplementaritás
miRNS-mRNS
kötődéskor felszabaduló szabad energia
BetelBetel,2008
miRTarget2/miRDB komplex algoritmus Wang, El
NaqaWang,2008;Wang,2008
RNA22 nem támaszkodik a fajok
közti konzervációs mechanizmusokra
elsőként az mRNS-ben keresi a vélt kötőhelyeket, aztán azonosítja a miRNS- t
MirandaMiranda,2006
PITA mag (seed)
régióparaméterei, az elégtelen
komplementaritás és hurkok kizárásával
KertészKertesz,2007
RNAHybrid a miRNS-mRNS
kötődéskor felszabaduló minimális szabad energia
KrügerKruger,2006
RehmsmeierRehmsmeier,2004 1 az mRNS-ek 3’-UTR régiója és a miRNS-ek „mag” (seed) régiója közötti komplementaritás
2 Kyoto Encyclopedia of Genes and Genomes
3.2. Szűkített számú miRNS-ek expressziójának vizsgálata és az általuk potenciálisan regulált fehérjék mennyiségi meghatározása
Szövetminták
A validációs vizsgálatokra 63 esetet választottunk ki. A kiválasztott esetek között 20 bACC, 22 sACC, kontrolljaikként pedig 11 bN és 13 sN esetből származó minta szerepelt. A validációs vizsgálatok elvégzése egyes minták esetében nem volt kivitelezhető, melynek okait a későbbiekben ismertetem. Az egyes kísérletekben szereplő pontos esetszámot az adott módszer leírása kapcsán ismertetem.
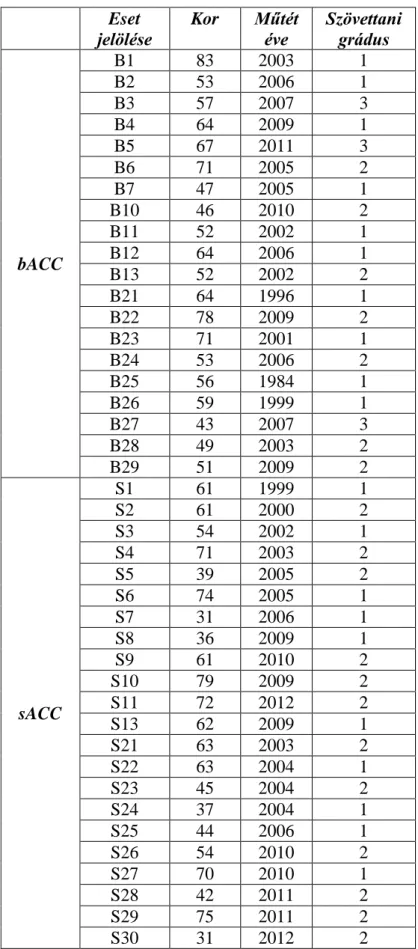
A tumoros esetekhez tartozó szöveti mintáink egy részét a II. sz. Patológiai Intézet beteganyagából választottuk, a további mintákat pedig külső patológiai intézetek biztosították, melyek a bevezető vizsgálathoz esetet szolgáltató intézményeken kívül a kistarcsai Flór Ferenc Kórház Patológiai Osztálya, az Országos Onkológiai Intézet Molekuláris és Sebészeti Patológiai Osztálya, a sarajevói Clinical Center of the University of Sarajevo Patológiai Osztálya voltak. Kontrollcsoportjaink összes mintája intézetünk beteganyagából került ki. Az emlő eredetű tumorok 43-83 éves, míg nyálmirigy eredetű tumoraink 31-79 év közötti betegekből származtak. bACC eseteink három kivételével jól, valamint közepesen differenciált tumorok voltak, míg sACC esteink között rosszul differenciált esetek nem szerepeltek (3. táblázat). A klinikopatológiai adatok néhány esetben nem voltak elérhetőek, így nem rendelkezünk minden eset TNM státuszára vonatkozó információkkal. A rendelkezésünkre álló adatok szerint vizsgált eseteink nagy része (emlő és nyálmirigy eredetű daganatok egyaránt) korai stádiuimban került felismerésre (T1 és T2 klinikopatológiai stádiumok). Mind bACC, mind sACC esetek között ismertek voltak olyan daganatok, melyek már a felismerés pillanatában regionális áttétet adtak, azonban a legtöbb betegnél a primer daganat felismerésekor még nem volt azonosítható nyirocsomó metasztázis. Emlő és nyálmirigy eredetű ACC-k között is két-két olyan esetünk volt, akiknél már a felismeréskor ismert volt a primer daganat távoli metasztázisa.
30
3. táblázat: bACC és sACC eseteink klinikopatológiai jellegzetességei Eset
jelölése
Kor Műtét éve
Szövettani grádus
bACC
B1 83 2003 1
B2 53 2006 1
B3 57 2007 3
B4 64 2009 1
B5 67 2011 3
B6 71 2005 2
B7 47 2005 1
B10 46 2010 2
B11 52 2002 1
B12 64 2006 1
B13 52 2002 2
B21 64 1996 1
B22 78 2009 2
B23 71 2001 1
B24 53 2006 2
B25 56 1984 1
B26 59 1999 1
B27 43 2007 3
B28 49 2003 2
B29 51 2009 2
sACC
S1 61 1999 1
S2 61 2000 2
S3 54 2002 1
S4 71 2003 2
S5 39 2005 2
S6 74 2005 1
S7 31 2006 1
S8 36 2009 1
S9 61 2010 2
S10 79 2009 2
S11 72 2012 2
S13 62 2009 1
S21 63 2003 2
S22 63 2004 1
S23 45 2004 2
S24 37 2004 1
S25 44 2006 1
S26 54 2010 2
S27 70 2010 1
S28 42 2011 2
S29 75 2011 2
S30 31 2012 2
miRNS expresszió meghatározása
A kiválasztott microRNS-ek mennyiségi meghatározása a betegek FFPE szövetmintáiból történt. Az esetekhez tartozó reprezentatív blokkokból 10 db 5 μm vastag metszetet készítettünk, melyeket a HE festés alapján makrodisszekáltunk azokban az esetekben, amelyekben a metszeten látott szöveti struktúra a tumor mellett jelentős mennyiségű normál szövetet is tartalmazott (ha a tumorsejtek százaléka nem érte el a 80%- ot).
RNS izolálását a Life Technologies teljes RNS izoláló kitjével végeztük (RecoverAll Total Nucleic Acid Isolation Kit, kat. szám: AM1975), a gyártó útmutatásai szerint, melyet kísérleti eredményeink alapján a legjobb minőségű végtermék elérése céljából – elsősorban az emésztési folyamatok időtartamára vonatkozóan módosítottunk (ld. Függelék, 1. pont). Az RNS koncentráció meghatározásához NanoDrop 1000 Spektrofotométert (Thermo Fisher Scientific Inc., Waltham, MA, USA) használtunk. Azon mintákat, amelyek RNS koncentrációja az ideális határérték alatt (20 ng/μl érték alatt) volt, a későbbi vizsgálatokból kizártuk. Ezek alapján 6 bACC, 6 sACC eset, valamint egy nyálmirigy kontroll és 2 normál emlőszövet esett ki és végül a vizsgálatainkba összesen 16 s ACC, valamint 14 bACC eset került be. A kontroll csoportokba tartozó esetek mindegyikéből ideális mennyiségű RNS volt izolálható, így a 11 nyálmirigyből származó és 9 emlőből származó normál szövet további vizsgálatát elvégeztük.
miRNS expressziós vizsgálatokat a következő humán (hsa) miRNS-ek esetében terveztünk: let-7b, let-7c, let-7e, miR-17, miR-17*, miR-20a, miR-23b, miR-24, miR-27b, miR-125a-3p, miR-134, miR-181a-2*, miR-193b, miR-195, miR-206, miR-320a, miR-320c, miR-379, miR-382, valamint miR-1275, miR-1234, miR-1280, miR-1826, miR-768-3p és miR-768-5p. Munkacsoportunk korábbi vizsgálatai alapján kontroll (referencia) miRNS-ként két kis nukleoláris RNS (sno/small nucleolar RNA), az RNU43 és RNU48 expresszióját vizsgáltuk.
A kiválasztott miRNS-ek közül nem nyílt lehetőségünk mindegyik miRNS mennyiségi meghatározására. Az érett miR-768 3p és 5p egymással részlegesen komplementer szálait egy snoRNS-sel (HBII-239) való átfedés miatt kellett kizárni, a miR-1826-ot azért, mert korábban az 5,8S rRNS egy fragmentjének bizonyult, a miR-1280-at pedig azért, mert korábban egy tRNS fragmentumaként azonosítottákKozomara,2011
. A let-7c és miR-181a-2* és miR-1234
32
ekre nem szerepeltek a gyártó (Life Technologies®) által forgalmazott termékek között. Két további miRNS, a miR-320a és miR-320c esetében közös primert alkalmaztunk, mivel ezekre külön-külön specifikus primert a gyártó szintén nem forgalmazott (későbbiekben: miR-320).
A mennyiségi meghatározás első lépésében a mintáinkból származó miRNS-t cDNS- re írtuk át miRNS specifikus primerek és TaqMan® Reverz Transzkripciós Kit segítségével a gyártó utasításai alapján. Az átíró kit, az alkalmazott mestermix és az egyes miRNS-ekhez tartozó primerek pontos azonosítóit a 4. táblázat tartalmazza. A 7,5 μl össztérfogatú reakcióelegy 4 μl mestermixet (puffer, dNTP, MultiScribe enzim, RNáz inhibitor, nukleázmentes víz), 1,5-1,5 μl primert és 0,5 μl RNS-t (20 ng/μl koncentrációjú) tartalmazott.
(ld. Függelék,2. pont). A reverz transzkripciót Eppendorf Mastercycler PCR gép segítségével végeztük a következő hőprofil szerint: 4 perc 4ºC-on, 30 perc 16 ºC-on, 30 perc 42 ºC-on, 5 perc 85 ºC-on, végül 4 ºC-ra hűtés és további felhasználásig 4 ºC-on tárolás.
4. táblázat: A reverz transzkripció és a qPCR során alkalmazott reagensek pontos gyártói azonosítói
Termék pontos neve és azonosítója Katalógusszám TaqMan® MicroRNA Reverse
Transcription Kit, 1000 reactions
4366597
TaqMan® Universal Master Mix II, No UNG
4440047
TaqMan®
MicroRNA Assays INV, S 002308, Human
miR-17
4427975 miR-20a
miR-24 miR-195 miR-23b miR-27b miR-320 miR-193b miR-1280 miR-1275 miR-125a-3p miR-134 miR-17*
miR-206 miR-379 miR-382 let-7b let-7e RNU43 RNU48
34
A minták közötti miRNS expresszió mértékének összehasonlításához qPCR-t végeztük szintén miRNS specifikus primerek (4. táblázat) és TaqMan® MicroRNA Reverse Transcription Kit (Life Technologies; katalógusszám: 4366597) felhasználásával a gyártó utasításai szerint. A 10 l reakcióelegy 8,84 l mestermixet (TaqMan mix és nukleázmentes víz), 0,5 l primert és 0,65 l cDNS-t tartalmazott (ld. Függelék, 3. pont). A minták mérése triplikátumban, 96 lyukú PCR plate-en történt ABI PRISM 7000 Sequence Detection System (Applied Biosystems)/LightCycler 480 Instrument II (Roche Applied Science) készülékkel.
Minden plate-en szerepelt tumoros, valamint normál esetekből származó kontrollminta, valamint egy cDNS-t nem tartalmazó negatív kontroll az esetleges nukleinsav- szennyeződések kizárására.
A qPCR-rel azt a ciklusszámot kapjuk meg eredményül, ahol az adott miRNS kiinduló kópiaszámától függően és a DNS amplifikálással arányosan növekvő fluoreszcens jel eléri a küszöbszintet. Az egy mintához tartozó Cq (quantification cycle) értékeket átlagoltuk, a triplikátumok között a 0,5-nél nagyobb különbségű értékeket az átlagnál nem vettük figyelembe. A legstabilabb expressziót mutató miRNS-nek, a kísérletet megelőző feltételezésünktől eltérően nem az RNU43 vagy RNU48, hanem a miR-125a-3p bizonyult, melyet a számolás során referenciaként használtunk. A relatív expressziót a 2-(Cq_tumor-
Cq_normál) alapján számoltuk, ahol a Cq az adott miRNS és a referencia miRNS Cq értékének különbsége.
Eredményeink statisztikai elemzéséhez ANOVA (variancia-analízis/ANalysis Of VAriance) és Tukey-teszteket alkalmaztunk a STATISTICA program (v 9.1, StatSoft Inc., Tulsa, OK), vagy GraphPad PRISM. program (v 5.001, GraphPad Software Inc, La Jolla, CA) segítségével. A p-érték <0,05 feltétel teljesülésekor a különbséget szignifikánsnak tekintettük.