Debreceni Egyetem Tudományegyetemi Karok
Természettudományi és Technológiai Kar Növénytani Tanszék
A cylindrospermopszin (CYN) hisztológiai és citológiai hatásainak vizsgálata edényes növényben
Diplomamunka
Készítette:
Garda Tamás
II. éves Biológus MSc – növénybiológia szakirány
Témavezető:
Dr. habil. Máthé Csaba
Debrecen
2014
2
Tartalomjegyzék
1 . Bevezetés és célkitűzés ... 3
2. Irodalmi áttekintés ... 4
2.1 A növényi mikrotubuláris citoszkeleton ...
4
2.2 A növényi sejtciklus ...
5
2.3 A cilindrospermopszin ...
9
3. Anyag és módszer ... 11
3.1 A cilindrospermopszin tisztítása ...
11
3.2 A Vicia faba csíranövények nevelése, és toxinkezelés ...
11
3.3 Hisztokémiai és immunhisztokémiai módszerek ...
12
3.4 DNS szintézis vizsgálatok ...
13
3.5 Kromoszóma („squash”) preparátumok készítése ...
14
3.6 Az oldalgyökér csúcsmerisztéma sejtek mitotikus aktivitásának vizsgálata ...
14
3.7 Az adatok analízise ...
14
4. Eredmények ... 15
4.1 CYN hatása a Vicia faba csíranövények fejlődésére...
15
4.2 A CYN mitotikus aktivitásra kifejtett hatás ...
16
4.3 Szövettani és citológiai elváltozások ...
18
4.4 A CYN rövidtávú hatásai a mitózisra és a fehérjeszintézisre ...
22
4.5 DNS szintézis vizsgálatok kidolgozása ...
23
5 . Diszkusszió ... 24
6. Összefoglalás ... 27
7. Köszönetnyilvánítás ... 29
8. Irodalomjegyzék ... 30
3
1. Bevezetés és célkitűzés
Napjainkban igen komoly környezeti problémát okoznak a felszíni vizeinkben létrejövő cianobakteriális vízvirágzások, víztérszíneződések. A vízvirágzást a feldúsult szerves anyag mennyiség következtében elszaporodott cianobaktériumok okozzák. A cianobaktériumok az egész élővilágban elterjedt fotoszintetizáló prokarióta szervezetek. Elszaporodásukhoz az emberek is nagymértékben hozzájárultak a műtrágyázással és a szennyvízkibocsátással. Ez a jelenség főleg nyáron figyelhető meg mikor hosszabb ideig van meleg és napos időjárás.
Ekkor túl sok szerves tápanyag szaporodik fel a vizekben, ami előidézi a cianobaktériumok és az algák gyors szaporodását (Carmichael, 1992). Hazai vízvirágzást eddig a cianobaktériumok néhány faja eredményezett, mint például Aphanizomenon flos-aquae, Microcystis sp., Cylindrospermopsis raciborskii és a Anabaena spiroides (Vasas és mtsai., 2004). A cianotoxinok a legtöbb esetben az eutrofizálódás következtében létrejövő cianobakteriális vízvirágzások alkalmával dúsulnak fel a felszíni vizekben. A cianotoxinok számos egészségügyi és ökológiai kockázatot jelentenek. Az emberi szervezettel főleg ivóvíz, fürdőzés vagy szennyezett vízből származó élőlény elfogyasztásával kerülhetnek kapcsolatba (Carmichael, 1992).
A CYN az állatokban és a növényekben egyaránt gátolja a fehérjeszintézist (Froscio és mtsai., 2001; Metcalf és mtsai., 2004), továbbá állati sejtekben bizonyított a cianotoxin DNS károsító hatása (Humpage és mtsai., 2000). Állati sejtekben a mikrotubulusok és a mikrofilamentumok dezorganizációját indukálja (Gácsi és mtsai., 2009). A CYN a vörösvértestekben jellegzetes morfológiai elváltozást okoz (Sukenik és mtsai., 2006). A fentiekből kitűnik, hogy a CYN sejtszintű hatásai viszonylag ismertek az állati sejtekben, a CYN hatást gyakorol a citoszkeletális elemekre és a kromatin szerkezetére. A növényi sejtekkel kapcsolatosan azonban, mindezidáig kevés az irodalmi adat.
Munkánk során Vicia faba (lóbab) modellnövényben vizsgáltuk a toxin hatását.
Növekedésvizsgálatok mellett célul tűztük ki a CYN mitotikus aktivitásra és sejtosztódásra gyakorolt hatásának vizsgálatát. Célunk volt továbbá, a sejtciklus egyes fázisaira jellemző mikrotubuláris rendszer és kromatinszerveződés vizsgálata valamint egy protokol kidolgozása, amellyel a CYN DNS szintézisre gyakorolt hatását tudjuk vizsgálni.
4
2. Irodalmi áttekintés
2.1 A növényi mikrotubuláris citoszkeleton
A mikrotubulusok az eukarióta szervezetek sejtjeiben előforduló citoszkeletális elemek, amelyeknek számos funkciójuk van, mint például a vezikuláris transzport, a sejtek polaritásának és alakjának meghatározása, valamint a sejtosztódás (Dowling & Nogales, 1998). A citoszkeletonnak ismertek növény specifikus funkciói is, úgymint a preprofázis köteg (PPB) és fragmoplaszt létrehozása valamint növény specifikus organellumok mozgatása (Davics és mtsai., 1996).
A mikrotubulusok protein alegységekből alakulnak ki. A tubulin alegység maga heterodimer formában van, ami két szorosan illeszkedő globuláris proteinből, α-tubulinból és β- tubulinból áll. Minden α- és β-monomer rendelkezik konzervált GTP kötőhellyel. A mikrotubulus egy 25-37 nm-es vastagságú, üreges henger alakú struktúra, amely 13 párhuzamos protofilamentből épül fel, α- és β-tubulin váltakozásával (Alberts és mtsai., 2008). Rendkívül dinamikus struktúrák, állandóan felépülnek a pozitív(+) végükön és lebomlanak a negatív(-) végükön. A mikrotubulusok egyik fő jellegzetessége a polimerizációs és depolimerizációs egyensúlyon alapuló sajátos növekedés, illetve mérettartás. A mikrotubulosok gyors átrendeződését a dinamikus instabilitás teszi lehetővé (Nogales, 1999). A növényekben nem található mikrotubulus szervező organellum, tehát a mikrotubulusok nukleációját a sejtmembrán és a sejtmag membrán közelében elhelyezkedő fehérje komplexek végzik, amelyek γ-tubulint tartalmaznak (Jacalyan és mtsai., 2001; Joshi, 1998).
A mikrotubulusokhoz számos különböző MAP (microtubule-associated protein) kapcsolódik. Egyesek a mikrotubulus stabilitását szabályozzák, mások keresztkötések kialakításával képesek mikrotubulus kötegeket létrehozni (Nogales, 1999). A MAP-ok több osztályára jellemző a mikrotubulus nukleációban és orsó összeszerelődésben a monomer kötés, polimer stabilizáció és destabilizáció. Ezek között a MAP-ok MAP215/Dis1 családjának vannak erősen kötött mikrotubulus szabályozói a mitotikus orsóban, mint például a MOR1 (microtubule organisation 1) Arabidopsisban és a TMBP200 a dohányban.
A mikrotubulus kötegek kialakulásában fontos szerepet tölt be a MAP65 fehérjecsalád. A MOR1 várható celluláris funkciója az Arabidopsisban a mikrotubulus stabilizációja és a mikrotubulus organizációja (Sedbrook, 2004). Viszont a MOR1 mutációja a PPB eltűnését és a mikrotubulusok diszrupcióját eredményezi (Hussey & Hawkins, 2001). A mor1 mutáns
5
szokatlanul rövid mikrotubulusokat eredményez az interfázisos sejteknél és valószínűleg ennek eredményeként következik be a dinamikus instabilitás megváltozása. Az Arabidopsis p60 fehérjének alapvető szerepe van az anizotropikus sejtmegnyúlásban és a gyökérszőrök kialakulásában. Ezek a hatások a hormonális jelátvitelben játszott szerepével magyarázhatóak. A p60 mutánsra a perinukleáris mikrotubulus köteg késleltetett eltűnése és a rendellenes kortikális mikrotubulus szerveződés jellemző. A p60 fehérje a mikrotubulusokhoz kapcsolódik, ezáltal jelentősen hat a sejtfal összetételére és növekedésére (Sedbrook, 2004; McNelly, 1996).
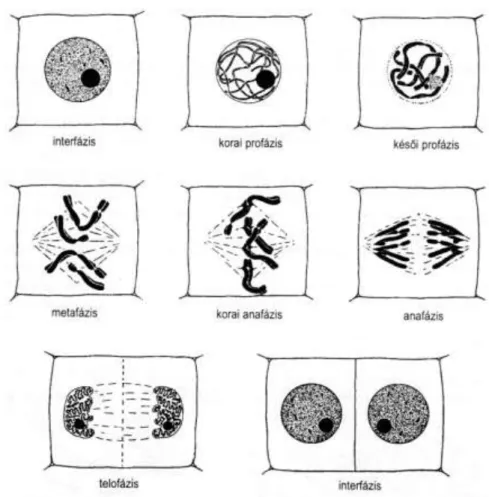
A növényi sejtekben 5 féle mikrotubulusból felépülő struktúrát figyelhetünk meg (1.
ábra). Az interfázisban lévő sejtekben kortikákis mikrotubulusokat (CMT) láthatunk. A kortikális mikrotubulusok a növekedés tengelyére merőleges, ferde lefutású párhuzamos mikrotubulus kötegekből állnak (1. a ábra). Az endoplazmatikus mikrotubulusok (EMT) váltják fel a kortikákis mikrotubulusokat az osztódó sejtekben (1. b ábra), amelyből a preprofázisban kialakul a preprofázis köteg (PPB; 1. c ábra). A PPB eltűnése után a metafázisban kialakul az osztódási orsó (1. d ábra), ezután pedig a telofázis alatt megjelenik a fragmoplaszt (1. e ábra) (Wright & Smith, 2007).
1. ábra: A növényi sejtekben található mikrotubuláris struktúrák. (a): CMT. (b): EMT. (c):
PPB. (d): mitotikus orsó. (e): fragmoplaszt. A mikrotubulusok piros színnel láthatók (Goddard és mtsai., 1994 valamint Dhonukshe és mtsai., 2004 nyomán).
2.2 A növényi sejtciklus
Az eukarióta szervezetek növekedése, fejlődése, szaporodása és fajfenntartása jelentős mértékben függ a mitotikus sejtosztódástól, melyet összetett és összehangolt biokémiai és genetikai folyamatok irányítanak. A sejtciklus teszi lehetővé a genetikai információ megkettőződését és átjutását az utódsejtekbe. A sejtosztódásnak két típusa van: a mitózis
(a) (b) (c) (d) (e)
6
(vagy számtartó osztódás) és a meiózis (vagy számfelező osztódás). A mitózis a szomatikus sejtek szaporodását foglalja magába, ahol az utódsejtek ugyanazt a genetikai anyagot tartalmazzák, mint az anyasejt. A meiózis ezzel szemben felére csökkent kromoszómaszámú ivarsejteket (növényekben spórákat) eredményez.
Az osztódásra képes eukarióta szomatikus sejtekre jellemzőek az egymást követő fázisok, melyek egy sejtciklust alkotnak. A sejtciklus alapvetően mitózisból és interfázisból áll. Régebben úgy gondolták, hogy az interfázis a sejtek nyugalmi állapota. Ma már tudjuk, hogy igen fontos események játszódnak le, így az interfázis is külön szakaszokra osztható.
A G1, vagy preszintetikus szakaszban történik meg a sejtek felkészülése az osztódásra.
A sejtek növekednek, a különböző sejtorganellumok megkettőződnek és beindul a makromolekulák (RNS és fehérjék) szintézise. (Velich, 2001).
S (szintetikus) szakaszban kettőződik meg a DNS, és a hiszton fehérjék is ekkor szintetizálódnak. Nemcsak a DNS, a nukleoszóma és az epigenetikus módosítások is átkerülnek az újonnan szintetizálódott kromatinszálra. A hisztonok a többi DNS-hez kapcsolódó fehérjékkel együtt elfoglalják helyüket a DNS-en. A folyamat végére kialakul a két testvérkromatida, melyeket kohezin fehérje komplexek tartanak össze (Costas és mtsai, 2011; Velich, 2001).
A posztszintetikus (G2) fázisban a sejt már felkészült a mitózisra. A diploid eukarióta szervezetekben az interfázis kezdetén (G1) a sejtmag DNS tartalma 2C. Az S fázisban történő DNS replikáció miatt a G2 fázisban a sejt DNS mennyisége 4C (Velich, 2001).
Ha az extracelluláris feltételek kedvezőtlenek, akkor a sejt belép egy speciális nyugalmi állapotba, aminek a neve G0 (Gzero). Ebben az állapotban a sejt napokig, hetekig vagy akár évekig is maradhat, mielőtt visszatér az osztódáshoz. Sok sejt marad tartósan G0-ban, ami egy bizonyos idő eltelte után sejthalálhoz vezet (Alberts és mtsai., 2008; Astor, 1986; Michaelis és mtsai., 1997).
A mitózis a szomatikus sejtek osztódási folyamata, ami a sejtmag és a citoplazma osztódását foglalja magába. Négy fázisra osztható:
A profázis előtt még meg kell említeni egy szakaszt, a preprofázist. A mitózis kezdetén a preprofázis alatt alakul ki a preprofázis köteg (PPB). A PPB előrejelzi, hogy az új sejtlemez hol fog kialakulni. A sejtosztódási sík PPB hiányában drasztikusan károsodik és ezt kísérletekkel alá is támasztották. (Dhonukshe és mtsai., 2005).
Profázisban (2. ábra) a kromatinállomány vékony fonalakká alakul, majd ezek a fonalak kondenzálódnak, és a profázis végére fénymikroszkóp alatt rendszerint jól megfigyelhető a két testvérkromatida. A kondenzáció számos hiszton módosításon keresztül szabályozott. A
7
kromatidák a centromeren keresztül kapcsolódnak össze. Létrejönnek a mikrotubulus szervező központok és a sejt két ellentétes pólusa felé vándorolnak. Közben szintetizálódnak a mitotikus orsófonalak. A profázis végére (prometafázis) a sejtmagvacska és a sejtmag- hártya eltűnik (Costas és mtsai, 2011; Sutka, 2004; Velich, 2001).
Metafázisban (2. ábra) a kromoszómák kapcsolatot létesítenek a magorsó mikrotubulusaival, és a sejt központi síkjában helyezkednek el. Elérik a teljes spiralizáltságukat, felveszik a jellemző alakjukat, formájukat. A kromoszómák középsíkba rendezése és az ellentétes pólusok felé történő mozgatása az osztódási orsó segítségével történik. A mitózis központi eseménye –a testvérkromatida szegregáció – az összes eukarióta sejtben a mitotikus orsó megjelenésétől függ. Az orsó egy bipoláris mikrotubulus köteg, amit a mikrotubulus szervező központ (MTOC – microtubule organizing center) hoz létre. Az MTOC-k az S fázisban képződnek, és a profázisban hozzák létre az orsót, miközben az ellentétes pólusokra vándorolnak. Az osztódási orsóban három fonaltípust különböztetnek meg. A kromoszomális fonalak a kromoszómákat kötik össze az orsó pólusaival, a poláris fonalak pólustól a középsíkig terjedő szabad rostok. Az asztrális fonalak csak állati sejtekre jellemzőek. Az orsó összeszerelődését a mikrotubulus-függő motor proteinek váltják ki a mitózisban.
Az eukarióta sejtekben ezek a fehérjék 2 családba tartoznak: a kinezinek, amelyek általában a mikrotubulus plusz vége felé mozognak és a dineinek, amelyek a mínusz vég felé mozognak. 4 fontos típusuk van: kinezin-5, kinezin-14, kinezin-4 és 10, valamint dynein, ezek különösen fontosak az orsó összeszerelődésében és funkciójában. A növényi sejtekben is leírták a kinezinek fenti típusait, de a dineinek jelenléte nem bizonyított (Alberts és mtsai., 2008).
Kromoszomális fonalak esetében a mikrotubulusok „plusz” végei a kromoszómák centomér régiójában található kinetochorokhoz kapcsolódnak (kinetochor mikrotubulusok).
A mikrotubulusok „negatív” végei centroszómán vagy annak közelében végződnek. Anafázis során a kromoszómák mozgását az ún. kinezin fehérjecsoportba tartozó molekulák teszik lehetővé. Gyakran molekuláris motoroknak is nevezik őket. ATP hidrolizációjából nyert energia segítségével képesek megváltoztatni alakjukat, ezáltal mozgatva a kromoszómákat a centroszómák felé (Alberts és mtsai, 2008; Astor, 1986; Uhlmann, 1999; Velich, 2001).
Anafázisban (2. ábra) a testvérkromatidák közötti kohézió teljesen megszűnik, kialakulnak a saját centromerrel rendelkező kromoszómák. A visszamaradt kohézió megszüntetése jelenleg két mechanizmus alapján történhet meg (szeparáz független és a szeparáz függő mechanizmusok). A szeparáz független módon történő eltávolításnál a
8
mikrotubulusok által generált erő az, ami fizikailag eltöri a kohezin gyűrűket. A szeparáz függő mechanizmus esetében a kohezin Ssc alegységeit hasítja a szeparin (Renshaw és mtsai, 2010; Uhlmann, és mtsai, 1999). Miközben a kromoszómák a sejt két ellentétes pólusa felé mozognak, az orsó pólusai is elkezdik az ellentétes irányú mozgást. Ennek következtében a sejt jellegzetes nyújtott alakú lesz, melynek nagy szerepe van a sejtek pontos szeparációjában.
Telofázis (2. ábra) során a sejtmagok köré maghártya szintetizálódik, a kromoszómák elveszítik sajátos mitózisbeli alakjukat (despiralizálódnak) és újra láthatóvá válik a sejt magvacska. Az osztódási orsó ebben a fázisban szétszerelődik.
2. ábra: A mitotikus sejtosztódás a növényekben (Sutka, 2004).
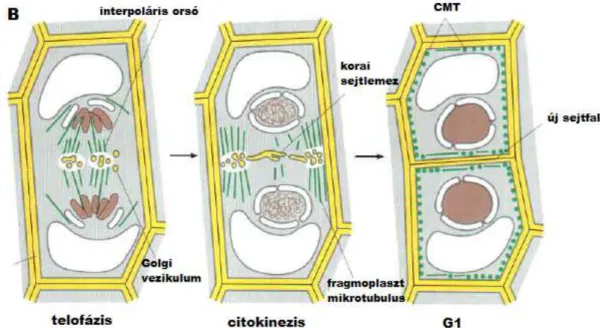
Végül a citokinezis során a sejt kettéoszlik, miközben a magorsó depolimerizálódik. A növényi sejtekben, az állati sejtektől eltérően, nem kontraktilis gyűrű osztja ketté a sejtet, hanem belülről indul meg az új sejtfal organizációja. A mitotikus orsó maradványaiból létrejön a fragmoplaszt. A fragmoplaszt mikrotubulusain keresztül motorproteinek segítségével a Golgi apparátus vezikulumai eljutnak a sejt középpontjába. A sejtfalszintézishez szükséges poliszacharidokat és glikoproteineket tartalmazó vezikulumok
9
fuzionálnak, és létrehoznak egy lemezszerű struktúrát, amit korai sejtlemeznek neveznek.
További vezikulumok fúziójával a sejtlemez kiterjed. A folyamat addig tart, amíg a sejtlemez eléri a plazmamembránt, ezáltal kettéosztva a sejtet (3. ábra) (Alberts és mtsai, 2008; Sutka, 2004; Velich, 2001).
3. ábra: A citokinezis folyamata növényi sejtekben. CMT: kortikális mikrotubulus (Alberts és mtsai, 2008).
2.3 A cilindrospermopszin
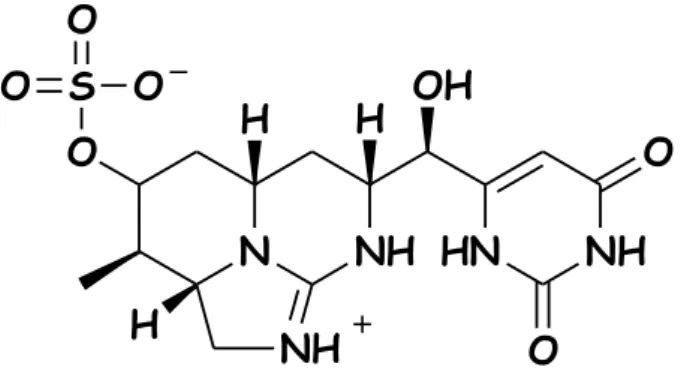
Kutatócsoportunk cilindrospermopszin (CYN) cianotoxinnal foglalkozik. A CYN egy hidroximetiluracil csoportot tartalmazó triciklikus guanidin származék, amelyeket főként Aphanizomenon és Cylindrospermopsis genuszba tartozó törzsek termelnek (Sivonen és Jones 1999). A CYN-t a szakirodalom az alkaloidok csoportjába a guanidin rész bázikus csoportja miatt sorolja (alkaloidok: növényi eredetű nitrogén tartalmú bázikus karakterű aromás vegyületek), azonban a CYN a szulfát csoport miatt ikerionos szerkezetű (Ohtani és mtsai., 1992).
10
N NH HN NH O
NH O O
S O
O O
H H OH
H
4. ábra: A CYN szerkezeti képlete (Othani és mtsai., 1992, nyomán)
A toxikus hatás kialakulásához, Banker és mtsai (2001) vizsgálatai szerint, az uracil rész feltétlenül szükséges. A CYN a pH és a hőmérséklet változásaira nem érzékeny és ráadásul kiválóan oldódik vízben. A CYN egy eukarióta protein szintézis gátló toxin, habár a molekuláris szintű hatásmechanizmusa még nem ismert. Ezen kívül beszámoltak még a pirimidin nukleotid színtézis gátló hatásáról is (Beyer és mtsai., 2009; Metcalf és mtsai., 2004). Máj szövetben megfigyeltek toxin okozta nekrózist, mely a csökkent glutation (GSH) szint miatt alakult ki (Runnegar és mtsai., 1995). Állati sejtekben megfigyelték a CYN sejtosztódásra gyakorolt gátló hatását is. Az állati illetve az emberi szervezetben a CYN elsősorban a májat károsítja, de más szervekben is előidéz szövetkárosodást (Hawkins 1985).
A CYN a vesét is károsítja, a nephrotubulusok proximális részén az epitél sejtek elpusztulnak, a glomeruluszokban vörösvértestek jelennek meg (Falconer és mtsai., 1999).
A növények esetében igen kevés tanulmány foglalkozott a CYN toxikus hatásaival, az adatok ráadásul ellentmondóak. Vasas és mtsai., (2002) mustár csíranövény tesztben vizsgálták a CYN-t, a cianotoxin gátolta a növények növekedését, az IC50 érték 18,2 µg ml-1. A Hydrilla verticillata növényekben a 0,4 µg ml-1 CYN-t tartalmazó Cylindrospermopsis raciborskii nyers kivonat enyhe növekedésserkentő hatásúnak bizonyult (Kinnear, 2008). A CYN növényekre gyakorolt citológiai hatásairól kevés adat áll rendelkezésre. Metcalf és mtsai (2004) a növényekben is kimutatták a CYN fehérjeszintézis gátló hatását.
11
3. Anyag és módszer
A lóbab (Vicia faba) csíranövényeket (Standard és ARC Egypt Cross fajták) axenikus körülmények között neveltük (Kónya és Tándor, 2008). A faj kromoszómaszáma 2n = 2x =12.
Az alacsony kromoszómaszám és a kromoszómák nagy mérete miatt, a V. faba a citogenetikusok kedvelt modellnövénye. A fentiek miatt a mitotikus kromatin szerveződés változásai jól vizsgálhatóak ebben a növényben.
3.1 A cilindrospermopszin tisztítása
A kísérleteinkhez szükséges CYN-t, egy Aphanizomenon ovalisporum (Forti) vízvirágzásból származó cianobaktérium törzsből (ILC-164) tisztították Vasas és munkatársai egy korábban közölt módszer szerint (Vasas és mtsai, 2002). A módszer röviden: 10 napig nevelt tenyészeteket centrifugáltak, majd a keletkezett üledéket -20°C hőmérsékleten tárolták.
A fagyasztott sejteket felolvasztották, majd két ismétlésben újrafagyasztották és hagyták felengedni. A kivonáshoz a sejteket egy éjszakán át 90 % (v/v) metanolban tartották (1:3 nedves tömeg: térfogat) folyamatos rázatás mellett 4°C-on. Centrifugálás után az üledéket még kétszer átmosták 100 ml 90 % (v/v) metanollal, majd az elegyített felülúszókat 40° C hőmérsékleten bepárolták. A bepárolt mintát 50 % (v/v) etanolban feloldották és 20 perc 20000 x g-n történő centrifugálás után a felülúszót gélkromatográfia (Toyopearl HW-40; 80 x 3 cm oszlop) segítségével frakcionálták. A frakciókat mustár csíranövény teszt (BGST, Kós és mtsai, 1995) segítségével ellenőrizték.
A toxikus frakciókat elegyítették, majd a töményítés után szemipreparatív C-18-as HPLC oszlopra vitték fel. Az elúciót 1-10 % (v/v) majd 10-30 % (v/v) metanol grádiens segítségével végezték. A preparátum tisztaságát HPLC és kapilláris elektroforézis módszerekkel ellenőrizték, Vasas és mtsai (2002, 2004) módszere szerint.
3.2 A Vicia faba csíranövények nevelése, és toxinkezelés
A kísérletek előtt a magvakat felületi sterilezésnek vetettük alá 50%-os hypo-oldattal 45 percig. Az oldatot 15 percenként cseréltük. Ezután a magvakat háromszor 5 percig steril desztillált vízzel mostuk, az utolsó mosásnál a magokat Erlenmeyer-lombikban hagytuk egy napig, hogy megpuhuljon a maghéj. Másnap a magvakat újrasterileztük 50%-os hypo-oldattal
12
háromszor 5 percig, majd többször mostuk őket steril desztillált vízben. Ezt követően steril körülmények között lefejtettük a maghéjat, és a magvakat agarral szilárdított táptalajon neveltük. Két táptalajt alkalmaztunk, az egyik a Gamborg vitaminjait és 2 % szacharózt tartalmazó Murashige Skoog (MS*) táptalaj (Gamborg és mtsai, 1968; Murashige és Skoog, 1962), a másik az Allen táptalaj (Allen, 1968) volt. A nevelés körülményei: fényintenzitás- 30 µmol/ m2/sec (14/10 óra fotoperiódus), hőmérséklet - fényen 22 +/-2°C, sötétben 18 +/-2°C.
A szilárd táptalajról steril körülmények között 5 ml folyékony táptalajra helyeztük a csíranövényeket, majd az első oldalgyökér kezdemények megjelenése után CYN-t adagoltunk a táptalajhoz: a kontroll mellett 0,01-20 µg/ml koncentrációtartományban adagoltuk a toxint.
Törzsoldatként 2mg/ml CYN-t használtunk. A toxinkezelés időtartama 3-6 nap volt. A toxinkezelés előtt lemértük a hajtás, a főgyökér és a leghosszabb oldalgyökér hosszát, valamint megszámoltuk az oldalgyökerek számát. Méréseinket a toxinkezelés leteltével megismételtük.
3.3 Hisztokémiai és immunhisztokémiai módszerek
A gyökércsúcsokat 16-24 órára mikrotiter lemezbe helyeztük, és PBS (NaCl tartalmú foszfát puffer) + 4%-os formaldehid oldatban vagy PBS +3,6%-os PFA (paraformaldehid) oldatban fixáltuk. Másnap a mintákat kétszer 5 percig PBS-ben mostuk, majd hozzáadtunk 40
%-os szacharóz tartalmú PBS-t és vákuuminfiltráltuk 20 percig. Négyórás inkubálást követően, fagyasztva metszést végeztünk Leica Histoslide 2000 mikrotómmal. Ezt követően, a metszeteket legalább egyszer átmostuk PBS-sel és mélyített tárgylemezre helyeztük át, 10 percig permeabilizáltuk 0,5%-os Triton X-100 tartalmú PBS-sel, majd háromszor 5 percig mostuk PBS-sel. A direkt immunfluoreszcenciás jelölés sötétben 16 órán keresztül tartott, Cy3-mal konjugált anti-ß-tubulinnal (Sigma). A jelölőoldat térfogata 30 µl, a Vicia faba esetében az antitestet harmincszorosra hígítottuk 1% BSA (borjúszérum albumin, Merck) tartalmú PBS-sel. Az antitesttel jelölt metszeteket háromszor 5 percig PBS-sel mostuk, majd ráhelyeztük a DAPI (4’,6’-diamidino-2-fenilindol, Fluka) festéket. 150 µg/ml DAPI törzsoldatot használtunk, és azt hígítottuk fel PBS-sel (a végkoncentráció 3 µg/ml volt). A festés időtartama 1 óra, sötétben. A megfestett metszeteket kétszer 5 percig PBS-sel mostuk, majd áthelyezzük egy másik tárgylemezre és antifading puffert cseppentettünk rá (összetétele:
0.1% p-feniléndiamin + 90% glicerin PBS pufferben pH 0.8-ra beállítva 0.5 M Na2CO3- 5 M NaHCO3 puffer segítségével). A preparátumokat Olympus Provis AX-70 konvencionális
13
fluoreszcens mikroszkóppal és Zeiss LSM 510 konfokális mikroszkóppal vizsgáltuk. A fluorokrómok gerjesztési hullámhosszai: 320-360 nm (DAPI) és 540-580 (Cy3) nm az Olympus Provis AX-70, 351/364 nm (DAPI) és 543 nm (Cy3) a Zeiss LSM 510 mikroszkóp esetében.
A rövidtávú szinkronkísérleteket hasonlóképpen végeztük, azzal a különbséggel, hogy a toxin hozzáadása előtt a sejteket hidroxi-urea (HU) oldattal szinkronizáltuk. Az inkubálás után steril ioncserélt vízzel kimostuk a HU-t és tiszta folyékony táptalajba helyeztük a növényeket, melyekhez hozzáadtuk a megfelelő mennyiségű CYN-t. A toxin koncentrációja 5 µg ml-1 volt. A preparátumok készítése és kiértékelése a fent említett módon történt.
3.4 DNS szintézis vizsgálatok
A lóbab (Vicia faba) csíranövények nevelése és felületi sterilezése a fent említett módon történt. A maghéjat steril körülmények között eltávolítottuk, és a magvakat Allen táptalajon neveltük melyet agarral szilárdítottunk meg, majd a megfelelő növekedési stádiumban lévő növényeket folyékony táptalajra helyeztük. A megfelelő növekedési stádiumban lévő növényekhez hidroxi-urea (HU) oldatot adtunk a sejtek szinkronizálása végett. Az inkubálást követően HU-t kimostuk a növényekből és tiszta folyékony táptalajra helyeztük. Ezek után megtörténik a mintavétel, amely során 2-3 mm oldalgyökércsúcsokat vettünk le a növényekről és ezekkel dolgoztunk tovább. A mintavételt követően az egész oldalgyökércsúcsokat 25 µM-os 5-BrdU oldattal kezeltük 1 órán keresztül 37 °C-on sötétben, majd pedig kimostuk PBS oldattal. Az 5-BrdU jelölést követően a gyökércsúcsokat PBS + 2%
formaldehid oldattal fixáltuk egy órán keresztül. Ezt követően szintén PBS-ben mostuk a mintákat majd hozzáadtunk 40 %-os szacharóz tartalmú PBS-t és vákuuminfiltráltuk 20 percig. Négyórás inkubálást követően, fagyasztva metszést végeztünk Leica Histoslide 2000 mikrotómmal. Ezt követően a DNS denaturálására 1N HCl-t használtunk, amelynek az inkubációs ideje 30 perc volt 37 °C-on. A HCl kimosás szintén PBS-sel történt. A sejtek neutralizálásához 0,1 M Borax (Na2B4O7) oldatot használtunk maximum 10 percig. Ezután következett az elsődleges ellenanyaggal történő jelölés (anti-BrdU, Sigma-Aldrich), amely 4 órán keresztül 37 °C-on sötétben történt. Az antitestet százszorosára hígítottuk 1% BSA (borjúszérum albumin, Merck) oldattal. A nem kötődött ellenanyag kimosása után következett a másodlagos ellenanyaggal (Alexa 546, Molecular Probes) történő jelölés szintén 4 órán keresztül 37 °C-on sötétben, majd pedig PBS-sel mostuk. A másodlagos ellenanyagot
14
ötvenszeresére hígítottuk szintén 1% BSA oldattal. A kromatin állomány jelölését DAPI (4’,6’-diamidino-2-fenilindol, Fluka) festékkel végeztük. 150 µg/ml DAPI törzsoldatot használtunk, és azt hígítottuk PBS-sel (a végkoncentráció 3 µg/ml volt). A festés időtartama 1 óra, sötétben. A jelölési eljárást követően pedig preparátumokat készítettünk a metszetekből.
A preparátumok elkészítése és kiértékelése a fent említett módon történt.
3.5 Kromoszóma („squash”) preparátumok készítése
A kromoszómapreparátumok készítése során a gyökércsúcsokat 0,1%-os colchicin oldattal kezeltük 4 órán keresztül, majd 20 percig fixáltuk 45% ecetsavban. Ezt követően a gyökereket 60°C-on 5,5 percig hidrolizáltuk 1N sósavban. A kromoszómákat 5%-os kármin- acetáttal festettük 60°C-on 30 percig, majd dörzspreparátumokat készítettünk.
3.6 Az oldalgyökér csúcsmerisztéma sejtek mitotikus aktivitásának vizsgálata
Az oldalgyökér csúcsmerisztéma sejtek osztódóképességének vizsgálatakor minden osztódási stádiumot külön megszámoltunk, majd az adatokból kiszámoltuk a mitotikus indexet az alábbi képlet segítségével: mitotikus index = osztódó sejtek száma/összes sejtek száma ×100. Az egyes mitotikus stádiumokban lévő sejtek arányát is kiszámítottuk. A sejtek számolásakor figyelmen kívül hagytuk a nyugvó centrum, a kialakuló szállító szövet, és a gyökérsüveg sejtjeit. A korai, ill. a késői mitotikus fázisok indexét is számoltuk.
3.7 Az adatok analízise
A növekedést és a mitotikus aktivitásokat három független kísérletben vizsgáltuk.
Minden kísérletben legalább 6 párhuzamos mintát analizáltunk. Az átlagok szórását Sigma Plot 10.0. szoftver segítségével ábrázoltuk.
15
4. Eredmények
Kísérleteinket sötétben és fényen nevelt növényeken végeztük, és két táptalajt alkalmaztunk. Ezáltal lehetőségünk nyílt arra is, hogy megnézzük, hogyan módosítja a megvilágítás a toxin hatását, valamint két eltérő táptalaj, egy szénhidrát tartalmú (MS*) és egy minimál táptalaj (Allen) módosító hatását is vizsgáltuk. A két Vicia fajtában végzett kísérletek alapján meg tudtuk állapítani, hogy az eredmények genotípusonként milyen mértékben térnek el.
4.1 CYN hatása a Vicia faba csíranövények növekedésére
A Vicai faba (Standard) fajta esetében a CYN-nek folyamatos megvilágítás mellett nem volt szignifikáns hatása a növekedésre rövidtávú (3 napos) kezelések során, kivéve a főgyökeret, ahol 5 µg ml-1 –es toxin koncentrációig serkentő, efölött pedig gátló hatása volt.
Hosszú távú (6 napos) kezeléseknél kettős válaszreakciót tapasztaltunk a toxin koncentráció függvényében. Az alacsony CYN koncentráció serkentő hatással volt a hajtás és főgyökér növekedésre valamint az oldalgyökerek kialakulására is. Magasabb koncentráció tartományban (5-20 µg ml-1) ezzel szemben enyhe növekedés gátlást figyeltünk meg a hajtás valamint szignifikáns gátlást tapasztaltunk a főgyökér növekedésében. 10-20 µg ml-1 –es toxin koncentráció tartományban gyenge gátlás volt megfigyelhető az oldalgyökerek fejlődésében. Sötétben nevelt növényeknél nem figyeltünk meg számottevő változást a hajtásnövekedésben viszont a főgyökér növekedése már kis koncentrációban is gátolt volt. A CYN kis koncentrációban (1 µg ml-1) serkentette az oldalgyökerek kialakulását, míg magas koncentráció tartományban (10 µg ml-1) gátolta azok kifejlődését.
A rövid és hosszú távú toxin tesztek (azonos körülmények között) hasonló tendenciát mutattak azzal a különbséggel, hogy, a hosszú távú tesztek során hangsúlyosabban jelentkeztek a toxin okozta növekedésváltozások.
Az ARC fajta esetében mind rövid (3 nap) mind hosszú távú (6 nap) kezelések során az epikotil növekedése gátolt volt. Főgyökér esetében alacsony (0.1 µg ml-1) toxinkoncentráció mellett serkentést, míg magasabb koncentráció mellett növekedés gátlást tapasztaltunk. A 6 napos kezelés esetében a növekedésserkentés intenzívebben jelentkezett. A toxin 1 µg ml-1 koncentrációig serkentően hatott az oldalgyökerek növekedésére 3 napos kezelések alatt, míg 6 napos kezelések alkalmával gátolta ezek növekedését. Az oldalgyökerek számában hasonló tendencia figyelhető meg.
(a) (b)
16
5. ábra: Vicia faba (Standard) növények morfológiája a toxintesztek után. (a) 6 napos, MS*, folyamatos fény. (b) 6 napos, Allen, folyamatos fény. (c) 3 napos, Allen, sötét.
4.2 A CYN mitotikus aktivitásra kifejtett hatása
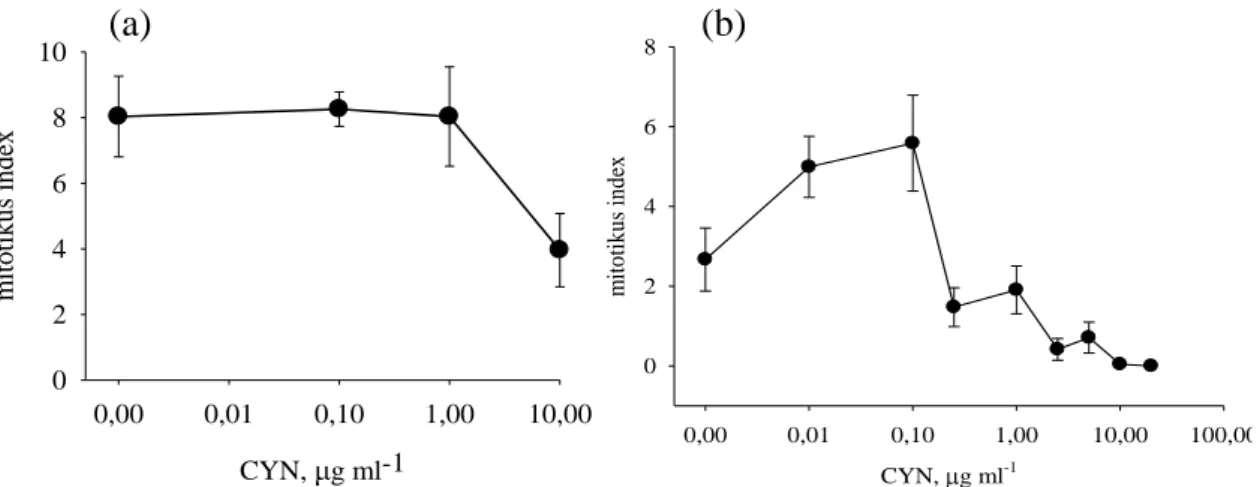
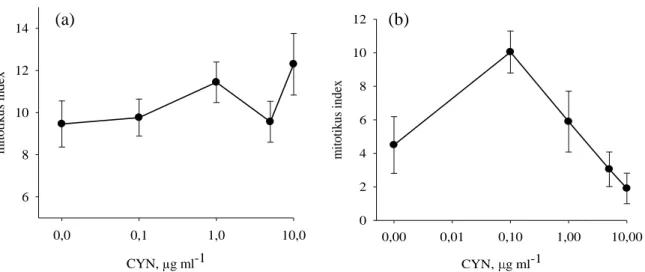
A Vicia faba (Standard) fajta esetében két különböző táptalajon végzett tesztek során (azonos megvilágítás mellett) összehasonlítottuk a mitotikus indexeket. Szacharóz tartalmú MS* táptalon a toxin nem váltott ki mitotikus aktivitásbeli serkentést, míg Allen táptalajon 0,01-0,1 µg ml-1 toxinkoncentráció tartományban magasabb volt a mitotikus index a kontrollhoz képest. Magas CYN koncentráció a mitózisok számának drasztikus csökkenését okozta. Magasabb CYN koncentrációk mellett (10-20 µg ml-1) a mitózis gátlását tapasztaltuk mindkét táptalaj típus esetében.
K 0.1 1 10 K 0.1 1 10
K 0.1 1 5 10 (c)
17
CYN, g ml-1
0,00 0,01 0,10 1,00 10,00
mitotikus index
0 2 4 6 8 10
CYN, g ml-1
0,00 0,01 0,10 1,00 10,00 100,00
mitotikus index
0 2 4 6 8
6. ábra: Vicia faba mitotikus aktivitások állandó fényen nevelt növényeknél 6 napos kezelések során, 2 különböző táptalajtípuson. (a) MS táptalajon nevelt növények mitotikus indexe (P+PM+M+A+T). (b) Allen táptalajon nevelt növények mitotikus indexe.
Rövidtávú tesztek során a megvilágítás számottevően nem befolyásolta a mitotikus indexek alakulását. Fényen nevelt növények esetében a mitotikus index magasabb volt, mint a sötétben nevelt növényeknél. Hosszú távú tesztek során alacsony toxinkoncentrációban (0.01- 1 µg ml-1) serkentette a mitotikus aktivitást, míg magasabb koncentrációban (2.5-20 µg ml-1) gátolta azt.
Az ARC fajta esetében mitotikus indexben 3 napos kezelések során enyhe növekedést, míg 6 napos kezeléseknél 0,1 µg ml-1 toxinkoncentrációig a mitózisban egy intenzívebb serkentést majd pedig magasabb koncentrációkban egy erős gátlást figyeltünk meg. A 3 napos kezelések során a korai (P+PM+M) és a kései (A+T) mitotikus fázisok számában egyaránt növekedést tapasztaltunk, de arányaiban az ana- és telofázisos sejtek száma növekedett nagyobb mértékben.
(a) (b)
18
7. ábra: ARC Egypt Cross Allen táptalajon nevelt növények mitotikus indexe (a) 3 napos és (b) 6 napos kezelések során.
4.3 Szövettani és citológiai elváltozások
3 napos tesztek során a CYN nem okozott szöveti nekrózist a Vicia faba gyökerekben.
Kontroll növényekből származó főgyökér keresztmetszeteken nem tapasztaltunk szöveti elváltozásokat (8. a ábra). A 6 napos tesztek során viszont barnás foltokat, nekrózist figyeltünk meg a főgyökéren magas toxinkoncentráció mellett. 0.1-5 µg mL-1 toxin koncentráció tartományban nekrotikus foltok (8. b ábra), míg magas (10-20 µg mL-1) koncentrációnál két nekrotikus gyűrű alakult ki a kortexben és a rizodermiszben (7. c ábra). A nekrózis mindkét Vicia faba fajtánál jelentkezett CYN hatására.
8. ábra: CYN indukálta sejthalál Vicia faba (Standard) gyökérben. (a, c) főgyökér keresztmetszetek (6 napos, Allen táptalaj, folyamatos fény). (a) Kontroll. (b) 1 µg ml-1-es CYN koncentrációnál nekrotikus foltok (nyilak). (c) 20 µg ml-1 CYN koncentráció a 2 nekrotikus gyűrűvel (nyilak). Lépték: 300 µm
CYN, g ml-1
0,0 0,1 1,0 10,0
mitotikus index
6 8 10 12 14
CYN, g ml-1
0,00 0,01 0,10 1,00 10,00
mitotikus index
0 2 4 6 8 10
(a) 12 (b)
(a) (b) (c)
19
A kontroll növények interfázisos merisztéma sejtjei normális mag morfológiát mutattak (9. a ábra). Minden vizsgált koncentrációban CYN hatására sejtmag morfológiai változás következett be függetlenül a kezelés időtartamától (3 és 6 nap), a megvilágítástól és a Vicia faba fajtájától (9. b ábra). Kontroll gyökérszőrökre az ép kromatin állomány volt jellemző (8.
c ábra). 6 napos kezelés során magas CYN koncentrációnál (10-20 µg mL-1) a sejtmag részleges vagy teljes fragmentálódását figyeltük meg (9. d, e ábra).
9. ábra: (a, b) Oldalgyökér csúcsmerisztéma sejtek DAPI jelölése ( 3napos, sötétben nevelt).
(d) Kontroll, (e) 5 µg ml-1- es CYN koncentrációnál jelentkező sejtmag morfológiai változás. (c-e) Gyökérszőrök 6 napos folyamatos fényen nevelt növényeknél. (c) Kontroll gyökérszőrök ép sejtmagokkal, (d) sejtmag degradációja 10 µg ml-1- es CYN koncentrációnál, (e) a sejtmag fragmentálódása 20 µg ml-1- es CYN koncentrációnál.
A mikrotubulusok organizációjának vizsgálata során CYN hatására a preprofázisban kialakuló preprofázis köteg (PPB) rendellenességeire lettünk figyelmesek. Alacsony toxin koncentrációnál kialakult aszimmetrikus, hasadt és dupla PPB is. Normál esetben a PPB a sejt középvonalán található (10. a ábra). Ha egy nagyobb kötegelési hiba esetén két PPB jelenik
(a)
(b)
(c) (d) (e)
20
meg egy sejtben azt dupla (10. b ábra), ha a kötegelésben valahol hiba történik, és valahol kettéválik akkor hasadt (10. c ábra), és ha a PPB sejtmaghoz viszonyított helyzete excentrikus, akkor aszimmetrikus PPB-nek nevezzük (10. d ábra). A rendellenes PPB-k megjelenése általánosnak mondható 0.1-10 µg ml-1 –es CYN koncentráció tartományban mindkét Vicia faba fajtában. A rendellenes PPB-k megjelenése független a kezelési időtől és a fényviszonytól is.
Továbbá CYN kezelés hatására megfigyelhető volt az osztódási sík drasztikus változása is. Magas (5-10 µg ml-1) CYN koncentrációnál a mitotikus sejtek véletlenszerű antiklinális és periklinális osztódási mintázatot mutattak (10. e, f ábra).
21
(f)
(e) (a)
(b)
(d)
anti-β-tubulin DAPI
Fig. 4.
(c)
10. ábra: CYN okozta elváltozások a preprofázis köteg (PPB) formációjában (a-d). (a) Normál PPB organizáció kontroll oldalgyökér merisztéma sejtekben (Standard, 3 nap, sötét). (b) Dupla PPB 3 napos kezelésnél sötétben nevelt Standard fajtánál 1 µg ml-1- es CYN koncentráció mellett. (c) Hasadt PPB (nyíl mutatja a hasadás helyét) folyamatos megvilágítás mellett 6 napos kezelésben 0,1 µg ml-1- es CYN koncentrációnál, (d) aszimmetrikus PPB-k folyamatos megvilágítás mellett 3 napos kezelésben 0,1 µg ml-1- es CYN koncentrációnál (Standard). (e) oldalgyökér kontroll merisztéma 6 napos kezelésnél ARC Egypt Cross fajtánál, (f) megváltozott osztódási sík ARC Egypt Cross fajtánál (a nyilak mutatják) 6 napos kezelés és folyamatos megvilágítás mellett 5 µg ml-1- es CYN koncentrációnál.
22
4.4 A CYN rövidtávú hatásai a mitózisra és a fehérjeszintézisre
A szinkronizált Vicia faba kontroll oldalgyökércsúcs merisztéma sejtek maximális mitotikus aktivitása a HU kimosása után 8-9 órával volt (11. a ábra). Ez egybeesett a korai és késői mitózisban lévő sejtek nagy százalékánál. A korai mitotikus sejtek a profázisban, prometafázisban és a metafázisban lévő sejtek, míg a késői mitotikus sejtek az anafázisban és telofázisban lévő sejtek összege. 5 µg ml-1 –es CYN koncentrációban végeztük a kezelést.
Megfigyeltük, hogy a CYN késlelteti a korai mitózisba való belépést. A maximális aktivitás a HU kimosása után 12-14 órával következett be (11. b ábra). A késői mitotikus index pedig a HU kimosása után 12-18 órával érte el a maximumot (11. c ábra), ami azt jelenti hogy a CYN a mitózisból való kilépést is késlelteti ami a sejtosztódás meghosszabbodását eredményezi.
Sinapis alba (fehér mustár) csíranövényeken elvégzett rövidtávú szinkronkísérletek megerősítették a Vicia faba növényekben kapott eredményeinket miként a toxin nem csak késlelteti a mitózisba való belépést, hanem az abból való kilépést is gátolja. Mivel a növekedési és mitotikus görbék némileg eltérnek, ezért arra következtetünk, hogy a toxin nem csak a sejtosztódásra van hatással, de a sejtek megnyúlását is befolyásolja.
idő (h) HU kimosás után
0 5 10 15 20 25
mitotikus index
-5 0 5 10 15 20 25
kontrol CYN 5
idő (h) HU kimosás után
0 5 10 15 20 25
P+PM+M index
0 5 10 15 20
kontrol CYN5
idő (h) HU kimosás után
0 5 10 15 20 25
A+T index
0 2 4
6 kontrol
CYN5
(b)
(a)
(c)
23
11. ábra: CYN rövidtávú hatása a mitózisra ARC Egypt Cross fajtánál. (a) Össz mitotikus index (P+PM+M+A+T), (b) Korai mitotikus index (P+PM+M), (c) késői mitotikus index (A+T).
S. alba csíranövények kontroll nem szinkronizált gyökereit 35S-metioninnal jelölték, amely megmutatta, hogy a fehérjeszintézis két ciklusa ment végbe a vizsgálat időtartama alatt.
A fehérjeszintézis maximális szintje a csírázás után 15-16 és 38-39 órával történt. 18 µg ml-1- es CYN koncentráció a S. alba csíranövények 50%-os növekedés gátlását okozta és késleltette a fehérjeszintézist (Vasas és mtsai., 2002). A toxinkezelésnél is két csúcs volt megfigyelhető, mint a kontrollban. Az első ciklusban a fehérjeszintézis gátolt volt a kontrollhoz képest, a maximális csúcs 16-18 óránál volt. A második ciklusban a fehérjeszintézist serkentette a CYN és a maximális értéket a csírázás megkezdése után 39-40 órával érte el.
4.5 DNS szintézis vizsgálatok kidolgozása
Több próbálkozás és sikertelenség után sikerült optimalizálni a DNS szintézis vizsgálatokhoz szükséges részfolyamatokat és jelöléseket. A kísérlet kezdeti lépéseit jelen esetben a magok sterilezését a magok csíráztatását valamint a HU kezelést a fentebb említettek alapján végeztük el. Több vizsgálat után sikerült meghatározni azt az 5-BrdU koncentrációt, amelynél csak a sejtosztódás S fázisában lévő sejtek jelölődnek. Ez a koncentráció jelen esetben 25 µM, amellyel 1 órán keresztül 37 °C-on sötétben kezeljük a 2-3 mm-es gyökércsúcsokat. A következő lépésben a fixálás időtartamát egész éjszakásról 1 órára valamint a formaldehid koncentrációját 4%-ról 2% csökkentettük. Erre azért volt szükség, mivel a formaldehid keresztkötéseket hoz létre a fehérjék között és emiatt nem tud az ellenanyag a már a DNS-be épült 5-BrdU-hoz kötődni. Az 50 perces 1N HCl kezelés időtartamát 30 percre csökkentettük, de továbbra is 37 °C-on sötétben történt a kezelés. Ezt követően szükségét éreztük a sejtek neutralizálásának, amelyet egy 0,1 M Borax (Na2B4O7) oldattal való maximun 10 perces kezeléssel értünk el. Az elsődleges és másodlagos ellenanyaggal való jelöléseket nem kellett megváltoztatnunk mivel azok jónak bizonyultak.
Másodlagos ellenanyag próbát is végeztünk annak érdekében, hogy biztosak legyünk abban, hogy a másodlagos ellenanyag csak specifikusan az elsődleges ellenanyaghoz kötődik e. A próba sikeres volt mivel, csak másodlagos ellenanyaggal jelölt metszeteknél nem figyeltünk meg fluorescens jelet.
24
5. Diszkusszió
A Standard genotípus esetében 3 napos kezelések során nem tapasztaltunk változást az epikotil növekedésében. 6 napos és állandó megvilágítás mellett végzett tesztek eredményei alapján 0,1 µg ml-1 koncentrációig a toxin serkentette a hajtás növekedését, fölötte gátló hatással volt a növekedésre. Az ARC fajta esetében a CYN gátolta az epikotil növekedését.
A főgyökér esetében eltérő eredményeket kaptunk:
A Standard fajta esetében a 3 napos tesztek során, a fényen nevelt növényeknél növekedésserkentést tapasztaltunk, és csak igen magas koncentrációban volt gátolt a főgyökér növekedése, ARC fajtánál alacsony toxinkoncentráció kis mértékben serkentette, magas koncentráció pedig gátolta a főgyökér növekedését. A sötétben tartott 3 napos Standard növényeknél a CYN már alacsony koncentrációban is gátolta a növekedést.
A Standard fajtán végzett 6 napos kezelések alkalmával, valamint az ARC fajta esetében mind rövid, mind hosszú távú teszteknél kettős választ figyeltünk meg, 0,1 µg ml-1 koncentrációig serkentő, fölötte gátló hatást detektáltunk.
Oldalgyökerek esetében 3 napos teszteknél, alacsony CYN koncentráció mellett mindkét fajtában méretbeli és számbeli növekedést tapasztalunk, viszont magas koncentrációban gátlást tapasztaltunk, kivéve a sötétben tartott Standard fajtánál, ahol 10 µg ml-1 CYN koncentrációnál tovább nőtt az oldalgyökerek száma, viszont ezek növekedése gátolt volt.
Hosszú távon az oldalgyökerek kialakulása és növekedése már alacsony CYN koncentráció mellett egyaránt gátolt volt.
A CYN növekedésre gyakorolt hatása az irodalmi adatok alapján minden növényben más és más. A CYN jelentősen gátolta a gyökerek megnyúlásos növekedését az axenikus nádnövényekben, az új gyökerek képződésére a CYN induktív hatásúnak bizonyult. A tengelyszervek növekedését a CYN gátolta mustár csíranövényekben (Vasas és mtsai, 2002), Hydrilla verticillata vízinövényben azonban a CYN tartalmú kivonatnak stimuláló hatása volt mind a tengelyszervek növekedésére, mind az új gyökerek képződésére (Kinnear és mtsai, 2008). A CYN fehérjeszintézis gátló hatású (Froscio és mtsai, 2008), tehát metabolikus inhibítorként gátolhatja a növények növekedését. Azonban a fehérje szintézis inhibítorok a stressz válaszra jellemző élettani és biokémiai változásokat is indukálnak a növényekben, amely magában foglalja a megnyúlásos növekedés gátlását (Dhindsa és Cleland, 1975).
Kinnear és mtsai (2008) szerint a Hydrilla növény a gyökerek számának és tömegének növelésével nagyobb detoxifikáló kapacitásra tesz szert. A kutatók kimutatták, hogy a gyökerek képesek a CYN részleges lebontására, a megnövekedett gyökértömeg
25
hatékonyabban hidrolizálja a cianotoxint. A fentiekből arra következtettünk, hogy a gyökerek esetén a CYN által indukált megnyúlásos növekedés gátlás a stresszválasz része, míg a gyökérszám növekedése védekezési reakció, amely a detoxifikáló kapacitást növeli (Beyer, 2010). A jelen munkában megfigyelt gyökérnekrózis (8. ábra) szintén védekezési reakció: a rizodermisz és a kortex szöveteinek elhalása megakadályozhatja a toxin továbbítását a xylem irányába.
A mitotikus aktivitás vizsgálata során megállapítottuk, hogy a megvilágítás nem befolyásolta a sejtosztódást, viszont a két eltérő tápközegben nevelt növényeknél már különbséget tapasztalunk a mitotikus indexekben. Allen táptalajon végzett hosszú távú kísérletek során a Standard növények ún. kettős válaszreakciót mutattak, azaz alacsony CYN koncentráció mellett megnőtt a mitotikus sejtek aránya, míg magas koncentráció gátolta a mitózist. Ezt a jelenséget egy másik cianotoxinnal, a mikrocisztin-LR-rel kapcsolatos kísérletek során is megfigyelték (Máthé és mtsai 2009).
Az ARC fajta szintén mutatta a kettős válaszreakciót 6 napos kísérletek során, viszont rövid távú tesztek során nem tapasztaltunk gátlást a mitotikus indexben.
Az ARC Egypt Cross fajta esetében mind a korai mind pedig a kései mitotikus fázisokban emelkedést tapasztaltunk, de a P+PM+M indexek nem mutattak szignifikáns különbséget kezelt és kezeletlen növényekben, míg az A+T indexek esetében, 10 µg ml-1 –es toxinkoncentrációval kezelt növényekben jelentős különbség mutatkozott a kontroll növényekhez képeset. Ebből adódóan szükségesnek éreztük rövid távú szinkronkísérletek elvégzését.
Rövidebb (3 napos) kezelésnél a CYN nincs jelentős hatással a mitotikus aktivitásra, de késlelteti a mitózist szinkronizált sejtekben nagyobb 5 µg ml-1-es koncentrációban 24 órás kezelés alatt. Ugyanez a hatás figyelhető meg Sinapis alba csíranövényeknél is valamint a toxin késlelteti a de novo fehérjeszintézist is a vizsgálat időtartama alatt (43h). A CYN növeli a késői mitózis időtartamát Vicia faba csíranövényekben és ezáltal késlelteti a mitózisból való kilépést is.
A citológiai vizsgálatok során elváltozásokat figyeltünk meg a preprofázis köteg formációjában. A rendellenességeket mindkét fajtánál megfigyeltük, ezek kialakulása nem függ a tesztek időtartamától, a tápközeg minőségétől és a megvilágítástól sem. A CYN más modellnövényben is okozott rendellenes PPB-ket, ezért úgy gondoljuk, hogy ez a hatás általános a növényi sejtek esetében (Beyer és mtsai, 2009).
A preprofázis köteg kontroll sejtekben is megduplázódhat (Hasezawa és mtsai, 1994), mi azonban nem találtunk eltéréseket a kontroll növényekben. Nogami és mtsai, (1996)
26
cikloheximid kezelt hagyma gyökerekben széles és dupla PPB-ket figyeltek meg. A jelenség hátterében feltehetőleg a mikrotubulusok kötegelésében résztvevő fehérjék mennyiségének csökkenése áll. Dohány sejtekben a cikloheximid kezelés szintén indukálta a dupla preprofázisok kialakulását (Mineyuki, 1999). Ezek a megfigyelések arra utalnak, hogy a CYN a PPB-re gyakorolt hatása összefüggésben áll a toxin által kiváltott fehérjeszintézis gátlással (Beyer, 2010).
A kettős PPB-k kialakulása az osztódási sík eltolódását eredményezi, ez pedig ferde osztódási orsó és fragmoplaszt kialakulásához vezet. Ezek a jelenségek sejt- és szövetmorfológiai változásokat okoznak (Dhonukshe és mtsai., 2005).
27
6. Összefoglalás
Munkánk során igazoltuk a magas (10-20 µg ml-1) CYN koncentráció V. faba növényekre gyakorolt növekedés gátló hatását mind hajtás mind gyökér esetében, továbbá gyökér nekrózist is tapasztaltunk. A nekrózis feltételezhetően egy védekezési mechanizmus része, a növény így próbálja gátolni a toxin szállítószövetbe való bejutását. A toxin növekedésre gyakorolt hatása nagymértékben függ a megvilágítástól, a kezelés időtartamától és a genotípustól. 6 napos kezelések során hajtás esetében a Standard fajtában kis toxin koncentráció mellett serkentés, míg nagy koncentrációban gátlás volt megfigyelhető. Ezzel szemben az ARC fajtánál csak gátlást tapasztaltunk az epikotil növekedésben. Főgyökér esetében kettős válaszreakció volt megfigyelhető: mindkét fajtánál a fényen végzett 3 és 6 napos tesztek során a főgyökerek növekedésében alacsony toxinkoncentráció mellett serkentést, míg magas koncentráció mellett gátlást tapasztaltunk. Az oldalgyökerek számában és méretében is növekedést figyeltünk meg alacsony CYN koncentrációnál, míg magas koncentrációban gátlást tapasztaltunk mindkét fajtánál kivéve a sötétben nevelt Standard fajtát ahol magas CYN koncentráció mellett is nőtt az oldalgyökerek száma.
A megvilágítás számottevően nem befolyásolta a mitotikus indexek alakulását, de Allen táptalajon 6 napos kezeléseknél 0,01-0,1 µg ml-1 toxinkoncentráció tartományban a mitotikus index jelentősen magasabb volt a kontrollhoz képest. Ez a tendencia MS* táptalajon nem jelentkezett. Magas CYN koncentráció a mitózisra nézve gátló hatású volt. 3 napos tesztek során azt tapasztaltuk, hogy a mitotikus index magas toxinkoncentráció mellett is tovább nő, és a korai (P+PM+M) és a kései (A+T) mitotikus fázisok számában egyaránt növekedést tapasztaltunk, de arányaiban az ana- és telofázisos sejtek száma növekedett nagyobb mértékben. Ebből adódóan azt feltételezzük, hogy a növények késői mitózisból való kilépését gátolja a CYN, melyet rövidtávú szinkronkísérletekkel igazoltunk. Mivel a növekedési és mitotikus görbék némileg eltérnek, ezért arra következtetünk, hogy a toxin nem csak a sejtosztódásra van hatással, de a sejtek megnyúlását is befolyásolja.
A rövidtávú szinkronkísérletek során azt tapasztaltuk, hogy a CYN késlelteti a mitózisba való belépést és gátolja a mitózisból való kilépést is. Ennek hatására a sejtosztódás M fázisának időtartama megnő. A mitózist, korai és késői mitotikus indexre lebontva szintén megfigyelhető volt ez a tendencia.
A citológiai vizsgálatok során a kontroll növényekre nem jellemző hasadt és dupla preprofázis kötetegeket figyeltünk meg a toxinnal kezelt növények esetében. A jelenség általános volt az alacsony CYN koncentrációval kezelt növényeknél. A jelenség feltehetően a
28
toxin fehérjeszintézis gátló hatása következtében a mikrotubulusok kötegelésében résztvevő fehérjék mennyiségének csökkenésével magyarázható. A rendellenes PPB-k a sejtciklus későbbi szakaszaira is hatással vannak, hatásukra ferde osztódási orsó és fragmoplaszt alakul ki.
29
7. Köszönetnyilvánítás
Köszönettel tartozom témavezetőnek Dr. habil. Máthé Csaba egyetemi adjunktusnak hogy lehetővé tette, nyomon követte és szakmai tapasztalatával segítette és koordinálta munkámat.
Szeretnék köszönetet mondani Dr. Mészáros Ilona tanszékvezető asszonynak, hogy lehetőséget biztosított arra, hogy a DE TTK Növénytani tanszékén készítsem diplomamunkámat.
Köszönet illeti Riba Milán első éves PhD hallgatót, akivel közösen végeztük a kutatómunkát.
Köszönjük Dr. Vasas Gábornak és munkatársaink a kísérletek során felhasznált toxint.
Köszönjük Dr. Vereb György, Dr. Roszik János és Dr. Beyer Dániel segítségét a konfokális mikroszkóppal végzett megfigyelésekért.
A Vicia faba ARC Egypt Cross magokat Dr. Walid M El-Rodeny (Centre of Agricultural Research, Institute of Field Crops Research, Food Legumes Research Section, P.O. Box 33717, Sakha Agricultural Research Station, Kafr El-Sheikh, Egyiptom) bocsátotta rendelkezésünkre, amit ezúton is köszönünk
Szeretnék köszönetet mondani a DE TEK TTK Növénytani Tanszék minden jelenlegi és volt dolgozójának, PhD hallgatójának illetve szakdolgozójának, akik segítették a munkámat és köszönöm, hogy munkámat kellemes légkörben, barátok között végezhettem.
Külön köszönet illeti:
Dr. Jámbrik Katalint, Tándor Ildikót és Jambrovics Károlyt, akik segítségemre voltak a szakmai problémák megoldásában.
Fülöpné Barabás Évát, aki a metszetek elkészítésében nyújtott segítséget.
A kutatás a TÁMOP-4.2.4.A/2-11/1-2012-0001 azonosító számú Nemzeti Kiválóság Program – Hazai hallgatói, illetve kutatói személyi támogatást biztosító rendszer kidolgozása és működtetése konvergencia program című kiemelt projekt keretében zajlott. A projekt az Európai Unió támogatásával, az Európai Szociális Alap társfinanszírozásával valósul meg.
30
8. Irodalomjegyzék
1. Alberts, B., Johnson, A., Lewis, J., Raff, M., Roberts, K., Walter, P. (2008). Molecular biology of the cell, 5th edition. Garland Science.
2. Allen, M.M. (1968) Simple conditions for the growth of unicellular blue-green algae on plates. J. Phycol. 4, 1–4.
3. Banker, R., Carmeli, S., Werman, M., Teltsch, B., Porat, R., Sukenik, A. (2001) Uracil moiety is required for toxicity of the cyanobacterial hepatotoxin cylindrospermopsin.
Journal of Toxicology and Environmental Health Part A: 62, 281-288.
4. Beyer, D., Surányi, G., Vasas, G., Roszik, J., Erdődi, F., M-Hamvas, M., et al. (2009).
Cylindrospermopsin induces alterations of root histology and microtubule organization in common reed (Phragmites australis) plantlets cultured in vitro.
Toxicon, 54(4), 440-449.
5. Costas, C., Desvoyes, B., & Gutierrez, C. (2011). A chromatin perspective of plant cell cycle progression. Biochimica et Biophysica Acta.
6. Dhindsa, R.S., Cleland, R.E. (1975). Water stress and protein synthesis II. Interaction between water stress, hydrostatic pressure, and abscisic acid on the pattern of protein synthesis in Avena coleoptiles. Plant Physiology: 55, 782–785.
7. Dhonukshe, P., Mathur, J., Hulskamp, M., Gadella, T.W.J. (2005) Microtubule plus- ends reveal essential links between intracellular polarization and localized modulation of endocytosis during division-plane establishment in plant cells. BMC Biology: 3, 11.
8. Downing, K.H., Nogales, E. (1998) Tubulin structure: insights into microtubule properties and functions. Current Opinion in Structural Biology: 8, 785-791.
9. Falconer, I.R., Hardy, S.J., Humpage, A.R., Froscio, S.M., Tozer G.J., Hawkins, P.R., (1999) Hepatic and renal toxicity of the blue-green alga (cyanobacterium) Cylindrospermopsis raciborskii in male Swiss Albino mice. Environmental Toxicology: 43, 143-150.
31
10. Froscio, S.M., Humpage, A.R., Burcham, P.C., Falconer, I.R. (2001) Cell-free protein synthesis inhibition assay for the cyanobacterial toxin cylindrospermopsin.
Environmental Toxicology: 16, 408-412.
11. Froscio, S.M., Humpage, A.R., Wickramasinghe, W., Shaw, G., Falconer, I.R. (2008) Interaction of the cyanobacterial toxin cylindrospermopsin with the eukaryotic protein synthesis system. Toxicon: 51, 191-198.
12. Goddard, R.H., Wick, S.M., Silflow, C.D., Snustad, D.P., (1994) Microtubule components of the plant cell cytoskeleton. Plant Physiology: 104, 1-6.
13. Gamborg, OL., Miller, RA., Ojima, K., (1968) Nutrient requirements of suspension cultures of soybean root cells. Exp. Cell Res. 50: 151-158.
14. Gácsi, M., Antal, O., Vasas, G., Máthé, C., Borbély, G., Saker, M.L., Gyıri, J., Farkas, A., Vehovszky, Á., Bánfalvi, G., (2009) Comparative study of cyanotoxins affecting cytoskeletal and chromatin structures in CHO-K1 cells. Toxicology in vitro: 23, 710- 718.
15. Hasezawa, S., Sano, T., Nagata, T., (1994) Oblique cell plate formation in tobacco BY-2 cells originates in double preprophase bands. Journal of Plant Research: 107, 355–359.
16. Hawkins, P.R., Runnegar, M.T.C., Jackson, A.R.B., Falconer, I.R., (1985) Severe hepatotoxicity caused by the tropical cyanobacterium (blue-green alga) Cylindrospermopsis raciborskii (Woloszynska) Seenaya and Subba Raju isolated from a domestic water supply reservoir. Applied and Environmental Microbiology: 50, 1292-1295.
17. Humpage, A.R., Fenech, M., Thomas, P., Falconer, I.R., (2000) Micronucleus induction and chromosome loss in transformed human white cells indicate clastogenic and aneugenic action of the cyanobacterial toxin, cylindrospermopsin. Mutation Research-Genetic Toxicology and Environmental Mutagenesis: 472, 155-161.
18. Jacalyan, V., Ben, D., Jamina, O., Dale, B., Kerry, B., Michael, S., (2001) Phosphorylation of γ-Tubulin Regulates Microtubule Organization in Budding Yeast.
Developmental Cell: 1, 621-631.
32
19. Joshi, H.C., (1998) Microtubule dynamics in living cells. Current Opinion in Cell Biology: 10, 35-44.
20. Kinnear, S.H.W., Fabbro, L., Duivenvoorden, L.J., (2008) Variable growth responses of water thyme (Hydrilla verticillata) to whole-cell extracts of Cylindrospermopsis raciborskii. Archives of Environmental Contamination and Toxcology: 54, 187–194.
21. Kónya, Z., Tándor, I., (2008) A mikrocisztin-LR hatása a mitotikus citoszkeleton és kromatin szerveződésére Vicia faba gyökércsúcsokban. OTDK pályamunka.
22. Kós, P., Gorzó, Gy., Surányi, Gy., Borbély, G., (1995) Simple and efficient method for isolation and measurement of cyanobacterial hepatotoxins by plant tests (Sinapis alba L.). Analytical Biochemistry 225: 49-53.
23. Máthé, C., Beyer, D., Erdődi, F., Serfőző, Z., Székvölgyi, L., Vasas, G., MHamvas, M., Jámbrik, K., Gonda, S., Kiss, A., Szigeti, Z.M., Surányi, G., (2009) Microcystin- LR induces abnormal root development by altering microtubule organization in tissue- cultured common reed (Phragmites australis) plantlets. Aquatic Toxicology: 92, 122–
130.
24. McNally, F. J., (1996) Modulation of microtubule dynamics during the cell cycle.
Current Opinion in Cell Biology: 8, 23-29.
25. Metcalf, J. S., Barakate, A., & Codd, G. A., (2004) Inhibition of plant protein synthesis by the cyanobacterial hepatotoxin, cylindrospermopsin. FEMS Microbiology Letters, 235(1), 125-129.
26. Michaelis, C., Ciosk, R., & Nasmyth, K., (1997) Cohesins: Chromosomal proteins that prevent premature separation of sister chromatids. Cell, 91 (1), 35-45.
27. Mineyuki, T., (1999) The preprophase band of microtubules: its function as a cytokinetic apparatus in higher plants. International Review of Cytology: 187, 1-49.
28. Murashige, T., Skoog, F., (1962) A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiol. Plant. 15: 473-497.
29. Nogales, E., (1999) A structural view of microtubule dynamics. Cellular and Molecular Life Sciences: 56, 133-142.
33
30. Nogami, A., Suzaki, T., Shigenaka, Y., Nagahama, Y., Mineyuki, Y., (1996) Effects of cycloheximide on preprophase bands and prophase spindles in onion (Allium cepa L) root tip cells. Protoplasma: 192, 109-121.
31. Ohtani, I., Moore, R.E., Runnegar, M.T.C., (1992) Cylindrospermopsin: a potent hepatotoxin from the blue-green alga Cylindrospermopsis raciborskii. Journal of the American Chemical Society: 114, 7941–7942.
32. Renshaw, M. J., Ward, J. J., Kanemaki, M., Natsume, K., Nédélec, F. J., & Tanaka, T.
U. (2010) Condensins promote chromosome recoiling during early anaphase to complete sister chromatid separation. Developmental Cell, 19(2), 232-244.
33. Runnegar, M.T., Kong, S.M., Zhong, Y.Z., Lu, S.C., (1995) Inhibition of reduced glutathione synthesis by cyanobacterial alkaloid cylindrospermopsin in cultured rat hepatocytes. Biochemical Pharmacology: 49, 219-225.
34. Sukenik, A., Reisner, M., Carmeli, S., Werman, M., (2006) Oral toxicity of the cyanobacterial toxin cylindrospermopsin in mice: Long-term exposure to low doses.
Environmental Toxicology: 21, 575-582.
35. Sutka, J. (Ed.)., (2004) Növényi citogenetika. Mezőgazda Kiadó, Bp.
36. Uhlmann F., Lottspeich F., Nasmyth K., (1999) Sister-chromatid separation at anaphase onset is promoted by cleavage of the cohesin subunit Scc1. Nature, 400, 37- 42.
37. Vasas, G., Gáspár, A., Páger, C., Surányi, G., Máthé, C., Hamvas, M. M., et al., (2004) Analysis of cyanobacterial toxins (anatoxin-a, cylindrospermopsin, microcystin-LR) by capillary electrophoresis. Electrophoresis, 25(1), 108-115.
38. Vasas, G., Gáspár, A., Surányi, Gy., Batta, Gy., Gyémánt, Gy., M. Hamvas, M., Máthé, C., Grigorszky, I., Molnár, E., Borbély, Gy., (2002) Capillary electrophoretic assay and purification of cylindrospermopsin, a cyanobacterial toxin from Aphanizomenon ovalisporum by plant test (Blue-Green Sinapis Test). Analytical Biochemistry 302: 195-203.
39. Velich, I. (Ed.)., (2001) Növénygenetika. Mezőgazda Kiadó, Bp.
34
40. Wright, A.J., Smith, L.G., (2007) Division plane reorientation in plant cells. In Verma, D.P.S., Hong, Z.,: Cell division control in plants. Plant Cell Monographs: 9, 33-5.