Gyulladás indukálta hám-mesenchyma/mesothel- makrofág átalakulás vizsgálata a hashártya mesothel
sejtjeiben
Doktori értekezés
Dr. Katz Sándor László
Semmelweis Egyetem
Molekuláris Orvostudományi Doktori Iskola
Témavezető: Dr. L. Kiss Anna, Ph.D., CSc., egyetemi docens Hivatalos bírálók: Dr. Kiss András Ph.D., egyetemi docens,
Dr. Pintér-Keller Anikó Ph.D., tudományos munkatárs
Szigorlati bizottság elnöke: Dr. Schaff Zsuzsa,az MTA tagja,egyetemi tanár Szigorlati bizottság tagjai: Dr. Lotz Gábor, Ph.D., egyetemi docens
Dr. Molnár Kinga, Ph.D., egyetemi adjunktus
Budapest
2015
1 Tartalomjegyzék
Rövidítések jegyzéke………3
Bevezetés………...7
1. Mesothel sejtek felépítése, eredete………7
2. Mesothelium funkciói………..11
3. Hám-mesenchyma átalakulás………..14
4. A TGF-β szerepe a jelátviteli folyamatokban……….17
5. Mesothelium-makrofág átalakulás?...22
6. GM-CSF………..23
7. GM-CSF receptor………24
Célkitűzések………...28
Anyag és Módszer……….30
Eredmények………...…...37
1. A mesothel sejtek morfológiájának változása a gyulladás 1-11. napján: fény- és elektronmikroszkópos vizsgálatok………37
2. Immuncitokémiai vizsgálatok a gyulladás indukálta hám-mesenchyma átalakulás igazolására………51
3. A mesothel sejtek makrofággá differenciálódásának vizsgálata in vitro hashártya-preparátumon………63
4. A GM-CSF és a TGF-β hatása a mesothel sejtekre: in vitro vizsgálatok…….68
5. Immuncitokémiai vizsgálatok az in vitro kezelt hashártyán……….72
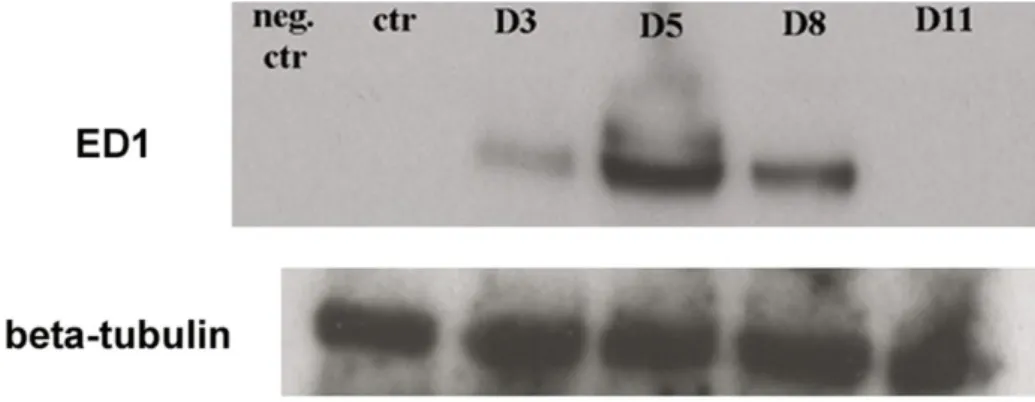
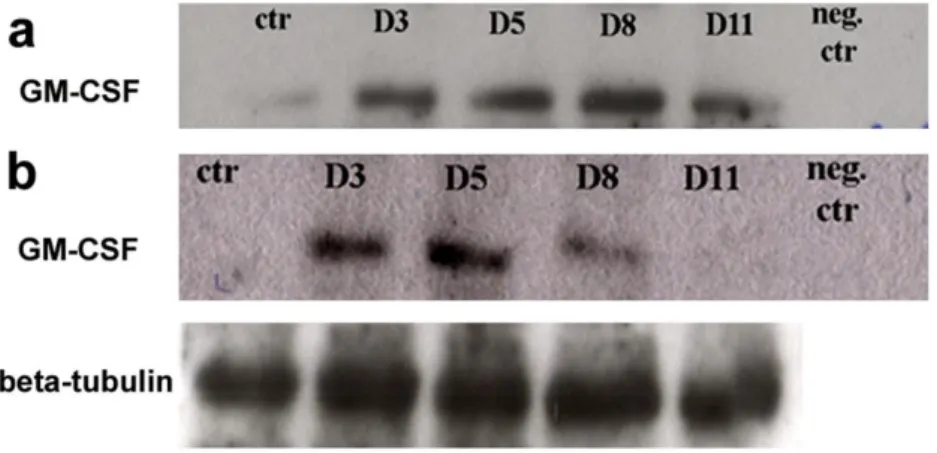
6. GM-CSF kimutatás a peritoneális mosófolyadékból és a mesothel sejtek lizátumából Western Blot technikával………..79
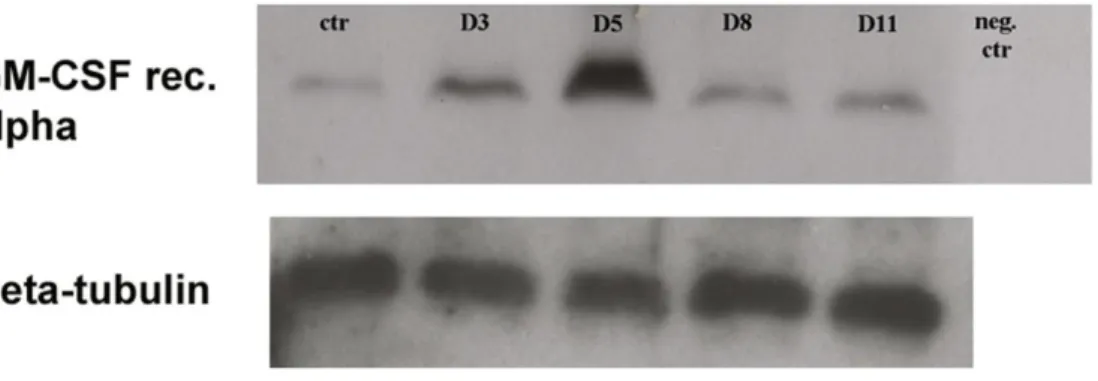
7. A GM-CSF receptorának kimutatása az in vivo rendszerből származó mesothel sejteken a gyulladás különböző időpontjaiban………..80
Megbeszélés………..84
Következtetések………...92
2
Összefoglalás………94
Summary………..95
Irodalomjegyzék………...97
Saját publikációk jegyzéke………...…111
Köszönetnyilvánítás………..112
3 Rövidítések jegyzéke
A: arteriola
Akt: protein kináz B ALK: activin-like kinase av: autofág vakuolum bm: bazális membrán
BMP: bone morphogenetic protein C: kapilláris
c: csilló
cf: kollagénrost
c-Jun: activator protein 1 CK: kazein kináz
ctr: kezeletlen/kontroll
dER: durva felszínű endoplazmás retikulum ECM: extracelluláris mátrix
EE: korai endoszóma
EEA: korai endoszóma antigén EGF: epidermális növekedési faktor EM: elektronmikroszkópos
EMT: hám-mesenchyma átalakulás
ERK: extracellular signal-regulated kinases
ESCRT: endosomal sorting complexes required for transport
4 Fes: protoonkogén c
FGF: fibroblaszt növekedési faktor FYVE: zinc finger domén
GA: glutáraldehid
GM-CSF: granulocyte-macrophage-colony stimulating-factor
GM-CSFR: granulocyte-macrophage-colony stimulating-factor receptor GPI: glikozilfoszfatidilinozitol
GTP-áz: guanozin trifoszfatáz HGF: májsejt növekedési faktor HLA: humán leukocita antigén Hsp: hőshock fehérje
IC: immuncitokémia
ICAM: intercelluláris adhéziós molekula IL: interleukin
ILK: integrin-kötött kináz JAK: Janus kináz
LFA-1: limfocita funkció-asszociált antigén-1 Lyn: Lck/Yes novel tirozin kináz
M: hízósejt
Mac-1: makrofág-1 antigén
MAPK: mitogén-aktivált protein kináz MH: Mad-homology
5 mlb: multilammelláris test
MMP: mátrix metalloproteináz MVB: multivezikuláris test n: sejtmag
NES: nukleáris export szignál
NF-κB: nuclear factor kappa-light-chain enhancer of activated B cells NLS: nukleáris lokalizációs szekvencia
NPS: magpórus szignál
PAGE: poliakrilamid gél elektroforézis PAI: plazminogén aktivátor inhibítor PBS: foszfát pufferes fiziológiás sóoldat PDGF: trombocita eredetű növekedési faktor PFA: paraformaldehid
PI3K: foszfoinozitol 3-kináz
RhoA: Ras homolog family member A SARA: Smad anchor for receptor activation SDS: sodium dedecil szulfát
Sp: specificity protein
STAT: JAK/signal transducer and activator of transcription TβR: TGF-β receptor
TEMED: tetrametiletiléndiamin
TGF-β: transforming növekedési faktor beta
6 TIMP: szöveti gátló metalloproteináz
TNF-α: tumor nekrózis faktor alpha tPA: szöveti plazminogén aktivátor TRIS: hidroximetil-aminometán Tyk: tirozin kináz
uPA: urokináz plazminogén aktivátor UTV: ultratiszta víz
v: ér
VEGF: vaszkuláris endotél növekedési faktor VLA: very late antigén
WB: Western Blot
ZO-1: zonula occludens-1
7 Bevezetés
1) Mesothel sejtek felépítése, eredete
A mesothelium egyrétegű laphámsejtekből – mesothel sejtekből – álló réteg, amely béleli a test savós üregeit: parietális mesothelium, ill. borítja a belső szerveket:
viscerális mesothelium. Ezt a szervezet savós üregeit, és az ezekben elhelyezkedő szerveket borító hámot Bichat írta le elsőként 1827-ben (Whitaker és mtsai 1982). A mesothelium elnevezés Minot-tól származik, aki az 1880-90-es években közzétett tanulmányaiban ennek az egyrétegű hámnak az embrionális eredetét vizsgálta és az emlősök mezodermális üregeit borító hámként írta le (Minot 1880, Minot 1890). A mesothelium fajtól függően a gesztáció 8. és 18. napja között fejlődik ki a mezodermából.
Emberben ez a folyamat a 14. nap körül figyelhető meg, amelynek során a cöloma üregét bélelő kerek vagy köb alakú sejtek fokozatosan lapossá válnak (Hesseldahl és Larsen 1969, Tiedemann 1976).
Számos emlős (patkány, egér, kutya, hörcsög, nyúl, ló) és az ember mesotheliumának összehasonlító morfológiai vizsgálatai alapján elmondható, hogy fajtól vagy az anatómiai elhelyezkedéstől függetlenül nagymértékben hasonlítanak egymáshoz (Mutsaers 2002). A fajok közötti hasonlóságot immunhisztokémiai vizsgálatok is alátámasztják (Raftery 1973, Whitaker és mtsai 1980).
Annak ellenére, hogy a mesotheliumot viszonylag korán fedezték fel és írták le, a kutatások csak az elmúlt években világítottak rá arra, hogy a mesothelium nem csak határoló hártya, amely súrlódásmentes felületet biztosít a szervek számára, hanem fontos szerepet játszik a rajta keresztül zajló transzportfolyamatokban, ill. gyulladásos és tumoros mechanizmusokban egyaránt.
A hashártya szöveti szerkezete
A mesothelium laphám sejtjeinek átmérője 25 µm, a sejtmagok kerek vagy ovális alakúak. A sejtek apikális felszínén mikrobolyhok, néha primer csilló is megfigyelhető.
A bazális membrán alatt vékony szubszerózus kötőszövet található kevés sejtes elemmel (zsírsejtek, fibroblasztok, hízósejtek) és kötőszöveti rostokkal. Bizonyos területeken (a
8
mediasztinális pleura redőin, máj, lép, a rekesz hasűri felszínén, ill. a nagy cseplesz ún.
„tejfoltjain”) a mesothel sejtek köb alakúak (Mironov és mtsai 1979, Wang 1974, Tsilibary és Wissig 1977, Michailova és mtsai 1999). Köbhámsejtek találhatók a savós hártyák sérült vagy stimulált területein is (Whitaker és Papadimitriou 1985, Fotev és mtsai 1987, Mutsaers és mtsai 2002).
A mesothel sejtek ultrastruktúrája
Ép, egészséges mesothel sejtek citoplazmájában viszonylag kevés sejtorganellum figyelhető meg: néhány mitokondrium, citoszkeletális elemek (mikrotubulusok, mikrofilamentumok), Golgi-apparátus és kevés durva felszínű endoplazmás retikulum (dER). A mikrofilamentumok a citoplazmában mélyen, párhuzamosan helyezkednek el.
A köb alakú mesothel sejtekben a mag nagyobb, prominens nukleolusszal rendelkezik, nagyszámú mitokondrium, dER, jól fejlett Golgi-apparátus és nagy mennyiségű mikrofilamentum figyelhető meg. A nagyobb számú sejtorganellum jelenléte aktívabb matabolikus állapotot feltételez (Kluge és Hovig 1967, Baradi és Hope 1964, Wang 1974, Baradi és Campbell 1974).
Vezikuláris rendszer, caveolák
A mesothel sejtek citoplazmájában nagy mennyiségű vezikula (clathrin-burkos vezikulák, caveolák), multivezikuláris test (MVB) és nagyszámú vakuolum figyelhető meg. A caveolák 50-100 nm átmérőjű, palack- vagy omega-alakú plazmamembrán befűződések, amelyeket először Palade írt le endotél sejteken (Palade 1953). A mesothel sejtek bazális és apikális plazmamembránján ezek a palack alakú befűződések különösen nagy számban figyelhetőek meg. Pontos szerepük a mai napig tisztázatlan. Yamada feltételezte, hogy ezek a vezikulák az extracelluláris mátrixszal kommunikálnak (Yamada 1955). Amennyiben a clathrin-burkos vezikulák részvételével végbemenő felvételi folyamatokat szelektíven gátolják, a sejtek felvételi folyamata, az internalizáció zavartalan, jelezvén hogy a sejtek alternatív endocitotikus folyamatot működtetnek (Kiss és Geuze 1997, Kiss és Botos 2009, Kiss 2009, Kiss 2012). Az utóbbi években kísérletek igazolták, hogy a caveolák fontos szerepet játszanak a folyadékfázisos és a receptorok által közvetített endocitotikus folyamatokban, elsősorban a glikozilfoszfatidilinozitol (GPI)- kötött fehérjék, albumin, bakteriális toxinok, humán leukocita antigének (HLA),
9
vírusok, immunkomplexek és kis molekulatömegű fehérjék felvételében. A caveolák egy másik, nagyon valószínű szerepe a jelátviteli folyamatok szabályozása, tekintettel arra, hogy a membránjukban jelen lévő caveolin-1 fehérje révén képesek jelátviteli molekulákat megkötni, és ennek révén azokat inaktiválni (Okamoto és mtsai 1998). A caveolák (caveolin-1) eltávolítása a plazmamembránról, tehát a jelátviteli folyamatok
„bekapcsolásához”, a gátlás feloldásához vezet. Az irodalom a caveolákat éppen ezért
„signalling organellumnak” nevezi (Kiss és Botos 2009). A caveolák elektronmikroszkópos felvételeken eltérő megjelenésű (nyitott, sekélyebb; zártabb, szűk nyakú) befűződések formájában figyelhetőek meg. Egyesével vagy csoportosan, szőlőfürt-, ill. gyöngysorszerű elrendeződésben „lógnak” be az intracelluláris térbe.
Számos sejtben fordulhatnak elő: fibroblasztokban (Röhlich és Allison 1976), endotél és simaizom sejtekben (Forbes és mtsai 1979), szívizom-, harántcsíkolt izomsejtekben, zsírsejtekben (Fan és mtsai 1983, Scherer és mtsai 1994, 1995, 1996), ill. asztrocitákban, oligodendrogliában és mikrogliában (Cameron és mtsai 1997), valamint más immunsejtekben is (Harris és mtsai 2002). Arra vonatkozóan azonban, hogy miért fordulnak elő ilyen tömeges mennyiségben a mesothel sejtek mindkét felszínén, még nincsenek adatok.
Mikrobolyhok
A mesothel sejtek apikális plazmamembránján jól fejlett, változatos alakú, hosszúságú és sűrűségű mikrobolyhok vannak. Az egyes szerveket borító mesothel sejtek apikális felszínén a mikrobolyhok száma változó, az élettani körülményekhez igazodó (Andrews és Porter 1973, Wang 1974, Tsilibary és Wissig 1977, Madison és mtsai 1979).
Leginkább a regenerálódó mesothelium felszínén figyelhetőek meg nagy számban (Madison és mtsai 1979, Wang 1974, Lindic és mtsai 1993, Mutsaers és mtsai 1996).
Sejtkapcsoló struktúrák
A mesothel sejtek közötti határ hullámos, a szomszédos sejtek gyakran részben fedik egymást. A mesothel sejtek egymás felé néző felszínén – más hámsejtekhez hasonlóan – sejtkapcsoló struktúrák vannak jelen (tight junction vagy zonula occludens, zonula adherens, gap junction és desmosomák) (Kluge és Hovig 1967, Pelin és mtsai 1994). A sejtfelszíni polaritás és a szemipermeábilis diffúziós barrier fenntartása
10
szempontjából a tight junction-ok rendkívül fontos szereppel bírnak. A zonula adherensek a sejtadhézió fenntartásában, a monolayer kialakításában játszhatnak szerepet, míg a gap junction-ok intercelluláris csatornaként funkcionálnak (Mutsaers 2002). A mesothel sejtek E-, N- és P- kadherineket, ill. zonula occludens (ZO)-1 fehérjét expresszálnak (Simsir és mtsai 1999, Foley-Comer és mtsai 2002).
Stomata
A stomata/stomák kb. 3-12 µm átmérőjű rések, amelyek a köb alakú mesothel sejtek között figyelhetőek meg, leginkább a rekesz peritoneális oldalán és az omentum majus tejfoltjai környezetében. Ezek a nyílások közvetlen kapcsolatot biztosítanak a submesothelialis nyirokrendszer és a savós üregek között, levetővé téve a folyadékok, sejtek, mikroszkópikus részecskék és baktériumok átjutását (Fukuo és mtsai 1990, Ohtani és mtsai 1995, Miura és mtsai 2000, Shao és mtsai 1998, Nakatani és mtsai 1996).
Feltételezhetően kapcsolatot teremtenek a mellkas és a hasüreg között, ez magyarázhatja a belélegzett anyagok – pl. azbeszt - hasüregben való megjelenését, fibrózist vagy mesotheliomát okozva (Ohtani és mtsai 1995, Ohtani és Ohtani 1997). A stomákat elsőként Von Recklinghausen írta le, aki feltételezte, hogy rajtuk keresztül a savós üregekből részecske- és folyadéktranszport valósul meg (Von Recklinghausen 1863).
Jelenlétüket később scanning- és transzmissziós elektronmikroszkópos vizsgálatok is egyértelműen igazolták, de az elhelyezkedésükről, számukról és funkcióikról sokáig viták folytak (Bettendorf 1978, Mironov és mtsai 1979, Baradi és Rao 1976, Tsilibary és Wissig 1977, Michailova és mtsai 1999, Leak és Rahil 1978, Wang 1975, Ohtani és mtsai 1995, Li 1993).
A hashártya „tejfoltjai” („milky spot-ok”)
Ezek a Von Recklinghausen által 1863-ban leírt struktúrák a cseplesz felszínén megfigyelhető apró, fehérvérsejt-akkumulációk – leginkább makrofágok és B-sejtek – a kapillárisok környezetében. Ezek az emberben és a legtöbb emlősben is jelen lévő struktúrák fontos szerepet töltenek be a peritoneum gyulladásos és daganatos folyamataiban, ugyanis az itt elhelyezkedő makrofágok képezik az immunrendszer elsődleges védelmi vonalát peritonitisz vagy tumoros disszemináció során (Van Vugt és mtsai 1996).
11 2) A mesothelium funkciói
A klasszikus elképzelés szerint a mesothel sejtek két fő funkcióval rendelkeznek:
a) a fizikai ártalmakkal és a kórokozókkal szemben védő határfelületet hoznak létre; b) súrlódásmentes felszínt biztosítanak a szervek egymáson való elmozdulásához. Az újabb kutatások azonban igazolták, hogy a mesothelium ennél jóval szerteágazóbb feladatokkal bír. Részt vesz az antigénprezentációban, sejt- és folyadéktranszportban, szövetregenerációban, koagulációban és fibrinolízisben, tumorsejtek megtapadásában és növekedésében, savós letapadások kialakításában peritoneális izgalom során, ill. jelentős szerepet tölt be a gyulladásos folyamatokban. A mesothel sejtek a tight junction-ok révén szoros kapcsolatban vannak egymással így képezve védő barriert a fizikai behatások és a kórokozókkal szemben (Mutsaers 2004). A védő funkcióhoz a tight junction-ok mellett az is hozzájárul, hogy az általuk termelt glükózaminoglikánok – leginkább hosszú hialuronsavláncok – a mikrobolyhok felszínét borítva távol tartják a baktériumokat, vírusokat. A hialuronsav réteg fontos szerepet játszik a sejtek differenciációjában és a tumorsejtek szóródásának gátlásában is (Jones és mtsai 1995), ill. kivédi a savós adhéziók létrejöttét (Kramer és mtsai 2002). A mesothel sejtek foszfatidil-kolint is termelnek, amelynek a súrlódásmentes felszín kialakításában van jelentős szerepe (Mutsaers 2004).
Specifikus immunválaszhoz szükséges a T-sejtek aktivációja és a mikrobiális töredékek sejtfelszíni bemutatása. A gyulladás során aktiválódott mesothel sejtek számos citokint, kemokint, növekedési faktort, adhéziós- és egyéb molekulákat termelnek.
Többek között interleukin-1β-t, tumor nekrózis faktor-α-t és interferon-γ-t, amelyek indukálják a neutrofil granulociták és monociták kemokinjeinek termelését, ill. a CD4+ T helper sejtek antigénprezentációját (Mutsaers 2002, 2004).
A mesothelium aktív szerepet tölt be a folyadékok transzmesotheliális transzportjában. Ez a transzport feltehetően pinocitotikus vezikulák közreműködésével (Fukata 1963, Fedorko és Hirsch 1971, Leak és Rahil 1978), intracelluláris kapcsolatokon és stomákon keresztül is végbemehet (Whitaker és mtsai 1980, 1982, Fedorko és Hirsch 1971, Cotran és Karnovsky 1968, Agostoni és Zocchi 1998).
A pro- és antiinflammatorikus faktorok, ill. immunmodulátorok szintjének szabályozásával a mesothel sejtek fontos szerepet játszanak a sebészeti beavatkozásokat,
12
gyulladásokat és egyéb kezeléseket (pl. peritoneális dialízis) követő regenerációs folyamatokban. Amennyiben ez a szabályozás sérül, megnő a permeabilitás, ödéma jön létre, végül pedig letapadások és fibrózis alakulhat ki Mutsaers 2004).
A fibrinolítikus aktivitásuknak köszönhetően a mesothel sejtek fontos szerepet játszanak a savós üregekben kialakuló fibrin lerakódások feloldásában és eltávolításában mechanikus sérülést, hemotoraxot vagy gyulladást követően. Amennyiben ez a képességük elégtelenné válik, a szerózus üregekben fibrotikus letapadások alakulnak ki.
Fibrinolítikus aktivitásuk az általuk termelt szöveti plazminogén aktivátornak (tPA) és urokináz plazminogén aktivátornak (uPA) köszönhető. Az uPA és tPA alakítja át az inaktív zimogén plazminogént aktív plazminná, ami a fibrint bontja (van Hinsbergh és mtsai 1990, Idell és mtsai 1992). A savós üregekben a tPA legfőbb forrásai a mesothel sejtek (Sitter és mtsai 1995).
A mesothel sejtek nem csak fibrinolítikus, de a plazminogén aktivátor inhibítor (PAI) 1 és 2 termelése révén prokoaguláns aktivitással is rendelkeznek (Holmdahl és mtsai 1997). Ezeknek a mediátoroknak a szintjét gyulladásos faktorok (lipopoliszacharidok, TNF-α, IL-1, thrombin és transforming növekedési faktor béta (TGF-β)) szabályozzák.
Számos kutatás kimutatta, hogy a sérült mesothelium megfelelő felületet biztosít a tumorsejtek letapadásához (Cunliffe és Sugarbaker 1989). In vitro vizsgálatok igazolták, hogy amennyiben hialuronsavat adunk a tenyésztői médiumhoz, akkor a tumorsejtek nem kötődnek a mesothelhez (Jones és mtsai 1995). Ezek az eredmények megkérdőjelezik a daganatok eltávolítása után bevett sebészi gyakorlatot, amelynek során kiöblítik a savós üreget eltávolítva a hialuronsav és egyéb glükózaminoglikánok által képzett felületet is (Yao és mtsai 2003, Mutsaers 2004).
A mesothelium stimulálását követően összenövések alakulnak ki a savós üregek viscerális és a parietális lemezei között. Az érintett területtel szembeni savós felszínen lerakódott fibrin normál esetben a stimulust követő 7. napra a saját fibrinolítikus aktivitásnak köszönhetően teljesen eltűnik. Amennyiben a fibrin eltávolítása zavart szenved, a szubszerózális rétegből fibroblasztok vándorolnak a fibrin-mátrixba és
13
kollagéntermelésbe kezdenek, amely állandó összenövés kialakulását eredményezi (Holmdahl és mtsai 1997).
Különböző pro- és antiinflammatorikus faktorok, ill. immunmodulátorok termelése révén a mesothel sejtek jelentős szerepet játszanak a savós üregek gyulladásos folyamataiban. Kemokinek termelésével biztosítják a neutrofil granulociták és monociták transzmesotheliális migrációját (Visser és mtsai 1998), amelyet a leukociták felszínén jelen lévő limfocita funkció-asszociált antigén (LFA)-1, makrofág (Mac)-1 antigén, valamint a mesothel sejtek felszínén lévő intercelluláris adhéziós molekula (ICAM)-1 segít (Liberek és mtsai 1996). A very late antigén (VLA)-4 és VLA-5 termelése révén a mesothelium szabályozni képes a különböző immunsejtek (pl.
makrofágok) kilépését a savós hártyákból (Bellingan és mtsai 2002).
Gyulladás hatására a mesothel sejtek által termelt mediátorok sejtosztódást, migrációt és extracelluláris mátrix (ECM) szintézist indukálnak. Ezeket a folyamatokat a TGF-β, trombocita eredetű növekedési faktor (PDGF), fibroblaszt növekedési faktor (FGF), májsejt növekedési faktor (HGF) és epidermális növekedési faktor (EGF) család tagjai szabályozzák (Mutsaers és mtsai 1997).
A mesothel sejtek termelik az ECM molekuláit (I, III, IV. típusú kollagén, elasztin, fibronektin, és laminin; Rennard és mtsai 1984), gyulladás során azonban mátrix metalloproteinázok (MMP) és szöveti gátló metalloproteinázok (TIMP) termelése révén részt vesznek a mátrix lebontásában is (Marshall és mtsai 1993).
A gyulladás során a mesothel sejteken megfigyelhető markáns morfológiai, fenotípusos változásokat biokémiai változások is kísérik (Katz és mtsai 2011). Az ilyen fenotípusváltást az irodalom hám-mesenchyma átalakulásnak nevezi (EMT).
3) Hám-mesenchyma átalakulás
A hám-mesenchyma átalakulás fogalmát a csirke embrió primitív csíkjának fejlődése során tapasztaltak alapján 1995-ben Elizabeth Hay vezette be (Hay 1995). Az EMT olyan összetett biológiai folyamat (1. ábra), amelynek során:
14
1. a hámsejtek alakváltozáson mennek keresztül: térfogatuk megnő, kerek sejtekké válnak és nyúlványokat bocsátanak a kötőszövet felé,
2. apoptózisra való hajlamuk csökken,
3. sejtorganellumaik (mitokondrium, endoplazmás retikulum, vezikuláris komponensek) száma megnő (Balogh és mtsai 2015, Zsiros 2015),
4. ECM komponensek (elsősorban kollagén) szintézise fokozódik, 5. sejtkapcsoló struktúrák eltűnnek,
6. a bazális membrán degradálódik, amely a sejtek leválását eredményezi,
7. a citoszkeleton átrendeződik (kötőszöveti sejtekre jellemző citoszkeletális fehérjék szintézise),
8. a sejtek migrációs képessége megnő, alkalmassá válnak a sejtinvázióra (Kalluri és Neilson 2003).
1. ábra: Hám-mesenchyma átalakulás folyamata: A hámsejtek alakja megváltozik, polaritásukat, sejtkapcsoló struktúráikat elveszítik, a citoszkeleton átrendeződik, a bazális membrán degradálódik, és végül elhagyják a felszínt (Micalizzi és mtsai 2010, Zsiros 2015).
Az EMT-nek a 2007-ben és 2008-ban tartott EMT konferenciák állásfoglalása szerint három típusát különböztetjük meg (2. ábra):
I típus: az implantáció, embriogenezis és szervfejlődés során megfigyelhető folyamatos átalakulás, amely egy funkcionális egység, szervezet létrehozására hivatott.
15
II típus: a szövetregeneráció és fibrózis kapcsán végbemenő, csak a gyulladás vagy provokáló stimulusok fennállásáig tartó folyamat.
III típus: A tumornövekedés és –progresszió kapcsán megfigyelhető változás, amikor az inváziós felszínen a daganatsejtek mesenchymális fenotípust vesznek fel és a vérkeringésbe jutva, vagy az ECM-ba vándorolva képessé válnak áttétek kialakítására (Kalluri és Weinberg 2009).
2. ábra: Hám-mesenchyma átalakulás (EMT) típusai: Az I típus az embriogenezis és szervfejlődés, a II típus a fibrózis és szövetregeneráció, míg a III típusú EMT a tumorigenezis során megfigyelhető folyamat (Acloque és mtsai 2009).
Munkám során a gyulladás indukálta II típusú EMT során végbenő morfológiai és biokémiai változásokat vizsgáltam patkány hashártya mesothel sejtjein.
II típusú EMT
16
Gyulladás hatására a hashártyán fibrózis alakul ki, amely különböző súlyosságú lehet. A fibrózis a művesekezelés egyik formájának a leggyakoribb mellékhatása. A peritoneális dialízis során – kihasználva a hashártya nagy szemipermeábilis felületét – hiperozmotikus glükóz tartalmú oldatot juttatnak a peritoneális üregbe, ahol diffúzió segítségével a szervezet megszabadul a méreganyagoktól és víztől. A dializáló oldatból visszamaradó glükóz és glükóz-degradációs termékek a mesothel sejtek vaszkuláris endotél növekedési faktor (VEGF) és TGF-β termelését indukálják. A gyulladt területen a VEGF – mint pro-angiogenikus citokin – hatására drámai mértékben megnő a kapillárisok száma. A mesothel sejtek által termelt TGF-β pedig a hám-mesenchyma átalakulás beindításáért felelős (Selgas és mtsai 2006).
A gyulladásos stimulus hatására kialakuló hám-mesenchyma átalakulást a savós üregben jelenlévő, ill. ide bevándorló sejtek TGF-β, PDGF, EGF, FGF-2 termelése indukálja. Ezek a sejtek többségükben makrofágok, aktivált fibroblasztok és mesothel sejtek, amelyek a sérült felszín környezetében helyezkednek el. A növekedési faktorok mellett számos kemokint (MMP-2, MMP-3 és MMP-9) is termelnek. Ezen molekulák hatására a IV típusú kollagén és laminin degradálódik, a bazális membrán károsodik, és a sejtek leválhatnak a felszínről (Kalluri és Weinberg 2009). A folyamatban az MMP-9 kulcsszerepet játszik: amennyiben az expresszióját gátolják, az EMT nem megy végbe (Yang és mtsai 2002).
A TGF-β szintjének csökkentésével a fibrózis kivédhető. Fibróziscsökkentő hatása van a hepatocita növekedési faktornak (HGF) is, amely képes helyreállítani a TGF- β hatására lecsökkent E-kadherin szintjét, ill. csökkenti az aktív MMP-9 expresszióját is (Yang és Liu 2002). A TGF-β indukálta hám-mesenchyma átalakulásban a β1 integrin és integrin-kötött kináz (ILK) szintén fontos mediátor szerepet tölt be a vesetubulus hámsejtekben (Li és mtsai 2003). A hám-mesenchyma átalakulást a bone morphogenetic protein (BMP)-7 kivédi a TGF-β jelátviteli útvonal gátlásával, megelőzve az EMT kialakulását, és az activin-like kinase (ALK)-2, 3, 6, valamint a Smad 4, 5 fehérjéken keresztül – a transzkripciós faktorok csökkentése révén – képes helyreállítani az E- kadherin mennyiségét is (Zeisberg és mtsai 2003).
Az elmondottakból egyértelműen látható, hogy a hám-mesenchyma átalakulás legfőbb szabályozója a TGF-β.
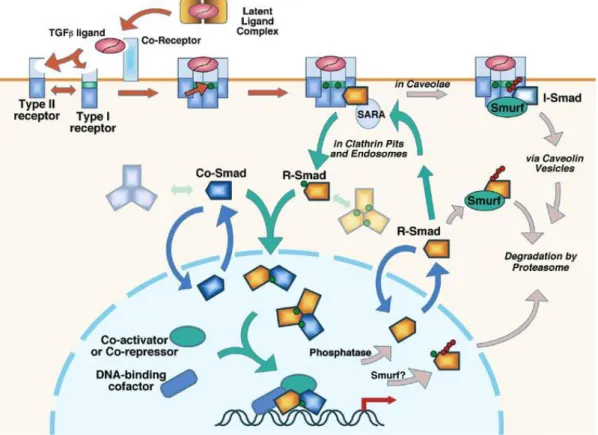
17 4) A TGF-β szerepe a jelátviteli folyamatokban
A TGF-β szupercsalád nagyszámú citokint (TGF-β1, 2, 3, BMP, inhibin, myostatin, anti-Müller hormon, Nodal) foglal magába, amelyek sejtdifferenciációt, apoptózist, sejtmigrációt és adhéziót szabályoznak. A TGF-β sejtfelszíni szerin/treonin kináz receptorain keresztül fejti ki hatását. Funkcionálisan és strukturálisan I és II típusú TGF-β receptort (TβR) különítünk el. A II típusú receptor egy konstitutív aktív kináz, amely autofoszforiláció révén aktiválódik, míg az I típusú receptor egy speciális GS doménnel rendelkezik, amelynek foszforilációja a receptor aktiválódását eredményezi.
A TGF-β kapcsolódása a TGF-β II receptorhoz egy heterotetramer receptor- komplex kialakulását eredményezi, miközben a TβR II transzfoszforilálja és aktiválja a TβR I-et, amely aktiválja a Smad útvonalat (3. ábra).
Smad-függő útvonal
A Smad fehérjéket strukturális és funkcionális sajátosságaik alapján három csoportra oszthatjuk: (1) a receptor szabályozott (R) fehérjék: Smad 2, 3 –amelyek az I.
típusú receptor kinázoknak a szubsztrátjai-, és a Smad 1, 5, 8 –amelyeket az aktivált BMP receptorok foszforilálnak. Foszforilálódásuk – ezáltal aktiválódásuk – után kapcsolódnak a (2) mediátor (Co) Smad proteinhez: a Smad 4-hez és egy oligomer komplexet alkotva a magba transzportálódnak, ahol a célgénjeik transzkripcióját szabályozzák egyéb magi kofaktorokkal együtt. (3) A Smad család harmadik csoportját a jelátviteli utak negatív szabályozói alkotják: az (I)-Smad 6 és 7 proteinek.
Kutatások igazolták, hogy járulékos proteinek is kapcsolatba lépnek az I és II típusú receptorokkal, ill. a Smad fehérjékkel. Ilyen fehérje a SARA (Smad anchor for receptor activation), amely elősegíti a receptor szabályozott (R) Smad fehérjék és a TβR kapcsolódását a plazmamembránon. Lokalizációja leginkább a korai endoszómák foszfatidilinozitol 3-foszátban gazdag membránjában figyelhető meg. Újabb vizsgálatok szerint a SARA képes kölcsönhatásba lépni a sejtfelszíni TβR-okkal, így védve azokat a degradációtól.
18
A TGF-β kötődése a sejtfelszíni receptoraihoz, nem csak a jelátviteli utat, de a receptor-ligand internalizációját is indukálja. A receptor internalizációja kulcsfontosságú lépése a jelátviteli folyamatnak. A TGF-β ligand-receptor komplex internalizációja két fő endocitotikus útvonalon mehet végbe: az egyik a jól ismert clathrin mediált endocitózis, a másik pedig a kevésbé tisztázott lipid raft/caveola mediált endocitózis.
3. ábra: TGF-β jelátviteli folyamat -a Smad-függő útvonal: A clathrin-burkos vezikulákkal, ill. caveolákkal megvalósuló receptor-ligand internalizáció összefoglalása.
(Nyilak színkódjai: piros: ligand és receptor aktiváció; szürke: Smad és receptor inaktiváció; zöld: Smad aktiváció/transzkripcionális komplex létrejötte; kék: Smad fehérjék sejtmag-citoplazma útvonala; zöld pontok: foszfátcsoportok; piros pontok:
ubiquitin (Shi és Massagué 2003)).
Clathrin-burkos vezikulákkal végbemenő endocitózis: a jelátviteli folyamat
„bekapcsolása”
19
A sejtfelszíni receptorok clathrin-függő endocitózisát rövid citoplazmikus tirozin- tartalmú szekvenciák és di-leucin motívumok – mint internalizációs szignálok – indukálják. Ezek a szekvenciák fontos szerepet játszanak, mivel segítik a szállítandó molekula clathrin-burkos vezikulával történő endocitózisát, ill. a vezikula kialakításában is részt vesznek (Bonifacio és Traub 2003). Mindkét TβR rendelkezik ilyen szignál szekvenciákkal, így a receptor-ligand komplex a Smad fehérjékkel és a SARA-val együtt rövid idő alatt internalizálódik. A komplex a korai endoszóma antigén (EEA) 1 pozitív korai endoszómába kerül, ahol szignáltranszdukciót indukál a FYVE (zinc finger) doménnel rendelkező fehérjék (pl. SARA) toborzása révén. Az R-Smad fehérjék C- terminálisának foszforilálódása a korai endoszómákban a leválásukat eredményezi a SARA-ról és a receptorról. A foszforilált R-Smad fehérjék ezután a Smad 4-el együtt oligomer komplexet képeznek, és a sejtmagba jutnak. A Smad-komplexek TGF-β indukálta transzportja a citoplazma és a mag között erőteljesen szabályozott folyamat: az R-Smad és Co-Smad fehérjék rendelkeznek egy Mad-homology (MH) 1 és MH2 doménnel, amelyeket egy linker régió kapcsol össze, viszont az I-Smad fehérjékben az MH1 domén nem található meg. Az R- és Co-Smad fehérjék MH1 doménjének nukleáris lokalizációs szekvenciája van (NLS), amely a magba jutást segíti, míg az MH2 domén nukleáris export szignállal (NES) és magpórus szignállal (NPS) rendelkezik. A foszforilált Smad 3 kapcsolatba lép a magpórus importin-β1-ével és GTPáz függő úton belép a sejtmagba (Balogh és mtsai 2012).
A magban a Smad fehérjék szabályozzák a TGF-β-reszponzív gének expresszióját. Ilyen gének kódolják az integrin-kötött kinázt (ILK), amely a β1 integrinek révén aktiválódva a protein kináz B (Akt) és glikogén szintáz kináz-3 foszforilációjához vezet. A foszforilált Akt a nuclear factor kappa-light-chain enhancer of activated B cells (NF-κB) aktivációjáért felelős, amely indukálja a Smad 7 expresszióját, így gátolva a Smad 2, 3 és Snail fehérjék foszforilációját. A Snail gátolja az E-kadherin expresszióját, leállítja a növekedést, és fokozza a túlélést (Selgas és mtsai 2006).
A korai endoszómák nem csak speciális körülményeket biztosítanak a TGF-β útvonal eseményeinek a jelátvivő molekulák toborzása révén, hanem az internalizált fehérjék és receptoraik szortírozási helyéül is szolgálnak. Ennek a folyamatnak a legfőbb tényezője az endoszóma savasodása, amely segíti a receptor-ligand disszociációt. A
20
disszociáció után a TβR-ok Rab11 pozitív reciklizáló endoszómák segítségével visszajutnak a plazmamembránhoz (Balogh és mtsai 2012).
Caveolák közvetítésével végbemenő endocitózis: a jelátviteli folyamat „kikapcsolása”
Mivel a TβR-ok a plazmamembrán lipid raftjaiban caveolin-1 tartalmú membrándoménekben is akkumulálódhatnak, a TGF-β internalizációja caveolák közreműködésével is végbemehet. Hosszú ideig tartotta magát az az elképzelés, hogy a caveolák az általuk szállított ligandumot egy speciális, caveosomának elnevezett kompartimentumba juttatják, amelyeket a korai endoszómákkal egyenértékű sejtorganellumként írtak le (Pelkmans és mtsai 2001). A feltételezések szerint a caveosomák a korai endoszómákkal ellentétben nem mennek át érési folyamatokon, a bennékük savasodása elmarad, így képtelenek összeolvadni a lizoszómákkal. Ily módon a caveosomákban felhalmozódott ligandok elkerülik/elkerülhetik a lebontó útvonalat.
Újabb vizsgálatok azonban igazolták, hogy a caveolin-1 pozitív vezikulák is fúzionálnak a korai- és késői endoszómákkal, így végül is kapcsolódnak a klasszikus, lizoszómális degradációs útvonalhoz (Kiss és Botos 2009, Kiss 2012).
Számos kísérleti eredmény és irodalmi adat szól amellett, hogy ha TGF-β receptor és ligandja caveolák segítségével internalizálódik a receptor-ligand komplex a lizoszómális/proteaszómális degradáció útjára kerül (Balogh és mtsai 2012). A receptor- ligand degradációja a jelátviteli folyamat leállítását, a TGF-β jelátvitel „kikapcsolását”
eredményezi. Ez a receptor-degradáció fontos szabályozóként befolyásolja a plazmamembránon elhelyezkedő TβR-ok mennyiségét. A folyamatban szerepet játszó jelátviteli molekulák nem teljesen ismertek, de az bizonyos, hogy a gátló Smad 7 az egyik fő szabályozója a folyamatnak. A Smad 7 gátolja a receptor-szabályozott R-Smad fehérjék „toborzását” a plazmamembránon, felbontja a Smad-DNS komplexet. Az R- Smad fehérjék kompetítora a receptorhoz való kötődésben egy ubiquitin ligáz a Smurf 1/2, amely segítségével a Smad 7 a TβR-okat ubiquitinálja és a degradációs útvonalra tereli. A Smad 7 fehérje nukleáris lokalizációs szignálja (NLS) révén a magban lokalizálódik, amíg a sejtet stimulus nem éri. A TGF-β hatására a Smad 7 a Smurf 1/2- vel komplexet alkotva elhagyja a magot és az aktivált TβR komplexet a caveoláris endocitózis útjára tereli. A TβR-ok az ubiquitináció után lizoszómális és proteaszómális degradáció révén lebomlanak.
21
A különböző ubiquitinációs szignálok részt vesznek a Smad fehérjék és a caveolin stabilitásának szabályozásában is. A poliubiquitináció közvetlen jel a komplex proteaszómába való juttatásához – degradatív útvonal -, míg a mono-/multiubiquitináció jel a korai endoszóma felé, ahol az ESCRT komplex (endosomal sorting complexes required for transport) felismeri és köti az ubiquitinált komplexet, majd segíti annak transzportját a MVB vagy késői endoszóma felé (Balogh és mtsai 2013).
TGF-β indukált Smad-független útvonalak
Kísérletek igazolták, hogy a kanonikus Smad útvonal mellett a TGF-β számos egyéb jelátviteli útvonalat (MAPK, Erk, RhoA) is beindít. A MAPK (mitogén-aktivált protein kináz) útvonal segíti a TGF-β indukálta hám-mesenchyma átalakulást, bár ez a jelátviteli folyamat nem teljesen feltárt. Számos protein kináz is a MAPK kaszkád tagja, amelyek aktiválódása a sejtmagba való transzlokációjukat idézi elő, ahol foszforilálják célmolekuláikat. Módosítják a Smad proteinek aktivitását, kölcsönhatásba lépnek a TβR- okkal és indukálják a Smad útvonal leállítását, ill. reciprok hatásként a Smad fehérjék módosíthatják őket, ezáltal egy másik útvonalra terelve a jelátvitelt. A TGF-β stimulus hatására mind a Smad, mind a MAPK útvonal aktiválódik és – mint sejtszintű komplex folyamat – együtt fejti ki hatását. Fehérjéik sejten belüli lokalizációja fontos szabályozó szereppel bír a folyamat kimenetelére, amely meghatározza a TGF-β-ra adott sejtszintű válaszokat (Balogh és mtsai 2013).
A fentiek alapján elmondható, hogy az endoszómák a TGF-β jelátviteli folyamatokban, a hám-mesenchyma átalakulás szabályozása során kulcsfontossággal bíró sejtorganellumok, mivel nem csak helyszínt biztosítanak a jelátviteli molekulák számára, hanem a különböző jelátviteli utak szabályozására is hivatottak.
5) Mesothelium-makrofág átalakulás?
A laboratóriumunkban folyó korábbi vizsgálataink során megállapítottuk, hogy komplett Freund adjuváns (inaktivált Mycobacterium tuberculosist tartalmazó ásványolaj) intraperitoneális injekciója által kiváltott gyulladás hatására a makrofágok száma jelentősen megnő a hasüregi mosófolyadékban (Kiss és Kittel 1995, Katz és mtsai
22
2011). A peritoneális makrofágok eredete mind a mai napig nem egyértelműen tisztázott.
Több forrásból is származhatnak. A vérből stimulus hatására az erek falán át kivándorló monociták, valamint a hashártya ún. tejfoltjaiban nyugvó, rezidens makrofágok aktiválódása, migrációja nagymértékben járul hozzá a hasüregben megjelenő, heterogén eredetű makrofág populációhoz. A gyulladás során a hasüregben megjelenő makrofágok nagy száma (1. táblázat) azonban nehezen magyarázható csupán csak ezzel a két forrással.
Felmerül a lehetőség, hogy a mesothel sejtek hám-mesenchyma átalakulás révén hozzájárulhatnak ezen populációhoz. A mesothel sejtek plaszticitása régóta ismert, saját maguk is képesek tetanus toxoid és Candida albicans részecskék felvételére, majd antimikrobiális antigének prezentálására (Valle és mtsai 1995). Intraperitoneális injektálást követően a Freund adjuváns lipid cseppjei is nagy számban akkumulálódnak a citoplazmájukban. Mindezek az eredmények azt jelzik, hogy a mesothel sejtek stimulusok hatására fagocitózisra, pinocitózisra képes sejtekké alakulnak. Ha sikerül igazolni, hogy a mesothel sejtek valóban képesek a makrofággá való differenciálódásra, akkor az általuk képviselt nagy felületről leváló sejtek már elegendő forrásául szolgálhatnak a gyulladás során nagy számban megjelenő makrofágoknak.
1. táblázat: A makrofágok és a mesothelin (mesothel sejtekre jellemző sejtfelszíni marker) pozitív sejtek aránya a peritoneális mosófolyadékban: A quantitatív analízis bizonyítja, hogy 24, 48 órával a Freund adjuváns kezelést követően a makrofágok és a mesothelin pozitív sejtek száma a hasüregben drámaian megnő, alátámasztva, hogy a mesothel sejtek gyulladás hatására leválhatnak a mezentérium felszínéről (Katz és mtsai 2011).
Kontroll
24h Freund adjuváns kezelés
48h Freund adjuváns kezelés
makrofág/ml 8x106 8x107 2x108
23 mesothelin-pozitív
sejtek aránya 0.7+0.01% 5+0.01% 15+0.02%
6) GM-CSF
A hemopoetikus őssejtek granulocitává, makrofággá, dendritikus sejtekké való differenciálódásának egyik fő szabályozója a GM-CSF. A humán granulocyte- macrophage-colony stimulating-factor egy négy rövid α-hélixet tartalmazó glükoprotein, hemopoetikus növekedési faktor, amely elsődlegesen felelős a granulociták és makrofágok proliferációjának a csontvelőben található prekurzorokból történő stimulálásáért. Segíti az érett myeloid sejtek aktivációját és túlélését, ezáltal hozzájárulva az immun-homeosztázis fenntartásához. Más citokinekkel ellentétben a GM-CSF biológiai aktivitása nem feltétlenül szükséges a differenciációhoz, mert az különböző útvonalak révén is megvalósulhat. Ha azonban a GM-CSF a hatását nem tudja kifejteni (genetikai defektus vagy autoantitestek által végbemenő hatástalanítás következtében) súlyos betegségek (pl.: pulmonáris alveoláris proteinózis) alakulhatnak ki. A GM-CSF az interleukin (IL) 3 és 5 mellett kulcsszerepet tölt be az ún. „emergency hematopoiesis”- ben, egy fertőzést követő azonnali immunválaszban, ezzel biztosítva a szükséges emelkedett fehérvérsejtszámot (Shiomi és Usui 2015).
A GM-CSF-et elsősorban az aktivált T és B sejtek, monociták, makrofágok, endotél sejtek és fibroblasztok termelik, de a neutrofil-, és eozinofil granulociták, hámsejtek, kondrociták, Paneth sejtek és tumorsejtek is szekretálják (Broughton és mtsai 2012). Tekintettel arra, hogy a GM-CSF több egymástól független jelátviteli útvonalat is képes indukálni a különböző sejteken, pozitív hatásai mellett hozzájárul patológiás állapotok kialakulásához is, ezért proinflammatorikus citokinként is számon tartják.
Lényeges szerepet játszik több autoimmun és gyulladásos betegségben pl. Chron- betegségben, Langerhans-szigetsejtek krónikus gyulladásában, reumatoid artritiszben, szklerózis multiplexben, asztmában és autoimmun glomerulonefritiszben.
A GM-CSF kulcsfontosságú szerepet játszik az alveoláris makrofágok surfactant katabolizmusában. Hiányában a surfactant felhalmozódik az alveoláris makrofágokban –
24
nagy, habos sejtformák megjelenést eredményezve – és az alveoláris térben, amelynek eredményeként a légzőfelület jelentős mértékben csökken.
A GM-CSF fontos szerepet játszik számos leukémia fenntartásában is.
Termelődése autokrin vagy parakrin mechanizmusok révén hozzájárul a fehérvérsejt klónok túléléséhez, ill. csökkenti a tirozin kináz inhibítorok terápiás hatását.
7) GM-CSF receptor
A GM-CSF receptora (GM-CSFR) egy citokin receptor-család tagja, amely a többi receptorhoz (IL-3, -5) hasonlóan heterodimer formában van jelen. Egy citokin specifikus α alegységből és egy közös β alegységből (βc) épül fel (4. ábra), amely a fő jelátviteli alegység. A GM-CSF receptor csak kis mértékben (<1500/sejt) expresszálódik a hemopoetikus sejtek felszínén (Broughton és mtsai 2012).
Az α alegység kis affinitással kötődik a citokinhez, míg a βc alegység a receptor heterodimerizáció révén jelentősen fokozza a GM-CSF-hez való affinitását, ezzel aktiválva számos jelátviteli folyamatot és biológiai funkciót. A GM-CSF jelátviteli útjának szabályozásában a legfontosabb szerepet citoszolikus tirozin kinázok játsszák (Corey és mtsai 1993, Quelle és mtsai 1994). Ezt igazolja az a tény is, hogy a humán neutrofil granulociták GM-CSF-el való kezelése számos tirozin kináz: Lyn (Lck/Yes novel tirozin kináz) és Fes (protoonkogén c) aktivációjához vezet (Corey és mtsai 1993, Linnekin és mtsai 1995).
25
4. ábra: GM-CSF receptor: A heterodimer formában lévő receptor egy citokinspecifikus α alegységből és egy közös βc jelátvitelért felelős alegységből épül fel (Hamilton 2008).
A GM-CSF-nek a GM-CSF receptorhoz való kötődése aktiválja a receptor- asszociált Janus kinázokat (JAK) is. A JAK fehérjék nagyméretű kinázok: 1150 aminosavból épülnek fel, molekulatömegük 120-130 kDa. A JAK2 a Janus tirozin kináz család többi tagjával (JAK1, JAK3 és tirozin kináz (Tyk) 2) regulátor szerepét tölti be számos jelátviteli folyamatban (Wojchowski és He 1993, Quelle és mtsai 1994, Witthuhn és mtsai 1994, Tanaka és mtsai 1994). A GM-CSF által kiváltott jelátviteli folyamat szabályozásában és a receptorfunkcióban a JAK2 kulcsfontosságú szereppel bír (Al- Shami és mtsai 1998, Brizzi és mtsai 1996). A JAK2 clathrin-burkos struktúrákhoz kötődik a GM-CSF receptor βc alegységével együtt. A clathrin-burkos vezikulához szelektíven kötődik a kazein-kináz (CK) 2 is, amely egy szerin-treonin protein kináz.
Ligand hiányában a CK2 azonban – feltehetően konformációs akadályok következtében – nem képes foszforilálni a JAK2-βc alegység komplexet. Ezt az állapotot ezért „zárt konformációnak” nevezzük. Ligand jelenlétében a GM-CSFR α alegysége köti GM- CSF-et, ez konformációváltozást idéz elő („nyitott konformáció”), amelynek következtében a GM-CSFR βc alegységhez kötött JAK2-t a CK2 foszforilálja. A JAK2
26
aktivitásának fokozódása még nem teljesen feltárt folyamat, de valószínű, hogy a CK2 képes a JAK2-t szerin-treonin, ill. tirozin kináz aktivitása révén, több tirozinon is foszforilálni (Chen és mtsai 2012). A JAK2 aktiválódásának hatására a GM-CSFR βc alegysége 6 esszenciális tirozinján transzfoszforilálódik, amelyek a βc alegység S585 részének foszforilációjával együtt dokkoló felszínt biztosítanak a jelátviteli molekulák számára, és aktiválják a JAK/STAT (signal trancducer and activator of transcription), MAPK és foszfoinozitol 3-kináz (PI3K) útvonalakat (5. ábra) (Carpenter és mtsai 1998, Guthridge és mtsai 1998, Broughton és mtsai 2012). Ezek a jelátviteli utak együttesen szabályozzák a sejtek proliferációját, differenciációját, túlélését, de számos myeloid leukémiát is. A JAK/STAT útvonal beindításáért számos citokin és interferon (IL-2, 3, 4, 5, 6, 7, 9, 11, 13, 15, GM-CSF, növekedési hormon, prolaktin, eritropoetin és trombopoetin) felelős (Leonard és O’Shea 1998).
5. ábra: A GM-CSF indukálta jelentősebb jelátviteli útvonalak összefoglalása: A GM-CSF kötődése receptorához aktiválja a kanonikus NF-κB kaszkádot, míg a JAK2 aktiváció révén indukálja a STAT, MAPK és PI3K útvonalakat (van de Laar és mtsai 2012).
27
A STAT fehérjék családja nyolc kb. 750-800 aminosavból álló fehérjét foglal magába: STAT1α, β, STAT2-4, STAT5A, B, STAT6. A citokin/interleukin kötődése a receptorához a JAK fehérjék receptor-tirozin foszforilációját eredményezi, kialakítva a dokkoló felszínt a STAT-ok számára. A dokkoláshoz elengedhetetlen a STAT fehérjék SH2 doménje, amely a foszforilált motívumok felismeréséért felelős. A STAT fehérjék saját N-terminálisukon elhelyezkedő tirozin tartalmú részek autofoszforilációját követően leválnak a receptorról és homodimert vagy heterodimert alkotnak az egyik STAT fehérje SH2 doménje és egy másik STAT foszforilált tirozinja között létrejött kötődések eredményeként. A dimer sejtmagba jutása nem teljesen tisztázott, valószínűleg a STAT fehérjék is rendelkeznek egy nukleáris lokalizációs szignállal (NLS), de a transzlokációban a hőshock fehérjék szerepe sem kizárt. A STAT-ok a sejtmagban specifikus DNS motívumokhoz kötődve célmolekuláik expresszióját szabályozzák. A STAT-DNS kötődés pár perccel a receptor-ligand kötődése után bekövetkezik (Leonard és O’Shea 1998, Al-Shami és mtsai 1998).
Egyes STAT fehérjék transzkripcionális aktivitásuk mellett fizikailag és funkcionálisan is képesek koaktivátor fehérjékhez kapcsolódni. A STAT1 az Sp (specificity protein) 1 transzkripciós aktivátorhoz képes kötődni, így részt vesz az ICAM- 1 jelátviteli folyamatában. A STAT3β a c-Jun (activator protein 1) fehérjével képes kapcsolatba lépni. Az erőteljes transzkripciós aktivátor a CREB binding protein (cAMP response element binding protein)/p300 a STAT1, STAT2-vel kötődhet. A STAT5A pedig glükokortikoid receptorokhoz képes kapcsolódni.
A JAK és STAT fehérjék együttesen egy rendkívül fontos jelátviteli rendszert alkotnak, amely még nem teljesen feltárt. Az azonban bizonyos, hogy a citokinek más jelátviteli útvonalakat (Ras/Raf/MAPK, inzulin receptor szubsztrát-1, -2, PI3K, Akt) is képesek beindítani, ezáltal egy komplex rendszert alkotnak, amely gátolja a sejtproliferációt, sejtdifferenciációt és az apoptózist is (Leonard és O’Shea 1998, Al- Shami és mtsai 1997).
Célkitűzések
28
Disszertációm alapját képező kísérleteim során Freund adjuváns intraperitoneális injekciójával akut peritonitiszt indukáltam.
1) Kísérleteim során fény- és elektronmikroszkópos vizsgálatokkal kívántam nyomon követni a II típusú hám-mesenchyma átalakulás morfológiai változásait. Ezen vizsgálatok elvégzéséhez elengedhetetlenül szükséges volt egy olyan preparációs technika kidolgozása, amelynek során lehetségessé vált a nagyon vékony hashártya ultrastruktúrális vizsgálatok céljára történő beágyazása.
2) A mesothel sejtekben a caveolákhoz hasonlatos palack-, omega alakú membránbefűződések azonosítását immuncitokémiai módszerekkel:
caveolin-1 kimutatásával szerettem volna igazolni. A citoszkeletális fehérjék (citokeratin, vimentin), Hsp (hőshock fehérje) 47, nestin és ED1 expressziójának változásait nyomon követve igazolni kívántam, hogy gyulladás hatására a hashártya mesothel sejtjei II típusú hám-mesenchyma átalakuláson mennek keresztül, ill. esetlegesen makrofággá differenciálódnak.
3) Arra voltam kíváncsi, hogy a TGF-β és a GM-CSF kezelés hatására kiváltható- e a mesothel sejtek II típusú hám-mesenchyma átalakulása és az esetleges makrofággá differenciálódása. A vizsgálatok elvégzéséhez szükséges volt egy in vitro túlélő hashártyatenyésztési technika kidolgozása.
4) Az in vitro rendszerben kezelt mesothel sejteken fény- és elektronmikroszkópos módszerekkel kívántam vizsgálni a TGF-β és a GM- CSF sejtekre gyakorolt hatását.
5) Az in vitro rendszerből származó mintákon immuncitokémiai módszerekkel szerettem volna követni a GM-CSF receptor expressziójának változását a GM- CSF kezelést követően, ill. ED1 pán-makrofág marker alkalmazásával a mesothel sejtek makrofággá differenciálódását. Annak eldöntésére, hogy a jelátviteli folyamatban a receptor-ligand internalizációja szerepet játszik-e Dynasore-al gátoltam mind a caveoláris, mind pedig a clathrin-burkos vezikulák közreműködésével végbemenő felvételi folyamatokat és vizsgálni kívántam az ED1 expresszióját.
6) Annak megállapítására, hogy a GM-CSF jelen van-e a hasűri mosófolyadékban, ill. a mesothel sejtek termelik-e ezt a citokint Western Blot
29
technikával GM-CSF meghatározást végeztem a peritoneális mosófolyadékból és a mesothel sejtek lizátumából.
7) In vivo rendszerből (gyulladt hashártya) izolált mesothel sejtek lizátumából Western Blot technikával kívántam nyomon követni a GM-CSF receptor expressziójának változását.
8) In vivo rendszerből származó gyulladt hashártya mesothel sejtjein immuncitokémiai módszerekkel szerettem volna alátámasztani az in vitro rendszerben tapasztalt eredményeimet, ezért vizsgáltam a GM-CSF receptor expressziójának változását, ill. a makrofággá differenciálódás folyamatát ED1 pán-makrofág marker alkalmazásával.
Anyag és Módszer
Állatok:
30
Valamennyi kísérlethez 70-90 napos, 200-250 g súlyú, hím Sprague-Dowley patkányokat (Charles River Research Models and Services, Germany) használtam. Az állatokban az akut peritonitiszt 1 ml komplett Freund adjuváns (elölt Mycobacterium tuberculosist tartalmazó ásványolaj, Sigma, USA) intraperitoneális injekciójával váltottam ki (állatkísérleti engedély: 22.1/1067/3/2010). Az 1, 2, 3, 5, 7, 8, 9, 10, 11, 20 napos inkubációs időt követően a patkányokat éter-narkózis alatt dekapitáltam, majd a mezentériumukat eltávolítottam, preparáltam.
Módszerek:
Hashártya-preparátum készítése: a hashártyát a vékony- és vastagbelekhez futó mezentérium kettőzetek kipreparálásával, majd a zsírszövet eltávolításával nyertem.
In vitro vizsgálatokhoz a kezeletlen állatokból nyert mezentérium kettőzeteket a zsírszövet eltávolítása nélkül, steril körülmények között DMEM/F12 (Dulbecco’s Modified Eagle Medium Nutrient Mixture F-12, Life Technologies, UK) tenyésztői médiumban 37℃-on, 5%-os CO2 koncentráció mellett 1, 2, 3, 6, 8, 24, 48, 72 órán át inkubáltam. A primer kultúrák számára ideális mikrokörnyezet kialakításához különböző kiegészítőket adtam a DMEM/F12 médiumhoz: Bovine Serum Albumint (10%, Sigma, USA), Penicillin-Streptomycint (1%, PAA Laboratories GmbH, Austria) és peritoneális mosófolyadékot (kezeletlen állatok hasüregének 2 ml steril PBS-sel való öblítésekor nyert folyadék) 10%-ban. A mesothel sejtek makrofággá differenciálódásának stimulálása céljából TGF-β1-t (5 nM, Sigma, USA) és GM-CSF-et (1 ng/ml, Sigma, USA) adtam tenyésztői médiumhoz. A GM-CSF receptor-ligand komplex internalizációjának blokkolását Dynasore (80 nM, Sigma, USA) kezeléssel végeztem.
Mind az in vivo és in vitro rendszerből nyert preparátumokat a hagyományos elektronmikroszkópos vizsgálathoz 2%-os glutáraldehid (GA, 0.1M cacodylate puffer, pH: 7.4) és 2%-os OsO4 (0.1M cacodylate puffer, pH: 7.4) 1:1 arányú keverékével jégen fixáltam 1 órán át. A sejtfelszín és az azzal összefüggő felszín jelölésére ruténium-vöröst (Ruthenium Red, Fluka, USA) alkalmaztam (0.5 mg/ml) a fixálás során. A fagyasztott félvékony metszetek készítéséhez, ill. az immuncitokémiai vizsgálatokhoz 4%-os paraformaldehiddel (PFA, foszfát pufferes fiziológiás sóoldat-PBS-ben oldva (PBS: 1000
31
ml ultratiszta vízben: 8g NaCl, 0.2g KCl, 1.42g Na2HPO4x2H2O, 0.2g KH2PO4, pH: 7.4) fixáltam 1 órán át szobahőmérsékleten.
Immuncitokémiai vizsgálatok
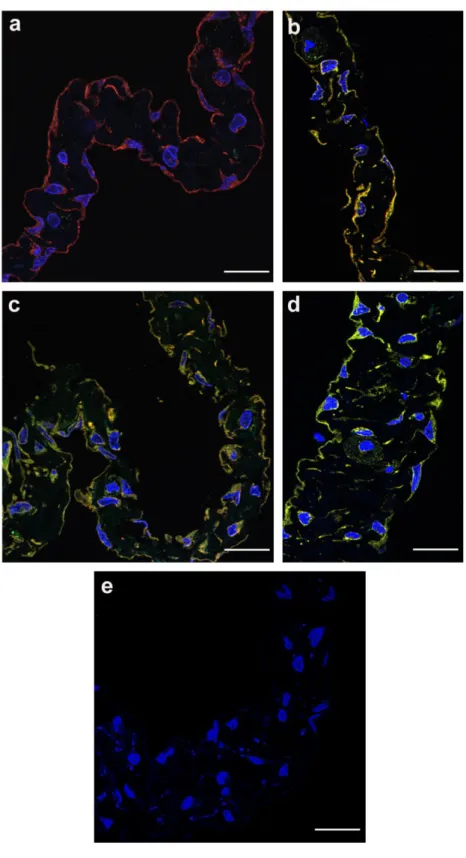
A PFA fixált mintákat a felhasználásig 1%-os PFA-ban tartottam 4℃-on. Az immunjelöléshez módosított Tokuyashu-technikát (Liou és mtsai 1996) alkalmazva végeztem a minták beágyazását és metszését. A hashártya-preparátumokból a fixálót foszfát pufferes mosásokkal (PBS, pH: 7.4) távolítottam el, majd a mintákat 10%-os zselatinba ágyaztam és 37℃-on 30 percig inkubáltam. Ezután a mezentériumot tartalmazó zselatint jégen dermedésig tartottam, majd a metszéshez megfelelően apró blokkokra vágtam. A felvágott blokkokat krioprotekció céljából 12 órára (4℃) 2.3 M-os cukoroldatba helyeztem. A zselatinos blokkokat folyékony nitrogén segítségével alumínium pin-ekre fagyasztottam és a metszésig folyékony nitrogénben tároltam. Az immuncitokémiai vizsgálatokhoz 0.6 µm vastagságú metszeteket készítettem Leica Ultracut S ultramikrotómmal (Vienna, Austria). A metszetekről a fixálót 0.02 M glicin- PBS oldattal történő mosásokkal távolítottam el. Ezután a mintákat 1% BSA (bovine serum albumin, Sigma, USA)-PBS-sel 15 percig blokkoltam. A makrofág karakter igazolásához ED1, OX43, CD63, pán-makrofág antitesteket, a citoszkeletális fehérjék és hám-mesenchyma fenotípusváltás detektálására anti-pán-citokeratint, anti-vimentint és anti-E-cadherint, a mesothel sejtek plaszticitásának igazolására anti-Hsp47-et és anti- nestint, a caveolák kimutatásához anti-caveolin-1-et, a mesothel sejtek láthatóvá tételéhez anti-mesothelint, a TGF-β II receptor és GM-CSF receptor α kimutatásához receptor- specifikus antitesteket használtam (ld. 2. táblázat). A mintákat az első antitesttel egy éjszakán át inkubáltam 4 ℃-on. Az inkubációt követően a mintákról a feleslegben lévő primer antitestet PBS-es mosásokkal távolítottam el. Ezután az immunoreaktív ellenanyagot fajspecifikus Alexa Fluor IgG 488 vagy 555 fluoreszcens festékkel konjugált második ellenanyaggal tettem láthatóvá 1 órán át, sötétben való inkubálással.
A felesleges fluorokrómot PBS-es mosásokkal távolítottam el, majd a metszeteket a sejtmagokat láthatóvá tevő Vectashield DAPI-val fedtem le, és a mikroszkópos feldolgozásig 4 ℃-on, sötétben tároltam. A mikroszkópizálást Bio-Rad Radiance 2100 és Zeiss LSM 780-as konfokális lézer mikroszkópokkal történt. A képeket Confocal Assistant és Adobe Photoshop 7.1 segítségével formáztam.
32 Antitestek, fluoreszcens próbák:
2. táblázat: Az immuncitokémiai és Western Blot vizsgálatok során alkalmazott ellenanyagok és fluoreszcens próbák.
Név Alkalmazás Faj Hígítás Gyártó
Pan-
Citokeratin, IC egér 1:200
BMA Biomedicals, Switzerland
33 Lu5
Vimentin, V9 IC egér 1:100 Chemicon Millipore, USA E-Cadherin IC egér 1:75 BD Transduction Laboratories,
USA
Mesothelin IC nyúl 1:200 Immuno-Biological
Laboratories Co., Japan
ED1 IC
WB
egér
1:400
1:1000
Vrije University, Dept.
Molecular Cell Biology and Immunology, Amsterdam, The
Netherlands OX43 IC egér hígítatlanul PTE Immunológiai és
Biotechnológiai Intézet
CD63 IC nyúl 1:100 Sanquin, The Netherlands
Caveolin-1 IC WB
nyúl 1:100 1:10000
BD Transduction Laboratories, USA
Hsp-47 IC egér 1:200 Merck Calbiochem, Germany
Nestin IC nyúl 1:50 Chemicon Millipore, USA
TGF-β RII, C-16
IC WB
nyúl 1:100 1:500
Santa Cruz Biotechnology, USA
TGF-β WB nyúl 1:1000 Cell Signalling, USA
GM-CSF WB kecske 1:1000 Sigma, USA
GM-CSFRα IC
WB
nyúl 1:100 1:500
GeneTex, USA
β-tubulin WB egér 1:1000 Millipore, USA
Vectashield- DAPI
IC ---- hígítatlanul Vector Laboratories Inc., USA
Alexa Fluor 488/ 555
IC egér/
nyúl
1:200 Molecular Probes, Life Technologies, The Netherlands
Elektronmikroszkópos vizsgálatok
34
A GA és OsO4 keverékével fixált hashártyákat a fixáló eltávolítása céljából 0.1 M cacodylate pufferrel (pH: 7.4) mostam, majd felszálló 30% és 50%-os alkoholsorban víztelenítettem. A membránkontrasztozást 70%-os etanolban oldott 1%-os uranyl- acetáttal végeztem (1 óra, szobahőmérsékleten). Ezután a felszálló alkoholsort folytatva a mintákat 80%, 90%, 96% és abszolút alkoholban, 10-10 percig, majd propilén-oxidba (30 perc) és propilén-oxid-araldit 1:1 arányú keverékébe helyeztem (1 óra), ezt követően aralditba ágyaztam. A fél- és ultravékony metszetek Leica Ultracut ultramikrotommal (Vienna, Austria) készültek. A félvékony metszeteket toluidin-kékkel festettük és Axiovision szoftver segítségével, hagyományos fénymikroszkóppal (Axiophot, Carl Zeiss) vizsgáltuk. Az ultravékony metszeteket ólom-citráttal kontrasztoztuk. A mintákat Hitachi H-7600 (Tokyo, Japan) transzmissziós elektronmikroszkóppal vizsgáltuk.
Immunoblot analízis
A hashártya preparálása előtt a patkányok hasüregét PBS-sel átmostam a hashártyához tapadt és a peritoneális üregben jelenlévő sejtek eltávolítása céljából. Az izolált mintákat további PBS-ses mosások után DMEM/F12-ben oldott, 0.2%-os kollagenázban (type II, Sigma, USA) 45 percig, 37℃-os termosztátban inkubáltam. A kollagenázos emésztés után a hashártyát borító mesothel sejtek összefüggő rétegben, könnyen leválaszthatóvá váltak a kötőszövetről. A kollagenáz eltávolítása céljából a mesothel sejteket háromszor PBS-el mostam centrifugálás közbeiktatásával (1000 rpm, 10 perc, 4℃-on). A pelleteket folyékony nitrogénben lefagyasztottam és a felhasználásig -80℃-on tároltam. A gélelektroforézis előtt az izolált mesothel sejteket mechanikusan és 50mM TRIS (hidroximetil-aminometán)-HCl, pH:7.5, 150mM NaCl, 2mM EDTA, 200mM Na3VO4, 1mM NaF, 1% Nonidet P-40 és proteáz inhibítor (Complete Mini, Roche, Germany) keverékével tártam fel (1 óra, jégen). Az oldhatatlan anyagok eltávolítását centrifugálással (20 perc 4℃-on 12000 rpm) végeztem. Az eltávolított felülúszók fehérjetartalmát Bradford assay-vel (Bradford 1976) határoztam meg.
A peritoneális mosófolyadék immunoblot analíziséhez az állatok hasüregét 2ml PBS-sel öblítettem, majd a mintákat 20 percig 4℃-on 12000 rpm-el centrifugáltam. A felülúszók fehérjetartalmát Bradford analízissel mértem meg és a közvetlen felhasználásig -80℃-on tároltam.
35
A Western Blot vizsgálatok során 1mg/ml-es fehérje-koncentrációjú mintákkal dolgoztam, ezeknek TRIS-SDS puffer (0.5M TRIS pH: 6.8, 10% glycerol, 2% SDS (sodium dodecil szulfát), 0.00125% brómfenolkék, 0.5% mercaptoethanol) 1:1 arányú keverékét 4 percig forraltam. A mintákat 10%-os, 1.5 mm-es SDS-PAGE (poliakrilamid gél elektroforézis) gélen futtattam (2 db alsó gélhez: 11.7 ml ultratiszta víz (UTV), 6 ml 1.5 M TRIS (pH: 8.8), 240 µl 10%-os SDS, 5.94 ml Akrilamid BIS 40%, 120 µl 10%-os ammónium-perszulfát és 12 µl TEMED (tetrametiletiléndiamin); 2 db felső gélhez: 6.425 ml UTV, 2.5 ml 0.5 M TRIS (pH: 6.8), 100 µl SDS, 0.975 ml Akrilamid BIS 40%, 50 µl ammónium-perszulfát és 10 µl TEMED). Az elektroforézishez a gélt futtató pufferbe (0.3% TRIS, 1.44% glicin, 0.1% SDS UTV-ben) helyeztem és a mintákat 200 V-on 40 percig futattam. Ezután a gélt és a nitrocellulóz membránt (Amersham Hybond ECL, Germany) blot pufferbe (800 ml 0.38% TRIS és 1.8% glicin tartalmú UTV-hez 200 ml metanolt adva) helyeztem 15 percre. A fehérjék nitrocellulóz membránra való transzferjéhez a fehérjéket tartalmazó gélt és a membránt blot pufferben folyamatos hűtés mellett 100 V-on 1 órán át blottoltam. A transzfer után a nitrocellulóz membránt 0.005%- os Tween (Sigma, USA) -PBS pufferben inkubáltam 10 percig, majd a fehérjefrakciók megjelenítése céljából a membránt Ponceau S (Sigma, USA) oldattal kezeltem. A fehérjék blokkolására a membránt egy éjszakán át 4℃-on 5%-os zsírmentes tejben (Nonfat Dry Milk, Cell Signalling, USA) inkubáltam. A tej eltávolítása PBS-Tween-es mosásokkal történt.
A nitrocellulóz membránon végzett immunreakcióhoz a primer antitesteket 0.5%- os BSA-PBS-Tween-el higítottam. A makrofággá differenciálódás igazolása céljából ED1 pán-makrofág markert, a GM-CSF, a GM-CSF receptor α, a TGF-β és a TGF-βII receptor jelenlétének bizonyításához specifikus ellenanyagokat használtam (ld. 2.
táblázat). Töltési kontrollként β-tubulin antitestet alkalmaztam. A membránt a primer antitestekkel egy éjszakán át 4℃-on inkubáltam, majd PBS-Tween-el mostam. A primer antitestek láthatóvá tételéhez fajspecifikus peroxidáz-konjugált, PBS-Tween-ben higított szekunder antitesteket (ECL Peroxidase labelled anti-mouse/rabbit/goat antibody, Amersham, GE Healthcare Biosciences, UK) használtam (2 óra, szobahő). Az immunreakció láthatóvá tételéhez a membránt kemolumineszcens oldattal (Luminata Forte/Classico Western HRP Substrate, Millipore, USA) inkubáltam, majd az immunreakciót röntgenfilm segítségével detektáltam.
36
A membránok újbóli használatához az immunreaktív anyagokat WB Reprobe- Reagent (Merck Calbiochem, Germany) oldat alkalmazásával távolítottam el.
Quantitatív analízis
A mesothelin pozitív sejtek százalékának meghatározásához minden csoportból 150 sejtet számoltam meg random, ugyanazon a nagyítással készített felvételeken.
Eredmények
1) A mesothel sejtek morfológiájának változása a gyulladás 1-11. napján: fény- és elektronmikroszkópos vizsgálatok
A kezeletlen patkányok mezentériumának mindkét felszínén lapos, nyúlványokkal rendelkező sejtekből álló mesothel réteg figyelhető meg. A mesothel sejtek csak a sejtmagjuk alapján azonosíthatóak, citoplazmájuk csak sejthető (6., 9. a
37
ábrák). A hashártya kötőszövetében néhány sejtes elem (hízósejt, fibrocita) és kötőszöveti rost (elsősorban kollagénrost) figyelhető meg.
6. ábra: Kontroll hashártya toluidin-kékkel festett, félvékony metszete: A hashártya mindkét felszínén lapos, elnyújtott mesothel sejtek (nagy nyíl) láthatóak. A sejtmag jól megfigyelhető, míg a citoplazmatikus állományuk alig kivehető. A mesothel réteg alatti kötőszövet relatíve sejtszegény, csak néhány fibrocitát (kis nyíl), egy-két hízósejtet (M) és kötőszöveti rostokat (kollagénrost-cf) tartalmaz. A: arteriola, C:
kapilláris. Bar: 20 µm.
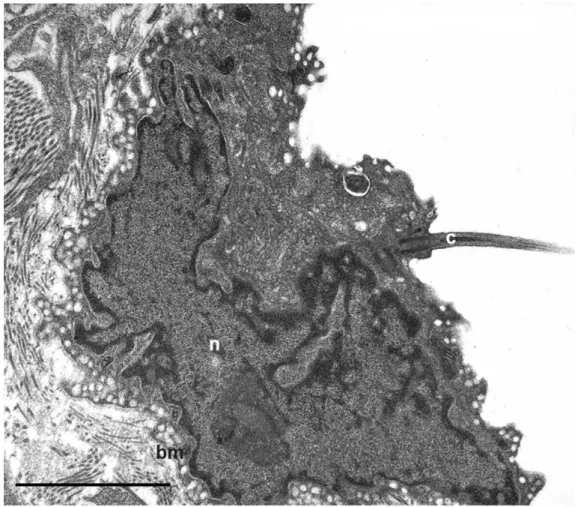
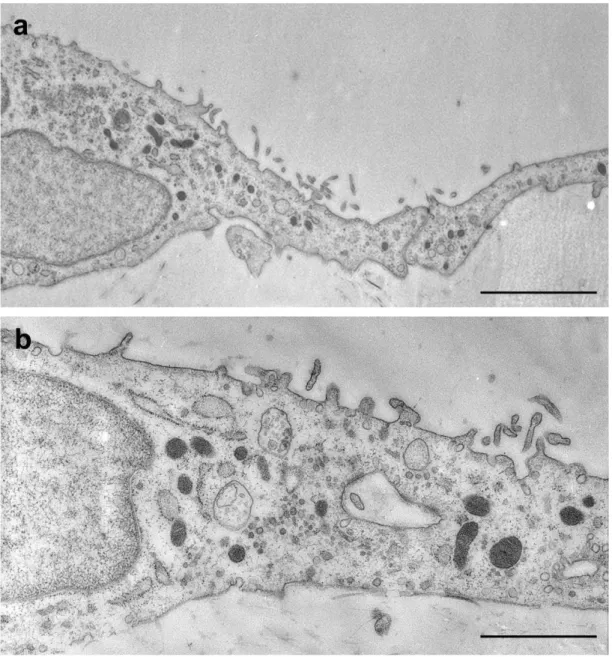
A kezeletlen hashártya elektronmikroszkópos (EM) felvételén (7. a-b ábra) is jól látható, hogy a mesothel sejtek citoplazmáját szinte teljes egészében a sejtmag tölti ki, csak néhány sejtorganellum (mitokondriumok, szekréciós granulumok és kisméretű
38
endoplazmás retikulum) figyelhető meg (7. d ábra). Néhány esetben a mesothel sejtekre is jellemző őscsilló (c) a bazális testével (nyílhegy) is azonosítható. A mesothel sejtek teljes bazális felszínükkel kapcsolódnak a lamina basalishoz. Sejtkapcsoló struktúráik is jól megfigyelhetőek (7. c ábra nyíl).
39
7. ábra: Kontroll hashártya és az azt borító mesothel sejtek elektronmikroszkópos felvételei: (a) Lapos mesothel sejtek borítják a hashártya mindkét felszínét. (a-d) A sejtmagok szinte teljes egészében kitöltik a citoplazmát, (d) csak néhány sejtorganellum (mitokondrium, szekréciós vezikula, endoplazmás retikulum) azonosítható, a lamina basalis ép (nyilak). (c) A mesothel sejtek közötti sejtkapcsoló struktúrák is jól megfigyelhetőek (nyíl). A: arteriola, cf: kollagénrost, c:
csilló, nyílhegy: bazális test. Bar: a: 6 µm, b-d: 0.8 µm.
Mind a lamina basalissal érintkező, mind pedig az apikális sejtmembránon számos omega- ill. palack alakú membránbefűződés látható, amelyek morfológiájuk alapján caveolákra emlékeztetnek. Jól látható, hogy a bazális felszínen nagyobb számban vannak jelen, mint az apikális membránon (8. ábra).
8. ábra: Kontroll mesothel sejt plazmamembrán invaginációi: Mind a bazális, mind az apikális sejtmembránon palack-, ill. omega alakú membránbefűződések