A
LTERNATÍV ÖKOTOXIKOLÓGIAI TESZTEKKÖRNYEZETSZENNYEZŐ KOMPONENSEK DETEKTÁLÁSÁRA
Ács András
DOKTORI (PhD) ÉRTEKEZÉS
Pannon Egyetem Vegyészmérnöki tudományok és Anyagtudományok Doktori Iskola Témavezetők:
Felpécziné Dr. Farkas Anna, tudományos főmunkatárs,
MTA Balatoni Limnológiai Kutatóintézet és
Dr. Kováts Nóra, egyetemi docens,
Pannon Egyetem, Limnológia Intézeti Tanszék
Pannon Egyetem VESZPRÉM,2010
ALTERNATÍV ÖKOTOXIKOLÓGIAI TESZTEK KÖRNYEZETSZENNYEZŐ KOMPONENSEK DETEKTÁLÁSÁRA
Értekezés doktori (PhD) fokozat elnyerése érdekében Írta:
Ács András
Készült a Pannon Egyetem Vegyészmérnöki tudományok és Anyagtudományok Doktori Iskolája keretében
Témavezető: Felpécziné Dr. Farkas Anna
Elfogadásra javaslom (igen / nem)
(aláírás) Dr. Kováts Nóra
Elfogadásra javaslom (igen / nem)
(aláírás) A jelölt a doktori szigorlaton ...%-ot ért el,
Az értekezést bírálóként elfogadásra javaslom:
Bíráló neve: …... …... igen /nem
……….
(aláírás) Bíráló neve: …... …...) igen /nem
……….
(aláírás) ***Bíráló neve: …... …...) igen /nem
……….
(aláírás) A jelölt az értekezés nyilvános vitáján …...%-ot ért el.
Veszprém, ……….
a Bíráló Bizottság elnöke A doktori (PhD) oklevél minősítése…...
………
Az EDHT elnöke
4
Tartalom
Rövidítések jegyzéke ...6
Kivonatok ...8
Bevezetés és célkitűzés ... 11
1. Irodalmi áttekintés ... 14
1.1. Az ökotoxikológiai tesztek fogalma és szükségessége ... 14
1.1.1. Klasszikus ökotoxikológiai tesztek ... 16
1.1.2. Alternatív ökotoxikológiai tesztek ... 18
1.1.2.1. In vivo módszerek ... 19
1.1.2.2. In vitro módszerek ... 28
1.2. A cianobaktériális toxicitás környezeti kockázata ... 30
1.2.1. A cianobaktériumok felépítése, működése, viselkedése ... 31
1.2.2. Cianobaktérium fajok a Balatonban ... 33
1.2.3. Cianotoxinok ... 34
2. Anyag és módszer ... 42
2.1. Anyagok ... 42
2.2. Algakivonatok... 43
2.2. Vizsgálatok Lemna minor makrofita növényen ... 44
2.2.1. Növekedési inhibíció teszt ... 44
2.2.2. Képelemzési módszeren alapuló Lemna minor teszt ... 45
2.3. Vizsgálatok Daphnia magna plankton rákon ... 46
2.3.1. Daphnia magna immobilitás teszt ... 46
2.3.2. Daphnia magna táplálkozás aktivitás-gátlás teszt... 46
2.4. Thamnocephalus platyurus mortalitás teszt ... 47
2.5. Mortalitás vizsgálatok Artemia salina héjnélküli kisrákon ... 47
2.6. Vibrio fischeri biolumineszcencia-gátlás vizsgálat ... 48
2.7. Enzimaktivitási vizsgálatok Artemia salina héjatlan kisrákon és Dikerogammarus villosus amphipoda rákon ... 49
2.7.1. LDH enzimaktivitási vizsgálatok ... 50
2.7.2. GST enzimaktivitási vizsgálatok ... 51
5
2.7.3. AChE enzimaktivitási vizsgálatok ... 52
2.7.4. Összprotein tartalom meghatározása ... 54
2.8. Analitikai módszerek ... 54
2.9. Statisztikai elemzés ... 55
3. Eredmények és értékelés ... 56
3.1. Két új ökotoxikológiai módszer fejlesztése ... 56
3.1.1. Daphnia magna táplálkozás aktivitás teszt ... 56
3.2. Duckweed Detector (DwD) – szoftveres képelemzési módszer Lemna minor növekedés-gátlás elemzésére ... 59
3.4. Cianobaktérium törzsek ökotoxikológiai kockázatának becslése ... 62
3.4.1. Daphnia magna táplálkozás aktivitás-teszt eredményei algakivonatokra ... 62
3.4.2. Cianobaktérium izolátumok hatásának összehasonlító vizsgálata egyéb ökotoxicitási tesztek alapján ... 65
3.4.3. Biokémiai marker vizsgálatok Artemia salina héjnélküli kisrákon ... 67
3.4.4. Biokémiai marker vizsgálatok Dikerogammarus villosus amphipoda rákon 73 3.4.5. In vitro acetilkolinészteráz gátlás vizsgálatok ... 75
3.5. A cianobaktériumok nyers kivonatainak analitikai elemzése ... 76
4. Az eredmények összefoglalása ... 85
Tézispontok ... 89
Theses ... 92
Irodalomjegyzék ... 94
Köszönetnyilvánítás ... 104
6
Rövidítések jegyzéke
ACT 9502 balatoni Cylindrospermopsis raciborskii törzs ACT9503 balatoni Cylindrospermopsis raciborskii törzs ACT 9504 balatoni Cylindrospermopsis raciborskii törzs ACT 9506 balatoni Cylindrospermopsis raciborskii törzs
AChE acetilkolinészteráz
ANOVA varianciaanalízis (ANalysis Of VAriance)
APHA foszfát puffer (American Public Health Association)
ASTM Amerikai Anyagvizsgálati Társaság (American Society for Testing and Materials)
ATCI acetiltiokolin-jodid
AQS Ausztrál cilindrospermopszint termelő Cylindrospermopsis raciborskii törzs
Atx anatoxin-a, 2–acetil-9-azabiciklo[4.2.1.]non2-én CCD töltéscsatolt félvezető eszköz (charge-coupled device)
CDNB 1-klór-2,4-dinitrobenzol
CYN cilindrospermopszin
DTNB 5,5 ditio-bisz-nitro-benzol
EC50 Median Effects Concentration, az a toxikus koncentráció, mely a kezelt alanyokon 50%-os hatást vált ki
FBS foetalis borjúszérum
GSH glutation
GST glutation S-transzferáz
GTX gonyautoxinok
Hman homoanatoxin-a, 2-(propán-1-oxo-1-il)-9- azobiciklo[4,2,1]non- 2én
IC50 Median Inhibitory Concentration, az a toxikus koncentráció, mely a vizsgált tulajdonság 50%-os gátlását okozza
ISO Nemzetközi Szabványügyi Szervezet (International
Organization for Standardization)
KDO 3-deoxi-D-mannózsavon
7 LD50 Median Lethal Dosis, az a toxikus mennyiség, melynél a kezelt
alanyok 50%-a elpusztul
LC50 Median Lethal Concentration, az a toxikus koncentráció, melynél a kezelt alanyok 50%-a elpusztul
LDH laktát dehidrogenáz, tejsav dehidrogenáz
LPS lipopoliszacharid
MC-LR mikrocisztin-LR
MTT (3,4,5-dimetilthiazol-2il)-2,5-difeniltetrazolium bromid NAD nikotinamid adenin dinukleotid
OECD Gazdasági Együttműködési és Fejlesztési Szervezet (Organisation for Economic Co-operation and Development) PBS fiziológiás sót tartalmazó foszfát puffer
PCC 6506 francia Oscillatoria sp. algatörzs
PP1 protein foszfatáz 1
PP2A protein foszfatáz 2A
PP2C protein foszfatáz 2C
PSI, PSII egyes és kettes fotokémiai rendszer
STX szaxitoxin
Tris-NaCl Trisz(hidroximetil)-aminometán, nátrium klorid és nátrium-azid tartalmú puffer
WHO Egészségügyi Világszervezet (World Health Organization)
8
Kivonatok
Alternatív ökotoxikológiai tesztek környezetszennyező komponensek detektálására A disszertáció célja újonnan kifejlesztett alternatív ökotoxikólógiai tesztek bemutatása, melyek megfelelően alkalmazhatóak környezeti kockázatbecslés céljára. A kidolgozott módszerek (Daphnia magna táplálkozás-gátlás teszt, szoftveres képelemzési módszer L.
minor növekedés-gátlás értékelésére) kalibrálása az ökotoxikológiában általánosan elterjedt validáló vegyület, a kálium-dikromát révén történt. A D. magna táplálkozás- gátlás-, valamint a konvencionális tesztek (D. magna, Thamnocephalus. platyurus, Asalina salina, Vibrio fischeri) érzékenységének összevetése a xenobiotikumok egy speciális csoportja, a vízi környezetre kockázatot jelentő cianobakteriális metabolit komplexekre adott válaszok alapján került sor. A vizsgálatok során a cilindrospermopszint termelő AQS Cylindrospermopsis raciborskii; anatoxinokat termelő Oscillatoria sp. (PCC 6506) és négy balatoni C. raciborskii törzset alkalmaztunk. A bioaktív anyagok toxicitásának jellemzése biokémiai marker vizsgálatok – LDH, GST, AChE enzimaktivitás – alapján in vivo kísérletekben, az A.
salina sórákon és a D. villosus amphipoda rákon került sor. Az algakivonatokban megtalálható metabolitok analízise LC-ESI-MS útján történt.
Valamennyi teszt a legnagyobb toxicitást az AQS törzsre jelezte. A legérzékenyebbnek T. platyurus, míg leghatékonyabbnak a V. fisheri és D. magna táplálkozás-aktivitás tesz bizonyult. Az A. salina naupliák GST aktivitásának változásai jól tükrözték az AQS törzs kivonatában a cilindrospermopszin jelenlétét. Az exponált A. salina naupliákban észlelt LDH aktivitás növekedés mértéke szoros pozitív korrelációt mutatott a nyers cianobaktérium kivonatok általános toxicitási mutatójával. Az AChE enzim aktivitásban észlelt változások néhány algatörzs esetében antikolinészteráz tulajdonságú metabolitok szintézisét jelzi. A D. villosus amphipoda rákokkal végzett akut vizsgálatok legjelentősebb eredménye, hogy a természetben is gyakran előforduló tömegprodukció esetén, még az AQS ill. PCC 6506 törzsek sem jelentenek számottevő környezeti kockázatot a vízi ökoszisztémára. A minták analitikai elemzése az AQS törzs cilindrospermopszin termelését mutatta ki nagy mennyiségben (12,7 mg/g). A PCC 6506 mintánál mindkét anatoxin homológ termelése igazolódott, az irodalomban leírt mennyiségi különbségekkel egyezően (anatoxin-a: 124 μg/g; homoanatoxin-a: 3,2
9 mg/g). A balatoni alga liofilizátumok analitikai elemzése alapján a törzsek a közismert cianotoxinokat nem termelik.
A mortalitási tesztek kiválthatóak szubletális végpontú eljárások által. Utóbbiak érzékenységük, pontosságuk, ökológiai relevanciájuk alapján megfelelőbben extrapolálhatók az ökoszisztémára nézve. További előnyük, hogy a megfelelően kiválasztott módszerek egymással kombinálva többletinformációt nyerhetünk a bioaktív anyagok hatásmechanizmusát illetően.
Alternative ecotoxicological testmethods for detecting environmental pollutants The main subject of the work was to develop new alternative ecotoxicity assays and to investigate the applicability of alternative test methods for the assessment of environmental health hazards of xenobiotics. The new assays (Daphnia magna feeding inhibition test, evaluation method of data processing for Lemna minor growth inhibition assay) were calibrated against potassium-dichromate, commonly applied as positive reference compound in ecotoxicological testing. The comparative sensitivity and reliability assessment of the Daphnia magna feeding inhibition test towards the conventionally used mortality/immobility assay methods was performed using a special group of xenobiotic compounds posing health hazards to the aquatic environment i.e.
the cyanobacterial secondary metabolites complex. The biological health hazards of cyanobacterial matrices were characterized using in vivo biochemical marker assays on Artemia salina and Dikerogammarus villosus. Quantitative and qualitative analysis of cyanobacterial matrices were executed using LC-ESI-MS. The investigations revealed that the conventional lethality assays can be substituted by test alternatives relying on sub-lethal endpoints. Relevant advantage of alternative methods is their applicability in battery of assays purchasing in this way important extra information about the mechanisms of action bioactive compounds.
Alternative Methoden für die Detektion Umweltschmutzstoffen
Haupt Ziel der Arbeit war die Entwicklung von neuen alternativen ökotoxikologischen Testmethoden und die Untersuchung der Anwendbarkeit der alternativen Testmethoden für die Bewertung der Umweltrisiken von Xenobiotika. Die neue Testmetoden (Daphnia magna Nahrungsaufnahme-hemmung Test, Software Wertung Methode für Lemna minor Wachstum Hemmung Test) wurde kalibriert gegen Kalium-Bichromat,
10 das allgemein in Ökotoxikologie als Referenzmaterial verwendet wird. Vergleichende Untersuchungen der Anwendbarkeit und der Empfindlichkeit von D. magna Nahrungsaufnahme-hemmung Test gegen die konventionellen Mortalität/Immobilität Methoden wurde durchgeführt gegen eine spezielle Gruppe der Xenobiotika, welch oft Gesundheitsrisiken in Gewässern darstellt, wie die sekundäre cyanobakterielle Metabolit Komplexe. Die biologische Gesundheitsrisiken der cyanobakterielle Matrizes wurde charakterisiert durch die Untersuchungen von Indikatorenzymen in vivo in Artemia salina und Dikerogammarus villosus. Qualitative und quantitative Analyse von cyanobakterielle Matrizes wurde mit Benutzung einen LC-ESI-MS System ausgeführt.
Die Untersuchungen zeigen darauf hin, dass die konventionelle Mortalitätsteste können durch subletalen Testalternativen ausgelöst werden. Wesentlicher Vorteil der alternativen Methoden ist ihrer Anwendbarkeit in Testbatterien, die wichtigen Extrainformationen liefern über die Effektmechanismus der bioaktiven Komponente.
11
Bevezetés és célkitűzés
A forgalomba kerülő illetve már forgalomban levő, de a környezetre gyakorolt hatás szempontjából nem ellenőrzött vegyi anyagok kockázatbecslése nagyszámú ökotoxikológiai teszt elvégzését igényli. Az Európai Unió a Tanács 793/93/EEC rendelete alapján rendelkezik a létező vegyi anyagok emberekre és környezetre való veszélyességének értékeléséről és ellenőrzéséről. E szerint mintegy százezer, az Unió piacán regisztrált vegyület van jelenleg forgalomban, melyek közül több mint tízezer termék kerül forgalomba 10 tonnánál nagyobb mennyiségben, és húszezerre tehető azon kemikáliák száma, melyek 1- 10 tonnás nagyságrendben kerülnek piacra. Ezen anyagok környezeti kockázatát utólag kell értékelni.
Újonnan forgalomba kerülő anyagok kockázatelemzéséről rendelkezik a Tanács 67/548, 91/41 számú rendelete és a 98/8 számú irányelve: ezek szerint „új” anyagnak tekinthető minden 1981 óta forgalomba került kemikália, míg „létező anyagkén” az említett időpont előtt forgalomba került anyagokat definiálják az említett rendeletek és irányelvek.
Az „új” anyagok száma 2700 körülire tehető, melyek környezeti és humán egészségügyi kockázatelemzését a 67/548 számú direktíva csak abban az esetben teszi kötelezővé piacra kerülésük előtt, amennyiben 10 kg felett van éves forgalmazott mennyiségük.
Ezzel szemben a „régi” anyagok a piacra kerülő anyagmennyiség közel 99 százalékát alkotják, melyek közül elenyésző számú készítményre készült mindenre kiterjedő kockázati elemzés.
A hazai jogszabályi környezetet, az előzőekkel konform jogszabályok, a 2000. évi XXV. törvény a kémiai biztonságról, a 12/2001. (V. 4.) KöM-EüM együttes rendelet (a vegyi anyagok kockázatának becsléséről és a kockázat csökkentéséről), valamint a 38/2003. (VII. 7.) ESzCsM-FVM-KvVM együttes rendelet (a biocid termékek előállításának és forgalomba hozatalának feltételeiről) alkotják.
Ökológiai kockázatelemzést nemcsak az említett rendeletekben meghatározott vegyi anyagokra végeznek, hanem (a teljesség igénye nélkül) pl. már fennálló szennyezések detektálására, vagy természetes anyagok (pl. biotoxinok) környezeti kockázatának értékelésére, tovább növelve ezzel az elvégzendő tesztek számát. Az Európai Unió
12 vegyi anyagokkal kapcsolatos stratégiája (Anonímusz, White paper 2001) ugyanakkor kimondja, hogy a magasabb rendű állatokon végzett tesztek számát csökkenteni kell.
Kiterjedt kutatás folyik annak érdekében, hogy olyan új teszteket dolgozzanak ki, amelyek eleget tesznek az alapvető minőségügyi követelményeknek, kellőképpen megbízható, és valós ökoszisztémákra/emberi hatásviselőre nagy biztonsággal extrapolálható eredményeket adnak, ugyanakkor az etikai követelményeknek is megfelelnek (Worth és Balls 2002).
Mint ahogy a nemzetközi és Nemzeti szabályozásból is kitűnik, a fokozott védelem csak a gerinces állatokra terjed ki. A gerinctelen állatokon végzett kísérletekre semmilyen szabályozó rendelet nem vonatkozik. Egyre nagyobb azonban azoknak a szakembereknek a száma, akik a Russell és Burch által (Russell és Burch 1959) megfogalmazott 3R elveinek kiterjesztését szorgalmazzák ezen élőlénycsoportokra is, olyan mindenki számára hozzáférhető adatbázisok létrehozásával, amelyek lehetővé teszik az elvégzett kísérletek számának csökkentését. Ezen túlmenően az utóbbi évtizedben egyre nagyobb igény jelentkezett olyan tesztvégpontok keresésére, melyek kiválthatják a konvencionálisan alkalmazott mortalitási (immobilizációs) teszteket.
A konvencionális mortalitási tesztek gyengesége, hogy olyan irreverzibilis és nem specifikus mutatót, azaz a tesztállat pusztulását alkalmazzák végpontként, mely jelentősége megkérdőjelezhető ökológiai szempontból. Ökológiai kockázatot jelenthetnek olyan anyagok is, melyek hatása mortalitási tesztekkel alacsony koncentrációjuk miatt még nem, azonban más, szubletális végpontok alkalmazása révén már megfelelően mérhetőek.
Az ilyen anyagok megjelenése nem feltétlenül az emberi tevékenység közvetlen következménye. Például, a felszíni vizek nagymértékű tápanyagterhelése a vízterek eutrofizációjához vezet. Az eutrofizáció egyik legfeltűnőbb jelensége a fonalas nitrogénkötő cianobaktériumok tömeges elszaporodása (Carmichael 1997; Codd et al.
1999; Pitois et al. 2001). A cianobaktérium tömegprodukciókról ma már ismert, hogy az esetek mintegy 25%-át toxintermelő törzsek okozzák, súlyos és tömeges elhullást okozva, mind a mezőgazdaságilag fontos haszonállatok, mind a vadon élő állatok között. Kivételes esetekben a cianobaktérium mérgezések az emberek súlyos megbetegedését és halálát is előidézték (Byth 1980; Bourke et al. 1983; Carmichael
13 1997; Codd, et al. 2005), ami világszerte a cianobaktériumok toxicitásának átfogó kutatását indokolta.
A cianobaktériumok toxikusságának és toxikus jellegének becslésére a leggyakrabban alkalmazott és a WHO által egyedüliként elfogadott szabvány eljárás az egérteszt, azonban, a toxikus vízvirágzások gyors kiszűrésére mind elterjedtebben alkalmaznak elsődleges elemzés céljából ökotoxikológiai „bioassay” eljárásokat is, közülük főként a planktonikus rákokra, mint a Thamnocephalus platyurus, Daphnia sp., vagy Artemia salina szervezetekre épülő teszteket is.
Doktori értekezésem témája az alternatív ökotoxikológiai tesztek környezetszennyező komponensek detektálására való alkalmazhatóságának vizsgálata. Céljaim a következőképp foglalhatóak össze:
• Új alternatív ökotoxikólógia tesztek kifejlesztése, melyek megfelelő érzékenységgel és alkalmazhatósággal rendelkeznek ahhoz, hogy gyors és objektív környezetei kockázatbecslést tegyenek lehetővé potenciális környezetszennyezőkkel szemben.
• Az általam kifejlesztett módszerek kalibrálása az ökotoxikológiában általánosan elterjedt kalibráló/validáló vegyület, a kálium-dikromát által.
• A kalibrált Daphnia magna táplálkozás aktivitás-gátlás teszt érzékenységének és hatékonyságának összevetése a konvencionális, mortalitási/immobilitási tesztmódszerrel. Erre a célra a xenobiotikumok egy speciális csoportját, a vízi környezetre veszélyt jelentő anyagcsoportot, a cianobakteriális metabolit komplexet választottam.
• A cianobaktérium mátrixban található bioaktív anyagok toxicitásának jellemzése biokémiai marker vizsgálatok alapján in vivo- kísérletekben az Artemia salina sórákon és a Dikerogammarus villosus amphipoda rákon.
• A cianobaktériális kivonatokban megtalálható metabolitok minőségi és mennyiségi vizsgálata folyadék-kromatográfia és tömegspektrometria útján, valamint az analitikai adatok összehasonlítása ökotoxikológiai tesztek eredményeivel.
14
1. Irodalmi áttekintés
1.1. Az ökotoxikológiai tesztek fogalma és szükségessége
Az ökotoxikológiai vizsgálatok célja, hogy viszonylag egyszerű biológiai tesztekkel az ökoszisztéma egészére extrapolálható kockázatbecslést adjanak. Az ökotoxikológiai tesztmódszerek egyed szinten az egyed élettani jelenségeit (pusztulás, növekedés, energiaháztartás, biokémiai folyamatok, mutáció) vizsgálják, a populáció szintjén pedig a szaporodás, egyedsűrűség, eloszlás törvényszerűségeivel foglalkoznak. Társulás szintjén a fajszám, a fajok közötti kapcsolatok, indikátor fajok jelenléte; míg az ökoszisztéma szintjén a rendszer egészének anyag és energia forgalma áll az ökotoxikológiai vizsgálatok középpontjában. Mindezekből látható, hogy az ökotoxikológia rendkívül széles eszköztárral rendelkezik és a vizsgálatok tárgyától függően igen változatos.
A szennyezőanyagok ökotoxikus hatását vizsgálhatjuk egy fajú laboratóriumi tesztekkel, amelyeknek többsége laboratóriumi körülmények között könnyen elvégezhető; műszert nem igényel, így kivitelezési költsége alacsony. Hátrányuk, hogy viszonylag alacsony környezeti relevanciával rendelkeznek, mivel természetes viszonyok között nem pusztán egy faj egyedei kerülnek kapcsolatba a szennyezőanyaggal, hanem különböző fajok populációi. Így a szennyezőanyagok természetes viszonyok között fellépő komplex hatásának becslése során, az egy fajt alkalmazó tesztek félrevezető eredményt adhatnak. Az extrapoláció egy fajról, jelen esetben a tesztorganizmusról, egy másik fajra vagy az ökoszisztéma egészére csak nagy körültekintéssel végezhető el (Robinson és Thorn 2005).
Alternatív tesztek alatt a toxikológiában/ökotoxikológiában olyan módszereket értünk, melyek helyettesíthetik, kiválthatják a magasabb rendű tesztszervezeteket a kísérletek során. Ez jelen pillanatban elsősorban a gerinceseket kiváltó módszereket jelent, ám egyre inkább érzékelhető azon szemlélet elterjedése, miszerint nem csak a gerincesek, de a gerinctelen élőlények kiváltása is kívánatos nem csak etikai szempontok miatt, de a tesztek eredményei által hordozott többletinformációk alapján is.
Többletinformációt szolgáltatathat a különböző biomarker enzimek vizsgálata, illetve szubletális jellemzők megjelölése végpontként, melyek szorosan összefüggnek a vizsgált élőlény életfunkcióival (Schirmera, et al. 2008). Az így nyert adatok által sok
15 esetben nem csak pontosabban meghatározható a környezeti kockázat, de ismeretlen összetételű minta esetében következtetni lehet a káros hatást kifejtő anyag típusára is.
Ugyanez megfordítva is igaz: ismert összetételű minta esetén fényt deríthetnek olyan mechanizmusokra, melyeket az összetétel ismeretében nem szükségképp feltételeznénk (Wadhia és Thompson 2007). Ez nagymértékben elősegítheti a vizsgált minta kvalitatív analitikai elemzését is.
Végcélként az említett szempontok alapján, az élőlények használatának kiváltása értelmezhető elsősorban in vitro, illetve in silico módszerek által (Anonímusz 1986).
Az in vitro módszerek alkalmazhatósága azonban erősen korlátozott. Ezen korlátok a következőképp foglalhatóak össze (Anonímusz 2005):
Az élő szervezetet felépítő sejtek és szövetek diverzitása: több száz különböző típusú és fejlődési szintű sejt különféleképp és különböző mértékű reakciót mutat(hat).
Közvetlen és közvetett (véráram, idegrendszer által közvetített)
Kölcsönhatások a szövetek közt: az immunreakciók, a csírasejt fejlődés, a metabolikus folyamatok és sok más normális és rendellenesség hatására kialakuló folyamat kiterjedt kölcsönhatásokat generál a test különböző tájain és szövetein belül.
A szövetszerkezet hatása a sejtkörnyezetre: az oxigénszint, a tápanyagellátás, a sejtközi kommunikáció és kommunikációs gátak egyaránt befolyásolják az egyes sejtek viselkedését és válaszát stimuláció hatására.
Az említett korlátózó tényezők miatt az in vivo eljárások egyelőre nem helyettesíthetőek egyetlen in vitro módszer használatával sem, különösen, ha többféle szennyező/mérgező anyag hatásának vizsgálata a cél egyetlen mintán belül. Utóbbi elég gyakori az ökotoxikológiai gyakorlatban, hiszen sok esetben nem az egyes komponensek hatásának vizsgálata, hanem a környezet egészére gyakorolt összesített hatás és kockázat meghatározása a fő cél. Ezért a gerinceseken végzett kísérletek alternatíváit (az ökotoxikológia területén) elsősorban a gerinctelen állatokon végzett kísérletek jelentik.
Az alacsonyabb rendű tesztszervezetet alkalmazó módszerek nem feltétlenül csak
16 etikailag elfogadhatóbbak, hanem sok esetben gyorsabban is adnak eredményt, mint pl.
a hagyományosan használt (és sok esetben a WHO által egyedüliként elfogadott) egér kísérletek és egyéb gerinces szervezeten végzett vizsgálatok.
1.1.1. Klasszikus ökotoxikológiai tesztek
A Klasszikus ökotoxikológiai tesztmódszereket kemikáliák önmagukban történő kockázatelemzésére fejlesztették ki. Később az így kidolgozott módszerek kerültek alkalmazásra természetes minták esetében is. Ezek a tesztek jellemzően egyfajú tesztek, melyek végpontja akut esetben leggyakrabban a tesztorganizmus túlélése, ill. valamely ehhez szorosan kötődő élettani jellemző. Ez a jellemző lehet például mortalitás (immobilitás), vagy növekedés-gátlás (pl. növényfajok, fitoplankton esetében) (Robinson és Thorn 2005).
Mivel a toxicitás faj és vegyület specifikus jellemző, a vizsgálatok során célszerű több fajból álló, ún. battery-tesztrendszert alkalmazni. Természetes minták vizsgálata esetében fontos szem előtt tartani, hogy a vizsgált biótára jellemző fajok kerüljenek kiválasztásra a vizsgálatok kivitelezésére, melyek megfelelően reprezentálják az egyes trofikus szinteket (LeBlanc 2004).
A konvencionális módszerek többnyire szabványok által meghatározott módon kerülnek alkalmazásra. A legelterjedtebben az OECD (Organisation for Economic Cooperation and Development), ISO (International Organisation for Standardisation), valamint az ASTM (American Standards for Testing Materials) által kiadott szabványokat alkalmazzák a laboratóriumok (1. táblázat). A standardizált módszerek közös előnye, hogy a megfelelően definiált eljárásoknak köszönhetően a különböző laboratóriumok által kapott eredmények jól összehasonlíthatóak. Hátrányuk, hogy az újabb eljárások és tesztszervezetek szabványosítása időigényes folyamat, így a korszerűbb eljárások csak kisebb-nagyobb időbeli csúszással jelenhetnek meg. Ezen felül a standardizált eljárások sem teljesen zárhatják ki az emberi szubjektivitást.
17 1. táblázat. A OECD, ISO és ASTM szabványok által alkalmazott tesztszervezetek.
Trofikus szint Faj Szabvány
Lebontók Vibrio fischeri ISO 11348-1-2-3:2007
Eleveniszap mikroorganizmusai ISO 15522:1999 OECD Test No. 209 Földigiliszta-félék
Eisenia foetida/andrei OECD Test No. 222
Eisenia fetida OECD Test No. 207
ASTM E1676 - 04
ISO 11268-1:1993-2:1998-3:1999 Televényféreg
Enchytraeus sp. OECD Test No. 220
ASTM E1676 - 04 Elsődleges termelők
Zöld alga fajok
Scenedesmus subspicatus OECD Test No. 201 Chlorella vulgaris
Pseudokirchneriella subcapitata
ISO 8692:2004
ASTM D3978 – 04, E1218 - 04e1 Tengeri alga fajok
Skeletonema costatum ISO 10253:2006 Phaeodactylum
tricornutum
Gonyaulax polyhedra ASTM E1924 - 97(2004) Brakkvízi alga fajok
Ceramium tenuicorne ISO 10710:2010 Békalencse fajok
Lemna minor ISO 20079:2005 OECD Test No. 221 Lemna gibba ASTM E1415 - 91(2004)e1
OECD Test No. 221 Szárazföldi növények OECD Test No. 208, 227
ASTM E1963 - 09 Elsődleges
fogyasztók
Édesvízi kisrák fajok
Daphnia magna ISO 6341:1996, 10706:2000 OECD Test No. 202, 211 ASTM E1193 - 97(2004) Ceriodaphnia dubia ISO 20665:2008
ASTM E1295 - 01(2006) Tengeri kisrák fajok
Acartia tonsa ISO 14669:1999 ASTM E2317 - 04 Tisbe battagliai
Nitocra spinipes Árvaszúnyog-félék
Chironomus tentans OECD Test No. 218 / OECD Test No. 219 Chironomus riparius
Másodlagos fogyasztók
Hal fajok pl. Danio reiro, Pimephales promelas, Oncorhynchus mykiss
ISO 7346-1-2-3:1996, 10229:1994, 15088:2007, 12890:1999, OECD Test No. 203-204, 210, 215, 219, 220, 229-230
ASTM E1711 - 95(2008), E729 - 96(2007), E1022 - 94(2007), E1192 - 97(2008)
18 1.1.2. Alternatív ökotoxikológiai tesztek
Az ökotoxikológiában használatos alternatív módszereket igen nagy sokféleség jellemzi. Ez a sokféleség adódik részben a vizsgálandó környezeti elemek sokféleségéből, részben pedig a potenciális stresszorok, xenobiotikumok diverzitásából.
Környezetszennyezőnek olyan anyagok nevezhetőek, melyek meghatározott koncentráció felett és kémiai formában megterhelést jelentenek az ökoszisztéma biotáira, káros, vagy toxikus hatásuk által.
A xenobiotikumok és a környezeti minták sokfélesége egy sor ún. mikrobioteszt kifejlesztéséhez vezetett, mint a Microtox (a Vibrio fischeri bakteriális biolumineszceciáján alapuló teszt), az Algaltoxkit (mikroalga teszt Raphidocelis subcapatia fajon), a Daphtoxkit, a Thamnotoxkit és a Rotoxkit (Pesoone 1998). A felsorolt módszerek mindegyike a mortalitást használja végpontkén. A tesztek fő előnye, hogy a mortalitás mérése viszonylag precíz, gyors és olcsó, főként mivel nem szükséges törzstenyészetek fenntartása (Rand és Petrocelli 1985).
Ugyanakkor a szubletális végpontú tesztek is fontos szerepet játszanak az ökotoxikológiában. A szubletális végpontot vizsgáló eljárásokat három fő csoportra oszthatjuk: (1) biokémiai és fiziológiai tesztek (pl. enzimatikus és respirációs tesztek), (2) viselkedéstani vizsgálatok (pl. lokomóciós vizsgálatok, és (3) hisztológiai vizsgálatok (pl. testszövetek elváltozásainak vizsgálata) (Rand és Petrocelli 1985;
Mitchell, et al. 2002).
Az ökotoxikológia területén alkalmazott alternatív módszerek az alábbi csoportokba sorolhatóak (Jamie és Ingrid 1999):
In vivo módszerek, ezen belül o Haltesztek
o Rovar tesztek o Zooplankton tesztek o Makrofita tesztek o Mikrobiális tesztek
In vitro módszerek:
o Biokémiai, immunológiai módszerek o Enzimatikus tesztek
19 o Immunológiai (ELISA) módszerek
o Sejtvonalakon végzett tesztek 1.1.2.1. In vivo módszerek
Az in vivo módszerek közös sajátossága, hogy nem alkalmazhatóak önmagukban specifikusan toxikus összetevők behatárolására, hanem összesített, kumulatív toxicitás meghatározására alkalmasak.
1.1.2.1.1. Hal tesztek
Különböző halfajokat elterjedten alkalmaz az ökotoxikológia mint modellorganizmust, nem csak különböző anyagok környezeti kockázatának meghatározására, de a hatásmechanizmusok feltérképezésére is. Mivel a szennyező anyagok koncentrációja gyakran szubletális tartományba esik, számos módszer került kifejlesztésre az egyed alatti szintű kockázat meghatározására. A haltesztek elsősorban a különböző fejlődési stádiumú egyedek viselkedéstani, hisztológiai, molekuláris biomarker és endokrin rendszerbeli változásokra fókuszálnak (Domingues et al. 2010).
A halfajok közül az egyik legelterjedtebben alkalmazott tesztorganizmus a Danio rerio.
A faj alkalmazásának előnye, hogy megfelelő érzékenységgel használható vegyi anyagok széles skálájának kockázatbecslése során. Ezen kívül könnyen kivitelezhetőek a fajon embrionális vizsgálatok, mivel: (1) nagyszámú és kis méretű ikrát produkál, így lehetőség nyílik kis mennyiségű minták vizsgálatára (akár 24 lyukú mikropléten is); (2) az ikrák áttetszőek, így a szervek fejlődése könnyen figyelemmel kísérhető az első 48 órában; (3) szubletális végpontok széles skálája alkalmazható a tesztek során, mint például fejlődéstani, és biomarker változások (Oliveira et al. 2009). További pozitívuma a faj alkalmazásának, hogy megfelelő korreláció figyelhető meg a korai fejlődési stádiumú és a felnőtt egyedek reakciói között. Így például kálium-dikromátra a felnőtt egyedek 112.76 ± 26,66 mg/l, míg a korai stádiumú (megtermékenyített ikrák) 362.42 ± 108,6 mg/l LC50(96h) értékkel reagálnak (Domingues et al. 2010).
További, a D. rerio fajhoz hasonlóan elterjedten alkalmazott fajok a Cyprinus carpio és az Oncorhynchus mykiss. Számos szubletális végpontú teszt kivitelezhető ezen taxonok felnőtt és embrió stádiumú egyedein is (Sanchez és Porcher 2009). A D. rerio fajhoz hasonlóan viselkedéstani, fejlődéstani és biomarker vizsgálatokra is van lehetőség. Az
20 O. mykiss érzékenysége kálium-dikromátra LC50= 28.5 mg/l, míg a C. carpio LC50= 61 mg/l körül adódik (96h) (Svecevicius 2007; Vutukuru et al. 2007).
Számos halfaj reakcióit vizsgálták cianotoxinok kapcsán. A tesztek végpontja a mortalitás mellett kiterjedt az embriófejlődés során bekövetkező anomáliákra, rheotaxis vizsgálatára, enzimatikus változásokra, hisztopatológiai vizsgálatokra, valamint a táplálékszelekció képességére. A legkiterjedtebben vizsgált fajok a Danio rerio, Cyprinus carpio, Oncorhynchus mykiss. Az expozíciós mód leggyakrabban az orális és a hasüregi injektálás.
Cyprinus carpio orális expozíciója esetén a mikrocisztin-LR már 550 μg/kg dózis mellett halálosnak bizonyult, melyet a máj károsodása okozott (Rabergh et al. 1991).
Mivel azonban ezek a vizsgálatok sem az expozíciós út, sem pedig ökológiai szempontból nem nevezhetőek relevánsak, ezt követően a kísérletek elsősorban vízben oldott komponensekre irányultak. Korai fejlődési stádiumú Cyprinus carpio egyedeken a neurotoxikus anatoxin-a már 160 μg/l-es koncentráció és 9 órás expozíciós idő mellett is jelentős mortalitást okozott. Ugyanilyen koncentráció mellett 5 napos expozíció hatására 75 %-os kelési arány csökkenést okozott. Ugyanakkor az is bebizonyosodott, hogy hasonló toxintartalmú nyers algakivonat szignifikánsan nagyobb hatást fejt ki, mint tisztított toxin önmagában (Osswald et al. 2009).
Danio rerio rheotaxis-vizsgálata során már 0,5 és 5 μg/l-es mikrocisztin koncentráció szignifikáns viselkedésbeli változást okozott. Ugyanakkor az 5 μg/l koncentráció felett jelentősen csökkent a szaporodás-aktivitás is (Baganz et al. 1998). Ugyanezen faj embrionális fejlődése kapcsán feljegyezték, hogy hasonló mikrocisztin-LR koncentráció (5-50 μg/l) a kezelés során nem okozott megfigyelhető elváltozást. Azonban a kezelt embriókat toxinmentes környezetbe áthelyezve jelentősen csökkent az embrió fejlődés üteme és a túlélési arány (Oberemm et al. 1997). Cilindrospermopszin nem okozott jelentős mortalitást D. rerio embrionális vizsgálata kapcsán. Azonban az embriókba injektálva az LD50érték 4.50 fmol CYN/embrióra adódott (Berry et al. 2009).
1.1.2.1.2. Rovar tesztek
Az ökotoxikológia számos rovarfajt és ezek különböző stádiumú lárváit alkalmazza a toxikus anyagok kockázatbecslése során. Ezek között számos szúnyogfaj és lárvái megtalálhatóak. Mind a felnőtt, mind pedig a lárvák egyedein gyakran végeznek
21 biomarker, fejlődési, lokomóciós és mortalitás vizsgálatokat. A leggyakrabban alkalmazott fajcsoport, a Chironomus sp. érzékenysége kálium-dikromátra 11,8 és 112,9 mg/l LC50 (48h) közé esik (Khangarot és Ray 1989; Meister 1995; Choi és Roche 2004;
Choi et al. 2001).
További elterjedten vizsgált a faj a sivatagi sáska (Schistocerca gregaria) (McElhiney és Lawton 2005) és a gyümölcslégy (Drosophila melanogaster) (Kaya et al. 2002). A fajok egyedein elsősorban mortalitási, genetikai és biomarker vizsgálatokat végeztek.
Az alternatív tesztek ezen csoportja a legkevésbé releváns, ha cianobakteriális toxicitás jelentette kockázat felmérését tekintjük. Ez részben nehézkes kezelésüknek, részben csekély ökológiai relevanciájuknak köszönhető, főként, ha azt vesszük figyelembe, hogy elsősorban nem vízi rovarokat vizsgáltak. A különböző rovarfajokon jellemezően akut toxicitási vizsgálatokat végeztek.
A vízi rovarok közül különböző szúnyogfajokat és ezek lárváit tanulmányozták (Turell és Middlebrook 1988). A lárvák vizsgálata elsősorban nem a cianobakteriális toxicitás meghatározására, hanem a cianotoxinok, szúnyogirtó szerként történő alkalmazhatóságának lehetőségére terjedt ki. A kifejlett egyedeket injekciózták, a lárvákat pedig oldatba helyezték a kísérletek során. Microcystin-RR esetében a sárgaláz vektor faja az Aedes aegypti érzékenysége LC50 =14,9 mg/l-re adódott (Kiviranta et al.
1992). A Westiellopsis sp. cianobactérium LC50 értéke Aedes aegypti 55.84mg/l, Anopheles stephensi 38.45 mg/l, Culex quinquefasciatusra 14,25 mg/l, Culex tritaeniorhynchusra 6.3 mg/l (Rao et al. 1999). Microcystis aeruginosa fajjal szemben a C. quinquefasciatusra és A. stephensi lárvák LC50 értéke 8 és 15 mg/l között adódott (Dhananjaya et al. 2003). Egy neuro- és hepatotoxinokat nem termelő Oscillatoria agardhii faj az A.aegypti különböző fejletségi szintű lárváira 8,7 és 6,1 mg élő sejt/l közötti LC50 értéket mutatott (Kiviranta és Abdel-Hameed 2004). A módszer megfelelő érzékenységet mutatott, de az organizmusok kezelésének bonyolultsága okán mégsem terjedt el alkalmazásuk.
Egy további rovarfaj, melyen kísérleteket végeztek a gyümölcslégy (Drosophila melanogaster) volt. Ezeket az állatokat könnyű kezelni, nem igényelnek különleges felszerelést. A toxinokat orális úton juttatták be a tesztszervezetekbe, szűrőlapocskákra cseppentett, répacukorban oldott formában, és a 24 óra alatt elpusztult egyedeket
22 számlálták. Sajnos a módszer nem mutatott kellő érzékenységet a neurotoxikus Aphanizomenon fajokkal szemben (Swoboda et al. 1994).
Tanulmányozták a sivatagi sáska (Schistocerca gregaria) fajt is, mint potenciális alternatívát. A módszer megfelelő érzékenységet mutatott bizonyos cianobakteriális toxinokra és törzsekre (Aphanizomenon flos-aquae LD50= 60 mg/kg; Anabaena aphanizomenoides LD50= 170,2 mg/kg; Cylindrospermopsis raciborskii LD50=131.4 mg/kg; LD50=15 mg/kg Microcystis aeruginosa 60 mg/kg Aphanizomenon flos-aquae;
170,2 mg/kg Anabaena aphanizomenoides; 131,4 mg/kg Cylindrospermopsis raciborskii; (15 mg/kg) Microcystis aeruginosa, microcystin-LR LD50 = 130 mg/kg. ) (Hiripi et al. 1998; J. McElhiney et al. 1998). Egy további vizsgálat alapján azonban, a módszer nem mutatott megfelelő érzékenységet szaxitoxinokra (LD50 = 554-914 μg/100 g) Ez az eljárás sem terjedt el szélesebb körben.
1.1.2.1.3. Zooplankton tesztek
A szakirodalom tekintélyes részét képezi a fajcsoporttal kapcsolatos vizsgálatok.
Számos taxonon végeztek a témakörben vizsgálatokat, melyek közt megtalálhatóak édes- és sósvízi fajok egyaránt, előbbiek közül több hazánkban is őshonos. Ezek a fajok fontos tagjai a vízi ökoszisztémáknak, hiszen a zooplankton elsődleges fogyasztóként számos magasabb rendű fajnak szolgál táplálékául.
A tesztek során a stresszor által kiváltott és vizsgált válasz, a mobilitás-gátlási (gyakorlatilag mortalitási) arány, a táplálkozás aktivitás gátlása, mozgási és légzési aktivitás csökkenése. Számos standardizált változata létezik az ilyen típusú vizsgálatoknak, illetve több faj hozzáférhető a kereskedelemben úgynevezett tox-kitek formájában, melyek tartalmazzák a vizsgálatok elvégzéséhez szükséges tesztszervezeteket tartóspete formájában, a keltetéshez szükséges oldatokat, valamint a szükséges eszközök többségét. Ezen körülményeknek, illetve a tesztszervezetek könnyű kezelhetőségének köszönhetően a toxikológiában, ökotoxikológiában igen elterjedt módszerekről van szó (Pesoone 1998).
Az egyik legelterjedtebb ezen kisrákok közül talán a sórák, vagy sóféreg (Artemia salina), mivel könnyen hozzáférhetőek, egyszerűen tarthatóak, és a tesztek kivitelezéséhez nem szükségesek különleges eszközök. A sórákot hosszú ideje használják környezetszennyező anyagok hatásának vizsgálatára, standardizált ún. teszt-
23 kitek formájában is forgalmazzák. A tesztek során 24 órás expozíciós idejű mortalitási arányt vizsgálhatunk (Nunes et al. 2006). Az Artemia salina kálium-dikromátra adott válasza (EC50; 24h) 91 és 126 mg/l között adódik (MacLean és Doe 1989).
Jó érzékenységet mutat a módszer különböző cianotoxinokkal szemben: mikrocisztinek:
LD50 = 5–10 mg/l (McElhiney és Lawton 2005; Metcalf et al. 2002), cilindrospermopszin: LC50= 2,86 mg/l (Metcalf, et al. 2002), anatxin-a: 2-14 mg/l (Laht, et al. 1995), ugyanakkor az is bebizonyosodott, hogy a módszer jól korrelál az egér toxikológiai vizsgálatok eredményeivel (Kiviranta et al. 1991; Metcalf, et al. 2002).
Hasonlóan elterjedten használják a Daphnia fajokat alkalmazó módszereket. Ezen fajok közül sok nálunk is őshonos, így nagy relevanciával bír a hazai ökotoxikológiában. A Daphnia fajok különösen alkalmasak mikrocisztinek vizsgálatára, a sórákhoz hasonló mortalitás teszteken keresztül. (Baird et al. 1989) A Daphnia fajokon alapuló kitek szintén elérhetőek a kereskedelemben. A Daphnia magna érzékenysége kálium- dikromátra 0.6–2.1 mg/l közé esik (Persoone et al. 2009).
A Daphnia fajok érzékenysége a cianobakteriális toxinokkal szemben hasonló az Artemia salina fajhoz. Három Daphnia faj (D. pulicaria, D. hyalma, D. pulex) vizsgálata alapján a Mikrocisztin-LR 48 órás EC50 értéke 9,6 és 21,4 mg/l közé, míg 24 órás vizsgálat esetén 10,7 és 50 mg/l közé esik. Ezek közül a D. pulex bizonyult a legérzékenyebbnek. (DeMott et al. 1991). D. magna esetében az LC50 értékek 0,6- 1,26 mg/l (24h) értékek közé esnek (Lindsay et al. 2006; Kim et al. 2003). Ugyanakkor mikrocisztin tartalmú cianobaktériumok nyers kivonataira D. pulicaria és D. similis fajok 36 – 162,45, illetve 34,2 – 1380 mg/l LC50 értéket mutattak (Jungmann és Benndorf 1994; Sotero-Santos et al. 2006; Okumura et al. 2007). Egy kísérletsorozatban D. pulex 10 klónján M. aeruginosa cianobaktérium nyers kivonatának vizsgálata 0,022 és 2,61 mg/l közötti LC50 (48h) értékek adódtak (Hietala, et al. 1997). Ezek az adatok azt mutatják, hogy nemcsak különböző Daphnia fajok között, de akár a klónok között is jelentős eltérések adódhatnak a cianotoxinokra (Dao et al. 2010).
Számos szubletális hatásról számol be a szakirodalom cianotoxinok hatásával kapcsolatban. Így például számos Microcystis faj (Nizan et al. 1986; Henning et al.
1991; Lotocka 2001; Rohrlack et al. 2001) kapcsán a táplálkozás aktivitás csökkenéséről, illetve ezen túlmenően, Cylindrospermopsis raciborskii és
24 Aphanizomenon ovalisporum fajok kapcsán az emésztőrendszer károsodásáról és ezen keresztül közvetlen toxikus hatásról számolnak be a szerzők (Nogueira et al. 2006).
Proteáz inhibitor szekunder metabolitok kapcsán (pl. microviridin J) a vedlési folyamat zavarát jegyezték fel. Bár az új kültakaró kialakult, az állatok képtelenek voltak a régitől megszabadulni, e közben a még lágy héj oly mértékben deformálódott, hogy végül az állatok pusztulását okozta (Rohrlack et al. 2004) .
Egy további, az Amerikai kontinensen őshonos kisrák, mely a kereskedelemben, teszt kitként forgalomban van, a Thamnocephalus platyurus. Ez a taxon is kellően érzékenynek mutatkozott egy sor toxinnal szemben (Törökné et al. 2000). A standard mortalitás teszten felül, lehetőség van úgynevezett táplálkozási aktivitás teszt kivitelezésére is, mely szintén standardizált és validált eljárás. Ennek előnye, hogy gyorsabb a mortalitási teszteknél, illetve szubletális végpontot vizsgál (Törökné et al.
2007). A T. platyurus érzékenysége kálium–dikromáttal szemben (LC50; 24h) 0,11 és 0,18 mg/l közé esik (Fochtman et al. 2000).
A legnagyobb számú irodalmi hivatkozás a mikrocisztin típusú toxinok és az ezeket termelő algafajok hatásának vizsgálatával kapcsolatos. Tisztított mikrocisztinekre 3,6- 8,6 mg/l (24h) (Blom et al. 2001), valamint 0.1-2.27 mg/l (1h táplálkozás aktivitás teszt) LC50 értékek adódnak (Törökné 1999). Hasonlóan érzékeny a tesztszervezet mikrocisztin tartalmú cianobaktériumok nyers kivonataira is, a toxintartalommal azonban az eredmények nem mindig korrelálnak (Törökné et al. 2007; Keil et al. 2002).
1.1.2.1.4. Makrofita tesztek
Makrofita növényeken végzett vizsgálatok során általában a növekedési aktivitás gátlás alapján lehet következtetni a vizsgált minta toxikus hatására. Az ilyen típusú vizsgálatoknál azonban sokkal nagyobb jelentőséggel bírnak és jóval elterjedtebbek az in vivo jellegű enzim vizsgálatok.
A vizsgálatok során talán legelterjedtebben használt faj a kis békalencse (Lemna minor).
Ez a faj könnyen hozzáférhető, könnyen tartható laboratóriumi körülmények között és könnyen hozható létre belőle törzstenyészet. A módszer hátránya ellenben, hogy a standard kísérleti eljárás meglehetősen hosszadalmas, egy hétig tart (OECD 2002).
További, a békalencséhez hasonló, gyakran vizsgált faj, a vízi dara (Wolffia arrhiza), mely hasonlóan használható, mint a már említett békalencse. Mindkét faj megfelelő
25 érzékenységet mutat toxinokkal szemben (Mitrovich et al. 2005; Mitrovic et al. 2004).
A L. minor IC50=10 és 30 mg/l értékek között adódik kálium-dikromátra (7 nap) (Merlin et al. 1993).
Lemna minor és Wolffia arrhiza mirocisztin-LR 10 és 20 mg/ml hatására 5 nap expozíciós idő jelentős növekedés-gátlást és tömegcsökkenést eredményez. Ezen felül L. minor esetében megfigyelték a peroxidáz enzim aktivitásának szignifikáns növekedését is (Mitrovich et al. 2005). Ezzel párhuzamosan Microcystis aeruginosa allelopátiás válaszokat váltott ki Lemna japonica fajon (Jang et al. 2007), ugyanakkor hasonló elváltozásokat Lemna gibba nem produkált (LeBlanc et al. 2005).
További, elterjedten vizsgált faj a közönséges nád (Phragmites australis). A vizsgálatok során a növények biomassza produkcióját, illetve növekedési ütemét határozzák meg.
Gyakran vizsgált paraméter a gyökér növekedésének üteme is. 0,5 mg/l mikrocisztin- LR koncentráció felett 50 %-nál magasabb növekedés-gátlást figyeltek meg 5-20 napos expozíciós idő mellett. Ugyanakkor szignifikáns hatást váltott ki két napos expozíciós idő mellett már 1 mg/ml mikrocisztin-LR koncentráció is (Máthé, et al. 2009).
Hasonló módon alkalmazott, faj a fehér mustár (Synapis alba). E faj vizsgálata során is a növények, vagy a magok (csíranövények) növekedési ütemét vizsgálják. A különböző mikrocisztin variánsok e növényre kifejtett inhibíciós hatása (IC50) 1,6-7,7 mg/l közé esik (McElhiney et al. 2001).
1.1.2.1.5. Mikrobiális tesztek
A legtöbb figyelmet kapott eljárás, a Microtox, amelynek tesztszervezete a mélytengeri biolumineszkáló baktérium, a Vibrio fischeri. A toxicitás mértéke a Microtox esetén az által válik mérhetővé, hogy a baktériumok által kibocsátott fény mennyisége csökken a mérgező vegyületek hatására. A fényintenzitás csökkenéséért a luciferáz enzim működésének gátlása a felelős. (Bulich 1979).
Az előzetes vizsgálatok azt mutatták, hogy ez a rendszer alkalmas lehet a mikrocisztinek gyors detektálására algamintákban. Ám a részletes vizsgálatok eredménye az volt, hogy az eljárás olyan mikrocisztintől eltérő anyagokra is érzékeny, melyeket tartalmaznak az algakivonatok, és eddig még nem sikerült azonosítani (Campbell et al. 1994). Mára számos olyan publikáció napvilágot látott, melyek egyértelműen azt mutatják, hogy nincs korreláció a Microtox eljárás által adott
26 eredmény és a sejtek cianotoxin tartalma között (Vezie et al. 1996). Mikrocisztinekre a módszer EC50 értéke 0,02 és 0,46 mg/l közé esik (Lawton et al. 1990; Aboal et al. 2002;
Volterra et al. 2006). Nodularinra a módszer kevésbé érzékeny, érzékelési határa 250 mg/l (Dahlmann et al. 2001).
A másik eljárás, melyet vizsgáltak, a Serratia marcescens pigment-termelésének (prodigiozin) gátlásán alapul. Ez az eljárás alkalmasnak mutatkozott szaxitoxinok és mikrocisztinek detektálására, de hasonlóan a Microtox teszthez, ez az eljárás is túl gyengén korrelált az aktuális minta cianotoxin tartalmával (Dierstein et al. 1989;
Lawton et al. 1994).
1.1.2.1.6. In vivo enzimatikus módszerek
Az in vivo enzimatikus vizsgálatok jó felvilágosítást adnak az élő szervezetben toxikus hatásra lejátszódó hatásokról. Az eljárásokkal általában azt vizsgáljuk, hogy az élőlény (lehet állati, vagy növényi szervezet) mely enzimjei gátoltak/aktiválódnak működésükben bizonyos mérgező anyag hatására. A gátolt enzim fajtája felvilágosítást ad egyrészt, hogy milyen hatásmechanizmus szerint hat az adott toxin, másrészt, a kérdést megfordítva, pontosítani lehet, hogy milyen típusú, minőségű anyagok okozzák a toxikus hatást.
A tejsavdehidrogenáz (LDH) aktivitásban bekövetkezett változás vizsgálatát széles körben alkalmazza mind a toxikológia, mind pedig a klinikai kémia sejt, szövet és szervkárosodások diagnosztizálására. Az LDH fontos glikogén enzim, mely szinte az összes szövetben előfordul, ezért elterjedten alkalmazott eljárássá vált az ökotoxikológia területén is. (Diamantino et al. 2001).
Az LDH-szint változása, elsősorban a sejtek, szövetek épségének jelzője. Megbízható, gyors és egyszerűen kivitelezhető (Decker és Lohmann-Matthes 1989). Széles körben használják, sokféle sejtvonalon pl.: HepG2 sejteknél (Dong et al. 1989), PC 12 sejtek (Satpute et al. 2008), RBE-4 endothel sejteknél (Price et al. 2006), de primer patkány kortikális neuronokon történő mérésre is van példa (Akasofu et al. 2006). Szövetek, magasabb rendű élőlények esetében egésztest/szövet homogenizátum, illetve vér alkalmas a vizsgálat céljára.
Számos esetben alkalmazták cianotoxinok hatásának becslésére, többnyire más enzimek együttes vizsgálatával mind sejtvonalakon (Pichardo et al. 2005; Dias et al.
27 2009; Botha et al. 2004), halakon (Rabergh et al. 1991), rágcsálókon (Ding et al. 1989;
Gehringer et al. 2004), makrogerinctelen fajokra (Dewes et al. 2006) és zooplanktonra (Chen et al. 2005).
A glutation S-transzferáz (GST) a detoxifikációs folyamatok indukciójának markere, mely fontos szerepet játszik a szervezetbe került xenobiotikumok metabolikus folyamataiban. A GST a glutation –SH csoportjának konjugációját katalizálja számos toxikus elektrofil komponensre, ezáltal semlegesítve és vízoldékonyabbá téve azt (Habig és et al. 1974).
A GST aktivitást elsősorban a hepatotoxikus összetevőkkel (mikrocisztinek és nodularinok) kapcsolatban vizsgálták, hiszen metabolízisük ezen az enzimrendszeren keresztül megy végbe mind emlősökben (Kondo et al. 1992), vízi gerincesekben (Pflugmacher et al. 1998, Wiegand et al. 1999) és vízi gerinctelenekben (Vinagre et al.
2002; Beattie et al. 2003; Chen és Xie 2005; Pflugmacher et al. 2005). Ezen felül bebizonyosodott, hogy anatoxin-a hatására növényekben megnő a peroxidáz- és GST- aktivitás (Mitrovic et al. 2004).
Az acetilkolinészteráz (AChE) az állatok szervezetének idegi működése során keletkező egyik neurotranszmitter anyag, az acetilkolin lebontását végzi. Optimális körülmények között az enzim az acetilkolint acetátra és kolinra bontja, gátlása esetén az acetilkolin felhalmozódik és blokkolja a neurotranszmissziót (Purves et al. 2004).
A módszer elsősorban anatoxinok és anatoxin-a(S) detektálására alkalmas. Az anatoxinok az acetilkolin hatását másoló vegyületek, melyek rendkívül erős kolinerg antagonista vegyületek, melyek erősebb kötődésre képesek a nikotin- és muszkarin receptorokhoz és lassabban távoznak, mint az acetilkolin. Az anatoxin-a(S) pedig az acetilkolinészteráz aktivitást blokkolja (Osswald et al. 2007; Smith et al. 2008).
A protein foszfatáz (PP2A) szerepét a fehérjék defoszforilálásában tölti be. Számos életfolyamatban, többek között a sejtciklusban, a növekedésben, a hő sokk folyamatokban, a jelátvitelben, a sejttranszformációban, ill. a DNS replikációban is részt vesz. Inhibíciója esetén ezek a folyamatok is károsodhatnak. Ez az enzim mikrocisztinek és nodularinok kimutatására szelektíven használható, alkalmazása azonban inkább ELISA módszerek esetében jelentős (Ikehara et al. 2008).
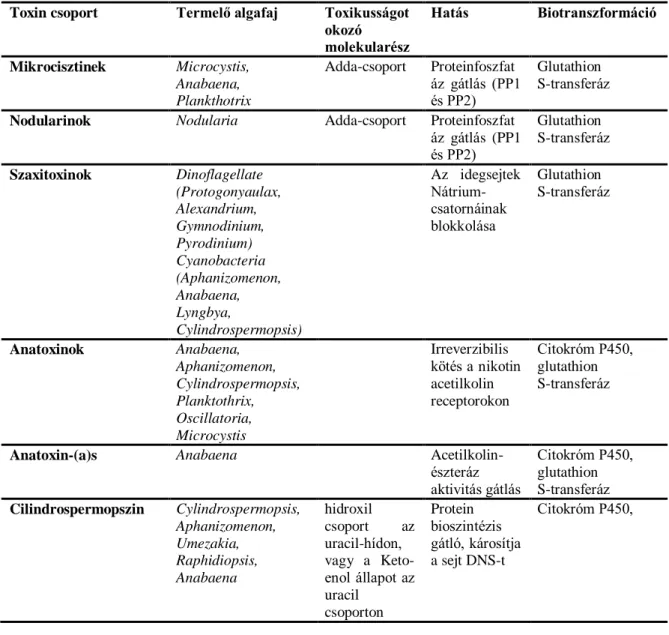
28 A különböző típusú cianobakteriális toxinok természetesen különböző enzimekre vannak hatással. Erről ad felvilágosítást a 2. táblázat. Látható, hogy a kékalgák által termelt toxinok vizsgálatára tejsavdehidrogenáz (LDH), Glutathion S-transferáz (GST), acetilkolinészteráz (AChE), valamint protein foszfatáz (PP2A) vizsgálatán alapuló módszerek alkalmasak (Wiegand és Pflugmacher 2005).
2. táblázat. A cianotoxinok enzimatikus hatásai. (Wiegand és Pflugmacher 2005)
1.1.2.2. In vitro módszerek
1.1.2.2.1. In vitro enzimatikus módszerek
Az előző fejezetben bemutatott in vivo enzimatikus módszerek alkalmazhatóak in vitro formában is. Ez elsősorban állati eredetű, szintetizált, vagy tejsavdehidrogenáz esetében sejtvonalas kísérletek során felszabaduló enzimek által lehetséges. Találunk számos példát LDH (Aune és Berg 1986), GST (Okada és Hase 2005; Best et al. 2002), AChE
Toxin csoport Termelő algafaj Toxikusságot okozó molekularész
Hatás Biotranszformáció
Mikrocisztinek Microcystis, Anabaena, Plankthotrix
Adda-csoport Proteinfoszfat áz gátlás (PP1 és PP2)
Glutathion S-transferáz
Nodularinok Nodularia Adda-csoport Proteinfoszfat áz gátlás (PP1 és PP2)
Glutathion S-transferáz
Szaxitoxinok Dinoflagellate (Protogonyaulax, Alexandrium, Gymnodinium, Pyrodinium) Cyanobacteria (Aphanizomenon, Anabaena, Lyngbya,
Cylindrospermopsis)
Az idegsejtek Nátrium- csatornáinak blokkolása
Glutathion S-transferáz
Anatoxinok Anabaena, Aphanizomenon, Cylindrospermopsis, Planktothrix, Oscillatoria, Microcystis
Irreverzibilis kötés a nikotin acetilkolin receptorokon
Citokróm P450, glutathion S-transferáz
Anatoxin-(a)s Anabaena Acetilkolin-
észteráz aktivitás gátlás
Citokróm P450, glutathion S-transferáz Cilindrospermopszin Cylindrospermopsis,
Aphanizomenon, Umezakia, Raphidiopsis, Anabaena
hidroxil csoport az uracil-hídon, vagy a Keto- enol állapot az uracil
csoporton
Protein bioszintézis gátló, károsítja a sejt DNS-t
Citokróm P450,
29 (Yunes et al. 2003; Monserrat et al. 2001) és PP2A (Sim és Mudge 1993) alkalmazására is.
1.1.2.2.2. Immunológiai (ELISA) módszerek
Az ELISA (Enzyme-Linked ImmunoSorbent Assay) esetében biológiai-biokémiai folyamatokat/reakciókat alapul vevő eljárásról van szó. Az ELISA jól kiegészíti mind az analitikai, mind pedig a toxikológiai vizsgálatokat, sőt néhány esetben e kettőt ötvözik. Ide sorolhatóak a különféle enzimaktivitás-gátlás vizsgálatán alapuló kromatográfiás eljárások, illetve az enzimkapcsolt immunoszorbens (ELISA) módszerek (Wild 2005).
Mivel az antigén - antitest reakció nagyon specifikus, elsősorban egészségkárosító mikrobák vagy toxinjaik azonosítására használják az orvostudományban; és innen került az ökotoxikológia/toxikológiai eszköztárába. Leggyakrabban alkalmazott változata az ún. szendvics ELISA, amelynél a keresett toxinra egy specifikus antitestet alkalmaznak egy hordozóközegen rögzített formában, legtöbbször a hordozó maga a vizsgálat kivitelezésére szolgáló mikroplét. Amennyiben a minta tartalmazta a kérdéses antigént, az megkötődik az antitest felületén. Enzimmel konjugált antitesteket tartalmazó reagenst a rendszerhez adva, újabb specifikus kötés jön létre az előzőekben kialakult antitest-antigén komplexeken. Majd az enzim kromogén szubsztrátját adjuk a rendszerhez, amely színreakciót eredményez és ez által detektálhatóvá válik a keresett vegyület (Wild 2005).
Az antitestek elkülönítését szolgáló technológia fejlődése révén ez az eljárás vált a mikrocisztinek detektálásának legfőbb eszközévé az utóbbi évtized során. Az ELISA legnagyobb előnye, hogy képes a mikrocisztinek szelektív detektálására a WHO irányelveknek megfelelő (<1 µg/l) tartományban. Mindezek mellett minimális mintaigényük van és kivitelezésük is egyszerű (McElhiney és Lawton 2005).
1.1.2.2.3. Sejtvonalakon végzett kísérletek
A cianotoxinok kimutatására, az emlős sejtvonalakon végzett kísérletek elsőként 1986- ban keltették fel a tudományos világ érdeklődését, amikor egy kísérlet során, mikrocisztinnel kezelt patkányokból frissen izolált májsejteken a laktát-dehidrogenáz (LDH) enzim csökkenése bizonyítottan jó korrelációt mutatott az in vivo egérkísérletek során kapott értékekkel (Aune és Berg 1986). Tíz évvel ez után újra a figyelem
30 középpontjába került a módszer. Ekkor már patkányból izolált májsejteket inkubáltak tiszta toxinnal, vagy algakivonatokkal 4 illetve 20 órán keresztül, és a sejtek életképességét az MTT ((3,4,5-dimetilthiazol-2il)-2,5-difeniltetrazolium bromid) teszt segítségével vizsgálták. A kísérlet eredményei megfelelő korrelációt mutattak az in vivo tesztek eredményeivel (Heinze 1996).
A májsejtek mellett, fibroblaszt-sejtekkel is végeztek kísérleteket cianobakteriális toxinok hatásának, főként mikrocisztin vizsgálatára (Lawton et al. 1994). A teszt jól korrelált az egérkísérletek eredményeivel, bár számos fals negatív és pozitív eredmény is született.
Az idegsejteket alkalmazó eljárásoknak két fő típusa terjedt el. Ezek egyike eredményesen detektálja a szaxitoxinokat; ez a módszer a neuroreceptorok felületén kompetitív kiszorítást vizsgálja radioaktívan megjelölt szaxitoxinnal (Davido és Fontelo 1984). A másik módszer neuroblasztóma sejtvonalak alkalmazásával vizsgálja a nátrium-csatornák blokkolását (Cembella et al. 1995). Mindkét módszer jelen pillanatban is gyors fejlődés alatt áll és már kereskedelmi forgalomban is kapható, ám már a korai vizsgálatok eredményei is jó korrelációt mutattak az egérkísérletek eredményeivel.
A közelmúltban ez a terület is óriási fejlődésen esett át és mára számos emlős (Price et al. 2006), hal (Pichardo et al. 2005), növény sejtvonal került alkalmazásra. Az enzimatikus vizsgálatok fejlődésével pedig ezek a vizsgálatok még inkább relevánssá váltak.
1.2. A cianobaktériális toxicitás környezeti kockázata
A cianobaktériumok azon pionír élőlények közé tartoznak, melyek elsőként népesítették be a Földet (Brock 1973). Ezek a fotószintetizáló mikrobák lehettek az ősi Föld szerves anyagának elsődleges termelői, és az első olyan organizmusok, amelyek elemi oxigént bocsátottak a légkörbe. A DNS-elemzések bebizonyították, hogy a legelső élőlények kiemelkedő hő tűrő tulajdonsággal bírtak és képesek voltak életben maradni extrém körülmények között; a vulkánok által fűtött óceánokban és a magas hőmérsékletű forrásokban egyaránt (Holland 1997).
31 A cianobaktérium és a kék-zöldalga (Cyanophyceae) kifejezések egyaránt használatosak és egymással helyettesíthető rendszertani kifejezések, szinonimák. A mikroorganizmusok ezen csoportja egy és többsejtű prokariótákat foglal magában, melyek klorofill-a-t tartalmaznak, fotoszintetizálnak I és II típusú fotokémiai rendszeren keresztül (Castenholz és Waterbury 1989).
Alkalmazkodó képességük, lehetővé teszi olyan élőhelyek benépesítésére, ahol más organizmusok életképtelenek. Számos talajlakó faj ismert, ahol a szervetlen tápanyagok forgalmában fontos szerepet töltenek be (Whitton 1992).
Mindezek ellenére, a cianobaktériumok többsége sós- (tengeri) és édesvízi élőlény.
Időlegesen uralkodóvá is válhatnak mind a felszín közeli (epilimnikus), mind pedig a mélyebb (hipolimnikus) vízrétegekben (Whitton 1973).
1.2.1. A cianobaktériumok felépítése, működése, viselkedése
Morfológiai szempontból egysejtű (pl. Chroococcales) (Chorus és Bartram 1999), csoportos (pl. Pleurocapsales) és többsejtű fonalas szerkezeteket (Oscillatoriales) különböztethetünk meg. A filamentumokat létrehozó rend tagjai esetében (Nostocales és Stigonematales) gyakran figyelhetőek meg heterogén sejtek. A vegetatív sejtek heterosejtekké differenciálódhatnak (vastag sejtfalú és áttetsző protoplasztiszú, valamint nitrogénfixációra képes sejtek), vagy akinéták (nagy, vastag sejtfalú sejtek, melyek tartalék tápanyagokat raktároznak) kialakítására is képesek. A Stigonematales rend tagjainál gyakran figyelhetünk meg többsoros filamentumokat, melyekből valódi ágak nyúlnak ki, valamint mindkét fent említett heterosejt-típus megtalálható.
A cianobaktériumok kizárólag ivartalan szaporodásra képesek. A szálas formák elsősorban a szálak töredezésével, vagy különleges, ún. hormogóniumok létrehozása révén képesek reprodukcióra. A hormogóniumok a trichómáktól elvált, önálló mozgásra is képes sejtek, melyekből fokozatosan újabb trichómák jönnek létre.
A cianobaktériumok fototrófok, melyek kétfajta reakciócentrummal rendelkeznek (PS I.
és PS II), hasonlóan a fejlett növényekhez. Járulékos pigmentek segítségével (allofikocianint (kék), fikocianint (kék) és néha fikoeritrint (vörös)) képesek hathatósan kihasználni a fény 500-650 nm tartományba eső spektrumát, melyet más algafajok aligha tudnak hasznosítani. A cianobaktériumok képesek azt a típusú járulékos