A szívizom regionális bioelektromos tevékenységeinek vizsgálata testfelszíni potenciáltérképezéssel
Doktori (PhD) értekezés
Szakolczai Krisztina
Készült a Pannon Egyetem Informatikai Tudományok Doktori Iskolája keretében
Témavezető: Dr. Kozmann György
Budapest, 2010
A szívizom regionális bioelektromos tevékenységeinek vizsgálata testfelszíni potenciáltérképezéssel
Értekezés doktori (PhD) fokozat elnyerése érdekében Írta:
Szakolczai Krisztina
**Készült a Pannon Egyetem Informatikai Tudományok Doktori Iskolája keretében Témavezető: Dr. Kozmann György
Elfogadásra javaslom (igen / nem)
……….
(aláírás)**
A jelölt a doktori szigorlaton …... % -ot ért el
Az értekezést bírálóként elfogadásra javaslom:
Bíráló neve: …... …... igen /nem
……….
(aláírás) Bíráló neve: …... …...) igen /nem
……….
(aláírás)
***Bíráló neve: …... …...) igen /nem
……….
(aláírás) A jelölt az értekezés nyilvános vitáján…...% - ot ért el
Veszprém/Keszthely,
……….
a Bíráló Bizottság elnöke A doktori (PhD) oklevél minősítése…...
………
Az EDT elnöke Megjegyzés: a * közötti részt az egyéni felkészülők, a ** közötti részt a szervezett képzésben résztvevők használják, *** esetleges
KÖSZÖNETNYILVÁNÍTÁS
Köszönetemet fejezem ki elsősorban témavezetőmnek Dr. Kozmann Györgynek, aki az elmúlt évek során alapvető szakmai iránymutatást adott, tanácsokkal és megfelelő kapcsolatokkal látott el.
Munkámban folyamatos segítséget jelentettek kollégáim a Pannon Egyetem Villamosmérnöki és Információs Rendszerek Tanszékén, valamint az MTA Műszaki Fizikai és Anyagtudományi Kutatóintézet Biomérnöki Osztályán.
Kutatásaim során jelentős támogatást nyújtottak Dr. Préda István igazgató főorvos (Országos Gyógyintézeti Központ, Kardiovaszkuláris Centrum), Dr. Medvegy Mihály osztályvezető főorvos (Pest Megyei Flór Ferenc Kórház, Kistarcsa, III. Belgyógyászat - Kardiológia Osztály), Dr. Szász Károly osztályvezető főorvos (Deszki Mellkasi Betegségek Szakkórháza), dr. Szűcs Endre (Központi Honvéd Kórház, II. Kardiológia-Belgyógyászat Osztály), valamint az Országos Gyógyintézeti Központ és a Belügyminisztérium Központi Kórház orvosai, azzal, hogy mérési lehetőségeket, nyers mérési adatokat és szakmai tanácsokat adtak, az adatokat validálták.
A modellezési vizsgálatokhoz a Szlovák Tudományos Akadémia két intézetének munkatársai – elsősorban Dr. Vavrinec Szathmáry (Institute for Normal and Pathological Physiology, Bratislava) és Dr. Milan Tysler (Institute for Measurement Science) - adtak felbecsülhetetlen szakmai segítséget és folyamatos támogatást.
Köszönöm a Covent Rt.-nek hogy támogatásával lehetővé tette 1997 és 2000 között a nappali tagozatos PhD képzésben való részvételemet. A munkavégzést – az alap és alkalmazott kutatási tevékenység kiváló körülmények közötti végzését az MTA MFA igazgatói Dr. Gyulai József akadémikus, majd Dr. Bársony István tették lehetővé. Financiális oldalról az OTKA T033085, T030747, F035268 az IKTA 128/2001 és az NKFP 2/052/2001, NKFP 2/004/2004 sz. projektek nyújtottak támogatást.
Szeretném kifejezni hálámat szüleimnek, testvéremnek és volt élettársamnak, hogy bátorítottak az elmúlt évek folyamán és hitték, hogy ez egyszer elkészül.
TARTALOMJEGYZÉK
KÖSZÖNETNYILVÁNÍTÁS... 3
TARTALOMJEGYZÉK ... 4
KIVONAT... 6
ABSTRACT IN ENGLISH... 7
EXTRAKT IN DEUTSCHE... 8
1. BEVEZETÉS ... 9
2. A SZÍV BIOELEKTROMOS TULAJDONSÁGÁNAK JELLEMZÉSE TESTFELSZÍNI POTENCIÁL-TÉRKÉPEZÉSSEL... 12
2.1 AZ ELEKTROKARDIOLÓGIA ALAPJAI... 12
2.1.1 A szív, mint szerv ... 12
2.1.2 A szív elektromos tevékenységének mérése... 15
2.2 A TESTFELSZÍNI POTENCIÁL-TÉRKÉPEZÉS... 19
2.2.1 Mérőrendszerek ... 21
2.2.2 A testfelszíni potenciáltérképek validitása... 25
2.2.3 Testfelszíni potenciáltérkép ábrázolások ... 25
2.3 A SZÍV BIOELEKTROMOS TEVÉKENYSÉGÉNEK MODELLEZÉSE... 29
2.3.1 Bioelektromos források és térfogati vezetők... 30
2.3.2 Modellezési megközelítések ... 34
2.3.3 Az elektrokardiológia inverz problémája ... 35
2.3.4 Numerikus kardiológiai kamrai aktivációs modell és testmodell ... 36
3. A TESTFELSZÍNI POTENCIÁLTÉRKÉPEK REPRODUKÁLHATÓ-SÁGÁNAK ÉS AZ ADATOK VARIABILITÁSÁNAK VIZSGÁLATA ... 41
3.1 AZ ELEKTRÓDA FELHELYEZÉS HIBÁI... 41
3.2 192 ELVEZETÉSES TPT REPRODUKÁLÁSA REDUKÁLT ELVEZETÉS-RENDSZERBŐL... 43
3.3 A CSONKÍTOTT KARHUNEN-LOEVE TRANSZFORMÁCIÓ REKONSTRUKCIÓS HIBÁI... 44
3.4 A TESTFELSZÍNI POTENCIÁLTÉRKÉPEK VARIABILITÁSÁNAK VIZSGÁLATA... 47
4. BIOELEKTROMOS SZÍVSZÖVETHIBÁK MODELLEZÉSE... 51
4.1 A NORMÁLIS SZIVMŰKÖDÉST LEGJOBBAN KÖZELÍTŐ MODELLPARAMÉTEREK MEGHATÁROZÁSA... 51
4.2 BIOELEKTROMOS SZÍVSZÖVET-HIBÁK SZIMULÁLÁSA... 54
4.2.1 Az elektrokardiológiai modell felbontási korlátai ... 55
4.2.2 Mérhető eltérés a nem aktiválható térfogatok mérete szerint... 57
5. A TESTFELSZÍNI POTENCIÁLTÉRKÉPEK SZEPARÁLÁSA STATISZTIKAI MÓDSZEREKKEL... 60
5.1 A KORONÁRIA-RENDSZER SZŰKÜLETEINEK DETEKTÁLÁSA... 60
5.2 PITVARI FUNKCIÓZAVAR VIZSGÁLATA NITROGLICERINNEL ÉRZÉKENYÍTETT TPT-K ESETÉBEN... 69
5.3 TERHELÉSES VIZSGÁLATOK KOSZORÚÉR BETEGEKNÉL... 72
6. ÚJ TÉRKÉPÉRTELMEZÉSI MÓDSZEREK... 76
6.1 QRS ÉS QRST INTEGRÁLOK ÖSSZEFÜGGÉSEINEK VIZSGÁLATA... 76
6.2 NITROGLICERINNEL ÉRZÉKENYÍTETT TPT IDŐBELI VÁLTOZÁSAINAK VIZSGÁLATA... 81
7. DÖNTÉSTÁMOGATÁSI RENDSZER NYUGALMI ÉS GYÓGYSZERES TESTFELSZÍNI POTENCIÁLTÉRKÉP FELVÉTELEK ÉRTÉKELÉSÉRE... 90
8. TÉZISEK ... 95
8.1TÉZISEK MAGYARUL... 95
8.1THESES IN ENGLISH... 97
9. ÖSSZEFOGLALÁS, AZ EREDMÉNYEK HASZNOSÍTÁSA... 100
REFERENCIÁK ... 102
MELLÉKLETEK... 111
1. MELLÉKLET -A SZÍV FŐ KORONÁRIA (KOSZORÚ) EREI... 111
2. MELLÉKLET -A SZÍV EGYES -A DISSZERTÁCIÓBAN EMLÍTETT – MEGBETEGEDÉSEI... 111
3. MELLÉKLET -A DIAGNOSZTIKAI TELJESÍTMÉNY JELZŐSZÁMAI... 112
4. MELLÉKLET -A TESTFELSZÍNI POTENCIÁL-TÉRKÉPEZÉS VALIDÁLÓ ADATAI... 112
5. MELLÉKLET -GYAKRABBAN HIVATKOZOTT ELVEZETÉS-RENDSZEREK TULAJDONSÁGAI... 113
6. MELLÉKLET -MEDVEGY ÉS MTSI ÁLTAL KIDOLGOZOTT TESTFELSZÍNI POTENCIÁL TÉRKÉPEZÉS KIÉRTÉKELŐ MÓDSZER... 114
KIVONAT
Évtizedek óta bizonyított tény, hogy a testfelszíni potenciáltérképezés (TPT) lényegesen informatívabb, mint a standard 12 elvezetéses EKG, valamint bizonyított az, hogy a szívizom lokalizált diagnosztikai problémái a testfelszínén mérhető potenciál-eloszlás finom térbeli részleteiben rejlenek. Ezen információ noninvazív kinyerésére modellezéses, vagy determinisztikus eljárások alkalmazhatók. A TPT diagnosztikai szempontból fontos részleteinek feltárására két lehetséges út adódik a rendelkezésre álló adat függvényében, amikor a bioelektromos forrás felől közelítjük meg a kiváltott potenciálok térbeli eloszlását, (elektrokardiológiai forward probléma); illetve amikor a noninvazív elektromos jelekből becsüljük a forráseloszlást (az elektrokardiológiai inverz probléma). A disszertáció tárgyalja a numerikus kamrai szívmodellel végzett kísérleteket: a kamramodell normál paramétereinek beállítását, a szív orientációjának hatását, a modell felbontóképességét, valamint régi miokardiális infarktusokra vonatkozó kivetülési térképeit. Statisztikai módszerekkel megtörtént a mért TPT-ből kinyerhető tömörített paraméterek segítségével (QRS és QRST integrál, gradiens vektor, nondipolaritási index, departure index) meghatározátam a nem akut fázisban levő normál és patológiás esetek szeparálhatóságát. Jellemeztem nitroglicerinnel végzett terheléses vizsgálatok impulzusválasz függvényének egészséges és ischemiás páciensek esetére történő jellemzése. Az eredményekből egy Matlab alapú döntéstámogatási rendszert fejlesztettem ki, mely szoftver modellezési és statisztikai módszereket használ és képes a páciens egyéni, valamint populációra vonatkoztatott diszkriminatív eltérései alapján a bioelektromos források szintjére lebontott diagnózist alkotni.
ABSTRACT IN ENGLISH
Analysis of the regional bioelectric properties of heart by the use of body surface potential maps
Body surface mapping is proved to be a useful non-invasive tool to detect local bioelectric changes of the heart not accessible by the standard 12 leads ECG. The diagnostic value of body surface potential maps (BSPMs) can be evaluated by modeling or by deterministic methods. From diagnostic point of view the information located in the temporal and spatial changes of BSPMs can be revealed by solving the forward and inverse problem of electrocardiology depending on the type of data (whether bioelectrical source distribution or series of BSPMs) available. In the thesis the numerical ventricular model is used to analyze the effect of changing heart orientation, and the effects of non excitable regions placed in the myocardium after the parameters of normal activation sequence and resolution limits of the model were determined. Additionally, compressed BSPM parameters (QRS and QRST integrals, gradient vectors, nondipolarity indexes as well as departure indexes) were used for statistical analysis to separate normal states from pathological states in the non acute phase. The impulse response of nitroglycerine based medication (as exercise test) was characterized in case studies for healthy and ischemic patients. For characterization of bioelectric activity changes a decision support software system in Matlab environment was created from the results obtained. The evaluation of BSPM uses statistical and modeling tools and is capable of providing a diagnosis on bioelectric source level from individual and population-related discriminative deviations of results.
EXTRAKT IN DEUTSCHE
Prüfung der regionalen bioelektrischen Aktivitäten der Herzmuskulatur durch Potentialmapping der Körperoberfläche
Die Tatsache, dass das kardiale Potentialmapping der Körperoberfläche (BSPM) wesentlich mehr Informationen liefert, als das gewöhnliche 12-Ableitungs-EKG, gilt seit Jahrzehnten als bewiesen, außerdem ist auch bekannt, dass die lokalisierten diagnostischen Probleme des Myokardiums in den feinen räumlichen Details der auf der Körperoberfläche messbaren Potentialverteilung liegen. Für die nichtinvasive Gewinnung dieser Informationen können Modell- oder deterministische Verfahren verwendet werden. Die Erschließung der aus diagnostischer Sicht wesentlichen Besonderheiten des BSPM ergeben sich je nach den verfügbaren Daten zwei Möglichkeiten: der bioelektrische Quellenansatz für die räumliche Verteilung der ausgelösten Potentiale (elektrokardiologisches Forward-Problem), bzw. die Einschätzung der Quellenverteilung aus den nichtinvasiven elektrischen Signalen (elektrokardiologisches inverses Problem). In der Dissertation wird über die Versuche berichtet, die mit dem numerischen Herzkammer-Modell durchgeführt wurden: Einstellung der Normalparameter des Kammermodells, Einfluss der Herzorientierung, Auflösungsvermögen des Modells bzw. Mapping von früheren myokardialen Infarkten. Durch statistische Methoden und mit Hilfe von verdichteten Parametern aus gemessenen TPT-Werten (QRS- und QRST-Integrale, Gradientenvektor, Nicht-Dipolaritätsindex, Departure Index) wurde die Trennbarkeit von normalen und pathologischen Fällen in der nicht-akuten Phase bestimmt. Ferner wurde das Impulsansprechverhalten von gesunden und ischämischen Patienten bei Belastungsprüfungen mit Nitroglyzerin beschrieben. Aus den Ergebnissen wurde ein System zur Entscheidungsunterstützung auf Matlab-Basis entwickelt, in dem Software-Modellierungs- und statistische Methoden verwendet werden, das in der Lage ist, anhand der individuellen und auf die Population bezogenen diskriminativen Abweichungen eine Diagnose auf bioelektrischen Quellebene aufzustellen.
1. BEVEZETÉS
Magyarországon épp úgy, mint a világ fejlettebb országaiban, a keringési rendellenességek az emésztőrendszeri problémák mellett mortalitási és morbiditási szempontból vezető helyen szerepelnek a statisztikákban, a fellnőttkorú lakosság 51%-át érintik. A keringési betegségeken belül az egyik legjelentősebb csoport a szívkoszorúér-problémáké, mely a lakosság számottevő részét érinti és nagy terhet ró a gazdaságra, valamint az egészségügyi ellátó szektorra. Hazánkban az elmúlt évtizedben csak a koronarográfiás beavatkozások száma 30-36.000 között mozgott éves szinten. A keringési rendszer megbetegedéseivel ambuláns szakrendelésen megjelenők száma pedig havonta 375-530.000 páciensközött mozog [1]. A probléma hátterében elsősorban a helytelen életmód, az elhízás, a stressz, a mozgáshiány, a dohányzás és egyéb környezeti ártalmak. állnak. A megelőzés és az új életmódra nevelés mellett - ami talán a későbbi generációknál hozhat átütő eredményt - a jelen feladata a nagy számú kardiológiai beteg szűrése, megfelelő módon történő diagnosztizálása, a helyes terápia és rehabilitációs eljárás kiválasztása és alkalmazása, lehetőleg az egyén adottságaira szabva. A kardiovaszkuláris morbiditást leginkább befolyásoló megbetegedéseknek két fő csoportja ismert.
Egyik a koronária megbetegedések (coronary artery diseases - CAD) csoportja, melyek egyfajta oxigénhiányos állapotból a szív szöveteinek bioelektromos elváltozásait idézik elő. Ezek rendszerint ischemiás tünetekkel kezdődnek, típusos esetben a szövődményként miokardiális infarktushoz vezethetnek. A másik csoportba a vezetési rendellenességek és aritmiás zavarok tartoznak, ez utóbbiak rendszerint a szív ingervezető rendszerének kóros elváltozásaiból, vagy a szívritmus rendellenességeiből adódnak és sok esetben hirtelen szívhalálhoz vezetnek.
A szív által generált elektromos jelek vizsgálata már több mint egy évszázadra tekint vissza. A legelterjedtebb noninvazív eljárás az elektrokardiológiai vizsgálat (EKG) nemzetközileg elfogadott, szabványosított napi rutin eljárássá vált és megjelentek egyéb specializálódott alkalmazások is. Az elmúlt évtizedekben az orvosi, a méréstechnikai és az informatikai rendszerek is ugrásszerű fejlődésen mentek keresztül. Mindezek hatására egyszerűbbé, olcsóbbá és gyorsabbá vált a jelfeldolgozás, valamint pontosabbá vált a diagnosztika. Az új eljárások közül a noninvazív módszereket mind a páciensek, mind pedig az egészségügyi intézmények a kisebb beavatkozási rizikó miatt előnyben részesítik. A ma már „hagyományosnak” mondott 12 elvezetéses EKG mellett az elmúlt 40 évben már nem csak a kutatólaboratóriumokban, hanem az orvosi gyakorlatban is megjelentek az új noninvazív módszerek között a több-elvezetéses testfelszíni potenciáltérképező rendszerek. Testfelszíni potenciáltérképezés (TPT) alatt olyan mérési eljárást értünk, mely a szív elektromos aktivitása hatására a testfelület mentén a hely és időfüggő elektromos és/vagy mechanikus tevékenység meghatározására és változásának követésére alkalmas.
A mért testfelszíni potenciál-eloszlás és a forrás közötti összefüggések pontosan –főleg patológiás állapotban – jelenleg nem, vagy csak korlátozottan ismertek. Ezeknek az összefüggéseknek a
kimutatására klinikai mérési, statisztikai és modellezési feladatok –sokszor egyszerre történő - használata szükséges.
A szívizom lokalizált diagnosztikai problémái tisztázásához szükséges információ, a testfelszínén mérhető potenciál-eloszlás finom térbeli részleteiben rejlik. Amennyiben ezt a mérés, feldolgozás, adattömörítés és kifejtés nem tudja elegendő pontossággal rekonstruálni, a lényeget – az információt - veszíthetjük el. A megfelelően nagy térbeli és időbeli mintavételi sűrűséggel mért TPT olyan – nem akut - esetekben lehet hasznos diagnosztikai információforrás, ahol az EKG térbeli felbontása jelenti a korlátot: emiatt azon problémák megoldásában lehet hasznos, ahol lényeges a lokális szívizom rendellenességek felderítése. Ebbe a kategóriába tartozik: pl. a szívizom ischemia detektálása, az életveszélyes aritmiák gócainak, vagy (re-entry) pályáinak felderítése, a hirtelen szívhalálra vezető aritmia feltételek vizsgálata (a szívizom akciós potenciáljainak lokalizált, jelentős megváltozása), a koszorúér betegség diagnosztikájának problémája, stb. Ezen mechanizmusok hátterében a szívizom anyagcseréjének abnormalitásai, kóros ion és metabolit koncentráció-változások vannak. A szív megbetegedései általában strukturális abnormalitásból (kóros ingerületképzés, pacemaker aktivitás) vagy átmeneti funkciózavarból (kóros ingerületvezetés: re-entry exitáció) adódnak.
A TPT mint diagnosztikai eszköz célja tehát, a test felszíni potenciál-eloszlás térbeli és időbeli függvényéből a szív bioelektromos tevékenységének megadása; vagyis hogy megoldja - páciensre szabottan- az elektrokardiológia inverz problémáját és a normáltól eltérő funkcionális és/vagy elektromos testfelszíni állapotokról a szív szöveti szintjére vonatkoztatva tudjunk diagnózist alkotni.
Ennek a problémának a megoldása azonban –matematikailag- nem egyértelmű.
Az orvosi informatika, mint interdiszciplináris tudományág ezen szűk területével, a testfelszíni potenciáltérképek információban gazdag tárházával foglalkoztam kutatásaim során, pontosabban a szív, mint bioelektromos forrás és a test felszínén mérhető jelek kapcsolatának kvantitatív jellemzésével. A mérések elektrokardiológiai variabilitásának technikai, biofizikai, élettani okait, valamint az invazív vizsgálatok korlátait figyelembe véve, a disszertációban ismertetett kutatási eredmények a patológiás események háttérben meghúzódó bioelektromos, szívszöveti elváltozások fontosságát és noninvazívan - statisztikai és modell vizsgálatokkal- is kimutatható hatását kívánták kihangsúlyozni. A disszertáció tárgyalja és bizonyítja, hogy egyes kardiológiai patológiás állapotok vonatkozásában a TPT informatívabb, mint a hagyományos 12 elvezetéses EKG. Mivel az EKG az elmúlt több, mint 100 évben elsődleges információ-forrássá vált, egyes esetekben az eredményeket a 12 elvezetéses EKG elvezetéseire vonatkoztatva is szerepelnek.
A disszertáció célja, hogy rávilágítson azokra a lényegi információkra, melyek elősegíthetik egyes kardiológiai megbetegedések, rendellenességek előrejelzését és diagnosztizálását kizárólag noninvazív módszerekkel. Az ehhez szükséges döntéstámogatási eszközöket és az általa generált javaslatokat az orvosok rendelkezésére lehet bocsátani, de nem szabad szem elől téveszteni, hogy a diagnosztizálás és a terápia meghatározása továbbra is a kardiológus feladata lesz. A disszertációban részletezett
problémákat jellemzően orvosok vetették fel, de megoldás csak az informatika és statisztika széles eszköztárával adható kérdéseikre: modellezési vizsgálatokkal (koncepcionális és hipotézis vizsgálatok) valamint mérési, adatgyűjtési és statisztikai értékeléssel, eljárás-fejlesztéssel.
A későbbi klinikai felhasználás miatt TPT értelmezés statisztikai és egyedi szinten, a biofizikai források szintjére visszavezetve kell, hogy történjen, hiszen az orvosi diagnosztikai tevékenységet ez segíti elő.
Mivel a disszertáció egy multidiszciplináris tudományágat tárgyal, emiatt a következő fejezetben a szív és az elektrokardiográfia alapdefinícióit (2.1), majd a test felszíni potenciáltérképezés módszereinek és kapcsolódó fogalmainak (2.2), illetve a bioelektromos jelenségek modellezésének alapjait ismertetem (2.3), miközben áttekintem a témához kapcsolódó irodalmat és ismertetem az ezek közül általam használt módszereket is (ezeket később a saját eredményeknél külön nem részleteztem).
A 3. fejezettől kezdődően bemutatom az általam végzett kísérleteket és kapott eredményeimet. A 4-7 fejezetek azokat az originális kutatásokat, vizsgálatokat tartalmazzák, melyek a téziseimet megalapozták. A 8. fejezetben találhatók a tézisek (angolul és magyarul) feltüntetve melyik fejezet(ek) eredményeinek következtetéseit tartalmazzák. A 9. fejezet a disszertáció tartalmi összefoglalása, ezt a hivatkozott irodalmak listája követi.
2. A SZÍV BIOELEKTROMOS TULAJDONSÁGÁNAK JELLEMZÉSE TESTFELSZÍNI POTENCIÁL-TÉRKÉPEZÉSSEL
2. 1 Az elektrokardiológia alapjai
2.1.1 A szív, mint szerv
A szív az ember keringési rendszerének központja, fő funkciója a keringés fenntartása, ezáltal a test szerveinek, szöveteinek folyamatos friss oxigénnel történő ellátása. A vért a szív ritmikus összehúzódása és elernyedése (szisztolé és diasztolé) tarja keringésben. A szív állapotának változása alapvetően befolyásolja az egész keringési rendszer működését. A szív fala szívizomsejtekből épül fel, melyet miokardiumnak (myocardium) neveznek, a pumpa funkciót pedig a szív négy ürege jobb pitvar (RA), bal pitvar (LA), jobb kamra (RV), bal kamra (LV) látja el a kis és nagy vérkörön keresztül (1.
ábra). A kamrákat elválasztó rész az intraventrikuláris szeptum. A szív orientációja szerint (átlagos esetben) úgy helyezkedik el, hogy anterior (mellkas felőli) részéhez a jobb kamra, posterior (hátsófali) oldalhoz pedig a bal pitvar esik legközelebb. A szív tömegének legnagyobb részét szívizomsejtek alkotják, melyek biológiai tulajdonságukat tekintve magukban hordozzák a harántcsíkolt izmok gyors összehúzódó képességét és a simaizmok hosszú távú igénybevehetőségét is. [2]. A szív szöveteinek oxigén-felhasználása arányos a szív által végzett munkával, ami azt jelenti, hogy terhelést is csak abban az esetben lehet növelni, ha az fokozott oxigénben dús vérellátással jár együtt.
1. ábra A szív kamráinak és ingervezető rendszerének sematikus rajza
A szív szöveteinek vérellátásáért a koronária-rendszer a felelős. A koronária-rendszer esetén 3 fő ércsoportot különíthetünk el: baloldalon a főérből eredően az anterior oldalt ellátó LAD (Left anterior descending) és a laterális területet ellátó CX (left circumflex), jobb oldalon pedig a szív jobb és hátsó régióit ellátó RC (right coronary) ereket. Az erek tovább ágaznak, de lefutásukban és ellátási területükben egyénenként igen nagy a variabilitás. (2. ábra) Megkülönböztetünk kiegyenlített érellátású (a hátsó falat a CX és az RC is ellátja), jobb domináns (az RC lenyúlik a hátsó fal központi
ágáig) és bal domináns (a hátsó fal ellátását CX végzi) koronária rendszereket. Megkülönböztethető még az érrendszer a szív csúcsi területének (apex, apical) ellátása szempontjából is, attól függően, hogy a LAD és RC fő erek végződése ezt a területet milyen mértékben és milyen irányból látja el.
Megnövekedett oxigén-igényt csak a koronária-rendszer fő ereinek (artériák) tágulásával lehet kielégíteni. A szívre háruló nagyobb munka esetén az érellenállás csökken, és ennek egyik kiváltó oka a szöveti oxigén csökkenése, ami helyi hypoxiát okoz.
2. ábra A szív koszorúér-rendszere
A szív ingerképző helye a szinusz csomó, ami a szinuszritmus kialakításáért és az ingervezető rendszeren történő ingerülettovábbításért felelős. A szívet felépítő szívizomrostok a vezető rendszer részei. A szívizomsejtek membránja között nyugalmi állapotban elektromos potenciálkülönbség mérhető, ezt nevezzük nyugalmi potenciálnak. Az, hogy egyes izomrostok belseje negatív a rostok felszínéhez képest már a 19. században tudták, a potenciálkülönbség (membránpotenciál) pontos mérése csak a 20. század közepe táján a patch clamp technika bevezetésével vált méréstechnikailag is lehetségessé [3]. Nyugalomban minden egyes sejt belseje (intracelluláris tér) negatív a membrán külső felszínéhez (extracelluláris tér) képest. Ez a negatív nyugalmi potenciál szívizomsejtek esetében megközelítőleg -90 mV. A membránpotenciál kialakulása a sejtek ionjainak (elsősorban a K+, Na+, Cl- ionok) egyenlőtlen megoszlására vezethető vissza, a nyugalmi potenciál megléte pedig a sejtek alapvető működési feltételeit – többek között az ingerelhetőséget biztosítják. A szívizomsejt inger hatására elektromos aktivitást fejt ki, mely ionállapot változással jár együtt, ennek mértékét a membrán ionokra vonatkozó permeabilitása (áteresztőképessége) adja meg. Az egyensúlyi potenciál minden egyes sejtben kiszámítható az ion koncentrációk ismeretében, mivel minden egyes ionra alkalmazható Nernst egyenlete az elektromos gradiens és a kémiai koncentráció gradiens kapcsolatáról [4]. Az ionkoncentráció különbség kiegyenlítődéséért – a nyugalmi állapothoz való visszatérés
elősegítése érdekében diffúziós folyamat indul el, melyet a sejtmembrán két oldalán felhalmozódott töltések befolyásolnak. A potenciál értéke minden sejtben minden időpillanatban megadható, melynek egyensúlyi ionképlete megadható a Goldman-Hodkin-Katz egyenlettel [5, 6]. A nyugalmi potenciál fenntartásához a diffúziós folyamaton felül aktív iontranszport szükséges, mely funkciót főként a Na- K ATPáz ionpumpa látja el.
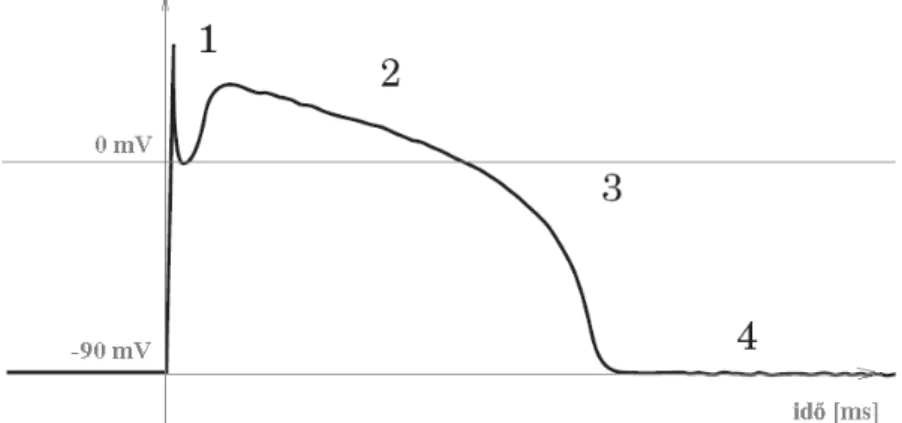
Az ingerelhető sejtek membránpotenciálja alapállapotban nyugalmi potenciálon van, megfelelő elektromos ingerlés hatására a sejten belül növekszik a pozitív ionok aránya és depolarizáció (1) következik be. Ez után egy plató fázis (2), majd lassú repolarizációs szakasz (3) következik, mikor a Na-K pumpa helyreállítja a nyugalmi potenciált. Két aktiváció között nyugalmi időszak található (4) (ld. 3. ábra). A folyamatot jellemző potenciál időfüggvényt akciós potenciálnak (action potential - AP) nevezik. A depolarizált membrán egy ideig nem képes új depolarizációra, vagyis refrakter periódusba kerül. A szívizomsejt akciós potenciálja megközelítőleg 100mV nagyságú, a hossza kb. 300ms.
3. ábra A szívizomsejt akciós potenciáljának időbeli függvénye
A potenciál értéke az ingerület hatására nem egyszerre változik a sejtmembrán minden pontjában, hanem egyenletes sebességgel terjed minden irányba, így az adott ponton átfolyó áram hely és időbeli függésével jellemezhetjük a folyamatot, amit jellemzően az egyváltozós Hodkin-Huxley féle kábel egyenlettel lehet leírni [259]
Egy szívciklus egy elektromos ingerület, amely végigfut a szívsejteken – a szív ritmikus kvázi-periodikus összehúzódását váltja ki. A szív izomzatára jellemző, hogy a szívizom sejteket és rostokat kis elektromos ellenállású kapcsolatok (gap-junction) kötik össze, ezen keresztül egy bárhol keletkezett ingerület tovaterjed az egész izomzatban. Az ingerület terjedése a szívszövetben úgy történik, hogy az a szívizomsejt az összes vele szomszédos sejtet ingerli, kivéve a pitvar és a kamra között, hiszen ott – egészséges esetben - egy nem vezető réteg található. Egy vékony réteg szeparálja az aktív sejteket a még nyugalmi állapotban levőktől, az ingerület-áttétel mindig csak a közvetlenül szomszédos sejteket érinti, feltéve, hogy meghaladja annak ingerelhetőségi küszöbértékét. A jobb pitvarban található szinusz csomó specializálódott sejtjei a pacemaker sejtek rendszeres időközönként (átlagos testalkatú egészséges embernél úgy 60-80-szor percenként) akciós potenciált generálnak, ez a pitvar sejtjeiben tovaterjed. Egy-két patológiás állapottól eltekintve általában a szinusz csomó ingerképzési időintervalluma határozza meg a szív frekvenciáját. Az
atrioventrikuláris (AV) csomó a pitvar és kamra közötti területen helyezkedik el, normál esetben ez az egyetlen ingervezetési terület a pitvar és a kamra között. A kamrákba ezek után egy speciális ingervezető rendszer, az úgynevezett His kötegen keresztül jut el az ingerület, a szeptum falának két oldalán jobb és bal kötegként (left bundle branch, right bundle branch), vagy más néven a Tawara szárakon. A kötegek később a legyezőszerűen szétterülő Purkinje réteg sejtjeiben folytatódnak, melynek végződései a kamrák endokardiális, azaz belső falán találhatók. A Purkinje sejtek vezetési sebessége a szívizomsejtekénél 2-12-szer gyorsabb [2]. Az ingerületet itt átadják és az hullámfrontot alkotva terjed tovább a szívizomsejtekben az endokardiumtól (szív belső felülete) az epikardiális terület (szív külső felülete) felé és mindenütt bekövetkezik a depolarizáció majd a repolarizáció is. Az egyes szívizom-rostok elektrofiziológiája eltérő, így a szívizom rétegenként eltérő vezetési tulajdonságokkal rendelkezik: az epikardium felé haladva az akciós potenciál hossza rövidül.
A normális ritmuson kívül megjelenhet az extraszisztolé (lehet pitvari vagy kamrai eredetű is), amennyiben a szívet diasztolés fázisban újra a küszöbérték feletti inger éri. Szisztolés fázisban a szív refrakter periódusba kerül és külső ingerekre nem válaszol. Akármilyen gyorsan jönnek is az elektromos ingerek, a szívösszehúzódások nem „folynak egybe”, vagyis a szív nem tetanizálható. A szív izomzatában lejátszódó komplex elektromos tevékenység - az akciós potenciálok összege - a test felszínén is minden egyes időpillanatban meghatározható mérhető potenciál jelet generál: ezt a potenciálingadozás időfüggvényt nevezzük elektrokardiogramnak, EKG-nak.
A szívciklusnak és a szív elektromos aktivációs szekvenciájának vizsgálatában, az ingerkeltő helyek, a metabolit folyamatok, valamint az ingerület terjedési mechanizmusának meghatározásában jelentős szerepet játszottak Stannius (1852) és Ringer (1880) békaszíven végzett kísérletei, valamint Scher és Young kutyaszív vizsgálatai [8]. Később emberszíven végzett vizsgálatok következtek: 1951-ben Weidmann intracelluláris elvezetésekkel regisztrálta a szívizomrostok akciós potenciálját [9], majd Durrer és munkatársai 1970-ben publikálták egy egészséges emberi szíven végzett kísérletük eredményeit, és ez alapján határozták meg, hogy az aktivációs hullámfrontok lényegében egyenletesen terjednek az endokardiumtól az epikardium felé, valamint a szív csúcsi régiói felől a bazális területek felé [10]. A szív háromdimenziós (3D-s) elektromos jelének feltérképezése a szív felületén és/vagy a szívbe szúrt elektródák segítségével történt. Az ilyen invazív 3D-s térképezési technika lehetővé teszi a normálistól eltérő ingerképzési és vezetési helyek pontos intramurális lokalizációjának kimutatását.
2.1.2 A szív elektromos tevékenységének mérése
Az első emberi elektrokardiogram mérése Waller nevéhez köthető és több mint egy évszázadra nyúlik vissza (1887) [11]. Lippmann kapilláris elektrométerét és 5 elektródát használt méréseihez, 4 végtagi elektródát és egyet a szájra helyezve, ezzel 10 elvezetést hozott létre. Néhány évvel később Willem Einthoven hasonló technikával, majd az általa kifejlesztett húros galvanométerrel is megismételte az EKG méréseket és 1902-ben publikálta a klinikai EKG mérésről szóló cikkét, az elektrokardiogram fogalma is tőle ered [12-15]. Mérései során 3 végtagi elektródát használt (L-bal kéz, R - jobb kéz és F - bal láb). Ezt az elrendezést hívjuk ma Einthoven háromszögnek, vagy Einthoven elvezetés-
rendszernek. A szívizom elektromos tevékenysége dipólusnak tekinthető, ahol a pólusok nagysága és iránya idő függvényében változik, emiatt vektorként kezelhető. Dipólusnak két azonos nagyságú de ellentétes pólusú töltést értünk. Így egy sejt (rost) ingerületi állapota a hozzárendelt elemi dipólus- vektorral adható meg: ahol vektor a pozitív potenciálértékű területek felől a negatív felé mutat. A szív egészének potenciálállapota ezeknek az elemi dipólusoknak az összegével jellemezhető. Így belátható, hogy az Einthoven háromszög elektróda-elrendezése, melynek közepében a potenciálgenerátor szív helyezkedik el, jó kezdeti dipólus közelítést adott. Az elvezetésekben mért feszültségek arányosak lesznek a szívvektor adott elvezetésre vonatkozó vetületével.
A dipólus-vektor klinikailag fontos információt szolgáltat; elsősorban a vektorkardiográfiában alkalmazzák. A dipólus-vektorokat egymás után fűzve, annak térbeli és időbeli változását detektálják, hurokgörbével ábrázolják, ezt vektorkardiográfiának nevezik. Előnye, hogy az ingerületterjedési mechanizmust pontosan követi, hátránya viszont az, hogy nem ad lehetőséget az időtartamok közvetlen regisztrálására – emiatt alkalmatlan például ritmuszavarok diagnosztizálására.
4. ábra A standard 12 elvezetéses EKG mellkasi elvezetései
Az Einthoven által használt elvezetések bipolárisak, azaz a testfelület két pontja között mért potenciálok különbségéből adódnak. Unipoláris elvezetéseknél a testfelület egy potenciálértékét valós vagy mesterségesen meghatározott nulla (referencia) szinthez viszonyítják. Az unipoláris elvezetéseknél emiatt fontos kérdés a referenciaszint megválasztása. Az Einthoven háromszög feltevéséből kiindulva (hogy a szív a háromszög közepén helyezkedik el) célszerűnek tűnt az egyenletesen távol eső végtagi elvezetésből – elvezetésenként egy nagy ellenálláson (pl. 5kΩ) keresztül vezetve – meghatározni a nulla potenciált [16]. Az ennek segítségével elvezethető potenciálok értéke elég kicsi, emiatt Goldberger (1942-ben) bevezette az ún. augmented (erősített) unipoláris végtagi elvezetéseket (aVL, aVR, aVF), mely a potenciálkülönbségeket 50%-kal növeli [17]. 1944-ben Wilson és munkatársai bevezették az unipoláris mellkasi EKG elvezetéseket, jelölésük szerint a V1-V6 elvezetéseket, melynek test felületén történő elhelyezkedéseit mutatja be az 4. ábra.
Einthoven és Goldberger rendszerekkel együtt ez alkotja a ma standard 12 elvezetéses EKG rendszerként ismert technológiát [18].
A standard 12 elvezetéses EKG elvezetéseinek megnevezése I, II, III, aVR, aVL, aVF V1, V2, V3, V4, V5, V6, melyet 6 mellkasi és 3 végtagi elvezetésből származtatunk. Az elektródák felhelyezése a következő: V1 elvezetés: 4. bordaköz parasternalisan jobb oldalon, V2 elvezetés: 4.bordaköz parasternalisan bal oldalon, V3 elvezetés: a V2 és V4 között, V4 elvezetés: 5. bordaköz, bal medioclavicularis vonalban, V5 elvezetés: bal elülső hónaljvonalban a V4 magasságában, V6 elvezetés: bal középső hónaljvonalban a V4 magasságában. A végtagi elvezetések megfelelnek Einthoven három elvezetésének (R, L, F).
A 12 elvezetésből számított feszültség értékeket egy referencia-ponthoz viszonyítva adjuk meg, ez pedig általában az ún. „Wilson central terminal”, ami a három végtagi elvezetés átlagának tekinthető, technikailag úgy hogy ezeket egy nagy rezisztanciájú ellenálláson átvezetve földelik [16]. Ebből az következik, hogy a mellkasi unipoláris elvezetések (prekordiális elvezetések) a mért és a Wilson central terminal különbségeként adódnak.
W Vi
Vi =Φ −Φ i=1..6
A származtatott elvezetések (augmented) pedig:
2
F R L
aVR=Φ −Φ +Φ ,
2
F L R
aVL=Φ −Φ +Φ és
2
R F L
aVF =Φ −Φ +Φ
5. ábra Normál elektrokardiogram hullámai és intervallumai (I) a V6-os elvezetésben (μV-ban)
A 5. ábra a normál EKG V6 elvezetésben mérhető időfüggvényét mutatja, a nevezetesebb hullámokkal és intervallumokkal. A hullámokat az amplitúdó lokális szélsőértékei alapján abc sorrendben nevezték el –ez nemzetközileg elfogadott jelölésrendszer-, az egyes intervallumoknak elektrofiziológiai jelentéstartalma van. A P hullám a pitvari ingerületterjedést, a PQ szakasz a pitvarok egészére kiterjedt ingerületi állapotot, a QRS komplexus a kamrai depolarizációt és pitvari repolarizációt, az ST szakasz a kamrák egészére kiterjedt ingerületi állapotot, a T hullám pedig a kamrai repolarizációt jelöli. Egyes esetekben megjelenik még az U hullám is. Az akciós potenciálok tulajdonságai miatt a repolarizációs fázis is az epikardiumtól az endokardium felé halad, épp emiatt lehet a repolarizációs szakaszt jelző T
hullám is pozitív polaritású. Az ST szakasz normál esetben nulla potenciálértékű, ami a szívizomsejtek plató fázisának nyugalmi időszakát jelzi [2].
A 12 elvezetéses EKG szabványosítási törekvései 1954-ben kezdődtek meg és ezt a szabványt az American Heart Association (AHA) időről időre felülvizsgálja, és új ajánlásokat ad ki. A szabványosított 12 elvezetéses EKG mérés követelményei között az elektródák helyének pontos megjelölésén kívül szerepel az 500Hz-es mintavételi frekvencia 12 bit pontossággal, az 5µV jelfelbontási képesség is. Az EKG a PQRST szakaszon bekövetkezett amplitúdó és intervallum eltéréseket vizsgálja, különös tekintettel a ritmus és hullámalak eltérések esetére. Ezen az elgondoláson alapuló un. Minnesota kódrendszert fejlesztett ki Blackburn 1960-ban, amit azóta többszörösen átdolgoztak [19, 20]. Ez vált az EKG kiértékelésének alapvető szabályrendszerévé, melyet folyamatosan továbbfejlesztenek, és ma már automatizált EKG kiértékelő validált algoritmusok állnak rendelkezésünkre. A Common Standards of Electrocardiology projekt referencia adatbázisa elősegíti, hogy a gyártók, fejlesztők a szolgáltatások szintjén egymással kompatibilis rendszereket hozhassanak létre [193]. A 12 elvezetéses rendszer vizsgálata és megfelelő klinikai diagnosztizálási eljárások kidolgozása odáig vezetett, hogy bizonyos patológiás elváltozásokat akár 90%-os biztonsággal is lehet detektálni, de más betegségek esetében a diagnosztikai pontosság ennél lényegesen kisebb.
Az EKG méréssel számos kardiális eredetű problémát lehet kimutatni:
• A szív ingerképző rendszerének problémáit: a szív ritmusából eredő abnormálisan gyors vagy lassú ritmusokat (tachicardia, bradicardia)
• A szív megváltozott szervi ingervezetési tulajdonságait, melyek a háttérben levő megváltozott metabolikus vagy szervi problémákat jelzik
• A szív munkaizomzatában megváltozott ingervezetés kihatásait (miokardiális infarktus)
• A véráram útjának lokális károsodását és az általa okozott oxigénhiányos állapotot (instabil angina)
• A kardiális rendszer kedvezőtlen változásainak hatását (a szív, mint szerv, vagy az egész keringési rendszerre vonatkozó elváltozások esetében, mint pl. a magas vérnyomás és a pajzsmirigy rendellenességek).
• A kardiális rendszer egyéb – a légzési rendszerrel összefüggő káros hatásait (emphysema, tüdőembólia)
• Bizonyos veleszületett szívrendellenességeket.
• A vér elektrolit szintjének változásait (különös tekintettel a K, Ca, Na és Mg ionokra)
• A szív izomzatának gyulladásos megbetegedéseit (myocarditis, pericarditis).
Számos egyéb feladatra specializálódott elektrokardiológiai mérőrendszer is létezik, melyek az alkalmazási terület és a felhelyezett elektródák száma és lokalizációja szerint folyamatosan változnak.
Alapkoncepciójuk szerint az adott feladatot (pl. hosszú távú monitorozás, vagy a potenciál-eloszlás
pontos térbeli megfigyelése) tekintve a lehető legtöbb – diagnosztikai szempontból fontos – többletinformáció megszerzése miatt célirányosan fejlesztették ki őket. Ilyen célalkalmazások egyrészt a Holter monitor illetve a vektorkardiográfiai alkalmazások, másfelől pedig a testfelszíni potenciáltérképező rendszerek.
2.2 A testfelszíni potenciál-térképezés
A testfelszíni potenciáltérképezés (TPT, vagy angolul body surface potential mapping - BSPM) kialakulására utaló első publikációk Wallertől származnak, aki 10-20 elvezetéses EKG alapján készített a mai izopotenciál szintvonalas testfelszíni potenciáltérképhez hasonlót [11]. 1951-ben Nahum és munkatársai publikálták az első leírását egy férfi elektromos szívciklusának izopotenciális térképekkel történő ábrázolásáról. Ez még nem detektálta az egyidejűleg meglévő minimumokat és maximumokat, de azt igazolta, hogy a TPT potenciál-eloszlása jóval bonyolultabb, mint az egyetlen áramdipólus esetén várható lenne [21]. Később Abildskov és munkatársai a felületi potenciál eloszlásokat megpróbálták meghatározni kezdetleges/elemi empirikus módszerekkel [22]. A szív elektromos tevékenységének feltérképezésével a testfelszíni potenciáltérképek mai értelemben vett rendszerének előfutárai mindenképp Taccardi és munkatársai voltak, akik az 1960-as évek elején kutyakísérletekkel [23], majd emberekre - a torzó 200 pontjában- helyezett elektródákkal a testfelszíni potenciáltérképek teljes térbeli és időbeli változásainak jellegét leírták. Ezeket a jeleket kezdetben szekvenciálisan mérték, majd nagy munkaerő-ráfordítással a térbeli és amplitúdó viszonyokat pontosan meghatározták [24]. Később az automatizált, real-time (azonnali), parallel (párhuzamos) adatgyűjtés és megjelenítés vált elterjedté, köszönhetően a méréstechnika és számítástechnika fejlődésének [25]. A kvalitatív és kvantitatív különbségek, melyek a megnövekedett elvezetés számból nyerhető többletinformációt taglalják, több évtizede fő témái a kardiológiai kongresszusoknak. Érdemi változás azonban nem történt, pedig pl. infarktusok esetén a fel nem derített esetek száma a hagyományos 12 elvezetéses EKG és a TPT technológia különbségeit és lehetőségeit ismerve elérhetik az esetek 50%-át.
A TPT számos esetben bizonyította, hogy diagnosztikai teljesítménye lényegesen jobb, mint az EKG-é és ezzel több patológiás állapot mechanizmusának feltárásában és pontosabb diagnosztizálásában van szerepe, valamint igazolta azt is, hogy a TPT diagnosztikai ereje a térbeli felbontásban van. Spach és munkatársai kutyakísérletek során meghatározták a P-QRS-T szekvencia testfelszíni potenciál-értékeit normál és supraventrikuláris aktiváció esetén, és ennek folyamán detektálták az ún. epicardial breakthrough eseményt, vagyis azt a pillanatot, mikor az aktiváció eléri az epikardiumot és ennek jele megjelenik a TPT jelekben [26]. Később bizonyították, hogy különbség van a jobb kamrai hipertrófia jeleiben attól függően, hogy mik a kiváltó tényezői [27]. Flowers és munkatársai különbségtérképekkel (difference, departure map) már 1976-ban megmutatták az akut infarktus és az
infarktust megelőző és azt követő állapotok közötti különbséget, elsősorban olyan a QRS-en megtalálható jellegzetességeket emelve ki, melyek a standard EKG diagnosztikai kritériumai között nem szerepeltek [28]. 1977-ben Vincent és munkatársai a hagyományos 12 elvezetéses EKG és a TPT mérési eredményeit vetették össze régi miokardiális infarktusos páciensek esetén. Míg az EKG normál értéket mutatott, a TPT képes volt szignifikánsan jelezni a korábbi infarktus tényét [29]. Mirvis kutyakísérletekkel az epikardiális ischemiás állapot pontos helyzetét volt képes meghatározni [30].
Koinreich és kollegái indirekt módon egy nagy - több diagnosztikai csoportot felölelő - vizsgálatban bebizonyították, hogy az anterior és posterior infarktusok, valamint a balkamra hipertrófiás esetek egymástól való legjobb szeparálását olyan elvezetésekkel – szám szerint 4-6 elvezetéssel – lehet megoldani, melyeket a standard 12 elvezetés nem tartalmaz. Megmutatták továbbá, hogy ischemiás esetekben az ST depresszió maximális értékei nem a 12 elvezetés elektródáinak lokalizációjával esnek egybe, így csak bővített elektródarendszerrel érzékelhetők [31, 32]. Később Koinreich és Lux közösen belátták, hogy 4 kiegészítő elvezetés használata esetén (V4R, V8, V8R és V8R-RS) a diagnosztikai információ 96-99%-a az újonnan bevezetett elvezetésekből származik, tehát mindenképpen indokolt lenne felülvizsgálni a hagyományos 12 elvezetéses rendszert. Ezzel optimalizálni lehetne több patológiás elváltozás diagnosztizálását is, többek között a hipertrófia, fibrózis, infarktus (mérete), lokális ischemia, kamrai ingervezetési rendellenességek detektálását [33, 34, 183]. Az infarktusos, ischemiás területek pontosabb feltárására számos vizsgálat folyik az óta is, a diagnosztikai szempontból fontos időtartomány és főleg a lokalizáció meghatározására [180-182, 186, 195], valamint a korábban lezajlott de EKG eltérést nem mutató patológiás állapotok feltárására [48, 194].
De Ambroggi és Taccardi, valamint munkatársaik meghatározták a WPW szindrómás esetek pre- excitációs területének detektálási kritériumait [35], ami nagy jelentőségűvé vált az ún. accessory pathway pontos helyének noninvazív feltárásában, és a radiofrekvenciás abláció előkészítése folyamán [185]. Stilli és munkatársaik voltak az elsők, akik képesek voltak a TPT jelek alapján érzékelni a balszár-blokkos eseteket [36] Majd Liebman és mtsi. meghatározták a jobbszár blokk TPT-n detektálható paramétereit, később ezt a munkát alapul véve Sohi és Flowers elkülönítette jellegzetességeit az egyes bal hemiblokkok jellegzetességeit is [37, 38]. Több betegség egyidejű diagnosztizálása nehéz feladat TPT rendszerekkel is, de izointegrál és izopotenciál térképek segítségével Song és munkatársai a jobbszár blokk jelenlétében – EKG által nem diagnosztizálható - kamrai hipertrófia jeleit voltak képesek kimutatni TPT-n [39], továbbá Reich és munkatársai is közöltek tanulmányt az ischemia és miokardiális infarktus jobbszár blokktól történő statisztikai megkülönböztetésének diagnosztikai lehetőségeiről. [40]. Ezt számos tanulmány követte, köztük kiemelkedően fontos Préda és munkatársai eredményei, akik potenciáltérképekkel egyidejűleg kétféle diagnózist is képesek voltak kimutatni, egyrészt balszár blokkot (left bundle branch block, LBBB) miokardiális infarktus esetén, másrészt ischemiás szívbetegséget és érelzáródást, mellyel hipotézisük szerint kiváltható volt a Thallium-201 izotópos vizsgálat. Mindkét esetben a hagyományos 12 elvezetéses EKG alkalmatlannak bizonyult a diagnosztizálásra, ezért feltehető, hogy a TPT mérések a jövőben kiválthatják az izotópos vizsgálatokat [41-44]. A kis epikardiális méretű, EKG-val általában
nem vagy nehezen detektálható eltérések vizsgálatában Medvegy és munkatársai jelentős eredményeket értek el a nem Q típusú miokardiális infarktus jellegzetességeinek – a potenciál- kiesések helyeinek - maghatározásában izopotenciál térképekkel [45-48]. A TPT nagy jelentőséget vívott ki magának egyéb hirtelen szívhalált okozó aritmia rizikófaktorok - pl. a kamrai utópotenciálok- kimutatásában és lokalizációjának meghatározásában is [49, 50].
Korán felismerték a kutatók, hogy nagy jelentősége van a normál populáció statisztikai vizsgálatának, hiszen kicsi vagy nehezen lokalizálható eltérések esetén a patológiás állapot jeleit, diagnosztizálásának kritériumait, csak az egészségesek - célszerűen nagy populációra vonatkoztatott – normál tartománya ismeretében lehet szignifikánsam megadni. Több publikáció is született egészséges gyermekek [26, 51, 52] és felnőttek nyugalmi [53-56] valamint terheléses [57] vizsgálataira vonatkozólag. Kozmann, Green, Lux, valamint munkatársaik meghatározták a TPT technika diagnosztikai teljesítményét, valamint a normál populáció nem, életkor, magasság és súly szerinti TPT variabilitását [58-60]. A fent említett tanulmányokra épülve számos diagnosztikai kritérium született, de az eredmények összevetését, valamint a szignifikancia szint növelését a kis validált mintaelemszám és az eltérő mérőrendszerek használata nem, vagy csak korlátozottan teszi lehetővé.
2.2.1 Mérőrendszerek
A TPT elvezetés-rendszerek jellemzően elszigetelt kutatócsoportok munkái alapján alakultak ki.
Magyarországon az 1970-es évek közepén jelent meg az első testfelszíni potenciál-térképező rendszer az Orvostovábbképző Intézet és a KFKI Bioelektronikai Osztályának közös fejlesztésében: előbb 19, 35, majd 67 és 120 elvezetést használtak. A rendszer az elektromos jeleken kívül gyorsulási adatokat is rögzített. [61]. A ma használt mérőrendszereknek nincs egységes szabványuk, az elvezetés számát, azok lokalizációját, vagy pedig méréstechnikai tulajdonságaikat tekintve sem. A párhuzamosan használt elektródaelvezetések mérési eredményeinek redundanciáját, illetve az adatredukció lehetőségeit is szükséges volt elemezni. A használt elvezetések száma jelenleg általában 24-256-ig, a mintavételi frekvencia pedig 500-2048Hz-ig terjed [33, 73, 77, 79-85]. A mérőrendszerek közül néhányat a melléklet részletez.
A mérésekhez általában egyszer-használatos Ag/AgCl elektródát használnak, mivel kedvező stabilitási és polarizációs tulajdonságai vannak, így biztosítja a megfelelő jel-zaj viszonyt. A kapacitív elektródák paraméterei nem kielégítők. Az elektródák átmérője befolyásolja a prekordiális jelek amplitúdóját [86], így ma jellemzően 8 mm átmérőjű elektródák használatosak. Elektródákat (egy-két kivételtől eltekintve) a mellkasi (anterior) és a háti (posterior) oldalon is elhelyeznek, ezzel térben nagyobb spektrumot fednek le a potenciál-eloszlásból, mint a standard EKG. Az analóg/digitális (AD) konverziót illetően a TPT rendszerek pontossági igénye legalább 9 bit [87], az alkalmazott rendszerek ezt a korlátot általában figyelembe veszik, hiszen a használt AD konverzió 8-16 bites, ami megközelítőleg 10μV-os felbontást tesz lehetővé. Az adattároló és feldolgozó rendszereket on-line erősítés, multiplexelés jellemzi, jellemzően kis zajú mérő-erősítőket alkalmaznak.
A hálózati zajok, elektromágneses zavarok szűrésére általában lyukszűrőt, simító eljáráson alapuló módszert, Fourier transzformációs vagy regressziós eljárást, továbbá EKG jelátlagolási technikákat használnak [88, 89]. A mérés- és számítástechnika fejlődésével lehetővé vált a hosszú, jó minőségű sokcsatornás felvételek tárolása és analízise is, ennek ellenére a vizsgálatok sok esetben egy szívciklushoz tartozó felvételekre korlátozódnak, amit nyugalmi vagy terheléses vizsgálat során készült reprezentatív mintának tekintenek.
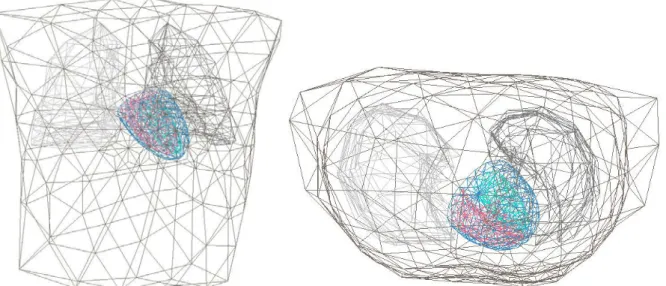
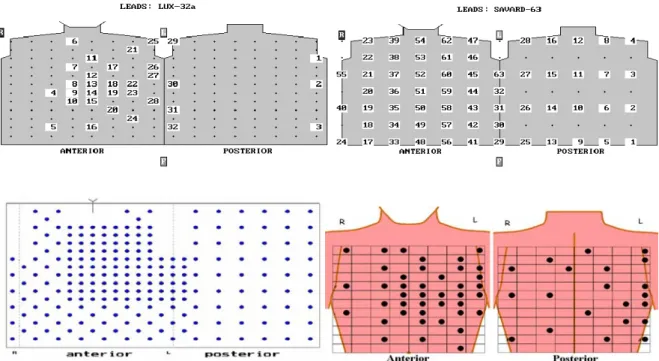
6. ábra A disszertációban használt elvezetés-rendszerek elektróda-elrendezései. Fent 32 elvezetéses Lux 32a (jobbra), 63 elvezetéses Savard (balra). Lent a 219 elvezetéses pármai (balra), Budapest-MARK8 hardver alapú 64 csatornásra
bővített Lux -32 rendszer. R: jobb kéz, L: bal kéz. [74, 75, 248]
A készülék és mérési rendszerek fejlesztése mellett az 1970-es évek végétől beindult a statisztikai adatgyűjtés majd a döntéstámogató rendszerek fejlesztése is. Ez többek között segítette az olyan betegségek diagnosztizálását, mely hagyományos EKG-val le nem fedett helyen, illetve közel a mérési zaj tartományában regisztrálható (pl. a hirtelen szívhalál egyik előfeltételeként számon tartott kamrai utópotenciálok mérése).
Eltérő méréstechnikájú TPT rendszerek alakultak ki az idő folyamán, melyek felhasználásából nyert eredmények egymással történő összevetése számos új kérdést, ezáltal kutatási irányt vetett fel: az elektródák számának és lokalizációjának problémakörében [62-65], általános diagnosztikai érvényű elvezetés-rendszer kutatásában [65,], tömörítési eljárások kidolgozásában [70], a mérőrendszerek közötti adatkonverzió és egységes adatbázis kialakításának problémakörében [67, 68, 71, 72].
Lehetőleg mindezeket úgy megoldva, hogy a kinyerhető diagnosztikai teljesítmény maximális legyen.
Érdekesség, hogy bár számos előnye ismert a TPT rendszereknek, a világszerte meglévő egyedi és több helyen használt rendszerek közül mind a mai napig egyedül Japánban vált a TPT megvalósítása rutinszerű klinikai alkalmazássá [73], a legtöbb helyen kiegészítő vagy kísérleti rendszerként üzemel.
Az alkalmazott elvezetések kiválasztása
A Shannon-Nyquist tétel kimondja, hogy a sávhatárolt analóg jelből képzett digitális jel esetén a maximális frekvenciakomponensnél legalább kétszer nagyobb mintavételi frekvenciát kell alkalmazni a megfelelő mintavételhez. Az EKG sávhatárolt jel általában a 0-100Hz tartományban, a kamrai utópotenciál jel, ami pedig az egyik legnagyobb frekvenciájú jel közé tartozik a 40-250Hz tartományban található jeleket generál. Éppen ezért a fenti feltételnek az EKG mérés eleget tesz, amennyiben legalább 500Hz a mintavételi frekvencia. Informatikai szempontból a térbeli mintavételezés megfelelő reprezentációjához a megközelítőleg 3cm-es elektródatávolság lenne elegendő, ez ekvidisztáns elvezetésre és normál testalkatra vonatkoztatva ez közel 200 elektródát jelent. A térbeli mintavételezést elsősorban empirikus közelítéssel, mérőcsoportonként végezték, de a legtöbb elvezetés-rendszer a fenti feltételt nem teljesíti. A jelenlegi legjobb közelítést a nem- ekvidisztáns elrendezésű Parma rendszer jelenti [61].
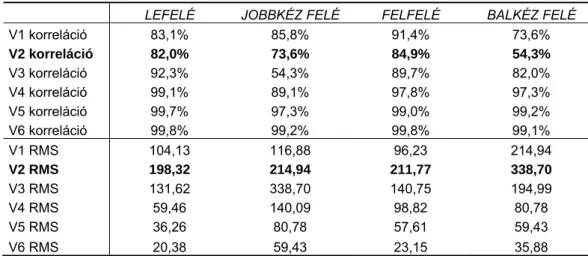
A nyolcvanas években – a számítástechnika kezdeti térnyerésekor - kulcskérdésnek számított a térben jól elhelyezett kevés (limitált) elektródaszám meghatározása, valamint a megfelelő adattömörítési eljárások használata, a redundancia csökkentése. Az elvezetés-szám csökkentése nem a kutatók, hanem a klinikusok munkájának megkönnyítését célozta. A cél: úgy csökkenteni az elvezetés számát, hogy az elvezetések egyedi információi megmaradjanak és a diagnosztikailag fontos információt a rendszer tartalmazza. 25-50 elvezetéssel kívánták úgy reprezentálni a potenciálteret, hogy az méréstechnikai és felhelyezési egyszerűsítéssel, de a patológiás állapotok jellegzetességeinek megfelelő rekonstrukciójával járjon együtt. Ebből a gondolatból kiindulva Barr és munkatársai, valamint Lux javasolta az ún. „limited lead system” használatát [77, 78]. Az alábbi kérdésekre keresték a választ: Hány felszíni elektróda szükséges egy előre definiált pontosság eléréséhez? Mi ezeknek az elektródáknak a helyzete (lokalizációja) és mennyire érzékeny a becslési hiba a különböző elektróda elrendezésre különböző patológiai eseteknél. A 192 elvezetéses (12x16 grid) potenciál- térképező rendszerből kiindulva kerestek egy olyan részhalmazt, melyre vonatkozó transzformációs mátrix legjobban tudta közelíteni a teljes elvezetés-rendszert. Közel 11000 térképet feldolgozva alkotta meg a róla elnevezett Lux-32 elvezetés-rendszert, melyben dominálnak a mellkasi elvezetések.
A 192 elvezetésre történő rekonstrukció hibája átlagosan 32μV, a korreláció átlaga 0.983 volt, a jel zaj arány (signal to noise ratio, SNR) 3.5%-nak adódott. Az elvezetés-rendszer tartalmazza a standard 12 elvezetéses EKG mérési pontjait is.
TPT adattömörítés Karhunen-Loeve eljárással
A számítástechnikai eszközök kezdeti korlátozott adattárolási kapacitása miatt az adattömörítés megoldása volt a következő kulcskérdés. A tér és időbeli TPT adat redukciójára a Karhunen-Loeve (KL) sorfejtés módszerét Lux és Evans vezette be [69, 70]. Matematikailag belátható, hogy bármely térkép egy mintavételi pillanatban előállítható ortonormális eloszlások súlyozott összegével, amire alkalmazható a KL véletlen folyamatokra vonatkozó sorfejtés. Lux és munkatársai 221 páciens közel
30000 TPT időpillanatának adatait felhasználva bizonyították, hogy az első 12 darab KL komponens már a populáció össz-varianciájának közel 98%-át tartalmazza. A térképek komplexitása a sajátérték csökkenésével növekszik, az első három térkép határozottan dipólus jelleget mutat, a többi multipoláris. A KL paraméterekből létrehozható a az ún. dipolaritási, valamint az általam is használt nondipolaritási index (NDI). Ez az változó érzékletesen mutatja a heterogenitás eloszlás időbeli változását emiatt alkalmas a malignus arritmiák feltérképezésére[99-101], de cserében a tömör ábrázolásért a módszer térbeli lokalizációra alkalmatlan és ebből az eredeti jel már nem állítható elő.
Nondipolaritási index alatt tehát az
∑
∑
=
= 12=
1 2 12
4 2
i i i
i QRS
KL KL NDI
függvényt értjük, ahol KLi a QRS integrál térbeli tömörítéséből számított sajátvektorok sajátértéke (QRST esetére hasonlóképpen megadható).
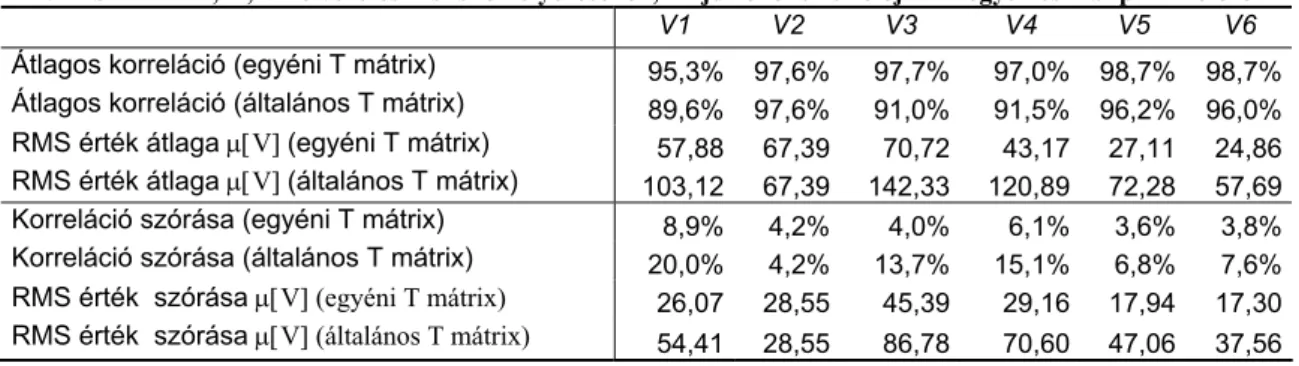
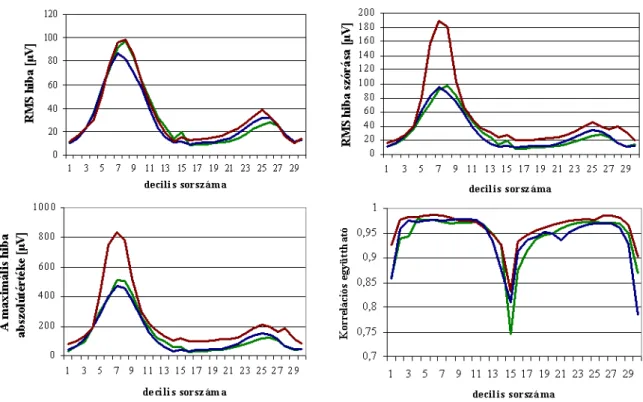
További tömörítés érhető el, ha nem csak a térbeli, hanem az időbeli sajátvektorok esetén is használjuk a fenti módszert. A QRS és STT szakaszok eltérő hullám és élettani (depolarizáció repolarizáció) tulajdonságait figyelembe véve, az időnormalizált hullámokra külön-külön újabb 12 illetve 6 saját- vektort határoztak meg, a QRS és STT egyaránt 150 időpillanatra történő (kvadratikus interpolációt használó) normalizálását követően. A térbeli és időbeli sajátvektorok használatával a teljes QRST 1 ciklusa 216 koefficienssel ábrázolható, ami 20-szoros adatcsökkenést jelent, de adatvesztéssel, ezáltal diagnosztikai információ vesztéssel jár. Ennek mértékére azonban csak egy általános – patológiás állapottól független - hibaértéket adtak meg (négyzetes hibaérték- RMS 45 μV), mely nem jellemzi jól a hullámalak időbeli és térbeli megváltozásainak sajátosságait. Mivel a Deszki Mellkasi Betegségek Szakkórházában tárolt adatok ilyen tömörített formában álltak rendelkezésemre, meg kellett határoznom az eljárás egészséges és normál populációra vonatkoztatott hibaértékeit térben és időben.
(ld. 3.3. fejezet). Ma már a számítástechnikai és adattárolási eszközök megfizethetők, a tárolási kapacitás elég nagy, így elvárás, hogy sok csatorna és hosszú felvétel esetén is veszteségmentesen tároljuk az adatokat.
TPT rendszerek közötti adatkonverzió, szabványosítási törekvések
A sokféle diagnosztikai probléma mellett a már kidolgozott módszerek sem gyorsítják a testfelszíni potenciáltérképezések szabványosítását úgy, ahogy az a 12 elvezetéses rendszerrel történt. Az egyedi mérőállomások magas költséggel épültek ki, általában nem bővíthetőek és jellemzően valami célfeladatot látnak el, ráadásul az adatok mérés és információ-technológiai eljárásai igen eltérőek. Az összevont adatbázisok kialakítása azonban mérhető hibákat generál, a járulékos „átszámítási zaj”
elfedheti a diagnosztikai-információt [72]. Több nemzetközi projekt kezdődött olyan nagy validált adatbázisok létrehozására, az adatformátumok egységesítésére, melyek a statisztikai osztályozás és döntéstámogatás elősegítéséhez elegendő validált minta elemszámot biztosítják [67, 92]. Ezen
projektek és Hoekma vizsgálatai is azt eredményezték, hogy a 64 csatorna elegendő a legtöbb kardiológiai patológiás állapot feltárására és megfelelő diagnosztikai információt tartalmaz [66]; ezért a testfelszíni potenciáltérképezésben, mint standard bevezetése javasolt. Ennek ellenére nincs előrelépés a TPT szabványosítási törekvéseiben. A TPT rendszerek között adatkonverzió tehát lehetséges, de diagnosztikai szempontból fontos információ elvesztésével járhat. [72, 90, 91].
2.2.2 A testfelszíni potenciáltérképek validitása
A döntéstámogató rendszerek kialakítása, a használhatósági kritériumok validálása nehéz feladat. A testfelszíni potenciáltérképek statisztikai osztályozási kritériumainak kidolgozására nagyszámú, homogén, klinikai értelemben pontosan besorolt páciens adatára van szükség. Csak így lehet megbízhatóan - statisztikai módszerekkel- bizonyítani az egyes patológiás állapotok bioelektromos eltérései és a testfelszíni potenciálok közötti összefüggést, valamint megállapítani az egyes diagnózisokat egymástól jól szeparáló paramétereket. A kardiológiai patológiás eltérések egy számottevő hányadánál a kritériumok validálása EKG független evidenciák alapján kell, hogy történjen, ami természetesen erre alkalmas adatbázisok létrehozását igényli. Rendszerint labor adatok, kérdőíves kikérdezés (szimptómák és rizikófaktorok) eredményei, EKG, terheléses EKG, tallium izotópos (Tl201) vizsgálat eredménye, angiográfia és koronarográfia támasztják alá a klinikai diagnózist [231]. Elmondható hogy ennek a kritériumnak igen kevés adat tesz eleget és manapság ez a TPT módszer széleskörű klinikai alkalmazásának egyik legfőbb akadálya.
A disszertációban használt mérési eredmények, így a Pármai Egyetemen, az Utah Egyetem kórházában (későbbiekben mint CVRTI adatbázis) a és a deszki Csongrád Megyei Önkormányzat Mellkasi Betegségek Szakkórházában, az Országos Gyógyintézeti Központban, valamint az MTA MFA Biomérnöki Osztályán mért adatok mind validáltak. A validáláshoz használt kvalitatív és kvantitatív adatok alapján a patológiás állapotok klinikai diagnosztikai besorolását kardiológusok végezték, annak mélysége eltérő lehet. Patológiás állapotokon túlmenően egészséges személyek adatait is felhasználtam. Ebben az esetben – mivel az invazív eljárások kockázattal járnak, csak a szimptómák kerültek rögzítésre, laborleletek és EKG alapján lettek validálva. Egészséges (normál, negatív): akiknek kórelőzményében nem szerepelt semmilyen kardiológiai megbetegedés, valamint a vizsgálatok sem mutattak ki eltéréseket. Az ennek megfelelően definiált klinikailag homogén patológiás és normál validált csoportokat használom téziseim alátámasztására. A validáláshoz felhasznált adattípusokat és paramétereket a melléklet tartalmazza [92].
2.2.3 Testfelszíni potenciáltérkép ábrázolások
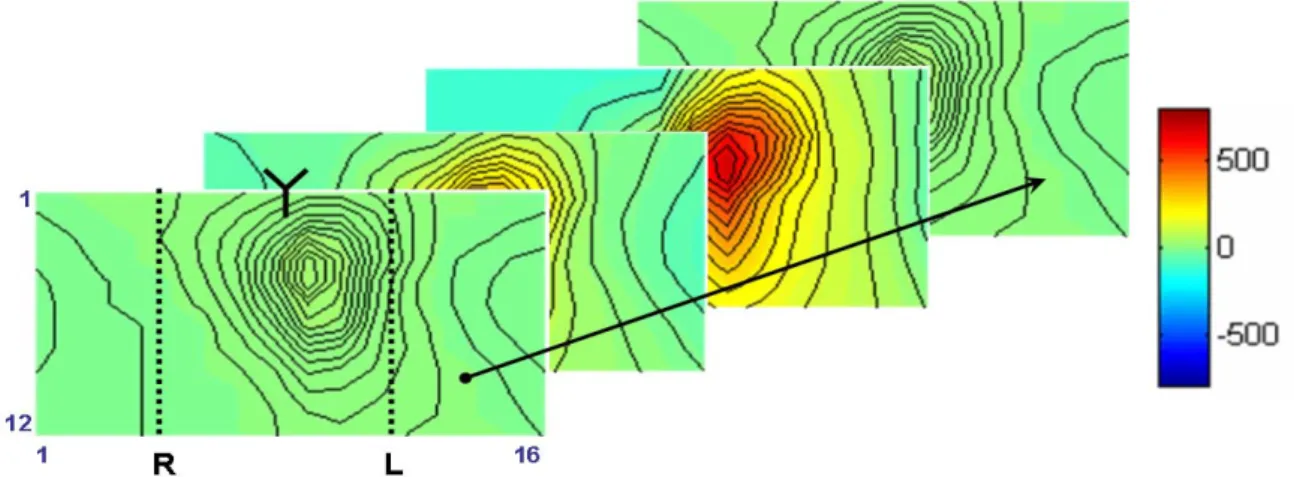
A szívciklus minden egyes mintavételezett ciklusa megjeleníthető az időpillanatok sorozataként, vagy tömörített alakban, a megjelenítés jellemzően mátrix-szerű, számítógépes alapú real-time rendszerű.
[191, 192]. Az ábrázolt pillanat vagy intervallum potenciál-értékeit reprezentáló eloszlást úgy kell elképzelni, mintha a test, mint hengerre vonatkozó jeleket a síkba kiterítenénk. A térkép középvonala jelen dolgozatban mindig egybeesik a szegycsont vonalával, a térkép felső széle a sternal notch (szegycsont) az alsó pedig a köldök vonalában található. A térkép két széle a háti oldalt reprezentálja, legszélén a gerincvonallal. A térképek jellemzően téglalap alakúak, az általam használt rendszer 12x16-os, minden egyes rácspontnak egy elektróda-elvezetés felel meg. A potenciál-térképek megjelenítésekor kulcskérdés általában a nem mért területek (elektródák) jeleinek becslése, amit jellemzően vagy becsléssel származtatnak, vagy lineáris interpolációval számolnak a környező elektródák mért értékeiből. Léteznek ma már háromdimenziós (3D) ábrázolások, melyek a test felszínén mérhető potenciál-eloszlás változásból származtatják és ábrázolják – akár a páciens saját torzómodelljén- az epikardiális potenciál változásait az idő függvényében [93-95]. A következő részben bemutatott térképábrázolásoknak kutatási és klinikai felhasználásai is ismeretesek, valamint ezen túlmenően bármely két azonos tartalmú térképből különbségtérképek képezhetők, melyet Flowers és munkatársai vezettek be az egészséges kontrollcsoport és a miokardiális infarktusos betegek QRS integrál térképének összehasonlítására [181].
Izopotenciál pillanattérképek
Az izopotenciál vonalak jelentése: azonos értékű potenciál. Ezeket általában egy vonallal vagy azonos színnel (vagy ezek kombinációjával) szokás jelölni. Pillanattérképek megjelenítésére vezetési zavarok és szívszövet hibák detektálásánál is szükség van, mert az aktiváció sorrendje mintázatának változásából többféle patológiás állapot diagnosztizálható. Ha pillanattérképek sorozata áll rendelkezésünkre, akkor a pillanattérképek egy fix elvezetési pontjában az egymást követő térképekből egy elvezetés EKG-ja adódik (ld. 7. ábra).
QRS és QRST integrál térképek
Az akcióspotenciál tulajdonságoknak közvetlen vizsgálatára általában nincs lehetőségünk, de annak tulajdonságait noninvazív módon jellemző paraméter vizsgálata lehetséges, azaz van lehetőségünk a normálistól eltérő akcióspotenciálok kimutatására a szívizomban. A szív elektrofiziológiája egyes tulajdonságainak a QRS, vagy a QRST integrál térkép paraméterek, mint tömörített ábrázolások, egyértelműen megfeleltethetők [22, 114].
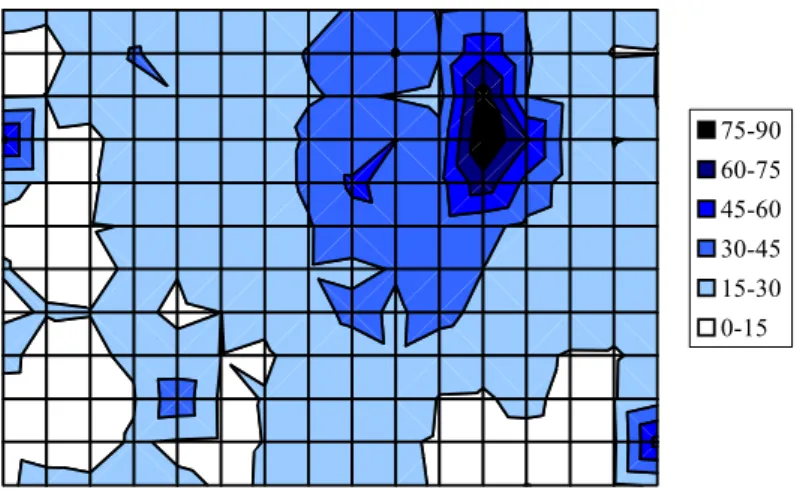
7. ábra Részlet az izopotenciál testfelszíni potenciáltérképek idősorozatából 192 elvezetéses rendszerben (12 sor és 16 oszlop rácspontjaiban mért és interpolált jelek). Felül a szegycsont (középen), alul a köldök vonaláig ér, szaggatott vonallal a jobb (R) és bal (L) hónalj vonala látható. Azonos potenciál-értékű helyek egy színnel és vonallal összekötötten ábrázoltak A nyíl mentén levő pontokban az adott elvezetés elektrokardiogram időfüggvénye (EKG-ja) mérhető. Adatok μV-ban értendők.
Valamely testfelszíni pontra számított QRST integrál értéke (QTint) forrás szinten a nyugalmi potenciálhoz, mint alapvonalhoz viszonyított akcióspotenciál alatti területek helyfüggő eltéréseitől függ. Spach igazolta, hogy a QRS integráltérkép (QRSint) egy érzékeny módszer az aktivációs szekvenciában bekövetkező rendellenességek vizsgálatára [187], majd további vizsgálatok bizonyították, hogy az izopotenciál térképek alkalmasak a miokardiális infarktus helyének és méretének feltárásában [196]. Kísérletek igazolták továbbá, hogy a miokardiális infarktuson átesett ventrikuláris tachycardia epizódokat nem mutató és a ventrikuláris tachycardiát átélt csoportok szeparálása, QRST integráltérkép (tehát a szívizom „súlyozott” elektromos inhomogenitását jellemző térkép) alapján lehetséges [194].
A QRS integrál biofizikailag a celluláris szintű elemi áramdipólus vektoroknak, a QRST integrál pedig az egyes sejtek akciós potenciálja alatti területeket leíró vektor skalár függvényből számítható gradiens vektoroknak a lead-field vektorokra eső vetületét összegzi a teljes kamrai izomzatra. A QRS integrál tartalmilag az (epi/endocardiális) aktivációs szekvencia lead-vektorral súlyozott képét mutatja.
Kísérletes vizsgálatokból ismert, hogy az akciós potenciál idő-integrál gradiens szíven belüli eloszlásának „inhomogenitása” a veszélyes aritmiák kialakulásának feltétele. Noninvazív módon ennek kimutatására elvileg a QRST integrálok a legalkalmasabbak.
∫
Φ=
QRS
dt t k l P k
l
QRSint( , ) ( ( , ), ) , illetve =
∫
ΦQRST
dt t k l P k
l
QTint( , ) ( ( , ), )
A QRST integráltérkép (elvileg) invariáns a szívizom-aktiváció sorrendjére, amennyiben az akciós potenciál nem változik. Ebből következik, hogy pl. valamilyen miokardiális infarktus vagy ischemia QRST integrál térképe azonos a normál, vagy kóros ingerületvezetésű páciensek esetén is. Ez jelentős információ kombinált szívbetegségek diagnosztizálásában. Az életveszélyes aritmiák keletkezésének az egyik szükséges, de nem elégséges feltétele az akcióspotenciálok (AP) elektromos inhomogenitása, ami alatt az értendő, hogy a szívizom valamely régiójában a fiziológiásnál szignifikánsan nagyobb az
![1. Táblázat Egyes emberi szövetek ellenállása és vezetőképessége Szerv, szövet Ellenállás ρ [Ωm] Vezetőképesség [S/cm]](https://thumb-eu.123doks.com/thumbv2/9dokorg/871812.46885/31.892.262.672.842.986/táblázat-emberi-szövetek-ellenállása-vezetőképessége-szövet-ellenállás-vezetőképesség.webp)
![9. ábra Numerikus kardiológiai modell rétegei és egyszerűsített akciós potenciálja [214]](https://thumb-eu.123doks.com/thumbv2/9dokorg/871812.46885/38.892.239.705.376.665/ábra-numerikus-kardiológiai-modell-rétegei-egyszerűsített-akciós-potenciálja.webp)