A kardiovaszkuláris rizikó és a C4B gén hiányos haplotípusok közötti kapcsolat mechanizmusának
vizsgálata
Doktori értekezés
Bánlaki Zsófia
Semmelweis Egyetem
Molekuláris Orvostudományok Doktori Iskola
Témavezető: Prof. Füst György
Hivatalos bírálók: Dr. Papp Krisztián Dr. Pós Zoltán
Szigorlati bizottság elnöke: Prof. Ligeti Erzsébet Szigorlati bizottság tagjai: Dr. Vásárhelyi Barna
Dr. Prechl József
Budapest
2012
2
TARTALOMJEGYZÉK
RÖVIDÍTÉSEK JEGYZÉKE ... 4
1 IRODALMI ÁTTEKINTÉS ... 7
1.1 AZ MHC RÉGIÓ ÉS A NÉVADÓ FEHÉRJÉK ... 7
1.1.1 A régió jellemzői ... 7
1.1.2 A klasszikus MHC molekulák ... 8
1.1.3 Az MHC fehérjéket kódoló gének nomenklatúrája ... 10
1.1.4 Az MHC régió egyéb, az immunrendszer működését szabályozó génjei ... 11
1.2 ŐSI MHC HAPLOTÍPUSOK ... 12
1.2.1 Az ősi haplotípus fogalma ... 12
1.2.2 Ősi MHC haplotípusok és különböző kórképek kapcsolata ... 13
1.2.3 A tagSNP fogalma ... 14
1.3 AZ RCCX MODULÁRIS STRUKTÚRA... 14
1.3.1 Az RCCX szerkezet felépítése, alkotói ... 14
1.3.2 Egyenlőtlen átkereszteződések az RCCX struktúrán belül ... 16
1.3.3 RCCX szerkezeti variációk ... 17
1.4 A 4-ES KOMPLEMENT KOMPONENS ... 17
1.4.1 A C4 fehérje és funkciója ... 17
1.4.2 A C4 gén és fehérje variációi ... 19
1.4.3 C4 hiányos egyének ... 20
1.4.4 C4A*Q0 haplotípusok ... 20
1.4.5 C4B*Q0 haplotípusok ... 21
1.5 A 21-HIDROXILÁZ ENZIM ... 22
1.5.1 A 21-hidroxiláz enzim működése ... 22
1.5.2 A CYP21 aktív- és pszeudogén ... 23
1.5.3 A CYP21A2 gén szabályozó régiói ... 24
1.5.4 A hipotalamusz-hipofízis-mellékvese tengely ... 24
1.5.5 A HPA tengely és a stresszválasz kapcsolata ... 25
1.5.6 21-hidroxiláz hiányos állapotok ... 26
1.5.7 A 21-hidroxiláz és a kardiovaszkuláris rendszer ... 27
2 CÉLKITŰZÉSEK ... 28
3 ANYAGOK ÉS MÓDSZEREK ... 29
3.1 VIZSGÁLT SZEMÉLYEK ... 29
3.1.1 Az MHC haplotípusok és RCCX szerkezetek felméréséhez gyűjtött minták ... 29
3.1.2 A C4A és a C4B gének 35. intronbeli szekvenciájának összehasonlításához válogatott minták ... 29
3.1.3 A C4B*Q0 hordozás és a szteroid hormonszintek kapcsolatának vizsgálata során analizált minták ... 30
3.2 DNS IZOLÁLÁS ... 30
3.3 GENETIKAI ANALÍZISEK ... 31
3.3.1 HLA-tipizálás ... 31
3.3.2 SNP detektálás restrikciós fragmenthossz polimorfizmus (RFLP) technikával 31 3.3.3 SNP meghatározás TaqMan technikával ... 33
3.3.4 Génkópia-szám mérések ... 33
3.3.5 Allélspecifikus long PCR reakciók ... 35
3.3.6 A C4 gének 35. intronjának szekvenálása ... 37
3.4 A SZTEROID HORMONOK KONCENTRÁCIÓJÁNAK VIZSGÁLATA ... 38
3.4.1 Nyugalmi hormonszint meghatározások ... 38
3.4.2 ACTH stimuláció és dexametazon teszt ... 38
3.5 STATISZTIKAI ELEMZÉS ... 38
3.5.1 A magyarországi MHC haplotípusok és RCCX szerkezetek elemzése ... 38
3
3.5.2 A C4B*Q0 hordozás és a szteroid hormonszintek kapcsolatának vizsgálata ... 39
4 EREDMÉNYEK ... 40
4.1 MHC HAPLOTÍPUSOK ÉS A C4B*Q0 HORDOZÁS ... 40
4.1.1 A vizsgált SNP-k allélfrekvenciái ... 41
4.1.2 A vizsgált haplotípusok és összeillesztésük ... 41
4.1.3 A hazai kaukázusi populációban előforduló MHC haplotípusok ... 43
4.1.4 C4B gén hiányos MHC haplotípusok az egészséges kaukázusi populációban.. 45
4.1.5 A mintavételezés validálása ... 47
4.2 AZ RCCX MODULÁRIS SZERKEZET VARIÁCIÓI ... 50
4.2.1 C4 és CYP21 gének az egészséges kaukázusi populációban ... 51
4.2.2 A kaukázusi populációban előforduló RCCX szerkezeti variánsok ... 52
4.2.3 C4B gén hiányos RCCX szerkezeti variánsok ... 54
4.3 A C4 GÉNEK 35. INTRONJÁBAN TALÁLHATÓ TRANSZKRIPCIÓS FAKTOR KÖTŐHELY VIZSGÁLATA ... 54
4.3.1 A C4A és C4B gének 35. intronbeli bázissorrendjének összehasonlítása ... 55
4.4 A SZTEROID BIOSZINTÉZIS ÉS A C4B*Q0 HORDOZÁS ... 56
4.4.1 A C4B*Q0 hordozás összefüggése a nyugalmi hormonszintekkel ... 56
4.4.2 ACTH stimuláció utáni kortikoszteroid szintek és a C4B géndózis... 57
4.4.3 Homozigóta C4B*Q0 hordozók hormonszintjei ... 61
4.4.4 Dexametazon beadást követő kortikoszteroid szintek és a C4B géndózis ... 62
5 MEGBESZÉLÉS ... 64
5.1 MHC HAPLOTÍPUSOK ÉS RCCX STRUKTÚRÁK ... 64
5.1.1 Az egészséges kaukázusiak MHC haplotípusai és a C4B*Q0 hordozás ... 64
5.1.2 MHC haplotípusok előfordulása különböző kaukázusi populációkban ... 67
5.1.3 Az RCCX szerkezet variációi és a C4B gén hiánya ... 68
5.2 A C4 ÉS A CYP21 GÉNEK KAPCSOLATA ... 70
5.2.1 A C4 gének 35. intronjában található regulációs szekvenciák vizsgálata ... 70
5.2.2 A szteroid bioszintézis és a C4B*Q0 haplotípusok kapcsolata ... 72
6 ÚJ MEGÁLLAPÍTÁSOK, KÖVETKEZTETÉSEK ... 76
7 ÖSSZEFOGLALÁS ... 78
8 SUMMARY ... 79
9 HIVATKOZÁSOK ... 80
10 SAJÁT PUBLIKÁCIÓK ... 89
11 KÖSZÖNETNYILVÁNÍTÁS ... 90
4
RÖVIDÍTÉSEK JEGYZÉKE
ACTH: adrenokortikotrop hormon
AGER: /advanced glycation endproducts receptor/ késői glikációs végtermékek receptora
AVP: arginin-vazopresszin
AH: /ancestral halpotype/ ősi haplotípus C4: 4-es komplement komponens
C4A és C4A: A izotípusú C4 fehérje és génje C4B és C4B: B izotípusú C4 fehérje és génje
C4L: HERV-K(C4) szekvenciát tartalmazó (hosszú) C4 gén C4S: HERV-K(C4) szekvenciát nem tartalmazó (rövid) C4 gén C4A*Q0: C4A gén hiányos haplotípus
C4B*Q0: C4B gén hiányos haplotípus CAH: congenitalis adrenalis hyperplasia
CEH: /conserved extended haplotype/ konzervált kiterjesztett haplotípus CFB: /complement factor B/ B faktor
cM: centiMorgan
CR1: 1-es típusú komplementreceptor
CRH: /corticotropin-releasing hormone/ kortikotropin felszabadító hormon CYP21: 21-hidroxiláz
CYP21A1P: 21-hidroxiláz pszeudogén CYP21A2: 21-hidroxiláz aktív gén DNS: dezoxiribonukleinsav
dNTP: dezoxi-nukleozid-triszfoszfát
FAM: 520 nm hullámhosszon emittáló fluorofór HERV: humán endogén retrovírus
HLA: humán leukocita antigén
HPA (-tengely): /hypothalamic-pituitary-adrenal/ hypothalamus-hypophysis-mellékvese HSP: /heat shock protein/ hősokkfehérje
IHWG: International Histocompatibility Workgroup IL: interleukin
5 kb: kilobázis
LD: /linkage disequilibrium/ kapcsoltsági egyensúlytalanság LPS: lipopoliszacharid
LTA: limfotoxin-α
MASP: mannóz asszociált szerin proteáz Mb: megabázis
MBL: /mannose binding lectin/ mannózkötő lektin
MHC: /major histocompatibility complex/ fő szövet-összeférhetőségi komplex MR: mineralokortikoid receptor
NK-sejt: /natural killer sejt/ természetes ölősejt NKT-sejt: /natural killer T-sejt/ természetes ölő T-sejt NF-W2: nukleáris faktor W2
OR: /odds ratio/ esélyhányados
PCR: /polymerase chain reaction/ polimeráz láncreakció RCCX modul: RP-C4-CYP21-TNX génekből álló modul RIA: radioimmunesszé
RFLP: /restriction fragment length polymorphism/ restrikciós fragmenthossz polimorfizmus
RNS: ribonukleinsav
mRNS: messenger RNS
ROC (-analízis): /receiver operating characteristics/ vevő működési karakterisztikája RP: ld. STK19
RS szám: referencia SNP szám
SDS: /sodium-dodecyl-sulphate/ nátrium-dodecil-szulfát SLE: szisztémás lupus erythematosus
SF-1: szteroidogén faktor 1
SNP: /single nucleotide polymorphism/ egypontos nukleotid polimorfizmus SSO: szekvencia-specifikus oligonukleotid
SSP: szekvencia-specifikus primer
STK19 (korábban RP): nukleáris szerin-protein kináz SV: /simple virilizing/ a CAH egyszerű virilizáló formája SW: /salt wasting/ a CAH sóvesztő formája
6 TNF: tumornekrózis-faktor
TNX: tenaszcin-X extracelluláris mátrixfehérje T1D: 1-es típusú cukorbetegség
UV: ultraviola
VIC: 545 nm hullámhosszon emittáló fluorofór
7
1 IRODALMI ÁTTEKINTÉS
1.1 AZ MHC RÉGIÓ ÉS A NÉVADÓ FEHÉRJÉK 1.1.1 A régió jellemzői
Az MHC régió (major histocompatibility complex, fő szövet-összeférhetőségi komplex) a humán genom egyik génekben leggazdagabb és legtöbbet tanulmányozott része. Az itt kódolt fehérjék döntő többsége az adaptív illetve a természetes immunrend- szer résztvevője, így a terület kiemelkedő jelentőséggel bír mind a gyulladásos folyama- tok, a patogének elleni küzdelem, az autoimmunitás és a szervátültetés szempontjából.
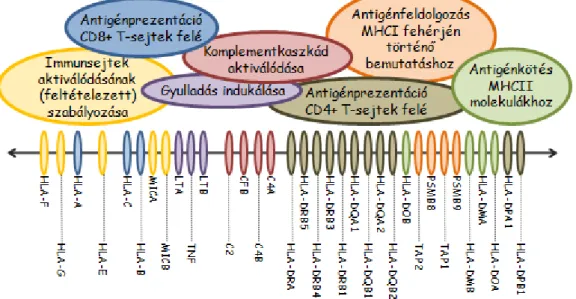
A régió a 6. kromoszóma rövid karján (6p21.3) található és egy 7,6 Mb hosszúságú szakaszt ível át. Öt fő egységre tagolódik: a három klasszikus MHC régióra (MHCI-III), valamint az ezeken 5’-, illetve 3’-irányban túlnyúló területekre. A klasszikus MHCI régió a teloméra, az MHCII a centroméra felé esik; közöttük foglal helyet a centrális MHC (MHCIII) (1. ábra). A kiterjesztett MHC régió összesen 421 lókuszt tartalmaz, melyek közül 252-ről fejeződik ki fehérjetermék, további 30-ról csupán RNS transz- kriptum keletkezik, 139 lókuszt pedig pszeudogénként tartanak nyilván [1].
1. ábra: Az MHC régió és a névadó fehérjék
8 1.1.2 A klasszikus MHC molekulák
A terület névadó molekuláját, az MHC-t a szövet- és szervátültetések kapcsán fedezték fel, mint a transzplantációt követő kilökődési reakciók elsődleges okozóját. A fehérjék valódi szerepe az adaptív immunválasz kialakulásához nélkülözhetetlen T- sejtek számára történő antigén-prezentáció. Az ember esetében az MHC fehérjéket HLA (human leukocyte antigen, humán leukocita antigén) néven is szokás említeni [2].
2. ábra: Az MHC molekulák doménszerkezete és peptidkötő zsebeik felülnézeti modellje (A doménszerkezetes ábrák Klein közleménye alapján [3] készültek; a szalagmodelles ábrák
készítője: Ermanno Gherardi, Paviai Egyetem)
Szerkezetüket tekintve az MHC molekulák az immunglobulin szupercsaládba tartozó heterodimer transzmembrán glikoproteinek. Két osztályba sorolhatók; ezek az MHCI és az MHCII (2. ábra). Az I-es osztály tagjai az öt domént tartalmazó, erősen polimorf α-láncból (nehézlánc) és annak α3-doménjével nem-kovalensen kapcsolódó konzervált β2-mikroglobulinból (könnyűlánc) állnak, az MHCII molekulák pedig két különböző, egyenként négy doménből felépülő és egymáshoz nem-kovalens módon
9
kötődő polimorf polipeptidláncból (α- és β-lánc) [4, 5]. Míg az MHCII fehérjék mindkét polipeptidlánca az MHCII régióban kódolt (HLA-DP, -DQ, -DR gének), az MHCI molekulák esetében csupán a polimorf α-lánc gének (HLA-A, -B, -C) találhatóak az MHCI régióban, a β2-mikroglobulin génje a 15. kromoszómán helyezkedik el. Bár a két osztály tagjainak felépítése jellegzetesen eltér, térbeli struktúrájuk igen hasonló. Mind a kettő tartalmaz egy két domén alkotta peptidkötő árkot, transzmembrán régiót és cito- plazmatikus farokrészt, amely a jelátvitelben szerepel. Az MHCI molekulák kizárólag meghatározott hosszúságú, 8-10 aminosavból álló peptidek bemutatására alkalmasak, mivel a kötőhelyük két végén elhelyezkedő ún. konzervatív aminosavak a peptidek terminális amino- illetve karboxicsoportjaival hoznak létre hidrogénhíd-kötéseket. Ezzel szemben a II-es osztály tagjai ún. nyitott peptidkötő hellyel rendelkeznek, amely változatos hosszúságú peptidláncokat is képes fogva tartani [6].
Az MHCI fehérjék a vörösvértestek kivételével gyakorlatilag minden testi sejten kifejeződnek és a citotoxikus T-sejtek felé prezentálják a fogva tartott, döntően endogén eredetű peptideket. Jelentőségük elsősorban a vírussal fertőzött illetve a tumoros sejtek elleni védekezésben áll. Az MHCII molekulák rendes körülmények között egyedül a hivatásos antigénprezentáló sejteken vannak jelen és az immunválasz szabályozásában játszanak fontos szerepet, mivel exogén eredetű peptideket mutatnak be a helper T- sejtek számára [3]. Amennyiben a T-sejt akár magát az MHC molekulát, akár a peptidet idegenként ismeri fel, aktiválódik, és közvetve vagy közvetlenül hozzájárul az idegen ágens eliminálásához [6].
Az MHC fehérjék peptidkötésért felelős polipeptidláncainak génjei igen nagyfo- kú polimorfizmust mutatnak, az egyes MHC allotípusok pedig eltérő kémiai sajátságú peptideket képesek megkötni. Így más-más kórokozókkal szemben tudják a leghatáso- sabb védelmet biztosítani, ami igen lényeges a populáció hosszú távú fennmaradása szempontjából [7]. Emellett az MHC molekulák polimorf láncait kódoló gének kodomináns öröklésmenetéből kifolyóan egyetlen sejten akár hat különböző MHCI-, és még több MHCII fehérje is kifejeződhet, ami az egyed szintjén is növeli a patogénekkel szembeni ellenállóképességet [6].
10
1.1.3 Az MHC fehérjéket kódoló gének nomenklatúrája
Történeti okokból kifolyólag a HLA-allélok nevezéktana meglehetősen bonyolult és összetett. A HLA-tipizálást korábban főként szerológiai módszerrel, limfocita- citotoxicitási teszttel [8] végeztek, ezt az eljárást azonban egyre inkább kiszorítja a DNS szintű meghatározás. Utóbbi révén az adott allélról igen részletes információ nyerhető; a részletesség a konkrét technika megválasztásától függ. Elterjedten alkalmazzák mind a PCR-SSP (szekvencia-specifikus primer), mind a PCR-SSO (szekvencia-specifikus oligonukleotid) hibridizációs eljárást. Előbbi lényege, hogy az egyes primerek enzimati- kus meghosszabbítása csak akkor következik be, ha a templát DNS az adott primer 3’- végével tökéletesen komplementer szekvencia-szakaszt tartalmaz, míg a PCR-SSO technika során a már amplifikált DNS szakaszt hibridizáltatják különböző oligonukleo- tidokkal [9, 10].
Az egyes HLA-allélokat eleinte a felfedezésük időrendi sorrendjének megfele- lően nevezték el, ám az egyes tipizálási módszerek eltérő felbontóképessége és a HLA- allélok nagyfokú diverzitása miatt utólag számos alléllal kapcsolatban kiderült, hogy az voltaképpen egy több szubtípust (vagy „split” antigént) is magába foglaló, „szélesen”
reagáló („broad”) antigént takar (1. táblázat) (www.ebi.ac.uk/imgt/hla).
1. táblázat: Szuballélokkal rendelkező HLA-allélok
Allél Szuballélok Allél Szuballélok
A9 A23, A24 B21 B49, B50
A10 A25, A26, A34, A43, A66 B22 B54, B55, B56
A19 A29, A30, A31, A32, A33, A74 B40 B60, B61
A28 A68, A69 B70 B71, B72
B5 B51, B52 DR2 DR15, DR16
B12 B44, B45 DR3 DR17, DR18
B14 B64, B65 DR5 DR11, DR12
B15 B62, B63, B70, B71, B72, B75, B76, B77 DR6 DR13, DR14
B16 B38, B39 DQ1 DQ5, DQ6
B17 B57, B58 DQ3 DQ7, DQ8, DQ9
11
1.1.4 Az MHC régió egyéb, az immunrendszer működését szabályozó génjei
A klasszikus MHC molekulákon túl az MHC régióban számos egyéb, immuno- lógiai szempontból kiemelkedő jelentőségű protein is kódolt (3. ábra) [1]. Az MHCI régióban található nem-klasszikus MHCI gének termékei például a sejtes immunitásban töltenek be szabályozó szerepet, a közéjük tartozó HLA-G fehérje terhesség alatt tölt be fontos szerepet a szövetidegen magzat kilökődésének megakadályozásában [11]. Az MHCII régió több, az antigén-prezentációhoz nélkülözhetetlen gént tartalmaz. A PSMB (korábban LMP) génekről keletkező fehérjék az ún. immunproteaszóma részei [12]. Ez az enzimkomplex a citoszólban degradálódó fehérjéket az MHC molekulák kötőhelyébe illeszkedő peptidekre hasítja. Utóbbiakat a TAP gének termékei pumpálják a citoplaz- mából az endoplazmatikus retikulumba. A HLA-DM gének által kódolt heterodimerek az MHCII molekulák peptidkötése során töltenek be chaperon funkciót; működésüket a HLA-DO fehérje szabályozza [13]. Az MHCIII régióban kódolódik a komplement- kaszkád több eleme (C2, C4, B faktor), bizonyos gyulladásos citokinek (TNF-α, LTA), a MIC fehérjék, melyek feltételezhetően az NK-, NKT- és a γδ T-sejtek aktiválódását szabályozzák, továbbá például a 70 kDa hősokkfehérjék családjába tartozó Hsp70-2 és a késői glikációs végtermékek receptora (AGER) [1, 6].
3. ábra: Az MHC régió immunológiailag fontos génjei
12 1.2 ŐSI MHC HAPLOTÍPUSOK
1.2.1 Az ősi haplotípus fogalma
A kiterjesztett MHC régió egyik nevezetessége az itt megfigyelhető nagyfokú linkage disequilibrium (LD; „kapcsoltsági egyensúlytalanság”), ami által akár mega- bázisnyi (Mb) hosszúságú kromoszómaszakaszok öröklődhetnek generációkon át szinte változatlan formában. Az egyetlen őstől származó, az emberi evolúció korai időszaká- ban kialakult és azóta csupán minimális módosulásokon átesett, hosszú DNS szekven- ciákat „ősi” (ancestral haplotype; AH) vagy „konzervált kiterjesztett” haplotípusnak (conserved extended haplotype; CEH) is nevezik [14, 15].
A humán MHC régió esetében az ilyen konzervált szekvenciák hossza elérheti a 3,2 Mb-t, ugyanakkor a konzerváltság kiterjedtségének tekintetében lényeges különbségek adódnak az egyének között [16]. Ennek magyarázata az ún. befagyott blokkok létében áll, amelyeken belül szinte soha nem történik rekombináció, közöttük azonban előfordulhat. Az MHC régión belül négy ilyen klasztert említ az irodalom, amelyek a telomérától a centroméra felé haladva a következők: HLA-Cw/B-, TNF-, komplotípus- és HLA-DQ/DR-blokk (4. ábra) [17]. Ennek megfelelően nem rokon egyének hordozhatnak egy az egyben azonos ősi haplotípusokat is, míg másokban ezeknek csak egy töredéke található meg. Mivel az ősi haplotípusok szekvenciája evolúciós viszonylatban korán konzerválódott, napjainkra etnikumra jellemző eloszlású haplotípus-mintázatok alakultak ki [18].
4. ábra: Az MHC régió befagyott blokkjai
13
1.2.2 Ősi MHC haplotípusok és különböző kórképek kapcsolata
Számos jól karakterizált ősi MHC haplotípust ismerünk, melyek közül soknak betegségre hajlamosító hatása is van. Ennek magyarázata esetenként magukban az MHC molekulákban keresendő, amelyek allotípusoknak megfelelően preferenciálisan mutatnak be adott tulajdonságú aminosavakat tartalmazó fehérjeszakaszokat. Előfordul azonban, hogy a haplotípus számos génjében fellelhető polimorfizmusok összessége okozza az effajta jelenségeket [19, 20].
A kaukázusi populációban leggyakoribb, több mint 9%-os előfordulási arányú 8.1 ősi haplotípus (AH8.1) [HLA-A1, B8, DR3, DQ2] hordozói például sajátos immunológiai profillal rendelkeznek. A TNF-α és az IL-10 szintjük konstitutívan emelkedett, az IgG2 szérumkoncentrációjuk alacsony, illetve relatíve magas a szerveztükben a cirkuláló immunkomplexek és az autoantigének mennyisége. Az AH8.1 hordozása előnyt jelent a patogének elleni küzdelemben, hosszú távon azonban egy egész sor autoimmun kórkép kialakulására hajlamosít, köztük 1-es típusú cukor- betegségre (T1D), szisztémás lupus erythematosusra (SLE), szisztémás szklerózisra, lisztérzékenységre és myasthenia gravisra [21-24]. Emellett munkacsoportunk eredményei alapján a 8.1 ősi haplotípus bizonyos tumorok kialakulásának esélyét is fokozza [25]. Kaukázusi populációban az AH7.1 [HLA-A3, B7, DR15, DQ6] össze- függést mutat multiplex szklerózissal [26], az AH18.2 [HLA-A26, B18, DR17, DQ2]
T1D-vel [27], az AH13.1 [HLA-A2, B13, DR7, DQ2] és az AH57.1 [HLA-A2, B57, DR7, DQ3] pikkelysömörrel [28], az AH35.2 [HLA-A11, B35, DR1, DQ5] pedig sporadikus zárványtestes myositisszel [29]. Ugyanakkor japánok körében ez utóbbi betegségre inkább az AH52.1 [HLA-A24, B52, DR15, DQ6] hajlamosít [30].
Az sem ritka, hogy nem egy teljes kiterjesztett haplotípus mutat asszociációt egy adott kórképpel, hanem annak csupán egy fragmentuma, amely állhat egy vagy több befagyott blokkból. Például a [HLA-DR3, DQ2] és a [HLA-DR4, DQ8] haplotípusok döntő többsége a T1D rizikófaktora, ugyanakkor a [HLA-DR15, DQ6], [HLA-DR14, DQ5] és a [HLA-DR7, DQ9] erős védőhatással rendelkezik e betegség ellen [31, 32]. A [HLA-B44, DR4] haplotípus autizmusra [33], a [HLA-A24, B35] pedig japán populá- cióban primer petefészek elégtelenségre hajlamosít [34].
14 1.2.3 A tagSNP fogalma
Bár az MHC régió esetében a haplotípusokat eredetileg a klasszikus MHC fehérjéket kódoló HLA allélokkal szokás leírni azok nagyfokú variabilitása miatt, elvileg bármely ősi haplotípus nagy megbízhatósággal meghatározható egy vagy néhány jól megválasztott egypontos nukleotid polimorfizmus (single nucleotide polymorphism, SNP) kombinációjával [35]. Az efféle, a genom erős linkage disequilibriummal rendel- kező régiójában elhelyezkedő SNP-ket, amelyek meghatározásából következtethetünk egyéb polimorfizmus(ok) vagy egy adott haplotípus jelenlétére azok közvetlen detek- tálása nélkül, tagSNP-nek szokás nevezni. A tagSNP-k száma és elhelyezkedése az adott kimutatandó variációtól illetve haplotípustól függ; az AH8.1 például jól jellemez- hető az LTA 252G, TNF -308A, HSPA1B 1267G, CFB S, és AGER -429C allélok együttesével [19, 36].
1.3 AZ RCCX MODULÁRIS STRUKTÚRA 1.3.1 Az RCCX szerkezet felépítése, alkotói
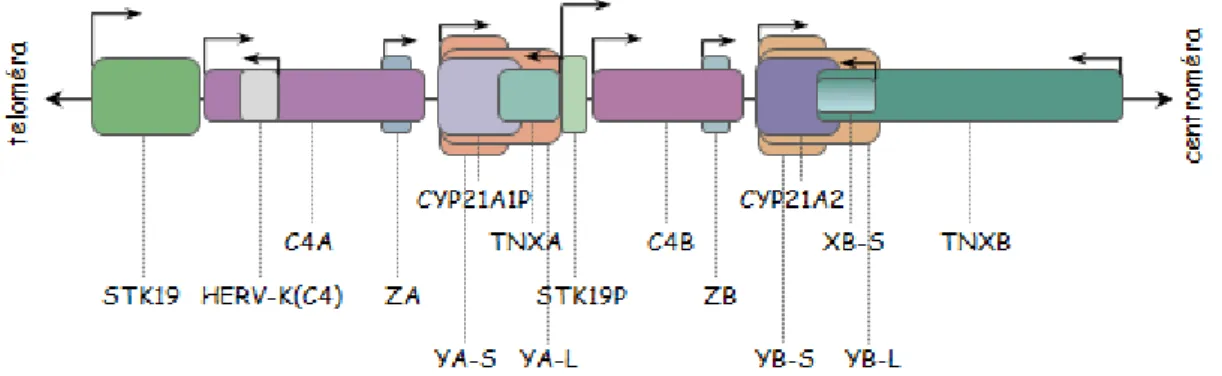
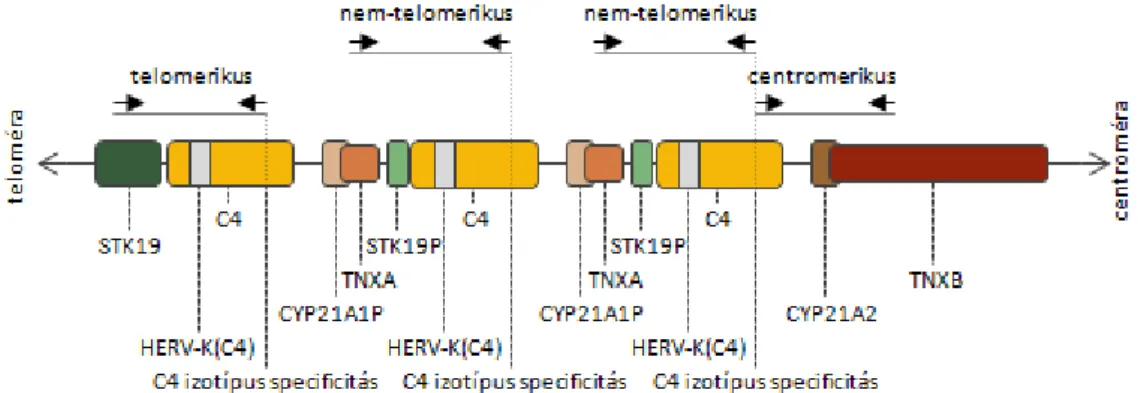
A centrális MHC régióban található a humán genom egyik legtöbbet tanulmányozott kópiaszám-variáció lókusza, az úgynevezett RCCX modul. Modulnak hívjuk azokat a többgénes szerkezeteket, amelyek diszkrét egységként viselkednek, vagyis az azokat alkotó gének mindig együtt duplikálódnak vagy deletálódnak. Az RCCX struktúra a nevét négy tagja után kapta; ezek az STK19 (korábban RP) nukleáris szerin-treonin kináz, a C4 komplement komponens, a 21-hidroxiláz (CYP21) és az extracelluláris mátrixfehérjék családjába sorolt tenaszcin-X (TNX) génjei. Az egy kromoszómán található RCCX modulok száma leggyakrabban kettő, nem ritkán egy vagy három, illetve igen ritkán négy (5. ábra) [37].
A mutációktól eltekintve a monomoduláris haplotípus kizárólag funkcionális géneket tartalmaz, a duplikált szegmensekben azonban egyedül a 4-es komplement komponens génjéről keletkezik protein. Az egyes C4 gének C4A, vagy C4B izotípusú fehérjét kódolhatnak, és egy HERV-K(C4) endogén retrovírus szekvencia jelenlététől függően különböző méretűek lehetnek (hosszú, C4L vagy rövid, C4S) [38]. Az aktív
15
STK19 génről kétféle hosszúságú fehérje keletkezik splicing közben bekövetkező exonátugrás miatt [39]. A TNX gének részlegesen átfednek a szomszédos CYP21 génnel és orientációjuk ellentétes a többi RCCX összetevőével [40]. A funkcionális STK19 és TNXB gének csonkolt pszeudogén párjait [41] STK19P-nek illetve TNXA-nak nevezik, az aktív CYP21A2 génnel nagyfokú homológiát mutató pszeudogént [42] CYP21A1P- nek. A leggyakrabban előforduló, egy C4A és egy C4B génkópiát tartalmazó bimodu- láris RCCX struktúrában a telomérától számítva a gének sorrendje: STK19-C4A- CYP21A1P-TNXA-RP2-C4B-CYP21A2-TNXB [43].
5. ábra: RCCX szerkezeti variációk
A fentieken túl a TNXB génről átíródik egy, a TNX fehérjét kódoló mRNS-hez képest megrövidült, szintén fehérjekódoló mRNS (XB-S) is [44], illetve két további, RNS transzkriptummal rendelkező lókuszpár (YA/YB és ZA/ZB) is található az RCCX szerkezetekben. Az YA és YB transzkriptumok a CYP21A1P illetve a CYP21A2 gének promóteréről íródnak át és két-két hossz-variánsuk létezik (YA-S/YA-L és YB-S/YB- L); melyek közül a hosszabbik teljes mértékben átfed a TNX génről származó RNS-sel
16
[45]. A ZA és ZB transzkriptumok átírása a C4A illetve C4B géneken belül elhelyezke- dő kriptikus promóterről indul, a C4 génekével azonos leolvasási kerettel (6. ábra) [46].
6. ábra: Transzkriptumok az RCCX struktúrában
Az RCCX szerkezetet alkotó gének élettani jelentőségét tekintve átfogó információ egyedül a C4-ről és a CYP21-ről áll rendelkezésre. Előbbi fehérjeterméke a komplementkaszkád tagjaként az immunológiai folyamatok szabályozásában tölt be fontos szerepet, míg a 21-hidroxiláz nélkülözhetetlen a glükokortikoidok és a mineralo- kortikoidok szintéziséhez. A tenaszcin-X a normális izomfejlődéshez szükséges [47, 48], míg az STK19 enzim feltételezhetően a DNS szintézisben és a transzkripcióban vesz részt [49]. Az XB-S protein szerepe nem tisztázott, de hipoxia hatására fokozódik a termelődése [50]. Az Y és Z lókuszok jelentősége egyelőre ismeretlen, viszont figyelemreméltó módon a transzkripciójuk szövetspecifikus [45, 46]; a CYP21A1P és a TNXA pszeudogénekéhez hasonlóan kifejezetten a mellékvesére jellemző [44, 51].
1.3.2 Egyenlőtlen átkereszteződések az RCCX struktúrán belül
Az RCCX struktúrán belül a sejtosztódás során aránylag gyakran történik hibás bázispárosodás a kromoszómánkénti modulszám variabilitása, valamint az itt található aktív- és pszeudogének nagyfokú szekvenciabeli hasonlósága miatt. Ezek vagy kislépté- kű génkonverzióhoz, vagy egyenlőtlen átkereszteződéshez vezethetnek. Az előbbi esetben pszeudogénre specifikus szekvencia-szakaszok kerülhetnek át a megfelelő aktív génbe, funkcióképtelenné téve azt, az utóbbi folyamat pedig gyakran aktív-/pszeudogén kimérák keletkezését eredményezi. De novo nem-allélikus homológ rekombinációs eseményeket elsősorban a CYP21 gének kapcsán említ az irodalom, ahol homozigóta formában az aktív gén hiánya vagy defektusa congenitalis adrenalis hyperplasiát (CAH)
17
okoz [52, 53]. Emellett de novo létrejött TNX aktív-/pszeudogén kimérákról is vannak feljegyzések, amelyek az Ehlers-Danlos szindróma III. (hipermobilis) típusának kiala- kulásához járulnak hozzá [54].
1.3.3 RCCX szerkezeti variációk
A kromoszómánkénti modulszámok diverzitásának és a C4 gének hossz- polimorfizmusának köszönhetően az RCCX struktúra figyelemreméltó variabilitást mutat. Az ezt vizsgáló tanulmányok rendszerint különféle Southern blot technikákra épültek, és elsősorban a telomerikusan elhelyezkedő C4 gén (ezáltal RCCX szegmens) hosszának, valamint az össz-C4A és -C4B génszám megállapítására irányultak [43, 55, 56]. Alkalmanként a haplotípusonkénti C4L és C4S gének számát is meghatározták [37, 57]. Mindezek alapján számos ritka variáns mellett hét gyakori RCCX szerkezeti típust írtak le: monomoduláris L (hosszú) és S (rövid), bimoduláris LL és LS, valamint trimoduláris LLL, LSS és LLS (vagy LSL; megkülönböztetni ilyen módszerrel nem lehet) változatokat [43]. Ezenkívül valószínűsíthető, hogy a leginkább telomerikusan elhelyezkedő modul rendszerint hosszú C4A gént tartalmaz és hogy a rövid monomoduláris struktúrákban gyakorlatilag kizárólag C4B gén található [38].
Amennyiben az RCCX szerkezet nem tartalmaz egyetlen C4A gént sem, C4A*Q0 haplotípusról beszélünk, míg a C4B gén hiánya esetében C4B*Q0-ról (ezekben az elnevezésekben a „Q0” megjelölés a „quantity zero” , azaz a „mennyisége nulla” kifeje- zés rövidítése) [58].
1.4 A 4-ES KOMPLEMENT KOMPONENS 1.4.1 A C4 fehérje és funkciója
A C4 fehérje (7. ábra) a komplementrendszer klasszikus és lektinindukált útvonalának résztvevője, szerkezetileg az α2 makroglobulinok családjába tarto- zik. Elsősorban a máj termeli, de kismértékű expresz- szió egyéb szövetekben is kimutatható. Prekurzora
7. ábra: A C4 fehérje térszerkezeti modellje a Swiss-
Prot adatbázis alapján (www.expasy.ch)
18
egyetlen, 200 kDa méretű polipeptidláncként szintetizálódik, majd a fehérje érése során egy három láncból (α-lánc: 95 kDa, β-lánc: 75 kDa, γ-lánc: 33kDa) álló struktúra alakul ki, a láncok között diszulfidhíd-kötésekkel [59, 60].
A molekula hasítás révén aktiválódik, amit a C1 komplement komponens C1s alegysége vagy a mannózkötő lektin asszociált szerin proteáz (MASP) végez. E két enzim alapesetben inaktív formában van jelen a keringésben, autoaktivációjukat a targethez való kötődés hatására bekövetkezett konformáció-változás indukálja. A C1 molekula elsősorban a célsejthez kikötődött IgG és IgM izotípusú ellenanyagokat képes felismerni, a MASP pedig az egyes patogének cukorban gazdag felszínéhez asszociált mannózkötő lektint (MBL) és a fikolinokat [60, 61].
8. ábra: A C4 fehérje szerepe a komplementrendszer aktiválódása során
A C4 fehérje hasításakor két fragmentum keletkezik: a nagyobb méretű C4b és az α-lánc N-terminális végéről leváló kismolekula, a C4a. Ez utóbbi feltételezhetően enyhe anafilatoxikus hatással rendelkezik, tehát gyulladást közvetítő anyagok felszaba- dulását váltja ki, serkenti a hisztamin felszabadulását hízósejtekben és granulocitákban, fokozva az ér permeabilitását, továbbá kemotaktikusan vonzza főként a neutrofil granulocitákat. A C4b peptiden a hasadáskor bekövetkező térszerkezeti változások eredményeképpen feltárul egy láncon belüli tioészterkötés, amely hidroxil- és amino- csoportokkal kovalens kötést képes létrehozni. Ezáltal a C4b az aktiváló felülethez
19
kapcsolódik, közvetlenül a C1 illetve a MASP mellett, ahol megköti a következő komplement komponenst, a C2-t. Ez utóbbit szintén a C1s vagy a MASP aktiválja hasítás révén. A keletkező nagyobbik fragmentum, a C2a a C4b molekulához kötődik, kialakítva a C3 proenzimet aktiválni képes C3 konvertázt. A kaszkád további aktiválódása végül a membránkárosító komplex kialakulásáig vezethet el, ami pórust hoz létre a célsejten (8. ábra). Emellett a komplementrendszer opszonizálja is a patogéneket, könnyebben felismerhetővé téve azokat a fagociták számára. Mindezeken túl a C4b peptid fontos szerepet tölt be az immunkomplexek keringésből történő eltávolításában is, egyrészt azok szolubilizálása (és a precipitáció gátlása) által, másrészt a vörösvértesteken kifejeződő CR1 receptorokhoz történő kötődésén keresztül [60, 61].
1.4.2 A C4 gén és fehérje variációi
A C4 gének 41 exonból állnak, méretük 14,6 kb vagy 21 kb lehet annak megfelelően, hogy a 9. intronba beékelődött-e a HERV-K(C4) szekvencia. Számuk a humán genomban kettő és nyolc között változhat az RCCX modulok számának megfelelően. A két izotípuson (C4A és C4B) belül több mint 41 különböző allotípusú fehérjét kódolhatnak. Az izotípusok DNS szekvenciája 99%-ban azonos, a köztük levő fő különbséget mindössze öt, a 26. exonban elhelyezkedő nukleotid eltérése jelenti, amelyek négy aminosavcserét okoznak [58]. Az RCCX szerkezeti variációkra vonatko- zó vizsgálatok alapján a C4A gének döntő többsége valószínűleg tartalmazza az endo- gén retrovírust, míg a C4B gének feltehetően körülbelül fele-fele arányban hosszúak illetve rövidek [38]. A C4 protein egyénenként változó szérumkoncentrációja (laboratóriumunk referencia tartománya szerint 150-550 mg/l) valamint hemolitikus aktivitása erősen összefügg a géndózissal, míg a C4A és C4B izotípusú fehérjék egymáshoz viszonyított aránya a megfelelő gének mennyiségi arányát tükrözi [62].
A C4A (acidic, savas) elsősorban amidkötést hoz létre aminocsoporttal rendelkező targetekkel, míg a C4B (basic, bázikus) az izotípusára jellemző 1106-os pozíciójú hisztidinnek köszönhetően inkább észterkötést alakít ki hidroxilcsoportot tartalmazó szubsztrátokkal. Az aktivált C4A féléletideje (~10 s) egy belső tioészterkötésnek köszönhetően hosszabb, mint a C4B-é (<1 s), így valószínűsíthető, hogy a C4A izotípus inkább az immunkomplexek eltávolításában, míg a C4B elsősor- ban a fertőző ágensek elleni védelemben játszik szerepet [63, 64].
20
A C4 gének többségébe beépült HERV-K(C4) szekvencia szintén élettani jelentőséggel bír. A benne található számos stop kodon lehetetlenné teszi a retrovirális fehérjék termelődését, ugyanakkor antiszensz irányban kimutattak RNS szintézist, ami transzfekciós kísérletek alapján hatékony védelmet nyújt az exogén retrovírusokkal szemben, különösen interferon-γ hatására [65, 66]. Ugyanakkor az endogén retrovírus jelenléte dózisfüggően csökkenti a C4 fehérje szérumszintjét, vélhetően a méretéből (6,4 kb) fakadóan a transzkripció lelassítása révén [62].
1.4.3 C4 hiányos egyének
A C4 fehérje expressziójának teljes hiánya rendkívül ritka, az irodalmi utalások szerint összesen harminc-negyven eset ismeretes. C4 gén ezekben az egyénekben is jelen van és kismértékű RNS szintézis is kimutatható, azonban a fehérjetermelést megakadályozzák a gén defektusai. A C4 gén működésképtelenségét rendszerint kisléptékű inszerciók és deléciók okozzák, amelyek eltolják a leolvasási keretet.
Közülük is leggyakoribb a 29. exont érintő 2 bázispáros inszerció, amely C4A és C4B génekben is fellelhető [67].
A C4 hiányos egyénekben súlyosan sérül az immunkomplexek keringésből történő eltávolítása, ami az esetek túlnyomó többségében immunkomplex-betegségeket indukál, nemritkán glomerulonephritishez, majd végállapotú veseelégtelenséghez vezetve. Mivel a komplementrendszer klasszikus útja az apoptotikus sejtek eliminálásában is szerepet játszik, valószínűleg ez a funkció is károsodik, ami antinukleáris autoantitestek termelését eredményezi. Emellett a C4 deficiens betegek többnyire visszatérő, elsősorban tokos baktériumok által okozott fertőzésekben is szenvednek, illetve fokozottan fogékonyak szepszis kialakulására [68-70].
1.4.4 C4A*Q0 haplotípusok
A C4A*Q0 haplotípusokat elsősorban különböző autoimmun betegségek rizikófaktoraként írták le. Többek között SLE-vel, szisztémás szklerózissal, rheumatoid arthritisszel, autoimmun hepatitisszel és T1D-vel hozták összefüggésbe [71-75]. Ennek egyik lehetséges oka, hogy – a C4 hiányos egyénekhez hasonlóan – a C4A*Q0 hordozók körében az A izotípusú C4 fehérjék átlagosnál alacsonyabb koncentrációja
21
(vagy hiánya) miatt az immunkomplexek viszonylag hosszú ideig vannak jelen a keringésben, ami gyulladásos folyamatokat indukál [76]. Ugyanakkor elképzelhető, hogy a magyarázat számos egyéb, egymástól viszonylag távoli gén bizonyos alléljaiban, vagyis genetikai kapcsoltságban keresendő, mivel a C4A gén hiánya mindenekelőtt az autoimmun kórképekre hajlamosító 8.1 ősi MHC haplotípusban fordul elő [21].
1.4.5 C4B*Q0 haplotípusok
A C4B*Q0 haplotípusok, illetve az átlagosnál alacsonyabb C4B szérumszint a C4A hiányos haplotípusokhoz képest változatosabb kórképekkel asszociálnak, köztük Schönlein-Henoch purpurával, autizmussal és szkizofréniával [77-79]. Homozigóta formában a C4B gén hiánya bakteriális eredetű agyhártyagyulladásra és visszatérő fertőzésekre hajlamosít, ami összhangban áll a fehérjetermék izotípusból eredő sajátsá- gaival [80, 81].
Munkacsoportunk megfigyelése szerint a C4B*Q0 haplotípusok szignifikánsan ritkábban fordulnak elő egészséges idős korosztályban (60-90 évesek) az egészséges fiatalokhoz (18-45 évesek) képest magyar és izlandi populációban egyaránt, ami arra utal, hogy a C4B*Q0 hordozók fokozatosan kiszelektálódnak az egészséges populáció- ból [82, 83]. A későbbiekben munkacsoportunk kimutatta, hogy a legalább egyik kromoszómájukon C4B gén hiányos egyének fokozottan hajlamosak myocardialis infarktusra, koronária artéria betegségre és stroke-ra [84-86]. Mindezeken felül a már infarktuson átesett C4B*Q0 hordozó betegek rövid távú (a kórházi bent fekvés idejére vonatkozó) túlélési esélyei rosszabbak a nem C4B*Q0 hordozókhoz képest [87]. Ez az összefüggés különösen a dohányzók körében bizonyult erősnek [88].
A C4B*Q0 hordozók körében tapasztalt, fokozott mértékű kardiovaszkuláris mortalitás és morbiditás megindokolhatja, hogy az ilyen haplotípusok előfordulási aránya miért csökken a kor előrehaladtával, molekuláris szinten viszont nem triviális az összefüggés háttere. Elvileg felmerül a lehetőség, hogy a C4B*Q0 hordozókban az átlagosnál alacsonyabb össz-C4 génszám, így relatíve alacsony C4 szérumszintek miatt a komplementrendszer aktivitása is csökkent mértékű, de a teljes szérummal végzett funkcionális vizsgálatok ezt nem támasztották alá [89]. Ráadásul éppen hogy a komplementrendszer nagyobb mértékű aktivitása eredményez komolyabb szöveti károsodást, így súlyosabb lefolyású kórképet a kardiovaszkuláris eseményeket követően
22
[90, 91]. Egy másik lehetséges magyarázat szerint a fenti jelenségek oka abban keresendő, hogy az alacsonyabb C4 fehérjeszint miatt csökken az immunkomplexek eltávolításának hatékonysága [92]. Ezt támasztja alá, hogy a C4B*Q0 hordozás az IgA immunkomplexek lerakódása által kiváltott Schönlein-Henoch purpurával asszociál [77], illetve hogy különböző autoimmun betegségekben szenvedő egyének esetében pozitív korrelációt írtak le a C4B szérumszint és az immunprecipitáció komplement mediálta megelőzhetősége között [93]. Ugyanakkor a C4A*Q0 hordozás és a kardiovaszkuláris morbiditás között nem sikerült összefüggést kimutatni [22], holott az immunkomplexek eltávolításában feltételezhetően még nagyobb is a C4A izotípusú fehérjék szerepe a C4B izotípushoz képest. Ezenkívül – a C2 deficienciától eltekintve – még a homozigóta komplement hiányos egyének kapcsán sem számol be semminemű tanulmány fokozott kardiovaszkuláris mortalitásról illetve morbiditásról [94].
1.5 A 21-HIDROXILÁZ ENZIM
1.5.1 A 21-hidroxiláz enzim működése
A CYP21 (citokróm P450 21-hidroxiláz) (9. ábra) a szteroid bioszintézis egyik kulcsenzime, hiányában nem keletkezhet sem kortizol, sem aldoszteron (10. ábra).
Expressziója erősen szövetspecifikus, kizárólag a mellékve- sekéregre jellemző. A fehérje tömege 52 kDa és többnyire 494 aminosavból áll (létezik egy extra leucint tartalmazó variánsa is) [95].
Az enzim aktivitásához magán a fehérjén és a szubsztrátján túl szükség van egy hem prosztetikus csoportra és a citokróm P450 oxidoreduktázra mint redox partnerre. A katalitikus modellek egyike szerint a reakció első lépéseként a szubsztrát az oxidált állapotú 21-hidroxilázhoz köt, majd a redox partnertől származó elektron redukálja a vasatomot. Ezután az enzim megköt egy oxigénmolekulát is, amit a redox partnertől származó második elektron negatív töltéssel ruház fel. Ekkor egy konzervált, savas aminosavmaradékról (aszpartát/ glutamát) közvetve két proton kerül a disztális oxigén-
9. ábra: A CYP21 enzim térszerkezeti modellje a
Swiss-Prot adatbázis alapján (www.expasy.ch)
23
atomra, ami víz formájában távozik. Végül a visszamaradó, erősen reaktív oxigénatom hidroxilálja a szubsztrátot [95, 96].
1.5.2 A CYP21 aktív- és pszeudogén
Az aktív CYP21A2 gén számottevő homológiát mutat a CYP21A1P pszeudogénnel, szekvenciájuk az exonokban 98%-ban, az intronokban 96%-ban azonos.
Hosszuk 3,1 kilobázis és 10-10 exont tartalmaznak. A köztük levő legnagyobb különbség a pszeudogén 3. exonjában található 8 bázispáros, frameshiftet (keretel- tolódást) okozó deléció, de egyéb defektusok is jellemzőek a CYP21A1P génre. Egy 2.
intronbeli nukleotid megváltozása aberráns splicingot okoz, a 7. exonban található egy frameshiftet okozó egy nukleotidos inszerció, a 8. exonban egy stop kodon, emellett összesen nyolc, aminosavcserét eredményező mutáció szintén ellehetetleníti a megfelelő fehérjetermék keletkezését [95].
A humán gén mutációs adatbázis (HGMD, www.hgmd.org) alapján a CYP21A2 génnek több mint 100 mutációja ismert, melyeknek csupán kb. 5%-a nem hozható
10. ábra: A 21-hidroxiláz szerepe a szteroid hormonok bioszintézisében
24
összefüggésbe a pszeudogénnel. A hibás allélok közel háromnegyede valószínűleg mikrokonverzió révén (pszeudogénre jellemző szekvencia szakaszok az aktív génben), míg a fennmaradó 20% egyenlőtlen átkereszteződés eredményeképp (aktív-/
pszeudogén kimérák vagy géndeléció) alakult ki [97, 98].
1.5.3 A CYP21A2 gén szabályozó régiói
A CYP21A2 gén transzkripciójának szabályozása kapcsán a közeli promóteren kívül távoli elemek szerepét is igazolták. Utóbbiak a – közvetlenül a CYP21 gén előtt elhelyezkedő – C4 gén 35. intronjában találhatóak, és az RCCX moduláris struktúra kapcsán említett Z transzkriptumok promóterének területére esnek. A régió három transzkripciós faktor kötőhelyet is tartalmaz. Közülük kettő a kísérletes eredmények alapján az SF-1 (szteroidogén faktor 1), míg a harmadik feltételezhetően az NF-W2 (nukleáris faktor W2) transzkripciós faktort köti [99].
A CYP21A1P pszeudogén transzkripciós aktivitása az aktív génhez viszonyítva mindössze 20% körüli, ami legalábbis részben a két gén proximális promótere közötti 4 bp-os eltérésnek köszönhető [100]. A disztális szabá-
lyozó régiók szerepéről a pszeudogén kapcsán nin- csen adat.
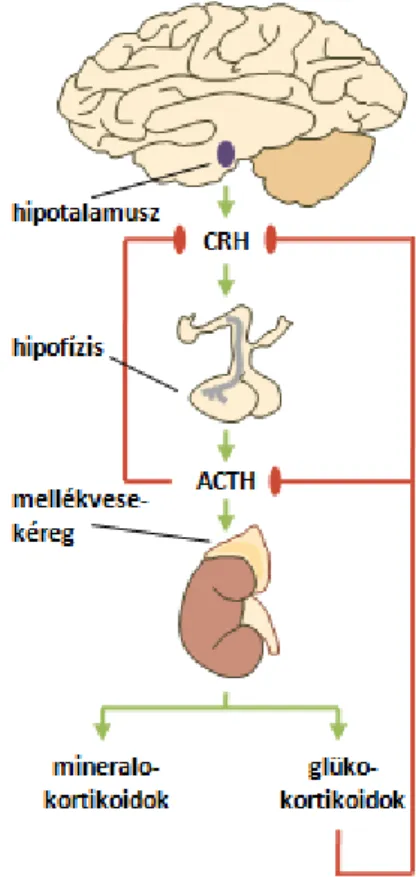
1.5.4 A hipotalamusz-hipofízis-mellékvese tengely A 21-hidroxiláz enzim termelődésének szabá- lyozásában központi szerepet játszik a hipotalamusz- hipofízis-mellékvese (HPA) tengely (11. ábra). A hipotalamusz paraventrikuláris magjában található neuroendokrin sejtek egyebek közt kortikotropin felszabadító hormont (CRH) szekretálnak. Utóbbi az agyalapi mirigy elülső lebenyében stimulálja az adrenokortikotrop hormon (ACTH) felszabadulását.
A CRH hatását a szintén a hipotalamuszban termelő- dő arginin-vazopresszin (AVP) tovább fokozza. Az
ACTH a mellékvesekéregben glüko- és mineralo- 11. ábra: A HPA tengely
25
kortikoidok, végső soron kortizol és aldoszteron bioszintézisét indukálja a megfelelő enzimek, köztük a 21-hidroxiláz expressziójának növelésén keresztül. Ugyanakkor a kortizol szintjének emelkedése negatív visszacsatolással hat a keletkezését serkentő CRH-ra és ACTH-ra, megakadályozva ezáltal önmaga túltermelődését [101].
A hipotalamusz-hipofízis-mellékvese tengely aktivitása cirkadián ritmust mutat, amit lényegében a CRH gén expressziós mintázata szabályoz. Ez a mintázat független a kortikoszteroid hormonok szintjétől, kialakításában elsősorban a szembe jutó fény és az étkezés szerepét feltételezik [102, 103]. Ezenkívül egyéb faktorok is befolyással bírnak a HPA tengely működésére, mint például a stressz és bizonyos bakteriális endotoxinok, köztük a Gram-negatív sejtfal lipopoliszacharid (LPS) komponense [104, 105].
1.5.5 A HPA tengely és a stresszválasz kapcsolata
Mivel a HPA tengely elemei sokrétű szabályozó funkcióval rendelkeznek, a rendszer aktivitása és aktiválhatósága központi tényező a homeosztázisban (12. ábra). A mineralokortikoidok hatására fokozódik a szervezetben a nátrium és ezáltal a víz vissza- tartása; növekszik a vérnyomás. A glükokortikoidok a májban raktározott glikogén és fehérjék lebontását serkentik, illetve emelik a vércukorszintet [101]. A glüko- és mineralokortikoidokra specifikus receptorok kifejeződnek különböző agyi területeken, köztük a hippokampuszban és az amigdalában, befolyásolva a kognitív funkciókat és az érzelmeket [106, 107]. A glükokortikoidok számos immunsejt működését, citokinterme- lését is szabályozzák, gyulladáscsökkentő hatásuk van és az immunválaszt humorális irányba tolják el [108].
12. ábra: A HPA tengely kapcsolata a szervezet egyéb rendszereivel
26
A HPA tengely stimulációja a stresszválasz lényeges eleme; aktivációja összefonódik a szimpatikus idegrendszerével és a hatásaik is kiegészítik, felerősítik egymást. Az akut stressz végeredményben az izmok oxigénnel és glükózzal való ellátottságát növeli és módosult tudatállapotot eredményez, ami a vészhelyzetből való elmenekülésnek vagy éppen a harckészültségnek, tehát a túlélésnek kedvez. Ezzel egyidejűleg negatív visszacsatolási hurkokon keresztül beindulnak a stresszreakciót gátló folyamatok is. A stresszor krónikus jelenléte esetében azonban a szervezet készültségi állapota állandósul, ami több szempontból is kártékony (2. táblázat) [109- 113].
2. táblázat: A stressz rövid- és hosszú távú hatásai (Sapolsky [114] után módosítva) Akut stresszválasz Krónikus stressz okozta kórképek
energia felszabadulás (lebontó anyagcsere) kimerültség, elhízás, 2-es típusú cukorbetegség megnövekedett kardiovaszkuláris tónus magas vérnyomás betegség, infarktus, stroke emésztőrendszer vérellátásának csökkenése gyomor-/ bélrendszeri fekélyek
immunválasz módosulása, gyulladásgátlás csökkent ellenállóképesség, daganatok ivarszervek vérellátásának csökkenése termékenység csökkenése
kognitív képességek fokozódása,
fájdalomérzet csökkenése fokozott neurodegeneráció
félelem, idegesség depresszió, poszt-traumás stressz szindróma
1.5.6 21-hidroxiláz hiányos állapotok
Amennyiben a szervezetben nem szintetizálódik ép funkciójú 21-hidroxiláz enzim, nem termelődik kielégítő mennyiségű kortikoszteroid sem. Emiatt kórosan magas lesz az ACTH szint, ami a mellékvesekéreg szteroid termelő sejtjeinek túlakti- válódásához és túlburjánzásához vezet, és kialakul a világszerte egyik leggyakoribb recesszív öröklésmenetű betegség, a congenitalis adrenalis hyperplasia (CAH). A betegség súlyossága egyénenként változik annak megfelelően, hogy az enzimfunkció milyen mértékben károsodott. Elkülöníthető a CAH enyhe, nem-klasszikus, valamint a klasszikus formája, illetve az utóbbinak két változata létezik: a sóvesztő (salt wastig, SW) és az egyszerű virilizáló (simple virilizing, SV) [115].
27
Az SW forma akkor alakul ki, ha az enzim aktivitása a normálisnak az 1%-át sem éri el. Ekkor az aldoszteron hiányában felborul a szervezet só- és vízháztartása, súlyos nátrium- és ezáltal vízvesztés következik be. A kortizol hiánya miatt csökken a szív pumpafunkciója, így a glomerulusok szűrőfunkciója is, még erőteljesebb sóvesztést eredményezve. Kezeletlen állapotban a sóvesztő CAH a születést követő néhány héten belül hipovolémiás sokkot idéz elő. Az SV fenotípusban a legfőbb gond a virilizáció, hiszen a felhalmozódó szteroid prekurzorok végül androgén hormonokká alakulnak. A nem klasszikus CAH nem jár szembeötlő tünetekkel, ugyanakkor például a termékenységre a betegség enyhébb formái is negatív hatással vannak [115, 116].
A CAH súlyosságát döntően a kisebb mértékben károsodott allél határozza meg;
a genotípus-fenotípus korreláció 80% körüli [117, 118]. A betegség klasszikus változatainak hátterében elsősorban az aktív gén hiánya, a hem- illetve szubsztrát-közeli aminosavak cseréje vagy a fehérje másodlagos szerkezetét érintő hibák állnak. Nem- klasszikus CAH-ért főleg sztérikus problémát okozó aminosav-cserék illetve az enzimműködés szempontjából nem kiemelt aminosavak polaritásának változása a felelősek [96]. Hibás CYP21A2 allélokat csupán az egyik kromoszómájukon hordozó egyének klinikailag tünetmentesek, kortikoszteroid prekurzoraik szintje nyugalomban normális, ACTH indukcióra átmenetet mutat a normál és a nem klasszikus CAH-ra jellemző tartomány között [119].
1.5.7 A 21-hidroxiláz és a kardiovaszkuláris rendszer
Miután a szteroid hormonok megfelelő termelődése és mobilizációja kulcsfon- tosságú lépés az adaptív stresszválasz során, a 21-hidroxiláz enzim aktivitását érintő mutációk befolyással bírnak ez utóbbi folyamatra is. Tekintve a stresszválasz zavarai és a kardiovaszkuláris betegségek kialakulása közötti szoros összefüggést, a hibás CYP21A2 allélok valószínűsíthetően szív- és érrendszeri kórképekre hajlamosítanak [120]. Ezt a feltételezést több tanulmány is alátámasztja. A CAH-ban szenvedő egyéneknek az átlagosnál magasabb a vérnyomásuk, testzsír-arányuk és test-tömeg indexük, illetve alacsonyabb az inzulinnal szembeni rezisztenciájuk, amelyek mind rizikótényezők a keringési rendszer betegségeinek kialakulásában [121-123]. A CAH-os betegekben továbbá megnövekedett intima-media vastagságot figyeltek meg, ami az atherosclerosis kezdeti stádiumának jellemzője [124].
28
2 CÉLKITŰZÉSEK
Doktori munkám a C4B*Q0 haplotípusok hordozása és a kardiovaszkuláris betegségekre mutatott fokozott hajlam közti összefüggés mibenlétének feltárására irányult. Mivel a C4B gén termékének részleges vagy teljes hiánya nem ad magyarázatot a megfigyelt jelenségekre, a választ a genetikai kapcsoltságban kerestük.
Tekintve, hogy a C4 gének egy igen hosszan konzervált kromoszómaszakaszon helyezkednek el, a közvetlenül szomszédos területeken túl figyelembe kellett vennünk a távolabbi régiók esetleges szerepét is.
A konkrét célkitűzések a következők voltak:
1. A kaukázusi populációban előforduló MHC haplotípusok összetételének és gyakoriságának felmérése, illetve válaszkeresés arra, hogy a C4B gén hiánya jellemzően egyazon, avagy több eltérő ősi, kiterjesztett MHC haplotípusban jelenik-e meg.
2. A kaukázusi populációban előforduló RCCX szerkezetek részletes jellemzése és annak vizsgálata, hogy a C4B gén hiánya társul-e valamely gyakori RCCX szerkezeti variánssal.
3. A C4A és C4B gének 35. intronjában található, CYP21 szabályozó régiók összehasonlítása, tekintettel arra, hogy az aktív CYP21A2 gén rendszerint C4B, míg a jelentősen alacsonyabb transzkripciós aktivitású CYP21A1P pszeudogén rendszerint C4A gén után áll.
4. Nyugalmi és indukált kortikoszteroid hormonszintek összehasonlítása C4B*Q0 hordozók és nem-hordozók között, abból kiindulva, hogy a C4 mellett található CYP21A2 gén polimorfizmusai közvetlen kihatással lehetnek a kortizol és az aldoszteron termelődésére, így a stresszválaszra is.
29
3 ANYAGOK ÉS MÓDSZEREK
3.1 VIZSGÁLT SZEMÉLYEK
3.1.1 Az MHC haplotípusok és RCCX szerkezetek felméréséhez gyűjtött minták A hazai MHC haplotípusok és RCCX szerkezeti variánsok feltérképezése egy családvizsgálat keretei között zajlott, így az egyes polimorfizmusokat egyértelműen kromoszómához tudtuk rendelni. A mintagyűjtést az Országos Vérellátó Szolgálat Transzplantációs Immunológiai Laboratóriumában végezték, 49, kaukázusi populációba tartozó szülőpár és összesen 105 gyermekük (203 személy) részvételével. Minden családban volt egy csontvelő-transzplantációra váró leukémiás gyermek (a betegségük természete heterogén volt); a betegek szülei és testvérei egészségesek voltak. A tanulmányokban részt vevő összes személy (kiskorúak esetében a szülők) írásos beleegyezését adta mintája kutatási célokra való felhasználására.
A mintavétel reprezentatív voltának ellenőrzéséhez az eredményeket egy bostoni kaukázusi családvizsgálat eredményeihez mint kontroll adatbázishoz hasonlítottuk. A szülők minden esetben egészségesek voltak; míg a családok többségében legalább egy gyermek valamiféle betegségben szenvedett. Amennyiben ez a betegség az MHC régió- val állt összefüggésben (pl. 1-es típusú cukorbetegség, rheumatoid arthritis, szisztémás lupus erythematosus, multiplex szklerózis, lisztérzékenység), az adott családban kizáró- lag azokat a haplotípusokat vettük figyelembe, amelyeket a szülők egyetlen beteg utódukba sem örökítettek. Mindent összevetve a bostoni kontroll adatbázis összesen 2675 független (szülői) kromoszómáról tartalmazott információt.
3.1.2 A C4A és a C4B gének 35. intronbeli szekvenciájának összehasonlításához válogatott minták
A C4A és a C4B gének 35. intronjában elhelyezkedő CYP21 regulációs szekvenciák összehasonlításához olyan egyéneket válogattunk össze, akik vagy egyetlen C4A vagy egyetlen C4B génkópiával sem rendelkeztek. A C4 génszámokat korábbi vizsgálatok során már több különböző, a munkacsoportunk által gyűjtött mintaanyagon is meghatároztuk, így egészségesekben [82, 83], 1-es típusú diabéteszesekben (nem publikált adatok), pneumónia eredetű szepszises betegekben [125, 126], valamint koro-
30
nária bypass műtéten [127] illetve myocardialis infarktuson átesetteken [84, 88]; össze- sen 1505 genetikailag független személyben.
3.1.3 A C4B*Q0 hordozás és a szteroid hormonszintek kapcsolatának vizsgálata során analizált minták
A C4B*Q0 hordozás és a szteroid hormonszintek közötti esetleges összefüggés felderítésére retrospektív vizsgálatot végeztünk 76 mellékvese incidentalómás beteg (11 férfi és 65 nő, koruk 64,2 ± 9,4 év) bevonásával. A betegeket a Semmelweis Egyetem II. számú Belgyógyászati Klinikáján diagnosztizálták és követték nyomon átlagosan 9,1 (legalább 5 és legfeljebb 16) éven át. Beválogatási kritérium volt, hogy a tumor ne legyen hormontermelő, illetve rosszindulatú. A tumor méretére vonatkozóan 63 beteg esetében állt rendelkezésünkre információ, amit komputer tomográfiával és/ vagy hasi ultrahang vizsgálattal határoztak meg.
3.2 DNS IZOLÁLÁS
A minták perifériás vérből származtak. A fehérvérsejtek DNS tartalmát hagyományos kisózásos módszerrel vontuk ki [128] az alábbiak szerint. 500 µl EDTA- val vagy heparinnal alvadásgátolt vérhez 1 ml vörösvértest lízis puffert mértünk, majd fél perces intenzív rázást követően maximális fordulatszámon lecentrifugáltuk azt. A felülúszót leöntöttük, a pelletként visszamaradt sejteket kétszer mostuk 1-1 ml desztillált vízzel. Ezután a sejteket 1% SDS-t tartalmazó proteináz K pufferben (0,075 M NaCl, 0,024 M EDTA) tártuk fel 0,75 mg/ml proteináz K enzimmel (Fermentas) 55oC-os vízfürdőben 30 percig. A minták szobahőmérsékletre hűlését követően 200 µl telített NaCl oldatot mértünk a lizátumra, és erőteljes rázás közepette kicsaptuk a fehérjéket. Majd maximális fordulatszámon 7 percig centrifugáltuk a mintákat, és a DNS-t tartalmazó felülúszót tiszta Eppendorf csőbe pipettáztuk át. A DNS-t 500 µl izopropanollal kicsaptuk, 500 µl 70%-os etanollal tisztítottuk, vákuum centrifugában 20 percig szárítottuk, végül 50-100 µl desztillált vízben oldottuk. (Ahol nincs másképp jelölve a vegyszereket a Sigma-Aldrich cégtől rendeltük.)
A családvizsgálatos minták esetében a DNS izolálás nagyobbik részben az Országos Vérellátó Szolgálat Transzplantációs Immunológiai Laboratóriumában történt
31
Puregene kereskedelmi kittel (Gentra), részben laboratóriumunkban a fent leírt módszerrel. A mellékvese incidentalómás betegcsoport esetében a DNS izolálást a Semmelweis Egyetem II. számú Belgyógyászati Klinikáján végezték. A tisztított DNS preparátumokat –20oC-on tároltuk.
3.3 GENETIKAI ANALÍZISEK 3.3.1 HLA-tipizálás
A HLA-A és HLA-B allélok meghatározása szerológiai módszerrel történt HLA Ready Plate mikrolimfocita-toxicitási tesztek felhasználásával (Inno-Train). A HLA- DRB1 és HLA-DQB1 lókuszok alacsony felbontású vizsgálata polimeráz láncreakcióval valósult meg szekvencia-specifikus primerek alkalmazásával (Olerup SSP, GenoVision), közepes felbontású vizsgálatuk pedig reverz dot-blot technikával történt Inno-LiPa DRB és DQB kitekkel (Innogenetics). A HLA-tipizálást minden esetben az Országos Vérellátó Szolgálat Transzplantációs Immunológiai Laboratóriumában végezték.
3.3.2 SNP detektálás restrikciós fragmenthossz polimorfizmus (RFLP) technikával Az RFLP módszerrel genotipizált polimorfizmusok közül az LTA 252A>G allélokat (rs909253) Seidemann [129], a HSPA1B 1267A>G variánsokat (rs1061581) Vargas-Alarcon [130], a CFB S>F (rs641153) alléljait Jahn [131], az AGER -374T>A SNP-t (rs1800624) pedig Hudson [132] módszere alapján detektáltuk. A PCR elegyek az alábbi összetevőket tartalmazták 10 µl-es végtérfogatban: 1× HotStartTaq puffer (Qiagen), 0,2 mM dNTP (Fermentas), 1-1 µM a megfelelő forward és reverse primerekből (3. táblázat), 2-5 ng DNS templát, 0,025 U/µl HotStartTaq polimeráz (Qiagen), valamint a 3. táblázatban jelzett koncentrációjú MgCl2 és/ vagy Q oldat (Qiagen). A termociklusok egy 95°C-on 15 percig zajló kezdeti denaturációs lépéssel indultak, amit 35 ciklusból álló DNS amplifikálás követett [denaturálás: 94°C 30 s, anellálás: 30 s a megfelelő hőmérsékleten (3. táblázat), elongáció: 72°C 1 perc], majd a reakciót a 72°C-on 7 percig tartó végső extenzió zárta.
32
3. táblázat: A PCR reakciók eltérései az RFLP technikával vizsgált SNP-k esetében MgCl2
Q
oldat Forward primer Reverse primer Anellálási hőmérséklet LTA
252A>G
6,25
mM -
5’ CTC CTG CAC CTG CTG CCT
GGA TC 3’
5’ GAA GAG ACG TTC AGG TGG
TGT CAT 3’
56°C
HSPA1B
1267A>G - 1x
5’ CAT CGA CTT CTA CAC GTC CA
3’
5’ CAA AGT CCT TGA GTC CCA AC
3’
58°C
CFB S>F
6,25
mM 1x
5’ GCC TCT TGT CTG GAG GTA
AG 3’
5’ GCA CAG GGT ACG GGT AGA
AG 3’
58°C
AGER
-374T>A - 1x
5’ TAG GGA GAG GGA GGA GGT
TGC 3’
5’ TCA GAG CCC CCG ATC CTA
TTT 3’
62°C
Az amplikonok restrikciós endonukleázzal történő emésztését 37°C-on végeztük minimum 4 órán, de legfeljebb egész éjszakán át tartó inkubációval. Az LTA 252A>G allélok meghatározásához StyI (Fermentas), a HSPA1B 1267A>G allélokéhoz PstI (Fermentas), a CFB S>F allélokéhoz pedig MspI enzimet (New England Biolabs) alkalmaztunk. A keletkezett hasítási termékeket 1 µg/ml etídium-bromidot tartalmazó, 3%-os (a HSPA1B 1267A>G variáció vizsgálatakor 2%-os) SeaKem agaróz gélen (Lonza) választottuk el. A gélelektroforézis 100 V feszültségen (6,7 V/cm térerő alkalmazásával) történt átlagosan 45 percig. Az etídium-bromiddal jelölt DNS fragmen- tumokat UV fénnyel detektáltuk Chemigenious2 rendszerben. Az egyes allélokhoz tartozó emésztési fragmentumok méretét a 4. táblázat tartalmazza.
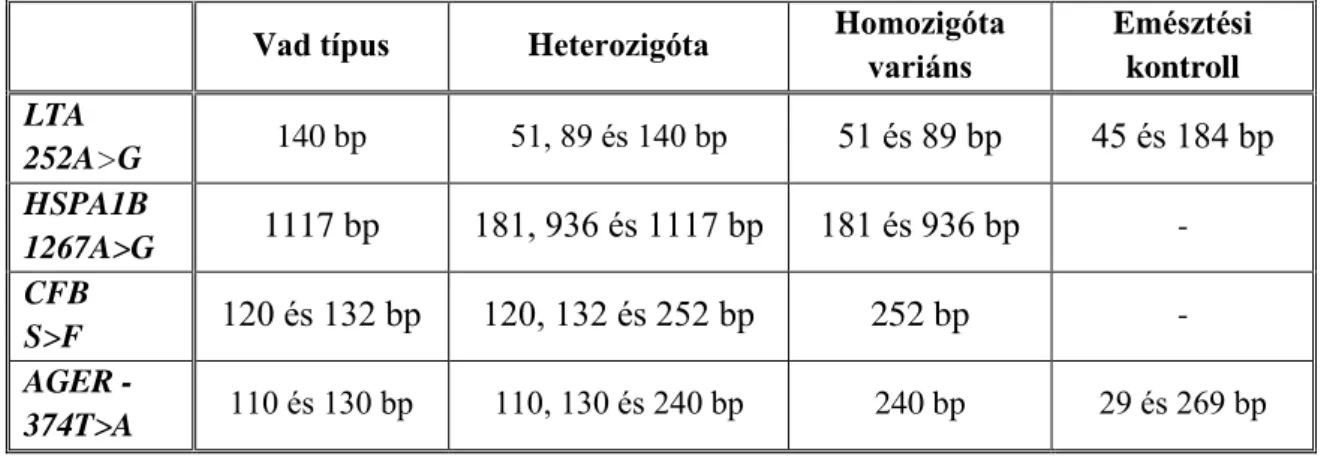
4. táblázat: Az emésztési termékek hossza az RFLP technikával vizsgált polimorfizmusok esetében
Vad típus Heterozigóta Homozigóta variáns
Emésztési kontroll LTA
252A>G 140 bp 51, 89 és 140 bp 51 és 89 bp 45 és 184 bp HSPA1B
1267A>G 1117 bp 181, 936 és 1117 bp 181 és 936 bp - CFB
S>F 120 és 132 bp 120, 132 és 252 bp 252 bp - AGER -
374T>A 110 és 130 bp 110, 130 és 240 bp 240 bp 29 és 269 bp
![2. ábra: Az MHC molekulák doménszerkezete és peptidkötő zsebeik felülnézeti modellje (A doménszerkezetes ábrák Klein közleménye alapján [3] készültek; a szalagmodelles ábrák](https://thumb-eu.123doks.com/thumbv2/9dokorg/1345168.109251/8.892.153.736.369.835/molekulák-doménszerkezete-peptidkötő-felülnézeti-doménszerkezetes-közleménye-készültek-szalagmodelles.webp)