β β β
β-laktám rezisztens Gram-negatív baktériumok vizsgálata
Doktori tézisek
Dr. Szabó Dóra
Budapest
2011
TARTALOMJEGYZÉK
1. IRODALMI HÁTTÉR 2
2. CÉLKITŐZÉSEK 2
3. ANYAGOK ÉS MÓDSZEREK 4
3.1.Általános bakteriológiai módszerek 4
3.2. Biokémiai vizsgáló módszerek 4
3.3. Genetikai módszerek 5
3.4. Epidemiológiai vizsgálatok 6
3.5 Állatkísérletek 7
4. EREDMÉNYEK 8
4.1. Epidemiológiai vizsgálatok 8
4.2. ESBL enzimek újabb fenotípusos és genotípusos detektálási lehetısége 10 4.3. Új ESBL enzimek izolálása és karakterizálása 12 4.4. Az ESBL termelés és a csökkent kinolon érzékenység kapcsolata 12 4.5. Gram-negatív baktériumok karbapenem rezisztenciájának vizsgálata 13 4.6. ESBL-termelı törzsek által okozott fertızések terápiás lehetıségei
kísérletes állatmodellekben 15
5. A TÉZISEK LEGFONTOSABB ÚJ MEGÁLLAPÍTÁSAI 17
6. KÖSZÖNETNYILVÁNÍTÁS 19
7. TUDOMÁNYOS KÖZLEMÉNYEK 20
7.1. A tézisek alapjául szolgáló tudományos közlemények 20 7.2. A tézisekhez nem kapcsolódó tudományos közlemények 22
1. IRODALMI HÁTTÉR
A β-laktám antibiotikumok (penicillinek, cefalosporinok, karbapenemek, monobaktámok) szerkezetében β-laktám győrő található. Antibakteriális hatásuk ezen győrő épségéhez kötött.
A β-laktám antibiotikumok a baktériumsejtfal peptidoglikán vázának a felépítését gátolják több támadásponton keresztül. A velük szemben kialakult rezisztencia hátterében többféle mechanizmus állhat: β-laktamáz termelés, permeabilitás változás (külsı membrán fehérje változás), target megváltozás (penicillin-kötı fehérjék megváltozása), efflux mechanizmus, illetve ezek a mechanizmusok együttesen is jelen lehetnek a baktériumban. A leggyakoribb rezisztencia mechanizmus azonban a baktériumok β-laktamáz enzim termelése. A β-laktamáz enzimek osztályozása hidrolízisuk alapján, gátlószerekkel szembeni érzékenységük, genetikai hátterük (kromoszomális, illetve extrakromoszomális), illetve molekuláris szerkezetük (A-D) alapján történik. A jelenleg elfogadott osztályozás a Bush-Jacoby-Medeiros féle osztályozás, mely a felsorolt szempontok alapján a β-laktamáz enzimeket 4 (1-4) nagy csoportba osztja.
A széles spektrumú cefalosporinokra kiterjedı rezisztencia a Gram-negatív baktériumok között, különös tekintettel az Enterobacteriaceae család tagjaira, az egész világra kiterjedı problémává vált a kiterjedt spektrumú β-laktamázok (extended-spectrum β-lactamase, ESBL- ek) és az AmpC-típusú β-laktamázok megjelenését követıen. Ma már több, mint 300 különbözı ESBL enzim ismert. Ezek az enzimek világszerte jelen vannak, elsısorban plazmid által kódoltak, és az Enterobacteriaceae család tagjai között elterjedtek, de Pseudomonas aeruginosa törzsekben is megfigyelték ıket. Jelenleg a TEM- és SHV-típusú ESBL-ek között több, mint 300 variánst, a CTX-M ESBL-nél több, mint 65 típust és az ún. minor ESBL-ek (VEB, GES, PER, SFO-1, TLA-1, TLA-2, BES-1, BEL-1) esetében több, mint 20 félét írtak le. Az ESBL enzimek hidrolizálják a Gram-negatív ellenes penicillin származékokat, az elsı, második, harmadik és negyedik generációs cephalosporinokat és a monobaktámokat. Nem képesek hidrolizálni a cephamycineket és a karbapenemeket. Aktivitásuk különbözı enzim gátlószerekkel - klavulánsav, tazobaktám, szulbaktám - jól gátolható.
Az ESBL-termelı, multirezisztens Enterobacteriaceae törzsek terjedésével a karbapenemek váltak a Gram-negatív baktériumok okozta súlyos fertızések antibiotikum terápiájának egyik utolsó hatékony eszközévé. Azonban a megemelkedett karbapenem használat következtében egyre gyakoribbak az e szerekkel szemben is rezisztens baktériumok.
A karbapenem rezisztens nem-fermentáló Gram-negatív kórokozók (Pseudomonas spp., Acinetobacter spp.,) megjelenése után, karbapenem rezisztens Enterobacteriaceae törzseket is izoláltak már. A legjelentısebb karbapenemázok a szerin típusú K. pneumoniae carbapenemase (KPC) enzimek, melyek klavulánsavval gátolhatók; illetve metallo-β- laktamázok (MBL), melyek aktivitása EDTA-val függeszthetı fel. Az MBL csoport legjelentısebb tagjai a VIM-, IMP- típusú MBL-ek.
2. CÉLKITŐZÉSEK
Epidemiológiai vizsgálatok
A TEM- és SHV-típusú ESBL-t termelı Klebsiella pneumoniae törzsek (ESBL-KP) fontos kórokozókká váltak a kórházi fertızésekben, multirezisztenciájuk miatt, illetve mert egyre több járványt okoznak a kórházakban elsısorban a koraszülött intenzív osztályokon (PIC).
1. Célunk volt jellemezni Magyarországon az elsı ESBL-K. pneumoniae törzsek által okozott járványt molekuláris epidemiológiai szempontból.
2. Célunk volt továbbá egy ötéves követéses molekuláris epidemiológiai vizsgálat során meghatározni az ESBL-termelı Klebsiella fajok molekuláris epidemiológiáját
a Semmelweis Egyetem II. PIC-en. Egyidejőleg, retrospektív módon vizsgálni a fertızések rizikófaktorait és a mortalitást is.
ESBL enzimek újabb fenotípusos és genotípusos detektálási lehetısége
A Clinical and Laboratory Standards Institute (CLSI) és az European Committee on Antimicrobial Susceptibility Testing (EUCAST) által meghatározott ESBL fenotípusos szőrıvizsgálatok csak Klebsiella spp., Escherichia coli és Proteus mirabilis törzsekre tartalmaznak ajánlásokat. A kromoszómális AmpC-típusú β-laktamáz termelı törzsek ESBL termelésének kimutatására azonban még nincsenek ajánlások.
3. Vizsgálni kívántuk, hogy kromoszomális AmpC-típusú β-laktamázt is termelı Enterobacter cloacae törzsekben, milyen módon tudjuk detektálni a párhuzamos ESBL termelést, ha a hagyományos tesztek a kromoszómális β-laktamáz enzim jelenléte miatt nem értékelhetıek.
A Gram-negatív baktériumok gyakran többféle ß-laktamáz enzimet termelnek. Abban az esetben, ha egy baktérium több, azonos csoportba és azonos izoelektromos ponttal rendelkezı ß-laktamáz enzimet termel, azoknak a detektálása különös gondot okoz.
4. Célunk volt azonos típusba tartozó többféle ß-laktamáz enzimek genotípusos azonosítására megfelelı módszer kidolgozása.
Új ESBL enzimek izolálása és karakterizálása
Az antibiotikumok szelekciós hatása következtében egyre több és újabb ESBL variánsok kerülnek izolálásra.
5. Célunk volt új TEM-, SHV-, CTX-M típusú ESBL változatok leírása, jellemzése.
6. Továbbá megpróbáltuk jellemezni az újonnan leírt TEM-131 és SHV-30 enzimet szubsztrátprofiljuk és a megfigyelhetı mutációk hatása alapján.
ESBL termelés és a csökkent kinolon érzékenység kapcsolata
Annak ellenére, hogy a kinolon rezisztencia általában kromoszómán kódolt, világszerte emelkedik a ciprofloxacin rezisztens ESBL-termelı törzsek aránya. Az utóbbi években több plazmidon kódolt kinolon rezisztencia gént (qnrA, qnrB, qnrS és aac(6’)-Ib-cr) írtak le.
7. Vizsgálatunk célja volt a qnrA, qnrB, qnrS és aac(6’)-Ib-cr gének prevalenciájának meghatározása magyarországi ESBL-termelı izolátumok között, illetve a qnr gének mobilitásának vizsgálata.
Gram-negatív baktériumok karbapenem rezisztenciájának vizsgálata
A karbapenem rezisztenciáért elsısorban a baktériumok karbapenemáz termelése felelıs, de egyéb mechanizmusok is szerepet játszhatnak.
8. Vizsgálni kívántuk egy a terápia során ertapenem-rezisztenssé vált E. cloacae klinikai izolátum antibiotikum rezisztencia-mechanizmusait.
9. Vizsgáltuk egy ertapenem rezisztens K. pneumoniae és egy szintén ertapenem rezisztens K. oxytoca antibiotikum rezisztencia mechanizmusait.
10. Szintén tisztázni kívántuk egy korábban külföldön kezelt betegbıl izolált karbapenem rezisztens P. aeruginosa és Acinetobacter baumannii törzsek rezisztencia viszonyait is.
ESBL-termelı törzsek által okozott fertızések terápiás lehetıségei kísérletes állatmodellekben
Az ESBL-termelı törzsek gyakran rezisztensek más antibiotikumokkal - aminoglikozidokkal, tetracyclinnel és trimethoprim/sulphametoxazollal - szemben is az azonos plazmidon
elhelyezkedı rezisztencia gének miatt. A keresztrezisztencia miatt az ESBL-termelı törzsek által okozott fertızések esetén a terápiás lehetıségek korlátozottak.
11. Célunk az volt, hogy összehasonlítsuk az amikacin, a cefepim, az amikacin-cefepim és az imipenem hatását SHV-5 ESBL-termelı K. pneumoniae törzzsel fertızött szeptikus egerekben, magas kezdeti csíraszám alkalmazásával.
12. Célunk volt továbbá, hogy meghatározzuk és összehasonlítsuk a ciprofloxacin és a levofloxacin aktivitását is az SHV-5 ESBL-termelı K. pneumoniae törzs ellen in vitro és in vivo.
13. Célunk volt egy új antibakteriális aktivitással is bíró peptid, az A3-APO, hatását összehasonlítani az imipenemmel ESBL-termelı E. coli törzzsel fertızött szeptikus egerekben.
3. ANYAGOK ÉS MÓDSZEREK
3.1. Általános bakteriológiai módszerek
Baktériumtörzsek azonosítása, tárolása
A baktériumtörzsek biokémiai azonosítása a rendelkezésre álló identifikáló rendszerekkel, automatákkal történtek: ATB-teszt, API 20E, VITEK II, VITEK III. A baktérium törzseket 20
% glicerint tartalmazó Tryptic Soy Brothban (TSB) tároltuk -80ºC-on. Tekintve, hogy munkánk során nagyszámú törzset használtunk, jelölésüket, forrásukat és releváns tulajdonságaikat a kísérletek jobb megértése okán azok leírásánál adjuk meg.
Antibiotikum érzékenység meghatározása
Az antibiotikum érzékenység meghatározása egyrészt korongdiffúziós módszerrel történt, illetve a minimális gátló koncentráció (MIC) meghatározásával. MIC értékeket az antibiotikumokat meghatározott koncentrációgradiensben tartalmazó E-teszt csíkokkal, a gyártó elıírásainak megfelelıen alkalmazva (AB Biodisk, Solna, Svédország) határoztuk meg, illetve bizonyos esetekben mikrodilúciós módszerrel. Az antibiotikum érzékenységi vizsgálatokat a Clinical and Laboratory Standards Institute/National Committee for Clinical Laboratory Standards (CLSI/NCCLS) aktuális évi, érvényben lévı nemzetközi ajánlásai alapján végeztük. A vizsgálatok kivitelezése az ajánlásoknak megfelelıen kontrolltörzsekkel ellenırzött táptalajokon, nemzetközi standardoknak megfelelı körülmények között történtek.
A β-laktamáz enzim termelés detektálása antibiotikum érzékenység meghatározása alapján Az indukálható, részlegesen derepresszált vagy derepresszált AmpC-termelés meghatározására a cefoxitin-cefotaxim antagonizmus-tesztet alkalmaztuk. Az ESBL termelés fenotípusos szőrését, illetve az ESBL termelés megerısítését a CLSI nemzetközi ajánlása alapján végeztük. A karbapenemáz termelés szőrését módosított Hodge-teszttel végeztük el.
Az MBL termelés fenotípusos szőrését, illetve az MBL termelés megerısítését szintén a CLSI nemzetközi ajánlása alapján végeztük.
3.2. Biokémiai vizsgáló módszerek
Analitikai és preparatív izoelektromos fókuszálás
Az analitikai izoelektromos fókuszáláshoz a baktériumokból a β-laktamáz enzimet lyzozymes feltárással nyertük ki. A teljes sejtek és a sejttörmelék centrifugálással történı eltávolítása után a felülúszót használtuk az izoelektromos pont (pI) meghatározására. Az elektroforézishez elıre elkészített pH 3-10 poliakrilamid géleket (BioRad) alkalmaztunk. A preparatív
izoelektromos fókuszáláshoz a baktériumokból a β-laktamáz enzimet Lin módszerével nyertük ki. A fehérjekoncentrációkat a Bio-Rad Protein Assay (BioRad) révén határoztuk meg, marha szérum albumin (BSA) standard alkalmazásával.
Enzimkinetikai vizsgálatok
Az SHV-30 β-laktamáz steady-state kinetikai paramétereit spektrofotométerrel határoztuk meg. A méréseket nitrocefinnel, cefotaximmal és cefepimmel végeztük el. A kinetikai paraméterek (vmax és KM) meghatározását az adatok Michaelis-Menten egyenletbe történı illesztésével végeztük a nemlineáris legkisebb négyzetek elve szerint.
Enzimhez kötött immunoszorbens vizsgálat (ELISA) SHV β-laktamáz kimutatására
Az immunoassay lemezeket egy éjszakára 4 µg/ml tisztított SHV-1 antitestet tartalmazó karbonát-pufferrel (pH 9,5) vontuk be. A standard 0,1 % BSA-ban 0,0015-100 ng/ml koncentrációra oldott tisztított SHV-1 volt. A minták egy éjszakán át növesztett baktériumtenyészetekbıl származó 100 µl-es aliquotok voltak, amelyeket 10 percig forraltunk és sorozatban hígítottuk. Jelölı anyagként sreptavidin-tormaperoxidázt használtunk. Az OD492
értékeket ELISA lemezolvasó segítségével kaptuk meg, és összehasonlítottuk a sorozathígítású, tisztított SHV-1 β-laktamázzal, amelyet belsı referenciapontként használtunk.
Külsı membrán fehérjék izolálása és kimutatása
A külsı membrán fehérjék izolálása során a baktériumsejtek ultrahangos feltárását követıen, a kapott fehérjéket sarkozylos kezelésnek vetettük alá. A különbözı fehérjefrakciók centrifugálással történı szétválasztása után a külsı membrán fehérjéket 11%-os tömörítı és 20%-os futtató SDS-PAGE géleken határoztuk meg. A géleket Coommassie Brilliant Blue R250-el festettük, hogy a fehérjéket láthatóvá tegyük.
3.3. Genetikai módszerek
Plazmid kimutatás, izolálás
A plazmidok rutinszerő kimutatásához az alkalikus lízis módszert használtuk, azonban néhány esetben a plazmidokat plazmid extrakciós kit segítségével nyertük ki (Wizard Plus Minipreps, DNA Purification System; Promega). A restrikciós enzimmel történı emésztés során az enzimeket - EcoRI, HindIII - a gyártó (BioLab) elıírásainak megfelelıen használtuk.
Transzformáció, konjugáció
A transzformáció során a baktérium törzsek extrahált plazmid DNS-ét E. coli DH5-alfa sejtekbe, illetve E. coli DH10B recipiens sejtekbe transzformáltuk. A transzformált baktériumokat a szelektáló antibiotikumot tartalmazó tartalmazó tápagaron tenyésztettük. A konjugáció során recipiensként azid-rezisztens vagy rifampicin-rezisztens E. coli J53 törzset használtunk.
Pulzáló mezejő gélelektroforézis
A pulzáló mezejő gélelektroforézist (pulsed field gel electrophoresis, PFGE) a Centers for Disease Control and Prevention PulseNet protokolljának megfelelıen végeztük. A dendrogramokat Molecular Analyst (Bio-Rad) segítségével készítettük el, a Dice-együttható alkalmazásával, nem súlyozott pár csoport módszerrel (UPGMA), 1,3 %-os pozíció toleranciával.
Polimeráz láncreakció (PCR)
Az egy éjszakán át tenyésztett vizsgálandó izolátum 10 µl-es aliquotját vízzel 10-szeresére hígítottuk és 15 percig forraltuk, majd lecentrifugáltuk. A keletkezett felülúszót használtuk
bakteriális templát DNS-ként a PCR során. A PCR-eket RedTaq DNS-polimerázzal végeztük és különbözı génekre specifikus megfelelı primereket használtunk. A PCR-terméket tartalmazó reakcióelegy 10 µl-ét elektroforézissel vizsgáltuk 0,8 w/v %-os gélben.
Klónozás
Az amplifikált blaSHV termékeket klónoztuk a gyártó elıírásai szerint egy pCR-XL-TOPO vektorba, amely egy kanamycin-rezisztencia determinánst kódolt.
Mutagenezis
A PCR-alapú site-directed mutagenesist a Stratagene QuikChange mutagenesis kit segítségével végeztük. Két komplementer oligonukleotidot állítottunk elı az SHV-1 β- laktamázban található 43-as és 238-as aminosavnak megfelelı helyen és side-directed mutagenesist hajtottunk végre. A mutagenezisnek alávetett DNS-t tartalmazó transzformált E.
coli DH10B telepeket 20 mg/l kloramfenikolt tartalmazó Luria-Bertani (LB) agarra szélesztettük és a telepeket szőrtük a kívánt mutációkra.
DNS-szekvenálás
Az amplifikált termékeket ABI 4500 és ABI 3100 genetikai analizátorok segítségével szekvenáltuk a gyártó elıírásai szerint. A szekvenáló reakciókat a különbözı génekre specifikus megfelelı primerekkel végeztük, amelyeket az elızetes amplifikáció során is használtunk. A szekvencia-analízist a Lasergene DNASTAR szekvencia-analízis szoftverrel (DNAStar) végeztük. Minden génszekvencia azonosítása a GénBank és EMBL adatbázisokban elérhetı szekvenciákkal összehasonlításban történt.
Real-time polimeráz láncreakció „single” nukleotid polimorfizmus (real-time PCR SNP) A blaSHV „single” nukleotid polimorfizmusainak detektálására az 5’-nukleáz assay-t alkalmaztuk. Két, csak egyetlen nukleotidban különbözı oligonukleotidokból álló fluoreszcens próbát használtunk, melyeknek mindkét végen volt jelzıfesték (6-karboxi- 2’,4,4’,5’,7,7’-hexaklorofluoreszcein [HEX] vagy 6-karboxi-fluoreszcein [FAM] és egy csillapító festék (6-karboxi-tetrametilrodamin [TAMRA]). A real-time PCR allél megkülönböztetı assay-ket a Primer Express szoftverrel (Applied Biosystems) terveztünk. A real-time fluoreszcencia detektálását minden egyes ciklus 60 °C-os, hibridizációs-szintetikus szakaszában végeztük. ABI allélmegkülönböztetı szoftvert alkalmaztunk a genotípusok ábrázolására, amely két-paraméteres ábrázoláson alapult a FAM és a HEX intenzitását használva 40 cikluson át.
Valósidejő reverz transzkriptáz PCR
Valósidejő reverz transzkriptáz PCR-t (RT-PCR) végeztünk az ompD és ompF porin gének és az acrB efflux pumpa génnek a rpoB housekeeping génhez viszonyított relatív expressziójának meghatározása céljából. A baktériumokból nyert RNS felhasználásával reverz transzkripció révén egyszálú cDNS-t készítettünk, melyek mennyiségét valósidejő PCR-amplifikációval határoztuk meg, a külsı membránfehérjék (OMP) és az efflux pumpa génekre specifikus primereket alkalmazva. Az expressziós szinteket minden izolátum esetén az rpoB (housekeeping gén) transzkripciós szintjéhez viszonyítva standardizáltuk. Az ompD, ompF és acrB gének expressziójában bekövetkezı relatív változásokat a referencia és a célpont hányadosaként számítottuk ki a 2-∆∆CT módszer segítségével, ahol CT a ciklusküszöb.
3.4. Epidemiológiai vizsgálatok
Epidemiológiai fogalmak
Azokat az eseteket vizsgáltuk, amikor az ESBL-termelés genotipizálással és izoelektromos fókuszálással megerısítésre került. Az izolátumok ismétlıdése akkor merült fel, ha
ugyanabból a betegbıl kerültek kitenyésztésre és genotipizálással nem voltak megkülönböztethetık a korábbi izolátumoktól. Fertızésnek tekintettük azt az esetet, ha a beteg fertızés jelét vagy tünetét mutatta és a vérébıl, vizeletébıl, liquorából, bronchoalveolaris lavage-ából vagy bármilyen egyéb fiziológiásan steril testfolyadékából Klebsiella spp. volt izolálható. Kolonizációnak tekintettük azt az esetet, ha Klebsiella spp.
volt izolálható a betegbıl, de a beteg nem mutatta a fertızés klinikai jeleit vagy tüneteit.
A kórtörténetek áttekintése
A Klebsiella-fertızéseket retrospektív módon elemeztük a kórtörténetek áttekintésével. A demográfiai és klinikai adatokat minden egyes újszülöttre vonatkozóan összegyőjtöttük, beleértve a szülés módját, az egyedüli vagy ikerterhességet, a nemet, a kort, a születési súlyt, a más mikróbák által okozott koinfekciók jelenlété, a gépi lélegeztetést és a fertızés kimenetelét.
3.5. Állatkísérletek
Állatmodell
Minden kísérletben 30-35 g tömegő CD-1 egereket használtunk. Az egereket 107 CFU/gr SHV-5-termelı K. pneumoniae törzzsel fertıztük intraperitoneálisan (i.p.). Az állatokat a Laboratóriumi Állatok Gondozása és Alkalmazása Irányelveinek megfelelıen tartottuk, a kísérleteket pedig a Semmelweis Egyetem (Budapest) Állatgondozási Bizottsága hagyta jóvá minden esetben.
Antibiotikum kezelés
A kezelés 3 órával a fertızés után kezdıdött és 24 óráig tartott. Két dózis amikacint (7,5 mg/kg 10,5 óránként), három dózis cefepimet (80 mg/kg 7 óránként), a monoterápiával megegyezı dózisú amikacin-cefepimet ill. négy dózis imipenemet (40 mg/kg 5,25 óránként) adtunk i.p.. A cisplatint (18 mg/ttkg) szintén i.p. injekcióval adtunk be a fertızés elıtt 3 nappal, a vesemőködés leállítása céljából az imipenemmel, cefepimmel illetve amikacinnal kezelt csoportokban. 20 mg/kg ciprofloxacint és 50 mg/kg levofloxacint adtunk i.p. minden 6 órában 24 óráig.
Antibiotikum szérum szintek meghatározása egerekben
Véletlenszerően kiválasztott CD-1 egereket (30-35 g) használtunk az antibiotikumok szérum szintjének a meghatározásához. Az egyszeri amikacin (7,5 mg/kg), cefepim (80 mg/kg), imipenem (40 mg/kg), ciprofloxacin (20 mg/kg) és levofloxacin (50 mg/kg) dózist intraperitoneálisan adtuk. Vérmintákat a beadás után 15 és 30 perccel ill. 1,2 és 3 órával vettünk. Az imipenem és cefepim szérumszinteket papírkorongos módszerrel, az amikacin szérumszinteket fluoreszcens polarizációs immunassay-vel és a ciprofloxacin és levofloxacin szérumszinteket magas nyomású folyadékkromatográfiával (HPLC) határoztuk meg. A farmakokinetikai féléletidı-értékeket (T1/2), a csúcskoncentrációt (Cmax), a Cmax elsı megjelenését (Tmax), a végtelenbe extrapolált koncentráció-idı görbe alatti területet (AUC) és a koncentráció-idı görbe 0-24 óra közötti görbe alatti területét (AUC0-24) a nonkompartmentalis módszerrel számítottuk ki
Baktérium csíraszám meghatározása az egerek vérében
Vért vettünk az egerektıl a fertızés után különbözı idıpontokban. A sorozathígítások után a mintákat kvantitatív módon tenyésztettük MH agar lemezeken. Egy éjszakán át 37 °C-on történı inkubáció után az élı baktériumokat megszámoltuk és log10 CFU/ml vér középértékben fejeztük ki. A baktériumnövekedés elmaradása esetén a kimutathatóság
határát, azaz 300 CFU/ml-t helyettesítettünk be. A számításokat SSPS 7.5 program segítségével végeztük el.
Túlélési elemzés
Az utánkövetés a túlélés megfigyelésével történt, az elhullást tekintettük végpontnak. A Kruskal-Wallis tesztet követıen Mann-Whitney U-tesztet alkalmaztunk statisztikai elemzésre, P<0,05 értéket tekintve szignifikánsnak. A kezelési idıszakot a kumulatív valószínőség megbecsülése alapján határoztuk meg a Kaplan-Meier túlélési görbe használatával. A P <
0,05 értéket fogadtuk el statisztikailag szignifikánsnak. A túlélést 24, 48 óra és 1 hét után vizsgáltuk a letalitás kiszámításához, a 24 órás túlélést pedig a kumulatív valószínőség megbecsülésével állapítottuk meg a Kaplan-Meier túlélési görbe felhasználásával. A csoportok közötti relatív kockázatot a hazard hányados segítségével becsültük meg (megfelelı 95 %-os konfidencia-intervallummal) a megfigyelt és a számított elhullás összehasonlításával.
A log sor tesztet használtuk a statisztikai elemzéshez, a P<0,05 értéket fogadva el szignifikánsnak.
4. EREDMÉNYEK
4.1. Epidemiológiai vizsgálatok
Az elsı magyarországi ESBL-termelı K. pneumoniae törzsek által okozott esethalmozódás molekuláris epidemiológiai jellemzése
Magyarországon az elsı dokumentált ESBL járvány során az elsı ESBL-termelı K.
pneumoniae törzset 1998. június 30-án észlelték egy szolnoki kórház perinatális intenzív osztályán (PIC). A retrospektív vizsgálat 1997. január 1-ig nem mutatott ki multirezisztens K.
pneumoniae izolátumot a PIC anyagában, azonban az elsı észlelést követıen 1998.
novemberéig további 14 primer és öt ismételt ESBL-termelı izolátumot detektáltak.
Augusztusban ESBL-termelı S. marcescens bukkant fel egy 1 héttel korábban ESBL-termelı K. pneumoniae-vel kolonizált koraszülöttben, továbbá egy ESBL-termelı K. pneumoniae törzset izoláltak a fürdıszappanból. Az összes törzs ESBL termelését izoelektromos fókuszálással és PCR vizsgálattal konfirmáltuk. Az összes ESBL-termelı K. pneumoniae törzs kétféle kromoszóma mintázatot mutatott AP-PCR módszerrel ERIC-2 primert használva. Az 1-14 klinikai ESBL-termelı K. pneumoniae izolátumok és a környezeti törzs A1 mintával rendelkezett, a 15-ös ESBL-termelı K. pneumoniae izolátum A2 mintát mutatott.
A tizennégy ESBL-termelı K. pneumoniae klinikai izolátum (az 1-14 izolátumok), a környezeti ESBL-termelı K. pneumoniae és a S. marcescens izolátum azonos rezisztencia- mintázattal rendelkezett, míg a 15. ESBL-termelı K. pneumoniae izolátumé eltérı volt; a cefepimre, cefpiromra, trimethoprim/sulfamethoxazolra és a tetracyclinre vonatkozó MIC értéke sokkal alacsonyabb volt, mint a többi törzsé. A plazmid elemzés alapján az összes primer klinikai törzs, a környezeti ESBL-termelı K. pneumoniae és a S. marcescens törzs egyetlen nagy plazmiddal rendelkezett és a 1-14 klinikai ESBL-termelı K. pneumoniae izolátum, a környezeti ESBL-termelı K. pneumoniae és a S. marcescens izolátum azonos restrikciós plazmid DNS profillal rendelkezett, ami megerısítette, hogy a törzsek ugyanazt a plazmidot hordozzák. Az SHV-t kódoló gén jelenlétét a plazmidon mindegyik esetben megerısítettük. Az 1-14 ESBL-KP izolátumok ESBL-kódoló plazmidja átvihetı volt az E.
coli J53-2 Rifr törzsbe konjugáció révén és az E. coli DH5-α-ba transzformációval. A Tf1- Tf14 transzformált E. coli MIC értékei kissé alacsonyabbak voltak, mint a donor törzseké, de a β-laktám rezisztencia mintázata az ESBL-termeléssel azonos volt a donor törzsekével. A transzformált törzsek szintén rezisztenssé váltak gentamicinre, tobramycinre, netilmicinre és
trimethoprim/sulfamethoxazolra, ami arra utalt,hogy az ezekre az antibiotikumokra vonatkozó rezisztenciát kódoló gének ugyanazon a plazmidon helyezkedtek el, mint az SHV-gén.
ESBL-termelı Klebsiella spp. ötéves követéses molekuláris epidemiológiai vizsgálatának eredménye a Semmelweis Egyetem II. Perinatális Intenzív Centrumában
Az SE II. Perinatális Intenzív Centrumából (PIC) 2001. január és 2005. decembere között összesen 101 Klebsiella törzset izoláltunk újszülöttekbıl (egy beteg—egy izolátum). Az ESBL-termelı K. pneumoniae és K. oxytoca törzseket két idıszakban izoláltuk, két éves idıkülönbséggel. Az elsı idıszakban (2001. januártól 2003. júniusig) 25 ESBL-termelı K.
pneumoniae és 9 ESBL-termelı K. oxytoca törzset izoláltunk, a második idıszakban (2005.
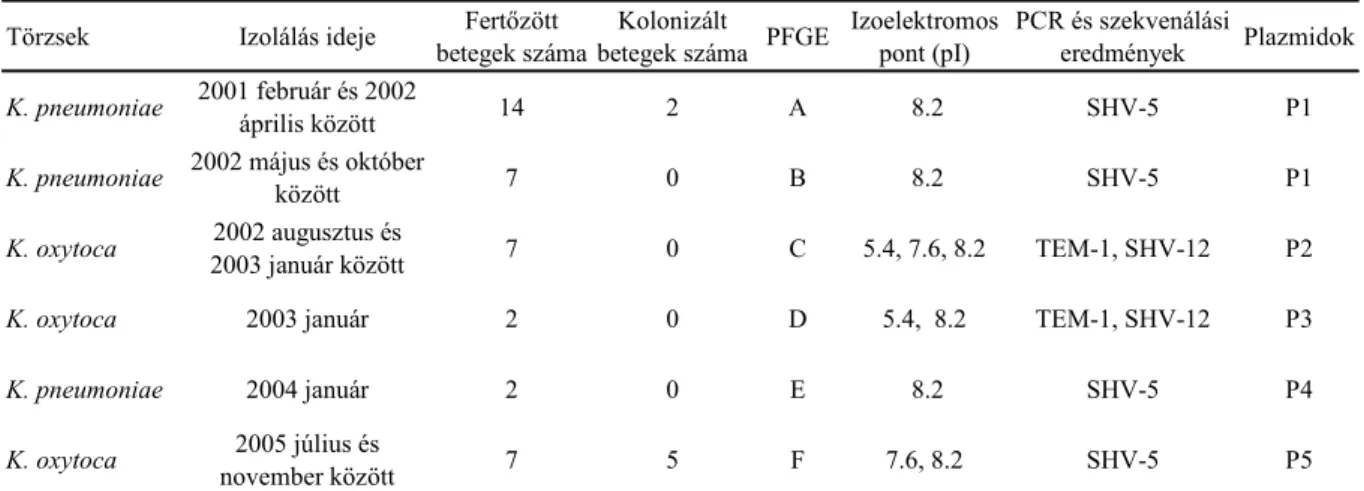
júniustól decemberig) 12 ESBL-termelı K. oxytoca törzset került izolálásra különbözı betegekbıl. Noha a törzsek két különbözı idıszakból származtak igen hasonló érzékenységi profillal rendelkeztek. Az ESBL-termelı Klebsiella spp. által termelt β-laktamáz enzimek, azok izoelektromos pontja és plazmid analízisük eredménye az 1. táblázatban látható.
1. táblázat A I. PIC-en izolált Klebsiella törzsek jellemzıi
Törzsek Izolálás ideje Fertızött betegek száma
Kolonizált
betegek száma PFGE Izoelektromos pont (pI)
PCR és szekvenálási
eredmények Plazmidok K. pneumoniae 2001 február és 2002
április között 14 2 A 8.2 SHV-5 P1
K. pneumoniae 2002 május és október
között 7 0 B 8.2 SHV-5 P1
K. oxytoca 2002 augusztus és
2003 január között 7 0 C 5.4, 7.6, 8.2 TEM-1, SHV-12 P2
K. oxytoca 2003 január 2 0 D 5.4, 8.2 TEM-1, SHV-12 P3
K. pneumoniae 2004 január 2 0 E 8.2 SHV-5 P4
K. oxytoca 2005 július és
november között 7 5 F 7.6, 8.2 SHV-5 P5
A 2001. február és 2003. január között izolált ESBL-termelı K. pneumoniae és K. oxytoca törzsek további vizsgálata három különbözı PFGE-mintázatú SHV-5 termelı K. pneumoniae (A, B, E) és két különbözı mintázatú SHV-12 termelı K. oxytoca (C, D) izolátumot derített fel, melyeknek plazmidprofilja is eltérı volt (1. táblázat). 2005. július és november között egy újabb PFGE típusba tartozó (F) SHV-5 termelı K. oxytoca törzs jelent meg. Az ESBL- termelı törzsek molekuláris epidemiológiai vizsgálata során a PIC-en nem egy domináns törzs jelenlétét, hanem több domináns törzs jelentıs idıbeli változását észleltük.
2001. január és 2005. december között 46 újszülöttbıl izoláltunk ESBL-termelı Klebsiella törzseket, 55 újszülöttbıl pedig nem ESBL-termelı Klebsiella törzseket. A klinikai tünetek alapján ESBL-termelı K. pneumoniae okozta fertızéseket állapítottunk meg 23 újszülöttnél, 2 esetben pedig kolonizációt. ESBL-termelı K. oxytoca fertızést 16 újszülöttnél állapítottunk meg, kolonizációt öt esetben. 37 újszülöttnek volt nem ESBL-termelı K. pneumoniae és nyolcnak nem ESBL-termelı K. oxytoca okozta fertızése, 10 esetben pedig nem ESBL- termelı Klebsiella törzsekkel való kolonizációt tapasztaltunk. A vizsgált kockázati tényezık tekintetében - nem, gesztációs idı, ikerterhesség, születési súly, centrális vénás katéter, gépi lélegeztetés, mesterséges táplálás, polimikróbás fertızés, császármetszés, transzfúzió—nem találtunk statisztikailag szignifikáns különbséget az elıbb részletezett csoportoknak megfelelıen az ESBL-termelı és a nem ESBL-termelı Klebsiella spp. között. Ugyan a nem ESBL-termelı Klebsiella fajokkal fertızött betegek esetében nagyobb volt a túlélési arány (mortalitási arány: 2/45, 4,4%), mint az ESBL-termelı Klebsiella fajokkal fertızötteknél (mortalitási arány: 6/39, 15%), ez a különbség szintén nem volt statisztikailag szignifikáns.
4.2. ESBL enzimek újabb fenotípusos és genotípusos detektálási lehetısége
ESBL enzimek fenotípusos detektálási lehetısége Enterobacter cloacae törzsekben
2003. március és 2004. július között a Pittsburgh-i Egyetem Orvosi Központjában (UPMC) izolált 45 hemokultúrából származó E. cloacae törzseket vizsgáltunk. Az E. cloacae izolátumok harmada (15) SHV-típusú ESBL-t - SHV-2, -5, -7, -12, -14, és -30-t is termelt az AmpC-típusú β-laktamázok túltermelése mellett. Az ESBL-termelık döntı része (11/15) TEM-1 β-laktamázt is termelt. Az E. cloacae-re vonatkozó CLSI ESBL-szőrési korongdiffúziós kritériumokat alkalmazva azt tapasztaltuk, hogy 23 izolátum esetén kaptunk
„pozitív” eredményt, de ezek közül 9 izolátum nem volt ESBL-termelı (2.
táblázat). A
megerısítı eredmé- nyek pozitívak voltak 7/15 ESBL-termelı törzs esetén, de a nem ESBL-termelık esetén nem. A CLSI ESBL- szőrési MIC-krité- riumok hasonló eredményekhez vezet- tek (2. táblázat), noha a megerısítı tesztek csak 2/15 ESBL- termelı törzs esetén voltak pozitívak. A szokványos kettıs korongdiffúziós tesz- tek, melyeknél ceftazidim és cefota- xim korongot használtunk, ritkán voltak pozitívnak. A cefepim érzékenységi eredményeknek az ESBL-termelés markereként történı alkalmazása jóval hasznosabbnak bizonyult (2.
táblázat). Mind a 13 izolátum, melynek cefepim MIC-e 2 µg/ml vagy nagyobb volt, ESBL- termelınek mutatkozott és 15/18 (83 %) izolátum, melynek cefepim MIC-e > 0,25 µg/ml volt, bizonyult ESBL-termelınek. A cefepim-klavulánsavas megerısítı teszt csak 73 %-ban volt szenzitív korong-diffúzió esetén és 53%-ban ≥ 3 MIC csökkenés esetén (2. táblázat). Kettı kivételével az összes ESBL-termelı E. cloacae törzs, de egyetlen nem ESBL termelı törzs sem rendelkezett ≥2 µg/ml-es MIC-értékkel. Az ESBL-termelı törzsek cefepimre vonatkozó MIC-értéke 64 µg/ml volt, míg a nem ESBL-termelık esetén 0,5 µg/ml. A CLSI cefepimre vonatkozó jelenlegi határértékei alapján az ESBL-termelı törzsek kétharmadát (10/15) lehetett volna cefepimre érzékenynek tekinteni.
ESBL enzimek újabb genotípusos detektálási lehetısége
A real-time PCR SNP vizsgálatot dolgoztunk ki, hogy az SHV fehérje 240-es helyén található aminosavat érintı GAA (glutamát) és AAA (lizin) mutációkat detektálni tudjuk. A vizsgálatot a következı törzseken állítottuk be (3. táblázat): SHV-7 és SHV-30-termelı E. cloacae ES24;
2. táblázat A cefepim ESBL-termelés indikátoraként történı alkalmazása
ESBL nem-ESBL Szenzitivitás Specificitás Korong-diffúziós szőrıteszt*
pozitív 13 0 0.87 1
negatív 2 30
Korong-diffúziós megerısítı teszt**
pozitív 11 0 0.73 1
negatív 4 30
Kettıs-korong diffúziós teszt 20 mm
pozitív 13 0 0.87 1
negatív 2 30
Kettıs-korong diffúziós teszt 30 mm
pozitív 8 0 0.53 1
negatív 7 30
Érzékenység alapján szőrıteszt (MIC)***
pozitív 14 0 0.93 1
negatív 1 30
Érzékenység alapján megerısítı teszt (MIC)****
pozitív 8 0 0.53 1
negatív 7 30
Kategóriák (No. izolátumok)
* <27 mm indikálhatja az ESBL termelést a vizsgálatban
**** A MIC érték > 3 koncentráció csökkenése klavulánsav jelenlétében
*** A cefepim breakpointja 1 ug/ml volt a vizsgálat során
** >5 mm növekedés a gátlási zóna átmérıjében klavulánsav hatására
SHV gén Izolátumok
száma Eredet SHV enzim szekvenciája
(692.-711. nucleotid) Allél diszkrimináció
SHV-30 1 Transzformáns E. coli CC GGA GCT AGC GAA CGG GGT Allél G
SHV-14 1 Klinikai E. cloacae izolátum CC GGA GCT GGC GAA CGG GGT Allél G
SHV-7, SHV-30 1 E. cloacae ES24 CC GGA GCT AGC KAA CGG GGT Allél G,A
SHV-5 2 Klinikai E. cloacae izolátum CC GGA GCT AGC AAA CGG GGT Allél A
SHV-7 5 Klinikai E. cloacae izolátum CC GGA GCT AGC AAA CGG GGT Allél A
SHV-18 1 K. pneumoniae ATCC 700603 CC GGA GCT GCC AAA CGG GGT Nem meghatározott SHV-29 1 KPC-1 termelı K. pneumoniae CC GGA GCT GCC GAA CGG GGT Nem meghatározott 3. táblázat Az SHV-termelı izolátumok SHV szekvenciának összehasonlítása
SHV-30-termelı plazmid-transzformált E. coli EP-MAX10B; SHV-18 termelı K.
pneumoniae ATCC 700603; SHV-29-termelı KPC-1 termelı K. pneumoniae; E. coli EP- MAX10B; AmpC β-laktamáz termelı klinikai E. cloacae; SHV-5 és AmpC β-laktamáz termelı klinikai E. cloacae; SHV-7 és AmpC β-laktamáz termelı klinikai E. cloacae; SHV- 14 és AmpC β-laktamáz termelı klinikai E. cloacae. Az SHV enzim 692 és 711 nukleotid pozíciójára tervezett próba egyik festék fluoreszcens jelének (FAM fluoreszcencia a G allélre és HEX fluoreszcencia az A allélre) a másikhoz viszonyított fokozódása a G és az A allélek homozigótaságára utalt a 703-as nukleotid pozícióban adott PCR allélre vonatkozóan. Mindkét jel növekedése heterozigótaságra utalt. Az eredmények az 1. ábrán láthatóak. Az E. cloacae ES24 izolátum jelentıs emelkedést mutatott mind a FAM, mind a HEX festék fluoreszcenciájában.
Az SHV-30 termelı plazmid- transzformált E. coli EP- MAX10B és az SHV-14 termelı klinikai E. cloacae izolátumok emelkedett FAM és változatlan HEX fluoreszcenciát mutattak, ami a FAM-specifikus G allélre vonatkozó homozigótaságra utal.
Csak a G volt jelent a 703-as pozícióban (3. táblázat). Mindazonáltal az SHV-14 termelı E. cloacae izolátumok a 700-as helyzető nukleotidban különbséget mutattak a próbához képest (3. táblázat). A két SHV-5 és az öt SHV-7 termelı klinikai E. cloacae izolátum csak a HEX festék fluoreszcenciájában mutatott emelkedést, ami a specifikus A allél jelenlétére utal a 703-as helyen (1. ábra). Az SHV-18 termelı K. pneumoniae ATCC 700603 izolátum és az SHV-29 termelı KPC-1 izolátum nem mutatott változást sem a FAM, sem a HEX fluoreszcenciájában (1. ábra). A szekvenálási eredmények alapján az SHV-18 termelı K. pneumoniae ATCC 700603 izolátumban a 703-mas helyen A, míg az SHV-29 termelı KPC-1 izolátumban G volt jelen;
ennek ellenére nem volt növekedés az A allélre jellemzı HEX, sem a G allélre jellemzı FAM fluoreszcenciájában. Ennek az az oka, hogy mindkét izolátumban a 700-as és a 701-es helyen is eltérés volt a nukleotidszekvenciában a próbához képest (3. táblázat), aminek következtében a specifikus próba nem kötıdött a DNS-hez. A E. coli EP-MAX10B és a kromoszómális AmpC β-laktamáz termelı E. cloacae izolátum esetén nem volt változás a fluoreszcencia intenzitásában sem a FAM, sem a HEX esetében (1. ábra), mivel nem tartalmazták a blaSHV gént.
0 1 2 3 4 5 6 7 8
0 0,5 1 1,5 2 2,5
Allél A (HEX)
Allél G (FAM)
G
G, A
A
1. ábra Allél diszkrimináció. ♦ SHV-30-termelı E. coli HB10B transzformáns, SHV-14- termelı E. cloacae törzs, ▲ E. cloacae ES24, ● egy SHV-5-termelı és hét SHV-7- termelı E. cloacae törzs, – SHV-18-termelı K. pneumoniae ATCC700603, SHV-29- termelı KPC-1 törzs, E. coli DH10B, kromoszómális béta-laktamáz termelı E. cloacae törzs, ■ víz
Nincs amplifikáció
4.3. Új ESBL enzimek izolálása és karakterizálása
Új ESBL enzimek izolálása
Különbözı vizsgálataink során több új ESBL enzimet sikerült azonosítanunk, melyek GénBank azonosítóval is rendelkeznek: a TEM-131-t (AY436361) Salmonella enterica subsp.
enterica serovar typhimurium-ból; az SHV-30-t (AY661885) E. cloacae-ból izoláltuk, és K.
pneumoniae-ból a CTX-M-59-t (DQ408762) és SHV-85-t (DQ322460). Ezek közül két enzimet, a TEM-131-t és az SHV-30-t vizsgáltuk meg részletesebben.
A TEM-131 és SHV-30 karakterizálása
A TEM-131 szekvenciájának aminosav-szubsztitúciói a TEM-1 β-laktamáz szekvenciájával összehasonlítva a Leu21Phe, Glu104Lys, Arg164Ser, Met182Thr és Ala237Thr voltak. A TEM-131 termelı transzformált törzsek a TEM-63 (Leu21Phe, Glu104Lys, Arg164Ser, Met182Thr) termelı transzformált törzsekhez képest kissé magasabb cefotaxim MIC értékkel rendelkeztek. Az emelkedett cefotaxim MIC értékekért az Ala237Thr szubsztitúció volt a felelıs.
Az SHV-30 szekvenciájának aminosav szubsztitúciói az SHV-1 β-laktamáz szekvenciájával összehasonlítva Ile8Phe, Arg43Ser, Glu238Ser. Az SHV-30 β-laktamáz ceftazidimre (MIC = 16 µg/ml), cefotaximra (MIC = 16 µg/ml) és cefepimre (MIC = 2 µg/ml) kiterjedı rezisztenciát okoz, az SHV-1-gyel összehasonlítva. Az SHV-30 β-laktamáz cefotaximra vonatkozó KM-értéke alacsonyabb volt, mint az SHV-2 (Glu238Ser) esetében (4.9 ± 0.1 µM ill. 18 ± 2.3 µM). Az Arg43Ser szubsztitúció hatására SHV-2 környezetben a piperacillin/tazobactamra vonatkozó MIC-ek megemelkednek az SHV-2-höz képest. A cefotaxim és a cefepim hidrolízisének katalitikus hatékonysága az SHV-30 esetén nagyobb volt, mint az SHV-2-nél. Az egy éjszakán át tartó növekedés során termelt β-laktamáz mennyisége nagyobb volt az Ile8Phe-Arg43Ser-Glu238Ser variánsban, mint a Glu238Ser variánsban.
4.4. Az ESBL termelés és a csökkent kinolon érzékenység kapcsolata
A vizsgálat során 2002 és 2006 között izolált 70 ESBL-termelı E. coli, 101 ESBL-termelı K.
pneumoniae, 5 ESBL-termelı Citrobacter freundii és 61 ESBL-termelı Enterobacter spp.
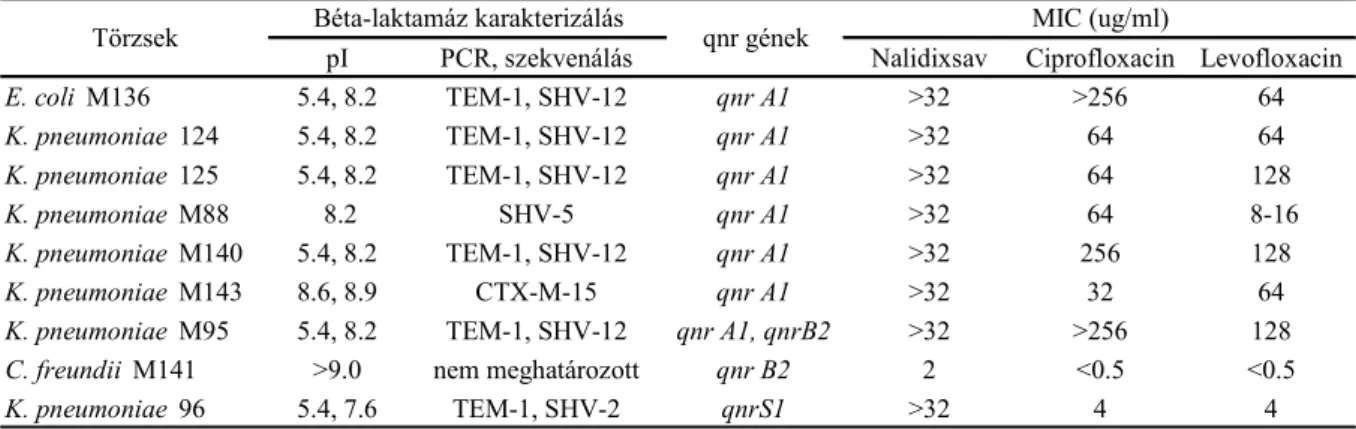
klinikai izolátum esetében vizsgáltuk a qnrA, qnrB, qnrS és aac(6’)-Ib-cr gének jelenlétét. A qnr determinánsok prevalenciája viszonylag magas volt a K. pneumoniae (8 %) és alacsony az E. coli izolátumokban (1,6 %) valamint az Enterobacter fajok esetén (0 %). Az ötbıl egy ESBL-termelı C. freundii izolátum volt qnr-pozitív (4. táblázat). A qnrA1, qnrB2 és qnrS1
volt kimutatható és a qnrA1-nek volt a legnagyobb prevalenciája (3 %). Tanulmányunk szerint a qnrA1 gén jelenléte kapcsolt volt az SHV-5, SHV-12 és CTX-M-15 enzimekkel. Az
4. táblázat A qnr-pozitív ESBL-termelı törzsek által termelt béta-laktamázok jellemzése és a törzsek MIC értékei
pI PCR, szekvenálás Nalidixsav Ciprofloxacin Levofloxacin
E. coli M136 5.4, 8.2 TEM-1, SHV-12 qnr A1 >32 >256 64
K. pneumoniae 124 5.4, 8.2 TEM-1, SHV-12 qnr A1 >32 64 64
K. pneumoniae 125 5.4, 8.2 TEM-1, SHV-12 qnr A1 >32 64 128
K. pneumoniae M88 8.2 SHV-5 qnr A1 >32 64 8-16
K. pneumoniae M140 5.4, 8.2 TEM-1, SHV-12 qnr A1 >32 256 128
K. pneumoniae M143 8.6, 8.9 CTX-M-15 qnr A1 >32 32 64
K. pneumoniae M95 5.4, 8.2 TEM-1, SHV-12 qnr A1, qnrB2 >32 >256 128
C. freundii M141 >9.0 nem meghatározott qnr B2 2 <0.5 <0.5
K. pneumoniae 96 5.4, 7.6 TEM-1, SHV-2 qnrS1 >32 4 4
Béta-laktamáz karakterizálás MIC (ug/ml)
Törzsek qnr gének
összes ESBL-termelı izolátumból hatvanhárom (26,6 %) volt pozitív aac(6’)-Ib-re, amelybıl 19-ben (az összes 8 %-a)—16 K. pneumoniae és 3 E. coli—volt jelen az aac(6’)-Ib-cr variáns.
Egyetlen qnr-pozitív törzs sem hordozta az aac(6’)-Ib-cr variánst. A qnrA1-pozitív törzsek—
hat K. pneumoniae és egy E. coli—rezisztensek voltak nalidixsavra, norfloxacinra, ciprofloxacinra és levofloxacinra, igen magas MIC-értékekkel, azonban a qnrA1 gén jelenléte önmagában csupán alacsony szintő kinolon-rezisztenciát okozott (5. táblázat). A qnrB gént két izolátumban detektáltuk: egy K. pneumoniae és egy C. freundii esetén. Egy K.
pneumoniae izolátum mind a qnrA1, mind a qnrB2 géneket hordozta, de csak a qnrA1 volt konjugációval átvihetı (5. táblázat). Önmagában a qnrA1 átvitele nem eredményezett jelentıs változást a kinolon--érzékenységben a transzkonjugánsok esetében (5. táblázat). A kizárólag a qnrB2 gént hordozó C. freundii M141 érzékeny volt a vizsgált fluorokinolonokra, legalább 8- szor kisebb MIC-értékekkel, mint a CLSI által javasolt érzékenységi határértékek. A qnrS1 gént csak egy K. pneumoniae törzsben detektáltuk, amely rezisztens volt a legtöbb vizsgált
fluorokinolonra. Azonban a norfloxacin (16 mg/l) és a ciprofloxacin (4 mg/l) MIC-értékei a CLSI által javasolt határértékek voltak. A levofloxacin MIC-értéke (4 mg/l) a két CLSI határérték (8 és 2 mg/l) között volt. A 19 aac(6’)-Ib-cr-pozitív izolátumból 6 (32 %) volt érzékeny mind ciprofloxacinra, mind levofloxacinra. A aac(6’)-Ib-cr jelenléte nem eredményez nagy emelkedést a kinolonok MIC-értékeiben, bár jelentısen növeli a kromoszómális mutánsok szelekciójának gyakoriságát.
4.5. Gram-negatív baktériumok karbapenem rezisztenciájának vizsgálata
Ertapenem rezisztens Enterobacter cloacae törzs vizsgálata
Egy betegbıl két különbözı idıpontban izolált ertapenem-érzékeny (ES24) és rezisztens (ER24) ESBL-termelı E. cloacae izolátumot vizsgáltunk meg. A két izolátum azonosságát a PFGE vizsgálat bizonyította. Bár az ER24 izolátumban kissé fokozottabb β-laktamáz termelést detektáltunk, nem volt különbség a két törzs által termelt β-laktamázok számában és típusában, mindkét törzs TEM-1, SHV-7, SHV-30 és MIR β-laktamáz enzimeket termelt. Az ES24 és ER24 ertapenem, imipenem, meropenem és ciprofloxacin MIC értékeit összehasonlítva önmagukban és PAβN – efflux pumpa inhibitor – jelenlétében, ER24 esetében a PAβN jelentıs mértékben csökkentette a MIC értékeket (ertapenem esetében
>32→12 µg/ml, imipenem 4→2 µg/ml, meropenem 6→0.75 µg/ml és ciprofloxacin >32→3 µg/ml-re). Az ES24 izolátumból mind OmpF és OmpD külsı membrán fehérjét tudtunk izolálni, addig az ER24-bıl csak OmpD-t (2. ábra). Valósidejő RT-PCR-rel vizsgálva az ER24 izolátumban az ompF és ompD gének transzkripciós szintje 11-szer ill. 55-ször volt
5. táblázat A qnr-pozitív törzsek konjugálásának eredménye és a konjugált baktériumok jellemzıi
Nalidixsav Ciprofloxacin Levofloxacin
E. coli M136 + qnr A1 <0.5 <0.5 <0.5
K. pneumoniae 124 + qnr A1 >32 16 16
K. pneumoniae 125 + qnr A1 >32 8 16
K. pneumoniae M88 + qnr A1
K. pneumoniae M140 - negatív K. pneumoniae M143 - negatív
K. pneumoniae M95 + qnr A1 >32 8 8
C. freundii M141 + negatív
K. pneumoniae 96 + negatív
Törzsek Konjugálás qnr gének jelenléte a konjugált sejtekben
A konjugát sejtek MIC (ug/ml) értékei
alacsonyabb az ES24 izolátumhoz képest. Az acrB efflux pumpa génjének transzkripciós szintjét vizsgálva azok megegyeztek a két törzsben (1,2-szer volt csak magasabb az ER24-ben, mint az ES24- ben). Az ompF és ompD gének csökkent mennyiségő RNS- transzkriptuma arra utalt, hogy az ER24 izolátum külsı membránja kevésbé volt permeábilis, mint a ES24 törzsé, valószínőleg ez vezethetett egy pumpa által okozott magasabb szintő rezisztenciához anélkül, hogy annak hiperexpressziója önmagában szükséges lenne.
Ertapenem rezisztens Klebsiella pneumoniae és Klebsiella oxytoca törzs vizsgálata
A K. pneumoniae kromoszómálisan kódolt, nem-ESBL típusú blaSHV-11 gént és plazmidon kódolt blaCTX-M-15, blaTEM-1 géneket, illetve class-1 integronon elhelyezkedı blaVIM-4 gént tartalmazott. A K. oxytoca törzsben csak a class-1 integronon lévı blaVIM-4 gént találtuk.
Mindkét integron azonos plazmidon helyezkedett el és két gén kazettát hordozott: az elsı pozícióban egy aac(6’)-Ib (úgynevezett aacA4) gént és ezt követıen egy blaVIM-4 gén kazettát.
A PFGE és MLST vizsgálatok igazolták, hogy a K. pneumoniae törzs a korábban leírt ST11 klónba tartozott.
Karbapenem rezisztens Pseudomonas aeruginosa és Acinetobacter baumannii törzsek vizsgálata
Egy külföldön kórházba került magyar beteg hazaszállítása után, a beteg mintáiból az itthoni felvétel napján cefalosporin illetve karbapenem rezisztens P. aeruginosa, rezisztens A.
baumannii és cefalosporin rezisztens K. pneumoniae törzs került izolálásra. A molekuláris vizsgálatok PER-1 termelı P. aeruginosa, PER-1 termelı A. baumannii, SHV-5 termelı K.
pneumoniae és VIM-2 termelı P. aeruginosa jelenlétét igazolták. Az izolált Gram-negatív baktériumtörzsek jellemzıi a 6. táblázatban láthatóak. A betegbıl származó P.
6. táblázat Az izolált Gram-negatív baktérium törzsek jellemzıi
TEM PCR SHV PCR PER PCR OXA PCR VIM PCR PFGE pI(s)
P.aeruginosa (PA1) negatív negatív PER-1 OXA-10 negatív A típus 5.3, 6.1, 8.0 P.aeruginosa (PA2) negatív negatív negatív negatív negatív B típus 8.0 P.aeruginosa (PA3) negatív negatív negatív OXA-1 VIM-2 C típus 5.3, 7.4, 8.0 A. baumanii TEM-1 negatív PER-1 negatív negatív NM 5.3, 5.4, > 8.5
K. pneumoniae TEM-1 SHV-5 negatív negatív negatív NM 5.4, 8.2
NM: nem meghatározott
aeruginosa törzsek PFGE mintázatát összevetve a kórházban korábban elıforduló P.
aeruginosa törzsek PFGE mintázatával megerısítést nyert, hogy a PER-1 termelı P.
aeruginosa és a VIM-2 termelı P. aeruginosa külsı eredető volt. A PER-1 termelı P.
aeruginosa és A. baumannii törzsek eltőntek a kórházból, s azóta sem figyeltek meg további fertızéseket ezekkel a törzsekkel.
2. ábra . ES24 és ER24-bıl izolált külsı membrán fehérjék SDS-PAGE képe.
75 kD
50 kD
37 kD
25 kD
20 kD OmpF
OmpD
4.6. ESBL-termelı törzsek által okozott fertızések terápiás lehetıségei kísérletes állatmodellekben
A elsı vizsgálatsorozat során összehasonlítottuk az amikacin, a cefepim, az amikacin-cefepim és az imipenem hatását; illetve a ciprofloxacin és levofloxacin hatását SHV-5 ESBL-termelı K. pneumoniae törzzsel fertızött szeptikus egerekben, magas kezdeti csíraszám alkalmazásával. Az antibiotikum érzékenységi vizsgálatok az eredménye 105 CFU/ml és 107 CFU/ml csíraszámot
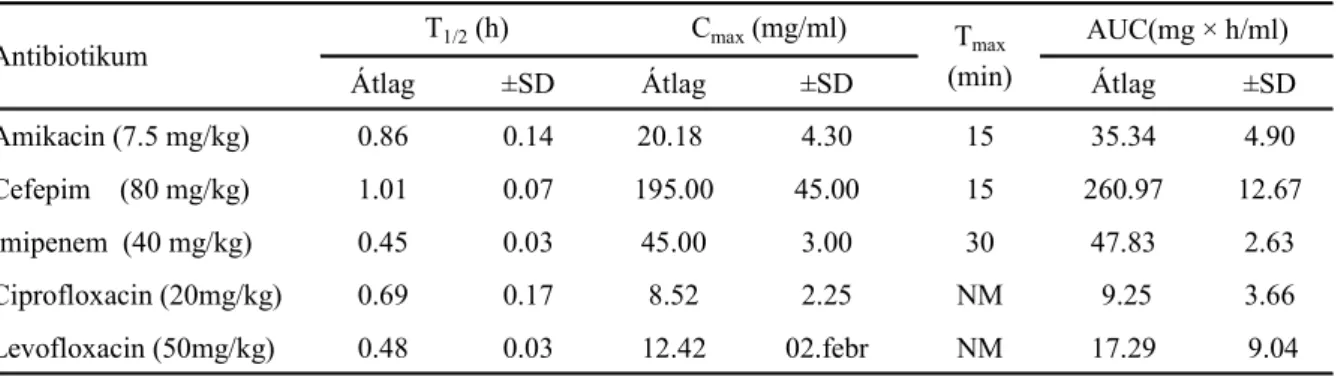
használva a 7. táblázatban láthatók. A farmakokinetikai elemzésbıl származó adatokat az 8.
táblázatban adjuk meg.
Az in vivo kísérlet során a magas csíraszámú 107 CFU/gr SHV-5-termelı K. pneumoniae-val i.p. fertızött egerek túlélését és vérükben a baktérium-jelenlétét vizsgáltuk. A vér
7. táblázat Az antibiotikumok MIC (µg/ml) és MBC (µg/ml) értékei
MIC MBC MIC MBC
Amikacin 0.5 0.5 0.5 0.5
Cefepim 1 1 >256 NM
Imipenem 0.125 0.125 0.5 1
Ciprofloxacin 0.063 0.063 0.125 0.125
Levofloxacin 0.063 0.063 0.25 0.25
NM: nem meghatározott
105 CFU/ml 107 CFU/ml Antibiotikum
8. táblázat Antibiotikumok farmakokinetikai paraméterei i.p. injekciót követıen
Átlag ±SD Átlag ±SD Átlag ±SD
Amikacin (7.5 mg/kg) 0.86 0.14 20.18 4.30 15 35.34 4.90
Cefepim (80 mg/kg) 1.01 0.07 195.00 45.00 15 260.97 12.67
Imipenem (40 mg/kg) 0.45 0.03 45.00 3.00 30 47.83 2.63
Ciprofloxacin (20mg/kg) 0.69 0.17 8.52 2.25 NM 9.25 3.66
Levofloxacin (50mg/kg) 0.48 0.03 12.42 02.febr NM 17.29 9.04
SD, standard deviáció; NM: nem meghatározott
AUC(mg × h/ml) Antibiotikum
T1/2 (h) Cmax (mg/ml) Tmax (min)
0 1 2 3 4 5 6 7 8 9 10
0 3 6 9 12 15 18 21 24 27
Idı (h)
K. pneumoniae log 10 CFU/ml
Kezeletlen fertızött Kezeletlen fertızött Kezeletlen fertızött Amikacin Amikacin Amikacin Amikacin+cefepim Amikacin+cefepim Amikacin+cefepim Cefepim Cefepim Cefepim Imipenem Imipenem Imipenem Detektálási határ
Antibiotikumkezelés idıtartama
3. ábra Az egerek vérében a csíraszám alakulása
baktériumkoncentrációját detektálva, a baktérium koncentráció folyamatosan növekedését észleltük a kezeletlen csoportban; a cefepimmel kezelt csoportban kezdetben csökkent a vérben a csíraszám, de 6 óra elteltével a baktériumok számának emelkedése következett be, míg a többi csoportban –imipenemmel, amikacinnal és amikacin-cefepimmel kezelt csoportban - a vérben a csíraszám folyamatosan csökkent (3. ábra). Míg a cefepimmel kezelt csoport vér csíraszáma statisztikailag is különbözött a többi kezelt csoporttól (P < 0,05), addig nem volt különbség az amikacint, az amikacin-cefepimet és az imipenemet kapott csoport között (P > 0,37). A vér baktérium-koncentrációját a ciprofloxacin 7,33 log10 CFU/ml-rıl 4,08 log10 CFU/ml-re, a levofloxacin 3,60 log10 CFU/ml-re csökkentette a fertızés után 8 órával, ami szignifikánsan különbözött a fertızött kezeletlen csoporttól.
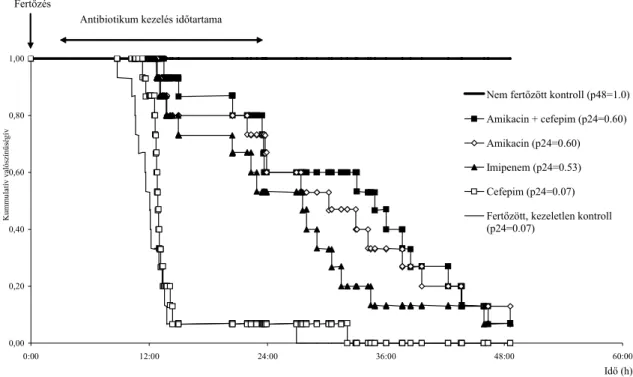
A túlélési elemzés során a nem fertızött csoportban nem volt elhullás. 24 óra után a letalitás 14 volt a 15-bıl a fertızött kezeletlen csoportban, 6 a 15-bıl az amikacinnal ill. amikacin- cefepimmel kezelt csoportokban, és 7 a 15-bıl az imipenemmel kezelt csoportban (4. ábra).
4. ábra SHV-5-termelı K. pneumoniae-vel i.p. fertızött, majd amikacinnal, cefepimmel, cefepim-amikacinnal és imipenemmel kezelt egerek túlélési görbéje.
0,00 0,20 0,40 0,60 0,80 1,00
0:00 12:00 24:00 36:00 48:00 60:00
Idı (h)
Kummulatív valószínőségív
Nem fertızött kontroll (p48=1.0) Amikacin + cefepim (p24=0.60) Amikacin (p24=0.60) Imipenem (p24=0.53) Cefepim (p24=0.07) Fertızött, kezeletlen kontroll (p24=0.07)
Fertızés
Antibiotikum kezelés idıtartama
A 24 órás túlélés 100 %, 93,3 % és 0 % volt a ciprofloxacinnal illetve a levofloxacinnal kezelt és a kezeletlen kontroll csoportban. A különbségek szignifikánsak voltak a kezelt csoportok és a kontroll csoport között (p<0,001 mindkét kezelésnél). A ciprofloxacin és a levofloxacin is jelentısen meghosszabbította az egerek túlélését a fertızött kezeletlen csoporttal összehasonlítva.
A második vizsgálat sorozatban meghatároztuk a toxikus dózisokat az A3-APO peptid i.p.
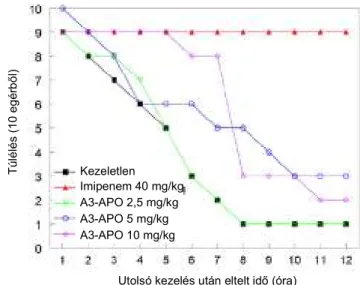
bevitele esetén és tanulmányoztuk az A3-APO alkalmasságát szisztémás fertızések kezelésére i.p. alkalmazás esetén. Az egyszeri akut letális dózis 50 mg/kg volt, a Nem Kimutatható Káros Hatás Határértéke (NKKHH) pedig az egerekben 3x20 mg/kg volt. Az egereket az ESBL-termelı E. coli 5770 törzs LD50:2 x 108 CFU/g dózisával fertıztük i.p. A vizsgálat elsı szakaszában a fertızött kezeletlen egerek (negatív kontroll) korai túlélése -19 órával a fertızés után - 20% volt és a késıi túlélése – 25 órával a fertızés után - csak 10 %-os volt. A túlélési arány az imipenemmel (3x40 mg/kg) kezelt állatok esetében 90 % volt. Az A3-APO kezelés a dózis függvényében volt sikeres. A korai (19 órával a fertızés után) túlélési arány 20%, 50%, illetve 80 % volt a 2,5 mg/kg, 5 mg/kg illetve a 10 mg/kg dózisoknál (5. ábra).
Ugyanezeknél a dózisok- nál (2,5, 5 és 10 mg/kg) a késıi (25 óra) túlélési arány kevésbé volt látványos 10%, 30%
illetve 20 % volt (5. ábra).
A fertızött kezeletlen állatokban a vér baktérium koncentrációja a fertızés után 4 órával mért alacsony 107 CFU/g értékrıl 108 CFU/g-ra nıtt a fertızés utáni 12.
órában. Az A3-APO peptid elsı 10 mg/kg dózisa után a baktérium szám a 105 CFU/g alatti tartományra csökkent. A peptid második dózisa után a baktériumok mennyisége tovább csökkent a kimutathatósági határ alá. A hosszú távú baktérium koncentrációk a közép-magas 104 CFU/g értékek körül voltak, hasonlóan a 40 mg/kg imipenemmel kezelt egerekbıl számolt értékekhez.
A cisplatinnal történı elızetes kezelés után a fertızés ugyanolyan sikeres volt, mint cisplatin kezelés nélkül. Amíg a fertızött nem kezelt csoport túlélése 10 % volt 24 és 48 órával a fertızés után, addig az imipenemmel (3x40 mg/kg) kezelt csoportban a túlélés csak 83 % és 56 % volt a fertızést követıen 24 illetve 48 óra múlva. A 10 mg/kg dózisban adott A3-APO nagyon hatékony volt: a túlélési arányok 70% és 40 % voltak a fertızést követıen 24 illetve 48 óra múlva. A kezeletlen egerek vérének baktérium koncentrációja folyamatosan emelkedett és 12 óra elteltével elérte a 6 x 107 CFU/ml-es maximumot. Az elsı dózis imipenem a vér baktérium koncentrációját 102 CFU/ml-rel csökkentette, és a második dózis után már közelítette a 103 CFU/ml-es értéket, ami a detektálás alsó határa. Az elsı adag 10 mg/kg és 20 mg/kg A3-APO esetén a baktériumkoncentráció 40, illetve 60-szoros csökkenése volt megfigyelhetı. A második dózis A3-APO a baktérium koncentrációt szintén a 103 CFU/ml-es alsó határra csökkentette. A 10 mg/kg A3-APO esetében a második dózis után az egérek vérében a baktériumkoncentráció a detektálási határérték alá csökkent. A 20 mg/kg A3-APO dózis esetében pedig az egerek 40%-ban nem tudtunk baktériumot detektálni a vérben.
5. A TÉZISEK LEGFONTOSABB ÚJ MEGÁLLAPÍTÁSAI
Epidemiológiai vizsgálatok
Az elsı magyarországi újszülött intenzív osztályon leírt ESBL-termelı (SHV-5)-termelı K.
pneumoniae törzs által okozott járvány egy domináns klón jelenlétét igazolta, mely környezeti mintából is kimutatható volt. Egyetlen betegbıl történı ESBL-termelı K. pneumoniae, majd a hasonló plazmiddal rendelkezı ESBL-termelı S. marcescens izolálása az SHV-5-t kódoló plazmid in vivo átvitelére utalt. Az in vivo illetve a kísérleti körülmények között megfigyelt plazmid átvitel az ESBL gének és a velük egy plazmidon elhelyezkedı egyéb rezisztencia gének elterjedése szempontjából komoly epidemiológiai problémát jelent.
Ötéves követéses epidemiológiai vizsgálatunk során kimutattuk, hogy az ESBL-termelı törzsek által okozott járványok epidemiológiája az évek során megváltozhat: egy járványt
Imipenem 40 mg/kg A3-APO 2,5 mg/kg A3-APO 5 mg/kg A3-APO 10 mg/kg Kezeletlen
Túlélés (10 egérbıl)
Utolsó kezelés után eltelt idı (óra)
5. ábraE. coli5770 törzzsel fertızött majd A3-APO-val és imipenemmel kezelt egerek túlélése
okozó törzs eltőnhet és helyét újabb járványt okozó törzsek vehetik át hosszabb idı alatt.
Mivel közös környezeti forrást nem sikerült bizonyítani, feltételezzük, hogy a fertızés egy lehetséges forrása, a gyermekek édesanyja, akiknek normál bélflórájában jelen lehetnek ESBL-termelı törzsek, melyekkel a gyermekek szülés során kontaminálódhatnak. Ez a magyarázat választ adhat a multiklonalitás és az ismételt felbukkanás kérdésére is az ESBL- termelı törzsek esetében. A fentebb említett eredmények alapján javasolnánk az éretlen újszülöttek édesanyjának rutinszerő bélflóra-szőrését.
Mivel az ESBL-termelı organizmusok világszerte egyre több beteget érintenek, a PIC-en elıforduló ESBL-termelı baktériumok molekuláris epidemiológiája még összetettebbé kezd válni. Sajnos az ESBL-termelés megjelenik olyan törzsekben, ahol korábban ez igen ritka volt pl: S. marcescens, C. freundii. Erre a helyzetre fel kell hívni a figyelmet, hogy az ezen törzsek elterjedésének megelızését célzó intézkedések optimalizálhatók legyenek.
ESBL enzimek újabb fenotípusos és genotípusos detektálási lehetısége
E. cloacae esetében a CLSI által ajánlott cefotaximot vagy ceftazidimet alkalmazó ESBL- termelés detektálására szolgáló módszerek nem megbízhatóak a kromoszomális β-laktamáz enzim egyidejő termelése miatt. Mivel csupán 15 ESBL-termelı és 30 nem ESBL-termelı E.
cloacae izolátumot vizsgáltunk, nem mondhatunk kategorikus ítéletet, de vizsgálataink azt mutatták, hogy a ≥ 2 µg/ml-es MIC-érték az ESBL-termelés következetesen erıteljes markerének tekinthetı E. cloacae törzsekben.
A real-time PCR SNP assay hasznosnak bizonyult azokban az esetekben, amikor a genomból történı amplifikálás és a primer PCR-termékek szekvenálása arra engedett következtetni, hogy több β-laktamáz is jelen volt egy baktériumban. A módszer igen jól reprodukálható és posztamplifikációs lépések nélkül is kivitelezhetı. Ezzel a módszerrel próbákat lehet tervezni minden célhely azonosítására, még azokra is, amelyek nem képeznek restrikciós endonukleáz hasítási helyeket, illetve kettınél több allél is elkülöníthetı. Ez különösen hasznos lehet nagy populációkon végzett követéses vizsgálatoknál, amelyek a β-laktamáz gének molekuláris epidemiológiájának meghatározására irányulnak.
Új ESBL enzimek izolálása és karakterizálása
Az antibiotikumok, elsısorban a cefalosporinok szelekciós nyomásának hatására egyre újabb és újabb ESBL variánsok kialakulásával kell számolni. A létrejövı mutációk hatása az enzim aktivitásra segít megérteni az ESBL enzimek evolúcióját is. A részletesebben vizsgált SHV- 30 enzim példája mutatja, hogy míg a Glu238Ser mutáció felelıs a β-laktamáz enzim kiterjedt spektrumáért, a további Arg43Ser mutáció más cefalosporinok fokozottabb hidrolíziséért és a megnövekedett enzimtermelésért felelıs. Valószínő, hogy az SHV-30 β-laktamáz egy prekurzor enzim az SHV-7 felé és az Arg43Ser szubsztitúciónak bonyolult szerepe van az oxyimino-cefalosporin rezisztencia kialakulásában.
ESBL termelés és a csökkent kinolon érzékenység kapcsolata
Elsıként számoltunk be plazmid-mediálta kinolon-rezisztenciáról ESBL-termelı Enterobacteriaceae baktériumok között Magyarországon. A prevalencia alacsony volt: ~3 % a qnrA, 0,8 % a qnrB, 04 % a qnrS- és 8 % az aac(6’)-Ib-cr génekre, emellett a legtöbb plazmid-kódolt rezisztencia-allélt a K. pneumoniae tartalmazta. Az eredmények mutatják, hogy a kiterjedt spektrumú cefalosporinokra és a kinolonokra vonatkozó rezisztencia átadásában részt vevı plazmidok megjelenésével számolni kell a klinikai izolátumokban.
Gram-negatív baktériumok karbapenem rezisztenciájának vizsgálata
Az izolált ertapenem rezisztencia hátterében a csökkent külsı membrán permeabilitás mellett egy efflux pumpa jelenlétét is bizonyítani tudtuk. Valószínőleg a csökkent külsı membrán